ГДЗ РФ по Химии 9 класс
Химия 9 класс
Автор: О.С. Габриелян
Химия 8-9 класс задачник с помощником
Авторы: Н.Н. Гара, Н.И. Габрусева
Химия 9 класс задачник
Авторы: Н.Е. Кузнецова, А.Н. Левкин
Авторы: Г.
 Е. Рудзитис, Ф.Г. Фельдман
Е. Рудзитис, Ф.Г. ФельдманХимия 8-11 класс сборник задач и упражнений
Автор: Хомченко И.Г.
Химия 8-9 класс дидактический материал
Автор: А.М. Радецкий
Химия 8-11 класс задачник
Авторы:
Гольдфарб Я.Л., Ходаков Ю.В.Химия 9 класс
Авторы: Гузей Л.
 С., Сорокин В.В.
С., Сорокин В.В.Химия 9 класс
Авторы: И.И. Новошинский, Н.С. Новошинская
Химия 9 класс рабочая тетрадь
Авторы: Габриелян О.С., Яшукова А.В.
Химия 9 класс
Авторы: Кузнецова Н.Е., Титова И.М
Химия 9 класс
Авторы: Оржековский П.
 А., Мещерякова Л. М.
А., Мещерякова Л. М.Химия 9 класс
Авторы: Е. И. Василевская, А. П. Ельницкий
-
Химия 9 класс рабочая тетрадь
Автор: Н.И. Габрусева
Химия 9 класс химический эксперимент
Автор: И.И. Борушко
Химия 9 класс рабочая тетрадь
Автор: Е.
 И. Шарапа
И. ШарапаХимия 9 класс лабораторные работы
Автор: Шарапа Е. И.
Химия 9 класс сборник задач
Авторы: Хвалюк B.Н., Резяпкин B.И.
Химия 9 класс
Авторы: Ерёмин В.В., Кузьменко Н.Е.
Химия 9 класс
Авторы: Буриньская Н.
М., Величко Л.П.
Химия 9 класс
Автор: Г.А. Лашевської
Химия 9 класс
Авторы: П.П. Попель, Л.С. Крикля
Химия 9 класс
Автор: Ярошенко О.Г.
Химия 9 класс рабочая тетрадь
Авторы: Гара Н.
 Н., Ахметов М.А.
Н., Ахметов М.А.Химия 9 класс
Авторы: Минченков Е. Е., Журин А. А.
Химия 9 класс
Автор: Журин А.А.
Химия 9 класс тетрадь-тренажёр
Автор:
Гара Н.Н.Химия 9 класс тетрадь-экзаменатор
Авторы: Бобылева О.
 Л., Бирюлина Е.В.
Л., Бирюлина Е.В.Химия 9 класс тетрадь-практикум
Автор: Журин А.А.
Химия 7-9 класс сборник контрольных и самостоятельных работ
Авторы: Масловская Т.Н., Пашуто Е.Н.
Химия 8-9 класс сборник задач
Автор: Рябов М.А.
Химия 9 класс
Авторы: Габриелян О.
 С., Остроумов И.Г.
С., Остроумов И.Г.Химия 9 класс контрольно-измерительные материалы
Автор: Стрельникова Е.Н.Химия 9 класс рабочая тетрадь
Авторы: Габриелян О.С., Сладков С.А.
Химия 9 класс контрольные и самостоятельные работы к уч. Габриеляна
Автор: Павлова Н.С.
Химия 9 класс
Авторы: Шиманович И.
 Е., Василевская Е.И.
Е., Василевская Е.И.Химия 9 класс тетрадь для оценки качества знаний
Авторы: Габриелян О.С., Купцова А.В.
Химия 9 класс контрольные и проверочные работы
Авторы: Габриелян О.С., Березкин П.Н.
Химия 9 класс тесты, задачи и упражнения
Авторы: Габриелян О.С., Сладков С.А.
org/Book» data-v-489d6f73=»» data-v-23346ed7=»»>Химия 9 класс сборник задач и упражнений
Авторы: Габриелян О.С., Тригубчак И.В.
Химия 9 класс контрольные работы
Авторы: Габриелян О.С, Краснова В.Г.
Химия 9 класс рабочая тетрадь
Авторы: Габриелян О.
 С., Остроумов И.Г.
С., Остроумов И.Г.Химия 9 класс тетрадь для практических работ и лабораторных опытов
Авторы: Габриелян О.С., Купцова А.В.
Химия 9 класс тесты
Автор: Т.А. Боровских
Химия 9 класс
Автор: Григорович О.В.
Химия 9 класс рабочая тетрадь
Автор: Савчин М.
 М.
М.Химия 9 класс
Автор: Савчин М.М.
Химия 9 класс Контрольные и проверочные работы
Авторы: В.В. Еремин, А.А. Дроздов
Химия 9 класс тесты (неметаллы)
Автор: М.А. Рябов
Химия 9 класс тетрадь для лабораторных работ
Автор: А.
 Д. Микитюк
Д. МикитюкХимия 9 класс тесты (металлы)
Автор: М.А. Рябов
Химия 8-11 класс сборник авторских задач
Автор: Маршанова Г.Л.
Химия 9 класс сборник контрольных и самостоятельных работ
Авторы: Сеген Е.А., Алексеева А.В.
Химия 9 класс рабочая тетрадь
Автор: Боровских Т.
 А.
А.Химия 9 класс рабочая тетрадь
Авторы: Еремин В.В., Дроздов А.А.
Химия 9 класс
Авторы: Усманова М.Б., Сакарьянова К.Н.
Химия 9 класс рабочая тетрадь
Автор: Микитюк А.Д.
Химия 9 класс тетрадь для лабораторных и практических работ
Авторы: Габриелян О.
 С., Аксёнова И.В.
С., Аксёнова И.В.Химия 9 класс тесты
Автор: М.А. Рябов
Химия 9 класс задачник
Автор: Журин А.А.
ГДЗ РФ — У нас подобраны готовые решения домашних заданий по Химии за 9 класс. Вы найдете ответы на вопросы, краткое и полное решение задач, переводы текстов, упражнения из учебников и тетрадей.
Химия 9 класс — параграф 36 Практическая работа 6 Рудзитис, Фельдман, ГДЗ, решебник, онлайн
ГДЗ / Решебники / 9 класс / Химия / Рудзитис / Практическая работа 6
ГДЗ(готовые домашние задания), решебник онлайн по химии за 9 класс авторов Рудзитис, Фельдман параграф 36 практическая работа 6, получение оксида углерода(IV) и изучение его свойств, распознавание карбонатов — вариант решения практической работы 6
§1.
 Окислительно-восстановительные реакции:
Окислительно-восстановительные реакции:Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§2. Тепловые эффекты химических реакций:
Подумай, ответь, выполни…: 2 3 4
§3. Скорость химических реакций:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на её скорость:
Практическая работа 1
§5. Обратимые реакций. Понятие о химическом равновесии:
Подумай, ответь, выполни…: 2 3 Тестовые задания
§6.
 Сущность процесса электролитической диссоциации:
Сущность процесса электролитической диссоциации:Подумай, ответь, выполни…: 1 2 3 4
§7. Диссоциация кислот, оснований и солей:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§8. Слабые и сильные электролиты. Степень диссоциации:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§9. Реакции ионного обмена:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания Лабораторный опыт
§10.
 Гидролиз солей:
Гидролиз солей:Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§11. Практическая работа 2. Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов»:
Практическая работа 2
§12. Характеристика галогенов:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт
§13. Хлор:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 Тестовые задания
§14. Хлороводород: получение и свойства:
Подумай, ответь, выполни. ..:
1
2
3
..:
1
2
3
§15. Соляная кислота и её соли:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств:
Практическая работа 3
§17. Характеристика кислорода и серы:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания Лабораторный опыт
§18. Свойства и применение серы:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§19. Сероводород. Сульфиды:
Подумай, ответь, выполни. ..:
1
2
3
4
Тестовые задания
Лабораторный опыт
..:
1
2
3
4
Тестовые задания
Лабораторный опыт
§20. Оксид серы(IV). Сернистая кислота:
Подумай, ответь, выполни…: 1 2 4 Тестовые задания Лабораторный опыт
§21. Оксид серы(VI). Серная кислота:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт
§22. Практическая работа 4. Решение экспериментальных задач по теме «Кислород и сера»:
Практическая работа 4
§23. Характеристика азота и фосфора. Физические и химические свойства азота:
Подумай, ответь, выполни. ..:
1
2
3
..:
1
2
3
§24. Аммиак:
Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§25. Практическая работа 5. Получение аммиака и изучение его свойств:
Практическая работа 5
§26. Соли аммония:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт
§27. Азотная кислота:
Подумай, ответь, выполни…: 1 2 3 4 5 7 Тестовые задания
§28. Соли азотной кислоты:
Подумай, ответь, выполни. ..:
1
2
3
..:
1
2
3
§29. Фосфор:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§30. Оксид фосфора(V). Фосфорная кислота и её соли:
Подумай, ответь, выполни…: 1 2 3 4
§31. Характеристика углерода и кремния. Аллотропия углерода:
Подумай, ответь, выполни…: 1 2 3
§32. Химические свойства углерода. Адсорбция:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 Тестовые задания
§33.
 Оксид углерода(II) — угарный газ:
Оксид углерода(II) — угарный газ:Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§34. Оксид углерода(IV) — углекислый газ:
Подумай, ответь, выполни…: 1 2 3 4 Лабораторный опыт
§35. Угольная кислота и её соли. Круговорот углерода в природе:
Подумай, ответь, выполни…: 1 2 3 4 5 6 7 Тестовые задания Лабораторный опыт
§36. Практическая работа 6. Получение оксида углерода(IV) и изучение его свойств. Распознавание карбонатов:
Практическая работа 6
§37.
 Кремний. Оксид кремния(IV):
Кремний. Оксид кремния(IV):Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§38. Кремниевая кислота и её соли. Стекло. Цемент:
Подумай, ответь, выполни…: 1 2 3 4
§39. Характеристика металлов:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§40. Нахождение метилов в природе и общие способы их получения:
Подумай, ответь, выполни…: 1 2 3
§41. Химические свойства металлов. Электрохимический ряд напряжений металлов:
Подумай, ответь, выполни. ..:
1
2
3
Лабораторный опыт
..:
1
2
3
Лабораторный опыт
§42. Сплавы:
Подумай, ответь, выполни…: 1 2 3
§43. Щелочные металлы:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§44. Магний. Щелочноземельные металлы:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания
§45. Важнейшие соединения кальция. Жёсткость воды:
Подумай, ответь, выполни…: 1 2 3 4 5 Тестовые задания Лабораторный опыт
§46.
 Алюминий:
Алюминий:Подумай, ответь, выполни…: 1 2 3 4 5 6 7 8 Тестовые задания
§47. Важнейшие соединения алюминия:
Подумай, ответь, выполни…: 1 2 3 4 5 Лабораторный опыт
§48. Железо:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§49. Соединения железа:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§50.
 Практическая работа 7. Решение экспериментальных задач по теме «Металлы»:
Практическая работа 7. Решение экспериментальных задач по теме «Металлы»:Практическая работа 7
§51. Органическая химия:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§52. Предельные (насыщенные) углеводороды:
Подумай, ответь, выполни…: 1 2 3 4 Тестовые задания
§53. Непредельные (ненасыщенные) углеводороды:
Подумай, ответь, выполни…: 1 2 3 4 5
§54. Полимеры:
Подумай, ответь, выполни…: 1 2
§55.
 Производные углеводородов. Спирты:
Производные углеводородов. Спирты:Подумай, ответь, выполни…: 1 2 3 Тестовые задания
§56. Карбоновые кислоты. Сложные эфиры. Жиры:
Подумай, ответь, выполни…: 1 2 3 4 5 6 Тестовые задания
§57. Углеводы:
Подумай, ответь, выполни…: 1 2 3
§58. Аминокислоты. Белки:
Подумай, ответь, выполни…: 1 2 3 4 5
Гдз 9 клас химия. Какая помощь по химии нужна ученику
Решебник по химии для 9 класса Габриелян — это сборник решений и ответов, совокупность готовых домашних заданий по учебнику, составленному для 9 классов авторитетным российским педагогом и ученым — Габриеляном О. С. Он призван помочь школьникам в изучении химии — практическом закреплении теоретических знаний.
С. Он призван помочь школьникам в изучении химии — практическом закреплении теоретических знаний.
Решебник по Химии 9 класс Габриелян — белый учебник 2014-2017г
Химия — предмет достаточно сложный. Оттого, по статистике, 60-65% школьников допускают ошибки в решении домашних задач. Как решить эту проблему? Вовсе необязательно искать дорогостоящего репетитора — школьник способен самостоятельно разобраться в уравнениях реакции и определению массы сложного раствора, если воспользуется ГДЗ по химии для 9 класса Габриелян.
Наш сайт — это продвинутая система использования онлайн-ответов на задачки и примеры по химии 9 класса. Школьники или их родители могут зайти на сайт при помощи планшета или телефона и по номеру найти нужный ответ.
Преимуществами нашего сайта перед иными ресурсами Рунете выступают:
- регулярное обновление базы решебников;
- предложение нескольких вариантов решения по каждому заданию.
Обратившись к решениям нашего сайта, девятиклассники смогут уяснить схему решения задач по химии и составления уравнений реакции. эти знания помогут им в выполнении контрольных работ и сдаче экзаменов. Родители же на основании готовых ответов смогут проверить правильность выполнения домашних заданий своих детей.
эти знания помогут им в выполнении контрольных работ и сдаче экзаменов. Родители же на основании готовых ответов смогут проверить правильность выполнения домашних заданий своих детей.
ГДЗ по Химии 9 класс Габриелян О.С. — ответы на вопросы учебника
В настоящее время в средних школах России используют учебник для 9 класса Габриеляна О.С., который был выпущен в 2014 году во его 2-м издании издательством «Дрофа».
Учебник состоит из 42 параграфов, в которых освещены основные вопросы неорганической химии:
- закономерности таблицы химических элементов Менделеева Д.И. и ее структура;
- виды металлов, их физические и химические свойства;
- неметаллы, их свойства и направления использования.
Учебное пособие Габриеляна О.С. также содержит вопросы, примеры и задания для повторения химии 8-9 классов. Тестовые задания к разделам позволяют проверить и закрепить теоретические знания.
Такая комплексная структура позволяет школьникам успешно выполнять домашние задания, решать контрольные работы, сдавать экзамены и даже использовать полученные знания при поступлении в вузы.
Готовые Домашние Задания (ГДЗ) к учебнику Рудзитиса Г.Е. «Химия. 9 класс» — это книга, включающая в себя решенные примеры и задачи. Не станут ли готовые ответы «медвежьей услугой» девятикласснику? Многие педагоги говорят, что такое пособие — спасательный круг для школьников, слабоуспевающих по химии. А все те, кто интересуется химией, желают дальше продолжить обучение, смогут проверять свои ответы и решения.
Какая помощь по химии нужна ученику?
Не каждый учебный предмет школьники усваивают без проблем. У некоторых еще с 8-го класса появляется отношение к химии, как к очень сложной и непонятной науке. Проблемы начинаются, когда требуется запомнить химические знаки, валентность, уметь определять коэффициенты в уравнениях и выполнять расчеты. Трудности могут быть временными и ученику нужно всего лишь увереннее разбираться в непонятном для него материале.
Используя ГДЗ, ребенок начнет понимать суть предлагаемых в учебнике Рудзитиса вопросов и заданий. В решебнике, кроме уравнений реакций и ответов к задачам, приводятся аргументированные объяснения и алгоритмы действий. Эти образцы помогут девятикласснику лучше выполнять учебные задания на уроках и дома.
Эти образцы помогут девятикласснику лучше выполнять учебные задания на уроках и дома.
Как использовать ГДЗ?
Решебник подходит для закрепления и самопроверки изученных на уроках тем. Первая глава, которую изучают по учебнику Рудзитиса — «Электролитическая диссоциация» — один из наиболее сложных разделов химии. Автор также включил несколько тем из органической химии, основы химических производств. Благодаря ГДЗ, девятиклассник сумеет проверить выполнение наиболее трудных заданий учителя на уроке, домашнюю работу. Многие пользуются для нахождения ошибок в расчетах или уравнениях реакций, из-за которых не сходится ответ.
Родителям школьников пособие дает возможность увидеть, каковы успехи ребенка в освоении химии. Книга позволяет контролировать учебную работу и помогать в усвоении сложного курса. Пособие можно использовать на нашем сайте в режиме онлайн. К каждому переизданию учебника Рудзитиса предлагается свой вариант ГДЗ.
Ось ви і підійшли на уроках хімії до вивчення важливих тем більш детально – розчини, хімічні реакції, органічні сполуки, вуглеводи, спирти, кислоти. Окрім вправ та задач, ви будете виконувати лабораторні досліди, а за їхніми результатами – писати роботи. Проте знаходження кожної правильної відповіді з хімії вимагає чималих знань. А вони формуються у процесі щоденного вивчення та повторення уроків. Спростіть собі виконання домашніх завдань з ГДЗ для дев’ятого класу з хімії. Це ваш особистий консультант на випадки, коли поруч немає вчителя, а батькам ніколи займатися уроками.
Окрім вправ та задач, ви будете виконувати лабораторні досліди, а за їхніми результатами – писати роботи. Проте знаходження кожної правильної відповіді з хімії вимагає чималих знань. А вони формуються у процесі щоденного вивчення та повторення уроків. Спростіть собі виконання домашніх завдань з ГДЗ для дев’ятого класу з хімії. Це ваш особистий консультант на випадки, коли поруч немає вчителя, а батькам ніколи займатися уроками.
Де знайти підказки до задач з хімії
Якщо вам складно визначати, наприклад, взаємозв’язки між речовинами та взаємоперетворення, чи виокремлювати сполуки різного походження, то загляньте в готові домашні завдання з хімії для 9 класу. Все, що ви не до кінця зрозуміли чи пропустили на уроці, пояснить решебник. Причому так просто і доступно, що ви обов’язково отримаєте за свою домашню роботу 12 балів. Не забудьте поділитися з іншими дев’ятикласниками секретами високих оцінок. Адже для когось з них дев’ятий клас стане випускним, тож оцінки з усіх предметів обов’язково мають бути гарними.
Вчити хімію онлайн – оптимальне рішення сучасних школярів
Якщо домашні завдання з хімії стали для вас навантаженням, поспішайте змінити ситуацію. Користуйтеся ГДЗ з хімії для 9 класу з задоволенням, адже це так просто! Зі свого телефону чи комп’ютера заходьте на сайт GDZ4YOU, де є відповіді на кожне завдання. Користуйтеся ними безкоштовно та без реєстрації. Оскільки нині існують декілька підручників за різними авторами, то на сайті можна знайти відповіді до потрібного підручника. Незалежно від того, де ви знаходитеся, портал доступний завжди. Єдина умова – підключення до мережі Інтернет.
Будьте вундеркіндом з решебником
Кожен предмет, який є у шкільному розкладі дев’ятикласників можна вчити з решебником з 9 класу. В тому числі й географію, яка є багатогранною та всебічно пізнавальною. Це предмет, який дозволяє дізнатися багато про весь світ – сушу, океани. З нею учні можуть за урок помандрувати з півночі на південь, побувати на різних півкулях землі. За допомогою контурних карт школярі вчаться наносити та розпізнавати різні позначення. А завдяки атласу та картам вони можуть розповісти багато цікавого про кожен материк.
А завдяки атласу та картам вони можуть розповісти багато цікавого про кожен материк.
ГДЗ онлайн по Химии, решебник и ответы
- ГДЗ
- Химия
7 класс
Химия 7 класс рабочая тетрадь
Авторы: О.С. Габриелян Г.А. Шипарева
Химия 7 класс рабочая тетрадь
Авторы: Сечко О.И. Манкевич Н.В.
Химия 7 класс
Авторы: И.
 Е. Шиманович О. И. Сечко
Е. Шиманович О. И. СечкоХимия 7 класс химический эксперимент
Автор: И.И. Борушко
Химия 7 класс лабораторные работы
Автор: Сечко О.И.
Химия 7 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 7 класс рабочая тетрадь
Авторы: Габриелян О.С. Сладков С.А.
Химия 7 класс тетрадь для лабораторных опытов и практических работ
Авторы: Габриелян О.
 С. Аксенова И.В.
С. Аксенова И.В.Химия 7-9 класс сборник контрольных и самостоятельных работ
Авторы: Масловская Т.Н. Пашуто Е.Н.
Химия 7 класс
Авторы: Габриелян О.С. Сладков С.А.
Химия 7 класс практикум
Авторы: Габриелян О.С. Аксенова И.В.
Химия 7 класс
Авторы: Попель П.П. Крикля Л.С.
Химия 7 класс
Авторы: Лашевская Г.
 А. Лашевская А.А.
А. Лашевская А.А.Химия 7 класс
Автор: Григорович О. В.
Химия 7 класс
Автор: Буринская Н.Н.
Химия 7 класс
Авторы: Дячук Л. С. Гладюк М. М.
Химия 7 класс рабочая тетрадь
Авторы: Иванащенко О.А. Михайлова И.Г.
Химия 7 класс
Автор: Савчин М.М.
Химия 7 класс рабочая тетрадь
Автор: Савчин М.
 М.
М.Химия 7 класс
Автор: Ярошенко О.Г.
Химия 7 класс сборник контрольных и самостоятельных работ
Авторы: Сеген Е.А. Масловская Т.Н.
Химия 7 класс
Авторы: Еремин В.В. Дроздов А.А.
8 класс
Химия 8 класс
Авторы: Г.Е. Рудзитис Ф.Г. Фельдман
Химия 8 класс задачник
Авторы: Н.
 Е. Кузнецова А.Н. Левкин
Е. Кузнецова А.Н. ЛевкинХимия 8 класс рабочая тетрадь
Авторы: В.В. Еремина Н.Е. Кузьменко
Химия 8 класс
Авторы: Кузнецова Н.Е. Титова И.М.
Химия 8 класс
Авторы: Гузей Л.С. Суровцева Р.П.
Химия 8-11 класс задачник
Авторы: Гольдфарб Я.Л. Ходаков Ю.В.
Химия 8-9 класс дидактический материал
Автор: А.
 М. Радецкий
М. РадецкийХимия 8-9 класс задачник с помощником
Авторы: Н.Н. Гара Н.И. Габрусева
Химия 8 класс
Автор: О.С. Габриелян
Химия 8-11 класс сборник задач и упражнений
Автор: Хомченко И.Г.
Химия 8 класс рабочая тетрадь
Автор: Габрусева Н.И.
Химия 8 класс тетрадь для оценки качества знаний
Авторы: О.
 С. Габриелян А.В. Купцова
С. Габриелян А.В. Купцова
Химия 8 класс
Авторы: И.И. Новошинский Н.С. Новошинская
Химия 8 класс
Авторы: Шиманович И.Е. Красицкий В.А.
Химия 8 класс
Авторы: Минченков Е.Е. Журин А.А.
Химия 8 класс
Авторы: Оржековский П. А. Мещерякова Л. М.
Химия 8 класс химический эксперимент
Автор: И.
 И. Борушко
И. БорушкоХимия 8 класс лабораторные работы
Автор: О.И. Сечко
Химия 8 класс сборник задач
Авторы: В.Н. Хвалюк В.И. Резяпкин
Химия 8 класс
Авторы: Еремин В.В. Кузьменко Н.Е.
Химия 8 класс рабочая тетрадь
Авторы: Гара Н.Н. Ахметов М.А.
Химия 8 класс
Автор: Журин А.
 А.
А.Химия 8 класс тетрадь-тренажёр
Автор: Гара Н.Н.
Химия 8 класс тетрадь-практикум
Автор: Журин А.А,
Химия 8 класс тетрадь-экзаменатор
Авторы: Бобылева О.Л. Бирюлина Е.В.
Химия 7-9 класс сборник контрольных и самостоятельных работ
Авторы: Масловская Т.Н. Пашуто Е.Н.
Химия 8-9 класс сборник задач
Автор: Рябов М.
 А.
А.Химия 8 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 8 класс контрольно-измерительные материалы
Авторы: Троегубова Н.П. Стрельникова Е.Н.
Химия 8 класс рабочая тетрадь
Авторы: Габриелян О.С. Сладков С.А.
Химия 8 класс контрольные и самостоятельные работы к уч. Габриеляна
Автор: Павлова Н.С.
Химия 8 класс
Авторы: Усманова М.
 Б. Сакарьянова К.Н.
Б. Сакарьянова К.Н.Химия 8 класс тетрадь для лабораторных опытов и практических работ
Авторы: Габриелян О.С. Купцова А.В.
Химия 8 класс
Авторы: Журин А.А. Корнилаев С.В.
Химия 8 класс контрольные работы
Авторы: Габриелян О.С. Краснова В.Г.
Химия 8 класс контрольные и проверочные работы
Авторы: Габриелян О.С.
 Березкин П.Н.
Березкин П.Н.
Химия 8 класс рабочая тетрадь
Автор: Боровских Т.А.
Химия 8 класс задачник
Автор: Журин А.А.
Химия 8 класс рабочая тетрадь
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 8 класс рабочая тетрадь
Автор: Савчин М.М.
Химия 8 класс
Автор: Савчин М.
 М.
М.Химия 8 класс
Автор: О.Г. Ярошенко
Химия 8 класс
Авторы: П.П. Попель Л.С. Крикля
Химия 8 класс
Автор: Н.М. Буринськая
Химия 8 класс
Автор: Григорович О.В.
Химия 8 класс
Авторы: Лашевська Г.А. Лашевська А.А.
Химия 8 класс
Автор: Гранкина Т.
 М.
М.Химия 8 класс
Авторы: Дячук Л.С. Гладюк М.М.
Химия 8 класс рабочая тетрадь
Авторы: Иванащенко О.А. Михайлова И.Г.
Химия 8 класс тесты
Автор: М.А. Рябов
Химия 8 класс тесты
Автор: М.А. Рябов
Химия 8 класс тесты
Автор: Т.
 А. Боровских
А. БоровскихХимия 8-11 класс сборник авторских задач
Автор: Маршанова Г.Л.
Химия 8 класс сборник контрольных и самостоятельных работ
Авторы: Сеген Е.Л. Власовец Е.Н.
Химия 8 класс рабочая тетрадь
Автор: Микитюк А.Д.
Химия 8 класс проверочные и контрольные работы
Авторы: Габриелян О.С. Лысова Г.Г.
Химия 8 класс контрольные измерительные материалы
Авторы: Корощенко А.
 С. Яшукова А.В.
С. Яшукова А.В.Химия 8 класс тетрадь для лабораторных опытов и практических работ
Авторы: О.С. Габриелян И.В. Аксенова
9 класс
Химия 9 класс
Авторы: И.И. Новошинский Н.С. Новошинская
Химия 9 класс
Автор: О.С. Габриелян
Химия 9 класс задачник
Авторы: Н.Е. Кузнецова А.Н. Левкин
Химия 9 класс
Авторы: Гузей Л.
 С. Сорокин В.В.
С. Сорокин В.В.Химия 9 класс
Авторы: Г.Е. Рудзитис Ф.Г. Фельдман
Химия 8-11 класс задачник
Авторы: Гольдфарб Я.Л. Ходаков Ю.В.
Химия 8-9 класс дидактический материал
Автор: А.М. Радецкий
Химия 8-9 класс задачник с помощником
Авторы: Н.Н. Гара Н.И. Габрусева
Химия 8-11 класс сборник задач и упражнений
Автор: Хомченко И.
 Г.
Г.Химия 9 класс
Авторы: Кузнецова Н.Е. Титова И.М
Химия 9 класс
Авторы: Оржековский П. А. Мещерякова Л. М.
Химия 9 класс
Авторы: Е. И. Василевская А. П. Ельницкий
Химия 9 класс рабочая тетрадь
Автор: Н.И. Габрусева
Химия 9 класс химический эксперимент
Автор: И.
 И. Борушко
И. БорушкоХимия 9 класс рабочая тетрадь
Автор: Е.И. Шарапа
Химия 9 класс лабораторные работы
Автор: Шарапа Е. И.
Химия 9 класс сборник задач
Авторы: Хвалюк B.Н. Резяпкин B.И.
Химия 9 класс рабочая тетрадь
Авторы: Габриелян О.С. Яшукова А.В.
Химия 9 класс
Авторы: Ерёмин В.
 В. Кузьменко Н.Е.
В. Кузьменко Н.Е.Химия 9 класс рабочая тетрадь
Авторы: Гара Н.Н. Ахметов М.А.
Химия 9 класс
Авторы: Минченков Е. Е. Журин А. А.
Химия 9 класс
Автор: Журин А.А.
Химия 9 класс тетрадь-тренажёр
Автор: Гара Н.Н.
Химия 9 класс тетрадь-экзаменатор
Авторы: Бобылева О.
 Л. Бирюлина Е.В.
Л. Бирюлина Е.В.
Химия 9 класс тетрадь-практикум
Автор: Журин А.А.
Химия 7-9 класс сборник контрольных и самостоятельных работ
Авторы: Масловская Т.Н. Пашуто Е.Н.
Химия 8-9 класс сборник задач
Автор: Рябов М.А.
Химия 9 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 9 класс контрольно-измерительные материалы
Автор: Стрельникова Е.
 Н.
Н.Химия 9 класс рабочая тетрадь
Авторы: Габриелян О.С. Сладков С.А.
Химия 9 класс
Автор: Ярошенко О.Г.
Химия 9 класс контрольные и самостоятельные работы к уч. Габриеляна
Автор: Павлова Н.С.
Химия 9 класс
Авторы: Шиманович И.Е. Василевская Е.И.
Химия 9 класс тетрадь для оценки качества знаний
Авторы: Габриелян О.
 С. Купцова А.В.
С. Купцова А.В.Химия 9 класс контрольные и проверочные работы
Авторы: Габриелян О.С. Березкин П.Н.
Химия 9 класс тесты, задачи и упражнения
Авторы: Габриелян О.С. Сладков С.А.
Химия 9 класс задачник
Автор: Журин А.А.
Химия 9 класс сборник задач и упражнений
Авторы: Габриелян О.
 С. Тригубчак И.В.
С. Тригубчак И.В.Химия 9 класс контрольные работы
Авторы: Габриелян О.С Краснова В.Г.
Химия 9 класс рабочая тетрадь
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 9 класс тетрадь для практических работ и лабораторных опытов
Авторы: Габриелян О.С. Купцова А.В.
Химия 9 класс тесты
Автор: Т.А. Боровских
Химия 9 класс
Авторы: П.
 П. Попель Л.С. Крикля
П. Попель Л.С. КрикляХимия 9 класс
Автор: Григорович О.В.
Химия 9 класс рабочая тетрадь
Автор: Савчин М.М.
Химия 9 класс
Автор: Савчин М.М.
Химия 9 класс
Авторы: Буриньская Н.М. Величко Л.П.
Химия 9 класс Контрольные и проверочные работы
Авторы: В.В. Еремин А.
 А. Дроздов
А. Дроздов
Химия 9 класс тесты (неметаллы)
Автор: М.А. Рябов
Химия 9 класс тетрадь для лабораторных работ
Автор: А.Д. Микитюк
Химия 9 класс тесты (металлы)
Автор: М.А. Рябов
Химия 8-11 класс сборник авторских задач
Автор: Маршанова Г.Л.
Химия 9 класс сборник контрольных и самостоятельных работ
Авторы: Сеген Е.
 А. Алексеева А.В.
А. Алексеева А.В.Химия 9 класс рабочая тетрадь
Автор: Боровских Т.А.
Химия 9 класс рабочая тетрадь
Авторы: Еремин В.В. Дроздов А.А.
Химия 9 класс
Авторы: Усманова М.Б. Сакарьянова К.Н.
Химия 9 класс рабочая тетрадь
Автор: Микитюк А.Д.
Химия 9 класс тетрадь для лабораторных и практических работ
Авторы: Габриелян О.
 С. Аксёнова И.В.
С. Аксёнова И.В.Химия 9 класс тесты
Автор: М.А. Рябов
10 класс
Химия 10 класс рабочая тетрадь, тестовые задания ЕГЭ
Авторы: Габриелян О.С. Яшукова А.В.
Химия 10-11 класс дидактический материал
Автор: Радецкий А.М.
Химия 10-11 класс
Автор: Цветков Л.А.
Химия 10 класс
Авторы: Гузей Л.
 С. Суровцева Р.П.
С. Суровцева Р.П.Химия 8-11 класс задачник
Авторы: Гольдфарб Я.Л. Ходаков Ю.В.
Химия 10 класс
Авторы: Рудзитис Г.Е. Фельдман Ф.Г.
Химия 10 класс
Авторы: И.И. Новошинский Н.С. Новошинская
Химия 8-11 класс сборник задач и упражнений
Автор: Хомченко И.Г.
Химия 10 класс
Автор: О.
 С. Габриелян
С. ГабриелянХимия 10 класс
Авторы: И.Е. Шиманович Е.И. Василевская
Химия 10 класс сборник задач
Авторы: В.Н. Хвалюк В.И. Резяпкин
Химия 10 класс лабораторные работы
Авторы: Шарапа Е.И. Ельницкий А.П.
Химия 10 класс рабочая тетрадь
Авторы: Т.Н. Мякинник Н.В. Манкевич
Химия 10 класс химический эксперимент
Автор: И.
 И. Борушко
И. БорушкоХимия 10 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 10 класс
Авторы: Ерёмин В.В. Кузьменко Н.Е.
Химия 10 класс
Авторы: Кузнецова Н.Е. Гара Н.Н.
Химия 10 класс
Авторы: Кузнецова Н.Е. Гара Н.Н.
Химия 10 класс
Авторы: Еремин В.
 В. Кузьменко Н.Е.
В. Кузьменко Н.Е.Химия 10 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 10 класс рабочая тетрадь
Автор: Ахметов М.А.
Химия 10 класс
Авторы: Рудзитис Г.Е. Фельдман Ф.Г.
Химия 10-11 класс сборник задач
Автор: Рябов М.А.
Химия 10 класс контрольно-измерительные материалы
Автор: Стрельникова Е.
 Н.
Н.
Химия 10 класс рабочая тетрадь
Авторы: Габриелян О.С. Сладков С.А.
Химия 10 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 10 класс контрольные и проверочные работы
Авторы: Габриелян О.С. Березкин П.Н.
Химия 10 класс задачник
Авторы: Кузнецова Н.Е. Левкин А.Н.
Химия 10 класс контрольные и проверочные работы
Авторы: Габриелян О.
 С. Сладков С.А.
С. Сладков С.А.Химия 10 класс контрольные работы
Авторы: Габриелян О.С. Сладков С.А.
Химия 10 класс тетрадь для практических работ
Авторы: Матулис В.Э. Матулис В.Э.
Химия 10 класс тетрадь для практических работ
Авторы: Матулис В.Э. Матулис В.Э.
Химия 10 класс
Авторы: Колевич Т.А.
 Матулис В.Э.
Матулис В.Э.Химия 10-11 класс сборник задач и упражнений
Авторы: Червина В.В. Варламова А.В.
Химия 10 класс тематические тесты
Автор: Т.А. Боровских
Химия 10 класс тетрадь для практических работ
Автор: Борушко И.И.
Химия 10 класс
Автор: Савчин М.М.
Химия 10 класс
Автор: Савчин М.
 М.
М.Химия 8-11 класс сборник авторских задач
Автор: Маршанова Г.Л.
Химия 10 класс
Авторы: С.А. Пузаков Н.В. Машнина
Химия 10 класс
Авторы: О.С. Габриелян И.Г. Остроумов
Химия 10-11 класс сборник задач и упражнений
Авторы: С.А. Пузаков В.А. Попков
11 класс
Химия 11 класс
Авторы: Гузей Л.
 С. Суровцева Р.П.
С. Суровцева Р.П.Химия 11 класс
Авторы: Рудзитис Г.Е. Фельдман Ф.Г.
Химия 10-11 класс дидактический материал
Автор: Радецкий А.М.
Химия 11 класс
Автор: О.С. Габриелян
Химия 10-11 класс
Автор: Цветков Л.А.
Химия 8-11 класс задачник
Авторы: Гольдфарб Я.Л. Ходаков Ю.
 В.
В.
Химия 8-11 класс сборник задач и упражнений
Автор: Хомченко И.Г.
Химия 11 класс
Авторы: Ельницкий А. П. Шарапа Е. И.
Химия 11 класс сборник задач
Авторы: Е.И. Шарапа А.П. Ельницкий
Химия 11 класс Рабочая тетрадь
Автор: Е. И. Шарапа
Химия 11 класс лабораторные работы
Авторы: Шарапа Е.
 И. Ельницкий А.П.
И. Ельницкий А.П.Химия 11 класс лабораторные работы
Автор: И.И. Борушко
Химия 11 класс задачник
Авторы: Левкин А. Н. Кузнецова Н. Е.
Химия 11 класс
Авторы: И.И. Новошинский Н.С. Новошинская
Химия 11 класс
Авторы: О.С. Габриелян И.Г. Остроумов
Химия 11 класс
Авторы: Габриелян О.
 С. Лысова Г.Г.
С. Лысова Г.Г.Химия 11 класс
Авторы: Кузнецова Н.Е. Левкин А.Н.
Химия 11 класс
Авторы: Кузнецова Н.Е. Литвинова Т.Н.
Химия 11 класс
Авторы: Еремин В.В Кузьменко Н.Е.
Химия 11 класс
Авторы: Еремин В.В Кузьменко Н.Е.
Химия 11 класс рабочая тетрадь
Авторы: Габриелян О.
 С. Сладков С.А.
С. Сладков С.А.Химия 11 класс
Авторы: Рудзитис Г.Е. Фельдман Ф.Г.
Химия 10-11 класс сборник задач
Автор: Рябов М.А.
Химия 11 класс контрольно-измерительные материалы
Авторы: Стрельникова Е.Н. Троегубова Н.П.
Химия 11 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 11 класс
Авторы: Жумадилова Р.
 Н. Алимжанова С.К.
Н. Алимжанова С.К.Химия 11 класс контрольные работы
Авторы: Габриелян О.С. Асанова Л.И.
Химия 11 класс контрольные и проверочные работы
Авторы: Габриелян О.С. Асанова Л.И.
Химия 11 класс контрольные и проверочные работы
Авторы: Габриелян О.С. Березкин П.Н.
Химия 11 класс тетрадь для оценки качества знаний
Авторы: Габриелян О.
 С. Купцова А.В.
С. Купцова А.В.
Химия 11 класс тетрадь для практических работ
Автор: Сечко О.И.
Химия 11 класс тетрадь для практических работ
Автор: Сечко О.И.
Химия 10-11 класс сборник задач и упражнений
Авторы: Червина В.В. Варламова А.В.
Химия 11 класс
Автор: Савчин М.М.
Химия 11 класс
Авторы: Лашевська Г.
 А. Лашевська А.А.
А. Лашевська А.А.Химия 11 класс
Автор: Григорович О.В.
Химия 11 класс
Авторы: Попель П.П. Крикля Л.С.
Химия 11 класс
Автор: Ярошенко О.Г.
Химия 8-11 класс сборник авторских задач
Автор: Маршанова Г.Л.
Химия 11 класс
Авторы: Мычко Д.И. Прохоревич К.Н.
Химия 11 класс Общая химия
Авторы: Габриелян О.
 С. Остроумов И.Г.
С. Остроумов И.Г.Химия 11 класс рабочая тетрадь
Авторы: Габриелян О.С. Яшукова А.В.
ГДЗ по химии для 9 класса от Спиши фан
Сборник Задач по химии 9 класс Хвалюк B.Н.
Авторы: Хвалюк B.Н., Резяпкин B.И., Ельницкий А.П., Шарапа Е.И.
Задачник С Помощником по химии 9 класс Н.Н. Гара
Авторы: Н.Н. Гара, Н.И. Габрусева
Задачник по химии 9 класс Гольдфарб Я.
 Л.
Л.Авторы: Гольдфарб Я.Л., Ходаков Ю.В., Додонов Ю.Б.
Решебник по химии 9 класс Кузнецова Н.Е.
Авторы: Кузнецова Н.Е., Титова И.М, Гара Н.Н.
Рабочая Тетрадь по химии 9 класс Н.И. Габрусева
Автор: Н.И. Габрусева
Рабочая Тетрадь по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Яшукова А.В.
Решебник по химии 9 класс О.
 С. Габриелян
С. ГабриелянАвтор: О.С. Габриелян
Решебник по химии 9 класс Е. И. Василевская
Авторы: Е. И. Василевская, А. П. Ельницкий, Е. И. Шарапа, И. Е. Шиманович
Решебник по химии 9 класс Гузей Л.С.
Авторы: Гузей Л.С., Сорокин В.В., Суровцева Р.П.
Тетрадь Для Практических Работ И Лабораторных Опытов по химии 9 класс Шарапа Е. И.
Автор: Шарапа Е. И.
org/Book»>Задачник по химии 9 класс Н.Е. Кузнецова
Авторы: Н.Е. Кузнецова, А.Н. Левкин
Решебник по химии 9 класс И.И. Новошинский
Авторы: И.И. Новошинский, Н.С. Новошинская
Дидактические Материалы по химии 9 класс А.М. Радецкий
Автор: А.М. Радецкий
Рабочая Тетрадь по химии 9 класс Е.И. Шарапа
Автор: Е.И. Шарапа
org/Book»>Сборник Задач И Упражнений по химии 9 класс Хомченко И.Г.
Автор: Хомченко И.Г.
Тетрадь Для Практических Работ И Лабораторных Опытов по химии 9 класс И.И. Борушко
Автор: И.И. Борушко
Решебник по химии 9 класс Г.Е. Рудзитис
Авторы: Г.Е. Рудзитис, Ф.Г. Фельдман
Решебник по химии 9 класс Оржековский П. А.
Авторы: Оржековский П. А., Мещерякова Л. М., Шалашова М. М.
org/Book»>Рабочая Тетрадь по химии 9 класс Гара Н.Н.
Авторы: Гара Н.Н., Ахметов М.А.
Решебник по химии 9 класс Ерёмин В.В.
Авторы: Ерёмин В.В., Кузьменко Н.Е., Дроздов А.А., Лунин В.В.
Решебник по химии 9 класс Минченков Е. Е.
Авторы: Минченков Е. Е., Журин А. А., Оржековский П. А.
Решебник по химии 9 класс Журин А.А.
Автор: Журин А.А.
org/Book»>Тетрадь-Экзаменатор по химии 9 класс Бобылева О.Л.
Авторы: Бобылева О.Л., Бирюлина Е.В.
Тетрадь-Тренажёр по химии 9 класс Гара Н.Н.
Автор: Гара Н.Н.
Тетрадь-Практикум по химии 9 класс Журин А.А.
Автор: Журин А.А.
Сборник Контрольных И Самостоятельных Работ по химии 9 класс Масловская Т.Н.
Авторы: Масловская Т.Н., Пашуто Е.Н., Власовец Е.Н.
org/Book»>Решебник по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Остроумов И.Г., Сладков С.А.
Сборник Задач по химии 9 класс Рябов М.А.
Автор: Рябов М.А.
Контрольно-Измерительные Материалы (Ким) по химии 9 класс Стрельникова Е.Н.
Автор: Стрельникова Е.Н.
Рабочая Тетрадь по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Сладков С.А.
org/Book»>Контрольные И Самостоятельные Работы по химии 9 класс Павлова Н.С.
Автор: Павлова Н.С.
Решебник по химии 9 класс Ярошенко О.Г.
Автор: Ярошенко О.Г.
Решебник по химии 9 класс Шиманович И.Е.
Авторы: Шиманович И.Е., Василевская Е.И., Красицкий В.А., Сечко О.И.
Тетрадь Для Оценки Качества Знаний по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Купцова А.В.
org/Book»>Тесты по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Сладков С.А., Смирнова Т.В.
Контрольные И Проверочные Работы по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Березкин П.Н., Ушакова А.А.
Задачник по химии 9 класс Журин А.А.
Автор: Журин А.А.
Сборник Задач И Упражнений по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Тригубчак И.В.
org/Book»>Рабочая Тетрадь по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Остроумов И.Г., Сладков С.А.
Контрольные Работы по химии 9 класс Габриелян О.С
Авторы: Габриелян О.С, Краснова В.Г.
Тетрадь Для Практических Работ И Лабораторных Опытов по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Купцова А.В.
Тесты по химии 9 класс Т.А. Боровских
Автор: Т.А. Боровских
org/Book»>Решебник по химии 9 класс Григорович О.В.
Автор: Григорович О.В.
Решебник по химии 9 класс П.П. Попель
Авторы: П.П. Попель, Л.С. Крикля
Рабочая Тетрадь по химии 9 класс Савчин М.М.
Автор: Савчин М.М.
Решебник по химии 9 класс Савчин М.М.
Автор: Савчин М.М.
Решебник по химии 9 класс Буриньская Н.
 М.
М.Авторы: Буриньская Н.М., Величко Л.П.
Контрольные И Проверочные Работы по химии 9 класс В.В. Еремин
Авторы: В.В. Еремин, А.А. Дроздов
Тесты по химии 9 класс М.А. Рябов
Автор: М.А. Рябов
Тетрадь Для Лабораторных Работ по химии 9 класс А.Д. Микитюк
Автор: А.Д. Микитюк
Тесты (металлы) по химии 9 класс М.
 А. Рябов
А. РябовАвтор: М.А. Рябов
Сборник Задач по химии 9 класс Маршанова Г.Л.
Автор: Маршанова Г.Л.
Сборник Контрольных И Самостоятельных Работ по химии 9 класс Сеген Е.А.
Авторы: Сеген Е.А., Алексеева А.В., Раппапорт А.И., Самолазов С.М., Тимошенко Л.М.
Рабочая Тетрадь по химии 9 класс Боровских Т.А.
Автор: Боровских Т.А.
Рабочая Тетрадь по химии 9 класс Еремин В.
 В.
В.Авторы: Еремин В.В., Дроздов А.А., Шипарева Г.А.
Решебник по химии 9 класс Усманова М.Б.
Авторы: Усманова М.Б., Сакарьянова К.Н., Сахариева Б.Н.
Рабочая Тетрадь по химии 9 класс Микитюк А.Д.
Автор: Микитюк А.Д.
Тетрадь Для Лабораторных И Практических Работ по химии 9 класс Габриелян О.С.
Авторы: Габриелян О.С., Аксёнова И.В., Остроумов И.Г.
org/Book»>
Тесты по химии 9 класс М.А. Рябов
Автор: М.А. Рябов
Ким контрольные работы Химия ГДЗ 9. Контрольная работа по химии, 9 класс
Учтено Согласованный иск
№
Вариант 1
Упражнение 1. Присвойте полный признак элементу с порядковым номером 15.
Задача 2.
а) АИ + О2
б.) Mg+h3 SO.4
в)CaCo.3
г)HCI + №2 Co.3
Задача 3.
а)Baci.2 + Н.3 PO4
б) нс.И. + Агно.3
Задание 4.
В.)
б) цинк + азотная кислота нитрат цинка + водород
в) хлорид бария + серная кислота
Задача 5.
Учтено Согласованный иск
На заседании СМО заместитель директора по ЕГР директор МОУ Дмитриево
Протокол от _______2017 МОУ Дмитриево Пеляскинская СШ Пеляскинская С.С.
№__________ _________________ Витман Д. А. ______________ Дубровская Ю.А.
А. ______________ Дубровская Ю.А.
Протокол МС от ________ 2017 г. № _____ Приказ от ______ 2017 г. № _______
Входной химический контроль 9 класс
Вариант 2.
Задание 1. Назовите полный признак элементу с порядковым номером 19.
Задание 2. Выделите реакции , назовите сложные вещества, укажите тип реакции:
а)Zn. + О.2
б)МГ. + HCI
дюйм)H.2 О.
г)Н.2 SO.4 + К.2 Co.3
Задание 3. Добавляете ли вы реакции и записываете их в ионных формах? Дайте названия веществам:
а)БА.( № 3 ) 2 + Н.3 PO4
б)На.ФРОМИ. + Агно.3
Задание 4. Составьте реакцию, разложите коэффициенты, укажите тип реакции:
а) фосфор + кислород оксид фосфора (III)
в) хлорид меди + гидроксид натрия
Задание 5. Рассчитайте объем углекислого газа (с н.у.), если он опосредован взаимодействием 230 г раствора, содержащего 10% карбоната натрия, с азотной кислотой.
(Вводной контроль) по химии 9 класс
Назначение работы — контроль уровня подготовки учащихся по химии за 8 класс.
Затраты времени — 40 минут (1 занятие).
Материал подлежит материалу основных химических блоков, который распространяется на содержание школьного курса химии: «Строение атома химического элемента», «Полная характеристика химического элемента» номенклатура неорганических веществ», «Виды химических реакций», «Реакции ионного обмена», «Составление химических реакций по схеме», «Решение химических задач с использованием понятия о примесях», «Решение химических задач на растворы».
№ задачи | Уровень сложности | Тип задачи | |
Основание | |||
Основание | Исполнение (решение) | ||
Базовый | Исполнение (решение) | ||
2,4 | Типы химических реакций | Основание | Исполнение (решение) |
Ионообменные реакции | Основание | Исполнение (решение) | |
Составление химических реакций по схеме | Основание | Исполнение (решение) | |
Основание | Исполнение (решение) | ||
Основание | Исполнение (решение) |
Критерии оценки — Первое и пятое задания оцениваются в 5 баллов, каждый правильный ответ на 2-4 задания (под каждой буквой) оценивается в 1 балл. За неправильный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе – 19.. Рекомендуемый балл перевода баллов в рейтинг:
За неправильный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе – 19.. Рекомендуемый балл перевода баллов в рейтинг:
Балл | 0 — 7 | 8 — 13 | 14 — 16 | 17 — 19 |
Оценка |
Ответы на задания. Опция 1
Задание 1.
1. Распределение Р, неметалл
2. Находится в пятой группе ПС, основной подгруппе, в 3-х периодах.
3. 15 Рр+ 15 Н.0 16 1с.2 2с.2 2р.6 3 С.2 3п.5 3 Д.0
е.- 15
4. Неметаллические свойства в период слева направо увеличиваются.
5. Неметаллические свойства в группах сверху вниз уменьшаются
6. Р.2 О 5 — формула высшего оксида, проявляет окислительные свойства
7. РН.3
— Формула соединения водородной бухты, фосфина.
Задача 2.
а) 4.AI + 3 О.2 2 AI2 О.3 — Оксид алюминия, реакция соединения
b)MG. + Н.2 SO.4 (серная кислота)MG.SO.4 (сульфат магния) +H.2 — Реакция замещения
в)CaCo.3 (карбонат кальция)CA.O (оксид кальция) +Co.2 (оксид углерода (IV)) — реакция разложения
d) 2.HCl + №2 Co.3 2 Na.CI + Н.2 О+Co2 (оксид углерода (IV)) — реакция обмена
салониновая кислота карбонат натрия хлорид натрия гидроокись
Задача 3.
а) 3.Baci.2 + 2 Н.3 PO4 ВА.3 ( PO4 ) 2 + 6 HCI
хлорид Барий Фосфорная кислота Фосфат Барий Соленая кислота
3 В.2+ + 6Си.- + 6 Н.+ + 2 ПО.4 3- ВА.3 (PO.4 ) 2 + 6ч.+ + 6Си.-
3 В.2+ + 2 ПО.4 3- ВА.3 (PO.4 ) 2
б.) Ns.I + AGNO3 АГФРОМИ +.Н. № 3
серебро Серебро Серебро Серебро Нитрат Нитрат Азотная кислота
N.+ + ОТ МИ.- + АГ+ + №3 — АГФРОМИ +.Н.+ + №3 —
АГ+ + С.И.- АГ ФРОМИ.
Задание 4.
а) фосфор + кислород оксид фосфора (V.)
4П + 5О2
2р. 2
О 5
— Реакция соединения
2
О 5
— Реакция соединения
б) цинк + нитрат цинка азотнокислый + вода + оксид азота (IV)
Зн. +4 Н.№3 Зн.( № 3 ) 2 + 2 Н.2 О. + 2 №2 — Реакция замещения
c) хлорид бария + серная кислота сульфат бария + соляная кислота
Baci.2 + Н.2 SO.4 2 нс.И. + БАСО.4 — Реакция обмена
Задача 5.
Данар: Решение:
м.( CaCo.3
w.etc
В.м.Х. Г. — Чистый
В.( Co.2 ) — ? м.( CaCo.3 ) = 250 * 90/100 = 225
225в. л. — при условии задания
CaCo.3 + Н.2 SO.4 СА SO.4 + Н.2 О КОМПАНИИ + Co.2
В.( Co.2 ) = 225 * 22,4 / 100 = 50,4 литра.
Ответ:В.( Co.2 ) = 50,4 л.
Ответы на задания. Вариант 2.
Задание 1.
1. К — калий, металл.
2. Находится в ПС в первой группе, основной подгруппе, в четвертом периоде.
3. 19 ТОР+ 19 Н.0 20 1с.2 2с.2 2р.6 3 С.2 3P.6 3 Д.0 4С.1
е.- 19
6. Л.2 Формула высшего оксида, проявляющего основные свойства
Задание 2.
а) 2.Zn. + О.2 2 Zn.О- оксид цинка, реакция соединения
б)МГ. + 2 HCI (соляная кислота) MG.CI2 (хлорид магния) +H.2 -Замена
нана 2Х.2 О. (оксид водорода) 2H.2 + О.2 — реакция разложения
г)Н.2 SO.4 + К.2 Co.3 К.2 SO.4 + Н.2 О+Co2 (оксид углерода (IV)) — обменная реакция
Задание 3.
а) 3 ВА (NO3 ) 2 + 2ч.3 PO4 ВА.3 (PO.4 ) 2 + 6хн3
нитрат бария фосфорнокислый фосфат бария азотнокислый
3ba.2+ + 6но.3 — + 6ч.+ + 2PO4 3- ВА.3 (PO.4 ) 2 + 6Н + 6 НО3 —
3 В.2+ + 2 ПО.4 3- ВА.3 (PO.4 ) 2
б.) Na.FROMI + AGNO3 На.№3 + АГФРОМИ.
хлорид натрия нитрат серебра хлорид натрия
На+ + ОТ МИ.- + АГ+ + №3 — Na.+ + № 3 — + АГФРОМИ.
АГ+ + С.И.- АГ ФРОМИ.
Задача 4.
а) фосфор + кислород оксид фосфора (III)
4П + 3О2 2р.2 О 3 — Реакция соединения
б) цинк + хлористоводородная кислота хлорид цинка + водород
Zn. + 2 HCIZnci.2 + Н.2 — Реакция замещения
в) хлорид меди (II. ) + гидроксид натрия гидроксид меди (II.) + хлорид натрия
) + гидроксид натрия гидроксид меди (II.) + хлорид натрия
Cuci.2 +2 Наох.Cu.( Ой.) 2 + 2 NACI — Реакция обмена
Задание 5.
Данар: Решение:
м.( №2 Co.3 ) = 230. 1. Найдите много карбоната натрия.
мас.т.д. = 10% 100 г. С примесями — 90. Чистое вещество
В.м. = 22,4 л/моль 230 г. С примесями -X. Г. — Чистый
В.( Co.2 ) — ? м.( CaCo.3 ) = 230 * 90/100 = 207
2. Найдите объем углекислого газа.
207в. л. — при условии задания
№2 Co.3 +2 ХНО.3 2 На №3 + Н.2 О КОМПАНИИ + Co.2
106, 22,4 л. — по уравнению реакции
В.( Co.2 ) = 207 * 22,4 / 106 = 43,7л.
Ответ:В.( Co.2 ) = 43, 67 литров.
Учтено Согласованный иск
На заседании СМО заместитель директора по ЕГР директор МОУ Дмитриево
Протокол от _______2017 МОУ Дмитриево Пеляскинская СШ Пеляскинская С.С.
№__________ _________________ Витман Д.А. ______________ Дубровская Ю.А.
Протокол МС от ________ 2017 г. № _____ Приказ от ______ 2017 г. № _______
№ _____ Приказ от ______ 2017 г. № _______
Вариант 1
Упражнение 1. Задайте полный признак элементу с порядковым номером 25.
Задание 2.
№2 О2 + ТОМНО.4 + Н.2 SO.4 О.2 + МНСО.4 + К.2 SO.4 + Н.2 О.
Задание 3.
Баки.2 + Н.3 PO4
Задача 4.
№2 С.
Задание 5. Рассчитайте объем углекислого газа (с н.у.), если он выделился при взаимодействии 250 г мела, содержащего 10 % примесей, с серной кислотой.
Учтено Согласованный иск
На заседании СМО заместитель директора по ЕГР директор МОУ Дмитриево
Протокол от _______2017 МОУ Дмитриево Пеляскинская СШ Пеляскинская С.С.
№__________ _________________ Витман Д.А. ______________ Дубровская Ю.А.
Протокол МС от ________ 2017 г. № _____ Приказ от ______ 2017 г. № _______
Входной химический контроль 10 класс
Вариант 2.
Задание 1. Назовите полный признак элементу с порядковым номером 30.
Задание 2.Обеспечить реакцию методом электронных весов:
№2 С.ОБ3 + ТОМНО.4 + Н.2 О На.2 SO.4 + МНО.2 + Koh
Задание 3. Извлеките реакцию и запишите ее в ионной форме:
Aici.3 + Агно.3
Задание 4. Напишите гидролиз соли, в том числе в ионных формах:
Feci3
Задание 5. Рассчитайте объем водорода (ат. ед.), если он выделился при взаимодействии 240 г магния, содержащего 12 % примесей, с соляной кислотой.
Спецификация контрольно-измерительной работы
(входной контроль) по химии 10 класс
Назначение работы — контроль уровня подготовки учащихся по химии за 9 класс.
Затраты времени — 40 минут (1 занятие).
Общая характеристика содержания и структуры работы:
Работа состоит из одной части, содержащей 5 задач, требующих решения.
Использование заданий, направленных на проверку базового уровня подготовки по химии, знания и понимания важных элементов содержания (понятий, их свойств, задач и др. ), владение основными алгоритмами, умение применять знания при решении химические проблемы. При выполнении этих заданий учащиеся также должны продемонстрировать определенную систему знаний и широту представлений, умение переходить с одного химического языка на другой.
), владение основными алгоритмами, умение применять знания при решении химические проблемы. При выполнении этих заданий учащиеся также должны продемонстрировать определенную систему знаний и широту представлений, умение переходить с одного химического языка на другой.
Материалу подчинен материал основных химических блоков, по которым распределено содержание школьного курса химии: «Строение атома химического элемента», «Полная характеристика химического элемента» номенклатура неорганических веществ», «окислительно-восстановительные реакции», «ионообменные реакции», «гидролиз веществ», «Решение химических задач с использованием понятия о примесях».
№ задачи | Проверенные элементы содержимого | Уровень сложности | Тип задачи |
Структура атома химического элемента | Основание | Исполнение (решение) | |
Полная характеристика химического элемента | Основание | Исполнение (решение) | |
2,3 | Номенклатура неорганических веществ | Основание | Исполнение (решение) |
Окислительно-восстановительные реакции | Основание | Исполнение (решение) | |
Ионообменные реакции | Основание | Исполнение (решение) | |
Гидролизные вещества | Основание | Исполнение (решение) | |
Решение химических задач с использованием концепции примесей | Основание | Исполнение (решение) |
Критерии оценки — Первое и пятое задания оцениваются в 5 баллов, каждый правильный ответ на 2-4 задания оценивается в 2 балла. За неправильный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе — 16. Рекомендуемый балл перевода баллов в рейтинг:
За неправильный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе — 16. Рекомендуемый балл перевода баллов в рейтинг:
Балл | 0 — 7 | 8 — 11 | 12 — 14 | 15 — 16 |
Оценка |
Ответы на задания. Опция 1
Задание 1.
1. Mn — марганец, переходный металл.
2. Находится в ПС в седьмой группе, боковой подгруппе, в четвертом периоде.
3. 25 М.н.р+ 25 Н.0 30 1с.2 2с.2 2р.6 3 С.2 3P.6 3 д. 5 4С.2
е.- 25
4. Свойства металла в период слева направо ослабевают.
5. Повышены свойства металла в группах сверху
6. МН.2 О 7 — формула высшего оксида, проявляет амфотерные свойства
7. Формула соединения водородной бухты отсутствует
Задача 2.
5 №2 О2 + 2 ТОМНО.4 +3 Г.2 SO.4 5О.2 + 2мнсо.4 + К.2 SO.4 + 8ч.2 О.
МН.+7 + 5Э.- МН.+2 (Окислитель, Восстановление)
2 О.-1 -2Э.- 2О-2 (восстановитель, окисление)
Задача 3.
3 Бачи.2 + 2 Н.3 PO4 Т.3 ( PO4 ) 2 + 6NCI
3ba.2+ +6 Ки.- + 6ч.+ + 3ПО.4 3- Т.3 (PO.4 ) 2 + 6 Н.+ + 6Си.-
3 БА.2+ +3 PO4 3- Т.3 ( PO4 ) 2
Задача 4.
№2 С 2НА.+ + С.2-
Н.2 О Х.+ + О.-
2NA.+ + С.2- + Х.+ + О.- ГС.- + 2НА.+ + О.-
№2 С. + Н.2 О.НаХС. + Наох.
Получен в результате гидролиза кислой соли — гидросульфида натрия, раствор щелочной среды.
Задание 5.
Данар: Решение:
м.( CaCo.3 ) = 250 г. 1. Найдем массу чистого карбоната натрия.
мас.т.д. = 10% 100 г. С примесями — 90. Чистое вещество
В.м. = 22,4 л/моль 250 г. С примесями -X. Г. — Чистый
В.( Co.2 ) — ? м.( CaCo.3 ) = 250 * 90/100 = 225
2. Найдите объем углекислого газа.
225В. л. — при условии задания
CaCo.3 + Н.2 SO.4 СА SO.4 + Н.2 О КОМПАНИИ + Co.2
100 г. 22,4 литра. — по уравнению реакции
В.( Co.2 ) = 225 * 22,4 / 100 = 50,4 литра.
Ответ:В.( Co.2 ) = 50,4 л.
Ответы на задания. Вариант 2.
Упражнение 1.
1. Зн. — цинк, переходный металл.
2. Находится в ПС во второй группе, боковой подгруппе, в четвертом периоде.
3. 30 Zn.r+ 30 Н.0 25 1с.2 2с.2 2р.6 3 С.2 3P.6 3 д. 10 4С.2
е.- 30
4. Свойства металла в период слева направо ослабевают.
5. Улучшены свойства металлов в группах сверху
6. Zn. Формула высшего оксида, проявляет амфотерные свойства
7. Формула соединения водородной бухты отсутствует
Задача 2.
3NA2 С.ОБ3 + 2 ТОМНО.4 + Н.2 О 3 На.2 SO.4 + 2мно.2 +2 кох.
МН.+7 + 3Э.- МН.+4 (Окислитель, Восстановление)
С.+4 -2Э.- С.+6 (восстановитель, окисление)
Задание 3.
Аици.3 + 3АГНО.3 АИ (№3 ) 3 + 3 АГ CI
AI3+ + 3 КИ- + 3Ag+ +3 №3 — АИ3+ + 3НО.3 — + 3 АГ КИ
3 АГ+ + 3 КИ- 3 AGCI
Задача 4.
Feci3 ФЭ.3+ + 3CI-
Н.2 О Х.+ + О.-
ФЭ.3+ + 3CI- + Х.+ + О.- 3CI- + Х.+ + Fe О.2+
Feci3 + Н.2 О ФЭ О CI2 + Н Ки.
В результате гидролиза образуется основная соль — железо гидроксохлорид (III), Запасной раствор среды.
Задача 5.
Данар: Решение:
м.(МГ.) = 240. 1. Найти много чистого магния.
вес.т.д. = 12% 100 гр. С примесями — 88. Чистое вещество
В.м. = 22,4 л/моль 240 г. С примесями -X. G. — Чистый
V.(H.2 ) — ? м. (мг.) = 240 * 88/100 = 211,2 г.
2. Найдите объем углекислого газа.
211.2в. л. — при условии задания
Mg + 2hci MGCI2 + Н.2
24 грамм.. 22,4 литра. — по уравнению реакции
В.(Ко.2 ) = 211,2 * 22,4 / 24 = 197,12л.
Ответ:V.(H.2 ) = 197,12 л.
Учтено Согласованный иск
На заседании СМО заместитель директора по ЕГР директор МОУ Дмитриево
Протокол от _______2017 МОУ Дмитриево Пеляскинская СШ Пеляскинская С. С.
С.
№__________ _________________ Витман Д.А. ______________ Дубровская Ю.А.
Протокол МС от ________ 2017 г. № _____ Приказ от ______ 2017 г. № _______
Вариант 1
Упражнение 1
а) SN2 = Сн — сн3
б) СН3 — О — Ч4 SN3
в) SN3 — Ч3 — СН — Сотон г)г) СН3
СН3
Задача 2.
а) пентадиен — 1,3 В) 4 — метилфенол — 2
б) бутен — 2 г) 2,5 — диметел, 3 — этилгексан
Задача 3.
а) С.2 №5 Он + О.2 в) сн = с — сн3 + N.2 О
б) СН2 = Сн — сн2 — Ч4 + Н.КИ
Задача 4.
а) фенол б) уксусная кислота
Задание 5. Рассчитайте объем этилена при (н.у.), если он выделяется в результате реакции дегидратации 350 г раствора, содержащего 15% спирта.
Учтено Согласованный иск
На заседании СМО заместитель директора по ЕГР директор МОУ Дмитриево
Протокол от _______2017 МОУ Дмитриево Пеляскинская СШ Пеляскинская С.С.
№__________ _________________ Витман Д. А. ______________ Дубровская Ю.А.
А. ______________ Дубровская Ю.А.
Протокол МС от ________ 2017 г. № _____ Приказ от ______ 2017 г. № _______
Входной биохимический контроль 11 класс
Вариант 2.
Задание 1 Дайте названия веществам. К каким классам органических веществ они относятся?
а) SN3 — Ч4
б) СН3 — Ч3 — О. г) г) о.
в)C.6 Н.6
Задание 2. Составьте формулы веществ по названиям, подпишите названия под формулами веществ. К каким классам органических веществ они относятся?
а) 1 — метилбензол в) 2.2 — диметилбутанол — 1
б) Бутан г) Потин — 2
Задание 3. Приведите реакцию, дайте названия органическим веществам, укажите условия протекания реакций:
а) С.Н.4 + О.2 в) С.2 №5 ИС ОН
б) С.2 №6 + КИ2
Задание 4. Как распознать химическим путем:
а) ацетилен б) раствор куриной белки
Задание 5. Рассчитайте объем и количество вещества хлорформа при (н.у.), если оно выделяется в результате реакции хлорирования 78,2 л пропана.
Спецификация контрольно-проверочной работы
(Вводной контроль) по химии 11 класс
Назначение работы — Контроль уровня подготовки учащихся по химии за курс 10 класса.
Затраты времени — 40 минут (1 занятие).
Общая характеристика содержания и структуры работы:
Работа состоит из одной части, содержащей 5 задач, требующих решения.
Использование заданий, направленных на проверку базового уровня подготовки по химии, знания и понимания важных элементов содержания (понятий, их свойств, задач и др.), владение основными алгоритмами, умение применять знания при решении химические проблемы. При выполнении этих заданий учащиеся также должны продемонстрировать определенную систему знаний и широту представлений, умение переходить с одного химического языка на другой.
Материалу подчинен материал основных химических блоков, по которым распределено содержание школьного курса химии: «Номенклатура органических веществ», «Классификация органических веществ» «Составление формул органических веществ по их названия», «Химические свойства органических веществ», «Качественные реакции на органические вещества», «Решение химических задач на растворы», «Решение химических задач с использованием понятия молярного объема газообразного вещества».
№ задачи | Проверенные элементы содержимого | Уровень сложности | Тип задачи |
Номенклатура органических веществ | Основание | Исполнение (решение) | |
Классификация органических веществ | Основание | Исполнение (решение) | |
Составление формул органических веществ по их наименованиям | Основание | Исполнение (решение) | |
Химические свойства органических веществ | Основание | Исполнение (решение) | |
Качественные реакции на органические вещества | Основание | Исполнение (решение) | |
Решение химических задач для растворов | Основание | Исполнение (решение) | |
Решение химических задач с использованием понятия молярного объема газообразного вещества | Основание | Исполнение (решение) |
Критерии оценки — Каждое задание 1-4 оценивается в 1 балл, за каждую букву правильного ответа пятое задание оценивается в 5 баллов. За неправильный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе -18. Рекомендуемая оценка перевода баллов в рейтинг:
2
За неправильный ответ или отсутствие ответа выставляется 0 баллов. Максимальное количество баллов в работе -18. Рекомендуемая оценка перевода баллов в рейтинг:
2
Ответы на задания. Опция 1
Задание 1.
а) Пропен, алкены б) диэтиловый эфир, простые эфиры
в) 2-метилбутановая кислота, карбоновые кислоты
г) 1,2-димиллибензол, ароматические углеводороды (арена)
Задание 2. 900 Задание 2. 900
а) SN2 = СН — СН = СНФ3 Пентадиен — 1,3 (диеновые углеводороды)
б) SN3 — СН = СН — Ч4 _ Бутен-2 (алкены)
в) SN3 — СН(он)-сн2 — СН (Ч4 ) — СН3 4 — метилпеннол — 2 (простые спирты)
г) СН3 — СН (Ч4 ) — СН (с3 №5 ) — СН2 — СН (Ч4 ) — СН3 2.5 — Диметил, 3 — этилгексан (алканы)
Задание 3.
а) Д.2 №5 Он + 3О2 2 с2 + 3Н2 О в) СН = С — СН4 + N.2 О SN2 = СН
Этанол Пропаин Пропен-Ол-2
(Не) — Ч4
б) SN2 = Сн — сн2 — Ч4 + Н.КИ SN3 — СН (КИ) — SN2 — Ч4
Бент — 1 2-хлорбутан
Задание 4.
а) Д.6 №5 Он +3В.р. ОТ6 №2 (Бр.) 3 Он + 3НВр.
фенол 2,4,6-трибромфенол
б.) 2 SN3 Скоро + На.2 Co.3 2 SN3 Соона + Co.2 + Н.2 О.
Задание 5.
Данар: Решение:
м.(С2 №5 Он) = 350. 1. Найти много этилового спирта.
вес.= 15 % м. (ОТ2 №5 It) = 350 * 15/100 = 52,5
В.м. = 22,4 л/моль
В. (С2 Н.4 ) — ?
2. Найдите объем этилена.
52,5 гв. л. — при условии задания
ОТ2 №5 ОН С3 Н.4 + N.2 О
46. 22,4 л. — по уравнению реакции
В.(С.2 №4 ) = 52,5 * 22,4 / 46 = 25,6 л.
Ответ:В.(С2 Н.4 ) = 25,6 л.
Ответы на задания. Вариант 2.
Задание 1.
а) Этан, класс — алканы б) этанол, класс — одноматовые спирты
в) бензол, класс — арена г) фенол, класс фенола
Задание 2.
SN3
а) Класс 1-метилбензола — Арена
б) Бутан Ч4 — Ч3 — Ч3 — Ч4 Класс-расплавы С) 2.2 — Диметилбутанол — 1, класс — одноосновные спирты2 (Он) — С (Ч4 ) 2 — Ч3 — Ч4
г) копейки — 2, класс — алкина, сн3 — С = С — Ч3 — Ч4
Задача 3.
а) С.Н.4 +2 О.2 SO2 +2 Н.2 ОБ.2 SO.4
метан в) с3 №5 ОН С3 №4 + N.2 О
б) С.2 №6 + КИ2 ОТ2 №5 CI + N.CI Этанол этилен
этан Хлорэтан
Задача 4.
а) Качественная реакция на ацетилен — обесцвечивание бромной воды:
СН = СН +2Br.2 знак равно Хр.2 — Хр.2
1,1,2,2 — Тетрабромэтан
б) качественная реакция на раствор белка — реакция белка Санто:
скорость белка +.Cu.(О.) 2 = Красный раствор, реакция на пептидные связи и пептидную группу
Задание 5.
Данар: Раствор:
В.(С3 №8 ) = 78,2 л. 1. Найдите объем хлородоранта.
78,2 литраV. л. — при условии задания
ОТ3 №8 + КИ2 = С.3 №7 КИ + HCI
В.м. = 22,4 л/моль 22,4 л. 22,4 литра. — по уравнениям реакций
В (HCI) -?
н (HCI) -? V(HCI)=78,2*22,4/22,4=78,2л..
2. Найти количество вещества хлородор
н.(НСl) = В./ V.м.=78,2/22,4=3,5 моль
Ответ: V.(HCI) = 78,2 л,n.(HCI) = 3,5 моль
М. : 20. 1 3. — 2 40 с.
: 20. 1 3. — 2 40 с.
Учебное пособие является частью учебного комплекса по химии, основу которого составляет Учебное пособие Габриеляна О.С. «Химия. 9 класс, оформленное в соответствии с ФГОС. Учебное пособие состоит из текстов контрольно-проверочных работ, соответствующих программе по химии для 9 класс Габриелян О. С. Пособие предназначено для текущего и итогового контроля по основным темам курса
Формат: PDF
Размер: 2,2 МБ
Смотреть, скачать: drive.google
Содержание
Предисловие 3.
Тематические ревизионные работы
Периодический закон и периодическая система химических элементов Менделеев Д.И. 5
Химическая организация природы. Химические реакции. Скорость химической реакции 18
Положение металлов в периодической системе химических элементов Д. И. Менделеев. Физические свойства металлов. Сплавы 32.
Химические свойства металлов 42
Щелочные металлы и их соединения 53
Металлы II группы основной подгруппы 63
Алюминий и его соединения 73
Железо и его соединения 84
Общая характеристика неметаллов. Кислород, озон, воздух 95
Кислород, озон, воздух 95
Водород и вода 105
Галогены 116.
Подгруппа кислорода 126.
Азот и его соединения 137
Фосфор и его соединения 148
Углерод подгруппа 158.
Металлы 9.710la 9 010841 181.
Итоговое тестирование по курсу основной школы 193
Подготовка к государственной итоговой аттестации (ГИА)
Периодический закон Менделеева Д.И.
Структура атома 205
Химические реакции 211.
Химические свойства неорганических веществ 217
Приблизительные варианты GIA
Вариант 1 224.
Вариант 2 229.
Тест
. Контрольная работа по химии за 9 классЦель: Объективная оценка уровня освоения учебных достижений обучающихся в соответствии с ГОСО по химии за 1 полугодие
План и структура тестовых заданий:
В качестве измерителя знаний и навыков учащихся по химии, тестовые задания используются в первом полугодии. Работа состоит из 25 заданий. Они расположены по возрастанию сложности и разделены на 2 блока.
Они расположены по возрастанию сложности и разделены на 2 блока.
Блок НО содержит 20 заданий, на каждое из которых даны ответы. При выполнении этих заданий выберите правильные ответы из предложенных вариантов.
Блок B содержит 5 задач, при выполнении которых требуется написать решение.
Тест имеет следующую структуру:
Раздел «Электродиссоциация» включает 8 заданий, проверяющих диссоциацию веществ на ионы, степень диссоциации, составление уравнений в молекулярной, полной и сокращенной ионной форме
Раздел «Характеристика фосфора и его соединений» включает 3 задания на изучение строения атома, определение степеней окисления в соединениях фосфора, химические свойства
Раздел «Сера и ее соединения» включает 4 задания на изучение строение атома, свойства соединений
В раздел «Азот и его соединения» включены задания, проверяющие знание свойств соединений азота, строение атома и определение степеней окисления
Решение задач
Спецификация испытаний.
Номер квеста | Проверяемый элемент |
Блок А. | |
Электролит невыборный | |
Разъединяющие кислоты | |
Диссоциация солей | |
Сильный, слабый электролит | |
Сумма коэффициентов полного ионного уравнения | |
Определение веществ, реагирующих по уравнению восстановленных ионов | |
Определение среды индикатора | |
Металл, немметалл | |
Определение степени окисления серы в соединениях | |
Схема превращений соединений серы | |
Химические свойства серной кислоты | |
Номенклатура серной кислоты | |
Азотная кислота | |
Физические свойства аммиак | |
Химические свойства азотной кислоты | |
Электронная формула атома фосфора | |
Схема превращений соединений фосфора | |
Определение степени окисления фосфора в соединениях | |
Определение относительной молекулярной массы | |
Расчет массовых долей | |
Блок Б. | |
Расчет относительной плотности газов | |
Расчет количества веществ по формуле | |
Расчет массы вещества по уравнению реакции, если один из исходных материалов дан в избытке | |
Расчет массовой доли выхода продукта реакции по сравнению с теоретически возможным | |
Расчет объема газа по уравнению реакции, если один из исходных материалов дан в избытке | |
1 вариант
Блок А.
1. Электролит
A) H 2 SO 4 B) CH 4 C) O 2 D) C 2 H 5 OH E) CO 2 900 в) H 3 PO 4 C) H 2 SO 4 D) NaHSO 4 E) H 2 CO 3
D) 2AL 3+ + 3SO 4 2- E) 2AL 2+ + 3SO 4 3-
4. Слабый электролит
A) kcl c) koh c) hno 3 d) H 2 CO 3 E) VA ( OH) 2
A) 3 b) 11 c) 9 d) 12 e) 15
D) карбонат натрия и соляная кислота
E) карбонат натрия и вода
A) синий b) желтый c) красный
D) бесцветный e) оранжевый
8. Неметалл
Неметалл
A) Ba c) s c) mg d) cr e) cu
A) H 2 S b) SO 2 C) H 2 SO 3 D) s e) SO 3
A) оксид серы (v1) b) сероводород C) сера
A) медь b) азот C) цинк d) соляная кислота E) углекислый газ
A) сульфиды b) сульфаты c) сульфиты
A) HRO 2 B) H 2 RO 3 C) HRO 3 D) H 2 RO 4 E) H 2 RO 4
A) жидкий B) с резким специфическим запахом
C) хорошо растворим в воде
C) оксид кальция
A) 1S 2 2S 2 2P 6 3S 2 3P 1 B) 1S 2 2S 2 2P 6 3S 2 3P 2 C) 1S 2 2S 2 2P 6 3S 2 3P 3
O 2 + 3H 2 O 17. Вещества x 1 и x 2 в схеме преобразования P À x 1 à
H 3 EO 4 À x 2
A) x 1 — p 2 o 3, x 2 — na 3 po 4 c) x 1 -p 2 O 5, x 2 — NAH 2 PO 4 C) x 1 — p 2 O 5, x 2 — Na 3 Po четыре
A) P 2 O 3 B) P 2 O 5 C) HPO 3 D) H 3 PO 4 E) Na 3 P
A) 32 c) 31 c ) 34 г) 64 д) 68
Блок Б.
А) 8,5 б) 11,5 в) 9,5 Г) 12,5 Д) 15,5
А) 1 моль б) 2 моль в) 0,5 моль 5 моль г) 0,2 моль д) 5 мол.
А) 10,7г в) 19,4г в) 13,6г г) 17г д) 8,5
24. Масса аммиака, полученного при разложении 10,7г хлористого аммония, при массовой доле выхода аммиака 25% а) 3 ,4G в) 9,4G c) 0,85 г D) 1,7H E) 8,5
Масса аммиака, полученного при разложении 10,7г хлористого аммония, при массовой доле выхода аммиака 25% а) 3 ,4G в) 9,4G c) 0,85 г D) 1,7H E) 8,5
Вариант 2
Блок А.
1. Неэлектрит
A) NaCl c) C 2 CO 3) D) HNO 12 O 6 E) Na 2 CO 3
2. В две стадии диссоциировать
A) HCl c) H 3 PO 4 C) HNO 3 D) NaHSO 4 E) Na 2 CO 3
A) Fe 2+ + 3Cl — б) Fe + Cl в) 2Fe 3+ + 3Cl 3- г) Fe 3+ + 3Cl — Д) Fe 3+ + 3Cl +
4. Слабый электролит
А) HNO 3 Б) Н 2 СО 3 C) H 2 SO 4 D) HCl E) BACL 2
A) 3 b) 11 c) 17 d) 12 e) 14
A) FECO 3 + 2NAOH c) Fe (NO3) 2 + 2NAOH C) Fesio 3 + Lioh
A) синий b) желтый c) красный d) бесцветный e) оранжевый
8. Неметалл
A) sic c) na c) fe d) pb e) ba
A) 1 c) 2 s) 3 d) 4 e) 5
A) Bao B) Cu(OH) 2 C) HCl D) Na 2 CO 3 E) HNO 3
A) MgCl 2 c) H 3 PO 4 C) Fe Cl 2 D) BACL 2 E) Na 2 CO 3
А) сульфиды б) сульфаты в) сульфиты г) гидроксильные кислоты Д) гидросульфаты
А) газы б) без цвета и запаха в) немного тяжелее воздуха
A) кислород B) гидроксид натрия C) сульфат калия D) вода E) водород
A) нет 2 c) NO C) H 2 D) N 2 E) N 2 O
A) 108 c) 142 c ) 133 d) 88 e) 164
A) ортофосфорная кислота B) гидроксид калия C) оксид калия
A) P 2 O 3 B) P 2 O 5 C) H 3 PO 4 D) HPO 3 E) pH 3
А) 32 в) 17 в) 34 г) 64 д) 68
А) 50% в) 25% в) 40% г) 80% д) 65%
Блок Б.
А) 8.5 б) 11.5 в) 23 г) 17 Д) 15.5
А) 21г б) 14г в) 56г г) 28г д) 42г
А) 37г в) 166 с) 83г г) 40г д) 62г
А) 53,5г в) 107г в) 85г г) 10, 7G E) 85G
A) 22,4L C) 5,6 L (S) 2,8 л D) 11,2L E) 33,6
Ответы
1 Variant
Блок A.
1. Электролит.
А) Х. 2 СО. 4 B) CH 4 C) O 2 D) C 2 H 5 OH E) CO 2
2. Диссоциировать в одну стадию
А) HCL C) H 3 PO 4 C) H 2 SO 4 D) NaHSO 4 E) H 2 CO 3
3. При диссоциации солей Al 2 (SO 4) 3 образуются частицы
A) Al 3+ + SO 4 2- b) 2 Al +3 SO 4 C) 2AL 3- + 3SO 4 2+
D) 2Al 3+ + 3СО. 4 2- E) 2Al 2+ + 3SO 4 3-
4. Слабый электролит
A) kcl c) koh c) hno 3 D. ) Г. 2 Компания 3 E) va (OH) 2
5. Сумма всех коэффициентов в полном уравнении ионной реакции (NO 3) 2 + K 2 CO 3 =
1CA + 2NO. 3 + 2К + 1Ко 3 = 1CA Co. 3 +2 К + 2НО 3
3 + 2К + 1Ко 3 = 1CA Co. 3 +2 К + 2НО 3
А) 3. Б. ) 11 В) 9 г) 12 д) 15
6. Сокращенное ионное уравнение: 2H + + CO 3 2- = H 2 O + CO 2 соответствует взаимодействию
A) карбонат кальция и соляная кислота
C) карбонат натрия и кремниевая кислота
C) натрия и силикат соляной кислоты
D. ) карбонат натрия и соляной кислоты
E) карбонат натрия и воды
7. В растворе соляной кислоты лактий пурпурный становится
A) синим b) желтым C) красным
D) бесцветным e) оранжевый
8. Неметалл
A) BA. В) С. В) мг г) кр д) у.е.
9. Сера имеет степень окисления +6 в соединении
А) H 2 S б) SO 2 С) Н 2 SO 3 Г) с Е) Итак. 3
10. Вещество А в цепи конверсии: H 2 S → SO 2 → A → H 2 SO 4 → SO 2 B) сероводород C) сера
D) сульфид натрия E) сульфат натрия
11. Раствор серной кислоты взаимодействует с:
Раствор серной кислоты взаимодействует с:
A) медь b) азот C. ) цинк D) соляная кислота E) углекислый газ
12. Соли серной кислоты называются
D) гидроксокислоты E) гидросульфаты
13. Формула гидроксида характерна для азота:
A) HRO 2 B) H 2 RO 3 C. ) гр. 3 D) H 2 RO 4 E) H 2 RO 4
14. Физические свойства аммиака не учитываются
A. ) Жидкость B) с резким специфическим запахом
C) хорошо растворим в воде
D) легче воздуха E) бесцветный
15. Активность может реагировать с
A) серная кислота B) оксид углерода (IV)
C. ) оксид кальция
D) оксид азота (II) E) сульфат калия
16. Электронной формуле отвечает атом элемента фосфора
A) 1S 2 2S 2 2P 6 3S 2 3P 1 Б) 1S 2 2S 2 2P 6 3S 2 3P 2 С) 1с. 2 2 с. 2 2 шт. 6 3 с. 2 3 шт. 3
3
D) 1S 2 2S 2 2P 6 3S 2 3P 4 E) 1S 2 2S 2 2P 6 3S 2 3P 5
17. Вещества x 1 и x 2 в цепи преобразования P À x 1 À H 3 EO 4 À x 2
O 2 + 3H 2 O + 3NAOH
A) x 1 — p 2 O 3, x 2 — Na 3 PO 4 c) x 1 -p 2 O 5, x 2 — NAH 2 PO 4 В) Х. 1 — стр. 2 О. 5 , Х. 2 — Нац. 3 Заказ на поставку 4
D) х 1 — pH 3, х 2 — Na 2 HPO 4 E) X 1 — PCL 5, X 2 — Na 3 PO 4
18. Фосфор имеет отсутствие окисления в соединении:
A ) P 2 O 3 B) P 2 O 5 C) HPO 3 D) H 3 PO 4 E) Na. 3 P.
19. Относительная молекулярная масса сероводорода
А) 32 Б) 31 В) 34. Г) 64 д) 68
20. Массовая доля серы в оксиде серы (IV)
А) 50% В) 25% в) 40% г) 80% Д) 65%
Блок Б.
21. Относительная плотность аммиака по водороду Д. = НХ. 3 \ Г. 2 =17\2=8,5
3 \ Г. 2 =17\2=8,5
А) 8,5 Б) 11,5 в) 9,5 Г) 12,5 Д) 15,5
22. Для получения 11,2 л аммиака (NH 3) необходимо азота по количеству вещества
3Н. 2 + 3ч. 2 = 2НХ 3 В = В\в М. =11,2\2*11,2= 0,5
A) 1 моль b) 2 моль C. ) 0,5 моль D) 0,25 моль e) 5 моль
23. При взаимодействии 11,2 л водорода и 12,83 сульфида серы образуется масса сульфида
ч. 2 + С. = Г. 2 С. v. ( Н. )= В. \ В. М. =11,2\11,2= 1 v. ( С. )= м. \ М. = 12,88 \ 32 = 0,4 Расчет ведется по наименьшему. м. ( Ч. 2 С. )= v. * М. ( Н. 2 С. )= 0,4*34= 13,6г
)= v. * М. ( Н. 2 С. )= 0,4*34= 13,6г
А) 10,7г в) 19,4г В) 13,6г Г) 17г д) 8,5г
24. Масса аммиака, полученного при разложении 10,7г хлорида аммония, если масса доля выхода аммиака 25%
NH. 4 кл. = НХ. 3 + HCL v. ( NH. 4 кл. )= м. \ М. = 10,7Г\53,5 = 0,2 0,2моль = 100% х. моль = 25% х. моль = 0,2моль * 25%\100% = 0,05 м. ( НХ. 3 )= т. * М. ( НХ. 3 )= 0,05 * 17= 0,85
А) 3,4г в) 9,4г В) 0,85 Г) 1,7г д) 8,5г
25. При взаимодействии 32г меди с разбавленным раствором, содержащим 31,5г азотной кислоты, выделился газ объем (N. U.)
U.)
Cu + 4хн. 3 = Cu (№ 3 ) 2 + № 2 + Н. 2 О.
v. ( Cu. )= м. \ М. = 32Г\64 = 0,5 v. ()= м. \ М. = 31,5Г\63*4 = 0,125 расчет ведется по наименьшему. м. ( № 3 )= v. * В. М. ( № 2 )= 0,125*22,4=2 ,8
A) 22,4L C) 5,6 C) 2,8L D) 11,2L E) 33,6
Опция 2
Блок A.
1. Неэлектрит
A) NACL C ) K 2 CO 3 C) HNO 3 D. ) С. 6 Г. 12 О. 6 E) Na 2 CO 3
2. Диссоциировать в две стадии
A) HCl c) H 3 PO 4 C) HNO 3 D. ) NaHSO. 4 E) Na 2 CO 3
) NaHSO. 4 E) Na 2 CO 3
3 При диссоциации солей ФЭХЛ 3 образуются частицы
A) Fe 2+ + 3Cl — б) Fe + Cl в) 2Fe 3+ + 3Cl 3- D. ) ИП. 3+ +3 кл. — E) Fe 3+ + 3Cl +
4. Слабый электролит
A) hno 3 B. ) Г. 2 Компания 3 17 D) 12 E) 14
6. Сокращенное ионное уравнение: Fe 2+ + 2OH — = Fe(OH) 2 соответствует взаимодействию
A) FECO 3 + 2NAOH IN ) FE (№ 3 ) 2 + 2Наох. C) Fesio 3 + Lioh
D) FECL 2 + CU(OH) 2 E) FES + 2KOH
7. В растворе гидроксида натрия Purple Lacmus
A) синий B) желтый C ) красный Г) бесцветный Е) оранжевый
8. Неметалл
А) СИ В) на С) ж е) ба
9. Сумма коэффициентов в уравнении реакции серы с калием
А) 1 в) 2 с) 3 Г. ) 4 Е) 5.
) 4 Е) 5.
10. Оксид серы (VI) взаимодействует с
А ) Бао. B) Cu(OH) 2 C) HCl D) Na 2 CO 3 E) HNO 3
11. Ион SO 4 2- можно обнаружить с помощью
A) MgCl 2 c) H 3 PO 4 C) Fe Cl 2 Д. ) БАКЛ 2 E) Na 2 CO 3
12.xal соли серной кислоты, называемые
A) сульфиды b) сульфаты c) сульфиты D) гидроксильные формы
E. ) Гидросульфат
13. Не относится к физическим свойствам азота:
A) газ б) без цвета и запаха C. ) немного тяжелее воздуха
D
4
4 ) Незначительная растворимость в воде E) Низкая температура плавления и кипения
14. Аммиак вступает в соединение с
A) кислородом B) гидроксидом натрия C) сульфатом калия D. ) Вода
E) водород
15 .При взаимодействии азотной кислоты с металлами газ не выделяется
A) нет 2 IN) No. C) H 2 D) N 2 E) N 2 O
16. Если элемент имеет конфигурацию атомов 1s 2 2p 6p 6 3S 2 3P 3, то молярная масса высшего оксида P. , стр. 2 О. 5
Если элемент имеет конфигурацию атомов 1s 2 2p 6p 6 3S 2 3P 3, то молярная масса высшего оксида P. , стр. 2 О. 5
А) 108. В) 142. В) 133 г) 88 д) 164
17. Вещество А в цепи превращений: P → P 2 O 5 → A → K 3 PO 4
A) ортофосфорная кислота B) гидроксид калия C) оксид калия
D) метафосфорная кислота E) фосфор
18. Фостелирование фосфора -3 окислением в соединении
A) P 2 O 3 B) P 2 O 5 C) H 3 PO 4 D) HPO 3 E. ) РН 3
19. Относительная молекулярная масса аммиака
А) 32. В) 17. В) 34 г) 64 д) 68
20. Массовая доля серы в оксиде серы (VI)
А)2) 60%
В) 25% в) 40% г) 80% Д) 50% Блок Б.
21. Относительная плотность водорода по водороду
А) 8,5 б) 11,5 с) 23 Г. ) 17 E) 15,5
22. Для получения 3 моль аммиака (NH 3) необходим азот
A) 21г b) 14г c) 56г d) 28г E. ) 42г
) 42г
93.002 При взаимодействии 69 г натрия из 22,4 л азота, образуется нитрид натрия A) 37 г c) 166 г C) 83 г D) 40 г e) 62 г
24. Масса хлорида аммония, полученного из 34 г аммиака, если массовая доля выход хлорида аммония 50%
А) 53,5 В) 107г в) 85г г) 10,7г д) 85г
25. При взаимодействии 32г меди с концентрированным раствором, содержащим 31,5г азотной кислоты, выделился коричневый газ выделенного объема (н.е.)
A) 22,4л c) 5,6 C) 2,8л D) 11,2л E) 33,6
Заключительные испытания
Вариант 1
2 2 По ряду элементов о s s те уменьшаются 1) Атомы радиуса 3) Неметаллические свойства
2) Свойства металлов 4) Количество электронов на внешнем слое
2. Оксид S (Vi) соответствует кислоте
1) H 2 SO 4 2) Н 2 С. 3) H 2 SO 3 4) К 2 SO 4
3. Среди металлов Au, Hg, W, Na, Cu, Zn наиболее тугоплавкие
Среди металлов Au, Hg, W, Na, Cu, Zn наиболее тугоплавкие
1) медь 2) натрий 3) золото 4) вольфрам
4. Молекулярно-кристаллическая решетка
1) Натрий и кислород 3) вода и кислород
2) Водород и хлористый калий 4) графит и двуокись углерода
5. Для взаимодействия 1 моль алюминия с соляной кислотой потребуется ___ оох кислоты
1) 1 2) 2 3) 3 4) 4
6. Формула высшего оксида элемента, имеющего строение электронной оболочки 2,8,7
1) Р 2 О 3 2) СО 3. 3) SL 2 O 7 4) Al 2 O 3
7. Ряд Zn(OH)2, H2CO3, NaOH соответственно представляет собой гидроксиды
1) Основной, кислотный, амфотерный
2)
3)
4)
8. Реакция водорода с оксидом меди (II) относится к реакциям
1) Соединения 2) обмен 3) Замена 4) разложение
9. Наиболее активно реагирует с водой
Наиболее активно реагирует с водой
1) калий 2) литиевый 3) натрий 4) рубидий
10.
Cu(OH)2 + HCl равен
1) 4 2) 5 3) 6 4) 8
11. Какой атом имеет такое же строение внешнего слоя, как и ион Na+?
В ответе укажите русское название элемента, в именительном падеже.
12. А с соляной кислотой и гидроксидом натрия будет взаимодействовать
1) Кох. 2) Н 3 ПО 4 3) ВЕ (ОН) 2 4) ТЗ 3. 5) Зно. 6) Al 2 O 3
13. Полное предложение. Продуктами взаимодействия калия с водой являются гидроксид калия и _______________.
14.
1) Нет 0. 2) Fe 3+ 3) Cu 0 4) Ф 0. 5) Ва 2+
15.
1) 2AL (OH) 3 Al 2 O 3 + 3H 2 O
2) Fe 2 O 3 + 3C 2FE + 3CO
3) 2NA + H 2 2NAH
4) Lioh + HCl LICL + H 2 O
5) Zn + Feso 4 Fe + ZNSO 4
Ответ запишите в виде последовательности цифр.
16.
Объем водорода ( скважина .), образовавшийся при взаимодействии 26 г. цинка с раствором серной кислоты составляет ______ л. .
Итоговая контрольная работа
Вариант 2.
1. В ряду элементов Si P S CL увеличение
1) Атомы радиуса 3) Неметаллические свойства
2) Свойства металлов 4) Количество уровней энергии
2. Оксид N (III) соответствует кислоте
1) HNO 2. 2) HNO 3. 3) НХ 3. 4) Нано 2.
3 . Среди металлов Au, Hg, W, Na, Cu, Zn очень мягкие, режет ножом
1) медь 2) натрий 3) золото 4) вольфрам
4 . Вещества с металлической кристаллической решеткой
1) Кремний и Теллур 3) Галлий и хлор
2) Литий и азот 4) Кальций и золото
5. При взаимодействии 3 молей цинка с серной кислотой образуется _____ моль водорода
При взаимодействии 3 молей цинка с серной кислотой образуется _____ моль водорода
1) 1 2) 2 3) 3 4) 4
6. Формула высшего оксида элемента, имеющего строение электронной оболочки 2,8,5
1) Р 2 О 3 2) СО 3. 3) Р 2 О 5 4) Al 2 O 3
7. Ряд вариантов (OH) 2, Ba (OH) 2, H 3 PO 4 соответственно представляет собой гидроксиды
1) Основной, амфотерный, кислотный
2) Кислота основная амфотерная
3) амфотерная, кислотная, основная
4) амфотерный, основной, кислотный
8. Необратимая химическая реакция произойдет при слиянии растворов веществ формулы:
1.Koh и NaCl 3.cucl 2 и Koh
2.MgCl 2 и HNO 3 4.al 2 (SO 4) 3 и Cu (NO 3) 2
9. С разбавленной серной кислотой не взаимодействует
1) ртуть 2) алюминий 3) цинк 4) железо
10. Сумма коэффициентов в сокращенном ионном уравнении
Сумма коэффициентов в сокращенном ионном уравнении
Fe(OH)3 + HNO3 равна
1) 4 2) 5 3) 6 4) 8
11. У какого атома такое же строение внешнего слоя, как у Иона Са 2+?
В ответ укажите русское название элемента в именительном падеже.
12. А с серной кислотой и гидроксидом калия будет взаимодействовать
1) NaOH 2) Al(OH) 3 3) HNO 3 4) FECL 2 5) BEO 6) Zn(OH) 2
Ответ запишите в виде последовательности чисел.
13. Полное предложение. Продуктами взаимодействия натрия с водой являются водород и _______________ натрий.
14. Нестабильными свойствами обладают
1) Na + 2) Cu 0 3) Al 0 4) Ca 0 5) Fe 3+
Ответ запишите в виде последовательности цифр.
15. Окислительно-восстановительные реакции носят окислительный характер + C Zn + Co
5) Ca(OH) 2 + 2HNO 3 Ca(NO 3) 2 + 2H 2 O
Ответ запишите в виде последовательности цифр.
16. Объем кислорода ( л. ) необходимый для окисления 25,6 г. медь ______ л. . В бланке ответа запишите число до сотых.
Критерии оценивания
Максимальное количество тестов по тесту-22, из них по заданиям части 1 — 10 (за задание 1 балл), части 2 -12 (за задание 2 балла) . Следующие оцениваются в -3 балла.
Баллы за оценки:
Решение задач
Часть 1
Номер квеста
Вариант 1
Вариант 2.
Часть 2
Номер квеста
Опция 1 Вариант 2. Гидроксид
Домашнее задание по химии 9. Какая помощь по химии нужна школьнику
Ось ви и дпидишли на уроках химии к изучению важных тем более подробно — различия, химические реакции, органические слаги, углеводы, спирты, кислоты. Давайте сразу к задачам, результаты лабораторных вы выиграете, а после результатов напишете работу. Защитите свои знания о дерматологии в химии, обладая большими знаниями. А вонь формируется процессом удачной свадьбы и повторением уроков. Прости себя за девятый класс химии. Ваш специальный консультант находится на свободе, если у вас нет проинструктированного учителя, а отцы не должны брать уроки.
Давайте сразу к задачам, результаты лабораторных вы выиграете, а после результатов напишете работу. Защитите свои знания о дерматологии в химии, обладая большими знаниями. А вонь формируется процессом удачной свадьбы и повторением уроков. Прости себя за девятый класс химии. Ваш специальный консультант находится на свободе, если у вас нет проинструктированного учителя, а отцы не должны брать уроки.
Найти разгадки задач по химии
Если вам несложно разобраться, например, во взаимосвязях между речами и взаимными превращениями, которые можно сделать со стороны другого путешествия, то взгляните на готов- сделал домашнее задание по химии за 9 класс. Все, что вы не до конца поняли, что пропустили на уроке, объясните решение. Причем настолько просто и доступно, что за домашнее задание снимаешь 12 баллов. Не забудьте поделиться секретами высоких оценок с другими девятиклассниками. Даже если для кого-то из них девятый класс станет выпускным, одинаковые оценки по тем же предметам обуви могут быть начислены.
Читать химию онлайн — лучшее решение для современных школьников
Поскольку домашнее задание по химии стало для вас приключением, поспешите изменить ситуацию. Пользуйтесь ГДЗ с химией для 9 класса с удовольствием, даже если это так просто! Со своего телефона или компьютера зайдите на сайт GDZ4YOU, где вы сможете проверить скин. Пользуйтесь ими бесплатно и без регистрации. Если вы не знаете гайда разных авторов, то на сайте вы можете найти информацию о нужном гайде. Независимо от того, что вы знаете, портал всегда доступен. Один ум — подключение к Интернету.
Будь вундеркиндом с решением
Кожаный предмет, который можно прочитать в школьном макете девятиклассников с помощью книги решений 9-го класса. В том числе и по географии, так как она многогранна и универсально познаваема. Это объект, который позволяет многое узнать обо всем мире — суше, океанах. С ней учащиеся могут для урока петь пивночи в пивной день, посещать различные пивкулы земли. С помощью контурных карт школьники начинают применять и узнавать отличия. И смрады атласа, и карты смрада могут рассказать богатую историю о коже материка.
И смрады атласа, и карты смрада могут рассказать богатую историю о коже материка.
Изображения обложек учебников представлены на страницах данного сайта исключительно в качестве иллюстративного материала (статья 1274, пункт 1 части четвертой Гражданского кодекса Российской Федерации)
- Химия 9 класс. задачник Кузнецова, Левкин Вентана -Граф
- Химия 9 класс. ФГОС Рудзитис, Фельдман Образование
- Контрольно-проверочная работа по химии 9 класс. ФГОС Габриелян, Краснова Дрофа
- Контрольно-измерительные материалы (КИМ) по химии 9 класс. ФГОС Стрельникова Waco
Рабочие тетради
- Габриелян, Сладков Дрофа
- Тетрадь для оценки качества знаний по химии 9 класс. ФГОС Габриелян, Купцова Дрофа
- Рабочая тетрадь по химии 9 класс. ФГОС Габрусева Просветительская тетрадь по химии
9335 Гара Просвещение- Тетрадь-референт по химии 9 класс. ФГОС Бобылева, Бирюлина Образование
- Рабочая тетрадь по химии 9 класс.
 ФГОС Боровских. К учебнику Рудзитиса Экзамен
ФГОС Боровских. К учебнику Рудзитиса Экзамен - Рабочая тетрадь по химии 9 класс. ФГОС Микитюк. К учебнику Габриеляна Экзамен
Контрольные работы
ГДЗ — три буквы, которые решат задачи в школе
- Химия — достаточно специфический предмет, и с каждым учебным годом разбираться в нем становится не так просто, как раньше. Разобраться с некоторыми темами за несколько школьных уроков не всегда удается, нанимать репетитора иногда не по карману финансово, поэтому помощники произвели настоящий фурор.
- Если вы обычный школьник и химия для вас не самый понятный предмет — ГДЗ ваше спасение. Если вы отличник, но хотите узнать дополнительные алгоритмы решения, подробно разобрать сложную задачу или хотите проверить себя, то это решение для вас. Если вы родитель и совсем забыли, что есть валентность и химические формулы, и проверяете домашнюю работу, которая нужна вашему ученику — эта книга-решение станет идеальным помощником. Если вы учитель химии, который хочет строго контролировать учебный процесс и, не решая самостоятельно задачи, быстро узнать ответ — эта книга — подсказка поможет и вам.

- Сейчас почти в каждом книжном магазине можно купить учебник по химии, но стоит ли отдавать деньги навсегда, если вам нужен всего один учебный год. Гораздо проще скачать электронную версию ГДЗ в интернете или поискать ответы в сети. В один небольшой файл поместится вся программа по химии для 9 класса. Благодаря ГДЗ химия станет доступнее, а изучение приятнее.
- Многие девятиклассники выбирают химию в качестве дисциплины, которую планируют сдавать на ОГЭ. В первую очередь это те выпускники, которые планируют поступать в медицинские и сельскохозяйственные вузы, где этот предмет является ведущим и базовым. Грамотное отношение к напряженной работе, ответственность, скрупулезность помогут девятиклассникам эффективно подготовиться. В помощь — качественный комплект учебных пособий и решений к ним. Достаточно регулярно выделять определенное количество времени на подготовку, и результат не заставит себя ждать.
- С помощью ГДЗ можно не только подготовиться к ВПР, диагностическим и итоговым тестам.
 Сборники позволят самостоятельно работать на предметных олимпиадах по дисциплине. Для девятиклассников его победа может означать возможность поступления в вузы после окончания одиннадцатого класса без внутренних экзаменов или с другими привилегиями. За победившими в 9-м классе преимущество сохраняется на следующие два года. Необходимый для подготовки комплект учебной, методической и информационной литературы школьники могут сформировать самостоятельно или обратившись за помощью к специалистам — школьным учителям, тьюторам, вожатым кружков и курсов.
Сборники позволят самостоятельно работать на предметных олимпиадах по дисциплине. Для девятиклассников его победа может означать возможность поступления в вузы после окончания одиннадцатого класса без внутренних экзаменов или с другими привилегиями. За победившими в 9-м классе преимущество сохраняется на следующие два года. Необходимый для подготовки комплект учебной, методической и информационной литературы школьники могут сформировать самостоятельно или обратившись за помощью к специалистам — школьным учителям, тьюторам, вожатым кружков и курсов. - Наиболее сложными для изучения и понимания учащимися являются такие разделы дисциплины химия в 9 классе, как:
— химические элементы и их характеристика;
— периодическая система Д. И. Менделеева и периодический закон;
— реакции и их катализаторы;
— понятия и свойства металлов и неметаллов с точки зрения химии;
— неорганические вещества и их основные свойства. - Ряд методических пособий предполагает подготовку к итоговой аттестации в течение последней четверти учебного года.
 Вы также можете формировать собственные учебные материалы, ориентируясь на свои задачи и цели. В этот комплект помимо стандартного учебного пособия Теоретически должны входить:
Вы также можете формировать собственные учебные материалы, ориентируясь на свои задачи и цели. В этот комплект помимо стандартного учебного пособия Теоретически должны входить:
— рабочая тетрадь по химии;
— тетрадь для практических и лабораторных опытов;
— проверка и контроль работы;
— тесты, задачи и упражнения по химии. - Для обучающихся самостоятельно и находящихся на семейной форме обучения в комплект могут быть включены рабочие программы и планы уроков по химии для 9 класса, методические разработки учителей и экспертов, тетради и сборники для оценки качества знаний.
Готовые домашние задания (ГДЗ) к учебнику Рудзитиса Г.Э. «Химия. 9 класс— книга, включающая решенные примеры и задачи. Не окажут ли готовые ответы медвежью услугу девятикласснику? Многие учителя говорят, что такое пособие — спасательный круг для школьников, плохо успевающих по химии. И всех интересующихся по химии, желающие продолжить обучение дальше, смогут проверить свои ответы и решения
Какая помощь по химии нужна школьнику
Не каждый предмет школьники усваивают без проблем. Некоторые даже с 8 класса имеют отношение к химии как к очень сложной и непонятной науке.Проблемы начинаются тогда, когда нужно запомнить химические знаки,валентность,уметь определять коэффициенты в уравнениях и производить расчеты.Трудности могут быть временными и ученику просто нужно более уверенно понимать материал,который непонятно для него
Некоторые даже с 8 класса имеют отношение к химии как к очень сложной и непонятной науке.Проблемы начинаются тогда, когда нужно запомнить химические знаки,валентность,уметь определять коэффициенты в уравнениях и производить расчеты.Трудности могут быть временными и ученику просто нужно более уверенно понимать материал,который непонятно для него
С помощью ГДЗ ребенок начнет понимать суть вопросов и заданий, предложенных в учебнике Рудзитиса. Помимо уравнений реакций и ответов на задания, в книге решений приведены аргументированные пояснения и алгоритмы действий. Эти образцы помогут девятикласснику лучше выполнять учебные задания в классе и дома.
Как пользоваться ГДЗ?
Книга решений подходит для закрепления и самопроверки изученных на уроках тем. Первая глава, которую изучают по учебнику Рудзитиса, — «Электролитическая диссоциация» — один из самых сложных разделов химии. Автор также включил несколько тем из органической химии, основ химической промышленности. Благодаря ГДЗ девятиклассник сможет проверить выполнение наиболее сложных заданий учителя на уроке, домашнего задания. Многие используют его для поиска ошибок в расчетах или уравнениях реакций, из-за которых ответ не сходится.
Многие используют его для поиска ошибок в расчетах или уравнениях реакций, из-за которых ответ не сходится.
Пособие дает родителям школьников возможность увидеть, каковы успехи ребенка в освоении химии. Книга позволяет контролировать учебную работу и помогает в усвоении сложного курса. Руководство можно использовать на нашем веб-сайте в режиме онлайн. Для каждого переиздания учебника Рудзитиса предлагается свой вариант ГДЗ.
Урок грамоты с презентацией «буквы «ш», «ш» Презентация в дошкольной группе буквы ш
Научно-техническая жизнь губернии
AP Химия – Студенты AP
Не студент?
Посетите AP Central, чтобы получить ресурсы для учителей, администраторов и координаторов.
AP Химия
Перейти к моей точке доступа
О курсе
Узнайте об основных понятиях химии, включая структуру и состояние вещества, межмолекулярные силы и реакции. Вы будете проводить практические лабораторные исследования и использовать химические расчеты для решения проблем.
Примечание: Сохраняйте лабораторные журналы и отчеты; колледжи могут попросить вас увидеть их, прежде чем предоставить вам кредит.
Навыки, которым вы научитесь
Эквивалентность и предварительные условия
Эквивалент курса колледжа
Годовой вводный курс общей химии в колледже
Рекомендуемые предварительные требования
Курсы средней школы по химии и алгебре Exam07 3007 II 9 9
Свидание
О блоках
Содержание курса, изложенное ниже, организовано в виде общеизучаемых единиц обучения, которые
предоставить одну возможную последовательность для курса. Ваш преподаватель может решить организовать курс
контента по-разному в зависимости от местных приоритетов и предпочтений.
Содержание курса
Блок 1: Атомная структура и свойства
Вы узнаете о составе атомов и о том, как ученые измеряют и классифицируют эти молекулярные строительные блоки.
Темы могут включать:
- Моль и молярная масса
- Масс-спектроскопия элементов
- Элементный состав чистых веществ
- Состав смесей
- Атомная структура и электронная конфигурация
- Фотоэлектронная спектроскопия
- Периодические тренды
- Валентные электроны и ионные соединения
7–9% от экзаменационного балла
Модуль 2: Молекулярная и ионная структура и свойства соединений
Вы узнаете о множестве химических связей и о том, как их структура может влиять на свойства создаваемых молекул.
Темы могут включать:
- Типы химических связей
- Внутримолекулярная сила и потенциальная энергия
- Структура ионных твердых тел
- Структура металлов и сплавов
- Диаграммы Льюиса
- Резонанс и официальное обвинение
- VSEPR и гибридизация связи
7–9% от экзаменационного балла
Блок 3: Межмолекулярные силы и свойства
Вы узнаете, как атомы собираются вместе, чтобы создавать твердые тела, жидкости и газы, и как субатомные силы управляют свойствами всего вокруг вас.
Темы могут включать:
- Межмолекулярные силы
- Твердые вещества, жидкости и газы
- Кинетическая молекулярная теория
- Растворы и смеси
- Фотоэлектрический эффект
18–22% от экзаменационного балла
Раздел 4: Химические реакции
Вы научитесь различать физические и химические процессы, а также измерять и выражать химические реакции с помощью химических уравнений.
Темы могут включать:
- Введение для реакций
- Сводные ионные уравнения
- Представления реакций
- Физические и химические изменения
- Стехиометрия
- Типы химических реакций
7–9% от экзаменационного балла
Раздел 5: Кинетика
Вы изучите различные методы наблюдения за изменениями, происходящими во время химической реакции, и последствиями ряда реакций.
Темы могут включать:
- Скорость реакции
- Введение в закон о тарифах
- Элементарные реакции
- Модель столкновения
- Введение в механизмы реакции
- Энергетический профиль многоступенчатой реакции
- Катализ
7–9% от экзаменационного балла
Раздел 6: Термодинамика
Вы узнаете об изменениях энергии в химических реакциях и о том, как передача энергии может изменить физические свойства вещества.
Темы могут включать:
9 Эндотермические и экзотермические процессы 1370 Теплопередача и тепловое равновесие Теплоемкость и калориметрия Энергия фазовых переходов Введение в энтальпию реакции Энтальпия образования Закон Гесса 7–9% от экзаменационного балла
Раздел 7: Равновесие
Вы наметите, как химические реакции меняются с течением времени, что заставляет вещества достигать равновесия и как системы реагируют, когда это равновесие нарушается.
Темы могут включать:
- Введение в равновесие
- Расчет константы равновесия
- Расчет равновесных концентраций
- Введение в принцип Ле Шателье
- Введение в равновесие растворимости
- рН и растворимость
- Свободная энергия растворения
7–9% от экзаменационного балла
Раздел 8: Кислоты и основания
Вы узнаете больше о рН, качествах и свойствах кислот и оснований, а также о том, как они взаимодействуют в химических реакциях.
 Если элемент имеет конфигурацию атомов 1s 2 2p 6p 6 3S 2 3P 3, то молярная масса высшего оксида P. , стр. 2 О. 5
Если элемент имеет конфигурацию атомов 1s 2 2p 6p 6 3S 2 3P 3, то молярная масса высшего оксида P. , стр. 2 О. 5  ) 42г
) 42г  Среди металлов Au, Hg, W, Na, Cu, Zn наиболее тугоплавкие
Среди металлов Au, Hg, W, Na, Cu, Zn наиболее тугоплавкие Наиболее активно реагирует с водой
Наиболее активно реагирует с водой
 При взаимодействии 3 молей цинка с серной кислотой образуется _____ моль водорода
При взаимодействии 3 молей цинка с серной кислотой образуется _____ моль водорода Сумма коэффициентов в сокращенном ионном уравнении
Сумма коэффициентов в сокращенном ионном уравнении
Номер квеста
Вариант 1
Вариант 2.
Номер квеста
Гидроксид
 Давайте сразу к задачам, результаты лабораторных вы выиграете, а после результатов напишете работу. Защитите свои знания о дерматологии в химии, обладая большими знаниями. А вонь формируется процессом удачной свадьбы и повторением уроков. Прости себя за девятый класс химии. Ваш специальный консультант находится на свободе, если у вас нет проинструктированного учителя, а отцы не должны брать уроки.
Давайте сразу к задачам, результаты лабораторных вы выиграете, а после результатов напишете работу. Защитите свои знания о дерматологии в химии, обладая большими знаниями. А вонь формируется процессом удачной свадьбы и повторением уроков. Прости себя за девятый класс химии. Ваш специальный консультант находится на свободе, если у вас нет проинструктированного учителя, а отцы не должны брать уроки.
 И смрады атласа, и карты смрада могут рассказать богатую историю о коже материка.
И смрады атласа, и карты смрада могут рассказать богатую историю о коже материка. ФГОС Боровских. К учебнику Рудзитиса Экзамен
ФГОС Боровских. К учебнику Рудзитиса Экзамен
 Сборники позволят самостоятельно работать на предметных олимпиадах по дисциплине. Для девятиклассников его победа может означать возможность поступления в вузы после окончания одиннадцатого класса без внутренних экзаменов или с другими привилегиями. За победившими в 9-м классе преимущество сохраняется на следующие два года. Необходимый для подготовки комплект учебной, методической и информационной литературы школьники могут сформировать самостоятельно или обратившись за помощью к специалистам — школьным учителям, тьюторам, вожатым кружков и курсов.
Сборники позволят самостоятельно работать на предметных олимпиадах по дисциплине. Для девятиклассников его победа может означать возможность поступления в вузы после окончания одиннадцатого класса без внутренних экзаменов или с другими привилегиями. За победившими в 9-м классе преимущество сохраняется на следующие два года. Необходимый для подготовки комплект учебной, методической и информационной литературы школьники могут сформировать самостоятельно или обратившись за помощью к специалистам — школьным учителям, тьюторам, вожатым кружков и курсов.— химические элементы и их характеристика;
— периодическая система Д. И. Менделеева и периодический закон;
— реакции и их катализаторы;
— понятия и свойства металлов и неметаллов с точки зрения химии;
— неорганические вещества и их основные свойства.
 Вы также можете формировать собственные учебные материалы, ориентируясь на свои задачи и цели. В этот комплект помимо стандартного учебного пособия Теоретически должны входить:
Вы также можете формировать собственные учебные материалы, ориентируясь на свои задачи и цели. В этот комплект помимо стандартного учебного пособия Теоретически должны входить: — рабочая тетрадь по химии;
— тетрадь для практических и лабораторных опытов;
— проверка и контроль работы;
— тесты, задачи и упражнения по химии.
 Некоторые даже с 8 класса имеют отношение к химии как к очень сложной и непонятной науке.Проблемы начинаются тогда, когда нужно запомнить химические знаки,валентность,уметь определять коэффициенты в уравнениях и производить расчеты.Трудности могут быть временными и ученику просто нужно более уверенно понимать материал,который непонятно для него
Некоторые даже с 8 класса имеют отношение к химии как к очень сложной и непонятной науке.Проблемы начинаются тогда, когда нужно запомнить химические знаки,валентность,уметь определять коэффициенты в уравнениях и производить расчеты.Трудности могут быть временными и ученику просто нужно более уверенно понимать материал,который непонятно для него Многие используют его для поиска ошибок в расчетах или уравнениях реакций, из-за которых ответ не сходится.
Многие используют его для поиска ошибок в расчетах или уравнениях реакций, из-за которых ответ не сходится.





 С., Сорокин В.В.
С., Сорокин В.В. А., Мещерякова Л. М.
А., Мещерякова Л. М. И. Шарапа
И. Шарапа
 Н., Ахметов М.А.
Н., Ахметов М.А. Л., Бирюлина Е.В.
Л., Бирюлина Е.В. С., Остроумов И.Г.
С., Остроумов И.Г. Е., Василевская Е.И.
Е., Василевская Е.И. С., Остроумов И.Г.
С., Остроумов И.Г.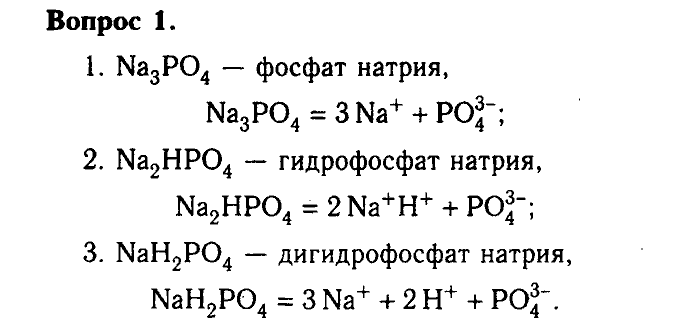 М.
М. Д. Микитюк
Д. Микитюк А.
А. С., Аксёнова И.В.
С., Аксёнова И.В. Е. Шиманович О. И. Сечко
Е. Шиманович О. И. Сечко С. Аксенова И.В.
С. Аксенова И.В. А. Лашевская А.А.
А. Лашевская А.А. М.
М. Е. Кузнецова А.Н. Левкин
Е. Кузнецова А.Н. Левкин М. Радецкий
М. Радецкий С. Габриелян А.В. Купцова
С. Габриелян А.В. Купцова И. Борушко
И. Борушко А.
А. А.
А. Б. Сакарьянова К.Н.
Б. Сакарьянова К.Н. Березкин П.Н.
Березкин П.Н. М.
М. М.
М. А. Боровских
А. Боровских