РАЗРАБОТКИ | 8 классВ категории разработок: 52 Фильтр по целевой аудитории — Целевая аудитория -для 1 классадля 2 классадля 3 классадля 4 классадля 5 классадля 6 классадля 7 классадля 8 классадля 9 классадля 10 классадля 11 классадля учителядля классного руководителядля дошкольниковдля директорадля завучейдля логопедадля психологадля соц.педагогадля воспитателя Урок разработан для УМК Г.Е. Рудзитиса, Ф.Г. Фельдмана. Основная цель данного урока – это обобщить и закрепить знания обучающихся о первоначальных химических понятиях; активизация познавательной деятельности и повышение мотивации обучающихся к изучению химии. Развитие интереса учащихся к химии и активизация их познавательной деятельности, при использовании нестандартных игровых форм учебной деятельности. Урок проводится в форме турнира.
Методы: словесные, наглядные, использование ИКТ, проблемно-поисковые.
Целевая аудитория: для 8 класса Цели игры:
Целевая аудитория: для 8 класса Методическая разработка урока на тему «Кислоты» включает в себя презентацию и конспект урока. Урок изучения нового материала по теме, знакомит учащихся с классом неорганических соединений — кислотами, их общей формулой, классификацией, распространением в природе. Так же учащиеся получат возможность познакомиться с основными неорганическими кислотами.
Целевая аудитория: для 8 класса Методическая разработка включает конспект первого урока химии в 8 классе + презентация.
Целевая аудитория: для 8 класса Данная разработка урока соответствует программному материалу.Используемый учебник: О.С.Габриелян «Химия 8 класс». Методы и приемы выбраны в соответствии с возрастными и индивидуальными особенностями обучающихся, используется личностно-ориентированный подход обучения. На уроке применяются различные формы работы: фронтальная работа, работа в парах, индивидуальная работа. Творческие задания, проблемная ситуация способствуют развитию познавательных способностей учеников, воспитанию социально значимых качеств личности. В течение урока учащиеся оценивают себя самостоятельно, используя листы самооценки с разработанными критериями оценки. В материале урока прослеживаются межпредметные связи, связь с жизнью. Дети учатся анализировать и обобщать материал, делать самостоятельно выводы, искать дополнительную информацию в различных источниках ( книги, компьютерные и медиа-пособия). Для повышения интереса к обучению использована мультимедийная презентация.
Целевая аудитория: для 8 класса Обобщающий урок по теме «Соединения химических элементов» по химии 8 класс. Урок проводится в форме игры-путешествия. Такая форма способствует качественному закреплению материала. Цель урока: выявить и закрепить знания учащихся по пройденным темам с помощью заданий и стандартных типовых задач.
Целевая аудитория: для 8 класса Разработка предназначена для учащихся восьмых классов по теме «Окислительно-восстановительные реакции» (учебник О.С.Габриеляна. Химия. 8 класс). С помощью презентаций учащимся легче усваивать метод электронного баланса, постигать сложные процессы окисления и восстановления.
Целевая аудитория: для 8 класса Урок готовился для участия в конкурсе «Учитель года». Урок рассчитан для учащихся 8 класса и занимающихся по учебнику Рудзитис. Цель:изучение физических свойств, способов получения, распространение водорода. Форма урока: Урок-объяснение нового материала. Оборудование: компьютер, проектор, презентация.
Целевая аудитория: для 8 класса Данная тема изучается в разделе «Соединения химических элементов» на уроках химии в 8 классе и занимает одно из главных мест, т.к. здесь идёт знакомство с важнейшими соединениями веществ, которые нас окружают. Знания, полученные на данном уроке, будут востребованы при изучении химических свойств разделе «Свойства растворов электролитов» и при изучении курса химии в 9, 11 классах, при подготовке к ГИА и ЕГЭ.
Целевая аудитория: для 8 класса Урок формирования новых знаний и способов действий (учебник Габриелян О.С. Химия. 8 класс. базовый уровень) Цель урока: развивать познавательную деятельность учащихся через химический эксперимент, продолжить формирование умения участвовать в обсуждении и отстаивать свою точку зрения; развивать навыки работы в условиях личного контроля с использованием различных форм самоконтроля. Уроку предшествует подготовка учащимися продвинутого уровня демонстрационных опытов, под руководством учителя. В ходе урока учащиеся расширяют свои представления о физических и химических явлениях, отличительных признаках химических реакций не только наблюдая видеоопыты,но самостоятельно проводя опыты. Целевая аудитория: для 8 класса | Конкурсы Диплом и справка о публикации каждому участнику! |
www.uchportal.ru
ВСЕ УРОКИ ХИМИИ — 8 класс — конспекты уроков — уроки химии — План урока — Конспект урока — Планы уроков — разработки уроков по химии
ПРЕДИСЛОВИЕ
Календарно-тематический план
ПОВТОРЕНИЕ ОСНОВНЫХ ВОПРОСОВ КУРСА ХИМИИ 7 КЛАССА
УРОК 1. Тема. Основные понятия химии
УРОК 2. Тема. Простые вещества кислород и железо
Тема 1. КОЛИЧЕСТВО ВЕЩЕСТВА. РАСЧЕТЫ ПО ХИМИЧЕСКИМ ФОРМУЛАМ
УРОК 3. Тема. Количество вещества. Моль — единица количества вещества. Стала Авогадро
УРОК 4. Тема. Вычисление количества атомов (молекул) в определенном количестве вещества
УРОК 5. Тема. Молярная масса
УРОК 6. Тема. Вычисление по химическим формулам молярной массы и количества вещества
УРОК 7. Тема. Молярный объем газов. Вычисление объема газа при нормальных условиях
УРОК 8. Тема. Относительная плотность газов. Вычисление относительной плотности
УРОК 9. Тема. Расчеты по химическим формулам
УРОК 10. Тема. Тематическое оценивание по теме «Количество вещества. Расчеты по химическим формулам»
Тема 2. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
УРОК 11. Тема. Основные классы неорганических соединений
УРОК 12. Тема. Оксиды, их состав и названия. Классификация оксидов
УРОК 13. Тема. Кислоты, их состав и названия. Классификация кислот
УРОК 14. Тема. Соли (средние), их состав и названия
УРОК 15. Тема. Основания, их состав и названия. Классификация основ
УРОК 16. Тема. Физические и химические свойства оксидов
УРОК 17. Тема. Оксиды в природе. Использование оксидов
УРОК 18. Тема. Физические и химические свойства кислот
УРОК 19. Тема. Химические свойства кислот. Реакции замещения и обмена. Меры безопасности при работе с кислотами. Использование кислот
УРОК 20. Тема. Расчеты по химическим уравнениям массы, объема, количества вещества реагентов и продуктов реакции
УРОК 21. Тема. Промежуточное оценивание по теме «Физические и химические свойства оксидов и кислот»
УРОК 22. Тема. Физические свойства оснований. Химические свойства щелочей
УРОК 23. Тема. Реакция нейтрализации. Разложение нерастворимых оснований в процессе нагрева
УРОК 24. Тема. Понятие о амфотерные основания
УРОК 25. Тема. Техника безопасности при работе с щелочами. Использование основ
УРОК 26. Тема. Техника безопасности при работе с щелочами. Использование основ
УРОК 27. Тема. Распространение солей в природе и их практическое значение
УРОК 28. Тема. Практическая работа № 1. Исследование свойств основных классов неорганических соединений
УРОК 29. Тема. Генетическая связь между классами неорганических соединений
УРОК 30. Тема. Генетическая связь между классами неорганических соединений
УРОК 31. Тема. Промежуточное оценивание по теме «Основные классы неорганических соединений»
УРОК 32. Тема. Анализ промежуточного оценивания и корректировки знаний учащихся. Итоговый урок за i семестр
УРОК 33. Тема. Общие способы получения оксидов, оснований, кислот, солей
УРОК 34. Тема. Общие способы получения оксидов, оснований, кислот, солей
УРОК 35. Тема. Значение экспериментального метода в химии
УРОК 36. Тема. Практическая работа № 2 «Решение экспериментальных задач»
УРОК 37. Тема. Расчеты по химическим уравнениям массы, объема, количества вещества реагентов и продуктов реакции
УРОК 38. Тема. Обобщение и систематизация знаний по теме «Основные классы неорганических соединений»
УРОК 39. Тема. Тематическое оценивание по теме «Основные классы неорганических соединений»
Тема 3. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА. СТРОЕНИЕ АТОМА
УРОК 40. Тема. Исторические сведения о способах классификации химических элементов
УРОК 41. Тема. Понятие о щелочные металлы, инертные элементы, галогены
УРОК 42. Тема. История открытия периодического закона и периодической системы химических элементов Д. И. Менделеева
УРОК 43. Тема. Периодический закон и периодическая система химических элементов Д. И. Менделеева
УРОК 44. Тема. Строение атома: ядро и электронные оболочки. Состав атомных ядер
УРОК 45. Тема. Современная формулировка периодического закона Изотопы
УРОК 46. Тема. Состояние электронов в атоме
УРОК 47. Тема. Строение электронных оболочек атомов. Энергетические уровни и подуровни
УРОК 48. Тема. Строение электронных оболочек атомов
УРОК 49. Тема. Структура периодической системы в свете теории строения атома
УРОК 50. Тема. Взаимосвязь между размещением элементов в периодической системе и свойствами химических элементов, простых веществ, соединений элементов с Гідрогеном и Оксигеном
УРОК 51. Тема. Характеристика химических элементов по положению в периодической системе химических элементов и строению атома
УРОК 52. Тема. Характеристика химических элементов по положению в периодической системе химических элементов и строению атома
УРОК 53. Тема. Тематическое оценивание по теме «Периодический закон и периодическая система химических элементов Д. И. Менделеева. Строение атома»
УРОК 54. Тема. Значение периодического закона. Жизнь и деятельность Д. И. Менделеева
Тема 4. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
УРОК 55. Тема. Электронная природа химической связи. Понятие об электроотрицательности
УРОК 56. Тема. Ковалентная связь, его виды — полярная и неполярная. Образования ковалентной неполярной и полярной видов связи
УРОК 57. Тема. Ионный связь
УРОК 58. Тема. Ковалентная полярная и неполярная связь, ионная связь. Электронные формулы молекул веществ
УРОК 59. Тема. Кристаллические решетки. Атомные, молекулярные и ионные кристаллы
УРОК 60. Тема. Зависимость физических свойств веществ от типов кристаллических решеток
УРОК 61. Тема. Степень окисления
УРОК 62. Тема. Определение степени окисления атомов элементов по химическим формулам соединений
УРОК 63. Тема. Составление формул соединений по известной степенью окисления атомов элементов
УРОК 64. Тема. Окислительно-восстановительные реакции
УРОК 65. Тема. Химическая связь и строение вещества
УРОК 66. Тематическое оценивание по теме «Химическая связь и строение вещества»
ЛИТЕРАТУРА
schooled.ru
химия 8 класс уроки габриелян — Видео
Видео:
Габриелян О. С. 8 класс §1 «Химия — часть естествознания» В этом видео мы начинаем изучение курса химии 8-го.
Габриелян О. С. 8 класс §28 «Химические уравнения» Учимся записывать химические уравнения реакций. Знаком
Химия 8 класс. Первоначальные понятия. Производство фильма — Кинокомпания Сова-фильм http://www.sova-film.com http://www
Габриелян О. С. 8 класс §38 «Ионные уравнения». Внимание! Тема, участвующая в ЕГЭ, ОГЭ, ВПР, олимпиадах и т.д…
Габриелян О. С. 8 класс §29 «Расчёты по химическим уравнениям» ВСЕ К НАМ! Ребята, решаем задачи с использова
Видеоуроки являются идеальными помощниками при изучении новых тем, закреплении материала, для обычных.
Габриелян О. С. 8 класс §44 «Окислительно-восстановительные реакции». ВНИМАНИЕ! Одна из ключевых тем в ЕГЭ,.
Габриелян О. С. 8 класс §36 «Электролитическая диссоциация». Батарейки, аккумуляторы и другие источники и..
Видеоуроки являются идеальными помощниками при изучении новых тем, закреплении материала, для обычных.
Видеоуроки являются идеальными помощниками при изучении новых тем, закреплении материала, для обычных.

Зайчик допустил большую ошибку — вылил краску на скатерть! Попробовал отстирать, но ничего не получилос…

С 15 по 28 февраля 2016 в поселке Сукко, на территории всероссийского детского центра «Смена», прошел фестив…

С 15 по 28 февраля 2016 в поселке Сукко, на территории всероссийского детского центра «Смена», прошел фестив…

Здраствуйте дорогие друзья и с вами снова Алина Болобан мастер по древнеяпонскому искуству Канзаши и н…

Официальный Интернет-магазин \r(видео уроки и материалы Игоря Сахарова) \rЗаписаться на мастер класс Иго…

Образец машинного вязания ажурный полуфанг. Подходит для оформления женской вязаной одежды. Раппорт на…
hytube.ru
видеоуроки химия 8 класс габриелян — Видео
Видео:
Габриелян О. С. 8 класс §1 «Химия — часть естествознания» В этом видео мы начинаем изучение курса химии 8-го.
Габриелян О. С. 8 класс §38 «Ионные уравнения». Внимание! Тема, участвующая в ЕГЭ, ОГЭ, ВПР, олимпиадах и т.д…
Тема видео: «Степень окисления. Химия 8 класс». В данном видео рассмотрены следующие вопросы: — что такое…
Габриелян О. С. 8 класс §28 «Химические уравнения» Учимся записывать химические уравнения реакций. Знаком
Габриелян О. С. 8 класс §29 «Расчёты по химическим уравнениям» ВСЕ К НАМ! Ребята, решаем задачи с использова
Габриелян О. С. 8 класс §39 «Кислоты, их классификация и свойства». ЕГЭ, ОГЭ, ВПР — еще одна важная тема! Разби
Габриелян О. С. 8 класс §37 «Основные положения теории электролитической диссоциации». Разговоры про элек
Габриелян О. С. 8 класс §42 «Соли, их классификация и свойства». Соль, перец, горчица — вкусно! Куда мы без сол
Габриелян О. С. 8 класс §30 «Реакции разложения». ФУ! Разложение! Слово «разложение» даже на слух воспринима
Габриелян О. С. 8 класс §44 «Окислительно-восстановительные реакции». ВНИМАНИЕ! Одна из ключевых тем в ЕГЭ,.

Школьная физика видеоуроки 9 класс Колебания и волны Пружинный маятник…

Master class is preparing for March 8! Casket from jute 2019, jute filigree «EVA».Мастер — класс готовимся к 8 Марта! Шкатулка из джута 2019, джу…

квнга дайындык. пародия «үнді махаббаты» (Кульсары) унди махаббаты 8 класс №8 мектеп (LIKE)…
http://www.aster-c.com.ua/freelessons…
Ты хорошо усвоил материал урока? \rПроверь себя — пройди несложный тест: \rСкачать видео урок, его текстов…
hytube.ru
Рабочая программа по химии 8 класс, Габриелян
Пояснительная записка
Рабочая программа учебного курса химии для 8 класса «Химия» составлена в соответствии со следующими нормативно-правовыми инструктивно-методическими документами:
Федеральный закон от 29.12.2012 № 273 -ФЗ «Об образовании в РФ» п.5 ч.3 ст.47; п.1 ч.1 ст. 48
Федерального государственного образовательного стандарта общего образования, утверждённым приказом Минобразования России от 05.03.2004 г. №1089 «Об утверждении федерального компонента государственных стандартов начального общего, основного общего и среднего (полного) общего образования»;
Примерной программы среднего (полного) общего образования по химии общеобразовательных учреждений;
Авторской программы О.С. Габриелян Химия 8 кл (Сборник: Программы курса химии для 8-11 классов общеобразовательных учреждений-2-е издание –М.: Дрофа, 2011г)
Локальные акты образовательного учреждения: Устав МБОУ «Мисцевская ООШ №1»; Основной образовательной программы МБОУ «Мисцевская ООШ №1» Учебного плана школы на 2015-2016 учебный год.
Программа детализирует и раскрывает содержание стандарта, определяет общую стратегию обучения, воспитания и развития учащихся средствами учебного предмета в соответствии с целями изучения химии которые определены стандартом.
Структура документа.
Программа включает несколько разделов: пояснительную записку; основное содержание с примерным распределением учебных часов по разделам курса и рекомендуемую последовательность изучения тем и разделов; требования к уровню подготовки; список дополнительной литературы для учителя и обучающегося.
Федеральный базисный учебный план для общеобразовательных учреждений Российской Федерации отводит 68 учебных часов для обязательного изучения химии в 8 классе основной школы из расчета 2 учебных часов в неделю.
Изучение химии в основной школе направлено на достижение следующих целей:
освоение важнейших знаний об основных понятиях и законах химии, химической символике;
овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций;
развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения практических задач в повседневной жизни, предупреждения явлений, наносящих вред здоровью человека и окружающей среде
Данная программа содержит все темы, включенные в федеральном компонентом содержания образования. Основное содержание курса химии 8 класса составляют сведения о химическом элементе, строении вещества, закономерностях протекания реакций и их классификации.
Методические особенности изучения предмета:
Значительное место в содержании курса отводится химическому эксперименту. Он открывает возможность формировать у учащихся специальные предметные умения:
работать с веществами;
выполнять простые химические опыты;
учит школьников безопасному и экологически грамотному обращению с веществами в быту и на производстве.
Рабочая программа ориентирована на учебник: О.С. Габриелян «Химия 8 кл» /10-е издание, переработанное- М.: Дрофа, 2011
Усвоение учебного материала реализуется с применением основных групп методов обучения и их сочетания:
Методами организации и осуществления учебно-познавательной деятельности: словесных (рассказ, учебная лекция, беседа), наглядных (иллюстрационных и демонстрационных), практических, проблемно-поисковых под руководством преподавателя и самостоятельной работой учащихся.
Методами стимулирования и мотивации учебной деятельности: познавательных игр, деловых игр.
Методами контроля и самоконтроля за эффективностью учебной деятельности: индивидуального опроса, фронтального опроса, выборочного контроля, письменных работ.
Используются следующие средства обучения: учебно-наглядные пособия (таблицы, карты и др.), организационно-педагогические средства (карточки, билеты, раздаточный материал).
Формы организации работы учащихся:
коллективные: урок, консультация, лабораторная работа, урок-игра (путешествие, виртуальный музей, викторина, др.), урок-экскурсия; парные и групповые творческие или исследовательские задания и др.;
индивидуальные: работа с учебником и дополнительной литературой, определенными электронными источниками информации, выполнение индивидуальных заданий учебного, творческого или исследовательского характера, работа с обучающими программами за компьютером и др.
Формы организации образовательного процесса
уроки-лекции
уроки-собеседования
уроки-соревнования
уроки с групповыми формами работы
уроки взаимообучения учащихся
уроки творчества
уроки, которые ведут обучающиеся
уроки-зачеты
уроки-творческие отчеты
уроки-конкурсы
уроки-игры
уроки-диалоги
уроки-семинары
СОДЕРЖАНИЕ ПРОГРАММЫ
Введение (9 часов)
Для чего нужно изучать химию.
Химия – наука о веществах, их свойствах и превращениях. Понятие о химическом элементе и формах его существования. Превращение веществ. Роль химии. Краткие сведения из истории возникновения и развития химии.
Химическая символика. Знаки химических элементов. Химические формулы. Индексы и коэффициенты. Относительная атомная и молекулярная массы. Расчет массовой доли химического элемента по формуле вещества.
Периодическая система химических элементов Д. И. Менделеева, ее структура: малые и большие периоды, группы и подгруппы (главная и побочная).
Валентность химических элементов. Валентность постоянная, переменная, высшая, низшая. Определение валентности по химической формуле. Составление химических формул по валентности.
Расчетные задачи. Нахождение относительной молекулярной массы вещества. Вычисление массовой доли химического элемента в веществе по его формуле.
Практические работы. 1. Приемы обращения с лабораторным оборудованием в кабинете химии. Правила техники безопасности на уроках химии.
Атомы химических элементов (10 часов)
Основные сведения о строении атома. Доказательства сложности строения атома. Планетарная модель атома. Состав атомных ядер: протоны, нейтроны. Изменение числа протонов – образование новых химических элементов. Изменение числа нейтронов – образование изотопов. Изотопы как разновидности атомов одного химического элемента.
Электроны. Строение электронных оболочек атомов химических элементов №1 — № 20 периодической системы Д.И. Менделеева. Понятие о завершенном электронном слое.
Физический смысл порядкового номера, номера периода и номера группы.
Изменение числа электронов на внешнем электронном слое – образование положительных и отрицательных ионов. Причины изменения металлических и неметаллических свойств, радиуса атома в периодах и группах.
Понятие об ионной связи. Схема образования ионной связи. Ковалентная неполярная химическая связь. Электронные и структурные формулы. Электроотрицательность. Понятие о ковалентной полярной связи. Понятие о металлической связи. Образование металлических кристаллов.
Простые вещества (4 часа)
Положение металлов и неметаллов в периодической системе химических элементов Д.И. Менделеева. Простые вещества – металлы железо, алюминий, кальций, магний, натрий, калий. Общие физические свойства металлов.
Простые вещества – неметаллы, образованные атомами кислорода, водорода, азота, серы, фосфора, углерода. Аллотропия. Аллотропные модификации кислорода, фосфора, олова.
Постоянная Авогадро. Количество вещества. Моль. Молярная масса. Молярный объем газообразных веществ. Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро».
Расчетные задачи. Вычисление молярной массы веществ по химическим формулам. Расчеты с использованием понятий «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро».
Демонстрации. Некоторые металлы и неметаллы количеством вещества 1 моль. Модель молярного объема газообразных веществ.
Соединения химических элементов (14 часов)
Степень окисления. Составление формул бинарных соединений. Представители оксидов и летучих водородных соединений.
Основания, их состав и названия. Классификация оснований. Таблица растворимости. Индикаторы. Изменение окраски индикаторов в щелочной среде.
Кислоты, их состав и названия. Классификация кислот. Изменение окраски индикаторов в кислой среде.
Соли. Построение названий солей. Растворимость солей. Представители солей.
Аморфные и кристаллические вещества. Типы кристаллических решеток: ионная, атомная, молекулярная и металлическая. Зависимость свойств веществ от типов кристаллических решеток.
Вещества молекулярного и немолекулярного строения. Закон постоянства состава для веществ молекулярного строения.
Чистые вещества и смеси. Способы разделения смесей. Массовая и объемная доли компонента смеси. Расчеты, связанные с использованием понятия «доля».
Расчетные задачи. 1.Расчет массовой и объемной долей компонентов смеси веществ. 2. Вычисление массовой доли вещества в растворе. 3. Вычисление массы растворяемого вещества и растворителя, необходимых для приготовления определенной массы раствора с известной массовой долей растворенного вещества.
Демонстрации. Образцы оксидов, кислот, оснований и солей. Получение нерастворимых оснований. Растворение концентрированных кислот и некоторых солей в воде, связанные с изменением температуры. Модели кристаллических решеток хлорида натрия, алмаза, графита, оксида углерода (IV), магния, натрия. Способы разделения смесей: дистилляция, действие магнитом и отстаивание.
Лабораторные опыты. 1. Действие растворов щелочей на индикаторы. 2. Действие растворов кислот на индикаторы.
Практические работы. 2. Очистка загрязненной поваренной соли. 3. Приготовление раствора сахара и определение массовой доли сахара в растворе.
Изменения, происходящие с веществами (12 часов)
Физические и химические явления. Признаки и условия протекания химических реакций. Понятие об экзо- и эндотермических реакциях.
Закон сохранения массы веществ. Химические уравнения. Составление химических уравнений. Типы химических реакций: соединения, разложения, замещения, обмена. Реакция нейтрализации.
Расчеты по химическому уравнению. Решение задач на нахождение количества вещества, массы или объема продукта реакции или исходного вещества по известной массе, объему или количеству вещества исходного вещества или продукта реакции.
Расчетные задачи. 1. Вычисление по химическому уравнению массы или количества вещества, объема по известной массе, количеству вещества или объему газа одного из вступивших в реакцию веществ или продуктов реакции. 2. Вычисление массы, количества вещества или объема продукта реакции, если известна масса раствора и массовая доля растворенного вещества.
Демонстрации. Примеры физических явлений: плавление парафина, возгонка бензойной кислоты, растворение перманганата калия. Примеры химических явлений: горение магния, взаимодействие мрамора с соляной кислотой, получение нерастворимого основания и растворения его в растворе кислоты. Типы химических реакций: разложение малахита, замещение меди из раствора меди железом, реакция нейтрализации между растворами гидроксида натрия и соляной кислоты.
Растворы. Реакции ионного обмена и окислительно-восстановительные реакции (18 часов)
Растворение как физико-химический процесс. Насыщенные, ненасыщенные и пересыщенные растворы. Значение растворов.
Понятие об электролитической диссоциации. Электролиты и неэлектролиты. Степень электролитической диссоциации. Сильные и слабые электролиты.
Основные положения теории электролитической диссоциации. Ионные уравнения и условия протекания их до конца.
Кислоты, основания, соли в свете теории электролитической диссоциации. Их классификация и характерные химические свойства в свете ТЭД.
Генетические ряды металла и неметалла. Генетическая связь между классами неорганических соединений.
Окислительно-восстановительные реакции Окислитель и восстановитель. Окисление и восстановление. Метод электронного баланса.
Демонстрации. Испытание веществ и их растворов на электропроводность. Движение окрашенных ионов в электрическом поле. Зависимость электропроводности уксусной кислоты от концентрации.
Лабораторные опыты. 1. Реакции характерные для растворов кислот. 2. Реакции характерные для растворов щелочей. 3. Реакции характерные для растворов солей. 4. . Реакции характерные для основных оксидов.
Практические работы. 6. Условия протекания химических реакций до конца. 7. Ионные реакции. 8. Свойства оксидов, кислот, оснований и солей. 9. Решение экспериментальных задач.
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ УЧАЩИХСЯ:
В результате изучения химии ученик должен
знать/понимать:
химическую символику: знаки химических элементов, формулы химических веществ и уравнения химических реакций;
важнейшие химические понятия: химический элемент, атом, молекула, относительные атомная и молекулярная массы, ион, химическая связь, вещество, классификация веществ, моль, молярная масса, молярный объем, химическая реакция, классификация реакций, электролит и неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление;
основные законы химии: сохранения массы веществ, постоянства состава, периодический закон;
уметь:
называть: химические элементы, соединения изученных классов;
объяснять: физический смысл атомного (порядкового) номера химического элемента, номеров группы и периода, к которым элемент принадлежит в периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в пределах малых периодов и главных подгрупп; сущность реакций ионного обмена;
характеризовать: химические элементы (от водорода до кальция) на основе их положения в периодической системе Д.И. Менделеева и особенностей строения их атомов; связь между составом, строением и свойствами веществ; химические свойства основных классов неорганических веществ;
определять: состав веществ по их формулам, принадлежность веществ к определенному классу соединений, типы химических реакций, валентность и степень окисления элемента в соединениях, тип химической связи в соединениях, возможность протекания реакций ионного обмена;
составлять: формулы неорганических соединений изученных классов; схемы строения атомов первых 20 элементов периодической системы Д.И. Менделеева; уравнения химических реакций;
обращаться с химической посудой и лабораторным оборудованием;
распознавать опытным путем: растворы кислот и щелочей, хлорид-, сульфат-, карбонат-ионы;
вычислять: массовую долю химического элемента по формуле соединения; массовую долю вещества в растворе; количество вещества, объем или массу по количеству вещества, объему или массе реагентов или продуктов реакции;
использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
безопасного обращения с веществами и материалами;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека;
критической оценки информации о веществах, используемых в быту;
приготовления растворов заданной концентрации.
Учебно-тематическое планирование
Химия 8 класс
№
Наименование разделов и тем
Всего
Количество часов
часов
теоретические
практические
1.
Введение в химию
9
8
1
2.
Атомы химических элементов
10
10
3.
Простые вещества
4
4
4.
Соединения химических
14
12
2
элементов
5.
Изменения, происходящие с
12
10
2
веществами
6.
Растворы. Реакции ионного
18
14
4
обмена. Окислительно-
восстановительные реакции
Итого
67
58
9
График проведения практических работ по химии.
№
Тема практической работы
Период проведения
1.
Практическая работа №1. «Приемы обращения с лабораторным оборудованием в кабинете химии»
2.
Практическая работа №2. «Очистка загрязненной поваренной соли»
3.
Практическая работа №3. «Приготовление раствора сахара и определение массовой доли сахара в растворе»
4.
Практическая работа №4. «Признаки химических реакций»
5.
Практическая работа №5. «Реакция обмена между оксидом меди и раствором серной кислоты»
6.
Практическая работа №6. «Условия протекания химических реакций до конца»
7.
Практическая работа №7. «Ионные реакции»
8.
Практическая работа №8. «Свойства оксидов, кислот, оснований и солей»
9.
Практическая работа №9. «Решение экспериментальных задач»
График проведения контрольных работ
№
Тема контрольной работы
Дата проведения
1
Контрольная работа №1«Атомы химических элементов»
2
Контрольная работа №2. «Соединения химических элементов»
3
Контрольная работа № 3«Изменения, происходящие с веществами»
4
Контрольная работа №4. «Растворы. Реакции ионного обмена и окислительно-восстановительные реакции»
Календарно-тематическое планирование
Химия 8 класс
№
урока
Тема урока
Кол-во часов
Плани-руемая дата
Факти-ческая дата
1
2
3
4
5
Введение (9 часов)
1
Для чего нужно изучать химию? Правила техники безопасности в кабинете химии.
1
2
Предмет химии. Вещества.
1
3
Практическая работа №1. «Приемы обращения с лабораторным оборудованием в кабинете химии»
1
4
Превращение веществ. Роль химии в нашей жизни.
1
5
Относительная молекулярная масса. Решение расчетных задач.
1
6
Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов.
7
Химическая формула. Относительная молекулярная масса.
8
Расчеты по химическим формулам.
9
Валентность химических элементов.
Атомы химических элементов (10 часов)
10
Основные сведения о строении атомов.
1
11
Изотопы.
1
12
Строение электронных оболочек атомов.
13
Периодическое изменение свойств элементов и простых веществ.
1
14
Ионы и ионная химическая связь.
1
15
Ковалентная неполярная связь.
1
16
Ковалентная полярная связь.
1
17
Металлическая связь.
1
18
Обобщение темы: «Атомы химических элементов»
1
19
Контрольная работа №1
«Атомы химических элементов»
1
Простые вещества (4 часа)
20
Простые вещества – металлы.
1
21
Простые вещества – неметаллы.
1
22
Количество вещества. Число Авогадро.
1
23
Молярная масса. Молярный объем.
1
Соединения химических элементов (14 часов)
24
Степень окисления элементов.
1
25
Бинарные соединения металлов и неметаллов.
1
26
Основания.
1
27
Кислоты.
1
28
Соли.
1
29
Повторение классов неорганических соединений.
1
30
Кристаллические решетки.
1
31
Чистые вещества и смеси.
1
32
Практическая работа №2. «Очистка загрязненной поваренной соли»
1
33
Массовая и объемная доли компонентов в смеси.
1
34
Решение расчетных задач.
1
35
Практическая работа №3. «Приготовление раствора сахара и определение массовой доли сахара в растворе»
1
36
Обобщение темы: «Соединения химических элементов»
1
37
Контрольная работа №2.
«Соединения химических элементов»
Изменения, происходящие с веществами (12 часов)
38
Физические и химические явления.
1
39
Практическая работа №4. «Признаки химических реакций»
1
40
Закон сохранения массы веществ.
1
41
Химические уравнения. Типы химических реакций.
1
42
Реакции соединения и разложения.
1
43
Реакции замещения и обмена.
1
44
Практическая работа №5. «Реакция обмена между оксидом меди и раствором серной кислоты»
1
45
Типы химических реакций на примере свойств воды.
1
46
Расчеты по химическим уравнениям.
1
47
Расчеты по химическим уравнениям
1
48
Обобщения темы: «Изменения, происходящие с веществами»
1
49
Контрольная работа №3.
«Изменения, происходящие с веществами»
1
Растворение. Растворы. Свойства растворов электролитов (18 часов)
50
Растворение. Растворимость веществ.
1
51
Электролитическая диссоциация веществ.
52
Диссоциация водных растворов кислот, щелочей и солей. Основные положения ТЭД.
1
53
Ионные реакции.
1
54
Практическая работа №6. «Условия протекания химических реакций до конца»
1
55
Ионные реакции.
1
56
Практическая работа №7. «Ионные реакции»
1
57
Оксиды, их классификация и свойства.
1
58
Кислоты, их классификация и свойства.
1
59
Основания, их классификация и свойства.
1
60
Соли, их классификация и свойства.
1
61
Генетическая связь между классами неорганических соединений.
1
62
Практическая работа №8. «Свойства оксидов, кислот, оснований и солей»
1
63
Окислительно-восстановительные реакции.
1
64
Окислительно-восстановительные реакции.
1
65
Практическая работа №9. «Решение экспериментальных задач»
1
66
Обобщение темы: «РИО и ОВР»
1
67
Контрольная работа №4.
«Растворы. Реакции ионного обмена и окислительно-восстановительные реакции»
1
68
Анализ контрольной работы
1
68
УЧЕБНО-МЕТОДИЧЕСКОЕ ОБЕСПЕЧЕНИЕ:
Химия. 8 класс: учебник для общеобразовательных учреждений/ О.С. Габриелян. — М.: Дрофа, 2012. – 267с.
Габриелян О.С., Остроумов И.Г. Химия. 8 класс: Настольная книга учителя. — М.: Дрофа, 2012.
Горковенко М.Ю. Поурочные разработки по химии: 8 класс. – М.: ВАКО, 2014 – 368с.
Габриелян О. С., Воскобойникова Н.П. Настольная книга учителя. Химия 8 класс. — М.: Дрофа, 2013 г.
Габриелян О. С. Химия в тестах, задачах, упражнениях. 8-9 класс.: учеб. пособие для общеобразоват. учреждений/ Габриелян О. С., Воскобойникова Н.П. — М.: Дрофа, 2012. – 350с. г.
Интернет-ресурсы
«Единая коллекция Цифровых Образовательных Ресурсов» (набор цифровых ресурсов к учебникам О.С. Габриеляна) (http://school-collection.edu.ru/).
http://him.1september.ru/index.php – журнал «Химия».
http://him.1september.ru/urok/- Все работы, на основе которых создан сайт, были опубликованы в журнале «Химия». Авторами сайта проделана большая работа по систематизированию газетных статей с учётом школьной учебной программы по предмету «Химия».
www.edios.ru – Эйдос – центр дистанционного образования
www.km.ru/education — учебные материалы и словари на сайте «Кирилл и Мефодий»
http://djvu-inf.narod.ru/ — электронная библиотека
«Согласовано»
Заместитель директора по УВР
________И.Г.Пшеничникова
«___»_____________ 2015 г.
infourok.ru
Конспект урока по химии на тему «Кислоты» (8 класс) (по учебнику О.С. Габриеляна)
Конспект урока
по химии
Тема: Кислоты
8 класс
(по учебнику О.С. Габриеляна)
учитель: Мирошникова Марина АлексеевнаМБОУ «Кузьмичевская СОШ»
2015 г.
Цель урока: познакомить учащихся с составом, классификацией кислот и названиями основных представителей этого класса.
Задачи:
— дидактические (образовательные): изучить состав, общие признаки классификации кислот, уметь составлять формулы кислот, рассмотреть названия основных представителей, продолжить знакомство учащихся со сложными ионами на примере кислотных остатков кислородных кислот, продолжить формирование знаний о различиях между зарядами ионов и степенью окисления элементов, об индикаторах;
— развивающие: развитие умственной и познавательной активности учащихся в решении проблемы, развитие практических умений и навыков при работе с химическими реактивами и химической посудой, умения обобщать и делать выводы при изучении материала темы;
— воспитательные: продолжить формирование у учащихся навыков: трудолюбие, усердие, дисциплинированность; прививать аккуратность при оформлении заданий в тетради и у доски, развитие химической речи, обогащение ее словарного запаса при устных ответах, и грамотное выполнение при самостоятельных заданиях.
Тип урока: урок формирования знаний.
Вид урока: урок-презентация.
Методы и методические приемы: объяснительно-иллюстративные (рассказ, рассказ с элементами беседы, сообщения учащихся, демонстрация слайдов), создание проблемной ситуации, практическая работа учащихся с использованием химических реактивов и химической посуды.
Оборудование и реактивы для учителя: ПСХЭ, таблица растворимости, компьютерная презентация на тему «Кислоты».
Оборудование и реактивы: ПСХЭ, таблица растворимости, набор для практической работы учащихся: штатив с пробирками, кислоты – 2 образца (серная, лимонная), индикаторы (лакмус, метиловый оранжевый, фенолфталеин).
Этапы урока и их содержание.
Проверка домашнего задания, воспроизведение и коррекция опорных знаний учащихся.Фронтальный опрос учащихся с целью актуализации имеющихся знаний:
— Какие классы неорганических соединений мы изучили?
— Что такое оксиды?
— Что такое основания?
— На какие группы делятся основания по растворимости в воде? С помощью какой таблицы мы сможем узнать о растворимости вещества?
— С помощью каких реакций распознают вещества? Какие вещества мы использовали на прошлом уроке для определения щелочей? Как изменяют окраску индикаторы в щелочной среде?
— Что такое степень окисления вещества? Чем отличается запись степеней окисления элементов от зарядов ионов?
С учащимися проводит фронтальную беседу.
Участвуют в фронтальном опросе.
III.
Сообщение темы, постановка цели и задач урока, мотивация учебной деятельности учащихся.
Сегодня на уроке мы продолжим изучать основные классы неорганических соединений — класс кислоты, их состав, названия, классификацию и основных представителей этого класса.
Сообщает тему урока, цель урока.
Записывают в тетради тему урока.
IV.
Актуализация знаний
На сегодняшнем уроке мы должны познакомиться со следующим классом неорганических веществ – кислотами. Практически со всеми кислотами приходится сталкиваться ежедневно. Дождевая вода лишь на первый взгляд кажется чистой, не содержащей примеси. В ней растворено немало веществ, например углекислый газ из атмосферы. Поэтому дождевая вода является слабым раствором угольной кислоты. После летней грозы в ней оказывается еще и азотная кислота.
Вступительное слово учителя о значении и нахождении кислот.
Слушают учителя.
V.
Введение новых знаний, с учетом закономерностей процесса познания, осмысление связей и отношений в объекте изучения.
Почему они имеют такое название? Кислые на вкус. Достаточно вспомнить вкус аскорбиновой или лимонной кислот. Но ни одни химик и ни один грамотный человек даже и не подумает распознать таким образом кислоты – это может быть смертельно опасно, т.к. к кислотам относят и серную кислоту. Поэтому гораздо проще и безопаснее распознать кислоты, как и щелочи, с помощью индикаторов.
Мы должны определить изменение окраски индикаторов, знакомых нам по прошлому уроку, в кислой среде. Для этого мы используем растворы 2-х кислот: серной кислоты и лимонной кислоты, и растворы 3-х индикаторов: фенолфталеин, лакмус, метиловый оранжевый.
Какими правилами по технике безопасности мы должны придерживаться при проведении этой лабораторной работы:
— строго выполняем указания учителя;
— не пробуем вещества на вкус;
— наливать жидкость в пробирку осторожно, заранее проверив, не разбита ли она;
— пробирку держим на расстоянии 10- 15 см от глаз, на уровне глаз;
— не переливать вещества из пробирки в склянку;
— не загромождать рабочее место;
— производить опыты только в чистой посуде, закончив работу вымыть посуду;
— банки и склянки закрывать теми же пробками и крышками, какими они были закрыты.
Приступим к работе:
В образцы 2-х кислот, в 1-м штативе добавляем небольшое количество лакмуса, в образцы 2-го штатива – метилоранж, в образцы 3-го штатива – фенолфталеин.
Отмечаем окраску растворов.
Лакмус изменяет окраску в кислой среде с фиолетовой на красную, метиловый оранжевый с оранжевой на красно – розовую, фенолфталеин – остается бесцветным.
Заполним таблицу.
Что же объединяет все эти кислоты, кроме кислого вкуса? Обратимся к составу кислот. На экране формулы и названия некоторых кислот.
HCl –соляная кислота
H2SO4 –серная кислота
HNO3 –азотная кислота
H2CO3 –угольная кислота
H3PO4 –фосфорная кислота
Что общего в формулах этих кислот?
Ответ: Входит атом водорода, остальная часть молекулы – кислотный остаток.
Давайте сформулируем определение кислот.
Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.
Как правило, кислотные остатки образуют элементы – неметаллов, значит за счет ковалентных связей. Состав кислотных остатков различен, в одни остатки входит кислород, в других нет. Так же формулы этих кислот отличаются числом атомов H, который определяет особый признак кислот – основность.
По этим признакам кислоты классифицируют:
По числу атомов Н (по основности):
а. одноосновные;
б. двухосновные;
в. трехосновные.
По наличию кислорода в кислотном остатке:
а. бескислородные;
б. кислородосодержащие.
По растворимости в воде:
а. нерастворимые;
б. растворимые.
Запишите по одному примеру по каждой группе кислот.
По формулам кислот можно определить степени окисления химических элементов, образующих кислоты.
+1 +5 -2
HNO3
Перечислим правила написания степеней окисления:
— знаки записывают перед цифрой;
— указывается для каждого атома химического элемента;
— суммарная степень окисления атомов всех элементов в соединении равна нулю;
— значения степеней окисления записывают строго над химическим элементом.
Зная степень окисления элемента – неметалла, образующего кислотный остаток кислородсодержащей кислоты, можно определить, какой оксид ей соответствует.
Например:
+1 +5 -2 +5 -2
HNO3 → N2O5 – оксид азота (V). Кислотам соответствуют оксиды металлов.
По формулам кислот можно определить и общий заряд ионов. Кислоты образуют ионы двух видов: ион водорода – H+ и ион кислотного остатка, который будет иметь отрицательный заряд, равный основности кислот.
Повторим правила записи зарядов ионов:
— заряд иона записывают справа от химического элемента;
— сначала пишут цифру, потом знак «+» или «-», цифру 1 не пишут.
Так для H2SO4:
Степень окисления
+1 +6 -2
H2SO4
заряд иона
+ 2-
H2SO4
Самостоятельное определение для фосфорной кислоты: зарядов ионов; с.о. элементов; соответствующий оксид.
А теперь поподробнее познакомимся с некоторыми кислотами, потому, что они играют большое значение в нашей жизни.
Обсуждение вопроса названий веществ – кислот.
Обсуждение правил по технике безопасности.
Учитель следит за выполнением экспериментальной части. Координирует работу учащихся.
Делает выводы вместе с учащимися.
Ставит проблемную ситуацию, об установлении состава веществ.
Объяснение материала с использованием слайдов.
Объяснение материала с помощью слайдов.
Предлагает самостоятельную работу. Осуществляет последующую проверку.
Вместе с учащимися повторяет правила вычисления степеней окисления и зарядов ионов.
Объяснение материала по слайдам.
Предлагает самостоятельно определить степени окисления, заряды ионов и соответствующий оксид для сернистой кислоты.
Проверка осуществляется по слайду.
Отвечают на вопросы учителя.
Отвечают на вопросы учителя.
Учащиеся выполняют экспериментальную работу по установлению окраски индикаторов в кислой среде.
Заполняют таблицу о изменении окраски индикаторов в кислой среде.
Отвечают на вопросы учителя, участвуют в изучении нового материала на основе имеющихся знаний.
Записывают в тетрадь определение.
Записывают признаки классификации в тетрадь.
Самостоятельно записывают в тетрадь примеры веществ.
Запись в тетрадь формул кислот со степенями окисления на химических элементах.
Запись в тетрадь соответствующих формул оксидов.
Запись в тетрадь зарядов ионов на примере кислот.
Самостоятельно выполняют в тетради задания, предложенного на слайде, с последующей самопроверкой.
VI.
Обобщение, первичное закрепление и систематизация знаний.
Итак, мы сегодня познакомились еще с одним классом неорганических веществ – кислотами.
— Что такое кислоты?
— С помощью, каких веществ мы распознали кислоты? Какой индикатор не пригоден для распознавания кислот?
— По каким признакам классифицируют кислоты? На какие группы делят кислоты по эти признакам?
— Какими правила по технике безопасности вы бы применили при работе с кислотами? Ваши действия, если кислота попала на кожу рук.
— Почему нельзя лить воду в серную кислоту для ее разбавления?
Отвечают на местах на вопросы учителя.
VII.
Анализ и оценка итогов работы.
Учащиеся выставляют оценки в дневник.
VIII.
Определение и разъяснение домашнего задания.
Записывают задание в дневник
Параграф 20, упражнения 1,4. Выучить формулы кислот.
Литература для учителя:
1. О.С.Габриелян «Химия. Учебник 8 класс», М.: «Дрофа», 2010.
2. О.С.Габриелян, И.П.Воскобойникова «Настольная книга для учителя 8 кл.», М.: «Дрофа», 2008.
3. Е.П.Сгибнева «Современные открытые уроки по химии 8-9 кл.», Ростов-на-Дону: «Феникс», 2002.
4. А.М.Радецкий «Проверочные работы по химии 8-11», М.: «Просвещение», 2008.
5. О.С.Габриелян, Т.В.Смирнова «Изучаем химию в 8 классе», М.: «Блик и К», 2008.
infourok.ru
МЕТОДИЧЕСКАЯ РАЗРАБОТКА УРОКА ХИМИИ В 8 КЛАССЕ ПО ТЕМЕ «ОСНОВАНИЯ». УМК ПОД РЕД. О.С. ГАБРИЕЛЯНА
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ БУРЯТИЯ
МКУ «КАБАНСКОЕ РАЙОННОЕ УПРАВЛЕНИЕ ОБРАЗОВАНИЯ»
МУНИЦИПАЛЬНОЕ АВТОНОМНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«КАБАНСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
УРОКА ХИМИИ В 8 КЛАССЕ
ПО ТЕМЕ: «ОСНОВАНИЯ»
УМК ПОД РЕД. О.С. ГАБРИЕЛЯНА
Учитель: Карпова Елена Ивановна,
учитель биологии и химии,
I квалификационная категория
Кабанск, 2015 г.
Тема урока: «Основания»
Цель урока: общее знакомство с классом неорганических соединений – основаниями.
Задачи урока:
Образовательные: познакомить учащихся с новым классом неорганических соединений – основаниями; рассмотреть классификацию, состав и номенклатуру оснований, свойства, практическое значение.
Развивающие: развить у учащихся такие личностные качества как сосредоточенность, наблюдательность; умение сравнивать, анализировать, обобщать, работать с таблицей растворимости, лабораторным оборудованием
Воспитательные: воспитать у обучающихся умение высказывать свою точку зрения и аргументировать её, умение слушать и уважать мнение товарищей.
Основные вводимые понятия урока: основания, гидроксид-ион, щелочи, индикаторы, качественная реакция
Уровень обучения: базовый
Тип урока: изучение нового материала
Вид урока: комбинированный (рассказ с элементами беседы, практическая работа, самостоятельная и групповая работа)
Оборудование:
учебник (УМК под авт. ред. О.С. Габриелян),
таблицы «Растворимость кислот, оснований и солей в воде», «Индикаторы»,
инструктивные карточки.
реактивы: твёрдые щелочи и их растворы (NaOH, KOH, Ca(OH)2 – в виде «известковой воды»), свежеполученные осадки гидроксидов нерастворимых оснований, лакмус, фенолфталеин, метиловый оранжевый, сок свеклы, сок черной смородины
Планируемые результаты обучения:
Знать состав оснований, их классификацию. Знать правила техники безопасности при работе со щелочами.
Уметь составлять формулы оснований, распознавать раствор щелочи с помощью индикатора
Ход урока
Оргмомент
Актуализация знаний
А) Рассказ учителя
Ребята, кто знает, чем мыли волосы женщины в Древней Руси? Оказывается – раствором золы. А рецепт раствора был такой: взять ковш золы, да не простой, а еловой или от подсолнечника, замочить в дубовом ведре ключевой или дождевой водой. Постоит такая смесь сутки, потом ее надо процедить или просто слить верхний слой, развести фильтрат чистой водой, подогреть на камельке в рубленой бане и вымыть косы. Полученный раствор, мыльный на ощупь – это средство под названием «щелок».
А вспомнила я о нем потому, что реакция среды раствора щелока такая же, как и растворов веществ, которые мы начинаем изучать.
Этап усвоения новых знаний:
А) Рассказ учителя с элементами беседы
В процессе изучения химии мы уже познакомились с бинарными веществами.
Что такое бинарные соединения?
Сложные вещества, состоящие и атомов двух химических элементов.
Какие бинарные соединения вы знаете?
− Оксиды, сульфиды, нитриды, силициды, гидриды, фториды, хлориды
Сегодня на уроке мы должны изучить новый класс веществ — основания.
Состав и названия оснований
Для этого рассмотрите формулы веществ, которые вы видите на доске:
SO2, Cu(OH)2, Na2O, NaCl, NaOH, CuS, Al2O3, HCl, Al(OH)3.
Задание 1: Выпишите формулы бинарных соединений, дайте им названия, определите степени окисления атомов химических элементов. ( Учащиеся работают в тетрадях, один ребенок –у доски)
SO2, Na2O, NaCl, CuS, Al2O3, HCl,—.
Задание2: Выпишите формулы веществ, которые не относятся к бинарным соединениям. Почему их нельзя отнести к бинарным соединениям? (состоят из атомов 3-х элементов металла, кислорода и водорода) Соединения такого состава являются основаниями:
Cu(OH)2, NaOH, Al(OH)3.
Что общего между записанными на доске химическими формулами оснований?
Рассказ учителя.
Атомы кислорода и водорода входят в состав молекул оснований в виде гидроксогруппы (гидроксид-иона) OH—.
Ребята, определите суммарный заряд гидроксид-ион, если степень окисления атомов водорода и кислорода — 
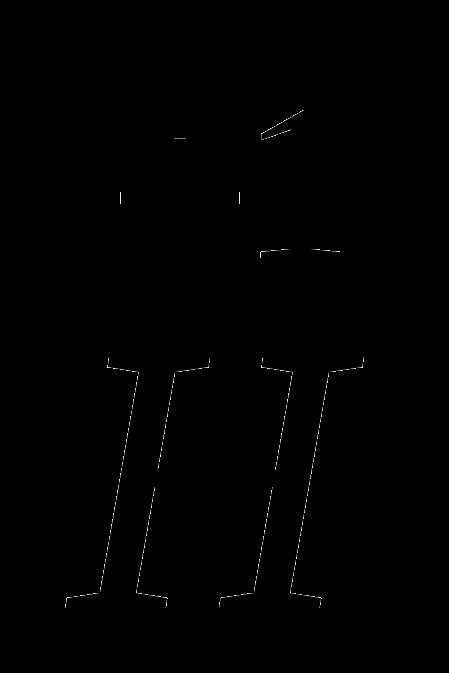 .
.
(Суммарный заряд гидроксид-иона «-1» (ОН—)).
Общая формула оснований:
Men+(OH)n, где n – заряд иона металла, численно равный его степени окисления.
Что называется основаниями?
Основания − это сложные вещества, состоящие из ионов металла и связанных с ними гидроксид-ионов (записывают в тетрадь).
Почему число гидроксид-ионов в формулах оснований разное?
Работа с учебником: Прочитайте текст учебника (§19,стр98,)
(Зависит от степени окисления металла)
Названия оснований состоят из слова гидроксид и названия металла в родительном падеже:
слово «гидроксид» | + | название металла в родительном падеже | + | (римская цифра, обозначающая числовое значение степени окисления металла) для металлов с переменной ст. ок. |
KOH – гидроксид калия, (калий-о-аш)
AI(OH)3 – гидроксид алюминия,
Ca(OH)2 – гидроксид кальция,
Cu(OH)2 – гидроксид меди (II) ( купрум-о аш-дважды)
«Соответствие основания – оксид металла»
Ме+ ОН — Me2O
Ме+2 (ОН)2 — MeO
Ме+3 (ОН)3 — Me2O3
NaOH — Na2O
Cu(OH)2 — CuO
Al(OH)3 — Al2O3
Правило: степени окисления элемента в оксиде и соответствующем ему гидроксиде равны
Классификация оснований
Рассказ учителя. По отношению к воде основания делят на растворимые (щелочи), малорастворимые, нерастворимые.
Работа с таблицей растворимости (Учитель знакомит и учит учащихся пользоваться таблицей растворимости).
KOH растворимое
AI(OH)3 нерастворимое
Ca(OH)2 малорастворимое
Cu(OH)2 нерастворимое
Растворимые основания – щелочи – могут вызвать химический ожог при попадании на незащищенные участки кожи рук и лица. Они могут разъедать кожу, ткань, бумагу. При работе со щелочами следует соблюдать следующие правила техники безопасности. На ваших столах находится инструктаж по технике безопасности при работе со щелочами. Для дальнейшей работы вам нужно с ним ознакомиться.
Работа с инструкцией
Правила техники безопасности
Действие щелочей, особенно концентрированных, характеризуется значительной глубиной ожога, поскольку они растворяют белок. В связи с этим очень опасно попадание щелочи в глаза: при поздней первой помощи оно сопровождается полной потерей зрения. Прием даже небольшого количества щелочи внутрь может привести к тяжелейшим повреждениям внутренних органов.
Во время приготовления раствора щелочь берут только специальной ложечкой и ни в коем случае не насыпают, потому что пыль может попасть в воздух, в глаза и на кожу. После использования ложечку тщательно моют, т. к. щелочь прочно пристает ко многим поверхностям.
При оказании первой помощи необходимо немедленно каким-либо предметом удалить приставшие к коже кусочки сухой щелочи и промыть пораженное место обильной струей воды. При попадании на кожу раствора — промыть пораженное место обильной струей воды. Промывание должно быть продолжительным (10—15 мин.) и тщательным. Для нейтрализации щелочи на пораженное место после промывания накладывают на 10 минут повязку из марли или ватный тампон, пропитанные 5%-м раствором уксусной кислоты. После снятия повязки, кожу обмывают.
Если щелочь попала в глаза, немедленно следует промыть их проточной водой в течение 15-20 мин. После этого глаза ополаскивают 2%-м раствором борной кислоты и закапывают альбуцид.
После оказания первой помощи нужно немедленно обратиться к врачу-окулисту.
Свойства оснований
Свойства оснований изучаются при проведении лабораторной работы.
(При проведении лабораторной работы класс делится на группы, каждая группа работает по инструктивной карточке)
1 группа
Рассмотрите выданное вещество. Определите его агрегатное состояние, цвет.
Поместите в пробирку 1-2 кусочка гидроксида натрия. Прилейте 5-6 мл воды. Наблюдайте за растворением вещества. Что выделяется при растворении гидроксида натрия?
Разлейте готовый раствор в 3 пробирки. В одну пробирку добавьте 1-2 капли лакмуса, в другую 1-2 капли фенолфталеина, в третью 1-2 капли метилового оранжевого.
Какие изменения произошли в пробирках? Свои наблюдения запишите в таблицу.
В учебнике на странице 101 прочитайте об индикаторах.Название вещества,
формула
Агрегатное
состояние
Цвет
Раствори
мость в
воде
Взаимодействие с
индикаторами
лакмус
фенолфталеин
метилоранж
Отчет о работе
2группа
Рассмотрите выданное вещество. Определите его агрегатное состояние, цвет.
Поместите в пробирку 1-2 кусочка гидроксида калия Прилейте 5-6 мл воды. Наблюдайте за растворением вещества. Что выделяется при растворении гидроксида калия?
Разлейте готовый раствор в 3 пробирки. В одну пробирку добавьте 1-2 капли лакмуса, в другую 1-2 капли фенолфталеина, в третью 1-2 капли метилового оранжевого.
Какие изменения произошли в пробирках? Свои наблюдения запишите в таблицу.
Название вещества, формула | Агрегатное состояние | цвет | Раствори мость в воде | Взаимодействие с индикаторами | ||
лакмус | фенолфталеин | метилоранж | ||||
В учебнике на странице 101 прочитайте об индикаторах.
Отчет о работе
3группа
Рассмотрите выданное вещество. Определите его агрегатное состояние, цвет.
Поместите в пробирку 1-2 кусочка гидроксида кальция. Прилейте 5-6 мл воды. Наблюдайте за растворением вещества. Что выделяется при растворении гидроксида кальция?
Разлейте готовый раствор в 3 пробирки. В одну пробирку добавьте 1-2 капли лакмуса, в другую 1-2 капли фенолфталеина, в третью 1-2 капли метилового оранжевого.
Какие изменения произошли в пробирках? Свои наблюдения запишите в таблицу.
Название вещества, формула | Агрегатное состояние | цвет | Раствори мость в воде | Взаимодействие с индикаторами | ||
лакмус | фенолфталеин | метилоранж | ||||
В учебнике на странице 101 прочитайте об индикаторах.
Отчет о работе
4 группа
Рассмотрите выданное вещество. Определите его агрегатное состояние, цвет.
Поместите в пробирку 1-2 кусочка гидроксида натрия. Прилейте 5-6 мл воды. Наблюдайте за растворением вещества. Что выделяется при растворении гидроксида натрия?
Разлейте готовый раствор в 2 пробирки. В одну пробирку добавьте 1-2 капли сока свеклы, в другую 1-2 капли сока черной смородины
Какие изменения произошли в пробирках? Свои наблюдения запишите в таблицу.
Название вещества, формула | Агрегатное состояние | Цвет | Раствори мость в воде | Взаимодействие с индикаторами | |
Сок свеклы | Сок смородины | ||||
В учебнике на странице 101 прочитайте об индикаторах.
Отчет о работе
Учитель: А изменится ли окраска индикатора в гидроксиде меди (II) и гидроксиде железа (III)?
Учитель выполняет демонстрационный опыт №1:
Получить гидроксид меди(II)
Получить гидроксид железа (III)
Добавить к полученным веществам индикаторы
Вывод: в растворах щелочей индикаторы изменяют окраску, а в нерастворимых основаниях – нет.
Учитель: Ребята, посмотрите на результат своей работы и ответьте на вопрос: так что же это за вещества, которые меняют свой цвет в зависимости от среды? Кто затрудняется, найдите ответ в учебнике.
(Реактив, который указывает не только на одно вещество, но и на группу и целый класс веществ. Индикаторы (лат. «указатели») – это реактивы на растворимые основания. (записать в тетрадь)
Работа с таблицей «Индикаторы» (основным индикатором на щелочи является фенолфталеин)
Изменение окраски индикаторов
Название индикатора | Щелочная среда | Нейтральная среда | Кислая среда |
Лакмус | Синяя | Фиолетовая | Красная |
Метиловый оранжевый | Желтая | Оранжевая | Красно-розовая |
Фенолфталеин | Малиновая | Бесцветная | Бесцветная |
Универсальный | Синий | Желто-зеленая | Красная |
Сок свеклы | желтая | красная | Ярко-красная |
Учитель: Есть еще один способ распознавания веществ – с помощью качественных реакций. Это реакция, в ходе которой доказывается наличие данного вещества или иона.(записать в тетрадь)
Демонстрационный опыт 2: (опыт проводит ученик) В пробирке находится известковая вода. Пропустите через стеклянную трубочку, опущенную в пробирку углекислый газ, который образуется при вашем дыхании. Что наблюдаете? (Результат – помутнение раствора)
Вывод: Вещество, с помощью которого доказывают присутствие другого вещества, называют реактивом на распознаваемое вещество.
Практическое значение оснований
Учитель: Мы познакомились еще с одним классом сложных веществ — основаниями. Как вы думаете, имеют ли основания практическое значение? Конечно же, да. (сообщения учащихся)
1) Гидроксид натрия. Что за вещество скрывается под названиями «алкаль», «едкая щелочная соль», «каустик», «каустическая сода»? Так называли в разные времена в России гидроксид натрия. До сих про сохранилось его старое название – едкий натр, предложенное еще в 1807 году русским химиком Александром Ивановичем Шерером. В быту гидроксид натрия именуют каустической содой, хотя к соде отношения он не имеет. Уж лучше его просто называть «каустиком» (от греческого «каустикос» – жгучий, едкий). Раствор и кристаллы очень опасны в обращении: при попадании в пищевод человека всего 0,01–0,02г наступает смерть впервые же часы или сутки. На коже он вызывает глубокие и долго незаживающие ожоги. Также гидроксид натрия применяют в производстве мыла, в кожевенной промышленности и в фармацевтике и в производстве бумаги.
2) Гидроксид калия. Называют «едкое кали» по аналогии с гидроксидом натрия. Используется при «варке» тугоплавкого стекла, производстве бумаги, жидкого мыла.
3) Гидроксид кальция. В технической литературе и в быту часто встречаются такие названия веществ: «воздушная», или «негашеная известь», «известковое молоко», «известковая вода». Негашеная известь – это оксид кальция, получаемый при обжиге мела; гашеная известь – это гидроксид кальция, получаемый при обработке оксида кальция водой. Этот процесс протекает с большим выделением теплоты. Известковое молоко – суспензия гидроксида кальция в воде, применяемая для побелки потолков, стен, стволов деревьев по весне для защиты от обморожений и вредных насекомых. Оксид кальция можно использовать для простейшей химической грелки: два пакетика, один большой, другой – маленький, из водонепроницаемого и химически стойкого материала. Чтобы грелка заработала, заполняют негашеной известью маленький пакет и добавляют в него немного воды. Потом пакет тщательно закрывают, вставляют в большой и еще раз закупоривают. Грелка готова. Гидроксид кальция входит в состав «бордосской жидкости» в смеси с медным купоросом для борьбы с возбудителями грибковых заболеваний плодовых, овощных и декоративных культур. Применяется для распознавания углекислого газа.
4) Гидроксид бария. Гидроксид бария – «баритовая вода» – применяют для качественного и количественного определения содержания углекислого газа в газах.
Этап закрепления новых знаний
Учитель: Сегодня мы познакомились с новым классом неорганических веществ – основаниями.
Для закрепления полученных знаний, ответьте на следующие вопросы:
каков состав оснований,
как назвать основания,
как составить формулу основания по названию,
как классифицируются основания,
какие оксиды соответствуют основаниям,
как отличить растворы щелочей от растворов других веществ.
Контроль полученных знаний.
Предлагается выполнить следующие задания самостоятельно:
1) Классифицируйте следующие основания: Ca(OH)2, Cr(OH)3, LiOH, Fe(OH)2
2) Составьте формулы гидроксидов и соответствующих оксидов: Sb(II), Bi(III), Rb
3) Выберите «лишнюю» формулу, объясните свой выбор:
а) LiOH, Al(OH)3, Ca(OH)2
б) Cu(OH)2, Mg(OH)2, Al(OH)3
в) CuO, SO2, ZnO
4) Как опытным путем различить гидроксид цинка и калия.
После выполнения работы, учащиеся обмениваются работами, обсуждают выполненные задания, исправляют ошибки (ответы представлены на доске) и оценивают работу друг друга.
Рефлексия
Домашнее задание
Изучить §19, выполнить упражнение №3-5.
Используемая литература
Габриелян О.С. Химия. 8 класс: учебник для общеобразовательных учреждений. – 16-е изд., стереотип. – М.: Дрофа, 2010.
Габриелян О.С. Химия. 8 кл.: Рабочая тетрадь к учебнику О.С. Габриеляна «Химия.8″/ О.С. Габриелян, А.В. Яшукова.– М.: Дрофа, 2010.
Сгибнева Е.П., Скачков А.В., “Современные открытые уроки химии 8-9 классы”, Ростов-на-Дону, 2002 г.
Алексинский В.Н. Занимательные опыты по химии: книга для учителя – 2-е изд.– М.: Просвещение, 1995.
kopilkaurokov.ru
