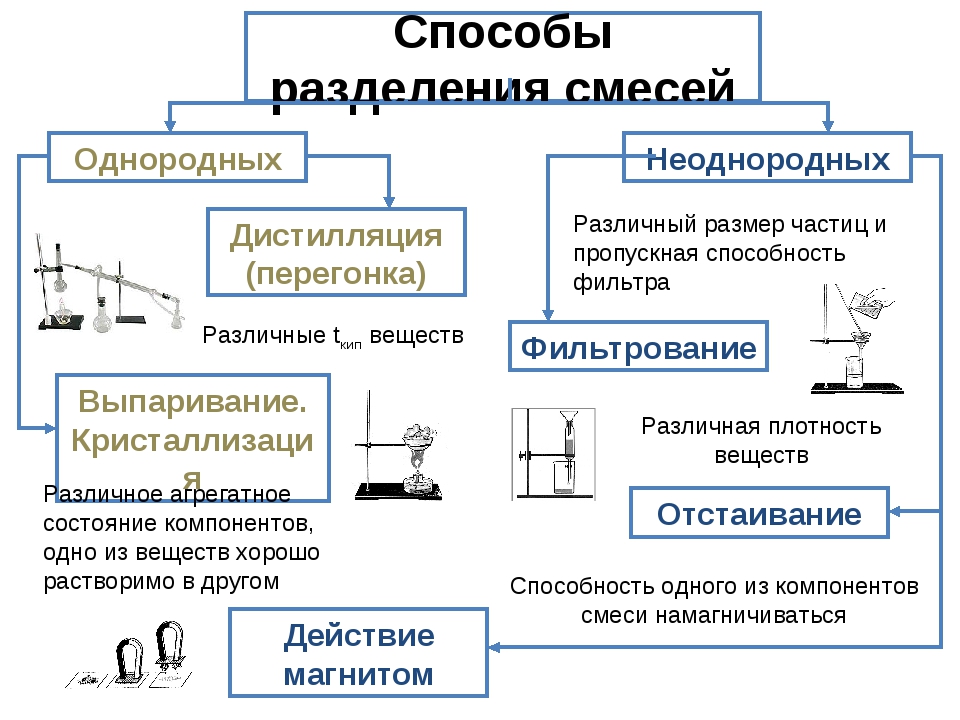
Разделение неоднородных смесей — урок. Химия, 8–9 класс.
В природе вещества обычно встречаются в виде смесей. Чтобы получить чистое вещество, надо его из смеси выделить.
Разделение смеси производят для выделения в чистом виде всех её составных частей. При очистке выделяют одно вещество, а примеси удаляют.
В составе смесей вещества сохраняют свои свойства. Способы разделения и очистки веществ основаны на их различиях.
Одним из самых простых способов разделения неоднородных смесей является отстаивание.
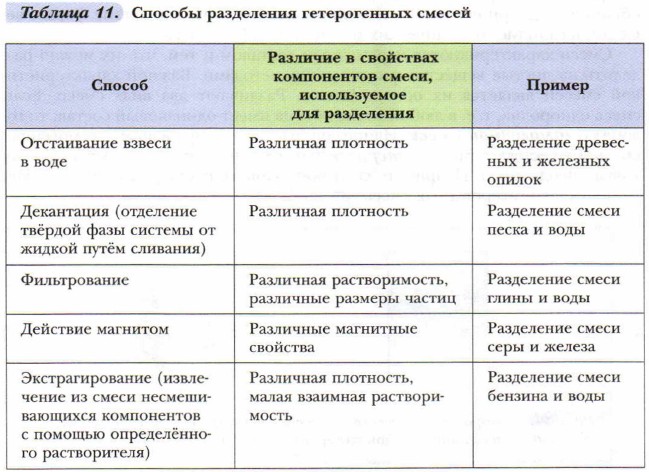
Используется для разделения неоднородных смесей жидкого и твёрдого вещества или двух жидкостей, которые различаются по плотности.
При отстаивании смеси жидкости и твёрдого вещества на дне сосуда оседает вещество с большей плотностью. Верхний слой осторожно отделяют.
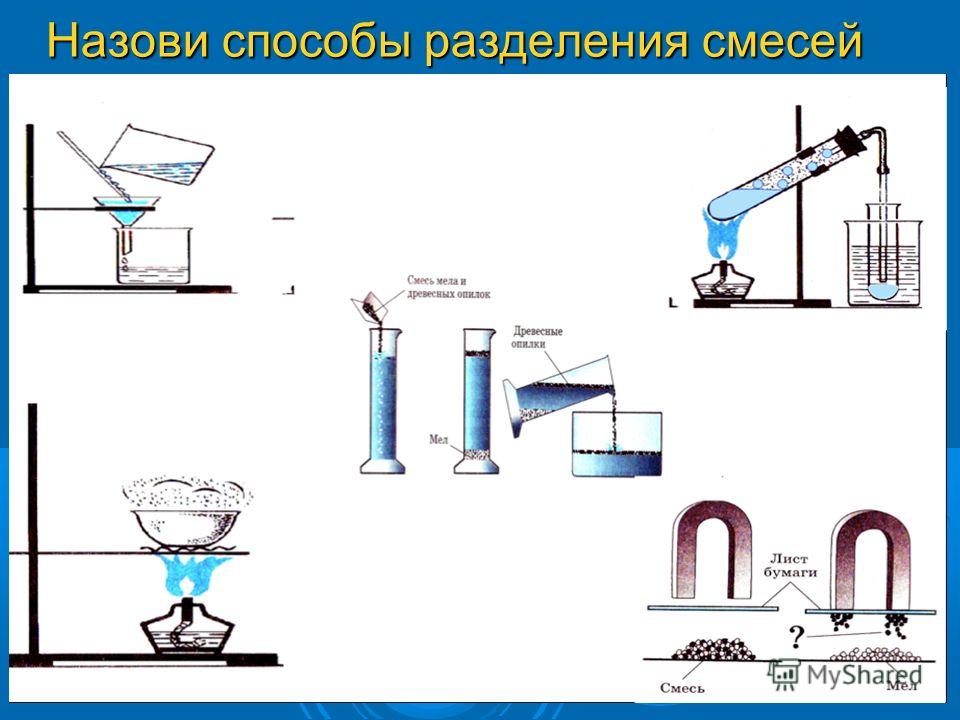
Отстаивание смеси песка и воды
Таким способом можно разделить смесь мела и воды, песка и воды.
Для разделения смеси двух жидкостей (растительное масло и вода, бензин и вода, нефть и вода) используется делительная воронка — сосуд с краном внизу. Сливают сначала более тяжёлый нижний слой, а затем — лёгкий верхний. Подобным образом в деревнях отделяли сливки от молока.
Делительная воронка
Фильтрование — это отделение жидкости или газа от взвешенных в них твёрдых частиц при пропускании через пористые материалы (фильтры). Фильтры задерживают частицы, если их размеры больше размера пор. Для фильтрования можно использовать специальную бумагу, ткань, марлю, вату, песок, уголь, пористую керамику.
Механизм фильтрования
Простейший прибор для фильтрования состоит из воронки с фильтром и сосуда для собирания фильтрата. При использовании бумажного фильтра смесь осторожно наливают в воронку по стеклянной палочке. Вода проходит через фильтр, а частицы твёрдого вещества задерживаются на нём.
Вода проходит через фильтр, а частицы твёрдого вещества задерживаются на нём.
Простейший прибор для фильтрования
(\(1\) — смесь, \(2\) — стеклянная палочка, \(3\) — воронка с фильтром, \(4\) — фильтрат)
С помощью фильтрования можно очистить воду от попавших в неё пылинок, частиц песка и других примесей. В лабораториях этим способом отделяют образовавшиеся в реакциях осадки.
Фильтрование используется в промышленности (в производстве растительного масла, творога). В качестве фильтров там используются ткани.
В двигателях автомобилей через фильтры обязательно проходит топливо и масло.
На одной из стадий очистки питьевой воды в водопроводах её пропускают через слой чистого песка. В домашних условиях для очистки питьевой воды применяется бытовой фильтр.
Бытовой фильтр для очистки воды
С помощью фильтрования очищают также воздух от примесей. На фильтровании воздуха основана работа пылесоса, противогаза.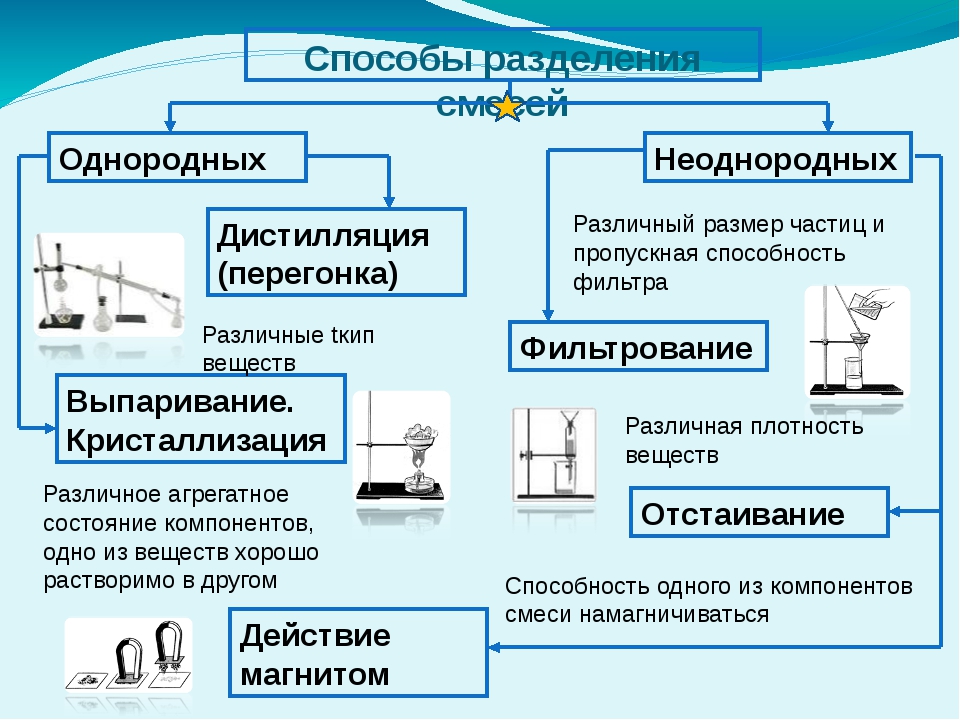
Для удаления нежелательных примесей часто используют адсорбенты. Так, в противогазах воздух проходит через слой активированного угля, который имеет много мелких пор и способен поглощать газообразные и растворённые вещества. Уголь применяется в производстве сахара для очистки сахарного сиропа от содержащихся в нём примесей.
Центрифугирование
Если частицы неоднородной смеси малы, то её сложно разделить отстаиванием или фильтрованием. В этом случае используют центрифугирование. Смесь помещают в сосуды, которые вращают с большой скоростью в центрифуге. Более тяжёлые частицы оседают на дне.
Центрифуга
Такой способ находит применение для разделения молока. При вращении в специальной центрифуге (сепараторе) отделяются сливки, и остаётся обезжиренное молоко.
Другие способы
Универсальных методов разделения смесей нет. В каждом конкретном случае основываются на различиях в свойствах веществ.
Смесь железных опилок с серой можно разделить, используя магнитные свойства железа. Если к поверхности смеси поднести магнит, то частицы железа притянутся к нему, а сера останется.
Смесь серы и железа
Железо и сера
Можно эту же смесь разделить с помощью воды. Железо тяжелее воды и оседает на дне. Сера водой не смачивается и остаётся на поверхности. Способ разделения смесей, основанный на различии смачиваемости компонентов, называется флотацией.
| 1. |
Отстаивание
Сложность: лёгкое |
1 |
2.
|
Сложность: лёгкое |
1 |
| 3. |
Однородные и неоднородные смеси
Сложность: лёгкое |
2 |
4.
|
Выпаривание
Сложность: среднее |
2 |
| 5. |
Перегонка
Сложность: среднее |
2 |
6.
|
Способы разделения смесей
Сложность: среднее |
2 |
| 7. |
Найди массы веществ
Сложность: сложное |
3 |
8.
|
Приборы для разделения смесей
Сложность: сложное |
3,5 |
| 9. | Способы очистки веществ Сложность: сложное | 4 |
Презентация к уроку «Чистые вещества и смеси. Способы разделения смесей» | Презентация к уроку по химии (8 класс) на тему:
Способы разделения смесей» | Презентация к уроку по химии (8 класс) на тему:
Слайд 1
Чистые вещества и смеси. Способы разделения смесей Подготовила Учитель химии МОУ « Вольновская школа» Алимова Эльвие Нзимовна 2015 г.Слайд 2
Цели урока : 1. Образовательная : Дать понятие о чистом веществе и смеси веществ , сходство и различие между ними. Раскрыть значение смесей в природе и жизни человека . 2. Развивающая : Формировать умение распознавать чистые вещества и смеси , составлять план действий разделения смесей . Развивать у учащихся различные виды памяти , мыслительной деятельности , и умение обращаться с лабораторным оборудованием . 3. Воспитательная : Способствовать формированию интереса к знаниям , умениям , самооценке своей деятельности .
Слайд 3
Загадка: Давайте отгадаем загадку В морях и реках обитает , Но часто по небу летает , А как наскучит ей летать , На землю падает опять .
Слайд 4
Задание : Перед вами 2 стакана. Один с дистиллированной водой, другой с морской. Я предлагаю вам следующую исследовательскую задачу: сравнить температуру кипения воды морской, дистиллированной.
Я предлагаю вам следующую исследовательскую задачу: сравнить температуру кипения воды морской, дистиллированной.
Слайд 5
Выводы: 1)Чистое вещество имеет постоянный состав; 2)Чистое вещество обладает постоянными физическими свойствами ( t пл , t кип, ρ и др.)
Слайд 6
Сравнительная характеристика смеси и чистого вещества Признаки сравнения Чистое вещество Смесь Состав Постоянный Непостоянный Вещества Одно и то же Различные Физические свойства Постоянные Непостоянные Изменение энергии при образовании Происходит Не происходит Разделение С помощью химических реакций Физическими методами
Слайд 7
Смеси Гомогенные (однородные, компоненты не видны) Гетерогенные (неоднородные, компоненты видны) Взвеси Растворы (г., ж, тв .) Суспензии ( тв.+ ж.) Эмульсии ( ж.+ ж.)
Слайд 8
Способы разделения смесей
Слайд 9
Лабораторная работа №2 «Разделение смеси, состоящий из порошков железа и серы» Инструкция для учащихся к опыту «Приготовление и изучение смеси железа и серы» 1. Насыпьте на лист бумаги отдельными кучками порошки серы и железа, рассмотрите их цвет. 2. Возьмите небольшую часть каждого вещества и проведите следующие операции: а) испытайте магнитом; б) опустите в стакан с водой. 3. Смешайте стеклянной палочкой оба порошка на бумаге, рассмотрите цвет смеси. 4. Проведите со смесью те же операции, что и с чистыми веществами.
Насыпьте на лист бумаги отдельными кучками порошки серы и железа, рассмотрите их цвет. 2. Возьмите небольшую часть каждого вещества и проведите следующие операции: а) испытайте магнитом; б) опустите в стакан с водой. 3. Смешайте стеклянной палочкой оба порошка на бумаге, рассмотрите цвет смеси. 4. Проведите со смесью те же операции, что и с чистыми веществами.
Слайд 10
Творческое задание: Вы пошли в поход. Совершенно случайно , вся ваша соль намочилась и к тому же в неё попали кусочки грязи . Другой соли нет . Как вы поступите?
Слайд 11
Творческое задание: Помогите героине русской народной сказки “Василиса Прекрасная” . В этой сказке Баба-Яга приказала Василисе отделить манку от гречки и мак от земли . Героине сказки помогли птицы . Мы же теперь можем разделить крупы , мак и землю различными научными методами. Опишите , как можно все это разделить ?
Слайд 12
Игра «Крестики-нолики» Найдите выигрышный путь. Выигрышный путь составляют чистые вещества или смеси сахар речная вода молоко гранит спирт золото сметана глина алюминий
Слайд 13
С приведенного перечня картинок определите чистые вещества, однородные и неоднородные смеси Б ензин Речная вода Крахмал Глина Молоко Спиртовой раствор йода Минеральная вода
Слайд 14
Предложите способы разделения таких смесей: бензин+вода+сахар ; соль+вода+песок ; порошок железа+вода+глицерин .
Слайд 15
Чемодан, мясорубка, корзина Ч емодан – всё, что пригодится в дальнейшем Мясорубка – информацию переработаю Мясорубка – информацию переработаю
Слайд 16
Домашнее задание: §4, выполнить задания № 2,4 на стр.17; Предложите способ разделения смеси: сахар+железный порошок+спирт+вода
Слайд 17
Использованные источники: http://blog.sfgate.com/hawaii/2011/03/30/waterfall-wailua-river-views-2-reasons-why-we-heart-kauai/ — речная вода http://oagb.ru/lib.php?txt_id=184 — минеральная вода http://xn--80afc4bal.kiev.ua/glina.html — глина https://auto.mail.ru/article/30288-otkuda_v_rossii_beretsya_98-i_benzin/ — бензин http://www.rnd-sale.ru/jod/ — йод http://xcook.info/product/moloko-ovechje.html — молоко http://zhkt.guru/lechenie-podzheludochnoy-zhelezy/narodnoe/recepty/krahmal — крахмал http://your-happy-life.com/turisticheskiy-pohod-pro-chto-ne-stoit-zabyivat/ поход http://deti-online.com/skazki/russkie-narodnye-skazki/vasilisa-prekrasnaja/ Василиса Преврасная http://wpapers. ru/wallpapers/nature/water-sky/11438/6400-4096_%D1%80%D0%B0%D1%81%D1%81%D0%B2%D0%B5%D1%82-%D0%BD%D0%B0-%D0%BC%D0%BE%D1%80%D0%B5.html море http://nordural.ru/article/reka_chusovaya/ река
ru/wallpapers/nature/water-sky/11438/6400-4096_%D1%80%D0%B0%D1%81%D1%81%D0%B2%D0%B5%D1%82-%D0%BD%D0%B0-%D0%BC%D0%BE%D1%80%D0%B5.html море http://nordural.ru/article/reka_chusovaya/ река
Чистые вещества и смеси — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
ЧАСТЬ 11. Чистые вещества представлены одним веществом, имеющим одну химическую формулу. Смеси состоят из нескольких веществ, каждое из которых имеет свою химическую формулу → если свойства компонентов смеси разные, то их можно разделить на основании этих свойств.
2. Классификация смесей (примеры).
3. Синонимы: однородные смеси – гомогенные;
неоднородные смеси – гетерогенные.
4. Химический анализ – это установление состава смесей.
ЧАСТЬ 2
1. Распределите по двум столбцам следующие вещества:
дистиллированная вода, бронза, алюминий, воздух, гранит, кефир, сера.
2. Напишите, какие минералы входят в состав горной породы – гранита. Кремнезем, полевой шпат, кварц, плагиоклаз.
3. Приведите состав двух используемых на кухне смесей, изучив сведения на их упаковках. 1) поваренная соль
2) сахар
4. Дополните таблицу, записав в неё по два примера смесей.
5. Дополните таблицу «Смеси и их применение». Для выполнения задания используйте возможности Интернета.
6. Подготовьте сообщение или презентацию на тему «Использование химического анализа в той или иной области человеческой деятельности» (область применения выберите самостоятельно). Для выполнения задания используйте возможности Интернета.
Определение нитратов в пищевых продуктах с целью обеспечения безопасности и качества, в частности, овощей и фруктов.
Каждый крупный рынок, где продают овощи и фрукты имеет химическую лабораторию, в которой проводят анализ – определяют количество нитрат – ионов в образцах. Предельно допустимое количество нитратов в овощах нормируется нормативными документами – ГОСТами, СанПинами, где для каждого вида продукции указана предельная допустимая концентрация нитрат-ионов. Если содержание нитратов в данном образце превышает эту норму, то продукцию бракуют и не допускают к продаже.
Анализ проводится следующим способом.
Образец данного овоща тщательно моется, измельчается, берётся навеска, равная 10 граммам и к ней добавляются алюмокалиевые квасцы. Специальный прибор – нитратомер – определяет в этом образце содержание нитратов.
Предельно допустимое количество нитратов в овощах нормируется нормативными документами – ГОСТами, СанПинами, где для каждого вида продукции указана предельная допустимая концентрация нитрат-ионов. Если содержание нитратов в данном образце превышает эту норму, то продукцию бракуют и не допускают к продаже.
Анализ проводится следующим способом.
Образец данного овоща тщательно моется, измельчается, берётся навеска, равная 10 граммам и к ней добавляются алюмокалиевые квасцы. Специальный прибор – нитратомер – определяет в этом образце содержание нитратов.
Ответы к упражнениям § 23. Химия 8 класс.
Приведите примеры жидких, твердых и газообразных смесей.
Смеси:
Жидкие: морская вода – раствор солей, нефть смесь жидких углеводородов.
Твердые: строительная смесь песка и цемента, чугун – смесь железа и углерода, сплавы цветных металлов – латунь: медь + цинк, бронза: медь + олово.
Газообразные: воздух – смесь газов, основные азот, кислород, аргон, углекислый газ и др.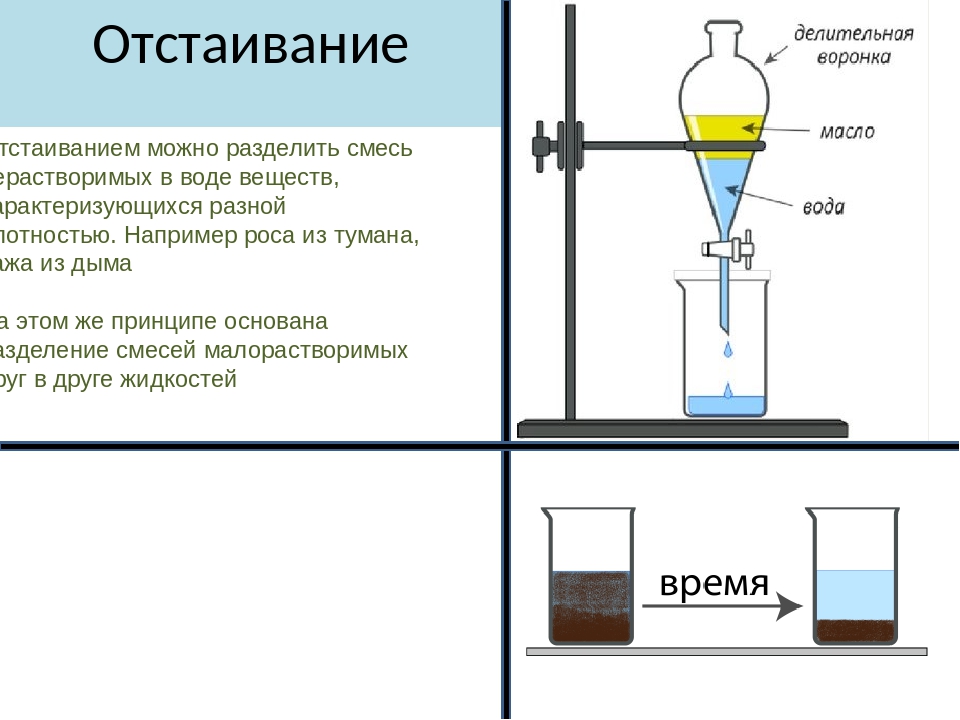 газы.
газы.
Упражнение: 3
Как применяют методы химического анализа в своей работе криминалисты, археологи, медики и искусствоведы? Приготовьте сообщение об этом, используя дополнительную литературу.
С помощью химического анализа криминалисты могут по пятнам определить качественный состав жидкости, которая оставила это пятно. Например, была ли эта жидкость кровью или вином и т.д. По следам и остаткам грунта могут определить где по какой почве проходил человек или проезжала машина и зная составы окрестных грунтов определить в каких местах проходил человек или проезжала машина.С помощью химического анализа археологи могут определять, как жили, из чего строили, что носили люди в данную эпоху, по остаткам пиши оставленной в черепках и сосудах могут определять, чем питались люди.
С помощью химического анализа качественного и количественного в, медицине, сравнивая с нормой анализы крови, мочи и др. жидких сред организма человека, можно поставить диагноз и проводить курс лечение под контролем, отслеживая динамику изменения анализов, наблюдать успешность или не успешность данного курса лечения и при необходимости корректировать курс лечения.
жидких сред организма человека, можно поставить диагноз и проводить курс лечение под контролем, отслеживая динамику изменения анализов, наблюдать успешность или не успешность данного курса лечения и при необходимости корректировать курс лечения.
Старые мастера сами готовили краски, лаки. Зная, какие составы готовил конкретный мастер, искусствоведы с помощью химического анализа, могут с большой долей уверенностью утверждать – авторство художественного произведения. Реставраторы так же пользуются химическим анализом и открывают секреты древних мастеров.
Разделение смеси | Примечания, видео, контроль качества и тесты | 11 класс> Химия> Язык химии
Разделение смеси
Смесь
Смеси можно разделить на отдельные компоненты с помощью различных процессов. Способы разделения зависят от физических свойств отдельных компонентов смеси. Вот некоторые обычно используемые лабораторные процессы для разделения смесей веществ:
Фильтрация
Процесс полного отделения нерастворимого твердого компонента от жидкости путем прохождения через пористую мембрану называется фильтрацией. Этот принцип основан на том факте, что молекулы растворителя и молекулы или ионы, присутствующие в растворе, могут проходить через пористую мембрану (например, фильтровальную бумагу), в то время как взвешенные частицы задерживаются на пористой мембране. Жидкость, собранная после прохождения через пористую мембрану, называется фильтратом, а нерастворимые частицы, оставшиеся в пористой мембране, называются остатком. Типичная экспериментальная установка для этого процесса показана на рисунке ниже.
Этот принцип основан на том факте, что молекулы растворителя и молекулы или ионы, присутствующие в растворе, могут проходить через пористую мембрану (например, фильтровальную бумагу), в то время как взвешенные частицы задерживаются на пористой мембране. Жидкость, собранная после прохождения через пористую мембрану, называется фильтратом, а нерастворимые частицы, оставшиеся в пористой мембране, называются остатком. Типичная экспериментальная установка для этого процесса показана на рисунке ниже.
Седиментация и декантация
Этот метод обычно используется для разделения компонентов смеси, в которой один компонент является жидким, а другой компонент находится в виде крупных твердых частиц тяжелее жидкости. Этот метод основан на действии силы тяжести. Крупные твердые частицы, будучи тяжелыми, оседают (осаждение) и верхний прозрачный слой жидкости осторожно переливают в другую емкость (декантация).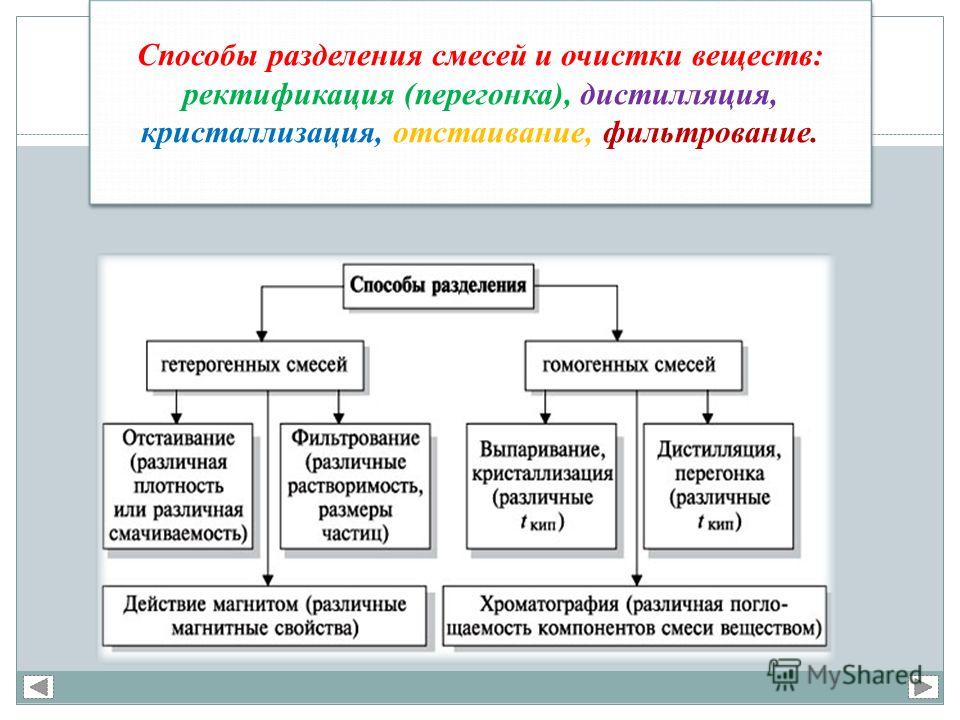 Например, этим методом очищается мутная речная вода.Этот метод не подходит для смесей, содержащих очень мелкие частицы. Типичная установка для этого эксперимента показана ниже:
Например, этим методом очищается мутная речная вода.Этот метод не подходит для смесей, содержащих очень мелкие частицы. Типичная установка для этого эксперимента показана ниже:
Сублимация
Процесс преобразования твердых веществ непосредственно в парообразное состояние без преобразования их в промежуточное жидкое состояние с применением тепла называется сублимацией. Пары при охлаждении возвращаются в твердое состояние, и это называется сублиматом.Этот метод используется для отделения твердых компонентов от смеси, которые при нагревании непосредственно превращаются в пары, тогда как остальные компоненты не подвергаются воздействию тепла. Некоторые из веществ, которые сублимируются при нагревании: камфора, хлорид аммония, нафталин, бензойная кислота и т. Д. Типичная установка для этого эксперимента показана ниже:
источник: socratic. org рис: сублимация
org рис: сублимацияИспарение
Процесс сублимации перевод жидкости в парообразное состояние при любой температуре называется испарением.Этот метод используется для извлечения растворимых твердых веществ из раствора. В этом методе раствор, содержащий твердое вещество, нагревается в фарфоровой ванне. Твердое растворенное вещество остается в фарфоровой емкости, а жидкость испаряется. Типичная установка для этого эксперимента показана ниже:
источник: study.com fig: ИспарениеКристаллизация
Этот метод используется для получения твердого соединения в чистой и геометрической форме. Неочищенный образец твердого вещества растворяют в подходящем растворителе, чтобы получить насыщенный раствор при более высокой температуре.При охлаждении такого раствора вещество появляется в виде кристаллов. Оставшийся раствор называется маточным раствором, который состоит из всех примесей. Полученные таким образом кристаллы можно отделить с помощью шпателя. Типичная установка для этого эксперимента показана ниже:
Типичная установка для этого эксперимента показана ниже:
Дистилляция
Процесс превращения жидкости в пары в нагревание и возврат пара в жидкость при охлаждении называется дистилляцией.Он бывает двух типов:
• Простая дистилляция
Этот метод используется для разделения жидкостей, температура кипения которых отличается на 10-20ºC. Жидкость, имеющая более низкую точку кипения, сначала отгоняется, оставляя за собой другую жидкость. Для перегонки жидкую смесь отбирают в перегонную колбу, снабженную термометром и конденсатором. Чтобы жидкость не ударилась, используется несколько стеклянных шариков. Затем перегонную колбу нагревают на песочной бане. Сначала закипает жидкость с низкой температурой кипения, и ее пары покидают колбу.Эти пары проходят через конденсатор и превращаются в жидкость. Эта конденсированная жидкость, называемая дистиллятом, собирается в приемнике, тогда как жидкость с высокой температурой кипения остается в перегонной колбе.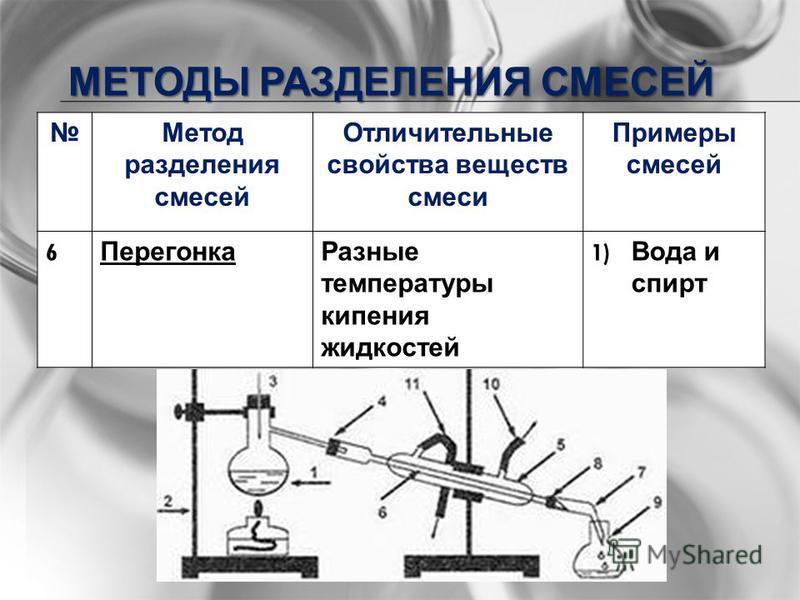 Типичная установка для этого эксперимента показана ниже:
Типичная установка для этого эксперимента показана ниже:
• Фракционная перегонка
Когда точки кипения двух жидкостей, присутствующих в смеси, не отличаются или они кипят в узком диапазоне температур, простая перегонка не работает.Таким образом, используется фракционная перегонка. При фракционной перегонке пары жидкости проходят через фракционирующую колонну, стеклянную колонку, заполненную стеклянными шариками, или колонку специальной конструкции. Пары жидкости с высокой температурой кипения конденсируются в этой колонне и возвращаются обратно в колбу, тогда как пары жидкости с низкой температурой кипения покидают колонну на выходе. Эти пары попадают в конденсатор и конденсируются, которые собираются в ресивере. Жидкость, собранная в приемнике, состоит из более чистой более летучей жидкости, а менее летучая жидкость остается в перегонной колбе.Типичная установка для этого эксперимента показана ниже:
источник: www. interwatt.org fig: Фракционная перегонка
interwatt.org fig: Фракционная перегонкаХроматография
Хроматография — важный экспериментальный метод разделения, очистки и идентификации компонентов смеси. Этот метод основан на дифференциальном распределении компонентов смеси между двумя фазами, обычно называемыми стационарной фазой и подвижной фазой. Подвижная фаза может быть жидкой или газовой.Компоненты смеси имеют разное сродство к двум фазам и, таким образом, перемещаются по системе с разной скоростью. Компонент, который имеет высокое сродство к подвижной фазе, перемещается относительно быстро, тогда как компонент, который имеет высокое сродство к неподвижной фазе, перемещается медленно. Из-за разницы в скорости становится возможным полное разделение. Распространенным типом хроматографии является колоночная хроматография.
источник: socratic.org fig: хроматографияСсылка:
Adhikari, Rameshwar; Ханал, Сантош; Субба, Бимала; Адхикари, Сантош; Khatiwada, Shankar Pd.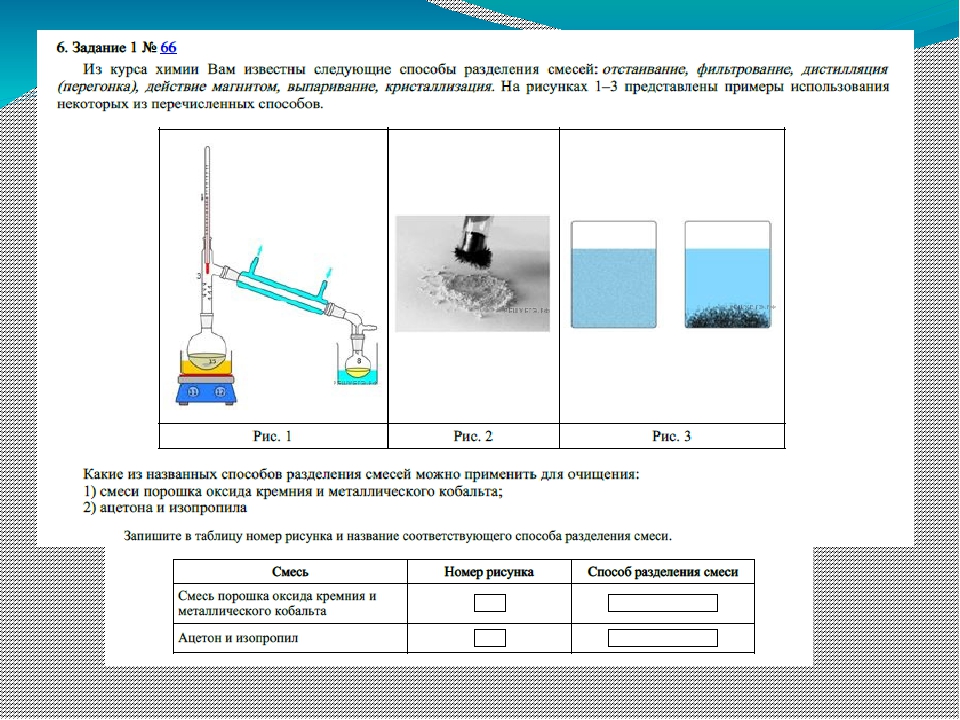 Универсальная химия XI . Первый. Vol. 1-й. Катманду: Публикация Оазиса, 2069.
Универсальная химия XI . Первый. Vol. 1-й. Катманду: Публикация Оазиса, 2069.
Чаудхари, Ганга Рам; Карна, Шила Кант Лал; Шарма, Канчан; Сингх, Санджай; Гупта, Дипак Кумар. Учебник высшей средней химии XI . Эд. 2-й. Катманду: Видьярти Пустак Бхандар, 2069 (2012).
Смеси: классификация и разделение
- Ресурс исследования
- Исследовать
- Искусство и гуманитарные науки
- Бизнес
- Инженерная технология
- Иностранный язык
- История
- Математика
- Наука
- Социальная наука
Лучшие подкатегории
- Продвинутая математика
- Алгебра
- Основы математики
- Исчисление
- Геометрия
- Линейная алгебра
- Предалгебра
- Предварительный расчет
- Статистика и вероятность
- Тригонометрия
- другое →
Лучшие подкатегории
- Астрономия
- Астрофизика
- Биология
- Химия
- Науки о Земле
- Наука об окружающей среде
- Здравоохранение
- Физика
- другое →
Лучшие подкатегории
- Антропология
- Закон
- Политология
- Психология
- Социология
- другое →
Лучшие подкатегории
- Бухгалтерский учет
- Экономика
- Финансы
- Менеджмент
Естественные науки 8 класс
Существует только два класса чистых веществ, а именно элементов и соединений .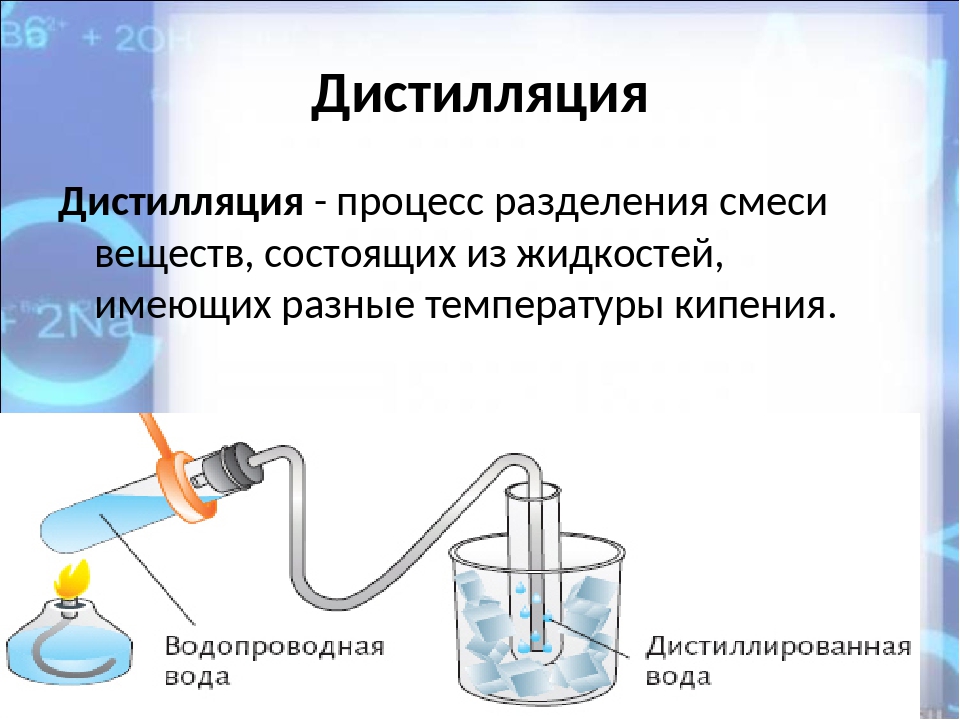 Чтобы понять разницу между ними, взгляните на две диаграммы ниже.
Чтобы понять разницу между ними, взгляните на две диаграммы ниже.
На диаграмме слева представлен элемент. Вы видите, что все атомы одного вида? Элемент — это материал, состоящий из атомов только одного вида.
Теперь посмотрите на диаграмму справа, представляющую комплекс. На этой диаграмме показаны две важные вещи о соединениях:
Соединение — это материал, состоящий из двух или более атомов, которые химически связаны друг с другом.
Теперь мы собираемся исследовать каждый из этих классов отдельно и обсудить несколько примеров каждого из них.
Элементы
Мы только что узнали, что элемент состоит из атомов одного вида. Это означает, что если бы у нас был кусок металлической меди, он полностью состоял бы из атомов меди. Точно так же кусок серебра полностью состоит из атомов серебра. Медь и серебро выглядят по-разному и имеют разные свойства, потому что они состоят из разных атомов.Взгляните на следующую таблицу, которая иллюстрирует субмикроскопическое изображение атомов, а также ювелирное изделие, сделанное из каждого из различных металлов.
ВОПРОСЫ:
Почему атомы серебра больше, чем атомы меди на предыдущих диаграммах? Подсказка: найдите два элемента в Периодической таблице и сравните их положение.Серебро находится ниже меди в Периодической таблице, что означает, что атомы серебра больше, чем атомы меди.
Считаете ли вы, что вещество, представленное на следующей диаграмме, является элементом? Чтобы помочь вам ответить на вопрос, просмотрите вопросы под диаграммой.
Сначала запишите то, что вы видите на картинке.Учащиеся могут сказать, что видят пары атомов, слипшихся вместе.
Грозди плотно упакованы или далеко друг от друга?Они относительно далеко друг от друга.
Что это значит? Вы думаете, что это твердое вещество, жидкость или газ?
Как вы думаете, это смесь веществ или чистое вещество? Почему вы так думаете?Это чистое вещество, потому что все молекулы выглядят одинаково.
Все ли атомы одного вида?
Какой класс веществ состоит только из одного вида атомов?
Является ли вещество элементом? Почему?Вещество является элементом, потому что оно состоит только из одного вида атома.
Примечание: На самом деле это двухатомные элементы, такие как кислород (O 2 ), азот (N 2 ), водород (H 2 ), которые существуют в виде двухатомных (двухатомных) молекул при комнатной температуре. .
Могут ли элементы состоять из молекул?
Не важно, чтобы учащиеся ответили на этот вопрос; он предназначен для введения понятия, что оба элемента И соединения могут существовать как молекулы, но что молекулы элементов фундаментально отличаются от молекул соединений.
Кластеры атомов в предыдущем примере называются молекулами. Молекула — очень важное слово в химии. Молекула — это два или более атома, которые химически связаны друг с другом.
Атомы в молекуле могут быть одного типа (в этом случае это может быть молекула элемента) или они могут быть разных типов (в этом случае это может быть молекула соединения).
Не все элементы имеют молекулы. Металлы в левой и средней части Периодической таблицы представляют собой твердые тела при комнатной температуре, поэтому они существуют в виде плотно упакованных массивов атомов, как в предыдущих примерах серебра и меди.
Многие неметаллы в правой части Периодической таблицы представляют собой газы при комнатной температуре, которые существуют в виде молекул, состоящих из двух атомов каждая.Их называют двухатомными молекулами . Изображение элемента, которое мы обсуждали ранее, показывает, как выглядят двухатомные молекулы. Кислород (O 2 ), азот (N 2 ), водород (H 2 ), хлор (Cl 2 ) и некоторые другие элементы из неметаллов — все они образуют двухатомные молекулы.
Нарисуйте изображение одной из этих двухатомных молекул в пространстве ниже.
Учащиеся должны нарисовать два соединенных друг с другом круга одинакового размера и цвета.Предлагается научить учащихся создавать некоторые из двухатомных молекул с помощью бусинок, шариков из пластилина и т. Д. Убедитесь, что они знают, что бусинки теперь представляют собой целые атомы, а не субатомные частицы.
Двухатомный относится к молекуле, состоящей из двух одинаковых атомов, связанных вместе, как в кислороде (O 2 ). «Ди» означает два. Трехатомный относится к молекуле, состоящей из трех одинаковых атомов, связанных вместе, как озон (O 3 ).
Это краткий обзор того, что учащиеся только что узнали об атомах и молекулах, и возможность различать их.
Давайте убедимся, что понимаем разницу между атомами и молекулами.
ВОПРОСЫ:
Посмотрите на следующие схемы. Решите, представляет ли каждый атом атом или молекулу. Если это молекула, укажите, сколько атомов составляет молекула.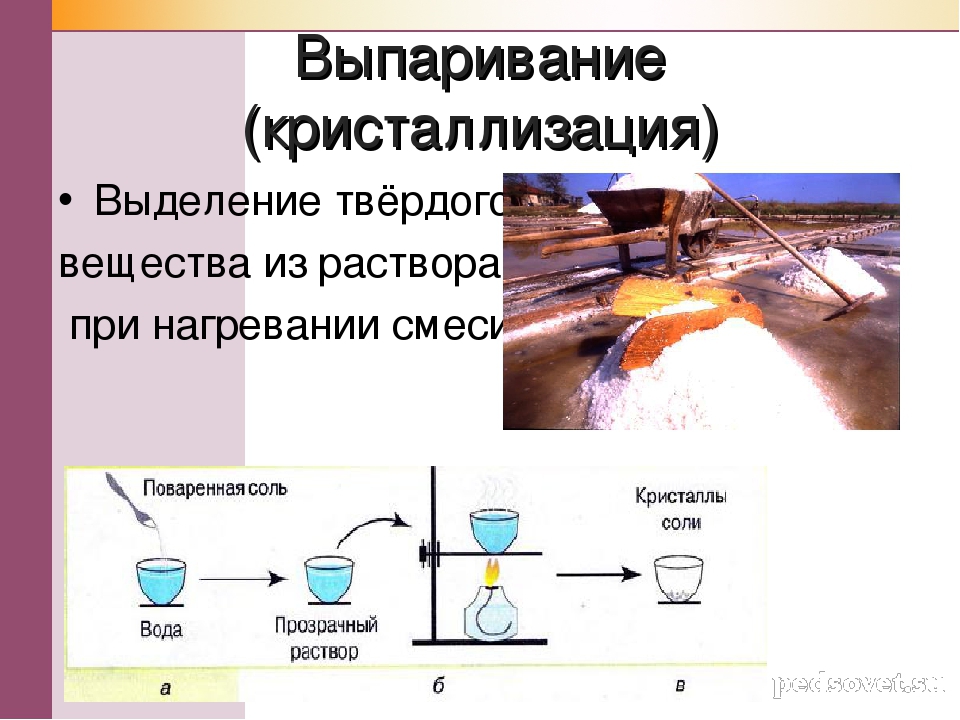
Схема | Атом или молекула? | |||
Атом | ||||
Молекула из 2 атомов | ||||
Молекула из 4 атомов57 | 903 | |||
Молекула из 9 атомов |
Посмотрите на следующую сложную молекулу.
Сколько атомов состоит в этой молекуле?
Сколько различных типов атомов состоит в этой молекуле?В состав этой молекулы входят 3 различных типа атомов.
Что удерживает атомы вместе в этой молекуле?Между атомами существуют химические связи.
Теперь давайте подумаем об этом: если соединения состоят из двух или более видов атомов, это будет означать, что соединения состоят из двух или более различных элементов, которые объединились.
Соединения
По мере того, как вы просматриваете этот материал, предложите учащимся создавать свои собственные молекулы, используя бусинки или пластилин на столе перед ними.
В известной нам Вселенной как минимум 118 элементов. Они могут образовывать соединения, соединяясь в миллионы различных комбинаций — слишком много, чтобы обсуждать здесь! Мы рассмотрим несколько простых комбинаций элементов, чтобы проиллюстрировать идею.
Поскольку вода является таким важным компонентом для организмов, живущих на Земле, мы будем использовать это в качестве первого примера.Ученые знают, что молекула воды состоит из одного атома кислорода и двух атомов водорода. Если бы мы могли их видеть, все молекулы воды были бы немного похожи на эту диаграмму молекулы воды.
Представление молекулы воды.Международный союз теоретической и прикладной химии (IUPAC) называет воду монооксидом дигидрогена.
Все молекулы воды одинаковы. Мы говорим, что атомы связаны в фиксированном соотношении : : два атома водорода на каждый атом кислорода.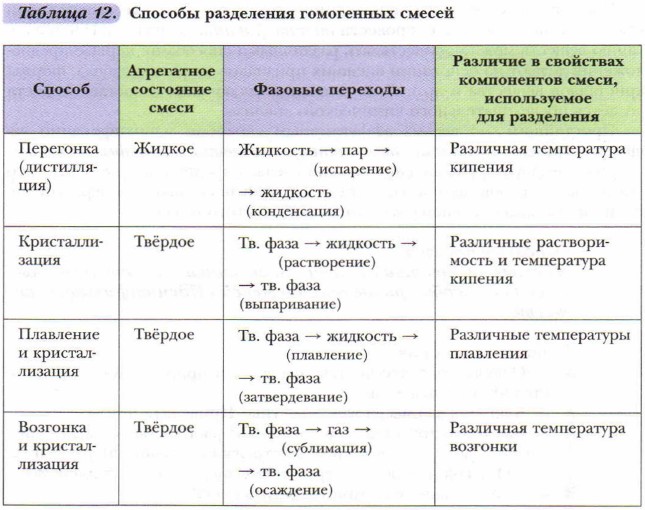 Атомы в молекуле удерживаются вместе особой силой, которую мы называем «химическая связь , ».
Атомы в молекуле удерживаются вместе особой силой, которую мы называем «химическая связь , ».
Эти связи известны как ковалентные связи, но учащиеся пока не обязаны это знать. Вы также можете напомнить учащимся на этом этапе, что диаграммы молекул — это просто представления, и мы используем разные цвета, чтобы различать атомы разных элементов. Атомы кислорода на самом деле не красные.
Химические формулы
Можете ли вы вспомнить, что у каждого элемента есть свой уникальный химический символ? Мы можем объединить эти символы в химическую формулу воды.Химическая формула — еще одно очень важное понятие в химии.
Химическая формула воды: H 2 O. Она показывает отношение атомов водорода (два) к атомам кислорода (один) в одной молекуле воды. Как вы думаете, о чем нам говорит химическая формула CO 2 ?
Он говорит нам, что один атом углерода (C) связан с двумя атомами кислорода (O) в CO 2 .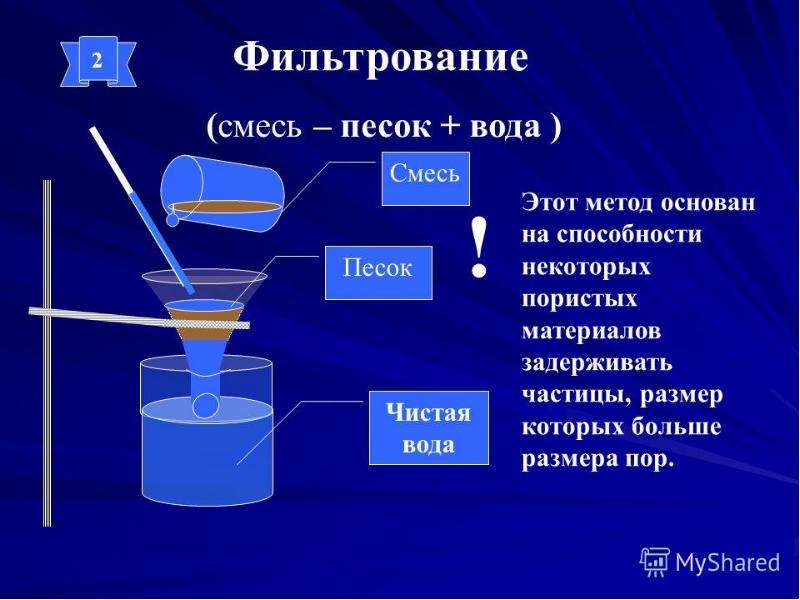 На этом этапе предлагается написать несколько химических формул на доске и попросить учащихся объяснить вам, что каждый из них говорит вам.Попросите учащихся делать заметки на боковых полях своих рабочих тетрадей, пока вы обсуждаете это в классе. Это послужит введением к следующему занятию. Например, вы также можете написать:
На этом этапе предлагается написать несколько химических формул на доске и попросить учащихся объяснить вам, что каждый из них говорит вам.Попросите учащихся делать заметки на боковых полях своих рабочих тетрадей, пока вы обсуждаете это в классе. Это послужит введением к следующему занятию. Например, вы также можете написать:
H 2 для газообразного водорода, что означает, что два атома водорода связаны вместе. Это двухатомная молекула.
- NaCl для хлорида натрия (поваренная соль), что означает, что один атом натрия связан с одним атомом хлора.
KMnO4 — перманганат калия.Это может быть немного сложнее, но подчеркивает, что молекула может состоять более чем из двух разных элементов. Здесь один калий, один марганец, один атом азота и четыре атома кислорода связаны вместе, образуя одну молекулу.
В следующем упражнении мы попрактикуемся в написании и понимании химических формул.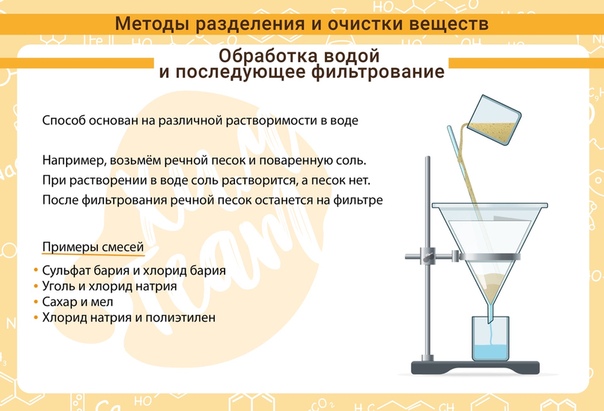 Всегда полезно думать о новой концепции разными способами. По этой причине мы также будем строить модели молекул, для которых пишем формулы.
Всегда полезно думать о новой концепции разными способами. По этой причине мы также будем строить модели молекул, для которых пишем формулы.
МАТЕРИАЛЫ:
- пластилин или пластилин разных цветов
ИНСТРУКЦИЯ:
- В следующей таблице названия некоторых чистых веществ приведены в левом столбце. Заполните все пустые блоки в таблице.
- Постройте модель одной молекулы каждого соединения на столе. Ваши атомы должны быть размером с горошину. Это может помочь вам построить модель, прежде чем рисовать молекулу в правом столбце.Когда вы закончите, покажите своему учителю.
Чтобы помочь вам в этом, вот несколько рекомендаций:
- Каждая строка в таблице содержит достаточно информации, чтобы вы могли заполнить все пустые блоки.
- Первая строка заполнена за вас, так что у вас есть пример:
- В графе 1 указано название: вода
Колонка 2 содержит формулу: H 2 O
Колонка 3: Формула воды (в колонке 2) содержит всю информацию, которая нам нужна для заполнения блока в «Из чего она сделана?» столбец.
 Когда мы читаем формулу H 2 O, нижний индекс «2» говорит нам, что существует два атома H. Поскольку у O нет нижнего индекса, это означает, что существует только один атом O.
Когда мы читаем формулу H 2 O, нижний индекс «2» говорит нам, что существует два атома H. Поскольку у O нет нижнего индекса, это означает, что существует только один атом O.- Колонка 4: Модель молекулы воды должна отражать наличие одного атома О и двух атомов Н. Откуда мы знаем, что О должен быть посередине? На данный момент достаточно знать, что атом, которого у нас меньше всего, обычно находится посередине.
На этом этапе не важно, чтобы учащиеся правильно знали точные углы между атомами, такие как угол между атомами водорода в молекуле воды, поскольку они узнают только о том, что влияет на это позже, в Gr.10-12.
Название вещества | Химическая формула | Из чего он сделан? | Как бы выглядела молекула этого соединения (если бы мы могли ее увидеть)? |
Вода | H 2 O | Два атома H и один атом O | |
Двуокись углерода | |||
Диоксид серы | |||
Сероводород | H 2 S | ||
Аммиак | Один атом N и три атома H | ||
Газообразный кислород | Два атома O | ||
Газообразный азот | N 2 | ||
Газообразный хлор | |||
Водородный газ | Два атома H |
Заполненная таблица должна выглядеть следующим образом.
Название вещества | Химическая формула | Из чего он сделан? | Как бы выглядела молекула этого соединения (если бы мы могли ее увидеть)? |
Вода | H 2 O | Два атома H и один атом O | |
Двуокись углерода07 CO 2 Два атома O и один атом C | |||
Диоксид серы | SO 2 | Два атома O и один атом S | |
| 9000 сероводород H 2 S | Два атома H и один атом S | ||
Аммиак | NH 3 | Один атом N и три атома H | |
Газообразный кислород | O 2 | Два атома O | 90 308 |
Газообразный азот | N 2 | Два атома азота | |
Хлорсодержащий газ | Cl 9007 3 | ||
Водородный газ | H 2 | Два атома H |
ВОПРОСЫ:
Перечислите все вещества из таблицы, которые являются элементами. Напишите их имена и формулы.
Напишите их имена и формулы.Водород, H 2
Кислород, O 2
Хлор, Cl 2
Азот, N 2
Перечислите все вещества из таблицы, которые являются соединениями. Напишите их имена и формулы.Вода, H 2 O
Двуокись углерода, CO 2
Диоксид серы, SO 2
Натрия хлорид, NaCl
Сероводород, H 2 S
Аммиак, NH 3
Как вы узнали, какие вещества в таблице являются соединениями, а не элементами?
Вы, наверное, искали, чтобы увидеть, какие из них состоят из более чем одного вида атомов.Соединение — это материал, состоящий из атомов двух или более различных элементов. Элементы не просто физически смешаны, но химически связаны друг с другом на атомном уровне.
Элементы не просто физически смешаны, но химически связаны друг с другом на атомном уровне.
Вода (H 2 O), диоксид углерода (CO 2 ) и соль или хлорид натрия (NaCl) являются примерами соединений, в то время как газообразный кислород (O 2 ), газообразный водород (H 2 ) и газообразный азот (N 2 ) являются примерами элементов.
Соединение формулы H 2 O 2 также состоит из атомов водорода и кислорода.Формула говорит нам, что одна молекула этого вещества состоит из двух атомов водорода и двух атомов кислорода. H 2 O 2 то же самое, что вода? Что вы думаете?
Не путайте H 2 O 2 с H 2 O! H 2 O 2 представляет собой соединение, называемое пероксидом водорода. Перекись водорода похожа на воду в том, что при комнатной температуре (25 ° C) это прозрачная бесцветная жидкость, хотя и не такая жидкая, но во многом отличается. Следующие свойства перекиси водорода могут убедить вас, что это не то же самое, что вода:
Следующие свойства перекиси водорода могут убедить вас, что это не то же самое, что вода:
- Пероксид водорода имеет температуру кипения 150 ° C и является очень эффективным отбеливателем для одежды и волос.
- Концентрированная перекись водорода настолько реактивна, что используется в качестве компонента ракетного топлива!
- Перекись водорода чрезвычайно агрессивна.
- Мы можем пить воду, но перекись водорода очень опасна и вредна.
Коррозионные вещества — это вещества, которые вызывают повреждение металла или других материалов в результате химического процесса.Представьте, что дождевая вода вызывает ржавчину, разъедающую металл.
Если это вас не убеждает, давайте сравним, как выглядит молекула перекиси водорода рядом с водой:
Перекись водорода. Вода. Несмотря на то, что они состоят из одних и тех же элементов, эти два соединения очень разные, и их никогда не следует путать друг с другом.
Целью приведенного выше сравнения перекиси водорода и воды было показать вам, что атомы в данном соединении всегда соединяются в фиксированном соотношении.Во всех молекулах воды во Вселенной всегда будут связаны один атом O и два атома H.
Это был пятый постулат Далтона:
5. Атомы химически соединяются в фиксированных соотношениях с образованием соединений.
Как атомы «сочетаются»? Что заставляет их слипаться и образовывать молекулы?
Химические связи
Посмотрите на фото с различными вариантами расположения металлических шариков. Эти шарики магнитные, что позволяет создавать различные узоры, склеивая их вместе.Что заставляет магниты склеиваться?
Учащиеся могут сказать, что магниты слипаются, потому что они притягивают друг друга. Укажите им, что магниты действительно будут притягиваться друг к другу, если они правильно расположены. Магниты также могут отталкивать друг друга, если они расположены по-другому. Учащиеся будут больше изучать магнитные силы в Gr. 9 Энергия и перемены.
Учащиеся будут больше изучать магнитные силы в Gr. 9 Энергия и перемены.
Магниты притягивают (или отталкивают) друг друга из-за магнитной силы между ними (вы узнаете больше о магнитах в Gr.9). Когда атомы объединяются, они делают это, потому что они также испытывают силу притяжения. Сила немного сложнее, чем сила между магнитами, но работает она так же: сила удерживает атомы вместе, как будто они склеены клеем. Силы, удерживающие атомы вместе, называются химическими связями .
В молекуле воды химические связи между О и двумя атомами Н удерживают всю молекулу вместе. Сколько химических связей в каждой молекуле воды? Если вы не уверены, посмотрите на диаграмму ниже:
Две облигации.Если на этом этапе вы хотите вывести учащихся за рамки требований учебной программы, вы могли бы дать краткое объяснение электронного обмена. Детали этого будут изучены только в Gr. 10. Эти прочные химические связи, называемые ковалентными связями, образуются, когда атомы делятся своими электронами. Это объясняет, почему после реакции разложения атомы немедленно преобразуются во что-то другое: требование совместного использования электронов, которое привело к первоначальной связи, все еще существует, они просто делятся электронами с другим атомом.
Это объясняет, почему после реакции разложения атомы немедленно преобразуются во что-то другое: требование совместного использования электронов, которое привело к первоначальной связи, все еще существует, они просто делятся электронами с другим атомом.
Молекула воды имеет две идентичные связи O-H. Что бы произошло, если бы у нас было достаточно энергии, чтобы разорвать эти узы?
Если бы у нас было достаточно энергии, чтобы разорвать связи O-H, мы смогли бы отделить атомы друг от друга.
Что бы мы получили, если бы разделили молекулы воды на их атомы? Теоретически у нас были бы атомы водорода и кислорода. На самом деле происходит то, что атомы водорода немедленно объединяются, образуя H 2 , а атомы кислорода немедленно объединяются, чтобы сформировать O 2 .
Когда атомы отделяются друг от друга и рекомбинируют в различные комбинации атомов, мы говорим, что произошла химическая реакция .
В указанной выше химической реакции вода разложилась (распалась) и рекомбинировала на более мелкие молекулы.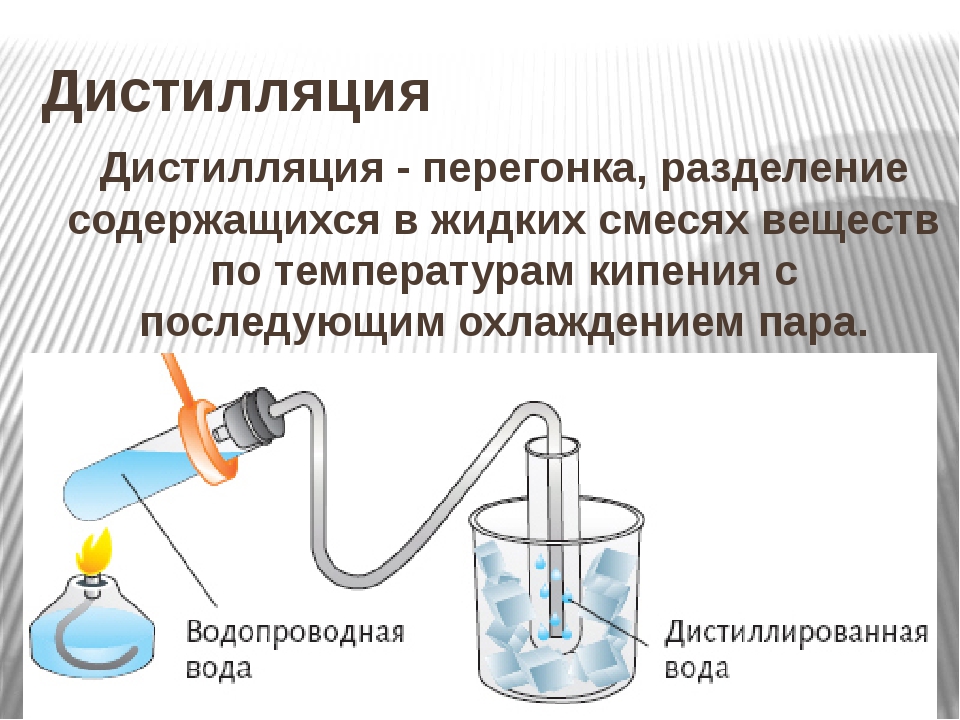 Мы говорим, что вода подверглась реакции разложения в приведенном выше примере. Конечно, не все химические реакции являются реакциями разложения. Есть много различных видов химических реакций, и мы собираемся исследовать некоторые примеры в следующем разделе.
Мы говорим, что вода подверглась реакции разложения в приведенном выше примере. Конечно, не все химические реакции являются реакциями разложения. Есть много различных видов химических реакций, и мы собираемся исследовать некоторые примеры в следующем разделе.
Химические реакции
Во всех химических реакциях происходят два важных события:
- разрыв химических связей
- новых химических связей образуют
Это означает, что в всех химических реакциях атомы в молекулах перестраиваются, образуя новые молекулы.
В следующем упражнении мы собираемся смоделировать реакцию разложения воды, используя глину или шарики из пластилина для представления различных атомов.
Это дополнительное расширение.Позднее в семестре учащиеся будут больше изучать химические реакции.
МАТЕРИАЛЫ:
- пластилин или пластилин двух разных цветов
ИНСТРУКЦИЯ:
- Соберите две молекулы воды из глины или пластилина.
 Посмотрите на предыдущие изображения, чтобы напомнить вам, как выглядит молекула воды. Вы можете использовать глину любого цвета для создания своей.
Посмотрите на предыдущие изображения, чтобы напомнить вам, как выглядит молекула воды. Вы можете использовать глину любого цвета для создания своей. - Теперь разорвите все связи, удерживающие молекулы вместе, разделив их на отдельные атомы.
Ответьте на следующие вопросы:
Сколько у вас атомов водорода (H)?
Сколько у вас атомов кислорода (O)?
Объедините атомы водорода и кислорода в молекулы водорода (H 2 ) и молекулы кислорода (O 2 ).
Ответьте на следующие вопросы:
Сколько молекул водорода можно построить из атомов H?Две молекулы водорода (H 2 ) могут быть образованы из четырех атомов H.
Сколько молекул кислорода можно построить из атомов O?Одна молекула кислорода (O 2 ) может состоять из двух атомов O.
Можете ли вы написать химическое уравнение для реакции, которую вы только что построили, с помощью глиняных моделей? Посмотрите на схему для вдохновения:
2 H 2 O \ (\ rightarrow \) 2 H 2 + O 2
Химические уравнения будут правильно представлены в последней главе Gr. 8 Материя и материалы, но это может быть хорошим местом, чтобы начать привлекать к этому внимание учащихся. Вы могли бы объяснить, что когда есть только одна молекула определенного вида (O 2 в приведенном выше примере), мы не пишем число перед ней в химической реакции. На данном этапе балансировка уравнений не требуется.
8 Материя и материалы, но это может быть хорошим местом, чтобы начать привлекать к этому внимание учащихся. Вы могли бы объяснить, что когда есть только одна молекула определенного вида (O 2 в приведенном выше примере), мы не пишем число перед ней в химической реакции. На данном этапе балансировка уравнений не требуется.
Давайте посмотрим на другой пример химической реакции: реакция, когда углерод (в угле) реагирует с кислородом (в воздухе) с образованием диоксида углерода:
Вы можете использовать шарики из пластилина для имитации этой реакции.
Попробуйте написать химическое уравнение реакции, когда углерод и кислород соединяются с образованием диоксида углерода. (Подсказка: используйте схему, чтобы направлять вас.)
C + O 2 \ (\ вправо \) CO 2
Как атомы угля и кислорода перегруппировываются с образованием диоксида углерода? Какие облигации рвутся?
Связь между двумя атомами кислорода разрывается.
Какие новые облигации образуют?
При образовании диоксида углерода образуются две новые углеродно-кислородные связи.
Затем ваш учитель продемонстрирует классу две химические реакции. Ваша задача — внимательно наблюдать и записывать свои наблюдения, которые вы можете видеть в происходящем.
Мы предлагаем сделать это в качестве демонстрации или поставить несколько экспериментов в классе, за которыми могут наблюдать разные группы учащихся. Видео в окне для посещения содержит простую демонстрацию электролиза с использованием сульфата меди вместо хлорида меди. Но наблюдения будут такими же, а именно, что медь покрывает катод, и вы можете наблюдать пузырьки газа на аноде (на видео это газообразный кислород, а не газообразный хлор, как в исследовании здесь, в рабочей тетради.
Видео, демонстрирующее аналогичную реакцию с использованием сульфата меди.
AIM: Определить, можно ли разложить хлорид меди с помощью электроэнергии.
МАТЕРИАЛЫ И АППАРАТ:
- стакан
- картонный диск, достаточно большой, чтобы закрыть верхнюю часть стакана
- два графитовых электрода
- 2 провода
- Растворы хлорида меди
- аккумулятор 9 вольт
Вместо графитовых электродов вы также можете получить угольные электроды из использованных ячеек горелки.
Длина провода с зажимами типа «крокодил» на обоих концах является идеальной. Они понадобятся вам для построения электрической цепи. Включение переключателя в схему не является обязательным.
Раствор хлорида меди можно приготовить, растворив две чайные ложки хлорида меди (II) в стакане водопроводной воды.
Перед запуском сделайте следующие наблюдения:
Какого цвета раствор хлорида меди?Какого цвета графитовые электроды?
МЕТОД:
- Налейте раствор хлорида меди в стакан.

- Сделайте два небольших отверстия в картонном диске и протолкните электроды через отверстия, как показано на следующей схеме.
- Поместите диск над стаканом так, чтобы большая часть каждого электрода находилась под поверхностью раствора.
- Подсоедините верхние части электродов к концам батареи с помощью длин проводов. Взгляните на схему экспериментальной установки.
- Дайте реакции развиться в течение нескольких минут и посмотрите, что произойдет.
- Когда реакция продлится примерно 10 минут, можно отсоединить провода и разобрать установку.
НАБЛЮДЕНИЯ:
Что вы наблюдаете на поверхности двух электродов после того, как реакция длилась несколько минут?Один электрод покрывается маленькими пузырьками, а другой становится коричневым.
Какого цвета в конце эксперимента был хлорид меди? Решение все еще синее.
Если вы сохранили часть исходного решения, учащиеся могут сравнить решение до и после эксперимента. Они могут заметить, что решение «после» не такое синее, как решение «до». Попросите учащихся задуматься, почему это могло быть. Это связано с двумя причинами:
- ионы меди выходят из раствора, поскольку они принимают электроны и превращаются в твердую медь, которая осаждается на катоде красновато-коричневого цвета. (Учащиеся еще не знают об обмене ионами или электронами, поэтому они могут предположить, что атомы / частицы меди выходят из раствора и накапливаются на электроде.)
ионов хлора образуют газообразный хлор Cl 2 на аноде. (Учащиеся могут наблюдать образование пузырьков газа на другом электроде и, возможно, сделать вывод, что это хлорид, выходящий из раствора в виде газообразного хлора.)
Следовательно, , концентрация раствора хлорида меди становится слабее, в результате чего он становится немного менее синим.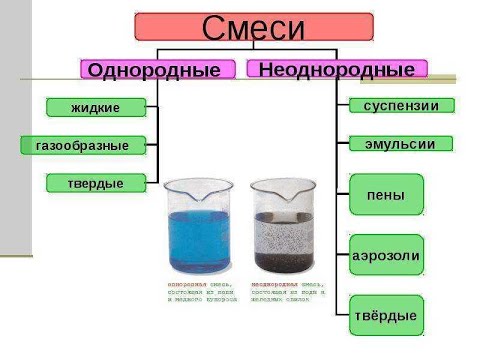
Один электрод все еще темно-серый или черный.Другой электрод покрыт красновато-коричневым слоем.
Можно отметить, что электрод, который остался серо-черным, был тем же электродом, на котором раньше были пузырьки. Пусть некоторые из учащихся почувствуют запах этого электрода. Они могут чувствовать запах отбеливателя, который представляет собой запах газообразного хлора Cl 2 . Попросите учащихся сравнить цвет слоя с цветом медной монеты. Может ли налет на втором электроде быть медью? Да, именно так.
Учащимся не нужно понимать, что происходит в растворе на ионном уровне.Акцент здесь делается на демонстрации того, что соединение можно разбить на элементы. Тем не менее, объяснение электролиза раствора хлорида меди (II) приводится здесь для справки, и если вы хотите расширить свои знания учащихся:
Когда электроды подключены к источнику питания, электроны перемещаются, заставляя электрод, прикрепленный к положительному концу батареи, становиться положительным.
 Это называется анод . Затем отрицательно заряженные ионы хлорида в растворе притягиваются к положительному аноду.Ионы хлора отдают свои электроны и образуют газообразный хлор, который наблюдается в виде пузырьков.
Это называется анод . Затем отрицательно заряженные ионы хлорида в растворе притягиваются к положительному аноду.Ионы хлора отдают свои электроны и образуют газообразный хлор, который наблюдается в виде пузырьков.Электрод, прикрепленный к отрицательному полюсу батареи, становится отрицательным. Он называется катодом . На катоде положительно заряженные ионы меди в растворе притягиваются к отрицательному электроду. На катоде ионы меди приобретают электроны, образуя металлическую медь, которая осаждается на катоде. Наблюдается коричневый налет.
(Вы можете попросить учащихся нарисовать положительные и отрицательные знаки и обозначить электроды на диаграммах в своих рабочих тетрадях в качестве дополнения.)
Электрод, прикрепленный к положительной стороне батареи, является положительным электродом и называется анодом . Электрод, прикрепленный к отрицательной стороне батареи, является отрицательным электродом и называется катодом .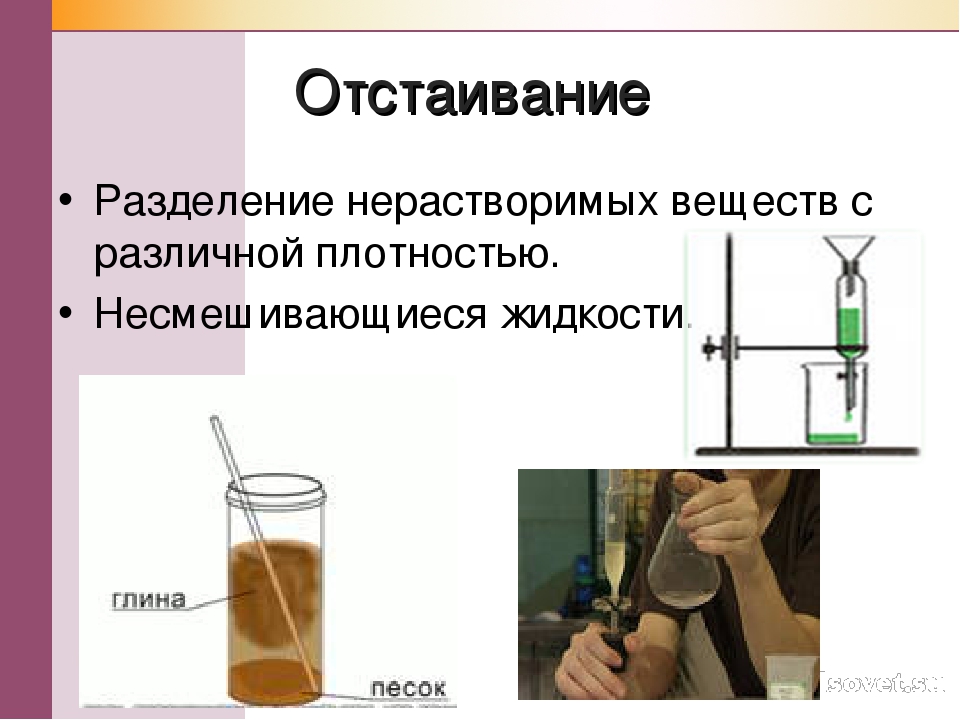
Обобщите ваши экспериментальные наблюдения в следующей таблице.
Раствор хлорида меди | Электрод 1 (называемый анодом) | Электрод 2 (называемый катодом) | ||||
До эксперимента | эксперимент |
Раствор хлорида меди | Электрод 1 (называемый анодом) | Электрод 2 (называемый катодом) | |
Перед экспериментом | цвет. | Темно-серая поверхность. | Темно-серая поверхность. |
После эксперимента | Раствор все еще был синим, но цвет был менее интенсивным. | Темно-серая поверхность, но со слабым запахом отбеливателя. Во время реакции пузырьков не наблюдалось. | Красновато-коричневый налет на поверхности. |
АНАЛИЗ И ОБСУЖДЕНИЕ:
Что придало раствору хлорида меди насыщенный синий цвет?Хлорид меди, растворенный в нем.
Как вы думаете, часть хлорида меди могла измениться во время реакции во что-то другое? Объясните, почему вы так думаете.Раствор хлорида меди стал менее синим. Это говорит нам о том, что часть хлорида меди превратилась во что-то другое.
Как бы вы объяснили пузырьки на поверхности первого электрода? Вы хоть представляете, какими они могли быть? Подсказка: чем потом пахнет электрод?Пузырьки означают, что на поверхности электрода образовался газ.Пахло отбеливателем. Газообразный хлор также пахнет отбеливателем, поэтому возможно, что газ, образующийся на электроде, мог быть хлором.
Примечание: Хлор фактически является активным ингредиентом отбеливателя.
Вы знаете, что такое красновато-коричневый налет на втором электроде? Подсказка: какой металл имеет такой же характерный красновато-коричневый цвет? Возможно, красновато-коричневый налет — медный.
Атомы в хлориде меди были перегруппированы, чтобы образовать различные материалы: медь (Cu) и хлор (Cl 2 ).
ВЫВОД:
Напишите заключение для расследования. В своем заключении вам следует переписать цель расследования в заявление о результатах вашего расследования.Заключение обучаемого должно содержать как минимум два из следующего:
Как вы думаете, возможно ли разделить хлорид меди на медь и хлор с помощью любого из методов физического разделения, о которых мы узнали в Gr.7 Материя и материалы, такие как просеивание, фильтрация, выпаривание, дистилляция или хроматография? Вот подсказка: ни один из этих методов не может разорвать связи между атомами в веществе.
Ответ — нет. Медь и хлор химически связаны в хлориде меди. Мы знаем это из его химической формулы: CuCl 2 . Методы физического разделения могут использоваться только для разделения смесей на вещества, из которых они состоят.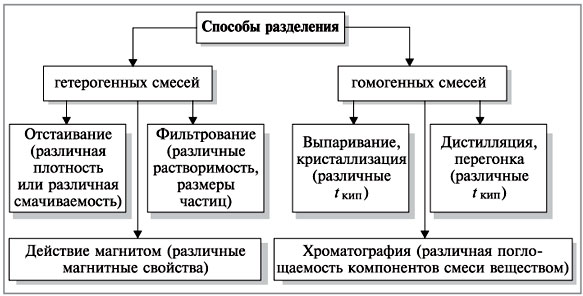
На данный момент мы узнали об атомах, молекулах, элементах и соединениях.Иногда эти концепции сбивают с толку, потому что они описывают вещи, которые слишком малы, чтобы их можно было увидеть, а иногда и трудно представить. В следующем разделе мы вернемся к идее смесей и посмотрим, как все, что мы узнали до сих пор, можно поместить в схему классификации материи и материалов.
Естественные науки 7 класс
Вещества в растворе смешиваются на уровне отдельных частиц. В растворе сахара и воды частицы сахара и частицы воды смешаны так хорошо, что мы не можем различить их невооруженным глазом.Вы можете подумать, что такие «хорошо перемешанные» смеси невозможно разделить! Но, как мы вскоре увидим, это неправда.
Разделение выпариванием
Продемонстрируйте это на уроке, растворив немного соли в воде перед классом в начале урока. Убедитесь, что они приняли к сведению прозрачное решение. Затем вылейте немного в неглубокую алюминиевую сковороду, похожую на те, что используются для выпечки. Поместите это в солнечное место на время урока и дайте воде испариться.Скорость испарения будет зависеть от того, насколько жарко и влажно в день, когда вы это делаете. В конце урока соберите кастрюлю и покажите оставшуюся засохшую соль, как в кастрюле для соли. Возможно, вам придется оставить его до конца дня, в зависимости от того, насколько жарко.
Поместите это в солнечное место на время урока и дайте воде испариться.Скорость испарения будет зависеть от того, насколько жарко и влажно в день, когда вы это делаете. В конце урока соберите кастрюлю и покажите оставшуюся засохшую соль, как в кастрюле для соли. Возможно, вам придется оставить его до конца дня, в зависимости от того, насколько жарко.
Вы знаете, откуда берется большая часть соли, которую мы используем в Южной Африке? Южная Африка получает соль из внутренних, прибрежных соляных бассейнов и морской воды. Соляной поддон — это неглубокая плотина в земле, где соленая вода испаряется , оставляя слой сухой соли.
Вид с воздуха на солончаки. http://commons.wikimedia.org/wiki/File:Salt_pans.jpg Соль в Индии. Мужчина занимается сбором сушеной соли для упаковки и продажи. Когда морская вода находится в неглубоких поддонах, вода нагревается солнечным светом и медленно превращается в водяной пар в результате испарения. Как только вода полностью испарится, остается твердая соль.
Как вы думаете, это хороший метод отделения соли от воды? Как вы думаете, подойдет ли раствор сахара и воды?
Если у вас есть время сделать это в классе, вы можете продемонстрировать это практически.Предложите учащимся попробовать соленую воду перед кипячением, а затем предложите им попробовать конденсат. Так они поймут, что испарилась только вода, а в чайнике осталась соль. Вы можете положить лед в небольшой пластиковый пакет, чтобы лед не соскользнул с пластины, но пластина все еще достаточно холодная для конденсации водяного пара. Хранение льда в пластиковом пакете также гарантирует, что тающий лед не будет капать в стакан, в котором собирается конденсированная вода.Вы также можете использовать химический стакан или стакан с солевым раствором над горелкой Бунзена и использовать холодный кусок стекла или зеркало, чтобы конденсировать воду и собирать ее в другой стакан.
ВОПРОСЫ:
Как вы думаете, разделение путем испарения будет хорошим методом разделения водно-солевого раствора, если вы хотите сохранить и соль, и воду? Почему ты так говоришь?
Испарение само по себе не является хорошим методом разделения, если вы хотите сохранить и соль, и воду.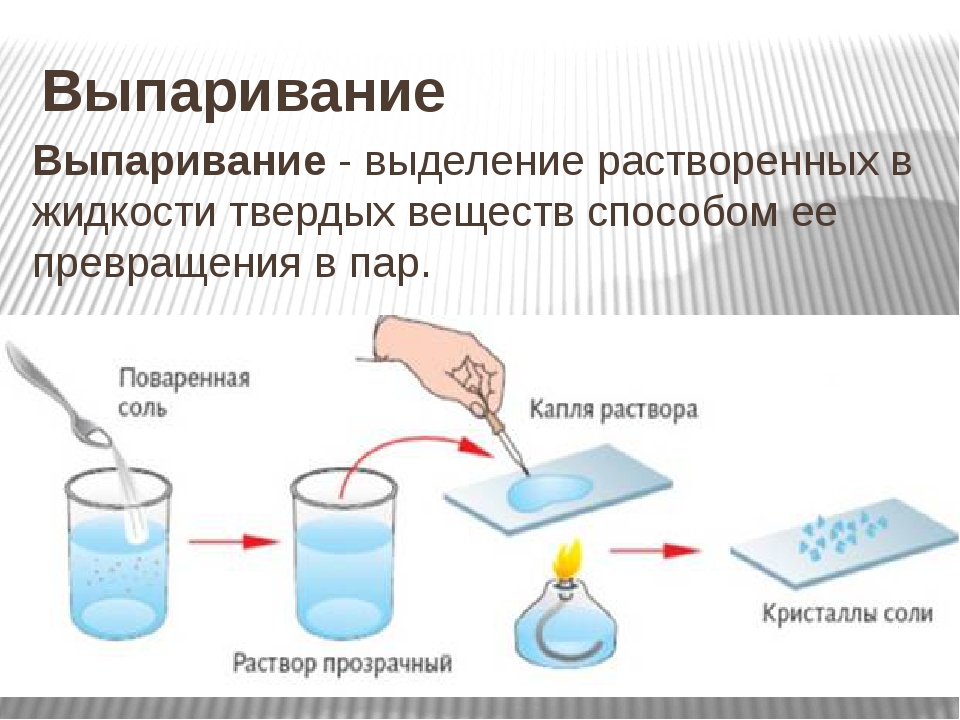 Как только вода испаряется, она теряется.
Как только вода испаряется, она теряется.
На рисунке раствор соленой воды нагревается в чайнике, а металлическая пластина (с небольшим количеством льда внутри, чтобы держать ее внешнюю поверхность холодной) удерживается в водяном паре, выходящем из носика чайника. Водяной пар охлаждается при соприкосновении с холодной металлической пластиной и конденсируется.Затем он стекает с планшета в стакан для сбора. После того, как вся вода испарится, соль останется в чайнике. Но у вас все еще есть вода в стакане.
Что происходит в чайнике?
Можете ли вы сказать, какое изменение состояния происходит внутри чайника? Как называется процесс?
Жидкая вода превращается в водяной пар. Процесс испарения.
Какое изменение состояния происходит на холодной поверхности металлической пластины? Как называется процесс? (Подсказка: изменение состояния с газа на жидкость было рассмотрено в предыдущей главе в разделе Физические свойства материалов . )
)
Водяной пар превращается в жидкую воду. Процесс называется конденсацией.
Соль испаряется с водой? Как бы вы узнали?
Нет. Вы можете почувствовать, что вода соленая до испарения и не соленая после конденсации. Если кипятить воду до полного испарения, можно увидеть, как образуются кристаллы соли.
Что вы можете сказать о чистоте воды после того, как она испарилась и конденсировалась?
Он не имеет соленого вкуса после испарения / конденсации, поэтому мы предполагаем, что он чистый, но в нем могут быть другие вещи, которые мы не можем попробовать.
Некоторые вещи, которые мы не можем обнаружить или попробовать, например, если бы мы использовали морскую воду.
Вода, теряемая при испарении, может конденсироваться на холодной поверхности. Холодная металлическая пластина справится с этой задачей, но будет трудно восстановить всю конденсированную воду, потому что она будет стекать с поверхности пластины в самых разных местах. У ученых есть решение этой проблемы: они используют особую технику для разделения подобных смесей без потери каких-либо компонентов.Методика перегонки называется .
У ученых есть решение этой проблемы: они используют особую технику для разделения подобных смесей без потери каких-либо компонентов.Методика перегонки называется .
Дистилляция
Если у вас есть оборудование для настройки процесса дистилляции, вы можете продемонстрировать его в классе. В противном случае вы можете использовать альтернативные материалы и оборудование. Например, если у вас нет конденсатора Либиха, вы можете использовать кусок медной трубы. Вот две ссылки, которые объясняют, как построить собственное оборудование для дистилляции: http://www.instructables.com/id/Build-a-Lab-Quality-Distillation-Apparatus/ и http: // nukegingrich.files.wordpress.com/2009/06/diy-still.pdf. Еще одно предложение — предложить учащимся также провести исследование, чтобы увидеть, как сделать свой собственный дистилляционный аппарат, в особенности обращая внимание на материалы, которые легче и дешевле найти. Для демонстрации множества научных экспериментов не обязательно иметь лабораторное оборудование — многие из них можно просто
это делается путем обдумывания материалов, которые вы используете в повседневной жизни, и составления плана! Это также делает науку более доступной для всех.
Дистилляция — это отделение одного вещества от другого путем испарения с последующей конденсацией.Аппарат, используемый в этой технике, называется Still .
Экспериментальная установка для дистилляцииПредположим, мы хотим разделить воду и соль в морской воде. Мы бы поместили морскую воду в круглую колбу слева от изображения (в колбу для перегонки). Затем мы кипятили морскую воду для получения водяного пара или пара. Соль не испаряется с водой, потому что испаряется только вода. Водяной пар поднимается через верхнюю часть колбы и попадает в конденсатор Либиха.
Два конденсатора Либиха, которые используются в процессе дистилляции http://commons.wikimedia.org/wiki/File:Liebig_condensers-two_2.jpgКонденсатор Либиха состоит из стеклянной трубки внутри большой стеклянной трубки. Конденсатор устроен таким образом, что холодная вода может протекать через пространство между трубками. Это охлаждает поверхность внутренней трубки. Водяной пар конденсируется на этой холодной поверхности и течет в приемную колбу. Поскольку соль не испарилась, она остается в перегонной колбе.
Видео, описывающее, как солнечная энергия еще может опреснять (убирать соль) воду.
Видео о солнечном кадре короткое, но предлагает интересную тему для обсуждения: применение методов разделения; изобретения; преимущества и недостатки; вы даже можете обсуждать проекты с открытым исходным кодом и делиться информацией. Итальянский изобретатель солнечной батареи Eliodomestico по-прежнему проектировал ее с учетом потребностей развивающихся стран. Он относительно дешев, прост в сборке и не требует электричества.Он описывается как экодистиллятор, работающий от солнечной энергии. Все, что вам нужно сделать, это налить 5 литров соленой или нечистой воды, закрутить крышку и оставить на солнце. К концу дня из него может быть получена чистая от бактерий и соленая вода, пригодная для питья. Это также проект с открытым исходным кодом, что означает, что любой может использовать дизайн и воспроизводить, изменять или обновлять его, но не продавать его для получения прибыли.
Дистилляция также является лучшим способом разделения двух жидкостей с разными точками кипения, например, воды и этанола.Давайте посмотрим.
Это дополнительное задание, или оно может быть выполнено как домашнее задание. Это продолжение того, что учащиеся узнали бы об использовании дистилляции.
ВОПРОСЫ:
Вы можете вспомнить температуру, при которой закипает вода? Запишите это ниже.
Как называется эта температура?
Температура кипения воды.
Этанол кипит при температуре ниже точки кипения воды, а именно 78 ° C.Предположим, вы смешали немного воды и этанола. Смесь для начала находится при комнатной температуре. Теперь предположим, что вы начали нагревать смесь. Какая температура будет достигнута первой: 78 ° C или 100 ° C?
Как вы думаете, что произойдет, когда смесь достигнет температуры 78 ° C? Вы думаете, этанол закипит?
Учащимся можно напомнить, что этанол по-прежнему остается этанолом, его не меняли в процессе смешивания, поэтому он наверняка закипит при 78 ° C.
Будет ли при этом закипать вода?
Нет. Вода закипает только при 100 ° C. Пока температура ниже 100 ° C, вода не закипает.
Эти вопросы идентичны вопросам, заданным в исходном задании. Они были включены в первоначальную деятельность, чтобы служить введением в концепцию дистилляции.
Мы можем использовать тот же метод дистилляции, который мы использовали для разделения морской воды, чтобы разделить две жидкости.Принцип точно такой же, за исключением того, что мы будем перегонять смесь более одного раза. Вот как это работает:
Смесь двух жидкостей помещают в перегонную колбу и нагревают до самой низкой точки кипения. В случае смеси этанол / вода этой температурой будет точка кипения этанола, а именно 78 ° C. Вся жидкость с такой температурой кипения испарится, конденсируется в конденсаторе Либиха и перейдет в приемную колбу. Жидкость с более высокой температурой кипения останется в перегонной колбе.Предположим, он содержит третье вещество, которое мы хотим отделить. Как бы вы это сделали?
Заменяем приемную колбу на чистую и снова нагреваем перегонную колбу, но на этот раз до температуры кипения второй жидкости. Вторая жидкость испарится, конденсируется в холодильнике и перетекает в чистую приемную колбу, оставляя последний компонент смеси в перегонной колбе.
Сырая нефть разделяется на различные компоненты с помощью дистилляции.Компоненты испаряются, начиная с более легкого топлива (которое имеет самую низкую точку кипения), затем реактивного топлива, затем нефти, затем автомобильного масла, пока не останется только смола. Мы называем разделенные компоненты фракциями, а процесс — фракционной перегонкой.
Узнайте больше о перегонке сырой нефти в этом видео
Видео о перегонке сырой нефти может быть слишком продвинутым, но в нем достаточно хорошо резюмируется процесс фракционной перегонки и упоминаются актуальные, реальные примеры производимых продуктов.Обратите внимание, что в видео неоднократно упоминаются «углеводороды». Вы можете успокоить учащихся и сказать им, что им пока не важно знать, что это означает. Периодическая таблица рассматривается только в главе 4, но вы можете помочь учащимся «расшифровать», что сырая нефть содержит много частиц водорода и частиц углерода , соединенных вместе в различных комбинациях (соотношениях). Каждая из фракций, которые в конечном итоге собираются, содержит одну комбинацию углеводородов.
Нам предстоит изучить еще один метод разделения. Вы замечали, как чернила на бумаге иногда «потекут», когда она намокнет?
Вы видите, как потекли чернила на этом знаке после намокания, вероятно, из-за дождя? http://www.flickr.com/photos/daquellamanera/4304246279/Большинство красок представляют собой смесь различных пигментов, смешанных для придания им нужного цвета. Пигмент — это химическое вещество, придающее цвет материалам. Когда смесь содержит цветные соединения, часто можно разделить различные компоненты с помощью метода разделения, называемого хроматографией.Давайте посмотрим на это дальше.
Хроматография
Хроматография происходит от греческих слов chroma (что означает «цвет») и graph (что означает «писать»).
Хроматография — это метод разделения окрашенных веществ на отдельные пигменты. Мы собираемся изучить это в следующем расследовании.
Ручка для науки о цвете.
AIM: Для разделения пигментных компонентов в чернилах с использованием различных жидкостей.
Это веселое занятие, которое можно выполнить быстро. Если класс разделен на небольшие группы, и каждая группа получает свой черный маркер для экспериментов, хроматограммы могут быть впоследствии повешены на стену, чтобы все могли увидеть и сравнить. Путем поиска совпадающих хроматограмм учащиеся могут сказать, в какой группе был маркер одной марки или какие маркеры были заполнены одинаковыми чернилами. Если чернила от определенного маркера не разделяются в одной жидкости, попробуйте использовать другую жидкость в химическом стакане.
Вы можете даже построить историю вокруг расследования: инсценировать тайну убийства, в которой убийца может быть идентифицирован его (или ее) черной ручкой. Используйте три или четыре черных или синих ручки разных марок и создавайте уникальные хроматограммы, связанные с каждой маркой. Чернила могут выглядеть одинаково при использовании для письма, но они будут вести себя по-другому, когда они будут проанализированы с помощью хроматографии.
ГИПОТЕЗА:
Какой вы предлагаете ответ на наш следственный вопрос? Это ваша гипотеза.
Ответ, зависящий от учащегося. Гипотеза может быть такой: «Черные чернила состоят из пигментов разного цвета».
МАТЕРИАЛЫ И АППАРАТ:
- Впитывающая бумага, нарезанная на полоски примерно 3 см шириной и 12 см длиной
Лабораторная фильтровальная бумага Whatman No. 1 идеально подходит для хроматографии. Как вариант, вы можете использовать кофейные фильтры, акварельную бумагу или полоски бумажного полотенца. Даже обычная копировальная бумага работает, но медленнее и часто из-за этого цвета лучше разделяются.Для более мягкой бумаги вам могут потребоваться более длинные полоски бумаги и более высокие емкости, поскольку жидкость поднимается по бумаге намного быстрее.
- прозрачный стакан для питья или химический стакан
- черные ручки и маркеры в ассортименте
- водопроводная вода
- карандаш
- канцелярская скрепка или прищепка
- фильтровальная бумага
- капельница
- различных жидких растворителей (аммиак, хирургический спирт, метилированный спирт и жидкость для снятия лака)
Растворитель — это вещество, которое растворяет растворенное вещество с образованием раствора.Растворитель обычно представляет собой жидкость, но также может быть твердым или газообразным.
Возможные опасности:
- Аммиак — это растворенный газ и слабое основание. Маловероятно, что это вызовет ожоги, но пары аммиака могут раздражать слизистые оболочки носа.
- Хирургический спирт и метанол содержат спирт. Жидкость для снятия лака содержит ацетон. Спирт и ацетон легко воспламеняются, и их следует хранить вдали от источников тепла и огня. Не вдыхайте пары этих растворителей.
Безопасная лабораторная практика чрезвычайно важна. Найдите минутку, чтобы обсудить с учащимися риски, меры предосторожности и безопасность. Обсудите тот факт, что ученым часто приходится иметь дело с опасными веществами и / или оборудованием, чтобы проводить наблюдения.
При работе с аммиаком старайтесь работать в вытяжном шкафу или в хорошо вентилируемом помещении. Оставьте дверь и окна открытыми, чтобы пары не задерживались. Точно так же спиртосодержащие вещества следует использовать в хорошо проветриваемом помещении, но они также легковоспламеняемы, поэтому не используйте их в присутствии открытого огня.
Всегда рекомендуется носить латексные / нитриловые перчатки (можно купить в аптеке), чтобы предотвратить всасывание опасных веществ через кожу. Надевайте защитные очки, чтобы защитить глаза от вредных химикатов. Всегда держите под рукой чистую воду, чтобы промыть глаза или руки, если химические вещества разбрызгиваются или проливаются.
Тщательная лабораторная практика не только обеспечит вашу безопасность, но и станет хорошим примером для учащихся.
МЕТОД:
Для изготовления стрип-хроматограммы
- С помощью черной ручки или маркера нарисуйте линию на одном конце бумажной полоски на расстоянии 2 см от конца.
- Залейте в стакан водопроводную воду на глубину примерно 1 см.
- Оберните немаркированный конец бумажной полоски вокруг карандаша и закрепите скрепкой.
- Перед тем, как положить ее в стакан, отрегулируйте полоску бумаги так, чтобы линия с чернилами была примерно на 1 см над поверхностью жидкости, прижимая ее к внешней стороне стакана.
- Опустите полосу в стекло и положите карандаш на верхнюю часть стекла, как показано на схеме.Конец полоски должен быть в воде, но нарисованная линия должна быть над поверхностью воды.
Дайте жидкости впитаться в бумагу, поднимаясь по линии с чернилами.
- Когда мигрирующие пигменты приблизятся к верхней части полоски, возле скрепки, удалите полоску бумаги и дайте ей высохнуть на плоской непористой поверхности.
- Сделайте аналогичную стрип-хроматограмму для каждой из собранных черных ручек.
- Сравните хроматограммы.Они такие же или разные?
- Когда вы закончите сравнивать свою хроматограмму с хроматограммой остального класса, вы можете либо прикрепить свою хроматограмму в поле ниже, либо нарисовать ее изображение в этой области.
Вы также можете использовать прищепку, чтобы удерживать полоску на месте во время сушки.
Для получения круговой хроматограммы
- Положите большой круглый кусок фильтровальной бумаги на гладкую неабсорбирующую поверхность, например, на поверхность стола.
- С помощью одного из цветных перьев нарисуйте чернильное пятно от 0,5 до 1 см в центре диска.
- Положите бумажный диск на верхнюю часть стакана.
- Поместите каплю воды в центр чернильного пятна.
Добавляйте по капле воды примерно каждую минуту, чтобы хроматограмма растекалась по краям бумажного диска.
- Повторите эксперимент с одним из других растворителей (нашатырный спирт, спирт или жидкость для снятия лака).
НАБЛЮДЕНИЯ:
Две хроматограммы выглядят одинаково или по-разному? Если они выглядят по-разному, и вы использовали одну и ту же ручку, как вы думаете, почему?
Какие цветные пигменты вы наблюдали?
Нарисуйте изображения ваших хроматограмм в поле ниже.
ВЫВОД:
Что вы можете сделать о пигментах, входящих в состав черных чернил?
Учащимся следует учитывать, что черные чернила на самом деле состоят из ряда пигментов разного цвета.
Более подробно, как это работает:
В бумажной хроматографии жидкость проходит через бумажные волокна. Но почему пигменты в чернилах разделяются на полосы разного цвета?
Пигменты чернил уносятся жидкостью, но, поскольку это разные соединения, они уносятся вверх с разной скоростью.Это приводит к тому, что они появляются на хроматограмме в виде полос разного цвета.
Посмотрите на изображение хроматограммы ниже.
Пример стрип-хроматограммы http://commons.wikimedia.org/wiki/File:TLC_black_ink.jpgКакой цветной пигмент движется вверх по бумаге с максимальной скоростью? Почему ты так говоришь?
Желтый пигмент движется быстрее всего, потому что он прошел самое большое расстояние.
Какой цветной пигмент движется вверх по бумаге с наименьшей скоростью?
Зеленый пигмент движется медленнее всего, потому что он прошел самое короткое расстояние.
Почему разные пигменты переносятся с разной скоростью?
Пигменты перемещаются с разной скоростью из-за различий в их свойствах: крупные частицы пигмента имеют тенденцию двигаться медленнее. Кроме того, частицы, которые хорошо растворяются в жидкости, будут стремиться оставаться в жидкости и быстро переноситься наверх, тогда как частицы, которые хорошо связываются с бумагой, будут двигаться медленнее.
Черный действительно черный? (видео)
Теперь, когда мы узнали о некоторых различных способах разделения смесей, мы собираемся применить то, что мы знаем, для разделения смеси, состоящей из многих компонентов.
Некоторые школы также используют комбинированные тарелки для различных практических заданий по Материи и Материалам. Это приветствуется, и задания в этих рабочих тетрадях можно немного скорректировать для работы с любым оборудованием и приборами, доступными вам в вашей школе.
Кроме того, если учащиеся сочтут блок-схему слишком сложной на этом этапе, вы также можете попросить их записать шаги, которые они будут выполнять, чтобы разделить все материалы в смеси, и почему они выбрали каждый метод разделения.
Представьте, что вы являетесь членом группы ученых, работающих вместе в лаборатории. Вашей команде поручена важная работа. Вам дали стакан со смесью веществ для разделения.
Смесь содержит следующие компоненты:
- песок
- стружка
- соль
- этанол
- вода
Ваша задача — разработать процедуру разделения смеси на отдельные компоненты.Как бы Вы это сделали? Ваша процедура должна быть представлена в виде блок-схемы.
Перед тем, как начать, представьте, как будет выглядеть смесь. Нарисуйте изображение прозрачного контейнера и различного содержимого смеси в пространстве.
Это может быть трудной задачей для учащихся, но для учащихся очень важно иметь возможность визуализировать смесь, прежде чем они начнут планировать эксперимент. Если они этого не сделают, идеи останутся абстрактными, и учащиеся могут столкнуться с трудностями в правильной последовательности различных этапов разделения.Вы можете направить их, задав следующие вопросы. Кроме того, вы можете приготовить смесь, чтобы они посмотрели на нее, прежде чем рисовать:
- Как выглядит контейнер? Нарисуйте это на своей странице.
- Какие жидкости находятся в емкости? (Этанол и вода). Теперь нарисуйте емкость со смесью этанола и воды. Сможете ли вы увидеть этанол И воду, когда они будут смешаны? (Нет, они будут выглядеть как жидкость в контейнере.)
- Теперь добавьте песок.Смешается ли он с водой или опустится на дно? (Большая часть опустится на дно.)
- Теперь добавьте железные опилки. Смешается ли он с водой или опустится на дно? (Он опустится на дно.)
- Теперь добавьте соль. Соль опускается на дно или растворяется в воде? (Он растворился бы в воде.) Сможем ли мы увидеть его, если бы он растворился в воде? (№)
Чтобы помочь вам разработать процедуру, вот несколько наводящих вопросов и шаблон для вашей блок-схемы:
Какое физическое состояние (твердое, жидкое или газообразное) у каждого из компонентов смеси? Заполните их в таблице.
Компонент (вещество) | Состояние (твердое, жидкое или газообразное) | Растворенное или нерастворенное? |
Компонент (вещество) | Состояние (твердое, жидкое или газообразное) | Растворенное или нерастворенное? | |
Железо | твердое | нерастворенное | |
Песок | твердое | нерастворенное | нерастворенное растворенный |
Этанол | жидкий | растворенный (в растворе с водой и солью) | |
Вода | жидкость в растворе этанол и соль) |
Назовите твердые вещества, которые не растворяются в смеси.Это нерастворенные твердые вещества.
Песок и железная стружка не растворяются.
Назовите растворенные в смеси твердые вещества.
Соль — единственное растворенное твердое вещество.
Какой метод является наилучшим для отделения нерастворенных твердых частиц от жидкостей в смеси? Напишите название этого метода в блоке под номером 1 на блок-схеме ниже.
Учащиеся должны написать ФИЛЬТРАЦИЯ в блоке 1.
Напишите названия нерастворенных твердых веществ в блоке 2 блок-схемы.
Учащиеся должны записать ПЕСКУ и ЖЕЛЕЗА в блоке 2.
Что остается после удаления нерастворенных твердых частиц из смеси? Напишите названия этих соединений в блоке 3.
Учащиеся должны написать СОЛЬ, ЭТАНОЛ и ВОДА в блоке 3.
Как мы могли отделить нерастворенные твердые частицы? (Подсказка: посмотрите на блок-схему для некоторых идей.) Напишите название этого процесса в блоке 4.
Учащиеся должны написать МАГНИТНОЕ РАЗДЕЛЕНИЕ в блоке 4.
Напишите названия двух нерастворенных твердых веществ в блоках 6 и 7.
Учащиеся должны записать ЖЕЛЕЗНЫЕ ФАЙЛЫ в блоке 6 и ПЕСОК в блоке 7.
Как мы могли отделить жидкости от растворенного твердого вещества? Мы могли бы испарить их, но тогда они были бы потеряны. Какой еще вариант доступен, если мы хотим разделить компоненты в решении? Напишите название этого процесса в блоке 5.
Учащиеся должны написать ДИСТИЛЛЯЦИЯ в блоке 5.
Какую жидкость нужно перегонять в первую очередь? (Подсказка: какая жидкость имеет самую низкую точку кипения?) Напишите название этой жидкости в блоке 8.
Учащиеся должны написать ЭТАНОЛ в блоке 8.
Что остается в растворе после удаления первой жидкости? Напишите названия этих компонентов в блоке 9.
Учащиеся должны написать ВОДА и СОЛЬ в блоке 9.
Как отделить жидкость от растворенного твердого вещества? (Подсказка: этот процесс такой же, как и в блоке 7.) Напишите имя процесса в блоке 10.
Учащиеся должны написать ДИСТИЛЛЯЦИЯ в блоке 10.
Запишите названия двух последних компонентов в блоках 11 и 12.
Учащиеся должны написать ВОДА в блоке 11 и СОЛЬ в блоке 12.
Заполненная блок-схема должна выглядеть следующим образом:
До сих пор мы обсуждали материалы, их свойства, как их смешивать и как разделять, если они смешаны. В последнем разделе этой главы рассматриваются отходы и то, что мы можем сделать, чтобы уменьшить их воздействие на окружающую среду.
1:10 описывают эти экспериментальные методы разделения смесей: простая дистилляция, фракционная перегонка, фильтрация, кристаллизация, бумажная хроматография
перейти к содержанию- Темы
- Списки спецификаций
- Разделы спецификаций
- 1 Принципы химии
- (a) Состояния вещества
- (b) Элементы, соединения и смеси
- (c) Атомная структура
- (d) Периодическая таблица
- (e) Химические формулы, уравнения и расчеты
- (f) Ионная связь
- 1:37 понять, как образуются ионы в результате потери или усиления электронов
- 1:38 узнать заряды этих ионов: металлы в группах 1, 2 и 3, неметаллы в группах 5, 6 и 7, Ag⁺, Cu²⁺, Fe²⁺, Fe³⁺, Pb²⁺, Zn²⁺, водород (H⁺), гидроксид (OH⁻), аммоний (NH₄⁺), карбонат (CO₃²⁻), нитрат (NO₃⁻), сульфат (SO₄²⁻)
- 1:39 напишите формулы для соединений, образованных между ионами, перечисленными в 1:38
- 1:40 нарисуйте точечные диаграммы, чтобы показать образование ионных соединений путем переноса электрона, ограниченное комбинациями элементов из групп 1, 2, 3 и 5, 6, 7, необходимо показать только внешние электроны
- 1:41 un Понять ионную связь с точки зрения электростатического притяжения
- 1:42 понять, почему соединения с гигантской ионной решеткой имеют высокие точки плавления и кипения
- 1:43 Знайте, что ионные соединения не проводят электричество в твердом состоянии, но проводят электричество при расплавлении и в водный раствор
- (ж) Ковалентная связь
- 1:44 знайте, что ковалентная связь образуется между атомами путем совместного использования пары электронов
- 1:45 понимайте ковалентные связи с точки зрения электростатического притяжения
- 1: 46 понять, как использовать точечные и перекрестные диаграммы для представления ковалентных связей в: двухатомных молекулах, включая водород, кислород, азот, галогены и галогениды водорода, неорганических молекулах, включая воду, аммиак и диоксид углерода, органических молекулах, содержащих до двух атомов углерода , включая метан, этан, этен и те, которые содержат атомы галогена
- 1:47 объясняют, почему вещества с простой молекулярной структурой s — это газы или жидкости, или твердые вещества с низкими температурами плавления и кипения.Термин «межмолекулярные силы притяжения» может использоваться для обозначения всех сил между молекулами.
- 1:48. Объясняет, почему точки плавления и кипения веществ с простой молекулярной структурой увеличиваются, как правило, с увеличением относительной молекулярной массы.
- 1:49. вещества с гигантскими ковалентными структурами представляют собой твердые тела с высокими температурами плавления и кипения
- 1:50 объясняют, как структуры алмаза, графита и фуллерена C 60 влияют на их физические свойства, включая электропроводность и твердость.
- 1:51 знайте, что ковалентный соединения обычно не проводят электричество
- (h) Металлические связи
- (i) Электролиз
- 2 Неорганическая химия
- (a) Группа 1 (щелочные металлы) — литий, натрий и калий
- (b) Группа 7 (галогены) — хлор, бром и йод
- (c) Газы в атмосфере
- (d) Ряд реакционной способности
- 2:15 понять, как металлы могут быть расположены в ряду реактивности на основе их реакций с: водой и разбавленной соляной или серной кислотой
- 2:16 понять, как металлы могут быть расположены в ряду реактивности на основе их реакций замещения между: металлы и оксиды металлов, металлы и водные растворы солей металлов
- 2:17 знать порядок реакционной способности этих металлов: калий, натрий, литий, кальций, магний, алюминий, цинк, железо, медь, серебро, золото
- 2 : 18 знать условия, при которых ржавеет железо
- 2:19 понять, как можно предотвратить ржавление железа с помощью: барьерных методов, цинкования и протекторной защиты
- 2:20 с точки зрения увеличения или уменьшения кислорода и потери или увеличения электронов, поймите термины: окисление, восстановление, окислительно-восстановительный потенциал, окислитель, восстановитель, с точки зрения получения или потери кислорода и потери или усиления электронов
- 2:21 Практически: исследуйте реакции между ди лютная соляная и серная кислоты и металлы (например,г. магний, цинк и железо)
- (e) Добыча и использование металлов
- (f) Кислоты, щелочи и титрование
- (g) Кислоты, основания и солевые препараты
- 2:34 знать общие правила прогнозирования растворимость ионных соединений в воде: обычные соединения натрия, калия и аммония растворимы, все нитраты растворимы, обычные хлориды растворимы, кроме серебра и свинца (II), обычные сульфаты растворимы, кроме сульфатов бария, кальция и свинец (II), обычные карбонаты нерастворимы, за исключением натрия, калия и аммония, обычные гидроксиды нерастворимы, за исключением гидроксидов натрия, калия и кальция (гидроксид кальция слабо растворим)
- 2:35 понять кислоты и основания с точки зрения переноса протона
- 2:36 понимать, что кислота является донором протона, а основание — акцептором протона.
- 2:37 описывают реакции соляной кислоты, серной кислоты и азотной кислоты с металлами, основания и карбонаты металлов (исключая реакции между азотной кислотой и металлами) с образованием солей
- 2:38 известно, что оксиды металлов, гидроксиды металлов и аммиак могут действовать как основания, а щелочи — это основания, растворимые в воде
- 2: 39 описывают эксперимент по приготовлению чистого сухого образца растворимой соли, исходя из нерастворимого реагента
- 2:40 (только Triple) описывают эксперимент по приготовлению чистого сухого образца растворимой соли, исходя из кислоты и щелочь
- 2:41 (только Triple) описать эксперимент по приготовлению чистого сухого образца нерастворимой соли, исходя из двух растворимых реагентов
- 2:42 Практически: приготовить образец чистого сухого гидратированного сульфата меди (II) кристаллы из оксида меди (II)
- 2:43 (только тройной) Практически: приготовьте образец чистого сухого сульфата свинца (II)
- (h) Химические испытания
- 2: 44a описывают испытания для этих газов : водород, диоксид углерода 9009 6
- 2:44 описывают испытания для этих газов: водород, кислород, двуокись углерода, аммиак, хлор
- 2:45 описывают, как проводить испытание пламенем
- 2:46 знать цвета, образующиеся при испытаниях пламенем для этих катионов: Li⁺ красный, Na⁺ желтый, K⁺ сиреневый, Ca²⁺ оранжево-красный, Cu²⁺ сине-зеленый
- 2:47 описывают тесты на эти катионы: NH₄⁺ с использованием раствора гидроксида натрия и определение выделяющегося газа , Cu²⁺, Fe²⁺ и Fe³⁺ с использованием раствора гидроксида натрия
- 2:48 описывают тесты для этих анионов: Cl⁻, Br⁻ и I⁻ с использованием подкисленного раствора нитрата серебра, SO₄²⁻ с использованием подкисленного раствора хлорида бария, CO₃²⁻ с использованием соляной кислоты. кислоты и определения выделившегося газа
- 2:49 описывают тест на присутствие воды с использованием безводного сульфата меди (II)
- 2:50 описывают физический тест, чтобы показать, является ли образец воды чистой
- 3 Физическая химия
- 4 Органическая химия
- (a ) Введение
- (б) Сырая нефть
- 4:07 знать, что сырая нефть представляет собой смесь углеводородов
- 4:08 описать, как промышленный процесс фракционной перегонки разделяет сырую нефть на фракции
- 4:09 знать названия и использование основных фракций, полученных из сырой нефти: нефтеперерабатывающих газов, бензина, керосина, дизельного топлива, мазута и битума
- 4:10 знать тенденцию изменения цвета, температуры кипения и вязкости основных фракций
- 4:11 знать, что топливо — это вещество, которое при сгорании выделяет тепловую энергию
- 4:12 знать возможные продукты полного и неполного сгорания углеводородов с кислородом в воздухе
- 4:13 понять, почему окись углерода ядовита, с точки зрения ее воздействия о способности крови переносить кислород ссылки на гемоглобин не требуются
- 4:14 Знайте, что в двигателях автомобилей достигнутая температура достаточно высока, чтобы позволить азоту и кислороду из воздуха вступить в реакцию, f Создание оксидов азота
- 4:15 объясните, как сгорание некоторых примесей в углеводородном топливе приводит к образованию диоксида серы
- 4:16 понять, как диоксид серы и оксиды оксидов азота способствуют возникновению кислотных дождей
- 4:17 описать как длинноцепочечные алканы превращаются в алкены и алканы с более короткой цепью путем каталитического крекинга (с использованием диоксида кремния или оксида алюминия в качестве катализатора и температуры в диапазоне 600-700 ° C)
- 4:18 объясняет, почему крекинг необходим с точки зрения баланс спроса и предложения на различные фракции
- (в) Алканы
- 1 Принципы химии

 Способы разделения смесей» | Презентация к уроку по химии (8 класс) на тему:
Способы разделения смесей» | Презентация к уроку по химии (8 класс) на тему:
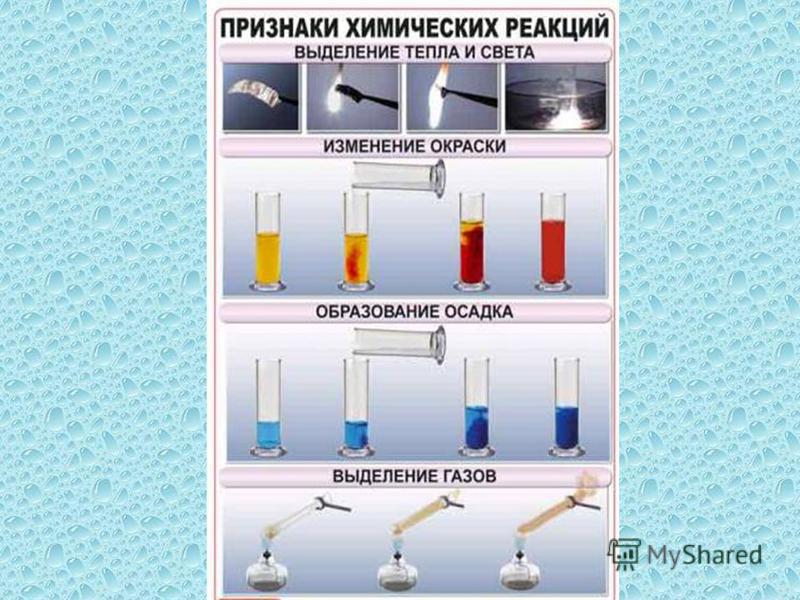 Когда мы читаем формулу H 2 O, нижний индекс «2» говорит нам, что существует два атома H. Поскольку у O нет нижнего индекса, это означает, что существует только один атом O.
Когда мы читаем формулу H 2 O, нижний индекс «2» говорит нам, что существует два атома H. Поскольку у O нет нижнего индекса, это означает, что существует только один атом O.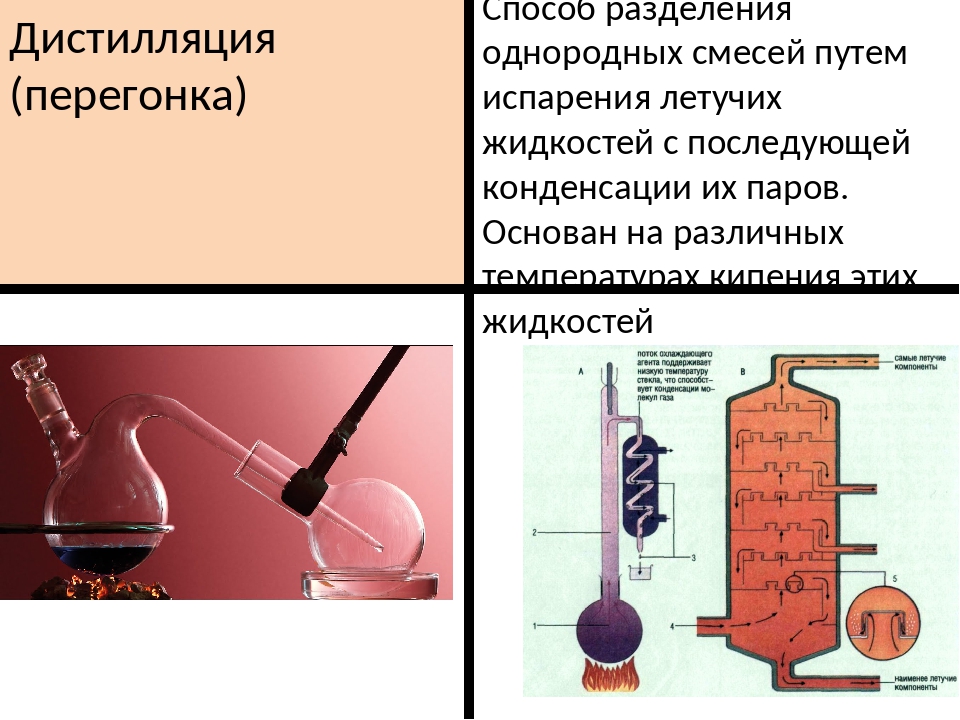 Посмотрите на предыдущие изображения, чтобы напомнить вам, как выглядит молекула воды. Вы можете использовать глину любого цвета для создания своей.
Посмотрите на предыдущие изображения, чтобы напомнить вам, как выглядит молекула воды. Вы можете использовать глину любого цвета для создания своей.
 Это называется анод . Затем отрицательно заряженные ионы хлорида в растворе притягиваются к положительному аноду.Ионы хлора отдают свои электроны и образуют газообразный хлор, который наблюдается в виде пузырьков.
Это называется анод . Затем отрицательно заряженные ионы хлорида в растворе притягиваются к положительному аноду.Ионы хлора отдают свои электроны и образуют газообразный хлор, который наблюдается в виде пузырьков.