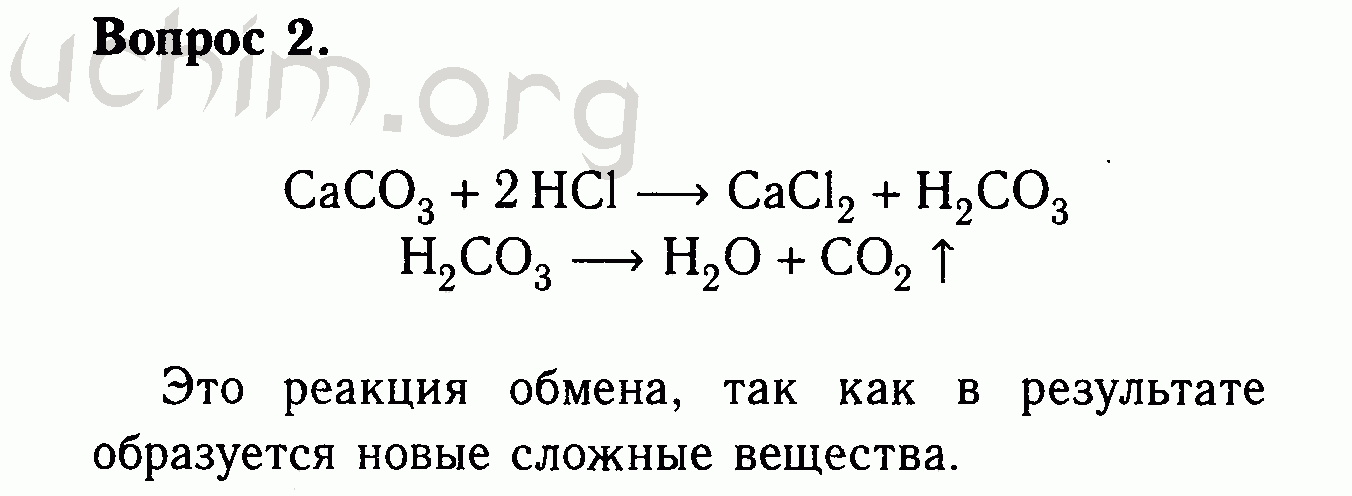Разработка урока по химии 8 класс. учебник О.С. Габриелян | План-конспект урока по химии (8 класс):
Тема урока: «Типы химических реакций: реакции замещения».
Форма проведения: урок-диалог
Тип урока: комбинированный.
Время проведения: урок №43 (рабочая программа курса химии 8 класса).
Место проведения: кабинет химии
Целевая аудитория: 8 класс
Цели урока:
Образовательные цели:
- обобщить и систематизировать знания учащихся о типах химических реакций: реакциях соединения и разложения; об условиях протекания химических реакций;
- закрепить умения учащихся по расстановке коэффициентов в уравнениях химических реакций;
- сформировать представления о реакциях замещения; о ряде активности металлов;
- продолжить формирование практических умений учащихся при работе с химическими веществами;
Развивающие цели:
- развивать у школьников умения выделять главное, сравнивать, анализировать учебный материал, обобщать, делать выводы;
- развивать логическое мышление; умение устанавливать причинно-следственные связи между понятиями и явлениями;
- развивать умения проводить самооценку;
- развивать творческие способности учащихся.

Воспитательные цели:
- прививать интерес к предмету;
- прививать навыки самостоятельной работы;
- формировать навыки работы в группе;
- воспитывать толерантность и дисциплинированность.
Здоровьесберегающие:
- воспитывать экологическую культуру у школьников: закрепить знания о влиянии кислот на здоровье человека;
- формировать навыки безопасного обращения с химическими веществами;
Задачи урока:
- закрепить знания учащихся о типах химических реакций;
- формировать у школьников компетентности, такие как:
-готовности к разрешению проблем и умения планирования результатов своей деятельности,
-коммуникативной компетентности,
Оборудование:
Химические реактивы: металлы – магний, цинк, железо, медь, соляная кислота, стальная скрепка, сульфат меди (II), пробирки в штативе.
Презентация «Типы химических реакций»
Ожидаемые результаты: самоанализ учащихся об уровне их подготовки по данной теме, развитие творческих способностей, формирование навыков работы в группе.
Продолжительность занятия: 45 минут.
Используемая литература:
- Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М.: Дрофа, 2009.
- Габриелян О.С. Учебник для общеобразовательных учреждений. Химия. 8 класс. М.: Дрофа, 2010г.
План урока и распределение времени на уроке
I. Организационный момент (1 мин.).
- Постановка целей и задач урока (1 мин.).
- Повторение изученного материала (15 мин.).
1. Фронтальный опрос: повторение химических понятий.
2. Индивидуальный опрос: работа учащихся у доски.
3. Выполнение учащимися самостоятельной работы с последующей
самопроверкой.
4. Физкультминутка для снятия напряжений с глаз и для снятия
статического напряжения с позвоночника.
IV. Изучение нового материала (20 мин.).
1. Сообщение темы урока. Постановка целей.
Сообщение темы урока. Постановка целей.
2. Формирование понятия «реакции замещения» (объяснение
с последующим диалогом).
3. Выполнение лабораторного опыта: взаимодействие металлов
с соляной кислотой (с последующим диалогом).
4. Формирование представления у учащихся о ряде активности
металлов (объяснение с последующим диалогом).
5. Выполнение лабораторного опыта: взаимодействие сульфата
Меди (II) и стальной скрепки (с последующим диалогом).
6. Демонстрационный опыт: взаимодействие меди с нитратом
серебра.
V. Подведение итогов урока. Рефлексия учащихся (2 мин.).
VI. Домашнее задание (1 мин.).
ХОД УРОКА
I. Организационный момент (1 мин.)
Учитель просит учащихся проверить готовность к уроку необходимых учебных принадлежностей.
II. Постановка целей и задач урока (1 мин.)
Учитель: основной целью нашего урока является знакомство с еще одним типом химических реакций – реакциями замещения.
Для того, чтобы понять, какие реакции в химии называются реакциями замещения, мы с вами сначала повторим учебный материал, который изучали на протяжении последних двух уроках, о реакциях соединения и разложения, повторим также правила расстановки коэффициентов, правила составления формул химических веществ.
III. Повторение изученного материала (15 мин.)
1. Фронтальный опрос: работа с химическими понятиями.
Учитель задает учащимся вопросы, за каждый правильный ответ ученик получает жетон, так легче учитывать количество правильных ответов, данных каждым учащимся.
Вопросы:
1. Какие явления называются физическими?
2. Какие явления называются химическими?
3. Что такое химическая реакция?
4. Что называют уравнением химической реакции?
5. На основании, какого закона составляют уравнение химической реакции?
6. На основании, какого закона составляют химическую формулу?
На основании, какого закона составляют химическую формулу?
7. Какие реакции называют экзотермическими?
8. Какие реакции называют эндотермическими?
9. Горение серы на воздухе – экзо- или эндотермическая реакция?
10. Какие реакции называются реакциями горения?
11. Какие реакции называются реакциями окисления?
12. Какие реакции называются реакциями соединения?
13. Какие реакции называются реакциями разложения?
2. Индивидуальный опрос учащихся у доски: презентация «Типы химических реакций», слайды № 3-4.
Учитель: проводит беседу по типам химических реакций: реакций соединения и реакций разложения, используя слайды 3-4. Учащиеся отвечают на вопросы и выполняют задания: продолжают уравнения химических реакций, расставляют коэффициенты и дают формулировку понятиям «реакции соединения», «реакции разложения».
3. Выполнение учащимися самостоятельной работы: слайд № 5 (выполняется в течение 3 минут — на слайде заложены часы, с помощью которых контролируется время). Учитель берет для проверки 2-4 тетради. Остальные учащиеся обмениваются тетрадями и проверяют выполнение задания друг у друга. Выставляют оценки в тетради карандашом.
Учитель берет для проверки 2-4 тетради. Остальные учащиеся обмениваются тетрадями и проверяют выполнение задания друг у друга. Выставляют оценки в тетради карандашом.
После этого учитель открывает на слайде №5 триггеры, и учащиеся могут проверить, правильно ли они выполнили задание.
Подводятся итоги. Ученикам, набравшим больше всех жетонов, выставляется оценка.
4. Физкультминутка «Отдохни с загадками» (упражнения для снятия напряжения глаз и для снятия статического напряжения с позвоночника).
IV. Изучение нового материала (20 мин.)
1. Сообщение темы урока. Постановка целей.
Учитель: тема нашего урока «Типы химических реакций: реакции замещения». Наша цель: познакомиться на практике с данным типом химических реакций, научиться прогнозировать и записывать формулы продуктов реакции, а также возможность их протекания.
Учащиеся записывают тему в тетрадь.
2. Формирование понятия «реакции замещения» (объяснение с последующим диалогом).
На экран проецируется слайд № 6.
Учитель: посмотрите внимательно на слайд, что происходит со словом «ДОМ», если в нем заместить первую букву «Д» на букву «С»?
Учащиеся высказывают свое мнение.
Учитель: правильно, образовалось новое слово «СОМ», а буква «Д» освободилась и готова для образования нового слова.
Учитель: Английский химик – лорд Г.Кавендиш провел очень интересный опыт .
Учитель: проводит демонстрационно опыт: если к цинку прилить соляной кислоты, то происходит бурная реакция, в ходе которой выделяется бесцветный газ – водород, способный сгорать с взрывом. Если выпарить капельку полученного раствора на предметном стекле, то увидим кристаллики соли.
Учитель: запишем уравнение химической реакции. Затем задает вопросы учащимся.
- Какие вещества принимают участие в данной химической реакции – простые или сложные?
- Какие вещества образуются в химической реакции – простые, сложные?
- Что же происходит с химическим элементом водородом в данной реакции?
- Сделайте вывод, какие реакции называются реакциями замещения?
- Учащиеся формулируют определение.

3. Выполнение учащимися лабораторного опыта: взаимодействие металлов с соляной кислотой (с последующим диалогом).
На экран проецируется слайд № 8.
Учащиеся выполняют лабораторный опыт.
Учитель: Какие признаки химических реакций вы наблюдаете: в пробирке №1? В пробирке №2? В пробирке №3?
Учащиеся: отвечают, что в пробирке №1 и №2 наблюдается выделение бесцветного газа – водорода, а в пробирке №3 – признаков химической реакции не наблюдается.
Учитель: обратили ли вы на скорость химической реакции в пробирке №1 и № 2?
Учащиеся: делают выводы, что скорость химической реакции в пробирке №1 больше, чем в пробирке №2.
4. Формирование представления у учащихся о ряде активности металлов (объяснение с последующим диалогом).
Учитель: русский ученый Н.Н.Бекетов, изучая взаимодействие металлов с кислотами, пришел к такому же выводу, как и вы. Он заметил, во-первых, что не все металлы реагируют с кислотами, во-вторых, скорость химических реакций зависит от активности металлов. Н.Н.Бекетов составил ряд активности металлов (электрохимический ряд напряжений металлов).
Н.Н.Бекетов составил ряд активности металлов (электрохимический ряд напряжений металлов).
На экран проецируется слайд № 9.
Учитель:
- Чем ближе металл расположен к левому краю ряда, тем он более активен.
- Активные металлы вытесняют ионы менее активных металлов из растворов солей;
- Металлы, расположенные до водорода в ряду активности металлов, реагируют и с кислотами, и с водой, вытесняя из них водород. Металлы, расположенные в данном ряду после водорода, с кислотами и с водой не реагируют, то есть не вытесняют из них водород.
Учитель: объясните, почему в пробирке №3, где находилась медь и соляная кислота, вы не наблюдали признаки химической реакции?
На экран проецируется слайд № 10.
Учитель: используя ряд активности металлов, продолжите возможные уравнения реакций замещения:
Mg + HCl =
Fe + HCl =
Cu + HCl =
Учащиеся дают объяснения, формулируют выводы. Записывают уравнения химических реакций.
5. Выполнение лабораторного опыта: взаимодействие сульфата меди (II) и стальной скрепки (с последующим диалогом).
На экран проецируется слайд №11 .
Учащиеся выполняют лабораторный опыт: взаимодействие сульфата меди (II) и стальной скрепки.
Учитель: данная реакция протекает с невысокой скоростью, необходимо немного подождать. Запишем пока уравнение реакции. Учащиеся записывают уравнение в тетрадь.
6. Демонстрационный опыт: взаимодействие меди с нитратом серебра.
Учитель показывает результат взаимодействия нитрата серебра с медной проволочкой (опыт проводится заранее).
Учащиеся объясняют, по каким признакам можно судить, что прошла реакция замещения.
Учитель: вернемся к реакции взаимодействия сульфата меди (II) и стальной скрепки.
- Как изменился цвет раствора?
- Какое вещество осаждается на стальной скрепке?
- Какая по типу протекает реакция?
На экран проецируется слайд №12.
Учитель: прочитайте определения и дайте ответ, какой тип химической реакции?
На экран проецируется слайд №13.
Учитель: решите проблему. В двух пробирках находятся металлы Al и Ag.
- Какую реакцию можно провести для распознавания данных металлов?
- К какому типу относится данная реакция?
Учащиеся отвечают на вопросы. Проводят мысленный эксперимент, решая проблему распознавания двух металлов.
V. Подведение итогов урока. Рефлексия учащихся (2 мин.).
Учитель: подведем итоги урока.
Учащиеся делают выводы о том, что нового они узнали на уроке.
Учитель: выставляет оценки.
VI. Домашнее задание (1 мин.).
Домашнее задание: параграф 31, стр. 164, №2 (письменно)
Химия 8 класс. Тесты, тренажеры, контрольные работы
Тесты и тренажеры по химииКонтрольные работы по химииУМК Габриелян — Павлова. Контр. и самост. работы по химии: 8 класс.
УМК Габриелян — Ястребова. Поурочные планы по химии 8кл.
К любому УМК — Добротин. Химия 8. Контрольные работы в новом формате (итоговая КР)
Химия 8 класс. Основные темыВведение
§ 1. Химия — часть естествознания
§ 2. Предмет химии. Вещества
§ 3. Превращения веществ. Роль химии в жизни человека
§ 4. Краткий очерк о истории развития химии
§ 5. Периодическая система химических элементов Д. И. Менделеева. Знаки химических элементов
§ 6. Химические формулы. Относительная атомная и молекулярная массы
Глава первая. Атомы химических элементов
§ 7. Основные сведения о строении атомов
§ 8. Изменения в составе ядер атомов химических элементов. Изотопы
§ 10. Изменение числа электронов на внешнем энергетическом уровне атомов химических элементов
§ 11. Взаимодействие атомов элементов-неметаллов между собой
§ 12. Ковалентная полярная химическая связь
§ 13. Металлическая химическая связь
Глава вторая. Простые вещества
Простые вещества
§ 14. Простые вещества — металлы
§ 15. Простые вещества — неметаллы
§ 16. Количество вещества
§ 17. Молярный объём газов
Глава третья. Соединения химических элементов
§ 18. Степень окисления
§ 19. Важнейшие классы бинарных соединений — оксиды и летучие водородные соединения
§ 20. Основания
§ 21. Кислоты
§ 22. Соли
§ 23. Кристаллические решётки
§ 24. Чистые вещества и смеси
§ 25. Массовая и объёмная доли компонентов смеси (раствора)
Глава четвёртая. Изменения, происходящие с веществами
§ 26. Физические явления в химии
§ 27. Химические реакции
§ 28. Химические уравнения
§ 29. Расчёты по химическим уравнениям
§ 30. Реакции разложения
§ 31. Реакции соединения
§ 32. Реакции замещения
§ 33. Реакция обмена
§ 34. Типы химических реакций на примере свойств воды
Глава пятая. Растворение. Растворы. Реакции ионного обмена
§ 35. Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде
§ 36. Электролитическая диссоциация
§ 37. Основные положения теории электролитической диссоциации
§ 38. Ионные уравнения
§ 39. Кислоты, их классификация и свойства
§ 40. Основания, их классификация и свойства
§ 41. Оксиды, их классификация и свойства
§ 42. Соли, их классификация и свойства
§ 43. Генетическая связь между классами веществ
§ 44. Окислительно-восстановительные реакции
Рекомендуемые материалы для очного контроля знаний
по предмету «Химия 8 класс»:
- Контрольно-измерительные материалы по химии 8 класс / Н.П.Троегубова, Е.Н.Стрельникова — М.:ВАКО, 2016
- Химия. 8 класс. Тетрадь для оценки качества знаний. Габриелян О.С., Купцова А.В. (2015, 112с.)
- Химия. 8 класс. Контрольные и проверочные работы. Габриелян О.С. и др. (2014, 224с.)
- Химия в тестах, задачах, упражнениях. 8 класс. Габриелян О.С., Смирнова Т.В., Сладков С.А. (2014, 224с.)
- Контрольные и самостоятельные работы по химии.
 8 класс: к учебнику Габриеляна О.С. — Павлова Н.С. (2015, 256с.)
8 класс: к учебнику Габриеляна О.С. — Павлова Н.С. (2015, 256с.) - Тесты по химии. 8 класс. Первоначальные химические понятия… К учебнику Рудзитиса Г.Е., … (2013, 144с.)
- Тесты по химии. 8 класс. Периодический закон и периодическая система… К учебнику Рудзитиса Г.Е., …(2013, 96с.)
- Химия 8 класс. Тесты. В 2 ч. Ким Е.П. (2011; 64с., 64с.)
- Химия 8 класс. Экспресс-диагностика. Расулова Г.Л. (2014, 112с.)
Перейти на Главную страницу сайта.
Опорные конспекты по химии (8 класс) – УчМет
МКОУ Тополинская СОШ
ОПРОНЫЕ КОНСПЕКТЫ
ПО ХИМИИ
8 КЛАСС
Составитель
Сумцова О.В.
Учитель информатики-химии
2011г.
Свойства → химические
Определяются с помощью специального оборудования
Физические → тепло- и электропроводность,
вязкость, t плавления,
кипения, замерзания
агрегатное
состояние запах плотность
цвет растворимость твердость
наблюдение устанавливаются экспериментально
Атом
– мельчайшая химически неделимая
частица вещества.
Молекула – мельчайшая частица вещества, состав и химические свойства которой, такие же, как у вещества.
Химический элемент — определенный вид атомов.
Химическая формула
(
Количественный состав (количество атомов)
Качественный состав (химические элементы)
условное обозначение)Символы
H2S O4
Индексы
(1 не пишется)
Обозначается индексами
(1 не пишется)
Обозначается символами (знаками) химических элементов
Алгоритм расчета Mr
(относительной молекулярной массы)
Определить Ar элементов по таблице Менделеева, округлить.

Умножить Ar на индексы.
Полученные значения сложить.
Пример.
1 32 16
Mr (H2 S O4) = 2•Ar(H) + 1•Ar(S) + 4•Ar(O) = 2•1 + 1•32 + 4•16 = 2 + 32 + 64 = 98 а.е.м.
Формулы расчета w (%)
(массовой доли элемента в веществе)
Ar(хэ) ∙ n (индекс)
ω%(хэ) = ∙ 100%
Mr(вещества)
(массовой доли элемента в образце)
m(хэ)
ω%(хэ) = ∙ 100%
m (вещества)
Валентность.
Металлов (М) Неметаллов (неМ)
Номеру группы Высшая Низшая
(максимальная) (минимальная)
номеру группы 8 – номер группы
Алгоритм составления
формулы по валентности
Над символами указать валентности.

Найти наименьшее общее кратное.
Наименьшее общее кратное разделить на показатели валентностей (получим индексы).
Полученные индексы записать около символов (индекс 1 не пишем).
: 6 :
Пример: III II
Al O
3
Алгоритм определения
валентности по химической формуле
Найти элемент с постоянной валентностью, указать ее.
Умножить индекс на валентность.
Полученное значение разделить на индекс другого элемента.
Указать валентность второго элемента.
4
Пример: IV
C1 O2X
Составление формул веществ
Химический знак металла всегда ставят на первое место.

На второе место ставят химический знак неметалла, проявляющего низшую валентность.
В соединении с металлами неметалл проявляет низшую валентность.
В соединении, состоящем из атомов двух неметаллов, элемент, располагающийся в таблице Менделеева правее или выше (ближе к фтору), проявляет низшую валентность, а если расположен левее или ниже – высшую.
Алгоритм вывода химической формулы вещества по массовым долям химических элементов.
А, В, С – химические элементы; х, y, z – индексы в формуле; АхByC z – химическая формула.
Дано: Решение
АхByCz 1) составляем соотношение массовых долей элементов в веществе
ω (A) x:y:z = ω(А):ω(В):ω(С)
ω(B) 2) разделить массовые доли на атомную массу
ω(C) соответствующего элемента
Найти: ω(А) ω(В) ω(С)
x, y, z x:y:z = : :
Ar(A) Ar(В) Ar(C)
4) в случае получения дробных чисел привести их к целым
5)
записать формулу вещества.
Химические реакции.
Реакцией разложения называется такая химическая реакция, в которой из одного сложного вещества получается два или несколько простых или сложных веществ.
Реакцией соединения называется такая реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно более сложное вещество.
Реакцией замещения называется реакция, протекающая между простым и сложным веществами, при которой атомы простого вещества замещают атомы одного из элементов в сложном веществе.
Алгоритм расстановки коэффициентов
в уравнении химической реакции
1. Подсчитать количество атомов каждого элемента в правой и левой части.
2. Определить, у какого элемента количество атомов меняется, найти наименьшее общее кратное.
3.
Разделить наименьшее общее кратное на
индексы – получить коэффициенты.
Поставить коэффициенты перед формулами.
4. Пересчитать количество атомов, при необходимости действия повторить.
5. Начинать уравнивать с атомов, находящихся в составе одного вещества.
Моль – это количество вещества, содержащее столько же частиц (атомов, молекул), сколько содержится атомов углерода в 0,012 кг (12г) углерода.
Молярная масса вещества – это масса одного моля вещества.
Вычисление массы и количества вещества.
М = m/ ν
m = M•ν
ν = m / М
M – молярная масса вещества, m – масса вещества, ν – количество вещества
Алгоритм решения задач по уравнениям химических реакций.
Если вещества даны с примесями, то сначала вычисляют массу чистого вещества.
Составляют уравнение химической реакции.
В уравнении одной чертой подчеркивают химические формулы веществ, массы которых указаны в условии задачи, а двумя чертами – формулы тех веществ, массы которых требуется вычислить.

По уравнению реакции определяют количества (моль) тех веществ, формулы которых подчеркнуты.
Найденные значения пишут под соответствующими химическими формулами и производят вычисления, используя пропорцию.
Кислород.
Физические свойства. Газ без цвета, без запаха, без вкуса.. tкип = — 183ºС. Tпл = — 219ºС. Малорастворим в воде. Тяжелее воздуха.
Молекула: О2
Ar(О) = 16
Mr(О2)= 32
Валентность II
Химические свойства:
Ме
простые МеО
вещества
О2 + неМе неМеО
сложные несколько оксидов по числу
вещества элементов в сложном веществе
Самый
распространенный элемент на Земле.
В воздухе по объему содержится 21%.
Вещества, которые ускоряют химические реакции, но сами при этом не расходуются, называют катализаторами.
Горение – это химическая реакция, при которой происходит окисление веществ с выделением теплоты и света.
Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород.
Водород.
Физические свойства. Газ без цвета, без запаха, без вкуса. Самый легкий, собирать его нужно, держа пробирку вверх дном. Имеет высокую теплопроводность. tкип = — 253ºС. tпл = — 259ºС. Малорастворим в воде. В 14,5 раз легче воздуха.
Молекула: Н2
Ar(H) = 1
Mr(H2)= 2
Валентность I
Химические свойства:
Ме
простые МеН (гидриды)
вещества
Н2 + неМе НнеМе (неметалл проявляет
низшую валентность)
сложные Ме + Н2О
вещества (оксиды)
Один
из наиболее распространенных элементов
на Земле.
Составляет примерно 0,88% от массы земного шара.
Входит в состав нефти, древесины, угля, природного газа, находится в органических соединениях, содержится в вулканических газах.
Водородные соединения элементов.
Гидриды Летучие водородные соединения
(соединения Ме с Н) (соединения неМе с Н)
Ме + Н2 неМе + Н2
СВОЙСТВА ВОДЫ.
Физические свойства.
Агрегатное состояние кристаллическое, жидкое, газообразное.
Без цвета, вкуса и запаха
tпл = 0ºС
tкип = 100ºС
ρж = 1 г/см3
ρ кр = 0,92 г/см3
С – удельная теплоемкость
Сж = 4200 кДж/кг•ºС
Скр= 2100 кДж/кг•ºС
Химические
свойства.
неМе
различные вещества
неМеО
ЭО кислотный оксид кислота НR
оксид МеО основание МеОН
Н2О + основной оксид
Ме до Al МеОН + Н2↑
Ме Ме от Be до Pb МеО + Н2↑
См.
ряд Ме после Н реакция не идет
актив —
ности
Ряд активности металлов
LI K Ba Sr Ca Na Mg Al Be Mn Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Au
ВОЗДУХ – СМЕСЬ
постоянные компоненты (содержание практически постоянно в любой порции сухого воздуха) | переменные компоненты (содержание меняется, но компоненты всегда присутствуют в воздухе) | случайные компоненты (компоненты могут отсутствовать |
О2 21% Фотосин-тез горе- ние, дыха- ние | N2 78% атмос-фера Земли в древ-ности вхо-дит в состав бел-ков | Инертные газы < 1% атмосфера Земли в древности исполь-зуются в народном хозяйстве | О3 гроза «ЩИТ» от УФ-лучей | СО2 горение, дыхание парниковый эффект | Н2О испаре-ние климат | SO2 химичес-кие заводы, топливо кислотные дожди | окси -ды азота двига-тели смог | CO непол- ное сгора- ние отрав-ление |
Изогнутые
стрелки характеризуют происхождение
и значение каждого компонента.
Mr(воздуха) = 29а.е.м. М(воздуха) = 29г/моль
Горение веществ в воздухе.
Схема составления уравнений реакций горения сложных веществ.
Записывают формулы исходных и образующихся веществ:
C6H6 + O2 → CO2 + H2O
Уравнивают число атомов элементов, входящих в состав сгоревшего вещества:
C6H6 + O2 → 6CO2 + 3H2O
Если в правой части уравнения получается нечетное число атомов кислорода, то все коэффициенты удваиваются, кроме коэффициента перед О:
2C6H6 + O2 → 12CO2 + 6H2O
В заключение подсчитывают число атомов кислорода в правой части уравнения и ставят коэффициент перед формулой О:
2C6H6 + 15O2 → 12CO2 + 6H2O
Этим
приемом расстановки коэффициентов
пользуются в тех случаях, если в реакции
участвуют газы, молекулы которых состоят
из двух атомов, например O2,
Cl2, H2.
Тепловой эффект химических реакций.
Реакции, протекающие с выделением теплоты, называют экзотермическими.
Реакции, протекающие с поглощением энергии, называют эндотермическими.
Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом реакции.
Химические уравнения, в которых указывается тепловой эффект, называют термохимическими.
Химические элементы
№ | Хими-чес-кий знак | Русское название | Латинское название | Произ –ношение | № | Хими-чес-кий знак | Русское назва-ние | Латин-ское назва-ние | Произ-ношение |
1 | H | водород | hydrogenium | аш | 3 | Li | литий | литий | litirum |
4 | Be | бериллий | berylium | берилий | 5 | B | бор | бор | borum |
6 | C | углерод | carboneum | цэ | 7 | N | азот | эн | nitrogenium |
8 | O | кислород | oxygenium | о | 9 | F | фтор | фтор | fluorum |
11 | Na | натрий | natrium | натрий | 12 | Mg | магний | магний | magnesium |
13 | Al | алюминий | aluminium | алюминий | 14 | Si | кремний | силициум | silicium |
15 | P | фосфор | phosphorus | п | 16 | S | сера | эс | sulfur |
17 | Cl | хлор | chlorum | хлор | 19 | K | калий | калий | kalium |
20 | Ca | кальций | calcium | кальций | 25 | Mn | марганец | марганец | manganum |
26 | Fe | железо | ferrum | феррум | 27 | Co | кобольт | кобольт | cobaltum |
29 | Cu | медь | cuprum | купрум | 30 | Zn | цинк | цинк | zincum |
35 | Br | бром | bromum | бром | 47 | Ag | серебро | аргентум | argentum |
50 | Sn | олово | stannum | олово | 51 | Sb | сурьма | сурьма | stibium |
53 | I | иод | iodum | иод | 55 | Cs | цезий | цезий | cesium |
56 | Ba | барий | barium | барий | 79 | Au | золото | аурум | aurum |
80 | Hg | ртуть | hydrargyrum | гидраргиум | 82 | Pb | свинец | плюмбум | plumbum |
Растворимость
кислот, оснований и солей в воде.
Сильные основания | Слабые основания | ||||||||||||||||||
катионы анионы | H+ | K+ | Ba2+ | Ca2+ | Na+ | NH4+ | Mg2+ | Al3+ | Mn2+ | Zn2+ | Cr3+ | Fe2+ | Fe3+ | Co2+ | Ni2+ | Pb2+ | Cu2+ | Hg2+ | Ag+ |
OH— | Р | Р | М | Р | Р | М | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | — | — | |
NO3— | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
SO42- | Р | Р | Н | М | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М | Р | Р | М |
I— | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | М | — | Н | Н |
Br* | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М | Р | М | Н |
Cl— | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | М | Р | Р | Н |
SO32- | Р | Р | М | М | Р | Р | М | — | Н | М | — | М | — | Н | Н | Н | — | — | М |
PO43- | Р | Р | Н | Н | Р | — | М | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
CH3 COO— | Р | Р | Р | Р | Р | Р | Р | М | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
CO32- | Р | Р | Н | Н | Р | Р | М | — | Н | Н | — | Н | — | Н | Н | Н | — | — | М |
S2- | Р | Р | — | Р | Р | Р | — | — | Н | Н | — | Н | Н | Н | Н | Н | Н | Н | Н |
SiO32- | Н | Р | Н | Н | Р | — | Н | — | — | Н | — | Н | — | — | — | Н | — | — | — |
Реакция раствора:
— | кислая | — | щелочная | — | нейтральная |
Растворы.
Растворами называют однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
При смешивании некоторых веществ (глины, керосина) с водой образуются не растворы, а мутные смеси, которые называют взвесями.
Взвеси, в которых мелкие частицы твердого вещества равномерно распределены между молекулами воды, называют суспензиями (глина с водой).
Взвеси, в которых мелкие капельки какой-либо жидкости равномерно распределены между молекулами другой жидкости, называют эмульсиями.
Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным, а раствор, в котором вещество еще может растворяться, — ненасыщенным.
Растворимость
(коэффициент растворимости) – максимально
возможное число граммов вещества,
которое может раствориться в 100г
растворителя при данной температуре.
Способы выражения количественного состава раствора.
массовая доля растворенного вещества
объемная доля растворенного вещества
молярная концентрация
Молярная концентрация, С, моль/л | Обозначение молярности | Название раствора |
0,1 | 0,1М | децимолярный |
0,01 | 0,01М | сантимолярный |
0,001 | 0,001М | миллимолярный |
4) расчет массы по плотности и объему
m = ρ • V
Оксиды.
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород.
Оксиды, которым соответствуют основания, называют основными.
Оксиды, которым соответствуют кислоты, называют кислотными.
Оксиды, которым соответствуют и основания, и кислоты, называют амфотерными оксидами.
Оксиды амфотерных элементов называют амфотерными.
Правила составления названия оксида.
“Оксид”
Название
оксида
Название элемента
в родительном падеже
(валентность элемента
римскими цифрами)
=
+
+
Физические
свойства оксидов.
Оксиды бывают твердые, жидкие и газообразные, различного цвета.
Получение и химические свойства оксидов.
Простое, сложное вещество + О2
II
ЭО
кислота + основный кислотный + основание
оксид + оксид
МеО неМеО или
МеО (валентность металла >4)
+ Н2О
+ Н2О
соль + Н2О основание соль кислота соль + Н2О
Основания.
Основания – это сложные вещества, состоящие из атомов металла и одной или нескольких гидроксогрупп. МеОН
“Гидроксид”
=
Название
основания
Название металла
в родительном падеже
+
Основания
Растворимые (щелочи) Нерастворимые
Химические свойства
соль = новое основание + новая соль
МеОН + кислотный оксид = соль +Н2О
кислота = соль + Н2О
t
МеОН (нерастворимое) = МеО + Н2О
Кислоты
Кислоты
– сложные химические вещества, состоящие
из одного или нескольких атомов водорода
и кислотного остатка.
Кислоты( HxR)
Минеральные Органические
Кислородсодержащие Безкислородные уксусная, лимонная,
H2O + неMеО H2 + неMе яблояная, щавелевая,
молочная, муравьиная
H2SO4, HNO3HCl, H2S, HF
H3PO4, H2SiO3HI, HBr
I I I II I I I III I II
HCl H2SO4 HNO3 H3PO4H2СO3
Химические свойства
Ме соль + H2
HxR + МеО соль + H2О
МеОН соль + H2О
соль более новая кислота и новая соль
слабой кислоты
При нагревании некоторые кислоты разлагаются на оксид и воду
Изменение
цвета индикаторов при действии растворов
кислот и щелочей.
индикатор | Цвет индикатора в среде | ||
кислой | щелочной | нейтральной | |
Лакмус | красный | синий | фиолетовый |
Фенолфталеин | бесцветный | малиновый | бесцветный |
Метиловый оранжевый | розовый | желтый | оранжевый |
Ряд кислот
(в соответствии с рядом кислот каждая предыдущая кислота может вытеснять из соли последующую)
HNO3
H2SO4 HCl H2SO3 H2СO3 H2S H2SiO3↓
H3PO4
Менее
летучие кислотные оксиды вытесняют
более летучие из их солей.
Названия важнейших кислот и солей
Формула кислоты | Названия | Формула кислоты | Названия | ||
Кислоты | Соли | Кислоты | Соли | ||
HAlO2 | Метаалюминиевая | Метаалюминат | HIO | Иодноватистая | Гипоиодит |
HAsO3 | Метамышьяковая | Метаарсенат | HIO3 | Иодноватая | Иодат |
H3AsO4 | Ортомышьяковая | Ортоарсенат | HIO4 | Иодная | Периодат |
HAsO2 | Метамышьяковистая | Метаарсенит | HMnO4 | Марганцовая | Перманганат |
H3AsO3 | Ортомышьковистая | Ортоарсенит | H2MnO4 | Марганцовистая | Манганат |
HBO2 | Матаборная | Метаборат | H2MoO4 | Молибденовая | Молибдат |
H3BO3 | Ортоборная | Ортоборат | HN3 | Азотисто-водородная | Азид |
H2B4O7 | Четырехборная | Тетраборат | HNO2 | Азотистая | Нитрит |
HBr | Бромоводородная | Бромид | HNO3 | Азотная | Нитрат |
HBrO | Бромноватистая | Гипобромит | H3PO2 | Фосфорноватистая | Гипофосфит |
HBrO3 | Бромноватая | Бромат | H3PO3 | Фосфористая | Фосфит |
HCOOH | Муравьиная | Формиат | HPO3 | Метафосфорная | Метафосфат |
CH3COOH | Уксусная | Ацетат | H3PO4 | Ортофосфорная | Ортофосфат |
HCN | Циановодородная | Цианид | H4P2O7 | Двуфосфорная (пирофосфорная) | Дифосфат (пирофосфат) |
H2CO3 | Угольная | Карбонат | H2S | Сероводородная | Сульфид |
H2C2O4 | Щавелевая | Оксолат | HSCN | Роданистоводородная | Роданид |
HCl | Хлороводородная | Хлорид | H2SO3 | Сернистая | Сульфит |
HClO | Хлорноватистая | Гипохлорит | H2SO4 | Серная | Сульфат |
HClO2 | Хлористая | Хлорит | H2Se | Селеноводородная | Селенид |
HClO3 | Хлорноватая | Хлорат | H2SeO3 | Селенистая | Селенит |
HClO4 | Хлорная | Перхлорат | H2SeO4 | Селеновая | Селенат |
HCrO2 | Метахромистая | Метахромит | H2SiO3 | Кремневая | Силикат |
H2CrO4 | Хромовая | Хромат | HVO3 | Ванадиевая | Ванадат |
H2Cr2O7 | Двухромовая | Дихромат | H2WO4 | Волфрамовая | Вольфрамат |
HI | Иодоводородная | Иодид | |||
Соли.
Соли – сложные вещества, состоящие из атомов металлов и кислотных остатков. (МеR), где R – кислотный остаток.
Название кислотного остатка
Название
соли
Название металла
в родительном падеже
=
+
Средние соли – это продукты полного замещения атомов водорода в молекуле кислоты на металл.
Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл.
Химические свойства.
Ме (более активный) = Ме + новая соль
МеR + кислота (более сильная) = новая соль и новая кислота
МеОН = новая соль и новое основание
Ме1R1 + Ме2R2 = новые соли (реакция обмена)
Как мы узнаем, что произошла химическая реакция? | Химические реакции
Обзор главы
1 неделя
Эта глава основывается на кратком введении в химические реакции, которое было рассмотрено в главе 1 (Атомы) Gr. 8 Материя и материалы, особенно параграф Чистые вещества. Важное послание этой главы состоит в том, что атомы перестраиваются во время химической реакции. Атомы не меняются, но то, как они расположены по отношению друг к другу, меняется.Это означает, что молекулы меняются, даже если количество атомов каждого типа, присутствующих в начале реакции, остается неизменным на всем протяжении. Чтобы помочь учащимся установить эту важную концептуальную связь, диаграммы частиц используются для представления некоторых реакций в этой главе. Учащимся также будет предоставлена возможность самостоятельно нарисовать такие диаграммы в упражнениях и ответить на вопросы этой главы.
8 Материя и материалы, особенно параграф Чистые вещества. Важное послание этой главы состоит в том, что атомы перестраиваются во время химической реакции. Атомы не меняются, но то, как они расположены по отношению друг к другу, меняется.Это означает, что молекулы меняются, даже если количество атомов каждого типа, присутствующих в начале реакции, остается неизменным на всем протяжении. Чтобы помочь учащимся установить эту важную концептуальную связь, диаграммы частиц используются для представления некоторых реакций в этой главе. Учащимся также будет предоставлена возможность самостоятельно нарисовать такие диаграммы в упражнениях и ответить на вопросы этой главы.
Упражнение «Можем ли мы использовать химическую реакцию, чтобы заглянуть внутрь яйца?» Занимает несколько дней.Предлагается начать с него на первом уроке этой главы. Это поможет показать учащимся, что химические изменения обычно наблюдаются в макроскопическом масштабе и что макроскопические наблюдения свидетельствуют об активности на уровне частиц.
Также неплохо подготовить известковую воду, необходимую для исследования «Можно ли использовать чистую известковую воду для обнаружения углекислого газа?», Прежде чем вы начнете эту главу. Чтобы сделать чистую известковую воду, следуйте инструкциям ниже:
Инструкции по приготовлению чистой известковой воды
Поместите несколько столовых ложек гидроксида кальция Ca (OH) 2 в прозрачную бутылку с реагентом на 500 мл и залейте водой.Встряхните или размешайте, чтобы получилась мутная суспензия.
Оставьте суспензию на несколько дней. Прозрачная жидкость над твердым Ca (OH) 2 представляет собой насыщенный раствор Ca (OH) 2 , также известный как чистая известковая вода.
Осторожно декантируйте столько, сколько вам нужно, не взбалтывая твердый осадок Ca (OH) 2 на дне.

Чтобы приготовить еще, просто добавьте еще воды, встряхните и дайте снова отстояться.Когда осадок полностью растворится, просто добавьте еще твердого Ca (OH) 2 .
3.1 Как мы узнаем, что произошла химическая реакция? (1,5 часа)
Задачи | Навыки | Рекомендация |
Деятельность: Разница между физическими и химическими изменениями | Доступ и вызов информации, сортировка и классификация, | Предлагается |
Задание: Можно ли с помощью химической реакции заглянуть внутрь яйца? | Наблюдение, запись информации, рисование и маркировка, интерпретация | CAPS рекомендуется |
3. 2 Реагенты и продукты (1,5 часа)
2 Реагенты и продукты (1,5 часа)
Задачи | Навыки | Рекомендация |
Упражнение: Анализ эксперимента с яичной скорлупой | Интерпретация, объяснение химической реакции | CAPS Рекомендуется |
Деятельность: Изучение реакции ферментации | Доступ и вызов информации, интерпретация | Дополнительно |
Активность: Некоторые химические реакции в жизни и в жизни | Подкрепление, отзыв информации | CAPS рекомендуется |
Деятельность: Карьера в химии | Доступ к информации и ее вызов, исследование, чтение и письмо, общение | Дополнительно |
В предыдущей главе мы рассмотрели модель частиц материи и, в частности, изменения состояния. Вы помните, как нагревали и охлаждали воск свечи, чтобы наблюдать, как он тает, а затем застывает. Воск сначала превратился из твердого вещества в жидкость, а затем снова в твердое состояние. Это физических изменений . Химические свойства вещества не меняются.
Вы помните, как нагревали и охлаждали воск свечи, чтобы наблюдать, как он тает, а затем застывает. Воск сначала превратился из твердого вещества в жидкость, а затем снова в твердое состояние. Это физических изменений . Химические свойства вещества не меняются.
Теперь мы посмотрим, что происходит, когда мы получаем химических изменений в веществах. Они происходят во время химических реакций.
Как мы узнаем, что произошла химическая реакция?
- химическая реакция Реакционная колба
- или реакционная емкость
Во время химической реакции одно или несколько веществ превращаются в новые.Вы знаете какие-нибудь химические реакции? Вы можете привести один или два примера?
Учащиеся могут помнить, что ржавление железа — это химическая реакция, или они могут привести в качестве примеров некоторые реакции из главы 1. Учащиеся также могут ссылаться на «изменение состояния» как на реакцию. Однако это НЕ химическая реакция или изменение. Объясните учащимся, что это всего лишь физическое изменение, а не химическое изменение.
Учащиеся также могут ссылаться на «изменение состояния» как на реакцию. Однако это НЕ химическая реакция или изменение. Объясните учащимся, что это всего лишь физическое изменение, а не химическое изменение.
Как мы узнаем, что происходит химическая реакция? Какие признаки?
Предложите учащимся обсудить это в небольших группах в течение нескольких минут.Составьте список на доске всех их предложений, который может включать:
- Смесь может измениться и выглядеть иначе. (Каким образом? Может произойти изменение цвета и образование пузырьков или «кристаллов».)
- Возможен взрыв.
- Смесь может изменять температуру, нагреваясь или остывая. Это НЕ следует путать с физическими изменениями во время нагревания и охлаждения, например, когда вещество плавится или затвердевает.
Мы можем определить, произошла ли химическая реакция, когда произойдет одно или несколько из следующих событий:
В большинстве практических руководств по вводной химии перечисляются только три визуальные подсказки, указанные выше, как признаки того, что реакция имела место. Тем не менее, приведенные ниже невизуальные знаки также заслуживают внимания.
Тем не менее, приведенные ниже невизуальные знаки также заслуживают внимания.
Все вышеперечисленные знаки являются визуальными или фиксируются визуально.Значит, мы их видим. Другие наши органы чувств также могут помочь нам определить, произошла ли химическая реакция:
- Иногда можно почувствовать запах химических изменений, например, когда образуется новый материал с сильным запахом.
- Могут ощущаться другие химические изменения, например, когда в результате реакции выделяется тепло.
- Слышны некоторые химические изменения, например когда происходит взрыв.
Видео о физических и химических изменениях.
Это короткое задание, чтобы убедиться, что учащиеся понимают разницу между химическими и физическими изменениями, и использует примеры из повседневной жизни.
ИНСТРУКЦИЯ:
Ниже представлена таблица, в которой перечислены некоторые химические и физические изменения.
Вам нужно решить, является ли изменение физическим или химическим, и записать ответ в последний столбец.
Изменение | Это физическое или химическое изменение? |
Нарезка картофеля кубиками | |
Кипяток в кастрюле на плите | |
Яичница на сковороде | |
Яичные белки для взбивания | |
Растворение сахара в воде | |
Горящий газ в газовой плите | |
Ваше мороженое тает на солнце | |
Молоко скисает | |
Ворота железные наружные ржавчины |
Вот ответы. Учащимся нужно только указать физический или химический состав — некоторые объяснения были предоставлены в качестве основы для учителя и, если вы хотите, объяснить изменения своим учащимся.
Учащимся нужно только указать физический или химический состав — некоторые объяснения были предоставлены в качестве основы для учителя и, если вы хотите, объяснить изменения своим учащимся.
Изменение | Это физическое или химическое изменение? |
Нарезка картофеля кубиками | Физический |
Кипяток в кастрюле на плите | Физический |
Яичница на сковороде | Химический (яичные белки подвергаются химическому изменению и сшиваются, образуя сеть) |
Яичные белки для взбивания | Физический (воздух нагнетается в жидкость, но новое вещество не образуется) |
Растворение сахара в воде | Физический (зерна сахара диспергированы в воде, но отдельные молекулы сахара не изменяются) |
Горящий газ в газовой плите | Химическая (форма водяного пара и углекислого газа) |
Ваше мороженое тает на солнце | Физический |
Молоко скисает | Химическая (производится молочная кислота) |
Ворота железные наружные ржавчины | Химический (формы оксида железа — более подробно об этом пойдет речь в Гр. |
Теперь мы применим наш контрольный список на практике, посмотрев на реакцию, достаточно безопасную, чтобы попробовать дома. Вы когда-нибудь задумывались, как будет выглядеть сырое яйцо без скорлупы? Мы собираемся использовать химическую реакцию, чтобы удалить скорлупу с яйца, не разбивая его!
Как сделать так, чтобы яйцо выглядело так? http: // www.flickr.com/photos/gemsling/2687069763/ Начните это упражнение как можно скорее, потому что для полного растворения яичной скорлупы требуется несколько дней. Возможно, стоит провести реакцию в двух экземплярах на случай, если с экспериментом что-то пойдет не так. Яйцо без скорлупы очень нежное и может разбиться, и тогда было бы неплохо иметь «запасное» яйцо.
Видео об эксперименте с голым яйцом
МАТЕРИАЛЫ:
- яйца
- стакан
- белый уксус
ИНСТРУКЦИЯ:
Осторожно поместите яйцо в стакан.Будьте осторожны, чтобы не треснуть скорлупу.
Залейте яйцо уксусом. Подождите несколько минут. Вы видите что-нибудь, что происходит на поверхности яичной скорлупы?
- Напишите свои наблюдения ниже.
- О чем свидетельствует это наблюдение?
- Яичная скорлупа постепенно покрывается пузырями.

Пузырьки — признак происходящей химической реакции.
Оставьте яйцо в уксусе на 4-5 дней. После этого вы должны завершить оставшуюся часть упражнения.
Примечание: Может потребоваться долить уксус, если реакция начинает замедляться.Не забудьте вернуться к занятиям в конце недели, когда яичная скорлупа полностью растворится.
Через 4–5 дней посмотрите на яйцо в уксусе и запишите свои наблюдения. На уксусе плывет пенистый коричневый слой.
Осторожно выньте яйцо из уксуса большой ложкой.Коснитесь поверхности яйца. Напишите свои наблюдения ниже. Что случилось с оболочкой?
Яйцо на ощупь мягкое и шаткое. Оболочка исчезла, потому что она растворилась. На его месте порошковое покрытие.
Сотрите с яйца порошкообразный налет и поместите его в чистую воду.Как это выглядит сейчас?Яйцо потеряло скорлупу, и мы видим внутри яичный белок и желток.
Нарисуйте и обозначьте изображения того, как выглядело содержимое стакана до и после реакции.
Учащиеся должны нарисовать изображения эксперимента в начале и в конце.На первой картинке должно быть изображено целое яйцо в стакане, залитое прозрачным жидким уксусом. На втором изображении должно быть показано прозрачное яйцо с четко обозначенными белками и желтком, погруженное в прозрачный жидкий уксус с плавающим сверху коричневым слоем.
ВОПРОСЫ:
Какие признаки вы видели, говорящие о том, что произошла химическая реакция? Яйцо выглядит иначе.Мы также видели пузыри на яичной скорлупе, а затем на уксусе плавал пенистый, липкий слой.
Абзац учащегося должен содержать как минимум следующие идеи:
- Яичная скорлупа прореагировала с уксусом и была «съедена».
- Яичная скорлупа растворяется в уксусе.
- Материал яичной скорлупы претерпел химические изменения. Их заменили на другие материалы.
Кости, зубы и жемчуг растворятся в уксусе, как и яичная скорлупа, хотя это может занять гораздо больше времени.
Как можно превратить одно соединение в другое? Что происходит с частицами, когда соединения вступают в реакцию? В следующем разделе мы ответим на эти вопросы.
Реактивы и продукты
- реагент
- товар
- химическое уравнение
- коэффициенты
- ферментация
В главе 1 мы узнали, что соединения образуются в результате химических реакций.Вы можете вспомнить, что такое соединение? Напишите здесь определение.
Соединение — это материал, состоящий из атомов двух или более элементов, которые химически связаны друг с другом в фиксированном соотношении. Поощряйте своих учеников записывать это на полях своей рабочей тетради.
Запишите формулы трех различных соединений.
Ответ, зависящий от учащегося.H 2 O, CO 2 , NaCl и т. Д.
Д.
При активности яичной скорлупы карбонат кальция в яичной скорлупе вступил в реакцию с уксусной кислотой и образовал ацетат кальция, диоксид углерода и воду.
Мы можем записать это химическое уравнение следующим образом:
яичная скорлупа + уксус → ацетат кальция + углекислый газ + вода
ВОПРОСЫ:
Есть два исходных вещества перед , эта химическая реакция имеет место.Кто они такие?
Яичная скорлупа (карбонат кальция) и уксус (уксусная кислота).
Присутствуют три вещества после реакции. Что это?
Что это?
Это ацетат кальция, диоксид углерода и вода.
Каковы химические формулы соединений воды и углекислого газа?Вода — это H 2 O, а диоксид углерода — это CO 2 .
Мы называем вещества, которые присутствуют до того, как произошла химическая реакция, реагентами .Каковы реагенты эксперимента с яичной скорлупой?
Яичная скорлупа (карбонат кальция) и уксус (уксусная кислота).
Используйте это, чтобы оценить понимание учащимся на данный момент.Они должны упомянуть, что реагенты используются для производства продуктов.
Мы называем вещества, которые образуются в ходе химической реакции, продуктами . Каковы результаты эксперимента с яичной скорлупой?
Это ацетат кальция, диоксид углерода и вода.
Во время химической реакции реагенты используются для производства продуктов. Атомы в реагентах были перегруппированы в новые соединения (продукты).
Атомы в реагентах были перегруппированы в новые соединения (продукты).
Химическая реакция — это перегруппировка атомов
Попросите ваших учеников проделать эти реакции сами на своих партах перед ними, используя бусинки / горох / чечевицу / шарики, и перегруппируйте атомы, чтобы получить продукты.
Чтобы преобразовать соединение в другое соединение, нам нужно изменить способ расположения атомов в соединении. Именно это и есть химическая реакция: перегруппировка атомов с целью превращения одного или нескольких соединений в новые соединения.
Каждый раз, когда атомы отделяются друг от друга и рекомбинируют в различные комбинации атомов, мы говорим, что произошла химическая реакция.
Мы собираемся использовать цветные кружки для обозначения атомов в соединениях, которые происходят в химических реакциях. Если у вас остались прежние бусинки или пластилин, вы также можете сами провести эти реакции на своем столе. Взгляните на следующую диаграмму.
Если у вас остались прежние бусинки или пластилин, вы также можете сами провести эти реакции на своем столе. Взгляните на следующую диаграмму.
Углерод и кислород слева от стрелки реагируют с образованием углекислого газа справа от стрелки.
Слева от стрелки у нас есть ситуация «до». Эта сторона представляет вещества, которые у нас есть до реакции. Их называют реагентами .
Справа от стрелки — ситуация «после». Эта сторона представляет собой вещества, которые у нас есть после того, как реакция произошла. Они называются продуктами .
РЕАКТИВЫ (до реакции) → ПРОДУКТЫ (после реакции)
Вы видите, как перегруппировались атомы? Это означает, что произошла химическая реакция. Обозначьте диаграмму «реагентами» и «продуктом».
Реакция между углеродом и кислородом происходит, когда мы сжигаем уголь. Уголь — это углерод, и когда он горит в кислороде, образуется углекислый газ.
Уголь — это углерод, и когда он горит в кислороде, образуется углекислый газ.
На схеме ниже представлена другая химическая реакция. Кислород (красные молекулы) реагирует с водородом (белая молекула) с образованием воды.
Какие реагенты в этой реакции?
Какой продукт в этой реакции?
Как вы думаете, почему водород и кислород представлены как два соединенных атома?
Это ссылка на то, что учащиеся рассмотрели в главе 1 о двухатомных молекулах.Эти элементы существуют в виде двухатомных молекул, поэтому в них два атома соединены вместе.
Вы помните, как мы говорили о химических связях между атомами в молекуле в главе 1? Химическая связь — это сила, удерживающая атомы вместе. Следовательно, во время химической реакции связи между атомами должны разорваться, чтобы атомы могли перегруппироваться с образованием продуктов. Между атомами продукта образуются новые связи.
Следовательно, во время химической реакции связи между атомами должны разорваться, чтобы атомы могли перегруппироваться с образованием продуктов. Между атомами продукта образуются новые связи.
Далее мы рассмотрим химическую реакцию, которая использовалась человечеством на протяжении веков.
Ферментация — это химическая реакция
Вы когда-нибудь забывали немного молока или сока в бутылке, чтобы обнаружить, что через несколько дней они «исчезли»? Если вы случайно его попробовали, он мог быть кислым, а в случае сока — немного шипучим. Ваши чувства могли предупредить вас, чтобы вы больше не пили его. Вы помните, как учились на гр. 7 что наше чувство вкуса защищает нас от испорченной пищи?
Кислый вкус молока или сока вызван продуктами брожения .Какие соединения имеют кислый вкус?
Ферментация приводит не только к образованию нежелательных продуктов. Йогурт, пахта и сыр — это кисломолочные продукты. В этих примерах в процессе ферментации образуются кислоты, которые придают этим продуктам кислый вкус.
Йогурт, пахта и сыр — это кисломолочные продукты. В этих примерах в процессе ферментации образуются кислоты, которые придают этим продуктам кислый вкус.
Ферментация — это также процесс, с помощью которого для производства алкоголя можно использовать различные фрукты, овощи и злаки.Во многих культурах приготовление алкогольных напитков является частью их местных знаний.
Два ведра имбирного пива для брожения. http://www.flickr.com/photos/nikonvscanon/4231775258/Как происходит брожение
Видео о том, как работает ферментация (5:39), короткое и веселое. Первые две минуты дают краткое описание. В оставшейся части видео ведущий демонстрирует, как самому приготовить имбирное пиво.
Базовую реакцию в процессе ферментации можно резюмировать следующим образом:
глюкоза → спирт + углекислый газ
Какие реагенты и продукты в этой реакции?
Глюкоза — реагент, спирт и диоксид углерода — продукты.
Мы можем изобразить молекулы, чтобы показать, как атомы перестраиваются во время реакции:
На приведенной выше диаграмме серые атомы представляют собой углерод (C), красные атомы — кислород (O), а маленькие белые — водород (H). Запишите названия соединений, участвующих в этой реакции.
Учащиеся должны написать слева глюкоза, а справа — алкоголь, а затем углекислый газ.
Сама по себе глюкоза не превращается в спирт и углекислый газ! Микроорганизмы, такие как дрожжи и бактерии, активно сбраживают глюкозу.
Дрожжи производят специальные химические вещества, называемые ферментами, которые могут разрушать связи в сахарах, таких как глюкоза, с образованием более мелких молекул, таких как спирт и углекислый газ.
Учащиеся впервые столкнулись бы с бактериями в Gr.7 Life and Living при изучении биоразнообразия и классификации организмов. Более подробно они рассмотрят микроорганизмы в гр. 9 Жизнь и жизнь.
В Южной Африке популярным напитком является имбирное или ананасовое пиво! Шипучие пузырьки в имбирном или ананасовом пиве — это пузырьки углекислого газа, вырабатываемые дрожжами во время брожения. Сделаем имбирное пиво!
Это дополнительное мероприятие, которое можно выполнять, если у вас есть время в классе.Это также может быть выполнено как проект . В следующем семестре мы снова рассмотрим ферментацию в «Материи и материалах». В процессе ферментации глюкоза не полностью расщепляется, поэтому она выделяет меньше энергии (в форме АТФ), чем при дыхании. Ферментация также является анаэробной, что означает, что она не требует кислорода, тогда как для дыхания требуется кислород. Спирт образуется при брожении. Однако имбирное пиво является безалкогольным . Хотя его называют пивом, оно не является алкогольным, потому что не ферментируется достаточно долго.
Спирт образуется при брожении. Однако имбирное пиво является безалкогольным . Хотя его называют пивом, оно не является алкогольным, потому что не ферментируется достаточно долго.
ИНСТРУКЦИЯ:
- Вам нужно исследовать, как приготовить традиционное южноафриканское имбирное пиво.
- Определите, какие ингредиенты вам понадобятся.
- Как только вы это сделаете, вы можете всем классом выбрать лучший рецепт, который вы будете использовать. Затем вы можете варить имбирное пиво в классе со своим учителем.
- Ответьте на следующие вопросы.
Здесь представлен рецепт имбирного пива. Учащийся также должен изучить свой собственный рецепт в группах и написать лучший рецепт, который у них есть. Затем вы можете либо выбрать один из их рецептов, либо использовать этот, либо вы можете протестировать разные рецепты, чтобы увидеть, какой из них работает лучше всего.
Пошаговое руководство по приготовлению имбирного пива. http://whatsforsupper-juno.blogspot.com/2007/06/old-fashioned-home-made-ginger-beer.html
МАТЕРИАЛЫ:
- 6-8 лимонов среднего размера
- цедра 2 лимонов тертая
- 250 мл (1 стакан) свежевыжатого лимонного сока (примерно из 6 лимонов)
- 2 кусочка свежего имбиря размером с большой палец
- 2 чайные ложки сухого порошка имбиря
- 6 изюмов
- 750 мл (3 стакана) белого сахара
- 5 литров воды
- 1 пакетик по 10 г быстрорастворимых (активных сухих) дрожжей
- терка
- соковыжималка для лимона
- контейнер или ведро
- ложка деревянная
- большая бутылка
- несколько бутылок меньшего размера с крышками
- воздушные шары
- резинки
ИНСТРУКЦИЯ:
- Натереть цедру 2 лимонов на терке в большую емкость или ведро.

- Натереть свежий имбирь крупными зубьями терки.
- Выжмите сок примерно из 6 лимонов. Вам понадобится 250 мл. Добавьте в смесь сок.
- Добавьте сушеный имбирь, изюм и сахар.
- Добавьте 1 литр горячей воды (не кипящей) и перемешивайте около 3 минут, пока сахар полностью не растворится.
- Добавьте еще 4 литра теплой воды.Убедитесь, что вода достаточно прохладная, чтобы вам было удобно держать в ней палец (иначе дрожжи погибнут!).
- Посыпьте пакетик сухих дрожжей водой и оставьте на несколько минут.
- Все перемешать деревянной ложкой.
- Налейте жидкость в большую бутылку и наденьте баллон на горлышко бутылки. Прикрепите баллон к шее толстой резинкой.
- Поставьте флакон в теплое место, но не под прямыми солнечными лучами.
- Дать постоять примерно 4 — 5 часов.

- Когда изюм всплывет вверх, имбирное пиво готово к употреблению.
- Процедите жидкость через сито. Убедитесь, что вы работаете над раковиной или подобным местом.
- Разлейте имбирное пиво в чистые прозрачные стеклянные бутылки и добавьте в каждую изюм. Убедитесь, что вы не наполняете бутылки полностью, а оставьте не менее 7-10 см между жидкостью и горлышком бутылки.
- Прикрепите баллон к горлышкам половины бутылок и закрепите их резиновыми лентами.
- Наверните крышки на другую половину бутылок.
- Храните бутылки вдали от источников тепла и солнечного света. (Необязательно находиться в теплом месте.)
- Оставьте на ночь минимум на 8 часов.
- Аккуратно откручиваем колпачки. Газ внутри захочет уйти, поэтому делайте это медленно и осторожно.
ВОПРОСЫ:
Какие реагенты вступают в реакцию при приготовлении имбирного пива? Химическая реакция происходит между сахаром и ферментирующими фруктами и дрожжами. Итак, реагентами являются сахар и фрукты (имбирь и изюм).
Итак, реагентами являются сахар и фрукты (имбирь и изюм).
Продукт — двуокись углерода (и очень небольшое количество спирта).
Почему в имбирном пиве появляются пузырьки?Это углекислый газ, задержанный в жидкости.
Как вы думаете, откуда взялся газ? Это результат химической реакции между дрожжами, сахаром и ферментирующими фруктами.
Реагентами являются древесина и кислород, а продуктами — углекислый газ и вода.
Химические реакции могут помочь нам обнаружить определенные вещества
Некоторые химические реакции могут дать уникальные и даже впечатляющие результаты! Вы когда-нибудь видели эксперимент с вулканом? Этот эксперимент показан по ссылке на видео в окне посещения.
Видео, показывающее вулкан из дихромата аммония
Когда дихромат аммония горит в кислороде, в результате реакции образуются ярко-оранжевые искры. В результате реакции образуются газообразный азот (N 2 ), вода и темно-зеленое соединение, называемое оксидом хрома, в качестве продуктов. Эта реакция уникальна. Только дихромат аммония вступает в реакцию с кислородом, образуя именно эти продукты с этими особыми визуальными эффектами.
Дихромат аммония до его сжигания в кислороде. Оксид хрома является продуктом.Когда два вещества реагируют уникальным и характерным образом при смешивании, одно из них может быть использовано для обнаружения другого.
Это упражнение укрепляет некоторые концепции дыхания и фотосинтеза, полученные в начале года в «Жизнь и жизнь». CAPS предлагает повторить эксперимент, надувая пузыри через известковую воду. Мы сделали это в главе 1 в этом году в качестве упражнения, но вы можете кратко повторить его здесь, чтобы снова показать результаты, если учащиеся плохо его помнят.
CAPS предлагает повторить эксперимент, надувая пузыри через известковую воду. Мы сделали это в главе 1 в этом году в качестве упражнения, но вы можете кратко повторить его здесь, чтобы снова показать результаты, если учащиеся плохо его помнят.
Вы помните, что в главе 1 книги «Жизнь и жизнь» мы использовали чистую известковую воду для обнаружения углекислого газа в дыхании? Какого цвета стала прозрачная известковая вода, когда мы пустили через нее пузыри?
Получился молочно-белого цвета.
Известковая вода — это раствор гидроксида кальция в воде. Между известковой водой и углекислым газом происходит реакция с образованием белого вещества в воде, называемого карбонатом кальция. Какие реагенты и продукты в этой реакции?
Какие реагенты и продукты в этой реакции?Реагентами являются известковая вода (гидроксид кальция) и диоксид углерода, а продуктами являются карбонат кальция и вода.
Мы говорим, что использовали изменение цвета известковой воды, чтобы обнаружить углекислый газ в нашем дыхании. Двуокись углерода является побочным продуктом химической реакции, происходящей во время дыхания у всех организмов. Напишите словесное уравнение для дыхания.глюкоза + кислород → энергия + углекислый газ + вода
В «Жизнь и жизнь» мы говорили об ингредиентах дыхания, поскольку еще не выучили термины «реагент» и «продукт». Какие реагенты и какие продукты выделяются при дыхании?
Какие реагенты и какие продукты выделяются при дыхании?Реагенты — глюкоза и кислород. Продуктами являются энергия, углекислый газ и вода.
Каковы реагенты и продукты фотосинтеза?Реагенты — углекислый газ и вода, продукты — глюкоза и кислород.
Мы также узнали, что химические реакции — это просто перегруппировки атомов в молекулах с образованием разных молекул. Этим зарабатывают на жизнь многие химики! Они находят способы перегруппировки атомов для создания новых соединений.
Карьера по химии
Этот раздел не предназначен для целей оценки, и вы можете его пропустить.Тем не менее, мы настоятельно рекомендуем вам дать вашим ученикам возможность открыть для себя применение того, что они изучают в классе, в окружающем их мире, даже если это будет домашнее задание. Для учащихся очень важно понимать, что то, чему они учатся в классе, выходит далеко за пределы вашего класса. Поощряйте их любопытство!
Естественные науки — это открытия! Мы хотим показать вам, как то, что вы изучаете в классе, полезно в реальном мире.Этот предмет слишком велик для нас, чтобы изучать его все в школе. Вы можете выбрать множество профессий, основанных на науке. Интересуйтесь окружающим миром и исследуйте его, используя свои растущие научные знания!
В следующем году вы выберете предметы, которые будете изучать до 12 класса. Выберете ли вы физические науки, науки о жизни и математику? Прежде чем решить, какие предметы выбрать, подумайте, что вы можете делать с каждым из них после школы.
Выберете ли вы физические науки, науки о жизни и математику? Прежде чем решить, какие предметы выбрать, подумайте, что вы можете делать с каждым из них после школы.
Давайте узнаем немного больше о возможностях областей, связанных с тем, что мы изучали в Matter and Materials.
Мария Кюри (1867-1934) была известным химиком и физиком, получившим особую награду за свои исследования радиоактивности. Она была первой женщиной, получившей Нобелевскую премию, единственной женщиной, выигравшей в двух областях, и единственным человеком, который еще не получил Нобелевскую премию в нескольких науках!Многие учащиеся могут задаться вопросом, в чем разница между химиком и инженером-химиком?
Химик изучает состав и свойства вещества.Они используют полученные знания для разработки новых соединений, продуктов и процессов, улучшающих нашу повседневную жизнь. Химик требует обширных знаний в области химии и компетентности в лабораторных условиях. Химики часто исследуют химические реакции, чтобы получить новые материалы и соединения. Это могут быть новые лекарства, инновационные строительные материалы, новые виды топлива, не наносящие вреда окружающей среде, и многое другое. Исследование новых химических реакций сложно. Работа часто исследуется в группах с другими учеными и инженерами.
Химик требует обширных знаний в области химии и компетентности в лабораторных условиях. Химики часто исследуют химические реакции, чтобы получить новые материалы и соединения. Это могут быть новые лекарства, инновационные строительные материалы, новые виды топлива, не наносящие вреда окружающей среде, и многое другое. Исследование новых химических реакций сложно. Работа часто исследуется в группах с другими учеными и инженерами.
A Инженер-химик обычно участвует в разработке способов производства новых соединений, разработанных химиками в больших масштабах, или в поиске способов снижения стоимости производства этих соединений. Инженеру-химику необходимы общие знания в области химии, но также необходимо много знать о процессах и о том, что ими движет.
Исследователь работает над открытием чего-то нового или нового способа работы, в то время как инженер оптимизирует известный процесс или выясняет, как лучше всего получить известное соединение.
Пригласите химика / инженера: Знаете ли вы химика или инженера-химика? Возможно, вы живете недалеко от университета? Если вы это сделаете, вы можете пригласить химика или инженера в вашу школу и поговорить с классом о работе, которую делают химики. Как вариант, вы можете посетить химика или инженера на их рабочем месте и попросить их показать вам все вокруг. Вы можете попросить своих учеников заранее подготовить несколько вопросов: вы можете спросить их об их работе, их обучении и о том, какие качества, по их мнению, необходимы, если кто-то хочет стать химиком.Просто не забудьте сначала записаться на прием! Это мероприятие можно превратить в небольшой групповой проект. Учащимся может потребоваться написать краткий отчет о собранной информации. Это не для целей оценки.
Существует множество применений и применений химии, и многие люди в разных профессиях тем или иным образом используют химию. Давай выясним.
ИНСТРУКЦИЯ:
- Ниже приведен список различных профессий, в которых все так или иначе используют химию.Просмотрите список, а затем выберите пять профессий, которые вам интересны.
- Поищите в Интернете информацию о каждой карьере.
- Напишите описание своей карьеры в одну строку.
- Если есть карьера, которая вас действительно интересует, нарисуйте рядом смайлик и обязательно прочитайте дополнительную информацию по теме и о том, куда химия может вас привести! Узнайте, какой уровень химии вам понадобится для этой конкретной карьеры.
- Есть много других профессий, помимо перечисленных здесь, в которых каким-то образом используется химия, поэтому, если вы знаете что-то еще, что не указано здесь и это вас интересует, следуйте своему любопытству и откройте для себя возможности!
Некоторые профессии, связанные с химией:
- Агрохимия
- Биохимия
- Биотехнологии
- Химическое образование / преподавание
- Химик-исследователь
- Экологическая химия
- Судебная медицина
- Пищевая наука и технологии
- Генетик
- Геохимия
- Материаловедение
- Медицина и медицинская химия
- Нефтяная и нефтяная промышленность
- Органическая химия
- Океанография
- Патентное право
- Фармацевтические препараты
- Освоение космоса
- Зоология
Ваши описания интересующих вас профессий:
Закон сохранения массы
Цель обучения
- Определите закон сохранения массы
Ключевые моменты
- Закон сохранения массы гласит, что масса в изолированной системе не создается и не разрушается химическими реакциями или физическими преобразованиями.
- Согласно закону сохранения массы, масса продуктов химической реакции должна равняться массе реагентов.
- Закон сохранения массы полезен для ряда вычислений и может использоваться для решения неизвестных масс, таких как количество газа, потребляемого или производимого во время реакции.
Условия
- реагент Любой из участников, присутствующий в начале химической реакции. Кроме того, молекула до того, как претерпит химическое изменение.
- Закон сохранения массы Закон, который гласит, что масса не может быть создана или разрушена; он просто переставлен.
- продукт Химическое вещество, образовавшееся в результате химической реакции.
История закона сохранения массы
Древние греки впервые предложили идею о постоянстве общего количества материи во Вселенной. Однако Антуан Лавуазье описал закон сохранения массы (или принцип сохранения массы / материи) как фундаментальный принцип физики в 1789 году.
Антуан Лавуазье Портрет Антуана Лавуазье, ученого, которому приписывают открытие закона сохранения массы.Этот закон гласит, что, несмотря на химические реакции или физические преобразования, масса сохраняется, то есть не может быть создана или уничтожена в изолированной системе. Другими словами, в химической реакции масса продуктов всегда будет равна массе реагентов.
Закон сохранения массы-энергии
Этот закон был позже изменен Эйнштейном в законе сохранения массы-энергии, который описывает тот факт, что полная масса и энергия в системе остаются постоянными.Эта поправка включает тот факт, что масса и энергия могут быть преобразованы друг в друга. Однако закон сохранения массы остается полезным понятием в химии, поскольку энергия, производимая или потребляемая в типичной химической реакции, составляет ничтожное количество массы.
Таким образом, мы можем визуализировать химические реакции как перегруппировку атомов и связей, в то время как количество атомов, участвующих в реакции, остается неизменным. Это предположение позволяет нам представить химическую реакцию в виде сбалансированного уравнения, в котором количество молей любого элемента, участвующего в ней, одинаково с обеих сторон уравнения.Дополнительное полезное применение этого закона — определение масс газообразных реагентов и продуктов. Если суммы твердых или жидких реагентов и продуктов известны, любую оставшуюся массу можно отнести к газу.
Сохранение атомов — YouTube В этом видео объясняется, как атомы сохраняются в химической реакции. Показать источникиBoundless проверяет и курирует высококачественный контент с открытой лицензией из Интернета. Этот конкретный ресурс использовал следующие источники:
моль | Определение, число и факты
Моль , также пишется моль , в химии — стандартная научная единица измерения больших количеств очень маленьких объектов, таких как атомы, молекулы или другие заданные частицы.
Популярные вопросы
Как определяется родинка?
Моль определяется как 6.02214076 × 10 23 некоторой химической единицы, будь то атомы, молекулы, ионы или другие. Моль — это удобная единица измерения из-за большого количества атомов, молекул и т. Д. В любом веществе. Изначально моль был определен как количество атомов в 12 граммах углерода-12, но в 2018 году Генеральная конференция по мерам и весам объявила, что с 20 мая 2019 года моль будет всего 6.02214076 × 10 23 какой-то химической единицы.
Как рассчитывается моль?
Если вы хотите узнать, сколько молей материала у вас есть, разделите массу материала на его молярную массу. Молярная масса вещества — это масса в граммах одного моля этого вещества. Эта масса определяется атомным весом химической единицы, из которой состоит это вещество, в атомных единицах массы (а.е.м.). Например, серебро имеет атомный вес 107,8682 а.е.м., поэтому один моль серебра имеет массу 107.8682 грамма.
Какой номер у Авогадро?
Число Авогадро — это количество единиц в одном моль вещества, или 6,02214076 × 10 23 . Это число также называют постоянной Авогадро. Он назван в честь итальянского физика XIX века Амедео Авогадро, который обнаружил, что при одинаковых температуре и давлении два газа с одинаковым объемом имеют одинаковое количество молекул. Французский физик Жан Перрен в начале 20 века назвал количество единиц в моле числом Авогадро.
Какова формула молярной массы?
Молярная масса некоторого вещества — это масса в граммах одного моля этого вещества. Эта масса определяется атомным весом химической единицы, из которой состоит это вещество, в атомных единицах массы (а.е.м.). Например, золото имеет атомный вес 196,967 а.е.м., поэтому масса одного моля золота составляет 196,967 грамма. Для вещества, которое состоит из более чем одного типа атомов, складывается атомный вес отдельных атомов для химической единицы, составляющей это вещество.Вода состоит из двух атомов водорода и одного атома кислорода. Атомный вес одного атома водорода составляет 1,008 а.е.м., а двух атомов — 2,016. Атомный вес одного атома кислорода равен 15,999, поэтому молярная масса воды составляет 2,016 + 15,999 = 18,015 грамма.
Крот обозначает чрезвычайно большое количество единиц, 6.02214076 × 10 23 . Генеральная конференция мер и весов определила моль как это число для Международной системы единиц (СИ), действующей с 20 мая 2019 года.Моль ранее определялся как экспериментально определенное количество атомов в 12 граммах углерода-12. Число единиц в молье также носит название числа Авогадро или постоянной Авогадро в честь итальянского физика Амедео Авогадро (1776–1856). Авогадро предположил, что равные объемы газов в одних и тех же условиях содержат одинаковое количество молекул, гипотеза, которая оказалась полезной при определении атомного и молекулярного веса и которая привела к концепции моль.( См. закон Авогадро.)
Число атомов или других частиц в одном моле одинаково для всех веществ. Моль соотносится с массой элемента следующим образом: один моль атомов углерода-12 имеет 6,02214076 × 10 23 атомов и массу 12 граммов. Для сравнения: один моль кислорода по определению состоит из того же количества атомов, что и углерод-12, но его масса составляет 15,999 грамма. Следовательно, кислород имеет большую массу, чем углерод. Это рассуждение также может быть применено к молекулярной массе или массе формулы.
Понятие «моль» помогает поместить количественную информацию о том, что происходит в химическом уравнении, на макроскопический уровень. Например, в химической реакции 2H 2 O → O 2 + 2H 2 два моля воды разлагаются на два моля молекулярного водорода и один моль молекулярного кислорода. Моль можно использовать для определения простейшей формулы соединения и для расчета количеств, участвующих в химических реакциях. Когда речь идет о реакциях, протекающих в растворах, полезно использовать родственное понятие молярности.Молярность ( M ) определяется как количество молей растворенного вещества в литре раствора.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчасЧто такое индикатор в химии
Что такое индикатор в химии Индикатор
Индикаторы — это вещества, которые меняют цвет при контакте с кислотами и основаниями.
Самый распространенный индикатор, используемый в лаборатории, — это лакмусовая бумажка.Он извлекается из лишайников и доступен либо в виде растворов, либо в виде полосок бумаги, известных как лакмусовая бумага. Лакмусовая бумага бывает красного или синего цвета. Он меняет цвет в зависимости от того, является ли соединение кислотой или основанием. Синяя лакмусовая бумага становится красной в кислых условиях, а красная лакмусовая бумага становится синей в основных условиях.
Растворы, которые не показывают изменения цвета ни на одном из индикаторов, не являются ни кислотными, ни основными. Эти вещества, как вы уже знаете, называются нейтральными веществами .Некоторыми примерами нейтральных веществ являются вода, хлорид натрия, сахар и т. Д.
Лакмус, метиловый апельсин и фенолфталеин — одни из наиболее часто используемых кислотно-основных индикаторов, которые меняют цвет следующим образом.
Показатель | Кислотный раствор | Базовый раствор | Нейтральный раствор |
Голубой лакмусовый раствор | Красный | Без изменений | изменение цвета|
Раствор красной лакмусовой бумажки | Без изменения цвета | Синий | Без изменения цвета |
Метиловый оранжевый | Красный | Желтый | Оранжевый |
Фенолфталеин | Бесцветный | Красный | Бесцветный |
Лакмус: Это натуральный краситель, получаемый из небольших растений, называемых лишайниками.Синяя и красная лакмусовая бумажка готовятся из двух разных разновидностей лишайников.
Лакмусовая бумага: Синяя или красная лакмусовая бумага готовится путем погружения полоски фильтровальной бумаги в синий или красный лакмусовые растворы. Затем бумагу вынимают из раствора и сушат.
Синяя лакмусовая бумага становится красной в кислотном растворе, а красная лакмусовая бумага становится синей в щелочном растворе.
Фенолфталеин: Это бесцветное соединение. В качестве индикатора используется спиртовой раствор фенолфталеина.Он бесцветен в кислотном растворе, но становится розовым (красным) в основном растворе:
Метиловый оранжевый: Очень небольшое количество твердого метилового оранжевого растворяется в горячей воде и фильтруется. Фильтрат используется как индикатор. В кислотных растворах он становится красным, а в щелочных — желтым.
Универсальные индикаторы
Кислоты или основания могут быть сильными или слабыми. Ученые упростили определение силы кислоты или основания. Различным значениям присваивается так называемый показатель pH, который колеблется от 1 до 14.Один считается сильнокислым, а 14 — сильно основным; 7 нейтрален. Вы можете измерить pH раствора с помощью кислоты или основания, которые могут быть сильными или слабыми. Ученые упростили определение силы кислоты или основания. Присваиваются разные уровни концентрации, так называемый показатель pH, который колеблется от 1 до 14. Один считается сильнокислым, а 14 — сильно основным; 7 нейтрален. Вы можете измерить pH раствора с помощью универсального индикатора.
Универсальный индикатор — это смесь индикаторов, выбранных таким образом, чтобы они давали разный цвет для разных значений pH.Индикатор можно использовать в виде жидкости или намочить в бумаге. Эта бумага называется pH-бумагой.
Когда pH-бумага окунается в кислоту или щелочь, полученный цвет может быть совмещен с таблицей, приведенной ниже.
Естественные индикаторы:
Некоторые полезные Природные индикаторы обсуждаются ниже.
(i) Сок куркумы Желтого цвета. Он остается желтым в кислых или нейтральных растворах, но становится темно-коричневым в щелочном растворе.
(ii) Краснокочанный сок Сам по себе имеет пурпурный цвет, он становится красным в кислотном растворе, но зеленым в щелочном растворе.
Индикаторные растворы можно приготовить путем кипячения окрашенных частей растения, таких как лепестки, в течение некоторого времени в воде и процеживания части растения. Этот раствор дает различный цвет в кислых и основных растворах.
Например, сок краснокочанной капусты изменится на темно-красный с кислотами, на фиолетовый с нейтральными и на зеленый и желтый с основаниями. Луковый сок также показывает похожие изменения цвета. Вы можете сразу положить несколько лепестков розы в посуду, содержащую уксус или лимонный сок, и несколько лепестков в мыльном растворе, и увидеть разницу в цвете.
Бытовые индикаторы могут использоваться для проверки того, являются ли некоторые из веществ повседневного употребления, перечисленных ниже, кислотными или основными.
| Кислотные вещества | Основное вещество |
| Таблетки витамина С (аскорбиновая кислота) Лимонный сок Апельсиновый сок Томатный Уксус |
Обонятельные индикаторы:
Существуют такие вещества, как луковый сок, ванильная эссенция и гвоздичное масло, которые по изменению своего запаха показывают, является ли раствор образца кислотным или щелочным.Это так называемые обонятельные индикаторы.
Вы узнали, что в реакциях нейтрализации кислота и основание реагируют с образованием соли и воды. Например, реакция нейтрализации между NaOH и HCl дает соль NaCl и воду.
NaOH + HCl → NaCl + H 2 O
Таким образом, соль можно определить следующим образом.
Соль — это соединение, образованное реакцией кислоты с основанием, в которой водород кислоты заменяется металлом.
В многоосновных кислотах в молекуле присутствует более одного атома водорода.Эти атомы водорода можно заменить частично или полностью. Итак, возможны два вида солей.
(i)
Здесь частичное замещение атомов водорода из H 2 SO 4 привело к образованию гидросульфата натрия.
(ii)
Здесь полное замещение атомов водорода из H 2 SO 4 привело к образованию сульфата натрия. NaHSO 4 и Na 2 SO 4 представляют собой два вида солей.
Мероприятие
Цель: Чтобы увидеть эффект естественного индикатора
Необходимые материалы: Порошок куркумы, спирт / вода, мыльный раствор и стакан Метод: —
1. Смешайте 1/4 чайную ложку куркумы ( haldi) порошка в 1/4 стакана спирта в небольшом стакане. Вы также можете смешать его с водой, но куркума лучше растворяется в спирте.
2. Приготовьте мыльный раствор в другом стакане, растворив в воде небольшой кусочек мыла для стирки.
3. Добавьте к мыльному раствору несколько капель раствора куркумы и спирта.
Наблюдение: Мыльный раствор становится красным.
Заключение: Мыло является основой, а соединение (называемое куркумином), придающее куркуме желтый цвет
, вступает в реакцию с мылом (основой) с образованием красного соединения.
Что такое материя и каковы свойства твердого тела, жидкости и газа
Что такое материя и каковы свойства твердого тела, жидкости и газа Материя:
Все, что занимает пространство и имеет массу называется дело .Еда, вода, воздух, одежда, стол, стул, растения и деревья. Индийские философы говорили, что все живое или неживое состоит из пяти основных элементов: воздуха, земли, огня, неба и воды. На основе его физических свойств и на основе его химических свойств. По химическим свойствам вещество отнесено к элементам, соединениям и смесям .
- Элемент — это вещество, состоящее только из одного типа атомов.
- Соединение — это вещество, которое содержит два или более элемента, которые химически связаны друг с другом.
- Материя состоит из крошечных и дискретных частиц. Между этими частицами есть промежутки.
- Частицы могут быть атомами, молекулами или ионами.
- Атом — это наименьшая частица элемента, которая может участвовать в химической реакции.
- Металлы и некоторые неметаллы, такие как углерод и благородные газы, существуют в виде атомов.
- Молекула представляет собой нейтральную частицу, которая состоит из двух или еще атомов , которые химически связаны друг с другом.
- Ион — это положительно заряженная или отрицательно заряженная частица.
- Частицы вещества находятся в движении. Это было подтверждено многими экспериментами, такими как диффузия брома.
- Диффузия происходит, когда частицы одного вещества перемещаются между частицами другого вещества из области высокой концентрации в область низкой концентрации.
- Скорость диффузии частиц газа зависит от их массы. Газы с низкой молекулярной массой диффундируют быстрее, чем с высокой молекулярной массой.
- На скорость диффузии влияет температура.
(a) Чем выше температура, тем быстрее движутся частицы и, следовательно, быстрее диффузия.
(b) Например, пурпурный цвет манганата калия (VII) в горячей воде распространяется гораздо быстрее, чем в холодной.
Люди также спрашивают
Характеристики частиц материиВсе вокруг нас состоит из мельчайших кусочков или частиц.Частицы, составляющие материю, представляют собой атомы или молекулы.
- Частицы вещества очень и очень маленькие.
- Между частицами материи есть промежутки.
- Частицы материи постоянно движутся.
- Частицы вещества притягиваются друг к другу.
На основе физических состояний все материи можно разделить на три группы.
- Твердые вещества
- жидкости
- Газы
- Твердые тела имеют фиксированную форму и фиксированный объем.
- Твердые тела нельзя сильно сжимать.
- Твердые тела имеют высокую плотность. Они тяжелые.
- Твердые частицы не полностью заполняют контейнер.
- Твердые тела не текут.
Пр. Лед, дерево, уголь, камень, железо, кирпич
Свойства жидкостей- Жидкости имеют фиксированный объем, но не имеют фиксированной формы.Жидкости принимают форму емкости, в которую они помещены.
- Как и твердые тела, жидкости нельзя сильно сжимать.
- Жидкости имеют плотность от средней до высокой. Обычно они менее плотные, чем твердые.
- Жидкости не заполняют контейнер полностью.
- Жидкости обычно текут легко.
Пр. Вода, молоко, фруктовый сок, чернила, арахисовое масло, керосин и т. Д.
Свойства газов- Газы не имеют ни фиксированной формы, ни фиксированного объема.Газы приобретают форму и объем сосуда, в котором они находятся.
- Газы легко сжимаются.
- Газы имеют очень низкую плотность. Они очень. очень легкий.
- Газы полностью заполняют свой контейнер.
- Газы текут легко.
Пр. . Воздух, кислород, водород, азот
Сравнение характерных свойств твердых тел, жидкостей и газовS.№ | Свойство | Твердые вещества | Жидкости | Газы |
| 1 | Форма | Определенно | Примите форму контейнера, но не обязательно занимайте его всю. | Примите форму контейнера, заняв все доступное для них пространство. |
| 2 | Объем | Определено | Определено | Возьмите объем контейнера. |
| 3 | Сжимаемость | Почти нулевая | Почти нулевая | Очень большая |
| 4 | Текучесть или жесткость | Жесткая | Жидкость | Жидкость |
| 5 | Плотность | Большая | Большой | Очень маленький |
| 6 | Распространение | Как правило, не рассеивать | Распространять медленно | Распространять быстро |
| 7 | Свободные поверхности | Любое количество свободных поверхностей | Только одна свободная поверхность | Свободной поверхности нет. |
Диффузия частиц в газе, жидкости и твердом теле. Эксперимент
Цель: Изучить диффузию частиц в газе, жидкости и твердом теле.
Материалы: Жидкий бром, 1 моль dnr 3 манганат калия (VII), раствор KMnO 4 , кристаллы манганата калия (VII), горячее жидкое желе, вода и папиросная бумага.
Аппарат: Газовые сосуды и крышка, капельница, пробирки, штатив для пробирок, пробка, подставка для реторты и зажим.
Процедура:
A. Диффузия в газе
Мера безопасности:
Жидкий бром токсичен и вызывает коррозию. Надевайте перчатки при работе с этим веществом. Это действие должно выполняться в вытяжной камере.
- Несколько капель жидкого брома помещают в сосуд с газом. Баллон с газом немедленно накрывают и отставляют на несколько минут.
- Другой сосуд с газом, содержащий воздух, переворачивают наверху сосуда с газом на этапе 1, который содержит пары брома.
- Крышка между двумя газовыми баллончиками снята. Аппарат откладывают на несколько минут и наблюдение записывают.
B. Распространение в жидкости
- Три четверти пробирки заполнено водой. Пробирка помещается в штатив для пробирок.
- Небольшой объем раствора манганата (VII) калия набирается с помощью пипетки.
- Избыток раствора манганата (VII) калия удаляется куском папиросной бумаги.
- Кончик пипетки опускается в воду в пробирке до тех пор, пока он не окажется рядом со дном пробирки.
- В воду выдавливают каплю раствора манганата (VII) калия.
- Пробирке дают постоять несколько часов. Наблюдение записывается.
C. Диффузия в твердом теле
- Пробирку заполняют горячим жидким желе почти до полного заполнения. Оставляем желе затвердеть.
- На желе кладут небольшой кристалл манганата калия (VII).
- Пробирка закрывается пробкой и зажимается вверх дном, как показано на рисунке ниже.
- Аппарат оставляют на несколько дней, и наблюдение записывается.
Наблюдения:
| Секция | Наблюдение |
| A | Красновато-коричневый пар быстро распространяется по двум газовым сосудам за несколько минут. |
| B | Пурпурный цвет раствора манганата калия (VII) медленно распространяется по воде.Через несколько часов вода станет равномерно фиолетовой. |
| C | Пурпурный цвет манганата калия (VII) очень медленно распространяется на желе. Через несколько дней желе становится полностью фиолетовым. |
Обсуждение:
- (a) Диффузия в газе:
Газообразный бром состоит из крошечных и дискретных частиц. Эти частицы беспорядочно перемещаются в промежутки между частицами воздуха.
(b) Диффузия в жидкости:
Манганат калия (VII) состоит из крошечных дискретных частиц.Эти частицы медленно перемещаются в промежутки между молекулами воды.
(c) Диффузия в твердом теле:
Кристалл манганата калия (VII) растворяется, и частицы очень медленно перемещаются в промежутки между частицами желе. - Скорость диффузии частиц наиболее высока в газах, ниже — в жидкостях и ниже — в твердых телах.
- Это связано с различным расположением частиц в твердых телах, жидкостях и газах. Частицы твердого вещества плотно упакованы вместе, тогда как частицы жидкости упакованы немного рыхлым образом.Частицы газа расположены очень далеко друг от друга и расположены беспорядочно.
Заключение:
Материя состоит из крошечных и дискретных частиц, которые движутся. Диффузия медленнее всего происходит в твердых телах, быстрее в жидкостях и быстрее всего в газах.
Q7 Напишите 10 строк о полезности микроорганизмов в нашем
«здравствуйте, добро пожаловать в еще один Сеанс домашнего задания в Лидо в сегодняшнем классе мы будем решаю научную задачу, так что давайте начнем с вопросом вопрос в том, почему 10 строк на полезность микроорганизмы в нашей жизни так что мои дорогие друзья, можете ли вы подумать о полезность микроорганизмов в нашей жизни точно очень хорошо да они используются в изготовление вина и соленья и все и многое другое главное творог да они используются для творог они используются для фиксации азота в атмосфера они также используются при приготовлении некоторых лекарства для биологических обработок Правильно, это лишь немногие из примеры, которые я могу привести теперь давайте посмотрим 10 полезностей микроорганизмы в наших жизнь начнем с первого они используются в них используются в они используются в виноделие они используются в виноделии выпечка травление травление и другой процесс приготовления пищи другая еда процесс изготовления второй алкоголь спиртовое брожение ферментация на восток на восток широко широко используется в подержанных при подготовке при подготовке подготовка вино и хлебное вино и хлеб третий — бактерии бактерии лактобациллы [Музыка] лактобацилла способствует способствует формированию способствует формированию творог они используются для уменьшения загрязнения они используются для уменьшения радиус они используются для уменьшения загрязнения пятый их используют для повышения плодородия почвы Они используются увеличить плодородие почвы плодородие почвы путем фиксации фиксация атмосферного путем фиксации атмосферный азот шесть они также используются в также используется в подготовка подготовка много лекарств много лекарств и антибиотики и антибиотики седьмой определенные микробы определенные микробы также используются в используется в биологической очистке в биологической очистке биологическая очистка сточных вод обжима и промышленные стоки и промышленный стоки съесть некоторые микроорганизмы некоторые микроорганизмы некоторые микроорганизмы принимаются как принимаются как пробиотики принимаются как пробиотики это то, что есть считается, что считается быть обеспечение предоставления польза для здоровья когда здоровье приносит пользу, когда потребляется девятая бактерия также бактерии также участвует в также участвует в делая изготовление сыр десятый acetobacter acetobacter уксусная acetobacter acetic используется используется для производства используется для производства уксусная кислота из уксусная кислота из спирта так что мои дорогие друзья это были 10 строки о полезности микроорганизмы в нашей жизни так что я надеюсь, что вы поняли решение, если у вас есть сомнения или вопросы, пожалуйста, прокомментируйте ниже, и если вы как это видео, дайте ему большой палец вверх и для дальнейших таких видео, пожалуйста подписывайтесь на наш канал А пока спасибо всем «
CBSE Class 8 English Paragraph Writing
CBSE Class 8 English Paragraph Writing являются частью решений NCERT для английского языка класса 8.Здесь мы дали CBSE Class 8 English Paragraph Writing.
CBSE Class 8 English Paragraph Writing
1. Неожиданный подарок
Четырнадцатое августа у меня день рождения. Каждый год в этот день я получаю подарки от родителей. Однако в прошлый раз я получил очень неожиданный подарок. Отец дал мне авиабилет, паспорт и визу. Он сказал мне, что я должен поехать в Лондон на неделю. Там живет мой дядя. Я был очень счастлив. Это был мой первый визит в Лондон. Это был также первый раз, когда я летел на самолете.
2. День, который я не могу забыть
В моей жизни много незабываемых дней. Из них — день, когда был объявлен результат моего экзамена на пятый класс. Я хорошо выполнил все свои документы. Я ожидал хорошего результата. Но я был первым во всем районе. Я был очень счастлив. Мои родители и другие члены семьи были в восторге. Все мои друзья и учителя пришли поздравить меня с этим большим успехом. В колонии раздавали сладости. Отец решил отдать меня в очень хорошую школу для дальнейшего обучения.Я не могу забыть тот день.
3. Как я отпраздновал свой день рождения
В прошлую субботу я отпраздновал свое 15-летие. Я пригласил всех своих друзей на день рождения к нам домой. Утром родители совершили хаван. Днем начали прибывать гости. Дом был красиво оформлен. Вечером нарезаю именинный торт. Мои друзья и семья поздравили меня с днем рождения. Гостей угощали сладостями и напитками. Мои друзья танцевали и пели. Все были в приподнятом настроении.Гости поели обед (ужин). Они ушли около полуночи.
4. Вы видели несчастный случай
Мне довелось стать свидетелем очень ужасного происшествия. Это произошло в прошлом месяце. Это было между грузовиком и мотоциклом. Дорога была скользкой из-за дождя. По дороге ехал грузовик. Внезапно его на огромной скорости обогнал мотоцикл. Мотоциклом управляли двое молодых студентов. Водители не могли видеть мини-грузовик, едущий с противоположной стороны.Он нажал на тормоза. Но мотоцикл поскользнулся. Всадник и другой ученик упали с Него. У них были травмы головы. Оба они скончались на месте. Я не могу забыть эту аварию.
5. Ночь перед экзаменом
Экзамены всегда страшны. Они являются прекрасной причиной страха, беспокойства, напряжения и беспокойства. Ночь перед обследованием действительно болезненна. Студенты не спят. Они перестают есть пищу. Они хотят все прочитать и пересмотреть. Их беспокоит, если кто-то говорит им о важном вопросе.Они сразу же изучают его ответ. Они раздражаются, если им кто-то мешает. Всю ночь они проводят в напряжении. Утром ничего не принимают. В смотровой зал идут натощак.
6. Праздник Холи в моей колонии
Холи — это праздник веселья и красок. Это произошло в конце зимнего сезона. В прошлый раз и наша колония отметила это как обычно. В день Холи мальчики колонии собирались в определенном месте. Они раскрашивали лица друг друга и прохожих.Еще они бросали шары с водой. Они отправились в соседнюю колонию, чтобы окрасить ее жителей. Вскоре собрались женщины. Они начали поливать друг друга цветной водой. Также предлагали сладости. Все были очень счастливы.
7. Утреннее собрание в моей школе
Утреннее собрание — очень важный ритуал. Это тоже часть вековой культуры нашей страны. Каждая новая работа начинается с молитв нашим богам. Так бывает и в школе. Школы похожи на наши храмы.Студенты и преподаватели выстраиваются в ряд. Они молятся перед тем, как приступить к работе. Сцена очень спокойная и умиротворяющая. Все ученики стоят рядами в школьной форме. Во многих школах на утренних собраниях также проводится некоторая физическая подготовка. Директор также предоставляет студентам важную информацию.
8. Сцена на железнодорожной платформе
Сцена на железнодорожной платформе всегда доставляет удовольствие. Он представляет собой картину мини-Индии. В прошлое воскресенье я пошел на городской вокзал проводить дядю.Платформа была переполнена. Можно было увидеть пассажиров всех штатов, таких как Раджастхан, Тамил Наду, Ассам и т. Д. На платформе было много киосков. Кое-где бегали маленькие дети. Кули в красном платье ходили туда-сюда. Пассажиры пили чай. Некоторые читали газеты. Ждали поезд. Вскоре приехал поезд. Мой дядя сел, и поезд тронулся. Я вернулся домой
9. Мое посещение исторического места
Посещение исторического места всегда познавательно.В прошлом году я ездил в Агра. Агра — историческое место. В нем много зданий, представляющих исторический интерес. Самый известный — Тадж-Махал. У меня нет слов, чтобы выразить ее красоту. Белый мрамор выглядит как серебро. Его отражение в воде просто завораживает. Четыре минарета добавляют ему великолепия. Его увеличивают травянистые газоны. Это похоже на сон в лунную ночь. Я не могу забыть свой визит в Тадж-Махал.
10. Однодневные матчи по крикету
Однодневные матчи по крикету стали фаворитами любителей крикета.Они прекращают работу, чтобы насладиться матчем. Так что эти однодневки стали популярнее контрольных матчей. Однодневный матч — это однодневная игра. Время и выходы фиксированы. Каждая команда играет не более пятидесяти оверов. Так что в этом матче есть интрига и романтика. Это редко заканчивается ничьей. Это дает результаты. Итак, игроки пытаются выиграть матч. Они стараются изо всех сил. Каждый сыгранный мяч наполнен большим весельем и напряжением.
11. Плохие последствия просмотра телевизора
Телевидение стало неотъемлемой частью каждого дома.Это самый дешевый источник развлечений. Детям это очень интересно. Но это также имеет плохие последствия. Видеть это в течение долгих часов вредит глазам. У студентов остается меньше времени на учебу. Так страдает их учеба. Многие программы неверно влияют на молодые умы. Иностранные программы не в хорошем вкусе. К ним легко тянется молодежь. Они забывают свою исконную культуру. Их жизнь испорчена. Итак, телевидение нужно смотреть под руководством старейшин.



 8 класс: к учебнику Габриеляна О.С. — Павлова Н.С. (2015, 256с.)
8 класс: к учебнику Габриеляна О.С. — Павлова Н.С. (2015, 256с.)




 9)
9)