Генетические цепочки металлы I. II. III группы главной подгруппы.
Карточка № 1. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Mg → MgO → MgCO3 → Mg(OH)2 → Mg(NO3)2 → MgO
↓
MgO
………………………………………………………………………………….
Карточка № 2. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Ca → CaO → Ca(OH)2 → CaSO4 → BaSO4
↓
CaCO3 → Ca(HCO3)2
…………………………………………………………………………………
Карточка № 3. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
CaS ← Ca → CaCl2 → Ca(OH)2 → Ca 3 (PO4 )2
↓
CaO → Ca(HCO3)2
Карточка № 4. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Ba3N2 ← Ba → BaCl2 → Ba(OH)2 → Ba(NO3)2 → BaCO3 → BaO
………………………………………………………………………………
Карточка № 5. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
K → K2O2 → K2O → K2CO3 → KCl →К
↓
KOH
,……………………………………………………………………………………
Карточка № 6. 9 класс.
Генетическая связь между классами соединений.
Напишите реакции, с помощью которых можно осуществить превращения.
Na → Na2O2 → Na2O → NaOH → Na2CO3 → NaCl → Na → Na2S
Карточка № 7. 9 класс.
Генетическая связь между классами соединений.
Напишите реакции, с помощью которых можно осуществить превращения.
K → KOH → K2CO3 → K2SO4 → MgSO4 → BaSO4
↓
K2S
………………………………………………………………………………….
Карточка № 8. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Li3PO
↓
Li3N
…………………………………………………………………………………….
Карточка № 9. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Mg → MgS → MgO → MgCO3 → Mg(OH)2 → Mg(NO3)2
↓
MgO
Карточка № 10. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
BeS → BeO → BeCO3 → Be (OH)2 → Be (NO3)2
↓
BeO → Be SO4
…………………………………………………………………………………
Карточка № 11. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
MgS → MgO → MgSO3 → Mg(OH)2 → Mg(NO3)2 → MgO
↓
MgO
……………………………………………………………………………………
Карточка № 12. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
CaCO3 → CaO → CaCl2 → Ca(OH)2 → CaSO4
↓ ↓
Ca Ca(NO3)2
Карточка № 13. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
CaO → CaSO4 → Ca(OH)2 → CaS → CaO → CaBr2
↓
Ca(NO
………………………………………………………………………………
Карточка № 14. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
MgO → MgSO4 → Mg(OH)2 → MgO → Mg → MgS
↓
Mg(NO3)2
……………………………………………………………………………….
Карточка № 15. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Ba → BaS → BaO → Ba(OH)2 → BaCl2 → BaSO4
↓
Ba(NO3)2
Карточка № 16. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Ca → CaSO4 → Ca(OH)2 → CaO → CaS → CaO
↓
Са(NO3)2
……………………………………………………………………………
Карточка № 17. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
MgO → MgSO4 → Mg(OH)2 → MgO → Mg → Mg 3N2
……………………………………………………………………………….
Карточка № 18. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Ba → BaS → BaO → Ba(OH)2 → BaCl2 → BaSO4
↓
Ba(NO3)2
Карточка № 19. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
K → KOH → K2CO3 → KCl →К → K2O2 → KOH
↓
K2S
,……………………………………………………………………………………
Карточка № 20. 9 класс.
Генетическая связь между классами соединений.
Напишите реакции, с помощью которых можно осуществить превращения.
Na → NaOH → Na2CO3 → NaCl → Na → Na2O2 → Na2O → Na2S
…………………………………………………………………………………
Карточка № 21. 9 класс.
Генетическая связь между классами соединений. Щелочные и щелочноземельные металлы.
Напишите реакции, с помощью которых можно осуществить превращения.
Li3PO4 ← LiOH ← Li → Li 2O → LiCl →Li → LiBr
↓
Li2S
……………………………………………………………………………………
infourok.ru
Методическая разработка по химии (9 класс) по теме: Контрольная по теме «Щелочные металлы»
Вариант № 1
1. Решите цепочку превращений
Na__+O2___-> A _ _+Na___-> B ___+h3O -> NaOH __+?__> Na2SO4
2. Запишите уравнение реакции взаимодействия калия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 94,5 г рубидия, содержащего 10 % примесей, если выход водорода составил 90% от теоретически возможного?
____________________________________________________________________________
Вариант № 2
1. Решите цепочку превращений
K__+O2___-> A _ _+K___-> B ___+h3O -> KOH __+?__-> KNO3
2. Запишите уравнение реакции взаимодействия рубидия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 22,5 г лития, содержащего 5 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 3
1. Решите цепочку превращений
Li__+O2___-> A ___+h3O -> B __+HCI__-> C __+?__-> Li2SO3
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 81,5 г калия, содержащего 3 % примесей, если выход водорода составил 95% от теоретически возможного?
_____________________________________________________________________________
Вариант № 4
1. Решите цепочку превращений
Rb__+O2___-> A _ _+Rb___-> B ___+h3O -> RbOH __+?__-> Rb3PO4
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 49,5 г натрия, содержащего 7 % примесей, если выход водорода составил 80% от теоретически возможного?
Вариант № 5
1. Решите цепочку превращений
Na__+O2___-> A _ _+Na___-> B ___+h3O -> NaOH __+?__> NaNO3
2. Запишите уравнение реакции взаимодействия калия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 94,5 г рубидия, содержащего 10 % примесей, если выход водорода составил 90% от теоретически возможного?
____________________________________________________________________________
Вариант № 6
1. Решите цепочку превращений
K__+O2___-> A _ _+K___-> B ___+h3O -> KOH __+?__-> K2SO4
2. Запишите уравнение реакции взаимодействия рубидия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 22,5 г лития, содержащего 5 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 7
1. Решите цепочку превращений
Li__+O2___-> A ___+h3O -> B __+HNO2__-> C __+?__-> Li2S
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 81,5 г калия, содержащего 3 % примесей, если выход водорода составил 95% от теоретически возможного?
_____________________________________________________________________________
Вариант № 8
1. Решите цепочку превращений
Rb__+O2___-> A _ _+Rb___-> B ___+h3O -> RbOH __+?__-> RbCI
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 49,5 г натрия, содержащего 7 % примесей, если выход водорода составил 80% от теоретически возможного?
Вариант № 9
1. Решите цепочку превращений
Na__+O2___-> A _ _+Na___-> B ___+h3O -> NaOH __+?__> Na2SO4
2. Запишите уравнение реакции взаимодействия калия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 94,5 г рубидия, содержащего 10 % примесей, если выход водорода составил 90% от теоретически возможного?
____________________________________________________________________________
Вариант № 10
1. Решите цепочку превращений
K__+O2___-> A _ _+K___-> B ___+h3O -> KOH __+?__-> KNO3
2. Запишите уравнение реакции взаимодействия рубидия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 22,5 г лития, содержащего 5 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 11
1. Решите цепочку превращений
Li__+O2___-> A ___+h3O -> B __+HCI__-> C __+?__-> Li2SO3
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 81,5 г калия, содержащего 3 % примесей, если выход водорода составил 95% от теоретически возможного?
_____________________________________________________________________________
Вариант № 12
1. Решите цепочку превращений
Rb__+O2___-> A _ _+Rb___-> B ___+h3O -> RbOH __+?__-> Rb3PO4
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 49,5 г натрия, содержащего 7 % примесей, если выход водорода составил 80% от теоретически возможного?
Вариант № 13
1. Решите цепочку превращений
Na__+O2___-> A _ _+Na___-> B ___+h3O -> NaOH __+?__> NaNO3
2. Запишите уравнение реакции взаимодействия калия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 94,5 г рубидия, содержащего 10 % примесей, если выход водорода составил 90% от теоретически возможного?
____________________________________________________________________________
Вариант № 14
1. Решите цепочку превращений
K__+O2___-> A _ _+K___-> B ___+h3O -> KOH __+?__-> K2SO4
2. Запишите уравнение реакции взаимодействия рубидия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 22,5 г лития, содержащего 5 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 15
1. Решите цепочку превращений
Li__+O2___-> A ___+h3O -> B __+HNO2__-> C __+?__-> Li2S
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 81,5 г калия, содержащего 3 % примесей, если выход водорода составил 95% от теоретически возможного?
_____________________________________________________________________________
Вариант № 16
1. Решите цепочку превращений
Rb__+O2___-> A _ _+Rb___-> B ___+h3O -> RbOH __+?__-> RbCI
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 49,5 г натрия, содержащего 7 % примесей, если выход водорода составил 80% от теоретически возможного?
Вариант № 17
1. Решите цепочку превращений
Na__+O2___-> A _ _+Na___-> B ___+h3O -> NaOH __+?__> Na2SO4
2. Запишите уравнение реакции взаимодействия калия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 94,5 г рубидия, содержащего 10 % примесей, если выход водорода составил 90% от теоретически возможного?
____________________________________________________________________________
Вариант № 18
1. Решите цепочку превращений
K__+O2___-> A _ _+K___-> B ___+h3O -> KOH __+?__-> KNO3
2. Запишите уравнение реакции взаимодействия рубидия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 22,5 г лития, содержащего 5 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 19
1. Решите цепочку превращений
Li__+O2___-> A ___+h3O -> B __+HCI__-> C __+?__-> Li2SO3
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 81,5 г калия, содержащего 3 % примесей, если выход водорода составил 95% от теоретически возможного?
_____________________________________________________________________________
Вариант № 20
1. Решите цепочку превращений
Rb__+O2___-> A _ _+Rb___-> B ___+h3O -> RbOH __+?__-> Rb3PO4
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 49,5 г натрия, содержащего 7 % примесей, если выход водорода составил 80% от теоретически возможного?
Вариант № 21
1. Решите цепочку превращений
Na__+O2___-> A _ _+Na___-> B ___+h3O -> NaOH __+?__> NaNO3
2. Запишите уравнение реакции взаимодействия калия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 94,5 г рубидия, содержащего 10 % примесей, если выход водорода составил 90% от теоретически возможного?
____________________________________________________________________________
Вариант № 22
1. Решите цепочку превращений
K__+O2___-> A _ _+K___-> B ___+h3O -> KOH __+?__-> K2SO4
2. Запишите уравнение реакции взаимодействия рубидия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 22,5 г лития, содержащего 5 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 23
1. Решите цепочку превращений
Li__+O2___-> A ___+h3O -> B __+HNO2__-> C __+?__-> Li2S
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 81,5 г калия, содержащего 3 % примесей, если выход водорода составил 95% от теоретически возможного?
_____________________________________________________________________________
Вариант № 24
1. Решите цепочку превращений
Rb__+O2___-> A _ _+Rb___-> B ___+h3O -> RbOH __+?__-> RbCI
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 49,5 г натрия, содержащего 7 % примесей, если выход водорода составил 80% от теоретически возможного?
Вариант № 25
1. Решите цепочку превращений
Na__+O2___-> A _ _+Na___-> B ___+h3O -> NaOH __+?__> Na2SO4
2. Запишите уравнение реакции взаимодействия калия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 94,5 г рубидия, содержащего 10 % примесей, если выход водорода составил 90% от теоретически возможного?
____________________________________________________________________________
Вариант № 26
1. Решите цепочку превращений
K__+O2___-> A _ _+K___-> B ___+h3O -> KOH __+?__-> KNO3
2. Запишите уравнение реакции взаимодействия рубидия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 22,5 г лития, содержащего 5 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 27
1. Решите цепочку превращений
Li__+O2___-> A ___+h3O -> B __+HCI__-> C __+?__-> Li2SO3
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 81,5 г калия, содержащего 3 % примесей, если выход водорода составил 95% от теоретически возможного?
_____________________________________________________________________________
Вариант № 28
1. Решите цепочку превращений
Rb__+O2___-> A _ _+Rb___-> B ___+h3O -> RbOH __+?__-> Rb3PO4
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 49,5 г натрия, содержащего 7 % примесей, если выход водорода составил 80% от теоретически возможного?
Вариант № 29
1. Решите цепочку превращений
Na__+O2___-> A _ _+Na___-> B ___+h3O -> NaOH __+?__> NaNO3
2. Запишите уравнение реакции взаимодействия калия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 94,5 г рубидия, содержащего 10 % примесей, если выход водорода составил 90% от теоретически возможного?
____________________________________________________________________________
Вариант № 30
1. Решите цепочку превращений
K__+O2___-> A _ _+K___-> B ___+h3O -> KOH __+?__-> K2SO4
2. Запишите уравнение реакции взаимодействия рубидия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 22,5 г лития, содержащего 5 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 31
1. Решите цепочку превращений
Li__+O2___-> A ___+h3O -> B __+HNO2__-> C __+?__-> Li2S
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 81,5 г калия, содержащего 3 % примесей, если выход водорода составил 95% от теоретически возможного?
_____________________________________________________________________________
Вариант № 32
1. Решите цепочку превращений
Rb__+O2___-> A _ _+Rb___-> B ___+h3O -> RbOH __+?__-> RbCI
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 49,5 г натрия, содержащего 7 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 33
1. Решите цепочку превращений
Na__+O2___-> A _ _+Na___-> B ___+h3O -> NaOH __+?__> Na2SO4
2. Запишите уравнение реакции взаимодействия калия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 94,5 г рубидия, содержащего 10 % примесей, если выход водорода составил 90% от теоретически возможного?
____________________________________________________________________________
Вариант № 34
1. Решите цепочку превращений
K__+O2___-> A _ _+K___-> B ___+h3O -> KOH __+?__-> KNO3
2. Запишите уравнение реакции взаимодействия рубидия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 22,5 г лития, содержащего 5 % примесей, если выход водорода составил 80% от теоретически возможного?
_____________________________________________________________________________
Вариант № 35
1. Решите цепочку превращений
Li__+O2___-> A ___+h3O -> B __+HCI__-> C __+?__-> Li2SO3
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 81,5 г калия, содержащего 3 % примесей, если выход водорода составил 95% от теоретически возможного?
_____________________________________________________________________________
Вариант № 36
1. Решите цепочку превращений
Rb__+O2___-> A _ _+Rb___-> B ___+h3O -> RbOH __+?__-> Rb3PO4
2. Запишите уравнение реакции взаимодействия натрия с кислородом и расставьте коэффициенты методом электронного баланса.
3. Какой объем водорода может быть получен при растворении в воде 49,5 г натрия, содержащего 7 % примесей, если выход водорода составил 80% от теоретически возможного?
nsportal.ru
Дидактический материал по химии для 9 класса теме «Щелочные металлы»
Задания по теме «Щелочные металлы»
В – 1. В каком виде встречаются в природе щелочные металлы? Почему? Как их получают? Приведите примеры.
———————————————————————————————————-
В – 2. Почему щелочные металлы хранят в закрытых склянках под слоем керосина? Что будет происходить с ними на воздухе? Напишите уравнения возможных реакций.
———————————————————————————————————-
В – 3. Приведите электронные формулы щелочных металлов (Li, Na, K). Что общего и в чем различие в их строении? Какой металл самый активный? Почему?
———————————————————————————————————
В- 4. Составить уравнения реакций взаимодействия а) лития б) натрия с: кислородом, бромом, водой, серой. Назовите полученные вещества.
———————————————————————————————————
В – 5. Осуществить превращения, назвать вещества:
KOH ← K → K2O2 → K2O → KCl
↓
K2S
———————————————————————————————————
В – 6
Кусочек натрия массой 2,3 г опустили в химический стакан с водой. Вычислите объем выделившегося водорода (н.у.) и массу образовавшейся щелочи.
———————————————————————————————————
В — 7
Кусочек калия массой 3,9 г опустили в химический стакан с водой. Вычислите объем выделившегося водорода (н.у.) и массу образовавшейся щелочи.
———————————————————————————————————
В – 8 При «растворении» какой массы натрия в воде выделится водород объемом 1,12 л (н.у.)?
———————————————————————————————————
В – 9
Натрий массой 23 г вступил в реакцию с избытком серы. Какая масса сульфида натрия образовалась при этом?
———————————————————————————————————
В – 10 Осуществить цепочку превращений:
Калий → Гидроксид калия → Сульфат калия → Хлорид калия → Калий
———————————————————————————————————-
В – 11. Осуществить превращение:
Li3N ← Li → L2
↓
LiOH
———————————————————————————————————-
В – 12. Осуществить превращения, назвать все вещества:
Na2S ← Na → Na2O2 → Na2O → NaOH
↓
NaCl
———————————————————————————————————-
В – 13. Какие химические реакции могут происходить, если кусочек натрия поместить в раствор сульфата меди (II)? Запишите эти уравнения реакций.
———————————————————————————————————
В – 14.
Запишите уравнения химических реакций а) лития б) калия
с кислородом, серой, хлором, водой, хлороводородом. Назовите полученные вещества.
———————————————————————————————————
В – 15. Напишите уравнения реакций взаимодействия оксида калия с:
а) водой б) оксидом углерода (IV) в) соляной кислотой г) серной кислотой
———————————————————————————————————
В – 16. Осуществить цепочку превращений:
Натрий → Пероксид натрия →Оксид натрия→ Гидроксид натрия → Фосфат натрия
———————————————————————————————————-
В- 17
Составьте уравнения реакций взаимодействия натрия с :
а) кислородом б) водородом г) азотом в) фосфором г) бромоводородом (HBr)
———————————————————————————————————-
В – 18.
Какая масса хлорида натрия будет получена, если раствор, содержащий 4,6 г гидроксида натрия нейтрализовали соляной кислотой?
———————————————————————————————————-
В – 19. Осуществить цепочку превращений:
Литий → Оксид лития → Гидроксид лития → Карбонат лития → Хлорид лития →литий
———————————————————————————————————-
В – 20.
Какая масса воды понадобится, чтобы полностью растворить 170 г рубидия?
———————————————————————————————————-
В – 21.
В вашем распоряжении только два вещества: вода и натрий. У вас есть практически любое оборудование, которое может понадобиться. Напишите уравнения всех возможных реакций, которые можно осуществить исходя из названных веществ с целью получения как можно большего числа новых веществ.
———————————————————————————————————-
В – 22
Напишите уравнения реакций взаимодействия гидроксида лития с:
а) оксидом серы (VI) б) фосфорной кислотой в) серной кислотой г) хлоридом магния. Назовите полученные вещества.
———————————————————————————————————-
В-23
Какой объем углекислого газа (н.у.) может быть поглощен раствором, содержащим 60 г гидроксида натрия.
———————————————————————————————————-
В-24
В вашем распоряжении только два вещества: вода и литий. У вас есть практически любое оборудование, которое может понадобиться. Напишите уравнения всех возможных реакций, которые можно осуществить исходя из названных веществ с целью получения как можно большего числа новых веществ.
———————————————————————————————————-
В-25
4,6 г натрия поместили в стакан, содержащий 200 г воды. Рассчитайте массовую долю щелочи в полученном растворе.
———————————————————————————————————
infourok.ru
Тема 12. Щелочные металлы. | 9 класс
Часть I
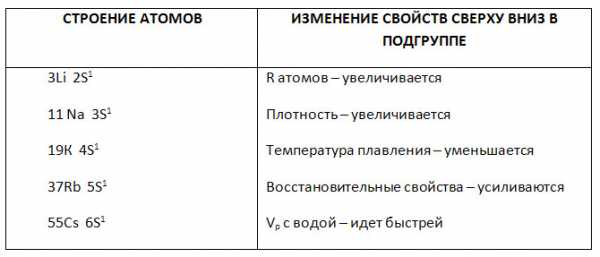
1. Заполните таблицу «Изменение свойств щелочных металлов».
2. Схема химической связи: М-1е=М+1
связь металлическая.
3. Общие химические свойства.
Дополните уравнения реакций щелочных металлов с различными соединениями, записав окислительно-восстановительный баланс к ним.
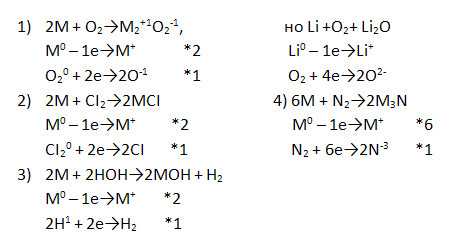
4. Получение – электролиз расплавов хлоридов или гидроксидов.
Часть II
1. Дополните цепочку переходов. Запишите уравнения реакцией, с помощью которых можно осуществить превращения по схеме. Рассмотрите их с позиций окисления-восстановления, а последний переход представьте в свете ТЭД.
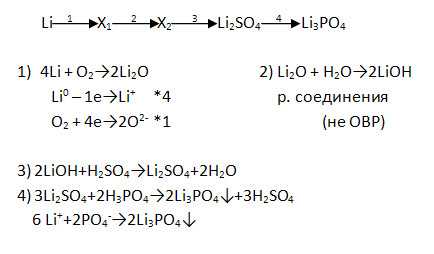
2. Дополните цепочку переходов. Запишите уравнения реакций, с помощью которых можно осуществить превращения по схеме. Рассмотрите переходы как ОВР, а два последних перехода представьте в свете ТЭД.
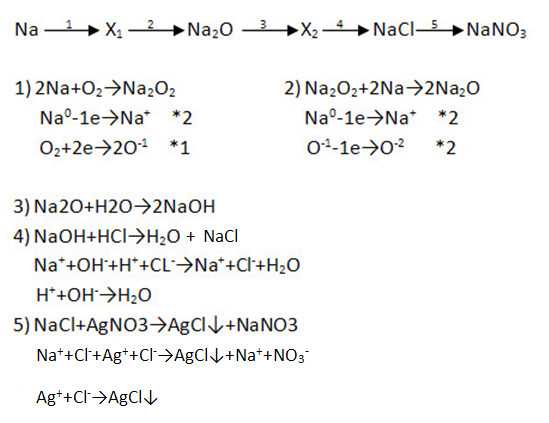
3. Сравните способы защиты от коррозии Li и Na.
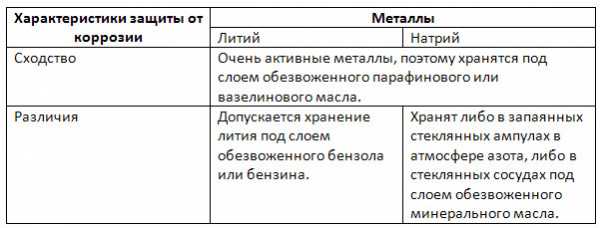
4. Рассчитайте массу натрия и объём хлора, полученных в результате электролиза 585 кг хлорида натрия, содержащего 12% примесей.

5. Какой объём займёт водород, выделившейся при растворении в 0,5 л воды 69 г натрия? Какова массовая доля щёлочи в полученном растворе?
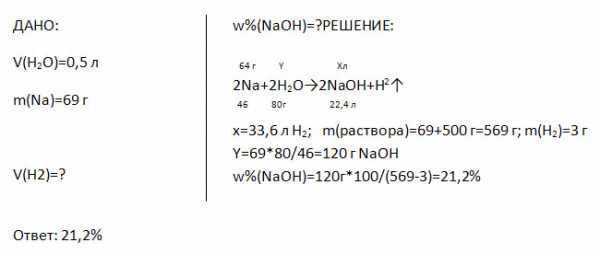
6. С помощью дополнительных источников информации (интернет), подготовьте небольшое сообщение об одном из щелочных металлов. Запишите план этого сообщения или тезисы в особой тетради.
Литий был открыт в 1817 году шведским химиком и минералогом Иоганном Арфведсоном сначала в минерале петалите. Металлический литий впервые получил Гемфри Дэви в 1825 году.
Свое название литий получил из-за того, что был обнаружен в «камнях» (от греч. литий – камень). Основные минералы лития — слюда лепидолит.
Литий — серебристо-белый металл, мягкий и пластичный, тверже натрия, но мягче свинца. Из всех щелочных металлов литий характеризуется самыми высокими температурами плавления и кипения, у него самая низкая плотность при комнатной температуре среди всех металлов.
Литий является наименее активным щелочным металлом, с сухим воздухом при комнатной температуре практически не реагирует. По этой причине литий является единственным щелочным металлом, который не хранят в керосине, он может непродолжительное время храниться на воздухе. Литий и его соли окрашивают пламя в карминово-красный цвет.
Применение:
• Термоэлектрические материалы
• Химические источники тока
• Ракетное топливо
• Лазерные материалы
• Сплавы – в авиации и космонавтике
• Оптический материал в радиоэлектронике, аккумуляторы
• Металлургия – восстановления методами металлотермии редких металлов
• Ядерная энергетика
• В медицине
• В качестве смазочных материалов
• Прочие области применения: соединения лития используются в текстильной промышленности (отбеливание тканей), пищевой (консервирование) и фармацевтической (изготовление косметики).
superhimik.ru
Практическая работа №1. Осуществление цепочки химических превращений
§18. Неметаллы: атомы и простые вещества. Кислороду озон, воздух. (стр. 129-135)
§19. Водород. (стр. 136-142)
Вопросы к параграфу:
1; 2; 3; 4; 5;Лабораторный опыт:
№19;§20. Вода. (стр. 143-152)
§21. Вода в жизни человека. (стр. 152-159)
§22. Галогены. (стр. 159-167)
§23. Соединения галогенов. (стр. 167-173)
Вопросы к параграфу:
1; 2; 3; 4;Лабораторный опыт:
№26;§24. Получение галогенов. Биологическое значение и применение галогенов и их соединений. (стр. 173-180)
§25. Кислород. (стр. 180-188)
Лабораторный опыт:
№27;§26. Сера. (стр. 188-195)
Вопросы к параграфу:
1; 2; 3; 4; 5;Лабораторный опыт:
№28;§27. Соединения серы. (стр. 195-204)
Лабораторный опыт:
№29;§28. Азот. (стр. 204-209)
Вопросы к параграфу:
1; 2; 3; 4; 5;§29. Аммиак. (стр. 210-216)
Лабораторный опыт:
№30;§30. Соли аммония. (стр. 216-219)
Вопросы к параграфу:
1; 2; 3; 4; 5;Лабораторный опыт:
№31;§31. Кислородные соединения азота. (стр. 220-225)
§32. Фосфор и его соединения. (стр. 225-232)
§33. Углерод. (стр. 232-241)
Лабораторный опыт:
№36;§34. Кислородные соединения углерода. (стр. 242-249)
§35. Кремний и его соединения. (стр. 249-265)
Вопросы к параграфу:
1; 2; 3; 4;Лабораторный опыт:
№40;Темы для дискуссии::
1; 2; 3;gdzplus.me
Инструктивная карта к практической работе № 1 «Осуществление цепочки химических превращений соединений металлов» по химии (9 класс)
9 класс
Практическая работа №1
Осуществление цепочки химических превращений соединений металлов
Вариант 1
MgCO3 → MgCl2 → Mg(OH)2 → MgSO4
ЦОР для проведения виртуальной практической работы
Осуществление цепочки химических превращений с соединениями магния (URL— http://files.school-collection.edu.ru/dlrstore/0abac637-4185-11db-b0de-0800200c9a66/x9_189.swf
Инструктаж по технике безопасности.
Цель работы: Осуществить реакции, соответствующие указанным цепочкам превращений.
Оборудование: Штатив с пробиркой, шпатель.
Реактивы: Карбонат магния MgCO3(тв.), щелочь NaOH, соляная кислота НCl, серная кислота H2 SO4, фенолфталеин.
Ход работы:
Откройте бюкс с MgCO3. С помощью шпателя поместите в пробирку немного MgCO3. Закройте бюкс. Добавьте в пробирку раствор НCl. Закройте склянку с НCl.
К полученному раствору добавьте раствор NaOH. Закройте склянку с NaOH. Добавьте в пробирку несколько капель фенолфталеина.
Теперь добавьте в пробирку раствор H2 SO4.
Запишите в таблицу свои наблюдения, а также уравнения соответствующих реакций в молекулярном и ионном виде.
2
3
Вывод: Благодаря практической работе, я повторил(а) химические свойства соединений металлов, а также химические свойства основных классов сложных веществ.
9 класс
Практическая работа №1
Осуществление цепочки химических превращений соединений металлов
Вариант 2
CuSO4 → Cu(OH)2 → CuCl2
↓
CuO
ЦОР для проведения виртуальной практической работы
Осуществление цепочки химических превращений с соединениями меди
(URL- http://school-collection.edu.ru/catalog/res/0abac638-4185-11db-b0de-0800200c9a66/view/
Инструктаж по технике безопасности.
Цель работы: Осуществить реакции, соответствующие указанным цепочкам превращений.
Оборудование: Штатив с пробирками, спиртовка, спички, пробиркодержатель.
Реактивы: Сульфат меди(II) CuSO4, щелочь NaOH, соляная кислота НCl.
Ход работы:
Налейте в обе пробирки небольшое количество раствора CuSO4. Закройте склянку с CuSO4. Добавьте раствор NaOH в обе пробирки. Закройте склянку с NaOH.
В одну из пробирок прилейте раствор НCl. Закройте склянку с НCl.
Вторую пробирку закрепите в держателе и нагрейте в пламени спиртовки. Потушите спиртовку, накрыв колпачком.
Запишите в таблицу свои наблюдения, а также уравнения соответствующих реакций в молекулярном и ионном виде.
2
3
Вывод: Благодаря практической работе, я повторил(а) химические свойства соединений металлов, а также химические свойства основных классов сложных веществ.
infourok.ru
Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
На уроке будет раскрыта тема «Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий». Вы узнаете общие свойства и закономерности щелочных и щелочноземельных элементов, изучите по отдельности химические свойства щелочных и щелочноземельных металлов и их соединения. С помощью химических уравнений будет рассмотрено такое понятие, как жесткость воды. Познакомитесь с алюминием, его свойствами и сплавами. Вы узнаете, что такое смеси, регенерирующие кислород, озониды, пероксид бария и получение кислорода.
Тема: Основные металлы и неметаллы
Урок: Металлы и их свойства. Щелочные металлы. Щелочноземельные металлы. Алюминий
Главную подгруппу I группы Периодической системы Д.И. Менделеева составляют литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Элементы этой подгруппы относят к металлам. Их общее название – щелочные металлы.
Щелочноземельные металлы находятся в главной подгруппе II группы Периодической системы Д.И. Менделеева. Это магний Mg, кальций Ca, стронций Sr, барий Ba и радий Ra.
Щелочные и щелочноземельные металлы как типичные металлы проявляют ярко выраженные восстановительные свойства. У элементов главных подгрупп металлические свойства с увеличением радиуса возрастают. Особенно сильно восстановительные свойства проявляются у щелочных металлов. Настолько сильно, что практически невозможно проводить их реакции с разбавленными водными растворами, так как в первую очередь будет идти реакция взаимодействия их с водой. У щелочноземельных металлов ситуация аналогичная. Они тоже взаимодействуют с водой, но гораздо менее интенсивно, чем щелочные металлы.
Электронные конфигурации валентного слоя щелочных металлов – ns1 , где n – номер электронного слоя. Их относят к s-элементам. У щелочноземельных металлов – ns2 (s-элементы). У алюминия валентные электроны …3s23р1 (p-элемент). Эти элементы образуют соединения с ионным типом связи. При образовании соединений для них степень окисления соответствует номеру группы.
Обнаружение ионов металла в солях
Ионы металлов легко определить по изменению окраски пламени. Рис. 1.
Соли лития – карминово-красная окраска пламени. Соли натрия – желтый. Соли калия – фиолетовый через кобальтовое стекло. Рубидия – красный, цезия – фиолетово-синий.
Рис. 1
Соли щелочноземельных металлов: кальция – кирпично-красный, стронция – карминово-красный и бария – желтовато-зеленый. Соли алюминия окраску пламени не меняют. Соли щелочных и щелочноземельных металлов используются для создания фейерверков. И можно легко определить по окраске, соли какого металла применялись.
Свойства металло
interneturok.ru
