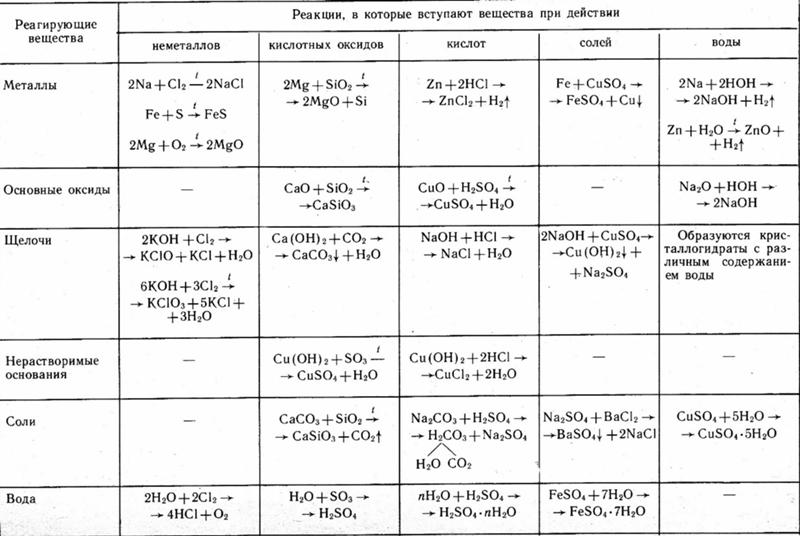
Практическая работа Теория электролитической диссоциации
Практическая работа № 1
Решение экспериментальных задач по теме: «Электролитическая диссоциация».
Цель: Основываясь на теоретических знаниях, научиться экспериментальным путем проводить реакции ионного обмена.
Реактивы и приборы: Растворы- NaOH, K2CO3, Na2CO3, Zn(NO3)2, K3PO4, Na2S, HCI, h3SO4, HNO3, CuSO4, Na2SO4, FeSO4, Cu(NO3)2, h3S, Mg(NO3)2. Пробирки, спиртовка, спички, держатель, штатив для пробирок.
Ход работы
К хлориду магния приливаю:
а) гидроксид натрия
?Выпадает осадок (цвет)
? Выделяется газ
? ничего не происходит
1) MgCI2 + NaOH → закончить
2) полное ионное уравнение
3) сокращенное ионное уравнение
б) карбонат натрия и т. д.
д.
2.
Смешиваю растворы
а) K2CO3 и HCI медленно нагреваю и осторожно определяю запах.
? выделяется газ без запаха
? с резким запахом
? со специфичным запахом
K2CO3 + HCI → KCI + h3O + CO2↑
2) полное ионное уравнение
3) сокращенное ионное уравнение
б) Na2S и h3SO4 и т.д.
3.
Для того чтобы получить:
а) карбонат кальция, необходимо смешать растворы ….
?Выпадает осадок (цвет)
? Выделяется газ
? ничего не происходит
Молекулярное и полное ионное уравнение
4.
Для того чтобы получить:
а) гидроксид железа необходимо смешать растворы …
?Выпадает осадок (цвет)
? Выделяется газ
? ничего не происходит
Молекулярное и полное и сокращенное ионное уравнение
Вывод: На данной практической работе я научился (ась) проводить экспериментальным путем реакции ионного обмена теоретически прогнозируя результат
Практическая работа № 1
Решение экспериментальных задач по теме: «Электролитическая диссоциация».
Цель: Основываясь на теоретических знаниях, научиться экспериментальным путем проводить реакции ионного обмена.
Реактивы и приборы: Растворы- NaOH, K2CO3, Na2CO3, Zn(NO3)2, K3PO4, Na2S, HCI, h3SO4, HNO3, CuSO4, Na2SO4, FeSO4, Cu(NO3)2, h3S, Mg(NO3)2. Пробирки, спиртовка, спички, держатель, штатив для пробирок.
Ход работы
К хлориду магния приливаю:
а) гидроксид натрия
?Выпадает осадок (цвет)
? Выделяется газ
? ничего не происходит
1) MgCI2 + NaOH → закончить
2) полное ионное уравнение
3) сокращенное ионное уравнение
б) карбонат натрия и т.д.
2.
Смешиваю растворы
а) K2CO3 и HCI медленно нагреваю и осторожно определяю запах.
? выделяется газ без запаха
? с резким запахом
? со специфичным запахом
K2CO3 + HCI → KCI + h3O + CO2↑
2) полное ионное уравнение
3) сокращенное ионное уравнение
б) Na2S и h3SO4 и т. д.
д.
3.
Для того чтобы получить:
а) карбонат кальция, необходимо смешать растворы ….
?Выпадает осадок (цвет)
? Выделяется газ
? ничего не происходит
Молекулярное и полное ионное уравнение
4.
Для того чтобы получить:
а) гидроксид железа необходимо смешать растворы …
?Выпадает осадок (цвет)
? Выделяется газ
? ничего не происходит
Молекулярное и полное и сокращенное ионное уравнение
Вывод: На данной практической работе я научился (ась) проводить экспериментальным путем реакции ионного обмена теоретически прогнозируя результат
Практическая работа «Решение экспериментальных задач по теме «Электролитическая диссоциация»
ПРАКТИЧЕСКАЯ РАБОТА №1.
РЕШЕНИЕ ЭКСПЕРИМЕНТАЛЬНЫХ ЗАДАЧ ПО ТЕМЕ «ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ»
Цели. Обобщить материал по основным положениям теории электролитической диссоциации и генетической связи неорганических веществ.
Обобщить материал по основным положениям теории электролитической диссоциации и генетической связи неорганических веществ.
Оборудование и реактивы. Спиртовка, спички, держатель для пробирок, штатив с химическими пробирками, набор индикаторов, железо (гвоздь), соляная кислота (раствор), H2SO4 (раствор) , NaOH, ZnCl2, КCl, FeCl3, К2CO3, AgNO3, CuSO4, BaCl2.
Электролитическая диссоциация — это процесс распада молекул на ионы при его растворении или плавлении.
Молекулярное уравнение – это уравнение, в котором как исходные вещества, так и продукты реакции записаны в виде молекул. Если химическая реакция протекает с образованием осадка, то в уравнении справа от формулы осадка ставят стрелку, направленную вниз (↓).
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями.
Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит.
ПРАВИЛА СОСТАВЛЕНИЯ УРАВНЕНИЙ РЕАКЦИЙ ИОННОГО ОБМЕНА
Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 ↓+ 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3Na+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3Na+ + 3Cl—
4.Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3Na+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3Na++ 3Cl—
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe3+ + 3OH— = Fe(OH)3
На ионы мы не разбиваем:
Оксиды; осадки; газы; воду; слабые электролиты (кислоты и основания)
Анионы кислотных остатков кислых солей слабых кислот (НСО3—, Н2РО4— и т.п.) и катионы основных солей слабых оснований Al(OH)2+
Комплексные катионы и анионы: [Al(OH)4]—
ХОД РАБОТЫ
Докажите опытным путем состав:
А) серной кислоты;
Б) хлорида железа (III).
Испытайте растворы хлорида калия, карбоната калия, хлорида цинка раствором индикатора или индикаторной бумагой. Объясните результаты испытаний. Запишите молекулярные и ионные уравнения реакций гидролиза.
Осуществите цепочку химических превращений:
CuSO4 Cu(OH)2 CuO CuCl2 Cu
Заполните таблицу:
Что делали | Наблюдения | Вывод |
Сделайте вывод о проделанной работе.
Глава 4 Определение проблемы
4.1 Постановка проблемы
Экспериментирование как процесс решения задач, осуществляемый в контролируемых условиях с целью обнаружения неизвестного эффекта или закона, проверки или установления гипотезы или иллюстрации известного закона
Экспериментирование описывается как множество вещей: метод, подход, тест или инструмент для получения доказательств. Все это верно, но экспериментирование — это прежде всего процесс решения проблем.
Отправной точкой вашего эксперимента не должна быть ни методология, ни заранее определенный ответ; это должна быть проблема, которую вы пытаетесь решить.
Чтобы помочь нам выбрать постановку задачи, мы можем выполнить следующие шаги:
Шаг 1: Выберите тему 1. Что мне кажется интересным в этой теме? 2. Что известно о предмете? 3. Чего не хватает и какие пробелы?
Теоретически тема может касаться любой области (например, сельского хозяйства, а также фискальной политики) и на любом уровне (например, она может затронуть 20 человек или большую часть населения Канады).
Проблема не обязательно должна быть причинно-следственной по своей природе, и в этом случае, возможно, лучше провести наблюдательное исследование.
Шаг 2. Сузьте тему 1. Что вам нужно знать больше по теме? 2. Интересуетесь ли вы социальными, политическими, экономическими, гендерными, религиозными вопросами, связанными с вашей темой? — Найдите «уклон» в своей теме и определите основные причины (физические, социальные или организационные причины) — Разработать возможные решения и выбрать решение 3. Покажут ли результаты что-то новое или неожиданное? 4. Что входит в рамки, а что выходит за рамки? 5. Можете ли вы четко сформулировать гипотезы (если… то…) и четко сформулировать вопросы исследования?
Формулировка проблемы, которую вы разрабатываете, должна быть ясной и точной, но также охватывать соответствующую область политики, которая находится в пределах вашей досягаемости (например, с точки зрения юрисдикции). Проблема, которая имеет слишком мало влияния, чтобы считаться важной, скорее всего, не очень подходит, и проблема с небольшими последствиями для принятия решений не очень полезна для изучения. Точно так же слишком расплывчатые формулировки проблемы необходимо изменить, чтобы они соответствовали области действия.
Проблема, которая имеет слишком мало влияния, чтобы считаться важной, скорее всего, не очень подходит, и проблема с небольшими последствиями для принятия решений не очень полезна для изучения. Точно так же слишком расплывчатые формулировки проблемы необходимо изменить, чтобы они соответствовали области действия.
Например, в статье рассматриваются эффекты фрейминга в здравоохранении и задается вопрос, меняются ли предпочтения пациентов в отношении терапии при наличии положительной контекстуальной информации? (конкретная и четкая постановка проблемы)
В этом случае они сообщают группе пациентов, что 90% из тех, кто перенес определенную операцию, живы через пять лет. Эти пациенты с большей вероятностью выберут операцию, чем когда им сообщат, что через пять лет
Шаг 3: Найдите ресурсы 1. Как мы разрабатываем исследовательское предложение, основанное на существующих знаниях для решения критических вопросов?
2. Ключевым моментом здесь является знакомство с тем, что уже сделано по теме, и как наш дизайн может улучшиться или опираться на текущие знания.
3. Выполните систематический поиск литературы, используя составленные вами ключевые слова, и используйте их для поиска книг в каталогах библиотек, блогов или статей в онлайн-базах данных.
4. Консультируйтесь с экспертами и ищите отзывы
Как мы разрабатываем исследовательское предложение, основанное на существующих знаниях для решения критических вопросов?
2. Ключевым моментом здесь является знакомство с тем, что уже сделано по теме, и как наш дизайн может улучшиться или опираться на текущие знания.
3. Выполните систематический поиск литературы, используя составленные вами ключевые слова, и используйте их для поиска книг в каталогах библиотек, блогов или статей в онлайн-базах данных.
4. Консультируйтесь с экспертами и ищите отзывы
В правительственном контексте правильный масштаб и масштаб эксперимента будет определяться тем, что необходимо знать лицам, принимающим решения, в сочетании с различными практическими ограничениями, неизбежно возникающими в процессе проектирования. Чтобы вопрос был MECE, его разные части НЕ МОГУТ перекрываться (взаимоисключающие). Но они должны охватывать ВСЕ возможные причины проблемы (в совокупности).
[Примечание]: В целом, этот шаг поможет нам сделать предложение более взаимоисключающим и всеобъемлющим, МЕСЕ .
К концу этого процесса, в большей степени, чем раньше, мы сможем делать заявления, которые не пересекаются по содержанию и полностью описывают проблему на самом высоком уровне.
Шаг 4: Поиск сотрудничества 1. Убедитесь, что вопрос такой, что другие люди могут его поддержать и поддержать.
2. Заключите соглашения о сотрудничестве и поддержите руководство
3. Рецензирование на ясность, научную точность и осуществимость
4. Есть ли у команды опыт, необходимый для завершения проекта? Если нет, то кто еще должен быть в команде?
Рецензирование на ясность, научную точность и осуществимость
4. Есть ли у команды опыт, необходимый для завершения проекта? Если нет, то кто еще должен быть в команде?
Выяснение проблемы займет время, и это должно быть сделано в консультации с как можно большим количеством сторон, прямо или косвенно потенциально затронутых результатами эксперимента. Прежде чем приступить к этапу определения проблемы, вам следует уделить время обсуждению с коллегами, руководством и другими лицами (экспертами и практиками, текущими пользователями), что именно вы хотите исправить.
Прежде чем переходить к следующему, необходимо выполнить каждый из вышеперечисленных шагов. Однако шаги можно повторить. Например, если вы находитесь на третьем шаге, вы все равно можете вернуться к предыдущему шагу и переопределить проблему.
4.2 Определение вмешательств
Важно четко понимать, что могут и что не могут нам сказать различные экспериментальные планы. Что отличает обсервационные исследования от экспериментальных исследований, так это то, что в эксперименте присутствует компонент вмешательства .
Например, группа занималась поощрением здорового питания в школьных столовых путем стратегического размещения определенных продуктов (вмешательства). Одна из двух обеденных линий была организована таким образом, чтобы демонстрировать более здоровую пищу. Что касается более здоровой пищи, продажи более здоровой пищи увеличились на 18%, а потребляемые граммы менее здоровой пищи уменьшились на 28% (Хэнкс и др. (2012), Здоровое удобство: подталкивание студентов к более здоровому выбору в столовой, Журнал общественного здравоохранения. )
Другая группа сделала что-то подобное и обнаружила, что другие вмешательства, такие как затруднение доступа к еде или замена сервировочной посуды в салат-баре с ложки на щипцы, снижают потребление нездоровой пищи на 8-16% (Rozin et al. (2011)). , Подтолкнуть к благородству I: Незначительные изменения в доступности уменьшают потребление пищи, суждения и принятие решений).
Только некоторые экспериментальные планы полезны для изучения влияния и эффективности вмешательства. Поэтому нам нужно выбрать дизайн, который лучше всего говорит нам, действительно ли наша новая идея имеет значение. Это приближается к контролируемому эксперименту фундаментальной науки.
При разработке плана эксперимента нам нужно подумать о том, как может выглядеть вмешательство (лечение) в нашей программе/операции. Полезно думать о вмешательстве как о шагах, которые помогают нам оценить прямое влияние лечения или профилактических мер на ситуацию.
Поэтому нам нужно выбрать дизайн, который лучше всего говорит нам, действительно ли наша новая идея имеет значение. Это приближается к контролируемому эксперименту фундаментальной науки.
При разработке плана эксперимента нам нужно подумать о том, как может выглядеть вмешательство (лечение) в нашей программе/операции. Полезно думать о вмешательстве как о шагах, которые помогают нам оценить прямое влияние лечения или профилактических мер на ситуацию.
Размышляя о вмешательстве, полезно учитывать два следующих момента:
Решить, что измерять : на примере государственного подрядчика подумайте, какие данные вам потребуются для ответа на ваш ключевой вопрос. В этом случае вам нужно знать количество и стоимость текущих сотрудников, а также процент времени, которое они тратят на необходимые бизнес-функции. Отвечая на этот вопрос, вам, вероятно, придется ответить на множество подвопросов (например, недостаточно ли в настоящее время используются сотрудники? Если да, то какие усовершенствования процессов могли бы помочь?).
Решить, как измерять : думать о том, как вы измеряете свои данные, не менее важно, особенно до этапа сбора данных, потому что ваш процесс измерения либо поддерживает, либо опровергает ваш анализ позже. Ключевые вопросы, которые необходимо задать на этом этапе, включают: — Каков ваш срок? (например, годовые и квартальные затраты) — Какая у вас единица измерения? (например, доллар США по отношению к евро) — Какие факторы следует учитывать? (например, только годовая заработная плата по сравнению с годовой заработной платой плюс расходы на вознаграждения персоналу)
4.3 Определение результатов
При разработке вмешательства также важно определить, что вы хотите измерить и каковы могут быть предполагаемые эффекты.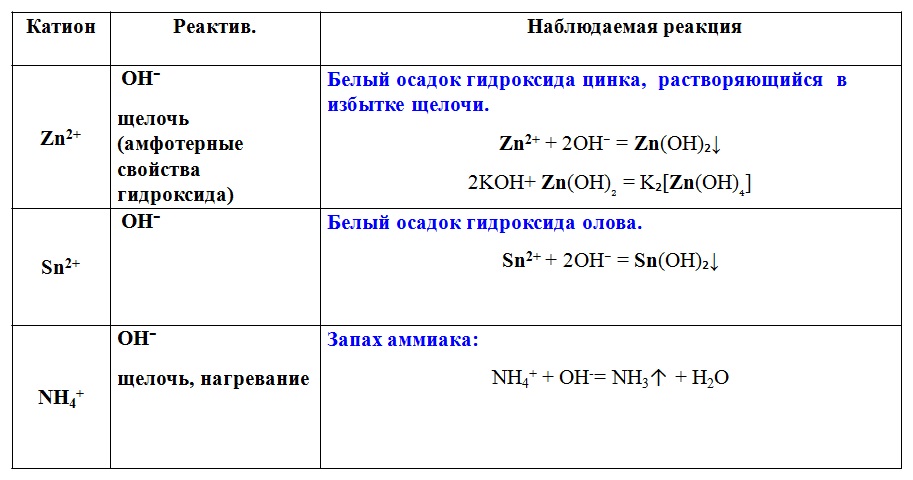 Это покажет, какие данные нам нужно собрать, установить цели и разработать контрмеры. В рамках этого мы хотели бы определить методы, которые нам потребуются для выполнения измерений и использования собранных данных для анализа.
Это покажет, какие данные нам нужно собрать, установить цели и разработать контрмеры. В рамках этого мы хотели бы определить методы, которые нам потребуются для выполнения измерений и использования собранных данных для анализа.
Показатель исхода, конечная точка, показатель эффекта или показатель эффекта – это показатель, который используется для оценки эффекта, как положительного, так и отрицательного, вмешательства или лечения. Меры часто можно количественно оценить с помощью величины эффекта. Их также можно рассматривать как оценку, интерпретацию результатов или, иногда, категоризацию риска для исследовательских групп. Прежде чем приступить к какому-либо вмешательству, мера результата предоставляет исходные данные о переменной.
Также следует отметить, что экспериментальные исследования обычно рандомизированы, то есть испытуемые группируются случайным образом, и мы изучаем, что происходит с людьми в каждой группе (лечебная и контрольная). Любая разница в результатах может быть связана с вмешательством.
Например, в одной старой и довольно известной газете изучалось вмешательство грунтовки в винный магазин. Игра французской или немецкой музыки на заднем плане, по-видимому, значительно повлияла на продажи французских и немецких вин (Север (19).97), Музыка в магазине влияет на выбор продукта, Природа). В этом случае вмешательство применяется случайным образом к одной группе клиентов и не применяется к другой.
Например, хорошо спланированное рандомизированное контрольное исследование (РКИ) дает убедительные доказательства того, что данное вмешательство может постулировать эффективность или безопасность. РКИ лучше всего использовать, когда нам нужно сделать выводы о причинно-следственной связи.
Например, General Electric хотела, чтобы ее сотрудники бросили курить. Команда провела рандомизированное контролируемое исследование, в котором группа лечения получала денежные поощрения за отказ от курения. Контрольная группа не получала стимулов.
Уход на 6 месяцев принес вам 250 долларов, а отказ на 12 месяцев — 400 долларов. В экспериментальной группе показатель успеха был в 3 раза выше, чем в контрольной группе, и этот эффект сохранялся даже после отмены финансовых стимулов.
прекращено через 12 месяцев (Volpp et al. (2009 г.)), Рандомизированное контролируемое исследование финансовых стимулов для отказа от курения, Медицинский журнал Новой Англии).
В экспериментальной группе показатель успеха был в 3 раза выше, чем в контрольной группе, и этот эффект сохранялся даже после отмены финансовых стимулов.
прекращено через 12 месяцев (Volpp et al. (2009 г.)), Рандомизированное контролируемое исследование финансовых стимулов для отказа от курения, Медицинский журнал Новой Англии).
Существуют и другие экспериментальные конструкции, которые будут обсуждаться в Модуле 3.
Это помогает думать о показателях результатов посредством визуализации результатов/прототипов
Наряду с улучшением нашего понимания того, какой экспериментальный дизайн и когда использовать, у экспериментаторов есть возможность улучшить использование различных инструментов в сочетании для более эффективного внедрения инноваций. Прототиперы, например, могут использовать недорогие рандомизированные испытания, такие как A/B-тесты, или гибкие испытания для оценки прототипов продуктов или услуг.
Прототипирование делает акцент на учете рисков и создании решения с более высокими шансами на успех благодаря привлечению заинтересованных сторон. Использование пластиковых кубиков Lego для создания прототипов инженерных изделий — это малозатратный и не требующий больших ресурсов способ сделать очевидными ранние проблемы с эксплуатацией или проектированием. Но он не скажет вам, работает ли новая система в реальной жизни или в масштабе.
Использование пластиковых кубиков Lego для создания прототипов инженерных изделий — это малозатратный и не требующий больших ресурсов способ сделать очевидными ранние проблемы с эксплуатацией или проектированием. Но он не скажет вам, работает ли новая система в реальной жизни или в масштабе.
При разработке прототипов мы должны подумать о вмешательстве для измерения результатов. Для этого нам нужна независимая переменная или фактор, которым манипулируют, изменяют или вмешиваются. Обычно это переменная, которая размещается по оси X при группировке. Нам также нужна зависимая переменная или фактор, который измеряется и обычно размещается на оси Y во время группировки и визуализации.
Например, группа изучила средние пожертвования, полученные, когда участникам (n=159) представили идентифицируемую жертву (девушку по имени Рокия) в сравнении с сухим статистическим обзором
проблема. Наибольшее количество пожертвований было получено только от Rokia, даже больше, чем от комбинации статистики и изображения Rokia (Small et al. (2007), Сочувствие и черствость: влияние
совещательные мысли о пожертвованиях идентифицируемым и статистическим жертвам, организационному поведению и процессам принятия решений человеком).
В этом случае измеряемым результатом здесь являются «пожертвования». Одна группа имеет доступ к Rokia, другая — к статистике, а третья — и к Rokia, и к статистике. Мы можем рассматривать все три как объясняющие или независимые переменные (ось x), а полученное пожертвование как зависящее от них (ось y).
(2007), Сочувствие и черствость: влияние
совещательные мысли о пожертвованиях идентифицируемым и статистическим жертвам, организационному поведению и процессам принятия решений человеком).
В этом случае измеряемым результатом здесь являются «пожертвования». Одна группа имеет доступ к Rokia, другая — к статистике, а третья — и к Rokia, и к статистике. Мы можем рассматривать все три как объясняющие или независимые переменные (ось x), а полученное пожертвование как зависящее от них (ось y).
4.4 План(ы) эксперимента
Следующие концепции будут объяснены более подробно в Модуле 5. Здесь мы даем только краткое описание тем, которые следует учитывать при рассмотрении вопроса о начале эксперимента и управлении экспериментальным проектом. Мы надеемся, что основным выводом будет рассмотрение опыта, необходимого команде экспериментаторов.
Эти концепции помогают, когда мы определяем, возможна ли рандомизация, какие могут быть единица выборки и подход, как может быть создана контрольная группа, а также сколько наблюдений необходимо на основе расчетов мощности.
Рандомизированные эксперименты или квази-экспериментальные планы, иногда изложенные на смертоносном техническом языке, имеют уникальную ценность. Несмотря на их немодный статус среди некоторых специалистов по вопросам политики и оценщиков, мы также подчеркнем ценность и полезность квазиэкспериментальных моделей в следующем модуле. Другие подходы также могут быть пригодны для выяснения разных вещей на разных этапах разработки политического решения.
Независимо от того, какой тип эксперимента мы решили провести, полезно подумать о следующих переменных:
- Контрольная группа — это группа «тестовых» элементов в эксперименте. Контрольная группа будет использоваться для сравнения с экспериментальной группой 90 122.
- Контрольная группа не получает лечение
- Экспериментальная группа — это группа (группы) тестовых заданий, в которые было внесено только одно изменение (называемое экспериментальной или независимой переменной)
- Экспериментальная группа получает лечение
- Экспериментальная группа может иметь зависимые или независимые переменные
В случае, когда реальная контрольная группа недоступна, может быть полезна синтетическая контрольная группа или более изобретательные статистические методы.
Например, команда Behavioral Insights работала с Home Retail Group (50 000 сотрудников и 1079 магазинов в Великобритании) и Charities Trust, чтобы привлечь благотворительные пожертвования с помощью схемы выплаты заработной платы. У них есть программа автоматической эскалации под названием Xtra Factor, которая увеличивает пожертвования на 3% в год. Однако только 10% новых доноров воспользовались ею. Изменив значение по умолчанию для Xtra Factor, чтобы отказаться от новых доноров, доля новых доноры, использующие его, подскочили с 6% до 49% (Группа Behavioural Insights Team (2013 г.), Применение поведенческих данных в благотворительной деятельности).
В другом примере команда изучила влияние уменьшения размера тарелки и предоставления социальных сигналов на потребление пищи на пищевые отходы в ресторанах отелей. Примером последнего является яркий знак с надписью «С возвращением! Очередной раз! И снова! Посетите наш буфет много раз. Это лучше, чем принять много один раз». Оба метода лечения оказались эффективными в изменении пищевого поведения, сокращении пищевых отходов на 20% (Kalbekken (2011), «Подталкивание» гостей отеля к сокращению пищевых отходов как беспроигрышная экологическая мера, Economics Letters).
Также на этом этапе мы определяем, какую информацию мы хотим собирать, устанавливаем временные рамки для сбора данных и определяем методы сбора данных.
Источники ошибок — Помните о константах: условия, которые остаются одинаковыми для контрольной и экспериментальной групп. — Отсутствие учета факторов или параметров, которые остаются одинаковыми как в контрольной, так и в экспериментальной группах, может привести к ошибке. — Ошибка I рода (α) – отклонение истинной нулевой гипотезы ( «ложноположительный результат» обнаружение или заключение, т.е. «осужден невиновный») или нахождение разницы там, где ее нет. — Ошибка II рода (β) — это неотвержение ложной нулевой гипотезы ( «ложноотрицательный» вывод или вывод, например, виновный не осужден) или не обнаружение различия, когда оно действительно существует
Соображения относительно размера выборки Размер выборки измеряет количество отдельных измеренных выборок или наблюдений, использованных в опросе или эксперименте. Например, если вы тестируете 100 человек на наличие COVID, размер вашей выборки составит 100 человек9.0006
Например, если вы тестируете 100 человек на наличие COVID, размер вашей выборки составит 100 человек9.0006
В общем, мы хотим: — Максимальный размер выборки (n): чем больше количество тестовых заданий, тем точнее оценка. — Используйте репрезентативные группы: выборки должны отражать естественную изменчивость населения. — Используйте случайную или систематическую выборку, чтобы уменьшить неотъемлемую погрешность данных.
Для расчета размера выборки нам нужна проверка гипотезы, уровень значимости для проверки, наименьшая величина эффекта (∆), представляющая научный интерес, и предполагаемая мощность (мощность = 1 – β) проверки.
Часто существует программное обеспечение, которое помогает статистикам решить, какой размер и мощность выборки выбрать для набора выборочных наблюдений. В общем:
— Цена увеличения мощности заключается в том, что по мере увеличения стандартного отклонения увеличивается и вероятность ошибки первого рода, потому что
— По мере увеличения размера выборки увеличивается и мощность теста значимости. Это связано с тем, что больший размер выборки сужает распределение тестовой статистики
Это связано с тем, что больший размер выборки сужает распределение тестовой статистики
Статистическая мощность — это мера вероятности того, что исследователь обнаружит статистическую значимость в выборке, если эффект существует во всей совокупности. Мощность зависит от трех основных факторов: размера выборки, размера эффекта, уровня значимости.
4.5 Сбор и анализ данных
На данный момент у нас есть проблема и вмешательство, план исследования и стратегии сбора данных. Поэтому мы готовы приступить к реализации плана эксперимента по сбору данных и последующему их анализу.
Мы можем рассматривать данные как качественные (описательные) или количественные (количественные значения/числа). Прежде чем собирать новые данные, определите, какую информацию можно получить из имеющихся баз данных или источников. Сначала соберите эти данные. Также заранее определите систему хранения и именования файлов, чтобы облегчить совместную работу всех членов рабочей группы. Этот процесс экономит время и не позволяет членам команды собирать одну и ту же информацию дважды. Если вам нужно собрать данные посредством наблюдения или интервью, заранее разработайте шаблон интервью, чтобы обеспечить согласованность и сэкономить время. Храните собранные данные в журнале с датами сбора и добавляйте любые примечания к источникам по ходу работы (включая любую выполненную нормализацию данных). Эта практика подтверждает ваши выводы в будущем.
Этот процесс экономит время и не позволяет членам команды собирать одну и ту же информацию дважды. Если вам нужно собрать данные посредством наблюдения или интервью, заранее разработайте шаблон интервью, чтобы обеспечить согласованность и сэкономить время. Храните собранные данные в журнале с датами сбора и добавляйте любые примечания к источникам по ходу работы (включая любую выполненную нормализацию данных). Эта практика подтверждает ваши выводы в будущем.
Количественные данные представлены в виде чисел, количеств и значений и описывают вещи в конкретных и легко измеримых терминах. Примеры включают количество студентов, подавших заявку на получение гранта, рейтинг, который клиент дал продукту из пяти звезд, и количество раз, которое посетитель провел на веб-сайте.
Качественные данные являются описательными, а не числовыми. Он менее конкретен и менее поддается измерению, чем количественные данные. Эти данные могут содержать описательные фразы и мнения. Примеры включают открытый обзор, который клиент пишет о продукте, ответ на вопрос анкеты о том, какие типы заявок клиент предпочитает заполнять, и беседу заявителя с представителем службы поддержки.
Примеры включают открытый обзор, который клиент пишет о продукте, ответ на вопрос анкеты о том, какие типы заявок клиент предпочитает заполнять, и беседу заявителя с представителем службы поддержки.
Независимо от того, какие данные мы собираем, стратегия проактивного управления данными упростит их хранение, поиск и анализ.
Этап анализа также важен, потому что он превращает необработанные данные в ценную информацию, которую мы можем использовать для улучшения стратегий, продуктов и бизнес-решений. Мы часто можем связать инструменты анализа данных с необработанными данными (например, программное обеспечение Power BI и т. д.), чтобы облегчить анализ. Visio, Nvivo, Minitab, Stata и Microsoft Excel — другие отличные инструменты и программные пакеты для расширенного статистического анализа данных. Цель анализа данных — действительно проверить эффекты вмешательства, которое мы хотели измерить (например, сравнить различия между группами, получившими лечение, и теми, кто его не получил).
Посвятите некоторое время просмотру результатов. Что произошло после того, как вы осуществили вмешательства? Что сработало, что не сработало и что улучшило ваше решение? Проанализируйте, оказали ли ваши действия требуемое влияние и устранили ли вы основные причины проблемы. Также пришло время искать улучшения в решении и планировать постоянный мониторинг. Вы также можете проанализировать, что вы узнали и что еще нужно изучить, когда речь идет о процессах и навыках решения проблем.
Интерпретируя результаты, задайте себе следующие ключевые вопросы:
- Отвечают ли данные на исходный вопрос? Как?
- Помогают ли данные защититься от каких-либо возражений? Как?
- Есть ли какие-то ограничения для выводов, какие-то неучтенные факторы?
После того, как вы обнаружите закономерности и идеи, вы можете начать сообщать о результатах заинтересованным сторонам. Этот шаг также повторяется, потому что, когда вы отчитываетесь, вы можете адаптировать информацию. Путем презентации результатов вы распространяете доказательства того, что идентифицируете ключевые выводы и адаптируете программу/операцию на основе того, что диктуют данные.
Путем презентации результатов вы распространяете доказательства того, что идентифицируете ключевые выводы и адаптируете программу/операцию на основе того, что диктуют данные.
Целью обмена результатами и отчета о процессе перед руководителями является достижение консенсуса, получение дополнительных знаний и разработка лучшего плана реализации.
Советы по решению проблем
Решение проблем — это процесс постоянного улучшения и повторения. Не ждите идеального решения с самого начала или того, что проблема не появится в будущем. Мы должны прилагать усилия, чтобы не избегать проблем, потому что они являются частью процесса обучения. Если вы примете позицию, при которой вы сосредотачиваетесь на поиске решений каждый раз, когда возникают новые проблемы, вы сэкономите себе много времени и стресса.
4.5: Концентрация растворов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 21718
Цели обучения
- Для количественного описания концентрации растворов
Многие люди имеют качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворитель или раствор. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. В химии концентрация раствора — это количество растворенного вещества , которое содержится в определенном количестве растворитель или раствор. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для растворных реакций. Химики используют множество различных методов для определения концентрации, некоторые из которых описаны в этом разделе.
Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (М) определяется как количество молей растворенного вещества, присутствующего ровно в 1 л раствора. Это эквивалентно количеству миллимолей растворенного вещества, присутствующего ровно в 1 мл раствора:
\[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из\: раствора} \label{ 4. 5.1} \]
5.1} \]
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно \(М\). Водный раствор, который содержит 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формулы растворенное вещество представляет собой молярную концентрацию растворенного вещества. Следовательно,
\[[\rm{сахароза}] = 1,00\: M \номер\]
читается как «концентрация сахарозы 1,00 молярная». Отношения между объемом, молярностью и молями могут быть выражены как
\[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \label{4.5.2} \]
или
\[ V_{мл} M_{ммоль/мл} = \cancel{мл} \left( \dfrac{ммоль} {\cancel{мл}} \right ) = ммоль \label{4.5.3} \]
Рисунок \(\PageIndex{1}\) иллюстрирует использование уравнений \(\ref{4.5.2}\) и \(\ref{4.5.3} \).
Рисунок \(\PageIndex{1}\): Приготовление раствора известной концентрации с использованием твердого растворенного веществаПример \(\PageIndex{1}\): Расчет молей по концентрации NaOH
Рассчитайте количество молей натрия гидроксида (NaOH) в 2,50 л 0,100 М NaOH.
Дано: идентичность растворенного вещества, объем и молярность раствора
Запрошено: количество растворенного вещества в молях
Стратегия:
Используйте либо уравнение \ref{4.5.2}, либо уравнение \ref{4.5. 3}, в зависимости от единиц измерения, указанных в задаче.
Решение:
Поскольку нам дан объем раствора в литрах и задано количество молей вещества, уравнение \ref{4.5.2} более полезно:
\( моль\: NaOH = V_L M_{моль/л} = (2,50\: \отменить{L}) \влево(\dfrac{0,100\: моль} {\отменить{L}} \вправо) = 0,250\: моль\: NaOH \)
Упражнение \(\PageIndex{1}\): Расчет молей по концентрации аланина
Рассчитайте количество миллимолей аланина, биологически важной молекулы, в 27,2 мл 1,53 М аланина.
- Ответить
41,6 ммоль
Расчеты с использованием молярности (M): Расчеты с использованием молярности (M), YouTube (opens in new window) [youtu. be]
be]
Концентрации также часто указываются в пересчете на массу (m/m) или на основе отношения массы к объему (m/v), особенно в клинических лабораториях и инженерных приложениях. Концентрация, выраженная в м/м, равна количеству граммов растворенного вещества на грамм раствора; концентрация на основе m/v представляет собой количество граммов растворенного вещества на миллилитр раствора. Каждое измерение можно выразить в процентах, умножив отношение на 100; результат сообщается как процент масс./масс. или процент масс./об. Концентрации очень разбавленных растворов часто выражаются в частей на миллион ( частей на миллион ), что составляет граммы растворенного вещества на 10 6 г раствора, или частей на миллиард ( частей на миллион ), что составляет граммы растворенного вещества на 10 9 г раствора. решение. Для водных растворов при 20°C 1 ppm соответствует 1 мкг на миллилитр, а 1 ppb соответствует 1 нг на миллилитр. Эти концентрации и их единицы приведены в таблице \(\PageIndex{1}\).
| Концентрация | Единицы |
|---|---|
| м/м | г растворенного вещества/г раствора |
| т/х | г растворенного вещества/мл раствора |
| частей на миллион | г растворенного вещества/10 6 г раствора |
| мкг/мл | |
| частей на миллиард | г растворенного вещества/10 9 г раствора |
| нг/мл |
Приготовление растворов
Для приготовления раствора, содержащего определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора. На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на 90 143 меньше, чем на 90 144 желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
На рисунке \(\PageIndex{1}\) показана эта процедура для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворитель не указан. Поскольку растворенное вещество занимает место в растворе, объем необходимого растворителя почти всегда на 90 143 меньше, чем на 90 144 желаемый объем раствора. Например, если желаемый объем равен 1,00 л, было бы неправильно добавлять 1,00 л воды к 342 г сахарозы, поскольку в результате получится более 1,00 л раствора. Как показано на рисунке \(\PageIndex{2}\), для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Пример \(\PageIndex{2}\)
Раствор содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 •2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Какова молярная концентрация \(\ce{CoCl2•2h3O}\)?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей \(\ce{CoCl2•2h3O}\), разделите масса соединения по его молярной массе. Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 •2H 2 O составляет 165,87 г/моль. Следовательно,
\[ моль\: CoCl_2 \cdot 2H_2O = \left( \dfrac{10,0 \: \cancel{g}} {165,87\: \cancel{g} /mol} \right) = 0,0603\: моль \номер \]
Объем раствора в литрах равен
\[ объем = 500\: \cancel{мл} \left( \dfrac{1\: L} {1000\: \cancel{мл}} \right) = 0,500\: L \nonumber \]
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора равна
\[ молярность = \dfrac{0,0603\: моль} {0,500\: L} = 0,121\: M = CoCl_2 \cdot H_2O \номер\]
Упражнение \(\PageIndex{2}\)
Раствор, показанный на рисунке \(\PageIndex{2}\), содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в достаточное количество воды, чтобы получить окончательный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Какова молярная концентрация дихромата аммония?
- Ответить
\[(NH_4)_2Cr_2O_7 = 1,43\: М \номер\]
Чтобы приготовить определенный объем раствора, который содержит указанную концентрацию растворенного вещества, нам сначала необходимо рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении \(\ref{4.5.2 }\). Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в примере \(\PageIndex{3}\).
Пример \(\PageIndex{3}\): Раствор D5W
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0,310 М глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г/моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: масса растворенного вещества
Стратегия:
- Рассчитайте количество молей глюкозы, содержащихся в заданном объеме раствора, умножив объем раствора на его молярность.
- Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала нужно вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\(V_L M_{моль/л} = моль \)
\( 500\: \cancel{mL} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{mL}} \right) \left( \dfrac{0.310\ : моль\: глюкоза} {1\: \cancel{L}} \right) = 0,155\: моль\: глюкоза \)
B Затем мы преобразуем количество молей глюкозы в требуемую массу глюкоза:
\( масса \: of \: глюкоза = 0,155 \: \cancel{mol\: глюкоза} \left( \dfrac{180,16 \: g\: глюкоза} {1\: \cancel{mol\: глюкоза }} \right) = 27,9 \: g \: глюкоза \)
Упражнение \(\PageIndex{3}\)
Другим раствором, обычно используемым для внутривенных инъекций, является физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
- Ответить
2,3 г NaCl
Раствор нужной концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Исходный раствор представляет собой коммерчески приготовленный раствор известной концентрации и часто используется для этой цели. Разбавление маточного раствора предпочтительнее, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества трудно выполнить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из маточного раствора показана на рисунке \(\PageIndex{3}\). Это требует расчета количества молей растворенного вещества, желаемого в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0006
Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет число молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора равно 9.0006
\[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d)\метка{4.5.4} \]
, где индексы s и d указывают запас и разбавленные растворы соответственно. Пример \(\PageIndex{4}\) демонстрирует расчеты, связанные с разбавлением концентрированного маточного раствора.
Рисунок \(\PageIndex{3}\): Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий требуемые моли растворенного вещества (M s ) измеряется в исходном растворе известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки ].
Пример \(\PageIndex{4}\)
Какой объем исходного раствора глюкозы 3,00 М необходим для приготовления 2500 мл раствора D5W в примере \(\PageIndex{3}\)?
Дано: объем и молярность разбавленного раствора
Запрошено: объем исходного раствора раствор по его молярности.
Решение:
A Раствор D5W в примере 4.5.3 представлял собой 0,310 М глюкозу. Начнем с использования уравнения 4.5.4 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\[ моль\: глюкоза = 2500\: \cancel{мл} \left( \dfrac{1\: \cancel{L}} {1000\: \cancel{мл}} \right) \left( \dfrac{0,310\: моль\: глюкоза} {1\: \cancel{L}} \right) = 0 .775\: моль\: глюкоза \номер \]
B Теперь мы должны определить объем 3,00 М маточного раствора, содержащего такое количество глюкозы:
\[объем\: из\: запас\: раствор = 0,775\: \отменить{моль\: глюкоза} \влево( \dfrac{1\: л} {3,00\: \отменить{моль\ : глюкоза}} \справа) = 0,258\: л\: или\: 258\: мл \нечисло \]
При определении необходимого объема исходного раствора мы должны были разделить желаемое число молей глюкозы по концентрации исходного раствора для получения соответствующих единиц. Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный нами ответ имеет смысл: разбавление исходного раствора примерно в десять раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это и происходит (3,00 М → 0,310 М).
Мы также могли бы решить эту задачу за один шаг, решив уравнение 4.5.4 для V s и подставив соответствующие значения:
\[ V_s = \dfrac{( V_d )(M_d )}{M_s } = \dfrac{(2.500\: L)(0.310\: \cancel{M})} {3.00\: \cancel{M}} = 0.258\: L \nonumber \]
Как мы уже отмечали, часто существует более одного правильного способа решения проблемы.
Упражнение \(\PageIndex{4}\)
Какой объем исходного раствора 5,0 М NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
- Ответить
16 мл
Концентрация ионов в растворе
В примере \(\PageIndex{2}\) концентрация раствора, содержащего 90,00 г дихромата аммония в конечном объеме 250 мл, рассчитана как 1,43 М. Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (водн.)\label{4.5.5} \]
Рассмотрим подробнее именно то, что это означает. Дихромат аммония представляет собой ионное соединение, содержащее два NH 9{2-} (водн.)\label{4.5.5} \]
Таким образом, 1 моль формульных единиц дихромата аммония растворяется в воде с образованием 1 моля Cr 2 O 7 2 − анионов и 2 моль катионов NH 4 + (см. рисунок \(\PageIndex{4}\)).
Рисунок \(\PageIndex{4}\): Растворение 1 моль ионного соединения. В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 O 7 дает раствор, содержащий 1 моль Cr 2 O 7 2 − ионов и 2 моль NH 4 + ионов. (Молекулы воды опущены из молекулярного изображения раствора для ясности.) 1 моль дихромата аммония показан в мерной колбе объемом 1 л. Полученная мерная колба справа содержит 1 литр раствора после растворения в воде. Порошкообразная форма бихромата аммония также включена в схему.
При проведении химической реакции с использованием раствора соли, такой как дихромат аммония, важно знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 CR 2 O 7 , затем концентрация CR 2 O 7 2 — также должен быть 1,43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43 M.43. 2 − ион на формульную единицу. Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 M. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 produces three ions when dissolved in water (2NH 4 + + 1Cr 2 O 7 2 − ), the total concentration of ions в растворе 3 × 1,43 M = 4,29 M.
Концентрация ионов в растворе из растворимой соли: концентрация ионов в растворе из растворимой соли, YouTube (opens in new window) [youtu.be]
Пример \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,21 М NaOH
- 3,7 М (СН 3 ) 2 СНОН
- 0,032 М In(NO 3 ) 3
Дано: молярность
Запрошено: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице. — (водн.) \)
— (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0,21 М и [ ОН — ] = 0,21 М.
B Одна формула единицы в IN (№ 3 ) 3 производит один в 3 + Ион и три NO 3 — Ion, So A 0.032 M 2 — Ion, So A A.0032 M.3 M.3.3 M.344444444444444444444444444. 3 раствор содержит 0,032 м в 3 + и 3 × 0,032 М = 0,096 м № 3 — –Т, [в 3 + 13138] = 2031313. − ] = 0,096 М.
− ] = 0,096 М.
Упражнение \(\PageIndex{5}\)
Каковы концентрации всех видов, полученных из растворенных веществ в этих водных растворах?
- 0,0012 М Ba(OH) 2
- 0,17 М Na 2 SO 4
- 0,50 М (CH 3 ) 2 CO, обычно известный как ацетон
Резюме
Концентрации растворов обычно выражаются в молях и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления маточного раствора.
- определение молярности: \[ молярность = \dfrac{моли\: из\: растворенного вещества}{литры\: из\: раствора} = \dfrac{ммоль\: из\: растворенного вещества} {миллилитры\: из \: решение} \номер\]
- связь между объемом, молярностью и молями : \[ V_L M_{моль/л} = \cancel{L} \left( \dfrac{mol}{\cancel{L}} \right) = моли \nonumber \ ]
- связь между объемом и концентрацией основного и разбавленного растворов : \[(V_s)(M_s) = моли\: of\: растворенное вещество = (V_d)(M_d) \номер\]
Концентрация вещества представляет собой количество растворенного вещества, присутствующего в данном количестве раствора.
