Металлы и неметаллы — урок. Химия, 8–9 класс.
Простые вещества по их свойствам делят на металлы и неметаллы.
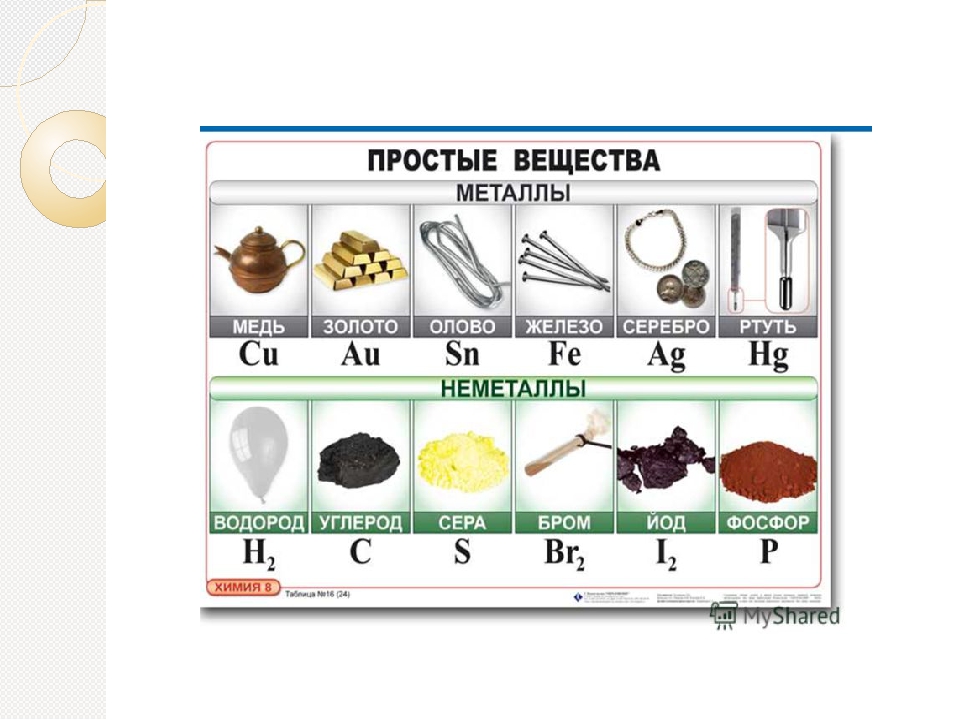
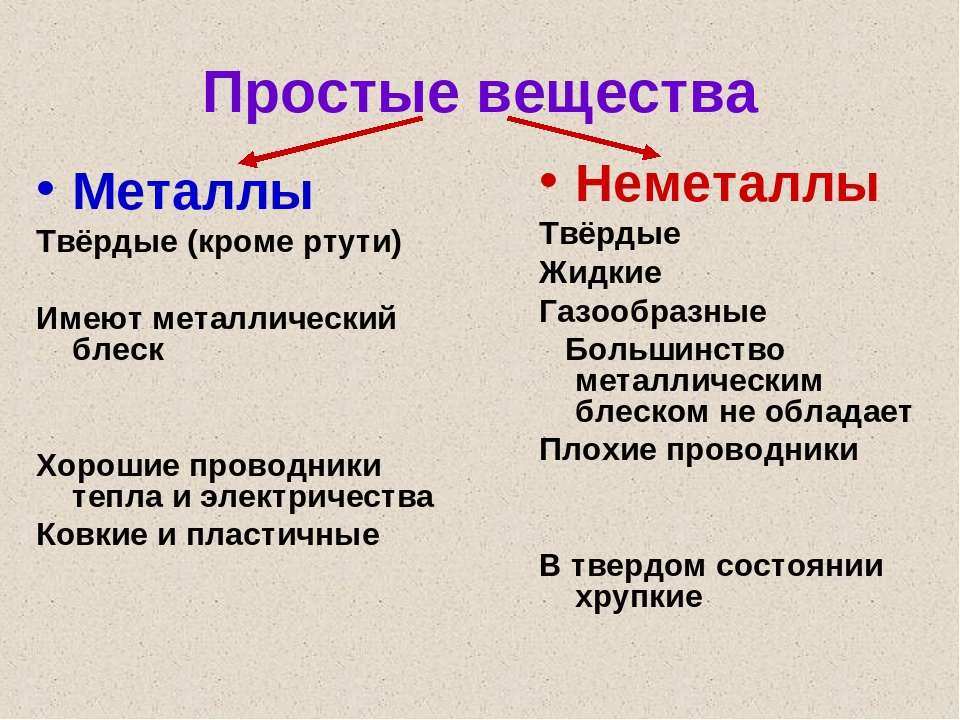
Металлы имеют немолекулярное строение и сходные физические свойства. Все металлы (кроме ртути) при обычных условиях представляют собой твёрдые вещества. Их легко узнать по характерному металлическому блеску. Металлы хорошо проводят тепло и электрический ток.
Ртуть
Алюминий
При ударе металлы не разрушаются, а меняют свою форму, т. е. им характерна пластичность. Металлы можно ковать, прокатывать в листы, вытягивать в проволоку.
Неметаллы не имеют общих физических свойств и не похожи на металлы. У них отсутствует металлический блеск. У большинства неметаллов низкие электропроводность и теплопроводность.
Большинство неметаллов имеет молекулярное строение. Такие вещества при обычных условиях являются газами (водород, кислород, азот, озон, фтор, хлор, инертные газы), жидкостями (бром) или хрупкими легкоплавкими твёрдыми веществами (сера, иод, белый фосфор).
Хлор
Бром
Сера
Некоторые неметаллы имеют немолекулярное строение, например, красный фосфор, кремний, алмаз и графит. Такие вещества твёрдые, тугоплавкие, нелетучие.
Красный фосфор
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы. Химические элементы металлы, образующие простые вещества с металлическими свойствами, располагаются в периодической таблице слева ниже диагонали «водород — бор — кремний — мышьяк — теллур — астат — № \(118\)». Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Вверху справа располагаются химические элементы неметаллы, которые образуют простые вещества с неметаллическими свойствами.
Элементов металлов больше, чем элементов неметаллов. Значит, и простых веществ с металлическими свойствами существует больше, чем с неметаллическими.
Урок по химии 8 класс «Простые вещества
ПЛАН-КОНСПЕКТ УРОКА
Простые вещества — металлы
(Тема урока)
ФИО (полностью)
Антипина Светлана Владимировна
Место работы
МБОУ СОШ №22Г.Балаково, Саратовская область
Должность
Учитель химии
Предмет
химия
Класс
8
Тема и номер урока в теме
Тема «Простые вещества — металлы» урок №1
Базовый учебник
О. С.Габриелян «Химия 8 класс»
С.Габриелян «Химия 8 класс»
Цель урока:
Образовательная цель: сформировать представления о металлах.
Развивающая цель: развить представления о металлах на основе строения атомов металлов и металлической химической связи.
Воспитательная цель: формирование научной картины мира на основе химических элементов – металлов, глобального значения металлов для человечества.
9. Задачи:
— обучающие: повторить особенности строения атомов металлов и виды химической связи, положения их в Периодической таблице, познакомить с общими физическими свойствами металлов, на примере олова дать об аллотропии на примере аллотропных модификаций этого элемента показать относительность деления элементов на металлы и неметаллы;
-развивающие: развитие химического языка, логического мышления, ключевых компетенций;
-воспитательные: представить глобальность металлов для окружающего мира.
Тип урока: урок формирования новых знаний.
Формы работы учащихся: работа в парах, работа с интернет – ресурсами, исследовательская работа.
Необходимое техническое оборудование: компьютер учителя, компьютеры учащихся, мультимедио- проектор, интернет – ресурсы.
Структура и ход урока
Таблица 1.
СТРУКТУРА И ХОД УРОКА
№Этап урока
Название используемых ЭОР
(с указанием порядкового номера из Таблицы 2)
Деятельность учителя
(с указанием действий с ЭОР, например, демонстрация)
Деятельность ученика
Время
(в мин. )
)
1
2
3
5
6
7
1.
Орг.момент
Проверка готовности класса к уроку
Подготавливаются к уроку
1мин.
2.
Анализ контрольной работы
Атомы химических элементов. Молекулы.
Проводит анализ контрольной работы, организуя работу с ЭОР
Работают в парах с ЭОР, выполняют работу над ошибками.
5 минут
3.
Актуализация знаний учащихся
1. Простые вещества металлы.
Проводит фронтальную беседу по вопросам. Задаёт вопросы учащимся
Задаёт вопросы учащимся
1.Сколько электронов на внешнем ЭУ у металлов?
2.Почему атомы металлов стремятся к отдаче электронов?
3. Назовите характерные химические связи металлов.
Выслушивает версии учащихся и организует работу с ЭОР
Отвечают на вопросы педагога.
Работают с ЭОР выводы записывают в тетрадь.
6 минут
4.
Введение новых знаний
2а) Образцы некоторых металлов.
2б) «История открытия металлов»
3. Положение металлов в периодической системе Д.И.Менделеева
4. Общие физические свойства металлов
Создаёт проблемную ситуацию, представляет тему урока.
Может ли человек в век пластмасс прожить без металлов? Сколько металлов вы знаете?
Организует работу с ЭОР
Учитель задаёт вопрос, какое положение должны занимать металлы в периодической системе.
Организует работу с ЭОР
Демонстрация физических свойств (организует работу с учебником)
А) на примере щелочных металлов (определение твёрдости, рассказ учителя об условиях хранения щелочных металлов и мерах безопасности при работе с металлами)
Б)Электоро- и теплороводность металлов (учитель демонстрирует опыт различной теплопроводности Ag, Al, Fe)
В) ковкость и пластичность, тягучесть (демонстрация изделий из алюминия)
Г)Металлический блеск (ювелирные украшения)
Выдвигают гипотезы, предположения, определяют цели урока, работают в парах с ЭОР.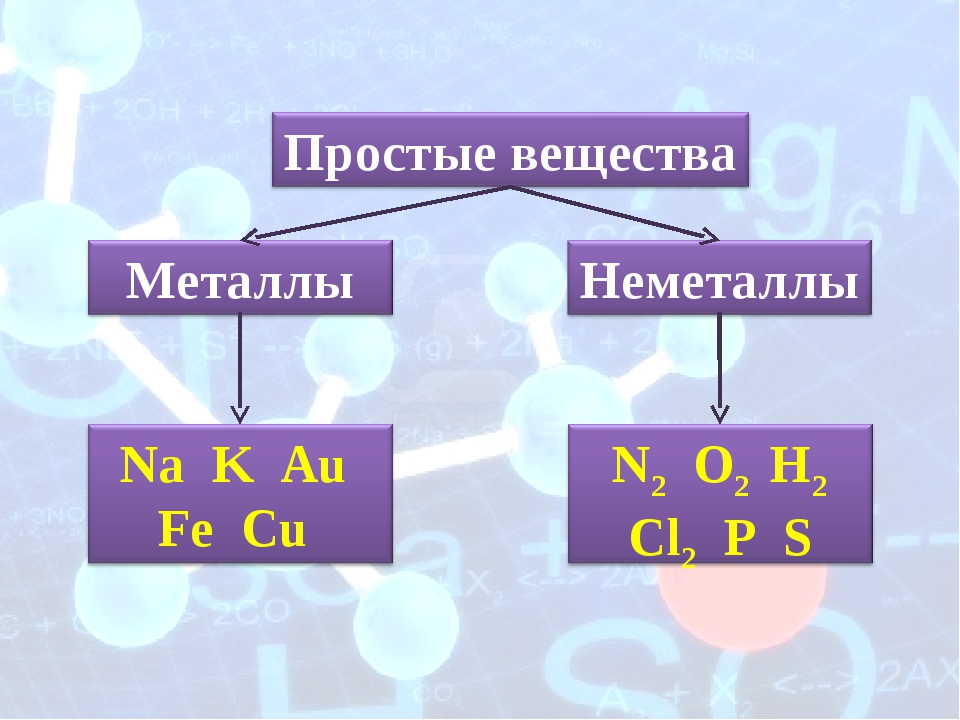
Работают в парах с ЭОР, делают записи в тетрадях.
Делают вывод о высокой активности щелочных металлов, работают с рис.42 стр.71
Лабораторный опыт, результаты записывают в тетрадь.
Сообщения учащихся по теме.
Сообщения учащихся по теме.
5 минут
7 минут
10 минут
5.
Первичное обобщение и систематизация знаний
(физкультминутка)
Проводит тестирование по теме «Металлы»
ФМ для снятия напряжения с мышц туловища I. И.п. — стойка, ноги врозь, руки за голову. 1—5 — круговые движения тазом в одну сторону; 4-6 — то же в другую сторону; 7-8 — руки вниз и расслабленно потрясти кистями.
Повторить 4-6 раз. Темп средний.
II. И.п. — стойка ноги врозь. 1-2 — наклон в сторону, правая рука скользит вдоль ноги вниз, левая, согнутая, вдоль тела вверх; 3-4 — и.п.; 5-8 — то же в другую сторону.
Повторить 5-6 раз. Темп средний.
Организует работу с ЭОР по тесту
Отвечают на вопросы теста.
5 минут
6.
Подведение итогов урока
(рефлексия)
Учитель предлагает учащимся составить синквейн по теме, работают в группах
Составляют синквейн.
4 минуты
7.
Домашнее задание
(дифференцированное)
Учитель комментирует домашнее задание
§13 упр. 3,4,5
Найти в тексте §13 высказывания великих химиков о металлах.
Записывают в дневник
2 минуты
Приложение к плану-конспекту урока
__________________________________________
(Тема урока)
Таблица 2.
ПЕРЕЧЕНЬ ИСПОЛЬЗУЕМЫХ НА ДАННОМ УРОКЕ ЭОР
№Название ресурса
Тип, вид ресурса
Форма предъявления информации (иллюстрация, презентация, видеофрагменты, тест, модель и т.д.)
Гиперссылка на ресурс, обеспечивающий доступ к ЭОР
1
Тесты по теме «Атомы и химические элементы, молекулы»
контрольный
тест
http://www. fcior.edu.ru/card/5264/testy-po-teme-atomy-i-himicheskie-elementy-molekuly.html
fcior.edu.ru/card/5264/testy-po-teme-atomy-i-himicheskie-elementy-molekuly.html
2
Простые вещества металлы
видеофрагмент
http://fcior.edu.ru/card/11249/prostye-veshestva-metally-i-nemetally.html
3
Образцы некоторых металлов
нформационный
иллюстрация
http://files.school-collection.edu.ru/dlrstore/0ab63259-4185-11db-b0de-0800200c9a66/ch08_13_18.jpg
4
История открытия и строение атомов металлов
информационый
видеофрагмент
http://fcior.edu.ru/card/134/istoriya-otkrytiya-i-stroenie-atomov-metallov.html
5
Положение металлов в Периодической системе элементов Д. И. Менделеева
И. Менделеева
информационный
видеофрагмент
http://files.school-collection.edu.ru/dlrstore/0ab60b40-4185-11db-b0de-0800200c9a66/ch08_13_01.swf
6
Особенности строения атомов — металлов
контрольный
тест
http://files.school-collection.edu.ru/dlrstore/0ab60b41-4185-11db-b0de-0800200c9a66/ch08_13_02.swf
________________________________КОНЕЦ ФОРМЫ___________________________
Простые вещества металлы и неметаллы
Модуль состоит из пяти кадров, на которых представлен текст, фотографии, интерактивная схема, иллюстрирующая физические свойства металлов, в интерактивной таблице указано положение металлов и неметаллов в периодической системе химических элементов. В том числе, ученику предлагается просмотреть и прослушать материал представленный в интерактивной схеме, о сущности свойств пластичности, электро- и теплопроводности, у металлов, прослушать легенду о кузнеце, изучить особые свойства некоторых металлов и неметаллов.
В том числе, ученику предлагается просмотреть и прослушать материал представленный в интерактивной схеме, о сущности свойств пластичности, электро- и теплопроводности, у металлов, прослушать легенду о кузнеце, изучить особые свойства некоторых металлов и неметаллов.
Тип: Информационный;
версия: 1.0.0.2 от 24.02.2009
Внимание! Для воспроизведения модуля необходимо установить на компьютере проигрыватель ресурсов.
Категория пользователей
Обучаемый, ПреподавательКласс
8Контактное время
15 минутИнтерактивность
СредняяДисциплины
Химия / Неорганическая химия / Понятия, определения и законы неорганической химии / Состав вещества / Простые и сложные веществаСтатус
Завершенный вариант (готовый, окончательный)Тип ИР сферы образования
Информационный модульМесто издания
МоскваЯзык
РусскийКлючевые слова
простые веществаАвтор
Издатель
Правообладатель
Морозов Михаил Николаевич
Марийский государственный технический университет
Марийский государственный технический университет ГОУВПО
ГОУВПО «Марийский государственный технический университет»
Россия, 424000, Республика Марий Эл, Йошкар-Ола, Ленина пл. , 3,
, 3,
Сайт — http://www.mmlab.ru
Эл. почта — [email protected]
Федеральное агентство по образованию России
Федеральное агентство по образованию России
Россия, 115998, Москва, Люсиновская ул. , 51
, 51
Характеристики информационного ресурса
Тип используемых данных:
application/xml, image/jpeg, image/png, application/x-shockwave-flash, audio/mpeg, text/htmlОбъем цифрового ИР
5 483 187 байтПроигрыватель
OMS-player версии от 1.0Категория модифицируемости компьютерного ИР
открытыйПризнак платности
бесплатныйНаличие ограничений по использованию
есть ограниченияРубрикация
Ступени образования
Основное общее образованиеЦелевое назначение
УчебноеТип ресурса
Открытая образовательная модульная мультимедийная система (ОМС)Классы общеобразовательной школы
8Уровень образовательного стандарта
ФедеральныйХарактер обучения
Базовое§ 14.
 Простые вещества — металлы
Простые вещества — металлы1.
Условие:
Какое из веществ, названных в приведённом ниже стихотворении, не относится к металлам?
Семь металлов создал свет
По числу семи планет:
Медь, железо, серебро…
Дал нам Космос на добро.
Злато, олово, свинец…
Сын мой, сера – их отец.
А ещё ты должен знать:
Всем им ртуть – родная мать.
Решение:
Это сера, она является неметаллом.
Советы:
Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
2.
Условие:
Как понимать приведённые в этом стихотворении образные выражения: «сера – их отец» и «ртуть – родная мать»?
Решение:
Согласно алхимической ртутно-серной теории происхождения металлов, сера и ртуть, соединяясь в различных отношениях, образуют семь металлов: железо, олово, свинец, медь, ртуть, серебро и золото.
Советы:
См. Википедию: — Ртутно-серная теория происхождения металлов, призванная объяснять такие свойства металлов, как блеск, ковкость, горючесть, и обосновывать возможность трансмутации, была создана в конце VIII века арабским алхимиком Джабиром ибн Хайяном. Согласно данной теории, в основе всех металлов лежат два «принципа» — ртуть (философская ртуть) и сера (философская сера). Ртуть является «принципом металличности», сера — «принципом горючести». Сера и ртуть, соединяясь затем в различных отношениях, и образуют семь металлов: железо, олово, свинец, медь, ртуть, серебро и золото.
3.
Условие:
О каком свойстве металлов говорится в начальной строке стихотворения А. С. Пушкина «Кинжал»?
Лемносский бог тебя сковал…
О каком свойстве металлов говорится в строках:
Как адский луч, как молния богов,
Немое лезвие злодею в очи блещет,
И, озираясь, он трепещет
Среди своих пиров…
Решение:
В первой строке стихотворения говорится о ковкости и пластичности металлов, а в следующих строчках говорится о металлическом блеске.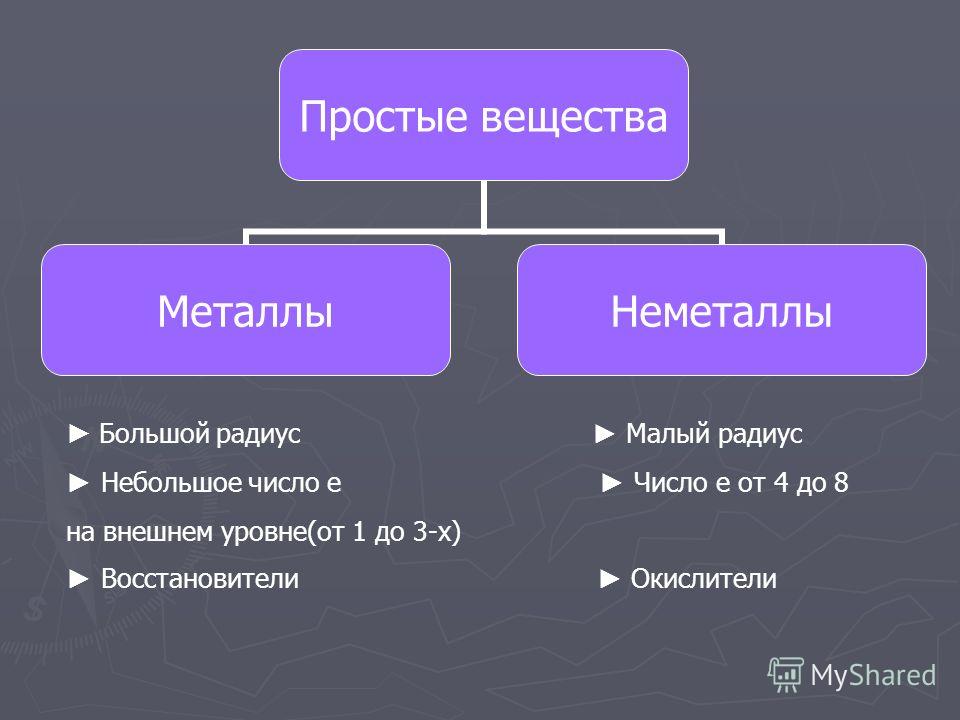
Советы:
Вспомним, что металлам присущи такие свойства как металлический блеск и пластичность.
4.
Условие:
Почему авиакомпаниям запрещено перевозить аппараты и приборы, содержащие ртуть?
Решение:
Потому, что пары ртути оказывают действие токсического характера на организм человека, поэтому, если при перевозке в самолете ртути попадет в места где находятся люди, они могут отравиться её парами.
Советы:
При нормальной температуре ртуть – тяжелая жидкость. Очень ядовиты пары ртути. Если при транспортировке произойдет повреждение прибора содержащего ртуть и она разольется, то ее очень трудно собрать всю, кроме того при перепадах давления на разной высоте испарение ртути может увеличится – это также очень опасно.
5.
Условие:
Пользуясь дополнительной литературой, подготовьте сообщение о появлении зеркал в жизни человека и совершенствовании способов их изготовления.
Решение:
В жизни человека зеркало появилось ещё в древности. Самые ранние зеркала появились около 7500 лет назад в Турции. Конечно, это были не те зеркала, что сейчас есть в каждой квартире и дамской сумочке. Это был до блеска отполированный обсидиан, кусок бронзы или стали. В такие зеркала можно было увидеть только очертания и, конечно, никаких оттенков цвета было практически не разобрать. К тому же, бронзу нужно было постоянно начищать и полировать, так как она окисляется. Более менее современное зеркало появилось к концу 13 века. Джон Пекам предложил новую технику: наносить тонкий слой свинца на стекло. Впервые производить зеркала стали в Венеции и секрет их изготовления ревностно охранялся, зеркальщикам запрещали покидать страну, грозя расправиться с ними и с их родными. Технология изготовления зеркала в этот период была очень сложной. На бумагу накладывалась тонкая оловянная фольга, затем слой ртути, снова бумага и слой ртути, а потом придавливалось стеклом, а бумагу вынимали. Зеркала были невероятно редкими и дорогими, несмотря на то, что были очень мутными.
Самые ранние зеркала появились около 7500 лет назад в Турции. Конечно, это были не те зеркала, что сейчас есть в каждой квартире и дамской сумочке. Это был до блеска отполированный обсидиан, кусок бронзы или стали. В такие зеркала можно было увидеть только очертания и, конечно, никаких оттенков цвета было практически не разобрать. К тому же, бронзу нужно было постоянно начищать и полировать, так как она окисляется. Более менее современное зеркало появилось к концу 13 века. Джон Пекам предложил новую технику: наносить тонкий слой свинца на стекло. Впервые производить зеркала стали в Венеции и секрет их изготовления ревностно охранялся, зеркальщикам запрещали покидать страну, грозя расправиться с ними и с их родными. Технология изготовления зеркала в этот период была очень сложной. На бумагу накладывалась тонкая оловянная фольга, затем слой ртути, снова бумага и слой ртути, а потом придавливалось стеклом, а бумагу вынимали. Зеркала были невероятно редкими и дорогими, несмотря на то, что были очень мутными.
Во времена короля Франции Людовика XIV фирма под названием Сан-Гобен разгадала секрет производства зеркал из Венеции и цены на зеркала резко упали, а уже к 18 веку многие парижане повесили из дома в картинных рамах. Процесс производства зеркал не претерпевал никаких изменений вплоть до середины 19 века. А затем химик Юстэс фон Либих предложил использовать вместо олова серебро для улучшения изображения.
Вообще появление зеркала сыграло большую роль в жизни человека: это дало возможность европейцам видеть себя со стороны и контролировать своё поведение, ухаживать за собой. Сейчас зеркала широко используются в качестве различных дизайнерских решений.
Советы:
Использованы интернет-источники.
Урок по химии в 8 классе на тему «Простые вещества
Золина Ольга Егоровна, учитель химии
Кемеровская область Новокузнецкий район п.Осиновое Плесо
(справка о публикации находится на 2 листе в файле со свидетельством)
Урок химии в 9 классе по Габриеляну. О.С.
О.С.
Разработала: учитель химии МБОУ «Осиноплесская СОШ» Золина Ольга Егоровна
Тема урока: «Простые вещества – металлы».
Цель:1. Расширить знания о классификации и свойствах веществ, познакомиться с общими физическими свойствами металлов.
2. Познакомиться с понятием аллотропия и на примере аллотропных модификаций олова показать относительность деления элементов на группы.
3.Развивать интеллектуальные и познавательные способности учащихся, содействовать воспитанию у них организованности способности к взаимопомощи при работе в малых группах.
Задачи:
Предметные: 1.Активизировать знания учащихся о строении атома, физическом смысле порядкового номера , номера группы , номера периода.
2.Сформулировать знания о металлах , в свободном состоянии присущих им характерных свойствах.
3.Показать зависимость физических свойств металлов от наличия в них металлической связи и особенностей кристаллической решетки.
Личностные: Показать роль химической науки и практики в жизни человека, развитии экономики страны, а так же в изучении истории Кемеровской области.
Метапредметные: 1.Организовывать учебную деятельность, формулировать ответы на вопросы учителя, использовать приемы работы с информацией, соблюдать правила поведения при работе с лабораторным оборудованием в кабинете химии, осваивать приемы исследовательской деятельности, устанавливать причинно – следственные связи.
2.Планировать учебное сотрудничество учебного процесса, владеть монологической и диалогической речью, участвовать в дискуссии, выражать свое мнение аргументировано, составлять план работы с учебником , выполнять задания в соответствии с поставленной целью.
3.Демонстрировать ответственное отношение к обучению, интеллектуальные и творческие способности, проявлять познавательный интерес.
Тип урока: урок открытия новых знаний (лабораторная работа)
Материально-техническое обеспечение:
— компьютер, мультимедийный проектор.
— электронное приложение к учебнику Габриеляна О.С. Химия. 8 класс;
— дидактический материал для обучающихся – Периодическая таблица химических элементов Д. И. Менделеева.
— карточки с заданиями для групповой работы;
Ход урока
1.Орг. момент (1 мин)
2. Повторение особенностей электронного строения атомов металлов. Атомы металлов содержат на внешнем уровне небольшое число электронов (1-3), имеют относительно небольшой радиус атомов (т.к. расположены в начале периодов)
3. Постановка учебной задачи: Учащимся предлагаются посмотреть результаты исследования активных учеников об использовании предметов, изготовленных из металлов, в быту, представленных в виде презентации. Вспомнить физические свойства металлов (из курса физики) и объяснить применение металлов в соответствии с их свойствами.
4. Да тема нашего урока: Простые вещества – металлы. Мы сегодня поговорим о свойствах металлов и их применении.
Учитель предлагает рассмотреть физические свойства металлов по плану:
Агрегатное состояние
Температуры плавления и кипения
Твердость
Плотность металлов
Электро- и теплопроводность
Ковкость, пластичность, прочность
Металлический блеск, непрозрачность, используя в качестве наглядного пособия образцы некоторых металлов (медь, цинк, железо, алюминий, магний и др), плакаты по кристаллическим решеткам металлов, диаграммы электропроводности, температур плавления и др.
Вывод: Общие физические свойства металлов определяются металлической связью и металлической кристаллической решеткой. Известно, что металлы расположены в начале периодов, но общей картины расположения у нас нет, т.к. мы изучали, только главные подгруппы. Обращает внимание ребят на периодическую систему химических элементов и сообщает, если провести диагональ от элемента бора (№5) до элемента астата (№85), то ниже диагонали все элементы являются металлами, а также четные ряды больших периодов состоят из металлов.
5. Первичное закрепление: Задание для учащихся:
Рассмотреть коллекцию металлов и описать агрегатные состояния металлов.
Используя предметные картинки уделить внимание применению металлов в соответствии с их свойствами.
6. Самостоятельная работа: Учащимся предлагается тестовый контроль.
ТЕСТ для контроля.
А. Атомы металлов имеют небольшое (1-3) число электронов на внешнем уровне.
Б. Для металлов характерно два вида связи: ионная и металлическая.
1) верно утверждение А
2) верно утверждение Б
3) Верны утверждения А и Б
4) Оба утверждения неверны
Металл Свойство
А) Ag 1) наиболее легкоплавкий
Б) Pd 2)наиболее электропроводный
В) W 3)наибольшая плотность
Г) Na 4)наибольший блеск
Ответы к тесту:
7. Рефлексия: Какие вопросы мы сегодня рассмотрели на уроке?
Какие из этих вопросов показались наиболее трудными?
Какую оценку вы бы себе поставили за работу на уроке?
Могут ли пригодиться приобретенные знания о металлах в вашей жизни?
8.Д.работа: п.13 № 1-3.
Видеоурок по химии 8 класс тема Простые вещества металлы
00:03:18
Обнаружено блокирование рекламы на сайте
Для существования нашего сайта необходим показ рекламы. Просим отнестись с пониманием и добавить сайт в список исключений вашей программы для блокировки рекламы (AdBlock и другие).
Просим отнестись с пониманием и добавить сайт в список исключений вашей программы для блокировки рекламы (AdBlock и другие).
03:18
Металлы — это химические элементы, атомы которых легко отдают свои внешние электроны, превращаясь в положительные ионы. Как мы знаем, металлические свойства химических элементов в таблице Менделеева увеличиваются справа налево и сверху вниз. На внешнем энергетическом уровне металлов находится от 1 до 3 электронов, металлы образуют кристаллическую решетку с помощью металлической связи.
К физическим свойствам металлов относят твердое агрегатное состояние (кроме ртути — она жидкая), металлический блеск, звон, высокую температуру плавления, различную плотность, серый цвет (кроме Au и Cu), также им присуще явление аллотропии — способность образовывать два вещества.
Следующие уроки
02:49
05:06
05:13
04:44
Металлы и неметаллы разработка урока Сальниковой С.
 И. Декабрь 23rd, 2014 admin
И. Декабрь 23rd, 2014 admin- Класс: 8
- Тема урока: Простые вещества металлы и неметаллы
- Базовый учебник (название, автор): Химия 8 класс Габриелян О.С.
- Цель урока: создать условия для самостоятельной работы учащихся по определению состава и строения простых веществ металлов и неметаллов, изучению их физических свойств с последующим закреплением полученных знаний в виде выполнения упражнений.
- Предполагаемые результаты обучения:
-личностные: постепенно выстраивать собственное целостное мировоззрение,осознавать единство и целостность окружающего мира, возможности его познаваемости и объяснимости на основе достижений науки.
-метапредметные: В диалоге с учителем совершенствовать самостоятельно выработанные критерии оценки. Преобразовывать информацию из одного вида в другой и выбирать удобную для себя форму фиксации и представления информации(составление таблицы), использование различных источников для получения химической информации.
Преобразовывать информацию из одного вида в другой и выбирать удобную для себя форму фиксации и представления информации(составление таблицы), использование различных источников для получения химической информации.
-предметные:определять простые вещества металлы и неметаллы;перечислять отличительные физические свойства металлов и неметаллов; составлять уравнения химических реакций, характеризующих свойства металлов и неметаллов.
- УУД, формируемые (базовые) на уроке :анализировать, сравнивать, классифицировать и обобщать факты и явления. Создавать схематические модели с выделением существенных характеристик объекта.Самостоятельно организовывать учебное взаимодействие в парах, исследуя свойства металлов и неметаллов, описывать простые вещества с помощью химических формул и химических уравнений, составлять опорный конспект.
- Тип урока: изучение нового материала
- Формы работы учащихся: работа с учебником, работа в парах, работа с Интернет-ресурсом
- Необходимое оборудование (дидактическое, техническое, компьютерное):
Учебник, компьютер учителя, проектор, презентация к уроку, Интернет-ресурс
Структура и ход урока
| № | Этап урока | Основной вид деятельности со средствами ИКТ (название используемых ЭОР, действий с ЭОР и интерактивной доской, с указанием порядкового номера из Таблицы 2) | Деятельность преподавателя (функции и виды: организация деятельности по постановке цели, система вопросов, организация урока в деятельностной парадигме, дифференцированный подход, индивидуальная помощь, система контроля, критериальное оценивание, рефлексия и т.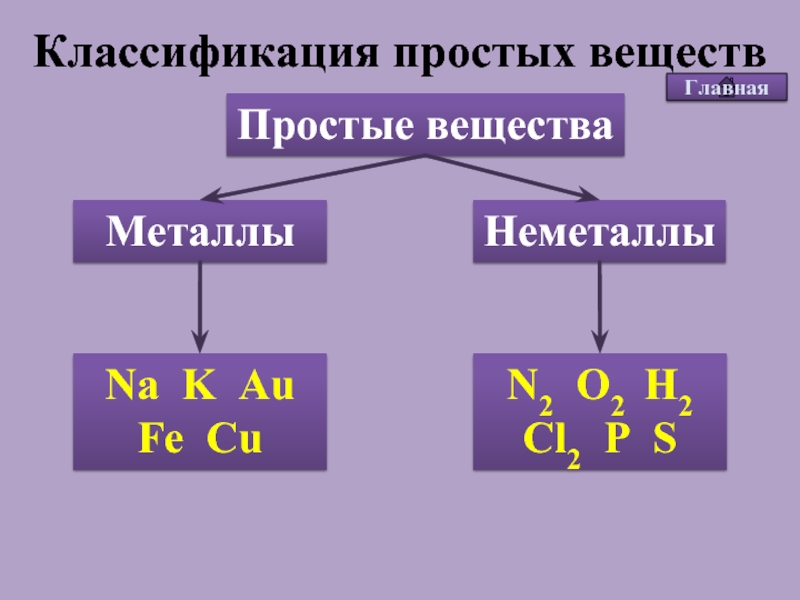 д.) д.)
| Деятельность учащихся (формы и виды) | Время (в мин.)
|
| 1 | Организационный | Слайды презентации Должны знать; должны уметь Домашнее задание | Сообщение плана урока | Слушают план | 2мин |
| 2 | Актуализация знаний учащихся | 1.Простые вещества
2. Моделирование. Химические формулы простых веществ
3.Образцы некоторых металлов и неметаллов
| Беседа. Какие вещества называются простыми? На какие группы делятся все простые вещества?
Как по внешнему виду отличить металл от неметалла? ( Демонстрация металлов и неметаллов).
| Беседа. Отвечают на вопросы
| 8 мин |
| 3 | Изучение нового материала |
Слайды презентации
3. Видеофрагменты: Теплопроводность Температура плавления Ковкость
Основа опорного конспекта на слайде | Знакомит со строением и физическими свойствами металлов и неметаллов. Демонстрация кристаллических решеток металлов и неметаллов Вводит понятия веществ молекулярного и немолекулярного строения Демонстрирует видеофрагменты о физических свойствах металлов и неметаллов
Химические свойства простых веществ.
| Сравнивают физические свойства металлов и неметаллов.
Составляют таблицу, используя полученные сведения из видеофрагментов и слайдов презентации.
Дополняют опорный конспект Выполняют задание стр.81 в.2,3 | 20 мин |
| 4 | Первичное закрепление материала | Дает задания разной уровни сложности из учебника. Дифференцированный подход. Индивидуальная помощь при составлении химических уравнений. | Работа в парах. Выполнение заданий стр.81, в. 4, 5, 6 | 13 мин | |
| 5 | Подведение итогов | Объявляет критерии оценивания работы на уроке | Ученик работает на доске с выполненным заданием в. 6 стр.81. 6 стр.81.Остальные проверяют и подсчитывают число заработанных баллов | 2 мин |
Перечень используемых на данном уроке ЭОР:
Таблица 2
- Создать условия психологически-комфортного микроклимата для каждого обучающегося.
- Обеспечить условия для восприятия и осмысления понятий «металлы» и «неметаллы» посредством нестандартных заданий для самостоятельной работы.
- Обеспечить условия для формирования устойчивого интереса обучающихся к изучаемому предмету, «химического» стиля мышления при обсуждении относительности деления элементов на металлы и неметаллы.
Задачи.
- Воспитательные: способствовать формирования коммуникативных навыков учащихся; навыков работы в паре и группах, личной и коллективной ответственности за результаты работы; проводить рефлексию собственной деятельности; содействовать воспитанию потребности в здоровом образе жизни; возбудить интерес к дальнейшей учебной деятельности, снять напряжение при ответах.

- Метапредметные: обеспечить «ситуацию успеха», создать условия для самореализации личности, развивать у обучающихся способность легко отличать простые вещества от сложных, металлы от неметаллов; развивать умение логически мыслить, сопоставлять, анализировать, делать выводы и умозаключения; продолжить развитие у учащихся навыков работы с различными источниками информации.
- Предметные: создать условия для усвоения понятий «металлы» расширить и углубить химические знания учащихся; содействовать формированию экспериментальных умений и навыков; включить элементы опережающего обучения как базу для более легкого последующего усвоения знаний о строении и свойствах веществ.
Тип урока: урок изучения новых знаний и первичных их закреплений.
Методы урока: частично-поисковый,частично-исследовательский, иллюстративный,эвристический; работа в паре и в группах,тестирование, работа с коллекциями,самоконтроль, взаимоконтроль.
Формы урока: индивидуальная, парная,групповая,фронтальная беседа.
Средства обучения, оборудование: ПСХЭ,коллекции металлов и неметаллов, инструкционные карты, слайд-презентация урока, подготовленная учителем, проектор, компьютер, поддерживающий формат MicrosoftPower Point-2007.
Применяемые технологии: урок построен с использованием здоровьесберегающих технологий, современных информационных технологий – программы MicrosoftPowerPoint. Презентация происходит в виде сменяющихся слайдов. Урок построен на основе личностно-ориентированного подхода в условиях гуманизации обучения.
Планируемые результаты
Урок позволяет создать ситуацию успеха,психологическую комфортную обстановку в учебном процессе, дает возможность, увидеть ученику свои сильные стороны, быть понятым.Личностно-ориентированный подход дает возможность строить учебный процесс на разных уровнях сложности, использовать нетрадиционные формы обучения.
План урока
1. Организационный момент.Вступительное слово учителя.
2. Актуализация темы.
3. Формулировка темы урока.
4. Целеполагание.
5. Изучение нового материала.
6. Заполнение таблицы
7. Первичная проверка понятия материала.
8. Физкультминутка.
9. Литературная разминка
10. Рефлексия.
11. Заключительное слово учителя. Оценка работы обучающихся на уроке.
12. Домашнее задание.
ХОД УРОКА.
Этапы урока | Основное содержание | Деятельность учащихся |
| 1. Оргмомент | Приветствие учащихся | |
2. Актуализация темы Актуализация темы | Чтобы сформулировать тему урока, предлагаю сначала ответить на несколько вопросов. 1. Что такое элемент? На какие две группы делятся все элементы в ПСХЭ? 2. Какие виды химической связи наблюдаются в веществах? 3. Дайте характеристику металла как простого вещества, опираясь на знания из курса физики. Что означает электронная схема элемента? 4.Составить электронную схему следующих элементов: AL. S.CL. | Фронтальная беседа
Работа у доски двух учащихся. |
| 3. Формулировка темы урока | Знания о простых и сложных веществах подводит нас к формулировке темы урока. Но прежде чем записать ее в тетрадь прошу вас отгадать загадку. В одной удивительной и загадочной стране жили два народа. Жители большого народа обладали твердым, но пластичным характером, они были теплы в общении и носили блестящие одежды.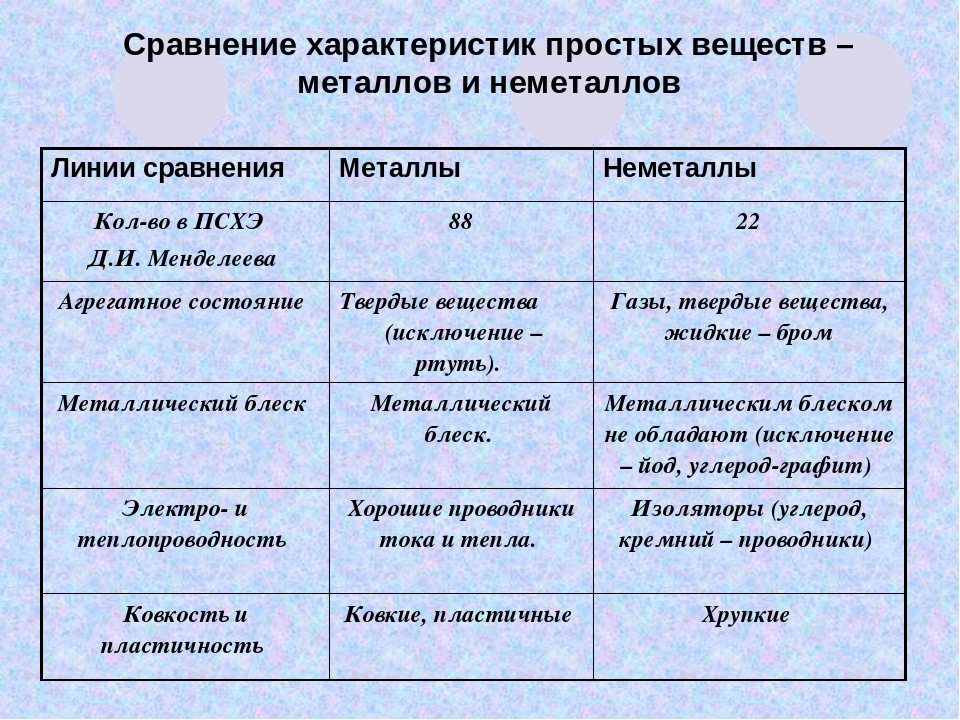 А жители малого народа носили разные одежды, были холодные и хрупкие. Что это за два народа? Какова же тема урока? А жители малого народа носили разные одежды, были холодные и хрупкие. Что это за два народа? Какова же тема урока? | Формулируют тему урока: «Простые вещества – металлы Записывают тему урока в тетради. |
| 4. Целеполагание | Эпиграфом нашего сегодняшнего урока, будут следующие слова: «Сами, трудясь. Вы сделаете все и для близких людей и для себя, а если при труде успеха не будет, неудача – не беда, попробуйте еще» Д.И.Менделеев Я не случайно взяла эти слова. Сегодня вы многое будете делать самостоятельно, сами будете добывать знания. Предлагаю вам сформировать цели урока исходя из темы. Цель урока: Познакомиться с понятием металлы, их физическими свойствами. Выявить отличие металлов от неметаллов .Итак начнем нашу работу с уточнения понятий: металлы – простые вещества, металлы – элементы. Ответим на вопросы . -в яблоках есть железо — в состав ляписа входит серебро — алюминий – легкий металл -степень окисления галлия +3
Выводы записываем в тетрадь. | Формулируют цель урока, исходя из темы: научиться отличать металлы от неметаллов.
Фронтально- воспроизводящая беседа. |
| 5. Изучение новой темы | Великий русский ученый М.В.Ломоносов, которому в этом году исполнилось 301год, определял металл как «твердое, непрозрачное, светлое тело, которое на огне плавить и холодное ковать можно»
Эти свойства относятся к металлам.Что означает термин « металлы»? А какие еще физические свойства характерны для металлов? Послушайте стихотворение о металлах.
Металл – это точность. Металл – это прочность. Скорость, высота, Блеск и красота. Не сразу в дом пришел металл, Не сразу вилкой, ложкой стал И заводной игрушкой Был путь металла долог…
Он в проводах несет нам свет, Металл – коньки, велосипед, Метро, трамвай, будильник, Утюг и холодильник . Многие металлы были известны с глубокой древности.Что это были за металлы? Стр.72 упр.1
Семь металлов создал свет Семь металлов, известные еще в Древнем Египте, считались представителями на Земле семи планет. Вам дано задание, найти металлы, известные еще в древности и соответствующие им планеты. Назовите их? Какое вещество не относят к металлам? Почему?. Вы убедились, что свойства металлов отличаются от свойств остальных веществ. Все металлы обладают рядом общих физических свойств. «Мощь и сила науки во множестве фактов,цель –в обобщении этого множества.» Сейчас вы с помощью раздаточного материала(набора металлов, картин, магнита,воды, планшетов с металлическими предметами) попробуете определить физические свойства металлов, работая в группе. Распределяю учащихся по группам. Выводы запись в тетрадях) — металлы имеют свойства: электро -теплопроводность, ковкость,блеск.звон.магнитизм,твердость Дополнение на слайде. Какой металл самый самый… | Ребята коллективно обсуждают проблему и определяют общие свойства металлов. Учащиеся отвечают с места.
Записывают общие свойства металлов в тетрадь
Работа в .группе По окончании работы – оглашение результатов ответственному в группе. |
| 6. Первичное закрепление понятия материала | Сейчас вам предстоит решить первую контекстную задачу, а именно по описанию угадать, что это за вещество и является ли это вещество металлом . | Работа в группах с информационными текстами по описанию вещества После обсуждения и коллективной работы, отчет каждой группы. |
| 7. Физкультминутка | «Гимнастика для глаз» Вращение глазами по часовой стрелке и обратно. | Делают упражнения для глаз. |
| 8. Литературные ребусы | 1. Корабли меня обходят. Знает лоцман наизусть. Если л на д заменят, То металлом окажусь. (Мель – медь 2. С «ка» – активный я металл, (Калий – галлий. 3. Я металл, меня ты знаешь. (Уран – буран. | Учащиеся все вместе отгадывают ребусы. |
| 9. Рефлексия | Используя новый материал, выполните тестовое задание, каждый индивидуально. После окончания выполнения теста проверьте сами и передайте проверить соседу по парте. Проверяем правильность выполнения тестового задания. Поставьте оценку, согласно критерию: одно задание – два; два задания – три; три задания – четыре; четыре задания – пять. | Индивидуальная работа по выполнению тестового задание. Самопроверка и взаимопроверка теста. |
| 10. Подведение итогов урока | А теперь подумайте и задайте один вопрос, который остался неясным. Почему одни химические элементы образуют простые вещества металлы, а другие не образуют? Для этого нам надо знать еще и химические свойства металлов. А их мы изучим на следующих уроках.
| Ученик задает вопрос. Учащиеся отвечают на вопросы учителя |
| 11. Оценки за работу на уроке | Оценки выставляю за работу на уроке и за выполнение теста. | |
| 12. Домашнее задание | Параграф учебника , подготовить презентации о металлах на выбор: (железо, алюминий, медь, серебро, золото, свинец, олово, натрий, магний, ртуть. |
на Ваш сайт.
7.6: Металлы, неметаллы и металлоиды
- Последнее обновление
- Сохранить как PDF
- Металлы
- Физические свойства металлов
- Химические свойства металлов
- Неметаллы
- Физические свойства неметаллов
- Химические свойства неметаллов
- Металлоиды
- Тенденции в изменении металлических и неметаллических характеристик Атрибуция
Цели обучения
- Чтобы понять основные свойства, отделяющие металлы от неметаллов и металлоидов
Элемент — это простейшая форма материи, которую невозможно разделить на более простые вещества или построить из более простых веществ обычными химическими или физическими методами. Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
Нам известно 118 элементов, из которых 92 встречаются в природе, а остальные были приготовлены искусственно. Элементы далее классифицируются на металлы, неметаллы и металлоиды на основе их свойств, которые коррелируют с их размещением в периодической таблице.
| Металлические элементы | Неметаллические элементы |
|---|---|
| Отличительный блеск (блеск) | Бесцветный, разные цвета |
| Ковкий и пластичный (гибкий) в твердом виде | Хрупкое, твердое или мягкое |
| Проводить тепло и электричество | Плохие проводники |
| Оксиды металлов основные, ионные | Неметаллические оксиды кислотные, ковалентные |
| Образует катионы в водном растворе | Образует анионы, оксианионы в водном растворе |
Металлы
За исключением водорода, все элементы, которые образуют положительные ионы, теряя электроны во время химических реакций, называются металлами. Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Таким образом, металлы являются электроположительными элементами с относительно низкими энергиями ионизации. Они отличаются ярким блеском, твердостью, способностью резонировать со звуком и отлично проводят тепло и электричество. В нормальных условиях металлы являются твердыми телами, за исключением ртути.
Физические свойства металлов
Металлы блестящие, пластичные, пластичные, хорошо проводят тепло и электричество. Другие свойства включают:
- Состояние : Металлы представляют собой твердые вещества при комнатной температуре, за исключением ртути, которая находится в жидком состоянии при комнатной температуре (в жаркие дни галлий жидкий).
- Блеск : Металлы обладают свойством отражать свет от своей поверхности и могут быть отполированы, например, золотом, серебром и медью.
- Ковкость: Металлы обладают способностью противостоять ударам молотком и могут быть превращены в тонкие листы, известные как фольга.
 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле. - Пластичность: Металлы можно втягивать в проволоку. Например, из 100 г серебра можно натянуть тонкую проволоку длиной около 200 метров.
- Твердость: Все металлы твердые, кроме натрия и калия, которые мягкие и поддаются резке ножом.
- Валентность: Металлы обычно имеют от 1 до 3 электронов на внешней оболочке их атомов.
- Проводимость : Металлы являются хорошими проводниками, потому что у них есть свободные электроны. Серебро и медь — два лучших проводника тепла и электричества. Свинец — самый плохой проводник тепла. Висмут, ртуть и железо также являются плохими проводниками
- Плотность : Металлы имеют высокую плотность и очень тяжелые.Иридий и осмий имеют самую высокую плотность, а литий — самую низкую.
- Точки плавления и кипения : Металлы имеют высокие температуры плавления и кипения.
 Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Химические свойства металлов
Металлы — это электроположительные элементы, которые обычно образуют основных или амфотерных оксидов с кислородом.Другие химические свойства включают:
- Электроположительный характер : Металлы имеют тенденцию к низкой энергии ионизации, и обычно теряют электроны (т.е. окисляются ), когда они подвергаются химическим реакциям реакции Обычно они не принимают электроны. Например:
- Щелочные металлы всегда 1 + (теряют электрон в s подоболочке)
- Щелочноземельные металлы всегда 2 + (теряют оба электрона в подоболочке с )
- Ионы переходных металлов не следуют очевидной схеме, 2 + является обычным (теряют оба электрона в подоболочке s ), и также наблюдаются 1 + и 3 +
\ [\ ce {Na ^ 0 \ rightarrow Na ^ + + e ^ {-}} \ label {1. {-}} \ label {1.3} \ nonumber \]
{-}} \ label {1.3} \ nonumber \]
Соединения металлов с неметаллами обычно имеют ионную природу . Большинство оксидов металлов являются основными оксидами и растворяются в воде с образованием гидроксидов металлов :
\ [\ ce {Na2O (s) + h3O (l) \ rightarrow 2NaOH (aq)} \ label {1.4} \ nonumber \]
\ [\ ce {CaO (s) + h3O (l) \ rightarrow Ca (OH) 2 (aq)} \ label {1.5} \ nonumber \]
Оксиды металлов проявляют свою основную химическую природу, реагируя с кислотами с образованием солей металла и воды:
\ [\ ce {MgO (s) + HCl (водн.) \ Rightarrow MgCl2 (водн.) + H3O (l)} \ label {1.{2 -} \), следовательно, \ (Al_2O_3 \).
Пример \ (\ PageIndex {2} \)
Вы ожидаете, что он будет твердым, жидким или газообразным при комнатной температуре?
Решения
Оксиды металлов обычно твердые при комнатной температуре
Пример \ (\ PageIndex {3} \)
Напишите вычисленное химическое уравнение реакции оксида алюминия с азотной кислотой:
Решение
Оксид металла + кислота -> соль + вода
\ [\ ce {Al2O3 (s) + 6HNO3 (водн.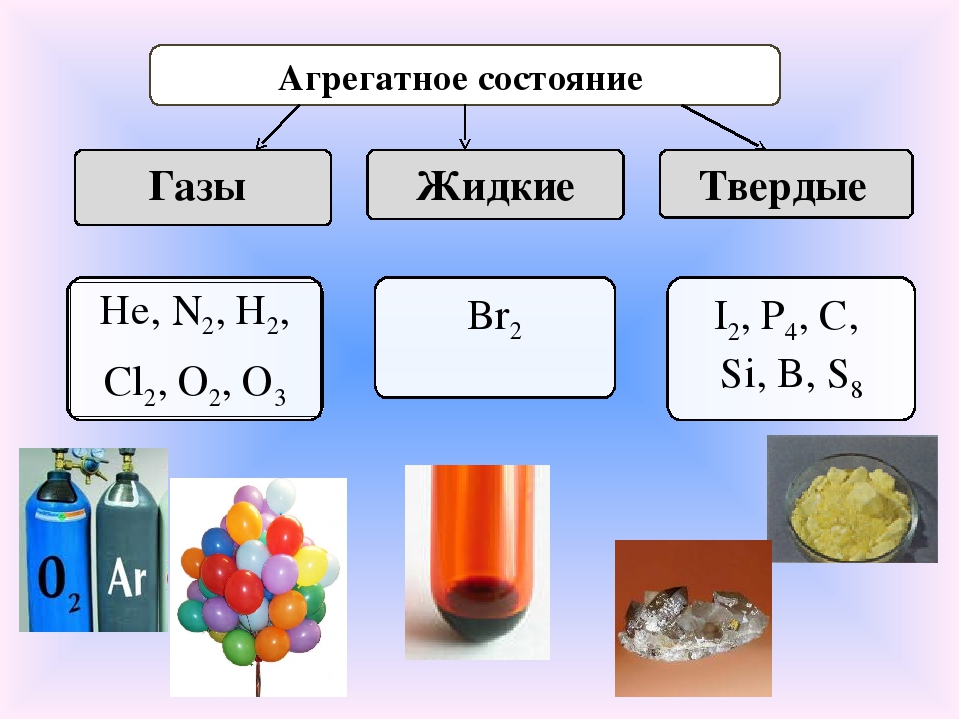 ) \ Rightarrow 2Al (NO3) 3 (водн.) + 3h3O (l)} \ nonumber \]
) \ Rightarrow 2Al (NO3) 3 (водн.) + 3h3O (l)} \ nonumber \]
Неметаллы
Элементы, которые стремятся получить электроны с образованием анионов в ходе химических реакций, называются неметаллами.Это электроотрицательные элементы с высокими энергиями ионизации. Они не блестящие, хрупкие и плохо проводят тепло и электричество (кроме графита). Неметаллы могут быть газами, жидкостями или твердыми телами.
Физические свойства неметаллов
- Физическое состояние : Большинство неметаллов существует в двух из трех состояний вещества при комнатной температуре: газах (кислород) и твердых телах (углерод). Только бром существует в жидком виде при комнатной температуре.
- Не податливый и ковкий : Неметаллы очень хрупкие, их нельзя свернуть в проволоку или растолочь в листы.
- Электропроводность : Они плохо проводят тепло и электричество.
- Блеск: Они не имеют металлического блеска и не отражают свет.

- Точки плавления и кипения : Точки плавления неметаллов на обычно на ниже, чем у металлов, но сильно варьируются.
- Семь неметаллов существуют при стандартных условиях в виде двухатомных молекул : \ (\ ce {h3 (g)} \), \ (\ ce {N2 (g)} \), \ (\ ce {O2 (g) } \), \ (\ ce {F2 (g)} \), \ (\ ce {Cl2 (g)} \), \ (\ ce {Br2 (l)} \), \ (\ ce {I2 ( s)} \).
Химические свойства неметаллов
Неметаллы имеют тенденцию получать электроны или делиться электронами с другими атомами. Они имеют электроотрицательный характер. Неметаллы, вступая в реакцию с металлами, имеют тенденцию приобретать электроны (обычно , достигая электронной конфигурации благородного газа) и превращаясь в анионы:
\ [\ ce {3Br2 (l) + 2Al (s) \ rightarrow 2AlBr3 (s)} \ nonumber \]
Соединения, полностью состоящие из неметаллов, являются ковалентными веществами.Обычно они образуют кислые или нейтральные оксиды с кислородом, который растворяется в воде с образованием кислот:
\ [\ ce {CO2 (г) + h3O (l)} \ rightarrow \ underset {\ text {углекислота}} {\ ce {h3CO3 (aq)}} \ nonumber \]
Как вы, возможно, знаете, газированная вода имеет слабую кислотность (угольная кислота).
Оксиды неметаллов могут соединяться с основаниями с образованием солей.
\ [\ ce {CO2 (г) + 2NaOH (водн.) \ Rightarrow Na2CO3 (водн.) + H3O (l)} \ nonumber \]
Металлоиды
Металлоиды обладают промежуточными свойствами между металлами и неметаллами.Металлоиды используются в полупроводниковой промышленности. Все металлоиды твердые при комнатной температуре. Они могут образовывать сплавы с другими металлами. Некоторые металлоиды, такие как кремний и германий, могут действовать как электрические проводники при определенных условиях, поэтому их называют полупроводниками. Кремний, например, выглядит блестящим, но не является ни ковким, ни пластичным ( хрупким, — характеристика некоторых неметаллов). Это гораздо более слабый проводник тепла и электричества, чем металлы.Физические свойства металлоидов, как правило, металлические, но их химические свойства, как правило, неметаллические. Степень окисления элемента этой группы может варьироваться от +5 до -2, в зависимости от группы, в которой он находится.
| Металлы | Неметаллы | Металлоиды |
|---|---|---|
| Золото | Кислород | Кремний |
| Серебро | Углерод | Бор |
| Медь | Водород | Мышьяк |
| Утюг | Азот | Сурьма |
| Меркурий | Сера | Германий |
| цинк | фосфор |
Тенденции в металлическом и неметаллическом характере
Металлический характер является наиболее сильным для элементов в самой левой части периодической таблицы и имеет тенденцию к уменьшению при движении вправо в любой период (неметаллический характер усиливается с увеличением значений электроотрицательности и энергии ионизации). Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Внутри любой группы элементов (столбцов) металлический характер увеличивается сверху вниз (значения электроотрицательности и энергии ионизации обычно уменьшаются по мере продвижения вниз по группе). Эта общая тенденция не обязательно наблюдается с переходными металлами.
Авторы и ссылки
Элементы, соединения и смеси
Элементы, Составы и смеси
Элементы
Известно любое вещество, содержащее только один вид атома. как элемент .Потому что атомы не могут быть созданы или разрушаются в химической реакции, такие элементы, как фосфор (P 4 ) или сера (S 8 ) не может быть разбита на более простые веществами этими реакциями.
Пример: вода разлагается на смесь водорода и
кислород, когда через жидкость пропускают электрический ток.
С другой стороны, водород и кислород нельзя разложить на
более простые вещества. Следовательно, они элементарные, или
простейшие, химические вещества — элементы.
Каждый элемент представлен уникальным символом. Обозначение для каждого элемента можно найти в периодической таблице элементов.
Элементы можно разделить на три категории, которые имеют характерные свойства: металлы, неметаллы и полуметаллы. Большинство элементов — это металлы, которые находятся слева и ближе к внизу периодической таблицы. Горстка неметаллов сгруппированы в верхнем правом углу периодической таблицы. В полуметаллы можно найти по разделительной линии между металлы и неметаллы.
Атомы
Элементы состоят из атомов, самые маленькие частица, обладающая любым из свойств элемента. Джон Дальтон в 1803 г. предложил современную теорию атома, основанную на следующие предположения.
1. Дело составлено атомов, которые неделимы и неразрушимы. |
2. |
3. Атомы различных элементов имеют разный вес и разные химические свойства. |
4. Атомы различных элементов объединяйте в простые целые числа, чтобы образовать соединения. |
5. Атомы не могут быть созданы или уничтожен. Когда соединение разлагается, атомы восстановлен без изменений. |
Соединения
Элементы объединяются в химические соединения, которые часто разделены на две категории.
Металлы часто реагируют с неметаллами с образованием ионных соединений . Эти соединения состоят из положительных и отрицательных ионов, образованных путем добавления или вычитания электронов из нейтральных атомов и молекулы.
Неметаллы объединяются друг с другом, образуя ковалентную форму соединения , которые существуют в виде нейтральных молекул.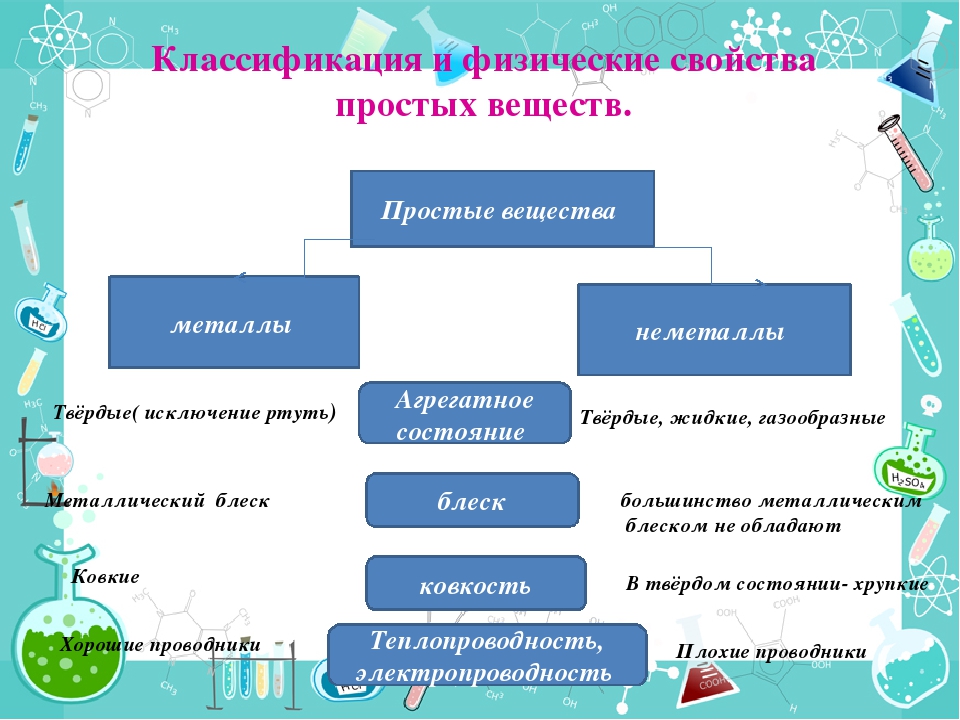
Сокращенное обозначение соединения описывает количество атомов каждого элемента, что обозначено нижним индексом, написанным после символа элемента.По соглашению, нижний индекс не используется. записывается, когда молекула содержит только один атом элемента. Таким образом, вода — это H 2 O, а диоксид углерода — это CO 2 .
Характеристики Ионные и ковалентные соединения
Ионный Соединения | Ковалентные соединения | |
Содержит положительные и отрицательные ионы (Na + Cl — ) | Существуют как нейтральные молекулы (C 6 H 12 O 2 ) | |
Твердые вещества такие как поваренная соль (NaCl (s) ) | Твердые, жидкие или газы (C 6 H 12 O 6 (с) , H 2 O (л) , CO 2 (г) ) | |
Высокая точки плавления и кипения | Нижняя плавка и
точки кипения (т. | |
Сильный сила притяжения между частицами | Относительно слабое усилие притяжения между молекулами | |
Отдельно в заряженные частицы в воде, чтобы получить раствор, который проводит электричество | Остаться той же молекулы в воде и не будет проводить электричество | |
Определение наличия Соединение ионное или ковалентное
Рассчитайте разницу между электроотрицательностями
два элемента в соединении и среднее их
электроотрицательности, и найти пересечение этих значений на
рисунок, показанный ниже, чтобы помочь определить, является ли соединение ионным
или ковалентные, или металлические.
| Практическая задача 1: Для каждое из следующих соединений, предскажите, будете ли вы можно ожидать, что он будет ионным или ковалентным. (а) оксид хрома (III), Cr 2 O 3 (б) четыреххлористый углерод, CCl 4 (в) метанол, CH 3 OH (г) фторид стронция, SrF 2 Нажмите здесь чтобы проверить свой ответ на практическую задачу 1 |
| Практическая задача 2: Использование следующие данные, чтобы предложить способ различения между ионными и ковалентными соединениями.
Нажмите здесь, чтобы проверить свой ответ на практическую задачу 2 |
Формулы
Молекула — самая маленькая частица, имеющая любой из свойства соединения.Формула молекулы должна быть нейтральный. При написании формулы ионного соединения заряды на ионах должны уравновешиваться, количество положительных зарядов должно равняться количеству отрицательных зарядов.
Примеры:
| CaCl 2 | Сбалансированная формула имеет 2 положительных заряда (1 кальций ион с +2 зарядом) и 2 отрицательных заряда (2 хлорида ионы с зарядом -1) |
| Al 2 (SO 4 ) 3 | Сбалансированная формула имеет 6 положительных зарядов (2 алюминиевых ионы с зарядом +3) и 6 отрицательных зарядов (3 сульфатных ионов с зарядом -2) |
Смеси Vs. Соединения
Соединения
Закон постоянного состава гласит, что соотношение по массе элементов в химическом соединении равно всегда одинаково, независимо от источника соединения. В закон постоянного состава может использоваться, чтобы различать соединения и смеси элементов: Соединения имеют постоянный состав; смеси не . Вода всегда 88,8% O и 11,2% H по весу, независимо от его источника. Латунь — это пример смеси двух элементов: меди и цинка.Может содержат всего 10% или 45% цинка.
Еще одно отличие соединений и смесей элементов это легкость, с которой можно разделить элементы. Смеси, такие как атмосфера, содержат два или более веществ, которые относительно легко разделить. Отдельные компоненты смеси могут быть физически отделены друг от друга.
Химические соединения сильно отличаются от смесей:
элементы в химическом соединении могут быть разделены только
уничтожение соединения.Некоторые различия между химическими
соединения и смеси элементов иллюстрируются
следующий пример с использованием изюмных отрубей и «Криспикс. ».
».
Изюмовые отруби имеют следующие характерные свойства смеси .
- Крупа не имеет постоянного состава; то соотношение изюма и хлопьев из отрубей меняется от образца к образец.
- Легко физически разделить два «элементы», чтобы выбрать изюм, для пример, и съесть их отдельно.
Crispix обладает некоторыми характерными свойствами соединения .
- Соотношение рисовых хлопьев и кукурузных хлопьев постоянно; Это составляет 1: 1 в каждой выборке.
- Нет возможности разделить «элементы» не разрывая узы, скрепляющие их.
металл | Определение, характеристики, типы и факты
Металл , любой из класса веществ, характеризующихся высокой электрической и теплопроводностью, а также пластичностью, пластичностью и высокой отражательной способностью света.
Британская викторина
27 вопросов, ответственных за истину или ложь, из самых сложных викторин «Британника»
Что вы знаете о Марсе? Как насчет энергии? Думаете, будет проще, если вам придется выбирать только истину или ложь? Узнайте, что вы знаете о науке, с помощью этой увлекательной викторины.
Примерно три четверти всех известных химических элементов — металлы.Наиболее распространенными разновидностями в земной коре являются алюминий, железо, кальций, натрий, калий и магний. Подавляющее большинство металлов находится в рудах (минеральных веществах), но некоторые из них, такие как медь, золото, платина и серебро, часто встречаются в свободном состоянии, потому что они не вступают в реакцию с другими элементами.
Металлы обычно представляют собой твердые кристаллические вещества. В большинстве случаев они имеют относительно простую кристаллическую структуру, отличающуюся плотной упаковкой атомов и высокой степенью симметрии.Обычно атомы металлов содержат менее половины полного набора электронов в своей внешней оболочке. Из-за этой характеристики металлы не склонны образовывать соединения друг с другом. Однако они легче соединяются с неметаллами (например, кислородом и серой), которые обычно имеют более половины максимального количества валентных электронов. Металлы сильно различаются по своей химической активности. Наиболее реакционноспособными являются литий, калий и радий, тогда как низкоактивными являются золото, серебро, палладий и платина.
Металлы сильно различаются по своей химической активности. Наиболее реакционноспособными являются литий, калий и радий, тогда как низкоактивными являются золото, серебро, палладий и платина.
Высокая электрическая и теплопроводность простых металлов (то есть непереходных металлов периодической таблицы) лучше всего объясняется с помощью теории свободных электронов. Согласно этой концепции, отдельные атомы в таких металлах потеряли свои валентные электроны в твердом теле, и эти свободные электроны, вызывающие проводимость, перемещаются как группа по всему твердому телу. В случае более сложных металлов (то есть переходных элементов) проводимость лучше объясняется зонной теорией, которая учитывает не только наличие свободных электронов, но также их взаимодействие с так называемыми d электронами.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подпишись сейчас Механические свойства металлов, такие как твердость, способность противостоять повторяющимся нагрузкам (усталостная прочность), пластичность и пластичность, часто приписывают дефектам или несовершенствам их кристаллической структуры. Например, отсутствие слоя атомов в его плотно упакованной структуре позволяет металлу пластически деформироваться и предотвращает его хрупкость.
Например, отсутствие слоя атомов в его плотно упакованной структуре позволяет металлу пластически деформироваться и предотвращает его хрупкость.
Свойства металлов Урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в периодической таблице — металлы.
Металлы находятся в центре и в левой части таблицы Менделеева. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок по науке о металлах
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части.Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоидами ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапинах или полировке.
- Ковкость: Металлы прочные, но податливые, а это значит, что их можно легко согнуть или придать форму.На протяжении веков кузнецы могли формировать металлические предметы, нагревая металл и ударяя по нему молотком. Если бы они попробовали это с неметаллами, материал бы лопнул! Большинство металлов также пластичны, , что означает, что их можно вытягивать для изготовления проволоки.
- Электропроводность: Металлы отлично проводят электричество и тепло. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это, используя некоторые предметы домашнего обихода.
 Продолжайте читать, чтобы узнать, как это сделать!)
Продолжайте читать, чтобы узнать, как это сделать!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, являются твердыми при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реакционная способность : Некоторые металлы подвергаются химическому изменению (реакции) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они содержатся. Калий и натрий являются наиболее химически активными металлами. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не вступают в реакцию с другими металлами.Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и проводки.
Пять групп металлов:
Благородные металлы встречаются как чистые металлы, потому что они не вступают в реакцию и не соединяются с другими элементами с образованием соединений. Поскольку они настолько инертны, они не подвержены коррозии. Это делает их идеальными для украшений и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реактивны. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было разрезать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы находятся в соединениях с множеством различных минералов. Они менее реактивны, чем щелочные металлы, а также тверже и имеют более высокие температуры плавления. В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах.Они твердые и блестящие, прочные и легко поддаются форме.
Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Poor Metals довольно мягкие, и большинство из них не используются сами по себе. Однако они становятся очень полезными при добавлении к другим веществам. Бедные металлы включают алюминий, галлий, олово, таллий, сурьму и висмут.
Сплавы: сильные комбинации
Свойства этих разных металлов можно комбинировать, смешивая два или более из них вместе.Полученное вещество называется сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковороды, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко поддаются форме и красивы на вид. Бронза также часто используется в судостроении, поскольку она устойчива к коррозии в морской воде.
Бронза также часто используется в судостроении, поскольку она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Кроме того, он очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото, как чистый металл, настолько мягкое, что при изготовлении ювелирных изделий оно всегда смешивается с другим металлом (обычно серебром, медью или цинком).Чистота золота измеряется в карат . Самое чистое, что вы можете получить в ювелирных изделиях, — это 24 карата, что составляет около 99,7% чистого золота. Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное для ювелирных украшений, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды — это горные породы или минералы, из которых можно извлечь ценное вещество — обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и боксит (алюминий).Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и боксит (алюминий).Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов переработки железа из руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода, обеспечиваемого сильфонами. Углерод и кислород, включая кислород в руде, соединяются и покидают железо. Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды.Его можно нагреть и выковать из кованого железа .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции происходит отделение железа от кислорода в руде. Этот «чугун» необходимо дополнительно перемешать, чтобы получить кованое железо. Его также можно использовать для другой важной цели: при нагревании углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Этот «чугун» необходимо дополнительно перемешать, чтобы получить кованое железо. Его также можно использовать для другой важной цели: при нагревании углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Учитывая этот процесс, неудивительно, что железо не использовалось примерно до 1500 года до нашей эры. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а легированная бронза, как полагают, была открыта шумерами около 3500 г. до н.э. Но алюминий, один из важнейших металлов в современном мире, не был открыт до 1825 года нашей эры и не использовался широко до 20 века!
Коррозия: процесс и предотвращение
Вы когда-нибудь видели кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже с отверстиями, вызванными коррозией? Это происходит, когда кислород (обычно из воздуха) вступает в реакцию с металлом.Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такому виду химического разрушения или коррозии .
Когда кислород вступает в реакцию с металлом, он образует оксид на поверхности металла. Для некоторых металлов, например алюминия, это хорошо. Оксид обеспечивает защитный слой, который предохраняет металл от дальнейшей коррозии.
С другой стороны, у чугуна и стали возникнут серьезные проблемы, если их не обработать для предотвращения коррозии.Красноватый оксидный слой, который образуется на железе или стали при реакции с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая большую часть металла коррозии, пока металл в конечном итоге не проедает.
Один из распространенных способов защиты железа — это покрытие его специальной краской, которая препятствует взаимодействию кислорода с металлом под краской. Другой способ — это цинкование : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе вступают в реакцию с цинком, образуя слой карбоната цинка, который защищает от коррозии. Посмотрите вокруг своего дома, двора и гаража, чтобы найти примеры коррозии, а также гальванизации и других средств защиты металла от ржавчины.
Посмотрите вокруг своего дома, двора и гаража, чтобы найти примеры коррозии, а также гальванизации и других средств защиты металла от ржавчины.
Технологии: фейерверки и химия
Если вы посмотрите фейерверк Четвертого июля, то увидите прекрасные сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ — химия. Более длинный включает в себя обзор свойств металлов.
Одним из основных ингредиентов петард, наземных и воздушных фейерверков (взрывающихся в небе) является черный порошок , изобретенный китайцами около 1000 лет назад.Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порошок смешивают с металлическими порошками и другими химическими соединениями в форме, которая будет гореть медленно, сверху вниз. В простых ракетах-фейерверках черный порох удерживается в трубке вокруг взрывателя. При зажигании порошок создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем заставляя соединения внутри него взорваться в воздухе.
В простых ракетах-фейерверках черный порох удерживается в трубке вокруг взрывателя. При зажигании порошок создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем заставляя соединения внутри него взорваться в воздухе.
Более сложные снаряды для фейерверков запускаются из миномета, трубы с черным порохом, которая при зажигании вызывает реакцию взрыва. Запал фейерверка зажигается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда вызывает взрыв его зарядов со специальными эффектами.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения представляют собой маленькие шарики, называемые звезды , сделанные из того же соединения, что и бенгальский огонь.
Металлы в качестве красителей
Различные металлы горят разными цветами; например, если горит соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным цветом, а калий горит пурпурным. В фейерверках металлы комбинируются для создания разных цветов.
Кальций горит красным цветом, а калий горит пурпурным. В фейерверках металлы комбинируются для создания разных цветов.
Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы испускают световую энергию. Этот свет делится на две категории: лампы накаливания и люминесценции. Накаливание — это свет, возникающий при нагревании: в фейерверках химически активные металлы, такие как алюминий и магний, при нагревании вызывают вспышку очень яркого света — иногда при температуре выше 5000 ° F!
Менее реактивные соединения не нагреваются до такой степени, что искры становятся тусклее. Люминесценция , с другой стороны, возникает из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они возвращаются на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам светящийся зеленый цвет, а хлорид меди — синий. Для любого типа света важно использовать чистые ингредиенты, поскольку следы других соединений будут затемнять цвет.
Для любого типа света важно использовать чистые ингредиенты, поскольку следы других соединений будут затемнять цвет.
Дополнительная литература по металлам:
открытых учебников | Сиявула
Математика
Наука
- Читать онлайн
Учебники
Английский
Класс 7A
Марка 7В
Класс 7 (вместе A и B)
Африкаанс
Граад 7А
Граад 7Б
Граад 7 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 8A
Марка 8Б
Оценка 8 (вместе A и B)
Африкаанс
Граад 8А
Граад 8Б
Граад 8 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 9А
Марка 9Б
Оценка 9 (комбинированные A и B)
Африкаанс
Граад 9А
Граад 9Б
Граад 9 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Класс 4A
класс 4Б
Класс 4 (вместе A и B)
Африкаанс
Граад 4А
Граад 4Б
Граад 4 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
Марка 5A
Марка 5Б
Оценка 5 (комбинированные A и B)
Африкаанс
Граад 5А
Граад 5Б
Граад 5 (A en B saam)
Пособия для учителя
- Читать онлайн
Учебники
Английский
класс 6А
Марка 6Б
Класс 6 (комбинированный A и B)
Африкаанс
Граад 6А
Граад 6Б
Граад 6 (A en B saam)
Пособия для учителя
Наша книга лицензионная
Эти книги не просто бесплатные, они также имеют открытую лицензию! Один и тот же контент, но разные версии (брендированные или нет) имеют разные лицензии, как объяснялось:
CC-BY-ND (фирменные версии)
Вам разрешается и поощряется свободное копирование этих версий. Вы можете делать копии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Вы можете делать копии, распечатывать и распространять их сколько угодно раз. Вы можете скачать их на свой мобильный телефон, iPad, ПК или флешку. Вы можете записать их на компакт-диск, отправить по электронной почте или загрузить на свой веб-сайт. Единственное ограничение заключается в том, что вы не можете адаптировать или изменять эти версии учебников, их содержание или обложки каким-либо образом, поскольку они содержат соответствующие бренды Siyavula, логотипы спонсоров и одобрены Департаментом базового образования. Для получения дополнительной информации посетите Creative Commons Attribution-NoDerivs 3.0 Непортированный.
Узнайте больше о спонсорстве и партнерстве с другими организациями, которые сделали возможным выпуск каждого из открытых учебников.
CC-BY (версии без бренда)
Эти небрендированные версии одного и того же контента доступны для вас, чтобы вы могли делиться ими, адаптировать, трансформировать, модифицировать или дополнять их любым способом, с единственным требованием — дать соответствующую оценку Siyavula. Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Для получения дополнительной информации посетите Creative Commons Attribution 3.0 Unported.
Извините! — Страница не найдена
Пока мы разбираемся, возможно, вам поможет одна из ссылок ниже.
Дома Назад- Класс
- Онлайн-тесты
- Ускоренный онлайн-курс JEE
- Двухлетний курс по JEE 2021
- Класс
- Онлайн-курс NEET
- Серия онлайн-тестов
- CA Foundation
- CA Средний
- CA Финал
- Программа CS
- Класс
- Серия испытаний
- Книги и материалы
- Тестовый зал
- Умный взломщик BBA
- Обучение в классе
- Онлайн-коучинг
- Серия испытаний
- Взломщик Smart IPM
- Книги и материалы
- GD-PI
- CBSE, класс 8
- CBSE, класс 9
- CBSE, класс 10
- CBSE, класс 11
- CBSE, класс 12
- Обучение в классе
- Онлайн-классы CAT
- Серия испытаний CAT
- MBA Жилой
- Умный взломщик CAT
- Книги и материалы
- Онлайн-классы без CAT
- Серия испытаний без CAT
- Тестовый зал
- GD-PI
- Обучение в классе
- Серия испытаний
- Интервью с Civils
- Класс
- Онлайн-классы
- Серия испытаний SSC
- Переписка
- Практические тесты
- Электронные книги SSC
- SSC JE Study Package
- Класс
- RBI класс B
- Банк испытаний серии
- Переписка
- Банковские электронные книги
- Банк ПДП
- Онлайн-коучинг
- Обучение в классе
- Серия испытаний
- Книги и материалы
- Класс
- Программа моста GRE
- GMAT Онлайн-коучинг
- Консультации по приему
- Консультации по GMAT
- Стажировка
- Корпоративные программы
- Студенты колледжа
- Рабочие специалисты
- Колледжи
- школы
Частей Периодической таблицы
Группа 2A (или IIA ) периодической таблицы — щелочные
земные металлы : бериллий (Be), магний (Mg), кальций (Ca),
стронций (Sr), барий (Ba) и радий (Ra). Они тяжелее и
менее реакционноспособен, чем щелочные металлы Группы 1А. Имя приходит
из-за того, что оксиды этих металлов давали основные растворы
при растворении в воде, и они оставались твердыми при температурах
доступный древним алхимикам. Подобно элементам Группы 1А,
щелочноземельные металлы слишком реактивны, чтобы их можно было найти в природе в их элементальная форма.
Они тяжелее и
менее реакционноспособен, чем щелочные металлы Группы 1А. Имя приходит
из-за того, что оксиды этих металлов давали основные растворы
при растворении в воде, и они оставались твердыми при температурах
доступный древним алхимикам. Подобно элементам Группы 1А,
щелочноземельные металлы слишком реактивны, чтобы их можно было найти в природе в их элементальная форма.
Щелочноземельные металлы имеют два валентных электрона на орбиталях самых высоких энергий. ( нс 2 ).Они меньше, чем щелочные металлы того же периода и, следовательно, имеют более высокую энергию ионизации. В большинстве случаев щелочноземельные металлы ионизируются. для формирования заряда 2+.
Щелочноземельные металлы имеют гораздо более высокие температуры плавления, чем щелочные металлы.
металлы: бериллий плавится при 1287 ° C, магний при 649 ° C, кальций при 839 ° C,
стронций при 768 ° C, барий при 727 ° C и радий при 700 ° C. Они есть
более твердые металлы, чем элементы Группы 1А, но мягкие и легкие
по сравнению со многими переходными металлами.
Они есть
более твердые металлы, чем элементы Группы 1А, но мягкие и легкие
по сравнению со многими переходными металлами.
Соли металлов группы 2А менее растворимы в воде, чем соли металлов Группа 1А из-за более высокой плотности заряда на катионах 2+; тем не менее, многие соли Группы 2А, по крайней мере, умеренно растворимы. Некоторые соли группы 2A прочно связываются с молекулами воды и кристаллизуются в виде гидратов ; среди них соль Эпсома, MgSO 4 7H 2 O и гипс, CaSO 4 2H 2 О.
Бериллий (Be, Z = 4).
Бериллий — серебристо-белый мягкий металл. Его название происходит от
греческое слово, обозначающее минерал берилл, beryllo . Он находится в
земная кора с концентрацией 2,6 частей на миллион, что делает ее 47-м по величине
обильный элемент. Первичные руды
бериллия являются бериллами [силикат бериллия-алюминия, Be 3 Al 2 (SiO 3 ) 6 ]
и бертрандит [гидроксид силиката бериллия, Be 4 Si 2 O 7 (OH) 2 ]. Бериллы ювелирного качества включают изумруды и аквамарин; зеленый цвет
из этих драгоценных камней происходит из следовых количеств хрома.
Бериллы ювелирного качества включают изумруды и аквамарин; зеленый цвет
из этих драгоценных камней происходит из следовых количеств хрома.
Из-за небольшого размера и высокой плотности заряда бериллий связывает через ковалентную связь вместо ионной связи. Элементаль бериллий очень инертен по отношению к воздуху и воде даже при высоких температуры.
Из бериллия делают окна для рентгеновских трубок (это прозрачны для рентгеновских лучей) и используется в сплавах с другими металлами, такими как медь и никель, для изготовления искробезопасных инструментов и часовых пружин. Бериллий также используется в оболочках для ядерного оружия и в ядерной энергетике. электростанции из-за его способности отражать нейтроны. Бериллий накапливается в костях; длительное воздействие бериллия приводит к воспаление легких и одышка (состояние, называемое бериллиозом).
Магний (Mg, Z = 12).
Магний — серебристо-белый относительно мягкий металл. Название элемента происходит от
Магнезия, район в Фессалии в центральной Греции.Он находится в
земная кора с концентрацией 2,3%, что делает ее 7-й по величине
обильный элемент. Большое количество магния также присутствует в
минералы в мантии Земли. Его получают из морской воды, карналита.
[MgKCl 3 6H 2 O], доломит
[смесь карбоната кальция и магния, CaMg (CO 3 ) 2 ],
и магнезит [карбонат магния, MgCO 3 ].
Название элемента происходит от
Магнезия, район в Фессалии в центральной Греции.Он находится в
земная кора с концентрацией 2,3%, что делает ее 7-й по величине
обильный элемент. Большое количество магния также присутствует в
минералы в мантии Земли. Его получают из морской воды, карналита.
[MgKCl 3 6H 2 O], доломит
[смесь карбоната кальция и магния, CaMg (CO 3 ) 2 ],
и магнезит [карбонат магния, MgCO 3 ].
Магний, легированный алюминием и следами других металлов, используется в автомобилестроение и авиастроение; магниевые сплавы также используются в других легкие устройства, такие как лестницы, фотоаппараты, велосипедные рамы, жесткий диск диски и т. д.Магний окисляется легче, чем железо, и используется в расходных анодах для защиты железных труб и других структуры, которые легко подвержены коррозии.
Магний горит на воздухе бриллиантом.
белое пламя,
и используется в фейерверках и зажигательных бомбах. (Это было
используется в одноразовых лампах-вспышках, но это использование было вытеснено другими
виды освещения.) Магниевые костры ставить очень сложно
наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с
азот с образованием нитрида магния (Mg 3 N 2 ) и
с водой для получения гидроксида магния и газообразного водорода.
(Это было
используется в одноразовых лампах-вспышках, но это использование было вытеснено другими
виды освещения.) Магниевые костры ставить очень сложно
наружу, так как даже в отсутствие воздуха горящий магний вступает в реакцию с
азот с образованием нитрида магния (Mg 3 N 2 ) и
с водой для получения гидроксида магния и газообразного водорода.
Магний содержится в ряде знакомых соединений. Магний
оксид MgO используется в огнеупорных кирпичах, которые способны
выдерживает высокие температуры в каминах и печах (магний
оксид плавится при 2800 ° С). Гептагидрат сульфата магния, MgSO 4 7H 2 O,
более известная как английская соль, это
миорелаксант и легкое слабительное. Гидроксид магния, Mg (OH) 2 ,
также известное как молоко магнезии, является слабительным и антацидным средством.
(«Молоко» в «молоке магнезии» относится к тому факту, что, поскольку магний
гидроксид плохо растворяется в воде, он имеет тенденцию к образованию мелового белого
суспензия, внешне похожая на молоко, но значительно отличающаяся
физиологические эффекты. )
)
Зеленые растения содержат молекулу, называемую хлорофилл, состоящий из плоского кольца атомов углерода и азота с большим открытым пространством посередине, в котором связан ион магния, удерживается на месте атомами азота.В Молекула хлорофилла поглощает солнечный свет, и в процессе фотосинтез, энергия света преобразуется в химическую энергия, которую завод может использовать для питания множества процессов.
В органической химии магний реагирует с бромалканами
(углеводороды, содержащие связи углерод-бром) с образованием магнийорганических соединений
реактивы Гриньяра (в честь их первооткрывателя Виктора
Гриньяр, лауреат Нобелевской премии по химии 1912 г.).Эти соединения чрезвычайно полезны при формировании
новый углерод-углерод
связи, и часто используются в синтезе органических соединений. Реагенты Гриньяра, как известно, чувствительны к воде, поэтому необходимо соблюдать осторожность.
приняты для того, чтобы аппарат, в котором протекает реакция
выполняется очень сухо.
Кальций (Ca, Z = 20).
Кальций — относительно мягкий металл серебристого цвета. Название элемента происходит от латинское слово, обозначающее лайм, calx .Он находится в земная кора с концентрацией 4,1%, что делает ее 5-й по величине обильный элемент. Основными источниками кальция являются кальцит и известняк. [карбонат кальция, CaCO 3 ], ангидрит [кальций сульфат, CaSO 4 ], гипс [дигидрат сульфата кальция, CaSO 4 2H 2 O], и доломит [смесь карбоната кальция и магния, CaMg (CO 3 ) 2 ].
Соли кальция образуют твердые части тела большинства живых существа, из раковин морских организмов и кораллов кораллов рифы (в виде кальция карбонат, CaCO 3 ) к костям и зубам наземных жителей существа (в виде гидроксиапатита кристаллы, Ca 3 (PO 4 ) 2 ] 3 Ca (OH) 2 ).
Поскольку кальций образует такие твердые минералы, он полезен в строительстве
материалы, такие как штукатурка, раствор и цемент. Строительный раствор изготавливается из оксида кальция, CaO, также известного как известь или негашеная известь. Когда оксид кальция обрабатывается водой, он образует гидроксид кальция,
Ca (OH) 2 , или гашеная известь, поглощающая углекислый газ из
воздух и постепенно образует карбонат кальция, CaCO 3 .
Известь, нагретая водородом в кислороде, горит ярко-белым.
свет, который можно сфокусировать в узкий луч, видимый на большом
расстояния.Такое освещение использовалось в маяках, в
съемку, а в театрах ставить софиты (оставив актера «в
в центре внимания »).
Строительный раствор изготавливается из оксида кальция, CaO, также известного как известь или негашеная известь. Когда оксид кальция обрабатывается водой, он образует гидроксид кальция,
Ca (OH) 2 , или гашеная известь, поглощающая углекислый газ из
воздух и постепенно образует карбонат кальция, CaCO 3 .
Известь, нагретая водородом в кислороде, горит ярко-белым.
свет, который можно сфокусировать в узкий луч, видимый на большом
расстояния.Такое освещение использовалось в маяках, в
съемку, а в театрах ставить софиты (оставив актера «в
в центре внимания »).
Хлорид кальция — это расплывчатый (он поглощает достаточно воды из воздух, который растворяется в растворе), и используется для удаления влаги с воздуха в сырых подвалах. (Потребуется более сильный человек что я сопротивляюсь называть только что открытую коробку хлорида кальция, не вёл себя должным образом как «несовершеннолетний расплывающийся организм».»)
«Жесткая вода» содержит растворенные минералы, имеющие 2+ или 3+ заряда,
такой как кальций и магний; эти соли вызывают некоторые мыла и
моющие средства для выпадения в осадок в виде «мыльной пены»; эти минералы выпадают в осадок
со временем образует «накипь» в воде
обогреватели и кастрюли.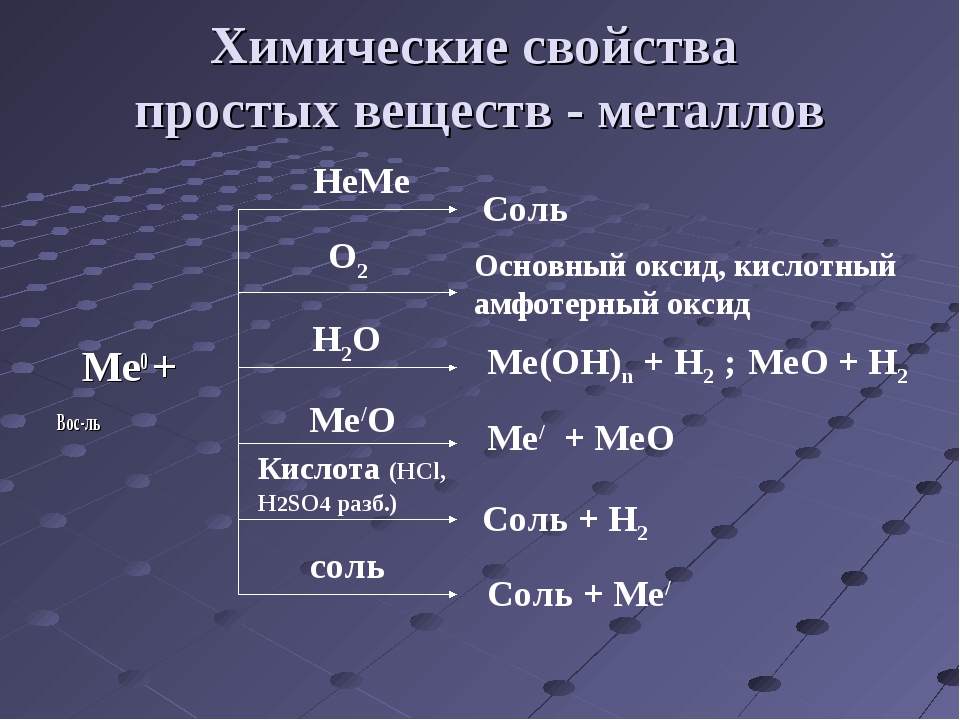 Кальций можно удалить водой
смягчители, которые обменивают ионы кальция на ионы натрия, которые имеют
1+ и не выпадают в осадок.
Кальций можно удалить водой
смягчители, которые обменивают ионы кальция на ионы натрия, которые имеют
1+ и не выпадают в осадок.
Стронций (Sr, Z = 38).
Стронций — блестящий, относительно мягкий металл. Название элемента происходит от Стронтиан, город в Шотландии, где добывали минерал стронтианит. открыли, из которого впервые был выделен стронций. Он находится в земная кора с концентрацией 370 ppm, что делает ее 16-м по величине обильный элемент. Встречается в рудах целестита [стронция сульфат, SrSO 4 ] и стронцианит [карбонат стронция, SrCO 3 ].
Соли стронция при нагревании дают ярко-красный цвет и являются
по этой причине используется в фейерверках и ракетах. Радиоактивный
стронций-90 (бета-излучатель) образуется при ядерных взрывах; поскольку
химически похож на кальций, он включается в кости
у людей, которые подвергаются этому. Стронций-90 — бета-излучатель,
и препятствует производству красных кровяных телец.
Барий (Ba, Z = 56).
Барий — блестящий мягкий металл. Название элемента происходит от греческое слово barys , что означает «тяжелый», применительно к высокая плотность некоторых минералов бария. Он находится в земная кора с концентрацией 500 ppm, что делает ее 14-й по величине обильный элемент. Он содержится в рудах барита [сульфат бария, BaSO 4 ] и витерит [карбонат бария, BaCO 3 ].
Барий был обнаружен в 1500-х годов в виде «болонских камней» (ныне известных как барий сульфат, BaSO 4 ), обнаруженный недалеко от Болоньи, Италия. Эти камни светились при свете, а также при нагревании. Соли бария при нагревании приобретают зеленый цвет и используются в фейерверк (в виде нитрата бария, Ba (NO 3 ) 2 ).
Сульфат бария, BaSO 4 , ядовит, но это так
нерастворим в том, что он проходит через тело до всасывания
барий может иметь место. Используется при диагностике некоторых
кишечные проблемы в виде «бариевых клизм»: сульфат бария
непрозрачен для рентгеновских лучей и может использоваться для рентгена пищеварительной системы
тракт.
Используется при диагностике некоторых
кишечные проблемы в виде «бариевых клизм»: сульфат бария
непрозрачен для рентгеновских лучей и может использоваться для рентгена пищеварительной системы
тракт.
Радий (Ra, Z = 88).
Радий — мягкий, блестящий, радиоактивный металл. Имя элемента произошло от латинского слова «луч», radius , из-за его способность светиться в темноте слабым голубым светом.Он находится в земной коры в концентрации 0,6 ppt (частей на триллион), что делает ее 84-й элемент по распространенности. Он содержится в следовых количествах в урановые руды, но коммерчески используемый радий легче получить из отработавшее ядерное топливо.
Радий был открыт
Пьера и Марии Кюри в 1898 году; они добыли миллиграмм радия
из трех тонн урановой руды. Радий производится в
радиоактивный распад урана-235, урана-238, тория-232 и
плутоний-241.После его открытия и до опасностей
радиация, радий использовался во многих шарлатанских лекарствах и
патентованные лекарства. Радий использовался для изготовления светящихся в темноте часов
лица в начале 1900-х годов; альфа-частицы, испускаемые радием
ударил частицы сульфида цинка, заставив их светиться, но остановился
по корпусу часов по стеклу в циферблате. Многие из
рабочие, рисовавшие эти циферблаты, заболели или умерли от
лучевая болезнь.
Радий использовался для изготовления светящихся в темноте часов
лица в начале 1900-х годов; альфа-частицы, испускаемые радием
ударил частицы сульфида цинка, заставив их светиться, но остановился
по корпусу часов по стеклу в циферблате. Многие из
рабочие, рисовавшие эти циферблаты, заболели или умерли от
лучевая болезнь.
Список литературы
Джон Эмсли, Элементы , 3-е издание. Оксфорд: Clarendon Press, 1998.
Джон Эмсли, Строительные блоки природы: Путеводитель по элементам от А до Я . Оксфорд: Оксфордский университет Пресс, 2001.
Дэвид Л. Хейзерман, Исследование Химические элементы и их соединения . Нью-Йорк: TAB Книги, 1992.
.

 Какие физические свойства металлов вам известны?
Какие физические свойства металлов вам известны? К какому типу относятся данные реакции?
К какому типу относятся данные реакции?
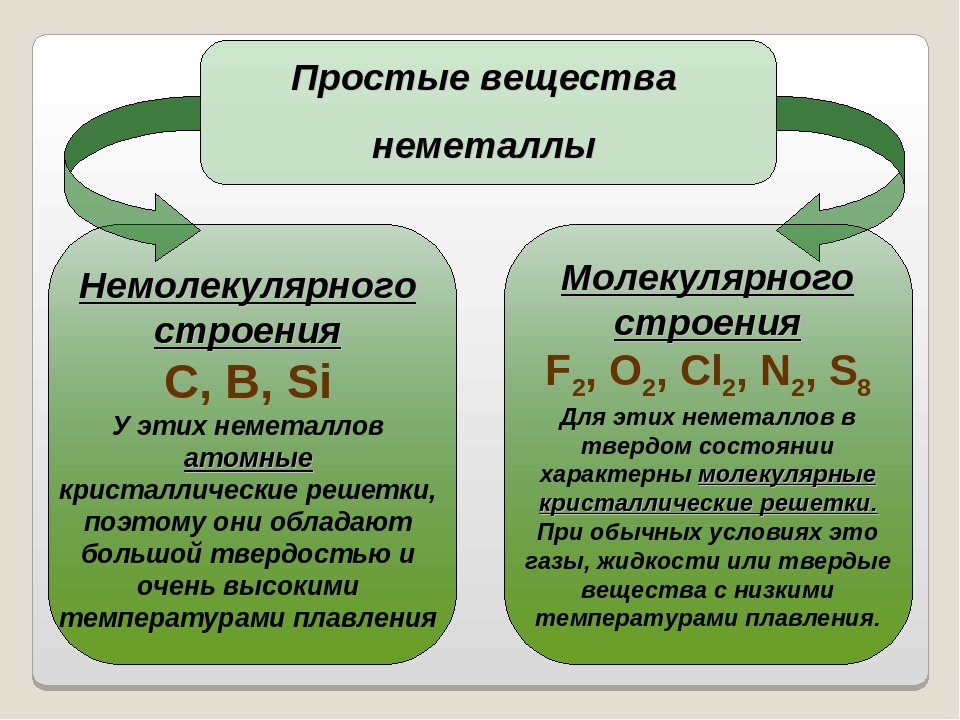
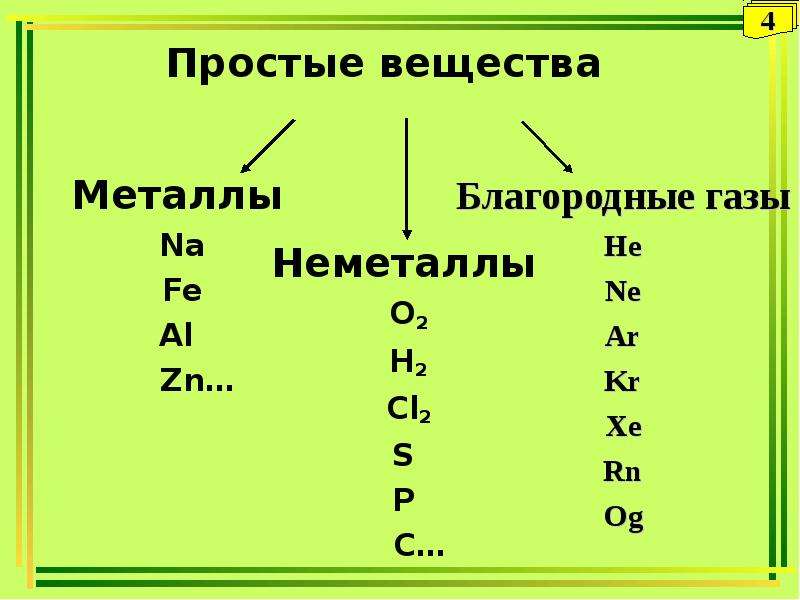

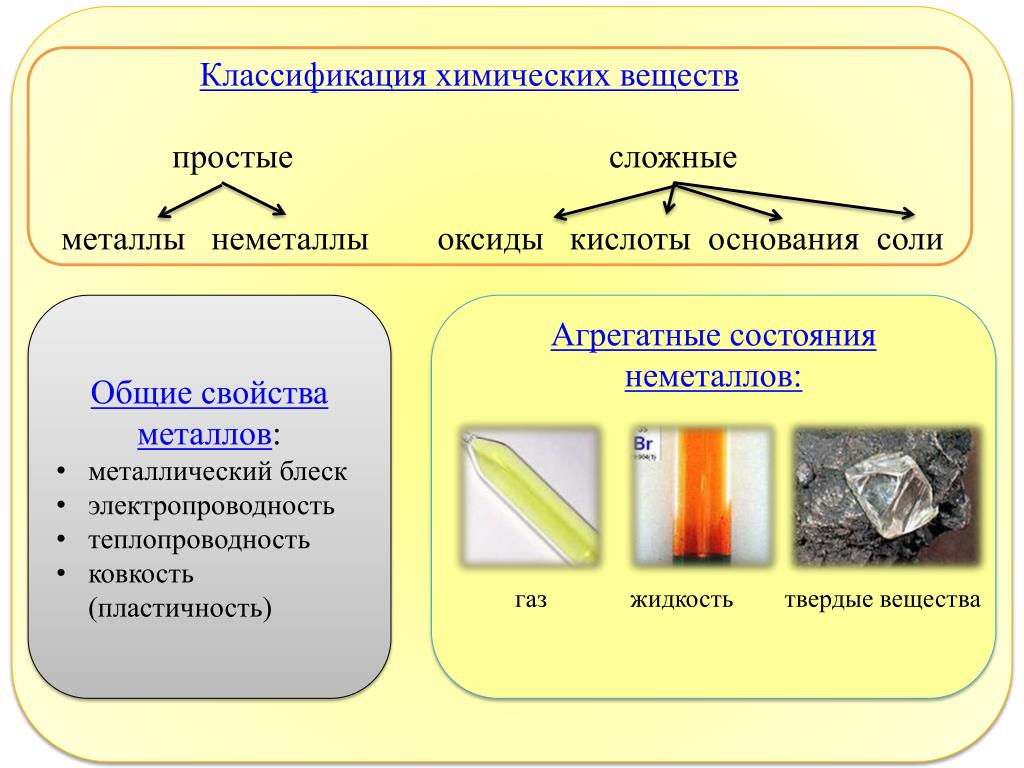

 Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле.
Например, кусок золота размером с кубик сахара можно растолочь в тонкий лист, которым будет покрыто футбольное поле. Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
Вольфрам имеет самые высокие температуры плавления и кипения, а ртуть — самые низкие. Натрий и калий также имеют низкие температуры плавления.
 Все атомы элемента являются
идентичный.
Все атомы элемента являются
идентичный. е.е., часто существуют в виде жидкости или газа при
комнатная температура)
е.е., часто существуют в виде жидкости или газа при
комнатная температура) 9
9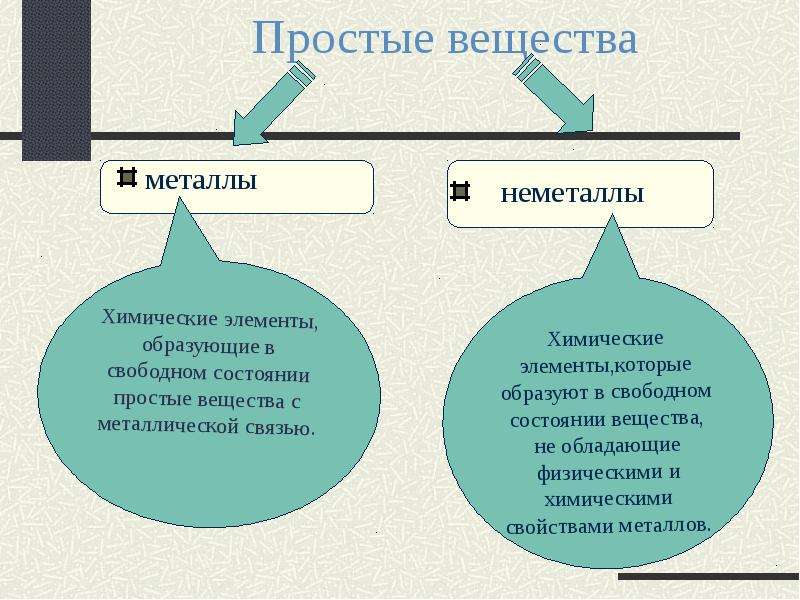 Продолжайте читать, чтобы узнать, как это сделать!)
Продолжайте читать, чтобы узнать, как это сделать!) Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.