Скорость химических реакций и факторы от которых она зависит
В жизни мы сталкиваемся с разными химическими реакциями. Одни из них, как ржавление железа, могут идти несколько лет. Другие, например, сбраживание сахара в спирт, — несколько недель. Дрова в печи сгорают за пару часов, а бензин в моторе — за долю секунды.
Чтобы уменьшить затраты на оборудование, на химических заводах повышают скорость реакций. А некоторые процессы, например, порчу пищевых продуктов, коррозию металлов, — нужно замедлить.
Скорость химической реакции можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) — сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt. Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т. е. получаем изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени:
υ = –––––––––– = –––––––– = Δс/Δt (1)
(t2 − t1) • v Δt • v
где c = n / v — концентрация вещества,
Δ (читается «дельта») — общепринятое обозначение изменения величины.
Если в уравнении у веществ разные коэффициенты, скорость реакции для каждого из них, рассчитанная по этой формуле будет различной. Например, 2 моль серни́стого газа прореагировали полностью с 1 моль кислорода за 10 секунд в 1 литре:
2SO2 + O2 = 2SO3
Скорость по кислороду будет: υ = 1 : (10 • 1) = 0,1 моль/л·с
Скорость по серни́стому газу: υ = 2 : (10 • 1) = 0,2 моль/л·с — это не нужно запоминать и говорить на экзамене, пример приведен для того, чтобы не путаться, если возникнет этот вопрос.
Скорость гетерогенных реакций (с участием твердых веществ) часто выражают на единицу площади соприкасающихся поверхностей:
Δn
υ = –––––– (2)
Δt • S
Гетерогенными называются реакции, когда реагирующие вещества находятся в разных фазах:
- твердое вещество с другим твердым, жидкостью или газом,
- две несмешивающиеся жидкости,
- жидкость с газом.

Гомогенные реакции протекают между веществами в одной фазе:
- между хорошо смешивающимися жидкостями,
- газами,
- веществами в растворах.
Условия, влияющие на скорость химических реакций
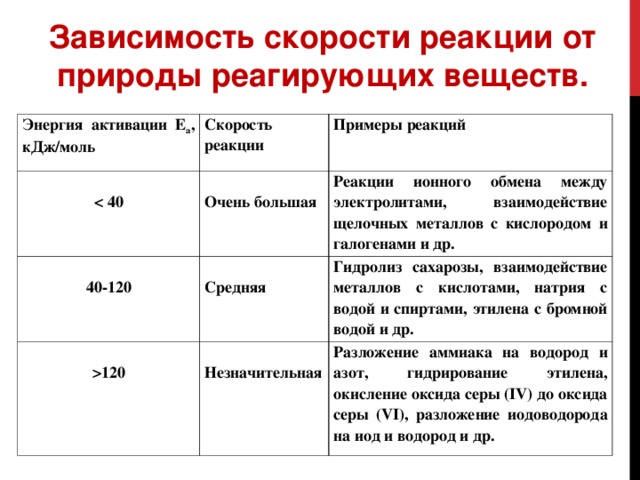
1) Скорость реакции зависит от природы реагирующих веществ. Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2) Скорость реакции тем больше, чем выше концентрация веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3) Скорость реакции значительно повышается с повышением температуры. Например, для горения топлива необходимо его поджечь, т. е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4) Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ. Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Обратите внимание, что в данном случае подразумевается формула (1)! Формула (2) выражает скорость на единице площади, следовательно не может зависеть от площади.
5) Скорость реакции зависит от наличия катализаторов или ингибиторов.
Катализаторы — вещества, ускоряющие химические реакции, но сами при этом не расходующиеся. Пример — бурное разложение перекиси водорода при добавлении катализатора — оксида марганца (IV):
2H2O2 = 2H2O + O2↑
Оксид марганца (IV) остается на дне, его можно использовать повторно.
Ингибиторы — вещества, замедляющие реакцию. Например, для продления срока службы труб и батарей в систему водяного отопления добавляют ингибиторы коррозии. В автомобилях ингибиторы коррозии добавляются в тормозную, охлаждающую жидкость.
Еще несколько примеров:
| Условия | Примеры |
| Природа реагирующих веществ | Многие вещества хранятся годами, а перекись водорода разлагается: 2Н2О2 = 2Н2О + О2↑ |
| Их концентрация | Чистая перекись водорода разлагается со взрывом, а в растворе — за несколько месяцев |
| Температура | В прохладном месте раствор Н2О2 сохраняется довольно долго |
| Присутствие катализаторов и ингибиторов | Раствор Н2О2, поступающий в продажу, содержит ингибиторы, чтобы лучше хранился. Но если к нему добавить щепотку MnO2 в качестве катализатора — происходит бурное выделение кислорода |
автор: Владимир Соколов
Нужны примеры реакций. Хелп! Вопрос 3 § 14 Химия 9 класс Рудзитис, Фельдман – Рамблер/класс
Нужны примеры реакций. Хелп! Вопрос 3 § 14 Химия 9 класс Рудзитис, Фельдман – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Подскажите, почему закрыли прием в Московский институт телевидения и радиовещания «Останкино»?
В таблице 11 (с.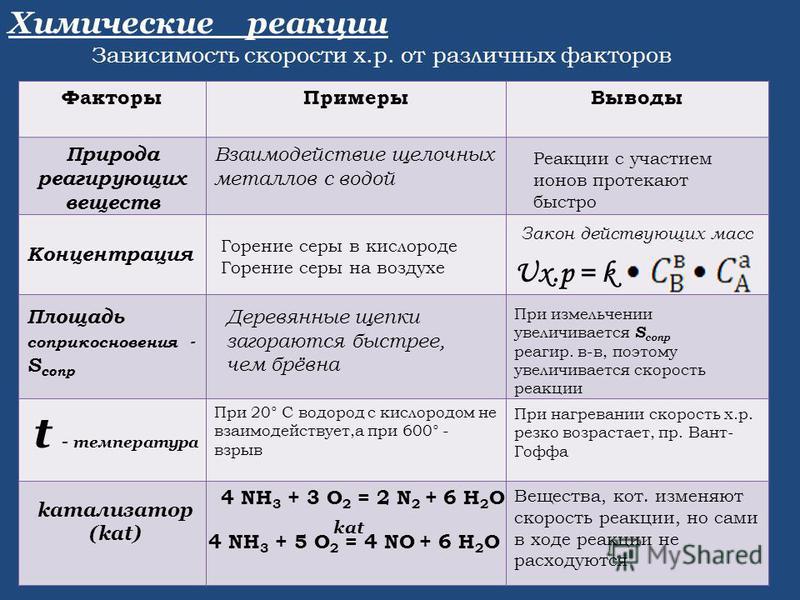 40) указаны условия, влияющие на скорость химических реакций, и даны примеры. Назовите для каждого условия один-два дополнительных примера, составьте уравнения реакций и дайте обоснование их осуществления.
40) указаны условия, влияющие на скорость химических реакций, и даны примеры. Назовите для каждого условия один-два дополнительных примера, составьте уравнения реакций и дайте обоснование их осуществления.
ответы
Скорость химической реакции зависит от
природы реагирующих веществ.
Металлы с одним и тем же веществом —
водой — реагируют с различными скоростями.
Литий энергично реагирует с водой с выделением
лития.
Калий реагирует со взрывом и горит фиолетовым
пламенем на поверхности воды.
Цинк бурно реагирует с соляной кислотой, а
железо довольно медленно.
Фтор с водородом реагирует со взрывом при
комнатной температуре:
Бром с водородом взаимодействует медленно и
при нагревании:
Для веществ в растворенном состоянии и
газов скорость химических реакций зависит от
концентрации реагирующих веществ.
1. Горение веществ в чистом кислороде происхо-
дит интенсивнее, чем в воздухе, где концентрация
кислорода почти в пять раз меньше.

2. При реакции цинка с раствором серной кис-
лоты большей концентрации, скорость выделения
водорода выше.
Это объясняется тем, что для осуществления
химического взаимодействия веществ А и 5, их мо-
лекулы (частицы) должны столкнуться. Чем больше
столкновений, тем быстрее протекает реакция. От-
сюда сформулирован основной закон химической
кинетики: скорость химической реакции пропор-
циональна произведению концентраций реагирую-
щих веществ. Зависимость скорости химической
реакции от концентрации реагирующих веществ
справедлива для газов и реакций, протекающих в
растворах, так как при реакции с участием твердых
веществ в этих случаях взаимодействие молекул
происходит не во всем объеме реагирующих ве-
ществ, а лишь на поверхности.
Для веществ в твердом состоянии скорость
реакции прямо пропорциональна поверхности
реагирующих веществ.
1. Вещества железо и сера в твердом состоянии
реагируют достаточно быстро лишь при предвари-
тельном измельчении и перемешивании.

2. Взаимодействие соляной кислоты с Zn, в виде
гранул происходит медленнее, чем в виде порошка
3. Уголь в виде больших кусков сгорает в печи
медленнее, чем измельченный
Чем сильнее измельчено твердое вещество, тем
больше его поверхность, а значит, скорость реакции
выше.
При повышении температуры на каждые
10°С скорость большинства реакций увеличивается в 2—4 раза.
1. Со многими веществами кислород начина-
ет реагировать с заметной скоростью уже при
обыкновенной температуре. При повышении темпе-
ратуры начинается горение. Медь при нагревании
в кислороде (и на воздухе) не горит, а «спокойно»
превращается в черный порошок оксида меди:
Железо горит в чистом кислороде, разбрасывая
в виде ярких искр частички раскаленной железной
окалины:
2. Водород восстанавливает оксиды металлов
при нагревании, при комнатной температуре эта
реакция не идет.
3. Взаимодействие оксида меди (II) с соляной
кислотой происходит как при комнатной температу-
ре, так и при нагревании, однако во втором случае
реакция протекает быстрее:
Скорость химических реакций зависит от
наличия катализаторов.

1. Разложение бертолетовой соли и пероксида
водорода ускоряется в присутствии катализатора
оксида марганца (IV):
Окисление оксида серы (IV) в оксид серы (VI)
ускоряется оксидом ванадия (V).
2. С водородом Mg непосредственно не взаимо-
действует, но при наличии катализатора и повышен-
ных температур такое взаимодействие возможно:
3. Реакция конверсии оксида углерода необхо-
дима в промышленности и протекает по реакции:
При этом смещение равновесия вправо осу-
ществляется катализатором и повышенной темпе-
ратурой.
Ферменты — природные катализаторы. Участ-
вуют практически во всех биохимических реакциях,
протекающих в живых организмах.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
10 класс
11 класс
Физика
похожие вопросы 5
Всем привет! Решим задачку? химия 10 класс Рудзитис задача 4 параграф 13
Подскажите верное решение) вот условие: Какой объем воздуха (н. у.) потребуется для сжигания 1 м3 бутана-1?
у.) потребуется для сжигания 1 м3 бутана-1?
ГДЗ10 классХимияРудзитис Г.Е.
Здравствуйте.
(Подробнее…)
Химия
Васильевых. 50 вариантов ответов по русскому языку. Вариант 31 ч.2 Задание 13 ОГЭ Русский язык 9 класс Однородное подчинение придаточных
Среди предложений 21-29:
(21) И Митрофанов услышал в этом смехе и прощение себе, и даже какое-то (Подробнее…)
ГДЗРусский языкОГЭ9 классВасильевых И.П.
16. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)… Цыбулько И. П. Русский язык ЕГЭ-2017 ГДЗ. Вариант 13.
16.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
ЕГЭ-2017 Цыбулько И. П. Русский язык ГДЗ. Вариант 13. 18. Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых). ..
..
18.
Расставьте все знаки препинания: укажите цифру(-ы), на месте которой(-ых)
в предложении должна(-ы) стоять запятая(-ые). (Подробнее…)
ГДЗЕГЭРусский языкЦыбулько И.П.
12.2: Факторы, влияющие на скорость реакции
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 38259
- OpenStax
- OpenStax
Цели обучения
- Описать влияние химической природы, физического состояния, температуры, концентрации и катализа на скорость реакции
Скорости расходования реагентов и образования продуктов в ходе химических реакций сильно различаются. Мы можем выделить пять факторов, влияющих на скорость химических реакций: химическая природа реагирующих веществ, степень разделения (один большой кусок против множества мелких частиц) реагентов, температура реагентов, концентрация реагентов, и наличие катализатора.
Мы можем выделить пять факторов, влияющих на скорость химических реакций: химическая природа реагирующих веществ, степень разделения (один большой кусок против множества мелких частиц) реагентов, температура реагентов, концентрация реагентов, и наличие катализатора.
Химическая природа реагирующих веществ
Скорость реакции зависит от природы участвующих веществ. Реакции, которые кажутся похожими, могут иметь разную скорость в одних и тех же условиях, в зависимости от идентичности реагентов. Например, когда небольшие кусочки металлов железа и натрия подвергаются воздействию воздуха, натрий полностью реагирует с воздухом в течение ночи, в то время как железо практически не изменяется. Активные металлы кальций и натрий реагируют с водой с образованием газообразного водорода и основания. Тем не менее, кальций реагирует с умеренной скоростью, тогда как натрий реагирует так быстро, что реакция почти взрывоопасна.
Состояние подразделения реагентов
За исключением веществ в газообразном состоянии или в растворе, реакции происходят на границе или границе раздела двух фаз. Следовательно, скорость реакции между двумя фазами в значительной степени зависит от поверхности контакта между ними. Мелкодисперсное твердое вещество имеет большую площадь поверхности, доступную для реакции, чем один большой кусок того же вещества. Таким образом, жидкость будет быстрее реагировать с мелкоизмельченным твердым веществом, чем с большим куском того же твердого вещества. Например, большие куски железа медленно реагируют с кислотами; мелкодисперсное железо реагирует гораздо быстрее (рис. \(\PageIndex{1}\)). Крупные куски дерева тлеют, более мелкие быстро горят, а опилки горят со взрывом.
Следовательно, скорость реакции между двумя фазами в значительной степени зависит от поверхности контакта между ними. Мелкодисперсное твердое вещество имеет большую площадь поверхности, доступную для реакции, чем один большой кусок того же вещества. Таким образом, жидкость будет быстрее реагировать с мелкоизмельченным твердым веществом, чем с большим куском того же твердого вещества. Например, большие куски железа медленно реагируют с кислотами; мелкодисперсное железо реагирует гораздо быстрее (рис. \(\PageIndex{1}\)). Крупные куски дерева тлеют, более мелкие быстро горят, а опилки горят со взрывом.
 На фото (б) видны палочка и пузырьки в пробирке, аналогичной фото (а), но газ в пробирке не такой темный.
На фото (б) видны палочка и пузырьки в пробирке, аналогичной фото (а), но газ в пробирке не такой темный. Видео \(\PageIndex{1}\) : Реакция цезия с водой в замедленной съемке и обсуждение того, как состояние реагентов и размер частиц влияют на скорость реакции.
Температура реагентов
Химические реакции обычно протекают быстрее при более высоких температурах. Еда может быстро испортиться, если ее оставить на кухонном столе. Однако более низкая температура внутри холодильника замедляет этот процесс, так что одни и те же продукты остаются свежими в течение нескольких дней. Мы используем горелку или электроплитку в лаборатории, чтобы увеличить скорость реакций, протекающих медленно при обычных температурах. Во многих случаях повышение температуры всего на 10 °С примерно удваивает скорость реакции в гомогенной системе.
Концентрация реагентов
Скорость многих реакций зависит от концентрации реагентов. Скорость обычно увеличивается, когда увеличивается концентрация одного или нескольких реагентов. Например, карбонат кальция (\(\mathrm{CaCO_3}\)) портится в результате его реакции с загрязняющим веществом диоксидом серы. Скорость этой реакции зависит от количества диоксида серы в воздухе (рис. \(\PageIndex{2}\)). В качестве кислотного оксида диоксид серы соединяется с водяным паром в воздухе с образованием сернистой кислоты в следующей реакции:
Скорость обычно увеличивается, когда увеличивается концентрация одного или нескольких реагентов. Например, карбонат кальция (\(\mathrm{CaCO_3}\)) портится в результате его реакции с загрязняющим веществом диоксидом серы. Скорость этой реакции зависит от количества диоксида серы в воздухе (рис. \(\PageIndex{2}\)). В качестве кислотного оксида диоксид серы соединяется с водяным паром в воздухе с образованием сернистой кислоты в следующей реакции:
\[\ce{SO}_{2(g)}+\ce{H_2O}_{(g)}⟶\ce{H_2SO}_{3(aq)} \label{12.3.1} \]
Карбонат кальция реагирует с сернистой кислотой следующим образом:
\[\ce{CaCO}_{3(s)}+\ce{H_2SO}_{3(aq)}⟶\ce{CaSO}_{3( aq)}+\ce{CO}_{2(g)}+\ce{H_2O}_{(l)} \label{12.3.2} \]
В загрязненной атмосфере, где концентрация диоксида серы карбонат кальция разлагается быстрее, чем в менее загрязненном воздухе. Точно так же фосфор сгорает гораздо быстрее в атмосфере чистого кислорода, чем в воздухе, который состоит всего лишь на 20% из кислорода.
Рисунок \(\PageIndex{2}\): Статуи, сделанные из карбонатных соединений, таких как известняк и мрамор, обычно медленно выветриваются с течением времени из-за воздействия воды, а также теплового расширения и сжатия. Однако загрязняющие вещества, такие как диоксид серы, могут ускорить выветривание. По мере увеличения концентрации загрязнителей воздуха разрушение известняка происходит быстрее. (Фото: Джеймс П. Фишер III). На фотографии изображена статуя ангела. Хотя некоторые детали статуи, в том числе черты лица, присутствуют, эффекты выветривания, по-видимому, уменьшают эти черты.
Однако загрязняющие вещества, такие как диоксид серы, могут ускорить выветривание. По мере увеличения концентрации загрязнителей воздуха разрушение известняка происходит быстрее. (Фото: Джеймс П. Фишер III). На фотографии изображена статуя ангела. Хотя некоторые детали статуи, в том числе черты лица, присутствуют, эффекты выветривания, по-видимому, уменьшают эти черты. Видео \(\PageIndex{2}\) : Фосфор быстро горит на воздухе, но он будет гореть еще быстрее, если концентрация кислорода в воздухе выше.
Присутствие катализатора
Растворы перекиси водорода пенятся при попадании на открытую рану, потому что вещества в открытых тканях действуют как катализаторы, увеличивая скорость разложения перекиси водорода. Однако при отсутствии этих катализаторов (например, во флаконе в аптечке) полное разложение может занять месяцы. Катализатор — это вещество, которое увеличивает скорость химической реакции за счет снижения энергии активации, но само при этом не расходуется в ходе реакции. Энергия активации – это минимальное количество энергии, необходимое для протекания химической реакции в прямом направлении. Катализатор увеличивает скорость реакции, предоставляя альтернативный путь или механизм реакции (рис. \(\PageIndex{3}\)). Катализ будет обсуждаться более подробно позже в этой главе, так как он связан с механизмами реакций.
Энергия активации – это минимальное количество энергии, необходимое для протекания химической реакции в прямом направлении. Катализатор увеличивает скорость реакции, предоставляя альтернативный путь или механизм реакции (рис. \(\PageIndex{3}\)). Катализ будет обсуждаться более подробно позже в этой главе, так как он связан с механизмами реакций.
 Стрелка проходит от горизонтальной линии к вершине кривой. Стрелка помечена как «Энергия активации некатализируемой реакции». Показана вторая черная вогнутая кривая вниз. Эта кривая также соответствует сегментам синей линии реагентов и продуктов, но простирается только примерно до двух третей высоты исходной кривой. От горизонтальной линии идет еще одна стрелка, указывающая на вершину второй кривой. Эта стрелка помечена как «Энергия активации катализируемой реакции».
Стрелка проходит от горизонтальной линии к вершине кривой. Стрелка помечена как «Энергия активации некатализируемой реакции». Показана вторая черная вогнутая кривая вниз. Эта кривая также соответствует сегментам синей линии реагентов и продуктов, но простирается только примерно до двух третей высоты исходной кривой. От горизонтальной линии идет еще одна стрелка, указывающая на вершину второй кривой. Эта стрелка помечена как «Энергия активации катализируемой реакции».Химические реакции происходят, когда молекулы сталкиваются друг с другом и подвергаются химическому превращению. Прежде чем физически провести реакцию в лаборатории, ученые могут использовать молекулярное моделирование, чтобы предсказать, как параметры, обсуждавшиеся ранее, повлияют на скорость реакции. Используйте интерактивное приложение PhET Reactions & Rates, чтобы узнать, как температура, концентрация и природа реагентов влияют на скорость реакции.
Резюме
На скорость химической реакции влияют несколько параметров. Реакции с участием двух фаз протекают быстрее при большей площади контакта. Если температура или концентрация реагента увеличиваются, скорость данной реакции обычно также увеличивается. Катализатор может увеличить скорость реакции, обеспечивая альтернативный путь, который приводит к снижению энергии активации реакции.
Реакции с участием двух фаз протекают быстрее при большей площади контакта. Если температура или концентрация реагента увеличиваются, скорость данной реакции обычно также увеличивается. Катализатор может увеличить скорость реакции, обеспечивая альтернативный путь, который приводит к снижению энергии активации реакции.
Глоссарий
- катализатор
- вещество, увеличивающее скорость реакции, но само не поглощающееся реакцией
Эта страница под названием 12.2: Факторы, влияющие на скорость реакции, распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax с помощью исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- ОпенСтакс
- Лицензия
- СС BY
- Версия лицензии
- 4,0
- Показать страницу TOC
- № на стр.

- Теги
- Тег автора:OpenStax
- катализатор
- источник@https://openstax.org/details/books/chemistry-2e
Природа реагентов
Скорость реакции относится к скорости, с которой продукты образуются из реагентов, когда происходит химическая реакция. Кроме того, он также дает важную информацию о сроках, необходимых для завершения реакции. Например, скорость реакции горения целлюлозы в огне намного выше, и реакция завершается менее чем за секунду.
Определение скорости реакции
Как упоминалось ранее, скорость реакции определяет скорость, с которой реагенты превращаются в продукты. Однако, когда мы рассматриваем химическую реакцию, скорость их реакции обычно резко различается. Хотя некоторые химические реакции завершаются немедленно, другим может потребоваться длительный период времени, чтобы достичь состояния равновесия.
В соответствии с общим определением скорости реакции, при сжигании древесины поддерживается более значительная скорость реакции, поскольку процесс протекает быстро. С другой стороны, процесс ржавления железа поддерживает низкую скорость реакции, поскольку это более медленный процесс.
Факторы, влияющие на скорость химической реакции
Многие факторы влияют на скорость химической реакции. Некоторые из них перечислены ниже:
- Концентрация реагентов
По мере увеличения концентрации реагентов, участвующих в химической реакции, количество столкновений или активированных столкновений имеет тенденцию к увеличению.
Это, в свою очередь, увеличивает скорость химической реакции. Эта концепция основана на теории столкновений, в которой количество столкновений увеличивается из-за увеличения концентрации. Таким образом, можно сказать, что скорость реакции прямо пропорциональна увеличению концентрации.
То есть скорость реакции ∝ частота столкновений (Z)
Формула = скорость (r) ∝ cn или r = kcn
Где r = скорость химической реакции
c = концентрация реагентов
n = порядок реакции
k = удельная скорость
Давление
Когда давление в конкретной газовой системе увеличивается, это напрямую увеличивает количество столкновений, происходящих между реагирующими веществами.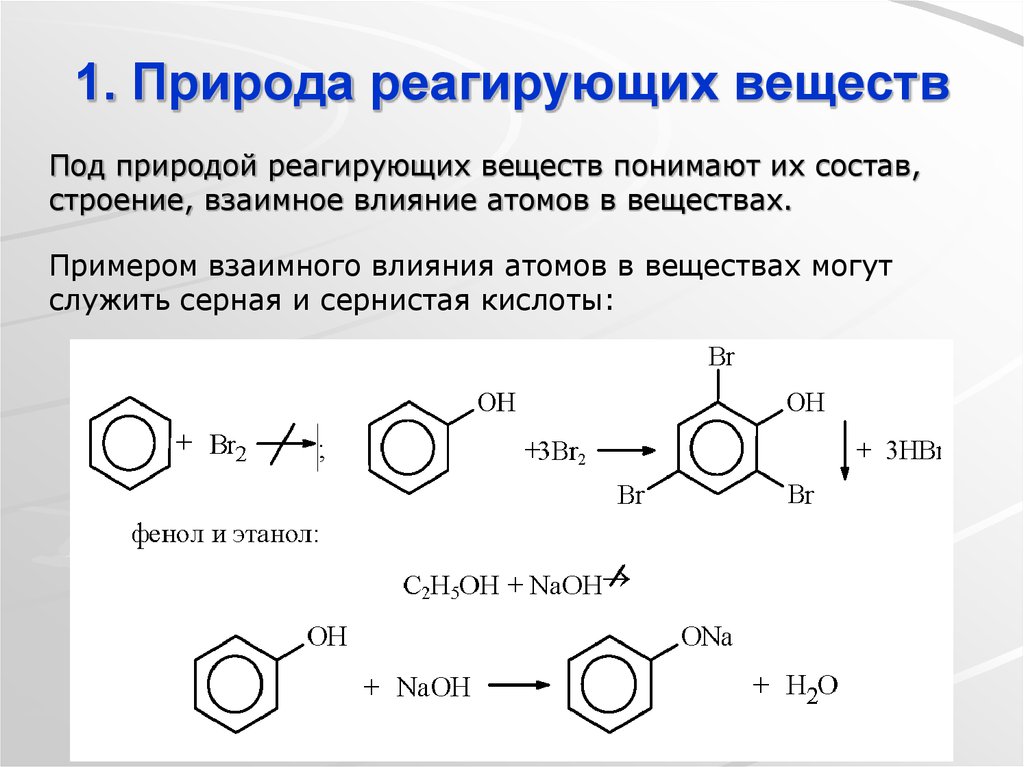 Это, в свою очередь, положительно влияет на скорость реакции. Это означает, что скорость реакции, в которой реагирующие вещества находятся в газообразной форме, также увеличивается.
Это, в свою очередь, положительно влияет на скорость реакции. Это означает, что скорость реакции, в которой реагирующие вещества находятся в газообразной форме, также увеличивается.
- Температура
Температура – третий фактор, влияющий на скорость реакций. Это немного сложно понять, так как есть несколько реакций, в которых скорость реакции увеличивается с повышением температуры.
В таких реакциях реагирующие вещества приобретают кинетическую энергию и становятся более активными. Это, в свою очередь, увеличивает столкновение реагирующих веществ, увеличивая скорость химической реакции.
Однако это верно не во всех случаях. Известно, что скорость биологических реакций, в которых в качестве катализатора используются ферменты, уменьшается с повышением температуры. Причина в том, что ферменты теряют свое функционирование и активность из-за повышения температуры.
- Наличие катализатора
Катализатор – это вещество, которое способствует увеличению скорости реакции. Следует помнить, что сам катализатор в реакции не участвует. Это означает, что он выходит в той же форме, в которой был добавлен.
Следует помнить, что сам катализатор в реакции не участвует. Это означает, что он выходит в той же форме, в которой был добавлен.
Катализатор обеспечивает альтернативный путь протекания реакции. Новый путь имеет более низкую энергию активации, что означает, что реагенты легко превращаются в продукты.
Катализаторы играют важную роль в обратимых реакциях. Известно, что они снижают энергию активации как прямой, так и обратной реакции.
Однако катализаторы бывают двух типов: положительные и отрицательные. Известно, что положительные катализаторы увеличивают скорость реакции, тогда как отрицательные катализаторы мешают реакции и замедляют ее.
- Природа реагентов
Природа реагентов является еще одним фактором, влияющим на скорость реакций. Известно, что два типа связи — ковалентная и ионная — вызывают разную скорость реакции.
Ионные соединения реагируют быстрее, что позволяет увеличить скорость реакции. С другой стороны, известно, что ковалентные соединения реагируют медленно, что позволяет снизить скорость реакции. Причина в том, что в ионных соединениях происходит только перенос ионов. Но, с другой стороны, ковалентные соединения должны подвергнуться разрыву связи, прежде чем они образуют продукты.
Причина в том, что в ионных соединениях происходит только перенос ионов. Но, с другой стороны, ковалентные соединения должны подвергнуться разрыву связи, прежде чем они образуют продукты.
- Ориентация реагентов
Скорость реакции зависит от ориентации, в которой реагенты реагируют и образуют продукты. Если реагенты присутствуют в правильной ориентации, это приведет к увеличению скорости реакции.
С другой стороны, если ориентация реагента делает невозможной атаку, это приведет к уменьшению скорости реакции.
Другими словами, простые реагенты имеют более высокую скорость реакции по сравнению со сложными из-за большей вероятности правильной ориентации.
Площадь поверхности
Площадь поверхности реагента напрямую связана с увеличением скорости реакции. Для увеличения скорости реакции реагенты и катализаторы применяют в виде мелкодисперсного порошка. Это увеличивает площадь поверхности реагентов, что, в свою очередь, увеличивает скорость реакции.


