Практическая работа №3 «Получение соляной кислоты и её свойства»
Практическая работа №3 по теме:«Получение соляной кислоты и изучение её свойств».
17.11.2016г.
Правила техники безопасности при работе с веществами и растворами.
- Наливать или насыпать вещества можно только над столом или специальным подносом. Для опыта брать только указанное количество вещества.
- Нельзя ошибочно взятый излишек реактива ссыпать (выливать) обратно в склянку или банку.
- Все работы, связанные с выделением вредных газов или паров, проводить только в вытяжном шкафу при исправной вентиляции.
- Твердые сыпучие реактивы можно брать только совочками, шпателями, но не руками. Измельчение твердых веществ разрешается проводить только в ступке с помощью пестика.
- Обо всех случаях разлива жидкостей, а также о рассыпанных твердых реактивах нужно сообщить учителю. Место разлива следует обработать нейтрализующим раствором, а затем промыть водой.
Реактивы:
- NaCl
- Mg
- AgNO 3
- NaOH
- CuSO 4
- CaCO 3
- H 2 SO 4
Оборудование:
- пробирки в штативе,
- газоотводная трубка,
- спиртовка,
- штатив.
Ход работы
- Получение соляной кислоты.
Собираем прибор по рисунку.
Наблюдения:
- Записать уравнение реакции получения соляной кислоты.
- Почему «Получение хлороводорода» необходимо проводить в вытяжном шкафу?
Сравнительная характеристика хлороводорода и соляной кислоты. (устно)
Хлороводород
Соляная кислота
Ход работы:
2. Свойства соляной кислоты.
В четыре пробирки налейте соляную кислоту.
- В первой пробирке определите среду раствора (рН) универсальным индикатором. Напишите уравнение электролитической диссоциации соляной кислоты. Отметьте окраску индикаторов и среду рН.
HCL ……+…..
- Во вторую пробирку положить гранулу магния Отметьте, что происходит. Составьте уравнение протекающей реакции, коэффициенты расставьте методом электронного баланса.
HCL +Mg ……+…..
Ход работы
- В третью – свежеприготовленного гидроксида меди. Отметьте, что происходит. Составьте уравнение протекающей реакции.
… ..+….. Cu(OH) 2 +……
HCL + Cu(OH) 2 ……+…..
Ход работы
- В четвертую пробирку добавьте немного мела. Что наблюдаете? Напишите молекулярные, полные и сокращенные ионные уравнения реакций.
HCL + CaCO 3 ……+…..
3. Качественная реакция.
- HCL + AgNO 3 ……+….
Напишите молекулярные, полные и сокращенные ионные уравнения реакций.
Что наблюдаете?
4.Экспериментальная задача
- В трех пробирках без этикеток содержатся прозрачные растворы NaCl , Н Cl , Н 2 О.
- Определите каждое из предложенных веществ.
- Выполните практическую часть эксперимента.
ВЫВОД.
1) Хлороводород — это:
а) жидкость; б) газ, легко растворимый в воде;
в) газ, без запаха; г) газ, тяжелее воздуха.
2) В реакцию с соляной кислотой вступает каждый из двух металлов:
а) Hg и Ag ; б) Mg и Zn ; в) Au и Cu ; г) Zn и Ag .
3) Необратимо протекает реакция ионного обмена между растворами
а) хлорида калия и серной кислоты;
б) нитрата серебра и хлорида железа ( III) ;
в) соляной кислоты и сульфата аммония;
г) карбоната калия и гидроксида натрия.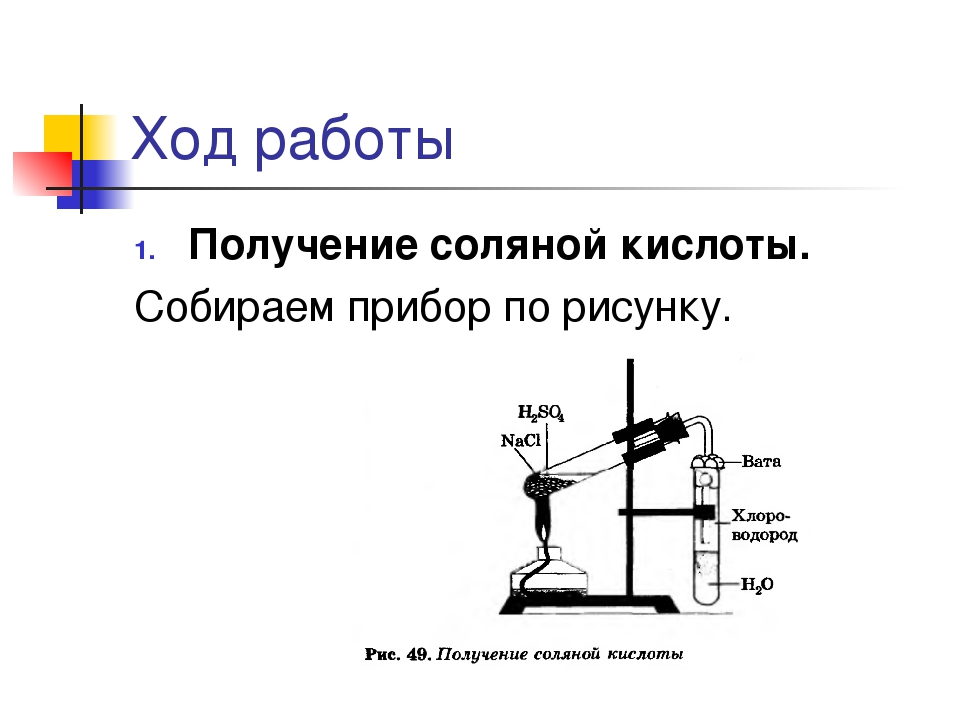
4) Соляная кислота реагирует с
а) H 2 S ; б) AgNO 3 ; в) Ag ; г) Н 2 О
5) Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cl 2 → HCl → Na Cl → AgCl .
Практическая работа №3 Получение соляной кислоты и изучение ее свойств
Ученик_____класса_________________________________________________
Дата__________________
Практическая работа №3
Получение соляной кислоты и изучение ее свойств
Цель работы: получить хлороводород и растворить его в воде, изучить химические свойства соляной кислоты, знать качественные реакции на ионы и уметь ими пользоваться для распознавания веществ, учится мыслить и анализировать информацию в познавательной деятельности.
Оборудование: штатив, лапка, пробирки, газоотводная трубка, вата, спиртовка, вода, поваренная соль, серная кислота 2: 1 , спички, цинк, магний, соляная кислота, медь, лакмус, оксид меди(II).
Ход работы
1.Получение соляной кислоты.
Соберите прибор как на рис. Стр 56.
В пробирку насыпьте 2-3 г поваренной соли и прилейте концентрированную серную кислоту, что бы она смочила всю соль.Закройте пробирку газоотводной трубкой. Конец газоотводной трубки опустите в пробирку с водой так, что бы он находился на расстоянии примерно 0,5- 1,0 см от поверхности воды. Нагреваем в течении 5-6 мин.
Напишите уравнения химических реакций
__________________________________________________________________
По каким признакам удается визуально судить о выделении хлороводорода?
____________________________________________________________________________________________________________________________________
2.Химические свойства соляной кислоты
1 пробирка – Соляная кислота + лакмусовая бумажка. Ваши наблюдения?
Ваши наблюдения?
____________________________________________________________________________________________________________________________________
2 пробирка — Соляная кислота + магний. Ваши наблюдения? Запишите уравнения реакций.
____________________________________________________________________________________________________________________________________
3 пробирка — Соляная кислота +цинк. Ваши наблюдения? Запишите уравнения реакций.
____________________________________________________________________________________________________________________________________
4 пробирка — Соляная кислота +медь. Ваши наблюдения? Запишите уравнения реакций.
____________________________________________________________________________________________________________________________________
5 пробирка — Соляная кислота +гидроксид меди (II). Ваши наблюдения? Запишите уравнения реакций.
______________________________________________________________________________________________________________________________________________________________________________________________________
6 пробирка — Соляная кислота +мел . Ваши наблюдения? Запишите уравнения реакций.
______________________________________________________________________________________________________________________________________________________________________________________________________
3.Расположение соляной кислоты и ее солей.
В одну пробирку налейте 1-2 мл разбавленной соляной кислоты, во вторую хлорида натрия , в третью – хлорида кальция. Во все пробирки добавим несколько капель нитрата серебра. Напишите уравнения реакции. Почему нитрат серебра используют для определения хлорид ионов? Что является реактивом на соляную кислоту и ее соли?
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Вывод_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
«Получение соляной кислоты и изучение её свойств»
Практикум по неорганической химии.
9 класс
Химический практикум II
Свойства соединений неметаллов
Практическая работа № 4.
Тема: « Получение соляной кислоты и изучение её свойств»
Цель: Получить соляную кислоту и изучить её свойства.
Оборудование и реактивы: металлический штатив с лапкой, две пробирки, пробирка с газоотводной трубкой, спиртовка, лопаточка, влажный тампон; раствор серной кислоты (1:1), хлорид натрия, индикатор, нитрат серебра (1%).
Инструкция к выполнению практической работы.
Поместите в сухую пробирку две лопаточки хлорида натрия и прилейте 4-5 капель раствора серной кислоты. К пробирке присоедините газоотводную трубку, её конец должен быть погружён в пробирку с 1мл воды, в которую опускают кусочек лакмусовой бумажки. Проследите за тем, чтобы конец газоотводной трубки был на расстоянии нескольких миллилитров от поверхности воды (ни в коем случае не погружайте её в воду! Почему?). Пробирку, в которую будет поступать хлороводород, прикройте влажным ватным тампоном (почему?).
Смесь слабо нагрейте и, когда изменится окраска лакмусовой бумажки, прекратите нагревание (следите, чтобы кислоту не перебросило во вторую пробирку с водой). Вынув тампон и лакмусовую бумажку, прилейте к жидкости 2-3 капли нитрата серебра. Что наблюдаете? Напишите уравнения происходящих реакций, наблюдаемых при получении соляной кислоты.
Химические свойства соляной кислоты
Оборудование и реактивы: спиртовка, четыре пробирки; раствор соляной кислоты (1:3), цинк, оксид меди (II), гидроксид натрия, карбонат натрия.
Экспериментальные задачи
Для решения задач используйте малые количества веществ: 5-10 капель раствора, одну лопаточку твёрдого вещества.
1. Получите из цинка хлорид цинка, какой газ при этом выделяется. Запишите уравнение реакции. Составьте схему электронного баланса.
2. Исследуйте, как реагирует соляная кислота с оксидом меди. Полученный раствор немного нагрейте. Что наблюдаете?
Полученный раствор немного нагрейте. Что наблюдаете?
3. Наберите 8-10 капель раствора гидроксида натрия в пробирку и проведите их нейтрализацию (в присутствии индикатора) раствором соляной кислоты.
4. К раствору карбоната натрия добавьте раствор соляной кислоты. Что наблюдаете?
Напишите уравнения проведённых вами реакций в молекулярном и ионном виде.
Составьте отчёт о работе. Сделайте вывод.
Приведите в порядок рабочее место.
Практическая работа № 5.(9 класс)
Тема: «Получение аммиака и изучение его свойств»
Цель: Получить аммиак и ознакомиться со свойствами водного раствора аммиака.
Оборудование и реактивы: спиртовка, металлический штатив, пробка с газоотводной трубкой, лопаточка, фарфоровая чашечка, стеклянная палочка, 5 пробирок, ватный тампон, кристаллизатор, наполненный наполовину водой, фенолфталеиновая бумажка; хлорид аммония, гидроксид кальция, раствор аммиака (1%), раствор серной кислоты (1:5), растворы сульфатов цинка и алюминия (W = 0,5), раствор соляной кислоты (1:3).
Инструкция к выполнению практической работы.
Повторите по учебнику вопросы: получение и свойства аммиака, аммиачной воды и солей аммония. После этого приступайте к работе.
Опыт №1. Получение аммиака.
Соберите прибор для получения аммиака.
В фарфоровую чашечку насыпьте четыре лопаточки хлорида аммония и две лопаточки гидроксида кальция. Смесь перемешайте лопаточкой и насыпьте в сухую пробирку. Закройте её пробкой с газоотводной трубкой и укрепите в лапке штатива (обратите внимание на наклон пробирки со смесью). На газоотводную трубку наденьте сухую пробирку для собирания аммиака и отверстие её закройте ватным тампоном.
Пробирку со смесью хлорида аммония и гидроксида кальция слегка прогрейте (2-3 движениями пламени), а затем нагревайте в том месте, где находится смесь. Для обнаружения аммиака поднесите к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку. Обнаружив аммиак, поднесите к отверстию пробирки стеклянную палочку, смоченную раствором соляной кислоты. Что наблюдаете? Каков химический состав образующихся твёрдых частиц (дыма)? Напишите уравнение реакции.
Обнаружив аммиак, поднесите к отверстию пробирки стеклянную палочку, смоченную раствором соляной кислоты. Что наблюдаете? Каков химический состав образующихся твёрдых частиц (дыма)? Напишите уравнение реакции.
Прекратите нагревание смеси. Пробирку, в которой собран аммиак, осторожно снимите с газоотводной трубки, держа её вверх дном (конец газоотводной трубки сразу же после снятия с неё пробирки с аммиаком закройте кусочком мокрой ваты).
Немедленно закройте отверстие снятой пробирки большим пальцем и опустите в сосуд с водой. Палец отнимите только под водой. Что наблюдаете? Почему вода поднялась в пробирке? Снова закройте пальцем отверстие пробирки под водой и выньте её из сосуда.
Ответьте на вопросы
1. Почему пробирку со смесью веществ для получения аммиака нужно укреплять в лапке штатива наклонно с приподнятым дном?
2. Почему аммиак собирают в перевёрнутую вверх дном пробирку? Какие ещё газы можно собирать таким способом?
3. Как доказать, что в водном растворе аммиака содержатся гидроксид-ионы?
С полученным водным раствором аммиака проделайте следующие опыты.
Изучение свойств водного раствора аммиака
Опыт № 1. В пробирку налейте 2-3мл водного раствора аммиака и добавьте 2-3 капли фенолфталеина. Каков цвет раствора? Нагрейте этот раствор до кипения. Как изменится окраска раствора? Чем вызвано это изменение?
Опыт № 2. Налейте в пробирку 2-3мл водного раствора аммиака. Добавьте 2-3 капли фенолфталеина и приливайте по каплям раствор серной кислоты до исчезновения малиновой окраски. Почему исчезла окраска? Напишите ионные уравнения реакции.
Опыт № 3. В пробирку налейте 2-3мл водного раствора сульфата алюминия (хлорида алюминия, сульфата цинка) и добавьте 1-2 капли раствора аммиака до помутнения. Испытайте, растворяется ли полученный амфотерный гидроксид в избытке раствора аммиака. Напишите полное и сокращённое ионные уравнения реакций.
Составьте отчёт о работе. Сделайте вывод.
Приведите в порядок рабочее место.
Практическая работа № 6.(9 класс)
Тема: «Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов».
Цель: Получить и собрать оксид углерода (IV), провести его качественное подтверждение, определить по характерным реакциям карбонаты.
Оборудование и реактивы: пробирка с газоотводной трубкой, стакан объёмом 50мл, спиртовка, лучинка, 3 пробирки, кусочки мрамора; раствор соляной кислоты (1:1), известковая вода, Растворы карбоната натрия и гидроксида натрия (W=0,5), фенолфталеин.
Инструкция к выполнению практической работы.
При подготовке к работе повторите вопросы: получение и свойства оксида углерода(IV), угольная кислота и её соли, распознавание углекислого газа и карбонатов.
Получение оксида углерода (IV) и изучение его свойств.
Соберите прибор для получения оксида углерода (IV) из пробирки и газоотводной трубки. В пробирку внесите несколько кусочков мрамора и прилейте немного разбавленной соляной кислоты.
Опыт №1. Соберите оксид углерода (IV) и докажите его наличие в сосуде.
Опыт № 2. Пропустите оксид углерода (IV) в пробирку с 1-2мл известковой воды. Что наблюдаете? Теперь продолжайте пропускать газ в эту пробирку до образования прозрачного раствора. Как объяснить растворение осадка?
Составьте уравнения происходящих реакций.
Опыт № 3. Опустите трубку в пробирку с 2-3мл дистиллированной воды и пропустите через неё газ. Через несколько минут выньте трубку из раствора, добавьте к полученному раствору несколько капель раствора синего лакмуса. Что наблюдаете?
Опыт № 4. В 1мл воды внесите каплю раствора гидроксида натрия и каплю фенолфталеина. В раствор пропускайте оксид углерода (IV) до исчезновения окраски.
Ответьте на вопросы
1. Что происходит, если на мрамор действуют соляной кислотой?
Что происходит, если на мрамор действуют соляной кислотой?
2. Почему при пропускании углекислого газа через известковую воду происходит сначала помутнение раствора, а затем растворение осадка.
3. Что происходит при пропускании оксида углерода (IV) через дистиллированную воду?
Напишите уравнения соответствующих реакций в молекулярном, ионном и сокращённом ионном виде.
Распознавание карбонатов.
В трёх пробирках под номерами находятся растворы веществ: хлорид натрия, карбонат натрия, сульфат натрия. Определите в какой пробирке какое вещество.
Рассуждения по анализу содержания задачи и её решению следует записать в таблицу.
| Вещество | Реактив | ||
| Ba2+ | H+ | № пробирки | |
| NaCl | |||
| Na2CO3 | |||
| Na2SO4 | |||
Составьте уравнения реакций в молекулярном, ионном и сокращённом ионном виде.
При практическом выполнении задачи необходимо помнить следующее:
1. Нельзя проводить реакции в пробирках, в которых даны исследуемые вещества. Нужно помнить, что часто приходится пользоваться несколькими реактивами при установлении одного и того же вещества.
2. Для распознавания берётся проба раствора исследуемого вещества с помощью пипетки (примерно 5 капель).
Сделайте вывод о проделанной работе. Уберите рабочее место.
Практическая работа № 7 (9 класс)
Экспериментальные задачи по теме: «Подгруппа азота»
Цель: Закрепить умения по распознаванию нитратов и солей аммония.
Оборудование: хлорид аммония, сульфат аммония, сульфат меди, нитрат бария, оксид меди, раствор азотной кислоты (1:2), гидроксид натрия, хлорид бария, нитрат серебра, хлорид натрия, хлорид алюминия, пробирки с удобрениями(аммофос, аммиачная селитра, сульфат калия).
Ход работы
Инструкция к проведению опытов.
Для решения предложенных задач следует повторить тему « Азот», особенно вопросы: азотная кислота и её соли, аммиак и соли аммония. Продумайте решение каждой задачи. При анализе задачи на распознавание веществ целесообразно вначале обдумать план её решения, отразив его в виде таблицы, написать все уравнения реакций, выбрать наиболее рациональный путь решения задачи. Только после этого приступайте к работе.
Задача 1. Докажите опытным путём, что: а) в состав хлорида аммония входят ионы аммония и хлорид- ионы, б) в состав сульфата аммония входят ионы аммония и сульфат-ионы.
| Реактивы | AgNO3 | BaCl2 | NaOH (нагрев.) |
| NH4Cl | + | ─ | + |
| (NH4)2SO4 | ─ | + | + |
Напишите уравнения реакций в молекулярном и ионном виде.
Задача 2. Вам выданы образцы следующих удобрений: аммофос, аммиачная селитра и сульфат калия. С помощью характерных реакций определите, в какой пробирке находится каждое из выданных веществ.
| Удобрения | BaCl2 | AlCl3 | Номер пробирки |
| NH4H2PO4 | + | + | |
| NH4NO3 | ─ | ─ | |
| К2SO4 | + | ─ |
При решении указанной экспериментальной задачи можно пользоваться таблицей «Распознавание удобрений». Необходимо приготовить растворы удобрений, брать пробу каждого удобрения в отдельности на один и тот же реактив, чтобы можно было сравнивать между собой удобрения.
Необходимо приготовить растворы удобрений, брать пробу каждого удобрения в отдельности на один и тот же реактив, чтобы можно было сравнивать между собой удобрения.
Задача 3. Получите нитрат меди (II) двумя способами, используя для этого реакции обмена.
Опыт № 1. К сульфату меди (II) добавьте раствор нитрата бария. Что наблюдаете? Запишите уравнения реакций в молекулярном и ионном виде.
Опыт № 2. К оксиду меди (II) прилейте раствор азотной кислоты. Что наблюдаете? запишите уравнения реакций в молекулярном и ионном виде.
Задача 4. Проведите реакции, которые выражаются следующими сокращенными ионными уравнениями:
H+ + OH─ → H2O
Ba2+ + SO42- → BaSO4↓
Ag+ + Cl─ → Ag Cl↓
Практикум по неорганической химии.
9 класс
Химический практикум I
Свойства металлов и их соединений
Практическая работа № 1
Тема: Осуществление цепочки химических превращений
Цель: Провести реакции для соответствующих химических превращений.
Оборудование: карбонат магния, раствор соляной кислоты (1: 3), гидроксид натрия, раствор серной кислоты (1:5), сульфат меди, спиртовка, чашечка для выпаривания, держатель, спички.
Ход работы
Инструкция к выполнению практической работы.
Проведите анализ задач, данных в практической работе, и предложите план их решения. При необходимости обратитесь к учебнику.
Вариант 1.
MgCO3 → MgCl2 → Mg(OH)2 → MgSO4
Опыт 1.
К карбонату магния прилейте соляной кислоты. Что наблюдаете? Запишите уравнения реакций в молекулярной и ионной формах.
Опыт 2.
К полученному раствору добавьте гидроксид натрия. Что наблюдаете? Запишите уравнения реакций в молекулярной и ионной формах.
Опыт 3.
К полученному осадку прилейте серную кислоту. Что наблюдаете? Запишите уравнения реакций в молекулярной и ионной форме.
Вариант 2.
CuSO4 → Cu(OH)2 → CuO→ CuCl2
Проведите реакции, в которых осуществляются записанные химические превращения. Составьте уравнения соответствующих реакций. Реакции ионного обмена запишите также в ионной форме.
Составьте отчёт о проделанной работе.
Приведите в порядок рабочее место.
Практическая работа № 2. (9 класс)
её свойства, получение, применение». 8-й класс
Цели:
- познакомить учащихся с соляной кислотой и её солями;
- систематизировать знания учащихся о химических свойствах кислот;
- познакомить с химическими и физическими свойствами соляной кислоты;
- познакомить с качественной реакцией на хлорид-ион;
- познакомить со способами получения и областями применения соляной кислоты и её солей.
- формировать умение доказывать химические свойства соляной кислоты, правильно записывать свойства с помощью уравнений химических реакций;
- совершенствовать практические трудовые навыки и умения по технике и методике химического эксперимента;
- закрепить знания по технике безопасности при работе с реактивами;
- развивать логическое мышление, умение проводить анализ, сравнение, обобщение;
- развивать творческую активность и самостоятельность учащихся;
- формировать интерес к науке, материалистическое мировоззрение.
Ход урока
1. Организационный момент2. Постановка темы урока, планирование работыУчитель:
Сегодня мы изучим одно из важнейших соединений галогенов. Вспомните, какую кислоту мы используем для получения водорода в лаборатории?Соединением, какого галогена является соляная кислота?
Теперь сформулируйте тему урока. Какое соединение будете изучать?
Какое соединение будете изучать?
Исходя из темы урока, составим план работы.
ПЛАН
1.Историческая справка о веществе (доклад ученика).
2.Способы получения (объяснение учителя, демонстрационный опыт).
3.Физичесие свойства.
4.Химические свойства (практическая работа учащихся в группах).
5.Применение соляной кислоты и её солей (доклад ученика).
6.Биологическая роль соляной кислоты (доклад ученика).
7.Рубрика «Полезные советы».
3.1.Фронтальая работа учащихся
Задание: Заполнить пропуски:
- Формула…
- Название…
- Валентность КО…
- Название соли…
3.2.Историческая справка
Учитель: Откуда, где и когда появилась соляная кислота, кто является её первооткрывателем, истории не известно. Ни древние египтяне, ни греки, ни римляне не открыли соляной кислоты. Ежедневно «пользуясь» этой кислотой, люди жили в неведении об этом имеющем первостепенное значение и в науке и в практике веществе вплоть до 17 века.
Доклад №1 ученика (из кн. Л.Ю.Аликберовой «Занимательная химия» с.241-243).
3.3. Способы получения
Учитель:Начиная со второй половины 17в. в 1658г. немецкий аптекарь-алхимик Иоганн Рудольф Глаубер разработал способ получения соляной кислоты-нагреванием смеси хлорида натрия(поваренной соли) и концентрированной серной кислоты. Реакция стала называться реакцией Глаубера; а получившаяся соль серной кислоты (сульфат натрия) — «глауберова соль».
В России метод Глаубера для получения соляной кислоты нашёл применение только с 1790г., но зато использовался почти до середины 20в.
Реакция Глаубера является и лабораторным способом получения соляной кислоты. Сейчас, основной метод производства HCI в нашей стране – это прямой синтез из хлора и водорода. Хлор и водород получают обычно на одном заводе, в одном цехе и в одном процессе – при электролизе раствора поваренной соли. Смесь хлора и водорода спокойно горит в специальном реакторе. Газообразный хлороводород поглощают водой. (См. учебник Л.В.Гузей с.214 рис.12, 16)
Смесь хлора и водорода спокойно горит в специальном реакторе. Газообразный хлороводород поглощают водой. (См. учебник Л.В.Гузей с.214 рис.12, 16)
H2 + Cl2 —> 2HCl
И в лабораторном и в промышленном способах реакции протекают в присутствии воды, т.к. в результате данных реакций образуется газообразный хлороводород, а раствор его в воде, ничто иное как соляная кислота.
Демонстрация лабораторного способа получения соляной кислоты.
2 NaCl + H2SO4 —> Na2SO4 + 2HCl
Условия проведения эксперимента.
1) Серную кислоту нужно приливать осторожно, чтобы она лишь смочила вещество, но не выступала над его поверхностью. Сразу закрыть пробирку пробкой с газоотводной трубкой.
2) Нагревать смесь нужно слабо, т.к.сильное нагревание может привести к выбросу хлороводорода и к растрескиванию пробирки.
3) Конец газоотводной трубки не должен касаться поверхности воды, т.к. это может привести к засасыванию воды.
4) Реакция должна проводиться в присутствии индикатора.
3.4.Физические свойства
Учитель: Водный раствор хлороводорода – соляная кислота. Концентрированная HCl содержит примерно 35–38% хлороводорода.
HCl – безцветная жидкость,концентрированная – дымится на воздухе.
3.5.Химические свойства
Вопросы перед работой в группах:
1) Какие общие химические свойства кислот вы знаете?
2) С какими веществами будет реагировать соляная кислота?
Доклад №2 ученика (из мет. «Поурочные разработки» с.154)
Работа в группах.
1 группа. Действие соляной кислоты на индикаторы.
2 группа. Взаимодействие соляной кислоты с металлами.
3 группа. Взаимодействие соляной кислоты с оксидами металлов.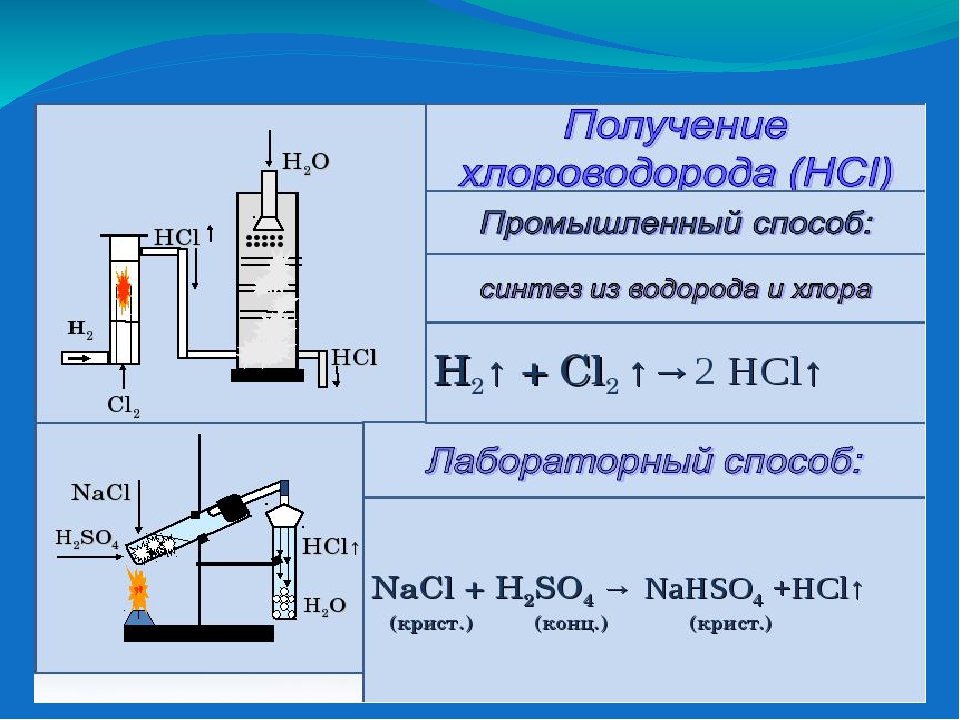
4 группа. Взаимодействие соляной кислоты с основаниями.
(Работа в группах проводится по инструкциям)
Качественная реакция на хлорид-ион.
Учитель: Есть ещё одно химическое свойство общее для кислот, которое поможет нам провести качественную реакцию на соляную кислоту и её соли.
Что это за свойство,как вы думаете?
(Взаимодействие с солями, где сильная кислота вытесняет слабую из её солей).
Демонстрационные опыты.
1) Даны 4 пробирки с растворами кислот: соляной, уксусной, азотной, серной. Во все пробирки добавляется нитрат серебра или ацетат свинца(или нитрат свинца).
Вопрос: В какой пробирке с какой кислотой произошла химическая реакция?
По какому признаку определили? (В результате образовался белый творожный осадок).
А можно ли нитратом серебра обнаружить соли соляной кислоты?
2) Даны 4 пробирки растворов солей: хлорид натрия, сульфат натрия, сульфат меди. Во все пробирки добавить нитрат серебра.
Вопрос: В какой пробирке произошла реакция? Что образовалось?
Запись уравнений реакций:
HCl + AgNO3 —> AgCl + HNO3
NaCl +AgNO3 —> AgCl +NaNO3
Дополнение: HCl – сильная кислота. Смесь концентрированной азотной и соляной кислот в соотношении 1V:3V назвали «царской водкой»,т.к.она растворяет такой металл как золото,который является так называемым «царём всех металлов».
3.6. Применение соляной кислоты и её солей
Учитель: В 18в. в России соляная кислота вовсе не ценилась, поэтому на заводах по производству глауберовой соли хлороводород выпускали с дымом на воздух. А это вредило атмосфере, растительности.
Теперь никому не придёт в голову выпускать хлороводород в воздух, и не только оттого, что это вредно для окружающей среды, но и потому, что хлороводород и соляная кислота – чрезвычайно нужные химические продукты.
Доклад №3 ученика о применении соляной кислоты.
Доклад №4 ученика о применении солей соляной.
3.7.Биологическая роль хлора и соляной кислоты
Учитель: Соляная кислота играет большую роль в жизнедеятельности организмов. Начнём с того, что HCl – вещество, присутствующее (хотя и в небольших количествах) в человеческом организме.
Доклад №5 ученика (из мет. «Поурочные разработки» с.153,207).
3.8.Полезные советы
Учитель: Какая соль соляной кислоты самая распространённая?
Послушайте, какие чудеса может совершить обычная поваренная соль!
Доклад №6 ученика (из мет. «Поурочные разработки» с.208-209).
4. Итог урокаУчитель:
- С каким веществом познакомились?
- Что интересного узнали?
- Какая реакция является качественной реакцией на соляную кислоту и её соли?
Опыты по химии. Соляная кислота
Получение соляной кислоты (практическая работа)
Соляная кислота HCl получается при растворении газа хлороводорода воде.
Хлороводород можно получить действием концентрированной серной кислоты на поваренную соль.
NaCl + H2SO4 = HCl ↑ + Na2HSO4
Направим поток хлороводорода в пробирку с водой. Этот газ легко растворяется в воде: до 450 объемов хлороводорода — в одном объеме воды. В пробирке образуется соляная кислота – раствор хлороводорода в воде.
Оборудование: пробирка, штатив для пробирок, пробирка с газоотводной трубкой, штатив, химические стаканы, воронка.
Техника безопасности.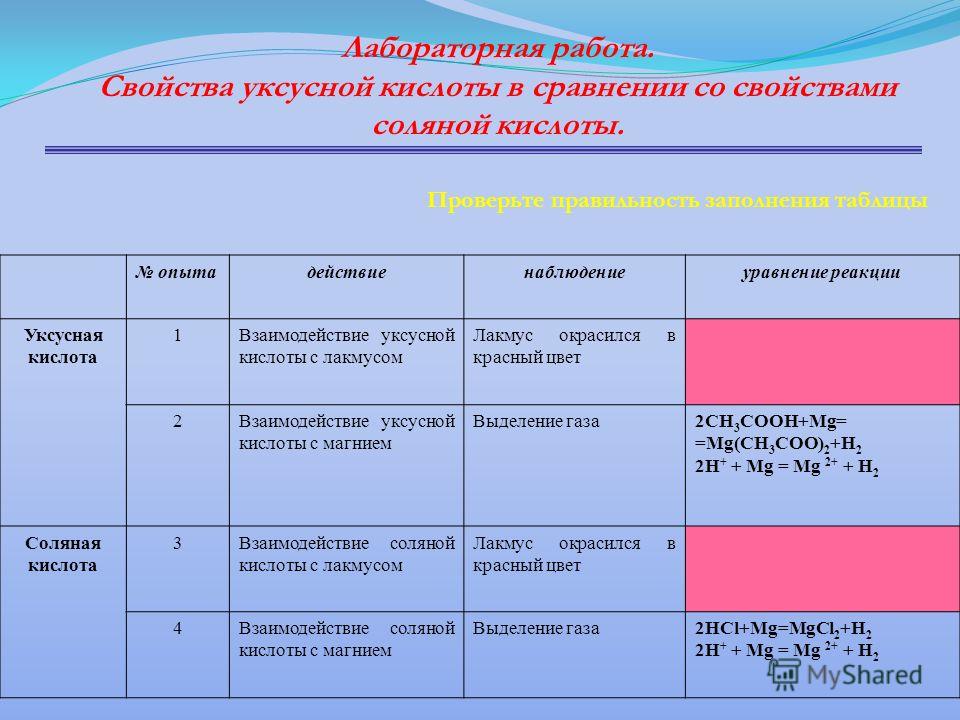 Соблюдать правила работы с нагревательными приборами. Необходима особая осторожность при работе с концентрированной серной кислотой. Недопустимо попадание выделяющегося хлороводорода в дыхательные пути. Опыт следует проводить под тягой.
Соблюдать правила работы с нагревательными приборами. Необходима особая осторожность при работе с концентрированной серной кислотой. Недопустимо попадание выделяющегося хлороводорода в дыхательные пути. Опыт следует проводить под тягой.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Химические свойства соляной кислоты (практическая работа)
Соляная кислота это раствор хлороводорода в воде. Чтобы получить кислоту, получим хлороводород взаимодействием растворов поваренной соли и серной кислоты.
NaCl + H2SO4 = HCl + Na2HSO4.
Растворим хлороводород в воде, получится кислота. Соляная кислота – сильная кислота с типичными для кислот свойствами. Соляная кислота взаимодействует с основаниями с образованием солей и воды. В стакане со щелочью при добавлении соляной кислоты происходит реакция нейтрализации ‑ цвет индикатора изменяется, указывая на появление нейтральной среды.
HCl + NaOH = NaCl+ H2O
Проведем качественную реакцию на хлорид-ион – реакцию с нитратом серебра.
Образуется нерастворимая соль – хлорид серебра.
HCl + AgNO3 = AgCl ↓ + HNO3
Соляная кислота взаимодействует с активными металлами: Когда цинк попадает в раствор соляной кислоты – начинается бурное выделение водорода.
2HCl + Zn = ZnCl2 + H2 ↑
Мы убедились в том, что соляная кислота реагирует с металлами, основаниями, солями.
Оборудование: спиртовка, шпатель, пробирка, штатив для пробирок, пробирка с газоотводной трубкой, штатив, химические стаканы, воронка.
Техника безопасности. Следует соблюдать правила работы с растворами кислот и щелочей. Избегать попадания кислот, щелочей, нитрата серебра на кожу и слизистые оболочки.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Растворение хлороводорода в воде
14.2: Кислоты — свойства и примеры
Цели обучения
- Изучить свойства кислот.
Многие люди любят пить кофе. Чашка с утра помогает начать день. Но содержать кофеварку в чистоте может быть проблемой. Через некоторое время накапливаются известковые отложения, которые замедляют процесс пивоварения. Лучшее лекарство от этого — налить в кастрюлю уксус (разбавленную уксусную кислоту) и пропустить его через цикл заваривания. Уксус растворяет отложения и очищает кофеварку, что ускоряет процесс пивоварения до исходной скорости.Просто обязательно пропустите воду в процессе заваривания после уксуса, иначе вы получите действительно ужасный кофе.
Кислоты
Кислоты очень часто встречаются в некоторых продуктах, которые мы едим. Цитрусовые, такие как апельсины и лимоны, содержат лимонную кислоту и аскорбиновую кислоту, более известную как витамин С. Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
Газированные газированные напитки содержат фосфорную кислоту. Уксус содержит уксусную кислоту. Ваш собственный желудок использует соляную кислоту для переваривания пищи. Кислоты представляют собой отдельный класс соединений из-за свойств их водных растворов, как указано ниже:
- Водные растворы кислот являются электролитами, то есть проводят электрический ток.Некоторые кислоты являются сильными электролитами, потому что они полностью ионизируются в воде, давая большое количество ионов. Другие кислоты представляют собой слабые электролиты, которые существуют в основном в неионизированной форме при растворении в воде.
- Кислоты имеют кислый вкус. Лимоны, уксус и кислые конфеты содержат кислоты.
- Кислоты изменяют цвет определенных кислотно-щелочных индикаторов. Два общих индикатора — это лакмусовая бумажка и фенолфталеин. Синий лакмус становится красным в присутствии кислоты, а фенолфталеин становится бесцветным.
- Кислоты реагируют с активными металлами с образованием газообразного водорода. Напомним, что серия активности — это список металлов в порядке убывания их реакционной способности. Металлы, которые находятся выше водорода в ряду активности, будут заменять водород кислоты в реакции однократного замещения, как показано ниже:
\ [\ ce {Zn} \ left (s \ right) + \ ce {H_2SO_4} \ left (aq \ right) \ rightarrow \ ce {ZnSO_4} \ left (aq \ right) + \ ce {H_2} \ left (g \ right) \ label {eq1} \] - Реакция взаимодействия кислоты и основания с образованием соединения соли и воды.Когда равные моли кислоты и основания объединяются, кислота нейтрализуется основанием. Продуктами этой реакции являются ионное соединение, обозначенное как соль, и вода.
Вам не составит труда назвать несколько распространенных кислот (но вы можете обнаружить, что перечисление оснований немного сложнее). Ниже приведен частичный список некоторых распространенных кислот, а также некоторые химические формулы:
Имя химика | Общее название | Использует |
|---|---|---|
соляная кислота, HCl | соляная кислота (используется в бассейнах) и желудочная кислота HCl | Используется при очистке (рафинировании) металлов, при обслуживании бассейнов и для уборки дома. |
серная кислота, H 2 SO 4 | Используется в автомобильных аккумуляторах и при производстве удобрений. | |
азотная кислота, HNO 3 | Используется при производстве удобрений, взрывчатых веществ и при добыче золота. | |
уксусная кислота, HC 2 H 3 O 2 | уксус | Основной ингредиент в уксусе. |
угольная кислота, H 2 CO 3 | отвечает за «шипение» в газированных напитках | В качестве ингредиента газированных напитков. |
лимонная кислота, C 6 H 8 O 7 | Используется в продуктах питания и диетических добавках. Также добавляется в качестве подкислителя в кремы, гели, жидкости и лосьоны. | |
ацетилсалициловая кислота, C 6 H 4 (OCOCH 3 ) CO 2 H | аспирин | Активный ингредиент аспирина. |
Что именно делает кислоту кислотой и что заставляет основание действовать как основание? Взгляните на формулы, приведенные в таблице выше, и сделайте предположение.
соляная кислота
Соляная кислота — это сильная коррозионная минеральная кислота, которая используется во многих промышленных целях.{-} (водн.)} \]
Соляная кислота поэтому может использоваться для получения хлоридных солей. Соляная кислота — сильная кислота, так как полностью диссоциирует в воде. Соляная кислота является предпочтительной кислотой при титровании для определения количества оснований.
Серная кислота
Серная кислота — сильнодействующая минеральная кислота с высокой коррозионной активностью с молекулярной формулой \ (\ ce {h3SO4} \). Серная кислота является дипротоновой кислотой и имеет широкий спектр применения, включая использование в бытовых кислотных очистителях канализации, [ в качестве электролита в свинцово-кислотных аккумуляторах и в различных чистящих средствах.Это также центральное вещество в химической промышленности.
Рисунок \ (\ PageIndex {1} \): Капли концентрированной серной кислоты быстро разлагают кусок хлопкового полотенца путем обезвоживания. (CC BY-SA 3.0; Токсичный ходок).Поскольку гидратация серной кислоты является термодинамически благоприятной (и сильно экзотермической), а ее сродство к воде достаточно велико, серная кислота является отличным дегидратирующим агентом. Концентрированная серная кислота обладает очень сильным обезвоживающим свойством, удаляя воду (\ (\ ce {h3O} \)) из других соединений, включая сахар и другие углеводы, и выделяя углерод, тепло и пар.Серная кислота ведет себя как обычная кислота в реакции с большинством металлов, выделяя газообразный водород (уравнение \ ref {Eq1}).
\ [\ ce {M + h3SO4 → M (SO4) + h3} \ label {Eq1} \]
Азотная кислота
Азотная кислота (\ (\ ce {HNO3} \)) — очень коррозионная минеральная кислота, которая также широко используется в качестве сильного окислителя. Азотная кислота обычно считается сильной кислотой при температуре окружающей среды. Азотную кислоту можно получить путем реакции диоксида азота (\ (\ ce {NO_2 (g)} \)) с водой.
\ [\ ce {3 NO2 (г) + h3O (l) → 2 HNO3 (ag) + NO (г)} \]
Азотная кислота реагирует с большинством металлов, но детали зависят от концентрации кислоты и природы металла. Разбавленная азотная кислота ведет себя как обычная кислота в реакции с большинством металлов (например, азотная кислота с магнием, марганцем или цинком выделяет газ \ (\ ce {h3} \)):
\ [\ ce {Mg + 2 HNO3 → Mg (NO3) 2 + h3} \]
\ [\ ce {Mn + 2 HNO3 → Mn (NO3) 2 + h3} \]
\ [\ ce {Zn + 2 HNO3 → Zn (NO3) 2 + h3} \]
Азотная кислота — это едкая кислота и мощный окислитель.Основная опасность, которую он представляет, — это химический ожог, так как он осуществляет кислотный гидролиз с белками (амидом) и жирами (сложным эфиром), что, следовательно, разлагает живую ткань (рисунок \ (\ PageIndex {2} \)). Концентрированная азотная кислота окрашивает кожу человека в желтый цвет из-за реакции с кератином
. Рисунок \ (\ PageIndex {2} \): ожог второй степени, вызванный азотной кислотой. (CC BY-SA 3.0; Алькаман).Угольная кислота
Угольная кислота представляет собой химическое соединение с химической формулой \ (\ ce {h3CO3} \), а также иногда называют растворы углекислого газа в воде (газированная вода), потому что такие растворы содержат небольшие количества \ (\ ce {h3CO3 (водн.)} \).Угольная кислота, которая является слабой кислотой, образует два вида солей: карбонаты и бикарбонаты. В геологии углекислота вызывает растворение известняка с образованием бикарбоната кальция, что приводит к образованию многих особенностей известняка, таких как сталактиты и сталагмиты. Угольная кислота представляет собой полипротонную кислоту, в частности, она дипротонна, что означает, что она имеет два протона, которые могут диссоциировать от исходной молекулы.
Когда диоксид углерода растворяется в воде, он находится в химическом равновесии (обсуждается в главе 15), образуя угольную кислоту:
\ [\ ce {CO2 + h3O <=> h3CO3} \]
Реакцию можно подтолкнуть к тому, чтобы реагенты генерировали \ (\ ce {CO2 (g)} \) из раствора, что является ключом к пузырькам, наблюдаемым в газированных напитках (рисунок \ (\ PageIndex {3} \)).
Рисунок \ (\ PageIndex {3} \): стакан газированной воды. (CC BY-SA 3.0; Невит Дильмен).Муравьиная кислота
Муравьиная кислота (\ (\ ce {HCO2H} \)) представляет собой простейшую карбоновую кислоту и является важным промежуточным продуктом в химическом синтезе и встречается в природе, особенно у некоторых муравьев. Слово «муравьиный» происходит от латинского слова «муравей», formica, что указывает на его раннее выделение путем дистилляции муравьиных тел. Муравьиная кислота широко встречается в природе в виде конъюгированного с ней формиата основания.
Лимонная кислота
Лимонная кислота (\ (\ ce {C6H8O7} \)) — слабая органическая трикарбоновая кислота, которая в природе встречается в цитрусовых.Цитрат-ион является промежуточным звеном в цикле TCA (цикл Кребса), центральном метаболическом пути для животных, растений и бактерий. Поскольку это одна из наиболее сильных пищевых кислот, лимонная кислота чаще всего используется в качестве ароматизатора и консерванта в продуктах питания и напитках, особенно в безалкогольных напитках.
Рисунок \ (\ PageIndex {4} \): лимоны, апельсины, лаймы и другие цитрусовые содержат высокую концентрацию лимонной кислоты (CC BY-SA 2.5; Андре Карват).Ацетилсалициловая кислота
Ацетилсалициловая кислота (также известная как аспирин) — это лекарство, используемое для лечения боли, лихорадки и воспалений.Аспирин в виде листьев ивы использовался для улучшения здоровья уже не менее 2400 лет.
Рисунок \ (\ PageIndex {5} \): шариковая модель молекулы аспирина. (Общественное достояние; Бен Миллс).Аспирин — белое кристаллическое слабокислотное вещество.
Сводка
Был дан краткий обзор ключевых аспектов некоторых кислот, с которыми обычно сталкиваются студенты. Кислоты представляют собой особый класс соединений из-за свойств их водных растворов.
Добавления и авторства
Эта страница была создана на основе содержимого следующими участниками и отредактирована (тематически или всесторонне) командой разработчиков LibreTexts в соответствии со стилем, представлением и качеством платформы:
Характеристики и способы получения хлора и его реакции с водой
[Депонировать фотографии]Хлор был впервые описан шведским химиком Шееле в «Трактате о пиролюзите».Ученый нагрел минерал пиролюзит соляной кислотой и заметил запах, характерный для царской водки. Он собрал желто-зеленый газ, вызывающий этот запах, и начал изучать его взаимодействие с другими веществами. Химик первым открыл отбеливающие свойства хлора и заметил влияние хлора на золото и киноварь. Элемент был назван ученым Дэви, который много изучал ядовитый газ.
Общие характеристики хлора
Хлор — галоген, очень мощный окислитель, чрезвычайно ядовитый газ и важный продукт химической промышленности. Это сырье для производства токсичных химикатов, пластмасс, искусственного волокна, резины, лекарств и красителей. Его используют для получения кремния, титана, фторопласта и глицерина. Хлор используется для отбеливания тканей и очистки питьевой воды.
В обычных условиях хлор представляет собой тяжелый желто-зеленый газ с характерным запахом.Его атомный вес — 35,453, а молекулярный вес — 70,906. Один литр хлора в газообразном состоянии в нормальных условиях весит 3,214 г. Если хлор охладить до температуры -34,05 градуса по Цельсию, газ конденсируется в желтую жидкость, а при температуре -101,6 градуса по Цельсию он становится твердым.
[Депонировать фотографии]При высоком давлении хлор превращается в жидкость даже при более высоких температурах.Этот газ обладает высокой активностью — он сочетается практически со всеми элементами таблицы Менделеева. По этой причине в природе хлор встречается исключительно в виде соединений. Хлор содержится в таких минералах, как галит, сильвинит, бишофит, карналлит и каинит. Эти минералы «виноваты» в том, что в земной коре содержится 0,17% хлора по весу. Для цветной металлургии важны такие относительно редкие минералы, содержащие хлор, как роговое серебро.Жидкий хлор входит в число сильнейших изоляторов электропроводности — вещество проводит ток почти в миллион раз хуже, чем дистиллированная вода, и в тысячу раз хуже, чем серебро. Скорость звука в хлоре в 1,5 раза меньше, чем в воде.
В настоящее время науке известно девять изотопов хлора, но в природе встречаются только два — хлор-35 и хлор-37. Хлор-35 встречается в три раза чаще, чем хлор-37. Семь из девяти изотопов получены искусственным путем.Самый короткоживущий изотоп, хлор-32, имеет период полураспада 0,306 секунды, а самый долгоживущий изотоп — хлор-36, который может «жить» 310 000 лет.
Хлор сжиженный отображается в кварцевой ампуле [Википедия]Способы получения хлора
Производство хлора требует большого количества электроэнергии для расщепления природных соединений этого элемента.Основным сырьем для получения хлора является обычная каменная соль, недорогой продукт, который используется в больших количествах (для получения 1 тонны хлора требуется не менее 1,7 тонны соли). Вы можете провести интересный и очень простой эксперимент по получению хлора электролизом хлорида натрия даже в домашних условиях.
Сначала соль измельчают, затем растворяют в теплой воде. Полученный раствор перекачивают в комнату очистки, где удаляют соли калия и магния, а затем осветляют (дают отстояться).Чистый концентрированный раствор хлорида натрия перекачивается в камеру.
Существует два типа промышленного производства хлора: ртутный и диафрагменный методы. Во втором случае перфорированный лист железа действует как катод, а катодная и анодная части электролитических ячеек разделены асбестовой диафрагмой. На железный катод выделяются ионы водорода, образуется водный раствор едкого натрия. Когда ртуть используется в качестве катода, ионы натрия разряжаются и образуется амальгама натрия, которая затем расщепляется водой.Форма водорода и едкого натрия. В этом случае разделительная диафрагма не нужна, а щелочь имеет высокую концентрацию.
Производство хлора одновременно включает производство водорода и едкого натрия. Водород удаляется в металлических трубах, а хлор — в керамических или стеклянных трубах. «Свежий» хлор насыщен водяным паром и поэтому проявляет свои наиболее агрессивные свойства. Хлор сначала охлаждают холодной водой в башнях, облицованных керамической плиткой, затем сушат концентрированной серной кислотой, которая является единственным осушающим агентом хлора, с которым элемент не реагирует.
Сухой хлор менее агрессивен и не оказывает разрушающего действия на металл. Хлор транспортируется в жидком состоянии в баллонах под давлением до 10 атмосфер или в железнодорожных цистернах. Для сжатия и перекачки хлора на заводах используются насосы с серной кислотой, которые одновременно выполняют роль смазки и рабочего тела.
Старинный аппарат для производства газообразного хлора [Депонировать фотографии]Реакция хлора с водой
Хлор растворяется в воде при 20 градусах Цельсия 2.В одном объеме воды растворяется 3 объема хлора. Изначально водный раствор хлора желтого цвета, но при длительном хранении на свету раствор постепенно теряет цвет. Это связано с тем, что растворенный хлор вступает в частичную реакцию с водой, образуя соляную и хлорноватистую кислоты. Раствор хлора в воде постепенно превращается в раствор соляной кислоты, так как хлорноватистая кислота нестабильна и постепенно распадается на хлористый водород и кислород.
При низких температурах хлор и вода вступают в реакцию и образуют кристаллогидрат необычного состава. Это кристаллы зелено-желтого цвета, которые стабильны только при температуре ниже 10 градусов Цельсия и образуются при прохождении хлора через воду, содержащую лед. В кристаллической структуре льда молекулы воды могут быть расположены так, что между ними появляются равномерно расположенные промежутки. Элементарная кубическая ячейка содержит 46 молекул воды с 8 микроскопическими промежутками между ними.В этих пространствах оседают молекулы хлора.
Хлористый водород | Encyclopedia.com
Свойства
Раннее открытие хлористого водорода
Приготовление и использование
Ресурсы
Хлористый водород — это химическое соединение, состоящее из элементов водорода и хлора. Он легко растворяется в воде с образованием раствора, называемого соляной кислотой. Оба вещества имеют много важных промышленных применений, в том числе в металлургии, производстве фармацевтических препаратов, красителей и синтетического каучука.Соляная кислота содержится в большинстве лабораторий, поскольку ее сильная кислотная природа делает ее чрезвычайно полезным веществом для анализов и в качестве общей кислоты. Поскольку хлористый водород и соляная кислота так тесно связаны, их обычно обсуждают вместе.
Хлористый водород представлен химической формулой HCl. Это означает, что молекула хлористого водорода содержит один атом водорода и один атом хлора. При комнатной температуре (около 77 ° F [25 ° C]) и давлении в одну атмосферу хлористый водород существует в виде газа.Следовательно, его обычно хранят под давлением в металлических контейнерах.
Намного более удобный способ использования хлористого водорода — растворение его в воде с образованием раствора. Хлористый водород хорошо растворяется в воде, последняя растворяет в сотни раз больше собственного объема газообразного хлористого водорода. Полученный раствор известен как соляная кислота, и ему также обычно дают химическую формулу HCl. Коммерческая соляная кислота обычно содержит 28-35% хлористого водорода по массе и обычно называется концентрированной соляной кислотой.Когда меньшие количества хлористого водорода растворяются в воде, раствор известен как разбавленная соляная кислота.
Хлористый водород — бесцветный негорючий газ с едким запахом. Газ конденсируется в жидкость при -121 ° F (-85 ° C) и замерзает в твердое состояние при -173,2 ° F (-114 ° C). Соляная кислота — бесцветная дымящаяся жидкость с раздражающим запахом. И хлористый водород, и соляная кислота вызывают коррозию, поэтому с ними нужно обращаться с большой осторожностью. Оба вещества сильно раздражают глаза и очень токсичны при вдыхании или проглатывании.Воздействие паров хлористого водорода может привести к повреждению носовых проходов и вызвать кашель, пневмонию, головные боли и учащенное сердцебиение; смерть может наступить из-за воздействия уровней в воздухе выше примерно 0,2%. Концентрированные растворы соляной кислоты вызывают ожоги и воспаление кожи. Химики всегда надевают защитные перчатки и защитные очки при использовании хлористого водорода или соляной кислоты и обычно работают в хорошо вентилируемом помещении, чтобы уменьшить воздействие паров.
В то время как сухой газообразный хлористый водород довольно инертен, влажный газообразный хлористый водород (и растворы соляной кислоты) вступают в реакцию со многими металлами.Следовательно, сухой газообразный хлористый водород можно хранить в металлических контейнерах, тогда как с растворами высококоррозионной соляной кислоты необходимо обращаться с кислотостойкими материалами, такими как керамика или стекло. Когда соляная кислота реагирует с металлами, обычно образуется газообразный водород и соединения, известные как хлориды металлов. Хлориды металлов образуются, когда металл вытесняет водород из хлористого водорода. Например, металлический цинк растворяется в соляной кислоте с образованием газообразного водорода и хлорида цинка.И влажный хлористый водород, и соляная кислота также реагируют со многими соединениями, включая оксиды, гидроксиды и карбонаты металлов. Все это примеры основных соединений, которые нейтрализуют соляную кислоту и образуют хлориды металлов.
Как и большинство кислот, хлористый водород образует в воде ионы водорода. Это положительно заряженные атомы водорода, которые очень реактивны и ответственны за то, что все кислоты ведут себя примерно одинаково. Поскольку все атомы водорода в хлористом водороде превращаются в ионы водорода, соляная кислота называется сильной кислотой.Азотная и серная кислоты — другие примеры сильных кислот.
Алхимики средневековья впервые получили хлористый водород путем нагревания обычной соли (хлорида натрия) с сульфатом железа. Немецкий химик Иоганн Глаубер (1604-1668) получил хлористый водород путем реакции соли с серной кислотой, и это стало обычным методом получения хлористого водорода в лаборатории. Пропуская газообразный хлористый водород в воду, образуется соляная кислота.
Поскольку хлористый водород сначала был приготовлен из соли, соляная кислота первоначально называлась соляным спиртом.В коммерческих целях ее также обычно называли соляной кислотой, от латинского muria, , что означает рассол или соленая вода. Соляная кислота растворяет многие вещества, и алхимики сочли эту кислоту очень полезной в своей работе. Например, его использовали для растворения нерастворимых руд, что упростило методы химического анализа для определения содержания металлов в рудах. Смесь соляной кислоты и азотной кислоты (известная как царская водка) также стала очень полезной, поскольку это была единственная кислота, которая растворяет золото.
Хлористый водород можно получить в промышленных масштабах реакцией соли с серной кислотой. Он также быстро образуется при температуре выше 482 ° F (250 ° C) за счет прямого сочетания элементов водорода и хлора и образуется как побочный продукт при производстве хлорированных углеводородов. Соляную кислоту получают путем пропускания газообразного хлористого водорода в воду.
Хлористый водород и соляная кислота имеют много важных практических применений. Они используются в производстве фармацевтических гидрохлоридов (водорастворимых лекарств, растворяющихся при проглатывании), хлора и различных хлоридов металлов, в многочисленных реакциях органических (углеродсодержащих) соединений, а также в пластмассовой и текстильной промышленности.Соляная кислота используется для производства удобрений, красителей, искусственного шелка и красок; при рафинировании пищевых масел и жиров; в гальванике, дублении кожи, рафинировании и обогащении руд, производстве мыла, добыче нефти, очистке металлов, а также в фотографической и резиновой промышленности.
Небольшие количества соляной кислоты встречаются в природе в выбросах действующих вулканов и в водах из вулканических горных источников. Кислота также присутствует в пищеварительных соках, выделяемых железами в стенке желудка, и поэтому является важным компонентом пищеварения.Когда в пищеварительной системе вырабатывается слишком много соляной кислоты, могут образовываться язвы желудка. Недостаточная секреция желудочной кислоты также может привести к проблемам с пищеварением.
См. Также Кислоты и основания.
КНИГИ
Эмсли, Джон. Строительные блоки природы: руководство по элементам от А до Я . Oxford: Oxford University Press, 2002.
Heiserman, D.L. Изучение химических элементов и их соединений . Саммит Голубого хребта, Пенсильвания: Tab Publications, 1992.
Mahn, W.J. Руководство по химическим опасностям в академической лаборатории . Нью-Йорк: Van Nostrand Rheinhold, 1991.
Salzberg, H.W. От пещерного человека до химика . Вашингтон, округ Колумбия: Американское химическое общество, 1991.
Sittig, M. Справочник по токсичным и опасным химическим веществам и канцерогенам . 3-е изд. Park Ridge, NJ: Noyes Publications, 1991.
OTHER
Агентство по охране окружающей среды США: Сеть передачи технологий, веб-сайт Air Toxics .«Соляная кислота (хлористый водород)»
Университетский колледж Корка, химический факультет . «Хлористый водород»
Николас К. Томас
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
БЕЗОПАСНОСТЬ — Хранение, транспортировка, обращение и утилизация соляной кислоты
БЕЗОПАСНОСТЬ — Хранение, транспортировка, обращение и утилизация соляной кислоты
БЕЗОПАСНОСТЬ - Хранение, транспортировка, обращение и утилизация соляной кислоты
В ответ обратитесь к:
Mail Stop 405, 22 ноября 1993 г.
МЕМОРАНДУМ ОТДЕЛЕНИЯ ВОДНЫХ РЕСУРСОВ №94,06
Тема: БЕЗОПАСНОСТЬ - Хранение, транспортировка, обращение и утилизация
соляной кислоты
Целью данного меморандума по безопасности является предоставление технических
руководство по обращению, хранению, транспортировке и утилизации
химической соляной кислоты (HCL) в соответствии с применимыми
Федеральные и государственные постановления.
ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ:
Соляная кислота - бесцветная жидкость с острым и
чрезвычайно раздражающий запах. При контакте с воздухом возникает
немедленное выделение токсичного газообразного хлористого водорода.Как сильная
коррозионная кислота, соляная кислота реагирует со многими металлами
производство горючего водорода, способного взорваться
опасность.
ОПАСНОСТИ ДЛЯ ЗДОРОВЬЯ:
Острые эффекты
A. Проглатывание - слизистая оболочка, а также сильное разъедание пищевода
травма, повреждение. Химические ожоги рта, глотки и желудка
может развиваться. Травма может быть серьезной и привести к смерти.
Первая помощь - не вызывать рвоту. Разбавьте кислоту
немедленно, выпив большое количество воды или молока.
Если рвота не проходит, дайте жидкости несколько раз.Проглоченную кислоту необходимо разбавить примерно в 100 раз до
обезвреживают ткани. Обратитесь за медицинской помощью
немедленно. При рвоте держите голову ниже бедер, чтобы
предотвратить аспирацию.
B. Вдыхание - Тяжелый отек легких и пневмонит могут
в результате вдыхания хлористого водорода (соляной
кислота) газ. Существовавшее ранее заболевание легких может обостриться.
по выдержке. Изъязвления носа, горла и гортани.
Первая помощь - вынести из зоны воздействия на свежий воздух.
немедленно.Если дыхание остановилось, сделайте искусственное
дыхание. Если возможно, введите кислород. Держать
пострадавший в тепле и покое. Обратитесь за медицинской помощью
немедленно.
C. Кожные - Изъязвления кожи. Соляная кислота будет
вероятно, не всасывается через кожу.
Первая помощь - снимите зараженную одежду и обувь.
немедленно. Вымойте пораженный участок с мылом или мягким раствором.
моющее средство и большое количество воды, пока не исчезнут признаки
химическое вещество остается.Немедленно обратитесь за медицинской помощью
при химическом ожоге.
D. Глаза - соляная кислота вызывает химические ожоги при контакте.
человеческими глазами, что может привести к необратимому повреждению роговицы.
повреждать.
Первая помощь - немедленно промыть глаза большим количеством
воды, периодически приподнимая верхнее и нижнее веко, пока
никаких следов химического вещества (минимум 15-20 минут).
Немедленно обратитесь за медицинской помощью.
Хронические эффекты
A. Канцерогенность - не сообщалось.B. Мутагенность - не сообщалось.
C. Токсичность - Продолжительное или многократное воздействие может привести к
нарушение дыхания и бронхит. Слизистые оболочки
серьезно повреждены в результате многократного воздействия.
ВНИМАНИЕ / ВНИМАНИЕ
Соляная кислота является сильным коррозионным веществом, поэтому следует соблюдать осторожность.
для предотвращения контакта с металлами, аминами и щелочами, которые могут
вызвать выделение легковоспламеняющегося газообразного водорода и токсичных или коррозионных
пары.
ПРЕДЕЛЫ ВОЗДЕЙСТВИЯ:
Предел допустимого воздействия в воздухе (PEL) для хлористого водорода
(соляная кислота) составляет 5 частей на миллион за 8-часовой рабочий день.Концентрация
100 ppm считается непосредственно опасным для жизни или
здоровье (IDLH).
ОБРАЩЕНИЕ И ИСПОЛЬЗОВАНИЕ В ПОЛЕВЫХ УСЛОВИЯХ:
Из-за возможности выделения токсичных паров соляная кислота
ни в коем случае нельзя открывать, смешивать или переносить в другие контейнеры на
в любое время, находясь в автомобиле или в любом другом небольшом помещении без
механизм для вывода всех паров наружу. Данные о безопасности материалов
Лист (MSDS) должен постоянно находиться у пользователя и
предоставляется тем, кто работает с этим химическим веществом.Паспорт безопасности материалов для
соляная кислота должна находиться в лабораторных и полевых файлах, содержащих
все соответствующие паспорта безопасности материалов. Файлы MSDS должны иметь четкую маркировку и
легко доступен для всего персонала.
Транспорт
Соляную кислоту нельзя перевозить только в пластиковом контейнере.
стеклянная тара с покрытием, точно маркированная и надлежащим образом хранимая в
автомобиль, чтобы предотвратить смещение, просыпание или поломку. Контейнеры
соляной кислоты, перевозимой в транспортных средствах в теплом климате, следует
помещены в кулеры, чтобы защитить их от чрезмерного нагрева.Несмотря на то что
соляная кислота имеет температуру кипения 110 градусов по Цельсию (230 градусов по Фаренгейту).
его следует транспортировать при комнатной температуре, чтобы свести к минимуму накопление
давление газа в баллоне.
Разливы на случай непредвиденных обстоятельств и меры реагирования
Во время эксплуатации, транспортировки и везде, где случайно
вероятность разлива, каждая лаборатория и полевое подразделение должны иметь,
как часть необходимого аварийного оборудования, достаточное количество абсорбента
материалы, такие как бикарбонат натрия, кальцинированная сода или известь, для обработки
небольшие разливы.Сгребайте химические отходы в контейнер и как следует
этикетка как «использованная соляная кислота». Остатки смывки от разлива с
обильное количество воды. Не позволяйте стокам загрязнять воду
запасов или близлежащих ручьев или рек. Не пытайтесь очистить, если
использование средств защиты кожи, глаз и органов дыхания. Поскольку соляная
кислота имеет pH менее 1, выброшенный материал является опасным отходом
(Агентство по охране окружающей среды (EPA) Опасные отходы № D002,
40 CFR 261.22), включая пустые емкости для соляной кислоты.Напрасно тратить
материал следует хранить в безопасном месте и иметь четкую маркировку для специальных
утилизация подрядчиком по переработке. Запишите, сколько химического
была пролита и метод очистки и надлежащей утилизации, в соответствии с требованиями
по правилам обращения с опасными отходами.
СРЕДСТВА ИНДИВИДУАЛЬНОЙ ЗАЩИТЫ:
Поскольку соляная кислота является сильным коррозионным веществом, кислотостойким
следует надевать фартук, перчатки и защитную маску или защитные очки.
все время при заливке, смешивании или переносе этого химического вещества.
Работать с соляной кислотой следует в хорошо проветриваемом помещении или
под вытяжным шкафом для разрешенных кислот.Из-за своей природы
вызвать сильные химические ожоги, промыть глаза и быстро смочить
душ должен быть доступен в рабочей зоне.
МЕСТО ХРАНЕНИЯ:
Соляную кислоту следует хранить в плотно закрытой таре и
Хранить в химической зоне, совместимой с другими химическими веществами.
Хранить в безопасном, хорошо проветриваемом месте, хорошо обозначенном и
вдали от общего рабочего населения. Не хранить рядом с окислителями.
материалы.
УТИЛИЗАЦИЯ:
Пролитая или использованная соляная кислота считается опасными отходами.
и с ними нужно обращаться соответственно.Он должен быть правильно промаркирован и
утилизирует подрядчик по опасным отходам. Хранение должно быть в
назначенная область, которая находится вдали от общего рабочего населения, и
хорошо обозначены, хорошо вентилируются и не подвержены тепловым циклам. Записи
необходимо поддерживать количество отработанной соляной кислоты,
срок хранения и подрядчик, занимающийся переработкой опасных отходов.
Использованная соляная кислота считается опасными отходами из-за ее
коррозионные свойства. Разбавив соляную кислоту до 5 процентов
от объема до объема или меньше и нейтрализовать его с помощью NAHCO3 до нейтрального
pH раствор больше не вызывает коррозии и может, в некоторых юрисдикциях,
утилизировать в канализацию.Раньше это практиковалось как средство
утилизации, необходимо получить разрешение от местной службы очистки сточных вод.
и соответствовать местным и государственным экологическим нормам.
нормативно-правовые акты.
Уильям Б. Манн IV
Помощник главного гидролога
для операций
ОРГАН ВЛАСТИ
1. Закон о безопасности и гигиене труда (OSHA) 1970 года - публичное право
91-596, Раздел 19.2. Распоряжение 12196 о программах безопасности и гигиены труда
для федеральных служащих.
СПРАВОЧНЫЕ ПРАВИЛА
1. 29 CFR 1910.1000 (OSHA) Токсичные и опасные вещества.
2. 29 CFR 1910.1450 (OSHA) Воздействие опасных веществ на рабочем месте.
химикаты в лабораториях.
3. 29 CFR 1910.1200 (OSHA) Стандарт информирования об опасностях
4. 40 CFR 260-272 (EPA) Сохранение и восстановление ресурсов
Закон (RCRA) Регламент.
5. 40 CFR 355, 370 и 372. (EPA) Комплексные меры по охране окружающей среды
Закон о реагировании, компенсации и ответственности (CERCLA) и Superfund
Постановления о внесении поправок и повторной авторизации (SARA).6. 40 CFR 710 (EPA) Закон о контроле за токсичными веществами (TSCA)
7. 49 CFR 172.101 (DOT) Таблица опасных и специальных материалов
Положения.
Этот меморандум не заменяет собой какой-либо предыдущий меморандум WRD.
Распределение: A, B, S, FO, PO
Ключевые слова: химические вещества, опасные материалы, правила техники безопасности.
Определение распределения хлор-комплексов меди в растворах соляной кислоты при 298 K
Аракава, К., Оно, К., Ишики, М., Мимура, К., Учикоши, М., Мори, ЧАС.: Наблюдение одномерной диффузии дислокационных петель нанометрового размера. Наука 318 , 956–959 (2007)
CAS Статья Google ученый
Фукуяма, Х., Морохоши, К., Учикоши, М., Иссики, М .: Динамическое поведение поверхностного натяжения жидкого железа во время процессов науглероживания и обезуглероживания. ISIJ Int. 54 , 2109–2114 (2014)
CAS Статья Google ученый
Китахара, Т., Танада, К., Уэно, С., Сугиока, К., Кубо, М., Цукада, Т., Учикоши, М., Фукуяма, Х .: Влияние статического магнитного поля на рекалесценцию и поверхность поле скорости в электромагнитно левитирующей капле расплавленного CuCo в переохлажденном состоянии. Металл. Матер. Пер. B 46B , 2706–2712 (2015)
Артикул Google ученый
Бост М.С., Махан Дж. Э .: Оптические свойства полупроводниковых тонких пленок дисилицида железа.J. Appl. Phys. 58 , 2696–2703 (1985)
CAS Статья Google ученый
Gotoh, K., Suzuki, H., Udono, H., Kikuma, I., Esaka, F., Uchikoshi, M., Isshiki, M .: монокристаллический β -FeSi 2 , выращенный с использованием источника FeSi высокой чистоты 2 . Тонкие сплошные пленки 515 , 8263–8267 (2007)
CAS Статья Google ученый
Кекеси, Т., Учикоши, М., Мимура, К., Иссики, М .: Анионообменное разделение в растворах соляной кислоты для сверхвысокой очистки кобальта. Металл. Матер. Пер. B 32B , 573–582 (2001)
CAS Статья Google ученый
Учикоши, М., Сибуя, Х., Кекеси, Т., Мимура, К., Иссики, М.: Массовое производство высокочистого железа с использованием анионообменной сепарации и плазменно-дуговой плавки. Металл. Матер.Пер. B 40B , 615–618 (2009)
CAS Статья Google ученый
Учикоши, М., Имаи, К., Мимура, К., Ишшики, М .: Окислительное рафинирование железа с использованием плазменно-дуговой плавки. J. Mater. Sci. 43 , 5430–5435 (2008)
CAS Статья Google ученый
Uchikoshi, M., Nagahara, T., Lim, J.W., Kim, S.B., Mimura, K., Isshiki, M.: Анионообменное поведение Mo (V) и W (VI) в растворах HCl. Высокий темп. Матер. Процесс 30 , 345–351 (2011)
CAS Статья Google ученый
Краус К.А., Нельсон Ф .: Анионообменные исследования продуктов деления. В: Материалы международной конференции по использованию атомной энергии в мирных целях, стр. 113–125. Женева (1955)
Dorfner, K. (ed.): Ion Exchangers. Вальтерде Гайтер, Бостон (1991)
Google ученый
Крерар, Д.А .: Метод расчета многокомпонентных химических равновесий на основе констант равновесия. Геохим. Космохим. Acta 39 , 1375–1384 (1975)
CAS Статья Google ученый
Сьюард Т.М .: Образование комплексов хлорида свинца (II) до 300 ° C: спектрофотометрическое исследование. Геохим. Космохим. Acta 48 , 121–134 (1984)
CAS Статья Google ученый
Гаммонс, C.H., Сьюард, T.M .: Стабильность комплексов хлорида марганца (II) от 25 до 300 ° C. Геохим. Космохим. Acta 60 , 4295–4311 (1996)
CAS Статья Google ученый
Брюггер, Дж., Макфейл, Д.К., Блэк, Дж., Спичча, Л .: Комплексообразование с ионами металлов в рассолах: применение электронной спектроскопии при исследовании системы Cu (II) –LiCl – h3O от 25 до 90 ° C. Геохим. Космохим. Acta 65 , 2691–2708 (2001)
CAS Статья Google ученый
Brugger, J .: BeerOz, набор программ Matlab для количественной интерпретации спектрофотометрических измерений состава металлов в растворах. Comput. Geosci. 33 , 248–261 (2007)
Статья Google ученый
Андерсон Г.М., Крерар Д.А.: Термодинамика в геохимии. Модель равновесия. Oxford University Press, Oxford (1993)
Google ученый
Бьеррум, Дж .: Определение малых констант устойчивости. Спектрофотометрическое исследование комплексов хлорида меди (II) в соляной кислоте. Acta. Chem. Сканд. A 41A , 328–334 (1987)
Артикул Google ученый
Сверженский, Д.А., Шок, Э.Л., Хельгесон, Х.К .: Прогноз термодинамических свойств водных комплексов металлов до 1000 ° C и 5 kb. Геохим. Космохим. Acta 61 , 1359–1412 (1997)
CAS Статья Google ученый
Уэкава, Э., Мурасе, К., Мацубара, Э., Хирато, Т., Авакура, Ю.: Определение химических веществ и их состава в ваннах для нанесения покрытия из сплава Ni – Mo с помощью факторного анализа спектров поглощения видимой части. J. Electrochem. Soc. 145 , 523–528 (1998)
CAS Статья Google ученый
Икеда, А., Хенниг, К., Россберг, А., Цусима, С., Шейност, А.С., Бернхард, Г.: Структурное определение отдельных химических соединений в смешанной системе с помощью итеративного анализа факторов трансформации рентгеновская абсорбционная спектроскопия в сочетании с поглощением в УФ-видимой области и квантово-химическими расчетами.Анальный. Chem. 80 , 1102–1110 (2008)
CAS Статья Google ученый
Мурас, К., Андо, Х., Мацубара, Э., Хирато, Т., Авакура, Й .: Определение видов и состава Mo (VI) в ваннах для нанесения покрытий из сплава Ni – Mo с помощью спектров комбинационного рассеяния света. факторный анализ. J. Electrochem. Soc. 147 , 2210–2217 (2000)
CAS Статья Google ученый
Фурлани, С., Морпурго, Г .: Свойства и электронное строение тетрагалогенкупратных (II) -комплексов. Теор. Чим. Acta 1 , 102–115 (1963)
CAS Статья Google ученый
Малиновский Е.Р., Ховери Д.Г .: Факторный анализ в химии, 3-е изд. Уайли, Нью-Йорк (1980)
Google ученый
Гемперлайн, П.Дж .: Практическое руководство по хемометрии, 2-е изд.Taylor & Francis Group, Boca Raton (2006)
Jaumot, J., de Juan, A., Tauler, R .: MCR-ALS GUI 2.0: новые функции и приложения. Chemom. Intell. Лаборатория. Syst. 140 , 1–12 (2015)
CAS Статья Google ученый
Мейдер, М .: Анализ развивающихся факторов для разрешения перекрывающихся хроматографических пиков. Анальный. Chem. 59 , 527–530 (1987)
CAS Статья Google ученый
Филиппони А., Д’Анджело П., Павел Н.В., Дичико А .: Триплетные корреляции в гидратной оболочке акваионов. Chem. Phys. Lett. 225 , 150–155 (1994)
CAS Статья Google ученый
Д’Анджело, П., Боттари, Э., Феста, М.Р., Нолтинг, Х.Ф., Павел, Н.В .: Структурное исследование растворов хлорида меди (II) с помощью рентгеновской абсорбционной спектроскопии. J. Chem. Phys. 107 , 2807–2812 (1997)
Артикул Google ученый
Марш A.R.W., Mcelroy, W.J .: Константа диссоциации и константа закона Генри HCl в водном растворе. Атмос. Environ. 19 , 1075–1080 (1985)
CAS Статья Google ученый
Хельгесон, Х.С., Киркхэм, Д.Х .: Теоретическое предсказание термодинамического поведения водных электролитов при высоких давлениях и температурах. Являюсь. J. Sci. 274 , 1199–1261 (1974)
CAS Статья Google ученый
Партанен, Дж. И., Юусола, П. М., Вахтеристо, К. П., де Мендонка, AJG: переоценка коэффициентов активности водных растворов соляной кислоты до моляльности до 16,0 моль кг −1 с использованием уравнений Хюккеля и Питцера при температурах от 0 до 50 ° С. J. Solution Chem. 36 , 39–59 (2007)
CAS Статья Google ученый
Kielland, Дж .: Индивидуальные коэффициенты активности ионов в водных растворах.Варенье. Chem. Soc. 59 , 1675–1678 (1937)
CAS Статья Google ученый
Хельгесон, Х.С., Киркхэм, Д.Х .: Теоретическое предсказание термодинамического поведения водных электролитов при высоких давлениях и температурах. Являюсь. J. Sci. 274 , 1089–1198 (1974)
CAS Статья Google ученый
Setchénow, M .: Über die columns der salzlösungen auf grund ihres verhaltens zu kohlensäure.Z. Phys. Chemie-Int. J. Res. Phys. Chem. Chem. Phys. 4 , 117–126 (1889)
Google ученый
Херши, Дж. П., Дамесено, Р., Миллеро, Ф. Дж .: Плотности и сжимаемость водных HCl и NaOH от 0 до 45 ° C. Влияние давления на ионизацию воды. J. Solution Chem. 13 , 825–848 (1984)
CAS Статья Google ученый
Келл, Г.С.: Плотность, тепловое расширение и сжимаемость жидкой воды от 0 до 150 ° C: корреляции и таблицы для атмосферного давления и насыщения рассмотрены и выражены по температурной шкале 1968 года. J. Chem. Англ. Данные 20 , 97–105 (1975)
CAS Статья Google ученый
Лагариас, Дж. К., Ридс, Дж. А., Райт, М. Х., Райт, П. Э .: Свойства сходимости симплексного метода Нелдера-Мида в малых размерностях.SIAM J. Optim. 9 , 112–147 (1998)
Артикул Google ученый
Ся, Ф.Ф., Йи, Х.Б., Цзэн, Д.: Гидраты дихлорида меди в водном растворе: теория функционала плотности и исследование модели поляризованного континуума. J. Phys. Chem. А 113 , 14029–14038 (2009)
CAS Статья Google ученый
Ся, Ф.Ф., Йи, Х.Б., Цзэн Д.: Гидраты Cu 2+ и CuCl + в разбавленном водном растворе: теория функционала плотности и исследование модели поляризованного континуума. J. Phys. Chem. A 114 , 8406–8416 (2010)
CAS Статья Google ученый
Yi, HB, Xia, FF, Zhou, Q., Zeng, D.: [CuCl 3 ] — и [CuCl 4 ] 2- гидраты в концентрированном водном растворе: теория функционала плотности и исследование ab Initio .J. Phys. Chem. A 115 , 4416–4426 (2011)
CAS Статья Google ученый
Аллен, П.Г., Бухер, Дж. Дж., Шух, Д.К., Эдельштейн, Н.М., Райх, Т .: Исследование акво- и хлорокомплексов UO 2 2+ , NpO 2 + , Np 4+ и Pu 3+ с помощью спектроскопии тонкой структуры рентгеновского поглощения. Неорг. Chem. 36 , 4676–4683 (1997)
CAS Статья Google ученый
Икеда, А., Яита, Т., Окамото, Ю., Шиваку, Х., Сузуки, С., Сузуки, Т., Фуджи, Ю.: Исследование тонкой структуры поглощения и разделения в рентгеновских лучах ионы металлов в органической смоле. Анальный. Chem. 79 , 8016–8023 (2007)
CAS Статья Google ученый
Кекеси Т., Мимура К., Ишшики М .: Сверхвысокая очистка железа путем анионного обмена в растворах соляной кислоты. Гидрометаллургия 63 , 1–13 (2002)
Статья Google ученый
Кекеси Т., Ишшики М .: Анионообменное поведение меди и некоторых металлических примесей в растворах HCl. Матер. T. Jim 35 , 406–413 (1994)
Статья Google ученый
Новые сведения об углекислоте в воде
Хотя углекислота существует всего лишь доли секунды, прежде чем превратиться в смесь ионов водорода и бикарбоната, она имеет решающее значение как для здоровья атмосферы, так и для здоровья человека.
Углекислота, гидратированная форма углекислого газа, имеет решающее значение как для здоровья атмосферы, так и для здоровья человека. Однако, поскольку угольная кислота существует всего лишь долю секунды, прежде чем превратиться в смесь ионов водорода и бикарбоната, она осталась загадкой. Новое исследование, проведенное учеными из лаборатории Беркли, дало ценную новую информацию об угольной кислоте, имеющую важные последствия как для геологических, так и для биологических проблем.
Ричард Сайкалли, химик из отделения химических наук лаборатории Беркли и профессор химии Калифорнийского университета в Беркли, провел исследование, в результате которого были впервые проведены измерения методом рентгеновской абсорбционной спектроскопии (XAS) для водного раствора углекислоты. Эти измерения XAS, которые были получены в Advanced Light Source (ALS) лаборатории Беркли, полностью согласуются с предсказаниями суперкомпьютера, полученными в Национальном научном вычислительном центре энергетических исследований (NERSC).
Комбинация теоретических и экспериментальных результатов дает новое и подробное представление о гидратационных свойствах водной угольной кислоты, что должно способствовать развитию технологий связывания углерода и смягчения его последствий, а также улучшить наше понимание того, как угольная кислота регулирует pH крови.
«Наши результаты подтверждают среднее число гидратации 3,17 с двумя протонами кислоты, каждый из которых передает сильную водородную связь сольватирующей воде, карбонильный кислород принимает сильную водородную связь от сольватирующей воды, а молекулы гидроксильного кислорода принимают слабые водородные связи из воды. , — говорит Сайкаллы.«Данные XAS необходимо интерпретировать, сравнивая измерения с результатами рассчитанного спектра, что является серьезной проблемой. Строгое согласие между нашими рассчитанными и наблюдаемыми рентгеновскими спектрами — новое и важное достижение ».
Моделирование молекулярной динамики и метод теории функционала плотности из первых принципов, используемые для моделирования и интерпретации измерений XAS, были выполнены под руководством Дэвида Прендергаста, штатного научного сотрудника Центра теории наноструктур в Молекулярной литейной лаборатории Беркли.Molecular Foundry, NERSC и ALS — все это национальные пользовательские объекты Управления науки Министерства энергетики США, расположенные в лаборатории Беркли.
«Используя нашу модель молекулярной динамики из первых принципов и моделирование молекулярной динамики, мы смогли смоделировать, как углекислая кислота сольватируется водой», — говорит Прендергаст. «Затем мы преобразовали эту информацию в прогнозируемый спектр поглощения XAS, который можно было напрямую сравнить с экспериментальными измерениями на ALS».
(Слева направо) Ричард Сайкалли, Дэвид Прендергаст, Джейкоб Смит и Ройс Лам были частью команды, которая предоставила новые ценные сведения о водной углекислоте.(Фото Роя Кальчмидта)
Сайкалли и Прендергаст опубликовали свои результаты в журнале « Chemical Physical Letters ». Работа озаглавлена «Структура гидратации водной угольной кислоты по данным рентгеновской абсорбционной спектроскопии». Сайкаллы является автором-корреспондентом. Другими соавторами, помимо Прендергаста, являются Ройс Лам, Элис Инглэнд, Алекс Ширди, Орион Ши, Джейкоб Смит и Энтони Риццуто.
Когда диоксид углерода растворяется в воде, примерно один процент его образует угольную кислоту, которая почти сразу диссоциирует на бикарбонатные анионы и протоны.Несмотря на свое недолговечное существование — около 300 наносекунд — углекислота является важным промежуточным звеном в равновесии между углекислым газом, водой и многими минералами. Он играет решающую роль в углеродном цикле — обмене углекислым газом между атмосферой и океанами — и в буферизации крови и других жидкостей организма. Короткий срок жизни углекислоты в воде чрезвычайно затрудняет ее изучение.
Сайкалли и его исследовательская группа преодолели это препятствие, разработав уникальную технологию микроструйного перемешивания жидкости, в которой два водных образца быстро смешиваются и протекают через сопло с мелким наконечником, изготовленное из плавленого кварца и имеющее отверстие диаметром всего несколько микрометров.Результирующий пучок жидкости проходит несколько сантиметров в вакуумной камере, прежде чем его пересекает рентгеновский пучок, который затем собирается и конденсируется. Сайкалли и его группа установили свою жидкостную микроструйную систему в ALS Beamline 8.0.1, ондуляторном канале с высоким потоком, который производит рентгеновские лучи, оптимизированные для исследований XAS.
«Ключом к нашему успеху стал прогресс в нашей технологии микроструйных жидкостей, который позволяет нам добиться быстрого смешивания наших реагентов, бикарбоната и соляной кислоты, а также немедленного исследования продуктов угольной кислоты», — говорит Сайкалли.
Для этого исследования он и его группа использовали разновидность XAS, называемую спектроскопией ближней рентгеновской абсорбции тонкой структуры (NEXAFS), метод атомно-специфического зонда как электронной структуры молекулы, так и ее локального химического окружения. NEXAFS идеально подходит для получения подробных характеристик гидратных взаимодействий, однако он в основном ограничивался исследованиями в газах и твердых телах из-за трудностей работы с жидкими образцами в высоком вакууме. Внедряя свою технологию микроструйной печати в среду высокого вакуума синхротронного рентгеновского луча, Сайкалли и его группа могут выполнять NEXAFS на жидких образцах.
Исследователи, стоящие за этим исследованием, говорят, что их результаты важны для понимания и моделирования того, как происходит химическое равновесие между угольной кислотой и диоксидом углерода в солевых водоносных горизонтах и других предлагаемых средах связывания углерода. Такой же равновесный процесс регулирует дыхание живых организмов.
«Поскольку углекислота в газовой и твердой фазах достаточно хорошо изучена, наша новая работа с водными растворами будет способствовать разработке детальных моделей обратимой газожидкостной химии диоксида углерода», — говорит Сайкалли.
Это исследование было поддержано Управлением науки Министерства энергетики США.
