Получение кислорода простыми способами — Вода и воздух — самое дешевое сырье — Практическая химия
26 июля 2007
Укрепим пробирку из тугоплавкого стекла на штативе и внесем в нее 5 г порошкообразной селитры (нитрата калия КNО3 или нитрата натрия NaNO3). Поставим под пробирку чашку из огнеупорного материала, наполненную песком, так как при этом опыте стекло часто плавится и вытекает горячая масса. Поэтому и горелку при нагревании будем держать сбоку. Когда мы сильно нагреем селитру, она расплавится и из нее выделится кислород (обнаружим это с помощью тлеющей лучины — она воспламенится в пробирке). При этом нитрат калия перейдет в нитрит KNO2. Бросим затем тигельными щипцами или пинцетом кусок черенковой серы в расплав (никогда не держать лицо над пробиркой).
Сера воспламенится и сгорит с выделением большого количества тепла. Опыт следует проводить при открытых окнах (из-за получающихся окислов серы). Полученный нитрит натрия сохраним для последующих опытов.
Процесс протекает следующим образом (через нагревание):
2KNO3 → 2KNO2 + O2
Можно получить кислород и другими методами.
Перманганат калия КMnO4 (калийная соль марганцевой кислоты) отдает при нагревании кислород и превращается при этом в оксид марганца (IV):
4KMnO4 → 4Mn2 + 2K2O + 3O2
или 4KMnO4 → MnO2 + K2MnO4 + O2
Из 10 г перманганата калия можно получить примерно литр кислорода, значит двух граммов достаточно, чтобы наполнить кислородом пять пробирок нормальной величины. Перманганат калия можно приобрести в любой аптеке, если он отсутствует в домашней аптечке.
Некоторое количество перманганата калия нагреем в тугоплавкой пробирке и уловим в пробирки выделяющийся лислород с помощью пневматической ванны.
В больших количествах кислород можно также получить из пероксида (перекиси) водорода Н2О2. Купим в аптеке трехпроцентный раствор — дезинфицирующее средство или препарат для обработки ран. Пероксид водорода мало устойчив. Уже при стоянии на воздухе он разлагается на кислород и воду:
2Н2О2 → 2Н2О + О2
Разложение можно существенно ускорить, если добавить к пероксиду немного диоксида марганца МnО
Мы можем в этом убедиться, если в маленькую пробирку поместим примерно 1 мл пероксида водорода с одним из названных веществ, а наличие выделяющегося кислорода установим с помощью пробы лучинкой. Если в химическом стакане к 5 мл трехпроцентного раствора пероксида водорода добавить равное количество крови животного, то смесь сильно вспенится, пена застынет и вздуется в результате выделения пузырьков кислорода.
Затем испытаем каталитическое действие 10 %-ного раствора сульфата меди (II) с добавкой гидроксида калия (едкого кали), раствора сульфата железа (П), раствора хлорида железа (III) (с добавкой железного порошка и без него), карбоната натрия, хлорида натрия и органических веществ (молока, сахара, размельченных листьев зеленых растений и т. д.). Теперь мы на опыте убедились, что различные вещества каталитически ускоряют разложение пероксида водорода.
Катализаторы повышают скорость реакции химического процесса и при этом сами не расходуются.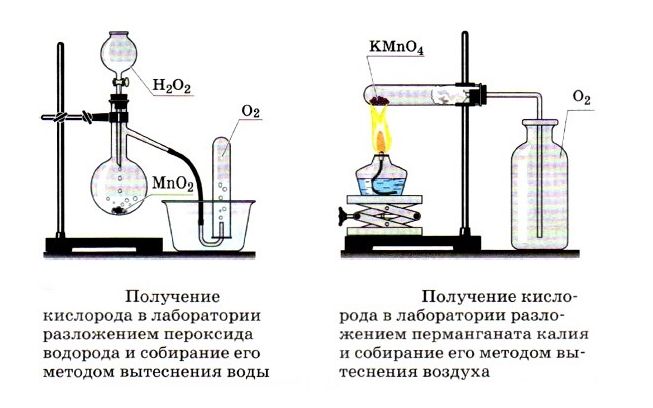 В конечном итоге они снижают энергию активации, необходимую для возбуждения реакции. Но существуют и вещества, действующие противоположным образом. Их называют отрицательными катализаторами, антикатализаторами, стабилизаторами или ингибиторами. Например, фосфорная кислота препятствует разложению пероксида водорода. Поэтому продажный раствор пероксида водорода обычно стабилизирован фосфорной или мочевой кислотой.
В конечном итоге они снижают энергию активации, необходимую для возбуждения реакции. Но существуют и вещества, действующие противоположным образом. Их называют отрицательными катализаторами, антикатализаторами, стабилизаторами или ингибиторами. Например, фосфорная кислота препятствует разложению пероксида водорода. Поэтому продажный раствор пероксида водорода обычно стабилизирован фосфорной или мочевой кислотой.
Катализаторы необходимы для многих химико-технологических процессов. Но и в живой природе во многих процессах участвуют так называемые биокатализаторы (энзимы, ферменты, гормоны). Так как катализаторы не потребляются в реакциях, то они могут действовать уже в малых количествах. Одного грамма сычужного фермента достаточно, чтобы обеспечить свертывание 400—800 кг молочного белка.
Особое значение для работы катализаторов имеет величина их поверхности. Для увеличения поверхности применяют пористые, испещренные трещинами вещества с развитой внутренней поверхностью, напыляют компактные вещества или металлы на так называемые носители. Например, 100 г платинового катализатора на носителе содержит только около 200 мг платины; 1 г компактного никеля имеет поверхность 0,8 см2, а 1 г порошка никеля — 10 мг. Это соответствует отношению 1 : 100000; 1 г активного глинозема обладает поверхностью от 200 до 300 м2, для 1 г активного угля эта величина составляет даже 1000 м2. В некоторых установках катализатора — на несколько миллионов марок. Так, бензиновая контактная печь в Белене высотой 18 м содержит 9—10 тонн катализатора.
Источник: Э.Гроссе, Х.Вайсмантель, «Химия для любознательных»
Получение и применение кислорода — урок. Химия, 8–9 класс.
Получение кислорода
- В лаборатории кислород получают разложением некоторых кислородсодержащих веществ. Собирают его вытеснением воды или воздуха.
Разложение марганцовки (перманганата калия) при нагревании:
2KMnO4=tK2MnO4+MnO2+O2.
Разложение пероксида водорода в присутствии катализатора:
2h3O2=MnO22h3O+O2.
Электролиз воды:
2h3O=эл. ток2h3+O2.
Можно получить кислород и при разложении некоторых других веществ: бертолетовой соли KClO3, нитратов NaNO3, KNO3 и т. д.
- В промышленных масштабах кислород получают из воздуха. Для этого воздух при повышенном давлении охлаждают и превращают в жидкость. Затем жидкий воздух нагревают. Сначала выделяется азот (температура кипения \(–196\) °С). Жидкий кислород остаётся, так как его температура кипения выше (\(–183\) °С). Хранят жидкий кислород в стальных баллонах голубого цвета.
Применение кислорода
- В металлургической промышленности кислород используется при выплавке чугуна и стали.
- В смеси с водородом или ацетиленом кислород применяется для резки и варки металлов.
- Находит применение кислород в качестве окислителя ракетного топлива.
- Используется он для обеспечения жизнедеятельности на подводных лодках и космических кораблях, при работе водолазов.
- Находит применение в медицине в лечебных целях.
Получение кислорода — Основы химии на Ида Тен
Содержание статьиИстория открытия кислородаОткрытие кислорода ознаменовало новый период в развитии химии. С глубокой древности было известно, что для горения необходим воздух. Процесс горения веществ долгое время оставался непонятным. В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени. Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
В эпоху алхимии широкое распространение получила теория флогистона, согласно которой вещества горят благодаря их взаимодействию с огненной материей, то есть с флогистоном, который содержится в пламени. Кислород был получен английским химиком Джозефом Пристли в 70-х годах XVIII века. Химик нагревал красный порошок оксида ртути (II), в итоге вещество разлагалось, с образованием металлической ртути и бесцветного газа:
2HgO t° → 2Hg + O2↑
Оксиды – бинарные соединения, в состав которых входит кислород При внесении тлеющей лучины в сосуд с газом она ярко вспыхивала.
Имея хорошо оснащенную на то время лабораторию, А. Лавуазье повторил и усовершенствовал опыты Д. Пристли. А. Лавуазье измерил количество газа, выделяющееся при разложении определенной массы оксида ртути. Затем химик нагрел в герметичном сосуде металлическую ртуть до тех пор, пока она не превратилась в оксид ртути (II). Он обнаружил, что количество выделившегося газа в первом опыте равно газу, поглотившемуся во втором опыте. Следовательно, ртуть реагирует с каким-то веществом, содержащимся в воздухе. И это же вещество выделяется при разложении оксида. Лавуазье первым сделал вывод, что флогистон здесь совершенно ни при чем, и горение тлеющей лучины вызывает именно неизвестный газ, который в последствии был назван кислородом. Открытие кислорода ознаменовало крах теории флогистона!
Способы получения и собирания кислорода в лабораторииЛабораторные способы получения кислорода весьма разнообразны. Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
Существует много веществ, из которых можно получить кислород. Рассмотрим наиболее распространенные способы.
1) Разложение оксида ртути (II)
Одним из способов получения кислорода в лаборатории, является его получение по описанной выше реакции разложения оксида ртути (II). Ввиду высокой токсичности соединений ртути и паров самой ртути, данный способ используется крайне редко.
2) Разложение перманганата калия
Перманганат калия (в быту мы называем его марганцовкой) – кристаллическое вещество темно-фиолетового цвета. При нагревании перманганата калия выделяется кислород. В пробирку насыплем немного порошка перманганата калия и закрепим ее горизонтально в лапке штатива. Недалеко от отверстия пробирки поместим кусочек ваты. Закроем пробирку пробкой, в которую вставлена газоотводная трубка, конец которой опустим в сосуд- приемник. Газоотводная трубка должна доходить до дна сосуда-приемника. Ватка, находящаяся около отверстия пробирки нужна, чтобы предотвратить попадание частиц перманганата калия в сосуд-приемник (при разложении выделяющийся кислород увлекает за собой частички перманганата). Когда прибор собран, начинаем нагревание пробирки. Начинается выделение кислорода.
Уравнение реакции разложения перманганата калия:
2KMnO4 t° → K2MnO4 + MnO2 + O2↑
Как обнаружить присутствие кислорода? Воспользуемся способом Пристли. Подожжем деревянную лучину, дадим ей немного погореть, затем погасим, так, чтобы она едва тлела. Опустим тлеющую лучину в сосуд с кислородом. Лучина ярко вспыхивает! Газоотводная трубка была не случайно опущена до дна сосуда-приемника. Кислород тяжелее воздуха, следовательно, он будет собираться в нижней части приемника, вытесняя из него воздух. Кислород можно собрать и методом вытеснения воды. Для этого газоотводную трубку необходимо опустить в пробирку, заполненную водой, и опущенную в кристаллизатор с водой вниз отверстием. При поступлении кислорода газ вытесняет воду из пробирки.
При поступлении кислорода газ вытесняет воду из пробирки.
Пероксид водорода – вещество всем известное. В аптеке оно продается под названием «перекись водорода». Данное название является устаревшим, более правильно использовать термин «пероксид». Химическая формула пероксида водорода Н2О2 Пероксид водорода при хранении медленно разлагается на воду и кислород. Чтобы ускорить процесс разложения можно произвести нагрев или применить катализатор.
Катализатор – вещество, ускоряющее скорость протекания химической реакции
Нальем в колбу пероксид водорода, внесем в жидкость катализатор. Катализатором может служить порошок черного цвета – оксид марганца MnO2. Тотчас смесь начнет вспениваться вследствие выделения большого количества кислорода. Внесем в колбу тлеющую лучину – она ярко вспыхивает. Уравнение реакции разложения пероксида водорода:
2h3O2 MnO2 → 2h3O + O2↑
Обратите внимание: катализатор, ускоряющий протекание реакции, записывается над стрелкой, или знаком «=», потому что он не расходуется в ходе реакции, а только ускоряет ее.
Разложение хлората калияХлорат калия – кристаллическое вещество белого цвета. Используется в производстве фейерверков и других различных пиротехнических изделий. Встречается тривиальное название этого вещества – «бертолетова соль». Такое название вещество получило в честь французского химика, впервые синтезировавшего его, – Клода Луи Бертолле. Химическая формула хлората калия KСlO3. При нагревании хлората калия в присутствии катализатора – оксида марганца MnO2, бертолетова соль разлагается по следующей схеме:
Разложение нитратов2KClO3 t°, MnO2 → 2KCl + 3O2↑.
Нитраты – вещества, содержащие в своем составе ионы NO3⎺. Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Соединения данного класса используются в качестве минеральных удобрений, входят в состав пиротехнических изделий.
Нитраты – соединения термически нестойкие, и при нагревании разлагаются с выделением кислорода:
Обратите внимание, что все рассмотренные способы получения кислорода схожи. Во всех случаях кислород выделяется при разложении более сложных веществ.
Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые В общем виде реакцию разложения можно описать буквенной схемой:
АВ → А + В.
Реакции разложения могут протекать при действии различных факторов. Это может быть нагревание, действие электрического тока, применение катализатора. Существуют реакции, в которых вещества разлагаются самопроизвольно.
Получение кислорода в промышленностиВ промышленности кислород получают путем выделения его из воздуха.
Воздух – смесь газов, основные компоненты которой представлены в таблице.
Сущность этого способа заключается в глубоком охлаждении воздуха с превращением его в жидкость, что при нормальном атмосферном давлении может быть достигнуто при температуре около -192°С. Разделение жидкости на кислород и азот осуществляется путем использования разности температур их кипения, а именно: Ткип.
О2 = -183°С
N2 = -196°С (при нормальном атмосферном давлении).
При постепенном испарении жидкости в газообразную фазу в первую очередь будет переходить азот, имеющий более низкую температуру кипения, и, по мере его выделения, жидкость будет обогащаться кислородом. Многократное повторение этого процесса позволяет получить кислород и азот требуемой чистоты. Такой способ разделения жидкостей на составные части называется ректификацией жидкого воздуха.
Итог статьи:
- В лаборатории кислород получают реакциями разложения
- Реакция разложения – реакция, в результате которой сложные вещества разлагаются на более простые
- Кислород можно собрать методом вытеснения воздуха или методом вытеснения воды
- Для обнаружения кислорода используют тлеющую лучину, она ярко вспыхивает в нем
- Катализатор – вещество, ускоряющее химическую реакцию, но не расходующееся в ней
Получение кислорода каталитическим разложением пероксида водорода (опыт) | Химия.
 Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книга
Шпаргалка, шпора, формула, закон, ГДЗ, опыты, тесты, сообщение, реферат, кратко, конспект, книгаТема: Опыты (лабораторные работы)
Тебе выданы лабораторный штатив, штатив с пробирками, пробка с газоотводной трубкой, горелка, кристаллизатор с водой, клочок ваты, лучинка; пероксид водорода, оксид марганца(IV) (или кусочки сырых овощей), известковая вода.
Выполняя эту работу, ты применишь знания о реакциях разложения и соединения, физических и химических свойствах кислорода для получения, собирания и изучения свойств этого газа.
В пробирку помести немного оксида марганца (IV). Вместо оксида марганца (IV) можно положить в пробирку кусочки сырых овощей. Добавь раствор пероксида водорода объемом 2 мл и быстро закрой пробирку пробкой с газоотводной трубкой. Собери кислород в пробирку, размещенную отверстием вверх. Полноту заполнения кислородом пробирки определи, поднося к ее отверстию тлеющую лучинку. Материал с сайта http://worldofschool.ru
Внеси в пробирку с кислородом тлеющую лучинку. Вынь лучинку из пробирки и добавь туда немного известковой воды.
В пробирку с продуктами реакции добавь еще немного пероксида водорода.
На этой странице материал по темам:О чем свидетельствуют изменения, которые произошли с известковой водой
Лабораторная работа с картофелем и перекисью водорода
Скачать опыт получение кислорода
Получение кислорода термическим разложением перекиси водорода
Ход работы при получении водорода и кислорода в лабораторной работе
Опиши ход работы и наблюдения
Какая роль оксида марганца (IV) в этой реакции?
Почему кислород можно собрать вытеснением воздуха в пробирку размещенную отверстием вверх?
О чем свидетельствуют изменения, произошедшие с известковой водой?
Запиши уравнение реакции разложения пероксида водорода, отметь условия ее прохождения.

Получение кислорода из перекиси водорода
Перекись водорода представляет собой сильный окислитель, причем продуктами ее разложения являются только кислород и вода. Поэтому перекись водорода широко применяется в тех случаях, когда нежелательно загрязнение веществ, получаемых при окислении продуктами восстановления окислителя. Растворы перекиси водорода используют для беления дорогих тканей, мехов, масел, бумажной массы, в медицине и тонкой химической технологии. Высококонцентрированная перекись водорода используется для получения паро-газовой смеси в различных реактивных устройствах. [c.354]В патентной литературе имеется также описание некаталитического (термического) окисления низших газообразных парафинов, которое проводили при недостатке кислорода в реакторе из металла, устойчивого к действию высоких температур и продуктов реакции [7]. Температура процесса равнялась 400—500°, причем температуру поверхности реактора поддерживали на уровне ниже 200°. Полученные гидроперекиси имели такое же строение, что и гидроперекиси, обнаруженные в только что описанном опыте, однако незначительные изменения в условиях реакции приводили к образованию водного раствора перекиси водорода как основного продукта из числа веществ, содержавших активный кислород. Так, например, при работе со смесью из 90% пропана и 10% кислорода с продолжительностью реакции 5 сек. (температура в реакторе 470°, температура стенки 150°) основным кислородсодержащим продуктом была перекись водорода, полученная в виде 3—4%-ного водного раствора [8]. Этот способ получения перекиси водорода, по-видимому, уступает место прямому окислению изопропилового спирта, в результате которого тоже образуется перекись водорода (см. гл. 8, стр. 150). [c.71]
Предлагая последовательное протекание реакции по уравнению (2), можно построить кривую ионизации кислорода до перекиси водорода делением пополам величин исправленных токов при каждом значении потенциала (рис. 7, кривая 1). Анализ полученных результатов приводит к следующим выводам. Так как зависимости стационарного потенциала серебряного электрода в щелочном растворе от парциального давления кислорода и от концентрации перекиси водорода хорошо согласуются с термодинамическими зависимостями, то можно заключить, что этот потенциал определяется обратимым протеканием реакции кислород — перекись водорода. [c.148]
7, кривая 1). Анализ полученных результатов приводит к следующим выводам. Так как зависимости стационарного потенциала серебряного электрода в щелочном растворе от парциального давления кислорода и от концентрации перекиси водорода хорошо согласуются с термодинамическими зависимостями, то можно заключить, что этот потенциал определяется обратимым протеканием реакции кислород — перекись водорода. [c.148]
Гидроксилирование. Ароматические соединения моя но перевести в производные фенольного типа путем воздействия на водные растворы радиации или реактива Фептона (перекись водорода и сульфат двухвалентного железа) [132]. Для получения хороших выходов при гпдро-ксилированип путем облучения Х-лучами водных растворов важно присутствие кислорода. Представляется вероятным, что ити реакции протекают через стадию образования гидроксильного свободного радикала с последующей атакой последнего па ароматическое кольцо. Типичные результаты суммированы в табл. 18. [c.467]
Рассмотрим теперь результаты электрохимических исследований пористых серебряных электродов. Из полученных данных следует, что при всех потенциалах отрицательнее 0,9 в при стационарном режиме работы электродов и = 4. В случае кислородного электрода наблюдается заметная зависимость электрохимической активности при постоянном перепаде от парциального давления кислорода. Парциальное давление кислорода изменялось в интервале 0,9—2,5 атм. После введения поправки м упругость паров воды [85] ток оказывается линейной функцией У Ро, (рис. 222) независимо от потенциала и перепада давления, что свидетельствует о первом порядке реакции ионизации молекулярного кислорода. Перекись водорода, которая, согласно опытам на дисковом вращаюш,емся электроде [86], образуется в качестве промежуточного продукта при Ф =0,8 в, в случае пористого электрода не успевает отводиться в объем электролита и целиком восстанавливается на электроде. В соответствии с данными работы Ц84], где ионизация кислорода исследовалась на гладких электродах из сплава Ag — М , можно предполагать, что замедленной стадией является присоединение первого электрона к молекуле кислорода. [c.320]
[c.320]
Перекись бария используется для отбелки шелка, кости, соломы, перьев и т. п., кроме того, в большом масштабе применяется для получения перекиси водорода, а также в качестве антисептика в медицине и других областях. Ранее она употреблялась для технического получения кислорода (способ Брина). [c.259]
Очень концентрированные (80% и выше) водные растворы Н2О2 находят применение в качестве источников энергии и самостоятельно (с помощью катализаторов быстрого разложения Н2О2 из одного литра жидкой перекиси водорода можно получить около 5000 л нагретой до 700 °С смеси кислорода с водяным паром), и как окислитель реактивных топлив. Перекись водорода применяется также как окислитель в химических производствах, как исходное сырье для получения многих перекисных соединений, инициатор полимеризационных процессов, при изготовлении некоторых пористых изделий. для искусственного старения вин, крашения волос, вывода пятен и т. д. [c.152]
Изображенный в верхней части схемы бесхлорный метод основан на окислительно-восстановительных реакциях. Для его осуществления нужен только пропилен, кислород воздуха и перекись водорода. Экономичность этого способа целиком определяется стоимостью получения перекиси водорода. [c.163]
Для работы требуется Аппарат Киппа для получения двуокиси углерода или кислорода (с двумя промывными склянками). — Приборы (см. рис. 21). — Бутыли с водой. — Цилиндры мерные емк. от 250 до 500 мл. — Термометр комнатный — Колба плоскодонная емк. 250 мл сухая с пробкой и резиновым кольцом. — Барометр. — Ампулы стеклянные. — Мрамор кусковой. — Катализатор из двуокиси марганца. — Соляная кислота (1 6). — Серная кислота конц. — Перекись водорода, 3%-ный раствор. — Гидрокарбонат натрия, насыщенный раствор. — Хлороформ. — Четыреххлористый углерод. Линейка металлическая. [c.31]
Наличие двух электрохимических процессов образования перекиси водорода открывает принципиальную возможность непосредственного ее получения как на катоде, так и на аноде. Действительно, если ртутный или амальгамированный медный, или серебряный катод, погруженный в кислоту, омывать газообразным кислородом, то на нем образуется перекись водорода по реакции (27). Стандартный потенциал этой реакции ф°=+0,69 в. [c.355]
Действительно, если ртутный или амальгамированный медный, или серебряный катод, погруженный в кислоту, омывать газообразным кислородом, то на нем образуется перекись водорода по реакции (27). Стандартный потенциал этой реакции ф°=+0,69 в. [c.355]
Медь даже в небольших количествах очень сильно мешает определению молибдена. (717, 1117]. Для него получают слишком низкие результаты. Медленная реакция аутоокисления пятивалентного молибдена кислородом воздуха резко ускоряется в присутствии меди как катализатора. Предполагается, что при этой реакции образуется перекись водорода в качестве промежуточного продукта. Когда раствор соединения пятивалентного молибдена, полученного в ртутном редукторе, фильтруют в присутствии воздуха, то происходит окисление следовых количеств ИОНОВ одновалентной меди кислородом с образованием перекиси водорода, которая затем окисляет некоторое количество пятивалентного молибдена. Вследствие протекания этой реакции для молибдена получают низкие результаты. В то же время при определенных условиях (1Л НС1) пятивалентный молибден спо собен восстанавливать медь до одновалентного состояния. [c.191]
Соединения трехвалентного кобальта более прочны. Общий метод их получения сводится к окислению растворов солей двухвалентного кобальта в присутствии аммонийной соли и аммиака. В качестве окислителей применяют кислород воздуха, перекись водорода [5], иод [6], перманганат калия [7], двуокись свинца [8] и др. [c.6]
Интерес представляет также способ, согласно которому для получения перекисных соединений применяется как катод-ний, так и анодный процесс. Благодаря двойному использованию тока, количество электричества, затрачиваемое на получение определенного количества активного кислорода, умень-и1астся примерно вдвое, с большим эффектом используется аппаратура, однако напряжение на ванне при этом также возрастает вдвое, а именно до 3,7 е. В анодное пространство электролизера, разделешюю керамиковой диафрагмой, вводят раствор сульфата аммония с серной кислотой, в катодное — 0,П%-ную серную кислоту, через которую пропускают сильный ток кислорода. При анодной плотности тока 0,02 а/см и катодной 0,04 а см в анодном пространстве с платиновым анодом получают персульфат аммония, в катодном — с амальгамированным золотым катодом — — перекись водорода. [c.145]
При анодной плотности тока 0,02 а/см и катодной 0,04 а см в анодном пространстве с платиновым анодом получают персульфат аммония, в катодном — с амальгамированным золотым катодом — — перекись водорода. [c.145]
Перекись водорода разлагается гораздо легче, образуя в качестве конечных продуктов воду и кислород. Спектроскопические данные указывают на образование гидроксильных радикалов НО — ОН -j- НО -j- ОН К Эта точка зрения подтверждается тем фактом, что фоторазложение перекиси водорода, сенсибилизированное ртутью, может быть использовано для получения гликолей из олефинов (гл. XI, стр. 268—9). [c.127]
Краусу удалось получить соедииения кремния, содержащие активный кислород. Он смешивал свежеприготопленный силикат натрия с 30%-ной перекисью водорода и подвергай, смесь вакуум-дестилляции. При этом удалялась только пода, ио не перекись водорода. Полученные кристаллы име.чи, примерно, следующий состав NasSiOa HgO 2Н202- [c.405]
Превращение, которое можно рассматривать как ферментативный вариант этой реакции, ускоряется лактатоксигеназой — гексамерным флавопротеидом с мол. весом 350 000, полученным из My oba terium. В анаэробных условиях фермент продуцирует пируват путем простого дегидрирования [142]. Однако в присутствии кислорода образуется уксусная кислота, причем один из атомов кислорода карбоксильной группы происходит из О2. Поскольку перекись водорода — обычный продукт, образующийся из кислорода под действием флавопротеидов, возможно, что в случае лактатоксигеназы образующаяся перекись водорода непосредственно окисляет пируват в соответствии с уравнением (8-67), [c.273]
Остаток после отгонки эфира в вакууме от продукта первого опыта (окисление эфира при 50° без облучения) и откачки в течение 1,5 часа при 30° и 1 мм рт. ст. по виду не отличался от соответствующих продуктов, получавшихся нами при окислении эфира в прежних условиях (легкой перекиси в дестиллате не получено).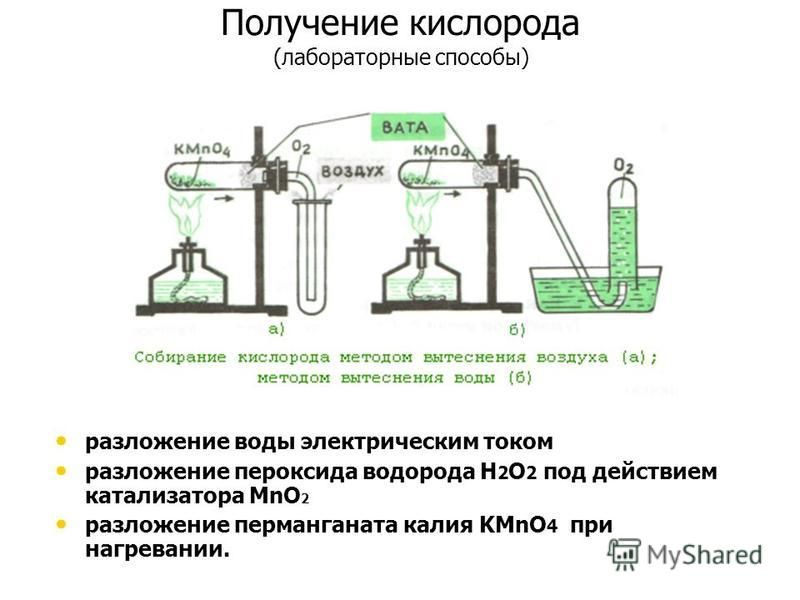 / = 1,055 По = 1,4380 мол. вес, определенный криоскопическим путем в бензоле, —169 содержание активного кислорода отвечает расходу 38,3 мл 0,1 N раствора РеС1з на миллимоль (станнометрическим методом). Он легко растворяется в органических растворителях и смешивается с водой, гидролитически разлагаясь ею на перекись водорода и ацетон (количественно определены и охарактеризованы как выше Н2О2—качественной реакцией с хромовой кислотой, ацетон —температурой плавления п-нитрофенилгидразона и пробой смешения с синтетически -полученным л-нитрофенилгидразоном ацетона). [c.138]
/ = 1,055 По = 1,4380 мол. вес, определенный криоскопическим путем в бензоле, —169 содержание активного кислорода отвечает расходу 38,3 мл 0,1 N раствора РеС1з на миллимоль (станнометрическим методом). Он легко растворяется в органических растворителях и смешивается с водой, гидролитически разлагаясь ею на перекись водорода и ацетон (количественно определены и охарактеризованы как выше Н2О2—качественной реакцией с хромовой кислотой, ацетон —температурой плавления п-нитрофенилгидразона и пробой смешения с синтетически -полученным л-нитрофенилгидразоном ацетона). [c.138]
Легкая окисляемость гидразобензола до азобензола (и возможность превращения азобензола обратно в гидразо) может быть использована для получения перекиси водорода. При действии кислорода на бензольный раствор гидразобензола может б1йть получена с почти количественным выходам высокопроцентная (94%) перекись водорода по реакции [c.141]
В отличие от реакции окисления изобутана, направленной п сторону образования перекисей, было найдено, что окисление и юпана и бутана (отношение углеводорода к кислороду 9 1, температура около 450°С, время контакта — 4 сек) приводит к получению смеси продуктов, содержащей органические перекиси, перекись водорода, альдегиды, спирты, окись и двуокись углерода, воду, олефины и водород . Органические перекиси в этом случае состоят, вероятнее всего, йз оксигидроперекисей и диоксиперекисей, образующихся в результате взаимодействия 1 рисутствующих в окисляемой среде альдегидов (например, формальдегида) и перекиси водорода. В более поздней работе описан способ превращения этана в гидроперекись путем окисления при 10—80° С под действием ультрафиолетового излучения в присутствии паров ртути, цинка или кадмия в качестве [c.20]
В гл. V упоминалось о низкотемпературном фотосенснбилн-зированиом окислении изопропилового спирта в 2-гидроперокси-пропанол-2 >2 . Это соединение оказалось устойчивым при перегонке, а при обработке водой давало ацетон и перекись водорода. В литературе приведены данные о разработанном процессе жидкофазного окисления изопропилового спирта с целью получения перекиси водорода и ацетона. Несмотря на то, что гидроперекись в этом процессе не была выделена, ее промежуточное образование, по-видимому, не вызывает сомнений. Этим методом одна из фирм собиралась производитьдо 15 000 г перекиси водорода в год, главным образом, для окисления акролеина при получении синтетического глицерина. Согласно патентным данным, перекись водорода получается также и при окислении других низших вторичных спиртов. Окисление производится при температуре от 70 до 160° С под давлением 2,5 ат кислородом, циркулирующим через реакционную смесь. При этом в реакционном аппарате не должно содержаться веществ, способных катализировать разложение перекиси водорода [c.446]
В литературе приведены данные о разработанном процессе жидкофазного окисления изопропилового спирта с целью получения перекиси водорода и ацетона. Несмотря на то, что гидроперекись в этом процессе не была выделена, ее промежуточное образование, по-видимому, не вызывает сомнений. Этим методом одна из фирм собиралась производитьдо 15 000 г перекиси водорода в год, главным образом, для окисления акролеина при получении синтетического глицерина. Согласно патентным данным, перекись водорода получается также и при окислении других низших вторичных спиртов. Окисление производится при температуре от 70 до 160° С под давлением 2,5 ат кислородом, циркулирующим через реакционную смесь. При этом в реакционном аппарате не должно содержаться веществ, способных катализировать разложение перекиси водорода [c.446]
Основные научные работы посвящены преимущественно неорганической химии. Исследования проводил главным образом совместно с Ж. Л. Гей-Люссаком. Вместе они разработали (1808) способы получения калия и натрия восстановлением гидроокисей посредством нагревания с железными стружками. Совместно с Гей-Люссаком получил (1808) свободный бор из борного ангидрида. Изучнл (1809) реакцию взаимодействия хлора с водородом. Доказал (1810), что калт»1, натрий, иод и хлор — элементы и что хлористо-и иодистоводородная кислоты не содержат кислорода. Открыл (1818) перекись водорода и получил ее в чистом виде. Открыл [c.486]
Кольтгоф и Йордан [105] предположили, что перекись водорода реагирует с анион-радикалом Of (образующимся при переходе электрона на молекулу Ог), причем регенерируется кислород. В таком случае должно было бы наблюдаться повышение первой волны кислорода. Возможность осуществления этого механизма побудила Корнелиссена и Гирста [106] опубликовать краткое сообщение, посвященное кинетике восстановления кислорода в таких растворах индифферентных электролитов, где величина фг при потенциалах первой волны кислорода имеет достаточно большое положительное значение. Действительно, и в отсутствие перекиси водорода в объеме раствора наблюдалось повышение первой волны кислорода, что было объяснено увеличением концентрации Oi на внешней плоскости под влиянием положительного фг-потенциала. Однако полученные в работе [106] результаты были объяснены Кольтгофом и Изуцу [107] перемешиванием раствора и наличием следов летучих загрязнений в солях тетраалкиламмония. Эти авторы подвергли также сомнению объяснение, данное ранее Кольтгофом [c.249]
Действительно, и в отсутствие перекиси водорода в объеме раствора наблюдалось повышение первой волны кислорода, что было объяснено увеличением концентрации Oi на внешней плоскости под влиянием положительного фг-потенциала. Однако полученные в работе [106] результаты были объяснены Кольтгофом и Изуцу [107] перемешиванием раствора и наличием следов летучих загрязнений в солях тетраалкиламмония. Эти авторы подвергли также сомнению объяснение, данное ранее Кольтгофом [c.249]
Эти методы используются для приготовления пористых эластомеров и термопластов, для которых получающиеся при разложении продукты не приносят вреда. Используется большое число порообразующих веществ, из которых наиболее распространены бикарбонаты натрия и аммония, нитрат аммония, карбонат кальция, диазопроизводные и диизоцианаты. Предложен в качестве порообразующего агента насыщенный газом активированный угольВ процессе Телейли для получения пористой резины источником газа служит перекись водорода, разлагающаяся с выделением кислорода под действием дрожжевого катализатора В любом случае порообразующий материал подмешивается в латекс до коагуляции или в эластомерную массу до вулканизации, причем материал должен быть равномерно распределен по всей пластической массе прежде, чем произойдет выделение газа. [c.92]
Для того, чтобы окончательно исключить промежуточное образование перекиси водорода при получении персульфата, мы применили метод изотопного разбавления. К электролиту добавлялась перекись водорода с другим изотопным составом кислорода, чем в воде. Если в ходе электролиза образуется перекись водорода из воды, то она должна разбавлять добавленную и изменять ее изотопный состав в направлении приближения к изотопному составу воды. Такое изменение не было обнаружено, несмотря на то, что количество образующегося персульфата во много раз превышало количество перекиси водорода, введенной в электролит. С другой стороны, было найдено, что при добавлении к раствору сульфата 20 г л Н2О2, образование персульфата подавляется и анодный -кислород вначале имеет тот же изотопный состав, как кислород добавлен- [c. 18]
18]
Несмотря на то что кислород воздуха обычно применяют для получения комплексов Со(1И), могут быть использованы и другие окислители. Многие из них в состоянии окислить Со(П) в Со(1И) в присутствии подходящих лигандов однако не все они удобны для применения. Такие окислители, как перманганат калия и бихромат калия, вводят в реакционную смесь ионы, трудно отделимые от продуктов реакции. Другие же окислители, например кислород и перекись водорода, не вводят в реакционную смесь посторонних ионов металлов. Подходящими окислителями являются также те, продукты восстановления которых не растворимы в воде и их можно отделить фильтровяние.м. Примерами являются РЬОз, который восстанавливается до РЬ , отделяемый в виде нерастворимого РЬС1г, и ЗеОо, который дает при восстановлении нерастворимый селен. [c.102]
Процесс протекает в жидкой и в паровой фазе в качестве инициатора применяют перекись водорода или какую-нибудь другую перекись, дающую щелочную реакцию. Жидкофазное окисление нужно вести так, чтобы между количествами абсорбированного кислорода и полученной перекисью водорода поддерживалось равновесие. Процесс идет непрерывно его осуществляют при температурах 100—105° С и давлении 2—3 ат, несколько большем, чем необходимо для поддержания изопропилового спирта в жидком состоянии. В этих условиях получается перекись водорода концентрацией 15—25% вес. В качестве стабилизатора перекиси водорода применяется метастанат натрия или ацетанилид. В качестве сырья применяется технический изопропиловый спирт (азеотропная смесь, содержащая 88% спирта и 12% воды) и кислород концентрацией не менее 95%. [c.450]
После вакуумной разгонки осталась бесцветная прозрачная жидкость, которая откачивалась в течение 1,5 часа при 30° С и 1 мм рт. ст. (перекиси в дестиллате не было получено) и непосредственно после этого исследовалась (выход 5,06 г). Она интенсивно выделяла иод из раствора KJ. Коэфициент рефракции ее оказался тем же, что у двухатомной перекиси изопропилового эфира (По = 1,4368), остальные же физические, а также химические свойства резко отличались. Она обладала меньшим удельным весом ( 4 = 0,947) и молекулярным весом (при криоскопическом определении в бензоле М = 149), значительно более низким содержанием активного кислорода (10,5 мл 0,1 N раствора РеС1з на 0,1 г или 15,8мл на миллимоль вещества), не смешивалась с водой и в пламени горелки сгорала спокойно, без вспышки, сначала синеватым, затем коптящим пламенем. Полученная жидкость давала положительную реакцию на перекись водорода с хромовой кислотой, что связано, повидимому, со способностью ее легко отщеплять перекись водорода. [c.138]
Она обладала меньшим удельным весом ( 4 = 0,947) и молекулярным весом (при криоскопическом определении в бензоле М = 149), значительно более низким содержанием активного кислорода (10,5 мл 0,1 N раствора РеС1з на 0,1 г или 15,8мл на миллимоль вещества), не смешивалась с водой и в пламени горелки сгорала спокойно, без вспышки, сначала синеватым, затем коптящим пламенем. Полученная жидкость давала положительную реакцию на перекись водорода с хромовой кислотой, что связано, повидимому, со способностью ее легко отщеплять перекись водорода. [c.138]
Практическая работа №4 7 класс. Получение кислорода из пероксида водорода и доказательство его наличия.
Практическая работа №4 7 класс.
Получение кислорода из пероксида водорода и доказательство его наличия.
Цель: 1) познакомиться со способом получения кислорода в лаборатории и его химическим свойством — поддерживать горение;
2) научиться собирать газ в сосуд вытеснением воздуха;
3) совершенствовать умение работать с простейшими приборами.
С техникой безопасности знаком (а)________________________________
План:
1.Налейте в стакан по 8—15 мл раствора пероксида водорода.
2.Добавьте в стакан (на кончике шпателя) оксид марганца (IV). Что наблюдаете?
3. Проверяем наличие кислорода тлеющей лучинкой.
4.Лучинку не макните в пероксид водорода.
5.Напишите уравнение реакции.
2 H2O2 = 2 H2O + O2
Пошла бурная реакция между пероксидом водорода и оксидом марганца (IV).
Тлеющая лучинка загорелась ярким пламенем.
Второй способ получения кислорода.
Получение кислорода из перманганата калия(марганцовки) и гидроперита
Получение кислорода из… — Youtube. com
com youtube.com/watch?v=-kem8rOavEo
В основание пробирки, в которой находится перманганат калия поместить комочек ваты и закрыть пробирку газоотводной трубкой.
Закрепить пробирку держателем. Опустить конец газоотводной трубки в пустую пробирку.
Нагреть пробирку с перманганатом калия, соблюдая правила нагревания.
Соберите кислород в пробирку способом вытеснения воздуха. Проверьте его наличие с помощью тлеющей лучинки. Прекратите нагревание.
оформите отчет о работе: а) зарисуйте прибор для сбора кислорода, сделайте соответствующие подписи; б) заполните таблицу, дописав предложения и закончив уравнения реакций.
KMnO4 K2MnO4 + … + …
2. Нагревание пробирки с перманганатом калия и собирание кислорода методом вытеснения воздуха
В пробирке происходит…
Пробирку для сбора кислорода следует держать … дном, потому что…
3. Доказательство наличия кислорода в пробирке с помощью тлеющей лучинки
Тлеющая лучинка…
Кислород поддерживает …
С + О2 =
ВЫВОД. Один из способов получения кислорода в лаборатории – разложение КMnO4. Кислород – газ без цвета и запаха, тяжелее воздуха в 1,103 раза (Mr(O2) = 32, Mr(возд.) = 29, из чего следует 32/29 1,103), малорастворим в воде. Вступает в реакции с простыми веществами, образуя оксиды. Приведите рабочее место в порядок. Сдайте тетради на проверку.
Подумайте и ответьте:
Кислород в лаборатории получают при нагревании перманганата калия. Полученный газ можно собрать путем вытеснения воздуха, используя прибор;
Какую посуду надо использовать при работе?
А) чистую Б) грязную В) с трещинами Г) какая есть, ту и использовать
Пробирку нагревают
А) в верхней части пламени Б) в нижней части пламени В) не имеет значения
Спиртовку тушат
А) задувая огонь Б) колпачком В) руками
Почему нельзя пользоваться грязной посудой?
А) неприятно брать в руки Б) можно получить неточный результат
Конспект урока.
 Фирсова Светлана Юрьевна -Архив
Фирсова Светлана Юрьевна -АрхивКонспект урока. Фирсова Светлана Юрьевна
13 ноября 2018
Просмотров: 1372
Тема урока химии «Кислород. Получение и свойства кислорода»
Разработала: Фирсова Светлана Юрьевна, учитель химии и биологии
АНО СОШ «Ломоносовская школа-пансион»
Класс: 9
Продолжительность: 80 минут
Тип урока: изучение новых знаний с элементами практической работы.
Цель урока: Создать условия для активного ознакомления учащихся с химическими свойствами кислорода, способами его получения и собирания в лаборатории и организовать их деятельность по развитию коммуникативных и учебно-исследовательских компетентностей.
Задачи урока:
— обучающие:
1) изучить общую характеристику химического элемента кислорода;
2) расширить представления учащихся о распространенности кислорода на Земле, его значении для живых существ;
3) познакомить учащихся с историей открытия кислорода и именами учёных, связанных с этим открытием;
4) обогатить лексический запас учащихся химическими понятиями: аллотропия, озон, катализаторы, окислительные свойства и др.;
5) познакомить учащихся с физическими и химическими свойствами кислорода;
6) познакомить учащихся со способами получения кислорода в лаборатории;
7) закрепить умения и навыки работы с химическим оборудованием и веществом с соблюдением техники безопасности;
8) развивать умение самостоятельно работать с информацией;
9) развивать учебно-исследовательские компетентности;
10) реализовать межпредметные связи: химии, истории, экологии, биологии;
— воспитательные:
1) развивать навыки самостоятельной работы;
2) воспитывать трудолюбие;
3) развивать коммуникативные качества;
4) воспитывать у учащихся организованность, аккуратность при проведении эксперимента;
— развивающие:
1) развивать познавательный интерес учащихся к истории открытия кислорода
2) развивать логическое мышление (операции анализа, синтеза, сравнения, обобщения, классификации и др. ), память, внимание, речь, эмоции;
), память, внимание, речь, эмоции;
3) развивать способность к самостоятельному приобретению знаний.
Методы обучения: проблемное обучение, индуктивный, фронтальный опрос, индивидуальный опрос, демонстрация, показ, рассказ, объяснение, учебная дискуссия, беседа, упражнение, самостоятельная работа учащихся, поощрение, предъявление требования.
Формы организации учебной деятельности: фронтальная, индивидуальная, групповая.
Оборудование урока: мультимедийная презентация, мультимедиапроектор, компьютер, периодическая система химических элементов Д. И. Менделеева, лабораторное оборудование: штатив, прибор для получения газов, спиртовка, перманганат калия, спички, пробирки, лучинка.
Основные понятия: Окислительные свойства кислорода, аллотропия.
Ход урока
Организационный момент.
Учитель: Приветствие, проверка отсутствующих.
— Ребята, отгадайте загадку:
Найди меня. Я газ. Я прост.
Я рыжий, словно лисий хвост.
Я образуюсь из нитрата,
А в воздухе — из газа-брата.
А если встречусь я с водой,
То стану сильной кислотой.
Учащиеся: оксид азота NO2.
Повторение пройденного материала.
Учитель (Слайд № 2):
- Что такое оксиды?
- Составьте химические формулы оксидов азота (I), (II), (III), (IV), (V).
- Вычислите, какой из оксидов азота богаче кислородом.
Учащиеся: записывают формулы: N2O, NO, N2O3, NO2, N2O5.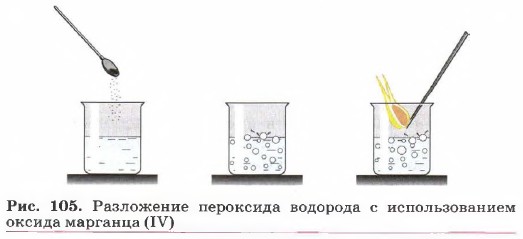
Вычисляют содержание кислорода в данных оксидах.
Изучение нового учебного материала (Слайд № 3):
«Кислород – это та ось, вокруг которой вращается химия».
А. Берцелиус
Учитель: Ребята, сегодня мы с вами начнем знакомиться с особенностями химического элемента кислорода. На уроке мы изучим особенности строения его атома, способов получения газообразного кислорода, физических и химических свойств простого вещества кислорода. Цель и задачи урока на доске (Слайд № 4).
План урока (Слайд № 5):
- Распространенность кислорода в природе.
- История открытия кислорода.
- Получение кислорода в лаборатории. Лабораторная работа.
- Свойства кислорода.
- Круговорот кислорода в природе и его применение.
- Аллотропные модификации кислорода.
Распространенность кислорода в природе.
Доклад ученика о распространении кислорода в природе (Слайд № 6).
Из курса биологии всем известна роль кислорода. Кислород – составная часть воздуха, в котором на долю кислорода приходится 21 % по объёму. Земная кора до глубины 10-15 км на 47 % своей массы состоит из кислорода, который является составной частью различных соединений. Кислород входит в состав почти всех окружающих нас веществ. Так, например, вода, песок, многие горные породы и минералы, составляющие земную кору, содержат кислород.
Если на какой-либо планете будут обнаружены вместе с кислородом вода и благоприятная температура, то можно предполагать, что там есть условия для жизни. Кислород является также важной частью многих органических соединений, например белков, жиров и углеводородов, имеющих исключительно большое значение в жизни растений, животных и человека. Для того чтобы как-то количественно оценить участие кислорода в образовании живых клеток, достаточно указать, что в состав клеток организма входит около 65 % кислорода.
Для того чтобы как-то количественно оценить участие кислорода в образовании живых клеток, достаточно указать, что в состав клеток организма входит около 65 % кислорода.
Из атомов мир создавала Природа.
Два атома легких взяла водорода.
Прибавила атом один кислорода
И получилась частица воды,
Море воды, океаны и льды…
Стал кислород чуть не всюду начинкой.
С кремнием он обернулся песчинкой.
В воздух попал кислород,
Как ни странно,
Из голубой глубины океана.
И на Земле появились растения,
Жизнь появилась: дыханье, горение…
Первые птицы и первые звери,
Первые люди, что жили в пещере…
Огонь добывали при помощи трения,
Хотя и не знали причины горения…
Роль кислорода на нашей Земле
Понял великий ЛАВУАЗЬЕ.
Е. С. Ефимовский
История открытия кислорода.
Доклад ученика об открытии кислорода.
С глубокой древности известно, что для горения необходим воздух, однако процесс горения оставался непонятным.
Долгое время существовала теория флогистона. Горение объяснялось как распад горючего тела с выделением флогистона, при котором каждое горючее вещество превращалось в негорючее. Необходимость воздуха химики объясняли тем, что флогистон соединяется с воздухом при горении, а не просто исчезает. Если воздуха нет, то горение прекращается, т.к. флогистону не с чем соединиться. В 1745-1748 гг. М. В. Ломоносов экспериментально доказал, что горение это реакция соединения веществ с частицами воздуха.
Впервые кислород был получен английским ученым Джозеф Пристли 1 августа 1774 г. (Слайд № 7).
При накаливании оксида ртути Пристли получил «воздух». Ученый решил исследовать действие полученного газа на пламя свечи и с удивлением отметил, что под действием этого газа пламя стало ослепительно ярким. Также он отметил, что в струе этого газа сгорает железная проволока. Мыши, помещенные в сосуд с этим газом, дышали легко, но скоро погибали. Сам ученый попробовал вдыхать этот газ и отметил, что он «помогает легким дышать».
Сам ученый попробовал вдыхать этот газ и отметил, что он «помогает легким дышать».
Антуан Лавуазье (Слайд № 8), обнаружив газ, который поддерживал горение и дыхание, показал, что кислород содержится во многих веществах, в том числе в кислотах. Отсюда и дал ему название Оксигениум, от греческих слов «оксос» — кислый и «геннас» — рождаю, т.е. рождающий кислоту. На русский язык название элемента переведено – кислород.
Итак, в 1777 г. была выяснена сущность горения, как химического взаимодействия различных веществ с кислородом. Кислородная теория горения пришла на смену флогистонной.
Учитель: Итак, мы узнали что заслуга открытия кислорода принадлежит двум ученым: Д. Пристли и А. Лавуазье.
Химический элемент кислород занимает свое место в периодической таблице химических элементов Д. И. Менделеева. Давайте, используя ее, дадим общую характеристику этого элемента по следующему плану (Слайды № 9):
Общая характеристика:
Химический знак – О
Относительная атомная масса Аr (O)=16
Химическая формула – О2
Относительная молекулярная масса Мr(O2)=32
Степень окисления -2.
Получение кислорода в лаборатории. Лабораторная работа.
Получение кислорода в лаборатории.
Учитель: Многообразие химических соединений, содержащих кислород, и их доступность позволяют получать кислород различными способами. Все способы получения можно разделить на физические и химические (Слайд № 10):
Способы получения кислорода
Химический Физический
— нагревание различных веществ;
— пропускание электрического тока через вещества
Физический способ основан на глубоком охлаждении воздуха и использовании различия в температурах кипения газов, входящих в состав воздуха. Воздух представляет собой смесь различных газов; основные компоненты в нем – азот и кислород. Для их разделения используют многократное испарение (температура кипения азота = -196°С, температура кипения кислорода = -183°С). Этот способ получил название фракционной перегонки.
Воздух представляет собой смесь различных газов; основные компоненты в нем – азот и кислород. Для их разделения используют многократное испарение (температура кипения азота = -196°С, температура кипения кислорода = -183°С). Этот способ получил название фракционной перегонки.
Химический способ получения кислорода в лаборатории, связан с разложением сложных веществ при нагревании и при пропускании через вещества электрического тока.
Сначала рассмотрим получение кислорода из различных веществ при нагревании.
1) В школьной лаборатории чаще всего получают кислород из перманганата калия. Реакция протекает при нагревании. Сейчас вы увидите видеофрагмент этого опыта. Смотрите внимательно, так как далее вам предстоит самим получить кислород этим способом (Слайд № 11 — видео).
Запишите уравнение реакции.
Учащиеся:в тетрадях записывают самостоятельно уравнение реакции:
2KMnO4 = K2MnO4 + MnO2 + O2
Учитель: Ребята, посмотрите на доску и проверьте себя на правильность записи реакции (Слайд № 12).
Кислород, получающийся в результате реакции можно собрать методом вытеснения воздуха или над водой.
Ребята, подумайте, как мы можем проверить, получили ли кислород?
Учащиеся: О заполнении сосуда кислородом можно судить по вспыхиванию тлеющей лучинки, опущенной в него.
Лабораторная работа «Получение кислорода из перманганата калия и собирание газа методом вытеснения воздуха».
Учитель: Ребята, вы только что посмотрели видеофрагмент получения кислорода из перманганата калия. Теперь вы выполните лабораторную работу, целью которой является самостоятельное получение кислорода из перманганата калия. При выполнении лабораторного опыта необходимо соблюдать правила техники безопасности. Давайте повторим их.
При выполнении лабораторного опыта необходимо соблюдать правила техники безопасности. Давайте повторим их.
Учащиеся: перечисляют правила обращения с лабораторным оборудованием и реактивами. Ход выполнения лабораторной работы учащиеся определяют самостоятельно на основе просмотренного видеофрагмента опыта.
Учитель: Для получения кислорода кроме перманганата калия можно использовать и другие вещества. Например, пероксид водорода:
Разложение пероксида водорода H2O2.
Запишите уравнение реакции.
Учащиеся: в тетрадях записывают самостоятельно уравнение реакции.
Учитель: Ребята, посмотрите на доску и проверьте себя на правильность записи реакции (Слайд № 13):
2H2O2 = 2H2O + O2
Учитель: Если в эту систему поместить немного оксида марганца (IV), то даже без нагревания начинается бурная реакция с выделением кислорода. Следовательно, оксид марганца ускоряет реакцию разложения пероксида водорода.
Вспомните, как называются вещества, которые ускоряют химические реакции.
Учащиеся: Вещества, которые ускоряют химическую реакцию, но сами при этом не расходуются, называются катализаторами.
Учитель:
3) Также для получения кислорода используют бертолетову соль КClO3, нагревая её.
Запишите уравнение реакции.
Учащиеся: в тетрадях записывают самостоятельно уравнение реакции.
Учитель: Ребята, посмотрите на доску и проверьте себя на правильность записи реакции (Слайд № 13):
2КClO3 = 2KCl + 3O2
4) Следующее вещество, при нагревании которого выделяется кислород, это оксид ртути.
Запишите уравнение реакции.
Учащиеся: в тетрадях записывают самостоятельно уравнение реакции.
Учитель: Ребята, посмотрите на доску и проверьте себя на правильность записи реакции (Слайд № 13):
2HgO = 2Hg + O2
Теперь рассмотрим получение кислорода путём пропускания электрического тока через воду.
5) Ребята, запишите самостоятельно реакцию разложения воды.
Учащиеся: в тетрадях записывают самостоятельно уравнение реакции.
Учитель: Ребята, посмотрите на доску и проверьте себя на правильность записи реакции (Слайд № 13):
2H2O = 2H2 + O2
Учитель: Итак, ребята, мы изучили несколько способов получения кислорода. Перечислите, какие вещества могут быть использованы для получения кислорода.
Учащиеся: перманганат калия, пероксид водорода, хлорат калия, оксид ртути, вода.
Свойства кислорода.
Учитель: Следующим этапом нашего урока является рассмотрение свойств простого вещества кислорода (Слайд № 14).
Физические свойства.
О2 – газообразное вещество, не имеет цвета, вкуса, запаха, малорастворим в воде (1 объеме H2O растворяется 3,1 объемов О2 , но лучше чем N2 , поэтому вода всегда обогащена кислородом. О2 – сжижается при очень низкой температуре: — 183 °С, а при температуре -219 °С он затвердевает. Интересно, что жидкий и твердый кислород голубого цвета.
Химические свойства кислорода
Кислород взаимодействует с простыми веществами (металлами и неметаллами) и сложными веществами при нагревании при этом выделяется теплота и свет. Такие реакции называют реакциями горения.
Такие реакции называют реакциями горения.
Демонстрация опытов (видеозапись) — взаимодействие кислорода с железом (Слайд № 15), серой (Слайд № 16), фосфором (Слайд № 17), природным газом (Слайд № 18).
Запишите уравнения реакций взаимодействия кислорода с железом, серой, фосфором и природным газом в тетрадь.
Учащиеся: записывают уравнения в тетрадях. Один ученик записывает уравнения у доски.
2О2 + 3Fe = Fe3O4
O2 + S = SO2
5O2 + 4P = 2P2O5
СН4 + 2О2 = СО2 + 2Н2О.
Учитель: проверяет правильность записи уравнений.
Круговорот кислорода в природе и его применение.
Учитель: Применение кислорода основано на его свойствах. В больших количествах кислород используется в различных отраслях химической промышленности и в металлургии. Жидкий кислород используется в ракетных двигателях. В медицине кислород служит для облегчения дыхания. В этом случае кислородом заполняют специальные подушки. Кислородные маски необходимы в высотных полетах, в космосе и при работе под водой. Отсюда видно, что очень много кислорода расходуется на разнообразную деятельность человека, также кислород необходим для дыхания всех живых организмов.
Еще Лавуазье отмечал, что кислород поддерживает горение и дыхание. Значит, мы с вами, используя кислород воздуха, уменьшаем его количество. Человек при дыхании в течение 1 мин. в среднем употребляет 0,5 дм3 кислорода, в течение суток – 720 дм3, а в год – 262 м3. Как же поддерживается необходимое нам постоянное содержание кислорода в воздухе?
Это объясняется процессом фотосинтеза, происходящим в зеленых растениях на свету. В результате этого процесса выделяется кислород. Упрощенно процесс фотосинтеза изображают так (Слайд № 19):
В результате этого процесса выделяется кислород. Упрощенно процесс фотосинтеза изображают так (Слайд № 19):
6CO2 + 6H2O = C6H12O6 + 6O2
Так в природе происходит непрерывный круговорот кислорода. Поэтому общая масса кислорода в воздухе, заметно не изменяется.
Но в настоящее время существует множество экологических проблем, одной из которых является вырубка лесов. Сейчас вырубка ведется очень быстрыми темпами, причём подвергаются этому тропические леса, которые являются легкими планеты. Считают, что при ускоренных темпах технического прогресса сокращение запасов кислорода на 1/3 произойдет через 150-170 лет. Организм человека чувствует снижение концентрации кислорода более чем на 1 %.
Вспомните! Каково процентное содержание кислорода в воздухе по объему?
Учащиеся: 21%.
Аллотропные модификации кислорода (Слайд № 20).
Учитель: Химический элемент кислород, кроме двухатомной молекулы, образует еще одно простое вещество, состоящее из трех атомов — озон.
Аллотропия — образование одним элементом нескольких простых веществ.
(Запишите определение в тетрадь)
Озон — газ, образуется в природе во время грозы и при окислении смолы хвойных деревьев. Придает воздуху запах свежести. Растворяется в воде гораздо лучше кислорода. Сильный окислитель. Спирт и некоторые другие вещества в озоне самовоспламеняются. Это связано с самопроизвольным распадом озона на молекулу кислорода и атоммарный кислород, обладающий большой окислительной активностью (Слайд № 21):
O3 = O2 + O
Озон можно получить пропусканием через воздух электрических разрядов (Слайд№ 22):
3O2 = 2O3
Применяется озон в озонаторах для уменьшения содержания в воздухе болезнетворных бактерий, для обеззараживания водопроводной воды на станциях водоочистки.
Озоновый слой в верхних слоях атмосферы (так называемый, озоновый экран) задерживает жесткое ультрафиолетовое излучение, без чего жизнь на поверхности суши была бы невозможна. Увеличение интенсивности ультрафиолетового излучения, достигшего Земли, могло бы привести к возрастанию заболеваемости раком кожи, катарактой глаз. Толщина озонового слоя очень мала. Если собрать весь озон. Находящийся в атмосфере, и опустить его на поверхность Земли при обычных условиях то получился бы слой всего 3 мм. Поэтому очень важно сохранять этот весьма чувствительный к действию различных химических веществ озоновый «щит» планеты от разрушения.
Закрепление.
Напишите уравнения взаимодействия кислорода с серой, натрием, углеродом (Слайд № 23).
Учащиеся: один из учеников выходит к доске и записывает уравнение реакции.
Решение задач на нахождение массы и объема кислорода с использованием способов получения и свойств кислорода (слайды № 24, 25, 26).
Учащиеся: трое учеников выходят к доске и записывают решение задач.
Выводы по уроку.
Учитель: Итак, наш урок подходит к концу. Сегодня мы узнали о распространенности кислорода в природе, о способах его получения, физических и химических свойствах кислорода, аллотропных модификациях, а также об учёных, которые совершили открытие кислорода.
А сейчас мы проведем викторину.
Задание «Волшебный цветок» (Слайд № 27)
Нас с вами ждет еще одно испытание: чтобы продолжить свой путь, вы должны разгадать тайну «Магических колец». Впишите в кольца отсутствующие формулы веществ с необходимыми индексами и коэффициентами (один ученик вызывается к доске).
Задание «Океан химических вопросов» (Слайд № 28)
Я думаю, что с этим заданием вы справитесь также успешно, как и с предыдущим.
1) Влажное зерно нельзя хранить в больших кучах: может произойти обугливание и даже самовозгорание. Объясните, почему это происходит.
Ответ: В данном случае мы сталкиваемся с медленным окислением. Зерно медленно реагирует с кислородом и теплота выделяется постепенно. Когда зерно лежит в больших кучах, то теплота выделяется в количестве, достаточном для обугливания или даже самовозгорания. Чтобы этого не произошло, зерно перелопачивают, то есть перебрасывают с места на место.
2) Почему перед уходом со стоянки туристы засыпают землей угли костра?
Ответ: Туристы засыпают угли костра, чтобы прекратить доступ кислорода, чтобы костер не смог снова загореться и не возник пожар.
3) Какую ошибку допустил ученик, сказав: «Фосфор при горении, соединяется с воздухом»?
Ответ: Фосфор при горении соединяется не с воздухом, а с кислородом, который содержится в воздухе.
4) Тигель с горящим скипидаром опустили в сосуд с холодной водой. Горение скипидара при этом прекращается. Почему?
Ответ: Горение скипидара прекращается, так как при опускании тигля в холодную воду, скипидар охлаждается ниже температуры горения.
5) Почему горение веществ на воздухе происходит медленнее, чем в кислороде?
Ответ: Кроме кислорода, который составляет 1/5 часть воздуха, в состав воздуха входят другие компоненты, которые не поддерживают горение. Поэтому горение на воздухе происходит медленнее.
Оценка работы учащихся.
Домашнее задание. §18, задачи 4,5 (стр. 99) (Слайд № 29).
Горение железа, формат wmv
Горение серы, формат wmv
Горение фосфора, формат wmv
Кислород, формат ppt
Получение кислорода разложением пероксида водорода, формат mp4
Получение кислорода разложением хлората калия, формат mp4
Получение озона, формат wmv
Список использованной литературы:
- Бучок С. В., Лелекова Л.
 Г. Весело и просто о сложном и простом. — Братск, 2008.
Г. Весело и просто о сложном и простом. — Братск, 2008. - Кузнецова Н. Е., Левкин А. Н. Задачник по химии. 9 класс. ФГОС. – М.: Вентана-Граф, 2010.
- Рудзитис Г. Е., Фельдман Ф. Г. Химия 9 класс. – М.: Просвещение, 2010.
- Электронное приложение к учебнику «Химия 9 класс» Г. Е. Рудзитиса, Ф. Г. Фельдмана. [Электронный ресурс]. – ЗАО «Образование-Медиа», ОАО «Издательство «Просвещение»», 2011. – 1 электрон. опт. диск (1 DVD). – Загл. с диска.
- Ширшина Н. В.Неорганическая химия. [Электронный ресурс]: Серия «Демонстрационное поурочное планирование». – Волгоград: Издательство «Учитель», 2009. – 1 электрон. опт. диск (CD). – Загл. с вкладыша контейнера.
Разложение перекиси водорода — Химия, Йоркский университет
Эта страница проекта впервые появилась в выпуске Chemistry Review за сентябрь 1995 г., том 5, номер 1, стр. 30.
ПРИМЕЧАНИЕ. Страница проекта предназначена для того, чтобы помочь вам подумать о своем расследовании. Он не является набором инструкций для практической работы и не включает список мер безопасности. CHEMISTRY REVIEW не несет ответственности, если Страница проекта используется каким-либо образом в качестве набора инструкций.
Каталитическое разложение перекиси водорода предоставляет ряд возможностей проекта различной продолжительности и сложности. Это связано с разнообразием катализаторов, которые увеличивают скорость разложения, и методами, которые можно использовать для контроля реакции:
2H 2 O 2 → 2H 2 O + O 2
Использование ферментного катализатора
Во многих живых организмах перекись водорода является продуктом метаболизма, который необходимо расщеплять, поскольку в заметных концентрациях он токсичен.Скорость разложения увеличивается за счет внутриклеточного фермента каталазы.
В качестве довольно простого проекта вы можете сравнить эффективность фермента из разных источников, таких как картофель, сельдерей и печень. Это может привести вас к более тщательному исследованию других факторов, влияющих на активность каталазы, включая, возможно, температуру, pH, концентрацию субстрата и фермента, а также присутствие ингибиторов ферментов.
Это может привести вас к более тщательному исследованию других факторов, влияющих на активность каталазы, включая, возможно, температуру, pH, концентрацию субстрата и фермента, а также присутствие ингибиторов ферментов.
Такие эксперименты могут на первый взгляд показаться довольно простыми, но когда вы попытаетесь интерпретировать свои результаты, вы столкнетесь с довольно сложными, но очень интересными аспектами химической кинетики и механизмов реакций.
Использование неорганического катализатора
Интересно отметить, что аналогичное увеличение скорости разложения перекиси водорода может быть достигнуто с использованием неорганического катализатора, такого как оксид марганца (IV) или оксид свинца (IV).
Вы можете посмотреть, как такие факторы, как концентрация перекиси, количество катализатора и температура, влияют на скорость разложения. Эксперименты такого рода могут привести вас к возможному механизму реакции и расчету задействованной энергии активации.
Химия контактных линз
Каталитическое разложение перекиси водорода будет хорошо знакомо некоторым студентам, поскольку это неотъемлемая часть одной системы для очистки контактных линз. В этом методе 18 декабря 2008 г. его очищают, а затем оставшийся раствор разлагают с помощью катализатора с платиновым покрытием. Возможно, вы захотите изучить, как эффективность этого катализатора меняется в различных условиях, и сравнить ее с другими катализаторами.
Контроль разложения
Есть несколько способов контролировать реакцию разложения.Вы можете решить следить за падением концентрации перекиси водорода. Вы можете сделать это, взяв образцы реакционной смеси в разное время и погрузив их в подкисленный раствор йодида калия. Полученный йод можно титровать раствором тиосульфата, используя индикатор крахмала:
2H + + H 2 O 2 + 2I — → I 2 + 2H 2 O
I 2 + 2S 2 O 3 2 — → 2I — + S 4 O 6 2–
Объем раствора тиосульфата, необходимый для титрования, позволяет измерить количество перекиси водорода в реакционной смеси в разное время. В качестве альтернативы вы можете предпочесть измерить объем кислорода, образующегося при разложении перекиси водорода. Это можно сделать, подключив стеклянный газовый шприц к колбе Бюхнера или трубке Хирша.
В качестве альтернативы вы можете предпочесть измерить объем кислорода, образующегося при разложении перекиси водорода. Это можно сделать, подключив стеклянный газовый шприц к колбе Бюхнера или трубке Хирша.
Существует также другой, более новый подход к мониторингу реакции, катализируемой ферментами, который вы, возможно, захотите попробовать. Сначала приготовьте экстракт каталазы. Затем используйте дырокол для файловой бумаги, чтобы штамповать круги на фильтровальной бумаге. Погрузите один из этих кружков в экстракт фермента, слейте воду и проткните стеклянной палочкой на дно пробирки, содержащей раствор перекиси водорода.Пузырьки кислорода, образующиеся при разложении перекиси, прилипают к кругу фильтровальной бумаги и переносят его на поверхность жидкости. Время, необходимое для этого, обеспечивает удивительно точную оценку относительной активности фермента в различных условиях.
Советы по проекту
- Экстракт каталазы можно легко получить путем мацерации равных количеств картофеля или другого источника ферментов с водой в кухонном комбайне или блендере. В качестве альтернативы вы можете удалить цилиндр картофеля с помощью сверла для пробок и отрезать диски одинаковой толщины.
- 20 объемная перекись водорода составляет 6% вес / объем или 1,8 моль дм -3 . (Также подойдет отбеливатель без хлора!)
- 5 см 3 порциями частично разложившейся перекиси водорода 1 объем можно добавить к смеси 4 см 3 2 моль дм -3 серной кислоты и 3 см 3 10% раствора йодида калия. Добавьте 1 каплю 3% раствора молибдата аммония и дайте смеси постоять 2 минуты. Титруйте выделившийся йод с помощью 0.1 моль дм -3 раствора тиосульфата натрия с использованием 2 см3 1% раствора крахмала в качестве индикатора.
- Иногда прилипает стеклянный шприц. Вы можете свести к минимуму эту проблему, постоянно нажимая на нее карандашом.
- Диски с платиновым покрытием являются частью системы «Septicon» для очистки контактных линз.
 Их можно приобрести в аптеке Boots.
Их можно приобрести в аптеке Boots.
Оригинальная статья была написана Дереком Денби. Мы благодарны Дереку за разрешение воспроизвести его здесь.
Эта страница бесплатна для личного использования, но авторские права остаются за Philip Allan Updates.Пожалуйста, не копируйте и не распространяйте его каким-либо образом.
Chemistry Review признателен Дону Эйнли, который помог подготовить эту статью для Интернета.
Разложение перекиси водорода
Перекись водорода (H 2 O 2 ) есть везде. Он есть в отбеливателе, краске для волос, шкафчике для чистки и даже в отбеливателях для зубов. Вы можете не знать, что это химическое вещество все время разлагается. Это происходит очень медленно, но с помощью магии науки мы можем это ускорить.
Почему разлагается перекись водорода?Когда дело доходит до того, чтобы точно определить, почему перекись водорода так легко разлагается, мы должны взглянуть на химическую структуру молекулы H 2 O 2 .
Перекись водорода содержит одинарную кислородно-кислородную связь. Иначе известная как перекисная связь, она невероятно слабая и нестабильная.
При разрыве кислородно-кислородной связи перекись водорода разлагается на воду и кислород.Когда это происходит, он высвобождает свободные радикалы, которые очень активно взаимодействуют с другими веществами.
Хотя эту реакцию разложения можно ускорить с помощью катализатора, нестабильность пероксидной связи означает, что разложение также происходит естественным образом.
Естественное разложение пероксида водородаПерекись водорода используется для различных целей, от косметических до промышленных. Но у всех этих отраслей всегда есть одна общая черта: как хранится перекись водорода.
Пероксид водорода имеет ограниченный срок хранения, поскольку со временем он естественным образом разлагается на воду и газообразный кислород. Хотя это займет некоторое время, ультрафиолетовые лучи солнечного света, а также теплые условия могут фактически катализировать реакцию разложения.
Хотя это займет некоторое время, ультрафиолетовые лучи солнечного света, а также теплые условия могут фактически катализировать реакцию разложения.
Вот почему перекись водорода обычно хранят в темных пластиковых контейнерах. Непрозрачный цвет защищает химическое вещество от солнечного света, а пластик приспосабливается к любому накоплению газообразного кислорода, которое может произойти.
Стеклянный контейнер, например, может разбиться при повышении давления.По этой же причине на емкостях с перекисью водорода устанавливаются вентилируемые крышки, так как они обеспечивают выход любого выделяющегося кислорода.
Темные пластиковые контейнеры используются для хранения перекиси водорода. Непрозрачный цвет защищает его от солнечного света, который может катализировать его разложение. Ускорение реакцииСолнечный свет — не единственное, что может ускорить реакцию разложения перекиси водорода. В лаборатории можно использовать несколько катализаторов для увеличения скорости реакции.К ним относятся:
В организме фермент каталаза катализирует разложение перекиси водорода на воду и газообразный кислород. Этот процесс происходит почти в каждом живом организме, включая пчел.
При проведении реакции в лаборатории обычно предпочтительным катализатором является оксид марганца (IV). Однако существует широкий выбор катализаторов, и каждый из них будет иметь разную эффективность.
Почему катализаторы ускоряют реакцию?Катализаторы способны снизить энергию активации, необходимую для реакции.Это означает, что они могут увеличивать скорость реакции, не расходясь.
Следовательно, в конце реакции оставшийся катализатор можно использовать повторно. Это очень удобно для коммерческих или промышленных процессов, поскольку потребляется меньше продукта.
Реакция разложения пероксида водорода Когда вы добавляете небольшое количество катализатора в колбу, содержащую водный раствор перекиси водорода, первое, что вы заметите, — это мгновенное изменение цвета.
В присутствии оксида марганца (IV) или хлорида железа (III) прозрачный раствор немедленно станет черным. Когда катализатор творит чудеса, перекись водорода начинает очень быстро разлагаться.
Когда это произойдет, раствор начнет быстро шипеть. Это вызвано двумя причинами:
- Быстрое разложение означает, что большое количество газообразного кислорода образуется в форме пузырьков
- При реакции разложения выделяется тепловая энергия, что превращает ее в экзотермическую и газообразную реакцию
По мере продолжения разложения перекиси водорода в колбе будет быстро повышаться давление из-за большого объема производимого газообразного кислорода.Реакция завершится резким выбросом смеси вверх из колбы.
Зубная паста слонаЭту химическую реакцию можно превратить в забавный эксперимент для детей (и взрослых!). При добавлении некоторого количества жидкости для мытья посуды к раствору H 2 O 2 конечный продукт представляет собой густую пену, которая выливается из контейнера, как выжимаемая зубная паста слона.
Присутствие мыльной воды может задерживать кислород, выделяющийся при разложении.Это создает густую пену, которая вытесняется из контейнера из-за повышения давления.
Наиболее распространенным катализатором, используемым в этом эксперименте, является йодид калия, но большинство катализаторов достигают того же эффекта при добавлении средства для мытья посуды.
Измерение реакции Добавляя катализатор к водному раствору H 2 O 2 и регистрируя скорость реакции через определенные интервалы времени, вы можете контролировать общий объем производимого газообразного кислорода. Вот как это сделать:
Вот как это сделать:
- Налейте водный раствор перекиси водорода в вертикальную колбу
- Добавьте небольшое количество катализатора в раствор
- Быстро закрыть колбу, чтобы предотвратить утечку выделяющегося кислорода
- Запишите объем кислорода через определенные интервалы времени на протяжении всей реакции
- Используя график, отобразите объем произведенного кислорода в зависимости от определенного времени
Когда вы закончите график, у вас должна остаться кривая.Чтобы рассчитать скорость реакции, просто выберите точку на кривой и проведите к ней касательную линию.
Расчет градиента касательной даст вам скорость разложения в этот конкретный момент времени. Чем круче градиент, тем выше скорость реакции.
ReAgent не только продает высококачественную перекись водорода в виде ряда растворов, но и предлагает различные катализаторы в нашем интернет-магазине. От йодида калия до хлорида железа (III) — у нас есть все ингредиенты, которые вам понадобятся для приготовления зубной пасты для слона!
Производство кислорода | Водородная связь
Газообразный кислород имеет множество применений — от добавок для здоровья (высотная болезнь, проблемы с дыханием, проблемы с кровообращением и кислородная добавка для благополучия или развлечений) до аэрации аквариумов, аэрации воды, использования в сельском хозяйстве и садоводстве, а также а также различные химические реакции.
Каталитическое производство кислорода
Перекись водорода H 2 O 2 — очень удобный, непосредственный источник кислорода для различных применений и в широком диапазоне применений, от небольших домашних нужд до больших масштабное производство кислорода.
Общая реакция разложения перекиси водорода приводит к образованию молекул воды и газообразного кислорода:
2 H 2 O 2 → 2 H 2 O + O 2
Однако на практике эта реакция не проходит легко без катализатора. Имеющиеся в продаже растворы перекиси водорода (промышленные, косметические и пищевые) всегда устойчивы к разложению и содержат химические вещества, предотвращающие образование кислорода при нормальных условиях. Поэтому раствор перекиси водорода можно хранить длительное время.
Имеющиеся в продаже растворы перекиси водорода (промышленные, косметические и пищевые) всегда устойчивы к разложению и содержат химические вещества, предотвращающие образование кислорода при нормальных условиях. Поэтому раствор перекиси водорода можно хранить длительное время.
Однако нет более простого способа получения газообразного кислорода, чем метод Каталитическая генерация кислорода с катализатором , разработанным Hydrogen Link . Катализатор представляет собой гранулят (3-5 мм) , который немедленно вызывает разложение перекиси водорода с выделением газообразного кислорода, оставляя после себя чистую воду.Чтобы инициировать поток кислорода, просто налейте немного перекиси водорода фармацевтического качества на гранулы катализатора. Реакция прекращается, когда израсходуется H 2 O 2 , и вы можете просто добавить следующую порцию перекиси водорода в свой контейнер. Время от времени из емкости можно выливать избыток воды, чтобы освободить место для предстоящей подачи перекиси водорода. Подача может быть альтернативно капельной или непрерывной.
Гранулят катализатора для производства кислорода
Катализаторы могут быть очень эффективными при разложении перекиси водорода.Это быстрый и удобный метод получения кислорода, при котором можно легко и безопасно достичь высокого расхода кислорода. С другой стороны, более высокие концентрации перекиси водорода могут быть чрезвычайно мощными и могут использоваться, например, в качестве ракетного топлива.
Реакция получения кислорода
Гетерогенный катализатор, разработанный в Hydrogen Link, имеет дополнительное преимущество. Он твердый и не растворяется в растворе, поэтому его можно многократно использовать повторно с новыми порциями перекиси водорода, в то время как продуктом реакции является просто чистая вода.Другими преимуществами нашего гетерогенного катализатора являются очень высокая эффективность (намного выше, чем у диоксида марганца или серебра) и низкая стоимость . Присутствие стабилизаторов в пероксиде водорода не ухудшает разложение и любой тип и марка H 2 O 2 можно использовать
Присутствие стабилизаторов в пероксиде водорода не ухудшает разложение и любой тип и марка H 2 O 2 можно использовать
Каталитический генератор кислорода
Генератор кислорода, использующий катализатор и перекись водорода, очень прост. Он состоит из контейнера / реактора (который может быть сделан из пластика, стекла или металла) и двух пластиковых шлангов — один для входа (дозирование перекиси водорода) и один для выхода кислорода.
Пожалуйста, свяжитесь с нами с вопросами, касающимися сотрудничества и покупки наших катализаторов: Свяжитесь с нами для запросов или [email protected]
Перекись водорода обычно доступна в виде водного раствора с концентрацией от 3% (для бытового использования) до 50% (промышленная концентрация). Однако балласт воды в таких растворах может стать недостатком в некоторых приложениях. В таких случаях могут использоваться альтернативные твердые формы перекиси водорода, такие как аддукты H 2 O 2 с карбонатом натрия или мочевиной (т.е.д. перкарбонат и перкарбамид натрия)
Структура перкарбоната натрия
Перкарбонат натрия (SPC) — Na 2 CO 3 · 1,5H 2 O 2 — представляет собой кристаллический аддукт H 2 O 2 с карбонатом натрия («кальцинированная сода»). Это удобный и концентрированный источник перекиси водорода, простой в обращении и транспортировке. Количество перекиси водорода в перкарбонате натрия превышает 30%.С ним можно обращаться удобнее и безопаснее, чем с такой же концентрацией H 2 O 2 в водных растворах. Перкарбонат натрия используется во многих экологически чистых моющих и чистящих средствах, таких как OxiClean и Vanish.
В воде перкарбонат натрия выделяет перекись водорода в соответствии с реакцией:
2Na 2 CO 3 . 3H 2 O 2 → 2Na 2 CO 3 + 3H 2 O 2
3H 2 O 2 → 2Na 2 CO 3 + 3H 2 O 2
Перекись водорода может выделяться из SPC в воду или в безводные растворители.Однако для получения кислорода для разложения выделившейся таким образом перекиси водорода необходим катализатор , поскольку этот раствор ведет себя аналогично перекиси водорода на водной основе.
Каталитическое разложение пероксида водорода из перкарбоната натрия столь же эффективно, как и из водного H 2 O 2 — и как источник кислорода и как источник гидроксильных радикалов, если это необходимо для специализированных химических реакций.
Сухой перкарбонат натрия SPC с порошком катализатора
Наш гетерогенный (твердый) катализатор может использоваться для получения кислорода из твердого перкарбоната натрия (SPC) в различных реакциях:
- Твердый SPC + твердый катализатор — можно удобно транспортировать и обрабатывать и впоследствии комбинировать с некоторым количеством воды для выработки кислорода
- Твердый SPC может быть сначала растворен в воде , а твердый катализатор добавлен в раствор для образования кислорода.
Одновременное растворение SPC и образование кислорода
Каталитическое образование кислорода из перкарбоната натрия
Реакция продолжается до тех пор, пока не израсходуется вся перекись водорода. Дополнительные порции перкарбоната натрия могут быть добавлены к тому же катализатору для образования большего количества кислорода.
Перкарбонат натрия — очень эффективный источник кислорода. Количество 30% H 2 O 2 в твердой форме соответствует значительному количеству выделившегося кислорода.Например, из 10 г перкарбоната натрия с катализатором (столовая ложка) образуется более 1 литра газообразного кислорода. Фактически, из перкарбоната натрия с катализатором можно получить больше кислорода, чем из газового баллона под давлением (150 бар) с таким же общим весом (включая вес стального баллона). Более того, перкарбонат натрия можно использовать небольшими порциями, например «саше», и при этом не требуется высокое давление. Единственным побочным продуктом этой реакции является кальцинированная сода (карбонат натрия) — распространенный и безвредный бытовой продукт, иногда используемый даже в пищевых продуктах.
Фактически, из перкарбоната натрия с катализатором можно получить больше кислорода, чем из газового баллона под давлением (150 бар) с таким же общим весом (включая вес стального баллона). Более того, перкарбонат натрия можно использовать небольшими порциями, например «саше», и при этом не требуется высокое давление. Единственным побочным продуктом этой реакции является кальцинированная сода (карбонат натрия) — распространенный и безвредный бытовой продукт, иногда используемый даже в пищевых продуктах.
Перкарбамид (пероксид карбамида)
Другой удобный твердый источник пероксида водорода — это пероксид карбамида (или перкарбамид), который представляет собой аддукт мочевины и пероксида водорода. Это белый нетоксичный порошок без запаха, содержащий большое количество H 2 O 2 , что эквивалентно по массе 36% концентрации перекиси водорода. Наш гетерогенный катализатор обеспечивает эффективное высвобождение кислорода из аддукта мочевины и пероксида водорода, и поэтому его можно использовать в качестве очень удобного источника кислорода или окислительной среды.Количество получаемого кислорода даже больше, чем при использовании перкарбоната натрия.
Катализированное образование кислорода из перекиси водорода
нажмите на изображение, чтобы посмотреть нашу видеопрезентацию
Пожалуйста, свяжитесь с нами с вопросами, касающимися сотрудничества и покупки наших катализаторов: Свяжитесь с нами для запросов или [email protected]
Подробнее
Перекись водорода — кислород, вода, газ и разложение
Перекись водорода, H 2 O 2 , представляет собой бесцветную жидкость, которая смешивается с водой и широко используется в качестве дезинфицирующего и отбеливающего средства. Он нестабилен и медленно разлагается (распадается) с образованием воды и кислорода газ. Высококонцентрированные растворы перекиси водорода являются мощными окислителями и могут использоваться в качестве ракетного топлива.
Он нестабилен и медленно разлагается (распадается) с образованием воды и кислорода газ. Высококонцентрированные растворы перекиси водорода являются мощными окислителями и могут использоваться в качестве ракетного топлива.
Перекись водорода наиболее широко встречается в домах в коричневых бутылках, содержащих 3% растворы (3% перекиси водорода и 97% воды). Разложение перекиси водорода происходит намного быстрее в присутствии света , так что непрозрачная бутылка помогает замедлить этот процесс.Разложение перекиси водорода можно описать химическим уравнением:
, в котором говорится, что две молекулы перекиси водорода распадаются с образованием двух молекул воды и одной молекулы газообразного кислорода, а также тепла энергии . В большинстве случаев этот процесс происходит медленно, но при открытии бутылки с перекисью водорода она разлагается быстрее, поскольку выделяется скопившийся газообразный кислород. Полностью разложившаяся бутылка с перекисью водорода состоит только из воды.Старые закрытые баллоны с перекисью водорода часто выпирали из-за давления газообразного кислорода, которое накапливалось с течением времени. Известно, что некоторые бутылки «лопаются» от такого давления газообразного кислорода.
Наиболее часто перекись водорода используется в качестве отбеливающего средства для волос и для отбеливания целлюлозы при производстве бумаги , а также в качестве дезинфицирующего средства в домашних условиях. Как и отбеливатель , перекись водорода является окислителем (вещество, которое принимает электроны от других молекул).Он становится все более широко используемым в промышленности, чем хлорные отбеливатели , потому что продуктами его разложения являются вода и кислород, а при разложении хлорных отбеливателей образуется ядовитый газообразный хлор.
В качестве дезинфицирующего средства перекись водорода широко используется для обработки порезов и царапин и вызывает образование пузырьков (вызванных образованием газообразных молекул кислорода).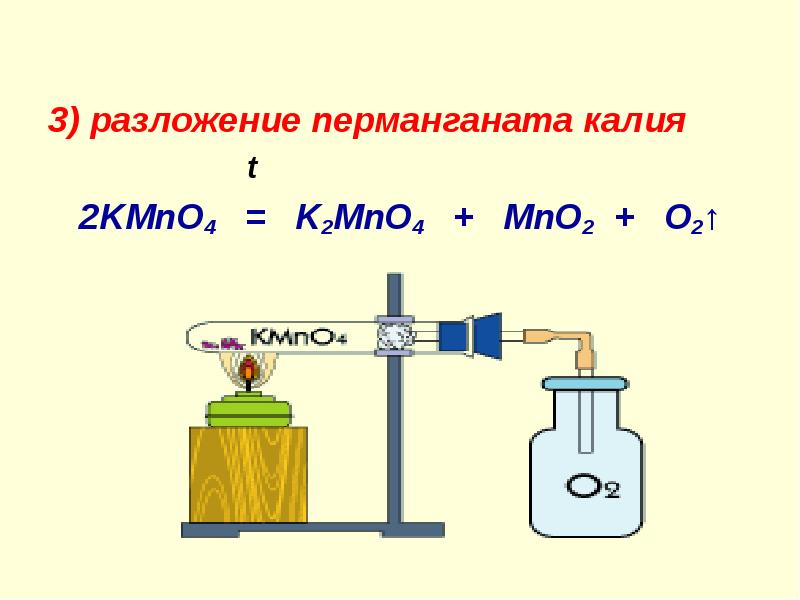 На срезах пузыриться довольно быстро из-за присутствия фермента (белкового катализатора или молекулы, ускоряющей реакцию) в крови , известного как каталаза.Подобное пузырение можно наблюдать, если добавить небольшое количество перекиси водорода в сырые нарезанные ломтики картофеля , поскольку фермент каталаза также содержится в картофеле.
На срезах пузыриться довольно быстро из-за присутствия фермента (белкового катализатора или молекулы, ускоряющей реакцию) в крови , известного как каталаза.Подобное пузырение можно наблюдать, если добавить небольшое количество перекиси водорода в сырые нарезанные ломтики картофеля , поскольку фермент каталаза также содержится в картофеле.
Образование синглетного кислорода (1O2) в результате разложения пероксида водорода с помощью реактивов гипервалентного йодаарена, генерируемого in situ
Процедура окисления 9,10-диметилантрацена (2a) и α-терпинена (2e) с помощью MesIO – H
2 O 2 Система (основной текст, Схема 3)К раствору субстрата ( 2 , 1 ммоль) и 35% H 2 O 2 (1.29 мл, 15 ммоль) в CH 2 Cl 2 (5 мл) при комнатной температуре добавляли MesIO ( 10 , 1,05 г, 4,0 ммоль) порциями в течение 2 часов. Смесь дополнительно перемешивали 2 ч. После добавления дифенилметана (168 мг, 1 ммоль) в качестве внутреннего стандарта смесь экстрагировали CH 2 Cl 2 (2 × 10 мл), промывали водой (10 мл) и сушили над Na . 2 СО 4 . После удаления растворителя при пониженном давлении (15 ° C, 25 Торр) конверсия и выход были непосредственно определены анализом 1 H ЯМР неочищенной смеси.
9,10-диметил-4a, 9,9a, 10-тетрагидро-9,10-эпидиоксиантрацен (3a): выход выделенного соединения: 94%; 1 H ЯМР (CDCl 3 ): 7,41-7,37 (AA ‘часть системы AA’BB’, 4H), 7,29-7,26 (BB ‘часть системы AA’BB’, 4H), 2,14 (с, 6H). 13 C ЯМР (CDCl 3 ): 140,8, 127,4, 120,6, 79,5, 13,7.
Бензол-1,2-диилбис (фенилметанон) (3b): Выделенный выход: 95%; 1 H ЯМР (CDCl 3 ): 7,71-7,36 (м, 14H). 13 C ЯМР (CDCl 3 ): 196,6, 140,0, 137,2, 133,0, 130,3, 129,8, 129,6, 128,3.
9,10-Дифенил-9,10-дигидро-9,10-эпидиоксиантрацен (3c): Выход выделенного продукта: 48%; 1 H ЯМР (CDCl 3 ): 7,71-7,69 (м, 4H), 7,65-7,61 (м, 4H), 7,56-7,52 (м, 2H), 7,22-7,16 (м, 8H). 13 C ЯМР (CDCl 3 ): 140,2, 133,0, 128,3, 128,2, 127,6, 127,5, 123,5, 84,1.
4-гидроперокси-2,4,6-триметилциклогекса-2,5-диен-1-он (3d): Изолированный выход: 20%; 1 H ЯМР (CDCl 3 ): 8.02 (с, 1H), 6,64 (с, 2H), 1,92 (с, 6H), 1,37 (с, 3H). 13 C ЯМР (CDCl 3 ): 186,6, 144,2, 136,8, 78,6, 23,0, 16,0.
1-Метил-4- (пропан-2-ил) -2,3-диоксабицикло [2.2.2] окт-5-ен (3e): Выделенный выход: 70%; 1 H ЯМР (CDCl 3 ): 6,50 (д, 3 J H, H = 8,6 Гц, часть системы AB, 1H), 6,42 (д, 3 J H, H = 8,6 Гц, B часть системы AB, 1H), 2,05–1,98 (м, 2H), 1.96–1,89 (м, 1H), 1,53–1,51 (м, 2H), 1,38 (с, 3H), 1,0 (д, J = 7,0 Гц, 6H). 13 C ЯМР (CDCl 3 ): 136,4, 133,0, 79,8, 74,4, 32,1, 29,5, 25,6, 21,4, 17,2, 17,2.
2,3-Диоксабицикло [2.2.2] окт-5-ен (3f): Выделенный выход: 65%; 1 H ЯМР (CDCl 3 ): 6,69 (дд, 3 J H, H = 4,4, 3,3 Гц, 2H), 4,68–4,64 (м, 2H), 2,31–2,25 (м , 2H, AA ‘часть системы AA’BB’), 1.51–1.47 (м, 2H, BB ‘часть системы AA’BB’). 13 C ЯМР (CDCl 3 ): 132,1, 70,8, 21,5.
6,7-Диоксабицикло [3.2.2] нон-8-ен (3g): Выделенный выход: 74%; 1 H ЯМР (CDCl 3 ): 6,40 (дд, 3 J H, H = 4,9, 3,2 Гц, 2H), 4,76–4,73 (м, 2H), 2,00–1,86 (м , 4H), 1,61–1,55 (м, 1H), 1,46–1,30 (м, 1H). 13 C ЯМР (CDCl 3 ): 127,9, 77,3, 31,7, 18,4.
8-Оксабицикло [5. 1.0] окт-2-ен (6a): 1 H ЯМР (CDCl 3 ): 5.91–5,88 (м, 1H), 5,81–5,77 (м, 1H), 3,44–3,43 (м, 1H), 3,27–3,25 (м, 1H), 2,25–2,23 (м, 2H), 1,99–1,98 (м , 2H), 1,60–1,59 (м, 2H).
1.0] окт-2-ен (6a): 1 H ЯМР (CDCl 3 ): 5.91–5,88 (м, 1H), 5,81–5,77 (м, 1H), 3,44–3,43 (м, 1H), 3,27–3,25 (м, 1H), 2,25–2,23 (м, 2H), 1,99–1,98 (м , 2H), 1,60–1,59 (м, 2H).
2,3-Диметилбут-3-ен-2-илгидропероксид (3h): 1 H ЯМР (CDCl 3 ): 7,41 (с, 1H), 5,02–5,01 (м, 1H), 4,97 –4,96 (м, 1H), 1,82 (дд, 3 J H, H = 1,4, 0,8 Гц, 3H), 1,37 (с, 6H). 13 C ЯМР (CDCl 3 ): 148,0, 112,0, 84,4, 23,9, 18,8.
2,3-Диметилбут-3-ен-2-ол (7a): 1 H ЯМР (CDCl 3 ): 5.00 (м, 1H), 4,77 (м, 1H), 1,81 (м, 3H), 1,54 (шир. С, 1H), 1,35 (с, 6H). 13 C ЯМР (CDCl 3 ): 151,9, 108,4, 73,1, 28,8, 19,2.
Тетраметилоксиран (6b): 1 H ЯМР (CDCl 3 ): 1,32 (с, 12H). 13 C ЯМР (CDCl 3 ): 62,0, 21,1.
2-Метилпент-1-ен-3-илгидропероксид (3i): 1 H ЯМР (CDCl 3 ): 7,73 (с, 1H), 5,04 (м, 1H), 5,02 (м, 1H). ), 4,25 (т, 3 J H, H = 6.9, 1H), 1,73 (с, 3H), 1,67–1,44 (м, 2H), 0,92 (т, 3 J H, H = 7,4, 3H). 13 C ЯМР (CDCl 3 ): 143,4, 114,4, 91,1, 23,7, 17,1, 10,0.
(3 E ) -2-метилпент-3-ен-2-илгидропероксид (3k): 1 H ЯМР (CDCl 3 ): 7,84 (с, 1H), 5,73 (м, 1H ), 5,57 (д, 3 J H, H = 1,4, 1H), 1,74 (д, 3 J H, H = 1,4, 3H), 1,32 (с, 6H) . 13 C ЯМР (CDCl 3 ): 134,3, 127,0, 82,2, 24,2, 14,1.
2-Метилпент-1-ен-3-ол (7b): 1 H ЯМР (CDCl 3 ): 4,94–4,92 (м, 1H), 4,86–4,84 (м, 1H), 3,99 ( t, 3 J H, H = 6,5 Гц, 1H), 1,72 (t, 3 J H, H = 1,3 Гц, 3H,), 1,69–1,67 (м, 1H ), 1,66–1,50 (м, 2H), 0,89 (т, 3 J H, H = 7,5 Гц, 3H).
3-Этил-2,2-диметилоксиран (6c): 1 H ЯМР (CDCl 3 ): 2.72 (т, 3 J H, H = 7,0 Гц, 1H), 1,53 (м, 2H), 1,35 (с, 3H), 1,30 (с, 3H), 1,00 (т, J = 7,0 Гц, 3H). 13 C ЯМР (CDCl 3 ): 65,1, 57,6, 24,9, 22,4, 18,5, 10,6.
2-Метилпент-1-ен-3-он (8): 1 H ЯМР (CDCl 3 ): 5,95 (м, 1H), 5,75 (м, 1H), 2,72 (кв, 3 J H, H = 7,3, 2H), 1,88 (с, 3H), 1,10 (т, 3 J H, H = 7.3, 3Н). 13 C ЯМР (CDCl 3 ): 202,6, 144,3, 124,1, 30,6, 17,7, 8,4.
Конспект лекций Джона Штрауба
Состав: перекись водорода, перманганат калия, дрожжи.
Процедура: Полный рецепт приводится ниже.
1. Наблюдайте за разложением перекиси водорода в колбе Эрленмейера.
2. Наблюдайте ту же реакцию при добавлении кристаллов перманганата калия.
3.Наблюдайте такую же реакцию при добавлении дрожжей.
Понимание: Катализатор — это вещество, которое приводит к увеличению скорости химической реакции, но не влияет на состояние равновесия между реагентами и продуктами. Хотя катализатор участвует в реакции, влияя на скорость реакции и даже на механизм, он не потребляется и не производится. В конце реакции катализатор может быть переработан.
Понятию «катализатор» более двух веков.Хотя великому химику Джонсу Якобу Берцелиусу обычно приписывают первое признание катализатора в 1836 году, есть свидетельства того, что первые предложения по пониманию катализа были сделаны миссис Элизабет Фулхейм в 1794 году в ее книге «Эссе». по горению «. Берцелиус и другие полагали, что катализ будет «лишь редко наблюдаемой силой, которая, вероятно, активна в образовании органических веществ». Тем не менее, Fulhame рассмотрел возможность того, что все реакции восстановления / окисления требуют воды в качестве катализатора.При этом она вообразила роль катализа, которая была гораздо более современной, распространяясь на неорганические, а также биохимические реакции.
Разложение перекиси водорода представляет собой реакцию восстановления / окисления диспропорционирование реакция с продуктами воды и газообразного кислорода
H 2 O 2 (водн.) → H 2 O (л) + O 2 (г)
Реакция является экзотермической и протекает с заметной скоростью в отсутствие катализатора, где за скоростью реакции можно следить, отслеживая объем образующегося газообразного кислорода как функцию времени.Добавление неорганического оксида марганца (IV) в качестве катализатора приводит к значительному увеличению скорости реакции. Реакцию также можно катализировать добавлением оксида меди (II) или оксида цинка. Оксид марганца (IV) дает наибольшее увеличение скорости реакции, а оксид цинка приводит к наименьшему увеличению скорости реакции.
В наших демонстрациях мы наблюдали быстрое разложение перекиси водорода при добавлении кристаллов перманганата калия.Поскольку реакция разложения является экзотермической, во время реакции раствор нагревается, образуя «облако» водяного пара, которое выталкивается из колбы.
Идентичное разложение перекиси водорода также катализируется протеином каталазы , ферментом, обнаруженным в клетках растений и животных. Каталаза катализирует превращение опасной для клеток перекиси водорода в воду и кислород. Известно, что это почти идеальный фермент, поскольку каталитическая эффективность настолько велика, что считается, что практически каждый раз, когда молекула субстрата сталкивается с ферментом, происходит реакция!
Как работает ферментативный катализ? Рассмотрим простой механизм реакции, когда субстрат S реагирует с образованием продукта P
S → P
В присутствии фермента-катализатора E реакция протекает в два этапа.На первом этапе субстрат связывается с активным центром фермента, образуя комплекс фермент-субстрат, ESE + S → ES
Скорость, с которой образуется ES, будет , ограниченная диффузией, , ограниченная временем, необходимым для беспорядочно диффундирующего фермента и субстрата, чтобы найти друг друга в растворе.На втором этапе субстрат реагирует с образованием продукта, а фермент и продукт разделяются.
ES → E + P
В общей сложности реакция превращает субстрат в продукт.Комплекс фермент-субстрат является промежуточным продуктом, а сам фермент является реагентом и продуктом, не измененным общей реакцией.Мы объединили перекись водорода с дрожжами, чтобы наблюдать драматический эффект каталазы на разложение перекиси водорода, приводящий к образованию значительного количества газообразного кислорода, который задерживается в поднимающейся пене из дрожжей и раствора.
Чтобы фермент мог эффективно катализировать реакцию, энергия активации реакции в присутствии фермента ES → EP должна быть на меньше, чем на , чем энергия активации реакции в отсутствие фермента, S → P.Как фермент снижает энергию активации реакции?
Именно Линус Полинг первым понял механизм катализа на молекулярном уровне. В 1946 году он писал, что «единственная разумная картина каталитической активности ферментов — это та, которая включает активную область поверхности фермента, которая по структуре тесно комплементарна не самой молекуле субстрата в ее нормальной конфигурации, а скорее к молекуле субстрата. молекула субстрата в напряженной конформации, соответствующей активированному комплексу.«То есть фермент действует, избирательно связывая структуру переходного состояния субстрата лучше, чем он связывает реагент в его ненапряженной конформации реагента. При этом фермент снижает энергию активации реакции и увеличивает скорость реакции.
Еще одно важное изобретение, рожденное работой Полинга по катализу, — это концепция каталитических антител . В 1969 году Уильям Дженкс предположил, что «если комплементарность между активным сайтом и переходным состоянием вносит значительный вклад в ферментативный катализ, можно будет синтезировать фермент, сконструировав такой активный сайт.Один из способов сделать это — приготовить антитело к гаптеновой группе, которое напоминает переходное состояние данной реакции. Сайты объединения таких антител должны быть комплементарны переходному состоянию и должны вызывать ускорение, заставляя связанные субстраты напоминать переходное состояние ». Эта способность создавать каталитические антитела была экспериментально продемонстрирована в лабораториях Питера Шульца и Ричарда Лернера. домыслы Полинга и Дженкса стали реальностью.
Скорость катализа зависит от формы катализатора
Вопрос: Разложение перекиси водорода катализируется добавлением перманганата калия. Наблюдается, что скорость реакции значительно увеличивается при добавлении водного раствора перманганата в отличие от добавления кристаллов перманганата. Объясните это наблюдение.Вы можете проверить свои ответы здесь.
Повышение скорости реакции
Вопрос: Было обнаружено, что химическая реакция, изучаемая при температуре 38 ° C, имеет скорость, которая увеличивается в 400000000 раз по сравнению с некаталитической реакцией.По мнению Полинга, катализатор действует путем снижения энергии активированного комплекса или переходного состояния по сравнению с состоянием реагента. Предположим, что увеличение скорости полностью связано с понижением энергии активационного комплекса. Что такое изменение энергии активации из-за стабилизации переходного состояния ферментом?Вы можете проверить свои ответы здесь.
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
.

 Г. Весело и просто о сложном и простом. — Братск, 2008.
Г. Весело и просто о сложном и простом. — Братск, 2008. Их можно приобрести в аптеке Boots.
Их можно приобрести в аптеке Boots.