Химия. Практическая работа по теме «Получение и свойства соединений металлов»
Данный документ содержит описание практической работы в виде таблице. Оформление индивидуально. В таблице красным цветом дан ответ. При подготовке таблицы необходимо содержимое двух колонок не выводить на печать. учащиеся сами должны заполнить данные колонки.
Просмотр содержимого документа
«Химия. Практическая работа по теме «Получение и свойства соединений металлов»»
Практическая работа №2
Тема: Получение и свойства соединений металлов.
Инструктаж по Т.Б.
Цель работы: повторить основные вопросы химии металлов. На практике закрепить знания об основных свойствах металлов, качественные реакции по металлам.
Оборудование: наборы химических реактивов и оборудование к практической работе
Что делали | Что наблюдали | Уравнение реакции |
1. 1)В пробирку с раствором хлорида алюминия добавим по каплям раствор щелочи
2) В другую пробирку с раствором щелочи добавим раствор хлорида алюминия.
Только, после добавления избытка А1С13 выпадет осадок А1(ОН)3. 3)Докажем амфотерный характер А1(ОН)3. Для этого, полученный осадок А1(ОН)3 разделим на 2 пробирки. В одну из пробирок добавим раствор любой сильной кислоты, в другую — раствор щелочи (избыток).
| Наблюдаем образование белого осадка гидроксида алюминия.
В данном случае, щелочь присутствует в избытке, поэтому А1(ОН)3 в начале не образуется, идет образование алюмината натрия
В обоих случаях наблюдаем растворение осадка гидроксида алюминия; Гидроксид алюминия растворяется, как в кислотах, так и в щелочах, поэтому он амфотерен | А1С13 + 3NaOH(недостаток) = 3NaCl + Al(OH)3↓ Al3+ + 3Сl— + 3Na+ + 3ОН— = А1(ОН)3↓ + 3Na+ + 3Сl— А13+ + 3ОН— = Al(OH)3↓
А1С13 + 4NaOH(избыток) = NaA1О2 + 3NaCl + 2Н2О А13+ + 3Сl— + 4Na+ + 40Н— = Na++А1О2—+ 3Na+ + 3Сl—+ 2Н2О А13+ + 4ОН— = А1О2— + 2Н2О
А1(ОН)3 + 3НС1 = А1С13 + 3Н2О А1(ОН)3 +3Н++3Сl— = А13+ +3Сl—+ 3Н2О А1(ОН)
А1(ОН)3 +NaOH = NaA1О2 + 2Н2О А1(ОН)3 + Na++ОН— = Na+ +А102— +2Н2О А1(ОН)3 + ОН— = А1О2— + 2Н2О |
2. Для этого раствор СаС12 разольем на 2 пробирки. В одну из них добавим раствор карбоната натрия,
В другую пробирку прильем раствор нитрата серебра
|
Наблюдаем выделение белого осадка карбоната кальция СаСО3
Наблюдаем выделение белого творожистого осадка.
|
Na2CО3 + СаС12 = CaCО3↓ + 2NaCl 2Na+ + СО32- + Са2+ + 2Сl— = СаСО3↓ + Na+ + 2Сl— Са2+ + СО32- = CaCО3↓ СаС12 + 2AgNО3 = Ca(NО3)2 + 2AgCl↓ Са2+ + 2Сl— +2Ag+ + 2NО3— = Ca2++ 2NО3— + 2AgCl↓ Сl— +Ag+ = AgCl↓ |
3. В пробирку с железными опилками добавим раствор соляной кислоты.
Качественная реакция на ион железа (II):
Качественные реакции на ион железа (III): а) Прильем к пробирке раствор желтой кровяной соли:
|
Наблюдаем растворение железа и выделение газообразного водорода
Наблюдаем, образование темно-синего осадка, следовательно, ионы Fe2+ получены.
Наблюдаем, образование темно-синего осадка берлинской лазури, значит, в растворе присутствуют ионы железа (III). |
Fe0 + 2Н+С1 = Fe2+Cl2 + Н20↑ Fe0— 2е = Fe2+ 2 1 восстановитель2Н+ +2е = Н20 2 1 окислитель
K3[Fe+3(CN)6] + Fe+2C12 = 2КС1 + KFe+3[Fe+2(CN)6] красная кровяная соль 3К++[Fe(CN)6]3-+Fe2+ +2Сl— =KFe [Fe(CN)6]↓+2K++ 3Сl— K+ + Fe2+ + [Fe(CN)6]3— = KFe [Fe(CN)6]↓
K4[Fe+2(CN)6] + Fe+3C13 = 3KCI + KFe+3lFe+2(CN)6]↓ желтая кровяная соль берлинская лазурь 4К+ + Fe3++3Сl— +[Fe(CN)6]4-=KFe [Fe(CN)6]↓+3K+ + 3Сl— К+ + Fe3+ + [Fe(CN)6]4- = KFe [Fe(CN)6]↓ |
Необходимо получить FeSO В пробирку с железными опилками прильем разбавленный раствор серной кислоты.
В пробирку с раствором медного купороса добавим железо.
|
Наблюдаем растворение железа и выделение водорода В результате реакции образуется сульфат железа.
Наблюдаем, изменение окраски раствора, из голубого раствор становится светло-зеленым, который быстро желтеет и мутнеет. В результате реакции выделяется красная медь. | Fe° + H2+‘S04 -» Fe+2S04 + H2°↑
Cu2+SO4 + Fe° = Fe+2SO4 + Cu0↓ Голубой светло-зеленый красный Fe° -2е= Fe2+ восстановитель |
4. Для получения FeSО4 осуществим следующие превращения: FeCl2→ Fe(OH)2 → FeSО4 К раствору хлорида железа прильем раствор щелочи:
К полученному, в предыдущем опыте осадку Fe(OH)2 добавим раствор серной кислоты |
В результате реакции образуется осадок гидроксида железа (II) белого цвета.
|
FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓ Fe2+ + 2Сl— + 2Na+ + 2ОH— = 2Na+ + 2Сl— + Fe(OH)2↓ Fe2+ + 2ОH—
Fe(OH)2 + H2SО4 = FeSО4 + 2Н2О Fe(OH)2 + 2Н+ + SО42- = Fe2+ + SО42- + 2H2О Fe(OH)2 + 2H+ = Fe2+ + 2H2О |
5. Для доказательства качественного состава FeSО4 разольем раствор сульфата железа в 2 пробирки. В одну из них добавим раствор красной кровяной соли:
В другую пробирку, добавим раствор хлорида бария:
|
Наблюдаем, образование темно-синего осадка, значит, в растворе присутствуют ионы железа — Fe2+.
Наблюдаем, выделение белого осадка сульфата бария BaSО4, значит, в растворе присутствуют сульфат-ионы SО 42-.
|
K3[Fe+3(CN)6] + FeS04 = K2S04 + KFe [Fe(CN)6]↓ красная кровяная соль
FeSO4 + ВаС12 = FeCl2 + BaS04↓ Fe2+ + SO42- + Ba2+ + 2Сl— = Fe2+ + 2Сl— + BaSO4↓ Ba2+ + SO42- = BaSO4↓
|
Вывод: ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата :________________
Фамилия, имя:________________________________________________________________
Класс:_______
Практическая работа № 2 «Получение и свойства соединений металлов», химия 9 класс
План-конспект урока химии 9 класс.
Тема: Практическая работа №2 Получение и свойства соединений металлов
Место урока: 9 класс. Тема II. Металлы
Тип урока: практическая работа
Цель работы: Образовательные:
— получение соединений металлов экспериментальным путем;
-применение теоретических знаний в решении экспериментальных задач;
— совершенствование навыков проведения реакций ионного обмена;
— повторить свойства и некоторые способы получения основных классов химических веществ;
Развивающие – способствовать развитию логического мышления, развитию наблюдательности, умения объяснять, анализировать, сопоставлять, проводить химический эксперимент;
Воспитательная – воспитание интереса к предмету.
Оборудование: приборы-пробирки, держатель для пробирок, мерная ложка, стеклянная палочка, спиртовка.
Материалы -хлорид алюминия, гидроксид
натрия, хлорид кальция, карбонат натрия, нитрат серебра, железные стружки,
соляная кислота, серная кислота, хлорид железа (III), сульфат
меди, сульфат натрия.
Ход урока
1.Организационный момент.
2.Актулизация знаний
Сегодня у нас необычный урок — практическая работа. В математике действует правило: От перестановки мест слагаемых сумма не меняется. Как вы думаете, действует ли это правило в химии?
II. Постановка целей и задач урока . Мотивация учебной деятельности.
Какова тема практической работы?
Чем мы будем заниматься на уроке? Сформулируйте цель практической работы. ( Рассмотреть свойства соединений металлов и выяснить действует ли в химии математическое правило)
III. Формирование навыков на основе применения их в стандартных условиях.
Откроем учебники и посмотрим, какие опыты мы будем проводить ( изучение инструкции проведения опытов).
Определяя план действий.
Какая перед нами стоит задача?
Какие необходимы приборы и материалы для проведения опытов?
Какие правила техники безопасности мы должны соблюдать при выполнении работы?
IV. Формирование дифференцированных обобщенных умений.
Формирование дифференцированных обобщенных умений.
Под руководством учителя формулируют тему и цель практической работы ( на основании инструкции) и записывают в тетради.
V. Анализ задачи.
Учащиеся получают таблицы для записей наблюдений:
При проведении практической работы мы должны заполнить таблицу
Действия (названия опытов, выполняемые операции) | Наблюдения | Уравнения химических реакций, условия реакций | Объяснения наблюдаемых явлений. Выводы. |
Опыт № 1 «Получение гидроксида алюминия» | |||
Используя одинаковые объемы исходных веществ:
сначала к раствору одного из исходных веществ (реагенту) прибавляли по каплям
раствор другого реагента, затем поменяли последовательность введения и
реакцию реагентов.
|
|
|
|
Опыт № 2 «Подтверждение качественного состава хлорида кальция» | |||
Провели реакции, подтверждающие качественный состав хлорида кальция
А) В пробирку с раствором CaCL2 добавили несколько капель раствора Na2CO3
Б) В пробирку с раствором CaCL2 добавили несколько капель раствора AgNO3 |
|
|
|
Опыт № 3 «Осуществление цепочки превращений » | |||
Осуществили превращения согласно следующей схеме Fe—> FeCl2—>Fe(ОН)2.
А) к железным стружкам прибавили раствор HCL
Б)к раствору FeCL3 прибавили раствор NaOH
|
|
|
|
Опыт № 4 «Получение сульфата железа »
| |||
А) к раствору Fe(OH)3 прилили раствор H2SO4
Б) к железным опилкам прилили раствор H2SO4
В) к раствору CuSO4 добавили железные опилки.
Г) к железным опилкам добавили раствор Na2SO4 |
|
|
|
VI. Выполнение практической работы
Выполнение практической работы
Задание 1 В химии данное правило не справедливо. Результат реакции часто определяется порядком сливания реагентов и их соотношением. Докажем это.
1) В пробирку с раствором хлорида алюминия добавим по каплям раствор щелочи:
А1С13 + 3NaOH(недостаток) = 3NaCl + Al(OH)3↓
Al3+ + 3Сl— + 3Na+ + 3ОН— = А1(ОН)3↓ + 3Na+ + 3Сl—
А13+ + 3ОН— = Al(OH)3↓
Наблюдаем образование белого осадка гидроксида алюминия.
2) В другую пробирку с раствором щелочи добавим раствор
хлорида алюминия. В данном случае, щелочь присутствует в избытке, поэтому А1(ОН)3 в начале не образуется, идет образование алюмината натрия:
А1С13 + 4NaOH(избыток) = NaA1О2 + 3NaCl + 2Н2О
А13+ + 3Сl— + 4Na+ + 40Н— = Na+ + А1О2— + 3Na+ + 3Сl— + 2Н2О
А13+ + 4ОН— = А1О2— + 2Н2О
Только, после добавления избытка А1С13 выпадет осадок А1(ОН)3.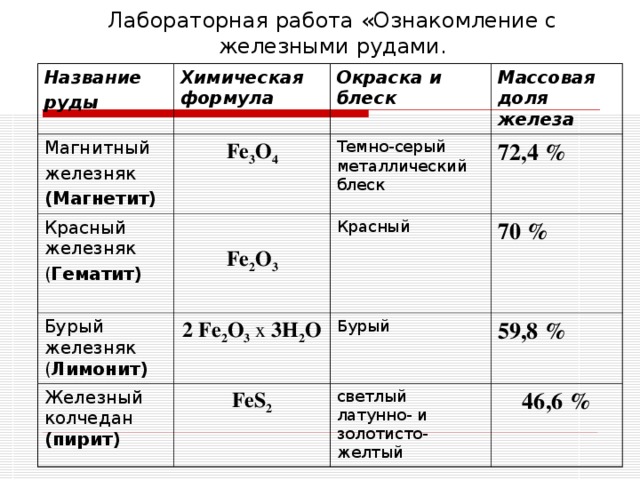
3) Докажем амфотерный характер А1(ОН)3. Для этого, полученный осадок А1(ОН)3 разделим на 2 пробирки. В одну из пробирок добавим раствор любой сильной кислоты, в другую — раствор щелочи (избыток). В обоих случаях наблюдаем растворение осадка гидроксида алюминия:
А1(ОН)3 + 3НС1 = А1С13 + 3Н2О
А1(ОН)3 + 3Н+ + 3Сl— = А13+ + 3Сl— + 3Н2О
А1(ОН)3 + 3Н+ = А13+ + 3Н2О
А1(ОН)3 +NaOH = NaA1О2 + 2Н2О
А1(ОН)3 + Na+ + ОН— = Na+ +А102— + 2Н2О
А1(ОН)3 + ОН— = А1О2— + 2Н2О
Таким образом, гидроксид алюминия растворяется, как в кислотах, так и в щелочах, поэтому он амфотерен.
Задание 2
Для доказательства качественного состава СаС12 проведем реакции, характерные для катиона кальция и хлорид-аниона. Для этого
раствор СаС12 разольем на 2 пробирки.
Для этого
раствор СаС12 разольем на 2 пробирки.
В одну из них добавим раствор карбоната натрия:
Na2CО3 + СаС12 = CaCО3↓ + 2NaCl
2Na+ + СО32- + Са2+ + 2Сl— = СаСО3↓ + Na+ + 2Сl—
Са2+ + СО32- = CaCО3↓
Наблюдаем выделение белого осадка карбоната кальция СаСО3
В другую пробирку прильем раствор нитрата серебра
СаС12 + 2AgNО3 = Ca(NО3)2 + 2AgCl↓
Са2+ + 2Сl— +2Ag+ + 2NО3— = Ca2++ 2NО3— + 2AgCl↓
Сl— +Ag+ = AgCl↓
Наблюдаем выделение белого творожистого осадка.
Задание 3
Необходимо осуществить следующие превращения:
Fe → FeCI2 → FeCl3
В пробирку с железными опилками добавим раствор соляной кислоты. Наблюдаем растворение железа и выделение газообразного водорода:
Наблюдаем растворение железа и выделение газообразного водорода:
Fe0 + 2Н+С1 = Fe2+Cl2 + Н20↑
Fe0— 2е = Fe2+ 2 1 восстановитель
2Н+ +2е = Н20 2 1 окислитель
Докажем наличие ионов железа (II). Для этого, добавим в пробирку раствор красной кровяной соли:
Качественная реакция на ион железа (II):
K3[Fe+3(CN)6] + Fe+2C12 = 2КС1 + KFe+3[Fe+2(CN)6]
красная кровяная соль турнбулева синь
3К+ + Fe2+ + 2Сl— + [Fe(CN)6]3- = KFe [Fe(CN)6]↓ + 2K+ + 3Сl—
K+ + Fe2+ + [Fe(CN)6]3— = KFe [Fe(CN)6]↓
Наблюдаем, образование темно-синего осадка турнбулевой сини, следовательно,
ионы Fe2+ получены.
Для осуществления второго превращения используем хлорную воду, которая представляет собой раствор хлора в воде, т. е. является реагентом С12.
2Fe2+Cl2 + С120 = 2Fe3+Cl3
Fe2+ -le= Fe3+ 2 восстановитель
Cl2° +2e = 2Сl— 1 окислитель
2Fe2+ +CI2° = 2Fe3+ + 2Сl—
Цвет раствора изменяется.
Докажем наличие ионов железа (III). Для этого можно провести одну из предлагаемых реакций:
Качественные реакции на ион железа (III):
а) Прильем к пробирке раствор желтой кровяной соли:
K4[Fe+2(CN)6] + Fe+3C13 = 3KCI + KFe+3lFe+2(CN)6]↓
желтая кровяная соль берлинская лазурь
4К+ + Fe3+ + 3Сl— + [Fe(CN)6]4- = KFe [Fe(CN)6]↓ + 3K+ + 3Сl—
К+ + Fe3+ + [Fe(CN)6]4- = KFe [Fe(CN)6]↓
Наблюдаем, образование темно-синего осадка берлинской лазури,
значит, в растворе присутствуют ионы железа (III).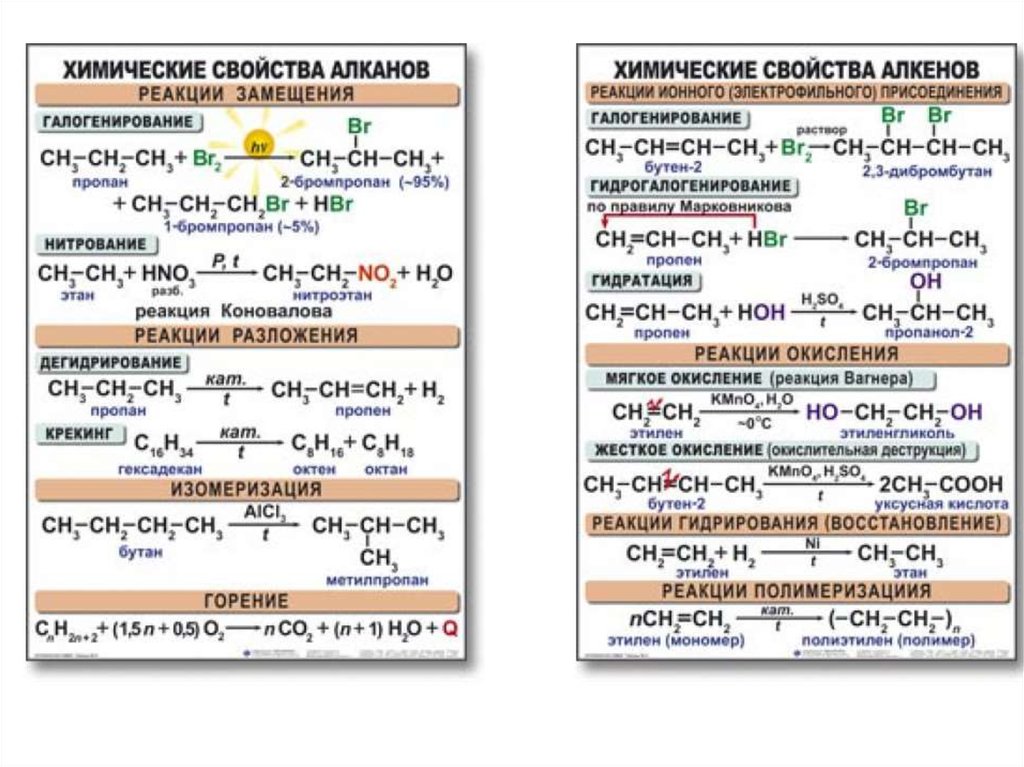
б) Добавим в пробирку с раствором FеС13 роданид аммония или натрия: Fe+3CI3 + NaNCS = [FeNCS]Cl2 + NaCI
роданид натрия
Fe3+ + NCS— = FeNCS2+
Задание 4
Необходимо получить FeSO4 тремя различными способами:
В пробирку с железными опилками прильем разбавленный раствор серной кислоты. Наблюдаем растворение железа и выделение водорода:
Fe° + H2+‘S04 -» Fe+2S04 + H2°↑
Fe° — 2e = Fe2+ 1 восстановитель
2H+ +2e = H2° 1 окислитель
В результате реакции образуется сульфат железа.
В пробирку с раствором медного купороса добавим железо. Наблюдаем, изменение окраски раствора, из голубого раствор становится светло-зеленым, который быстро желтеет и мутнеет. В результате реакции выделяется красная медь.
Cu2+SO4 + Fe° = Fe+2SO4 + Cu0↓
Голубой светло-зеленый красный
Fe° -2е= Fe2+ 1 восстановитель
Cu2+ +2е = Cu° 1 окислитель
Для получения FeSО4 осуществим следующие превращения: FeCl2→ Fe(OH)2 → FeSО4
К раствору хлорида железа прильем раствор щелочи:
FeCl2 + 2NaOH = 2NaCl + Fe(OH)2↓
Fe2+ + 2Сl— + 2Na+ + 2ОH— = 2Na+ + 2Сl— + Fe(OH)2↓
Fe2+ + 2ОH— = Fe(ОH)2↓
В результате реакции образуется осадок гидроксида железа (II)
белого цвета.
К полученному, в предыдущем опыте осадку Fe(OH)2 добавим раствор серной кислоты:
Fe(OH)2 + H2SО4 = FeSО4 + 2Н2О
Fe(OH)2 + 2Н+ + SО42— = Fe2+ + SО42- + 2H2О
Fe(OH)2 + 2H+ = Fe2+ + 2H2О
Задание 5
Для доказательства качественного состава FeSО4 разольем раствор сульфата железа в 2 пробирки. В одну из них добавим раствор красной кровяной соли:
K3[Fe+3(CN)6] + FeS04 = K2S04 + KFe [Fe(CN)6]↓
красная кровяная соль турнбулева синь
Наблюдаем, образование темно-синего осадка турнбулевой сини, значит, в растворе присутствуют ионы железа — Fe2+.
В другую пробирку, добавим раствор хлорида бария:
FeSO4 + ВаС12 = FeCl2 + BaS04↓
Fe2+ + SO42- + Ba2+ + 2Сl- = Fe2+ + 2Сl- + BaSO4↓
Ba2+ + SO42- = BaSO4↓
Наблюдаем, выделение белого осадка сульфата бария BaSО4,
значит, в растворе присутствуют сульфат-ионы SО42-.
VII. Самоконтроль выполнения работы.
Обучающиеся заполняют таблицу и делают выводы по каждому опыту
VIII. Итоги урока. Рефлексия.
Математическое правило От перестановки мест слагаемых сумма не меняется в химии не действует. Иногда итог реакции зависит от порядка сливания растворов, как в случае с хлоридом алюминия и гидроксида натрия.
IX. Домашнее задание: закончить оформление практической работы в тетради
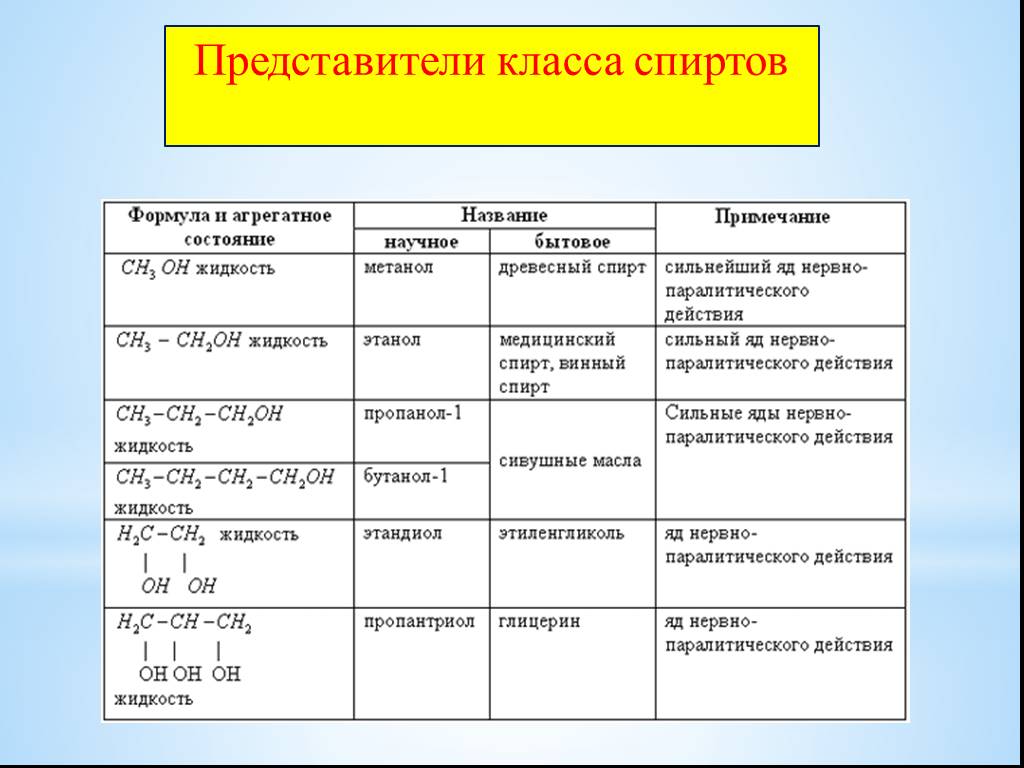
Свойства металлов Научный урок
Для большинства людей металл — это другое слово, обозначающее железо, сталь или подобное твердое блестящее вещество.
Но соответствует ли это определение истинным свойствам металлов?
Да… и нет.
Прежде чем мы объясним, вы должны знать, что большинство элементов в таблице Менделеева — это металлы.
Металлы находятся в центре и слева в таблице Менделеева. Их можно дополнительно классифицировать как щелочные металлы, щелочноземельные металлы, переходные металлы и основные металлы.
Урок науки о металлах
Свойства металлов
Элемент — это вещество, состоящее из одного вида атомов; его нельзя разделить на более простые части. Например, элемент гелий (вспомните воздушные шары) состоит исключительно из атомов гелия.
Элементы обычно классифицируются как металлы или неметаллы (хотя некоторые элементы имеют характеристики обоих; они называются металлоиды ).
Три свойства металлов:
- Блеск: Металлы блестят при резке, царапании или полировке.
- Пластичность: Металлы прочные, но податливые, что означает, что их можно легко согнуть или придать им форму. На протяжении веков кузнецы могли придавать металлическим предметам форму, нагревая металл и отбивая его молотком. Если бы они попытались сделать это с неметаллами, материал бы раскололся! Большинство металлов также пластичны , что означает, что их можно вытягивать для изготовления проволоки.

- Проводимость: Металлы являются отличными проводниками электричества и тепла. Поскольку они также пластичны, они идеально подходят для электропроводки. (Вы можете проверить это с помощью некоторых предметов домашнего обихода. Продолжайте читать, чтобы узнать, как!)
Дополнительные свойства металлов
Высокая температура плавления : Большинство металлов имеют высокие температуры плавления, и все, кроме ртути, твердые при комнатной температуре.
Звонкий : Металлы часто издают звенящий звук при ударе.
Реактивность : Некоторые металлы претерпевают химическое изменение (реакцию) сами по себе или с другими элементами и выделяют энергию. Эти металлы никогда не встречаются в чистом виде, и их трудно отделить от минералов, в которых они находятся. Наиболее реакционноспособными металлами являются калий и натрий. Они бурно реагируют с воздухом и водой; калий воспламеняется при контакте с водой!
Другие металлы вообще не реагируют с другими металлами. Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и электропроводки.
Это означает, что их можно найти в чистом виде (например, золото и платина). Поскольку медь относительно недорога и имеет низкую реакционную способность, ее можно использовать для изготовления труб и электропроводки.
Пять групп металлов:
Благородные металлы встречаются в виде чистых металлов, потому что они нереакционноспособны и не соединяются с другими элементами с образованием соединений. Поскольку они настолько нереактивны, они не подвержены коррозии. Это делает их идеальными для ювелирных изделий и монет. Благородные металлы включают медь, палладий, серебро, платину и золото.
Щелочные металлы очень реакционноспособны. Они имеют низкую температуру плавления и достаточно мягкие, чтобы их можно было резать ножом. Калий и натрий — два щелочных металла.
Щелочноземельные металлы встречаются в соединениях со многими различными минералами. Они менее реакционноспособны, чем щелочные металлы, а также тверже и имеют более высокие температуры плавления.
В эту группу входят кальций, магний и барий.
Переходные металлы — это то, о чем мы обычно думаем, когда думаем о металлах. Они твердые и блестящие, прочные и легко поддаются формовке. Они используются во многих промышленных целях. В эту группу входят железо, золото, серебро, хром, никель и медь, некоторые из которых также являются благородными металлами.
Бедные металлы довольно мягкие, и большинство из них не используются сами по себе. Однако они становятся очень полезными при добавлении к другим веществам. К бедным металлам относятся алюминий, галлий, олово, таллий, сурьма и висмут.
Сплавы: сильные комбинации
Свойства этих различных металлов можно комбинировать, смешивая два или более из них вместе. Полученное вещество называется сплавом . Некоторые из наших самых полезных строительных материалов на самом деле являются сплавами. Сталь, например, представляет собой смесь железа и небольшого количества углерода и других элементов; комбинация, которая одновременно сильна и проста в использовании. (Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!)
(Добавьте хром, и вы получите нержавеющую сталь. Проверьте свои кухонные кастрюли и сковородки, чтобы узнать, сколько из них сделано из нержавеющей стали!)
Другие сплавы, такие как латунь (медь и цинк) и бронза (медь и олово), легко поддаются обработке и выглядят красиво. Бронза также часто используется в судостроении, потому что она устойчива к коррозии в морской воде.
Титан намного легче и менее плотный, чем сталь, но такой же прочный; и хотя он тяжелее алюминия, он вдвое прочнее. Он также очень устойчив к коррозии. Все эти факторы делают его отличным сплавом. Титановые сплавы используются в самолетах, кораблях и космических кораблях, а также в красках, велосипедах и даже портативных компьютерах!
Золото как чистый металл настолько мягкое, что его всегда смешивают с другим металлом (обычно серебром, медью или цинком), когда из него делают украшения. Чистота золота измеряется в карат. Самое чистое, что вы можете получить в ювелирных изделиях, составляет 24 карата, что составляет около 99,7% чистого золота.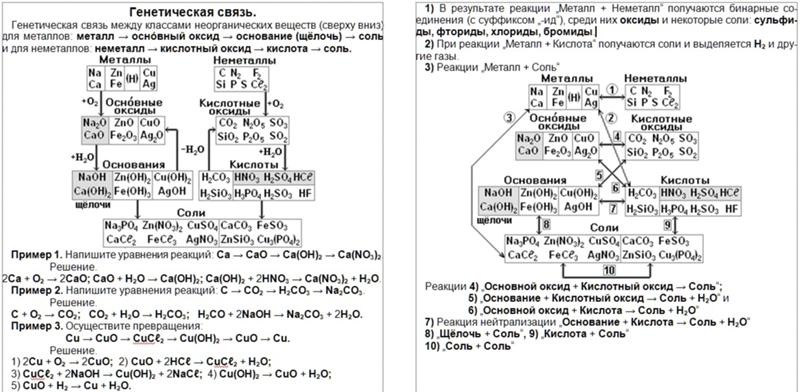 Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Золото также можно смешивать с другими металлами, чтобы изменить его цвет; белое золото, популярное в ювелирных изделиях, представляет собой сплав золота и платины или палладия.
Металл из руды
Руды – это горные породы или минералы, из которых можно извлечь ценное вещество – обычно металл. Некоторые распространенные руды включают галенит (свинцовая руда), борнит и малахит (медь), киноварь (ртуть) и бокситы (алюминий). Наиболее распространенными железными рудами являются магнетит и гематит (минерал ржавого цвета, образованный железом и кислородом), которые содержат около 70% железа.
Существует несколько процессов переработки железа из руды. Более старый процесс заключается в сжигании железной руды с использованием древесного угля (углерода) и кислорода, подаваемого с помощью мехов. Углерод и кислород, включая кислород в руде, соединяются и выходят из железа. Однако железо не нагревается настолько, чтобы полностью расплавиться, и содержит силикаты, оставшиеся от руды. Его можно нагреть и выковать, чтобы сформировать кованое железо .
Его можно нагреть и выковать, чтобы сформировать кованое железо .
В более современном процессе используется доменная печь для нагрева железной руды, известняка и кокса (угольный продукт, а не безалкогольный напиток). В результате реакции железо отделяется от кислорода в руде. Этот «чугун» необходимо дополнительно смешать для создания кованого железа. Его также можно использовать для другой важной цели: при нагревании с углеродом и другими элементами он становится более прочным металлом, называемым сталью .
Принимая во внимание процесс, неудивительно, что железо не использовалось примерно до 1500 г. до н.э. Но некоторые чистые металлы — золото, серебро и медь — использовались и раньше, а сплав бронзы, как полагают, был открыт шумерами около 3500 г. до н.э. Но алюминий, один из самых важных металлов в современном использовании, не был открыт до 1825 года нашей эры и не использовался до 20-го века!
Коррозия: обработка и предотвращение
Видели ли вы когда-нибудь кусок серебра, который потерял свой блеск, или железо с красноватой ржавчиной на нем или даже отверстия в нем, вызванные коррозией? Это происходит, когда кислород (обычно из воздуха) реагирует с металлом. Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такому химическому разрушению или коррозии .
Металлы с более высокой реакционной способностью (такие как магний, алюминий, железо, цинк и олово) гораздо более склонны к такому химическому разрушению или коррозии .
Когда кислород реагирует с металлом, он образует оксид на поверхности металла. Для некоторых металлов, таких как алюминий, это хорошо. Оксид обеспечивает защитный слой, который предотвращает дальнейшую коррозию металла.
Железо и сталь, с другой стороны, имеют серьезные проблемы, если они не обработаны для предотвращения коррозии. Красноватый оксидный слой, который образуется на железе или стали при взаимодействии с кислородом, называется ржавчиной . Слой ржавчины постоянно отслаивается, подвергая коррозию большую часть металла, пока металл не будет проеден насквозь.
Одним из распространенных способов защиты железа является покрытие его специальной краской, которая предотвращает реакцию кислорода с металлом под краской. Другим методом является гальванизация : в этом процессе сталь покрывается цинком. Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии. Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины.
Кислород, молекулы воды и углекислый газ в воздухе реагируют с цинком, образуя слой карбоната цинка, защищающий от коррозии. Осмотрите свой дом, двор и гараж на предмет коррозии, а также оцинковки и других средств защиты металла от ржавчины.
Технология: фейерверк и химия
Если вы посмотрите фейерверк на Четвертое июля, вы увидите красивые сочетания цветов и искр.
Как работает этот удивительный пиротехнический дисплей? Короткий ответ: химия. Более длинный включает в себя повторение свойств металлов.
Одним из ключевых ингредиентов петард, наземных и воздушных фейерверков (которые взрываются в небе) является черный порох , изобретенный китайцами около 1000 лет назад. Это смесь нитрата калия (селитры), древесного угля и серы в соотношении 75:15:10. Черный порох используется для запуска антенн, а также вызывает взрывы, необходимые для создания специальных эффектов, таких как шум или цветной свет.
В бенгальских огнях черный порох смешивается с металлическим порошком и другими химическими соединениями в форме, которая будет медленно гореть сверху донизу. В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе.
В простых ракетах для фейерверков черный порох находится в трубке вокруг взрывателя. Когда горит, порох создает силу, которая приводит к равной и противоположной реакции, отталкивая фейерверк от земли, а затем вызывая взрыв соединений внутри него в воздухе.
Более сложные снаряды для фейерверков запускаются из миномета, трубки с черным порохом, который при поджигании вызывает реакцию отрыва. Затем взрыватель снаряда фейерверка загорается, когда он поднимается в воздух, и в нужный момент взрыв внутри снаряда приводит к разрыву зарядов спецэффектов.
Яркая, красочная часть фейерверка вызвана «возбужденными» электронами в атомах различных соединений металлов и солей. Эти соединения находятся в маленьких шариках, называемых звездами , и сделаны из того же соединения, что и бенгальский огонь.
Металлы как красители
Различные металлы горят разными цветами; например, если зажечь соединение меди, его пламя будет сине-зеленого цвета. Кальций горит красным, а калий — фиолетовым. В фейерверках металлы объединяются для создания разных цветов.
В фейерверках металлы объединяются для создания разных цветов.
Когда звездные соединения внутри фейерверка нагреваются, возбужденные атомы выделяют световую энергию. Этот свет делится на две категории: накаливания и люминесценции. Лампа накаливания — это свет, создаваемый теплом: в фейерверках химически активные металлы, такие как алюминий и магний, вызывают вспышку очень яркого света, когда они нагреваются — иногда при температуре более 5000 ° F!
Менее реакционноспособные соединения не так сильно нагреваются, что приводит к более тусклым искрам. Люминесценция , с другой стороны, производится из других источников и может возникать даже при низких температурах. Электроны в соединении поглощают энергию, делая их «возбужденными». Однако электроны не могут поддерживать этот высокий уровень, поэтому они прыгают обратно на более низкий уровень, высвобождая при этом световую энергию (фотоны).
Хлорид бария — химическое соединение, придающее фейерверкам люминесцентный зеленый цвет, а хлорид меди — синий.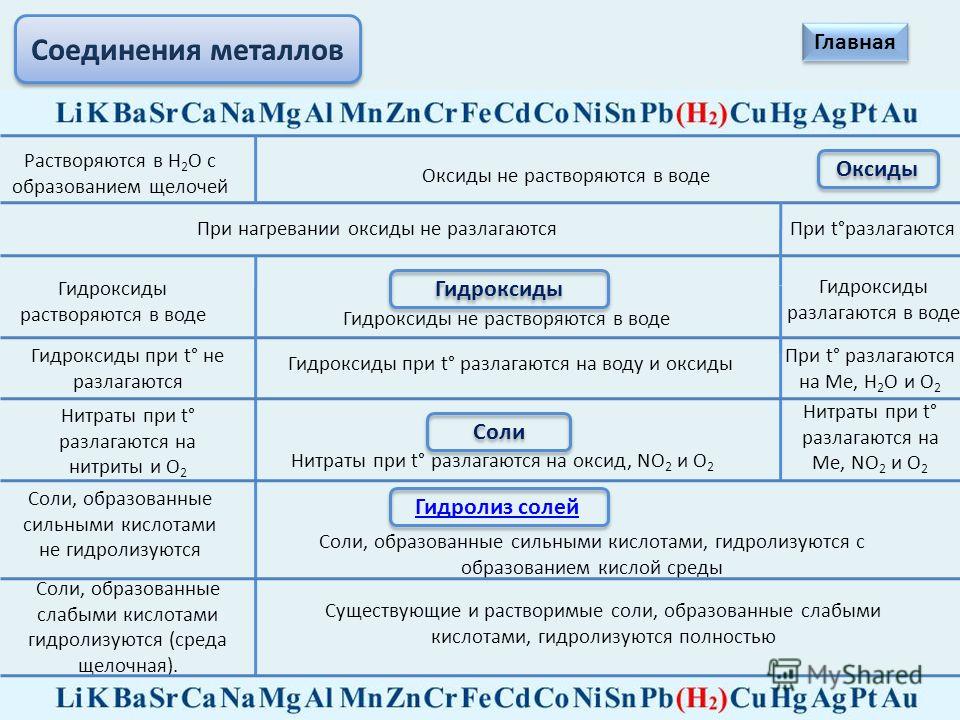 Для любого типа света важно использовать чистые ингредиенты, так как следы других соединений затемняют цвет.
Для любого типа света важно использовать чистые ингредиенты, так как следы других соединений затемняют цвет.
Дополнительная литература по металлам:
- Скульптура с вращающейся проволокой
- Научные проекты по химии
- Научные проекты по физике
- Научные проекты по реакциям металлов с кислотами | Эксперимент
- Защита глаз
- Пробирки, 100 мм x 16 мм или аналогичные, 8 шт.

- Штатив для пробирок
- Пробки или пробки для свободной установки пробирок, 2 шт.
- Горелка Бунзена
- Деревянная шина
- Коническая колба, 100 см 3
- Стакан, 100 см 3
- Мерный цилиндр, 100 см 3
- Стеклянная палочка для перемешивания
- Шпатель
- Воронка для фильтра, диаметр около 65 мм
- Фильтровальная бумага
- Горелка Бунзена
- Штатив
- Треугольная трубка или керамическая сетка (см. примечание 1)
- Термостойкий коврик
- Испарительная чаша, не менее 50 см 3 вместимость
- Чашка для кристаллизации (см. примечание 2)
- Вместо треугольников из глины для поддержки испарительного резервуара можно использовать керамические сетки, но в этом случае испарение займет больше времени.

- Стадии выпаривания и кристаллизации вполне могут быть незавершенными за время, отведенное для Урока 2. В этом случае необходимо отложить чашки для кристаллизации, чтобы кристаллизация происходила медленно. Однако нельзя допускать полного высыхания посуды, так как это портит качество кристаллов. Время от времени проверяя, можно решить, когда сцеживать излишки раствора из каждой чашки, чтобы оставить хорошие кристаллы для изучения учащимися на следующем уроке.
- Разбавленная соляная кислота, 1 М, 25 см 3
- Разбавленная серная кислота, 0,5 М (РАЗДРАЖАЮЩЕЕ СРЕДСТВО), 25 см 3
- Мелкие гранулы, крупные опилки или кусочки фольги из этих металлов в небольших маркированных контейнерах: медь, железо, магний, цинк
- Маленькие гранулы цинка, около 5 г в маркированной упаковке
- Разбавленная серная кислота, 0,5 М (РАЗДРАЖАЮЩЕЕ СРЕДСТВО), 50 см 3
- Прочтите наше стандартное руководство по охране труда и технике безопасности.

- Всегда используйте защитные очки.
- Выбор металлов может варьироваться в зависимости от того, что доступно в виде мелких гранул (до 5 мм), крупных опилок или фольги. Важно то, что в каждой группе есть по крайней мере два металла, которые легко реагируют, и один, который не вступает в реакцию.
- Медь, Cu(s) – см. карточку опасности CLEAPSS HC026.
- Железные опилки, Fe(s) – см. карточку опасности CLEAPSS HC055a.
- Лента из магния, Mg(s) — см. карточку опасности CLEAPSS HC059a. Магниевая стружка ЛЕГКО ОГНЕОПАСНА. Раздача кусочков магниевой ленты должна контролироваться, чтобы учащиеся не взяли несколько кусков и не экспериментировали с их поджиганием позже.
- Цинковые гранулы, Zn(s) — см. карточку опасности CLEAPSS HC107. В то время как другие комбинации металла и кислоты реагируют таким же образом, извлечение соли путем кристаллизации (в Уроке 2) может быть не таким успешным, как использование цинка и серной кислоты.
- Разбавленная соляная кислота, HCl (водн.
 ) — см. карту опасности CLEAPSS HC047a и книгу рецептов CLEAPSS RB043.
) — см. карту опасности CLEAPSS HC047a и книгу рецептов CLEAPSS RB043. - Разбавленная серная кислота, H 2 SO 4 (водн.), (РАЗДРАЖАЮЩАЯ при используемой концентрации) – см. карту опасности CLEAPSS HC098a и книгу рецептов CLEAPSS RB098.
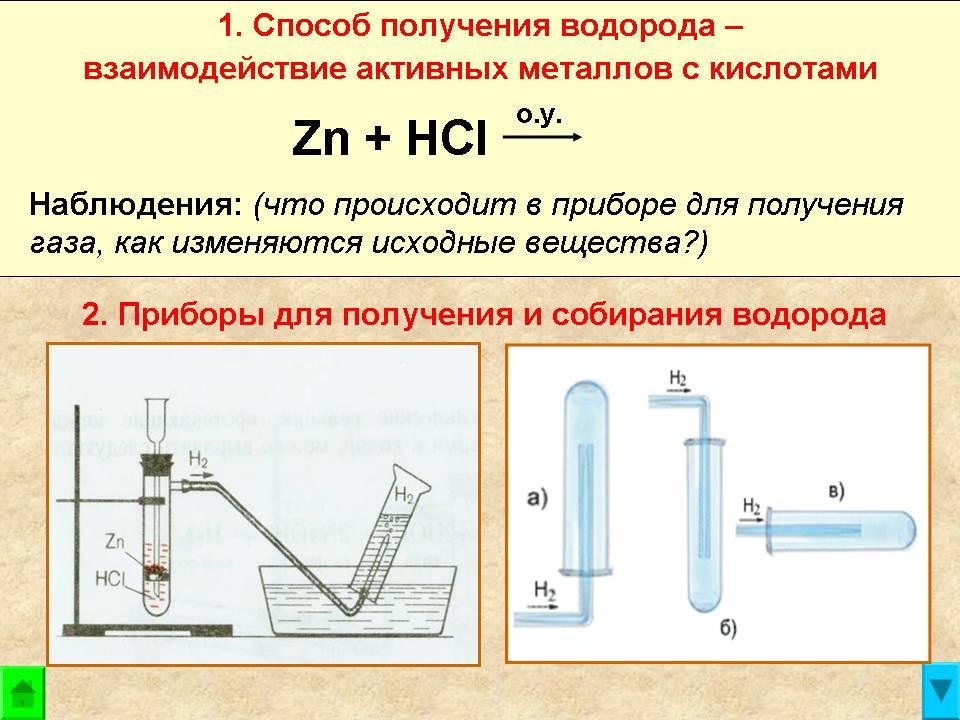
- Поместите шесть пробирок в штатив для пробирок.
- Добавьте в первые три пробирки разбавленную соляную кислоту на глубину 2–3 см, а в оставшиеся три пробирки — на 2–3 см разбавленной серной кислоты.
- Добавьте в каждую из пробирок с соляной кислотой по небольшому кусочку другого металла. Запишите, какой металл вы добавляете в каждую пробирку.
- Добавьте в каждую из пробирок с серной кислотой по небольшому кусочку того же металла. Запишите, какой металл вы добавляете в каждую пробирку.
- Ваш учитель покажет вам, как проверить газ, образующийся в этих реакциях. №
- Выберите один из металлов, быстро реагирующих с кислотами, и в чистую пробирку добавьте кусочек этого металла на глубину 2–3 см в одну из кислот.
 На этот раз неплотно поместите пробку в верхнюю часть пробирки, чтобы образовавшийся газ медленно выходил. Зажгите щепку, удалите пробку и сразу же поднесите пламя к отверстию трубки. Если ничего не происходит, возможно, вам придется повторить попытку.
На этот раз неплотно поместите пробку в верхнюю часть пробирки, чтобы образовавшийся газ медленно выходил. Зажгите щепку, удалите пробку и сразу же поднесите пламя к отверстию трубки. Если ничего не происходит, возможно, вам придется повторить попытку. - Отмерьте 50 см 3 разбавленной серной кислоты с помощью мерного цилиндра и налейте ее в химический стакан. Аккуратно нагрейте эту кислоту на слабом не дымящемся пламени Бунзена. Выключите горелку Бунзена до того, как раствор закипит. Осторожно снимите стакан с кислотой со штатива в соответствии с указаниями учителя и поставьте его на термостойкий коврик. Будьте очень осторожны, чтобы не ударить штатив, когда на нем находится стакан.
- Добавьте в эту горячую кислоту примерно половину предоставленных кусочков цинка. Избегайте вдыхания кислотных паров, которые могут подняться из стакана в результате сильного барботирования.

- Если весь цинк вступит в реакцию, добавьте еще два кусочка и перемешайте стеклянной палочкой. Добавляйте больше цинка, пока не перестанут образовываться пузырьки. Кислота уже израсходована.
- Профильтруйте теплый раствор в коническую колбу, чтобы удалить избыток цинка. Перенесите фильтрат в испарительную ванну.
- Поместите испарительную емкость на треугольник из глины или марлю на штатив и осторожно вскипятите раствор на слабом пламени Бунзена. Будьте очень осторожны, чтобы не ударить штатив, поддерживающий чашу. Когда объем уменьшится примерно наполовину, опустите стеклянную палочку в раствор и дайте ей остыть. Если на стеклянной палочке образуются маленькие кристаллы, прекратите нагревание, в противном случае продолжайте до тех пор, пока не будет достигнута эта точка. Не продолжайте нагревать до тех пор, пока на верхней кромке раствора не начнут появляться кристаллы.
- Вылейте оставшийся горячий раствор в чашу для кристаллизации в соответствии с указаниями учителя.
 Пометьте блюдо и оставьте до следующего занятия кристаллизоваться. Затем кристаллы можно исследовать с помощью ручной линзы или микроскопа.
Пометьте блюдо и оставьте до следующего занятия кристаллизоваться. Затем кристаллы можно исследовать с помощью ручной линзы или микроскопа. - Какие металлы реагируют с соляной кислотой? Как понять, что идет реакция? Нарисуйте в тетради таблицу, чтобы записать все эти наблюдения.
- Какие металлы реагируют с серной кислотой? Как понять, что идет реакция? Расширьте таблицу наблюдений в своем блокноте, чтобы включить их.
- Запишите, какой металл и какую кислоту вы используете, и что произойдет, если зажженную лучину приложить к образующемуся газу.
 Как называется этот газ?
Как называется этот газ? - Какие другие металлы и кислоты выделяют такой же газ? Напишите список проверенных другими группами.
- Ваш учитель может показать вам другие примеры реакции металлов с кислотами. Добавьте их в свою таблицу. Одинаково ли реагирует большинство металлов с кислотами? Объясните свой ответ, обратившись к таблице результатов.
- Заполните это общее уравнение слов в своей тетради: Металл + кислота → +
- Напишите уравнение реакции между цинком и серной кислотой.
- Напишите словесные уравнения реакций i) цинка и соляной кислоты ii) магния и серной кислоты
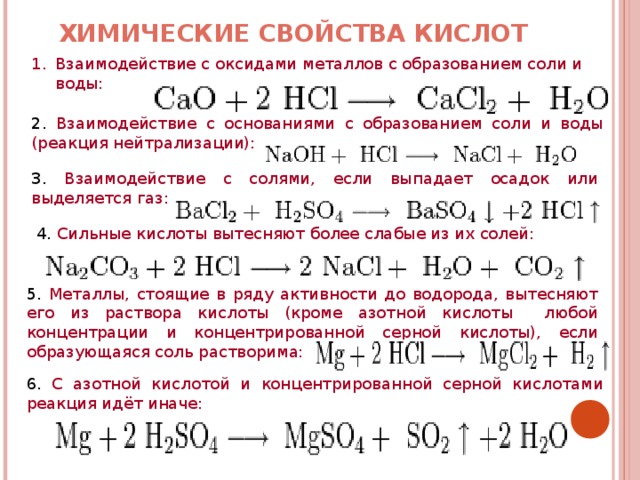
Многие, но не все металлы реагируют с кислотами. Газообразный водород образуется, когда металлы реагируют с кислотой с образованием солей. Этот классовый эксперимент часто используется при вводном изучении кислот, чтобы установить, что такое поведение является характерным свойством 9.0003
Эксперимент проводится сначала в меньшем масштабе с использованием пробирок (урок 1 ниже), без попыток восстановления образовавшихся солей. Это устанавливает, что образование водорода является характерным свойством реакции металлов и кислот. Затем это можно сделать в большем масштабе (урок 2 ниже), а образовавшиеся соли можно восстановить путем кристаллизации.
Урок 1 представляет собой серию экспериментов в пробирке, в которых каждая рабочая группа устанавливает в качестве общего признака выделение водорода при реакции металлов с кислотой – если металл вообще реагирует. Это должно занять около 40 минут, и большинство классов должны справиться с этой версией. Каждой рабочей группе нужен небольшой набор металлов и кислот для тестирования.
Диапазон протестированных металлов и кислот может быть расширен до демонстрации учителем в заключительной части этого урока.
Урок 2, на котором образовавшаяся соль извлекается путем кристаллизации, занимает больше времени, и класс должен быть достаточно надежным в поведении и манипулятивных навыках, чтобы справиться с опасностями, связанными с нагреванием кислых растворов в стаканах на треногах.
Время реакции зависит от размера частиц используемого металла. Использование мелких гранул помогает сократить время приема.
Оборудование
Оборудование
Урок 1
Урок 2
Примечания к аппарату
Химические вещества
Урок 1
Урок 2
Примечания по охране труда и технике безопасности
Процедура
Урок 1Аппарат для извлечения соли, образующейся при реакции цинка и серной кислоты.
Учебные заметки
Используйте раздаточный материал для учащихся, доступный с этим ресурсом, и попросите учащихся ответить на каждый вопрос после наблюдения за реакцией.
Безопасность особенно важна для младших школьников. Помните о проблемах, связанных с нагревом мензурок или выпариванием посуды на штативах, а также с подъемом таких горячих контейнеров со штатива после нагревания. При выполнении этих операций учащиеся не должны сидеть на лабораторных стульях.
Использование щипцов подходящего размера является хорошим способом подъема горячих контейнеров, но в некоторых школах их может не быть. Если есть какие-либо сомнения относительно безопасности этого шага, учитель должен сначала поднять каждую мензурку на термостойкий коврик, используя толстую ткань или надев подходящие теплозащитные перчатки, прежде чем учащиеся добавят кусочки цинка. То же самое относится к перемещению чаши для выпаривания перед заливкой ее содержимого в чашку для кристаллизации.
То же самое относится к перемещению чаши для выпаривания перед заливкой ее содержимого в чашку для кристаллизации.
Процедура безопасного тестирования выделяющегося газообразного водорода в реакциях в пробирке должна быть продемонстрирована в подходящем месте урока 1. Неплотно вставленная пробка обеспечивает достаточное накопление газа при медленной реакции для успешного проведения теста. Тем не менее, многим учащимся трудно провести успешный «взрывной» тест на водород, поэтому вам, возможно, придется провести дополнительные демонстрации.
Эта пара экспериментов является важным этапом для младших школьников в развитии понимания того, что такое кислота. Им нужно понять, как обобщать на достаточном количестве примеров, и видеть пределы этого обобщения в металлах, которые не реагируют. Это может помочь развить это обсуждение на заключительных этапах урока 1 путем дополнительных демонстраций других металлов и кислот. В частности, разбавленная азотная кислота (< 0,5 М) действительно образует водород с умеренно реакционноспособными металлами, такими как магний и цинк, хотя реакции при более высоких концентрациях и с другими металлами различны.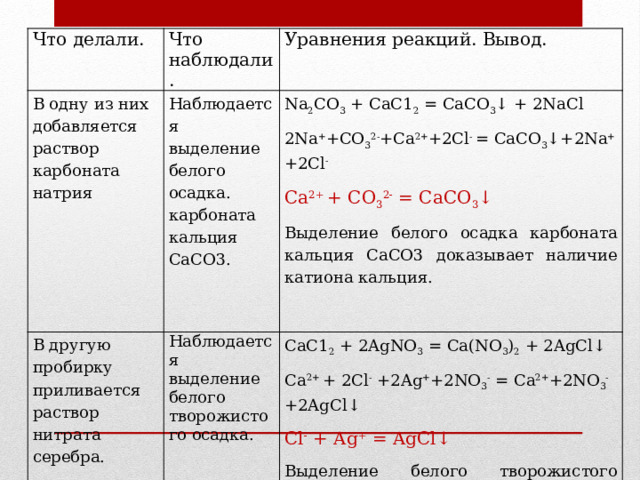 К концу урока учащиеся должны быть в состоянии легко сделать вывод:
К концу урока учащиеся должны быть в состоянии легко сделать вывод:
Металл + кислота → соль + водород
Этот эксперимент также является хорошей возможностью для учащихся научиться составлять подходящие таблицы для записи экспериментальных наблюдений.
На уроке 2 выбор цинка и серной кислоты в качестве примера для получения кристаллов соли обусловлен необходимостью иметь легко кристаллизующуюся соль. К сожалению, хлориды магния и цинка нелегко кристаллизовать, а сульфат магния настолько растворим, что для достаточного испарения требуется больше времени. Соединения железа (II) могут страдать от проблем с окислением при выпаривании раствора, что дает явно нечистый продукт.
Существует возможность образования опасных паров, если классы допускают чрезмерное испарение растворов солей либо в результате испарения любого избытка серной кислоты, либо в результате разложения соли. Также существует опасность выплескивания горячего материала из контейнера. Если начинают появляться кристаллы, например, на верхней кромке раствора, горелку Бунзена следует немедленно выключить и дать раствору остыть. Обратитесь к разделу 13.2.6 Лабораторного справочника CLAPSS для обсуждения.
Обратитесь к разделу 13.2.6 Лабораторного справочника CLAPSS для обсуждения.
Если учащиеся старшего возраста проведут эти эксперименты, их можно попросить написать символьные уравнения:
Mg(s) + 2HCl(aq) → MgCl 2 (aq) + H 2 (g)
и
Mg(s) + H 2 SO 4 SO 4 4 (водн.) + H 2 (г)
Для реакций этих кислот с железом или цинком учащиеся просто заменяют Mg в этих уравнениях Fe или Zn.
Вопросы для учащихся
Загрузите эти вопросы в виде рабочего листа из нижней части этой статьи.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции.


 Для доказательства качественного состава СаС12 проведем реакции, характерные для катиона кальция и хлорид-аниона.
Для доказательства качественного состава СаС12 проведем реакции, характерные для катиона кальция и хлорид-аниона.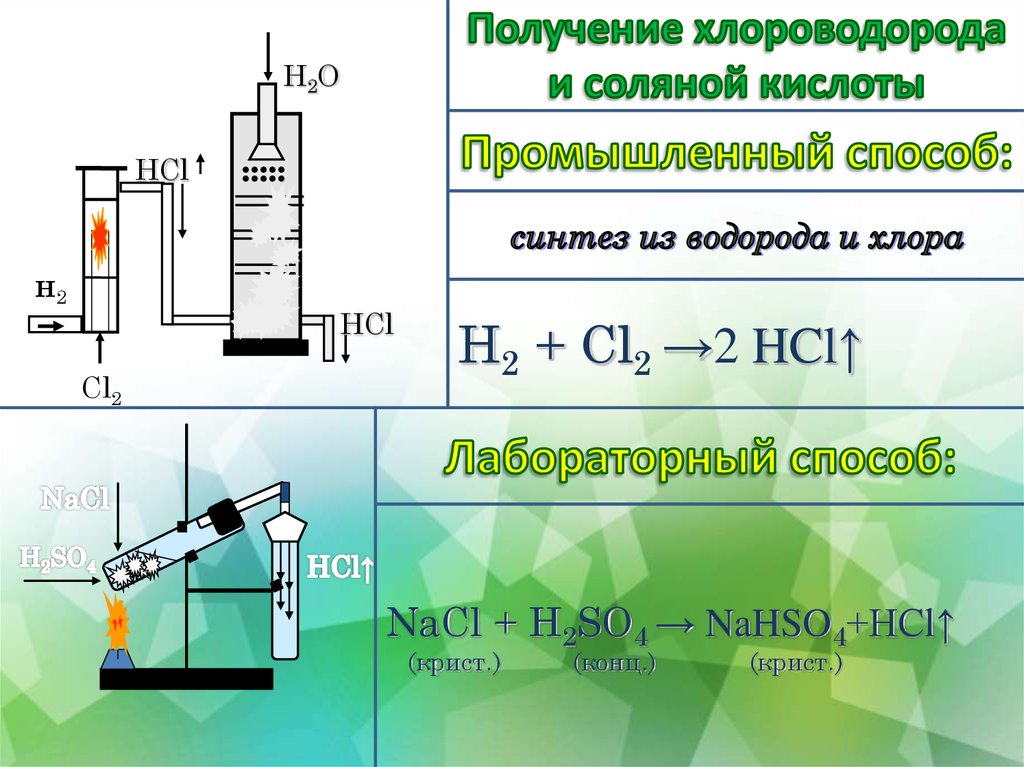 Необходимо осуществить следующие превращения:Fe → FeCI
Необходимо осуществить следующие превращения:Fe → FeCI


 В эту группу входят кальций, магний и барий.
В эту группу входят кальций, магний и барий.


 ) — см. карту опасности CLEAPSS HC047a и книгу рецептов CLEAPSS RB043.
) — см. карту опасности CLEAPSS HC047a и книгу рецептов CLEAPSS RB043. На этот раз неплотно поместите пробку в верхнюю часть пробирки, чтобы образовавшийся газ медленно выходил. Зажгите щепку, удалите пробку и сразу же поднесите пламя к отверстию трубки. Если ничего не происходит, возможно, вам придется повторить попытку.
На этот раз неплотно поместите пробку в верхнюю часть пробирки, чтобы образовавшийся газ медленно выходил. Зажгите щепку, удалите пробку и сразу же поднесите пламя к отверстию трубки. Если ничего не происходит, возможно, вам придется повторить попытку.
 Пометьте блюдо и оставьте до следующего занятия кристаллизоваться. Затем кристаллы можно исследовать с помощью ручной линзы или микроскопа.
Пометьте блюдо и оставьте до следующего занятия кристаллизоваться. Затем кристаллы можно исследовать с помощью ручной линзы или микроскопа.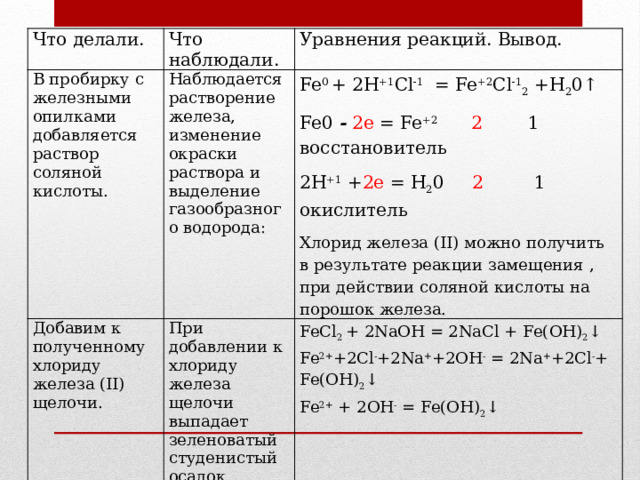 Как называется этот газ?
Как называется этот газ?