| Тема: «Алюминий и его соединения». Цели: Образовательная -сформировать знания обучающихся о физико – механических и химических свойствах алюминия на основе его положения в ПСХЭ, строения атома и кристалла — выявить и оценить степень овладения системой знаний и комплексом навыков и умений об амфотерных элементах и их соединениях на примере алюминия, готовности обучающихся применять полученные знания на практике, позволяющие обеспечить обратную связь и оперативную корректировку образовательного процесса; — продолжить развитие умений наблюдать, делать выводы, объяснять ход эксперимента -формировать навыки составления уравнений химических реакций с участием простых веществ. Развивающая цель: -развитие критического мышления, самостоятельности и способности к рефлексии, обеспечение системности учения Воспитательная: -воспитание положительной мотивации учения, правильной самооценки, чувства ответственности Лабораторный опыт №14 «Получение гидроксида алюминия и исследование его кислотно- основных свойств». Оборудование и реактивы: хлорид алюминия, соляная кислота, гидроксид натрия. Ход урока
Слайд №2 (-леруогд, — имийекр, — иксолодр, -ддрооов, -лйминиаю) Задание классу. Решите анаграммы и исключите лишнее (углерод, кремний, кислород, водород, алюминий). Откуда произошло название этого элемента? (Алюмен – в переводе с латин. – квасцы, которые в древности использовали для крашения тканей) Слайд №3 (Алюмен – в переводе с латин. – квасцы, которые в древности использовали для крашения тканей) 1.2. Итак, вы уже поняли, что тема сегодняшнего урока «Алюминий и его соединения», а я хочу назвать урок «Номер 13! Счастливый или нет?». Почему же я дала такое название? (порядковый номер Al в ПСХЭ – 13, с таким числом связаны суеверия. Слайд №4: (положение в ПСХЭ), строение атома, тип связи, тип кристаллической решетки) Алюминий: переходный элемент, соединения которого обладают амфотерными свойствами. Металл. Тип связи: металлическая. Тип кристаллической решетки: металлическая. Слайд №5: Открытие алюминия. Сообщение обучающегося: однажды к римскому императору Тиберию пришел незнакомец. В дар императору он преподнес изготовленную им чашу из блестящего, как серебро, но чрезвычайно легкого металла. Мастер поведал, что этот никому неизвестный металл он сумел получить из глинистой земли. Должно быть, чувство благодарности редко обременяло Тиберия, да и правителем он был недальновидным. Боясь, что новый металл с его прекрасными свойствами обесценит хранившееся в казне золото и серебро, он отрубил изобретателю голову, а его мастерскую разрушил, чтобы никому не повадно было заниматься производством «опасного металла». Спустя полторы тысячи лет в историю алюминия была вписана новая страница.
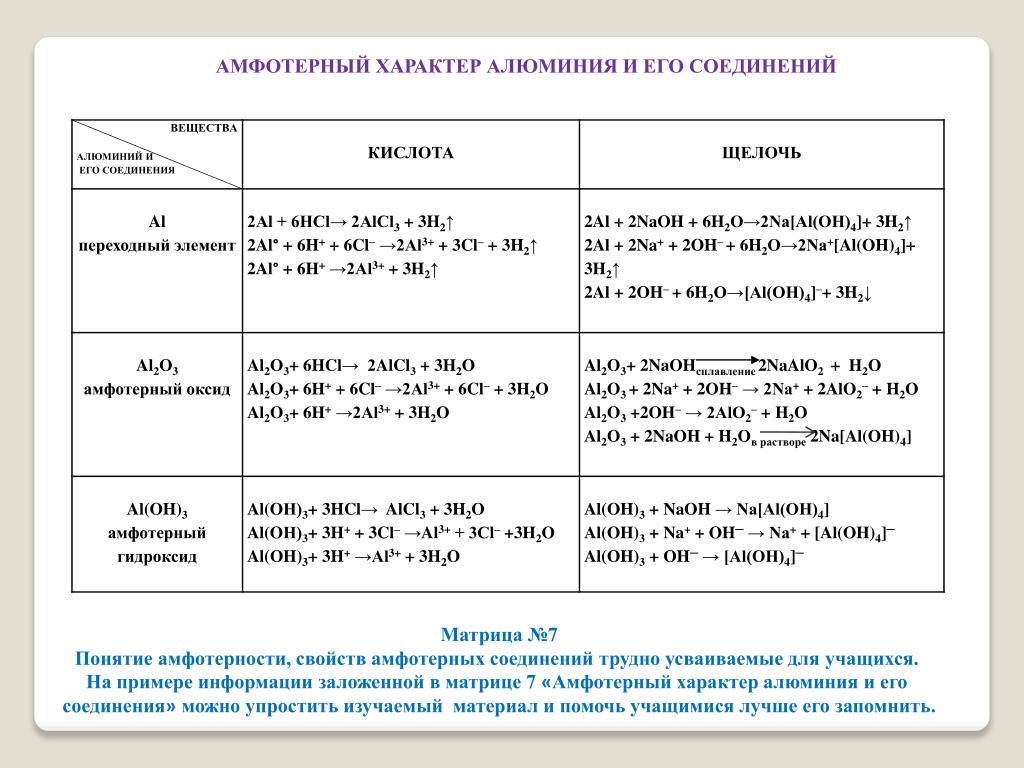
-1. Алюминий — один из семи металлов древности? (Al не относится к металлам древности). -2. Алюминий — не пропускает солнечные и тепловые лучи? (фольга на окнах отражает тепловые, но пропускает световые лучи) -3 Алюминиевая посуда — признак низкого достоинства? (Алюминиевую посуду называют посудой бедняков, т.к. этот металл способствует развитию старческого атеросклероза. При приготовлении пищи в такой посуде алюминий частично переходит в организм, где и накапливается. А в 19 веке на императорских приемах алюминиевая посуда была самой престижной. Наполеон III устроил однажды банкет, на котором особо почетным гостям выдали алюминиевые ложки и вилки. Гости попроще удостоились обычными для императорского двора золотыми и серебряными приборами. К тому же, только у сына Наполеона III была очень дорогая по тем временам алюминиевая погремушка.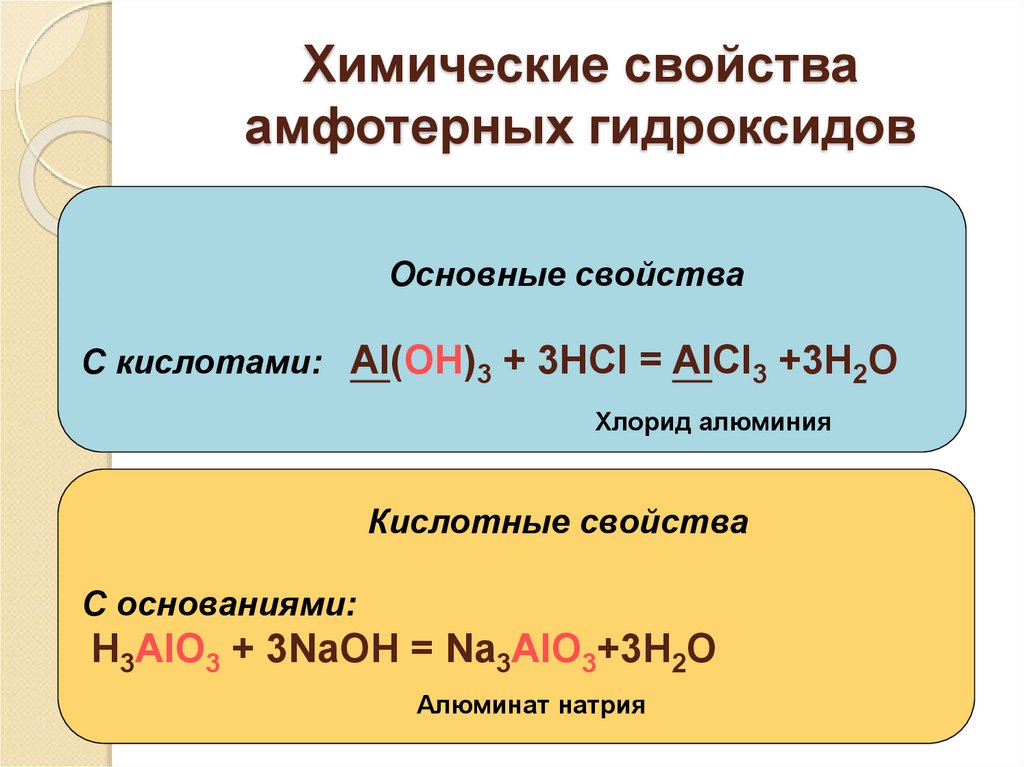 ) )4. Алюминий — После окончания школы за отличную учебу Вас могут премировать алюминиевой кружкой? (сейчас нет, а вот раньше стоимость алюминия превосходила стоимость многих драгоценных металлов. К примеру, Д.И.Менделееву среди других подарков из золота и платины преподнесли еще более дорогой подарок, чем все предыдущие, — чашу из алюминия). 1.4. Слайд №6: Нахождение в природе. Используя данные таблицы, сделайте вывод о нахождении алюминия в природе? ( Al находится в природе в виде соединений: -бокситы Al2O3 · n H2O (c примесями SiO2, Fe2O3, CaCO3) — каолин Al2O3 · 2 SiO2 · 2 H2O — корунд Al2O3 (кристаллы, окрашенные примесями в красный цвет – рубины, в синий цвет – сапфиры) Почему алюминия нет в природе в свободном состоянии? (исходя из положения в электрохимическом ряду напряжений металлов можно заключить, что он обладает высокой химической активностью) 1. (это серебристо- белый мягкий, легкий (плотность 2,699г/см3) металл. Масса алюминиевой детали составляет лишь треть массы стальной детали такого же размера. Устойчив к коррозии. Поверхность алюминия всегда покрыта плотным, тончайшим слоем Al2O3; эта пленка прозрачна, поэтому алюминий обладает высокой отражательной способностью (отражает 90% падающих на него световых лучей) и благодаря своему блеску имеет декоративный вид. Хорошо поддается обработке, его можно раскатать в фольгу толщиной менее 0,01 мм. Проводит электрический ток и тепло лучше, чем все другие обычные металлы (кроме меди и серебра). На физических свойствах алюминия основано применение его в быту (первые слайды дали информацию о направлениях применения алюминия и его сплавов). 1.6. Слайд №8 Химические свойства алюминия (Работа в группах) Сделайте вывод о химической активности алюминия. Сравните с хим. Задание классу: используя информационную схему, сделайте вывод о химической активности алюминия. Al + простые вещества: Al + сложные вещества: +O2 + Hal2 + S + H2O + MeO + кислоты + щелочи + соли Какое свойство в этой схеме характерно для алюминия в отличие от других металлов? (взаимодействие со щелочью) Охарактеризуйте взаимодействие алюминия с кислотами (с разбавленными; с концентрированными серной и азотной кислотами на холоде) Вывод: алюминий активный металл, сильный восстановитель. Задание классу: найдите соответствие между реагентами и продуктами реакции. Запишите соответствующие уравнения реакций. Если испытываете затруднение, обратитесь за помощью к странице 184 учебника: 1. Al + O2 A AlCl 3 + H2 2. Al + H2O Б AlCl3 3 Al + Cl2 B AlCl3 + H2O 4 Al + HCl Г AlCl3 + Hg 5 Al + NaOH Д AlCl3 + HgCl2 6 Al + HgCl2 Е NaAlO2 + H2 7 Al + Fe3O4 Ж Al(OH)3 + H2 З Al(OH)3 + Na И Al2O3 + Fe K Al2O3 (для самопроверки: 1-к, 2-ж, 3-б, 4-а, 5-е, 6 –д, 7 – и) Вывод: алюминий проявляет амфотерные свойства (реагирует и с кислотами, и со щелочами)
2.1. Слайд №9 Оксид алюминия (глинозём) — Al2O3: встречается в природе в виде твердого минерала корунда; загрязненный примесями SiO Задание классу: определите характер данного оксида, подтвердите уравнениями реакций: Al2O3 + 6HCl→ 2AlCl3 + 3H2O; Al2O3 + 2NaOH→ 2NaAlO2 + H2O; 2.2. Гидроксид алюминия Al(OH)3 Al(OH)3 + 3HCl→ AlCl3 + 3H2O Al(OH)3+ NaOH→ NaAlO2 + 2H2O
1. AlCl3 + 3NaOH → Al(OH)3 + 3NaCl Al3+ + 3OH— → Al(OH)3↓ (наблюдается выпадение осадка) 2. Al(OH)3+ 3HCl→ AlCl3 + 3H2O H+ + OH—→ H2O Вывод: гидроксид алюминия является амфотерным гидроксидом и взаимодействует как с кислотами, так и со щелочами.
Графический диктант (+, ─)
Домашнее задание: §41; упр. Какой момент урока вам понравился? Какое впечатление у вас осталось от урока? жүктеу/скачать 64.5 Kb. Достарыңызбен бөлісу: |
Алюминий и его реакция с водой
[Deposit Photos]Впервые алюминий был получен лишь в начале XIX века. Cделал это физик Ганс Эрстед. Свой эксперимент он проводил с амальгамой калия, хлоридом алюминия и ртутью.
Кстати, название этого серебристого материала произошло от латинского слова «квасцы», потому что именно из них добывается этот элемент.
Квасцы [Wikimedia]Квасцы – это природные минералы на основе металлов, которые объединяют в своем составе соли серной кислоты.
Раньше алюминий считался драгоценным металлом и стоил на порядок дороже, чем золото. Объяснялось это тем, что металл было довольно сложно отделить от примесей. Так что позволить себе украшения из алюминия могли только богатые и влиятельные люди.
Японское украшение из алюминия [Wikimedia]Но в 1886 году Чарльз Холл придумал метод по добыче алюминия в промышленном масштабе, что резко удешевило этот металл и позволило применять его в металлургическом производстве. Промышленный метод заключался в электролизе расплава криолита, в котором растворен оксид алюминия.
Алюминий — очень востребованный металл, ведь именно из него изготавливаются многие вещи, которыми человек пользуется в быту.
Применение алюминия
Благодаря ковкости и легкости, а также защищенности от коррозии, алюминий является ценным металлом в современной промышленности. Из алюминия изготавливают не только кухонную посуду — он широко используется в авто- и авиастроительстве.
Из алюминия изготавливают не только кухонную посуду — он широко используется в авто- и авиастроительстве.
Также алюминий является одним из самых недорогих и экономичных материалов, так как его можно использовать бесконечно, переплавляя ненужные алюминиевые предметы, например, банки.
Алюминиевые банки [Deposit Photos]Металлический алюминий безопасен, но его соединения могут оказывать токсическое действие на человека и животных (особенно хлорид, ацетат и сульфат алюминия).
Физические свойства алюминия
Алюминий — достаточно легкий металл серебристого цвета, который может образовывать сплавы с большинством металлов, особенно с медью, магнием и кремнием. Также он весьма пластичен, его без труда можно превратить в тонкую пластинку или же фольгу. Температура плавления алюминия = 660 °C, а температура кипения — 2470 °C.
Химические свойства алюминия
При комнатной температуре металл покрывается прочной пленкой оксида алюминия Al₂O₃, которая защищает его от коррозии.
С окислителями алюминий практически не реагирует из-за защищающей его оксидной пленки. Однако ее можно легко разрушить, чтобы металл проявил активные восстановительные свойства. Разрушить оксидную пленку алюминия можно раствором или расплавом щелочей, кислотами или же с помощью хлорида ртути.
Благодаря восстановительным свойствам алюминий нашел применение в промышленности — для получения других металлов. Этот процесс называется алюмотермией. Такая особенность алюминия заключается во взаимодействии с оксидами других металлов.
Алюмотермическая реакция с участием оксида железа (III) [Wikimedia]Например, рассмотрим реакцию с оксидом хрома:
Cr₂O₃ + Al = Al₂O₃ + Cr.
Алюминий хорошо вступает в реакцию с простыми веществами. Например, с галогенами (за исключением фтора) алюминий может образовать иодид, хлорид, или бромид алюминия:
2Al + 3Cl₂ → 2AlCl₃
С другими неметаллами, такими как фтор, сера, азот, углерод и т.д. алюминий может реагировать только при нагревании.
Также серебристый металл вступает в реакцию и со сложными химическими веществами. Например, с щелочами он образует алюминаты, то есть комплексные соединения, которые активно используются в бумажной и текстильной промышленности. Причем в реакцию вступает как гидроксид алюминия
Al(ОН)₃ + NaOH = Na[Al(OH)₄]),
так и металлический алюминий или же оксид алюминия:
2Al + 2NaOH + 6Н₂О = 2Na[Al(OH)₄] + ЗН₂.
Al₂O₃ + 2NaOH + 3H₂O = 2Na[Al(OH)₄]
С агрессивными кислотами (например, с серной и соляной) алюминий реагирует довольно спокойно, без воспламенения.
Если опустить кусочек металла в соляную кислоту, то пойдет медленная реакция — сначала будет растворяться оксидная пленка — но затем она ускорится. Алюминий растворяется в соляной кислоте с выделением водорода. В результате реакции получается хлорид алюминия:
Алюминий растворяется в соляной кислоте с выделением водорода. В результате реакции получается хлорид алюминия:
Al₂O₃ + 6HCl = 2AlCl₃ + 3H₂O
2Al + 6HCl → 2AlCl₃ + 3H₂.
Хлорид алюминия [Wikimedia]Здесь вы найдете интересные опыты на изучение химических свойств металлов.
Реакция алюминия с водой
Если опустить алюминиевую стружку в обычную воду, ничего не произойдет, потому что алюминий защищен оксидной пленкой, которая не дает этому металлу вступить в реакцию.
Только сняв защитную пленку хлоридом ртути, можно получить результат. Для этого металл нужно вымачивать в растворе хлорида ртути на протяжении двух минут, а затем хорошо его промыть. В результате получится амальгама, сплав ртути и алюминия:
3HgCI₂ + 2Al = 2AlCI₃ + 3Hg
Причем она не удерживается на поверхности металла. Теперь, опустив очищенный металл в воду, можно наблюдать медленную реакцию, которая сопровождается выделением водорода и образованием гидроксида алюминия:
2Al + 6H₂O = 2Al(OH)₃ + 3H₂.
Опыт 1. Взаимодействие металлического алюминия со щелочью
Поместить в пробирку немного алюминиевых стружек и добавить к нему 5-10 капель раствора щелочи. Легко ли алюминий растворяется в щелочи? Объяснить механизм реакции алюминия со щелочами. Написать уравнения реакций.
Опыт 2. Получение гидроксида алюминия и исследование его свойств
В две пробирки поместить по 2-3 капли раствора соли алюминия и осторожно добавить в каждую по 1-3 капли 2н раствора едкого натра до образования осадка гидроксида алюминия. К полученному осадку прибавить в одну пробирку 3-4 капли раствора соляной кислоты, в другую — такое же количество раствора едкого натра. Что наблюдается в обоих случаях? Какой вывод о свойствах гидроксида алюминия можно сделать? Написать в молекулярном и ионном виде уравнения: а) реакции получения гидроксида алюминия; б) реакции взаимодействия гидроксида алюминия с кислотой и щелочью; в) схему равновесия диссоциации гидроксида алюминия. Как смещается равновесие диссоциации гидроксида алюминия при добавлении избытка кислоты? При добавлении избытка щелочи?
Как смещается равновесие диссоциации гидроксида алюминия при добавлении избытка кислоты? При добавлении избытка щелочи?
Опыт 3. Гидролиз растворов солей алюминия.
Определить рН водного раствора соли алюминия.Для этого нанести 1 каплю раствора соли на полоску универсального индикатора.
Написать молекулярное и ионное уравнения первой ступени гидролиза. Почему гидролиз данной соли не идет до конца? Какие продукты получаются в результате реакции? Как можно уменьшить или усилить гидролиз соли алюминия?
Контрольные вопросы:
1. Составить электронную формулу атома алюминия, иона алюминия в в характерной степени окисления.
2. Написать уравнения реакций горения алюминия в кислороде; в хлоре; в парах серы.
3. Какие кислотно-основные свойства характерны для оксида и гидроксида алюминия? Составить уравнения соответствующих реакций.
4. Какие вещества и в какой последовательности образуются при постепенном прибавлении избытка раствора гидроксида натрия к раствору хлорида алюминия? Составить уравнения реакций в молекулярной и ионной форме.
5. Почему нельзя пользоваться алюминиевыми сосудами для хранения щелочных растворов? Привести уравнения реакций.
6. Почему алюминий, находясь в ряду электродных потенциалов левее водорода, не вытесняет его из воды, но легко вытесняет водород из водного раствора щелочи?
7. Какие вещества и в какой последовательности образуются при постепенном добавлении избытка раствора соляной кислоты на раствор алюмината натрия?
8. Как алюминий реагирует с разбавленными и концентрированными соляной и серной кислотами? Составить уравнения реакций.
9. Как алюминий реагирует с разбавленной и с концентрированной азотной кислотой ? Составить уравнения реакций.
10.Чем объясняется высокая коррозионная устойчивость алюминия? Как влияют ионы ртути на коррозию алюминия? Составить уравнения реакций.
11.Написать уравнения реакций для следующих превращений:
а) Al2O3 ® AlCl3 ® Al(OH)3 ® K3AlO3 ;
б) K3AlO3 ® Al(OH)3 ® Al2O3 ® Al .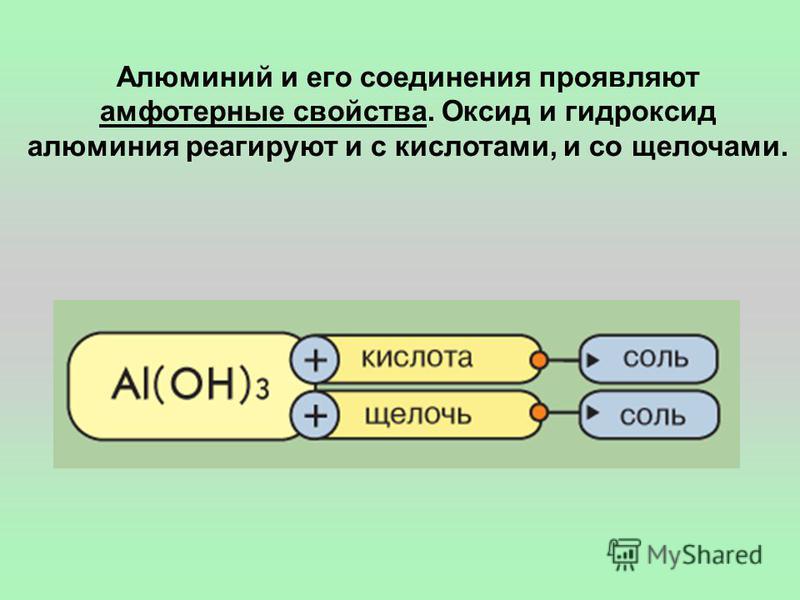
12. Написать уравнения реакций для следующих превращений:
а) Al ® AlCl3 ® Al(OH)Cl2 ® Al(OH)3 ;
б) K3AlO3 ® Al2(SO4)3 ® Al(HSO4)3 ® Al(OH)3 .
13. Написать уравнения реакций гидролиза следующих солей : а) хлорида алюминия; б) сульфида алюминия. Какая реакция среды в водных растворах этих солей?
14. Как изменяется окраска лакмуса в водных растворах солей: нитрата алюминия; метаалюмината натрия; алюмокалиевых квасцов? Составить уравнения реакций.
15. Объяснить, почему при сливании растворов нитрата алюминия и сульфида натрия не образуется осадка сульфида алюминия. Что образуется?
16. Почему при действии сульфида натрия и карбоната натрия на водный раствор алюмокалиевых квасцов выпадает осадок одинакового состава? Составить уравнения реакций.
17. Какой процесс называется алюмотермией? Для чего он используется?
18. Каков состав термитной смеси? Для чего она используется? Составить уравнение реакции.
19.Написать уравнения реакций для следующих превращений:
Al ® Al2S3 ® Al(OH)3 ® AlCl3 ® K[Al(OH)4]
20.Как получают алюминий в промышленности?
Олово. Свинец
Олово и свинец — металлы IV А подгруппы периодической системы Д.И.Менделеева. Электронные формулы валентных электронов этих металлов:
Sn … 5s25p2
Pb … 6s26p2
Степень окисления элементов в нормальном состоянии +2, при возбуждении +4, поэтому известны два ряда производных олова и свинца.
Отношение Sn и Pb к кислотам различно. Олово растворяется в соляной кислоте ( в разбавленной медленно, а в концентрированной и при нагревании — быстро) :
Sn + 2HCl = SnCl2 + H2
Свинец при взаимодействии с HCl покрывается слоем PbCl2, препятствующим дальнейшему взаимодействию Pb с кислотой.
Аналогично происходит взаимодействие свинца с разбавленной серной кислотой, но при концентрации кислоты выше 80% на поверхности металла образуется растворимая кислая соль Pb(HSO4)2 . Разбавленная серная кислота на олово не действует. Горячая концентрированная серная кислота растворяет оба элемента по схеме
Разбавленная серная кислота на олово не действует. Горячая концентрированная серная кислота растворяет оба элемента по схеме
Э + 4H2SO4 = Э(SO4)2 + 2SO2 + 4H2O
В сильно разбавленной азотной кислоте олово медленно растворяется с образованием Sn(NO3)2. Концентрированная азотная кислота действует на Sn по схеме
Sn + 4HNO3 = SnO2 + 4NO2 + 2H2O
При действии HNO3 на свинец реакция протекает по схеме
3Pb + 8HNO3 = 3Pb(NO3)2 + 2NO + 4H2O
Образующаяся соль Pb(NO3)2 не растворима в концентрированной азотной кислоте, и наоборот, хорошо растворима в воде, поэтому Pb хорошо растворяется в разбавленной азотной кислоте.
Олово и свинец растворяются в щелочах с выделением водорода и образованием комплексных солей:
Pb + 4KOH + 2H2O ® K4[Pb(OH)6] + H2
Для олова и свинца известны оксиды типов ЭО и ЭО2. В воде они почти не растворимы, поэтому отвечающие им гидроксиды получают действием щелочей на растворы соответствующих солей:
В воде они почти не растворимы, поэтому отвечающие им гидроксиды получают действием щелочей на растворы соответствующих солей:
SnCl4 + 4NaOH = 4NaCl + Sn(OH)4¯
Pb(NO3)2 + 2NaOH = 2NaNO3 + Pb(OH)2¯
По химическим свойствам все эти гидроксиды — амфотерные соединения.
Изменения кислотных и основных свойств можно представить схемой:
Усиление основных свойств
Sn(OH)2 Sn(OH)4
Pb(OH)2 Pb(OH)4
Гидроксиды H2SnO2 и H2PbO2 называют оловянистой и свинцовистой кислотами, а их соли — станнитами и плюмбитами. Гидроксиды H2SnO3 (H4SnO4) и H2PbO3 (H4PbO4) называют оловянной и свинцовой кислотами, а их соли — станнатами и плюмбатами.
Ввиду слабости основных свойств гидроксидов Э(ОН)4 их соли подвергаются в растворах сильному гидролизу.
Наибольшее значение из соединений этих элементов имеют галиды ЭГ4. Самое характерное свойство для них — склонность к реакции присоединения. Например, SnCl4 образует комплексы с HCl, H2O.
Галиды ЭГ2 имеют ярко выраженный характер солей, гидролизуются значительно меньше, чем ЭГ4.
Для Sn известны сульфиды SnS и SnS2, которые отличаются по своему отношению к сернистому аммонию. В то время как сульфид олова(II) с ним не взаимодействует, сульфид олова(IV) в растворе сульфида аммония образует аммонийную соль тиооловянной кислоты: (NH4)2S + SnS2 = (NH4)SnS3
Для характеристики окислительно – восстановительных свойств используют диаграммы Латимера.
Диаграммы Латимера:
а) для олова;
-0,118
SnO2
+0,154 -0,141
Sn4+Sn2+ Sn0
-0,96 -0,79
[Sn(OH)6]2- [Sn(OH)6]4-
б) для свинца: -0,956
PbS
1,685 -0,356
PbSO4
1,456 — 0,126
PbO2 Pb2+ Pb0
0,305-0,538
[Pb(ОН )6]2- [Pb(OH)4]2-
Соединения олова и свинца характеризуются различными окислительно-восстановительными свойствами (см. диаграмму Латимера).Для олова более устойчивой является степень окисления (+4), соединения Sn+2 — восстановители, легко окисляются кислородом воздуха и другими окислителчми; для свинца — более устойчива степень окисления (+2), соединения свинца (+4) — чрезвычайно сильные окислители.
диаграмму Латимера).Для олова более устойчивой является степень окисления (+4), соединения Sn+2 — восстановители, легко окисляются кислородом воздуха и другими окислителчми; для свинца — более устойчива степень окисления (+2), соединения свинца (+4) — чрезвычайно сильные окислители.
Например, возможно окисление диоксидом свинца соединений марганца (II) до перманганат-иона:
5PbO2 + 2Mn(NO3)2 + 6HNO3 = 5Pb(NO3)2 + 2HMnO4 + 2H2O
Лабораторная работа №4
ВНИМАНИЕ! Все соединения свинца ядовиты! При работе с ними соблюдать особую осторожность! По окончании опытов с кислотами растворы слить в слив, а не растворившиеся металлы положить в специальную посуду!
Опыт 1. Отношение олова и свинца к кислотам (проводить в вытяжном шкафу!).
а) растворение олова в кислотах
В три пробирки положить по кусочку металлического олова и прилить по 5 капель кислот, в первую — соляной, во вторую — серной, в третью — азотной. Отметить наблюдения. Написать уравнения реакций в ионной и молекулярной формах.
Отметить наблюдения. Написать уравнения реакций в ионной и молекулярной формах.
б) В три пробирки поместить по кусочку свинца и прилить по 5-8 капель растворов кислот: в первую — соляной, во вторую — серной, в третью — азотной. Нагреть пробирки на спиртовке. Во всех ли пробирках протекает реакция? После охлаждения растворов в каждую пробирку добавить 1-2 капли раствора KI. В какой из пробирок выпал осадок?
Гидроксид алюминия – свойства, структура, получение и применение
Как известно большинству людей, алюминий является естественным минералом, тогда как гидроксид алюминия выпускается в форме антацида. Он подходит для лечения расстройства желудка, кислотного несварения, изжоги и повышенной кислотности желудка. Вы также можете использовать его для снижения уровня фосфатов у людей, страдающих от проблем с почками. Антацид может быть даже пригоден для других немедицинских целей.
Для тех, кто не знает, что такое гидроксид алюминия, он также известен как гидроксид алюминия, гидроксид алюминия (III) или алюминиевая кислота. Это химическое название алюминия, как и всех других разновидностей карбонатов, сульфатов и гидроксидов металлов. Он встречается в природе в виде минерального гиббсита вместе с его полиморфными формами, называемыми байеритом, дойлеитом и нордстрандитом.
Это химическое название алюминия, как и всех других разновидностей карбонатов, сульфатов и гидроксидов металлов. Он встречается в природе в виде минерального гиббсита вместе с его полиморфными формами, называемыми байеритом, дойлеитом и нордстрандитом.
Производство гидроксида алюминия
Что касается свойств гидроксида алюминия, то его плотность составляет 2,42 г/см 3 , а его температура плавления составляет 300 градусов Цельсия. Это аморфный порошок белого цвета, нерастворимый в воде. Однако он растворим в кислых и щелочных растворах. Молярная масса гидроксида алюминия 78,0036.
Гидроксид алюминия, который необходимо использовать в коммерческих целях, производится по методу Байера. Процесс включает растворение боксита в растворе гидроксида натрия при температуре 270 градусов Цельсия.
После завершения процедуры проводят удаление отходов, оставляя раствор алюмината натрия осаждаться. Минерал, полученный путем осаждения, называется гидроксидом алюминия. Прокаливание — это процесс, используемый для получения оксида алюминия или оксида алюминия из гидроксида алюминия.
Минерал, полученный путем осаждения, называется гидроксидом алюминия. Прокаливание — это процесс, используемый для получения оксида алюминия или оксида алюминия из гидроксида алюминия.
Процесс Байера используется для производства коммерческого гидроксида алюминия. Это делается путем растворения боксита в растворе едкого натра при температуре, скажем, 270 0С. Отходы удаляют и дают раствору алюмината натрия подняться. Поэтому образующийся гидроксид алюминия называют осадком. Глинозем или оксид алюминия можно получить из гидроксида алюминия с помощью расчетного процесса.
Компания Bayer перерабатывает почти весь коммерчески доступный гидроксид алюминия, который помогает растворять бокситы в гидроксиде натрия при температуре до 270°C (518°F). Производится экстракция гидроксида алюминия, из которого твердые отходы, бокситовые хвосты, удаляются из оставшегося раствора алюмината натрия. Этот гидроксид алюминия можно преобразовать в оксид алюминия или глинозем путем расчета. 9{-} + H_{2}O (II)\]
9{-} + H_{2}O (II)\]
Типичная структура гидроксида алюминия состоит из связей водорода и двойных покрытий ионов алюминия и гидроксильных групп. Они занимают около двух третей октаэдрических отверстий, доступных в двух слоях. Амфотерный гиббсит работает в форме основания Бренстеда-Лоури для получения определенной соли путем захвата водородных кислот и их нейтрализации. Реакция следует процедуре:
\[3 HCl + Al (OH)_{3} - AlCl_{3} + 3 H_{2}O\]
Какие меры предосторожности необходимо соблюдать при приготовлении геля гидроксида алюминия?
Лицо, готовящее препарат, должно очистить коническую колбу, чтобы избежать попадания грязи и микробов в процессе горячего кипячения.
Разрушение отремонтированного геля приводит к образованию побочного продукта (соляной кислоты) в реакции.
 Поэтому его необходимо удалить в процессе диализа.
Поэтому его необходимо удалить в процессе диализа.В растворы хлорида алюминия необходимо добавить нисходящую спираль.
Приготовление
Нет необходимости готовить гидроксид алюминия, так как он присутствует в огромном количестве в различных геологических системах. Тем не менее, он производится с использованием методов спекания и Байера для получения глинозема из минерального боксита. Таким образом, 97 % гидроксида алюминия, обнаруженного в мире, образуется в результате обработки каустической соды и бокситов. В процессе образуется алюминат натрия, который далее разлагается с использованием процедуры перемешивания с получением гидроксида алюминия. Формула выглядит так:
\[NaAl(OH)_{4} – Al(OH)_{3} + NaOH\]
Существуют и другие способы получения гидроксида алюминия, в том числе золь-гель или микро -эмульсионные и гидротермальные процедуры. Использование этих процедур может помочь в получении гидроксида алюминия с более высоким уровнем чистоты.
Использование этих процедур может помочь в получении гидроксида алюминия с более высоким уровнем чистоты.
Пошаговое приготовление геля гидроксида алюминия
Необходимо приготовить раствор хлорида алюминия с концентрацией не менее 2% (путем добавления 2 г хлорида алюминия на 100 мл воды).
Коническая колба должна содержать не менее 100 мл дистиллированной воды.
Проволочную сетку следует использовать для кипячения воды.
Добавить 10 мл приготовленного выше 2% раствора хлорида алюминия. Добавьте этот раствор с помощью пипетки-бюретки. Как и алюминий, композиты по своей природе агрессивны.
Раствор необходимо регулярно встряхивать с добавлением хлорида алюминия.

При нагревании раствора необходимо учитывать цвет раствора, а цвет раствора гидроксида алюминия должен быть белым.
Дайте смеси остыть до комнатной температуры.
Охлаждающий раствор называется гелем гидроксида алюминия.
Использование гидроксида алюминия
(Изображение будет загружено в ближайшее время)
Существует множество применений гидроксида алюминия в химической промышленности. Фармацевтические и химические применения гидроксида алюминия включают:
Его можно использовать в виде антацида для лечения язв и гастрита.
Вы также можете использовать его в качестве добавки к различным вакцинам.

Гидроксид алюминия также используется в качестве наполнителя в процессе производства некоторых лекарств.
Чаще всего эта формула используется в качестве сырья при производстве оксида алюминия или глинозема, что также помогает в производстве металлического алюминия.
Используется в форме геля.
В качестве наполнителя в различных косметических средствах.
Для производства активированного оксида алюминия.
В виде промежуточного химического вещества.
Гидроксид алюминия используется в качестве добавки к стеклу для повышения термостойкости.

В качестве огнезащитного и мягкого абразива для пластмасс.
Он также широко используется в производстве различных водостойких тканей и бумаги.
Побочные эффекты гидроксида алюминия
Существуют крупномасштабные побочные эффекты гидроксида алюминия, о которых пользователи должны знать. Высокие концентрации того же самого могут нанести большой ущерб здоровью. Это может даже повредить легкие и привести к аллергическим реакциям, таким как отек языка, губ, горла и лица; крапивница и затрудненное дыхание. К другим побочным эффектам применения гидроксида алюминия относятся:
Боль при мочеиспускании
Сильная боль в желудке или запор
Appetite loss
Tiredness and muscle weakness
Tarry or bloody stools
Coughing blood
Vomiting
Extreme drowsiness
If you witness any of эти побочные эффекты, вы должны получить неотложную помощь как можно скорее. Более того, проконсультируйтесь со своим лечащим врачом, прежде чем принимать что-либо с высокой концентрацией этого минерала.
Более того, проконсультируйтесь со своим лечащим врачом, прежде чем принимать что-либо с высокой концентрацией этого минерала.
Вы не должны этого знать, знали ли вы факты до сих пор?
Основание и кислота являются реагентами гидроксида алюминия.
Гидроксид алюминия используется для покрытия наночастиц TiO 2 .
Гидроксид алюминия используется для снижения уровня фосфатов у людей с определенными заболеваниями почек.
Использование гидроксида алюминия снижает абсорбцию других химических веществ в организме. Таким образом, интервалы в два часа до и после приема гидроксида алюминия должны быть сохранены для дальнейшего использования в этом отношении.
Формула гидроксида алюминия.
 Структура, свойства, применение, примеры вопросов
Структура, свойства, применение, примеры вопросов Алюминиевая кислота, гидроксид алюминия и гидроксид алюминия (III) — все это названия гидроксида алюминия. Это химический термин для алюминия, как и для всех других карбонатов, сульфатов и гидроксидов металлов.
Встречается в природе в виде минерального гиббсита и его полиморфных форм, таких как дойлеит, нордстрандит и байерит.
Формула гидроксида алюминия
Химическая формула гидроксида алюминия: Al(OH) 3 . Гидроксид алюминия представляет собой белый аморфный порошок. Не растворяется в воде, но растворяется в щелочных и кислых растворах. Его можно использовать для лечения дискомфорта в желудке, кислотного расстройства желудка, изжоги и повышенной кислотности желудка. Его также можно использовать для снижения уровня фосфатов у людей с заболеваниями почек. Антацид также может быть полезен в немедицинских целях.
Структура гидроксида алюминия
Гидроксид алюминия представляет собой амфотерное химическое вещество, способное вести себя как кислота и как основание. Он встречается в кислых растворах в виде иона алюминия Al 3 + и ион гидроксида OH – . Это происходит в основных растворах, таких как ион гидроксида алюминия, Al(OH) 4 -. Ион гидроксида алюминия имеет тетраэдрическую структуру с валентным углом 116,5° между Al-O-Al. Гидроксид алюминия имеет нормальную структуру гидроксида металла с водородной связью.
Он встречается в кислых растворах в виде иона алюминия Al 3 + и ион гидроксида OH – . Это происходит в основных растворах, таких как ион гидроксида алюминия, Al(OH) 4 -. Ион гидроксида алюминия имеет тетраэдрическую структуру с валентным углом 116,5° между Al-O-Al. Гидроксид алюминия имеет нормальную структуру гидроксида металла с водородной связью.
Он состоит из двух слоев гидроксильных групп и двух слоев ионов алюминия, которые занимают две трети октаэдрических отверстий, образованных между двумя слоями.
Гиббсит представляет собой амфотерный минерал, который действует как основание Бренстеда-Лоури для производства соли путем поглощения ионов водорода и нейтрализации кислоты. Вот реакция:
3HCl + Al(OH) 3 → AlCl 3 + 3H 2 O
В основаниях действует как кислота Льюиса. Он восстанавливает гидроксид-ионы электронной пары. Другая реакция:
Al(OH) 3 + OH – → Al(OH) 4 –
Получение гидроксида алюминия
Процесс Байера используется для производства гидроксида алюминия, используемого в коммерческих целях. Его осуществляют растворением боксита в растворе едкого натра при температуре от 0 до 270°С. После удаления мусора раствору алюмината натрия дают выпасть в осадок. В результате образовавшийся осадок представляет собой гидроксид алюминия.
Его осуществляют растворением боксита в растворе едкого натра при температуре от 0 до 270°С. После удаления мусора раствору алюмината натрия дают выпасть в осадок. В результате образовавшийся осадок представляет собой гидроксид алюминия.
Прокаливание можно использовать для получения оксида алюминия или оксида алюминия из гидроксида алюминия.
Bayer Process Reactions
- First: Al 2 O 3 .2H 2 O + 2 NaOH → 2 NaAlO 2 + 3 H 2 O
- Second: NaAlO 2 + 2 H 2 O → Al(OH) 3 + NaOH
- Third : 2 Al(OH) 3 → Al2O 3 + 3 H 2 O
Физические свойства гидроксида алюминия
Ниже приведены физические характеристики гидроксида алюминия.
- Гидроксид алюминия встречается в виде белого аморфного порошка.

- Гидроксид алюминия имеет температуру плавления около 573К.
- Гидроксид алюминия нерастворим в воде, но растворим в щелочах и кислотах.
- Твердый гидроксид алюминия имеет плотность около 2,42 г/см 3 .
Химические свойства гидроксида алюминия
- Гидроксид алюминия является амфотерным веществом.
- Может действовать как кислота и как основание.
- Гидроксид алюминия в кислотах ведет себя как основание Бренстеда–Лоури.
- В результате нейтрализует кислотообразующую соль и воду, которые являются конечными результатами.
Использование гидроксида алюминия
- Гидроксид алюминия имеет ряд преимуществ, включая крупномасштабное производство, достаточные сырьевые ресурсы, превосходную чистоту продукта и хорошую растворимость в кислотах. В результате гидроксид алюминия можно использовать в качестве ключевого сырья при производстве солей алюминия, таких как алюминат бария, сульфат алюминия и др.

- Благодаря наполнителю, огнестойкости, дымоудалению и нетоксичности порошок гидроксида алюминия широко известен как подходящий огнезащитный наполнитель для пластмасс, ненасыщенных полиэфиров, каучука и других органических полимеров. Механизм антипирена гидроксида алюминия заключается в следующем: при температуре выше 200°С гидроксид алюминия начинает проводить эндотермический распад с выделением трехкристаллической воды, а скорость его разложения достигает максимума при 250°С.
- Гидроксид алюминия может быть преобразован в оксид алюминия, материал с хорошей термической химической стабильностью, термической прочностью, сопротивлением ползучести, диэлектрическими характеристиками и низким коэффициентом теплового расширения. Глинозем является важным ингредиентом в производстве керамики.
Мы можем регулировать фазовое развитие композита в процессе синтеза керамики, активируя гидроксид алюминия и управляя процессом кристаллизации. - Гидроксид алюминия встречается в воде в основном в форме Al(OH) 4 – , которые могут осаждать опасные тяжелые металлы в сточных водах методом соосаждения для очистки воды после дополнительной фильтрации.
 Гидроксид алюминия имеет большую удельную поверхность и может адсорбировать коллоиды, взвешенные частицы, красители и органические соединения из сточных вод.
Гидроксид алюминия имеет большую удельную поверхность и может адсорбировать коллоиды, взвешенные частицы, красители и органические соединения из сточных вод. - Гидроксид алюминия обладает способностью нейтрализовать желудочную кислоту и не токсичен, поэтому он постоянно используется в качестве традиционного лекарства для лечения желудка.
Использование гидроксида алюминия в качестве адъюванта также может повысить иммуногенность вакцины. Механизм действия следующий: гидроксид алюминия адсорбирует антиген на своей поверхности, позволяя антигену медленно высвобождаться, тем самым увеличивая эффективность. - Контролируя температуру, концентрацию и рН реагентов, мы можем получить множество целевых продуктов с различной площадью поверхности, объемом пор, структурой пор и кристаллической структурой, которые можно эффективно использовать в качестве носителя катализатора для гидрирование ненасыщенных карбонильных соединений и получение фуллеренов и других подобных соединений.

- Гидроксид алюминия имеет высокую белизну, сверхмалый размер частиц и полную кристаллическую форму, и он очень совместим с отбеливателями. Гидроксид алюминия в качестве дополнительного покрытия и смолы может значительно увеличить белизну, непрозрачность, гладкость и абсорбцию краски мелованной бумаги.
Примеры вопросов
Вопрос 1. Какова функция гидроксида алюминия?
Ответ:
Алюминий – природный металл. гидроксид алюминия является антацидом. гидроксид алюминия используется для лечения изжоги, дискомфорта в желудке, боли в желудке и кислотного расстройства желудка. гидроксид алюминия также используется для снижения уровня фосфатов у лиц с различными почечными заболеваниями.
Вопрос 2: Объясните важность геля гидроксида алюминия?
Ответ:
Гель гидроксида алюминия представляет собой суспензию аморфного гидроксида алюминия.
Частично заменители углерода присутствуют в форме минерального геля. Глицерин, масло перечной мяты, сахарин, сахароза и сорбит, помимо других ингредиентов, могут присутствовать в форме геля. Различные антибактериальные компоненты также могут присутствовать в соответствующих концентрациях в геле. Он в основном используется для лечения симптомов, вызванных избытком желудочной кислоты, таких как изжога, кислотное расстройство желудка и расстройство желудка. Это работает лучше, чем таблетки или капсулы. Осаждение этанольных растворов хлорида алюминия приводит к образованию геля, а также присутствуют первичные амины, такие как октиламин, пропиламин и додециламин.
Они действуют как акцепторы протонов во время гидролиза, позволяя происходить осаждению.
Вопрос 3: Безопасно ли использовать гидроксид алюминия в косметике?
Ответ:
Гидроксид алюминия — это искусственное вещество, которое действует как замутнитель.
Агент и абсорбент для покраски — два наиболее распространенных применения. Нет никаких доказательств того, что гидроксид алюминия вреден для кожи.
Вопрос 4: Вреден ли гидроксид алюминия?
Ответ:
Побочные эффекты гидроксида алюминия включают сильную боль в желудке или запор, потерю аппетита, трудности при мочеиспускании, мышечную слабость, усталость и чрезмерную сонливость.
Вопрос 5. Является ли гидроксид щелочного металла слабым основанием?
Ответ:
Гидроксид алюминия как химическое соединение имеет молекулярную формулу Al(OH)3…. В гидроксиде алюминия, например, гидроксид (ОН) может функционировать как слабое основание при взаимодействии с сильной кислотой, соляной кислотой (HCl). Слабым основанием считается такое основание, которое частично диссоциирует или отщепляется в растворе.
Вопрос 6: Почему гидроксид алюминия является кислотой?
Ответ:
Гидроксид алюминия нерастворим в воде и может растворяться только в основаниях и кислотах.
Ожидается, что гидроксид алюминия будет служить амфотерным материалом в воде.
Гидроксид алюминия действует как кислота, если присутствует сильное основание.
Вопрос 7: Что вызывает дефицит фосфатов в гидроксиде алюминия?
Ответ:
Гидроксид алюминия может вызвать дефицит фосфора у людей с низким содержанием фосфора в рационе путем взаимодействия с фосфатами с образованием нерастворимого фосфата алюминия.
Гидроксид алюминия — StatPearls — Книжная полка NCBI
Натаниэль Н. Шон; Трейси Ярбро; Анкур Д. Шах.
Информация об авторе
Последнее обновление: 12 июля 2022 г.
Непрерывное обучение
Гидроксид алюминия — это лекарство, используемое для лечения кислотного расстройства желудка. Он относится к классу антацидов. В этом упражнении описываются показания, действие и противопоказания для гидроксида алюминия как ценного средства при лечении кислотного расстройства желудка или местных ожогов. В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие отношение к членам медицинской бригады при лечении пациентов с кислотой. рефлюкс и связанные с ним состояния.
В этом упражнении будут освещены механизм действия, профиль нежелательных явлений и другие ключевые факторы (например, применение не по прямому назначению, дозировка, фармакодинамика, фармакокинетика, мониторинг, соответствующие взаимодействия), имеющие отношение к членам медицинской бригады при лечении пациентов с кислотой. рефлюкс и связанные с ним состояния.
Цели:
Определите механизм действия гидроксида алюминия.
Опишите побочные эффекты и противопоказания гидроксида алюминия.
Проверить токсичность гидроксида алюминия.
Опишите стратегии межпрофессиональной команды для улучшения координации ухода и коммуникации, чтобы надлежащим образом направить результаты для пациентов, получающих гидроксид алюминия.
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Показания
Гидроксид алюминия часто вводят перорально для временного облегчения изжоги или гастроэзофагеального рефлюкса. Его можно использовать местно, временно, для защиты и облегчения натертой и потертой кожи, незначительных ран и ожогов, а также раздражений кожи, возникающих в результате трения и трения. Пациенты также могут получать его для лечения вызванного химиотерапией орального мукозита в виде жидкости для полоскания рта.[2] Кроме того, он одобрен для использования в качестве адъюванта во многих вакцинах из-за его способности усиливать фагоцитоз и стимулировать иммунный ответ.[3] Он также одобрен для использования в широком спектре косметических продуктов в различных концентрациях.[4] Гидроксид алюминия также может служить фосфатсвязывающим средством у пациентов с хроническим заболеванием почек. Однако его использование таким образом нечасто из-за риска побочных эффектов. Обычно пероральный гидроксид алюминия представляет собой жидкий состав гидроксида алюминия и магния.
Его можно использовать местно, временно, для защиты и облегчения натертой и потертой кожи, незначительных ран и ожогов, а также раздражений кожи, возникающих в результате трения и трения. Пациенты также могут получать его для лечения вызванного химиотерапией орального мукозита в виде жидкости для полоскания рта.[2] Кроме того, он одобрен для использования в качестве адъюванта во многих вакцинах из-за его способности усиливать фагоцитоз и стимулировать иммунный ответ.[3] Он также одобрен для использования в широком спектре косметических продуктов в различных концентрациях.[4] Гидроксид алюминия также может служить фосфатсвязывающим средством у пациентов с хроническим заболеванием почек. Однако его использование таким образом нечасто из-за риска побочных эффектов. Обычно пероральный гидроксид алюминия представляет собой жидкий состав гидроксида алюминия и магния.
Механизм действия
Гидроксид алюминия [Al(OH)3] диссоциирует в желудке на Al3+ и OH-. Освобожденные гидроксидные группы затем связываются со свободными протонами, в конечном итоге образуя воду и нерастворимые соли алюминия, в основном Al(Cl)3, в желудке. Связывание протонов служит для повышения общего pH желудка, т. е. менее кислого, уменьшая симптомы несварения желудка. Произведенная соль алюминия в основном выводится с калом, при этом менее 1% биодоступного алюминия абсорбируется в желудочно-кишечном тракте.
Связывание протонов служит для повышения общего pH желудка, т. е. менее кислого, уменьшая симптомы несварения желудка. Произведенная соль алюминия в основном выводится с калом, при этом менее 1% биодоступного алюминия абсорбируется в желудочно-кишечном тракте.
Алюминий находится в организме в стационарном состоянии, поэтому организм справляется с кратковременным увеличением поглощения алюминия при использовании в качестве антацида с эквивалентным увеличением экскреции немодифицированного алюминия с мочой. Тем не менее, уставка этого равновесного состояния может повышаться при длительном повышенном потреблении алюминия, поэтому лечение гидроксидом алюминия не следует рассматривать как долгосрочное решение для пациентов, страдающих кислотным расстройством желудка. Кроме того, пациенты с хроническим заболеванием почек могут быть не в состоянии выводить из организма повышенное количество алюминия, и поэтому их также следует тщательно обследовать.
Гидроксид алюминия для местного применения создает кислый гидрофильный слой на области раздражения; это служит защитным барьером для предотвращения инфекции и сдерживания роста бактерий в ране.
Известно, что в качестве адъюванта в вакцинах гидроксид алюминия усиливает фагоцитоз макрофагов, возможно, за счет активации NLRP3-инфламмасомы, увеличивая поглощение желаемого антигена. Кроме того, известно, что он способствует так называемому «репозиторному эффекту», при котором антигены агрегируют на молекуле и вокруг нее, что помогает предотвратить их деградацию в организме.
Введение
Гидроксид алюминия при использовании в качестве антацида следует вводить перорально. Хорошо встряхните суспензию гидроксида алюминия перед использованием. Его следует принимать 5–6 раз в день после еды и перед сном, не превышая 3,84 г в сутки. Пациент должен следить за дозой с потреблением воды.
Гидроксид алюминия для местного применения следует нанести на желаемую область и оставить на месте. Алюминий для местного применения имеет минимальную абсорбцию через кожу, поэтому местное лечение гидроксидом алюминия может потребовать повторного применения по мере необходимости.
Применение гидроксида алюминия в качестве антацида не должно применяться для длительного лечения симптомов пациента. Точно так же гидроксид алюминия не следует назначать пациентам с почечной недостаточностью. В этих случаях повышенное содержание алюминия может вызвать более серьезные побочные эффекты или привести к истощению запасов фосфатов в организме.[4]
Побочные эффекты
Основные побочные эффекты гидроксида алюминия включают гипомагниемию, гипофосфатемию, запор и анемию.[5] Кроме того, из-за его способности стимулировать иммунную систему наблюдались случаи персистирующих гранулем в месте инъекции вакцин, содержащих гидроксид алюминия.[7] Местное применение не продемонстрировало каких-либо побочных эффектов, прежде всего потому, что гидроксид алюминия не всасывается через эпидермис.[4]
Противопоказания
Гидроксид алюминия противопоказан пациентам с подтвержденной повышенной чувствительностью к препарату. Длительное введение не следует рассматривать у пациентов с почечной недостаточностью или у пациентов, находящихся на диализе, поскольку нарушение клиренса избыточного алюминия может ускорить побочные эффекты препарата [4]. Из-за способности гидроксида алюминия связывать фосфаты его не следует назначать пациентам с тяжелой диареей, так как может усугубиться гипофосфатемия. Кроме того, введение гидроксида алюминия перед применением фторхинолонов, таких как ципрофлоксацин, продемонстрировало снижение биодоступности противомикробного препарата, снижая его эффективность. Таким образом, его нельзя назначать одновременно с этими препаратами. Однако пациент может значительно смягчить этот эффект, если гидроксид алюминия будет введен по крайней мере через два часа после противомикробного препарата.][10] Из-за того, что он является подщелачивающим средством, его также не следует назначать одновременно с препаратами, зависящими от кислотной абсорбции, такими как риоцигуат или ралтегравир, поскольку это снижает эффективность этих методов лечения.[11][12]
Из-за способности гидроксида алюминия связывать фосфаты его не следует назначать пациентам с тяжелой диареей, так как может усугубиться гипофосфатемия. Кроме того, введение гидроксида алюминия перед применением фторхинолонов, таких как ципрофлоксацин, продемонстрировало снижение биодоступности противомикробного препарата, снижая его эффективность. Таким образом, его нельзя назначать одновременно с этими препаратами. Однако пациент может значительно смягчить этот эффект, если гидроксид алюминия будет введен по крайней мере через два часа после противомикробного препарата.][10] Из-за того, что он является подщелачивающим средством, его также не следует назначать одновременно с препаратами, зависящими от кислотной абсорбции, такими как риоцигуат или ралтегравир, поскольку это снижает эффективность этих методов лечения.[11][12]
Мониторинг
При назначении гидроксида алюминия в качестве антацида пациенту следует контролировать концентрацию кальция и фосфата в плазме. Функция почек также требует контроля, особенно при длительном применении гидроксида алюминия.
Токсичность
Судороги, остеомаляция и энцефалопатия являются хорошо задокументированными токсическими эффектами гидроксида алюминия. Пациентов следует расспросить о любых проблемах с почками перед введением гидроксида алюминия, поскольку эти результаты тесно связаны с использованием гидроксида алюминия в качестве фосфатсвязывающего средства у пациентов, находящихся на диализе.[7] Большинство сообщений об энцефалопатии и остеомаляции поступило из периода, когда стандарты очистки воды для диализа не были такими строгими, как сейчас, что, вероятно, искажает связь перорального алюминия с токсичностью. Реверсирование токсичности гидроксида алюминия происходит при прекращении приема препарата. Местные вакцины на основе гидроксида алюминия и адъювантные вакцины на основе гидроксида алюминия не показали каких-либо токсических эффектов, в первую очередь из-за небольшой концентрации, связанной с обоими применениями.
Улучшение результатов работы команды здравоохранения
Управление назначением пациентам гидроксида алюминия в качестве антацида требует межпрофессиональной группы медицинских работников, в которую входят медсестра, лаборанты, фармацевты, социальные работники и несколько врачей разных специальностей. После постановки диагноза заболевания, поддающегося лечению гидроксидом алюминия, такого как изжога, необходимо установить, есть ли у пациента какие-либо факторы риска или противопоказания к применению гидроксида алюминия.
После постановки диагноза заболевания, поддающегося лечению гидроксидом алюминия, такого как изжога, необходимо установить, есть ли у пациента какие-либо факторы риска или противопоказания к применению гидроксида алюминия.
Рекомендации по увеличению успешных результатов антацидной терапии гидроксидом алюминия
Прекратить прием гидроксида алюминия у пациентов с почечной недостаточностью.
Не вводите гидроксид алюминия одновременно с противомикробными препаратами, такими как фторхинолоны.
Избегайте использования антацидов у пациентов, принимающих лекарства, правильное всасывание которых зависит от кислой природы желудка.
Назначать гидроксид алюминия для временного использования, а не для длительного лечения
Прекратить прием гидроксида алюминия при использовании в качестве антацида, если у пациента развивается тяжелая диарея
Врач и медсестры должны наблюдать за пациентом и сообщать о неблагоприятных результатах к команде. Фармацевты также могут проконсультировать пациента относительно дозирования и правильного применения лекарственных форм для местного применения. Фармацевт также должен проверить лекарственные взаимодействия. Об осложнениях или проблемах с терапией следует сообщать медицинской бригаде. Все практикующие врачи должны быть осведомлены о потенциальных проблемах при длительном применении и соответствующим образом консультировать и направлять пациентов, особенно при нарушении функции почек. Межпрофессиональный мониторинг пациентов, принимающих гидроксид алюминия, приведет к лучшим результатам. [Уровень 5]
Фармацевты также могут проконсультировать пациента относительно дозирования и правильного применения лекарственных форм для местного применения. Фармацевт также должен проверить лекарственные взаимодействия. Об осложнениях или проблемах с терапией следует сообщать медицинской бригаде. Все практикующие врачи должны быть осведомлены о потенциальных проблемах при длительном применении и соответствующим образом консультировать и направлять пациентов, особенно при нарушении функции почек. Межпрофессиональный мониторинг пациентов, принимающих гидроксид алюминия, приведет к лучшим результатам. [Уровень 5]
Контрольные вопросы
Доступ к бесплатным вопросам с несколькими вариантами ответов по этой теме.
Комментарий к этой статье.
Ссылки
- 1.
Марголис Д.Дж., Льюис В.Л. Литературная оценка использования различных местных агентов, факторов роста и кожных эквивалентов для лечения пролежней. Дерматол Хирург.
 1995 г., 21 февраля (2): 145-8. [PubMed: 7894932]
1995 г., 21 февраля (2): 145-8. [PubMed: 7894932]- 2.
Чан А., Игноффо Р.Дж. Обзор растворов для местного применения для лечения химиоиндуцированного орального мукозита. Дж. Онкол Фарм Практ. 2005 г., декабрь 11(4):139-43. [PubMed: 16595065]
- 3.
He P, Zou Y, Hu Z. Успехи в исследованиях адъювантов на основе гидроксида алюминия и их механизма. Hum Вакцина Иммунотер. 2015;11(2):477-88. [Бесплатная статья PMC: PMC4514166] [PubMed: 25692535]
- 4.
Becker LC, Boyer I, Bergfeld WF, Belsito DV, Hill RA, Klaassen CD, Liebler DC, Marks JG, Shank RC, Slaga TJ, Снайдер П.В., Андерсен Ф.А. Оценка безопасности глинозема и гидроксида алюминия при использовании в косметике. Int J Toxicol. 2016 ноябрь; 35 (3 исп): 16S-33S. [В паблике: 27913785]
- 5.
Willhite CC, Karyakina NA, Yokel RA, Yenugadhati N, Wisniewski TM, Arnold IM, Momoli F, Krewski D. Систематический обзор потенциальных рисков для здоровья, связанных с фармацевтическим, профессиональным и потребительским воздействием металлических и наноразмерный алюминий, оксиды алюминия, гидроксид алюминия и его растворимые соли.
 Критический преподобный Toxicol. 2014 окт;44 Приложение 4:1-80. [Статья бесплатно PMC: PMC4997813] [PubMed: 25233067]
Критический преподобный Toxicol. 2014 окт;44 Приложение 4:1-80. [Статья бесплатно PMC: PMC4997813] [PubMed: 25233067]- 6.
Hogenesch H. Механизм иммунопотенцирования и безопасность алюминиевых адъювантов. Фронт Иммунол. 2012;3:406. [Бесплатная статья PMC: PMC3541479] [PubMed: 23335921]
- 7.
Krewski D, Yokel RA, Nieboer E, Borchelt D, Cohen J, Harry J, Kacew S, Lindsay J, Mahfouz AM, Rondeau V. Оценка риска для здоровья человека от алюминия , оксид алюминия и гидроксид алюминия. J Toxicol Environ Health B Crit Rev. 2007;10 Suppl 1:1-269. [Бесплатная статья PMC: PMC2782734] [PubMed: 18085482]
- 8.
Гольпер Т.А., Хартштейн А.И., Мортленд В.Х., Кристенсен Дж.М. Влияние антацидов и времени пребывания в диализате на фармакокинетику многократных доз перорального ципрофлоксацина у пациентов, находящихся на постоянном амбулаторном перитонеальном диализе. Противомикробные агенты Chemother. 1987 ноября; 31 (11): 1787-90.
 [Бесплатная статья PMC: PMC175040] [PubMed: 3435126]
[Бесплатная статья PMC: PMC175040] [PubMed: 3435126]- 9.
Frost RW, Lasseter KC, Noe AJ, Shamblen EC, Lettieri JT. Влияние антацидов гидроксида алюминия и карбоната кальция на биодоступность ципрофлоксацина. Противомикробные агенты Chemother. 1992 г., апрель; 36 (4): 830-2. [Статья бесплатно PMC: PMC189440] [PubMed: 1503446]
- 10.
Arayne MS, Sultana N, Hussain F. Взаимодействие между ципрофлоксацином и антацидами — исследования растворения и адсорбции. Взаимодействие с наркотиками. 2005;21(2):117-29. [PubMed: 16355977]
- 11.
Кришна Р., Ист Л., Ларсон П., Валиатан С., Баттерфилд К., Тенг Ю., Эрнандес-Иллас М. Влияние антацидов с катионами металлов на фармакокинетику 1200 мг ралтегравира. Дж Фарм Фармакол. 2016 ноябрь;68(11):1359-1365. [PubMed: 27671833]
- 12.
Becker C, Frey R, Unger S, Artmeier-Brandt U, Weimann G, Mück W. Влияние омепразола и гидроксида алюминия/гидроксида магния на абсорбцию риоцигуата.





 5. Слайд №7 Физические свойства алюминия. ( Работа в парах)
5. Слайд №7 Физические свойства алюминия. ( Работа в парах)
 Al(OH)3+ NaOHизб → NaAlO2 + 2H2O
Al(OH)3+ NaOHизб → NaAlO2 + 2H2O 3 – 5, стр.187
3 – 5, стр.187  Поэтому его необходимо удалить в процессе диализа.
Поэтому его необходимо удалить в процессе диализа.




 Гидроксид алюминия имеет большую удельную поверхность и может адсорбировать коллоиды, взвешенные частицы, красители и органические соединения из сточных вод.
Гидроксид алюминия имеет большую удельную поверхность и может адсорбировать коллоиды, взвешенные частицы, красители и органические соединения из сточных вод.
 Частично заменители углерода присутствуют в форме минерального геля. Глицерин, масло перечной мяты, сахарин, сахароза и сорбит, помимо других ингредиентов, могут присутствовать в форме геля. Различные антибактериальные компоненты также могут присутствовать в соответствующих концентрациях в геле. Он в основном используется для лечения симптомов, вызванных избытком желудочной кислоты, таких как изжога, кислотное расстройство желудка и расстройство желудка. Это работает лучше, чем таблетки или капсулы. Осаждение этанольных растворов хлорида алюминия приводит к образованию геля, а также присутствуют первичные амины, такие как октиламин, пропиламин и додециламин.
Частично заменители углерода присутствуют в форме минерального геля. Глицерин, масло перечной мяты, сахарин, сахароза и сорбит, помимо других ингредиентов, могут присутствовать в форме геля. Различные антибактериальные компоненты также могут присутствовать в соответствующих концентрациях в геле. Он в основном используется для лечения симптомов, вызванных избытком желудочной кислоты, таких как изжога, кислотное расстройство желудка и расстройство желудка. Это работает лучше, чем таблетки или капсулы. Осаждение этанольных растворов хлорида алюминия приводит к образованию геля, а также присутствуют первичные амины, такие как октиламин, пропиламин и додециламин.  Агент и абсорбент для покраски — два наиболее распространенных применения. Нет никаких доказательств того, что гидроксид алюминия вреден для кожи.
Агент и абсорбент для покраски — два наиболее распространенных применения. Нет никаких доказательств того, что гидроксид алюминия вреден для кожи. Ожидается, что гидроксид алюминия будет служить амфотерным материалом в воде.
Ожидается, что гидроксид алюминия будет служить амфотерным материалом в воде. 1995 г., 21 февраля (2): 145-8. [PubMed: 7894932]
1995 г., 21 февраля (2): 145-8. [PubMed: 7894932] Критический преподобный Toxicol. 2014 окт;44 Приложение 4:1-80. [Статья бесплатно PMC: PMC4997813] [PubMed: 25233067]
Критический преподобный Toxicol. 2014 окт;44 Приложение 4:1-80. [Статья бесплатно PMC: PMC4997813] [PubMed: 25233067] [Бесплатная статья PMC: PMC175040] [PubMed: 3435126]
[Бесплатная статья PMC: PMC175040] [PubMed: 3435126]