Лабораторная работа №2. Моделирование построения Периодической системы Д.И. Менделеева
§18. Неметаллы: атомы и простые вещества. Кислороду озон, воздух. (стр. 129-135)
§19. Водород. (стр. 136-142)
Вопросы к параграфу:
1; 2; 3; 4; 5;Лабораторный опыт:
№19;§20. Вода. (стр. 143-152)
§21. Вода в жизни человека. (стр. 152-159)
§22. Галогены. (стр. 159-167)
§23. Соединения галогенов. (стр. 167-173)
Вопросы к параграфу:
1; 2; 3; 4;Лабораторный опыт:
№26;§24. Получение галогенов. Биологическое значение и применение галогенов и их соединений. (стр. 173-180)
§25. Кислород. (стр. 180-188)
Лабораторный опыт:
№27;§26. Сера. (стр. 188-195)
Вопросы к параграфу:
1; 2; 3; 4; 5;Лабораторный опыт:
№28;§27. Соединения серы. (стр. 195-204)
Лабораторный опыт:
№29;§28. Азот. (стр. 204-209)
Вопросы к параграфу:
1; 2; 3; 4; 5;§29. Аммиак. (стр. 210-216)
Лабораторный опыт:
№30;§30. Соли аммония. (стр. 216-219)
Вопросы к параграфу:
1; 2; 3; 4; 5;Лабораторный опыт:
№31;§31. Кислородные соединения азота. (стр. 220-225)
§32. Фосфор и его соединения. (стр. 225-232)
§33. Углерод. (стр. 232-241)
Лабораторный опыт:
№36;§34. Кислородные соединения углерода. (стр. 242-249)
§35. Кремний и его соединения. (стр. 249-265)
Вопросы к параграфу:
1; 2; 3; 4;Лабораторный опыт:
№40;Темы для дискуссии::
1; 2; 3;gdzplus.me
Учебно-методическое пособие по химии по теме: Моделирование построения Периодической таблицы.
Лабораторная работа№1.
«Моделирование построения Периодической таблицы химических элементов Д.И. Менделеева».
Цель: изучение s, p,d, f элементов на основании их положения в Периодической системе, моделирование Периодической системы.
Оборудование: Периодическая система химических элементов Д.И. Менделеева, рисунки строения s, p,d, f элементов.
Ход работы:
- Строение s, p,d, f элементов и их положение в Периодической системе.
Существует 4 типа орбиталей : s, p,d, f .
s – орбитали имеют сферическую форму;
p- орбитали имеют форму гантели;
d – орбитали имеют форму листа клевера;
f – орбитали – форму шести лепестного цветка.
Каждую орбиталь могут занимать 2 электрона. Следовательно, максимальное число электронов, которые могут находиться на первом уровне равно двум.
N=2 n2 ,
где n-номер энергетического уровня, N-максимальное число электронов на этом уровне. На втором -8 ( 2 – на s – орбитали и 6 на р- орбитали). На третьем — 18 электронов (2 на s, 6 на р, 10 на d и 14 на f). В зависимости от того, на какую орбиталь отправлен последний электрон, химические элементы можно разделить на семейства (блоки): s, p,d, f .
К s-элементам относятся элементы I и II групп главных подгрупп, а также гелий.
К р- элементам относятся элементы III и VIII групп главных подгрупп.
К d- элементам относятся элементы побочных подгрупп.
К f — элементам относятся лантаноиды и актиноиды.
Деление Периодической таблицы на блоки.
s- облако р-облако d -облако
Задание:
1) Написать электронную формулу атома кислорода, магния и фосфора.
2) К каким элементам они относятся и где располагаются в Периодической таблице Д.И. Менделеева?
3) Какое максимальное количество электронов может находиться в IV периоде таблицы Д.И. Менделеева?
4) Сделайте вывод.
nsportal.ru
Лабораторная работа №1 «Моделирование построения Периодической таблицы химических элементов»
Лабораторная работа №1
«Моделирование построения Периодической таблицы химических элементов»
Цели работы
научиться видеть, что Периодическая таблица химических элементов – графическое отображение периодического закона.
рассмотреть структуру периодической таблицы: периоды (малые и большие), группы (главная и побочная).
уметь определять строение электронных оболочек атомов элементов малых периодов по положению хим. элемента в ПС.
Порядок выполнения работы:
Запустите модуль «Периодические закономерности в строении атомов».
Выполните задания, ответ зафиксируйте в рабочую тетрадь.
Закройте модуль и откройте «Состав атомных ядер». Также потренируйтесь в определении числа протонов и числа нейтронов (5-7 элем.). Завершите работу.
Откройте следующий модуль «Характеристика элемента металла».
Выполните задания по приведенной ниже схеме, по ходу выполнения работы делайте записи в рабочую тетрадь.

Вносить данные вместо пропусков можно с помощью клавиатуры, в некоторых случаях необходимо будет переключаться на английский язык.

Перед тем, как перейти к следующему пункту необходимо зарисовать в тетради схему электронной конфигурации атома и заполнить ее
5s5p
5d
5f
4s
4p
4d
4f
3s
3p
3d
2s
2p
1s
Пояснение: вместо пропуска
После выполнения всех заданий закройте модуль и откройте «Характеристика элемента неметалла».
По указанному выше образцу проведите характеристику выбранного элемента
Оформите отчет, сдайте тетрадь на проверку.
infourok.ru
Лабораторная работа «Моделирование построения ПСХЭ»
Лабораторная работа №1
«Моделирование построения Периодической таблицы химических элементов»
Цель работы: научиться видеть, что Периодическая таблица химических элементов – графическое отображение периодического закона.
Задачи:
рассмотреть структуру периодической таблицы: периоды (малые и большие), группы (главная и побочная).
уметь определять строение электронных оболочек атомов элементов малых периодов и особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов) по положению хим. элемента в ПС.
Краткие теоретические сведения
Периодический закон открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс. Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса»
Данные о строении ядра и о распределении электронов в атомах позволяют рассмотреть периодический закон и периодическую систему элементов с фундаментальных физических позиций. На базе современных представлений периодический закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Закономерности ПСХЭ Д. И. Менделеева
Рис.1
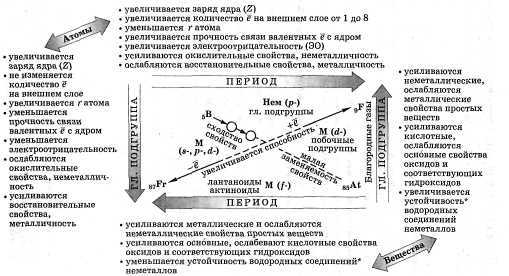
Оборудование: ПСХЭ Д. И. Менделеева
ЗАДАНИЕ: Дать характеристику химических элементов с № 3 по № 20 (по выбору преподавателя) по плану.
ПЛАН ХАРАКТЕРИСТИКИ ХИМ. ЭЛЕМЕНТА
ПО ПЕРИОДИЧЕСКОЙ СИСТЕМЕ Д.И. МЕНДЕЛЕЕВА.
1. Положение элемента в периодической системе:
порядковый номер
период, ряд
группа, подгруппа
относительная атомная масса
2. Строение атома элемента:
заряд ядра атома
формула состава атома (количество р; n; е )
количество энергетических уровней и размещение на них электронов
графическая формула
число электронов на последнем слое => металл или неметалл
3. Формулы соединений:
оксида
гидроксида (кислоты или основания)
4. Химический характер, его доказательство:
а) кислотный: кислотный оксид + щелочь = соль + вода; кислота + основание = соль + вода
б) основной: основной оксид + кислота = соль + вода; основание + кислота = соль + вода
в) амфотерный (а + б)
5. Запишите сведения по двум химическим элементам в таблицу.
Таблица 1.
Строение атома элемента
Формулы соединений
Химический характер
№1.…
№2…
Сформулируйте выявленную вами закономерность в виде закона.Вопросы для выводов
Почему формулировка ПЕРИОДИЧЕСКОГО ЗАКОНА (Д. И. Менделеева) была изменена?
Контрольные вопросы
Как изменяются неметаллические свойства элементов в периодах периодической системы?
Как определяется принадлежность химического элемента к тому или иному электронному семейству?
Что такое «провал» электрона? Приведите примеры элементов, у которых это явление наблюдается, запишите их электронные формулы.
infourok.ru
9. Содержание отчета
9.1. Наименование и цель работы.
9.2. Выполненное задание (результаты моделирования, наблюдения, выводы)
9.3. Ответы на контрольные вопросы.
10. Контрольные вопросы.
1. Запишите общую формулу аминокислот.
2. Дайте определения аминокислоты, реакции поликонденсации, пептидной связи.
3.Какие вещества называют аминами?
4.Какие модели молекулы метиламина изображены на рисунке:
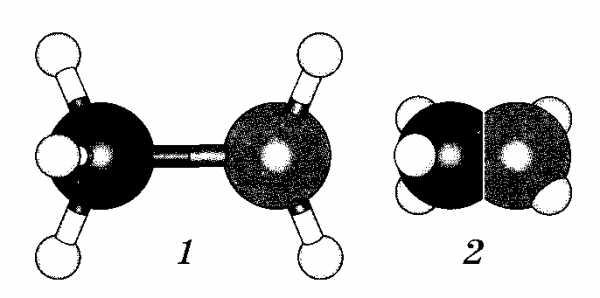
6.
7.
8.Запишите определения: пластмассы, волокна.
9.
10. Даны вещества, формулы которых:
11.
Практическая работа №1
Моделирование построения Периодической таблицы химических элементов
Цель работы
Изучить моделирование построения периодической таблицы химических элементов.
Подготовка к работе
Изучить материал по указанной литературе.
Ответить на контрольные вопросы.
Литература: 1.конспекты по химии;
2. Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для обще- образоват. учреждений.- М.,2009,стр. 10-11;13-19.
Перечень необходимых материалов
Программа «Виртуальная химическая лаборатория».
Задание
Используя методические указания и программу «Виртуальная химическая лаборатория» изучить моделирование построения периодической таблицы химических элементов.
Порядок выполнения работы
Получить допуск к работе.
Выполнить задание.
Методические указания
Запустить программу Виртуальная химическая лаборатория.
Получить допуск к работе. Для этого навести курсор правой кнопкой мыши на панель «Коллекция» и выбрать заголовок «Правила выживания в химической лаборатории».
Далее перейти к изучению оборудования химической лаборатории.
Навести курсор правой кнопкой мыши на панель «Коллекция» и выбрать заголовок «Периодический закон Д.И. Менделеева». Изучить все подзаголовки находящиеся в заголовке «Периодический закон Д.И. Менделеева».
Навести курсор правой кнопкой мыши на панель «Таблицы» и выбрать строку 1 « Периодическая система элементов Д.И. Менделеева». Рассмотреть таблицу.
Оформить отчет о проделанной работе.
7. Содержание отчета
7.1. Наименование и цель работы.
7.2. Ответы на контрольные вопросы.
8. Контрольные вопросы.

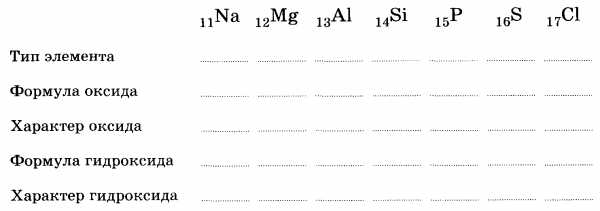
2. Какие предпосылки послужили основой открытия Периодического закона?
3. Как был открыт Периодический закон?
4. Как изменялась формулировка Периодического закона по мере развития науки?
5. Запишите современную формулировку периодического закона.
6.
7.
8.Дайте характеристику элемента серы по его положению в Периодической системе Д.И. Менделеева.
Практическая работа №2
Решение экспериментальных задач
Цель работы
Научиться решать экспериментальные задачи по теме «Металлы и Неметаллы».
Подготовка к работе
Изучить материал по указанной литературе.
Выполнить задания.
Оформить отчет о проделанной работе.
Литература: 1.конспекты по химии;
2. Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для обще- образоват. учреждений.- М.,2009,стр. 164 – 180.
4. Задания
4.1. Нержавеющая (легированная) сталь содержит 8% хрома и 18% никеля.Рассчитайте количество (моль) хрома и никеля, содержащихся в образце нержавеющей стали массой 100 г.
4.2. Образец латуни массой 10 г обработали избытком разбавленного раствора серной кислоты. При этом выделилось 1,1 л (н.у.) газа. Определите массовые доли цинка и меди в сплаве.
4.3. Железную пластинку массой 10 г погрузили в раствор сульфата меди (II). Рассчитайте массу выделившейся меди, если в реакцию вступило 5,6 г железа. Во сколько раз изменится (увеличится или уменьшится) масса металлической пластинки по окончании реакции?
4.4. Найдите и исправьте ошибки в уравнениях: 4.5. Исправьте ошибки:
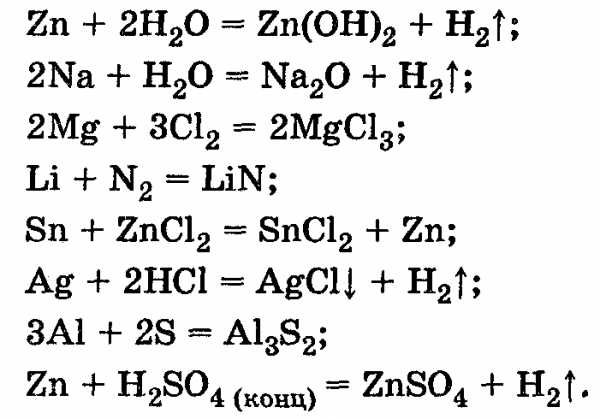
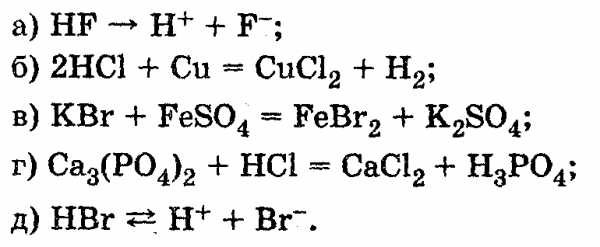
studfiles.net
| Сначала идите на рабочее место gemba На первом этапе Вам предлагается практическое знакомство с действием «Периодической таблицы элементов управления, экономики, качества»,… | Инструкция по эксплуатации и подготовки. Подготовка бочек для напитков Запрещено: Заливка и выдержка медовухи, мёда, жидкости с красителями и с содержанием химических элементов которые пагубно влияют… | ||
| Составление таблицы исторических элементов постижерных изделий. Сравнительная… Цель: Изучить историю развития постижерного дела, возникновение парика. Составить таблицу исторических элементов постижерных изделий…. | Практическая работа «Построение диаграмм различных типов» Цели работы: закрепить практические навыки построения диаграммы по данным электронной таблицы | ||
| Физическое моделирование технологического процесса формообразования… | Инструкция по действиям при угрозе и совершении террористической… В мире известно более 6 млн химических веществ. Из этого количества на производстве и в быту человека окружает более сотни аварийно-химических… | ||
| Методическая разработка открытого урока по выполнению практической… Развивать навыки оформления учебной документации, в частности расчетов по практической работе | Тема: Углерод Используя Периодическую систему химических элементов Д. И. Менделеева, охарактеризуйте химический элемент углерод по плану | ||
| Площадь кабинета, оборудование Классная доска -1, магнитная доска; шкафы; стенды экспозиционные «периодическая система химических элементов Д. И. Менделеева» | Аэрограф мини с набором Инструкция по эксплуатации Аэрограф – не игрушка! Прежде чем начать демонтаж каких-либо элементов аэрографа, отсоедините его от источника сжатого воздуха. Соблюдайте… | ||
| Руководство пользователя оператора связи. Информационная система… Сортировка элементов таблицы по значениям выбранного столбца согласно заданному типу сортировки 31 | Должностная инструкция Механик училища в своей практической работе руководствуется приказами, положениями органов образования, Гостехнадзора и гибдд, а… | ||
| Инструкция по созданию страницы портфолио. Страница портфолио имеет… Возможность редактирования портфолио подключается администратором (klesnk), поэтому необходимо отправить сообщение через сайт или… | Bandar abbas 4×350 mw steam power plant Том 4/1: Таблицы данных по производительности, Таблицы с технической информацией (тепломеханическое и прочее оборудование) | ||
| П. Д. Киселев моделирование движения бесконечной цепи тел Направление подготовки бакалавров: 010800 Механика и математическое моделирование | Тема: информационные технологии, документация по программному обеспечению Названия элементов интерфейса (флажки, кнопки и т п.) переведенные или непереведенные проверять и исправлять не надо. Скопируйте… |
rykovodstvo.ru
Методические указания к лабораторным работам по учебному предмету «Химия»
Введение.
Настоящий комплект лабораторных работ предназначен в качестве методического пособия при проведении лабораторных работ по программе дисциплины «Химия», утвержденной для специальностей:
13.02.01 Тепловые электрические станции
13.02.03 Электрические станции, сети и системы
Выполнение лабораторных работ по дисциплине «Химия» обеспечивает достижение студентами следующих результатов:
личностных:
— чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
— готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное
осознание роли химических компетенций в этом;
— умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
метапредметных:
— использование различных видов познавательной деятельности и основных интеллектуальных операций (постановка задачи, формулирование гипотез, анализ и синтез, сравнение, обобщение, систематизация, выявление причинно-следственных связей, поиск аналогов, формулирование выводов) для решения поставленной задачи, применение основных методов познания (наблюдение, научный эксперимент) для изучения различных сторон химических объектов и процессов, с которыми возникает необходимость сталкиваться в профессиональной сфере;
— использование различных источников для получения химической информации, умение оценить её достоверность для достижения хороших результатов в профессиональной сфере;
предметных:
— сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач;
— владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой;

— владение основными методами научного познания, используемыми в химии: наблюдение, описание, измерение, эксперимент; умение обрабатывать,объяснять результаты проведённых опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
— сформированность умения давать количественные оценки и проводить расчёты по химическим формулам и уравнениям;
— владение правилами техники безопасности при использовании химических веществ;
— сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
Лабораторная работа №1
«Моделирование построения Периодической таблицы химических элементов»
Цели работы:
— научиться видеть, что Периодическая таблица химических элементов – графическое отображение периодического закона.
— рассмотреть структуру периодической таблицы: периоды (малые и большие), группы (главная и побочная).
— уметь определять строение электронных оболочек атомов элементов малых периодов и особенности строения электронных оболочек атомов элементов больших периодов (переходных элементов) по положению хим. элемента в ПС.
Краткие теоретические сведения.
Периодический закон открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс.
Термин «периодический закон» Менделеев впервые употребил в ноябре 1870, а в октябре 1871 дал окончательную формулировку Периодического закона: «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Графическим (табличным) выражением периодического закона является разработанная Менделеевым периодическая система элементов.
Несмотря на всю огромную значимость такого открытия, периодический закон и система Менделеева представляли лишь гениальное эмпирическое обобщение фактов, а их физический смысл долгое время оставался непонятным. Причина этого заключалась в том, что в XIX в. совершенно отсутствовали какие-либо представления о сложности строения атома.
Данные о строении ядра и о распределении электронов в атомах позволяют рассмотреть периодический закон и периодическую систему элементов с фундаментальных физических позиций.
На базе современных представлений периодический закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Весь материал — в документе.
videouroki.net
