Хлорид серебра, характеристика, свойства и получение, химические реакции
Хлорид серебра, характеристика, свойства и получение, химические реакции.
Поделиться в:
Хлорид серебра – неорганическое вещество, имеет химическую формулу AgCl.
Краткая характеристика хлорида серебра
Физические свойства хлорида серебра
Получение хлорида серебра
Химические свойства хлорида серебра
Химические реакции хлорида серебра
Применение и использование хлорида серебра
Краткая характеристика хлорида серебра:
Хлорид серебра – неорганическое вещество белого цвета. При плавлении становится оранжево-желтым. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Химическая формула хлорида серебра AgCl.
Хлорид серебра – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и серебра, бинарное соединение серебра и хлора.
Практически не растворяется в воде, ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
Негорюч. Пожаробезопасен.
В расплавленном виде хорошо пристает к стеклу, кварцу и металлам.
Хлорид серебра встречается в природе в виде минерала хлораргирита.
Физические свойства хлорида серебра:
| Наименование параметра: | Значение: |
| Химическая формула | AgCl |
| Синонимы и названия иностранном языке | silver chloride (англ.) серебро хлористое (рус.) хлораргирит (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые кубические кристаллы |
| Цвет | белый, при плавлении становится оранжево-желтым |
| Вкус | —* |
| Запах | без запаха |
Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм. ) ) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5560 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,56 |
| Температура кипения, °C | 1550 |
| Температура плавления, °C | 455 |
| Молярная масса, г/моль | 143,32 |
| Растворимость в воде (10 oС), г/100 г | 0,00009 |
Получение хлорида серебра:
Хлорид серебра получают в результате следующих химических реакций:
- 1. взаимодействия нитрата серебра и хлорида калия:
AgNO3 + KCl → AgCl + KNO3.
В ходе реакции используется разбавленный раствор хлорида калия.
- 2. взаимодействия нитрата серебра и хлорида натрия:
AgNO3 + NaCl → AgCl + NaNO3.
В ходе реакции используется разбавленный раствор хлорида натрия.
- 3. взаимодействия нитрата серебра и хлорида кальция:
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl.
- 4. взаимодействия серебра и хлорида железа (III):
Ag + FeCl3 → AgCl + FeCl2.
- 5. взаимодействия серебра и хлора:
2Ag + Cl2 → 2AgCl (t = 150-200 °C).
Химические свойства хлорида серебра. Химические реакции хлорида серебра:
Химические свойства хлорида серебра аналогичны свойствам хлоридов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида серебра и фтора:
2AgCl + 2F2 → 2AgF2 + Cl2.
В результате реакции образуются фторид серебра (II) и хлор.
2. реакция взаимодействия хлорида серебра и цинка:
2AgCl + Zn = ZnCl2 + 2Ag.
В результате реакции образуются хлорид цинка и серебро.
3. реакция взаимодействия хлорида серебра и оксида бария:
4AgCl + 2BaO → 2BaCl2 + 4Ag + O2 (t > 324°C).
В результате реакции образуются хлорид бария, серебро и кислород.
4. реакция взаимодействия хлорида серебра и гидроксида калия:
4AgCl + 4KOH → 4KCl + 4Ag + O2 + 2H2O (t > 450 °C).
В результате реакции образуются хлорид калия, серебро, кислород и вода.
5. реакция взаимодействия хлорида серебра и сульфида натрия:
2AgCl + Na2S → Ag2S + 2NaCl.
В результате реакции образуются сульфид серебра (II) и хлорид натрия.
6. реакция взаимодействия хлорида серебра и йодида натрия:
AgCl + NaI ⇄ AgI + NaCl.
В результате реакции образуются йодид серебра и хлорид натрия.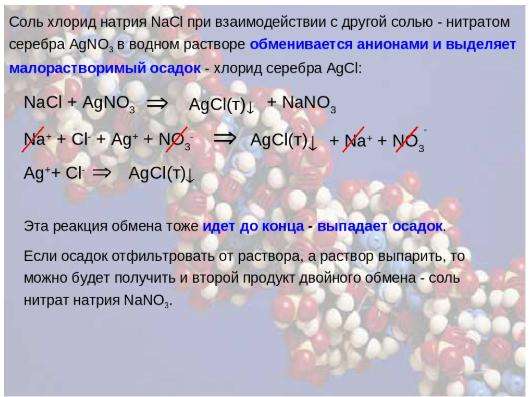 Реакция носит обратимый характер.
Реакция носит обратимый характер.
7. реакция взаимодействия хлорида серебра и карбоната натрия:
4AgCl + 2Na2CO3 → 4Ag + 4NaCl + 2CO2 + O2 (t = 850-900 °C).
В результате реакции образуются серебро, хлорид натрия, оксид углерода (IV) и кислород.
8. реакция взаимодействия хлорида серебра и нитрата бария:
2AgCl + Ba(NO3)2 → BaCl2 + 2AgNO3 (kat = NH3).
В результате реакции образуются хлорид бария и нитрат серебра. Реакция протекает в растворе жидкого аммиака.
9. реакция взаимодействия хлорида серебра, пероксида водорода и гидроксида калия:
2AgCl + H2O2 + 2KOH → 2KCl + 2Ag + O2 + H2O.
В результате реакции образуются хлорид калия, серебро, кислород и вода.
10. реакция разложения хлорида серебра:
2AgCl → 2Ag + Cl2 (hv).
В результате реакции образуются серебро и хлор. Реакция протекает при комнатной температуре под действием светового излучения.
Применение и использование хлорида серебра:
Хлорид серебра используется во множестве отраслей промышленности и для бытовых нужд:
– как светочувствительный компонент фотографических эмульсий различных фотографических материалов;
– входит в состав антимикробных композиций на основе ионов серебра;
– в химической промышленности как реагент для получения сереброорганических соединений;
– как компонент электродов химических источников тока, электропроводящих стёкол;
– как материал для линз в ИК-спектроскопии.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
хлорид серебра реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида серебра
реакции
Коэффициент востребованности 4 208
Смешать, но не взбалтывать
Для многих химия – это когда в колбах что-то кипит, дымит, взрывается, или, по меньшей мере, меняет цвет. Мы решили не разрушать это представление и показать несколько прекрасных видеозаписей, раскрывающих всю красоту химических реакций.
Мы решили не разрушать это представление и показать несколько прекрасных видеозаписей, раскрывающих всю красоту химических реакций.
За основу для этой медитативной видеогалереи мы выбрали серию видео Beautiful Chemistry, снятых профессором Янь Ляном и его коллегами из Университета науки и технологии Китая. Кстати, эти видеоролики получили премию Experts Choice («Выбор экспертов») на конкурсе 2015 VIZZIES Visualization Challenge.
На первом видео пять классических реакций, сопровождающихся
выпадением осадка. Первая — это выпадение хлорида серебра при внесении капли
нитрата серебра в раствор обычной соли — реакция, позволяющая обнаружить в
растворах следы хлоридов (а также бромидов и иодидов). Следующая реакция —
осаждение быстро темнеющего тиосульфата серебра при смешивании нитрата серебра
и тиосульфата натрия.
Следующая видеозапись показывает эксперимент, известный как
«Неорганический сад». В раствор силиката натрия («жидкого стекла») бросают кристаллики
солей металлов. Из-за нерастворимости силикатов большинства металлов вокруг
кристаллов быстро возникают тонкие силикатные оболочки.
Рост вытянутых столбов связан с тем, что плотность жидкости внутри оболочки может оказаться меньше плотности жидкого стекла — остальное делает сила Архимеда. Для реакции используют кристаллы хлоридов кальция, кобальта и железа, а также сульфатов цинка и кобальта.
Третий ролик посвящен реакциям вытеснения металлов из их
солей. Из-за того, что у разных металлов сильно отличаются свойства — например,
способность восстанавливать ионы водорода, — в некоторых ситуациях могут
протекать реакции, в которых один металл, более активный, вытесняет менее
активный металл из его соли. В частности, серебро, относящееся к металлам с
невысокой активностью, легко вытесняется из соли металлическим цинком.
В четвертом видеоролике химики показывают крупным планом
реакции, сопровождающиеся выделением газов. Первая реакция — растворение цинка
в соляной кислоте, в результате которого образуются пузырьки водорода, а цинк
превращается в хлорид цинка. Следующая реакция — растворение магния в уксусной
кислоте с тем же результатом (образуется ацетат магния). Третья реакция — растворение в соляной кислоте карбоната
кальция (содержащегося в яичной скорлупе). В результате реакции выделяется
углекислый газ. Если довести реакцию до конца, то яйцо станет мягким и будет
прогибаться при прикосновении. Ту же процедуру можно повторить и в крепком уксусе. Последняя часть видео показывает электролиз воды
— под действием тока она разлагается на водород и кислород.
В этом видео химики капают растворы кислот и щелочей на растения. Многие цветы, ягоды (и не только) содержат в себе индикаторы — вещества, меняющие свою структуру и окраску в кислых или щелочных средах. Здесь для опытов использовали краснокочанную капусту и цветок из семейства Линдерниевых — Torenia fournieri. С тем же успехом можно экспериментировать над цветами рода гибискус, входящими например, в состав каркаде.
Шестое видео, строго говоря, не показывает химических
реакций. Оно посвящено кристаллизации — переходу солей из растворов в твердую
форму. Тем не менее, каждый химик сталкивается с этим явлением, например,
занимаясь очисткой веществ. Для того, чтобы вырастить небольшие кристаллы
необходимо растворить соль в большом количестве горячей воды, удалить не растворившийся
осадок (например, слив с него чистый раствор) и оставить жидкость остывать. Чем
медленнее жидкость остывает (или испаряется), тем больше шансов получить большой
кристалл.
Чем
медленнее жидкость остывает (или испаряется), тем больше шансов получить большой
кристалл.
На видео показано как кристаллизуются медный купорос, тиосульфат натрия, трисоксалат железа калия и ацетат натрия. Последний еще используется в известном опыте «горячий лед», в котором перенасыщенный раствор соли почти полностью затвердевает от прикосновения или падения одного маленького кристалла.
На следующем видео авторы показали «танцующие капли», сделанные из флуоресцирующих палочек. Химики смешали жидкости, запускающие интенсивное свечение смеси — обычно это комбинация дифенилоксалата, перекиси и красителя. Затем они поместили смесь в раствор щелочи. Из-за того, что светящаяся основа растворена в маслянистом веществе, капли не растворились в щелочи. На границах капель происходит химическая реакция, заставляющая их двигаться.
Последний видеоролик посвящен дыму. Если первая его часть — обычное горение свечи и ароматических палочек, то затем химики показывают как дым может возникнуть без огня. Следует отметить, что дым это аэрозоль, взвесь твердых частиц в воздухе. Последняя реакция — взаимодействие газообразного аммиака с парами соляной кислоты. В результате реакции образуются крошечные кристаллы хлорида аммония, которые и кажутся похожими на дым. Как шутят авторы — все три типа дыма пахнут совершенно-по разному. Например, ароматические палочки пахнут довольно приятно, а хлорид аммония нюхать явно не стоило.
Сайт проекта Beautiful Chemistry давно не пополнялся новыми видео. Среди последних добавленных записей мы обнаружили трейлер следующих роликов. Судя по нему, химики явно планируют поработать с тем, как выглядят реакции под микроскопом — надеемся, они не заставят долго ждать.
Владимир Королёв
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
AgNO3 + NaCl = AgCl + NaNO3
При смешивании водного раствора AgNO 3 и водного раствора NaCl высока вероятность придание белого цвета осадок, если исходное серебро нитрат и исходный хлорид натрия концентрации значительно выше. Это означает, что AgNO 3 и NaCl являются реакцией осаждения. В этом уроке мы узнаем о различных аспектах этого реакция, такая как осаждение, и требуемые концентрации для осаждения.
AgNO
3 (водн.) + NaCl (водн.) = AgCl (тв.) + NaNO 3 (водн.) Растворы нитрата серебра и хлорида натрия представляют собой бесцветные растворы. Когда они реагируют друг с другом, выпадает белый осадок и
дают бесцветный раствор. Нитрат натрия представляет собой бесцветное водорастворимое соединение.
Наблюдения во время реакции
Когда вы медленно добавляете одно химическое вещество к другому химическому веществу по капле, в какой-то момент вы увидите белый осадок образуется в растворе. Если сразу добавить одно химическое вещество к другому, то осадок тоже сразу образуется. Но помните, что нужно быть осторожным с нитратом серебра и нитратом во время эксперимента, потому что это очень токсичное химическое вещество.
Концентрация, необходимая для образования осадка
При смешивании одинаковых объемов NaCl и AgNO 3 будет ли образовываться осадок? Оба раствора имеют концентрацию 0,1 моль дм -3 .
Предположим, что при смешивании обоих растворов осадка нет, а затем рассчитаем концентрацию каждого соединения. Поскольку каждое соединение разбавлено в два раза, концентрация NaCl и AgNO3 уменьшается вдвое.
Тогда каждое соединение имеет концентрацию 0,05 моль дм -3 .
Затем мы можем применить выражение Ksp, чтобы проверить, будет ли выпадать осадок AgCl.
Начальная концентрация Cl
— после смешения = 0,05 моль дм -3Исходная концентрация Ag
+ после смешения = 0,05 моль дм -3Выражение Ksp для AgCl = [Ag
+ (водн.) ][Cl — (водн.) ][Ag
+ (водн.) ][Cl — (водн.) ] = 0,05 моль дм -3 * 0,05 моль дм -3[Аг
+ (водн.) ][Cl — (водн.) ] = 2,5 * 10 -3 моль 2 дм -6Ksp, Ag Cl = 1,7 * 10
-10 моль 2 dm -6Поскольку расчетное значение выражения Ksp больше, чем значение Ksp AgCl. Следовательно, вы можете видеть, что AgCl осаждается в растворе.
pH NaCl и AgNO
3 реакция NaCl и AgNO 3 являются нейтральными растворами. Продуктами реакции являются AgCl и NaNO 3 . AgCl выпадает в осадок и не вызывает реакции гидролиза. Кроме того, NaNO 3 является нейтральным соединением. Следовательно, итоговый раствор должен иметь значение pH, близкое к 7.
Продуктами реакции являются AgCl и NaNO 3 . AgCl выпадает в осадок и не вызывает реакции гидролиза. Кроме того, NaNO 3 является нейтральным соединением. Следовательно, итоговый раствор должен иметь значение pH, близкое к 7.
Вопросы студентов
Задайте свой вопрос и найдите ответ бесплатно.
Что касается нитрата серебра, какие другие неорганические соединения также могут давать белый осадок с нитратом натрия?
Нитрат свинца дает белый осадок с нитратом натрия, и соответствующая реакция приведена ниже.
Pb(NO 3 ) 2 + NaCl → PbCl 2 + NaNO 3
Что произойдет, если вместо водного раствора NaCl добавить твердый NaCl к водному раствору AgNO
3 добавлено? В этом случае также дается осадок AgCl, потому что, когда твердый NaCl очень хорошо растворяется в воде и диссоциирует до Na + и ионы Cl — . Затем ион Cl — соединяется с ионами Ag + и дает белый осадок AgCl.
Затем ион Cl — соединяется с ионами Ag + и дает белый осадок AgCl.
Какого цвета осадок получается при реакции AgNO
3 и NaCl? Кроме того, будет ли выделяться газ в этой реакции?AgCl представляет собой белый осадок, во время реакции выделения газа не происходит.
Связанные руководства
FeCl 2 + реакция NaOH Реакция холодного и горячего NaOH + Cl 2 Растворимость гидроксидов металловЧто происходит при добавлении раствора нитрата серебра к раствору хлорида натрия a Напишите уравнение …
Перейти к
- Упражнение
- Глава 1 Химические реакции и уравнения
- Глава 2 Кислоты, основания и соли
- Глава 3 Металлы и неметаллы
- Глава 4 Углерод и его соединения
- Глава 5 Периодическая классификация элементов
Главная > Лахмир Сингх Солюшнс Класс 10 Химия > Глава 1 — Глава 1 Химические реакции и уравнения > Упражнение > Вопрос 89
Вопрос 89 Упражнение
Что произойдет, если раствор нитрата серебра добавить к раствору хлорида натрия?
(а) Напишите уравнение протекающей реакции.
Ответ:
При добавлении раствора нитрата серебра к раствору хлорида натрия вместе с раствором нитрата натрия образуется белый осадок хлорида серебра.
(a)AgNO 3 (водн.) + NaCl (водн.) → AgCl (т) + NaNO 3 (водн.) 9 0215
Связанные вопросы
**Объясните, почему пищевые продукты, содержащие жиры и масла (например, картофельные чипсы), упаковываются в азот.*…
**Что такое антиоксиданты? Почему их добавляют в продукты, содержащие жиры и масла?**
**Назовите важное применение реакций разложения.**
**Каково общее название химических веществ, которые добавляют в жиро- и маслосодержащие пищевые продукты для предотвращения…
** Какой тип химической реакции используется для извлечения металлов из их природных соединений, таких как оксид.
