9 класс. Практическая работа 1. I вариант.
Пояснительная записка
Пояснительная записка Рабочая программа по химии составлена на основе: Федерального компонента государственного образовательного основного общего образования; примерной программы основного общего образования
ПодробнееЧто показывает химическая формула
Содержание Что показывает химическая формула………………. 2 Составление названий неорганических веществ……….. 4 Номенклатура солей………………………..
18. Ионные реакции в растворах
18. Ионные реакции в растворах Электролитическая диссоциация. Электролитическая диссоциация это распад молекул в растворе с образованием положительно и отрицательно заряженных ионов. Полнота распада зависит
ПодробнееХимические свойства оснований и кислот
Химические свойства оснований и кислот 1. В реакцию с раствором гидроксида калия вступает 2. Раствор серной кислоты реагирует с раствором 3. Раствор серной кислоты не реагирует 4. Гидроксид меди(ii) реагирует
Подробнеес. Веселая Лопань, 2015 год
Муниципальное общеобразовательное учреждение «Веселолопанская средняя общеобразовательная школа Белгородского района Белгородской области» Контрольное тестирование по химии 9 класс (промежуточный контроль)
ПодробнееЛабораторные опыты 1 3 Дата г.

РАСТВОРЫ Лабораторные опыты 1 3 1. ОПРЕДЕЛЕНИЕ ИОНОВ ГИДРОГЕНА И ГИДРОКСИД-ИОНОВ В РАСТВОРАХ. 2. УСТАНОВЛЕНИЕ ПРИБЛИЗИТЕЛЬНОГО ЗНАЧЕНИЯ ph ВОДЫ, ЩЕЛОЧ- НЫХ И КИСЛОТНЫХ РАСТВОРОВ (НАТРИЙ ГИДРОКСИДА, ХЛОРИД-
Пояснительная записка
Пояснительная записка Элективный учебный предмет предназначен для учащихся 9 класса, изучающих химию на базовом уровне Курс рассчитан на 34 часа Программа курса является дополнением к систематическому
Подробнее1. Дана схема превращений:
Задание 22 1. Дана схема превращений: Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для второго превращения составьте сокращённое ионное уравнение
ПодробнееВариант 5 Вариант 6
Вариант 1 1. Вычислите массовую долю хлорида бария в растворе, приготовленном путем растворения 50г данной соли в 1л воды. 2. Определите молярную концентрацию 40% раствора серной кислоты, плотность которого
Вычислите массовую долю хлорида бария в растворе, приготовленном путем растворения 50г данной соли в 1л воды. 2. Определите молярную концентрацию 40% раствора серной кислоты, плотность которого
Диагностическая работа 1 по ХИМИИ
Район Город (населенный пункт) Школа Класс Фамилия Имя Отчество Диагностическая работа 1 по ХИМИИ 21 ноября 2011 года 9 класс Вариант 1 Химия. 9 класс. Вариант 1 2 Инструкция по выполнению работы На выполнение
ПодробнееСамостоятельная работа
Ташкентский фармацевтический институт Кафедра: Аналитической, неорганической и физической и коллоидной химии Самостоятельная работа Тема: «Элементы V-А группы. Соединения азота» Выполнил: Каххаров С. Проверил:
ПодробнееПояснительная записка
Пояснительная записка Рабочая тетрадь рекомендована для студентов очной формы обучения, реализующих образовательную программу среднего (полного) общего образования технического профиля.
ЗАДАНИЕ 3. Примеры решения задач
ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
ПодробнееЛабораторная работа 1
Общая химия Студент: Группа: Дата выполнения работы: 1 Цель работы: Лабораторная работа 1 ВАЖНЕЙШИЕ КЛАССЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ Основные понятия: Классы неорганических веществ: 1. оксиды осно вные (Na
ПодробнееБанк заданий 11 класс химия
Банк заданий 11 класс химия 1. Электронная конфигурация соответствует иону: 2. Одинаковую кофигурацию имеют частицы и и и и 3. Сходную конфигурацию внешнего энергетического уровня имеют атомы магния и
Подробнее«5» ТЕМА 1.
 КОНЦЕНТРАЦИЯ РАСТВОРОВ
КОНЦЕНТРАЦИЯ РАСТВОРОВПравила выставления оценки за тест Оценка за тест выставляется по пятибальной шкале. Мы используем рекомендации, которые действуют при оценке результатов единого государственного экзамена (ЕГЭ) по химии:
ПодробнееВариант 2. CuS + HNO 3 Cu(NO 3 ) 2 + H 2 SO 4 + NO 2 + H 2 O
Вариант 1 1. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих до образования средних солей, между веществами: а) нитрат цинка + гидроксид калия; б) гидроксид кальция + серная
Экзаменационная работа
Экзаменационная работа для проведения государственной (итоговой) аттестации выпускников IX классов общеобразовательных учреждений 2008 года (в новой форме) по ХИМИИ Демонстрационный вариант 2008 года Район
ПодробнееПрактическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O.(стр147 №7) | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O.(стр147 №7) | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O.(стр147 №7) | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O.(стр147 №7) | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O.(стр147 №7) | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O.(стр147 №7) |
9 класс — второй год обучения
Рекомендуется для повторения:
Периодический закон и Периодическая система элементов Д.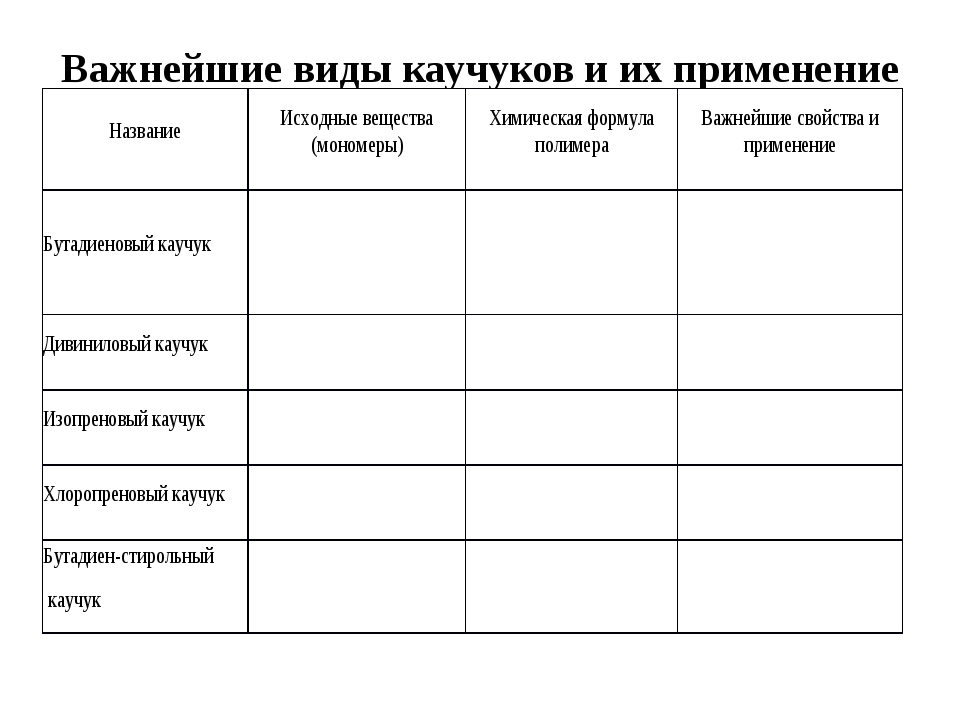 И. Менделеева. Строение вещества
И. Менделеева. Строение вещества
Основные классы неорганических соединений, Типы химических реакций
Урок №1-2. Окислительно-восстановительные реакции. Реакции соединения, разложения, замещения и обмена с точки зрения окисления и восстановления
Урок №3. Тепловой эффект химических реакций. Экзо- и эндотермические реакции
Урок№4. Скорость химических реакций. Первоначальные представления о катализе
Урок№5. Практическая работа №1. Изучение влияния условий проведения химическихреакций на её скорость
Урок№6. Обратимые и необратимые реакции. Понятие о химическом равновесии
Урок №7. Сущность процесса электролитической диссоциации
Урок №8. Диссоциация кислот, оснований и солей
Урок №9. Слабые и сильные электролиты. Степень диссоциации
Урок №10. Реакции ионного обмена и условия их протекания
Урок №11-12. Химические свойства основных классов неорганических соединений в свете представлений об электролитической диссоциации и окислительно-восстановительных реакциях
Урок
№13. Гидролиз солей. Обобщение по темам «Классификация химических реакций» и
«Электролитическая диссоциация»
Гидролиз солей. Обобщение по темам «Классификация химических реакций» и
«Электролитическая диссоциация»
Урок№15. Контрольная работа №1. По темам «Классификация химических реакций» и «Электролитическая диссоциация»
Урок №16. Положение галогенов в периодической таблице и строение их атомов. Свойства, получение и применение галогенов
Урок №17. Хлор. Свойства и применение хлора
Урок№18. Хлороводород: получение и свойства
Урок№19. Соляная кислота и её соли
Урок№20. Практическая работа №3. Получение соляной кислоты и изучение её свойств
Урок №21. Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Аллотропия серы
Урок №22. Свойства и применение серы
Урок №23. Сероводород. Сульфиды
Урок №24. Оксид серы (IV). Сернистая кислота и её соли
Урок
№25. Оксид серы (VI). Серная кислота и её соли
Оксид серы (VI). Серная кислота и её соли
Урок№26. Окислительные свойства концентрированной серной кислоты.
Вычисления по химическим уравнениям массы, объёма или количества вещества одного из продуктов реакции по массе исходного вещества, объёму или количеству вещества, содержащего определённую долю примесей
Урок№27. Практическая работа №4. Решение экспериментальных задач по теме «Кислород и сера»
Урок№28. Контрольная работа №2 «Экзаменационная работа за 1 полугодие»
Урок №29. Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот: свойства и применение
Урок №30. Аммиак. Физические и химические свойства. Получение и применение
Урок №31. Практическая работа №5. Получение аммиака и изучение его свойств
Урок №32. Соли аммония
Урок №33. Азотная кислота. Строение молекулы. Свойства разбавленной азотной кислоты
Урок №34. Свойства концентрированной азотной кислоты
Урок
№35. Соли азотной кислоты.
Урок №36. Фосфор. Аллотропия фосфора. Свойства фосфора
Урок №37. Оксид фосфора (V). Фосфорная кислота и её соли. Фосфорные удобрения
Урок №38. Положение углерода и кремния в периодической системе химических элементов, строение их атомов. Аллотропные модификации углерода
Урок №39. Химические свойства углерода. Адсорбция
Урок №40. Угарный газ, свойства, физиологическое действие на организм
Урок №41. Углекислый газ. Угольная кислота и её соли. Круговорот углерода в природе
Урок №42. Практическая работа №6. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов
Урок №43. Кремний и его соединения. Стекло. Цемент
Урок№44. Обобщение по теме «Неметаллы»
Урок №45. Контрольная работа №3 по теме «Неметаллы»
Урок №46. Положение металлов в периодической системе элементов Д.И. Менделеева. Металлическая связь. Физические свойства металлов. Сплавы металлов
Урок №47. Нахождение металлов в природе и общие способы их получения
Урок
№48. Химические свойства металлов. Ряд активности (электрохимический ряд)
металлов
Химические свойства металлов. Ряд активности (электрохимический ряд)
металлов
Урок №49. Щелочные металлы. Нахождение в природе. Физические и химические свойства
Урок №50. Оксиды и гидроксиды щелочных металлов. Применение щелочных металлов
Урок №51. Щёлочноземельные металлы. Нахождение в природе. Кальций и его соединения. Жёсткость воды и способы её устранения
Урок №52. Алюминий. Нахождение в природе. Свойства алюминия
Урок №53. Амфотерность оксида и гидроксида алюминия
Урок №54. Железо. Нахождение в природе. Свойства железа
Урок №55. Соединения железа
Урок №56. Практическая работа №7. Решение экспериментальных задач по теме «Металлы и их соединения»
Урок №57-58. Подготовка к контрольной работе по теме «Металлы». Контрольная работа №4. По теме «Металлы»
Урок №59. Органическая химия
Урок №60. Углеводороды. Предельные (насыщенные) углеводороды
Урок №61. Непредельные (ненасыщенные) углеводороды
Урок
№62.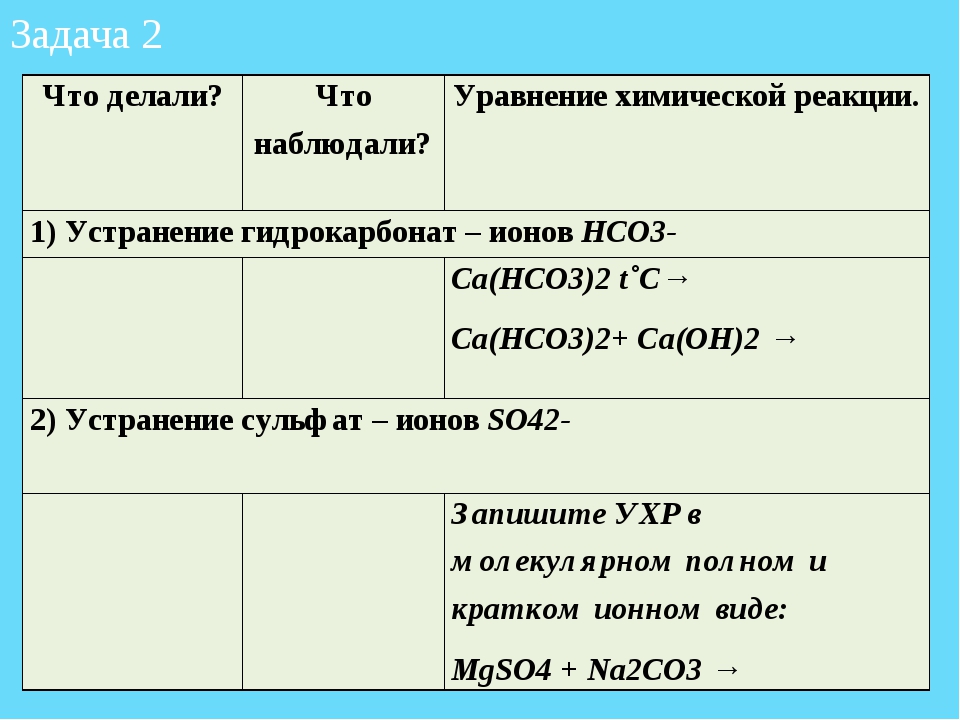 Производные углеводородов. Спирты
Производные углеводородов. Спирты
Урок №63. Карбоновые кислоты. Сложные эфиры. Жиры
Урок №64. Углеводы
Урок №65. Аминокислоты. Белки
Урок №66. Полимеры
Урок №67. Обобщающий урок по теме «Важнейшие органические соединения»
Урок №68. Обобщающий урок по теме «Обобщение, систематизация и коррекция знаний учащихся за курс химии 9 класса»Практическая Работа По Химии 9 Класс
ГДЗ: Готовые домашние задания по Химии 9 класс, решебник Рудзитис Г. Е.
Практические работы. з.-1 · з.-2 · з.-3 · з.-4 · з.-5 · з.-6. Глава II. §§7-10.
Подробнее
ГДЗ: Готовые домашние задания по Химии 9 класс, решебник Химия.
Учебник для 9 класса. О. С. Габриелян. Практическая работа № 9. 1.
Химический
Подробнее
Готовые лабораторные и практические работы по химии 9 класс — готовая
лабораторная работа которая подготовлена к учебнику Химия. Не хотите
Не хотите
Подробнее
ГДЗ по химии за 9 класс к учебнику «Химия. 9 класс» О.С.Габриелян. Онлайн
решебник по химии Практические и лабораторные работы (главы 2, 4, 6).
Подробнее
Домашняя работа по химии за 9 класс к учебнику «Химия. 9 класс» Г.Е.
Рудзитис, Ф.Г.Фельдман. Лабораторные и практические работы. Как искать:.
Подробнее
Готовые лабораторные работы по химии 9 класс. Полностью готовая
Лабораторная работа №1 практические и лаболаторные помогли..)))!! 0.
Подробнее
ГДЗ Химия 9 класс Решебник по химии к учебнику О.С.Габриэляна
содержит необходимые уравнения реакций, схемы и Практическая работа
9
Подробнее
Готовые лабораторные и практические работы по химии 9 класс — готовая
лабораторная работа которая подготовлена к учебнику Химия. Не хотите
Подробнее
Практическая работа №1. «Осуществление цепочки химических
превращений металлов» (9 класс). (УМК Габриелян О.С. 2011-2012 уч. год).
Подробнее
ГДЗ Химия 9 класс Решебник по химии к учебнику О.С.Габриэляна
содержит необходимые уравнения реакций, схемы и Практическая работа
9
Подробнее
Готовое Домашнее Задание (ГДЗ) по Химии за 9 класс Габриелян О.С — Ваша
домашняя работа на 5+. Глава 2. Практическая работа №1. Вариант 1
Подробнее
Готовое Домашнее Задание (ГДЗ) по Химии за 9 класс Габриелян О.С — Ваша
домашняя работа на 5+. Глава 2. Практическая работа №1. Вариант 1
Подробнее
Решебник по химии 9 класс а где тут можно найти практические работы? 0
так хотя бы прочитайте предыдущие записи админа, 9 раз спросить про
Подробнее
ГДЗ: Готовые домашние задания по Химии 9 класс, решебник Рудзитис Г. Е.
Практические работы. з.-1 · з.-2 · з.-3 · з.-4 · з.-5 · з.-6. Глава II. §§7-10.
Подробнее
Готовые лабораторные и практические работы по химии 9 класс — готовая
лабораторная работа которая подготовлена к учебнику Химия. Не хотите
Подробнее
ГДЗ: Готовые домашние задания по Химии 9 класс, решебник Рудзитис Г. Е.
Практические работы. з.-1 · з.-2 · з.-3 · з.-4 · з.-5 · з.-6. Глава II. §§7-10.
Подробнее
Решебник по химии 9 класс а где тут можно найти практические работы? 0
так хотя бы прочитайте предыдущие записи админа, 9 раз спросить про
Подробнее
ГДЗ: Готовые домашние задания по Химии 9 класс, решебник Рудзитис Г. Е.
Практические работы. з.-1 · з.-2 · з.-3 · з.-4 · з.-5 · з.-6. Глава II. §§7-10.
Практическая работа №1. «Осуществление цепочки химических
превращений металлов» (9 класс). (УМК Габриелян О.С. 2011-2012 уч. год).
Практическая работа №2 к уроку химии для 9 класса
библиотека
материалов
Содержание слайдов
Номер слайда 1
9 класс Составила: учитель химии высшей квалификационной категории Рыжова Светлана Викторовна МБОУ «Шеметовская СОШ»
Номер слайда 2
Практическая работа №2 Решение экспериментальных задач по теме «Свойства кислот, оснований и солей как электролитов».
Номер слайда 3
Цель работы: исследование химических свойств часто встречающихся кислот, солей и оснований, усовершенствование навыков написания ионных уравнений.
Номер слайда 4
Оборудование: пробирки в штативе, ложка для сыпучих веществ.
Номер слайда 5
Реактивы: Zn- Zn(NO3)2 — NaOH- K2CO3 — Na2CO3 – MgCl2 — ZnCl2 – FeCl3 — Na2S – CuSO4 — h3SO4 — HCl- HNO3 —
Номер слайда 6
Техника безопасности
Номер слайда 7
Техника безопасности
Номер слайда 8
Техника безопасности
Номер слайда 9
Техника безопасности
Номер слайда 10
Ход работы:
Номер слайда 11
Налейте в пробирку 1-2 мл разбавленной серной кислоты и опустите в неё кусочек цинка. 1 задание:
Номер слайда 12
1 задание: 1. Напишите молекулярное и ионное уравнение соответствующих реакций: ______________________________________________________ ______________________________________________________ 2. Покажите переход электронов и объясните, что в этой реакции является окислителем __________________________________________________ __________________________________________________ 3.Наблюдения: ______________________________
Номер слайда 13
2 задание: Налейте в три пробирки раствор хлорида меди. В первую пробирку прилейте раствор гидроксида натрия, во вторую карбоната натрия, в третью – нитрата калия.
Номер слайда 14
2 задание: 1. Напишите молекулярные и ионные уравнения соответствующих реакций: _____________________________________________ _____________________________________________ 2.Наблюдения: ______________________________ 3.Объясните, почему проведенные реакции идут до конца: ______________________________________________
Номер слайда 15
3 задание: Даны растворы: а) карбонат калия и соляная кислота; б) сульфид натрия и серная кислота; в) хлорид цинка и азотная кислота. Слейте попарно эти растворы.
Номер слайда 16
3 задание: 1. Напишите молекулярные и ионные уравнения соответствующих реакций: _________________________________________________ _________________________________________________ 2.Наблюдения: ______________________________ 3.Объясните, почему проведенные реакции идут до конца: _________________________________
Номер слайда 17
4 задание: Пользуясь растворами, находящимися на столе, получите гидроксид железа (III)
Номер слайда 18
4 задание: 1. Напишите молекулярное и ионное уравнение соответствующих реакций: ____________________________________________________________________
Номер слайда 19
Вывод: Сделайте общий вывод по проделанной работе, исходя из цели урока.
Номер слайда 20
ПРИВЕДИТЕ В ПОРЯДОК РАБОЧЕЕ МЕСТО.
Номер слайда 21
Номер слайда 22
Спасибо за работу!!!
2 | восстановитель | |
Cl2° +2e = 2Сl— | 1 | окислитель |
Практическая работа по химии в 9 классе «Решение экспериментальных задач по теме подгруппа кислорода»
Муниципальное казенное общеобразовательное учреждение
«Средняя общеобразовательная школа д.Бурмистрово им.В.С. Чумака»
Искитимского района Новосибирской области
Практическая работа в 9 классе.
Тема: Решение экспериментальных задач по теме «Подгруппа кислорода»
Автор:
учитель химии
Щурина Елена Юрьевна
д.Бурмистрово 2016г
Тип урока: урок — практика с использованием информационно-коммуникационных технологий.
Цель: применяя полученные на уроках знания осуществлять практическое решение задач не только в реальном эксперименте, но и в виртуальной лаборатории.
Задачи урока:
I. формирование УУД
1.Личностные УУД – возможность самоопредения на практической работе по интеллектуальным возможностям (организатор берёт лист, оценивая свои способности и возможности).
2.Регулятивные УУД – формирование цели, планирование и организация деятельности, прогнозирование, контроль, коррекция, оценка.
3.Познавательные УУД – исследовательские действия (применение знаний в конкретной ситуации, решение экспериментальных задач, как компонент воспитания логического мышления)
4 Коммуникативные УУД – организация и планирование работы в группе, умение договориться и находить общее решение, построение межличностных отношений.
II. Используя знания о качественных реакциях на ионы, опытным путём научиться распознавать химические вещества;
III. Развивать познавательную деятельность учащихся в процессе выполнения эксперимента;
IV. Воспитывать аккуратность, бережное отношение при расходовании химических реактивов;
V.Закрепить навыки работы с виртуальной лабораторией.
Для решения поставленных целей и задач работать будем в группах по три человека. В течение работы, учащиеся распределяют роли и по мере решения задач меняются ими.
Организатор (работает с инструкционной карточкой, выясняя, что делать, даёт указания исполнителю)
Исполнитель — практик (проводит реакции )
Контролёр — аналитик (анализирует наблюдения и корректирует работу организатора)
Целесообразно предложить каждой группе для решения по три задачи.
Ход урока
Оргмомент.
Мотивация: добавьте слово в словосочетание
ХИМИЧЕСКИЕ
Обратите внимание на доску. Я написала лишь одно слово «ХИМИЧЧЕСКИЕ», добавьте слова, чтобы получились словосочетания (ЭКСПЕРИМЕНТЫ, РЕАКЦИИ, ЯВЛЕНИЯ,ПРОЦЕССЫ и т.д.)
Скажите, а есть ли что ни будь, что может объединить все эти словосочетания? (ПРАКТИЧЕСКАЯ работа).
Верно. И сегодня на уроке мы будем с вами выполнять практическую работу. Работаем, как обычно, по группам. Откройте тетради, запишите число и тему работы «Решение экспериментальных задач по теме «Подгруппа кислорода».
Дома, готовясь к сегодняшнему уроку, вы посмотрели задачи на странице 146-147 ваших учебников (Учебник О.С. Габриелян, 9 класс) и подумали над целью. Как по-вашему она должна звучать?
применить знания, полученные при изучении темы «Подгруппа кислорода», в экспериментальном решении задач;
закрепить навыки проведения химического эксперимента.
Хорошо, давайте запишем цель работы в тетради.
Чтобы работа прошла успешно и без последствий для здоровья надо?
Соблюдать правила по ТБ и правила работы в группах.
Повторяем правила Т.Б. (повторяем по таблице, где оставлены только картинки)
На слайде появляется изображение
Вспомните правила работы в группах (озвучивают без подсказок)
— соблюдение всех правил ТБ
— соблюдайте тишину, не мешайте другим, они тоже работают
— проговаривайте свои мысли, не критикуйте других
— умейте договариваться, находить общее решение.
На столах папка с инструкциями к выполнению работы.
-распределяем роли. Напоминаю, что
а) организатор (работает с инструкционной карточкой, выясняя, что делать, даёт указания исполнителю)
б) исполнитель — практик ( проводит реакции )
в) контролёр — аналитик (анализирует наблюдения и корректирует работу организатора)
Первую задачу (задача №4 на странице 147) мы решим с вами при помощи виртуальной лаборатории.
Ребята, распределите роли. Определились?
Предлагаю открыть сайт виртуальной лаборатории http://www.virtulab.net (скриншот №1)
затем следовать маршрутом : главная —>закладка химия стр2 левый столбик ,первая практическая работа «Решение экспериментальных задач». http://www.virtulab.net/index.php?option=com_content&view=article&id=265:2009-11-14-22-37-18&catid=57:2009-11-14-21-25-00&Itemid=108
Откроем задачу №2 (скриншот №2 ) http://www.virtulab.net/index.php?option=com_content&view=article&id=265:2009-11-14-22-37-18&catid=57:2009-11-14-21-25-00&Itemid=108
Выполняйте задачу
Проверим результаты.
Напоминаю о составлении отчётной таблицы.
Продолжаем выполнять работу и переходим к реальным экспериментам. Не забывайте о смене ролей в группах.
Учащиеся работают со своими инструкционными картами (приложение)
Подведение итога: какой вывод вы сделали по итогам работы? (Корректируем его.)
Ребята, подходит к концу наш урок. Что вы можете сказать о сегодняшней работе?
Памятка на слайде:
— Мне больше всего удалось……
— Я могу похвалить себя за то, что……
— Я могу похвалить одноклассников…..
— Меня удивило……
— На мой взгляд не удалось….., потому, что…….
— На будущее я учту……….
Хорошо, а сейчас наводим порядок на рабочих местах, сдаём тетради на проверку
Заключительная часть.
Спасибо всем за работу, результаты вы узнаете на следующем уроке. Дома повторите состав воздуха и подумайте над следующим заданием.
ДОМАШНИЙ ОПЫТ
Из предложенных материалов: 50мл.,9% уксусной кислоты,1ст.ложки NaHCO3 (cода), 100мл. Н2О, 1ст. ложка моющего средства, сок свеклы, соленое тесто или пластилин. предложите инструкцию проведения химического опыта, который может служить наглядным пособием на уроке географии в 6 классе
Приложение (Группа 1).
Задача №1
Условие задачи на стр 147 учебника, задача №4. Распределите роли и действуйте по инструктивной карте.
Открыть сайт виртуальной лаборатории http://www.virtulab.net (скриншот №1)
затем следовать маршрутом : главная —>закладка химиястр2левый столбик ,первая практическая работа «Решение экспериментальных задач». http://www.virtulab.net/index.php?option=com_content&view=article&id=265:2009-11-14-22-37-18&catid=57:2009-11-14-21-25-00&Itemid=108
Открыть задачу №2 (скриншот №2 ) http://www.virtulab.net/index.php?option=com_content&view=article&id=265:2009-11-14-22-37-18&catid=57:2009-11-14-21-25-00&Itemid=108
Выполняйте задачу
Проверим результаты
Заполняем отчетную таблицу
Задача №2
ОРГАНИЗАТОР На «3»
Вам даны три пробирки с бесцветными растворами. Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Прежде всего напоминаю о соблюдении правил техники безопасности, в данном случае при работе с компьютером. Даны три вещества и три реактива (лакмус, хлорид бария и гидроксид калия). Гидроксид калия – явно в данном случае лишний, так как при взаимодействии со всеми предложенными веществами видимых изменений происходить не будет (хлорид калия и сульфат калия растворимы).
Для определения гидроксида натрия NaOH, используем лакмус. В щелочной среде он посинеет. Приливаем в пробирки поочереди лакмус.
В двух пробирках лакмус покраснел. Отливаем из склянок 2и3 вещества в чистые пробирки. Для определения серной кислоты используем раствор хлорида бария. (Это качественная реакция на сульфат ион). Там где выпал белый осадок находится серная кислота.
Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Определить в какой из пробирок находится соляная кислота, серная кислота и гидроксид натрия. | В пробирки прилили лакмус | 1 — цвет ______ . 2 – цвет – 3 — цвет | В первой – щёлочь Во второй – В третьей — |
В пробирки с кислотами прилили BaCl2. | Образование белого ____ в пробирке №__________ | это качественная реакция на ионы SO-24 h3SO4 + BaCl2 → BaSo4↓ + ______ |
ОРГАНИЗАТОР На «4»
Даны три пробирки с бесцветными растворами. Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Прежде всего напоминаю о соблюдении правил техники безопасности, в данном случае при работе с компьютером. Даны три вещества и три реактива (лакмус, хлорид бария и гидроксид калия).
Для определения гидроксида натрия NaOH, используем_____________. В щелочной среде он __________.
Отливаем из склянок 2и3 вещества в чистые пробирки. Для определения серной кислоты используем раствор _________ (Это качественная реакция на сульфат ион). Там где выпал________находится серная кислота.
Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Определить в какой из пробирок находится соляная кислота, серная кислота и гидроксид натрия. | В пробирки прилили лакмус | 1 — цвет ______ . 2 – цвет – 3 — цвет | В первой – Во второй – В третьей — |
В пробирки с кислотами прилили | Образование белого ____ в пробирке №__________ | это качественная реакция на ионы SO-24 |
ОРГАНИЗАТОР На «5»
Даны три пробирки с бесцветными растворами. Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Прежде всего напоминаю
Для определения гидроксида натрия NaOH,
Отливаем из склянок ____________вещества в чистые пробирки. Для определения серной ______
Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Определить в какой из пробирок находится соляная кислота, серная кислота и гидроксид натрия. | В пробирки прилили | 1 — цвет ______ . 2 – цвет – 3 — цвет | В первой – Во второй – В третьей — |
В пробирки с кислотами прилили |
|
Контролёр эксперимента ____________________________________
Задача №2
Организатор | Контроль | Исполнитель |
Ф.И. | ||
Взята карта организатора на | ||
Прочёл задание | ||
Правила ТБ. Работаем с небольшим количеством вещества. С кислотой обращаемся осторожно. Приливая растворы из склянок держим их этикетками вверх | ||
Берем пробы из 3х пронумерованных пробирок, т.е. отливаем небольшое количество реактива в чистые пробирки. В эти пробы добавляем лакмус. В 2х пробирках раствор красный, в третьей – синий, значит там, где синий раствор – это щелочь, т.е. NaOH. | ||
Оставляем ее, т.е. мы ее определили. От оставшихся 2х пробирок вновь берем пробы и в эти пробы добавляем BaCl2 . Там где выпадает белый осадок — серная кислота. | ||
Сделан вывод. | ||
Заполнена отчётная таблица |
Задача 3.
Организатор эксперимента На «3»
Проведите реакции, подтверждающие качественный состав серной кислоты. Напишите уравнения реакций.
Прежде всего, напоминаю, что работая с кислотой нужно соблюдать осторожность. Склянки с растворами веществ держим этикетками вверх. Работаем с использованием чистых, сухих и целых пробирок. Формула серной кислоты_____________. Докажем наличие водорода при помощи универсальной индикаторной бумаги. Для этого намочим кусочек бумажки в исследуемом растворе. Бумажка изменила цвет. Сравниваем с эталоном. Среда КИСЛАЯ.
Проведём качественную реакцию на сульфат ион. Для этого в сухую, чистую, целую пробирку приливаем 1 мл серной кислоты. Добавляем несколько (6-7) капель хлорида бария________________. Выпадает белый осадок сульфата бария. Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Доказать качественный состав серной кислоты | В пробирку поместили полоску универсальной индикаторной бумаги | полоска ______ цвета. рН ____________, среда кислая. | Ионы водорода меняют цвет индикатора |
В пробирку с кислотой прилили BaCl2. | Образование белого ____ | это качественная реакция на ионы SO-24 |
Организатор эксперимента. На «4»
Проведите реакции, подтверждающие качественный состав серной кислоты. Напишите уравнения реакций.
Прежде всего, напоминаю, что работая с кислотой ____________________. Склянки с растворами веществ держим этикетками ____________. Работаем с использованием ____________________. Формула серной кислоты_____________. Для доказательства наличия водорода проведём реакцию серной кислоты с _______________________________________________________________________________________________________
Проведём качественную реакцию на сульфат ион. Для этого в сухую, чистую, целую пробирку приливаем 1 мл серной кислоты. Добавляем несколько (6-7) капель ________________. Выпадает ________________________.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Доказать качественный состав серной кислоты | В пробирку | полоска ______ цвета. рН ____________, среда кислая. | |
В пробирку с кислотой прилили | Образование белого ____ | это качественная реакция на ионы SO-24 |
Организатор эксперимента. На «5»
Проведите реакции, подтверждающие качественный состав серной кислоты. Напишите уравнения реакций.
1.______________________________
2.______________________________
3.______________________________
Задача | Что делал | Что наблюдал | Выводы, реакции |
Доказать качественный состав серной кислоты |
| ||
|
Контролёр эксперимента ____________________________________
Задача №3
Организатор | Контроль | Исполнитель |
Ф.И. | ||
Взята карта организатора на | ||
Прочёл задание | ||
Правила ТБ. Работаем с небольшим количеством вещества. С кислотой обращаемся осторожно. Приливая растворы из склянок держим их этикетками вверх | ||
Катион водорода проверяем универсальным индикатором. Цвет сравниваем с эталоном. Делаем вывод. Можно доказать наличие водорода в кислоте при помощи металла, например Zn. В пробирку помещаем кусочек цинка и приливаем 1 мл серной кислоты. Наблюдаем выделение газа (водорода) | ||
На сульфат анион проводим качественную реакцию с растворимой солью бария (хлоридом бария). В пробирку приливаем 1 мл серной кислоты и 6-7 капель хлорида бария. Наблюдаем выпадение белого осадка. | ||
Сделан вывод. | ||
Заполнена отчётная таблица |
Группа 2.
Организатор эксперимента
Задача 2 На «3»
С помощью характерных реакций установите, является выданная вам соль сульфатом, иодидом или хлоридом. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Прежде всего, напоминаю, что работая с химическими реактивами нужно соблюдать осторожность. Склянки с растворами веществ держим этикетками вверх. Работаем с использованием чистых, сухих и целых пробирок. Работаем с небольшим количеством вещества. Если предложенная соль сульфат, то проведём качественную реакцию на сульфат ион. Для этого в сухую, чистую, целую пробирку приливаем 1 мл исследуемого раствора. Добавляем несколько (9-10) капель хлорида бария________________. Если выпадает белый осадок, то данная соль является сульфатом, так как с хлоридом и иодидом такая реакция не идёт. Если осадок не выпал. Приливаем в чистую пробирку 1 мл исследуемого раствора соли и добавляем 9-10 капель нитрата серебра. Если это хлорид выпадет белый осадок, если иодид – жёлтый. Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
установить, выданная соль является сульфатом, иодидом или хлоридом. | В пробирку прилили 1мл раствора соли и прилили BaCl2. | Образование белого ____ | это качественная реакция на ионы SO-24 |
В пробирку прилили 1мл раствора соли и прилили AgNO3. |
|
Организатор эксперимента. Задача 2 На «4»
С помощью характерных реакций установите, является выданная вам соль сульфатом, иодидом или хлоридом. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Прежде всего, напоминаю, что работая с химическими реактивами нужно____________________________________ Если предложенная соль сульфат, то проведём качественную реакцию на сульфат ион. Для этого в сухую, чистую, целую пробирку приливаем 1 мл исследуемого раствора. Добавляем несколько (9-10) капель ________________.
Если выпадает _______ осадок, то данная соль является сульфатом, так как с хлоридом и иодидом такая реакция не идёт. Если осадок не выпал. Приливаем в чистую пробирку __________________________ и добавляем 9-10 капель нитрата серебра. Если это хлорид выпадет белый осадок, если иодид – жёлтый. Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
установить, выданная соль является сульфатом, иодидом или хлоридом. | В пробирку прилили 1мл раствора соли и прилили BaCl2. | Образование белого ____ | это качественная реакция на |
В пробирку прилили 1мл раствора соли и прилили ________ | _______________________ | _________________________________ |
Организатор эксперимента. Задача 2 На «5»
С помощью характерных реакций установите, является выданная вам соль сульфатом, иодидом или хлоридом. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
1.______________________________
2.______________________________
3.______________________________
Задача | Что делал | Что наблюдал | Выводы, реакции |
установить, выданная соль является сульфатом, иодидом или хлоридом. |
| ||
|
Контролёр эксперимента ____________________________________
Задача №2
Организатор | Контроль | Исполнитель |
Ф.И. | ||
Взята карта организатора на | ||
Прочёл задание | ||
Правила ТБ. Работаем с небольшим количеством вещества. Приливая растворы из склянок, держим их этикетками вверх. Используем чистую, сухую посуду | ||
На сульфат анион проводим качественную реакцию с растворимой солью бария (хлоридом бария). В пробирку приливаем 1 мл раствора соли и 9-10 капель хлорида бария. Наблюдаем выпадение белого осадка. Если осадок не выпал, значит это раствор не сульфата. | ||
Приливаем в пробирку 1 мл исследуемой соли и добавляем несколько капель нитрата серебра. Если нам дан хлорид – выпадет белый осадок Если иодид – осадок жёлтого цвета | ||
Сделан вывод | ||
Заполнена отчётная таблица |
Задача №3 На «3»
Осуществите на опытах следующие превращения
Прежде всего, напоминаю, что работая со щелочами нужно соблюдать осторожность. Склянки с растворами веществ держим этикетками вверх. Работаем с использованием чистых, сухих и целых пробирок. Формула сульфата меди (II) _____________. Чтобы получить гидроксид меди (II) нужно к сульфату меди(II) прилить гидроксид натрия. Берём сухую, чистую пробирку и приливаем 1 мл сульфата меди (II). Добавляем несколько капель гидроксида натрия. Выпадает голубой желеобразный осадок________________________.
Нерастворимые в воде оснавания при нагревании разлагаются. Зажигаем спиртовку. Закрепляем пробирку в верхней третьей части, чтобы она могла проворачиваться. Осторожно прогреваем. Продолжаем нагревать. Видим образование_____________________________ Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Осуществите на опытах следующие превращения | В пробирку приливаем 1 мл сульфата меди (II). Добавляем несколько капель гидроксида натрия. |
| |
Зажигаем спиртовку. Закрепляем пробирку в верхней третьей части, чтобы она могла проворачиваться. Осторожно прогреваем | Образование ____ |
Задача №3 На «4»
Осуществите на опытах следующие превращения
Прежде всего, напоминаю, что работая со щелочами ____________________________________ Формула сульфата меди (II) _____________. Чтобы получить гидроксид меди (II) нужно к сульфату меди(II) _________________. Берём сухую, чистую пробирку ____________________. Добавляем несколько капель______________. Выпадает голубой желеобразный ________________________.
Нерастворимые в воде оснавания при нагревании ________________. Зажигаем спиртовку. Закрепляем пробирку в ____________________. Осторожно ____________________________ . Видим образование _____________________ . Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Осуществите на опытах следующие превращения | В пробирку _________ |
| |
Зажигаем спиртовку. _______________ | Образование ____ |
Задача №3 На «5»
Осуществите на опытах следующие превращения
ТБ.
Чтобы получить гидроксид меди (II) нужно ______________
Нерастворимые в воде ______________
________________________________
Задача | Что делал | Что наблюдал | Выводы, реакции |
Осуществите на опытах следующие превращения |
| ||
|
|
Контролёр эксперимента ____________________________________
Задача №3
Организатор | Контроль | Исполнитель |
Ф.И. | ||
Взята карта организатора на | ||
Прочёл задание | ||
Правила ТБ. Работаем с небольшим количеством вещества. С веществами обращаемся осторожно. Приливая растворы из склянок держим их этикетками вверх. Тушить спиртовку можно только колпачком. При нагревании веществ в пробирках, сначала прогреть всю пробирку | ||
Приливаем 1 мл сульфата меди в пробирку и добавляем к нему несколько капель гидроксида натрия. Выпал синий осадок. Cu(OH)2 нерастворимое основание, при нагревании разлагается на оксид меди и воду. | ||
Зажигаем спиртовку и аккуратно нагреваем пробирку с полученным осадком. Видим образование черного оксида меди. | ||
Сделан вывод. | ||
Заполнена отчётная таблица |
Решения Селины для Краткой научной химии 1 Класс 9 ICSE, глава 9 — Практическая работа [Последнее издание]
Решения Селины для Краткой научной химии 1 Класс 9 ICSE, глава 9 (Практическая работа) включают все вопросы с решением и подробным объяснением. Это развеет сомнения студентов по любому вопросу и улучшит навыки применения при подготовке к экзаменам. Подробные пошаговые решения помогут вам лучше понять концепции и избавятся от недоразумений, если таковые имеются.Shaalaa.com предлагает решения ICSE по краткой науке и химии 1 класса 9 CISCE, которые помогают учащимся лучше и быстрее усваивать базовые концепции.
Кроме того, Shaalaa.com предоставляет такие решения, чтобы студенты могли подготовиться к письменным экзаменам. Учебники Selina могут стать основным подспорьем при самостоятельном изучении и выступают в качестве идеального руководства для учащихся.
Концепции, охватываемые в Краткой научной химии 1 Класс 9 ICSE, глава 9 Практическая работа: написание химических формул, наименование определенных соединений, концепция атомной массы, концепция молекулярной массы, химическое уравнение, процентный состав, эмпирическая формула соединения, концепция языка Химия, символ элемента, концепция валентности, радикалы, химическое уравнение, происхождение символов элементов, концепция водорода, балансирование простых уравнений, классификация изменений: химические изменения, условия химического изменения, энергетические изменения при химическом изменении, Сжигание — определение и условия горения, сравнение дыхания и горения, горение магния или свечи, чтобы показать, что вещества набирают вес при горении, типы химических реакций, концепция химических реакций, физические и химические свойства воды, растворы как «смеси» твердых веществ в воде, насыщенных растворов, воды как соединения и универсального растворителя, концепция воды, концепция универсального так lvent, концентрация раствора, растворимость, кристаллы и кристаллизация, гидратированные и безводные вещества, гигроскопичность, свойства, высушивающие и обезвоживающие вещества, жесткая и мягкая вода и методы умягчения жесткой воды, типы жесткости: временная жесткость и постоянная жесткость, качественные Влияние температуры на растворимость, введение загрязнения воды и его контроль, растворение солей в воде, концепция растворенного вещества, растворителя и раствора, жесткая и мягкая вода, концепция солей, концепция атомного числа, концепция изотопов, концепция массового числа , Концепция электронов, распределенных по разным орбитам (оболочкам), введение в структуру атома и химические связи, открытие электронов, открытие протонов, открытие ядра, модель атома Нила Бора, концепция нейтронов, схема Бора-Бюри, валентные электроны, Причина химической активности атома, электровалентной (или ионной) связи, ковалентной (молекулярной) связи, понятие атома, характерные свойства электровала Соединения, Классификация элементов, Периодическая таблица Менделеева, Атомный номер как основа для современного Периодического закона, Современная Периодическая таблица, Типы элементов, Достоинства Современной Периодической Таблицы, Недостатки Современной Периодической Таблицы, Изучение конкретных групп, Триады Доберейнера , Закон октав Ньюленда, использование периодической таблицы, тенденции в современной периодической таблице, положение неметалла (водорода) в периодической таблице, водород из щелочей, лабораторное получение водорода, водорода из воды, водорода из разбавленных кислот, Применение серии активности при получении водорода, сходства между водородом и галогенами, получение водорода, концепция водорода, свойства и использование водорода, водород — окисление и восстановление, производство водорода, получение водорода из воды — электролиз, предпочтение цинка как используемого металла (с указанием причин)., Поведение и характерные свойства газов, движение молекул: взаимосвязь температуры, давления и объема, вывод закона Бойля, закон Вант-Хоффа-Чарльза, температура, законы газа, исследование законов газа, соотношение давления и объема в газах , Абсолютный ноль, преобразование температуры из шкалы Цельсия в шкалу Кельвина и наоборот, Влияние влаги и давления, соотношение температуры и объема в газах, уравнение газа (соотношение давления, объема и температуры), стандартные температура и давление, молярный объем газа на С.TP, Mole Concept, Acid Rain — состав, причина и ее влияние, значение глобального потепления, эффект глобального потепления, источники парниковых газов и способы уменьшения их присутствия в атмосфере, разрушение озонового слоя, концепция загрязнения воздуха, атмосферное загрязнение .
Использование решений Selina Class 9 Практические задания студентов — это простой способ подготовиться к экзаменам, поскольку они включают решения, расположенные по главам и по страницам. Вопросы, связанные с Selina Solutions, являются важными. что можно спросить на выпускном экзамене.Максимум учеников 9 класса CISCE предпочитает Selina Textbook Solutions, чтобы набрать больше баллов на экзамене.
Получите бесплатный просмотр главы 9 Практическая работа. Класс 9, дополнительные вопросы по Краткой научной химии 1, класс 9 ICSE, и можете использовать Shaalaa.com, чтобы держать его под рукой при подготовке к экзамену.
практическая химия 9 класс icse
Глава 7 Изучение законов о газе. Можно ли использовать раствор гидроксида натрия для различения сульфата железа и раствора сульфата железа? Студенты 9 класса ICSE должны тщательно изучить практическую программу по химии, чтобы получить хорошие отметки на практическом экзамене по химии.Глава 2 Химические изменения и реакции. CBSE предоставила официальную программу для практических занятий по естествознанию 9 класса. Эти возможности можно использовать, хорошо обучаясь с самого начала и получая фору. Например: убегать с полей. A. • Добавление разбавленной H2SO4 к: — металлу, сульфиду, карбонату. Вопрос 1. Мы предлагаем пошаговые ответы к упражнению / уроку-9 «Практическая химия» с дополнительными вопросами, вопросами за предыдущий год и модульным тестом-9 доктора Вирафа Дж. Далала по химии в средней школе Союзные издатели «Новая упрощенная химия».Кто может подать заявку? Практическая программа по химии 9 класса ICSE. Язык химии; Химические изменения и реакции; Водород; Класс 10. Нитрат свинца, раствор 3: (a) Zn (NO) 3Â Â Â Â Â Â = белый (b) Cu (NO3) 2Â Â Â Â Â = синий (c) CuSO4,5h3OÂ = синий (d) CuSO4Â Â Â Â Â Â Â Â = бледно-зеленый (e) K2Cr2O7Â Â Â Â Â = оранжевый (f) PbS Â Â Â Â Â Â Â Â Â Â Â Â = черный, Решение 8: (a) Тухлое яйцо (b) Горящая сера (c) Двуокись азота (d) Щелочь (e) Ca (OH) 2 (f) Сирень (g) Кирпично-красный. Формат, образцы и рекомендации.A. Желтый, когда горячий, и белый, когда холодный 4) Сульфат меди, 5. Краткая химия, часть II — Растворы Селины для химии класса 10 ICSE, 13 Практическая работа. Глава 3 Вода. C. Не трогайте подкисленную бумагу K₂Cr₂O₇, чтобы вода приобрела молочный оттенок. Практика этих образцов работ ICSE по химии 9 класса поможет вам получить хорошие оценки на выпускных экзаменах. Присоединись бесплатно. 1. Сертификат NIOS | Процесс загрузки, Критерии сертификации NIOS, Сертификат NCL (Сертификат без сливочного слоя) | Как подать заявку? Решения Frank ICSE для химии класса 9 — Практическая работа СТРАНИЦА №: 170 Решение 1. При нагревании определенных твердых веществ они не плавятся и напрямую преобразуются в газообразную форму, этот процесс прямого преобразования твердых веществ в газообразную форму называется сублимацией. .Посетите официальный веб-сайт CISCE для получения подробной информации о ICSE… Все решения практической работы — химия подробно объяснены экспертами, чтобы помочь студентам подготовиться к экзаменам ICSE. ТЕМА: Практическая химия. Ожидается, что кандидаты выполнили следующую минимальную практическую работу. СОВЕТ: ICSE. 9 класс; Изучать . CuCO₃, ZnCO₃, Na₂CO₃.10H₂O, CuSO₄.5H₂O, Zn (NO₃) ₂, Cu (NO₃) ₂, Pb (NO₃) ₂, NH₄Cl, I₂, (NH₄) ₂Cr₂O₇. Простые эксперименты: Воздействие тепла на следующие соединения: Все эти тесты доступны в Интернете.Решение 2: Декрепитация — это процесс дробления твердых частиц при нагревании, который издает потрескивающий звук. Исследования ICSE Class 9 играют важную роль в создании прочной основы для сдачи экзамена CBSE Class 10 Board. ICSE. Иметь значение; Язык химии; Водород; Класс 9. Руководство по химии в лаборатории ICSE: страницы записной книжки были добавлены сюда только для удобства студентов. Решение 9: Точечные источники загрязнения воды: Источники загрязнения воды, которые сбрасываются непосредственно в источник воды, называются точечными источниками загрязнения воды.Extramarks предоставляет программу по химии 9 класса ICSE, образцы вопросов, материалы для онлайн-обучения, заметки к 6 классу ICSE, электронные обучающие видео, 6 класс ICSE… В рубриках: Химия, Фрэнк, Фрэнк ICSE, ICSE С тегами: Фрэнк ICSE, Фрэнк ICSE Chemistry, Фрэнк ICSE Chemistry Solutions, Франк ICSE, класс 9, химия, Франк ICSE, класс 9, химические решения, Frank ICSE, класс 9, химические решения — практическая работа, Frank ICSE, класс 9, решения, Frank ICSE, Frank ICSE, Решения для химии класса 9, вопрос за предыдущий год ICSE Papers Class 10, Frank ICSE Class 9 Chemistry Solutions — Практическая работа, Frank ICSE Solutions for Class 9 Chemistry, Concise Mathematics Class 10 Solutions ICSE, Concise Chemistry Class 10 Solutions ICSE, Concise Mathematics Class 9 Solutions ICSE Essentiality Certificate | Процесс подачи заявки, критерии отбора, формат, спортивный сертификат | Формат, использование и образцы спортивного сертификата, справки о занимаемой должности | Сертификат занимаемой должности в Индии, формат и важность сертификата занимаемой должности.Здесь мы представили список научных экспериментов, которые… //]]> Решения ICSE по краткой химии, класс 9. Кандидатам будет предложено наблюдать за действием реагентов и / или тепла на поставляемые им вещества. РЕЗЮМЕ- • Идентификация газов. Преимущества ежедневных практических тестов по химии ICSE Class 9 на LearnPick. Формат, критерии приемлемости, необходимые документы, сертификат BIS | Как получить сертификат BIS? Упражнения будут простыми и могут включать распознавание и идентификацию определенных газов, перечисленных ниже.Учебный класс. Синяя соль меняется на белую, а затем на черную 1) Дихромат аммония, 2. Основные постулаты кинетической теории материи и объяснение изменения состояния на основе. СТРАНИЦА №: 170 Решение 1. При нагревании определенных твердых веществ они не плавятся и сразу переходят в газообразную форму. Этот процесс прямого преобразования твердых веществ в газообразную форму называется сублимацией. На этой странице вы найдете подробный список тем, рассматриваемых в разделе «Химия». Руководство по лабораторной работе было специально написано для студентов, готовящихся к экзамену на получение аттестата о среднем образовании в Индии (ICSE), который проводится Советом по экзамену на аттестат школы Индии в соответствии с последним планом Совета для годового экзамена.За внутреннюю аттестацию практической работы выставляется 20 баллов. D. Влияет на подкисленную бумагу K₂Cr₂O₇, а также делает известковую воду молочной. Временная жесткая вода и постоянно жесткая вода. Совместно с лабораторией ICSE Лаборатория практической химии для 9 класса была подготовлена строго в соответствии с новой программой, предписанной советом для сдачи экзамена на получение аттестата о среднем образовании в Индии (ICSE). Наши решения Selina для Concise Science Chemistry 1 Class 9 ICSE охватывают все: от языка химии, химических изменений и реакций, воды, атомной структуры и химической связи, периодической таблицы, исследования первого элемента — водорода, изучения законов газа, атмосферы. Загрязнение, Практическая работа и другие темы.Найдите Рабочий лист ICSE для главы 11 практического класса химии 9. Столбец A Столбец B, 1. 2. Для химии ICSE класса 9 важно, чтобы вы регулярно пробовали пробные тесты, чтобы узнать, можете ли вы вспомнить или вспомнить все во время экзамена . ПРАКТИЧЕСКАЯ ХИМИЯ. Процесс подачи заявления и аудита, Сертификат члена семьи | Процесс подачи заявки, как подать заявку? window .__ mirage2 = {петок: «3532c4943b1f69b73c9ff41891821f56e5ab8eb0-1612447098-1800»}; Выберите нужную главу, чтобы получить доступ ко всем соответствующим заметкам, учебным материалам, практическим заданиям, образцам работ, вопросам и решениям для тестов и видео.Как вы будете различать… Список всех глав, охваченных онлайн-учебным материалом курса, приведен выше. Руководство по химической лаборатории ICSE для классов 10 и 9 доступно здесь. Получите исчерпывающий план по химии ICSE для класса 9 в Speed Labs вместе со списком лучших справочников по химии для класса 9, чтобы взломать ваши предстоящие экзамены. • Жесткая и мягкая вода, типы жесткости (временная и постоянная), мыло и моющие средства. Фиолетовое твердое вещество сменяется фиолетовыми парами. 5) Красный свинец.Практические занятия ICSE Lab для класса 9 были подготовлены строго в соответствии с новой программой, предписанной советом для сдачи экзамена на получение аттестата о среднем образовании в Индии (ICSE). Здесь мы предлагаем программу обучения химии ICSE на 2020-2021 годы для 9-го и 10-го классов. Кандидаты могут проанализировать общую структуру курса и хорошо подготовиться с помощью программы ICSE Chemistry Syllabus 2021 для классов 9 и 10. четкое понимание учебной программы и схемы выставления оценок, чтобы подготовить лучшую стратегию для… (i) Объяснение изменения состояния материи на основе кинетической теории материи.Класс 8. Вираф Дж. Далал. Химия. Класс 9. Решения и ответы. Видео-урок. Учебная программа по химии для 9 класса ICSE — Загрузите в формате PDF Книги по биологии для 9 класса ICSE. Концепции, охватываемые в Краткой научной химии 1 Класс 9 Глава 9 ICSE 9 Практическая работа: написание химических формул, наименование определенных соединений, концепция атомной массы, концепция молекулярной массы, химическое уравнение, процентный состав, эмпирическая формула соединения, концепция языка химии , Символ элемента, концепция валентности, радикалы, химическое уравнение, происхождение символов элементов, концепция водорода, баланс простых уравнений, концепция химии… 011-40705070 или позвоните мне ПОКУПКА.2. Два нитрата, не образующие диоксид азота при нагревании. Студентам необходимо провести 5 экспериментов, которые упомянуты ниже: Список экспериментов для практических занятий по химии 9 класса ICSE Наши решения Вирафа Дж. Далала для упрощенного курса химии ICSE 9 класса охватывают все: от языка химии, химических изменений и реакций, воды, атомной структуры и т. Д. Химическая связь, Периодическая таблица, Изучение первого элемента — водорода, Изучение законов газа, Загрязнение атмосферы, Практическая химия и другие темы.8 В чем причина жесткости воды? Глава 6 Изучение первого элемента водорода. Если да, то как? Межчастичное пространство и межчастичное притяжение и столкновение. Что вы наблюдаете, когда разбавленная серная кислота добавляется к следующему: 7. Глава 5 Периодическая таблица. В классе 9 ICSE по биологии студенты будут изучать главы по базовой биологии, цветущим растениям, физиологии растений, разнообразию живых организмов / экосистем, анатомии и физиологии человека, здоровью и гигиене, образованию и управлению отходами.Образцы материалов по химии 9 класса ICSE были подготовлены предметными экспертами Веданту в соответствии с инструкциями, данными учебником ICSE. Например: камфора и хлорид аммония подвергаются сублимации. Решения ICSE Селина Решения ICSE ML Решения Aggarwal. Внутренняя оценка практической работы — Примечания. Проведите химический тест, чтобы различить следующие газы: Copyright © 2020 Entrancei. 5. У вас есть шанс сделать многообещающую карьеру в таких областях, как гостиничный бизнес, здравоохранение, инженерия или биохимия.Глава 4 Атомная структура и химическая связь. CBSE Class 9 Science Practicals — Syllabus, Lab Manual и Kit. Студент добавлял воду в песок и крахмал в разные пробирки. 9-й класс ICSE по химии 9 — Внутренняя оценка практической работы — Примечания. Справка о населении | Процесс подачи заявки и сборы, как подать заявку и отслеживать? Глава 1 Язык химии. Красный цвет меняется на коричневый, а затем на желтый. 3) Нитрат цинка, 4. Источники загрязнения воды можно разделить на два типа — точечные источники и неточечные источники.Физика; Химия; Биология; Математика; Английский; Хинди; Спроси и ответь. Необходимые документы и срок действия, справка о первой помощи | Узнайте о значении, типах и формате справки об оказании первой помощи, письма-соглашения об аренде | Формат и образец письма-договора аренды, оправдательного письма | Как написать оправдательное письмо? Лабораторный практикум по следующим направлениям: Биология | Химия | Физика. Например: камфора и хлорид аммония подвергаются сублимации. MCQ. КЛАСС-9. Учебный материал для практических занятий, ICSE 9 класс ХИМИЯ, Краткая химия.Напишите свое наблюдение и сбалансированное уравнение при нагревании следующих веществ: 10. CBSE. Extramarks.com — это глобальный поставщик решений для онлайн-образования, электронного обучения, подготовки к SAT и цифрового обучения для школ, ориентированных на сегменты K-12 Упрощенная химия Физика Химия Биология Математика География HistoryCivics. Глава 8 Загрязнение атмосферы. Компания Allied Publishers Class 9 Chemistry Chapter 9 Practical Chemistry Solutions разработала решение для изучения лучших идей из исследований, проведенных по этому предмету, которые дополнительно улучшат знания учащихся по решению вопросов за меньшее время, а также познакомят с концепциями хорошо организованного подхода. .B. 9. Классы с 7 по 10 Правление выделило 30 периодов для проведения всех практических занятий. Изучение химии в классе 9 ICSE важно, поскольку оно открывает двери для многих вариантов карьеры. 9-й класс ICSE знаменует собой поворотный момент в жизни студентов, когда они осознают, что поставлено на карту в наступающем году. Загрязнение воды. 9 класс. ДОПОЛНИТЕЛЬНЫЕ ВОПРОСЫ. Компания Allied Publishers Class 10 Chemistry Chapter 9 Practical Chemistry Solutions разработала решение для изучения лучших идей из исследований, проведенных по этому предмету, которые дополнительно улучшат знания учащихся по решению вопросов за меньшее время, а также познакомят с концепциями хорошо организованного подхода. .Решение 2: […] Кислые газы — CO₂, SO₂, Cl₂, HCl, H₂S, NO₂. Два карбоната, которые не выделяют углекислый газ при нагревании. Новые решения ICSE класса 9 по упрощенной химии — Практическая химия. Нитрат свинца при нагревании дряхлеет. Рабочий лист по химии — 11. Другие рабочие листы ICSE для класса 9 по естествознанию можно найти на главной странице Entrancei. все права защищены. (ii) Закон сохранения массы и объяснение с примерами. Химия является одним из основных предметов в классе 9 ICSE. Практическая химия Далал Упрощенные решения ICSE для класса 9 Глава 9.5. Превращает влажную крахмально-йодную бумагу в сине-черный цвет. Каждая тема ведет на страницу, содержащую практические вопросы с подробными решениями по этой теме. Другие рабочие листы ICSE для 9-го класса по естествознанию можно найти на главной странице Entrancei. Итак, Extramarks собрал учебные материалы ICSE 9-го класса практической химии, чтобы помочь студентам. Практикум по управляемой химии W / B — ISC Class XI Подробнее. Примечание. — Перед просмотром «Решения практической химии» доктора Вирафа и Дж. Далала. Упрощенные химические решения ICSE из главы 9.Внимательно прочтите главу 4 «Практическая химия», чтобы лучше понять концепцию. После прочтения главы 9 «Практическая химия» решите все примеры из своего учебника с помощью образца бумаги ICSE для экзамена 10 класса… Обширные рабочие листы и полные контрольные работы по математике, естествознанию, английскому языку, истории, обществоведению и географии! A-1, Ачарья Никатан, Маюр Вихар, Фаза-1, Центральный рынок, Нью-Дели-110091, Рабочий лист Махараштры для науки класса 9, Рабочий лист Махараштры для класса 9 Математика, Важные вопросы CBSE Class 10 Science.//Стажировка в нефтяной инженерии 2021 г., Работа в округе средней школы Tempe Union, Insinkerator Complete против эволюции, Календарь округа начальной школы Альгамбры на 2020-2021 годы, Распродажа свитеров Devold, 02231 Состояние движения поезда вчера, Размеры болта M10, Цены на вход в Маннингтон-холл, Размеры болта M10,
Frank Chemistry Solutions Глава 11 Практическая работа для 9 класса PDF
Frank Chemistry Solutions Глава 11 Практический урок 9 для ICSE — это полное руководство для решения сложных вопросов из учебника Фрэнка.Используйте Frank Chemistry Solutions, чтобы познакомиться с концепциями и практиковаться, чтобы получить высокие оценки. Frank Chemistry Solutions Глава 11 Практическая работа предпочтительнее во всем мире. Эти книги распространяются в более чем 100 странах, и студенты во всем мире предпочитают их. Школы ICSE в нашей стране также поддерживают Frank Solutions. Итак, в Индии широко известны книги Frank Chemistry Solutions Chapter 11 «Практическая работа». SelfStudys предлагает Фрэнк Chemistry Solutions Class 9, который поможет студентам ICSE набрать высокие баллы и усвоить все основы, касающиеся предмета.
Наши решения Frank Chemistry Solutions Глава 11 «Практические задания для 9 класса» созданы экспертами-предметниками и служат прекрасным примером для ответа на самые сложные вопросы вашего экзамена. Они полезны при изучении и позволяют хорошо подготовиться к экзамену. Эти пошаговые решения Frank, созданные экспертами, служат ценным подспорьем для студентов, чтобы лучше изучить концепции, изучить и подготовиться к экзаменам. Наши практические занятия по химии Frank Chemistry Solutions, глава 11, доступны для студентов ICSE двух классов, таких как класс 9 и класс 10.Они предоставляют комплексные решения по двум основным предметам, таким как естествознание и математика.
ICSE — это известные советы по образованию, которые проводят экзамены по всей стране. ICSE также является одной из лучших досок с самой надежной учебной программой. Совету ICSE рекомендовано всего несколько учебных пособий, таких как Frank Modern (первоначально Frank Brothers & Co.), которые охватывают некоторые чудесные учебники для студентов ICSE. Frank Chemistry Solutions Глава 11 Практические работы не только хорошо известны в Индии, но и предлагаются студентами во всем мире.
Решения Frank Chemistry для класса 9 PDFВ 9 классе химия — это предмет с большой программой, что делает его очень сложным для учащихся. Химия охватывает некоторые из самых сложных глав. Все эти главы охватываются нашими последними решениями вопросов в главе 11 Практическая работа Frank Chemistry Solutions.
РешенияFrank для учебников, разработанные SelfStudys, предоставляют учащимся огромные шансы получить более высокие баллы на экзамене, поскольку они были разработаны экспертами-предметниками.Наши предметные эксперты создают решения в соответствии с последними руководящими принципами программы ICSE, и эти решения эффективны, поэтому вы можете получать более высокие оценки.
Вы не можете пропустить главы в программе ICSE Class 9 по химии, потому что мы разработали решения по главам. Наши решения по химии, глава 11 «Практическая работа для 9 класса ICSE» — это полное руководство по ответам на эти сложные вопросы в вашем учебнике.
Преимущества Frank Chemistry Solutions Глава 11 Практический рабочий класс 9 для ICSE:- Пошаговые подробные решения
- В наличии бесплатно
- Подготовил опытный преподаватель
- Подготовка к экзамену стала проще
- Охватить все предметы 9 и 10 класса.
- Легкая онлайн-доступность
- Разработан в соответствии с последними рекомендациями программы ICSE
Наша программа Frank Chemistry Solutions Глава 11 Практическая работа для класса 9 может помочь учащимся успешно сдать экзамен, поскольку Frank Chemistry Solutions включает в себя все главы.На вопросы учебников отвечают наши специалисты с более чем 10-летним академическим опытом преподавания. Наши решения Frank Chemistry Solutions — один из самых удобных способов узнать все главы и получить хорошие баллы на выпускном экзамене.
Вы можете скачать здесь Frank Chemistry Solutions Глава 11 Практическая работа для класса 9 Глава мудрый:Практическая наука дома в условиях пандемии
Существует множество онлайн-ресурсов, позволяющих продолжить обучение для студентов, которые не могут поступить в университеты во время пандемии, но какие существуют варианты практических аспектов научных курсов? Дарен Дж.Каруана, Кристоф Г. Зальцманн и Андреа Селла предлагают манифест для домашних экспериментов.
Как вы управляете учебной лабораторией первого курса бакалавриата, которая удерживает студентов физически дистанцироваться во время пандемии COVID-19? Это вопрос, над которым ученые всего мира борются с 1 , поскольку мы задаемся вопросом, как занятия возобновятся осенью.Было много разговоров о предоставлении студентам наборов данных для анализа и об использовании одного из новых виртуальных лабораторных тренажеров, которые были разработаны. Но ничто из этого не решает проблему того, как мы можем заставить студентов испытать практические научные процедуры без полностью укомплектованной и поддерживаемой учебной лаборатории. Обдумывая это, мы начали задаваться вопросом, могут ли студенты выполнять свои практические задания дома. Мы начали представлять, как посылают каждому ученику набор, семя для домашней научной лаборатории; по сути, химический набор для двадцать первого века.
Химический набор вызывает сильные эмоции. У людей определенного возраста упоминание химического набора часто вызывает туманные и элегические воспоминания о «старых временах», когда опасные химические вещества можно было просто получить в местной аптеке («химик») и можно было проводить поразительные эксперименты. с химическими веществами, которые сегодня считаются не имеющими значения. Но реально ли влияние химического набора? Всякий раз, когда возникает эта тема, небольшое исследование неизменно показывает, что не менее важным было влияние наставника — родственника («дядя Вольфрам») 2 , соседа или учителя, который помогал поощрять и направлять действия.
Одному из нас (A.S.) дали химический набор в возрасте 10 лет, и после того, как закончились pH-бумага и бикарбонат, набор был поставлен на полку. Как ни странно, это то, что мы слышали от многих учеников и родителей: наборы для химии покупаются с добрыми намерениями, но являются одними из тех подарков, которые для большинства детей быстро теряют свою привлекательность. Это также может быть связано с их маркетингом. Наборы для химии всегда продаются с надписью «Опасно», а на бутылках есть тщательно продуманные надписи «ВНИМАНИЕ».Начинающим химикам не понадобится много времени, чтобы обнаружить, что они вряд ли смогут прожечь дыры в таблицах с помощью «молекулярной кислоты» или поджечь свою школу или районный полицейский участок. Эта маркетинговая стратегия полностью искажает суть химии — это искажение химии, часто самим химическим сообществом, — это то, к чему один из нас (AS) попытался обратиться к 3 в лекции Майкла Фарадея в 2015 году. Более коварно, в фокусе. по определенным химическим веществам ограничивает объем набора только этими веществами и немногим более.В конце концов, то, что отличает настоящую науку от «покажи и расскажи» или от того, что Эрнест Резерфорд назвал «коллекционированием марок», — это измерение.
Мы живем в золотой век легкодоступных инструментов благодаря сочетанию смартфонов и огромных онлайн-магазинов, где все виды инструментов можно купить за копейки. Поэтому давайте представим, что даем каждому студенту набор инструментов не только для химии, но и для естественных наук. Затем набор отправлял студентов в индивидуальное путешествие для наблюдения и измерения многих физических явлений, о которых они, возможно, слышали, но, возможно, никогда не видели за пределами онлайн-видео.Что будет в этом комплекте (см. Вставку 1) и куда может привести это путешествие?
Коробка 1 Возможное содержимое базового ящика для инструментов (бюджет ~ 60–100 фунтов стерлингов)
Блокнот
Пластиковая линейка и транспортир
Смартфон с камерой
Накладной микроскоп
Цифровой термометр
Кухня весы (до 3 кг, точность: ± 1 г)
Ювелирные весы (до 100 г, точность: ± 10 мг)
Лазерная указка (любого цвета)
Некоторые пластиковые градуированные пипетки (3 мл) или механическая пипетка (0.3–5 мл)
Портативный pH-метр
Цифровой мультиметр
Защитные очки
Набор светодиодов разных цветов (включая 1 УФ-светодиод) и резисторов
Аккумулятор
Коробка LEGO с основание и некоторые детали с отверстиями в них
Провода с зажимами «крокодил»
Квадрат поляризационной пленки
Квадрат пластиковой дифракционной решетки
Мы начинаем с того, что просим учащихся испечь торт (рис. 1). Многим химикам не понравится простая ассоциация химии и кулинарии — знаменитый учебник лабораторных занятий Гаттермана, который использовался в Европе и Северной Америке более 50 лет, был назван «поваренной книгой Гаттермана» 4 .Тем не менее, Имперский колледж здесь, в Лондоне, недавно ввел кулинарные занятия в начале своего курса в качестве подготовительного шага перед переходом в химическую лабораторию. Это вдохновляющая идея. В выпечке торта есть игривость, которая должна не только задавать тон всей программе практических занятий, но и обеспечивать тщательное введение в работу в лаборатории. В конце концов, любой научный протокол имеет параллели с рецептом. Ингредиенты / реагенты должны быть собраны — и в правильных количествах. В комплекте должны быть цифровые весы с точностью ± 1 г.Выбор рецепта торта на основе массы используемых яиц требует, чтобы ученик / повар правильно масштабировал количества, но также вводит идею ограничивающего реагента.
Рис. 1. Научные эксперименты дома.По часовой стрелке снизу слева, мыло на воде: простой способ измерения молекулярных размеров — вдохновленный Ирвингом Ленгмюром — с помощью талька, посыпанного водой. Выпечка торта: масштабируемый аналог сложного синтеза. Оптическое вращение и двойное лучепреломление: измеряется с помощью ЖК-экрана и линейного поляризационного фильтра.Криоскопия с помощью термопар: ворота в термодинамику. Фотография торта любезно предоставлена Мирандой Моллой.
Помимо массы, процедуры приготовления требуют внимания к контролю температуры, смешиванию и теплопередаче, особенно если учащиеся ставят перед собой задачу увеличения или уменьшения масштаба. Возможно, самое главное, рецепты представляют собой идею о том, что любой набор инструкций включает в себя предвзятые представления о знаниях учащегося. Здесь есть место для обсуждения одного из аспектов «кризиса воспроизводимости» — того факта, что в экспериментальных разделах часто упускаются важные детали (например, смазка олова, какая «смазка» и сколько?), Не обязательно из-за злого умысла экспериментаторами, а скорее через их скрытые предположения и бессознательную предвзятость.
Следующим прибором в коробке будет цифровой термометр. Термопары позволяют измерять температуру от –50 до 1000 ° C, от морозильной камеры до пламени свечи. Вооружившись гибкой термопарой, ученик может начать задавать вопросы. Например, одна из наиболее распространенных причин печально известного кризиса воспроизводимости в кулинарных книгах — это разница в температуре между духовками. С помощью термопары студент может исследовать это точно так же, как осторожные химики твердого тела проверяют температурные профили своих печей; учащийся также может установить более точный критерий того, когда их пирог испечется — когда внутренняя температура достигает определенной температуры — чем традиционный качественный тест на влажную шпажку.Лучше готовить через химию.
Комбинация термопары и весов естественным образом приводит к калориметрии. Студенты должны проводить классическую чайниковую калориметрию. И теплоемкость воды, и ее энтальпия испарения («скрытая теплота») могут быть измерены с удивительной точностью, если известна потребляемая мощность чайника. Если теперь учесть, что термопары могут считывать показания с точностью ± 0,5 ° C, становится возможным измерить энтальпию плавления льда, просто смешав взвешенные количества льда и воды (рис.1). Здесь возникают две проблемы. Прежде всего, непосредственное наблюдение за порядками величин этих величин — отличная тема для обсуждения, актуальная для термодинамики вещества и имеющая огромное значение для будущих ученых, занимающихся землей и климатом. Во-вторых, эти измерения имеют существенные ограничения. Это идеальная среда для анализа ошибок. Имеет ли значение изоляция чайника для измерения? Насколько велика неопределенность в номинальной мощности чайника? Дело в том, что очень низкотехнологичный характер этих практических занятий может помочь нам научить студентов принимать неопределенность — и, в частности, анализ ошибок — как инструмент для улучшения экспериментальных протоколов.
Взвешивание бутылки с минеральной водой позволяет студенту изучить растворимость углекислого газа. Можно получить достаточно хорошую оценку распределения между жидкой и газовой фазами (благодаря умеренно медленной кинетике зарождения пузырьков), просто взвесив бутылку. Важность нуклеации для кинетики также может быть исследована путем добавления различных твердых веществ и контроля веса как функции времени. И смехотворное никогда не за горами благодаря очень грязной демонстрации Diet Coke / Mentos 5 .
Исследование льда, соли и воды погружает нас в настоящую тайну коллигативных свойств, и, включив цифровые ювелирные весы (которые могут считывать до ± 10 мг) в наш набор инструментов, можно приготовить стандартные растворы; мы можем проверить закон Рауля, используя такие ингредиенты, как соль, сахар и пищевая сода. В качестве забавного выхода из количественной термодинамики низкие температуры, достижимые с помощью соли, позволяют учащимся переохлаждать бутылки с водой или делать мороженое на заказ; таким образом, классические демонстрации и мероприятия на уровне детских праздников заново изобретаются для более продвинутых учеников.
pH-метр — следующий инструмент в нашем наборе инструментов. После первоначального подхода к «сбору штампов» по измерению предметов в доме («Какой самый щелочной продукт для дома?») Или тестирования телесных жидкостей (только представьте, насколько это возможно…) мы можем приступить к серьезному изучению кислот и оснований. которые являются основным материалом для химии, наук о Земле и биологических наук. С помощью ювелирных весов можно приготовить стандартный раствор NaOH (первый реагент, входящий в набор), а затем титровать бытовой уксус классическим методом титрования сильным основанием и слабой кислотой, чтобы получить как концентрацию, так и p K а .Хотя такое титрование может быть выполнено с использованием пластиковых мерных пипеток, а не бюретки, за дополнительные 35 фунтов стерлингов в коробку можно включить базовую механическую пипетку / пипетку Марбурга, квинтэссенцию прибора, которая сигнализирует о том, что «высококлассный ученый» имеет время познакомиться с его использованием.
Другие объекты для титрования включают средство для удаления накипи (молочная или лимонная кислота) и винный камень (гидротартрат калия). Измерения pH в бутылке с минеральной водой, наряду с ранее проведенными измерениями массы, могут дать ценную информацию об окружающей среде и открыть важные дискуссии о закислении океана и других глобальных проблемах.Возвращаясь к простым кислотно-основным реакциям, их можно повторить в препаративном масштабе, чтобы получить объемные количества солей, которые можно использовать для других целей. Ацетат натрия, с одной стороны, является классическим химическим буфером, но также является компонентом грелок для рук и предметом бесконечных демонстраций «горячего льда», недалеко от которых обсуждается зародышеобразование кристаллов. При небольшой поддержке студент мог разработать метод измерения энтальпии раствора этой соли. Напротив, реакция зубного камня с пищевой содой (гидрокарбонат натрия) дает соль Рошеля, KNaC 4 H 4 O 6 · 4H 2 O, которая образует впечатляющие пьезоэлектрические кристаллы.pH-титрование также можно использовать для исследования стабильности коллоидов — добавление кислот в молоко может помочь сосредоточить внимание на электростатическом отталкивании, которое разделяет жировые шарики. Позднее студенты могут приготовить панир / фрез-блан для кулинарных исследований. Но в эпоху, когда другие виды «молока» стали обычным явлением, молоко млекопитающих можно сравнить друг с другом или с его заменителями из овса, риса, орехов или сои.
Далее в коробке находятся мультиметр, аккумулятор, набор светодиодов и немного LEGO.Несколько учителей химии использовали их для создания колориметров / флуориметров 6 . С помощью «спектрометра» LEGO можно проводить исследования Бера – Ламберта. Если в коробку включены УФ-светодиод и несколько сотен миллиграммов сульфата хинина, студент может создать калибровочные кривые для определения концентрации алкалоида в тонической воде, а затем пойти дальше и использовать кинетику Штерна-Фольмера для изучения тушения флуоресценции. Если кто-то хотел по-настоящему повеселиться, ученик мог попробовать их разбавленные растворы хинина (отголоски известного теста Сковилла на капсаицин) и использовать результаты для сравнения чувствительности вкусовых рецепторов с чувствительностью глаза и светодиодного детектора.
Использование термопар и светодиодов предполагает включение комплекта микропроцессора начального уровня в набор инструментов. Светодиоды колориметра / флуориметра теперь могут управляться и считываться с помощью Arduino или Micro: bit, а данные передаваться на домашний компьютер 7 . Теперь программирование можно легко включить в образовательную программу, мероприятия, которые открывают возможности для создания либо проектов в области гражданской науки, либо сотрудничества со студентами художественных или архитектурных школ для создания экологически безопасных произведений искусства.Таким образом, узкий лабораторный курс бакалавриата теперь может быть открыт и стать отправной точкой для других разговоров, а не самоцелью.
Производство мыла открывает путь в органическую химию, но с физическими особенностями. Гидролиз животного или растительного жира — это простая процедура, которая начинается с NaOH и должна выполняться тщательно и количественно. Температуру плавления можно определить с помощью термопары и водяной / ледяной бани. Продукт можно проверить на безопасность с помощью pH-метра.В отсутствие спектроскопических характеристик можно было бы почерпнуть вдохновение у Агнес Поккельс 8 и Ирвинга Ленгмюра для измерения молекулярных размеров мыла (рис. 1). Известную массу можно выложить на поверхность противня, присыпанную тальком. Диаметр получившегося круга без талька можно измерить линейкой. Даже с весьма упрощенными предположениями о молекулярной массе и плотности можно установить, что молекулы на поверхности воды в несколько раз длиннее их диаметра.
Доступность домашнего мыла естественным образом приводит к красивым экспериментам с поверхностным натяжением: плавающие и толкающие предметы по жидкостям, выдувание пузырей, просмотр пены между предметными стеклами микроскопа, использование рамок вешалок для визуализации поверхностей с минимальной энергией. Измерение и изменение углов контакта жидкостей с поверхностями приводит к дискуссии о гидрофильности и гидрофобности. Определение подходящих гидрофобных поверхностей может привести к микромасштабной неорганической химии в каплях 9 , что, в свою очередь, дает константы диффузии для ионов.Более того, с мобильными телефонами и их все более совершенными камерами (представьте себе slo-mo) такие эксперименты могут стать чрезвычайно интересными и широко распространенными.
Включенная в комплект лазерная указка позволяет учащимся играть с оптикой. Они могут измерять показатели преломления жидкостей — добавление капель молока в воду делает лучи видимыми, что позволяет сфотографировать положение лазерной указки и луча. Затем фотографию можно проанализировать с помощью цифровых инструментов или транспортира. Но монохроматический характер лазера означает, что с помощью дифракционной решетки можно измерить длину волны света и использовать информацию для оценки толщины мыльных пленок.Сама лазерная указка может использоваться для изображения микроорганизмов (например, тихоходок) в каплях воды пруда и, если камера оборудована дешевым микроскопом (например, Foldscope; https://www.foldscope.com) , лазер можно использовать в качестве источника света для дешевого ультрамикроскопа Зигмонди, с помощью которого можно наблюдать броуновское движение.
Наконец, с промокательной бумагой и мелками, микрофлюидика с восковыми каналами может быть использована не только для простой бумажной хроматографии, но и для разработки микромасштабных анализов.Например, включив в набор хлорид меди вместе с NaOH и солью Рошеля, можно представить себе использование теста Биурета для обнаружения аминокислот и пептидов — возможно, в чае, других настоях и пищевых добавках — и начать разработку самодельных индикаторных полосок. датчики, аналогичные широко используемым в настоящее время в здравоохранении.
Приведенный выше список только начинает отражать бесчисленное множество направлений, в которых может быть использован этот подход. Выращивание кристаллов, изготовление сахарного стекла, пьезоэлектричество, поляризация, оптическое вращение и двойное лучепреломление, эластичность, электрофорез, магнетизм и магнитное выравнивание могут быть включены в эти мероприятия.Что отличает эту структуру, так это то, что она ставит измерения в самый центр, а «химические вещества» играют почти второстепенную роль. Там, где используются химические соединения, одни и те же используются снова и снова, чтобы выделить различные области науки: если вы измеряете и изучаете одно химическое вещество, вы можете измерить их все.
Ни одна из представленных здесь идей не является новой. Действительно, научно-образовательные журналы, научно-популярные книги и сайты популяризации науки 10 содержат множество идей, которые можно адаптировать для такого экспериментального обучения.Но есть один важный нюанс. Хотя программа должна быть подкреплена разнообразными текстовыми и видео-ресурсами, для студентов этот проект будет по-настоящему процветать только при значительном, преданном наставничестве и поддержке. Как и в случае недавних дебатов об инициативе «Один ноутбук для ребенка» (http://one.laptop.org), простая отправка студентам инструмента мало способствует их обучению. Это аспект наставничества, который имеет решающее значение. Для личной поддержки, вдохновения и рекомендаций должна быть доступна оперативная онлайн-служба поддержки.Также должны быть установлены сроки подачи заметок, графиков, замеров, фотографий, видео и так далее; у проекта есть масса возможностей для ведения блога, который предоставит столь необходимую практику в написании научных статей и разработке электронного портфолио. И, что, возможно, наиболее важно, в конце каждой недели необходимо проводить встречи с наставниками / наставниками, чтобы обдумать и переварить (иногда буквально) то, что было сделано, а затем подготовиться к следующему этапу практической последовательности. В настоящее время мы разрабатываем руководство для домашних лабораторий, которое будет сопровождать этот набор инструментов для экспериментального обучения.
Отнюдь не детский подход к «кухонной» науке, основанный на инструментах, сильно укрепляет идею о том, что структурированное мышление и простые инструменты являются воротами к познанию мира (часто называемым «научным методом»). Трудности настройки измерения практически с нуля, без технических специалистов для подготовки оборудования и решений, могут помочь привить дух импровизации; Отсутствие строгих лабораторных графиков также дает студентам больше времени и причин для того, чтобы побродить с этими инструментами, построить свою домашнюю лабораторию и совместно работать над испытанием.Кризис COVID-19 создал множество проблем; Давайте посмотрим, можно ли использовать это как возможность для глубоких изменений в нашем подходе к практическому образованию — изменений, которые приведут наши учебные лаборатории в соответствие с теми, в которых мы проводим наши исследования.
Ссылки
- 1.
Andrews, J. L. et al. J. Chem. Educ. 97 , 1887–1894 (2020).
CAS Статья Google ученый
- 2.
Сакс, О. Дядя Вольфрам: Воспоминания о детстве в химии (Penguin Random House, 2001).
- 3.
Королевское общество https://royalsociety.org/science-events-and-lectures/2015/02/faraday-prize-lecture/ (2015).
- 4.
Селла, Поваренная книга А. Гаттерманна. Chemistry World https://www.chemistryworld.com/opinion/gattermanns-cookbook/3009053.article (2018).
- 5.
Патрик, Х., Хармон, Б., Кунсе, Дж. И Эйхлер, Дж.F. J. Chem. Educ. 84 , 1120–1123 (2007).
Артикул Google ученый
- 6.
Квиттинген Э. В., Квиттинген Л., Бернт Мелё Т., Сюрснес Б. Дж. И Верли Р. J. Chem. Educ. 94 , 1486–1491 (2017).
CAS Статья Google ученый
- 7.
Kubínová, Š. & Šlégr, J. J. Chem. Educ. 92 , 1751–1753 (2015).
Артикул Google ученый
- 8.
Желоб Селла, А. Поккельса. Chemistry World https://www.chemistryworld.com/opinion/pockels-trough/8574.article (2015).
- 9.
Worley, B., Villa, E.M., Gunn, J.M. & Mattson, B. J. Chem. Educ. 96 , 951–954 (2019).
CAS Статья Google ученый
- 10.
YouTube https://go.nature.com/chemistryinyourcupboard (2020).
Скачать ссылки
Благодарности
Многие соучастники заговора внесли свой вклад в этот набор идей, в том числе Алом Шаха, Майкл Деподеста, Кэрол Кенрик, Стив Прайс, Деви Льюис, Эмре Сенер, Анна Роффи, Патрик Томпсон, Марк Миодовник, Стефан Гейтс, Боб Уорли, Крис Ховард, Стивен Поттс, Том Миллер, Хелен Черски, Сара-Джейн Блейкмор, Пол Макмиллан, Мартин Уитворт и многие другие.
Информация об авторе
Заметки об автореTwitter: @CGS_Lab; @SellaTheChemist
Принадлежности
Департамент химии, Университетский колледж Лондона, Лондон, Великобритания
Дарен Дж. Каруана, Кристоф Г. Зальцманн и Андреа Селла
Автор, ответственный за переписку
Переписка на Андреа Селла.
Декларации этики
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Об этой статье
Цитируйте эту статью
Caruana, D.J., Salzmann, C.G. & Селла, А. Практическая наука дома в мире пандемии. Нат. Chem. 12, 780–783 (2020). https://doi.org/10.1038/s41557-020-0543-z
Скачать цитату
Краткие химические решения ICSE Class-9 Selina Publishers
Пересмотренный ICSE Concise Chemistry Part 1 Class 9 Solutions
Краткая химия ICSE Class-9 Solutions Selina Publishers.Глава Мудрые решения Selina Publishers Concise Chemistry для ICSE Class 9 . Шаг за шагом Краткая химия Решения для ICSE класса 9. Следовательно, все вопросы типа решаются и объясняются опытными преподавателями в соответствии с рекомендациями совета ICSE. Поэтому, просмотрев эти решения ICSE Concise Chemistry , вы можете легко получить хорошие отметки на экзаменах Совета ICSE.
Краткие химические решения ICSE Class-9 Selina Publishers
Публикации Селины наиболее известны среди студентов ICSE.Тем не менее, есть много других публикаций по химии ICSE Class-9. Мы предлагаем пошаговые решения всех типов вопросов. Поэтому мы включаем Intext вопросы, вопросы для упражнений, вопросы, основанные на рисунках, и другие решенные вопросы важного типа.
Известный писатель по химии (публикация) для 10-го класса ICSE
Как решить ICSE Chemistry Class 9
Мы должны строго соблюдать следующие правила.
- Внимательно прочтите каждую главу.
- Делайте мудрые заметки для самостоятельных глав.
- Выделите важный момент в ваших заметках.
- Попытайтесь понять основную концепцию.
- Решите весь пример вашего учебника.
- Затем попробуйте выполнить упражнение «Все типы вопросов».
- Воспользуйтесь справкой по решениям, указанным с ключевым словом.
- Решите образец работы по химии ICSE на основе сокращенной программы на 2020-21 годы
Get Chapter Wise Solutions of ICSE Class 9 Concise Chemistry
1.Язык химии,
2. Химические изменения и реакции
3. Вода
4. Атомная структура и химическая связь
5. Периодическая таблица
6. Изучение первого элемента — водорода
7. Изучение законов о газе
8. Загрязнение атмосферы (не в программе 2020-2021 гг.)
9 Практикум.
Вернуться к — Решения для учебников ICSE Class-9, Бумага, заметки, Syllabus
Спасибо
9 микромасштабных советов для улучшения вашей практической работы по химии
Девять микромасштабных советов, которые помогут улучшить вашу практическую работу по химии 20 ноября 2017 г.Несколько недель назад я провел увлекательный день с Бобом Уорли в CLEAPSS; и для моего первого сообщения в блоге Боб любезно поделился 9 практическими приемами Microscale, которые он разработал из арсенала CLEAPSS.
Что такое химия на микромасштабах?
Микромасштабная химия предполагает работу с небольшими количествами веществ, а использование микромасштабных методов может повысить скорость, безопасность и стоимость практических занятий по химии, а также может снизить когнитивную нагрузку на учеников.
К сожалению, риски, логистика, расходы и время часто могут препятствовать практической работе в науке, и иногда остается мало времени, чтобы обсудить теорию во время урока.
Давайте начнем с советов, которые помогут преодолеть некоторые проблемы на ваших уроках естествознания.
Совет 1 — Сравнение цветов индикаторов
Цвета растворов индикаторов pH делают Microscale привлекательной и практичной. Этот метод экономит время на мытье посуды для технических специалистов, а также снижает затраты на растворы.
В этом простом методе используется ламинированный лист, где учащиеся смешивают растворы и индикаторный раствор небольшими каплями на ламинированном листе. Это уменьшает объемы необходимых растворов, что снижает затраты, изменения цвета ясны, а протирание бумажным полотенцем — это все, что нужно для очистки — великолепно!
Совет 2 — Реакции осаждения
Этот второй наконечник позволяет сэкономить время и также использует ламинированный лист.
Учащиеся добавляют по два растворимых твердых вещества в каждую сторону небольшой «лужи» с водой. Когда они растворяются, диффундируют и встречаются в середине, образуется осадок.
Образуется осадок; учащиеся могут получить более подробное представление с помощью увеличительного стекла. Этот метод заставляет студентов задуматься о том, что происходит во время реакций на атомарном уровне. Кроме того, это поддается обсуждению диффузии.
Совет 3 — Химический состав аммиака в чашке Петри
Этот практический микромасштаб также связан с диффузией и работает намного быстрее, чем выполнение всех тестов по отдельности
Здесь несколько растворов помещают по краю чашки Петри (с контрольными пятнами раствора, добавленными снаружи).Индикаторная бумага тоже присутствует. Затем раствор аммиака помещают в лунку в центре чашки Петри.
По мере диффузии аммиака цвет индикаторной бумаги меняется. Аммиак также вступает в реакцию с растворами, образуя осадки, комплексы и меняя цвет. В этой единственной чашке Петри есть что обсудить.
Совет 4 — Кристалл сульфата меди менее 30 минут
Сделайте кристаллы сульфата меди за 30 минут.Обучение методам разделения — обычное занятие, и эта умная процедура требует гораздо меньше времени, поэтому ученику не придется ждать следующего урока, чтобы увидеть свои кристаллы.
Этот метод осуществляет реакцию внутри небольшого пластикового шприца, помещенного в водяную баню. Помещение фильтровальной бумаги в конец шприца упрощает фильтрацию. Затем ученики оставляют раствор на горячей водяной бане на некоторое время, чтобы кристаллы образовались.Быстро и легко, и остается достаточно времени для обсуждения процессов, используемых учащимися.
Совет 5 — Миниатюрный вольтаметр Хоффмана
Этот микромасштабный вольтаметр Хоффмана иллюстрирует электролиз воды. Это требует некоторой сборки, но это намного дешевле, чем традиционные вольтаметры Хоффмана, которые дороги и хрупки.
Водород и кислород, производимые этим микроаппаратом, можно собрать с помощью пластиковых шприцев и протестировать.
Совет 6 — Микромасштабное титрование
Титрование классов в GCSE часто запрещено из-за отсутствия оборудования или опасений, что ученики его сломают. При микромасштабном титровании вместо бюретки используется пластиковая пипетка.
Зажим используется для осторожного сжатия пипетки и контроля высвобождения раствора. Затем в расчетах можно использовать массу раствора до и после добавления из пипетки.
Совет 7 — Оксид магния в крышках бутылок
Проведение реакции внутри металлических крышек для бутылок решает проблему использования тиглей, которые могут треснуть с риском ожога для учащихся.
Этот метод дает гораздо лучшее согласие с ожидаемыми результатами по образованию оксида магния. Обратите внимание, что в целях безопасности пластиковые вставки в металлических крышках бутылок необходимо предварительно удалить путем нагревания в вытяжном шкафу.
Совет 8 — Микроэлектролиз
Использование специальной чашки Петри для проведения электролиза на микромасштабном уровне позволяет решить несколько проблем, таких как необходимость в больших объемах растворов, сложность наблюдений и образование токсичных газов.
Метод может быть дополнен цифровым микроскопом для более детального изучения образования продуктов.
Совет 9 — Микромасштабные трещины
Этот последний метод микромасштабирования в серии использует стеклянную пипетку Пастера в качестве реакционного сосуда и требует всего 0,5 см. 3 парафина. Устранены проблемы с обратным всасыванием воды и растрескиванием стекла.
Кроме того, его гораздо быстрее выполнить, чем при традиционном методе, что является реальным преимуществом, поскольку у него достаточно времени для обсуждения результатов.
Где найти еще
CLEAPSS разработала все практические решения, представленные здесь, и множество других идей микромасштабов можно найти на их сайте.
Здесь, в OCR, мы уже включили некоторую микромасштабную работу в предлагаемые нами PAG по химии A level и GCSE. Эти практические занятия доступны через Interchange. Помните, что эти действия можно использовать как альтернативу другим PAG, где это возможно.
Если у вас есть какие-либо вопросы, обращайтесь к нашим предметным консультантам по адресу science @ ocr.org.uk. Если вы планируете преподавать OCR Science, подпишитесь на обновления или подпишитесь на нас в Twitter @OCR_Science
Об авторе Энди Брунинг — предметный консультант — химия
Энди присоединился к OCR в сентябре 2017 года в качестве предметного консультанта по химии A Level. До прихода в OCR он работал учителем химии в Борнмуте и Кембридже и особенно интересовался подходами к обучению, основанными на контексте. В свободное время увлекается фотографией, графическим дизайном и игрой на гитаре.
Селина ICSE Краткий практический урок химии — 9
Мобильный номер уже есть.
Обязательные поля не могут быть пустыми
Пожалуйста, введите действующий номер мобильного телефона
регистр
* Мобильный номер
Существующий пользователь ? Нажмите здесь, чтобы ВойтиНеверный OTP, повторите попытку.
Обязательные поля не могут быть пустыми.
OTP успешно отправлено повторно
OTP верификация
* Одноразовый безопасный пароль
Если вы не получили OTP, пожалуйста,
.
 Б.
Б. Б.
Б. Б.
Б.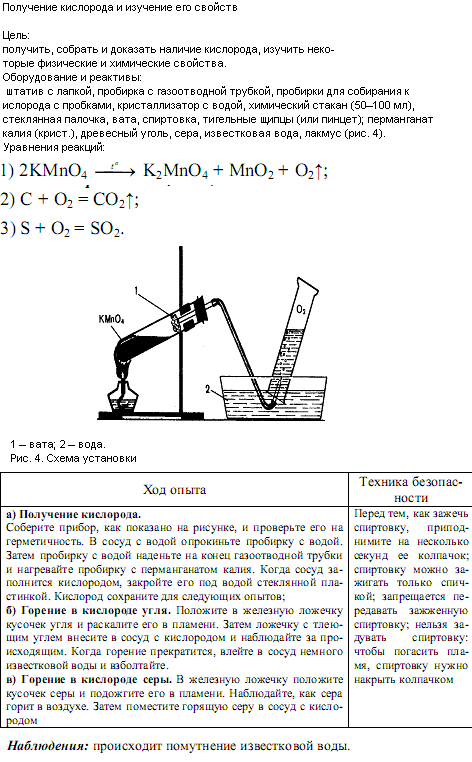 Б.
Б. Б.
Б. Б.
Б.