Тест на свойства соединений кислорода и серы. Часть 1.
Задание №1
Определите соединения, в которых степень окисления кислорода равна -2. Число верных ответов может быть любым.
- 1. CaO
- 2. Al2O3
- 3. SO2
- 4. BaO2
- 5. K2O2
Задание №2
Определите соединения, в которых степень окисления кислорода равна -1. Число верных ответов может быть любым.
- 1. Na2O
- 2. H2O2
- 3. SO3
- 4. K2O2
- 5. Fe2O3
Задание №3
Определите соединения, в которых степень окисления серы равна -2. Число верных ответов может быть любым.
- 1. K2S
- 2. NH4HS
- 3. KHSO4
- 4. P2S5
- 5. FeS2
Задание №4
Определите соединения, в которых кислород имеет минимальную возможную степень окисления. Число верных ответов может быть любым.
Число верных ответов может быть любым.
- 1. BaO2
- 2. CO2
- 3. CO
- 4. BeO
- 5. H2O2
Задание №5
Определите соединения, в которых сера имеет минимальную возможную степень окисления. Число верных ответов может быть любым.
- 1. S8
- 2. H2S
- 3. ZnSO4
- 4. PbS
- 5. FeS2
Задание №6
Из приведенного перечня простых веществ выберите два таких, которые могут взаимодействовать с кислородом.
1) фосфор
2) цинк
3) золото
4) бром
5) хлор
РешениеЗадание №7
Из приведенного перечня простых веществ выберите два таких, которые могут взаимодействовать с серой.
1) азот
2) неон
3) бром
4) хлор
5) йод
РешениеЗадание №8
Из приведенного перечня простых веществ выберите два таких, которые не могут взаимодействовать с кислородом.
1) углерод
2) железо
3) натрий
4) аргон
5) хлор
РешениеЗадание №9
Из приведенного перечня простых веществ выберите два таких, которые не могут взаимодействовать с серой.
1) фтор
2) кислород
3) азот
4) калий
5) гелий
РешениеЗадание №10
Из приведенного перечня простых веществ выберите два таких, которые не могут взаимодействовать с кислородом.
1) платина
2) марганец
3) свинец
4) хлор
5) сера
РешениеЗадание №11
Из приведенного перечня веществ выберите два таких, которые не могут взаимодействовать с кислородом.
- 1. Al2O3
- 2. P2O3
- 3. ZnS
- 4. Fe
- 5. CuO
Задание №12
Из приведенного перечня оксидов выберите два таких, которые могут взаимодействовать с кислородом.
- 1. FeO
- 2. Fe2O3
- 3.
 CrO
CrO - 4. Cr2O3
- 5. SO3
Задание №13
Из приведенного перечня веществ выберите два таких, которые не могут взаимодействовать с серой.
- 1. P2S3
- 2. O2
- 3. HCl
- 4. HF
- 5. H2
Задание №14
Из приведенного перечня веществ выберите два таких, которые могут взаимодействовать с серой.
- 1. Ar
- 2. Fe
- 3. Cu2S
- 4. K2SO4
- 5. H2O
Задание №15
Из приведенного перечня веществ выберите два таких, которые не могут взаимодействовать с кислородом.
- 1. H2O2
- 2. Pt
- 3. H2S
- 4. FeS
- 5. CO
Задание №16
Из приведенного перечня веществ выберите два таких, которые не могут взаимодействовать с серой.
- 1. HNO3
- 2. HBr
- 3. H2SO4
- 4. NaOH
- 5. CO2
Задание №17
Из приведенного перечня веществ выберите два таких, которые могут взаимодействовать с кислородом.
1) неон
2) серная кислота
3) угарный газ
4) веселящий газ
5) сернистый газ
РешениеЗадание №18
Из приведенного перечня веществ выберите два таких, которые могут взаимодействовать с серой.
1) хлор
2) вода
3) соляная кислота
4) азот
5) медь
РешениеЗадание №19
Из приведенного перечня веществ выберите два таких, которые не могут взаимодействовать с кислородом.
1) платина
2) хлор
3) цинк
4) графит
5) пирит
РешениеЗадание №20
Из приведенного перечня веществ выберите два таких, которые не могут взаимодействовать с серой.
1) плавиковая кислота
2) азотная кислота
3) кремниевая кислота
4) гидроксид стронция
5) гашеная известь
РешениеЗадание №21
Из приведенного перечня веществ выберите два таких, которые при термическом разложении дают кислород.
1) гашеная известь
2) пирит
3) мел
4) бертолетова соль
5) нитрат калия
РешениеЗадание №22
Из приведенного перечня веществ выберите два таких, которые при термическом разложении не дают кислород.
1) карбонат кальция
2) перманганат калия
3) хлорид аммония
4) хлорат калия
5) пероксид водорода
РешениеЗадание №23
Из приведенного перечня веществ выберите два таких, которые при термическом разложении дают кислород.
- 1. NaNO3
- 2. H2O2
- 3. BaCO3
- 4. BeO
- 5. Fe3O4
Задание №24
Из приведенного перечня веществ выберите два таких, которые при термическом разложении не дают кислород.
- 1. KMnO4
- 2. KNO3
- 3. K2CO3
- 4. KClO3
- 5. KOH
Задание №25
Из приведенного перечня веществ выберите два таких, при нагревании которых выделяется кислород
1) нитрат аммония
2) нитрат калия
3) перманганат калия
4) бромид лития
5) сульфид цинка
РешениеЗадание №26
К водному раствору, содержащему йодид калия и серную кислоту добавили пероксид водорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: H2O2 + 2KI + H2SO4 = K2SO4 + I2 + 2H2O
Задание №27
К водному раствору, содержащему перманганат калия и серную кислоту, добавили пероксид водорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 5H2O2 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 5O2 + 8H2O
Задание №28
Смешали водные растворы пероксида водорода и сульфита калия.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: H2O2 + K2SO3 = K2SO4 + H2O
Задание №29
К гидроксиду железа (II) добавили водный раствор пероксида водорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: H2O2 + 2Fe(OH)2 = 2Fe(OH)3
Задание №30
К водному раствору, содержащему сульфат железа (II) и серную кислоту, добавили пероксид водорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: H2O2 + 2FeSO4 + H2SO4 = Fe2(SO4)3 + 2H2O
Задание №31
Сульфид цинка подвергли обжигу в токе кислорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2ZnS + 3O2 = 2ZnO + 2SO2
Задание №32
Алюминиевый порошок сожгли в токе кислорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 4Al + 3O2 = 2Al2O3
Задание №33
Сульфид алюминия подвергли обжигу в токе кислорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2Al2S3 + 9O2 = 2Al2O3 + 6SO2
Задание №34
Запишите уравнение реакции между кислородом и фосфином.
Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2PH3 + 4O2 = P2O5 + 3H2O
Задание №35
Запишите уравнение реакции между кислородом и угарным газом.
Используйте в качестве разделителя левой и правой частей знак равенства.
Ответ: 2CO + O2 = 2CO2
Задание №36
Пирит подвергли обжигу в токе кислорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Задание №37
Перманганат калия подвергли термическому разложению.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2KMnO4 = K2MnO4 + MnO2 + O2
Задание №38
Смесь хлората калия и диоксида марганца прокалили.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2KClO3 = 2KCl + 3O2
Задание №39
К раствору пероксида водорода добавили диоксид марганца.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2H2O2 = 2H2O + O2
Задание №40
Нитрат калия подвергли термическому разложению.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2KNO3 = 2KNO2 + O2
Задание №41
Из приведенного перечня веществ выберите два таких, которые реагируют с сероводородом.
1) вода
2) кислород
3) азот
4) едкий натр
5) гидроксид алюминия
РешениеЗадание №42
Из приведенного перечня веществ выберите два таких, которые не реагируют с сероводородом.
1) хлор
2) гидроксид цезия
3) углерод
4) бром
5) оксид алюминия
РешениеЗадание №43
Из приведенного перечня веществ выберите два таких, которые реагируют с сероводородом.
1) перманганат калия
2) нитрат свинца
3) хлорид натрия
4) углекислый газ
5) нитрат аммония
РешениеЗадание №44
Из приведенного перечня веществ выберите два таких, которые не реагируют с сероводородом.
1) хлорид меди
2) нитрат цинка
3) хлорид железа(II)
4) нитрат серебра
5) нитрат свинца
РешениеЗадание №45
Из приведенного перечня веществ выберите два таких, которые реагируют с сероводородом.
1) азотная кислота
2) соляная кислота
3) серная кислота
4) угольная кислота
5) кремниевая кислота
РешениеЗадание №46
Из приведенного перечня веществ выберите два таких, которые реагируют с серой.
1) кислород
2) азот
3) натрий
4) аргон
5) йод
РешениеЗадание №47
Из приведенного перечня веществ выберите два таких, которые не реагируют с серой.
1) бром
2) гидроксид рубидия
3) гидроксид алюминия
4) оксид цинка
5) водород
РешениеЗадание №48
Из приведенного перечня веществ выберите два таких, которые реагируют с серой.
1) кислород
2) неон
3) гидроксид бериллия
4) азот
5) азотная кислота
РешениеЗадание №49
Из приведенного перечня веществ выберите два таких, которые не реагируют с серой.
1) гидроксид бария
2) оксид кремния
3) соляная кислота
4) гидроксид цезия
5) железо
РешениеЗадание №50
Из приведенного перечня веществ выберите два таких, которые реагируют с серой.
1) алюминий
2) оксид алюминия
3) гидроксид алюминия
4) хлорид алюминия
5) хлор
РешениеЗадание №51
Из приведенного перечня веществ выберите два таких, которые реагируют с сульфидом калия.
1) соляная кислота
2) кремниевая кислота
3) силикат натрия
4) нитрат серебра
5) нитрат натрия
РешениеЗадание №52
Из приведенного перечня веществ выберите два таких, которые реагируют с сульфидом меди.
1) водород
2) кислород
3) бромоводородная кислота
4) азотная кислота
5) нитрат свинца
РешениеЗадание №53
Из приведенного перечня веществ выберите два таких, которые реагируют с сульфидом алюминия
1) азот
2) вода
3) медь
4) кислород
5) водород
РешениеЗадание №54
Из приведенного перечня веществ выберите два таких, которые не реагируют с сульфидом натрия.
1) хлорид аммония
2) нитрат цинка
3) водород
4) серная кислота
5) перекись водорода
РешениеЗадание №55
Из приведенного перечня веществ выберите два таких, которые не реагируют с сульфидом цинка.
1) карбонат калия
2) нитрат серебра
3) кислород
4) азотная кислота
5) соляная кислота
РешениеЗадание №56
Сероводород сожгли в избытке кислорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2H2S + 3O2 = 2SO2 + 2H2O
Задание №57
Сероводород сожгли в недостатке кислорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2H2S + O2 = 2S + 2H2O
Задание №58
Сероводород пропустили через избыток водного раствора гидроксида калия.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: H2S + 2KOH = K2S + 2H2O
Задание №59
Через водный раствор гидроксида калия пропустили избыток сероводорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: H2S + KOH = KHS + H2O
Задание №60
Запишите уравнение реакции сероводорода с избытком хлора в водном растворе.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: H2S + 4Cl2 + 4H2O = H2SO4 + 8HCl
Задание №61
Через раствор хлорида железа (III) пропустили избыток сероводорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: H2S + 2FeCl3 = 2FeCl2 + S + 2HCl
Задание №62
Смешали сероводород с диоксидом серы.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2H2S + SO2 = 3S + 2H2O
Задание №63
Через водный раствор, содержащий дихромат калия и серную кислоту пропустили сероводород.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: K2Cr2O7 + 3H2S + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3S + 7H2O
Задание №64
Сероводород пропустили через избыток концентрированной азотной кислоты.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: H2S + 8HNO3 = H2SO4 + 8NO2 + 4H2O
Задание №65
Серу растворили при нагревании в концентрированной серной кислоте.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: S + 2H2SO4 = 3SO2 + 2H2O
Задание №66
Смешали водные растворы сульфида лития и сульфата алюминия
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 3Li2S + Al2(SO4)3 + 6H2O = 3Li2SO4 + 2Al(OH)3 + 3H2S
Задание №67
К водному раствору бромида железа (III) добавили избыток водного раствора сульфида натрия.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2FeBr3 + 3Na2S = 2FeS + S + 6NaBr
Задание №68
К избытку концентрированной соляной кислоты добавили сульфид натрия.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: Na2S + 2HCl = 2NaCl + H2S
Задание №69
Сульфид меди (II) обработали избытком концентрированной азотной кислоты. Наблюдали выделение бурого газа.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: CuS + 8HNO3 = CuSO4 + 8NO2 + 4H2O
Задание №70
Сульфид меди (II) прокалили в токе кислорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2CuS + 3O2 = 2CuO + 2SO2
Задание №71
Запишите уравнение реакции обжига сульфида железа(II) в токе кислорода.
В качестве разделителя левой и правой частей используйте знак равенства.
РешениеОтвет: 4FeS + 7O2 = 2Fe2O3 + 4SO2
Задание №72
Через водный раствор сульфата меди пропустили сероводород. Если реакция протекает, впишите ее уравнение в поле ответа, используя в качестве разделителя левой и правой частей знак равенства. Если реакция не протекает поставьте в поле ответа знак минус (-).
РешениеОтвет: CuSO4 + H2S = CuS + H2SO4
Задание №73
Серу сожгли в избытке кислорода.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
Задание №74
Серу растворили в избытке концентрированной азотной кислоты.
Впишите в поле ответа уравнение проведенной реакции, используя в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: S + 6HNO3 = H2SO4 + 6NO2 + 2H2O
Задание №75
Запишите уравнение реакции серы с избытком концентрированного раствора гидроксида калия при нагревании.
Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 3S + 6KOH = 2K2S + K2SO3 + 3H2O
Задание №76
Запишите уравнение реакции серы с алюминием при нагревании.
Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеОтвет: 2Al + 3S = Al2S3
Задание №77
Запишите уравнение реакции избытка серы с углеродом.
Используйте в качестве разделителя левой и правой частей знак равенства.
РешениеЗадание №78
Установите соответствие между формулой/названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) сера Б) сероводород В) сульфид калия | 1) хлорид железа(III), гидроксид калия, нитрат серебра 2) серная кислота, нитрат свинца, сульфат цинка 3) водород, кислород, фосфор 4) азотная кислота, соляная кислота, гидроксид натрия |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №79
Установите соответствие между формулой/названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) перекись водорода Б) сульфид натрия В) оксид алюминия | 1) HCl, HNO3, NaOH 2) KI, KMnO4, K2SO3 3) H2O, H2, Cl2 4) Cu(NO3)2, HCl, HBr |
Запишите в таблицу выбранные цифры под соответствующими буквами.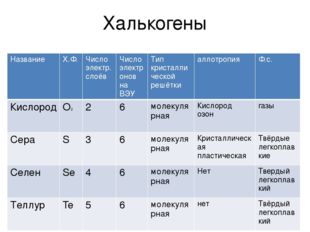
Задание №80
Установите соответствие между формулой/названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) Na2O Б) S В) O2 | 1) Fe, N2, H2S 2) Cl2, HNO3, Mg 3) MgO, AgCl, KNO3 4) HCl, H2O, Al2O3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №81
Установите соответствие между формулой/названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) H2O2 Б) CO2 В) Li2S | 1) AgNO3, HCl, H2S 2) CaO, NaOH, Li2O 3) KMnO4, Fe(OH)2, CaI2 4) CO, N2O, HNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Задание №82
Установите соответствие между формулой/названием вещества и набором реагентов, с каждым из которых оно может взаимодействовать.
| ВЕЩЕСТВО | РЕАГЕНТЫ |
А) S Б) PbS В) KHS | 1) HCl, NaOH, H2SO4 2) O2, KOH, H2 3) HNO3, O2, H2O 4) O2, H2O2, HNO3 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
РешениеЗадание №83
Рассчитайте массу серы, необходимую для полного окисления 54 г алюминия при нагревании. Ответ укажите в граммах и округлите до целых.
РешениеЗадание №84
Определите объем кислорода, который выделяется при каталитическом разложении 5 моль бертолетовой соли. Ответ укажите в литрах и округлите до целых.
Задание №85
Вычислите массу осадка, полученного при пропускании избытка сероводорода в раствор 15 г нитрата цинка и 33,1 г нитрата свинца. Ответ округлите до десятых.
РешениеЗадание №86
При добавлении 10 г раствора перекиси водорода к избытку подкисленного серной кислотой раствора иодида натрия образовалось 25,4 г твердого осадка. Вычислите массовую долю перекиси водорода в исходном растворе. Ответ укажите в процентах и округлите до целых.
РешениеЗадание №87
Навеску серы полностью растворили в избытке горячей концентрированной азотной кислоты, при этом выделилось 13,44 л газа. Определите массу исходной навески. Ответ укажите в граммах и округлите до десятых.
РешениеЗадание №88
Определите объем кислорода, который можно получить при разложении 15 г перманганата калия, содержащего 5% примесей по массе. Ответ укажите в литрах и округлите до целых.
РешениеЗадание №89
Вычислите объем 10% раствора гидроксида калия (плотность 1,05 г/мл), необходимый для полной нейтрализации 11,2 л сероводорода. Ответ укажите в миллилитрах и округлите до целых.
Ответ укажите в миллилитрах и округлите до целых.
Задание №90
Навеску сульфида цинка подвергли обжигу в токе кислорода, при этом образовалось 1,12 л газа. Определите массу 10% раствора гидроксида натрия, в котором можно полностью растворить полученный твердый остаток. Ответ укажите в граммах и округлите до целых.
РешениеОтвет: 40 г
Пояснение:
Уравнение реакции:
2ZnS + 3O2 = 2ZnO + 2SO2
2NaOH + ZnO + H2O = Na2[Zn(OH)4]
ν(SO2) = 1,12/22,4 = 0,05 моль
ν(NaOH) = 2ν(SO2) = 2⋅0,05 = 0,1 моль
m(NaOH) = M⋅n = 40⋅0,1 = 4 г
mр-ра(NaOH) = 4 г/0,1 = 40 г
Задание №91
Вычислите объем кислорода, необходимый для неполного сгорания 22,4 л сероводорода. Ответ укажите в литрах и округлите до десятых.
РешениеЗадание №92
После пропускания 2,24 л сероводорода в 400 г раствора нитрата серебра газ израсходовался полностью, а в растворе не осталось катионов металла. Определите массовую долю соли в исходном растворе. Ответ укажите в процентах и округлите с точностью до десятых.
Определите массовую долю соли в исходном растворе. Ответ укажите в процентах и округлите с точностью до десятых.
Задание №93
Вычислите объем кислорода, который можно получить из 170 г 30% раствора перекиси водорода при взаимодействии с избытком подкисленного серной кислотой раствора перманганата калия. Ответ укажите в литрах и округлите до десятых.
РешениеЗадание №94
При взаимодействии 100 г раствора хлорида железа(III) с избытком сульфида калия выпало 4,16 г осадка. Вычислите массовую долю соли в исходном растворе. Ответ укажите в процентах и округлите до десятых.
РешениеОтвет: 6,5
Пояснение:
Запишем уравнение реакции:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Как видно из уравнения осадок представляет из себя смесь сульфида железа (II) и серы.
Пусть
ν(S) = x моль, тогда
ν(FeS) = 2ν(S) = 2x моль, а
масса серы будет равна:
m(S) = ν(S)⋅M(S) = 32x г, а масса m(FeS) = ν(FeS)⋅M(FeS) = 88⋅2x = 176x г, а суммарная масса осадка:
m(S+FeS) = 32x + 176x = 208x г
В то же время из условия m(S+FeS) = 4,16 г
Тогда,
208x = 4,16
x = 0,02
Тогда
ν(FeCl3) = 2ν(S) = 2⋅0,02 = 0,04 моль
m(FeCl3) = M⋅n = 162 ⋅ 0,04 = 6,48 г
ω(FeCl3) = 100% ⋅ m(FeCl3)/ m(р-ра) = 100% ⋅ 6,48 / 100 ≈ 6,5 %
Задание №95
Вычислите объем кислорода, необходимый для полного окисления 30 г сульфида алюминия при нагревании. Ответ укажите в литрах и округлите до сотых.
Ответ укажите в литрах и округлите до сотых.
Задание №96
Навеску серы массой 19,2 г растворили в избытке раствора гидроксида натрия при нагревании. Определите суммарный объем газов, который можно получить при подкислении образовавшегося раствора избытком соляной кислоты. Ответ укажите в литрах и округлите до сотых.
РешениеЗадание №97
Рассчитайте массу осадка, который можно получить при взаимодействии 10 мл 5% раствора нитрата серебра (плотность 1,05 г/см3) и 20 мл 1% раствора сульфида лития (плотность 1,0 г/см3). Ответ укажите в граммах и и округлите до десятых.
РешениеОтвет: 0,4
Пояснение:
mр-ра(AgNO3) = Vр-ра(AgNO3)⋅ρ(р-ра(AgNO3) = 10 мл⋅1,05 г/мл = 10,5 г
m(AgNO3) = mр-ра(AgNO3)⋅ω(AgNO3)/100% = 10,5 г⋅0,05 = 0,525 г
ν(AgNO3) = m(AgNO3)/M(AgNO3) = 0,525 г/170 г/моль = 0,0031 моль
mр-ра(Li2S) = Vр-ра(Li2S)⋅ρ р-ра(Li2S) = 20 мл ⋅ 1,0 г/мл = 20 г
m(Li2S) = mр—ра(Li2S) ⋅ ω(Li2S) / 100% = 20 г ⋅ 0,01 = 0,2 г
ν(Li2S) = m(Li2S) / M(Li2S) = 0,2 г / 46 г/моль = 0,00435 моль
Li2S + 2AgNO3 = Ag2S + 2LiNO3
Найдем избыток и недостаток
ν(AgNO3)/2 = 0,00155 < ν(Li2S)/1 = 0,00435 моль
т. е. в недостатке у нас нитрат серебра, расчет ведем по нему
е. в недостатке у нас нитрат серебра, расчет ведем по нему
ν(Ag2S) = ν(AgNO3)/2 = 0,00155 моль
m(Ag2S) = M(Ag2S) ⋅ ν(Ag2S) = 248 г/моль ⋅ 0,00155 моль ≈ 0,4 г
Подгруппа кислорода | Дистанционные уроки
22-Окт-2012 | комментария 2 | Лолита Окольнова
Элементы 6-й группы главной подгруппы. Очень часто употребляемое название — ХАЛЬКОГЕНЫ — «руду рождающие». Думаю, этим названием они в большей степени обязаны сере, чем кислороду 🙂
В формате подготовки к ЕГЭ мы рассмотрим физические и химические свойства двух элементов — кислорода O и серы S.
Электронное строение
nS2 np4
Но тут не все так просто.
К кислороду претензий нет — у него электронное строение соответствует общей формуле, а вот у серы и остальных элементов есть и другие варианты… Если детально рассмотреть строение p-элементов по периодам, то нужно обратить внимание, что с 3-го периода у p- элементов появляется свободная d-орбиталь, на которую могут переходить электроны.
Именно поэтому степень окисления серы может быть не только -2.
Итак, выводы:
- Валентность элементов:
- валентность кислорода = 2,
- валентность серы — 2,4,6
- Степени окисления:
- степень окисления кислорода = -2 — типичный неметалл, сильный окислитель;
- степень окисления серы = -2(минимальная степень окисления), +2 (редко), +4, +6 (максимальная степень окисления) в минимальной с.о. S будет проявлять восстановительные свойства, в максимальной — окислительные.
- Сверху вниз в подгруппе радиус атома увеличивается, следовательно, электроны все слабее притягиваются к ядру атома, следовательно, сверху вниз металлические свойства увеличиваются.
- Как следствие этого сверху вниз в подгруппе усиливаются восстановительные свойства.

Физические свойства
Кислород — O2 (O=O, O::O) -газ без цвета, без запаха. Аллотропная модификация — озон O3 — бесцветный газ со специфическим запахом (запах «после грозы»)
Сера — S — твердое вещество, хотя мы пишем формулу этого вещества как S , но обычно образуются кристаллы состава S4 и S8. Обычно сера — пластичное вещество коричневого или желтого цвета.
На воздухе сера горит: S + O2 = SO2 (бесцветный газ с резким запахом)
Химические свойства
Свойства кислорода
| Окислительные свойства | |
| Кислород может проявлять восстановительные свойства только к элементу, у которого больше электроотрицательность, т.е., он должен стоять в периодической системе элементов правее кислорода. Это КОРОЛЬ НЕМЕТАЛЛОВ — F:
|
Свойства серы:
| Окислительные свойства | Восстановительные свойства |
|
|
Cернистая кислота — h3SO3 (степень окисления серы= +4). Соли — сульф
Серная кислота — h3SO4 (cтепень окисления серы=+6). Соли — сульфаты
Их свойства мы рассмотрим отдельно.
[TESTME 32]
Категории: |
Обсуждение: «Подгруппа кислорода»
(Правила комментирования)водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Видеоурок: Свойства неметаллов
Лекция: Характерные химические свойства простых веществ неметаллов: водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния
Водород
Водород (Н) — элемент особого значения, широко распространенный в природе. В переводе с латинского Hydrogenium означает «порождающий воду».
В переводе с латинского Hydrogenium означает «порождающий воду».
В таблице Менделеева, водород располагается в главной подгруппе I группы, порядковый номер 1 . Данную позицию можно объяснить тем, что атом данного элемента, как и атомы щелочных металлов, содержит всего 1 валентный электрон. Водород одновременно находится и в VII группе. Поэтому в его атоме, как и в атомах галогенов, не достаёт одного электрона, который необходим для полного заполнения внешнего энергетического уровня. Положение водорода в VII группе вместе с галогенами наиболее правильное, так как он образует двухатомные молекулы и отрицательно заряженные ионы. Водород является неметаллом.
Двухатомные молекулы Н2 достаточно легки, подвижны и неполярны. Межмолекулярное взаимодействие — дисперсионное. Именно поэтому водород достаточно плохо растворяется в жидкостях. Водород возможен во всех агрегатных состояниях. Н2 в обычных условиях — это газ, без цвета, запаха и вкуса. При t ок. −253oC сжижается и превращается в бесветную, легкую и текучую жидкость. А при t ок. −259
Химические свойства:
Энергия связи атомных ядер довольно велика, равна 434 кДж. Поэтому, химические реакции с участием водорода, обычно протекают при нагревании или освещении. При обычных условиях реакция возможна только с очень активными металлами и только с одним неметаллом — фтором.
- Проявляет одновременно восстановительные и окислительные свойства.
- В состав соединений входит со степенями окисления -1 и +1. Самая распространенная из них +1. Соединения водорода, имеющие степень окисления -1 называются гидридами (Li+1H-1, Ca+2H-12 и др.).
Взаимодействие с другими элементами:
1. С кислородом образует гремучий газ. Реакция взрывоопасная:
2. С щелочными и щелочноземельными металлами образует гидриды: В данных реакциях проявляет окислительные свойства. С оксидами металлов проявляет восстановительные свойства, вытесняя металл:
- CuО + Н2 → Cu + Н2О.
3. Соединения с галогенами образуют галогеноводороды, водные растворы которых являются кислотами:
- водный р-р хлороводорода HCl — соляная кислота;
- водный р-р фтороводорода HF — плавиковая кислота;
- водный р-р бромоводорода HBr — бромоводородная кислота;
- водный р-р иодоводорода HI — иодоводородная кислота;
- водный р-р астатоводорода HAt — астатоводородная кислота.
4. С азотом при нагревании, давлении и в присутстсвии катализатора (Fe), образуя аммиак:
5. С серой при нагревании, образуя сероводород. Это обратимая реакция:
6. С углеродом, образуя метан:
Галогены
Вы можете повторить характеристику галогенов, которую мы рассматривали на уроке 1.2.4 Общая характеристика неметаллов IVA – VIIA групп.
На данном уроке рассмотрим химические свойства и взаимодействие галогенов с другими элементами. Все галогены являются окислителями. Окислительные свойства уменьшаются при перемещении от фтора вниз по группе. Все галогены обладают двухатомными молекулами.
Фтор. Наиболее сильным окислителем является фтор. Он легко вступает в реакцию со всеми металлами и со многими неметаллами. И не образует фторидов лишь с тремя инертными газами: гелием, неоном и аргоном. При обычных условиях и даже при низких t фтор реагирует с водородом с воспламенением и со взрывом, образуется фтороводород: Н2 + F2 → 2HF. При реакции фтора с водой, последняя начинает гореть: 2F2 + 2H2O → 4HF + O2. Со фтором непосредственно не реагируют азот (N), кислород (O), алмаз, углекислый и угарный газы. Во всех соединениях фтор проявляет только одну степень окисления –1.
Хлор — газ в обычных условиях. Сильный окислитель. В соединениях проявляет степени окисления -1, 0, +1, +3, +5, +7. Почти со всеми металлами реагирует непосредственно, образуя хлориды: 2Na + Cl 2 → 2NaCl; 2Fe + 3Cl2→ 2FeCl3. Также непосредственно реагирует с неметаллами, кроме углерода, азота и кислорода. Оксиды хлора: Cl2O, ClO2, Cl2O6 и Cl2O7 взаимодействуют с водой и образуют кислородсодержащие кислоты: хлорноватистую HClO, хлористую HClO2, хлорноватую HClO3 и хлорную HClO4. Из них наиболее сильным окислителем является хлорноватистая. Все названные кислоты неустойчивы. Водный р-р хлора содержит две кислоты — соляную HCl и хлорноватистую HСlO. Соляную кислоту получают путем растворения хлороводорода (газообразного соединения HCl) в воде при повышенной t: H2 + Cl2 → HCl.
Бром имеет такие же степени окисления, как и хлор. Он также активно взаимодействует с металлами и неметаллами, образуя бромиды, но менее энергичнее, чем хлор. Немного лучше других галогенов растворяется в воде. В результате получается р-р называемый бромная вода. В ней образуются две кислоты (бромоводородная и бромноватистая): Br
Астат. По химическим свойствам близок к йоду. Как и другие галогены образует соли — астатиды, например, AgAt. При взаимодействии с металлами образует соединения со стпенью окисления — 1, что также свойственно всем галогенам.
Кислород, сера, азот
Кислород является наиболее распространенным среди элементов. Его молекула состоит из двух атомов. Отличается высокой реакционностью. Уже при обычных условиях окисляет многие вещества, например: 4Li + O2 → 2Li2O. А если проводить реакции с нагревом или с применением катализаторов, то они протекают довольно таки бурно, выделяя большое количество тепла. Взаимодействует со всеми элементами Периодической системы, кроме золота и инертных газов. Соединения, включающие в себя кислород, имеют степени окисления, равные -2, -1, +2 и +1. Соединения, имеющие степень окисления, равную -2 (оксиды, основания, кислоты, соли) наиболее распространены. В степени окисления -1 кислород находится в пероксидах. Последние получают при сгорании щелочных металлов в кислороде: 2Na + O2 → Na2O2. Выступая в реакциях как окислитель, только со фтором кислород проявляет восстанавливающие свойства: O2 + F2 → F2O2.
Сера. Данный химический элемент существует в виде восьмиатомных молекул S8. Химическая активность повышается с повышением температуры. при обычных условиях реагирует только с ртутью. Начинает плавиться при 1150С. Кипит при 4450С. В случае проведения реакций с металлами, данный химический элемент выступает в роли окислителя, образуя сульфиды: Zn + S → ZnS; 2Al + 3S → Al2S3. При взаимодействии с сильными окислителями и сложными веществами является восстановителем: S + 6HNO3 → H2SO4 + 6NO2 + 2H2O. Сера не взаимодействует с водой. В щелочах при нагревании диспропорционирует по уравнению: 3S + 6NaOН → 2Na2S + Na2SО3 + 3Н2О. В последней реакции образуются сульфиды и сульфиты.
Азот содержится в атмосфере в виде прочных двухатомных молекул N2, имеющих тройную связь. Малая химическая активность азота объясняется его большой прочностью. В соединениях проявляет степени окисления от от +5 до -3. Азот взаимодействует как окислитель, всего с несколькими активными металлами (например, литием) при невысоких температурах, при этом образует нитриды: 6Li+N2 → 2Li3N. Другие металлы, а так же водород окисляются азотом только при повышенных температурах. В реакции с кислородом азот является восстановителем. Взаимодействие этих веществ с образованием NO становится заметным только при температуре свыше 4000 С. Энергия «запуска» этой реакции — самая высокая из всех известных. Она равна 540 кДж/моль. Главная сфера применения азота — синтез аммиака. Аммиак, NH3, получают с помощью взаимодействия простых веществ по обратимой реакции: N2+ 3H2 → 2NH3+Q. Далее аммиак используется для получения разбавленной азотной кислоты. Реакция ступенчатая, суммарное уравнение выглядит так: NH3 + 2О2 → HNO3 + Н2О.
Фосфор, углерод, кремнийФосфор обладает высокой химической активностью, поэтому в свободном виде его не встретить. В природе существует в разных модификациях: белый, красный, чёрный, металлический. Это явление, когда одно химическое вещество образует несколько веществ называется аллотропией. Белый фосфор — это мягкое, воскообразное вещество, имеющее молекулярную кристаллическую решетку и состоящее из тетраэдрических молекул Р4. Не растворяется в воде, но растворяется в органических растворителях. Белый фосфор является реакционноспособным веществом. На воздухе быстро окисляется вплоть до Р4О10, а при 400С, происходит самовоспламенение и бурное горение фосфора: Р4+ 5О2 → Р4О10. Поэтому хранится он под водой. Белый фосфор — сильный яд. Противоположными белому фосфору свойствами обладает красный фосфор, имеющий порошкообразную структуру. Не растворяется в воде и не растворяется в органических растворителях. На воздухе не окисляется и не воспламеняется. Не ядовит.
Фосфор проявляет как окислительные, так и восстановительные свойства. Во взаимодействии с металлами, ведет себя как окислитель и образует фосфиды: 2P + 3Ca → Ca3P2. С неметаллами реагирует, как восстановитель: 2P + 3Cl2 → 2PCl3. С водородом не реагирует. С водой диспропорционирует, образуя фосфорноватистую кислоту: 4Р + 6Н2О → РН3 + 3Н3РО2. Под действием сильный окислителей превращается в фосфорную кислоту: 2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O.
Практически каждый день мы наблюдаем реакцию фосфора с бертолетовой солью, когда от удара фосфор воспламеняется: 5KClO3 + 6P → 3P2O5 + 5KCl. Наверняка вы догадались, что речь идет о зажигании спичек (бока спичечной коробки намазаны красным фосфором, а в головке спички содержится бертолетова соль). Эта реакция является реакцией окисления.
Углерод еще более, чем фосфор, аллотропное вещество. В природе можно встретить в составе минералов: в углекислом газе в атмосфере, в карбонате кальция, природном газе, торфе, каменном угле. В свободном состоянии в виде графита и алмаза. Графит и алмаз достаточно инертны. Они не взаимодействуют с HNO3. Достаточно устойчивы в щелочах. Взаимодействуют с кислородом, серой, галогенами и металлами только при повышенной температуре. Простые вещества, образованные углем являются неметаллами. Горение угля образует оксид углерода (IV) — углекислый газ: С + О2 → СО2. Так выглядит реакция, проведенная в избытке кислорода, недостаток которого образует оксид углерода (II) – угарный газ: 2С + О2 → 2СО. Взаимодействие угля с водородом при нагревании образует метан: C + 2H2 → CH4. В данной реакции углерод проявляет себя окислителем. Также окислителем является в реакциях с металлами, при которых образуются карбиды: 4Al + 3C → Al4C3. С оксидами металлов проявляет восстановительные свойства: C + 2CuO → 2Cu + CO2. Углерод окисляться концентрированными азотной и серной кислотами: С + 4HNO3(конц.) → СO2 + 4NO2 + 2H2O.
Углерод достаточно широко применяется в деятельности человека. Применяться в виде кокса в металлургии для восстановления металлов.
Кремний является вторым по распространенности (после кислорода) элементом. Входит в состав множества минералов, образующих горные породы и земную кору. Кремний достаточно инертный элемент. При нормальной t взаимодействует со фтором. Химические реакции с хлором и кислородом протекают с заметной скоростью при t 400 — 6000С. С кислотами кремний не взаимодействует. В раствор в виде комплексного соединения, кремний переводит смесь азотной и фтороводородной кислоты: 3Si + 4HNO3 + 18HF → 3H2SiF6 + 4NO + 8H2O. Реагирует с расплавами и растворами щелочей, не диспропорционирует, а только окисляется: Si + 4KOH → K4SiO4+ 2H2.При высоких температурах, элемент реагирует со многими металлами. При взаимодействии с металлами образуются силициды. В силицидах щелочных и щелочноземельных металлов химическая связь носит ионно-ковалентный характер. Состав данных химический соединений является постоянным. Так же состав соответствует степени окисления кремния (-4): Na4Si, Mg2Si. Следовательно, кремний проявляет окислительные свойства.
Кремний не способен взаимодействовать с водородом. Но, несмотря на это, его соединения с водородом всё же существуют. Например: SiH4 (моносилан). С галогенами кремний образует тетрагалогениды: газообразный SiF4, жидкие SiCl4 и SiBr4 и твердый SiI4. С серой кремний образует дисульфид кремния SiS2. С углеродом кремний образует карбид кремния.
Элементы VI – А группы – халькогены. Кислород. Сера. — Студопедия.Нет
Сравнительная характеристика свойств элементов
8O 1s2 │2s2 2p4
16S 1s22s2 2p6 │3s23p43d0
34Se 1s22s2 2p63s2 3p6 │4s2 3d104p44d0
52Te 1s22s2 2p63s2 3p64s2 3d10 4p6 │5s2 4d105p45d0
84Po 1s22s2 2p63s2 3p64s2 3d10 4p6 5s2 4d105p6 │6s2 4f14 5d106p46d0
валентные электроны
В VI-А группу входят пять элементов: кислород, сера, селен, теллур и полоний (полоний — радиоактивный элемент).
Это р-элементы VI группы периодической системы Д. И. Менделеева. Они имеют групповое название — халькогены, что означает «образующие руды».
У атомов халькогенов одинаковое строение внешнего энергетического уровня ns2np4. Этим объясняется сходство их химических свойств.
Все халькогены в соединениях с водородом и металлами проявляют степень окисления — 2, а в соединениях с кислородом и другими активными неметаллами — обычно + 4 и +6. Для кислорода, как и для фтора, не типична степень окисления, равная номеру группы. Обычно кислород проявляет степень окисления ─2 и в соединении со фтором +2, +1.
У атома кислорода на 2р-подуровне два неспаренных электрона. Его электроны не могут разъединяться, поскольку отсутствует d-подуровень на внешнем (втором) уровне, т. е. отсутствуют свободные орбитали. Поэтому валентность кислорода всегда равна двум, а степень окисления — 2 и +2 (например, в Н2О и OF2). Таковы же валентность и степени окисления у атома серы в невозбужденном состоянии. При переходе в возбужденное состояние (что имеет место при подводе энергии, например при нагревании) у атома серы сначала разъединяются Зр-, а затем 3s-электроны. Число неспаренных электронов, а, следовательно, и валентность, в первом случае равны четырем (например, в SO2, а во втором — шести (например, в SO3,). Четные валентности 2, 4, 6 свойственны аналогам серы — селену, теллуру и полонию, а их степени окисления могут быть равны — 2, +2, +4 и +6.
Водородные соединения элементов Подгруппы кислорода отвечают формуле H2Э:
Н.2О, H2S, H2Se, Н2Те. Они называются хальководородами. При растворении их в воде образуются кислоты (формулы те же). Сила этих кислот возрастает с ростом порядкового номера элемента, что объясняется уменьшением энергии связи в ряду соединений H2Э. Вода, диссоциирующая на гидратированные ионы Н+ и ОН─, является амфотерным электролитом.
Сера, селен и теллур образуют одинаковые формы соединений с кислородом типа ЭO2 и ЭO3. Им соответствуют кислоты типа H2ЭO3 и H2ЭO4. С ростом порядкового номера элемента сила этих кислот убывает. Все они проявляют окислительные свойства, а кислоты типа H2ЭO3, еще и восстановительные.
Закономерно изменяются свойства простых веществ: сувеличением заряда ядра ослабевают неметаллические и возрастают металлические свойства.
Так, кислород и теллур — неметаллы, но последний обладает металлическим блеском и проводит электрический ток.
Некоторые свойства этих элементов приведены в таблице.
Физические свойства.
| Состав молекулы | Аллотропные модификации | t°пл.С° | t°кип.С° | |
| О | O2 | 1) кислород — O2 2) озон — O3 | — 218,7 — 193 | — 183 — 110 |
| S | S8 (при t комн.) S6 (500ºС) S2 (1000ºС) | 1) ромбическая < 95,6ºС 2) моноклиническая > 95,6ºС 3) аморфная. | 112,8 | 444,6 |
| Se | Sе8, Sе ∞ (при t комн.) Sе2 (900ºС) | 1) кристаллический (красный) 2) металлический (серый) 3) аморфный. | 220,9 | 688 |
| Te | Те ∞ (при t комн.) Те (>1400ºС) | 1) металлический 2) аморфный | 450 | 1390 |
Халькогены могут образовывать ковалентную полярную, ионную, ковалентную неполярную химические связи.
С увеличением заряда ядра атома элемента увеличивается радиус атома, увеличивается легкость отдачи валентных электронов (уменьшается энергия, необходимая для отрыва электрона от нейтрального атома), уменьшается способность присоединять электрон к. нейтральному атому.
Увеличение электроотрицательности от Те к О обуславливает увеличение устойчивости соединений элементов со степенью окисления —2.
Соединения элементов со степенями окисления меньше +6 могут быть окислены.
Соединения элементов с минимальной степенью окисления (— 2) могут быть только восстановителями, а с максимальной степенью окисления (+ 6, +2 для кислорода) только окислителями.
Кислород имеет положительные степени окисления только в соединениях с фтором, электроотрицательность которого больше. Это фторид кислорода OF2 и фториддикислорода O2F2.
Получение кислорода:
1. Из воздуха.
2. Электролиз воды. 2H2O = 2H2 + O2↑;
t°
3. 2KClO3 = 2KCl + 3O2↑;
t°
4. 2H2O2 = 2H2O + O2↑;
t°
5. 2KMnO4 = K2MnO4 + MnO2 + O2↑;
Свойства О2.
→ Н2 t ° H 2 О
О2 → → S t ° S О2
→М e t ° С a О; Li 2 O (оксиды)…
→Me (I-Aгруппа, кроме Li) Na2O2; K2O2 (пероксиды)
→P t° P4O10 (P2O5)
→ N2 t° NO
→CS2 t° CO2 + SO2
→H2S (избыток О 2 ) H2O + SO2
→ H 2 S (недостаток О2) H 2 O + S ↓
→ SO2 t° SO3
Проверь себя .
Al2O3
H2O ZnO
CaO
Na2O2 Na2O
горение O3
P4O10.
горение CO2 CO
O2 SO2 SO3
t°
KMnO4 t° NO NO2
t°
KClO3 горение
HgO
Ag2O кат. t°
H2O2 BaO2
Напишите уравнения химических реакций
горения сложных веществ: аммиака,
этилового спирта, метана.
Задания для самопроверки.
1. Что называется степенью окисления? Как отличить по написанию степень окисления и зараяд иона?
2. Что называется окислителем и восстановителем? Могут ли атомы в высшей степени окисления быть восстановителям, а в низшей степени окисления быть окислителями?
3. Расставьте коэффициентыи укажите восстановитель и окислитель в следующих уравнениях:
а) Fе(ОН)2 + 02+ Н2О = Fe(ОН)3;
б) Fe + НNO3 = Fe(NО3)3 + NO + Н2О;
в) Fe + НNO3 =Fe2O3 + NO2 + Н2О;
г) А1+ Н2О + NaОН = Na3[А1(ОН)6] + Н2;
д) А1+ Н2О + NaОН = Na2[А1(ОН)5 (Н2О)] + Н2;
е) Cu + HNO3 = Cu (NO3)2 + NO + Н2О;
ж) Pt + HNO3 + HCl = H2PtCl6 + NO + Н2О;
З) Mg + HNO3 =Mg (NO3)2 + NH4NO3 + Н2О;
и) Аu + О2 + Н2О +КCN = К[Аu (СN)2] + КОН;
к) Zn + О2 + КОН + Н2О = К2[Zn (ОН)4];
л) HClO4 = Cl2 + O2 + H2O;
м) KMnO4 + HCl = KCl + MnCl2 + Cl2 + H2O;
н) K2Cr2O7 + KNO2 + HNO3 = Cr(NO3)3 + KNO3 + H2O;
о) KMnO4 + H2O2 + H2SO4 = MnSO4 + K2SO4 + H2O + O2;
п) As2O3 + Zn + HCl = AsH3 + ZnCl2 + H2O;
р) Pb + PbO2 + H2SO4 = PbSO4 + H2O;
с) AgNO3 +AsH3 + H2O = Ag + H3AsO4 +HNO3;
т) Cr2(SO4)3 + (NH4)2S2O8 + H2O = (NH4)2Cr2O7 + (NH4)2SO4 + H2SO4;
у) MnSO4 + NaBiO3 + HNO3 = Bi(NO3)3 + HMnO4 + Na2SO4 + NaNO3 + H2O;
ф) NaVO3 + Kl + H2SO4 = V2(SO4)3 + I2 + Na2SO4 + K2SO4 + H2O;
х) NH3 + O2 = NO2 + H2O;
ц) KCrO2 + Br2 +KOH = K2CrO4 + KBr + H2O;
ш) AsH3 + O2 = As2O3 + H2O
Свойства серы .
→ H 2 t ° H 2 S ;
S → → М e t° Na2 S; (сульфиды )
→O2 t° SO2 ;
→KOH t° K2S + K2 SO3 + H2O
→ K2 SO3 t° K2 S2O3
Свойства H2S
→ O2 t ° S + H2O
H2S → → O2 ( избыток ) t ° SO2 + H2O
→ Cl2 S + HCl
→ CuSO4 CuS↓ + H2 SO4
→ SO2 S + H2O
→ Li Li2S + H2
→ Li2O Li2S + H2O
→ LiOH Li2S + H2O
Свойства SO2 .
→ O2 ( кат .) t° SO3
SO2 → → H2O H2SO3
→ H2S S + H2O
→ Li2O Li2SO3
→ LiOH Li2SO3 + H2O
Серная кислота H 2 SO 4 .
Качественная реакция на сульфат-ион SO 4 2─ : Ba 2+ + SO 4 2─ = Ba SO 4 ↓
Свойства серной кислоты.
конц. t ° конц. t ° конц.
Тяж. металлы (Pb, Cu, Ag) Активные металлы Al, Fe, Cr, Au,
Немеет. (As, P, S, С ..) (Na,…Mg,Zn…) Pt
Оксиды (FeO, Fe3O4, Cu2O)
KJ, PH3
(пассивируется)
SO2 H2S не реагирует
Получение серной кислоты.
Башенный способ:
t°
4 FeS2 + 11 O2 = Fe2O3 + 8 SO2;
t°,V2O5
2 SO2 + O2 = 2 SO3;
SO3 + H2O = H2SO4;
Камерный способ:
2 NO + O2 = 2NO2;
SO2 + H2O = H2SO3;
H2SO3 + NO2 = H2SO4 + NO;
Разложение сульфатов.
t° Ме2O3 + SO3 (Al, Fe ..)
Сульфат → MeO + SO2 + O2
Me + SO2 + O2 (Ag…Pt)
Пример: Отличить вещества: карбонат натрия, карбонат аммония, сульфит натрия, сульфид натрия, сульфат натрия.
Решение:
1) К небольшому количеству каждого вещества прилить концентрированную соляную кислоту:
Na.2CO3 + 2HC1 = 2NaCl + Н2О + СО2↑;
(NH4)2CO3 + 2HC1 = 2NH4C1 + H.2O + СО2↑;
Na2S03 + 2НС1 = 2NaCl + SО2 ↑(запах)+ Н2О;
Na2S + 2НС1 = 2NaCl + H2S ↑- запах тухлых яиц;
Na.2SO4 + НСl = не идет;
К отверстиям пробирок поднести фильтровальную бумагу, смоченную раствором сульфата меди:
H2S + CuSO4 = CuS↓ + H2S04;
Выпадает черный осадок — CuS.
2) Карбонаты натрия и аммония можно различить при нагревании:
tº
Na2CO3 = не идет;
tº
(NH4)2CO3 = 2NH3 ↑(резкий запах) + СО2 ↑ + H2O↑;
Задания для самопроверки.
1. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
а) S → SO2 → SO3 → H2SO4 → BaSO4
б) S → A12S3 → H2S → NaHS → Na2S → H2S
б) Fe2 (SO4)3 → SO3 → H2SO4 → H2S → S
в) FeS2 → SO2 → KHSO3 → K2 SO3
2. Сероводород объемом 896 мл (н.у.) сожгли в избытке кислорода, а полученный газ полностью поглотили 20 г 10%-ного раствора гидроксида натрия. Вычислите массовые доли веществ в полученном растворе.
3. Насыщенный водный раствор оксида серы (IV)объемом 100 мл при 20°С способен поглотить 7,2 л сероводорода. Какова растворимость оксида при этой температуре в литрах на 1 литр воды? Какую массу желтого осадка можно получить при условиях, указанных в задаче?
4. Раствор сульфата ртути (II) массой 200 г подвергли полному электролизу при инертных электродах. При этом на катоде было получено 8,04 г металла. Вычислите массовую долю соли в исходном растворе. Какова массовая доля вещества в полученном растворе?
Глава 10 — Соединения с серой, фосфором и азотом — Химия
Глава 10 — Соединения с серой, фосфором и азотом
Эта глава скоро будет доступна в виде загружаемого файла PDF.
Этот текст опубликован под лицензией Creative Commons, для ссылки и адаптации нажмите здесь.
Вступительное эссе — Органические химические вещества как агенты войны
Горчичный газ
Разработка первого химиотерапевтического препарата
Фосфаторганические нервные агенты
10.1 Соединения, содержащие серу
Тиолы и дисульфиды
Тиоэфиры
Тиоэфиры
10.2 Соединения, содержащие фосфор
10,3 Азотсодержащие соединения
Амины
Амиды
10.4 Краткое содержание главы
10,5 Ссылки
Вступительное эссе — Органические химические вещества как агенты войны
Напомним, что гетероатом — это любой атом, отличный от углерода или водорода, который находится в органической молекуле.В предыдущей главе мы познакомились с соединениями, содержащими кислород. В этой главе мы сосредоточимся на соединениях, которые содержат азот, сульфур и фосфор. Соединения, содержащие эти уникальные гетероатомы, использовались множеством способов, в том числе смертельно опасными и разрушительными. Небольшие органические молекулы, содержащие гетероатомы, такие как азот, фосфор и сера, использовались для создания боевых отравляющих веществ. Сюда входят иприты серные, азотные и органофосфаты (например, газ зарин), представленные следующими соединениями:
Горчичный газ
Горчица серная — это прототипное вещество из семейства цитотоксических боевых агентов на основе серы, которые способны образовывать большие пузыри на открытых участках кожи и в легких.Чистые серные горчицы представляют собой бесцветные вязкие жидкости при комнатной температуре. При использовании в нечистой форме, например, в качестве боевых агентов, они обычно желто-коричневого цвета и имеют запах, напоминающий запах горчицы, чеснока или хрена, отсюда и название. Первоначально серная горчица получила название LOST в честь ученых Вильгельма Ломмеля и Вильгельма Стейнкопфа, которые разработали метод крупномасштабного производства для Императорской немецкой армии в 1916 году.
Горчичные отравляющие вещества регулируются Конвенцией о химическом оружии 1993 года.В соответствии с настоящей Конвенцией осуществляется мониторинг трех классов химикатов, включая серу и азотный иприт, сгруппированные в Списке 1, как вещества, которые не используются, кроме как в химической войне. Агенты горчицы могли быть развернуты на поле боя с помощью артиллерийских снарядов, авиабомб, ракет или распыления с боевых самолетов.
Рисунок 10.1 Использование иприта во время Первой и Второй мировых войн. A. Газовый идентификационный плакат армии США времен Второй мировой войны, ок. 1941–1945 гг. Б. Волдыри на руке человека, образовавшиеся в результате воздействия иприта.
Фотография опознавательного плаката предоставлена: Армией США. Фотография блистеров предоставлена: ClockworkSoul
(Вернуться к началу)
Разработка первого химиопрепарата
Еще в 1919 году было известно, что горчичники подавляют кроветворение , или образование клеток крови. Кроме того, исследователи из Пенсильванского университета, которые сообщили о снижении количества лейкоцитов, провели вскрытие 75 солдат, умерших от горчичного агента во время Первой мировой войны.Это привело к тому, что Американское управление научных исследований и разработок (OSRD) профинансировало биологические и химические факультеты Йельского университета для проведения исследований по применению химического оружия во время Второй мировой войны. В рамках этих усилий группа исследовала азотистый иприт в качестве терапии лимфомы Ходжкина и других типов лимфомы и лейкемии, и это соединение было опробовано на своем первом пациенте-человеке в декабре 1942 года. Результаты этого исследования не были опубликованы до тех пор, пока 1946 г., когда они были рассекречены. Параллельно с этим после авианалета на Бари в декабре 1943 года врачи армии США отметили снижение количества лейкоцитов у их пациентов. Спустя несколько лет после окончания Второй мировой войны инцидент в Бари и работа группы Йельского университета с азотным ипритом совпали, и это побудило поиск других подобных химических соединений. Из-за использования в предыдущих исследованиях азотистый иприт под названием «HN2», позже известный как мустин, стал первым применяемым химиотерапевтическим препаратом против рака.Мустин (HN2) больше не используется из-за чрезмерной токсичности.
Фосфаторганические нервные агенты
Зарин является фосфорорганическим нервно-паралитическим агентом. Как и все другие нервно-паралитические агенты, зарин атакует нервную систему, препятствуя распаду нейромедиатора ацетилхолина в нервно-мышечных соединениях. Смерть обычно наступает в результате асфиксии из-за неспособности контролировать мышцы, участвующие в дыхательной функции.
Первыми симптомами воздействия зарина являются насморк, стеснение в груди и сужение зрачков.Вскоре после этого у человека возникнет затруднение дыхания, тошнота и слюнотечение. Поскольку они продолжают терять контроль над функциями организма, они могут рвать, испражняться и мочиться. За этой фазой следуют подергивания и подергивания. В конце концов, человек впадает в кому и задыхается от серии судорожных спазмов. Более того, обычная мнемоника для симптоматики отравления фосфорорганическими соединениями, включая газ зарин, является «убийцей В» бронхореи и бронхоспазма, потому что они являются основной причиной смерти, и СЛОЙ — слюноотделение, слезотечение, мочеиспускание, дефекация, желудочно-кишечные расстройства и рвота .Смерть может наступить через 1-10 минут после прямого вдыхания.
Зарин обладает высокой летучестью (легкостью, с которой жидкость может превращаться в газ) по сравнению с аналогичными нервно-паралитическими веществами, поэтому вдыхание может быть очень опасным, и даже концентрация паров может немедленно проникнуть через кожу. Одежда человека может выделять зарин в течение примерно 30 минут после контакта с газом зарина, что может привести к контакту с другими людьми. Производство и хранение зарина были объявлены вне закона с апреля 1997 года Конвенцией 1993 года о химическом оружии, и он классифицируется как вещество Списка 1.Подозреваемого применение зарина в последние теракты в Сирии остается спорной темой в глобальной политике.
Кислород является наиболее распространенным и многочисленным гетероатомом, обнаруживаемым в органических молекулах, и является составной частью всех основных макромолекул, обнаруженных в организме человека (белков, углеводов, жиров / липидов и нуклеиновых кислот). Помимо кислорода, сера, фосфор и азот также являются общими гетероатомами , которые играют особую роль в биологических системах. Азот является ключевым компонентом белков, а фосфор содержится в дезоксирибонуклеиновой кислоте (ДНК) и рибонуклеиновой кислоте (РНК).Сера содержится в более ограниченных количествах в белке, а также во многих других небольших молекулах человеческого тела, включая несколько витаминов. Серосодержащие органические соединения также необходимы для биосинтеза многих химических сигнальных молекул, таких как гормоны и нейротрансмиттеры. Таким образом, в этой главе основное внимание будет уделено органическим функциональным группам и связанным с ними химическим реакциям, связанным с молекулами, содержащими азот, серу и фосфор.
(Вернуться к началу)
10.1 Соединения, содержащие серу
Тиолы и дисульфиды
Поскольку сера находится в той же группе (6A) периодической таблицы, что и кислород, эти два элемента обладают некоторыми схожими свойствами. Можно ожидать, что сера будет образовывать органические соединения, родственные соединениям кислорода, и это действительно так. Тиолы (также называемые меркаптанами) являются серными аналогами спиртов и имеют общую формулу R-SH. Например, метантиол (также называемый метилмеркаптаном) имеет формулу CH 3 SH.Этантиол (этилмеркаптан или CH 3 CH 2 SH) является наиболее распространенным одорантом для жидкого пропана (LP). Его структура аналогична структуре этанола, но с серой вместо кислорода. Запах CH 3 CH 2 SH печально известен. Этантиол более летуч, чем этанол, из-за пониженной способности участвовать в водородных связях. Этантиол токсичен. Он встречается в природе как второстепенный компонент нефти и обычно добавляется к газообразным продуктам без запаха, таким как сжиженный нефтяной газ (LPG), в очень малых дозах, чтобы предупредить утечки газа.В этих концентрациях этантиол не опасен.
Тиолы могут подвергаться мягкому окислению с образованием соединений, называемых дисульфидами. Этот тип реакции распространен в белковых структурах, где он образует внутримолекулярные дисульфидные мостиковые структуры. Аминокислоты цистеин [HSCH 2 CH (NH 2 ) COOH] и метионин [CH 3 SCH 2 CH 2 CH (NH 2 ) COOH] содержат атомы серы, как и все белки. которые содержат эти аминокислоты.Дисульфидные связи (–S – S–) между белковыми цепями чрезвычайно важны в структуре белка.
Рис. 10.2. Образование дисульфидов из тиоловых структур. A. изображает общее уравнение образования дисульфида из двух молекул тиола. Обратите внимание, что во время этой реакции требуется окисляющий реагент, чтобы удалить 2 атома водорода и 2 электрона из тиоловых структур с целью образования окисленного дисульфидного продукта. Б. Показывает две цистеиновые аминокислоты, которые образовали дисульфидную связь. C. Когда цистеин присутствует в белковых последовательностях, он может реагировать с другими остатками цистеина в структуре и образовывать внутренние белковые структуры, называемые дисульфидными мостиками. Дисульфидные мостики важны для поддержания правильной трехмерной структуры и, следовательно, общей функции белков в биологических системах.
Изображение дисульфидных белковых мостиков в C, предоставлено: Jü
Дисульфидные связки в волосах и перьях — внимательный взгляд
Более 90% сухого веса волос составляют белки, называемые кератинами, которые имеют высокое содержание дисульфидов из аминокислоты цистеина.
Устойчивость, частично обеспечиваемая дисульфидными связями, иллюстрируется обнаружением практически неповрежденных волос из древних египетских гробниц. Перья имеют аналогичные кератины и чрезвычайно устойчивы к пищеварительным ферментам. Различные части волос и пера имеют разный уровень цистеина, что приводит к получению более твердого или мягкого материала. Манипулирование дисульфидными связями в волосах — это основа перманентной завивки в прическе. Реагенты, которые влияют на образование и разрыв связей S – S, являются ключевыми, например.г., тиогликолят аммония. Высокое содержание дисульфидов в перьях обусловливает высокое содержание серы в птичьих яйцах. Высокое содержание серы в волосах и перьях способствует появлению неприятного запаха, возникающего при их сжигании.
Рис. 10.3 Значение дисульфидных мостиков. Дисульфидные связи очень распространены в волосах и перьях. A. Показывает увеличение человеческого волоса в 200 раз. B. Показывает структуру пера без какой-либо окраски. C. Показывает постоянную прическу.
Фотография увеличенного человеческого волоса предоставлена: Ян Хоманн. Фотография пера предоставлена: Ритой Баллантайн. Фотография постоянной прически предоставлена: LJP Assistant.
В белке волос, кератине, дисульфидные связи образуются в результате окисления сульфгидрильных групп цистеина. Различные белковые цепи или петли внутри одной цепи удерживаются вместе прочными ковалентными дисульфидными связями. В процессе перманентной волны сначала добавляется основное восстанавливающее вещество (обычно тиогликолят аммония) для восстановления и разрушения дисульфидных поперечных связей.
Рисунок 10.4 Первый шаг в получении перманентного средства для волос. Сначала волосы плотно накручиваются на бигуди. Затем к волосам добавляется первый реагент, основной восстановитель. Восстанавливающий агент разрушает дисульфидные связи в кератиновых белках волос, позволяя сместить структуру складчатости кератина и приспособиться к завитой структуре волос.
Для стабилизации волос в новом положении добавляется окислитель, обычно разбавленный раствор перекиси водорода (также называемый нейтрализатором), чтобы восстановить дисульфидные связи в их новых положениях.Перманент будет удерживать эти новые позиции дисульфидных связей, пока волосы не отрастут. Новые волосы не обрабатывались и, таким образом, перенимают структуру естественной дисульфидной связи.
Рисунок 10.5 Второй этап перманентного ухода за волосами. После обработки вьющихся волос восстановителем. В волосы добавляется окислитель для восстановления дисульфидных мостиков, пока волосы находятся в свернутом состоянии. После раскручивания волосы теперь сохраняют вьющуюся форму из-за образования новых дисульфидных мостиков.
Тиоэфиры
Тиоэфиры, являющиеся серными аналогами простых эфиров, имеют общую формулу RSR ‘. Серный горчица во вступительном эссе — это пример тиоэфира. Аналогичным, но нетоксичным тиоэфиром является диметилсульфид (CH 3 SCH 3 ), который вызывает иногда неприятный запах вареной капусты и связанных с ней овощей.
Тиоэфиры
Подобно спиртам, тиолы могут также реагировать с карбоновыми кислотами в реакции дегидратации с образованием сложноэфирной структуры.В этом случае группа -ОН из карбоновой кислоты действует как уходящая группа после нуклеофильной атаки серы на карбонильный углерод. Полученный продукт называется тиоэфиром. Общая структура тиоэфира показана ниже:
Реакция дегидратации, необходимая для образования тиоэфира, показана ниже:
Образование тиоэфиров очень важно в биологических системах, особенно в отношении метаболизма жиров. Жирные кислоты с длинной цепью не могут переноситься через клетку в виде свободных жирных кислот.Структура карбоновой кислоты может нарушить целостность клеточной мембраны. Таким образом, жирные кислоты безопасно перемещаются внутри клетки в виде сложного тиоэфира с важной органической молекулой, известной как кофермент А. Структура кофермента А довольно большая и сложная. Однако важным активным компонентом является ключевая тиоловая группа, указанная стрелкой.
Фактически, кофермент A часто сокращенно называют HSCoA, чтобы подчеркнуть, что именно тиоловая сера обеспечивает критическую связь тиоэфира с группами жирных кислот.Когда жирная кислота присоединена к коферменту A, группа жирной кислоты называется жирной ацил- или более просто группой ацил-. Пример жирной кислоты C 16 , которая была активирована и связана с коферментом A, показан ниже:
Когда ваша пища (углеводы и жир) расщепляется в вашем теле, она в конечном итоге превращается в простую двухуглеродную единицу, называемую ацетил-КоА, которая, по сути, является производным тиоэфира уксусной кислоты:
Ацетил-КоА затем используется в сложном метаболическом цикле, называемом циклом Креба, для производства большого количества аденозинтрифосфата (АТФ).АТФ — основной источник энергии, который поддерживает жизнь и функционирование ваших клеток.
Ключевые вынос
Тиолы, дисульфиды, тиоэфиры и тиоэфиры часто встречаются в биологических соединениях.
Глава 12 Органические соединения, содержащие кислород и серу
1 Глава 12 Органические соединения, содержащие кислород и серу 1
2 Спирты Спирт содержит гидроксильную группу (ОН), которая замещает атом водорода в углеводороде.Фенол содержит гидроксильную группу (ОН), присоединенную к бензольному кольцу. 2
3 Обозначение спиртов В названиях спиртов в системе ИЮПАК вместо -e на -ol в общих названиях используется название алкильной группы, за которой следует спирт Формула Общее название ИЮПАК CH 4 метан CH 3 OH метанол метиловый спирт CH 3 CH 3 этан CH 3 CH 2 OH этанол этиловый спирт
4 4 Именование спиртов
5 Присвоение имен спиртам Шаг 1 Назовите самую длинную углеродную цепь с группой ОН.Назовите ароматический спирт фенолом. CH 3 CH 2 CH 2 OH пропанол OH CH 3 CH CH 2 CH 3 бутанол CH 3 OH CH 3 CH CH 2 CH 2 CH CH гексанол 5
6 Присвоение имен спиртам Шаг 2 Пронумеруйте цепочку, начиная с конца ближе к ОН. CH 3 CH 2 CH 2 OH 1-пропанол OH CH 3 CH CH 2 CH 3 2-бутанол CH 3 OH CH 3 CH CH 2 CH 2 CH CH гексанол 6
7 Присвоение названий спиртам Шаг 3 Укажите расположение и название каждого заместителя относительно группы ОН.CH 3 CH 2 CH 2 OH 1-пропанол OH CH 3 CH CH 2 CH 3 2-бутанол CH 3 OH CH 3 CH CH 2 CH 2 CH CH метил-2-гексанол 7
8 Некоторые типичные спирты OH Медицинский спирт CH 3 CH CH 3 2-пропанол (изопропиловый спирт) Антифриз HO CH 2 CH 2 OH 1,2-этандиол (этиленгликоль) OH Глицерин HO CH 2 CH CH 2 OH 1,2,3 -пропантриол 8
9 Проверка обучения Назовите следующие соединения: 1.CH 3 CH 2 CH 2 CH 2 OH OH CH 3 2. CH 3 CH CH CH 2 CH 3 3. OH 9
10 Решение Шаг 1 Назовите самую длинную углеродную цепь с группой ОН. Назовите ароматический спирт фенолом. 1. CH 3 CH 2 CH 2 CH 2 OH бутанол OH CH 3 2. CH 3 CH CH CH 2 CH 3 пентанол OH 3. циклопентанол 10
11 Решение Шаг 2 Пронумеруйте цепочку, начиная с конца ближе к OH.1. CH 3 CH 2 CH 2 CH 2 OH 1-бутанол OH CH 3 2. CH 3 CH CH CH 2 CH 3 2-пентанол OH 3. циклопентанол 11
12 Решение Шаг 3 Укажите расположение и название каждого заместителя относительно группы ОН. 1. CH 3 CH 2 CH 2 CH 2 OH 1-бутанол OH CH 3 2. CH 3 CH CH CH 2 CH 3 3-метил-2-пентанол OH 3. циклопентанол 12
13 Фенолы в медицине Фенол — это название IUPAC для бензола с гидроксильной группой, используемого в антисептических и дезинфицирующих средствах. OH OH OH OH OH CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 Фенол Резорцин 4-гексилрезорцин 13
14 Производные фенола. Соединения фенола являются активными ингредиентами эфирных масел гвоздики, ванили, мускатного ореха и мяты.14
15 Присвоение имен фенолам Шаг 1 Назовите самую длинную углеродную цепь с группой ОН. Назовите ароматический спирт фенолом. OH OH Cl Br фенол фенол 15
16 Именование фенолов Шаг 2 Пронумеруйте цепочку, начиная с конца, более близкого к ОН. OH 1 OH 1 3 Cl Br 4 фенол фенол 16
17 Присвоение имен фенолам Шаг 3 Укажите расположение и название каждого заместителя относительно группы ОН.OH 1 OH 1 3 Cl Br 4 3-хлорфенол 4-бромфенол 17
18 Тиолы Тиолы содержат серу, похожи на спирты, содержат тиоловую (SH) группу, часто имеют сильный запах, присутствуют в сыре, луке, чесноке и устрицах используются для обнаружения утечек газа 18
19 Тиолы Тиолы названы в системе IUPAC путем добавления тиола к названию алкана самой длинной углеродной цепи.19
20 Эфиры Эфир, содержащий О между двумя углеродными группами, имеет общее название, которое дает алкильные названия присоединенных групп, за которыми следует эфир CH 3 O CH 3 CH 3 CH 2 O CH 3 20
21 Проверка знаний Запишите следующую структуру: A.3-пентанол B. этантиол C. диэтиловый эфир 21
22 Раствор OH A. 3-пентанол CH 3 CH 2 CH CH 2 CH 3 B. этантиол CH 3 CH 2 SH C. диэтиловый эфир CH 3 CH 2 O CH 2 CH 3 22
23 Эфиры как анестетики Анестетики подавляют болевые сигналы в мозг, такие как диэтиловый эфир, CH 3 CH 2 O CH 2 CH 3, использовались более века, но вызывали тошноту и были горючими веществами, разработанными к 1960-м годам, были негорючими Cl FF Cl FHHCCOCHCCOCHFFFHFH Этран (энфлуран) Пентран 23
24 Классификация спиртов Классификация спиртов определяется количеством алкильных групп, присоединенных к углероду, связанных с гидроксилом первичной (1), вторичной (2) или третичной (3) первичной ( 1) Вторичный (2) Третичный (3) 1 группа 2 группы 3 группы H CH 3 CH 3 CH 3 C OH CH 3 C OH CH 3 C OH HH CH 3 24
25 Растворимость спиртов в воде Спирты содержат полярные группы ОН и образуют водородные связи с другими молекулами спиртов, которые имеют от одного до трех атомов углерода, растворимы в воде растворимость в воде уменьшается с увеличением количества атомов углерода 25
26 Растворимость эфиров в воде Эфиры не имеют полярную группу OH, но имеют группу COC, не образуют водородных связей с числом атомов углерода менее четырех; слабо растворимы в воде; число атомов углерода более четырех; не растворяется в воде. 26
27 Растворимость фенолов. Фенолы слабо растворимы в воде, имеют группа ОН, которая может образовывать водородные связи с водой, может реагировать с водой с образованием ионов феноксида, когда-то использовалась в качестве антисептика OH O — + H 2 O + H 3 O + 27
28 Проверка знаний Укажите, растворимо ли каждое из следующего воды и объясните почему.A. CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 OH B. CH 3 O CH 2 CH 3 C. CH 3 CH 2 OH 28
29 Раствор Укажите, растворимо ли каждое из следующих веществ в воде, и объясните, почему. A. CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 OH Нерастворимые спирты с длинными углеродными цепями (неполярные) не растворимы. B. CH 3 O CH 2 CH 3 Слаборастворимые простые эфиры с менее чем четырьмя атомами углерода плохо растворяются в воде. C. CH 3 CH 2 OH Растворимые короткоцепочечные спирты образуют водородные связи с водой.29
30 Дегидратация спиртов Спирты подвергаются дегидратации при нагревании с кислотным катализатором потеря H и OH из соседних атомов углерода с образованием алкена H OH H +, нагревание HCCHHHHH спирт HC = CH + H 2 O алкен 30
31 Окисление спиртов 1 Спирты окисляются, увеличивая количество углеродных и кислородных связей. Первичные спирты окисляются с образованием альдегида. 1 связь с O 2 связями с O H OH окисление H O H C C H H C C H H H H H 1 спиртовой альдегид 31
32 Окисление 1 спиртов Спирты подвергаются окислению, увеличивая количество углеродных и кислородных связей.Альдегиды могут дополнительно окисляться с образованием карбоновой кислоты. 1 связь с O 2 с O H O H O окисление H C C H H C C OH H H альдегид карбоновая кислота 32
33 Окисление двух спиртов Вторичные спирты окисляются с образованием кетона. Чтобы обозначить процесс окисления, над стрелкой реакции помещен [O]. Связь 1 с O 2 связана с O H OH H H O H [O] H C C C H H C C C H H H H H H 2 кетон спирта 33
34 Окисление третичных 3 спиртов Третичные (3) спирты окисляются с трудом.OH CH 3 C CH 3 [O] нет продукта CH 3 3 спирт нет H для окисления нет реакции 34
35 Окисление и восстановление При окислении увеличивается количество связей CO, происходит потеря H. При уменьшении количества связей CO происходит увеличение H 35
36 Отравление метанолом Метанол также известен как метиловый спирт, он очень токсичен и содержится в жидкости для омывателя лобового стекла, Sterno и средствах для удаления краски, быстро абсорбируется и окисляется до формальдегида, а затем до муравьиной кислоты OO [O] [O] CH 3 OH H CH H COH метиловый спирт формальдегид муравьиная кислота 36
37 Этанол, CH 3 CH 2 OH Этанол действует как депрессант и убивает или выводит из строя больше людей, чем любой другой наркотик метаболизируется алкоголиком со скоростью мг / дл в час, метаболизируется со скоростью 30 мг / дл в час 37
38 38 Влияние алкоголя на организм
39 Окисление тиолов Когда тиолы подвергаются окислению, атом H теряется из каждой из двух групп SH, продукт представляет собой дисульфидный белок в волосах, сшитый дисульфидными связями, обнаруженными в амино кислота цистеин 39
40 Проверка знаний Дайте первичный продукт для реакции 2-пропанола, когда он подвергается воздействию А.окисление B. дегидратация 40
41 Раствор OH CH 3 CH CH 3 = 2-пропанол = C 3 H 8 O A. окисление OH 2CH 3 CH CH 3 + 9O 2 [O] O CH 3 C CH 3 + 6CO 2 + 8H 2 O B. дегидратация OH CH 3 CH CH 3 H +, нагревание CH 3 CH = CH 2 + H 2 O 41
42 Карбонильная группа в альдегидах и кетонах Карбонильная группа состоит из полярной двойной связи углерод-кислород. очень электроотрицательный атом кислорода имеет две неподеленной пары электронов на атоме O, имеет частичный положительный заряд на C и частичный отрицательный заряд на OOC 42
43 Карбонильная группа в альдегидах и кетонах Карбонильная группа в альдегиде присоединена по крайней мере к одному атому H в кетон присоединен к двум углеродным группам 43
44 Обозначение альдегидов Альдегид имеет название IUPAC, в котором -e в названии алкана заменено на -al имеет общее название для первых четырех альдегидов. при использовании следующих префиксов: 1 углерод, форма 2 атома углерода, ацет 3 атома углерода, пропион 4 углерода, бутир, за которым следует альдегид 44
45 45 Обозначение альдегидов
46 46 Обозначение альдегидов
47 Обозначение альдегидов Дайте название IUPAC для следующих альдегидов : O CH 3 CH 2 CH 2 CH CH CH 3 Cl Cl OCH 47
48 Обозначение альдегидов Шаг 1 Назовите самую длинную углеродную цепь, содержащую карбонильную группу, заменив e в названии алкана на al.O CH 3 CH 2 CH 2 CH CH CH 3 пентаналь Cl Cl OC бензальдегид H 48
49 Обозначение альдегидов Этап 2 Назовите и пронумеруйте заместители, считая карбонильную группу как углерод 1. O CH 3 CH 2 CH 2 CH CH CH 3 2 -метилпентаналь Cl Cl OCH 3,4-дихлорбензальдегид 49
50 Альдегиды в ароматизаторах Некоторые природные альдегиды используются в качестве ароматизаторов для пищевых продуктов и ароматизаторов. OCHOCH бензальдегид (миндаль) HO OCH 3 O ванилин HC CHCH коричный альдегид корица 50
51 Обозначение кетонов При обозначении следующих кетонов в системе IUPAC -e в названии алкана заменяется на -one с общим названием, алкильными группами присоединенные к карбонильной группе, названы в алфавитном порядке, за ними следует кетон OO CH 3 C CH 3 CH 3 C CH 2 CH 3 пропанон (диметилкетон) 2-бутанон (этилметилкетон) 51
52 52 Обозначение кетонов
53 Обозначение кетонов Назовите следующие кетоны, используя систему ИЮПАК.O O CH 3 CH 2 CH CH 2 C CH 3 CH 3 CH 3 CH 3 53
54 Название кетонов Шаг 1 Назовите самую длинную углеродную цепь, которая содержит карбонильную группу, заменив e в названии алкана на единицу. O CH 3 CH 2 CH CH 2 C CH 3 CH 3 гексанон O CH 3 пентанон CH 3 54
55 Обозначение кетонов Шаг 2 Пронумеруйте углеродную цепь, начиная с конца, более близкого к карбонильной группе, и укажите ее местоположение. O CH 3 CH 2 CH CH 2 C CH 3 CH 3 2-гексанон O CH 3 CH 3 пентанон 55
56 Обозначение кетонов Этап 3 Назовите и пронумеруйте любые заместители в углеродной цепи.O CH 3 CH 2 CH CH 2 C CH 3 CH 3 4-метил-2-гексанон O CH 3 CH 3 2,3-диметилцилкопентанон 56
57 Кетоны общего назначения Ацетон (пропанон) — растворитель, используемый в жидкости для снятия лака . 57 Бутандион — это масляный ароматизатор, используемый в маргарине.
58 Физические свойства Полярная карбонильная группа обеспечивает диполь-дипольные взаимодействия C = O C = O Поскольку электроотрицательный атом кислорода образует водородные связи с молекулами воды, альдегиды и кетоны с одним или четырьмя атомами углерода очень растворимы.58
59 59 Растворимость альдегидов и кетонов в воде
60 Растворимость в воде Электроотрицательный атом О карбонильной группы альдегидов и кетонов образует водородные связи с водой. 60
61 Окисление альдегидов Первичные спирты могут быть окислены до альдегидов, которые легко окисляются до карбоновых кислот. Вторичные спирты могут окисляться до кетонов, которые не могут подвергаться дальнейшему окислению.61
62 Тест Толленса В тесте Толленса реагент Толленса, содержащий Ag +, окисляет альдегиды, но не кетоны. Ag + восстанавливается до металлического Ag, который выглядит как зеркало в пробирке. 62
63 63 Тест Толленса
64 Тест Бенедикта В тесте Бенедикта реагент Бенедикта, содержащий Cu 2+, вступает в реакцию с альдегидами, имеющими смежную группу ОН.Моносахаридные сахара обычно имеют такое расположение гидроксидов, примыкающих к альдегиду. 64
65 Тест Бенедикта В тесте Бенедикта альдегид окисляется до карбоновой кислоты, а Cu 2+ восстанавливается до красного Cu 2 O (s). Синий Cu 2+ в растворе Бенедикта образует твердое вещество кирпично-красного цвета Cu 2 O в положительном тесте на многие сахара и альдегиды с соседними гидроксильными группами. 65
66 Восстановление альдегидов и кетонов Альдегиды и кетоны можно восстановить с помощью боргидрида натрия, NaBH 4 или H 2.Восстановление альдегидов и кетонов уменьшает количество углеродно-кислородных связей за счет добавления водорода или потери кислорода. 66
67 Изомеры Молекулы являются структурными изомерами, если они имеют одну и ту же молекулярную формулу, но разные схемы связывания. 67
68 Стереоизомеры Стереоизомеры имеют идентичные молекулярные формулы, но не являются структурными изомерами. В стереоизомерах атомы связаны в одной и той же последовательности, но различаются способом их расположения в пространстве.Когда стереоизомеры имеют разные зеркальные отражения, говорят, что они обладают рукой. 68
69 У хиральных молекул есть рука. Хиральные молекулы имеют одинаковое количество атомов, расположенных по-разному в пространстве, имеют один или несколько хиральных атомов углерода, каждый из которых связан с четырьмя разными группами, как ваши руки. Попробуйте совместить ваши большие пальцы рук, ладони и спину. рук и мизинцев. 69
70 70 Некоторые повседневные хиральные и ахиральные объекты
71 Хиральные атомы углерода — зеркальные изображения Зеркальные изображения хиральных соединений нельзя накладывать друг на друга.Когда атомы H и I выровнены, атомы Cl и Br находятся на противоположных сторонах. 71
72 Ахиральные структуры накладываются друг на друга Когда зеркальное отображение ахиральной структуры вращается, структуру можно выровнять с исходной структурой. Таким образом, это зеркальное отображение накладывается. 72
73 Проверка обучения Определите каждое из них как хиральное или ахиральное соединение. Ч С l C C H 3 C H 2 C H 3 C l H C C H 3 H C l H C C H 3 B r A.B. C. 73
74 Решение Определите каждое из них как хиральное или ахиральное соединение. HC l CCH 3 CH 2 CH 3 C l HCCH 3 HC l HCCH 3 B r ABC хиральная ахиральная хиральная 74
75 Проекции Фишера Проекция Фишера представляет собой двумерное представление трехмерной молекулы, в которой наиболее окисленная группа top использует вертикальные линии вместо черточек для облигаций, которые возвращаются назад, использует горизонтальные линии вместо клиньев для облигаций, которые выходят вперед 75
76 76 Рисование проекций Фишера
77 Обозначения D и L По соглашению буква L назначается символу структура с ОН слева.Буква D назначается структуре с ОН справа. 77
78 Проверка обучения Укажите, является ли каждая пара зеркальным отображением, которое невозможно наложить (энантиомеры). CH 2 OH CH 2 OH A. H C CH 3 и CH 3 C H Br Br Cl Cl B. H C CH 3 и CH 3 C H H H 78
79 Решение Укажите, является ли каждая пара зеркальным отображением, которое невозможно наложить (энантиомеры). A. CH 2 OH H C CH 3 и CH 3 CH 2 OH C H Да Br Br Cl Cl Нет B.HC CH 3 и CH 3 CHHH 79
80 Concept Map Органические молекулы с O и S 80
GCSE CHEMISTRY — Реакция диоксида серы с кислородом с образованием триоксида серы для контактного процесса с образованием серной кислоты
GCSE CHEMISTRY — Реакция диоксида серы с кислородом для получения триоксида серы для контактного процесса для производства серной кислоты — GCSE SCIENCE.gcsescience.com 11 gcsescience.com
Кислоты и щелочи
Производство серной кислоты Кислота — Контакт Процесс.
Реакция кислорода с диоксидом серы сделать триоксид серы.
Диоксид серы производится путем реакции
сера с кислородом.
Диоксид серы можно заставить реагировать с большим количеством
кислород
для получения триоксида серы.
Это еще один пример окисления.
Реакция обратимая (показана
стрелка).
Прямая реакция (слева направо
справа) является экзотермическим.
Это сбалансированный
химический
уравнение реакции
диоксида серы с кислородом.
сера
диоксид + кислород сера
триоксид.
2SO 2 (г) + O 2 (г) 2SO 3 (г)
В
промышленные условия для химической
реакция
1) Температура 450 ° C.
2) Давление
между 1 и 2
атмосферы.
3) Оксид ванадия (V)
Используется катализатор (V 2 O 5 ).
О
99% диоксида серы
превращается в серу
триоксид в этих условиях.
Сера
триоксид используется для производства серной кислоты.
Влияние на скорость
реакция и
урожай
которая получается в результате обратимой реакции
зависит от условий (температуры, давления и катализатора).
Они были обобщены для
Габер
Процесс.
1. Увеличение температура способствует эндотермическому реакция.
2. Увеличение давление способствует меньшему объем.
3. Использование катализатора дает условия равновесия еще быстрее.
Ссылки Серная кислота Вопросы по пересмотру
gcsescience.com Периодическая таблица Индекс Кислотная викторина gcsescience.com
Дом GCSE химия GCSE Физика
Авторские права © 201
5 Dr.
 CrO
CrO

 неприятный запах)
неприятный запах)