получение и свойства.» (9 класс)
Класс 9 А, Г Дата: 05.11.20г.
Тема урока. Хлороводород: получение и свойства.
Цель урока: рассмотреть способы получения, свойства хлороводорода; научить соотносить области применения хлороводорода с его свойствами.
Задачи урока:
Образовательные: познакомить учащихся с химической формулой и строением молекулы хлороводорода, физическими и химическими свойствами, получением и применением хлороводорода.
Воспитательные: показать единство материального мира.
Развивающие: приобретение навыков самостоятельной работы.
Формировать УУД:
Познавательные УУД: умение осуществлять поиск нужной информации, выделять главное в тексте, структурировать учебный материал, грамотно формулировать вопросы,
Личностные УУД: умение применять полученные знания в своей практической деятельности.
Регулятивные УУД: умение планировать свою работу при выполнении заданий учителя, делать выводы по результатам работы.
Коммуникативные УУД: умение работать в составе творческих групп, высказывать свое мнение.
Оборудование: учебник «Химия 9 класс» Рудзитис Г.Е., Фельдман Ф.Г.; периодическая система химических элементов Д.И. Менделеева; карточки с индивидуальными заданиями, раздаточный материал.
ХОД УРОКА
Организационный момент.
Мотивация.
«Всякое вещество – от самого простого до самого сложного – имеет три различные, но взаимосвязанные стороны: состав, строение, свойства …»
(Б.М.Кедров)
Актуализация знаний.
Фронтальная беседа.
— Расскажите о физических свойствах хлора (хлор – газ, желто-зеленого цвета, имеет резкий, удушливый запах.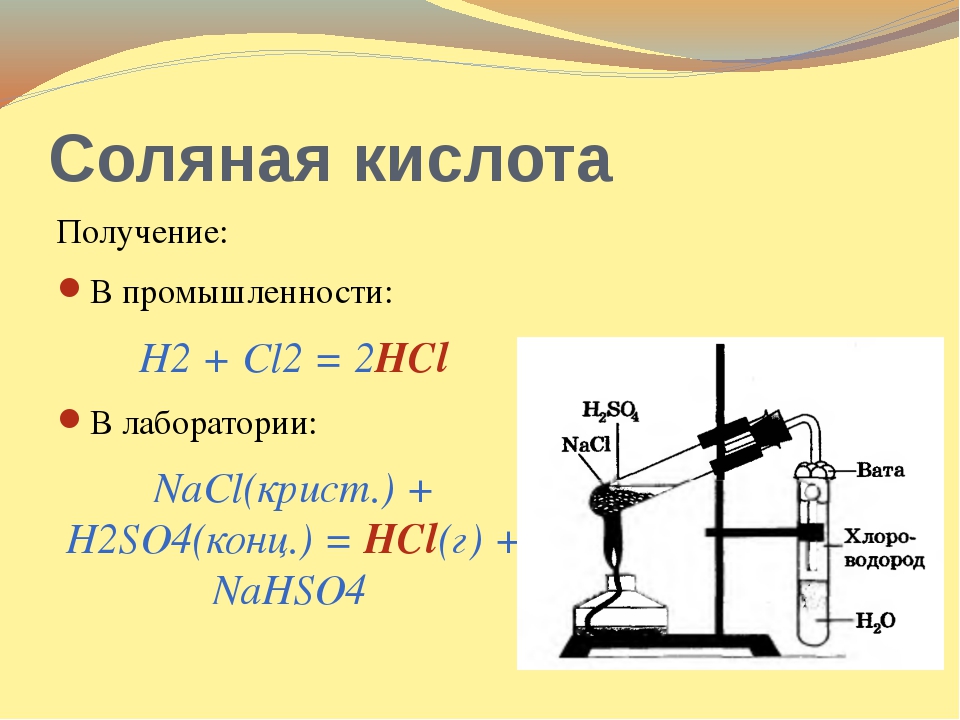 Яд для всех живых организмов. Тяжелее воздуха в 2,5 раза. Кипит при температуре от +15 ºС).
Яд для всех живых организмов. Тяжелее воздуха в 2,5 раза. Кипит при температуре от +15 ºС).
— Как меняется химическая активность галогенов от фтора к йоду? (фтор химически наиболее активен, а йод наименее активен).
— Как меняется вытеснительная активность галогенов в растворах их солей? (более активные галогены вытесняют менее активные галогены из их соединений).
— С какими простыми веществами реагирует хлор? (с металлами и водородом).
— Опишите взаимодействие хлора с водой, раскрыв сущность реакции ( Cl2 + H2O = HCl + HClO. Реакция обмена, в результате образуются две кислоты: соляная и хлорноватистая; ОВР).
— Расскажите о возможных случаях реакции соединения хлора с водородом, механизме и сущности реакции (с водородом хлор реагирует на свету, а также при нагревании; взрывается при облучении, с образованием хлороводорода).
— Как растворяется хлороводород в воде и чем является его раствор? (в воде растворяется очень хорошо, образуется соляная кислота).
Письменное домашнее задание. (Выполняется на доске учащимися, пока учащиеся выполняют задания у доски, учитель проводит фронтальную беседу с классом).
Индивидуальное задание.
Проанализируйте текст, определите вещества и запишите уравнения описанных реакций:«Во время Первой мировой войны (1915 г.) около города Ипр на западе Фландрии впервые был использован отравляющий газ. Эта газовая атака унесла жизни 5 тыс. солдат и около 15 тыс. сделала инвалидами. Взаимодействие этого газа с водородом может происходить со взрывом, водный раствор продукта этой реакции раньше называли «муриевой кислотой». Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Этот газ – хлор. При взаимодействии хлора с водородом образуется хлороводород, водный раствор «муриевая кислота» — соляная кислота. При нагревании минерала пиролюзита с соляной кислотой образуется хлор по реакции:
При нагревании минерала пиролюзита с соляной кислотой образуется хлор по реакции:
Изучение нового материала.
Химическая формула хлороводорода – HCl. Химическая связь – ковалентная полярная.
В промышленности хлороводород получают взаимодействие хлора с водородом.
Cl2 + H2 = 2HCl
В лаборатории получают нагреванием хлорида натрия с концентрированной серной кислотой. В таких условиях, при отсутствии воды, выделяется газообразный хлороводород, его затем растворяют в воде и получают соляную кислоту.
2NaCl + H2SO4 = Na2SO4 + 2HCl↑ (см. рис. 13 §14).
Хлороводород – бесцветный газ, немного тяжелее воздуха, с резким запахом, во влажном воздухе дымит.
Можно ли получить хлороводород, используя раствор поваренной соли? (нет, т.к. все находящиеся в растворе вещества являются сильными электролитами).
Химические свойства: хлороводород не реагирует ни с металлами, ни с основными оксидами (в отличие от соляной кислоты). Запомните, что соляная кислота и хлороводород – не одно и то же вещество, хотя и описываются условно одинаковой формулой. Эти вещества имеют разные физические и химические свойства.
Применение хлороводорода:
1) Получение соляной кислоты
2) Получение пластмасс и каучука.
Закрепление изученного материала.
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления (хлороводород является одной из составляющих ядовитых вулканических газов).

Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Вопросы – подсказки: что такое желудочный сок? Вспомните состав желудочного сока? Какова роль соляной кислоты в пищеварении? При каких нарушениях процесса пищеварения выписывают сильно разбавленный раствор соляной кислоты?
Домашнее задание.
Выучить материал § 14, выполнить № 1-2 с. 55.
Рефлексия.
Учащимся необходимо выбрать 3 слова из 12, которые наиболее точно передают его состояние на уроке:
Раздражение
Злость
Радость
Равнодушие.

Удовлетворение
Вдохновение
Скука.
Тревога.
Покой.
Уверенность
Неуверенность.
Наслаждение.
Индивидуальное задание.
Проанализируйте текст, определите вещества и запишите уравнения описанных реакций:
«Во время Первой мировой войны (1915 г.) около города Ипр на западе Фландрии впервые был использован отравляющий газ. Эта газовая атака унесла жизни 5 тыс. солдат и около 15 тыс. сделала инвалидами. Взаимодействие этого газа с водородом может происходить со взрывом, водный раствор продукта этой реакции раньше называли «муриевой кислотой».
 Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту.
 Сделайте предположение о происхождении этого явления.
Сделайте предположение о происхождении этого явления.Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.

Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
получение и свойства» (9 класс)
Урок № 9кл дата: _____
Тема урока.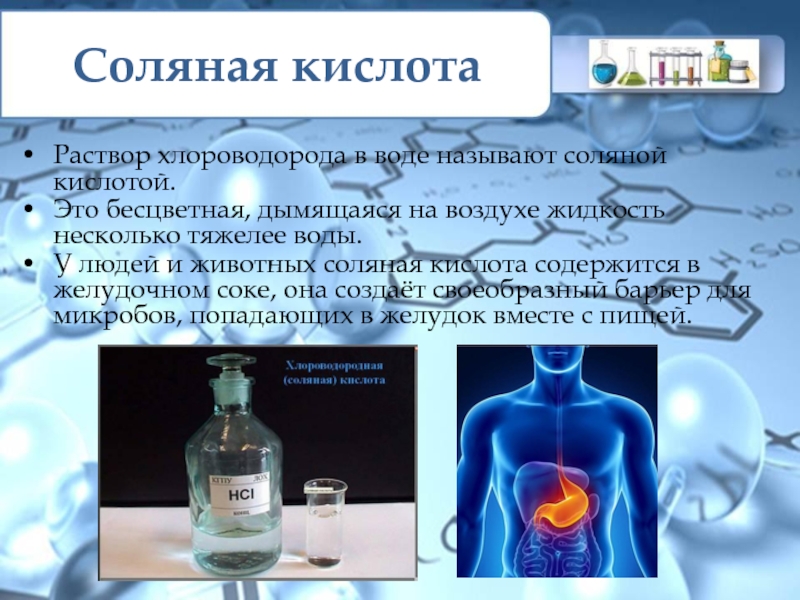 Хлороводород: получение и свойства.
Хлороводород: получение и свойства.
Тип урока: комбинированный урок.
Цель урока: рассмотреть способы получения, свойства хлороводорода; научить соотносить области применения хлороводорода с его свойствами.
Задачи урока:
Образовательные: познакомить учащихся с химической формулой и строением молекулы хлороводорода, физическими и химическими свойствами, получением и применением хлороводорода.
Воспитательные: показать единство материального мира.
Развивающие: приобретение навыков самостоятельной работы.
Методы и приемы: фронтальная беседа, индивидуальная, самостоятельная работа.
Оборудование: учебник «Химия 9 класс» Рудзитис Г.Е., Фельдман Ф.Г.; периодическая система химических элементов Д.И. Менделеева; карточки с индивидуальными заданиями, раздаточный материал.
ХОД УРОКА
Организационный момент.
Проверка домашнего задания.
Фронтальная беседа.
— Расскажите о физических свойствах хлора (хлор – газ, желто-зеленого цвета, имеет резкий, удушливый запах. Яд для всех живых организмов. Тяжелее воздуха в 2,5 раза. Кипит при температуре от +15 ºС).
— Как меняется химическая активность галогенов от фтора к йоду? (фтор химически наиболее активен, а йод наименее активен).
— Как меняется вытеснительная активность галогенов в растворах их солей? (более активные галогены вытесняют менее активные галогены из их соединений).
— С какими простыми веществами реагирует хлор? (с металлами и водородом).
— Опишите взаимодействие хлора с водой, раскрыв сущность реакции ( Cl2 + H2O = HCl + HClO. Реакция обмена, в результате образуются две кислоты: соляная и хлорноватистая; ОВР).
— Расскажите о возможных случаях реакции соединения хлора с водородом, механизме и сущности реакции (с водородом хлор реагирует на свету, а также при нагревании; взрывается при облучении, с образованием хлороводорода).
— Как растворяется хлороводород в воде и чем является его раствор? (в воде растворяется очень хорошо, образуется соляная кислота).
Письменное домашнее задание. (Выполняется на доске учащимися, пока учащиеся выполняют задания у доски, учитель проводит фронтальную беседу с классом).
Индивидуальное задание.
Проанализируйте текст, определите вещества и запишите уравнения описанных реакций:
«Во время Первой мировой войны (1915 г.) около города Ипр на западе Фландрии впервые был использован отравляющий газ. Эта газовая атака унесла жизни 5 тыс. солдат и около 15 тыс. сделала инвалидами. Взаимодействие этого газа с водородом может происходить со взрывом, водный раствор продукта этой реакции раньше называли «муриевой кислотой». Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Этот газ – хлор. При взаимодействии хлора с водородом образуется хлороводород, водный раствор «муриевая кислота» — соляная кислота. При нагревании минерала пиролюзита с соляной кислотой образуется хлор по реакции:
4HCl + MnO2 = MnCl2 + Cl2 + 2H2O
Изучение нового материала.
Химическая формула хлороводорода – HCl. Химическая связь – ковалентная полярная.
В промышленности хлороводород получают взаимодействие хлора с водородом.
Cl2 + H2 = 2HCl
В лаборатории получают нагреванием хлорида натрия с концентрированной серной кислотой. В таких условиях, при отсутствии воды, выделяется газообразный хлороводород, его затем растворяют в воде и получают соляную кислоту.
2NaCl + H2SO4 = Na2SO4 + 2HCl↑ (см. рис. 13 §14).
Хлороводород – бесцветный газ, немного тяжелее воздуха, с резким запахом, во влажном воздухе дымит. Наиболее характерным свойством хлороводорода является его большая растворимость в воде (при 0 ºС в одном объеме воды растворяется около 500 объемов газа).
Можно ли получить хлороводород, используя раствор поваренной соли? (нет, т.к. все находящиеся в растворе вещества являются сильными электролитами).
Химические свойства: хлороводород не реагирует ни с металлами, ни с основными оксидами (в отличие от соляной кислоты). Запомните, что соляная кислота и хлороводород – не одно и то же вещество, хотя и описываются условно одинаковой формулой. Эти вещества имеют разные физические и химические свойства.
Закрепление изученного материала.
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления (хлороводород является одной из составляющих ядовитых вулканических газов).
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Вопросы – подсказки: что такое желудочный сок? Вспомните состав желудочного сока? Какова роль соляной кислоты в пищеварении? При каких нарушениях процесса пищеварения выписывают сильно разбавленный раствор соляной кислоты?
Домашнее задание. Выучить материал § 14, выполнить № 1-2 с. 55.
Индивидуальное задание.
Проанализируйте текст, определите вещества и запишите уравнения описанных реакций:
«Во время Первой мировой войны (1915 г.) около города Ипр на западе Фландрии впервые был использован отравляющий газ. Эта газовая атака унесла жизни 5 тыс. солдат и около 15 тыс. сделала инвалидами. Взаимодействие этого газа с водородом может происходить со взрывом, водный раствор продукта этой реакции раньше называли «муриевой кислотой». Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Решение проблемных вопросов.
Установлено, что воды рек вблизи вулканов содержат соляную кислоту. Сделайте предположение о происхождении этого явления.
Известно, что хлороводород и соляная кислота – это ядовитые вещества, оказывающие отравляющее действие на организм человека. В то же время при некоторых желудочных заболеваниях врачи прописывают соляную кислоту как лекарственное средство.
Проблемный вопрос: «Чем объясняются действия врача, выписывающего больному в качестве лекарства ядовитое вещество?».
Урок № 9кл дата: _____
Тема урока. Соляная кислота и ее соли.
Тип урока: комбинированный урок.
Цель урока: обобщить знания о свойствах соляной кислоты, познакомить с качественными реакциями на галогенид – ионы.
Задачи урока:
Образовательные: рассмотреть эмпирическую формулу соляной кислоты и хлоридов, изучить значение качественных реакций, проводить химический эксперимент по распознаванию важнейших неорганических веществ, распознавать хлориды, составлять уравнения характерных для соляной кислоты реакций.
Воспитательные: показать единство материального мира.
Развивающие: приобретение навыков самостоятельной работы.
Методы и приемы: фронтальная беседа, индивидуальная, самостоятельная работа.
Оборудование: учебник «Химия 9 класс» Рудзитис Г. Е., Фельдман Ф.Г.; периодическая система химических элементов Д.И. Менделеева; карточки с индивидуальными заданиями, раздаточный материал, набор реактивов: раствор соляной кислоты, цинк, нитрат серебра.
Е., Фельдман Ф.Г.; периодическая система химических элементов Д.И. Менделеева; карточки с индивидуальными заданиями, раздаточный материал, набор реактивов: раствор соляной кислоты, цинк, нитрат серебра.
ХОД УРОКА
Организационный момент.
Подготовка к восприятию нового материала.
Инструктаж по технике безопасности при работе с кислотами.
Вопросы по изученной теме.
-Докажите, что в состав соляной кислоты входит водород (проведение реакции соляной кислоты с цинком; наблюдение газа).
Zn + 2HCl = ZnCl2 + H2↑
— Докажите, что в состав соляной кислоты входит хлор (проведение качественной реакции на соляную кислоту и ее соли – реакция с нитратом серебра AgNO3; наблюдение выпадения белого осадка хлорида серебра).
AgNO3 + HCl = AgCl↓ + HNO3
— Как осуществить превращение, отраженное схемой:
CuO → CuCl2 → AgCl
CuO + 2HCl = CuCl2 + H2O
CuCl2 + 2AgNO3 = 2AgCl↓ + Cu(NO3)2
Изучение нового материала.
Проведение исследовательского задания.
— Опишите физические свойства соляной кислоты с помощью своих наблюдений и данных учебника, с. 56 (бесцветная жидкость с резким запахом).
— Прочитайте статью учебника с.56 о способах получения соляной кислоты в лаборатории и промышленности.
2. Исследование химических свойств соляной кислоты.
Составление схемы, отражающей химические свойства соляной кислоты, общие с другими кислотами, специфические свойства.
Выполнение задания № 2 с.58.
Соли соляной кислоты.
NaCl – поваренная соль – является неизменным спутником человека на протяжении всей его жизни, о чем красноречиво свидетельствует история человечества.
— В чем смысл известной поговорки «Несолено хлебавши»?
— Каковы, на ваш взгляд, предпосылки возникновения старинных городов России – Соликамска, Солигорска, Сольвычегорска и др. ?
?
Постановка проблемного вопроса: «Чем объясняется такое отношение людей к обычному и всем нам известному веществу? Почему поваренная соль всегда и везде считается продуктом первой необходимости?» (Поваренная соль как пищевая добавка является важнейшим источником образования соляной кислоты в организме, которая является необходимым компонентом желудочного сока. Поступление хлорида натрия в организм поддерживает постоянство химического состава крови).
Закрепление изученного материала.
Выполнение самостоятельной работы.
Составьте уравнения осуществимых реакций:
1 вариант
NaOH + HCl →
NaCl + AgNO3 →
NaCl + KNO3 →
Na2CO3 + HCl →
2 вариант
Ca(OH)2 + HCl →
KCl + AgNO3 →
HCl + AgNO3 →
K2CO3 + HCl →
3 вариант
Ba(OH)2 + HCl →
BaCl2 + AgNO3 →
KCl + AgNO3 →
BaCO3 + HCl →
Домашнее задание. Выучить материал § 15, выполнить № 3, 5 с. 58. Индивидуальное задание * № 4 с. 58.
Выучить материал § 15, выполнить № 3, 5 с. 58. Индивидуальное задание * № 4 с. 58.
1 вариант
NaOH + HCl →
NaCl + AgNO3 →
NaCl + KNO3 →
Na2CO3 + HCl →
2 вариант
Ca(OH)2 + HCl →
KCl + AgNO3 →
HCl + AgNO3 →
K2CO3 + HCl →
3 вариант
Ba(OH)2 + HCl →
BaCl2 + AgNO3 →
KCl + AgNO3 →
BaCO3 + HCl →
Урок по теме: «Хлороводород: получение и свойства» | План-конспект урока по химии (9 класс):
Тема урока. Хлороводород: получение и свойства.
Тип урока: комбинированный урок.
Цель урока: рассмотреть способы получения, свойства хлороводорода; научить соотносить области применения хлороводорода с его свойствами.
Задачи урока:
Образовательные: познакомить учащихся с химической формулой и строением молекулы хлороводорода, физическими и химическими свойствами, получением и применением хлороводорода.
Воспитательные: показать единство материального мира.
Развивающие: приобретение навыков самостоятельной работы.
Методы и приемы: фронтальная беседа, индивидуальная, самостоятельная работа.
Оборудование: учебник «Химия 9 класс» Рудзитис Г.Е., Фельдман Ф.Г.; периодическая система химических элементов Д.И. Менделеева; карточки с индивидуальными заданиями, раздаточный материал.
ХОД УРОКА
- Организационный момент.
- Проверка домашнего задания.
Фронтальная беседа.
— Расскажите о физических свойствах хлора
(хлор – газ, желто-зеленого цвета, имеет резкий, удушливый запах. Яд для всех живых организмов. Тяжелее воздуха в 2,5 раза. Кипит при температуре от +15 ºС).
— Как меняется химическая активность галогенов от фтора к йоду?
(фтор химически наиболее активен, а йод наименее активен).
— Как меняется вытеснительная активность галогенов в растворах их солей? (более активные галогены вытесняют менее активные галогены из их соединений).
— С какими простыми веществами реагирует хлор? (с металлами и водородом).
— Опишите взаимодействие хлора с водой, раскрыв сущность реакции (Cl2 + h3O = HCl + HClO. Реакция обмена, в результате образуются две кислоты: соляная и хлорноватистая; ОВР).
— Расскажите о возможных случаях реакции соединения хлора с водородом, механизме и сущности реакции (с водородом хлор реагирует на свету, а также при нагревании; взрывается при облучении, с образованием хлороводорода).
— Как растворяется хлороводород в воде и чем является его раствор? (в воде растворяется очень хорошо, образуется соляная кислота).
Проверка знаний по теме: «Хлор» (тест у доски)
1.Из галогенов как отравляющее вещество в боевых действиях был применен впервые
1) фтор 2) хлор 3) бром 4) иод.
2. На схеме изображена модель атома:
1) Хлора 2) брома 3)йода
3. В ряду F CI Br I радиус атома:
1) увеличивается 2) уменьшается 3) не изменяется
4. Хлор вступает в реакцию с :
1) углекислым газом 2) железом 3) оксидом серы (VI) 4) азотом
5. Сумма коэффициентов в уравнении реакции между алюминием и хлором равна
1) 3 2) 4 3) 5 4) 7
6. Коэффициент перед формулой окислителя в уравнении реакции
Al + Cl2 →
1 2) 2 3) 3 4) 4
7. Степень окисления хлора в хлорной кислоте HCLO4 равна
1) 0 2) -1 3) +7 4) + 1
8. Установите соответствие:
А. Газ светло-зелёного цвета 1. Хлор
Б. Жёлто-зелёный газ 2.Фтор
В. Красно-бурая жидкость 3. Иод
Г. Кристал. вещество тёмно-фиолетового цвета 4. Бром
9. Укажите все правильные утверждения
1.Химическая связь в молекуле хлора – ковалентная неполярная
2. Хлор ядовит
3. Наиболее сильным окислителем среди галогенов является хлор
4. Хлор применяется для обеззараживания питьевой воды
5. Хлор в соединениях с металлами проявляет степень окисления -1
- Актуализация знаний (работа с текстом)
Проанализируйте текст, определите вещества и запишите уравнения описанных реакций:
«Во время Первой мировой войны (1915 г.) около города Ипр на западе Фландрии впервые был использован отравляющий газ. Эта газовая атака унесла жизни 5 тыс. солдат и около 15 тыс. сделала инвалидами. Взаимодействие этого газа с водородом может происходить со взрывом, водный раствор продукта этой реакции раньше называли «муриевой кислотой». Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Этот газ – хлор. При взаимодействии хлора с водородом образуется хлороводород, водный раствор «муриевая кислота» — соляная кислота. При нагревании минерала пиролюзита с соляной кислотой образуется хлор по реакции:
4HCl + MnO2 = MnCl2 + Cl2 + 2h3O
- Изучение нового материала.
Химическая формула хлороводорода – HCl. Химическая связь – ковалентная полярная.
В промышленности хлороводород получают взаимодействие хлора с водородом.
Cl2 + h3 = 2HCl
В лаборатории получают нагреванием хлорида натрия с концентрированной серной кислотой. В таких условиях, при отсутствии воды, выделяется газообразный хлороводород, его затем растворяют в воде и получают соляную кислоту.
2NaCl + h3SO4 = Na2SO4 + 2HCl↑ (см. рис. 13 §14).
Хлороводород – бесцветный газ, немного тяжелее воздуха, с резким запахом, во влажном воздухе дымит. Наиболее характерным свойством хлороводорода является его большая растворимость в воде (при 0 ºС в одном объеме воды растворяется около 500 объемов газа).
Можно ли получить хлороводород, используя раствор поваренной соли? (нет, т.к. все находящиеся в растворе вещества являются сильными электролитами).
Химические свойства: хлороводород не реагирует ни с металлами, ни с основными оксидами (в отличие от соляной кислоты). Запомните, что соляная кислота и хлороводород – не одно и то же вещество, хотя и описываются условно одинаковой формулой. Эти вещества имеют разные физические и химические свойства.
- Закрепление изученного материала.
Звуковой диктант «Данетка»
- Формула хлороводорода – HCl?
- Химическая связь в молекуле хлороводорода – ковалентная неполярная?
- В промышленности хлороводород получают сжиганием водорода в хлоре?
- Синяя лакмусовая бумажка в водном растворе хлороводорода краснеет?
- Водный раствор хлороводорода имеет щелочную реакцию?
- Водный раствор хлороводорода – серная кислота?
- В лабораторных условиях хлороводород получают нагреванием хлорида натиря с конц. серной кислотой?
- При обычных условиях хлороводород не реагирует ни с металлами , ни с их оксидами?
- Водный раствор хлороводорода реагирует со щелочами?
- Хлороводород — это бесцветный газ с резким неприятным запахом?
- Рефлексия
Составление синквейна
Хлороводород
Бесцветный, тяжёлый
Дымит, растворяется, краснеет
Хлороводород используется для получения соляной кислоты
Газ
- Домашнее задание. Выучить материал § 14
Индивидуальное задание.
Проанализируйте текст, определите вещества и запишите уравнения описанных реакций:
«Во время Первой мировой войны (1915 г.) около города Ипр на западе Фландрии впервые был использован отравляющий газ. Эта газовая атака унесла жизни 5 тыс. солдат и около 15 тыс. сделала инвалидами. Взаимодействие этого газа с водородом может происходить со взрывом, водный раствор продукта этой реакции раньше называли «муриевой кислотой». Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Конспект урока химии на тему «Хороводород; получение, свойства
Планконспект урока по химии в 8 классе на тему «Хлороводород: получение, свойства» Разработчик: Меновщикова Светлана Ивановна, учитель химии, биологии МБОУ Усть Калманская СОШ» с.УстьКалманка Алтайского края Тип урока: Комбинированный Технологии урока: экспериментальная, поисковая, здоровьесберегающая. Цель урока: изучить способы получения хлороводорода, его физические и химические свойства. Задачи: Общеобразовательные: создать условия для формирования представлений об образовании химической связи в молекуле хлороводорода, изучения физических и химических свойств хлороводорода, его практического значения и влияния на здоровье человека. Развивающие: создать условия для стимулирования познавательной активности ребят; развития умений быстро и чётко формулировать и высказывать свои мысли, логически рассуждать; формирования умений самостоятельного поиска необходимой информации в дополнительных источниках; расширения мотивационного поля при изучении химии. Воспитательные: создать условия для формирования коммуникативной компетенции учащихся, умения работать в группах, воспитания ответственности за коллективный результат. Планируемые результаты деятельности: Личностные (ЛР): условия для формирования коммуникативной компетентности в общении и сотрудничестве со сверстниками в процессе образовательной деятельности; Метапредметные (МПР): осознание практической значимости изучаемого материала; развитие умений наблюдать, сравнивать, создавать обобщения, устанавливать аналогии, делать выводы; условия для формирования умений и навыков индивидуальной и групповой работы; Предметные (ПР): знание: о строении, физических и химических свойствах хлороводорода; об областях применения хлороводорода; о правилах техники безопасности при проведении наблюдений и опытов; умение: составлять уравнения химических реакций получения хлороводорода и использовать их для решения расчетных задач; составлять простейшую схемуопору по данной теме; делать выводы из наблюдений, спрогнозировать свойства новых веществ по аналогии со свойствами изученных. Основные термины, понятия: хлороводород, соляная кислота Оборудование: мультимедийный проектор, компьютер с модемом, DVDдиск с электронным приложением к учебнику, карточки с тестами, План урока: I. Мотивационноцелевой этап 1. Организационный момент (1 мин). 2. Актуализация знаний (повторение) (7 мин.) 3. Целеполагание (3 мин) II. Организационнодеятельностный этап. 4. Изучение нового материала. (20 мин) III. Рефлексивнооценочный этап. 5. Домашнее задание (2 мин) 6. Закрепление полученных знаний (3 мин) 7. Оценивание (3 мин) 8. Рефлексия (1 мин) Ход урока: Этап урока Деятельность учителя 1. Орг. момент 2.Актуализация знаний (повторение) (7 мин.) I. Мотивационноцелевой этап Добрый день, ребята! А добрый он потому, что ____ Какое у Вас настроение, я узнаю и по Вашей работе на уроке, и по рисунку в Вашем Маршрутном листе, который не забудьте заполнять в течение урока. Сейчас отметьте смайлик Вашего настроения. Вы готовы к уроку, а, значит, для Вас не составит труда напомнить нам, о чем шла речь на прошлом занятии. (Опрос у доски по вопросам учебника с.164 письменно) 1 ученик №5, 2 ученик №6 (а,б), 3 ученик №6 (в,г), 4 ученик – устно ответ на вопрос «Какие элементы образуют семейство галогенов и что у них общего?», 5 ученик устно – №3. Давайте оценим ответы ребят. 3.Целеполагание (3 мин) Ребята, посмотрите, пожалуйста, еще раз на уравнения химических реакций, записанные на Деятельность ученика Продолжают предложение (на улице солнце и хорошее настроение; готовы к уроку и не страшно, что вызовут и т.д) Рисуют в Маршрутном листе. Слушают ответы, исправляют ошибки и добавляют. Совместное оценивание ответов учащихся с комментированием. Дают названия продуктов реакций. Высказывают свои предположения. Отвечают на вопрос учителя (это газ) Отвечают: можно газ получить самим; изучив параграф учебника; послушать рассказ учителя. Отвечают: может, есть особенные свойства, знания о которых пригодятся в жизни и т.п. Объясняют правила составления схемы. доске. Назовите продукты взаимодействия хлора с веществами (Ответ: хлорид лития, хлорид железа, хлороводород, соляная и хлористая кислоты). Какое вещество из этого перечня, на Ваш взгляд, лишнее и почему Вы так считаете? Тогда посмотрите, что я принесла (во флаконах): соли LiCl, FeCl3, хлорная вода. Но вот хлороводорода в лаборантской я не нашла. Как Вы думаете, почему? Если существующие в лаборатории вещества мы можем исследовать, то как же нам изучить вещество, которого нет? Какими способами изучим понятно, только вот нужно ли Вам знать именно про это вещество? Зачем? Тогда запишите тему нашего урока в тетрадь «Хлороводород: получение, свойства». Итак, цели есть, а сейчас начинаем к ним двигаться. II. Организационнодеятельностный этап. Обычно вещество сначала получают, а потом изучают его свойства. Я предлагаю сделать наоборот. А изучим свойства хлороводорода, прочитав параграф №48 учебника. Но не просто прочитать, а составить опорную схему, используя условные обозначения, как Вы уже умеете. Напомните правила. 1) лист делится на 4 квадрата, посредине которого формула вещества; 2) условные обозначения газа легкого и тяжелого, запаха, цвета, растворимости в воде; 3) способы получения в промышленности и лаборатории; 4) свойства; 5) области применения. вкуса, Один ученик выполняет схему на доске (время выполнения 10 минут) Ребята, Вам достаточно информации для полной характеристики вещества? Читают параграф учебника, составляют схему 4. Изучение нового материала. (20 мин) Тогда обратимся к справочной информации каталога электронного учебника (п.48). (проецирование на экран, некоторые открывают на планшете). А теперь добавьте данные в схему. Давайте проверим, что у Вас получилось. Оцените свою работу в Маршрутном листе. На какое свойство особенно Вы обратили внимание? о Отвечают: нет, не достаточно сведений физических свойствах, температуре кипения плавления и Ответ у доски, обсуждение результатов. Любой ученик выходит к доске и подписывает, что считает нужным. Получается общий продукт. Оценивание ответа, самооценка. в Отвечают: присутствие воздухе раздражает кожу и слизистые оболочки, разрушает зубы и вызывает катар верхних дыхательных путей Какой вывод сделаете? Я согласна с Вами, и так как в кабинете нет вытяжного шкафа, предлагаю посмотреть видео «Получение хлороводорода» http://files.schoolcollection.edu.ru/dlrstore/95f1a5f7 5a77c9524865b3b0618b7571/136.wmv Что же общего у хлороводорода и соляной кислоты? Ответ: нельзя допускать ПДК HCl в воздухе (5 мг/м3), чтобы не навредить своему здоровью. Смотрят видеоопыт Отвечают: соляная кислота это раствор хлороводорода в воде. Именно о процессе получения хлороводорода и соляной кислоты наша задача Решают задачу в парах, а один ученик решает и пишет на доске с обратной стороны. Давайте проверим решение задачи. Оцените совместную работу в Маршрутном листе. Проверяют на доске и у себя. У доски ученик проговаривает решение. Если кто то не согласен, объясняет причину. Все выставляют в Маршрутный лист себе оценку 5. Домашнее задание (2 мин) 6. Закрепление полученных знаний (3 мин) 7. Оценивание (3 мин) 8. Рефлексия (1 мин) III. Рефлексивнооценочный этап. Запишите в дневниках задание на дом: обязательно параграф 48, после параграфа на с.169 задача №3, проработать схемуопору; по желанию составить ребус по теме урока, или найти в доп.литературе информацию об условиях получения HCl в промышленности А сейчас проверим, как Вы усвоили материал урока. Выполните 5 тестовых заданий, в которых нужно выбрать один верный вариант ответа. (см.Приложение) Обменяйтесь рабочими тетрадями с соседом по парте и проверьте ответы по ключу (на экране) Согласно критериям оцените работу и верните тетради. Выставьте оценку в Маршрутный лист. Мне приятно было сегодня с Вами работать на уроке. А Вы как думаете, мы достигли поставленной цели? У Вас еще остались вопросы? Если они требуют моей помощи, то я Вас жду на перемене. А сейчас прошу отметить смайлик, отражающий Ваше настроение, с которым Вы уходите с урока. До встречи! Записывают домашнее задание, обязательное и на выбор. Выполняют самостоятельную работу индивидуально. Взаимопроверка, оценивание, выставление оценок. Отвечают вопросы. на Сдают Рисуют. Маршрутные листы учителю ПРИЛОЖЕНИЯ Задача №2 (с.169). Дано: Решение: m(HCl)=58,5 г NaCl+h3SO4→HCl+ m(Н2O)=146г +NaHSO4 58,5г ω(HCl)? ν(NaCl)==1моль 58,5г/моль ν(NaCl)= ν(НCl)=1 моль m(HCl)=ν*M=36,5г mрра(HCl)=146г + 36,5г = =182,5г 36,5г ω(HCl)=*100%=20% 182,5г Ответ: ω(HCl)=20% Схемаопора Задание ученикам по рефлексии их деятельности: 1) Закрепление полученных знаний. Тест. 1) Хлороводород – это: а) легкокипящая жидкость б) легкий газ в) тяжелый газ г) твердое вещество 2) Хлороводород получают в лаборатории, используя вещества: а) соляная кислота и MnO2 в) поваренная соль и h3SO4 (конц) б) смесь водорода и хлора г) хлор и вода 3) Такую же химическую связь в молекуле, как и связь в HCl, имеет: а) NaH в) Na г) Nh4 б) Cl2 4) Кристаллическая решетка в молекуле хлороводорода: а) атомная б) молекулярная в) ионная г) металлическая 5) Свойство хлороводорода: а) хорошо растворяется в воде с образованием соляной кислоты б) хорошо горит с выделением большого количества энергии в) хорошо проводит электрический ток г) изменяет окраску индикатора 1в, 2в, 3г, 4б, 5а Верные варианты ответа: Формы контроля и оценки результатов урока: устный опрос, тестовая работа во карточкам, составление схемыопоры. Информация о домашнем задании: Обязательно: параграф 48, после параграфа на с.169 задача №3, проработать схемуопору; по желанию: 1) составить ребус по теме урока; 2) найти в дополнительной литературе информацию об условиях получения хлороводорода в промышленности (температура, давление, катализатор, аппараты, принципы производства, их обоснование) Список использованной литературы, компактдисков, ссылок на Интернетресурсы: 1. Рудзитис Г.Е., Фельдман Ф.Г. Химия. 8 класс: учебник для общеобразовательных учреждений.— М.: Просвещение, 2011. 2. Электронное приложение к учебнику Образование – Медиа.», ОАО «Издательство «Просвещение», 2010. Г.Е.Рудзитиса, Ф.Г.Фельдмана . – ЗАО 3. http://files.schoolcollection.edu.ru/dlrstore/95f1a5f75a77c9524865 b3b0618b7571/136.wmv Единая коллекция цифровых образовательных ресурсов, видео «Получение соляной кислоты»
Урок по теме «Хлороводород. Соляная кислота»
Тема: Хлороводород. Соляная кислота
Цель:
обучающая: обобщить знания о классификации и химических свойствах
кислот; познакомить учащихся с лабораторным способом по-
лучения хлороводорода (соляной кислоты), знакомство с
общими химическими свойствами кислот и изучение индивидуальных свойств соляной кислоты, области её применения;
развивающая: развивать логическое мышление, навыки сравнения и обоб-
щения;
воспитательная: формировать навыки самоанализа и объективного оценива-
ния, воспитывать чувство коллективизма.
Оборудование и реактивы: ПК, презентация
Тип урока: комбинированный.
I.1Мотивация учебной деятельности учащихся, сообщение темы, цели и задач урока.
2. Фронтальный опрос.
1) Какие вещества относятся к кислотам?
2) Как классифицируются кислоты, по каким признакам?
3) Какие вещества мы называем индикаторами? Какие индикаторы вам
известны? Как они изменяются в растворах кислот?
4) Какие еще химические свойства кислот вам известны?
II.Изучение нового материала.
Ребята, из всех известных нам бескислородных кислот соляная или хлороводородная имеет наибольшее значение.
1.Физические свойства. (ЦОР «Строение и физические свойства хлороводорода»)
HCl – бесцветный газ с резким запахом, немного тяжелее воздуха (Mr(HCl)=36,5). (Вопрос классу. А какая относительная молекулярная масса воздуха?) Очень хорошо растворяется в воде, с образованием раствора соляной кислоты.
2. Получение. (ЦОР «Получение и химические свойства хлороводорода»)
В лабораторных условиях хлороводород можно получить из NaClкр. и Н2SO4конц.
а) При слабом нагревании (150о С):
NaClкр. + Н2SO4конц.= NaHSO4 + HCl↑
натрия хлороводород
гидросульфат
б) При сильном нагревании (550о С):
NaClкр. + Н2SO4конц.= Na2SO4 + HCl↑
натрия хлороводород
сульфат
3. Химические свойства.
Хлоридная кислота имеет высокую химическую активность. Она проявляет общие свойства, характерные для всех кислот.
Какие же это свойства? Как вы думаете?
(Изменяет окраску индикаторов.)
1.Действие кислот на индикаторы
Действительно, вы видите, что если добавить к раствору хлоридной кислоты лакмус, то он приобретает красный цвет, метиловый оранжевый – розовый цвет, а фенолфталеин не изменяет окраску.
2. Взаимодействие с металлами.
3. Взаимодействие с основными оксидами.
Al 2O3 + 6HCl = 2 AlCl3 + 3H2O — реакция обмена
Na2О + 2HCl = 2NaCl + H2О — реакции обмена
MgО + 2HCl = MgCl2 + H2О — реакции обмена
В отличие от хлоридной кислоты, хлороводород при обычных условиях не реагирует ни с металлами, ни с их оксидами. Поэтому его хранят в стальных баллонах под давлением.
4. Взаимодействие с основаниями.
NaОН + HCl = NaCl + H2О — реакция нейтрализации
Mg(ОН)2 + 2HCl = MgCl2 + 2H2О — реакция нейтрализации
Al(ОН)3 + 3HCl = AlCl3 + 3H2О — реакция нейтрализации
5. Взаимодействие с солями, образованных более слабыми кислотами.
Na2СО3 + 2HCl = 2NaCl + H2СО3
4. Применение.
Самостоятельная работа с текстом учебника (стр.112)
III. Закрепление. (ЦОР «Тест хлороводород»)
Что такое хлороводород и как его можно получить?
Как доказать: а) что выданный вам раствор – кислота;
б) что эта кислота – хлоридная?
Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
Mg MgO MgCl2
IV. Подведение итогов.
V. Задание на дом: учить §10, повторить §§8, 9.
упр.2 (1ур.), 3(2ур.), 4(3 ур.), 5,6 (4уровень) стр.66.
Соединения галогенов
Соединения галогенов
Среди соединений галогенов следует выделить галогеноводороды. Само название говорит о том, что в состав этих соединений входят атомы водорода и галогена.
Галогеноводороды представляют собой бесцветные газы, с резким запахом, они токсичны, очень хорошо растворяются в воде с образование соответствующих кислот.
Если растворить хлороводород в воде с лакмусом, то лакмус изменит свою окраску с фиолетовой на красную.
Галогеноводороды дымятся во влажном воздухе, потому что притягивают к себе водяные пары, находящиеся в воздухе, образуя, при это, туманное облако.
Растворы галогеноводородов в воде являются кислотами. Так, HF – фтороводородная, или плавиковая кислота, HCl – хлороводородная, или соляная кислота, HBr – бромоводородная кислота, а HI – йодоводородная кислота.
В ряду от плавиковой до йодоводородной кислоты сила кислот увеличивается, так как увеличивается их способность к электролитической диссоциации с образованием ионов водорода. Самая слабая из этих кислот плавиковая, а самая сильная – йодоводородная. В HF расстояние между ядрами атомов маленькое, радиус атома фтора тоже, поэтому прочность связи высокая, поэтому и способность к диссоциации небольшая, а у HI радиусы атомов большие, расстояние между ядрами атомов тоже, поэтому эта кислота легко диссоциирует на ионы.
Наибольшее значение имеет хлороводород и соляная кислота. В промышленности хлороводород получают синтезом водорода и хлора.
А в лаборатории хлороводород получают действием концентрированной серной кислоты на кристаллический хлорид натрия.
Соляная кислота – это бесцветная жидкость, дымящаяся на воздухе. Тяжелее воды. В химических реакциях она проявляет свойства типичных кислот.
Соляная кислота реагирует с металлами, стоящими в ряду напряжений металлов до водорода. В реакции соляной кислоты с цинком образуется соль – хлорид цинка и газ – водород.
Это окислительно-восстановительная реакция, в которой атом цинка повышает свою степень окисления с 0 до +2, поэтому цинк – восстановитель, водород понижает свою степень окисления с +1 до 0, поэтому водород – окислитель.
Соляная кислота взаимодействует с основными оксидами. Так, в реакции оксида магния с соляной кислотой образуется соль – хлорид магния и вода.
Соляная кислота реагирует с основаниями. В этих реакциях образуется соль и вода.
В результате взаимодействия гидроксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.
Соляная кислота реагирует с солями слабых кислот. Так в реакции соляной кислоты с карбонатом кальция образуется новая соль – хлорид кальция и слабая кислота – угольная, которая распадается на углекислый газ и воду.
Соляная кислота имеет большое значение. Её применяют для очистки поверхности металлов, при паянии, получении солей, в производстве пластмасс и других синтетических материалов, в получении лекарственных препаратов и красок.
Галогеноводородные кислоты образуют соли: фториды, хлориды, бромиды и йодиды. Хлориды, бромиды и йодиды многих металлов хорошо растворимы в воде. Для определения в растворе хлорид-, бромид- и йодид-ионов используют нитрат серебра. В результате взаимодействия иона серебра и хлорид-иона выпадает белый творожистый осадок хлорида серебра.
В результате взаимодействия иона серебра с бромид-ионом образуется осадок светло-жёлтого цвета.
В реакции иона серебра с йодид-ионом образуется осадок жёлтого цвета.
Для распознавания фторид-иона используют ионы кальция, потому что фторид серебра – это растворимая в воде соль. В результате этой реакции выпадает осадок – фторид кальция – белого цвета.
Плавиковая кислота обладает уникальным свойством: при взаимодействии с оксидом кремния (IV), который входит в состав стекла, она плавит его.
SiO2 + 4HF = SiF4↑ + 2H2O
Эту реакцию используют для изготовления надписей и рисунков на стекле. На стекло наносят тонкий слой парафина, по которому процарапывают рисунок, а затем изделие погружают в раствор плавиковой кислоты. Некоторые художники это свойство используют при написании своих картин.
Галогены в природе существуют только в связанном виде. Наиболее распространены хлор и фтор. Важнейшее природное соединение хлора – галит – NaCl. Кроме галита, встречается и природный хлорид калия – KCl. Он входит в состав минерала сильвина и сильвинита.
Фтор входит в состав природного минерала – флюорита или плавикового шпата – CaF2.
Бром и йод своих минералов не образуют, они сконцентрированы в водах океанов и морей, в водорослях.
Заметки о получении, свойствах и использовании хлористого водорода
Хлористый водород был открыт в 1648 году. Это очень полезное химическое соединение. В свободном состоянии встречается в вулканических газах и в желудочном соке млекопитающих. Впервые он был приготовлен в 1648 году ученым по имени Иоганн Рудольф Глаубер с использованием каменной соли и концентрированной серной кислоты. В 1772 году Джозефу Пристли удалось получить его в чистом виде.
Молекулярная формула: HCl
Молекулярная масса: 36,5
Методы получения:
Комбинированная реакция:
Хлористый водород можно получить реакцией влажного газообразного водорода с хлором в присутствии рассеянного солнечного света.Реакция должна поддерживаться в рассеянном, но не на прямом солнечном свете, так как это взрывная реакция. И даже не в темноте, так как он очень медленный.
H 2 + Cl 2 Рассеянный солнечный свет → 2HCl (г)
H 2 + Cl 2 Прямой солнечный свет → 2HCl (г) (взрывоопасный)
H 2 + Cl 2 Темный → 2HCl (г) (незначительно)
Лабораторное приготовление хлористого водорода:
Реакция хлорида натрия с серной кислотой:
NaCl + H 2 SO 4 420 K → NaHSO 4 + HCl
Хлорид натрия Конц. Серная кислота Бисульфат натрия Хлороводород
Хлористый водород можно получить в лаборатории путем обработки хлорида натрия концентрированной серной кислотой.
При приготовлении, когда смесь концентрированной серной кислоты и хлорида натрия, находящаяся в круглодонной колбе, подвергается нагреванию, образуется газообразный хлористый водород.Этот хлористый водород пропускается через сушильный агент и собирается путем вытеснения воздуха вверх.
Осушитель используется для удаления влаги из продукта.
Концентрированная серная кислота (H 2 SO 4 ), пятиокись фосфора (P 2 O 5 ) и оксид кальция (CaO) обычно используются в качестве осушающих агентов.
Подтверждение выпуска хлористого водорода:
При переворачивании над сосудом с газообразным аммиаком, который находится рядом с сосудом с хлористым водородом, образуются плотные белые пары.Эти пары состоят из взвешенных в воздухе частиц твердого хлорида аммония. При взаимодействии хлористого водорода с аммиаком образуется твердый хлорид аммония. Образование белых густых паров подтверждает образование хлористого водорода.
Физические свойства:
- Хлороводород — бесцветный газ.
- Имеет резкий запах.
- Имеет кисловатый вкус.
- Дым во влажном воздухе
- Негорючие
- Просто гасит светящуюся шину
- Хорошо растворим в воде; раствор хлористоводородной кислоты
- Точка кипения: –83⁰C
- Температура замерзания: –113⁰ C
Химические свойства:
Водный раствор реагирует с металлами, оксидами, гидроксидами, карбонатами и бикарбонатами металлов с образованием соответствующих хлоридов.
2HCl + Ca → CaCl 2 + H 2
2HCl + MgO → MgCl 2 + H 2 O
HCl + NaOH → NaCl + H 2 O
2HCl + CaCO 3 → CaCl 2 + H 2 O + CO 2
HCl + NaHCO 3 → NaCl + H 2 O + CO 2
Образование акварели:
Смесь трех частей концентрированного хлористого водорода с одной частью концентрированной азотной кислоты называется акварегией.
3HCl + HNO 3 → NOCl + 2H 2 O + 2 [Cl]
Образующийся хлорид, выделяющийся при смешивании, может вступать в реакцию с благородными металлами, такими как золото и платина, с образованием хлоридов металлов.
Реакция с нитратами:
Обычно разбавленная HCl не реагирует с нитратами, но может реагировать с нитратом серебра с образованием белого осадка хлорида серебра.
HCl + AgNO3 → AgCl + HNO 3
Использует:
Полезно производить хлор и некоторые другие хлориды.
Он полезен как растворитель для благородных металлов.
Используется в качестве реактива в лабораториях.
Насыщенный раствор хлорида цинка в разбавленной соляной кислоте используется для очистки металлических поверхностей перед нанесением покрытия или пайкой.
Хлористый водород против соляной кислоты — стенограмма видео и урока
Химическая формула
HCl — это химическая формула хлористого водорода и соляной кислоты.Основное различие заключается в их состоянии. Хлороводород — это газ, а соляная кислота — водный раствор. Водный просто означает, что он растворен в воде. Вот почему важно указывать состояние вопроса в скобках. Для газообразной версии мы пишем HCl (g), а для кислотной версии мы пишем HCl (aq). Давайте углубимся в каждое из этих состояний.
HCl (г)
Как мы уже говорили, хлористый водород — это газ.Мы можем нарисовать точечную структуру Льюиса HCl (г), которая показывает расположение электронов в связи между водородом и хлором. Диаграмма 1 показывает точечную структуру Льюиса газообразного хлористого водорода.
Точки на диаграмме 1 представляют электроны внешней оболочки. Между водородом и хлором делятся два электрона, что делает его ковалентной молекулой . Что-то особенное происходит, когда газообразный хлористый водород пузырится через воду.Давай проверим.
HCl (водн.)
Полярное вещество в целом электрически нейтрально, но одна его сторона заряжена положительно, а другая — отрицательно. Диаграмма 2 показывает полярную природу воды.
Когда газообразный хлористый водород попадает в воду, молекулы воды захватывают атом водорода в HCl (г) и оттягивают его от атома хлора.Это процесс растворения , при котором образуется соляная кислота. Теперь у нас есть кислый раствор, потому что в нем присутствуют ионы h4 O + 1, которые носят название гидрокония. На диаграмме 3 показан ион гидроксония.
Напишем реакцию.
HCl (г) + h3 O (л) → h4 O + 1 + Cl-1
На диаграмме 4 показано, как газообразный хлористый водород может попасть в воду.
Давайте теперь рассмотрим свойства газообразного хлористого водорода и соляной кислоты.
Свойства
Мы будем иметь дело со свойствами газообразного хлористого водорода и соляной кислоты, наблюдаемыми при комнатной температуре. Газообразный хлористый водород очень агрессивен и легко вступает в реакцию с водой, даже с водяным паром в воздухе. Несмотря на то, что он едкий, он не воспламеняется. Если бы хлористый водород был выпущен в замкнутом пространстве, он выглядел бы слегка желтым и опускался бы к полу.Он имеет характерный запах, который может гореть при вдыхании, потому что вступает в реакцию с влагой во рту, легких и носовых проходах с образованием соляной кислоты.
Соляная кислота также очень агрессивна и имеет такой же светло-желтый оттенок. Его точка кипения немного выше, чем точка кипения воды, и он очень реактивен с металлами. Сила кислоты измеряется ее значением pH. Значения pH, приближающиеся к нулю, сильнее. Чем больше хлористого водорода пропускается через заданное количество воды, тем выше pH полученной соляной кислоты.
Итоги урока
Давайте рассмотрим. Хлороводородный газ и соляная кислота имеют одинаковую химическую формулу: HCl. Разница между ними заключается в том, что хлористый водород представляет собой газ, а соляная кислота представляет собой водный раствор.
В HCl (г) атом водорода имеет два общих электрона с атомом хлора. Когда этот газ барботируется через воду, молекулы воды отделяют атом водорода от атома хлора, что называется растворением .Свободный ион водорода связывается с молекулой воды, образуя гидроксоний h4 O + 1. Реакция:
HCl (г) + h3 O (l) → h4 O + 1 + Cl-1
Газообразный хлористый водород тяжелее воздуха, слегка желтого цвета, негорючий и обладает высокой реакционной способностью по отношению к воде.
Соляная кислота тоже слегка желтоватая, и ее силу можно измерить по значению pH. Чем ниже pH, тем сильнее кислота. Соляная кислота очень реактивна с металлами.
Обе формы HCl вызывают коррозию.
Хлористый водород — обзор
1 Введение
Галогенводородные кислоты составляют группу одноосновных кислот, которые образуются при растворении галогенидов водорода в воде, с концентрацией в порядке убывания:
иодистоводородных (HI)> бромистоводородных (HBr )> соляная (HCl)> фтористоводородная (HF)
Различия в силе возникают из-за различий в размерах соответствующих галогенид-ионов. Таким образом, самый крупный иодид-анион относительно слабо взаимодействует со своим дополнительным протоном, оставляя его относительно свободным для диссоциации.На практике различия между кислотами HI, HBr и HCl невелики, и все они являются сильными кислотами, которые сильно диссоциируют в воде при всех концентрациях с высвобождением протонов и соответствующего галогенид-аниона следующим образом:
HX = H ++ X —
Результат по отношению к значениям pH галогеноводородных кислот состоит в том, что на верхнем конце диапазона pH растворы являются эффективно подкисленной водой. Таким образом, pH 2, 3 и 4 эквивалентны концентрациям 360, 36 и 3,6 ppm (мас. / Мас.) Соляной кислоты, соответственно, при 25 ° C.Однако HF кислота является исключением из этого поведения. Между неионизированными молекулами HF и воды существует очень прочная водородная связь, а небольшой фторид-анион налагает высокую степень порядка на окружающие протоны и молекулы воды, в результате чего HF-кислота является очень слабой кислотой, pH которой варьируется. сложным образом с концентрацией, показанной на рис. 1. 1
Рис. 1. pH растворов плавиковой кислоты.
По материалам Honeywell, 2002. Свойства фтористоводородной кислоты. Специальные материалы Honeywell.Доступно по адресу: http://www51.honeywell.com/sm/hfacid/common/documents/HF_Properties_Graph_technical_doc.pdf.Хлористый водород, бромид и йодид являются газами при температуре окружающей среды и коммерчески доступны в номинально безводных спецификациях, содержащих следовые количества воды. Безводный фтористый водород (AHF) — это жидкость, которая кипит при ~ 20 ° C и обычно определяется как содержащая <400 частей на миллион воды. К основным товарным сортам кислот относятся:
- 1.
Кислота HI, наименее значимая кислота на рынке, поставляется в различных концентрациях, обычно 47% или 55% (мас. / Мас.), Но также доступны концентрированные сорта в диапазоне 90–98% (мас. / Мас.).
- 2.
Бромистоводородная кислота производится в значительных количествах и поставляется в различных концентрациях, чаще всего ~ 47–49% (мас. / Мас.).
- 3.
Соляная кислота производится в наибольших количествах при концентрациях до ~ 38% (мас. / Мас.), Выше которых дымящая природа кислоты создает проблемы при хранении и транспортировке.Концентрация большинства товарных сортов составляет 30–35% (мас. / Мас.).
- 4.
HF кислота также имеет важное коммерческое значение и доступна в больших количествах при концентрациях 49% и 70% (мас. / Мас.).
С точки зрения коррозии галогеноводородные кислоты обычно классифицируются как «восстанавливающие» кислоты, потому что единственный катодный процесс, который могут обеспечить чистые кислоты, — это восстановление протонов с выделением водорода:
2H ++ 2e− = h3
В этом отличие от «окисляющих» кислот, таких как серная и азотная кислоты, в которых восстановление самой кислоты или составляющих ее компонентов происходит при потенциалах более благородных, чем выделение водорода, и в степени, которая может определять поведение материалов. подвергается воздействию кислоты, как описано в отдельных главах этой книги, посвященных двум кислотам.В случае галогеноводородных кислот их «восстанавливающие» характеристики усугубляются агрессивными свойствами галогенид-анионов, которые ингибируют образование и разрушают ранее существовавшие защитные пассивные слои на металлах и сплавах. Действительно, как HCl, так и HF кислоты находят широкое коммерческое применение при очистке и травлении металлов и сплавов из-за их способности растворять оксиды металлов.
На практике катодные процессы, альтернативные выделению водорода, могут быть доступны из-за присутствия в кислоте определенных примесей, в частности окислителей, таких как растворенный кислород и катионы металлов с более высокой степенью окисления, такие как трехвалентное железо, Fe 3+ или меди, Cu 2+ ионов.Присутствие соответствующего газообразного галогена, например хлора в случае соляной кислоты, также может иметь значительное влияние. Воздействие окислителей, которые повышают потенциал металлов и сплавов, почти всегда пагубно сказывается на коррозионных характеристиках галогеноводородных кислот, в которых металлы и сплавы в основном неспособны или с трудом образуют защитные пассивные пленки, как будет показано ниже.
Из литературы, влияние галогенид-ионов ( Cl —, Br —, I —) на ингибирование коррозии различными ингибиторами органического типа, включая полимеры, натуральные продукты растительного происхождения. , органические красители, поверхностно-активные вещества, лекарства и др.варьируется в зависимости от различных водных агрессивных сред и в различных экспериментальных условиях. Большинство доступных данных показывают, что галогенидные добавки синергетически увеличивают эффективность ингибирования большинства молекул типа органических катионов в порядке Cl — < Br — < I — в различных исследованных средах . Такие синергические эффекты часто проявляют чувствительность к различным факторам, включая характер и концентрацию добавок, температуру, а также природу металла и агрессивную среду.
Согласно им, галогенид-ионы доказали способность улучшать ингибирование коррозии широкого спектра органических веществ. Считается, что ионы галогенидов способны улучшать адсорбцию органических катионов за счет образования промежуточных мостиков между положительно заряженной поверхностью металла и положительным концом органического ингибитора. Способность галогенидов вызывать нарушение пассивности железа классически исследуется с помощью хроноамперометрических измерений, в которых применяется постоянный электрический потенциал, и путем изучения внешнего вида образцов вместе с результатами, полученными с помощью методов анализа поверхности.Различные исследователи предлагали различные механизмы, приводящие к нарушению пассивности (механизм проникновения, механизм разрыва пленки, механизм адсорбции, модель точечных дефектов), но весь процесс разрушения пассивных пленок до конца не изучен. Более того, в зависимости от различных экспериментальных условий и особенностей окружающей среды каждый из этих механизмов может быть преобладающим, иногда различия между ними весьма незначительны и, вероятно, необходимо учитывать взаимные аспекты каждого из них.
Коррозионные свойства различных классов материалов в галогеноводородных кислотах были подробно рассмотрены в других источниках. 2–10 Большая часть данных относится к соляной и HF кислотам, что отражает их коммерческое значение. Данных по бромистоводородной кислоте относительно мало, а по HI кислоте в открытом доступе практически нет. Читатели, которые заинтересованы в том, чтобы определить, «что и где работает», могут обратиться к этим источникам и к соответствующим главам, посвященным конкретным материалам в этой книге.В этой главе рассматриваются коррозионные характеристики материалов с акцентом на принципы и механизмы, лежащие в основе их коррозионных характеристик в кислотах.
Паспорт безопасности материалаСоляная кислота 32-38% раствор ACC № 11155
| Раздел 1 — Идентификация химического продукта и компании |
Паспорт безопасности данных Наименование: Соляная кислота 32-38% раствор
Каталожные номера: A142-212, A142P-19, A142P-20, A144-212, A144-212LC, A144-500, A144-500LB,
A144-500LC, A144-612GAL, A144C-212, A144C-212EA, A144P-19, A144P-20,
A144S-212, A144S-212EA, A144S-500, A144SI-212, A466-1, A466-2, A466-250,
A466-2LC, A466-500, A481-212, A481-212LC, A508-212, A508-212LC, A508-4,
A508-500, A508SK-212, AS481-212LC, NC9373124, S71942SC, S71942SCND, S71943,
S71943ND, S80038, SA49
Синонимы: Соляная кислота; Хлороводородная кислота; Хлороводород в водной среде
решение.
Идентификационный номер компании:
Fisher Scientific
1 Реагент переулок
Fair Lawn, NJ 07410
Для информации звоните: 201-796-7100
Экстренный номер: 201-796-7100
Для получения помощи CHEMTREC звоните: 800-424-9300
Для получения международной помощи CHEMTREC звоните: 703-527-3887
| Раздел 2 — Состав, информация о компонентах |
| Номер CAS | Химическое название | Процент | EINECS / ELINCS |
| 7732-18-5 | Вода | 62-68 | 231-791-2 |
| 7647-01-0 | Хлороводород | 32-38 | 231-595-7 |
| Раздел 3 — Идентификация опасностей |
ОБЗОР АВАРИЙНЫХ СИТУАЦИЙ
Внешний вид: прозрачная жидкость от бесцветной до бледно-желтой.
Опасно! Вызывает ожоги глаз и кожи. Причины
ожоги пищеварительного и дыхательного тракта. Может быть смертельным при вдыхании или
проглотил. Повторное или продолжительное воздействие может вызвать эрозию
обнаженные зубы. Едкий по отношению к металлу.
Органы-мишени: Дыхательная система,
желудочно-кишечный тракт, зубы, глаза, кожа.
Возможное воздействие на здоровье
Глаз: Может вызвать необратимую травму глаз. Пар или туман могут вызвать раздражение и сильные ожоги.Контакт с жидкостью вызывает коррозию глаза и вызывает сильные ожоги.
Кожа: Контакт с жидкостью вызывает коррозию и вызывает тяжелые ожоги и изъязвление. Тяжесть травмы зависит от концентрации раствор и продолжительность воздействия.
Попадание внутрь организма: Вызывает сильные ожоги пищеварительного тракта с болями в животе, рвотой, и возможная смерть. Может вызвать коррозию и постоянное повреждение тканей разрушение пищевода и пищеварительного тракта.
Вдыхание: Может быть смертельным при вдыхании. Может вызвать сильное раздражение дыхательные пути с болью в горле, кашлем, одышкой и отсроченный отек легких. Вызывает химические ожоги дыхательных путей тракт. Вызывает разъедающее действие на слизистые оболочки.
Хроническая токсичность: Продолжительный или повторяющийся контакт с кожей может вызвать дерматит. Повторяется воздействие может вызвать эрозию зубов. Повторное воздействие слабого концентрации паров HCl или тумана могут вызвать кровотечение из носа и десны.Сообщалось также о хроническом бронхите и гастрите.
| Раздел 4 — Меры первой помощи |
Глаза: В случае контакта немедленно промойте глаза большим количеством воды в течение t минимум 15 минут. Немедленно обратитесь за медицинской помощью.
Кожа: В случае контакта немедленно промыть кожу большим количеством воды для не менее 15 минут при снятии загрязненной одежды и обуви.Немедленно обратитесь за медицинской помощью. Постирать одежду перед повторным использованием.
Попадание внутрь организма: При проглатывании НЕ вызывайте рвоту. Немедленно обратитесь за медицинской помощью. Если пострадавший полностью в сознании, налейте ему стакан воды. Никогда не давай что-нибудь в рот человеку без сознания.
Вдыхание: ЯД материал. При вдыхании немедленно обратитесь за медицинской помощью. Удалять пострадавший на свежем воздухе. Если нет дыхания проведите искусственную вентиляцию легких.Если дыхание затруднено, дайте кислород.
На заметку врачу: НЕ используйте бикарбонат натрия для нейтрализации кислоты.
| Раздел 5 — Меры пожаротушения |
Общая информация: Как и при любом пожаре, наденьте автономный дыхательный аппарат в по требованию давления, MSHA / NIOSH (одобренный или эквивалентный) и полный Защитное снаряжение. Сток воды может нанести ущерб окружающей среде.Дайка и собирать воду для тушения пожара. Не горюч, но реагирует с большинство металлов образуют горючий газообразный водород. Используйте водный спрей, чтобы сохранить контейнеры, подверженные воздействию огня, остыть. Пары могут быть тяжелее воздуха. Они может распространяться по земле и собираться на низких или ограниченных участках. Емкости могут взорваться при нагревании.
Средства пожаротушения: Вещество негорючее; использовать агент, наиболее подходящий для тушить окружающий огонь.
Температура воспламенения: Не применимо.
Температура самовоспламенения: Не применимо.
Пределы взрываемости, нижний: Не доступен.
Верх: Не доступен.
Рейтинг NFPA: (приблизительно) Здоровье: 3; Воспламеняемость: 0; Нестабильность: 1
| Раздел 6 — Меры при случайном выбросе |
Общая информация: Используйте соответствующие средства индивидуальной защиты, как указано в разделе 8.
Разливы / Утечки: Избегайте попадания стоков в ливневую канализацию и канавы, ведущие в водные пути. Немедленно убирайте пролитую жидкость, соблюдая меры предосторожности, указанные в Защитной Раздел оборудования. Изолируйте территорию и запретите вход. Обеспечьте вентиляцию. Разлив можно осторожно нейтрализовать известью (оксид кальция, CaO). А Пена для подавления паров может использоваться для уменьшения испарений. Подход к разливу с подветренной стороны.
| Раздел 7 — Обращение и хранение |
Обработка: После работы тщательно вымыть.Снимите загрязненную одежду и постирать перед повторным использованием. Содержание может оказывать давление при продолжительном место хранения. Не допускать попадания в глаза, на кожу или одежду. Хранить контейнер плотно закрытый. Выбросьте загрязненную обувь. Держитесь подальше от сильных основы и металлы. Будьте осторожны при открытии. Не использовать с металлом шпатель или другие металлические предметы. Не вдыхайте пары или туман. Использовать только с соответствующей вентиляцией или защитой органов дыхания.
Хранение: Хранить в прохладном, сухом, хорошо вентилируемом месте вдали от несовместимых вещества.Область агрессивных веществ. Не хранить в металлических контейнерах. Магазин вдали от щелочей. Отдельно от окислителей.
| Раздел 8 — Контроль воздействия, личная защита |
Инженерный контроль: Помещения для хранения или использования этого материала должны быть оборудованы. с устройством для промывания глаз и безопасным душем. Используйте адекватные общие или местная вытяжная вентиляция для удержания концентраций в воздухе ниже допустимые пределы воздействия.Используйте устойчивую к коррозии вентиляцию. система.
Пределы воздействия
| Химическое наименование | ACGIH | NIOSH | OSHA — Final PELs |
| Вода | нет в списке | нет в списке | нет в списке |
| Хлористый водород | 2 ppm потолок | 50 частей на миллион IDLH | 5 ppm потолок; 7 мг / м3 потолок |
OSHA освобожденные PEL: Воды: Для этого химического вещества нет списков OSHA Vacated PELs.Хлороводород: Для этого химического вещества нет списков OSHA Vacated PELs.
Средства индивидуальной защиты
Глаза: Надевайте защитные очки для защиты от брызг и защитную маску.
Кожа: Надевайте соответствующие перчатки, чтобы предотвратить попадание на кожу.
Одежда: Носите соответствующую защитную одежду, чтобы предотвратить появление кожных покровов. экспозиция.
Респираторы: Соблюдайте правила OSHA в отношении респираторов, изложенные в 29 CFR 1910.134 или европейский стандарт EN 149. Используйте Утверждено NIOSH / MSHA или европейским стандартом EN 149 респиратор, если пределы воздействия превышены или если раздражение или другие симптомы.
| Раздел 9 — Физические и химические свойства |
Физическое состояние: Жидкость
Внешний вид: прозрачный, от бесцветного до бледно-желтого
Запах: сильный, резкий
pH: 0.01
Давление пара: 84 мм рт. Ст. При 20 ° C
Плотность пара: 1,27 (воздух = 1)
Скорость испарения: > 1,00 (N-бутилацетат)
Вязкость: Не доступен.
Точка кипения: 83 ° C при 760 мм рт. Ст.
Температура замерзания / плавления: -66 ° C
Температура разложения: Не доступен.
Растворимость: Растворим.
Удельный вес / плотность: 1,19 (38%)
Молекулярная формула: HCl.h3O
Молекулярный вес: 36,46
| Раздел 10 — Стабильность и реакционная способность |
Химическая стабильность: Стабилен при нормальных температурах и давлениях.
Условия, которых следует избегать: Избыточное тепло.
Несовместимость с другими материалами: Металлы, сильные окислители, сильные восстановители, основания, уксусный ангидрид, спирты, амины, серная кислота, винилацетат, эпоксиды (например,грамм. бутилглицидиловый эфир), хлорсульфоновая кислота, карбиды, бета-пропиолактон, этиленимин, оксид пропилена, литий силициды, 2-аминоэтанол, 1,1-дифторэтилен, борид магния, сульфат ртути, альдегиды, цианиды, сульфиды, фосфиды.
Опасные продукты разложения: Хлороводород, хлор, газообразный водород.
Опасная полимеризация: Не произойдет.
| Раздел 11 — Токсикологическая информация |
RTECS №:
CAS № 7732-18-5: ZC0110000
CAS № 7647-01-0: MW4025000; MW4031000
LD50 / LC50:
CAS # 7732-18-5:
Оральный, крыса: LD50 = > 90 мл / кг;
.
CAS # 7647-01-0:
Вдыхание,
мышь: LC50 = 1108 частей на миллион / 1H;
Вдыхание, мышь: LC50 = 20487
мг / м3 / 5М;
Вдыхание, мышь: LC50 =
3940 мг / м3 / 30М;
Вдыхание, мышь:
ЛК50 = 8300 мг / м3 / 30М;
Вдыхание,
крыса: LC50 = 3124 частей на миллион / 1H;
Вдыхание, крыса: LC50 = 60938
мг / м3 / 5М;
Вдыхание, крыса: LC50 =
7004 мг / м3 / 30М;
Вдыхание, крыса:
ЛК50 = 45000 мг / м3 / 5М;
Вдыхание,
крыса: LC50 = 8300 мг / м3 / 30M;
Устный,
кролик: LD50 = 900 мг / кг;
.
Вдыхание LC50 (аэрозоль) крыса: 8300 мг / м3 / 30M; Оральный LDLo Мужчина: 2857
мкг / кг; Оральный LDLo для женщин: 420 мкл / кг; Вдыхание LCLo Человека: 1300
частей на миллион / 30 М.
Канцерогенность:
CAS # 7732-18-5:
Не включен в список ACGIH, IARC, NTP или CA Prop 65.
CAS # 7647-01-0:
Не включен в список ACGIH, IARC, NTP или CA Prop 65.
Эпидемиология: Данные недоступны.
Тератогенность: Самки крыс подвергались воздействию 450 мг / м3 HCl в течение 1 часа.
либо до спаривания, либо на 9 день беременности.Эффекты развития наблюдались у потомства.
Однако это воздействие вызвало токсические эффекты, в том числе:
смертность у матерей.
Влияние на репродуктивную функцию: Нет доступной информации.
Мутагенность: См. Фактическую запись в RTECS для получения полной информации.
Нейротоксичность: Нет доступной информации.
Другие исследования:
| Раздел 12 — Экологическая информация |
Экотоксичность: Рыба: Синежабрик / Солнцефабрик: 3.6 мг / л; 48 часов; Смертельная (неуточненная) рыба: Bluegill / Sunfish: LC50; 96 часов; pH 3,0-3,5 Данные недоступны.
Окружающая среда: Будет проявлять сильное испарение с поверхности почвы. При транспортировке через почву соляная кислота растворяет часть почвы материалы (особенно с карбонатными основаниями) и кислота будет нейтрализовать до некоторой степени.
Физический: Нет доступной информации.
Другое: Нет доступной информации.
| Раздел 13 — Рекомендации по утилизации |
Производители химических отходов должны определить, классифицируется ли выброшенное химическое вещество. как опасные отходы. Рекомендации Агентства по охране окружающей среды США по определению классификации перечислены в 40 CFR, часть 261.3. Кроме того, производители отходов должны ознакомиться с государственными и местными правилами обращения с опасными отходами, чтобы обеспечить полную и точную классификацию.
RCRA P-Series: Нет в списке.
RCRA U-Series: Нет в списке.
| Раздел 14 — Информация о транспортировке |
| ТОЧКА США | Канада TDG | |
| Отгрузочное наименование: | ВОДОРОДНАЯ КИСЛОТА | ВОДОРОДНАЯ КИСЛОТА |
| Класс опасности: | 8 | 8 |
| Номер ООН: | UN1789 | UN1789 |
| Группа упаковки: | II | II |
| Раздел 15 — Нормативная информация |
ФЕДЕРАЛЬНАЯ ИНФОРМАЦИЯ США
TSCA Номер
CAS 7732-18-5 внесен в список TSCA.Номер
CAS 7647-01-0 внесен в список TSCA.
Список отчетов по охране здоровья и безопасности
Ни один из химических веществ не включен в Список отчетов по охране труда.
Правила химического тестирования
Ни один из химикатов в этом продукте не попадает под действие Правила химического теста.
Раздел 12b
Ни один из химикатов не перечислен в Разделе 12b TSCA.
TSCA Правило значимого нового использования
Ни один из химикатов в этом материале не имеет сертификата SNUR согласно TSCA.
CERCLA Опасные вещества и соответствующие RQ
CAS # 7647-01-0: 5000 фунтов окончательный RQ; 2270 кг финал RQ
SARA Раздел 302 Чрезвычайно опасные вещества
CAS # 7647-01-0: 500 фунтов TPQ (только газ)
Коды SARA
CAS # 7647-01-0: немедленно.
Раздел 313
Этот материал содержит водород. хлорид (CAS № 7647-01-0, 32-38%), который подлежит отчетности требования раздела 313 SARA Title III и 40 CFR Part 373.
Закон о чистом воздухе:
CAS № 7647-01-0 внесен в список опасных загрязнителей воздуха (HAP).
Этот материал не содержит озоноразрушителей класса 1.
Этот материал не содержит озоноразрушителей класса 2.
Закон о чистой воде:
CAS № 7647-01-0 внесен в список опасных веществ согласно CWA.
Ни один из химикатов в этом продукт внесен в список приоритетных загрязнителей согласно CWA.
Ни один из химикатов в этом продукт внесен в список токсичных загрязнителей согласно CWA.
OSHA:
CAS № 7647-01-0 считается OSHA очень опасным.
ГОСУДАРСТВО
CAS # 7732-18-5 отсутствует на списки штатов из CA, PA, MN, MA, FL или NJ.
CAS # 7647-01-0 можно найти на следующие списки прав на информацию штата: Калифорния, Нью-Джерси, Пенсильвания, Миннесота, Массачусетс.
California Prop 65
California Отсутствие значительного уровня риска: Ни один из химических веществ в этом продукте не указан.
Европейские / международные правила
Европейская маркировка в соответствии с директивами ЕС
Символы опасности:
C
Фразы риска:
R 34 Вызывает ожоги.
R 37 Раздражает дыхательную систему.
Фразы безопасности:
S 26 В случае попадания в глаза немедленно промыть большим количеством воды
и обратиться к врачу.
S 45 В случае аварии или плохого самочувствия немедленно обратиться к врачу
(по возможности показать этикетку).
WGK (Водная опасность / защита)
CAS # 7732-18-5: Информация отсутствует.
CAS # 7647-01-0: 1
Канада — DSL / NDSL
CAS # 7732-18-5 внесен в Список DSL Канады.
Номер
CAS # 7647-01-0 внесен в Список DSL Канады.
Канада — WHMIS
Этот продукт имеет классификацию WHMIS E, D1A.
Этот продукт был классифицирован в соответствии с опасностями.
критерии Положения о контролируемых продуктах и Паспорта безопасности материалов
содержит всю информацию, требуемую этими правилами.
Канадский список раскрытия ингредиентов
CAS № 7647-01-0 включен в Канадский список раскрытия ингредиентов.
| Раздел 16 — Дополнительная информация |
Паспорт безопасности материала Дата создания: 06.07.1999
Редакция № 20 Дата: 01.04.2008
Приведенная выше информация считается точной и представляет информация, доступная нам в настоящее время.Однако мы не даем никаких гарантий товарной пригодности или любой другой гарантии, явной или подразумеваемой, в отношении такая информация, и мы не несем ответственности за ее использование. Пользователи должны провести собственное расследование, чтобы определить пригодность информация для их конкретных целей. Ни при каких обстоятельствах Fisher не несет ответственности за любые претензии, убытки или ущерб любой третьей стороны или за упущенную выгоду или любые специальные, косвенные, случайные, косвенные или образцовые убытки, как бы они ни возникли, даже если Fisher был уведомлен о возможность таких повреждений.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Хлористый водород — Введение, производство, использование и ответы на часто задаваемые вопросы
В химии, хотя хлор и хлористый водород представлены как разные элементы, мы всегда стремимся изучать их вместе. У них обоих более близкие отношения. Например, большая часть HCl образуется как побочный продукт реакций с участием хлора. Следовательно, в принципе, это делает желательным рассматривать оба химических вещества вместе. Как уже было сказано, давайте посмотрим на методы получения хлора и хлористого водорода.
Хлористый водород
Во-первых, хлористый водород был получен в 1648 году Глаубером путем нагревания хлорида натрия с концентрированным h3SO4. Тогда как в 1840 году Дэви объяснил, что HCl — это соединение, смешанное с водородом и хлором. Обычное название соляной кислоты — соляная кислота.
Производство хлористого водорода
Большая часть хлористого водорода, производимого в промышленных масштабах, может использоваться для производства соляной кислоты.
Прямой синтез
Очень чистый хлористый водород можно получить путем объединения хлора и водорода.Химическая реакция для них представлена следующим образом:
Cl2 + h3 → 2 HCl
Поскольку реакция является экзотермической, мы можем назвать установку либо горелкой для HCl, либо печью для HCl. Образовавшийся газообразный хлористый водород может быть абсорбирован деионизированной водой с образованием химически чистой соляной кислоты. Также эта реакция дает очень чистый продукт, например, для использования в пищевой промышленности.
Органический синтез
Промышленное производство хлористого водорода часто объединяется путем образования фторированных и хлорированных органических соединений, например фреона, тефлона и других CFC, а также хлоруксусной кислоты, скважины из ПВХ и т. Д.Производство соляной кислоты часто совмещается с ее использованием на месте. В случае химических реакций атомы водорода, присутствующие в углеводороде, могут быть заменены атомами хлора, после чего высвобождающийся атом водорода рекомбинирует с запасным атомом молекулы хлора, образуя хлористый водород. Фторирование представляет собой последующую реакцию замещения хлора путем повторного получения хлористого водорода, где химическая реакция может быть представлена следующим образом:
R − H + Cl 2 → R − Cl + HCl
R − Cl + HF → R − F + HCl
Образующийся хлористый водород может быть абсорбирован водой или использован повторно, что дает соляную кислоту промышленного или технического качества.
Свойства хлористого водорода
HCl имеет резкий аромат и представляет собой неокрашенный газ.
Соляная кислота представляет собой водный раствор хлористого водорода.
HCl растворим в воде.
Он сжижается при температуре 189 К с образованием бесцветной жидкости и замерзает при температуре 159 К с образованием белого твердого вещества.
Использование газообразного хлористого водорода
HCl можно использовать для получения царской водки, хлора, включая другие хлориды.
Может также действовать как реагент в лабораториях.
Может использоваться в качестве растворителя для растворения благородных газов.
Хлор
Хлор имеет атомный номер 35, а в периодической таблице это соединение занимает группу 17 и период 3. Химический состав хлора играет ключевую роль в удовлетворении повседневных потребностей. Ученые всего мира работают над развитием современных лекарств и возобновляемых источников энергии. В 1774 году Шееле обнаружил присутствие этого зеленовато-желтого газа, заметив действие HCl на MnO2.Этому газу не было дано название, пока Дэви не внедрил его элементарное описание и не рекомендовал название в соответствии с цветом газа.
Получение Cl2
Газообразный хлор можно получить с использованием любого из следующих процессов:
MnO2 + 4HCl → MnCl2 + Cl2 + 2h3O
4NaCl + MnO2 + h3SO4 → MnCl2 + 4NaHSO4 + 2h3Cl9 + 2h3O3 → 2KCl + 2MnCl2 + 8h3O + 5Cl2
Другие способы получения хлора
Метод Дикона: В этом конкретном методе Cl2 получают окислением газов HCl кислородом в присутствии катализатора.CuCl2 также действует как катализатор при 723 К в этом процессе.
Электролитический процесс: в этом конкретном процессе рассол подвергается электролизу. Рассол определяется как концентрированный раствор хлорида натрия. После процесса электролиза Cl2 отводится на анод.
Свойства Cl2
Cl2 представляет собой газ с резким запахом и зеленовато-желтой окраской.
Газовая природа ядовита.
Этот газ кипит при температуре 239 ° С.11К и плавится при температуре 171,6К.
Хлорная вода может образовываться при растворении Cl2 в воде. Желтый цвет воды исчезает под воздействием солнечного света из-за образования HCl и хлорноватистой кислоты. Образующаяся хлорноватистая кислота нестабильна и, следовательно, разлагается с образованием кислорода, который отвечает за окислительное и отбеливающее действие Cl2.
Cl2 + → h3O (солнечный свет) HCl + HOCl
2HOCl + 2HCl → 2 [O]
Cl 2 также сильно электроотрицателен по природе
Cl 2 газ содержит большое количество сродство к водороду, и он реагирует с водородом с образованием HCl.
Хлороводород
Хлороводород — это газ при комнатной температуре. Растворы хлористого водорода в воде известны как соляная кислота. Хлористый водород широко используется в химической промышленности в качестве реагента при производстве других химикатов. Большая его часть образуется как побочный продукт реакций с участием хлора.
Использование хлористого водорода
Среди его многочисленных применений в химической промышленности используется хлористый водород:
- при производстве 1,2-дихлорэтана (этилендихлорид) и хлорэтилена (винилхлорида), используемых, в свою очередь, для производства поли (хлорэтилена) (ПВХ).
- в производстве фторуглеродов (например, тетрафторэтилена, мономера для поли (тетрафторэтилена).
- в производстве хлора. По сути, это рециркуляция, поскольку большая часть хлористого водорода образуется в качестве побочного продукта, когда хлор вступает в реакцию с реагентом, например, при производстве хлорэтилена (винилхлорида) с образованием ПВХ. Кислота, превышающая потребность (см. Ниже), может быть подвергнута электролизу с образованием водорода и хлора. Особым достижением этого электролиза, который используется компанией Bayer в Китае, является процесс ODC (катод, истощающий кислород).
- для очистки поверхности стали («травление»), поскольку она оставляет поверхность стали в лучшем состоянии для дальнейшей обработки, такой как покрытие и гальваника. Другие кислоты иногда используются для травления нержавеющей стали.
- при производстве титана и магния.
- для регенерации ионообменных смол.
- для производства неорганических хлоридов (например, хлорида алюминия).
- для регулирования pH в самых разных производственных процессах, включая производство питьевой воды и пищевых продуктов.
- при производстве некоторых красителей.
Производство хлористого водорода
Подавляющее большинство хлористого водорода / соляной кислоты образуется как побочный продукт. В США, например, хлористый водород / соляная кислота в качестве побочного продукта составляет около 90% от общего объема производства, большая часть этого приходится на производство хлорэтилена через 1,2-дихлорэтан для производства поли (хлорэтен), ПВХ. Затем он используется для производства большего количества 1,2-дихлорэтана и, таким образом, недоступен для других процессов.
При производстве магния электролизом хлорида магния также производится кислота, но ее снова рециркулируют.
Среди других процессов, которые производят хлористый водород / соляную кислоту, — хлорирование углеводородов, например хлорирование метана с образованием хлорметана, этана в хлорэтан и бензола в хлорбензол.
Другие процессы производства хлористого водорода / соляной кислоты включают производство изоцианатов, используемых для производства полиуретанов и фторуглеродов.
Некоторые заводы, на которых образуется хлористый водород / соляная кислота, были построены рядом с заводами, которые используют эту кислоту. Например, хлористый водород / соляная кислота, полученная при производстве изоцианатов, затем подается по трубопроводу на завод по производству ПВХ для производства 1,2-дихлорэтана.
Кислота также производится при производстве сульфата калия (используется в качестве специального удобрения, например, для цитрусовых и винограда) из хлорида калия и серной кислоты.
Небольшое количество кислоты образуется при сжигании хлора в водороде. Оба реагента получают в результате электролиза водных растворов хлорида натрия (рассола). Реагенты нагревают вместе. Реакция является сильно экзотермической, и большое внимание уделяется контролю реакции, главным образом, за счет управления расходами двух газов.



 Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой».
Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой». Сделайте предположение о происхождении этого явления.
Сделайте предположение о происхождении этого явления.