ГДЗ по Химии 9 класс Шиманович
Авторы: Шиманович И.Е., Василевская Е.И., Красицкий В.А., Сечко О.И..
Химия, в отличие от большинства школьных предметов, кажется трудной подросткам с самого первого урока. Именно подросткам – ведь в средних классах об изучении такого сложного предмета не может идти и речи, хотя элементы этой науки встречаются в нескольких дисциплинах, даже в «Окружающем мире», с которым ученики знакомятся ещё в начальной школе. А ведь в старшем звене учебная нагрузка настолько велика, что ценится каждая возможность ускорить выполнение домашнего задания, поддерживая при этом высокое качество работы. И сделать это проще всего при поддержке квалифицированного консультанта – «ГДЗ по химии за 9 класс Шиманович, Василевская (Народная Асвета)».
Персональный тренер – ГДЗ
Хим. наука не входит в число обязательных экзаменационных дисциплин ГИА в украинских школах – к большому облегчению для многих учащихся.
Что входит в состав решебника
Пособие рассматривает все темы основного курса химии для девятого класса:
- Азотная кислота.
- Кислородо-содержащие соединения фосфора.
- Углерод – основа органических соединений.
- Оксид кремния, кремниевая кис-та и её соли.
- Металлы – общая характеристика элементов.
Таблицы, схемы и формулы сопровождают каждое задание.
Коротко о содержании онлайн-решебника по химии для 9 класса Шиманович
Издание составлено с максимальным удобством для работы школьника и обладает удобной навигацией, позволяя быстро находить нужную тему. В книге содержится:
- 54 тематических параграфа;
- 4 практические работы;
- подробные верные ответы и пояснения к ним.
Безусловно, взаимодействие с готовыми д/з предполагает вдумчивый и систематический характер, а не бездумное списывание правильного ответа. Именно такой способ работы обеспечивает учащемуся стабильную успеваемость и надёжную подготовку к любым контрольным проверкам в классе.
ГДЗ к тетради для практических работ по химии 9 класс Борушко
Автор: И.И. Борушко.
Тип: Тетрадь для практических работ и лабораторных опытов
Всем известно, что первые экзамены начинаются в 9 классе. Нагрузка на ребенка в школе увеличивается с каждым годом, поэтому подготовке к выпускным испытаниям стоит уделить много сил и времени. У многих ребят могут возникнуть трудности с особо сложными предметами, такими как, например, химия. Несмотря на всю увлекательность этой дисциплины, освоить ее удается не каждому девятикласснику. В этом случае на помощь придут ГДЗ к тетради для практических работ по химии 9 класс Борушко.
Нагрузка на ребенка в школе увеличивается с каждым годом, поэтому подготовке к выпускным испытаниям стоит уделить много сил и времени. У многих ребят могут возникнуть трудности с особо сложными предметами, такими как, например, химия. Несмотря на всю увлекательность этой дисциплины, освоить ее удается не каждому девятикласснику. В этом случае на помощь придут ГДЗ к тетради для практических работ по химии 9 класс Борушко.
Сборник был разработан профессионалами своего дела, ведущими методистами и талантливыми педагогами, что исключает вероятность ошибок. Cправочник обладает рядом достоинств:
- Круглосуточный онлайн-доступ.
- Удобная навигационная линейка.
- Простой и понятный язык изложения материала.
- Только положительные отзывы пользователей.
- Охватывает всю программу за 9 год обучения.
Как пользоваться онлайн-помощником к тетради для практических работ по химии 9 класс Борушко
Многие родители и учителя настроены скептически по отношению к сборникам с готовыми ответами и считают, что они поощряют лишь списывание и не приносят никакой пользы. Но это мнение ошибочно. Пособие к тетради Борушко поможет учащимся, если нужно самостоятельно подготовиться к контрольной или проверочной работе, в ситуации, когда приходится делать заданное на дом, не прибегая к чьей-либо помощи или в случае пропуска урока по причине болезни и необходимости пройти материал, чтобы нагнать сверстников. Самое главное – правильно использовать учебно-методический комплекс, и уже после нескольких регулярных занятий можно будет заметить результат.
Но это мнение ошибочно. Пособие к тетради Борушко поможет учащимся, если нужно самостоятельно подготовиться к контрольной или проверочной работе, в ситуации, когда приходится делать заданное на дом, не прибегая к чьей-либо помощи или в случае пропуска урока по причине болезни и необходимости пройти материал, чтобы нагнать сверстников. Самое главное – правильно использовать учебно-методический комплекс, и уже после нескольких регулярных занятий можно будет заметить результат.
Отметим, что
ГДЗ по химии 9 класс задачник Кузнецова, Левкин
Авторы: Н. Е. Кузнецова, А.Н. Левкин, И.М. Титова, Н.Н. Гара.
Е. Кузнецова, А.Н. Левкин, И.М. Титова, Н.Н. Гара.
Изучение химии — задача не из лёгких. Чтобы успешно с ней справиться, эксперты рекомендуют использовать в процессе обучения «ГДЗ по Химии 9 класс Задачник Кузнецова, Левкин, Титова, Гара Вентана-граф».
Ведь залог хорошей успеваемости – это понимание предметного материала.Реальная помощь ГДЗ
Страницы онлайн-решебника содержат подробные и верные ответы, которые помогут тщательно разобрать сложные вопросы, а также:
- проверить правильность домашнего задания;
- дополнительно проработать изученные темы;
- на «отлично» подготовиться к самостоятельной во время урока.
Найти нужную информацию не составит никакого труда, так как сборник полностью идентичен учебному изданию и расположение номеров с заданиями имеет полное соответствие. Постоянное применение ГДЗ только положительно отразится на результатах учёбы и сделает процесс получения знаний более эффективным.
Для чего нужно изучать химию
Это наука, которая изучает вещества, их состав и строение, а также взаимодействия друг с другом. Она имеет огромное значение в жизни современного общества, поскольку процессы химического характера окружают нас повсеместно и происходят ежесекундно. Элементарными навыками и умениями в этой области должен обладать каждый, чтобы понимать суть происходящих явлений. В рамках школы дисциплина появляется в среднем звене и сопровождает учащихся вплоть до выпуска. Программа девятого года обучения отличается особой сложностью и желательно, чтобы сборник
- Виды химической связи.
- Структура и функции периодического закона.
- Условия протекания реакций.
- Кислородсодержащие органические вещества.
- Металлы и неметаллы, их основные свойства.

Выпускников ждут теоретические и практические занятия, где они смогут закрепить и отработать свои навыки и умения, а также воочию проследить за протеканием различных реакций.
Плюсы онлайн-решебника по химии за 9 класс от Кузнецовой
В нем собран материал по всему учебному курсу. Он поможет отточить и закрепить навыки решения расчётных, типовых, а также комбинированных задач. Издание полностью соответствует всем нормативам и рекомендовано для общеобразовательных учреждений.
ГДЗ к учебникам, рабочим тетрадям, тестам по химии 9 класс
Химия достаточно специфичный предмет и с каждым учебным годом понимать её становится не так легко, как раньше. Разобраться с некоторыми темами за несколько школьных уроков не всегда получается, нанимать репетитора порой не доступно финансово, поэтому настоящий фурор произвели решебники.
Если ты обычный школьник и химия не самый понятный тебе предмет – ГДЗ твоё спасение.
Сейчас приобрести решебник по химии можно практически в каждом магазине книг, но стоит ли отдавать свои деньги навсегда, если он необходим всего один учебный год. Намного проще скачать электронную версию ГДЗ в интернете или посмотреть ответы онлайн. На одном небольшом файле вместится вся программа химии за 9 класс. Благодаря ГДЗ химия станет доступнее, а учёба приятнее.
Химия в 9 классе — советы для успешной подготовки выпускникам и не только
Многие девятиклассники выбирают химию в качестве дисциплины, которую они планируют сдавать на ОГЭ.
С помощью ГДЗ можно не только готовиться к ВПР, диагностическим и итоговым испытаниям. Сборники позволят провести самостоятельную работу к предметным олимпиадам по дисциплине. Для девятиклассников победа в ней может означать возможность поступления в ВУЗы по окончании одиннадцатого класса без внутренних экзаменов или с другими привилегиями. Для победивших в 9-м классе преимущество сохраняется на два последующих года. Сформировать необходимый для подготовки комплект учебно-методической и информационной литературы школьники могут самостоятельно или обратившись за помощью к специалистам — школьным педагогам, репетиторам, руководителям кружков и курсов.
Наиболее сложными для изучения и понимания учащихся признаны такие разделы дисциплины химия в 9 классе, как:
— химические элементы и их характеристика;
— периодическая система Д. И. Менделеева и периодический закон;
— реакции и их катализаторы;
— понятия и свойства металлов и неметаллов в точки зрения химии;
— неорганические вещества и их основные свойства.
Ряд учебных пособий предполагают подготовку к итоговой аттестации в течение последней школьной четверти. Можно сформировать и собственный УМК, ориентируясь на свои задачи и цели. В такой комплект, помимо стандартного учебного пособия по теории надо включить:
— рабочую тетрадь по химии;
— тетрадь для практических и лабораторных опытов;
— проверочные и контрольные работы;
— тесты, задачи и упражнения по химии.
Для занимающихся самостоятельно и находящихся на семейной форме обучения можно включить в комплект рабочие программы и поурочные планы по химии за 9 класс, методические разработки педагогов и экспертов, тетради и сборники для оценки качества знаний.
Полезные уроки. Химия за 10 минут в день. 9 класс
При приобретении одной лицензионной копии учебного пособия автоматически предоставляется лицензия на один компьютер.
Лицензия на 15 отдельных р.м.: для любых физических и юридических лиц возможно приобретение дополнительных лицензий на 15 рабочих мест. Дополнительная лицензия на 15 р.м. и одна лицензионная копия программного продукта дают лицензиату право на использование данного программного продукта на количестве компьютеров, меньшем или равном шестнадцати.
Лицензия для образовательной организации: для образовательных организаций любого типа возможно приобретение дополнительной лицензии, дающей лицензиату право на использование данного программного продукта на всех компьютерах в образовательной организации, а также на домашних компьютерах ее сотрудников и учащихся.
Приобретение только продукта и лицензий к нему дает возможность использовать продукт на определенном количестве рабочих мест, но не обеспечивает режим групповой работы в виртуальном классе под руководством учителя. Для организации работы в локальной сети общеобразовательной организации или через Интернет, с использованием преимуществ групповой работы и электронного журнала, необходимо приобрести систему «1С:Образование 5. Школа» (см. ниже).
Для организации работы в локальной сети общеобразовательной организации или через Интернет, с использованием преимуществ групповой работы и электронного журнала, необходимо приобрести систему «1С:Образование 5. Школа» (см. ниже).
Учебные пособия «1С:Школа» можно использовать для работы в сетевом режиме в локальной сети школы или через интернет. Для работы в сетевом режиме необходимо приобрести программу «1С:Образование 5. Школа» и дополнительные лицензии к учебным пособиям. Подробнее
Для покупки программы «1С:Образование 5. Школа» и дополнительной лицензии вы можете обратиться к одному из наших партнеров. Для выбора Партнера 1С пройдите по ссылке.
Рекомендованная цены (Партнер уточнит для вас цены и сделает запрос на подключение) :
Комплектация изделия: CD-диск, упакованный в jewel-case.
Разработчик — Группа «МАРКО ПОЛО».
Издатель — ООО «1С-Паблишинг».
> ISBN: 978-5-9677-2256-1▶▷▶▷ гдз по химия 9 класс объяснение
▶▷▶▷ гдз по химия 9 класс объяснение| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 02-10-2019 |
гдз по химия 9 класс объяснение — ГДЗ по Химии 9 класс Габриелян Решения по Учебнику onlinegdznetreshebnik-ximiya- 9 -klass-gabriely Cached Заходи и делай уроки с ГДЗ по Химии 9 класс Габриелян База решебников и учебников которая всегда пополняется Более ГДЗ (решебник) по химии 9 класс Рудзитис, Фельдман reshatorcomgdz 9 -klasshimijarudzitis Cached ГДЗ (решебник) по химии 9 класс Рудзитис, Фельдман Сложная наука со своей логикой, формулировками, законами станет гораздо понятнее, если пользоваться домашним помощником с доступным Гдз по Химии за 9 класс, авторы ОС Габриелян от Путина клаб gdzotputinaclub 9 -klasshimiyagabrielyan Cached ГДЗ к рабочей тетради по химия за 9 класс Габриелян ОС можно скачать здесь ГДЗ к контрольным и самостоятельным работам по химия за 9 класс Павлова НС можно скачать здесь Гдз По Химия 9 Класс Объяснение — Image Results More Гдз По Химия 9 Класс Объяснение images ГДЗ по химии 9 класс — gdzplusme gdzplusme 9 -klasshimiyarudzitis Cached Здесь вы найдёте ответы на нужные вопросы и задания, а так же сможете скачать ГДЗ по химии за 9 класс к учебнику Рудзитиса, Фельдман бесплатно Решебник (ГДЗ) Хімія 9 класс ПП Попель, ЛС Крикля 2017 vshkolecom 9 -klassreshebnikihimiyapp-popel Cached Химия и новые темы Мы с Вами можем сами увидеть сколько новых тем предстоит выучить всем ребятам в девятом классе по химии А, соответственно, и заданий в них будет немало Решебник (ГДЗ) по химии за 9 класс megareshebarupublgdzkhimija 9 _klass99-1-0-1277 Cached Подробный решебник ( гдз ) по Химии за 9 класс к учебнику школьной программы Мегарешеба — ГДЗ и решебники по Химии за 9 класс онлайн megareshebanetgdz-himiya 9 -class Cached Добро пожаловать на мегарешеба — с лучшими ГДЗ по Химии за 9 класс Здесь Вы найдете готовые ответы на домашнюю работу Решебник (ГДЗ) по химии 9 класс Габриелян megareshebarupublreshebnikkhimija 9 _klass Cached Подробные ответы, решебник и гдз к учебнику по химии за 9 класс , автор ОС Габриелян, издательство Дрофа на 2016 учебный год ГДЗ по Химии за 9 класс: Габриелян ОС Решебник gdzruclass- 9 himiyagabrielyan- 9 Cached ГДЗ : Спиши готовые домашние задания по химии за 9 класс , решебник ОС Габриелян, ФГОС, онлайн ответы на gdzru ГДЗ по Химии, решебник и ответы онлайн gdzruhimiya Cached ГДЗ : Спиши готовые домашние задания по Химия , решебник и ответы онлайн на GDZru GDZRU 1 класс Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of 1 2 3 4 5 Next 471,000
- Видеоуроки по математике.
 Готовые домашние задания, видеоуроки. Поэтому ученик, усвоив объяснение, у
Готовые домашние задания, видеоуроки. Поэтому ученик, усвоив объяснение, у - своит и ход мыслей, который привел к правильному ответу. Домашние задание по химии за 9 класс: Габриелян, Лысова практическая работа 2 — решебник, ответы и онлайн гдз. Спиши по химии 9 класс. ГДЗ по
- иелян, Лысова практическая работа 2 — решебник, ответы и онлайн гдз.
Спиши по химии 9 класс. ГДЗ поможет школьнику вернуться к нужному материалу и выполнить типовые примеры без особого труда.
Все задания сделаны довольно таки подробно и с объяснениями. Решебник по химии 9 класс автор о с габриелян. ГДЗ от Путина 2016 admingdzputina.com.
Пособие предназначено ученикам средней школы, их родителям и учителям, работающим по учебнику Г. Е. Рудзитиса Химия. Гдз по химии за 9 класс к учебнику рудзитиса г е фельдмана ф г.
Ответы по химии. Введите в строку поиска только фамилию автора и класс. Готовые лаборaторные работы. ГДЗ.
ГДЗ по предметам. В учебнике по химии за 10 класс Г.
 Е.Рудзитис Ф.Г.Фельдман вопросы и задачи задаются в конце главы, либо в конце параграфа. Решения и ответы к этому учебнику по химии очень подробные, с формулами и объяснениями.
You donapos;t have permission to access php-binphpindex.php on this server. Гдз для 9 класса по химии габриелян.
Решебник по химии 8 класс Габриелян. Все грамотно выстроенные ответы на вопросы к 45 параграфам, все лабораторныепрактические работы изложены в ГДЗ как образцы.
Е.Рудзитис Ф.Г.Фельдман вопросы и задачи задаются в конце главы, либо в конце параграфа. Решения и ответы к этому учебнику по химии очень подробные, с формулами и объяснениями.
You donapos;t have permission to access php-binphpindex.php on this server. Гдз для 9 класса по химии габриелян.
Решебник по химии 8 класс Габриелян. Все грамотно выстроенные ответы на вопросы к 45 параграфам, все лабораторныепрактические работы изложены в ГДЗ как образцы.
усвоив объяснение
их родителям и учителям
- онлайн ответы на gdzru ГДЗ по Химии
- онлайн ответы на gdzru ГДЗ по Химии
- формулировками
Нажмите здесь , если переадресация не будет выполнена в течение нескольких секунд гдз по химия класс объяснение Поиск в Все Картинки Ещё Видео Новости Покупки Карты Книги Все продукты Решебник ГДЗ по химии класс Габриелян _ klass Подробные ответы , решебник и гдз к учебнику по химии за класс , автор О С Габриелян, издательство Дрофа ГДЗ по химии класс Габриелян онлайн решебник gdz poximii klass Готовые домашние задания по химии к учебнику Химия Учебник для класса общеобразовательных ГДЗ по Химии класс Габриелян Решения по Учебнику gdz netreshebnikximiya Заходи и делай уроки с ГДЗ по Химии класс Габриелян База ГДЗ по химии класс Габриелян включает в себя не просто ответы на задачки, а подробный разбор решения и объяснение ГДЗ по Химии за класс Габриелян Решебник учебника https gdz putinainfo klass Готовое домашние задание ГДЗ , решебники, ответы онлайн по Химии за класс учебник О С Габриелян ГДЗ по химии класс Габриелян eurokiorg gdz _ klass Решебник по химии за класс авторы Габриелян издательство Дрофа ГДЗ по химии за класс к учебнику Химия класс ОС ГДЗ по химии за класс к учебнику Химия класс ОСГабриелян ГДЗ по Химии за класс Габриелян ОС Решебник https gdz ru class himiyagabrielyan ГДЗ Спиши готовые домашние задания по химии за класс , решебник ОС Габриелян, ФГОС, онлайн ответы на Решебник по химии Габриелян класс Reshakru index Новый решебник Габриелян класс по химии включает в себя сразу несколько вариантов ответа ГДЗ по Химии класс Габриелян Учебник Решебник gdz com klass gabrielyan Готовое домашние задание из решебника гдз по Химии класса от О С Габриелян е издание, Дрофа, Задание Химия класс Габриелян YouTube июл Задание Химия класс Габриелян videogdz Loading Unsubscribe from videogdz? myoutubecom Химия класс InternetUrok class Видеоуроки, тесты и тренажёры по Химия за класс по школьной программе Используйте конспект уроков ГДЗ , Химия , класс ,Габриелян ОС Рамблеркласс https class ramblerrutemymulti gdz Сборник готовых домашних заданий по предмету Химия за класс Авторы Что такое ингибиторы коррозии? Задание Химия класс Габриелян YouTube ноя ФИЗИКИ не знают, что такое ЭЛЕКТРИЧЕСКИЙ ТОК крамольных фактов об ЭЛЕКТРИЧЕСТВЕ myoutubecom ГДЗ по химии класс Габриелян ответы из учебника klass himiyagabrieljan Разбор задач из школьного учебника по химии за класс авторов Габриелян Дополнительное пояснение к ГДЗ по химии класс Василевская гдзпохимии кла ГДЗ по химии класс Василевская с таким помощником не страшна ни одна тема и задача Все сразу станет ГДЗ решебник по химии класс Гузей allengorgdchemchemhtm Решебник ГДЗ Химия класс Гузей ЛС и др Готовые домашние задания , правильные ответы и решения к класс ГДЗ по химии для класса К Знак качества znakkaestvaru klass gdz pohimii класс ГДЗ по химии для класса К Химия класс Габриелян ОС Главная ГДЗ Химия ; класс Решебник ГДЗ Химия , класс ОС DocBazaru Решебник ГДЗ для Химия , класс ОС Габриелян , ГДЗ по химии класс Рудзитис, Фельдман решебник с https gdz plusme klass himiyarudzitis Здесь вы найдёте ответы на нужные вопросы и задания, а так же сможете скачать ГДЗ по химии за класс к Решебник по химии класс Габриелян ГДЗ Лайф GDZ life https gdz life klass khimiyagabrielyan Решебник по химии ОС Габриелян за класс содержит подробные ответы к параграфам учебника Дрофа Гдз по химия класс габриелян учебник ГДЗ по химии за klass gdz po Гдз вип Решебник Гдз по химии класс Габриелян учебник ОС Издание М Дрофа, г ГДЗ по Химии за А в решебнике, кроме ГДЗ , есть объяснения , подсказки! Грядущие экзамены С Т Жуков Химия класс Химический факультет МГУ wwwchemmsusuruswelcomehtml С Т Жуков Химия класс Определение химической формулы вещества Расчеты по уравнениям ГДЗ решебник Химия класс О С Габриелян Моя obozrevatelcom gdz kla Рейтинг голосов Правильные и полные ГДЗ решебник Химия класс О С Габриелян в формате онлайн то решебник , содержащий помимо ГДЗ еще и объяснение теории, сможет объяснить и ГДЗ по химии для класса ОС Габриелян https gdz putinarupo klass gabrielyan Вначале ГДЗ по химии за класс Габриелян предоставят основные химические понятия ; ; ; ; ; ; ; ; ; Галогены Химия класс ГДЗ Габриелян vippvippbegettech Химия _ Галогены Химия Учебник для класса Габриелян ГДЗ Спирты Химия класс Конспект урока Российский учебник Химия класс учебдля общеобразоватучреждений ОСГабриелян е изд,стереотип Определение спиртов Выслушав ответы учащихся, учитель демонстрирует слайд со схемой Решебник ГДЗ Химия класс ИИ Новошинский, НС klass ework klass ii Полный и качественный решебник ГДЗ Химия класс ИИ Новошинский, Н С Новошинская Доступно на Химия , класс уроки, тесты, задания ЯКласс ya klass ruphimija klass Теоретические уроки, тесты и задания по предмету Химия , класс Задания составлены профессиональными С Т Жуков Химия класс Глава Химические реакции wwwchemmsururusschoolhtml При химической реакции происходит разрыв одних и образование других химических связей В результате ГДЗ по Химии за класс Рудзитис ГЕ gdz freeru gdz Ch Готовое Домашнее Задание ГДЗ по Химии за класс Рудзитис ГЕ Ваша домашняя работа на Химия , класс , Габриелян ОС, Nasholcom klass июн Учебник Химия это вторая часть авторского курса ОС Габриеляна, Учебники, ГДЗ , решебники, ЕГЭ, ГИА, экзамены, книги Химия , класс , Габриелян ОС, Определение выхода продукта реакции ГДЗ , Ответы по Химии класс Габриелян Все решебники https gdz naru gdz otvetypoximii янв В девятом классе преподаётся неорганическая химия Становится известно, что такое ионная Гдз вип Решебник Гдз по химии класс Габриелян учебник gdz vipru класс гдзпохимии В помощь ученикам, родителям, а порой учителям, представлена готовая домашняя работа гдз по химии класс РЕШУ ЕГЭ химия ЕГЭ задания, ответы Тысячи заданий с решениями для подготовки к ЕГЭ по всем предметам Система тестов для подготовки и ГДЗ и Решебник онлайн по химии для класса ответы https gdz avrinfo gdz himiya klass ГДЗ решебник по химии класс рабочая тетрадь Габрусева ГДЗ решебник по химии класс рабочая тетрадь ГДЗ самые качественные решебники на Решебами Решебники и ГДЗ , тут есть ВСЁ! Готовые ответы , пояснение к задачам, подробное решение примеров по Картинки по запросу гдз по химия класс объяснение Мы скрыли некоторые результаты, которые очень похожи на уже представленные выше Показать скрытые результаты В ответ на официальный запрос мы удалили некоторые результаты с этой страницы Вы можете ознакомиться с запросом на сайте LumenDatabaseorg В ответ на жалобу, поданную в соответствии с Законом США Об авторском праве в цифровую эпоху , мы удалили некоторые результаты с этой страницы Вы можете ознакомиться с жалобой на сайте LumenDatabaseorg Запросы, похожие на гдз по химия класс объяснение химия класс габриелян гдз гдз по химии класс габриелян химия класс габриелян читать химия класс рудзитис учебник по химии класс габриелян читать химия класс габриелян старый учебник онлайн гдз по химии класс габриелян зеленый учебник гдз по химии класс дидактический материал габриелян Войти Версия Поиска Мобильная Полная Конфиденциальность Условия Настройки Отзыв Справка
Видеоуроки по математике. Готовые домашние задания, видеоуроки. Поэтому ученик, усвоив объяснение, усвоит и ход мыслей, который привел к правильному ответу.
Домашние задание по химии за 9 класс: Габриелян, Лысова практическая работа 2 — решебник, ответы и онлайн гдз.
Спиши по химии 9 класс. ГДЗ поможет школьнику вернуться к нужному материалу и выполнить типовые примеры без особого труда.
Все задания сделаны довольно таки подробно и с объяснениями. Решебник по химии 9 класс автор о с габриелян. ГДЗ от Путина 2016 admingdzputina.com.
Пособие предназначено ученикам средней школы, их родителям и учителям, работающим по учебнику Г. Е. Рудзитиса Химия. Гдз по химии за 9 класс к учебнику рудзитиса г е фельдмана ф г.
Ответы по химии. Введите в строку поиска только фамилию автора и класс. Готовые лаборaторные работы. ГДЗ.
ГДЗ по предметам. В учебнике по химии за 10 класс Г.Е.Рудзитис Ф.Г.Фельдман вопросы и задачи задаются в конце главы, либо в конце параграфа. Решения и ответы к этому учебнику по химии очень подробные, с формулами и объяснениями.
Готовые домашние задания, видеоуроки. Поэтому ученик, усвоив объяснение, усвоит и ход мыслей, который привел к правильному ответу.
Домашние задание по химии за 9 класс: Габриелян, Лысова практическая работа 2 — решебник, ответы и онлайн гдз.
Спиши по химии 9 класс. ГДЗ поможет школьнику вернуться к нужному материалу и выполнить типовые примеры без особого труда.
Все задания сделаны довольно таки подробно и с объяснениями. Решебник по химии 9 класс автор о с габриелян. ГДЗ от Путина 2016 admingdzputina.com.
Пособие предназначено ученикам средней школы, их родителям и учителям, работающим по учебнику Г. Е. Рудзитиса Химия. Гдз по химии за 9 класс к учебнику рудзитиса г е фельдмана ф г.
Ответы по химии. Введите в строку поиска только фамилию автора и класс. Готовые лаборaторные работы. ГДЗ.
ГДЗ по предметам. В учебнике по химии за 10 класс Г.Е.Рудзитис Ф.Г.Фельдман вопросы и задачи задаются в конце главы, либо в конце параграфа. Решения и ответы к этому учебнику по химии очень подробные, с формулами и объяснениями. You donapos;t have permission to access php-binphpindex.php on this server. Гдз для 9 класса по химии габриелян.
Решебник по химии 8 класс Габриелян. Все грамотно выстроенные ответы на вопросы к 45 параграфам, все лабораторныепрактические работы изложены в ГДЗ как образцы.
You donapos;t have permission to access php-binphpindex.php on this server. Гдз для 9 класса по химии габриелян.
Решебник по химии 8 класс Габриелян. Все грамотно выстроенные ответы на вопросы к 45 параграфам, все лабораторныепрактические работы изложены в ГДЗ как образцы.
Контрольная работа по химии за I полугодие 9 класс
Контрольная работа по химии за I полугодие 9 класс
Инструкция по выполнению работы
Работа состоит из двух частей, включающих в себя 15 заданий.
Часть 1 содержит 13 заданий с кратким ответом, часть 2 содержит 2 задания с развёрнутым ответом.
На выполнение работы по химии отводится 40 минут.
Ответы к заданиям 1–10 записываются в виде числа.
Ответом к заданиям 11-13 является последовательность цифр.
К заданиям 14–15 следует дать полный развёрнутый ответ, включающий в себя необходимые уравнения реакций и расчёты.
При выполнении работы Вы можете пользоваться Периодической системой химических элементов Д.И. Менделеева, таблицей растворимости солей, кислот и оснований в воде, электрохимическим рядом напряжений металлов и непрограммируемым калькулятором.
Задания рекомендуется выполнять в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаю успеха!
1 вариант
Часть 1
На приведённом рисунке изображена модель атома химического элемента
2-го периода VIIIA группы 2-го периода VIA группы 3-го периода VIA группы 3-го периода VIIIA группы |
Ряд, в котором элементы расположены в порядке возрастания их атомного радиуса
B→Be→Li
K→Na→Li
Mg→Ca→Be
Na→Mg→Al
Эндотермическая реакция соединения
2Mg + O2 = 2MgO + Q
N2 + O2 = 2NO – Q
CaCO3 = CaO + CO2 – Q
NaOH + HCl = NaCl + h3O + Q
Скорость химической реакции между медью и азотной кислотой зависит от
массы меди
объёма кислоты
концентрации кислоты
объёма колбы
И с цинком, и с медью реагирует |
Хлор Оксид углерода (II) Гидроксид натрия Соляная кислота |
Метод переработки руд, основанный на восстановлении металлов из оксидов при высоких температурах, является
гидрометаллургия
пирометаллургия
электрометаллургия
гальваностегия
Соли натрия и калия окрашивают пламя соответственно:
в розовый и малиновый цвета
в фиолетовый и голубой цвета
в желтый и фиолетовый цвета
в желтый и синий цвета
Укажите схему реакции «гашения извести»
CaO + h3O →
CaO + CO2 →
CaCO3 →
Ca(OH)2 + CO2 →
Установите вещество X AlCl3 → X → Al2(SO4)3
SO3
Al2O3
Al(OH)3
h3SO4
Для вытеснения меди из раствора ее соли можно использовать
натрий
серебро
кальций
железо
Установите соответствие между формулой вещества и его названием
Формула вещества: Название вещества:
А) CaCO3 1) Железная окалина
Б) Fe3O4 2) Мрамор
В) NaHCO3 3) Поваренная соль
4) Пищевая сода
Установите соответствие между исходными веществами и продуктами реакции
Исходные вещества: Продукты реакции:
А) Al(OH)3 + NaOH (р-р) → 1) FeCl3
Б) Al(OH)3 + NaOH (сух) → 2) NaAlO2 + h3O
В) Fe + Cl2 → 3) FeCl2
4) Na [Al(OH)4]
В ряду химических элементов Al → Mg → Na происходит уменьшение (ослабление)
числа электронов на внешнем энергетическом уровне
числа электронных слоев в атомах
металлических свойств
степени окисления в высших оксидах
радиуса атома
Часть 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Na → Na2O2 → Na2O → NaOH → Na2SO4
Вычислите объем оксида углерода (IV) (при н. у.), который может быть поглощен гидроксидом кальция, массой 80 г, содержащим 0,08 массовой доли примесей.
у.), который может быть поглощен гидроксидом кальция, массой 80 г, содержащим 0,08 массовой доли примесей.
Ответы и критерии оценивания
Часть 1
Верное выполнение каждого из заданий 1–10 оценивается 1 баллом.
За полный правильный ответ на каждое из заданий 11, 12, 13 ставится 2 балла; если допущена одна ошибка, то ответ оценивается в 1 балл. Если допущены две и более ошибки или ответа нет, то выставляется 0 баллов.
Номер задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
Ответ | 2 | 1 | 2 | 3 | 1 | 2 | 3 | 1 | 3 | 4 | 214 | 421 | 14 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
14. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения Na → Na2O2 → Na2O → NaOH → Na2SO4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения Na → Na2O2 → Na2O → NaOH → Na2SO4
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Элементы ответа: 2Na + O2 = Na2O2 Na2O2 + 2Na = 2Na2O Na2O + h3O = 2NaOH 2NaOH + h3SO4 = Na2SO4 + 2h3O | |
Ответ правильный и полный, включает все названные выше элементы | 4 |
Правильно записаны 3 уравнения реакций | 3 |
Правильно записаны 2 уравнения реакций | 2 |
Правильно записаны 1 уравнения реакций | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 4 |
Вычислите объем оксида углерода (IV) (при н. у.), который может быть поглощен гидроксидом кальция, массой 80 г, содержащим 0,08 массовой доли примесей.
у.), который может быть поглощен гидроксидом кальция, массой 80 г, содержащим 0,08 массовой доли примесей.
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Элементы ответа: Составлено уравнение реакции: Ca(OH)2 + CO2 = CaCO3 + h3O Рассчитана масса чистого гидроксида кальция, вступившего в реакцию: W (ч.в.) = 1- 0,08 = 0,92 m(ч.в. Na) = 0,92 × 80 = 73,6 г Рассчитано количество вещества гидроксида кальция: n(Ca(OH)2) = m/M = 73,6/74 = 0,9 моль По уравнению реакции найдено количество вещества оксида углерода (IV): n(CO2) = n(Ca(OH)2) = 0,9 моль Рассчитан объем оксида углерода (IV), который может быть поглощен: V(CO2) = n(CO2) × Vm = 0,9 × 22,4 = 20,16 л | |
Ответ правильный и полный, включает все названные выше элементы | 5 |
Правильно записаны 4 элемента ответа | 4 |
Правильно записаны 3 элемента ответа | 3 |
Правильно записаны 2 элемента ответа | 2 |
Правильно записан 1 элемент ответа | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 5 |
2 вариант
Часть 1
На приведенном рисунке изображена модель атома
магния кальция лития калия |
В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ
калий → натрий → литий
сурьма → мышьяк → фосфор
магний → кадьций → стронций
алюминий → кремний → углерод
Гетерогенная реакция обмена
Fe + CuSO4 = Cu + FeSO4
СаО + СO2 = СаСО3
CuS + h3SO4 = CuSO4 + h3S
NaOH + HCl = NaCl + Н2О
Соляная кислота с максимальной скоростью реагирует с железом, которое находится в виде
стружки
слитка
порошка
пластинки
Кальций вступает в реакцию с каждым из двух веществ
магний и соляная кислота
вода и гидроксид калия
гидроксид натрия и соляная кислота
соляная кислота и хлор
Какого вида металлургического процесса не существует
пирометаллургия
аэрометаллургия
гидрометаллургия
электрометаллургия
Наиболее активно с водой при комнатной температуре будут взаимодействовать оба металла из пары
Na и Cu
Li и Na
K и Mg
Cu и Hg
Барий не реагирует с одним из следующих веществ
1) O2
2) S
3) Н2О
4) Са(ОН)2
Гидроксид алюминия проявляет амфотерные свойства при взаимодействии с
NaOH и CаSO4
HCl и NaOH
KOH и Na2O
HCl и CaCl2
10. Железо реагирует с
Железо реагирует с
хлоридом кальция
хлором
оксидом натрия
гидроксидом натрия
Установите соответствие между формулой вещества и его названием
Формула вещества: Название вещества:
А) K2CO3 1) поваренная соль
Б) CaO 2) гашеная известь
В) NaCl 3) поташ
4) негашеная известь
Установите соответствие между исходными веществами и продуктами реакции
Исходные вещества: Продукты реакции:
А) CaO + CO2 → 1) Ca(OH)2
Б) Ca + h3O → 2) CaCO3 + h3O
В) CA(OH)2 + CO2→ 3) CaCO3
4) Ca(OH)2 + h3
В ряду химических элементов Sr → Ba → Ra
увеличивается значение электроотрицательности
уменьшается число электронов на внешнем уровне
увеличивается атомный радиус
увеличиваются основные свойства образуемых гидроксидов
возрастает высшая степень окисления
Часть 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe
Рассчитайте объем водорода (н. у.), который может быть получен при растворении 11,5 г натрия, содержащего 2% примесей.
у.), который может быть получен при растворении 11,5 г натрия, содержащего 2% примесей.
Ответы и критерии оценивания
Часть 1
Верное выполнение каждого из заданий 1–10 оценивается 1 баллом.
За полный правильный ответ на каждое из заданий 11, 12, 13 ставится 2 балла; если допущена одна ошибка, то ответ оценивается в 1 балл. Если допущены две и более ошибки или ответа нет, то выставляется 0 баллов.
Номер задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
Ответ | 1 | 3 | 3 | 3 | 4 | 2 | 2 | 4 | 2 | 2 | 341 | 342 | 34 |
Часть 2
Критерии оценивания заданий с развёрнутым ответом
14. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Элементы ответа: 2Fe + 3Cl2 = 2FeCl3 FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl 2Fe(OH)3 = Fe2O3 + 3h3O Fe2O3 + 3CO = 2Fe + 3CO2 | |
Ответ правильный и полный, включает все названные выше элементы | 4 |
Правильно записаны 3 уравнения реакций | 3 |
Правильно записаны 2 уравнения реакций | 2 |
Правильно записаны 1 уравнения реакций | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 4 |
Рассчитайте объем водорода (н. у.), который может быть получен при растворении 11,5 г натрия, содержащего 2% примесей.
у.), который может быть получен при растворении 11,5 г натрия, содержащего 2% примесей.
Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) | Баллы |
Элементы ответа: Составлено уравнение реакции: 2Na + 2h3O = 2NaOH + h3 Рассчитана масса чистого натрия, вступившего в реакцию: W (ч.в.) = 100% — 2% = 98% = 0,98 m(ч.в. Na) = 0,98 × 11,5 = 11,27 г Рассчитано количество вещества натрия: n(Na) = m/M = 11,27/23 = 0,49 моль По уравнению реакции найдено количество вещества водорода: n(h3) = 1/2 × n(Na) = 1/42 × 0,49 = 0,245 моль Рассчитан объем водорода, который был получен при растворении натрия: V(h3) = n(h3) × Vm = 0,245 × 22,4 = 5,488 л | |
Ответ правильный и полный, включает все названные выше элементы | 5 |
Правильно записаны 4 элемента ответа | 4 |
Правильно записаны 3 элемента ответа | 3 |
Правильно записаны 2 элемента ответа | 2 |
Правильно записан 1 элемент ответа | 1 |
Все элементы ответа записаны неверно | 0 |
Максимальный балл | 5 |
Спецификация
измерительных материалов
промежуточной контрольной работы по химии за I полугодие 9 класса
Назначение КИМ — проверка знаний учащихся по курсу неорганической химии за I полугодие 9 класса, подготовка школьников к итоговой аттестации в 9 классе по химии.
Документы, определяющие содержание КИМ
Содержание КИМ определяется на основе Федерального государственного образовательного стандарта основного общего образования и примерной основной образовательной программы основного общего образования.
Подходы к отбору содержания, разработке структуры КИМ
Разработка КИМ осуществлялась с учетом следующих общих положений:
− КИМ ориентированы на проверку знаний учащихся по химии за I полугодие, которые необходимы для дальнейшего успешного изучения химии и подготовки к итоговой аттестации в 9 классе. Требования к результатам обучения определяются в соответствии с Федеральным государственным образовательным стандартом основного общего образования.
− КИМ призваны обеспечивать возможность дифференцированной оценки подготовки учащихся. В этих целях проверка усвоения знаний основных элементов содержания курса химии I полугодия 9 класса осуществляется на трех уровнях сложности: базовом, повышенном и высоком.
− Учебный материал, на базе которого строятся задания, отбирается по признаку его значимости для подготовки учащихся к дальнейшему изучению курса химии.
Содержание заданий разработано по основным темам курса химии I полугодия 9 класса, объединенных в два содержательных блока: «Общая характеристика химических элементов и химических реакций. Периодический закон и Периодическая система химических элементов Д.И. Менделеева», «Металлы».
Характеристика структуры и содержания КИМ
Работа состоит из 2 частей.
Часть 1 содержит 13 заданий базового и повышенного уровня сложности с кратким ответом, подразумевающих запись ответа в виде числа или последовательности цифр.
Часть 2 содержит 2 задания высокого уровня сложности, подразумевающих запись развернутого ответа.
Распределение заданий по частям КИМ представлено в таблице 1.
Таблица 1. Распределение заданий по частям КИМ
Части работы | Число заданий | Максимальный первичный балл | Процент максимального первичного балла за задания данной части от максимального первичного балла за всю работу, равного 25 | Тип заданий |
Часть 1 | 13 | 16 | 64 | С кратким ответом |
Часть 2 | 2 | 9 | 36 | С развернутым ответом |
Итого | 15 | 25 | 100 |
Распределение заданий по разделам приведено в таблице 2.
Таблица 2. Распределение заданий по разделам
№ | Название раздела | Число заданий | Максимальный первичный балл | Процент максимального первичного балла за задания данного вида деятельности от максимального первичного балла за всю работу, равного 25 |
1 | Общая характеристика химических элементов и химических реакций. Периодический закон и Периодическая система химических элементов Д.И. Менделеева | 5 | 6 | 24 |
2 | Металлы | 10 | 19 | 76 |
ИТОГО | 15 | 25 | 100 |
Часть 1 КИМ содержит 10 заданий базового уровня сложности и 3 заданий повышенного уровня сложности. Часть 2 содержит 2 задания высокого уровня сложности.
Часть 2 содержит 2 задания высокого уровня сложности.
Распределение заданий по уровням сложности представлено в таблице 3.
Таблица 3. Распределение заданий по уровню сложности
Уровень сложности заданий | Число заданий | Максимальный первичный балл | Процент максимального первичного балла за задания данного вида деятельности от максимального первичного балла за всю работу, равного 25 |
Базовый | 10 | 10 | 40 |
Повышенный | 3 | 6 | 24 |
Высокий | 2 | 9 | 36 |
Итого | 15 | 25 | 100 |
Система оценивания выполнения отдельных заданий и работы в целом
Верное выполнение каждого из заданий 1–10 базового уровня оценивается 1 баллом.
За полный правильный ответ на каждое из заданий 11, 12, 13 повышенного уровня ставится 2 балла; если допущена одна ошибка, то ответ оценивается в 1 балл. Если допущены две и более ошибки или ответа нет, то выставляется 0 баллов.
Максимальное количество баллов, которое можно получить за выполнение заданий части 1, равно 16.
Выполнение заданий 14 высокого уровня части 2 оценивается от 0 до 4 баллов, задания 15 – оценивается от 0 до 5 баллов. Максимальное количество баллов, которое можно получить за выполнение заданий части 2, равно 9.
Максимальное количество первичных баллов, которое можно получить за выполнение всех заданий КИМ работы, равно 25.
Итоговая оценка определяется по 5-балльной шкале (таблица 4).
Таблица 4. Шкала перевода суммарного балла за выполнение
КИМ в отметку по пятибалльной шкале
Отметка по пятибалльной шкале | «2» | «3» | «4» | «5» |
Суммарный балл | 0-8 | 9-14 | 15-21 | 22-25 |
Продолжительность выполнения работы
На выполнение всей работы отводится 40 минут.
Рекомендуемое время на выполнение части 1 – 19 минут; на выполнение заданий части 2 рекомендуется отвести 21.
Дополнительные материалы и оборудование
В процессе выполнения работы учащийся использует следующие дополнительные материалы:
− Периодическая система химических элементов Д.И. Менделеева;
− таблица растворимости солей, кислот и оснований в воде;
− электрохимический ряд напряжений металлов;
− непрограммируемый калькулятор.
Обобщенный план варианта КИМ по химии
Коды элементов содержания представлены в соответствии с разделом 1, а коды требований – в соответствии с разделом 2 кодификатора элементов содержания и требований к уровню подготовки учащихся для проведения промежуточной контрольной работы по химии за I полугодие в 9 классе.
Уровни сложности задания: Б – базовый, П – повышенный, В – высокий.
Таблица 5. Обобщенный план варианта КИМ по химии
№ задания | Проверяемые элементы содержания | Коды проверяе-мых элемен- тов содержа-ния по кодифи- катору | Коды требо ваний к уров ню подго товки по кодификатору | Уро вень сложности зада ния | Макс. балл за выпол-нение зада ния | Время выпол-нения зада ния (мин.) |
Часть 1 | ||||||
1 | Характеристика химических элементов по их положению в Периодической системе Д. | 1.1 | 1.2 2.3 | Б | 1 | 1 |
2 | Периодический закон и Периодическая система. Закономерности изменения свойств элементов в связи с положением в Периодической системе химических элементов | 1.2 | 2.3 | Б | 1 | 1 |
3 | Классификация химических реакций по различным признакам | 1.3 | 1.1 2. | Б | 1 | 1 |
4 | Скорость химических реакций. Факторы, влияющие на скорость химических реакций | 1.4 | 1.1 2.2 | Б | 1 | 1 |
5 | Общие химические свойства металлов | 2.1 | 2.3 | Б | 1 | 1 |
6 | Общие способы получения металлов | 2. | 2.3 | Б | 1 | 1 |
7 | Щелочные металлы и их соединения | 2.3 | 2.3 2.5 | Б | 1 | 1 |
8 | Щелочноземельные металлы и их соединения | 2.4 | 2.3 2.5 | Б | 1 | 1 |
9 | Алюминий и соединения алюминия | 2. | 2.3 2.5 | Б | 1 | 1 |
10 | Железо и соединения Fe2+ и Fe3+ | 2.6 | 2.3 2.5 | Б | 1 | 1 |
11 | Номенклатура соединений металлов и их тривиальные названия | 2.7 | 2.1 | П | 2 | 3 |
12 | Химические свойства металлов и их соединений | 2. 2.3 2.4 2.5 2.6 | 2.3 | П | 2 | 3 |
13 | Закономерности изменения свойств элементов в связи с положением в Периодической системе химических элементов | 1.2 | 1.2 2.3 | П | 2 | 3 |
Часть 2 | ||||||
14 | Взаимодействие между основными классами неорганических веществ – соединений металлов | 2. 2.9 | 2.4 | В | 4 | 8 |
15 | Вычисление количества веществ, массы или объема вещества одного из реагентов или продуктов реакции, если одно из веществ содержит примеси | 2.8 | 2.6 3.1 | В | 5 | 13 |
Кодификатор
элементов содержания и требований к уровню подготовки учащихся
для проведения промежуточной контрольной работы по химии
за I полугодие в 9 классе
Кодификатор составлен на базе Федерального компонента Государственного стандарта среднего (полного) общего образования.
Кодификатор состоит из двух разделов:
– раздел 1. «Перечень элементов содержания, проверяемых в рамках промежуточной контрольной работы по химии за I полугодие в 9 классе»;
– раздел 2. «Перечень требований к уровню подготовки обучающихся, освоивших курс неорганической химии за I полугодие 9 класса».
Раздел 1. Перечень элементов содержания, проверяемых в рамках промежуточной контрольной работы по химии за I полугодие в 9 классе
Код блока/ контролируемого элемента | Элементы содержания, проверяемые заданиями работы вводного контроля |
Общая характеристика химических элементов и химических реакций. Периодический закон и Периодическая система химических элементов Д. | |
1.1 | Характеристика химических элементов по их положению в Периодической системе химических элементов Д.И.Менделеева |
1.2 | Периодический закон и периодическая система Д.И.Менделеева. Закономерности изменения свойств элементов в связи с положением в Периодической системе химических элементов. |
1.3 | Классификация химических реакций по различным признакам |
1.4 | Скорость химических реакций. Факторы, влияющие на скорость химических реакций: концентрация реагирующих веществ, температура, природа реагирующих веществ, площадь поверхности соприкосновения реагирующих веществ, катализатор. |
Металлы | |
2.1 | Общие химические свойства металлов |
2.2 | Общие способы получения металлов |
2.3 | Щелочные металлы и их соединения. Химические свойства щелочных металлов и их соединений. Способы получения. Качественные реакции на ионы щелочных металлов. |
2.4 | Щелочноземельные металлы и их соединения. Химические свойства щелочноземельных металлов и их соединений. Способы получения. Качественные реакции на ионы Ca2+, Mg2+, Ba2+ |
2.5 | Алюминий и его соединения. |
2.6 | Железо и его соединения. Химические свойства железа и его соединений Fe2+ и Fe3+ . Способы получения. Качественные реакции на Fe2+ и Fe3+ |
2.7 | Тривиальные названия соединений металлов |
2.8 | Вычисление по химическому уравнению, если одно из реагирующих веществ содержит примеси |
2.9 | Генетическая связь между основными классами соединений металлов. Генетический ряд металла. |
Раздел 2. Перечень требований к уровню подготовки обучающихся, достижение которых проверяется заданиями промежуточной контрольной работы по химии за I полугодие в 9 классе
Код требований | Описание требований к уровню подготовки, достижение которого проверяется в ходе вводного контроля |
1. | |
1.1 | важнейшие химические понятия: оксиды, основания, кислоты, соли, реакции соединения, разложения, замещения, обмена, гетерогенные и гомогенные реакции, эндотермические и экзотермические реакции, скорость химической реакции, катализаторы |
1.2 | основные законы химии: сохранения массы веществ, Периодический закон; |
1.3 | основные теории химии: химической связи, электролитической диссоциации; |
2. Уметь: | |
2.1 | называть изученные вещества по «тривиальной» или международной номенклатуре; |
2. | определять степень окисления химических элементов, тип химической связи в соединениях, заряд иона, окислитель и восстановитель, принадлежность веществ к различным классам неорганических соединений; факторы, влияющие на скорость химической реакции; |
2.3 | характеризовать элементы по их положению в Периодической системе Д.И. Менделеева; закономерности изменения свойств элементов в связи с положением в Периодической системе химических элементов; общие химические свойства металлов; способы получения металлов |
2.4 | объяснять зависимость свойств веществ от их состава; сущность изученных видов химических реакций: ионного обмена, окислительно-восстановительных, реакции соединения, разложения, замещения, обмена, экзотермических и эндотермических реакций, гомогенных и гетерогенных реакций; взаимосвязь разных классов соединений металлов |
2. | составлять формулы веществ основных классов соединений металлов; уравнения реакций изученных типов; |
2.6 | вычислять: количество вещества, массы или объема по количеству вещества, массе или объему одного из реагентов или продуктов реакции, если один из реагентов содержит примеси |
3. Использовать приобретенные знания и умения в повседневной жизни для: | |
3.1 | понимания взаимосвязи химии с особенностями профессий и профессиональной деятельности, в основе которых лежат знания по данному учебному предмету; |
3. | экологически грамотного поведения в окружающей среде |
Образец материи, который фиксируется ее состоянием. | ||
Система информации об опасных материалах на рабочем месте: символы, используемые для обозначения осторожного поведения при работе с определенными материалами | ||
Различные формы, которые принимают разные фазы материи. | ||
Молекулы довольно плотно связаны между собой и только колеблются. | ||
Имеет почти фиксированный объем, но не заданную форму.Жидкость принимает форму контейнера, в котором она находится. Частицы движутся свободно прикрепленными и быстро с небольшим пространством и небольшим количеством столкновений между частицами. | ||
Молекулы движутся свободно и независимо. | ||
Молекулы движутся очень свободно и очень быстро.Между частицами много места и много столкновений. | ||
Твердое вещество превращается в жидкость при нагревании до точки плавления. | ||
Жидкость превращается в газ при нагревании. | ||
Жидкость превращается в твердое вещество при охлаждении до точки замерзания. | ||
Переход непосредственно от твердого тела к газу без превращения в жидкость. | ||
Газ превращается в жидкость. | ||
Когда газ превращается в твердое тело, не превращаясь в жидкость. | ||
Любое свойство, используемое для характеристики материи и энергии и их взаимодействия. | ||
Изменения, влияющие на химическую форму вещества.Переход из одного состояния в другое. | ||
свойство, используемое для характеристики материалов в реакциях, изменяющих их идентичность. | ||
Обычно необратимая химическая реакция, включающая перегруппировку атомов одного или нескольких веществ и изменение их химических свойств или состава, приводящая к образованию по крайней мере одного нового вещества | ||
Чистое вещество — это образец вещества как определенного, так и постоянного состава с отчетливыми химическими свойствами. | ||
одно из класса веществ, которые нельзя разделить на более простые химическими средствами. | ||
Таблица химических элементов, расположенная в порядке атомных номеров, обычно в строках, так что элементы с аналогичной атомной структурой (и, следовательно, схожими химическими свойствами) появляются в вертикальных столбцах | ||
Вещество, состоящее из двух или более элементов, химически объединенных в фиксированных пропорциях | ||
Продукт случайного распределения одного вещества через другое без какой-либо химической реакции, в отличие от соединения | ||
однородная смесь двух и более веществ; часто (но не обязательно) жидкий раствор | ||
смесь, в которой видны все компоненты. | ||
смесь, в которой мелкие частицы взвешены в жидкости, где они поддерживаются плавучестью | ||
Гомогенное вещество, состоящее из больших молекул или ультрамикроскопических частиц одного вещества, диспергированных во втором веществе. | ||
форма химии и спекулятивной философии, занимающаяся главным образом открытием методов превращения неблагородных металлов в золото и поиском универсального растворителя и эликсира жизни. | ||
наименьший компонент элемента, имеющий химические свойства элемента | ||
Стабильная субатомная частица, встречающаяся во всех атомных ядрах, с положительным электрическим зарядом, равным по величине заряду электрона, но противоположным знаком | ||
элементарная частица с нулевым зарядом и массой, примерно равной протону; входит в структуру атомного ядра | ||
Стабильная субатомная частица с зарядом отрицательного электричества, обнаруженная во всех атомах и действующая как первичный переносчик электричества в твердых телах | ||
орбита, заполненная электронами вокруг ядра атома | ||
электрон во внешней оболочке атома, который может объединяться с другими атомами с образованием молекул | ||
Положительно заряженное центральное ядро атома, содержащее большую часть его массы | ||
Число протонов в ядре атома, определяющее химические свойства элемента и его место в периодической таблице | ||
Масса атома химического элемента, выраженная в атомных единицах массы. | ||
любой из нескольких химических элементов, которые обычно представляют собой блестящие твердые вещества, которые проводят тепло или электричество и могут быть сформированы в листы | ||
Химический элемент, образующий кислые оксиды и плохо проводящий тепло и электричество (кислород, углерод, сера и т. | ||
Элемент, свойства которого являются промежуточными между свойствами металлов и твердых неметаллов.Это электрические полупроводники | ||
Семья — это вертикальный столбец в периодической таблице. | ||
Горизонтальные строки в периодической таблице | ||
Неметаллические элементы 17 группы периодической таблицы. | ||
Газообразные элементы 18 группы таблицы Менделеева.Эти элементы являются единственными элементами с полной валентной электронной оболочкой. | ||
Все металлы 2 группы периодической таблицы. | ||
Все металлы группы 1 периодической таблицы.Эти элементы очень реактивны. | ||
комбинация символов и нижних индексов, которая показывает вид и пропорцию атомов каждого элемента, которые образуют определенное соединение. | ||
Атом или молекула с чистым электрическим зарядом из-за потери или усиления одного или нескольких электронов | ||
химическое соединение, в котором ионы удерживаются вместе в структуре решетки ионными связями. | ||
Вещество, образующееся при соединении двух или более неметаллических молекул | ||
Группа связанных вместе атомов, представляющая наименьшую фундаментальную единицу химического соединения, которая может принимать участие в химической реакции | ||
Вещество, которое принимает участие и претерпевает изменения в ходе реакции | ||
Вещество, полученное в ходе естественного, химического или производственного процесса | ||
Процесс, включающий перестройку молекулярной или ионной структуры вещества, в отличие от изменения физической формы | ||
Химическая реакция, при которой тепло выделяется при образовании химических соединений. | ||
Реакция, при которой у окружающей среды забирается тепловая энергия, снижает температуру. | ||
Экзотермический и эндотермический | Экзотермическая реакция — это химическая реакция с выделением тепла, эндотермическая реакция — это химическая реакция с поглощением тепла. | |
Быстрое химическое соединение вещества с кислородом с выделением тепла и света | ||
вызвать ухудшение из-за действия воды, воздуха или кислоты | ||
Передача энергии от различных молекул для производства АТФ. | ||
Процесс, при котором зеленые растения и некоторые другие организмы используют солнечный свет для синтеза пищи из углекислого газа и воды.Расходуется углекислый газ, образуется кислород. | ||
Клеточное дыхание vs. | Клеточное дыхание потребляет кислород и генерирует углекислый газ, фотосинтез потребляет углекислый газ и производит кислород. | |
Материальная система, в которой масса или энергия могут быть потеряны или получены из окружающей среды | ||
Системы, которые не находятся под влиянием окружающей среды и не взаимодействуют с ней. | ||
Открытая система против закрытой системы | Открытые системы могут терять или набирать массу или энергию из окружающей среды, закрытые системы не взаимодействуют с окружающей средой и не могут набирать или терять энергию или массу. | |
фундаментальный принцип классической физики, согласно которому материя не может быть создана или разрушена в изолированной системе | ||
Вещество, которое увеличивает скорость химической реакции без каких-либо постоянных химических изменений |
Как достичь 9-го класса по химии GCSE
👆Некоторые примечания к пересмотру по хроматографии, ионам и молям
Документ 2
В работе 2 я сосредоточился в основном на двух темах: это очень большая тема, и хотя большая часть ее содержания кажется довольно общей (переработка и повторное использование, ограниченные ресурсы и т. д.), многие ученики не понимают, что тема 10 содержит некоторые нишевые области, такие как керамика, композиты и полимеры.В прошлом году у многих студентов возникли проблемы с этой темой, поскольку они упустили из виду сложность и детализацию. Так что обязательно разберитесь с этой темой!
д.), многие ученики не понимают, что тема 10 содержит некоторые нишевые области, такие как керамика, композиты и полимеры.В прошлом году у многих студентов возникли проблемы с этой темой, поскольку они упустили из виду сложность и детализацию. Так что обязательно разберитесь с этой темой!
Я сосредоточился на теме 6 , потому что она содержит самую сложную часть (на мой взгляд) GCSE Chemistry: Обратимые реакции и принцип Ле Шателье . В обязательном порядке эти вопросы появятся на более высоком уровне, и тип вопроса для обратимых реакций всегда будет относительно схожим, поскольку существует не так много способов задать вопрос об этой области, не достигнув территории уровня химии.Во время урока обратите внимание на то, что вы думаете о спецификации, почему бы даже не распечатать ее и не принести в класс. Что бы вы ни делали, убедитесь, что у вас есть к этому доступ. Вот ссылка на спецификацию курса.
В основном я использовал справочник CGP по GCSE Chemistry . Это включало в себя руководство по пересмотру, буклет с дополнительными вопросами, буклет с дополнительными вопросами с фокусом на 8/9 классы и собственные карты пересмотра CGP .
Это включало в себя руководство по пересмотру, буклет с дополнительными вопросами, буклет с дополнительными вопросами с фокусом на 8/9 классы и собственные карты пересмотра CGP .
Я не только регулярно пользуюсь этими ресурсами, но и подписался на сайт My GCSE Science.Это предоставило мне доступ к пересмотренным видеороликам по каждой теме и всем наукам, а также к викторинам и экзаменационным вопросам.
Наконец, я очень рекомендую ресурс Quizlet ; Платформа для быстрой и легкой викторины, которая поможет вам изучить ключевые концепции и определения с помощью активного отзыва. Вот хороший видеоролик, который стоит посмотреть, если вы не знаете, что такое активное вспоминание.
В целом, я бы сказал, что я, вероятно, выполнил за пару часов проверки в неделю , за несколько месяцев до сезона экзаменов.Все работают по-разному, но если у вас есть расписание пересмотра, которое работает, будь то 3 часа каждый вечер или всего 30 минут в субботу, тогда вам хорошо.
Экзамен
Мои сильные стороны при сдаче экзамена по химии или экзаменам по естествознанию в целом заключались в том, что я хорошо знал программу и руководство по пересмотру, поэтому я мог легко понять, к какой теме относится каждый вопрос.
Однако одной из моих самых больших слабостей было неправильное понимание или игнорирование конкретной цели вопроса.Иногда я начинал отвечать на вопрос и писать по теме, не совсем понимая, что меня просил сделать вопрос. В результате я всегда перечитывал каждый вопрос экзамена, по крайней мере, 2 или 3 раза , чтобы убедиться, что я правильно понимаю.
Я написал столько прошлых работ, сколько мне было доступно, в том числе все те, что есть на сайте AQA.
Что я нашел наиболее полезным, так это ответы на вопросы с 6 баллами, которые есть во всех статьях по химии.Многие учащиеся находят 6 маркеров сложной задачей и не могут разработать твердый подход, не зная, какую терминологию использовать, чтобы попасть в нужный сценарий. Прошлые статьи действительно помогли развить мою технику быстрого и эффективного ответа на 6 маркеров.
Прошлые статьи действительно помогли развить мою технику быстрого и эффективного ответа на 6 маркеров.
Настоящий экзамен прошел на удивление хорошо. Последний вопрос по бумаге 1 был маркером 6, основанным на титровании расчетов. Этот вопрос был легкой задачей, потому что, как я упоминал ранее, мое внимание к количественным тематическим областям сделало такие вопросы очень доступными.
Экзамен , работа 2, , содержал множество вопросов по органической химии, и скрытно включал тему статьи 1, а также печально известную тему : использование ресурсов . Я покинул экзамен очень довольный своей успеваемостью, особенно в отношении темы 6 вопросов об обратимых реакциях / хабер-процессе, которые я ожидал до экзамена.
Резюме
Что касается экзаменов по естествознанию, я разбил предмет на две основные части:
Знание содержания
Применение концепций
Если эти фундаментальные принципы усвоены, вы сможете » т ошибиться.
Знание содержания : Вы должны использовать спецификацию в качестве компаса; Вы должны знать каждую тему от и до той степени, в которой вы чувствуете себя достаточно уверенно, чтобы преподавать другому ученику. Регулярно пересматривайте, и контент останется неизменным, но это не гарантирует успеха.
Применение концепций : Вам необходимо уметь применять полученные знания. Вопросы на практических экзаменах — лучшая форма применения, и они доказывают, действительно ли вы знаете, что вы узнали.
Имея это в виду, химия может быть разбита на очень доступный предмет, в котором любой студент может преуспеть.
Хотите помочь в подготовке к экзаменам в этом году? Ознакомьтесь с The Online Exam Preparation Bootcamp .
9 класс — Темы секции химии Вы должны изучить этот материал!
Презентация на тему: «9 класс — Темы секции химии. Вы должны изучить этот материал!» — стенограмма презентации:
1 9 класс — Темы секции химии Вы должны изучить этот материал!
2
Что такое материя? Категоризованный вопрос. Физические свойства материи. Вещи, которые можно потрогать, увидеть или понюхать. Карточки с 12 свойствами. Мы сосредоточились на вычислении плотности с использованием уравнения: вычислить плотность по наклону графика зависимости объема от массы. ПОНЯТЬ! Определите физические свойства на примерах. Физическое изменение — что это?
Физические свойства материи. Вещи, которые можно потрогать, увидеть или понюхать. Карточки с 12 свойствами. Мы сосредоточились на вычислении плотности с использованием уравнения: вычислить плотность по наклону графика зависимости объема от массы. ПОНЯТЬ! Определите физические свойства на примерах. Физическое изменение — что это?
3 Химические свойства вещества. В частности, как атомы реагируют с другими атомами — реакционная способность! Токсичность и др.Химическое изменение — что это такое? (Что-то о создаваемом новом веществе…) Горение, коррозия и т. Д. Определение химического и физического изменения и почему.
4
История атома — ранние модели вплоть до модели в ее понимании 1920-х годов. Диаграммы Аристотеля, Алхимиков Далтона, Томсона, Резерфорда, Бора-Бора-Резерфорда для первых 20 элементов. Вы должны знать и узнавать символы первых 20 элементов ПЛЮС эти переходные металлы: железо, никель, медь, цинк, серебро, золото, ртуть, олово, свинец. Узнай атомный номер и массу.
Узнай атомный номер и массу.
5 Мы пропустили историю периодической таблицы Менделеева, но она была кратко освещена в просмотренном нами фильме. Достаточно сказать, что он произошел от ранних моделей. Русский ученый Менделеев представил свою версию, ныне широко признанную, в 1869 году. Таблица Менделеева разделена на периоды и группы. Периоды идут горизонтально и в основном считают протоны. Группы работают вертикально.
6 Группы в таблице Менделеева объединяют элементы, имеющие схожие физические и химические свойства.Вы должны знать эти группы: Щелочные металлы Щелочноземельные металлы Галогены Благородные газы Металлоиды Вам также следует знать, что металлы отличаются от неметаллов. Разделены на металлоиды…
7
Группы элементов имеют одинаковое количество валентных электронов. Это основная характеристика каждой группы в периодической таблице! Точечные диаграммы Льюиса для первых 20 элементов. Изотоп — это атом с другим количеством нейтронов.(Это все, что вам нужно знать) Атомы хотят быть стабильными. Это делается, когда валентный слой заполнен. Для этого нужно добавить или удалить электроны к внешнему слою (чтобы сформировать октет).
Это основная характеристика каждой группы в периодической таблице! Точечные диаграммы Льюиса для первых 20 элементов. Изотоп — это атом с другим количеством нейтронов.(Это все, что вам нужно знать) Атомы хотят быть стабильными. Это делается, когда валентный слой заполнен. Для этого нужно добавить или удалить электроны к внешнему слою (чтобы сформировать октет).
8 Ион — когда в атоме электронов больше или меньше, чем протонов. Элементы в группах 1–3 имеют тенденцию терять электроны. Когда они это делают, они теряют отрицательно заряженные электроны и в результате имеют чистый положительный заряд. Элементы в группах 5-7 имеют тенденцию приобретать электроны.Тогда у них будет чистый отрицательный заряд. Атомы группы 4 могут приобретать или терять электроны — это для дальнейшего изучения.
9
Благородные газы вообще не ионизируются! Положительно заряженные ионы будут притягиваться к отрицательно заряженным ионам. Ионная молекула образуется, когда положительно заряженный ион соединяется с отрицательно заряженными ионами. Пример: ионы натрия притягиваются к ионам хлора с образованием хлорида натрия. Затем вы составили рабочий лист по молекулам и именованию.
Ионная молекула образуется, когда положительно заряженный ион соединяется с отрицательно заряженными ионами. Пример: ионы натрия притягиваются к ионам хлора с образованием хлорида натрия. Затем вы составили рабочий лист по молекулам и именованию.
10 Таким образом, наши занятия по химии заканчиваются в 9 классе … В 10 классе вы продолжите изучение химии с того места, на котором мы остановились в этом году. Так что не теряйте свои заметки!
| Телефон : | 780-427-5318 | |
| (Composer d’abord le 310-0000 pour obtenir une ligne sans frais) | ||
| Телекопье: | 780-427-1179 | |
| Adresse de Courriel: | cshelpdesk @ gov. ab.ca ab.ca | |
9 класс — Блок 3 — Периодическая таблица, формулы и уравнения
В этом разделе студенты будут изучать закономерности, встречающиеся в Периодической таблице, и использовать их для предсказания поведения элементов и свойств соединений, которые они образуют. Они будут использовать свои знания об атомной структуре, чтобы выводить формулы химических веществ.Студенты также получат опыт написания сбалансированных химических уравнений для простых химических реакций. Теория будет проиллюстрирована серией практических занятий.
Учебные цели
СМЭО
Тщательное наблюдение и распознавание моделей поведения позволяет нам делать прогнозы относительно поведения мира природы
С4. Стехиометрия
- Используйте символы элементов, чтобы написать формулы простых соединений
- Выведите формулу простого соединения из относительного числа присутствующих атомов
- Вывести формулу простого соединения из модели или графического представления
- Составьте и используйте словесные уравнения
- Дополнение: Определите формулу ионного соединения по зарядам на имеющихся ионах
- Приложение: построение и использование символьных уравнений с государственными символами
- Дополнение: Выведите вычисленное уравнение химической реакции с учетом соответствующей информации.

C9. Периодическая таблица
- Опишите, как Периодическая таблица классифицирует элементы в порядке протонного числа
- Приложение: используйте периодическую таблицу для прогнозирования свойств элементов с помощью групп и периодов
C9.1 Периодические тенденции
- Опишите переход от металлического к неметаллическому характеру за период
- Приложение: Опишите взаимосвязь между номером группы, количеством электронов внешней оболочки (валентностью) и металлическим / неметаллическим характером
С9.2 Объекты группы
- Опишите литий, натрий и калий в Группу I как совокупность относительно мягких металлов, демонстрирующих тенденцию изменения температуры плавления и реакции с водой
- Опишите тенденции в свойствах хлора, брома и йода в Группе VII, включая цвет, физическое состояние и реакции с другими галогенид-ионами
- Приложение: Прогнозирование свойств других элементов в Группе I с учетом данных, где это необходимо
- Приложение: Предсказать свойства других элементов в Группе VII, учитывая данные, где это необходимо
С9.
 3 Переходные элементы
3 Переходные элементы- Опишите переходные элементы как совокупность металлов, имеющих высокую плотность, высокую температуру плавления и образующих окрашенные соединения, которые, как элементы и соединения, часто действуют как катализаторы.
C9.4 Благородные газы
- Описать инертные газы как инертные
- Приложение: Опишите использование благородных газов для создания инертной атмосферы, например, аргона в лампах, гелия для наполнения воздушных шаров.
Естественные науки 9 класс
Элементы и соединения
- соединение
- кристаллическая решетка
- элемент
- двухатомный
- молекула
Этот первый раздел представляет собой пересмотр того, что учащиеся должны были изучить в предыдущих классах. Он занимает несколько страниц, но в основном представляет собой исправленную версию и был включен в качестве справочного материала для учащихся. В зависимости от вашего класса вам нужно будет решить, сколько времени вам нужно посвятить пересмотру этих тем или попросите учащихся прочитать содержание и завершить задание в конце.
В зависимости от вашего класса вам нужно будет решить, сколько времени вам нужно посвятить пересмотру этих тем или попросите учащихся прочитать содержание и завершить задание в конце.
Можете ли вы вспомнить, что узнали о соединениях в гр. 8 Материя и материалы? Мы начнем эту главу с обобщения и пересмотра некоторых основных идей о элементе и соединении из Gr. 7 и 8. Это должно помочь нам связать новые идеи в этой главе с тем, что мы уже знаем.
Частицы, входящие в состав соединений
Учащиеся должны знать, что соединения могут иметь два типа структур, а именно молекулы и решетки:
- Когда соединение полностью состоит из неметаллов (например, CO 2 , H 2 O или NH 3 ), наименьшей единицей этого соединения будет молекула.
- Однако, когда соединение состоит из металла и неметалла (например, NaCl или CuO), тип связи в соединении различается.
 Во время связывания атомы металла и неметалла обмениваются электронами с образованием ионов. Из-за притяжения противоположных зарядов эти ионы объединяются в огромные трехмерные кристаллы или решетки, а не образуют простые молекулы.
Во время связывания атомы металла и неметалла обмениваются электронами с образованием ионов. Из-за притяжения противоположных зарядов эти ионы объединяются в огромные трехмерные кристаллы или решетки, а не образуют простые молекулы.
В этот раздел мы включили краткое упоминание кристаллических решеток, чтобы впоследствии избежать неправильного представления о том, что NaCl и другие ионные соединения состоят из молекул.Учащиеся должны знать, что NaCl, например, состоит из регулярного расположения атомов натрия и хлорида, объединенных в соотношении 1: 1, упакованных в кристаллическую структуру.
Частицы соединения всегда состоят из двух или более атомов. В области физических наук Gr. 10 вы узнаете, что эти атомы объединяются по-разному. В некоторых случаях они могут образовывать молекулу . Возможно, вы помните, что «молекула» — это слово, которое ученые используют для обозначения кластера атомов, которые соединяются определенным образом.Другие соединения состоят из атомов, которые расположены в правильном порядке, который называется кристаллической решеткой .
Молекулы соединения всегда состоят из двух или более атомов разных типов, как молекулы воды на следующей диаграмме.
Молекулы воды.Соединения, образующие кристаллическую решетку, состоят из множества атомов, но всегда соединяются в фиксированном соотношении. Например, в хлориде натрия (поваренная соль) на каждый атом натрия в кристалле приходится один атом хлора.Самая маленькая «единица», которая повторяется в кристалле, состоит из одного Na и одного Cl. Формула NaCl представляет собой одну «формульную единицу» NaCl.
Кристаллическая решетка хлорида натрия, состоящая из атомов натрия (фиолетовый) и хлорида (зеленый) в фиксированном соотношении.Из приведенной выше диаграммы молекул воды и решетки хлорида натрия мы видим, что соединение — это не просто смесь элементов. Смесь элементов водорода и кислорода будет выглядеть так:
Смесь молекул водорода и кислорода. Почему на диаграмме выше атомы водорода и кислорода спарены? Прежде чем мы ответим на этот вопрос, сделаем важное напоминание: элементы состоят только из одного вида атомов.
Некоторые элементы существуют в виде двухатомных молекул, например, на диаграмме справа внизу и молекулы водорода и кислорода на диаграмме «смеси» выше. Наиболее важными примерами двухатомных молекул являются H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 и I 2 . Двухатомный означает «состоящий из двух атомов ».
Некоторые элементы существуют в виде двухатомных молекул.Вы видите, что все молекулы воды на диаграмме выше идентичны? Это подводит нас к следующему вопросу о соединениях.
Атомы в молекулах и решетках объединены в фиксированном соотношении
В воде, например, один атом кислорода (O) соединился с двумя атомами водорода (H). В этом отношении все молекулы воды абсолютно одинаковы.
Все молекулы воды состоят из одного атома O и двух атомов H, что придает воде ее особые свойства. Любая другая комбинация атомов водорода и кислорода НЕ была бы водой. Например, перекись водорода состоит из тех же элементов, что и вода (водород и кислород), но соотношение другое: два атома кислорода объединились с двумя атомами водорода.
Например, перекись водорода состоит из тех же элементов, что и вода (водород и кислород), но соотношение другое: два атома кислорода объединились с двумя атомами водорода.
Следующий важный момент, касающийся соединений, заключается в следующем.
Каждое соединение имеет уникальное название и формулу
Вода может быть представлена формулой H 2 O. Формула говорит нам, что два атома водорода (H) соединены с одним атомом кислорода (O) в молекуле воды.
Какая формула перекиси водорода? Вы можете вспомнить название соединения с формулой CO 2 ? Не забывайте делать заметки, обсуждая вещи в классе!
Формула перекиси водорода H 2 O 2 .Формула CO 2 — диоксид углерода.
Какая формула представляет одну «формульную единицу» типа оксида железа на предыдущей диаграмме?
Атомы в соединении удерживаются вместе химическими связями
- химическая связь
- реагент
- товар
- химическая формула
Что удерживает вместе кластеры атомов, которые мы называем молекулами? Когда атомы объединяются в молекулы, они делают это, потому что испытывают силу притяжения между собой.Силы, удерживающие атомы вместе, называются химическими связями .
Далее нам нужно напомнить, откуда берутся соединения.
Соединения образуются в ходе химических реакций
Во всех химических реакциях атомы в молекулах перестраиваются, образуя новые молекулы. Вот как образуются соединения: атомы в одном наборе соединений разделяются по мере разрыва связей между ними, и они перестраиваются в новые группы по мере образования новых связей. Когда это происходит, мы говорим, что произошла химическая реакция. Взгляните на следующую иллюстрацию.
Взгляните на следующую иллюстрацию.
В приведенном выше примере элементы слева от стрелки называются реагентами . Они перестроились, чтобы образовать новое соединение. Он называется продуктом и показан справа от стрелки.
Вы можете описать, что случилось с атомами и связями в этой реакции? Обсудите, какая связь разорвалась, какие образовались и как атомы перестроились во время реакции.
Обсудите это со своим классом.Поощряйте их делать заметки во время обсуждения.
- Связь между двумя красными атомами разорвана.
- Черный атом двигался между двумя красными атомами.
- Образовались две новые связи: между черным атомом и каждым из двух красных атомов.
Последний аспект соединений, который мы узнали в Гр. 8 заключается в том, что каждое соединение может быть представлено уникальной химической формулой:
Соединение имеет химическую формулу
Сравните формулу воды с диаграммой молекулы воды, которую вы видели ранее. Вы можете установить связь?
Вы можете установить связь?
Химическая формула соединения одинакова для всех молекул этого соединения. Когда мы читаем формулу, нижние индексы говорят нам, сколько атомов определенного элемента находится в одной молекуле этого соединения:
Когда мы пишем H 2 O, мы на самом деле имеем в виду H 2 O 1 . Согласно соглашению, мы не используем 1 в качестве нижнего индекса в формулах, поэтому первая формула является правильной. Это означает, что на 1 кислород приходится 2 атома водорода.Это тоже соотношение, которое можно записать как 2: 1. В следующем упражнении мы попрактикуемся в написании формул.
ИНСТРУКЦИЯ:
- В следующей таблице названия некоторых чистых веществ приведены в левом столбце. В среднем столбце указано, из чего состоит одна молекула каждого соединения.
- Вы должны использовать эту информацию для записи формулы каждого соединения в последнем столбце справа.

- Первая строка заполнена за вас, так что у вас есть пример:
- В 1-й графе указано название: вода
- Колонка 2: одна молекула воды содержит два атома H и один атом O.
- Столбец 3: Из информации во втором столбце мы можем записать формулу: H 2 O
Название вещества | Из чего он сделан? | Химическая формула |
вода | 2 атома H и 1 атом O | H 2 O |
| 09 диоксид углерода 1 атом и 2 атома O | ||
аммиак | 1 атом N и 3 атома H | |
метан | 1 атом C и 4 атома H |
Название вещества | Из чего он сделан? | Химическая формула |
вода | 2 атома H и 1 атом O | H 2 O |
| 09 диоксид углерода 1 атом и 2 атома O | CO 2 | |
аммиак | 1 атом N и 3 атома H | NH 3 |
метан 1 атом C и 4 атома H | CH 4 |
ВОПРОСЫ:
Что связывает атомы в соединении?
Химическая связь удерживает атомы вместе.
На следующей диаграмме показано, как углерод и кислород реагируют с образованием диоксида углерода.
Каковы реагенты и каков продукт в этой реакции? Напишите эти имена на диаграмме.
реагентами являются углерод (серый кружок) и кислород (красные кружки), а продуктом является диоксид углерода.
Почему кислород представлен двумя кружками вместе?
Каждый из двух кружков представляет атом кислорода, поскольку кислород представляет собой двухатомную молекулу, что означает, что он существует в виде двух атомов кислорода, связанных вместе в двухатомных молекулах.
Оксид магния имеет формулу MgO. что это соотношение говорит нам об атомах в соединении?
Это означает, что на каждый 1 атом магния приходится 1 атом кислорода, соединенный с ним химической связью.
Теперь, когда мы освежили нашу память, мы собираемся вернуться к таблице, которую ученые используют для систематизации своих знаний об элементах. Вы можете вспомнить, как это называется?
Вы можете вспомнить, как это называется?
Периодическая таблица
Первая часть этого раздела — это пересмотр того, что учащиеся должны были изучить в предыдущих классах.
- Периодическая таблица
- символ (или символ элемента)
- атомный номер
- уникальный
Мы впервые столкнулись с Периодической таблицей в Gr. 7. Вот краткое изложение того, что мы уже знаем:
- Все известные элементы можно расположить в таблице, называемой Периодической таблицей.
- Открытия многих ученых на протяжении многих лет внесли свой вклад в информацию в Периодической таблице, но версия таблицы, которую мы используем сегодня, была первоначально предложена Дмитрием Менделеевым в 1800-х годах.
- Каждый элемент занимает фиксированную позицию в Периодической таблице. Элементы расположены в порядке возрастания атомного номера, при этом самый легкий элемент (водород: H) находится в верхнем левом углу.

- Положение элемента в Периодической таблице указывает нам, является ли он металлом, неметаллом или полуметаллом.
- металлов находятся в левой части таблицы;
- неметаллов находятся в дальнем правом углу таблицы; и
- полуметаллов находятся в области между металлами и неметаллами.
- Элемент можно идентифицировать 3 различными способами:
- каждый элемент имеет уникальное имя;
- каждый элемент имеет уникальный химический символ; и
- каждый элемент имеет уникальный атомный номер.
- Металлы обычно блестящие, пластичные и податливые. Большинство из них представляют собой твердые вещества при комнатной температуре и имеют высокие температуры плавления и кипения.
- Неметаллы могут быть твердыми телами, жидкостями или газами при комнатной температуре. У них есть множество свойств, которые обычно зависят от состояния, в котором они находятся.

- Все полуметаллы являются твердыми телами при комнатной температуре. Обычно они обладают сочетанием металлических и неметаллических свойств.
Мы узнали о происхождении Периодической таблицы в Gr. 7. Давайте также пересмотрим то, что мы узнали тогда, чтобы у нас была прочная основа для нашего нового обучения.
Периодическая таблица — это в основном диаграмма, которую ученые используют для перечисления известных элементов. Таблица состоит из отдельных плиток для каждого из элементов. Какую информацию мы можем найти в Периодической таблице? Об этом весь следующий раздел.
Какую информацию мы можем найти в Периодической таблице?
Информация, которая чаще всего появляется на каждой плитке Периодической таблицы, следующая:
- Химический знак; и
- Атомный номер
На схеме ниже показан пример одной из плиток Периодической таблицы. Можете ли вы определить элемент, который он представляет? Сколько протонов в его атомах?
C — углерод. В нем 6 протонов (обозначено атомным номером).
В нем 6 протонов (обозначено атомным номером).
Атомный номер (Z) обычно пишется вверху каждой плитки для элемента Периодической таблицы, а большее атомное массовое число (A) записывается внизу каждой плитки.
На внутренней стороне обложки ваших рабочих тетрадей напечатана большая версия Периодической таблицы, к которой вы легко можете обратиться.
Существуют разные версии Периодической таблицы, каждая из которых может содержать различную информацию об элементах.Можете ли вы определить, какая информация предоставляется об элементах в следующей таблице?
Таблица содержит только химический символ и атомный номер каждого элемента.
В следующей периодической таблице показаны только символы элементов.
Другие версии Периодической таблицы могут содержать дополнительную информацию, например:
- Имя элемента; и / или
- Атомная масса элемента, обычно указываемая внизу каждой плитки.

На схемах ниже показаны примеры того, как иногда представляется эта информация.
Эта плитка показывает информацию об элементе медь.Интерактивный сайт периодической таблицы Менделеева. Щелкните каждый элемент, чтобы просмотреть много интересной информации о нем http://www.chemicool.com/
Как элементы расположены в Периодической таблице?
- металл
- неметалл
- полуметалл
- группа
- период
- электронов
- нейтронов
- протонов
Мы узнали, что элементы Периодической таблицы расположены очень специфическим образом.
Элементы расположены в порядке возрастания атомного номера. Элемент с наименьшим атомным номером — водород (H: атомный номер = 1) находится в верхнем левом углу таблицы. Элементы с наибольшим атомным номером находятся внизу таблицы.
Элементы также расположены в областях, и эти области часто представлены разными цветами. Следующая таблица Менделеева показывает нам, где можно найти металлы, неметаллы и полуметаллы.
Следующая таблица Менделеева показывает нам, где можно найти металлы, неметаллы и полуметаллы.
Суммируем:
- Металлы находятся в левой части Периодической таблицы, охватывая почти всю таблицу, за исключением правого верхнего угла. В таблице выше металлы синие.
- неметаллы находятся в относительно небольшой треугольной области в верхней правой части таблицы. В приведенной выше таблице неметаллы отмечены красным цветом.
- Несколько элементов с металлическими и неметаллическими свойствами (называемые полуметаллами ) отделяют металлы от неметаллов.Они расположены в диагональной полосе с правой стороны стола. В приведенной выше таблице полуметаллы желтые.
Полуметаллы также иногда называют металлоидами.
Теперь, когда мы пересмотрели то, что мы уже узнали в предыдущих классах, давайте узнаем некоторые новые характеристики Периодической таблицы.
Во всех таблицах есть строки и столбцы. Вы можете вспомнить разницу между вертикальной и горизонтальной? Нарисуйте короткие линии, чтобы показать разницу между «вертикальным» и «горизонтальным» в следующей таблице.
Ученики должны нарисовать следующее:
Вертикальный | Горизонтальный |
Вертикальные ходы «вверх-вниз» и горизонтальные «из стороны в сторону». В обычной таблице столбцы располагаются вертикально, а строки — горизонтально.
Есть специальные слова для описания столбцов и строк Периодической таблицы.На следующей диаграмме показано, как называются столбец и строки.
Группы: Вертикальные столбцы Периодической таблицы называются группами. Группы в Периодической таблице пронумерованы таким образом, что группа 1 находится слева. Сколько всего групп?
Группы пронумерованы от 1 до 18. В старых таблицах группы пронумерованы более сложным образом. Красочная таблица Менделеева из Gr. 7 (показанный ранее) — это пример стиля нумерации, который вы можете найти в старых учебниках и других научных ресурсах.
В старых таблицах группы пронумерованы более сложным образом. Красочная таблица Менделеева из Gr. 7 (показанный ранее) — это пример стиля нумерации, который вы можете найти в старых учебниках и других научных ресурсах.
Периоды: Горизонтальные строки Периодической таблицы называются периодами. Первый период находится в верхней части таблицы. Что является первым элементом в третьем периоде?
Какой элемент находится в группе 14 и во втором периоде? Напишите его символ и название.
Названия и химические символы
в гр. 7 мы узнали, что каждый элемент имеет уникальное имя. Мы также узнали, что каждый элемент имеет уникальный символ. Вот список простых правил, которые следует помнить при использовании химических символов:
- Каждый элемент имеет свой уникальный символ.
- Символ обычно (но не всегда) — это первые одна или две буквы названия элемента.
- Первая буква символа всегда заглавная.

- Если символ состоит из двух букв, вторая буква всегда будет строчной.
- Некоторые элементы имеют символы, которые произошли от их латинских названий.
Мы, как ученые, должны знать названия и символы всех наиболее важных элементов. От вас пока не ожидается, что вы выучите их все наизусть, но в конце этой главы вы должны знать названия и химические символы первых 20 элементов в таблице.Чтобы их было немного легче запомнить, они помещены в таблицу ниже.
Песня о Периодической таблице!
Вам необходимо знать названия и символы первых 20 элементов Периодической таблицы, а также железа, меди и цинка.
ИНСТРУКЦИЯ:
- Воспользуйтесь Периодической таблицей, чтобы заполнить следующую таблицу.
- Напишите химический символ и название элемента для каждого из первых 20 элементов, обозначенных их атомными номерами.

Атомный номер | Химический символ | Название элемента | |
1 | |||
4 | |||
5 | |||
6 | |||
7 | |||
7 | 000|||
7 | 000|||
7 | 000 9009 | ||
10 | |||
11 | |||
12 | |||
16 | |||
17 | |||
18 | |||
Атомный номер | Химический символ | Название элемента | ||
1 | H 000 | He | Гелий | |
3 | Li | Литий | ||
4 | ||||
B | Бор | |||
6 | C | Углерод | ||
7 | 0009 9000 9000 9000 Nrogen | O 900 05 | Кислород | |
9 | F | Фтор | ||
10 | Ne | Neon | Натрий | |
12 | Mg | Магний | ||
13 | Al 05 | 000 0009 Si | Кремний | |
15 | P | Фосфор | ||
16 | S | 000Хло rine | ||
18 | Ar | Аргон | ||
19 | K | Калий |
Есть три важных промышленных металла, названия и формулы которых вам необходимо знать.
 Их атомные номера указаны в таблице ниже. Заполните таблицу, заполнив химические символы и названия элементов.
Их атомные номера указаны в таблице ниже. Заполните таблицу, заполнив химические символы и названия элементов.Атомный номер
Химический символ
Название элемента
26
09
09
09
Атомный номер | Химический символ | Название элемента |
26 | ||
Cu | Медь | |
30 | Zn | Цинк |
ВОПРОСЫ:
Это также является пересмотром того, что учащиеся изучали в Gr.8 об атоме.
Что атомный номер говорит нам об атомах элемента?
Он сообщает нам, сколько протонов находится в атомах.
Сколько протонов в атомах кислорода?
Протонов 8 (атомный номер 8).
Сколько нейтронов содержится в большинстве атомов кислорода?
Также есть 8 нейтронов.
Учащиеся будут узнавать об изотопах только в более поздних классах, а пока достаточно знать, что атомная масса указывает количество нуклонов (протонов и нейтронов), поэтому для кислорода атомная масса равна 15.999 (с округлением до ближайшего целого числа 16), поэтому количество нейтронов = 16-8, что составляет 8.
Сколько электронов будет в нейтральном атоме кислорода?
Будет 8 электронов.
На этом этапе учащиеся еще не узнали об ионах, поэтому мы рассматриваем только нейтральные атомы, в которых количество электронов равно количеству протонов.
Какой заряд у протонов и электронов?
Электроны заряжены отрицательно, а протоны — положительно.
Как протоны, нейтроны и электроны (субатомные частицы) расположены в атоме?
Протоны и нейтроны группируются вместе в центре, образуя ядро, а электроны занимают очень большое пространство / облако / область вокруг ядра.
Нарисуйте модель атома кислорода в пространстве ниже. Обозначьте свою диаграмму.
Учащиеся должны нарисовать центральное ядро с 8 протонами и 8 нейтронами, при этом 8 электронов образуют облако вокруг ядра.Пример модели атома азота приведен ниже в качестве ссылки:
Вы можете задаться вопросом, почему в Периодической таблице ровно 18 групп, а не 14, 10 или любое другое число. Это очень хороший вопрос! Фактическое объяснение довольно сложное и связано с распределением электронов внутри атома. Вы узнаете об этом более подробно, если возьмете Physical Sciences в Gr. 10.
Хотя электроны в атоме движутся так быстро, что невозможно описать их фактическое «положение», ученые смогли выяснить закономерности в расположении электронов. Эти шаблоны повторяются после каждого 18-го элемента.
Эти шаблоны повторяются после каждого 18-го элемента.
Свойства элементов в одной группе
Элементы из одной группы часто имеют схожие физические и химические свойства. На данный момент достаточно знать, что электроны в атомах элемента определяют химические свойства этого элемента. А поскольку «электронные узоры» повторяются после каждого 18-го элемента, получается 18 групп. Поскольку элементы в группе имеют схожие «электронные модели», они будут вести себя одинаково в химических реакциях.
Вот пример, чтобы убедить вас в этом факте:
Металлы группы 1 называются щелочными металлами . Можете ли вы написать имя и химический символ самого легкого члена группы? Вы можете не обращать внимания на водород, который на самом деле является неметаллом, но он помещен вместе с щелочными металлами в Периодической таблице, потому что он имеет аналогичную структуру электронов.
Посмотрите это видео о реакции металла с водой! youtube.com/embed/oqMN3y8k9So»/>
Это видео, чтобы помочь учителям продемонстрировать свойства щелочных металлов, включая горение на воздухе и реакцию с водой.Это длинное видео, но его стоит посмотреть.
Литий и все другие щелочные металлы — мягкие тускло-серые металлы. Внешний вид очень похож и имеет физических свойств .
Все эти элементы очень своеобразным образом реагируют с водой.
Например, когда небольшой кусочек лития падает в воду, он сразу же начинает реагировать с водой. Вот химическое уравнение реакции:
2 Li + 2 H 2 O → 2 LiOH + H 2
Кусок металлического лития будет танцевать на поверхности воды, потому что в результате реакции образуется газообразный водород (H 2 ), который заставляет крошечные пузырьки вытекать из-под лития.Также выделяется тепло, и иногда водород начинает гореть на поверхности воды. Другой образующийся продукт — гидроксид лития. Можете ли вы найти его формулу в приведенном выше химическом уравнении?
Другой образующийся продукт — гидроксид лития. Можете ли вы найти его формулу в приведенном выше химическом уравнении?
Напишите слово уравнение под химическим уравнением выше.
Учащиеся должны написать следующее словесное уравнение: литий + вода → оксид лития + газообразный водород.
Каковы реагенты и продукты в указанных выше химических реакциях?
Реагентами являются литий и вода, а продуктами являются гидроксид лития и газообразный водород.
Металлический литий хранится в масле и плавает в бутылке. Как вы думаете, почему это так? http://commons.wikimedia.org/wiki/File:Lithium_in_mineral_oil.jpg Сначала спросите учащихся, почему они думают, что он может храниться, например, в масле, а не в воде. Это связано с тем, что он очень хорошо реагирует с водой, а также со временем медленно реагирует с кислородом в воздухе, поэтому лучше всего хранить его в масле. Затем спросите учащихся, почему они думают, что кусок металлического лития плавает в бутылке с маслом. Это связано с тем, что литий — самый легкий металл во Вселенной, он легче и менее плотен, чем нефть, поэтому он плавает.Это связано с моделью частиц материи и тем, что изучали в Gr. 8 по плотности различных материалов.
Это связано с тем, что литий — самый легкий металл во Вселенной, он легче и менее плотен, чем нефть, поэтому он плавает.Это связано с моделью частиц материи и тем, что изучали в Gr. 8 по плотности различных материалов.
Интересно, что все остальные щелочные металлы ведут себя аналогичным образом. Натрий более активен, чем литий, поэтому он не только качается на поверхности воды, но и сразу же воспламеняется. Хотя химическая реакция почти идентична:
2 Na + 2 H 2 O → 2 NaOH + H 2
Вы видите, насколько это похоже на реакцию лития с водой?
Когда большое количество натрия вступает в контакт с водой, происходит взрыв, как на этой фотографии, где вода была вылита на 1,5 кг натрия.Калий даже более активен, чем натрий, поэтому он взрывается при попадании на поверхность воды:
2 K + 2 H 2 O → 2 KOH + H 2
Небольшой кусочек металлического калия взрывается, вступая в реакцию с водой. http://commons.wikimedia.org/wiki/File:Kaalumi_reaktsioon_veega.jpg
http://commons.wikimedia.org/wiki/File:Kaalumi_reaktsioon_veega.jpgВы должны заметить, что эти элементы, все из одной группы, одинаково реагируют при контакте с водой. Именно это имеется в виду, когда мы говорим, что элементы из одной и той же группы имеют схожие химические свойства.
Названия соединений
CAPS требует, чтобы учащиеся лепили модели (из бусинок, бобов, пластилина или пластилина) из нескольких элементов и соединений. Мы намеренно воздерживаемся от включения действий, в которых требуется построить или нарисовать «молекулы» ионных соединений, таких как NaCl и CuO. Причина упущений такого рода связана с более ранним примечанием, в котором объяснялось, что ионные соединения образуют решетки, а не молекулы. Их фундаментальные единицы называются не молекулами, а «формульными единицами».
- ИЮПАК
- Система ИЮПАК
- систематическое название
- суффикс Префикс
Возможно, в вашем классе есть два или более человека с одинаковым именем? Тогда вы поймете, насколько запутанным может быть ситуация, когда два человека носят одно и то же имя!
Мы узнали, что каждый элемент имеет уникальное имя. Это важно, чтобы мы не путали элементы друг с другом.
Это важно, чтобы мы не путали элементы друг с другом.
Каждое соединение имеет уникальное имя
Не менее важно, чтобы каждое соединение имело уникальное имя.Следующий пример поможет вам понять, почему:
Два соединения CO и CO 2 состоят из тех же двух элементов, углерода и кислорода. Если мы назовем их оба «оксидом углерода» (поскольку они оба состоят из углерода и кислорода), мы легко сможем их спутать. При определенных обстоятельствах это может создать проблемы, потому что CO гораздо более ядовит для людей и животных, чем CO 2 . Так что легко понять, почему каждому соединению нужно уникальное имя.
Когда мы пишем химические формулы для соединений, они всегда представляют собой комбинацию символов элементов в составе.Например, когда мы видим формулу NaCl, мы знаем, что это соединение состоит из Na и Cl.
Когда мы называем соединения, названия элементов в соединении объединяются и иногда слегка изменяются, чтобы образовать название соединения.
Когда мы слышим, например, название хлорид натрия , совершенно очевидно, что описываемое соединение должно состоять из натрия и хлора . Но почему это хлорид , а не хлор ? Что ж, как вы вскоре увидите, когда мы объединяем имена элементов, меняется тот, который назван последним.
Все вышесказанное может показаться очень сложным, и по этой причине была разработана система именования соединений. Система была разработана Международным союзом теоретической и прикладной химии (IUPAC) . Система разработана таким образом, что название соединения описывает элементы, которые он содержит, и то, как они сочетаются.
Система именования соединений ИЮПАК очень сложна, но нам не нужно изучать все ее правила. На этом этапе нам нужно только научиться называть соединения, состоящие из двух элементов.
На этом уровне мы должны различать два типа соединений, потому что тип соединения определяет, как оно должно называться.
Тип 1: Соединения, содержащие металл и неметалл
Эти соединения называются ионными соединениями из-за типа участвующих связей. CAPS не делает различий между ковалентными и ионными соединениями на этом уровне. С одной стороны, это понятно. Учащиеся еще не узнали об ионных и ковалентных связях в соединениях и поэтому не смогут понять различие между ионными и ковалентными соединениями.С другой стороны, без явного различия, учащиеся не смогут понять, почему MgO называется оксидом магния, когда CO называется монооксидом углерода, или MgCl 2 называется хлоридом магния, а SCl 2 называется дихлоридом серы. По этой причине мы решили проводить различие между соединениями, которые содержат металл и неметалл (ионные соединения), и соединениями, которые содержат только неметаллы (ковалентные соединения).
Это не единственные возможные комбинации возможных элементов — полуметалл может соединяться с неметаллом, например, в диоксиде кремния (SiO 2 ), — но два типа соединений, обсуждаемых здесь, представляют собой два наиболее распространенных типа. комбинаций элементов.
комбинаций элементов.
Для соединений этого типа правило простое. Металл идет первым, а неметалл — вторым. Название неметалла меняется немного: суффикс -ide заменяет окончание названия.
Суффикс — это что-то, что помещается в конец слова . «Префикс» — это что-то, что помещается в начало слова.
Все соединения этого типа образуют не молекулы, а кристаллические решетки. Что мы называем повторяющимися «единицами» в кристаллической решетке?
Вот несколько примеров:
Формула | Состоит из | Название | Изображение одной формульной единицы соединения | |
| NaCl и хлора натрия | Хлорид натрия | |||
FeS | Железо и сера | Сульфид железа | ||
MgO | ||||
LiF | Литий и фтор | Фторид лития |
ИНСТРУКЦИЯ:
- Обратитесь к Периодической таблице и заполните следующую таблицу.

- Вам необходимо определить элементы, из которых состоит соединение, и дать название соединению.
Формула | Из каких элементов она состоит? | Название |
Li 2 O | ||
KCl | ||
Формула | Из каких элементов она состоит? | Название |
Li 2 O | 2 лития и 1 кислород | Оксид лития |
Хлорид калия | ||
CuO | 1 медь и 1 кислород | Оксид меди |
NaBr | бром натрия | бром натрия |
Тип 2: Соединения, содержащие только неметаллы
Этот тип соединения немного сложнее назвать. Есть три правила, которым вы должны следовать. Они следующие:
Есть три правила, которым вы должны следовать. Они следующие:
Правило 1:
Имя элемента, расположенного левее в Периодической таблице, идет первым, за ним следует имя элемента, расположенного дальше справа в таблице. Название второго элемента немного изменится: суффикс -ide заменяет окончание имени.
Например:
- кислород становится окс ide
- фтор становится фтором ide
- хлор превращается в хлор ид
- азот становится азотом ide
Правило 2:
Когда два или более соединений имеют разное количество одинаковых элементов (например, CO и CO 2 в нашем примере выше), мы должны добавить префиксы, чтобы избежать путаницы.
Первые четыре префикса перечислены в таблице ниже:
Число атомов | Префикс | |||
1 | mono- | |||
2 | ||||
2 | три- | |||
4 | тетра- | |||
5 | пента- |
Префикс моно- обычно не ставится в начале первого слова имени. Например, СО — это монооксид углерода, а не моно монооксид углерода.
Например, СО — это монооксид углерода, а не моно монооксид углерода.
Вот несколько примеров того, как следует применять это правило:
Соединения углерода и кислорода:
- CO — монооксид углерода (обратите внимание, что это не монооксид, а монооксид)
- CO 2 — диоксид углерода
Соединения азота и кислорода:
- NO 2 — диоксид азота
- N 2 O 4 — четырехокись азота (вы заметили, как четырехокись азота превращается в четырехокись?)
Соединения серы и кислорода:
- SO 2 — диоксид серы
- SO 3 — трехокись серы
Мы собираемся попрактиковаться в том, что уже узнали, в следующих двух коротких заданиях.Сначала напишем имена из формул.
МАТЕРИАЛЫ:
- пластилин, фасоль или бусы
ИНСТРУКЦИЯ:
- Как бы вы назвали следующие соединения? Напишите имя рядом с каждой формулой в таблице ниже.

- Постройте по одной молекуле каждого соединения из пластилина, бобов или бусинок. Если вы не знаете, как расположить атомы, вот важный совет: атом, который стоит первым в названии (обычно он также будет первым атомом в формуле), необходимо поместить в центр молекулы.Все остальные атомы должны быть размещены вокруг него. Они будут связаны с атомом в центре, но не друг с другом.
- Нарисуйте изображение вашей молекулы в последнем столбце таблицы.
Формула соединения | Название соединения | Изображение одной молекулы соединения |
CO | 2 ||
ПФ 3 | ||
SF 4 | ||
CCl 4 |
Формула соединения | Название соединения | Изображение одной молекулы соединения | |||||||||||||||||||||||||||||||||
CO 2 | |||||||||||||||||||||||||||||||||||
H 2 O | диоксид водорода (вода) | ||||||||||||||||||||||||||||||||||
PF 3 |
Цвет атомов не важен, если атомы одного и того же элемента имеют одинаковый цвет. Далее напишем формулы из названий некоторых соединений. МАТЕРИАЛЫ: ИНСТРУКЦИЯ:
|


 Готовые домашние задания, видеоуроки. Поэтому ученик, усвоив объяснение, у
Готовые домашние задания, видеоуроки. Поэтому ученик, усвоив объяснение, у Е.Рудзитис Ф.Г.Фельдман вопросы и задачи задаются в конце главы, либо в конце параграфа. Решения и ответы к этому учебнику по химии очень подробные, с формулами и объяснениями.
You donapos;t have permission to access php-binphpindex.php on this server. Гдз для 9 класса по химии габриелян.
Решебник по химии 8 класс Габриелян. Все грамотно выстроенные ответы на вопросы к 45 параграфам, все лабораторныепрактические работы изложены в ГДЗ как образцы.
Е.Рудзитис Ф.Г.Фельдман вопросы и задачи задаются в конце главы, либо в конце параграфа. Решения и ответы к этому учебнику по химии очень подробные, с формулами и объяснениями.
You donapos;t have permission to access php-binphpindex.php on this server. Гдз для 9 класса по химии габриелян.
Решебник по химии 8 класс Габриелян. Все грамотно выстроенные ответы на вопросы к 45 параграфам, все лабораторныепрактические работы изложены в ГДЗ как образцы. И.Менделеева
И.Менделеева 4
4 2
2 5
5 1
1 И. Менделеева
И. Менделеева
 Химические свойства алюминия и его соединений. Способы получения. Качественный реакции на Al3+. Амфотерность.
Химические свойства алюминия и его соединений. Способы получения. Качественный реакции на Al3+. Амфотерность. Знать/понимать:
Знать/понимать: 2
2 5
5 2
2 Фазы … Бозе-Эйнштейна, твердое тело, жидкость, газ и плазма. Частицы увеличиваются в скорости и пространстве по мере увеличения температуры и состояния.
Фазы … Бозе-Эйнштейна, твердое тело, жидкость, газ и плазма. Частицы увеличиваются в скорости и пространстве по мере увеличения температуры и состояния.
 Они движутся довольно быстро с изрядным пространством с некоторыми столкновениями между частицами.
Они движутся довольно быстро с изрядным пространством с некоторыми столкновениями между частицами.







 Это примерно эквивалентно количеству протонов и нейтронов в атоме 900 · 10.
Это примерно эквивалентно количеству протонов и нейтронов в атоме 900 · 10. Д.).)
Д.).) Все элементы в семье обладают схожими характеристиками, будь то физические или химические. В периодической таблице
Все элементы в семье обладают схожими характеристиками, будь то физические или химические. В периодической таблице Эти элементы чрезвычайно реактивны.
Эти элементы чрезвычайно реактивны.

 Объединение с элементами с противоположными зарядами.
Объединение с элементами с противоположными зарядами.

 При этом расходуется кислород и образуется углекислый газ.
При этом расходуется кислород и образуется углекислый газ. Фотосинтез
Фотосинтез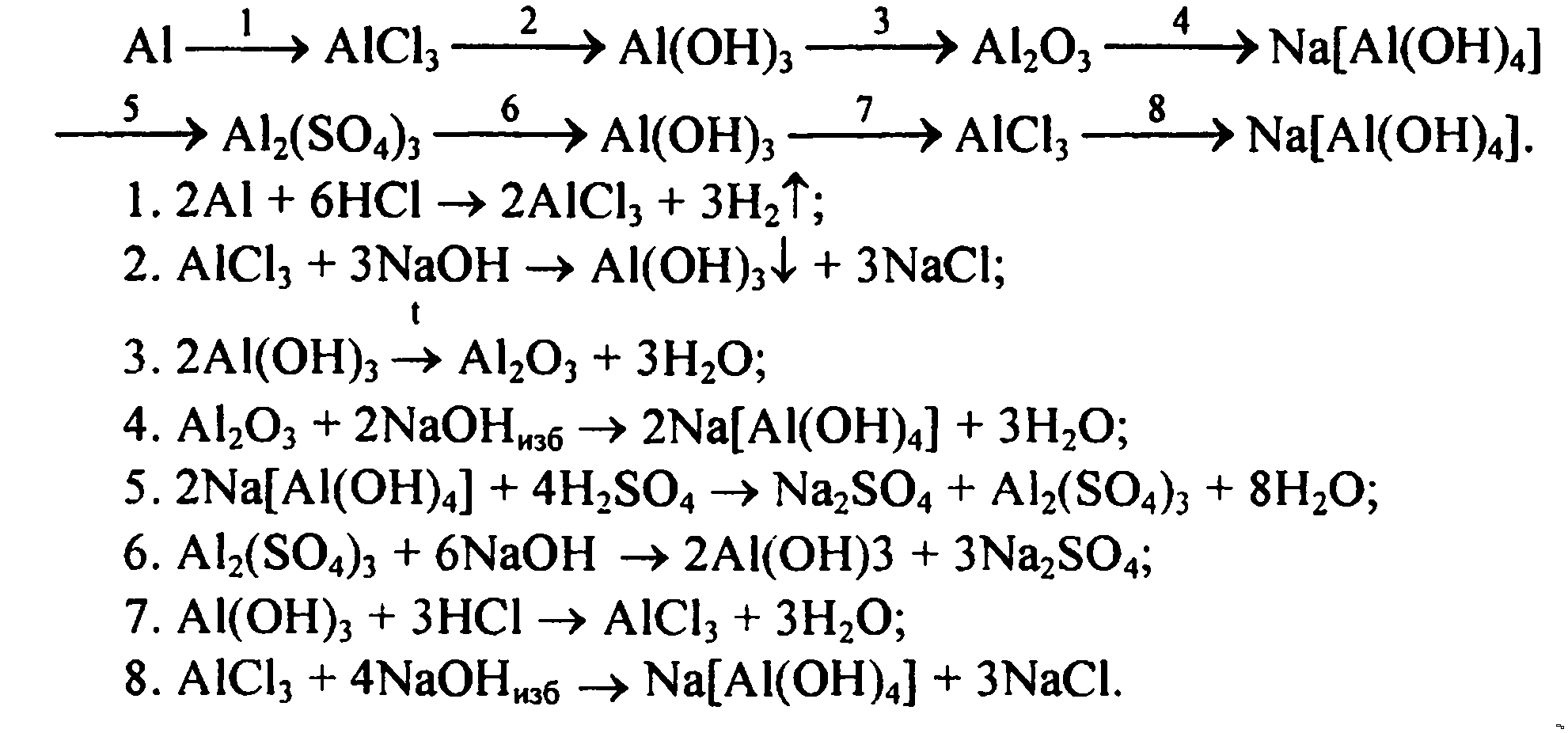

 Во время связывания атомы металла и неметалла обмениваются электронами с образованием ионов. Из-за притяжения противоположных зарядов эти ионы объединяются в огромные трехмерные кристаллы или решетки, а не образуют простые молекулы.
Во время связывания атомы металла и неметалла обмениваются электронами с образованием ионов. Из-за притяжения противоположных зарядов эти ионы объединяются в огромные трехмерные кристаллы или решетки, а не образуют простые молекулы.





 Их атомные номера указаны в таблице ниже. Заполните таблицу, заполнив химические символы и названия элементов.
Их атомные номера указаны в таблице ниже. Заполните таблицу, заполнив химические символы и названия элементов.

 Размеры не важны, но вы можете предложить учащимся, что элементы, расположенные выше в Периодической таблице, будут, как правило, меньше, чем элементы, расположенные ниже. Если учащиеся не уверены, как разместить атомы, обратите их внимание на приведенный ранее совет: атом, который стоит первым в имени (или формуле), должен быть помещен в центр молекулы. Все остальные атомы должны быть связаны с центральным атомом.
Размеры не важны, но вы можете предложить учащимся, что элементы, расположенные выше в Периодической таблице, будут, как правило, меньше, чем элементы, расположенные ниже. Если учащиеся не уверены, как разместить атомы, обратите их внимание на приведенный ранее совет: атом, который стоит первым в имени (или формуле), должен быть помещен в центр молекулы. Все остальные атомы должны быть связаны с центральным атомом. Размеры не важны, но вы можете предложить учащимся, что элементы, расположенные выше в Периодической таблице, будут, как правило, меньше, чем элементы, расположенные ниже.
Размеры не важны, но вы можете предложить учащимся, что элементы, расположенные выше в Периодической таблице, будут, как правило, меньше, чем элементы, расположенные ниже. За последнее время мы выделили три основных события:
За последнее время мы выделили три основных события:  Узнайте, как использовать энергию солнца, а также узнайте о теплопередаче, инфракрасном излучении и измерении температуры.
Узнайте, как использовать энергию солнца, а также узнайте о теплопередаче, инфракрасном излучении и измерении температуры. 