Тема урока химии в 9 классе Подгруппа кислорода.Сера: строение атома, свойства,применение.
Технологическая карта урока химии в 9 классе
« Подгруппа кислорода. Сера атома, свойства и применение серы ».
Тип урока: урок изучения и первичного закрепления полученных знаний.
Цель урока: создать условия для изучения строения атома серы, ее физических и химических свойств, опираясь на алгоритмы освоения материала при изучении химических элементов.
Задачи урока:
1) конкретизировать знания учащихся о строении атома серы и ковалентной неполярной связи на примере строения атома и молекулы серы;
2) рассмотреть физические и химические свойства серы в свете ОВР;
3) показать значение серы как биогенного элемента, познакомить учащихся с нахождением его в природе;
4) сформировать понятие « аллотропные видоизменения серы», научить сравнивать их свойства, объяснять результаты этого сравнения
4) расширить знания учащихся о значении серы в природе и деятельности человека.
Планируемые результаты:
Познавательные УУД
1) поиск и отбор необходимой информации ;
2) овладение умением оценивать информацию, выделять в ней главное;
3)систематизация информации;
4) формулирование проблемы.
Коммуникативные УУД
1)умение работать в группе, обмениваться с одноклассниками информацией;
2)адекватное использование речевых средств для дискуссии и аргументации своей позиции;
3)сравнение разных точек зрения, аргументирование своей точки зрения, отстаивание своей позиции.
Регулятивные УУД
1) умение организовать выполнение задания учителя;
2) составление плана работы с учебником;
3)выполнение задания в соответствии с поставленной целью, нахождение ответов на поставленные вопросы;
4) развитие навыков самооценки и самоанализа.
Личностные УУД
1) осознание ответственного отношения к природе, необходимости защиты окружающей среды;
2) проявление любознательности и интереса к изучению природы методами естественных наук (наблюдение, эксперимент, измерение, моделирование и т. д.):
д.):
3) доброжелательное отношение к другому человеку;
4) формирование потребности в справедливом оценивании своей работы и работы одноклассников.
Формы организации работы
Фронтальная, индивидуальная, парная, беседа.
ИКТ
Компьютерная презентация
Оборудование
Учебник, рабочая тетрадь, таблицы, цветная бумага, клей, доска, мел.
Этапы урока
1.Организационный момент (самоопределение деятельности)
2.Актуализация знаний. Мотивационно – целевой этап урока.
3.Постановка проблемы.
4.Открытие новых знаний
5.Первичное закрепление знаний. Применение серы и ее соединений.
6.Применение нового знания.
7.Рефлексия учебной деятельности.
8. Домашнее задание.
Сера — химические и физические свойства
Сера – важнейший элемент в современной промышленности.
Особые свойства серы (антисептические и антипаразитарные) делают её незаменимым компонентном многих лекарственных препаратов.
…
Вконтакте
Google+
Мой мир
Что такое сера и как она выглядит
Сера – химический элемент, находящийся по 16 номером в таблице Д. И. Менделеева и обозначающийся буквой S (по первой букве латинского названия Sulphur).
Молярная масса серы равна 32, 065 г/моль, атомная масса — 32,066 а. е. м. Это вещество может быть как ярко-желтого, так и коричневого цвета.
Различают порошкообразную (молотую) и жидкую серу.
Характеристика серы
При взаимодействии с кислородом и галогенами, т. е. с элементами с большей электроотрицательностью, сера может проявлять положительную валентность, например, +4 и +6.
Физические свойства
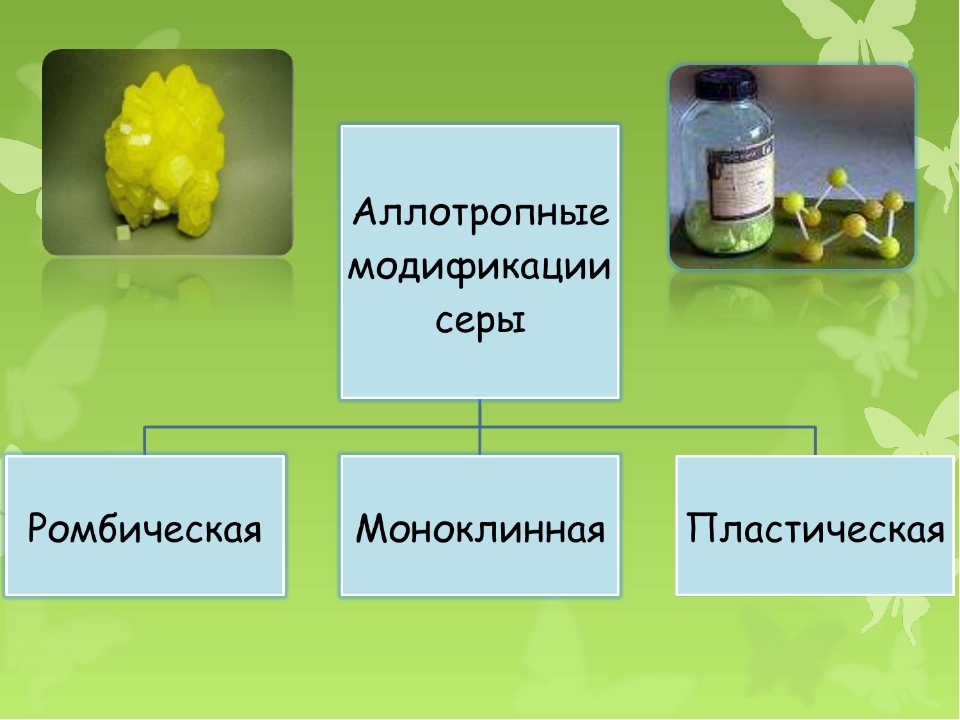
Как простое вещество, сера образует несколько аллотропных модификаций:
- Ромбическая – то, что мы привыкли называть обычной серой. Она устойчива при обычных условиях, встречается чаще всего недалеко от действующих или потухших вулканов.
- Пластическая – представляет собой замкнутые или открытые цепочки соединяющейся между собой серы, получаемые обычно при её сжигании. Имеет самую большую молекулярную массу среди всех разновидностей серы.
- Моноклинная (S8) – соединение серы, которое в молекулярном виде представляет собой восьмиугольник с атомами серы в вершинах. Выглядит как множество цилиндров, похожих на иглы. При комнатной температуре быстро превращается в ромбическую.
Приблизительная молярная масса одной молекулы моноклинной серы – 256 г/моль. В России сера, в основном, бывает только двух товарных видов: гранулированная и комовая.
В России сера, в основном, бывает только двух товарных видов: гранулированная и комовая.
Сера – легкоплавкое вещество, температура плавления около 120 градусов. Нерастворима в воде и не намокает про соприкосновении с ней.
Не обладает электролитическими свойствами и теплопроводностью. Плотность серы — 2,070 г/см³.
Химические свойства
В соединениях с водородом образует серную (химическая формула h3SO4) со степенью окисления серы +6 и сернистую (h3SO3) со степенью окисления +4 кислоты, которые дают соответственно сульфаты и сульфиты.
В нормальных условиях реагируют с активными металлами и ртутью, образуя сульфиды:
Hg + S = HgS
Na + S = Na2S
Также образует сульфиды при нагревании с большинством неактивных металлов, кроме платины и золота:
Fe + S (t) = Fe2S3
Проявляет восстановительные свойства в реакции с кислородом при нагревании, образуя кислотный оксид:
S + O2 = SO2
В реакциях с водородом образует сернистый газ, летучее бесцветное вещество с неприятным запахом тухлых яиц:
h3 + S = h3S
Области применения
Широко применяется в медицине, обладает антисептическими и антипаразитарными свойствами, используется для дезинфекции помещений и избавления от паразитов.
В низких концентрациях способствует формированию новых клеток эпидермиса, из-за чего её часто используют для лечения воспалений. Помимо этого сера имеет слабительное действие, а при приеме внутрь оказывает отхаркивающий эффект.
Благодаря легковоспламеняемости и горючим свойствам, сера хорошо горит. Например, самое простое, где можно взять серу, это открыть полный спичечный коробок — сера входит в состав спичечной головки.
При трении головка касается шероховатой поверхности (например, наждачной бумаги), и спичка легко загорается.
Серная кислота (h3SO4) – важнейший продукт химической промышленности, используется в качестве электролита в свинцовых аккумуляторах, применяется для получения соляной, азотной, борной и других кислот.
Серная кислота является необходимым сульфирующим средством при получении многих лекарственных веществ и красок.
Сероводород (h3S) используется для выделения чистой серы, сульфитов и серной кислоты из растворов.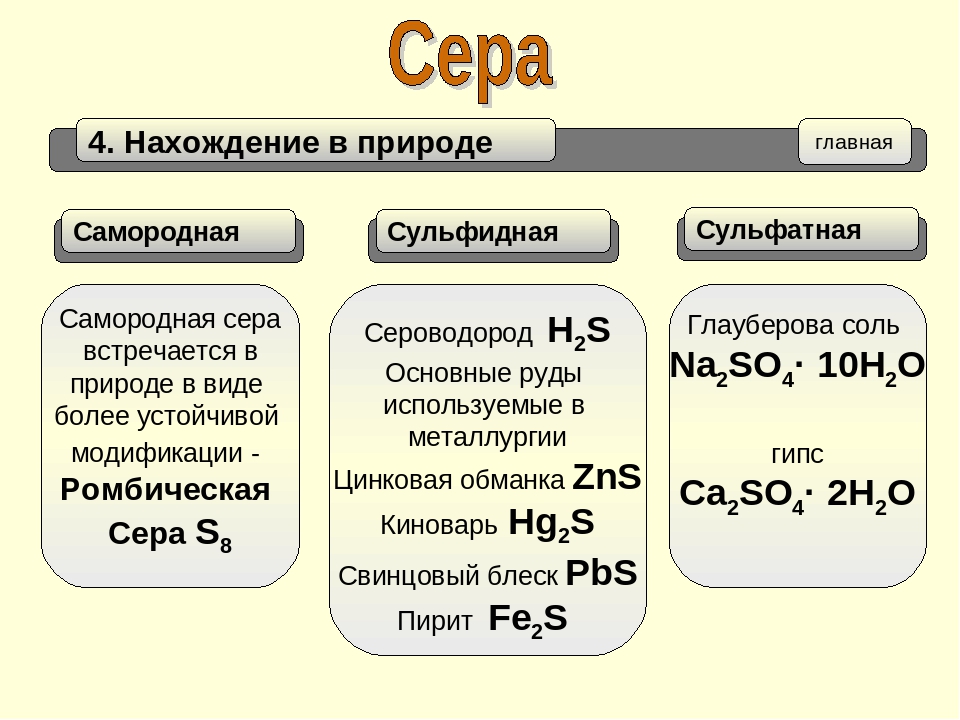
Оксиды серы (SO2 и SO3) находят применения в производстве серной и азотной кислот, а также используются в бытовой химии: входят в состав отбеливателей, дезинфицирующих средств.
Нахождение серы в природе
Чаще всего в природе находится самородная сера (S), однако встречаются и её соединения с другими элементами: FeS2 (сульфат железа (II), пирит), ZnS (сульфат цинка, цинковая обманка), CaSO4*2h3O (гипс), PbS (сульфат свинца, свинцовый блеск) и другие.
Биологическая роль серы
Сера содержится в живых организмах, особенно много её в белках ногтей, волос, копыт. Общая масса серы в человеческом организме составляет около 130 грамм. Также это вещество встречается в составе некоторых витаминов и гормонов.
Сера обладает уникальными химическими и физическими свойствами, благодаря чему является важнейшим компонентом промышленности и незаменима при создании лекарственных препаратов.
youtube.com/embed/fkzmef2_RxY» frameborder=»0″ allowfullscreen=»allowfullscreen»/>11 класс. Химия. Водород. Галогены.Кислород.Сера — Кислород. Сера
Комментарии преподавателя
Получение и свойства кислорода и озона
Химические свойства кислорода
Кислород – это самый распространённый на Земле химический элемент. На его долю приходится чуть меньше половины массы твердой Земной коры и более 1,5 тысяч соединений Земной коры содержат кислород. Его очень много в воде, около 89%, в воздухе – около 20% по массе.
В соединениях кислород способен проявлять все степени окисления от -2 до +2.См. рис. 1. В подавляющем большинстве соединений кислород проявляет степень окисления -2. Это используется даже при определении степени окисления других элементов.
Аллотропия.
Кислород образует 2 простых вещества – кислород О2 и 
Кислород – простое вещество
Кислород – это вещество молекулярного строения, состоит из двух атомов, связь между которыми ковалентная неполярная. Это бесцветный газ, без запаха, малорастворимый в воде.
Химическая активность кислорода высока. Он является сильным окислителем. Он реагирует со всеми простыми веществами, кроме инертных газов, галогенов и благородных металлов.
1. Взаимодействие с металлами
2Zn + O2 =2ZnO
В зависимости от температуры, степени дисперсности железа, он может образовывать с ним несколько оксидов.
2Fe + O2 = 2FeO
3Fe +2O2 = Fe3O4
4Fe + 3O2 = 2Fe2O3
2. Взаимодействие с неметаллами
O2+ C = CO2
5O2 + 4P = 2P2O5
O2+ S = SO2
C3H8 +5O2 = 3CO2 +4h3OПолучение кислорода.
В промышленности кислород получают перегонкой жидкого воздуха. Этот метод основан на различие температур кипения азота и кислорода – основных составляющих воздуха.
И в промышленности, и в лаборатории можно получать кислород электролизом воды.
2h3O = Н2↑ + О2↑
Получают кислород при термическом разложении кислородсодержащих веществ.
2h3O2 Н2O + О2↑
2KMnO4 K2MnO4 + MnO2 + О2↑
2KClO3 KCl + 3О2↑
2KNO3 KNO2 + О2↑
Сера и её соединения
Сера встречается в природе в виде простого вещества и входит в состав многих минералов-сульфидов. Из них наиболее распространенные это: пирит FeS2, халькопирит FeCuS2, киноварь HgS, мирабилит Na2SO4·10h3O, гипс CaSO4·2h3O. См. рис. 3.
Рис. 3. Распространенность серы в природе
Аллотропные модификации серы
Наиболее устойчивы ромбическая и моноклинная модификации серы. Это кристаллические вещества, которые различаются формой кристаллов и некоторыми физическими свойствами. Ромбическая сера имеет лимонно-желтую окраску, Тпл.= 112,80С. Моноклинная сера окрашена в темно-желтый цвет. Тпл.= 119,30С. Кристаллы моноклинной и ромбической серы построены из молекул S8. Рис. 4.
Ромбическая сера имеет лимонно-желтую окраску, Тпл.= 112,80С. Моноклинная сера окрашена в темно-желтый цвет. Тпл.= 119,30С. Кристаллы моноклинной и ромбической серы построены из молекул S8. Рис. 4.
Рис. 4
При быстром охлаждении расплавленной серы образуется еще одна аллотропная модификация серы – это пластическая сера. Рис. 5. Она состоит из длинных молекул Sx (число х равно нескольким тысячам).
Рис. 5
Химические свойства серы
Для серы характерна окислительно-восстановительная двойственность.
1. Сера как типичный неметалл взаимодействует с металлами, образуя сульфиды.
Na + S = Na2S
Fe + S = FeS
2. Взаимодействует с неметаллами.
S + O2 = SO2
h3 + S = h3S↑.
Сероводород имеет характерный запах, который можно ощутить при разложении белка, например, при протухании яиц. Для сероводорода характерны восстановительные свойства обусловленные наличием S2-.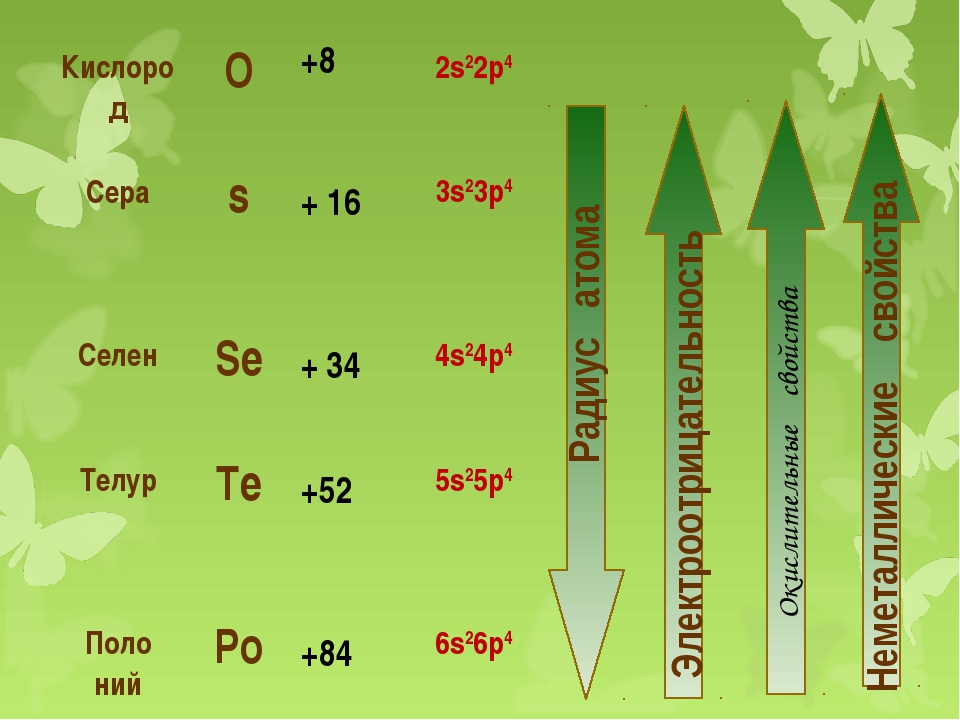 Раствор сероводорода в воде называется сероводородной кислотой, которая относится к слабым кислотам. Образует 2 ряда солей: кислые и средние.
Раствор сероводорода в воде называется сероводородной кислотой, которая относится к слабым кислотам. Образует 2 ряда солей: кислые и средние.
3. Сера взаимодействует с кислотами, являющимися сильными окислителями.
S + 4HNO3 = SO2 + 4NO2 + 2h3O
S + 2HSO4 = 3SO2 + 2h3O
4. Взаимодействует со щелочами.
3S + 6NaOH = 2NaS+ Na2SO3 + 3h3O
Оксид серы (
При обычных условиях SO2 – бесцветный газ с удушливым запахом, хорошо растворим в воде. Раствор называется сернистой кислотой, которая является нестабильной. Для SO2 характерна окислительно-восстановительная двойственность.
SO2 + 2h3S = 3S + 2h3О (SО2 – окислитель)
2SO2 + О2 = 2SО3 (SО2 – восстановитель)
В промышленности сернистый газ получают при обжиге пирита.
4FeS2 + 11О2 = 2Fe2О3 + 8SO2↑
В лаборатории сернистый газ получают действием сильных кислот на сульфиды.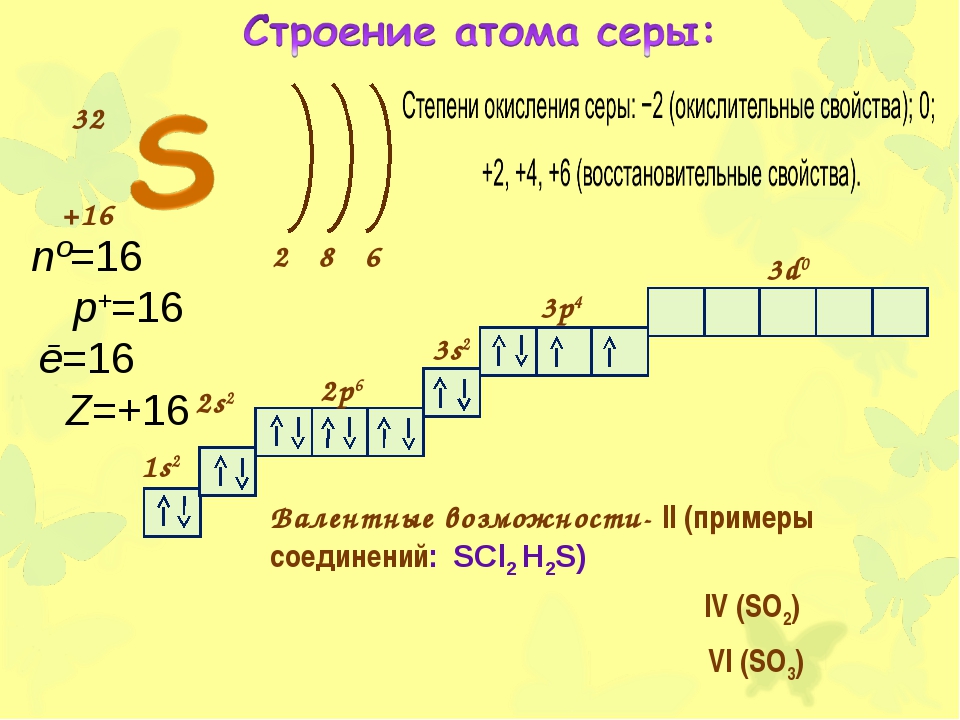
Na2SO3 + 2h3SO4 = 2NaHSO4 + SO2↑ +h3O
Озон
Озон образуется из кислорода под действием электрического разряда или ультрафиолетового излучения.
3О2⇆ 2О3
Молекула озона неустойчива и самопроизвольно распадается.
Озон – это очень сильный окислитель. Он окисляет как простые так и сложные вещества.
2Fe +3O3 = Fe2O3 + 3О2
О3 + Н2 = Н2О + О2
PbS + 2O3 = PbSO4 + O2
В промышленности озон получают из кислорода или из воздуха в озонаторах под действием электрического разряда.
Чтобы определить озон, используется реакция с иодидом калия.
2KI + h3O + O3 →2KOH + I2 + O2
Озоновый слой.
Озон образует озоновый слой, защищающий нашу планету от жесткого солнечного излучения. Наибольшая концентрация озона в атмосфере наблюдается на высоте около 20 км.
Рис. 2
Озон все чаще используется при обеззараживании питьевой воды. Этот процесс дороже хлорирования, но при озонировании не образуется токсичных хлоробразующих соединений, которые в небольших количествах присутствуют при хлорировании питьевой воды.
Этот процесс дороже хлорирования, но при озонировании не образуется токсичных хлоробразующих соединений, которые в небольших количествах присутствуют при хлорировании питьевой воды.
Перекись водорода.
Перекись водорода Н2О2 – это простейший представитель пероксидов. Это неустойчивое соединение и легко разлагается. В нашем организме есть фермент каталаз, который способствует разложению перекисных соединений. Пероксидная группа –О-О- входит в состав многих соединений, которые называются пероксидами. К ним относятся пероксиды металлов: Na2O2, BaO2. Кислоты, содержащие пероксидную группу называются пероксокислотами или надкислотами.
Химические свойства Н2О2.
1. Восстановительные свойства.
h3O2 + Ag2O = 2Ag + O2 + h3O
2. Окислительные свойства.
KNO2 + h3O2 = KNO3 + h3O
PbS + 4h3O2 = PbSO4 + 4h3O. Эта реакция используется при реставрации картин. Поскольку применявшаяся ранее краска на основе свинца Pb3(ОН)2(СО3)2 ( свинцовые белила)
при взаимодействии с сероводородом, в незначительных количествах содержащимся в воздухе, образует черный сульфид свинца PbS. Из-за него картины темнеют.
Из-за него картины темнеют.
Pb3(ОН)2(СО3)2 + 3h3S → 3PbS + 2CO2 + 4h3O
Осторожной обработкой перекисью водорода, их можно восстановить.
В промышленности пероксид водорода получают окислением изопропилового спирта или электролизом серной кислоты, в ходе которого образуется надсерная кислота, которая при разложении водой образует пероксид водорода и серную кислоту.
Серная кислота
В серной кислоте сера находится в высшей степени окисления S+6. Бесцветная маслянистая жидкость, неограниченно смешивающаяся с водой. Эта кислота очень гигроскопичная.
Химические свойства серной кислоты во многом зависят от её концентрации.
Разбавленная серная кислота взаимодействует с металлами, при этом выделяется водород. Металлы, стоящие в электрохимическом ряду напряжений после водорода, с разбавленной серной кислотой не взаимодействуют.
Zn + h3SO4 = ZnSO4 + h3↑
Концентрированная серная кислота является сильным окислителем за счет S+6. Она окисляет многие металлы. Продуктами восстановления кислоты обычно являются SO2,H2S, S (h3S и S образуются в реакциях кислоты с активными металлами Mg, Ca, Na, K и др.)
Cu + 2h3SO4 = CuSO4 + SO2↑ + 2h3O
Mg + 2h3SO4 = MgSO4 + SO2↑ + 2h3O
4Mg + 5h3SO4 = 4MgSO4 + h3S↑ + 4h3O
Серная кислота высокой концентрации не взаимодействует с железом в результате пассивации металла. Явление пассивации связано с образованием на поверхности металла прочной пленки, состоящей из оксидов или других соединений. Она препятствует контакту металла с кислотой. Благодаря пассивации, можно хранить и перевозить концентрированную серную кислоту в стальной таре. Концентрированная серная кислота пассивирует также алюминий, никель, хром, титан.
Концентрированная серная кислота может окислять и неметаллы.
S + 2h3SO4 = SO2↑ + 2h3O
C + 2h3SO4 = CO2↑ + SO2↑ + 2h3O
Концентрированная серная кислота может окислять сложные вещества.
2KBr + 2h3SO4 = Br2 + SO2↑ +K2SO4 + 2h3O
Контактный способ получения серной кислоты.
I стадия: 4FeS2 + 11О2 = 2Fe2О3 + 8SO2↑
II стадия: 2SO2 + О22SО3
III стадия: SО3 + h3O = h3SO4
Нитрозный способ получения серной кислоты
2NO + O2 ⇆ 2NO2
2SO2+ NO2 ⇆ 2SO3 + NO, остальные стадии такие же, как в контактном способе.
Сульфаты – соли серной кислоты
Сульфаты – это ионные соединения, в узлах кристаллической решетки которых находятся катионы металлов и сульфат-анионы. Обычно это бесцветные кристаллы, но некоторым придают окраску ионы металлов. Медный купорос – это ярко-синие кристаллы, железный купорос – кристаллы зеленого цвета. Рис. 6.
Рис. 6.
Рис. 6. Сульфаты – соли серной кислоты
Качественная реакция на сульфаты – это реакция с растворимыми солями бария.
K2SO4+ BaCl2 = BaSO4↓ + 2KCl
5. Гексафторид серы, титрование
Гексафторид серы SF6 – при обычных условиях газ, несмотря на высокую молярную массу. Он в 5 раз тяжелее воздуха.
Рис. 7
Молекула в целом химически инертна, т. к. реагенты не могут подойти к атому серы, окруженной атомами фтора. При вдыхании гексафторида серы голос становится низким басом, а не писклявым, как в ситуации с вдыханием гелия. Гексафторид серы SF6 применяют в системах пожаротушения из-за его химической инертности.
Сероводород. Кислоты серы. Титрование
При образовании химических соединений атомы серы склонны к катенации (с латинского – цепеобразование, сцепление) Например, сероводород Н-(S)n-H – это родоначальник серных кислот, содержащих до 8 атомов серы в цепи. Серосодержащих кислот намного больше, чем вам известно по школьной программе. Явлением катенации обусловлена вулканизация каучука и действие некоторых антиоксидантных систем организма. В серных кислотах может происходить замена атома кислорода на атом серы. Если заменить атом кислорода в серной кислоте, то получается тиосерная кислота h3S2O3. Она образует ряд солей, которые называются тиосульфаты. Тиосульфаты используются для количественного определения йода методом титрования.
Серосодержащих кислот намного больше, чем вам известно по школьной программе. Явлением катенации обусловлена вулканизация каучука и действие некоторых антиоксидантных систем организма. В серных кислотах может происходить замена атома кислорода на атом серы. Если заменить атом кислорода в серной кислоте, то получается тиосерная кислота h3S2O3. Она образует ряд солей, которые называются тиосульфаты. Тиосульфаты используются для количественного определения йода методом титрования.
Рис. 8
Титрование – это метод когда концентрацию, какого либо вещества, в раствор которого добавлен специальный индикатор, определяют медленным добавлением другого вещества с известной концентрацией. Этот метод применяется часто, так как позволяет быстро и точно определять концентрации веществ.
ИСТОЧНИКИ
источник видео — https://www.youtube.com/watch?v=kiPQyS-GctY
https://www.youtube.com/watch?v=2h3Vo6pLrfY
источник презентации — http://ppt4web. ru/khimija/soedinenija-sery0.html
ru/khimija/soedinenija-sery0.html
Химия кислорода и серы
Химия кислорода и сера
Химия Кислород
Кислород — самый распространенный элемент на этой планете. В земная кора содержит 46,6% кислорода по весу, океаны — 86% кислород по весу, а атмосфера составляет 21% кислорода по объему. В название Oxygen происходит от греческого слова oxys , «кислота» и геннан «с образованием или генерировать.Таким образом, кислород буквально означает «кислота». бывшее «. Это имя было введено Лавуазье, который заметил это соединения, богатые кислородом, такие как SO 2 и P 4 O 10 , растворяются в воде с образованием кислот.
Электронная конфигурация атома кислорода [He] 2 с 2 2 p 4 предполагает, что нейтральные атомы кислорода могут
получить октет валентных электронов, разделив две пары
электроны с образованием двойной связи O = O, как показано на рисунке
ниже.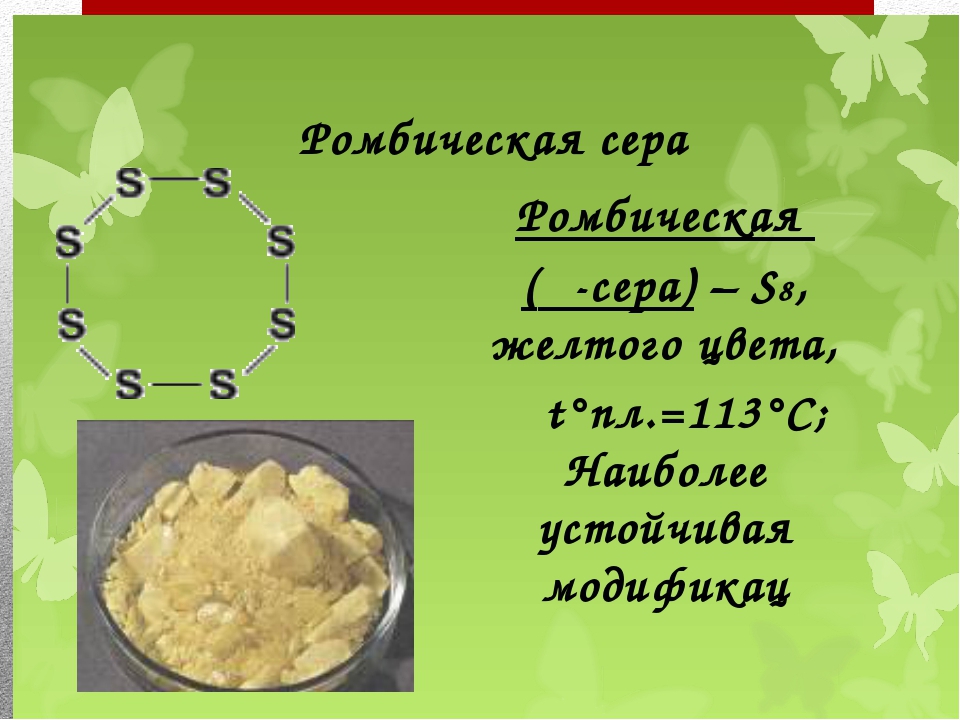
Согласно этой структуре Льюиса, все электроны в O 2 молекулы спарены. Следовательно, соединение должно быть диамагнитным он должен отталкиваться магнитное поле. Экспериментально установлено, что O 2 парамагнитен это притягивается к магнитному полю. Это можно объяснить, если предположить что есть два неспаренных электрона в * разрыхляющей молекулярные орбитали молекулы O 2 .
| На этой фотографии видно, что жидкость O 2 настолько сильно притягивается к магнитному полю, что преодолеть разрыв между полюсами подковообразного магнита. |
При температурах ниже -183 o C, O 2 конденсируется с образованием жидкости характерного голубого цвета
который возникает в результате поглощения света с длиной волны
630 нм.Это поглощение не наблюдается в газовой фазе и
относительно слабый даже в жидкости, потому что для этого требуется три
тела
сталкиваются две молекулы O 2 и фотон
одновременно, что является очень редким явлением даже в
жидкая фаза.
Химия Озон
Молекула O 2 — не единственная элементарная форма кислород. При наличии молнии или другого источника искра, O 2 молекул диссоциируют с образованием атомов кислорода.
| искра | |||
| O 2 ( г ) | 2 O ( г ) |
Эти атомы O могут реагировать с молекулами O 2 с образованием озон, O 3 ,
| O 2 ( г ) | + | O ( г ) | O 3 ( г ) |
, структура Льюиса которого показана на рисунке
ниже.
Кислород (O 2 ) и озон (O 3 ) являются примерами. из аллотропов (от греческого значения «в другой способ «). Аллотропы по определению разные формы элемента. Потому что у них разные структуры, аллотропы обладают разными химическими и физическими свойствами (см. Таблица ниже).
Свойства аллотропов кислорода
| Кислород (O 2 ) | Озон (O 3 ) | |||
| Точка плавления | -218.75 o С | -192,5 o С | ||
| Точка кипения | -182.96 o С | -110,5 o С | ||
| Плотность (при 20 o C) | 1,331 г / л | 1. 998 г / л 998 г / л | ||
| Порядок облигаций O-O | 2 | 1,5 | ||
| Длина соединения O-O | 0,1207 нм | 0,1278 нм |
Озон — нестабильное соединение с резким резким запахом, медленно разлагается до кислорода.
| 3 O 3 ( г ) | 3 O 2 ( г ) |
При низких концентрациях озон может быть относительно приятным.(The характерный чистый запах, связанный с летними грозами, из-за образования небольших количеств О 3 .)
Воздействие O 3 при более высоких концентрациях приводит к
кашель, учащенное сердцебиение, боль в груди и общие
телесная боль. При концентрациях выше 1 ppm озон токсичен.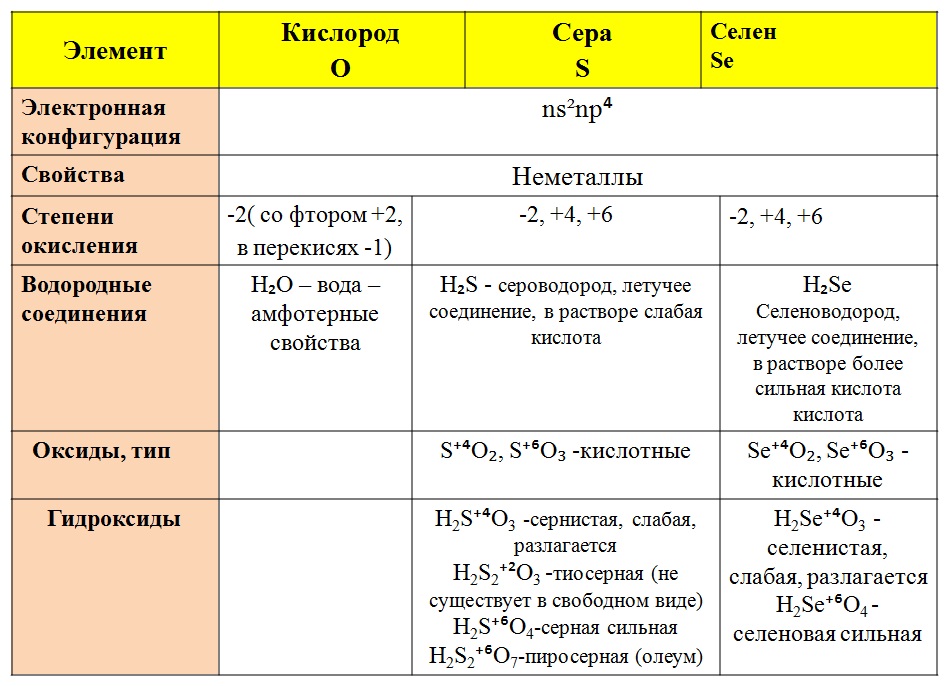
Одним из характерных свойств озона является его способность поглощать излучение в ультрафиолетовой части спектра ( > 300 нм), тем самым обеспечивая фильтр, защищающий нас от воздействие высокоэнергетического ультрафиолетового излучения солнца.Мы сможем понять важность этого фильтра, если подумаем о что происходит, когда наша кожа поглощает солнечное излучение.
Электромагнитное излучение в инфракрасном, видимом и низкоэнергетические участки ультрафиолетового спектра (<300 нм) несет достаточно энергии, чтобы возбудить электрон в молекуле в орбиталь с более высокой энергией. Этот электрон в конечном итоге возвращается в орбитали, с которой он был возбужден, и энергия передается окружающие ткани в виде тепла.Любой, у кого есть пострадавшие от солнечных ожогов могут оценить болезненные последствия чрезмерного количества этого излучения.
Излучение в высокоэнергетической части ультрафиолета
спектр (300 нм) при поглощении оказывает другое действие. Это излучение несет достаточно энергии для ионизации атомов или
молекулы. Ионы, образующиеся в этих реакциях, имеют нечетное число
электронов и чрезвычайно реактивны. Они могут вызвать постоянное
повреждают клеточную ткань и вызывают процессы, которые в конечном итоге
привести к раку кожи.Относительно небольшое количество этого излучения
поэтому может оказывать сильное воздействие на живые ткани.
Это излучение несет достаточно энергии для ионизации атомов или
молекулы. Ионы, образующиеся в этих реакциях, имеют нечетное число
электронов и чрезвычайно реактивны. Они могут вызвать постоянное
повреждают клеточную ткань и вызывают процессы, которые в конечном итоге
привести к раку кожи.Относительно небольшое количество этого излучения
поэтому может оказывать сильное воздействие на живые ткани.
В 1974 г. Молина и Роуленд указали, что хлорфторуглероды, такие как CFCl 3 и CF 2 Cl 2 , которые использовались как хладагенты и как пропелленты в аэрозолях банки начали накапливаться в атмосфере. в стратосфера, на высоте от 10 до 50 км над земной поверхности, хлорфторуглероды разлагаются с образованием атомов Cl и оксиды хлора, такие как ClO, когда они поглощают солнечный свет.Атомы Cl и молекулы ClO имеют нечетное количество электронов, как показано на рисунок ниже.
В результате эти вещества необычно реакционноспособны. в
атмосфере, они реагируют с озоном или с атомами кислорода, которые
необходимы для образования озона.
в
атмосфере, они реагируют с озоном или с атомами кислорода, которые
необходимы для образования озона.
| Класс | + | О 3 | ClO | + | О 2 | |
| ClO | + | O | Класс | + | О 2 |
Молина и Роуленд предположили, что эти вещества могут
в конечном итоге разрушить озоновый щит в стратосфере, с
опасные последствия для биологических систем, которые могут быть
подвергается повышенному воздействию ультрафиолетового излучения высокой энергии.
Кислород как Окислитель
Фтор — единственный элемент, который более электроотрицателен, чем кислород. В результате кислород приобретает электроны практически во всем химические реакции. Каждая молекула O 2 должна получить четыре электронов, чтобы удовлетворить октеты двух атомов кислорода без обмен электронами, как показано на рисунке ниже.
Следовательно, кислород окисляет металлы с образованием солей, в которых атомы кислорода формально присутствуют в виде ионов O 2-.Ржавчина образуется, например, когда железо реагирует с кислородом в присутствии воды с образованием соли, формально содержащей Fe 3+ и ионов O 2-, в среднем три молекулы воды координирована с каждым из ионов Fe 3+ в этом твердом теле.
| H 2 O | |||||
| 4 Fe ( с ) | + | 3 O 2 ( г ) | 2 Fe 2 O 3 ( с ) 3 H 2 O |
Кислород также окисляет неметаллы, такие как углерод, с образованием
ковалентные соединения, в которых кислород формально окисляется
количество -2.
| C ( с ) | + | O 2 ( г ) | CO 2 ( г ) |
Кислород — прекрасный пример окислителя потому что он увеличивает степень окисления практически любого вещества с которой он реагирует. В ходе своих реакций кислород уменьшено. Таким образом, вещества, с которыми он вступает в реакцию, уменьшают агенты .
Пероксиды
Требуется четыре электрона, чтобы восстановить молекулу O 2 до пара ионов O 2-. Если реакция прекращается после O 2 молекула получила только два электрона, O 2 2- ион, показанный на рисунке ниже.
Этот ион имеет на два электрона больше, чем нейтральный O 2 молекула, что означает, что атомы кислорода должны иметь только одну
одна пара связывающих электронов для достижения октета валентности
электроны. Ион O 2 2- называется пероксидом ион, потому что соединения, содержащие этот ион, необычно богаты
кислород. Это не просто оксиды, это (гипер) пероксиды.
Ион O 2 2- называется пероксидом ион, потому что соединения, содержащие этот ион, необычно богаты
кислород. Это не просто оксиды, это (гипер) пероксиды.
Самый простой способ приготовить перекись — провести реакцию натрия или металлический барий с кислородом.
| 2 Na ( с ) | + | O 2 ( г ) | Na 2 O 2 ( с ) | ||
| Ba ( с ) | + | O 2 ( г ) | BaO 2 ( с ) |
Когда эти пероксиды вступают в реакцию с сильной кислотой, перекись водорода (H 2 O 2 ).
| BaO 2 ( с ) | + | 2 часа + ( водн. ) ) | Ba 2+ ( водн. ) | + | H 2 O 2 ( водн. ) |
Структура Льюиса перекиси водорода содержит O-O одинарная связь, как показано на рисунке ниже.
Теория VSEPR предсказывает, что геометрия вокруг каждого кислорода атом в H 2 O 2 должен быть изогнут. Но это теория не может предсказать, должны ли четыре атома находиться в в той же плоскости или следует визуализировать молекулу лежащей в двух пересекающихся плоскостях. Экспериментально определенная Структура H 2 O 2 показана на рисунке ниже.
Валентный угол H-O-O в этой молекуле лишь немного больше
чем угол между парой соседних 2 p атомных
орбитали на атоме кислорода, а угол между плоскостями
образующие молекулу немного больше тетраэдрической
угол.
Степень окисления атомов кислорода в перекиси водорода равно -1. H 2 O 2 , следовательно, может действовать как окислитель и захватить еще два электрона, чтобы сформировать пару гидроксид-ионы, в которых кислород имеет степень окисления -2.
| H 2 O 2 | + | 2 e — | 2 ОН — |
Или он может действовать как восстановитель и потерять пару электронов с образованием молекулы O 2 .
| H 2 O 2 | О 2 | + | 2 часа + | + | 2 e — |
Реакции, в которых соединение одновременно подвергается обоим
окисление и восстановление называются диспропорционированием Реакция . Продукты диспропорционирования H 2 O 2 кислород и вода.
Продукты диспропорционирования H 2 O 2 кислород и вода.
| 2 H 2 O 2 ( водн. ) | O 2 ( г ) | + | 2 H 2 O ( л ) |
Диспропорционирование H 2 O 2 является экзотермическая реакция.
| 2 H 2 O 2 ( водн. ) | O 2 ( г ) | + | 2 H 2 O ( л ) | H o = -94.6 кДж / моль H 2 O |
Эта реакция является относительно медленной, однако в отсутствие
катализатор, например пыль или металлическая поверхность. Основные виды использования
H 2 O 2 вращаются вокруг его окислительной способности.
Используется в разбавленных (3%) растворах как дезинфицирующее средство. В большем
концентрированные растворы (30%), используется как отбеливающий агент для
волосы, мех, кожа или древесная масса, используемая для изготовления бумаги.В очень
концентрированные растворы, H 2 O 2 было использовано
в качестве ракетного топлива из-за легкости, с которой оно разлагается на
дать О 2 .
Основные виды использования
H 2 O 2 вращаются вокруг его окислительной способности.
Используется в разбавленных (3%) растворах как дезинфицирующее средство. В большем
концентрированные растворы (30%), используется как отбеливающий агент для
волосы, мех, кожа или древесная масса, используемая для изготовления бумаги.В очень
концентрированные растворы, H 2 O 2 было использовано
в качестве ракетного топлива из-за легкости, с которой оно разлагается на
дать О 2 .
Методы Подготовка O 2
Небольшие количества газа O 2 можно приготовить в количество способов.
1. Разложив разбавленный раствор перекиси водорода с помощью пыль или металлическая поверхность в качестве катализатора.
2 H 2 O 2 ( водн. ) ) | O 2 ( г ) | + | 2 H 2 O ( л ) |
2. Путем реакции перекиси водорода с сильным окислителем. агент, такой как перманганат-ион, MnO 4 — .
| 5 H 2 O 2 ( водн. ) | + | 2 MnO 4 — ( водн. ) | + | 6 часов + ( водн. ) | 2 Mn 2+ ( водн. ) | + | 5 O 2 ( г ) | + | 8 H 2 O ( л ) |
3. Путем пропускания электрического тока через воду.
Путем пропускания электрического тока через воду.
| электролиз | ||||
| 2 H 2 O ( л ) | 2 H 2 ( г ) | + | O 2 ( г ) |
4.При нагревании хлората калия (KClO 3 ) в наличие катализатора до его разложения.
| MnO 2 | ||||
| 2 KClO 3 ( с ) | 2 KCl ( с ) | + | 3 O 2 ( г ) |
Химия Сера
Поскольку сера находится непосредственно под кислородом в периодической таблице,
эти элементы имеют похожие электронные конфигурации. В следствии,
сера образует множество соединений, являющихся аналогами кислородных соединений,
как показано в таблице ниже. Примеры в этой таблице показывают, как
префикс thio — может использоваться для обозначения соединений, в которых
сера заменяет атом кислорода. Тиоцианат (SCN —)
ион, например, является серосодержащим аналогом цианата
(OCN — ) ион.
В следствии,
сера образует множество соединений, являющихся аналогами кислородных соединений,
как показано в таблице ниже. Примеры в этой таблице показывают, как
префикс thio — может использоваться для обозначения соединений, в которых
сера заменяет атом кислорода. Тиоцианат (SCN —)
ион, например, является серосодержащим аналогом цианата
(OCN — ) ион.
Соединения кислорода и их серные аналоги
| Кислородные соединения | Соединения серы | |
| Na 2 O (оксид натрия) | Na 2 S (сульфид натрия) | |
| H 2 O (вода) | H 2 S (сероводород) | |
| O 3 (озон) | SO 2 (диоксид серы) | |
| CO 2 (диоксид углерода) | CS 2 (сероуглерод) | |
| OCN — (цианат) | SCN — (тиоцианат) | |
| OC (NH 2 ) 2 (мочевина) | SC (NH 2 ) 2 (тиомочевина) |
Есть четыре основных различия между химическим составом
сера и кислород.
1. Двойные связи O = O намного прочнее двойных связей S = S.
2. Одинарные связи S-S почти вдвое прочнее одинарных O-O. облигации.
3. Сера ( EN = 2,58) гораздо менее электроотрицательна. чем кислород ( EN = 3,44).
4. Сера может расширять свою валентную оболочку, удерживая более восьми электроны, а кислород — нет.
Эти, казалось бы, незначительные различия имеют важные последствия для химии этих элементов.
Эффект Различия в силе связей X-X и X = X
Радиус атома серы примерно на 60% больше, чем у атома серы. атом кислорода.
В результате атомам серы труднее подойти близко достаточно вместе, чтобы образовать узы. S = S двойные связи, следовательно, намного слабее, чем двойные связи O = O.
Двойные связи между серой и атомами кислорода или углерода могут быть
обнаружен в таких соединениях, как SO 2 и CS 2 (см.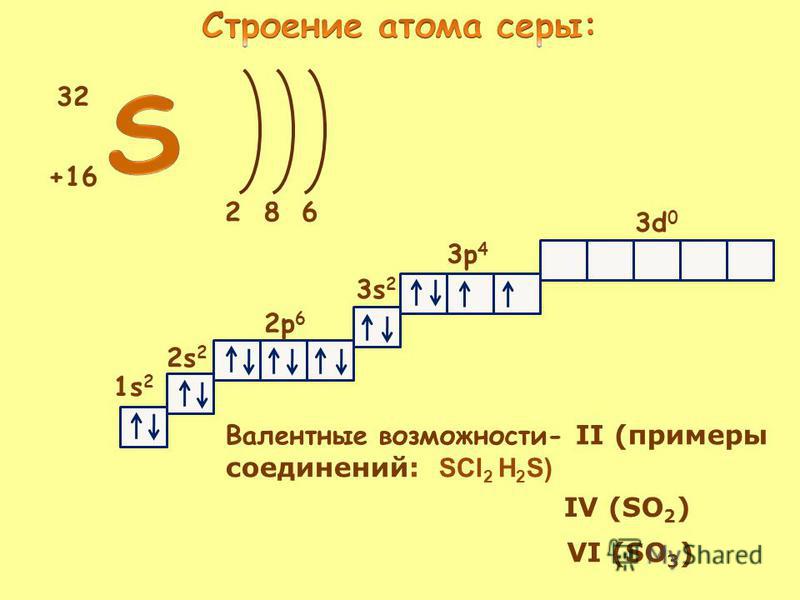 рисунок ниже).Но эти двойные связи намного слабее, чем
эквивалентные двойные связи с атомами кислорода в O 3 или CO 2 .
Энтальпия диссоциации связи для двойной связи C = S составляет 477
кДж / моль, например, тогда как энтальпия диссоциации связи для
Двойная связь C = O составляет 745 кДж / моль.
рисунок ниже).Но эти двойные связи намного слабее, чем
эквивалентные двойные связи с атомами кислорода в O 3 или CO 2 .
Энтальпия диссоциации связи для двойной связи C = S составляет 477
кДж / моль, например, тогда как энтальпия диссоциации связи для
Двойная связь C = O составляет 745 кДж / моль.
Элементарный кислород состоит из молекул O 2 , в которых каждый атом завершает свой октет валентных электронов, разделяя два пары электронов с одним соседним атомом.Потому что сера не образует прочных двойных связей S = S, элементарная сера обычно состоит из циклических S 8 молекул, в которых каждый атом завершает свой октет, образуя одинарные связи с двумя соседними атомов, как показано на рисунке ниже.
S 8 молекул могут упаковываться, образуя более одной
кристалл. Самая стабильная форма серы состоит из орторомбической кристаллы молекул S 8 , которые часто встречаются вблизи
вулканы. Если эти кристаллы нагреть до плавления и
расплавленная сера затем охлаждается, аллотроп серы состоит из моноклинных кристаллов молекул S 8 составляет
сформирован. Эти моноклинные кристаллы медленно трансформируются.
в более стабильную ромбическую структуру за период
время.
Если эти кристаллы нагреть до плавления и
расплавленная сера затем охлаждается, аллотроп серы состоит из моноклинных кристаллов молекул S 8 составляет
сформирован. Эти моноклинные кристаллы медленно трансформируются.
в более стабильную ромбическую структуру за период
время.
Склонность элемента к образованию связей с самим собой называется цепью (от латинского catena , «цепочка»). Потому как сера образует необычно прочные одинарные связи S-S, лучше при катенации, чем любой элемент, кроме углерода.В результате орторомбические и моноклинные формы серы — не единственные аллотропы элемента. Также существуют аллотропы серы, которые отличаются размером молекул, образующих кристалл. Циклический молекулы, содержащие 6, 7, 8, 10 и 12 атомов серы, являются известный.
Сера плавится при 119,25 o C с образованием желтой жидкости.
которая менее вязкая, чем вода. Если эту жидкость нагреть до 159 o C,
превращается в темно-красную жидкость, которую невозможно вылить из
контейнер. Вязкость этой темно-красной жидкости в 2000 раз.
больше, чем у расплавленной серы, потому что циклический S 8 молекулы открываются и соединяются вместе, образуя длинные цепочки из
около 100 000 атомов серы.
Вязкость этой темно-красной жидкости в 2000 раз.
больше, чем у расплавленной серы, потому что циклический S 8 молекулы открываются и соединяются вместе, образуя длинные цепочки из
около 100 000 атомов серы.
Когда сера реагирует с активным металлом, она может образовывать сульфид-ион, S 2-.
| 16 К ( с ) | + | с 8 ( с ) | 8 К 2 S ( с ) |
Однако это не единственный продукт, который можно получить.А может быть произведено множество полисульфид-ионов с зарядом -2 которые различаются количеством атомов серы в цепи.
Эффект Различия в электроотрицательностях серы и кислорода
Поскольку сера гораздо менее электроотрицательна, чем кислород, она
с большей вероятностью будет образовывать соединения, в которых он имеет положительный
степень окисления (см. таблицу ниже).
таблицу ниже).
Общие числа окисления для серы
| Окисление Число | Примеры | |
| -2 | Na 2 S, H 2 S | |
| -1 | Na 2 S 2 , H 2 S 2 | |
| 0 | S 8 | |
| +1 | S 2 Класс 2 | |
| +2 | S 2 O 3 2- | |
| +2 1 / 2 | S 4 O 6 2- | |
| +3 | S 2 O 4 2- | |
| +4 | SF 4 , SO 2 , H 2 SO 3 , СО 3 2- | |
| +5 | S 2 O 6 2- | |
| +6 | SF 6 , SO 3 , H 2 SO 4 , СО 4 2- |
Теоретически сера может реагировать с кислородом с образованием SO 2 или SO 3 , чьи структуры Льюиса приведены на рисунке
ниже.
| СО 2 | |
| СО 3 |
На практике при сжигании сернистых соединений образуется SO 2 , независимо от того, горит ли сера или ее соединение.
| S 8 ( с ) | + | 8 O 2 ( г ) | 8 SO 2 ( г ) | |||
| CS 2 ( л ) | + | 3 O 2 ( г ) | CO 2 ( г ) | + | 2 SO 2 ( г ) | |
| 3 FeS 2 ( с ) | + | 8 O 2 ( г ) | Fe 3 O 4 ( с ) | + | 6 SO 2 ( г ) |
Хотя образующийся в этих реакциях SO 2 должен
реагирует с O 2 с образованием SO 3 , скорость этого
реакция очень медленная.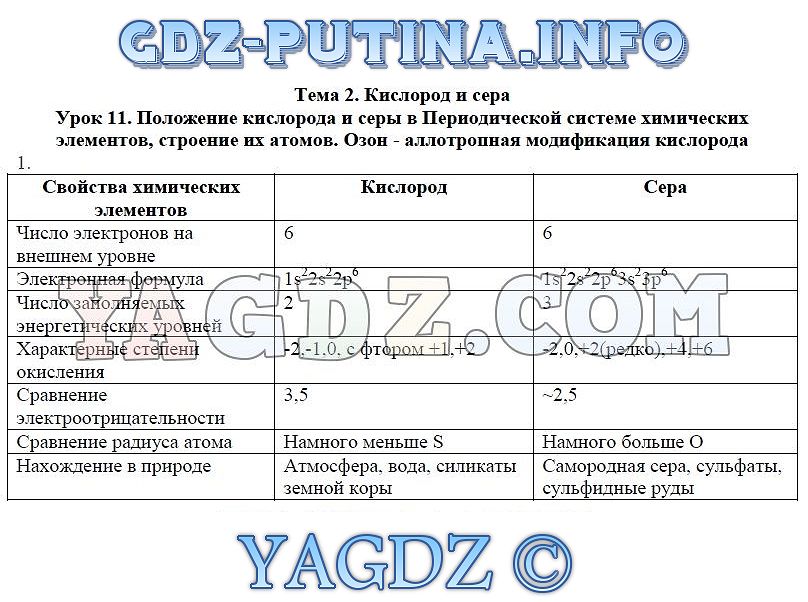 Курс конвертации СО 2 в SO 3 можно значительно увеличить, добавив
соответствующий катализатор.
Курс конвертации СО 2 в SO 3 можно значительно увеличить, добавив
соответствующий катализатор.
| В 2 О 5 / К 2 О | ||
| 2 SO 2 ( г ) | 2 SO 3 ( г ) |
Огромное количество SO 2 производится промышленностью каждый год, а затем конвертируется в SO 3 , который можно использовать для производства серной кислоты, H 2 SO 4 .Теоретически, серную кислоту можно получить, растворяя газ SO 3 в вода.
| SO 3 ( г ) | + | H 2 O ( л ) | H 2 SO 4 ( водн. ) ) |
На практике это неудобно. Вместо этого SO 3 абсорбируется 98% H 2 SO 4 , где он реагирует с водой для образования дополнительных H 2 SO 4 молекулы.Затем при необходимости добавляют воду, чтобы концентрация этого раствора от 96% до 98% H 2 SO 4 по весу.
Серная кислота на сегодняшний день является наиболее важным промышленным
химический. Утверждалось даже, что существует прямой
соотношение между количеством серной кислоты в стране
потребляет и его уровень жизни. Более 50%
ежегодно производимая серная кислота используется для производства удобрений. В
остальное используется для изготовления бумаги, синтетических волокон и текстиля,
инсектициды, моющие средства, кормовые добавки, красители, лекарства,
антифриз, краски и эмали, линолеум, синтетический каучук,
печатные краски, целлофан, фотопленка, взрывчатые вещества,
автомобильные аккумуляторы и металлы, такие как магний, алюминий,
железо и сталь.
Серная кислота диссоциирует в воде с образованием HSO 4 — ион, который известен как гидросульфатный или бисульфатный ион.
| H 2 SO 4 ( водн. ) | H + ( водн. ) | + | HSO 4 — ( водн. ) |
10% этих ионов гидросульфата диссоциируют дальше с образованием SO 4 2-, или сульфат-ион.
| HSO 4 — ( водн. ) | H + ( водн. ) | + | SO 4 2- ( водн. ) |
Различные соли могут быть образованы путем замены H + ионы в серной кислоте с положительно заряженными ионами, такие как
Ионы Na + или K + .
| NaHSO 4 | = | натрия гидросульфат |
| Na 2 SO 4 | = | натрия сульфат |
Диоксид серы растворяется в воде с образованием серной кислоты.
| SO 2 ( г ) | + | H 2 O ( л ) | H 2 SO 3 ( водн. ) |
Сернистая кислота не так сильно диссоциирует в воде как серную кислоту, но еще можно заменить H + ионы в H 2 SO 3 с положительными ионами с образованием соли.
| NaHSO 3 | = | гидросульфит натрия |
| Na 2 SO 3 | = | натрия сульфит |
Серная кислота и сернистая кислота являются примерами класса
соединений, известных как оксикислоты , потому что они
буквально кислоты, содержащие кислород. Потому что они отрицательные
ионы (или анионы), содержащие кислород, SO 3 2- и ионы SO 4 2- известны как оксианионы .Структуры Льюиса некоторых оксидов серы, образующих
оксикислоты или оксианионы приведены в таблице ниже.
Потому что они отрицательные
ионы (или анионы), содержащие кислород, SO 3 2- и ионы SO 4 2- известны как оксианионы .Структуры Льюиса некоторых оксидов серы, образующих
оксикислоты или оксианионы приведены в таблице ниже.
Один из этих оксианионов заслуживает особого упоминания. Этот ион, который известен как ион тиосульфата, образуется в результате реакции между серой и ионом сульфита (SO 3 2- ).
| 8 SO 3 2- ( водн. ) | + | с 8 ( с ) | 8 S 2 O 3 2- ( водн. ) | |
Эффект Различия в способности серы и кислорода расширять свои Валентная оболочка
Электронные конфигурации кислорода и серы обычно
написано следующим образом.
| O | = | [He] 2 с 2 2 p 4 | |
| S | = | [Ne] 3 с 2 3 с 4 |
Хотя это обозначение показывает сходство между конфигурации двух элементов, он скрывает важную разница, которая позволяет сере расширять свою валентную оболочку, чтобы удерживать более восьми электронов.
Кислород реагирует с фтором с образованием OF 2 .
| O 2 ( г ) | + | 2 F 2 ( г ) | 2 ИЗ 2 ( г ) |
На этом реакция останавливается, поскольку кислород может удерживать только
восемь электронов в валентной оболочке, как показано на рисунке
ниже.
Сера реагирует с фтором с образованием SF 4 и SF 6 , показано на рисунке ниже, поскольку сера может расширять свою валентность оболочка для хранения 10 или даже 12 электронов.
| S 8 ( с ) | + | 16 F 2 ( г ) | 8 SF 4 ( г ) | |
| S 8 ( с ) | + | 24 F 2 ( г ) | 8 SF 6 ( г ) |
Примечания к редакции для науки Глава 2 — Чиста ли окружающая нас материя (9-й класс)
Что такое вещество?
Все, что не может быть разбито на другие частицы с помощью каких-либо физических процессов, называется Веществом .

Вещество можно разделить на два типа веществ — чистые вещества и смеси
Что такое чистое вещество?
Вещество, состоящее только из одного типа частиц, называется чистым веществом . Например, , алмаз, соль, сера, олово.
Что такое смесь?
Когда мы соединяем разные вещества друг с другом, образуется смесь. В примере лимонад представляет собой смесь трех веществ: лимонного сока, сахара и воды.
Что из этого представляет собой смесь или чистое вещество?
Вода, Медь, Шоколадный торт, Водород, Почва, Воздух
Смесь — Шоколадный торт, Почва, Воздух
Чистое вещество — вода, медь, водород
Типы смесей
Есть две категории смесей: гомогенные смеси и гетерогенные смеси
Гомогенные смеси
Когда мы добавляем вместе сахар, воду и лимонный сок, они все равномерно смешиваются друг с другом.
 Теперь невозможно отделить эти вещества от смеси. Такие смеси, в которых компоненты смешиваются друг с другом равномерно, называются гомогенными смесями .
Теперь невозможно отделить эти вещества от смеси. Такие смеси, в которых компоненты смешиваются друг с другом равномерно, называются гомогенными смесями .Соотношение составов однородных смесей может быть различным. Например, , один может добавить две ложки сахара в лимонад, а кто-то другой может добавить только одну ложку сахара в свой лимонад. Тем не менее, лимонад — это однородная смесь.
Гетерогенные смеси
Компоненты гетерогенной смеси не растворяются полностью друг в друге, и мы можем разделить их физическими средствами.Другими словами, состав таких смесей неоднороден.
Например, , если мы смешиваем песок с водой, через некоторое время песок оседает в воде, и мы можем отделить его фильтрацией.
Вот несколько отличий гомогенных и гетерогенных смесей —
| Гомогенные смеси | Гетерогенные смеси |
Они имеют единый состав на всем протяжении | Имеют неоднородный состав |
Мы не можем разделить компоненты смеси с помощью физических процессов | Мы можем разделить компоненты с помощью физических процессов |
Детали не видны невооруженным глазом | Компоненты видны невооруженным глазом |
Смесь является однофазной на всем протяжении | Вещества могут быть двух разных фаз, и мы можем видеть отдельные слои веществ |
Пример: Смесь воды и молока | Пример : Смесь масла с водой |
Какое решение?
Раствор — это не что иное, как однородная смесь двух или более веществ. Гомогенные смеси — это растворы.
Гомогенные смеси — это растворы.
Раствор —
Жидкость в жидкость: Вода и чернила
Твердое тело в твердое: Сплавы
Газ в газ: Воздух
Твердое вещество в жидкость: Сахар и вода
Твердое вещество в газ: Водород и металлы
Жидкость в газ: Двуокись углерода и вода
Что такое сплав?
Сплав — это смесь различных металлов или неметаллов и металлов, которые невозможно отделить друг от друга физическими методами. Например:
Латунь — Медь с содержанием цинка до 50%
Бронза — Медь с содержанием олова до 12%
Раствор состоит из двух типов веществ: растворенного вещества и растворителя.
Раствор = Раствор + Растворитель
Растворитель — Вещество, в которое смешано другое вещество, называется Растворителем . Например, , вода — это растворитель, в котором мы можем смешивать различные вещества, такие как соль или сахар.
Например, , вода — это растворитель, в котором мы можем смешивать различные вещества, такие как соль или сахар.
Раствор — Вещество, которое добавляется к растворителю для образования раствора, называется Растворенным веществом . Например, , соль при смешивании с водой действует как растворенное вещество для смеси.
Свойства решения:
Раствор представляет собой однородную смесь.
Мы не можем увидеть частицы раствора невооруженным глазом, так как они маленькие, как 1 нанометр в диаметре.
Путь света сквозь раствор не виден. Частицы раствора не рассеивают свет через себя, так как они очень маленькие.
Мы не можем отделить частицы раствора методами фильтрации.
Что такое стабильное решение?
Устойчивый раствор — это раствор, в котором частицы не оседают, если оставить раствор в покое на некоторое время. Это потому, что частицы стабильного раствора распределены равномерно.
Это потому, что частицы стабильного раствора распределены равномерно.
Различные типы решений
Разбавленный — Раствор, в котором концентрация растворенного вещества намного меньше, чем концентрация растворителя. Для примера , если мы смешаем 1 г соли в 500 мл воды, полученный таким образом раствор соли будет разбавлен. Если мы продолжаем добавлять растворенное вещество в раствор, наступает момент, когда растворенное вещество больше не растворяется в растворе.Это называется точкой насыщения решения .
Ненасыщенный раствор — Раствор, в который мы можем добавить больше растворенного вещества, поскольку он еще не достиг уровня насыщения, называется ненасыщенным раствором. Разбавленный раствор можно назвать Ненасыщенным Раствором .
Концентрированный раствор — Раствор с большим количеством растворителя называется Концентрированным раствором .

Насыщенный раствор — Раствор, в который больше нельзя добавлять растворенное вещество, поскольку он уже растворил максимальное количество растворенного вещества, которое может быть растворено, называется насыщенным раствором .
Что такое концентрация?
C Концентрация относится к количеству вещества на определенное пространство или может быть определена как отношение растворенного вещества в растворе к растворителю или общему раствору.
Для расчета концентрации рассмотрите следующие формулы:
Массовый процент = (Масса растворенного вещества / Масса раствора) X 100
Объемные проценты = (Объем растворенного вещества / Объем раствора) X 100
Молярность (M) = количество молей растворенного вещества / объем раствора в литрах
Где, молей растворенного вещества = заданная масса / молярная масса
= Масса растворенного вещества / (эквивалентная масса * объем раствора в литрах)
частей на миллион (частей на миллион) = (масса растворенного вещества / масса растворителя) * 10 6
Молярная доля РАСТВОР = моль растворенного вещества / общее количество молей раствора
Молярная доля РАСТВОРИТЕЛЬ = моль растворителя / общее количество молей раствора
мольная доля РАСТВОРИТЕЛЬ + мольная доля РАСТВОРИТЕЛЬ = 1
Что такое подвеска?
Суспензия образуется, когда два или более вещества смешиваются неравномерно. Гетерогенные смеси представляют собой суспензии. Растворенное вещество не смешивается с растворителем и его можно увидеть невооруженным глазом.
Гетерогенные смеси представляют собой суспензии. Растворенное вещество не смешивается с растворителем и его можно увидеть невооруженным глазом.
Свойства суспензий:
Суспензия представляет собой гетерогенную смесь.
Частицы взвеси можно увидеть невооруженным глазом.
Мы можем видеть путь света через частицы взвеси.
Частицы суспензии, если их не трогать, имеют тенденцию оседать.Затем их можно разделить с помощью фильтрации.
Что такое коллоиды или коллоидные растворы?
Коллоидный раствор или коллоид — это однородный раствор двух или более веществ. Частицы относительно очень маленькие, поэтому раствор выглядит как гомогенная смесь, но это не так.
Свойства коллоидов:
Коллоиды неоднородны по своей природе.
Частицы коллоида нельзя увидеть невооруженным глазом.
Частицы рассеивают луч света, прошедший через коллоид, и создают эффект Тиндаля.
Коллоиды стабильны по своей природе. Частицы коллоидов не оседают, если их не прерывать.
Мы не можем отделить частицы коллоида фильтрацией. Мы используем метод под названием Centrifugation для отделения частиц коллоида.
Что такое эффект Тиндаля?
Когда луч света проходит через коллоид, частицы коллоида рассеивают луч света, и мы можем видеть путь света в растворе. Например, , когда луч света входит в темную комнату, он рассеивается частицами пыли, присутствующими в воздухе, и мы можем ясно видеть путь света.
Классификация коллоидов
Дисперсная фаза — Дисперсные частицы или растворенные вещества в коллоиде
Диспергирующая среда — Вещество, в которое добавлены эти подобные растворенным веществам частицы
По состоянию диспергирующей среды коллоиды классифицируются как:
Типы коллоидов
| Пример | Диспергирующая среда | Дисперсное вещество | Коллоидный тип |
| Туман, аэрозольные баллончики | Газ | Жидкость | Аэрозоль |
| Дым, бактерии, переносимые по воздуху | Газ | Жидкость | Аэрозоль |
| Взбитые сливки, мыльная пена | Жидкость | Газ | Пена |
| Молоко, Майонез | Жидкость | Жидкость | Эмульсия |
| Краски, глина, желатин | Жидкость | Цельный | сол |
| Зефир, пенополистирол | Цельный | Газ | Твердая пена |
| Масло сливочное, сыр | Цельный | Жидкость | Твердая эмульсия |
| Рубиновое стекло | Цельный | Цельный | твердый раствор |
Как разделить компоненты смеси?
Мы можем разделить гетерогенные смеси на составляющие с помощью таких физических методов, как:
Фильтрация
Ручной сбор
Просеивание
Компоненты смеси можно отделить друг от друга, используя несколько других методов, например:
Испарение
Центрифугирование
Сублимация
Хроматография
Дистилляция
1.Испарение — Для разделения смеси нелетучих и летучих веществ
2. Центрифугирование — Отделение плотных частиц от более легких
Заявки:
Отделение молока от сливок
Отделение сливочного масла от сливок
Выдавливание воды из мокрой одежды
Метод:
3.Использование делительной воронки — для разделения двух несмешивающихся жидкостей
Заявки:
Масло из воды
Железо и железная руда
Метод:
Несмешивающиеся жидкости могут осесть в воронке. Вскоре они образуют отдельные слои из-за разной плотности.Первой жидкости позволяют вытекать из воронки, и как только она полностью выливается, запорный кран закрывается, тем самым отделяя две жидкости друг от друга.
4. Сублимация — Отделение сублимируемого компонента от несублимируемого компонента
Заявки:
Метод:
Нагрейте смесь в перевернутой воронке так, чтобы сублимируемый компонент сублимировался в воздухе и оседал на стенках воронки, а несублимируемый компонент, с другой стороны, оставался позади.
5. Хроматография — для разделения растворенных веществ, которые могут растворяться в одном растворителе
Заявки:
Метод:
Возьмите фильтровальную бумагу или промокательную бумагу и поместите каплю чернил на задний конец. Окуните конец в воду. Поскольку чернила представляют собой смесь двух или более цветов, компонент чернил, растворимый в воде, смешивается с ней и затем быстро отделяется от других компонентов, которые менее растворимы в воде.
6. Дистилляция — Для разделения смешивающихся жидкостей (точки кипения жидкостей должны быть достаточно разными)
Заявки:
Метод:
Смесь нагревают в ректификационном аппарате. Одно вещество с более низкой точкой кипения сначала испаряется, конденсируется и отделяется от вещества с более высокой температурой кипения.
Простая дистилляция — когда смешивающиеся жидкости имеют удовлетворительную разницу в точках кипения
Фракционная перегонка — когда разница между температурами кипения жидкостей менее 25 К
Отделение различных газов от воздуха
Метод — Фракционная перегонка
Сожмите и охладите воздух, повысив температуру и уменьшив давление.Воздух превращается в жидкий воздух.
Жидкий воздух медленно нагревается в аппарате фракционной перегонки
Несколько компонентов воздуха разделяются и собираются на разной высоте в зависимости от их точек кипения
Очистка твердых веществ
Используемый метод — Кристаллизация
Методом кристаллизации из раствора можно получить чистое твердое вещество в виде кристаллов.
Заявки:
Метод:
Примеси вещества отфильтровываются.
Воду упаривают до насыщенного раствора.
Раствор накрывают фильтровальной бумагой и оставляют как есть.
Через некоторое время образуются кристаллы чистого твердого вещества.
- Испарение лучше кристаллизации?
Простое испарение не лучше кристаллизации, потому что:
1.Некоторые твердые вещества разлагаются из-за избыточного тепла. Например, , сахар обугливается при дополнительном нагревании.
2. Если после фильтрации в растворе останутся примеси, они могут загрязнить твердое вещество, и поэтому мы не сможем получить чистое вещество.
Физические изменения и химические изменения
Физические свойства вещества:
Свойства вещества, такие как жесткость, цвет, текучесть, точка кипения, точка плавления, плотность и твердость, которые мы можем наблюдать, называются Физическими свойствами .
Физическое изменение:
Когда физические свойства вещества меняются, это называется Physical Change . Когда мы переводим вещество из одного состояния в другое, например твердое тело в жидкость или наоборот, это также физическое изменение, поскольку изменяется только физическая природа вещества, не влияя на его химическую природу.
Например, , Превращение льда в воду. Химические свойства воды остаются прежними.
Химические свойства вещества:
Химическая природа вещества известна как Химическое свойство , такое как запах или химический состав.
Химическая замена:
Когда химические свойства или химический состав вещества изменяются, это называется химическим изменением. Его также называют химической реакцией .
Например, , сжигание бумаги
Типы чистых веществ
Чистые вещества классифицируются как элементы и соединения
Элементы
Элемент — это простейшая форма материи.Элементы не могут быть разбиты на другие элементы с помощью химических реакций. Элементы далее характеризуются как Металлы, Неметаллы и Металлоиды
Металлы — Серебро, Ртуть, Медь, Золото
1. Металлы блестящие (блестящие)
2. Металлы проводят тепло и электричество
3. Металлы серебристо-серого или золотисто-желтого цвета
4. Мы можем обрабатывать металлы и формировать тонкие листы (Ковкость)
5. Мы можем превращать металлы в проволоку (Дуктильность)
6.Металлы всегда издают звонкий звук при ударе (Звонкий)
Неметаллы — Углерод, йод, хлор, кислород, водород
1. Неметаллы не проводят тепло и электричество
2. Неметаллы не имеют звука, блеска и пластичности
3. Неметаллы имеют разные цвета
Металлоиды — Кремний, Германий
Они показывают некоторые свойства металлов и некоторых неметаллов.
Краткая информация —
1.Нам известно 100 элементов
2. 92 элемента из них встречаются в природе
3. Остальное, 8 — техногенные элементы
4. Большинство элементов твердые по своей природе
5. При комнатной температуре 11 элементов находятся в газообразном состоянии
6. При комнатной температуре в жидком состоянии существуют 2 элемента — бром и ртуть
7. При температуре немного выше комнатной в жидком состоянии существуют 2 элемента — кальций и галлий
Соединения
Это вещество, состоящее из двух или более веществ.Эти вещества химически соединены друг с другом в фиксированных пропорциях. Свойства соединения отличаются от свойств его составляющих. Например, , сульфат аммония, хлорид серы, вода.
Смеси и соединения
Смеси | Соединения |
Свойства смеси Отражают свойства содержащихся в ней материалов. | Свойства, отличные от свойств элементов, входящих в состав. |
Без однородного состава | Определенный состав. Определенное соотношение / формула |
Может отделяться физическим способом. | Невозможно разделить физическими средствами. |
Особенности курса
- 728 Видео-лекции
- Примечания к редакции
- Документы за предыдущий год
- Интеллектуальная карта
- Планировщик исследования
- Решения NCERT
- Обсуждение Форум
- Тестовая бумага с видео-решением
Оценка технологий обессеривания для удаления серы из жидкого топлива
DOI: 10.1039 / C1RA00309G (Обзорная статья) RSC Adv., 2012, 2 , 759-783Поступила 14 июня 2011 г. Принято 18 октября 2011 г.
Впервые опубликовано 5 декабря 2011 г.
Соединения серы представляют собой одну из наиболее распространенных примесей, присутствующих в сырой нефти. Сера в жидком топливе напрямую ведет к выбросам SO 2 и сульфатных твердых частиц (SPM), которые ставят под угрозу здоровье людей и общественное имущество; и сокращает срок службы двигателя из-за коррозии.Кроме того, соединения серы в выхлопных газах дизельных двигателей могут значительно ухудшить технологию контроля выбросов, разработанную в соответствии со стандартами выбросов NO x и SPM. Усиливаются исследования по разработке традиционных методов гидрообессеривания и альтернативных методов обессеривания, таких как селективная адсорбция, биодесульфуризация, окисление / экстракция (окислительное обессеривание) и т. Д. Для удаления этих тугоплавких соединений серы из нефтепродуктов.Исследовательские лаборатории и нефтеперерабатывающие заводы тратят огромные деньги на поиск жизнеспособного и осуществимого решения по снижению концентрации серы до концентрации менее 10 мг. Л -1 . В этой статье подробно рассматривается текущее состояние различных технологий сероочистки, изучаемых во всем мире. В нем представлен обзор новых появляющихся технологий сверхглубокой сероочистки с целью производства топлива со сверхнизким содержанием серы.
1. Введение
Производство энергии — одна из самых актуальных проблем современности.Экономическая деятельность и потребление энергии тесно связаны. Производство полезных товаров и услуг требует энергии. Ископаемое топливо — наиболее широко используемый источник энергии в мире. Хотя процент энергии, получаемой из ископаемого топлива, снизился за последние годы, доля мировой энергии из ископаемого топлива по-прежнему превышает 82%, половина из которых приходится на нефть. 1 Сырая нефть, сложная смесь органических жидкостей, является крупнейшим источником энергии. Основная часть сырой нефти используется в качестве транспортного топлива, такого как бензин, дизельное и реактивное топливо.Он естественным образом встречается в земле и образовался миллионы лет назад. Содержание серы и плотность Американского института нефти (API) — это два свойства, которые имеют большое влияние на стоимость сырой нефти. Содержание серы выражается в процентах от серы по массе и варьируется от менее 0,1% до более 5% в зависимости от типа и источника сырой нефти. 2 Соединения серы существуют в различных формах и могут быть разделены на четыре основные группы: меркаптаны, сульфиды, дисульфиды и тиофены (THs).Соединения серы нежелательны в процессе нефтепереработки, поскольку они имеют тенденцию дезактивировать некоторые катализаторы, используемые при переработке сырой нефти, и вызывают проблемы с коррозией в трубопроводе, насосном и нефтеперерабатывающем оборудовании. Таблица 1 показывает уровень серы в мировых поставках сырой нефти. Встречающиеся в природе соединения серы, оставшиеся в топливе, приводят к выбросу газов оксида серы. Эти газы вступают в реакцию с водой в атмосфере с образованием сульфатов и кислотных дождей, которые повреждают здания, разрушают лакокрасочное покрытие автомобилей, подкисляют почву и, в конечном итоге, приводят к потере лесов и различных других экосистем. 3 Выбросы серы также вызывают респираторные заболевания, усугубляют сердечные заболевания, вызывают астму и способствуют образованию твердых частиц в атмосфере. 4 На автомобили также отрицательно влияет присутствие соединений серы в жидком топливе. Уровни содержания серы в автомобильном топливе сильно влияют на эффективность каталитических нейтрализаторов.
Таблица 1 Уровни серы в мировых запасах сырой нефти 10Современный промышленный метод удаления серы из топлива — это гидрообессеривание (HDS), которое представляет собой каталитический процесс при высоких температурах и давлении.Это делает HDS очень дорогим вариантом для глубокого обессеривания. Более того, HDS не эффективен для удаления гетероциклических соединений серы, таких как дибензотиофен (DBT) и его производные, особенно 4,6-диметилдибензотиофен (4,6-DMDBT). Глубокое обессеривание бензина (от 500 до <10 ppm серы) в значительной степени ограничивается DMDBT, который является наименее химически активным серосодержащим соединением. Окислительное обессеривание (ODS), окислительно-экстракционное обессеривание (OEDS), адсорбционное обессеривание и биодесульфуризация (BDS) - это другие методы обессеривания, с помощью которых можно получить сверхчистое топливо.В ОРВ серосодержащие соединения окисляются до сульфона химической реакцией с использованием окислителя, а именно. H 2 O 2 , H 2 SO 4 и т. Д. Сульфоновое соединение затем легко извлекается из топлива благодаря его более высокой полярности. В процессе адсорбции адсорбенты, используемые в процессе, избирательно захватывают серу. Активный адсорбент помещен на пористую нереакционноспособную подложку, которая обеспечивает наибольшую площадь поверхности для адсорбции.Адсорбция происходит, когда молекулы серы прикрепляются к адсорбенту на подложке и остаются там отдельно от топлива. В последнее время BDS привлекла к себе широкое внимание из-за экологически чистой переработки ископаемого топлива. Однако медленность процесса удаления является серьезным препятствием для использования процесса BDS.
Сегодня самая сильная мотивация к снижению содержания серы в топливе связана с экологическими нормативами, которые устанавливают строгие ограничения на содержание серы в топливе для транспортных средств.Требуются новые методы удаления серы из сырья более низкого качества, чтобы обеспечить доступность энергии по разумной цене. В этом документе содержится обзор текущего состояния и деталей различных методов десульфурации, изучаемых во всем мире для удаления соединений серы из жидкого топлива, и направлена на выявление пробелов в исследованиях этих методов.
2. Влияние серы на окружающую среду
Загрязнение, выбрасываемое автомобильными двигателями, сильно влияет на качество воздуха.Соединения серы превращаются в оксиды серы при горении, что в конечном итоге приводит к кислотным дождям. 5–7 Диоксид серы и другие загрязнители, связанные с горением, из серосодержащих соединений топлива вызывают экологические проблемы, такие как смог, глобальное потепление и загрязнение воды. 8 Даже при более строгих стандартах для двигателей большой мощности, эти двигатели будут продолжать выделять большое количество оксидов азота (NO x ) и твердых частиц (ТЧ), которые способствуют серьезным проблемам со здоровьем населения.ТЧ, присутствующие в выхлопных газах дизельных двигателей, могут вызывать высокий уровень рака легких у людей. Другие последствия для здоровья включают обострение респираторных и сердечно-сосудистых заболеваний, обострение существующей астмы, хронический бронхит и снижение функции легких. Следовательно, обессеривание топлива чрезвычайно важно в нефтяной промышленности.Удаление серы из нефти также необходимо с промышленной точки зрения. Производители автомобилей требуют удаления серосодержащих соединений из нефти, чтобы снизить общие выбросы от транспортных средств.Это связано с тем, что соединения серы отравляют каталитические нейтрализаторы, которые сокращают выбросы твердых частиц и NO x . 9 Сера влияет на эти устройства контроля выбросов, сильно адсорбируя катализаторы из драгоценных металлов, предотвращая адсорбцию и реакцию углеводородов, NO x и монооксида углерода. 10
Кроме того, соединения серы в нефти также вызывают коррозию деталей двигателей внутреннего сгорания и нефтеперерабатывающих заводов из-за образования кислородных кислот серы из продуктов сгорания. 11 Кроме того, соединения серы нежелательны в процессах нефтепереработки, потому что они имеют тенденцию дезактивировать некоторые катализаторы, используемые в процессе переработки и повышения качества углеводородов. 12 Кроме того, соединения серы способствуют образованию смолистых отложений в жидких нефтепродуктах.
3. Стандарты
Агентство по охране окружающей среды США (US EPA) обязало снизить содержание серы в дизельном топливе и бензине. В 2006 году EPA установило максимальное содержание серы в дизельном топливе на уровне 15 частей на миллион. 10 В таблице 2 показано, как действуют стандарты выбросов в мире. 13 Согласно нормам Euro V в ближайшем будущем содержание серы в топливе должно быть снижено до 10 ppm. Правила по сере, вступившие в силу в Канаде и США с 1 июня 2006 г., снизили содержание серы в дорожном дизельном топливе и бензине с 500 мг кг −1 и 350 мг кг −1 до 15 мг. кг −1 и 30 мг кг −1 соответственно. 14,15 В настоящее время максимально допустимое содержание серы в дизельном топливе в США и Европе составляет 10 мг кг −1 . 16,17 Таблица 2 Дорожная карта мировых стандартов выбросов. Изменено из CAI-Asia 13| Страна | 96 | 97 | 98 | 99 | 00 | 01 | 02 | 03 | 04 | 05 | 06 | 07 | 08 | 09 | 10 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Калифорния (США) | CARB (90 частей на миллион) | CARB (80 частей на миллион) | CARB (15 частей на миллион) | ||||||||||||
| Соединенные Штаты Америки | EPA (500 частей на миллион) | 300 частей на миллион | 80 частей на миллион | 15 (частей на миллион) | |||||||||||
| Европа | Euro II (500 частей на миллион) | E III (150 частей на миллион) | E IV 50 частей на миллион | E V 10 частей на миллион | |||||||||||
| Китай (H) | E I | Евро II | Евро III | Евро IV | |||||||||||
| Таиланд | Евро I | E II | Евро III | E IV | |||||||||||
| Сингапур | Евро I | E II | Евро III | E IV | |||||||||||
| Малайзия | Евро I | Евро II | E III | ||||||||||||
| Индия (метро) | E I | Евро II | Евро III | E IV | |||||||||||
| Индия | Евро I | Евро II | E III | ||||||||||||
| Непал | Евро I | ||||||||||||||
| Филиппины | Евро I | ||||||||||||||
| Индонезия | Евро II | ||||||||||||||
Последний нормативный акт в Индии, который был принят в 2010 году для крупных городов Индии, снизил содержание серы в бензине со 150 до 50 частей на миллион и содержание серы в дизельном топливе с 350 до 50 частей на миллион.Нефтеперерабатывающие заводы в Индии сталкиваются с серьезными проблемами, связанными с соблюдением требований по содержанию серы в топливе, а также с необходимым снижением содержания ароматических углеводородов. 18 В следующих разделах обсуждаются детали различных технологий удаления серы, таких как HDS, ODS, OEDS, адсорбционное удаление и BDS.
4. Гидрообессеривание
4.1. Введение
HDS традиционно используется на нефтеперерабатывающих заводах для снижения содержания серы в топливе. Первоначально интерес к HDS был стимулирован доступностью водорода из установок каталитического риформинга. 19 Обычно процесс HDS включает каталитическую обработку водородом для преобразования различных соединений серы в H 2 S и органические соединения, не содержащие серы, при высокой температуре и парциальном давлении водорода. 20–21 Обычный каталитический метод HDS для снижения содержания серы требует жестких условий эксплуатации. На нефтеперерабатывающих заводах H 2 S, образующийся в результате реакции HDS, в конечном итоге превращается в элементарную серу с помощью модифицированной версии процесса Клауса. 224.2. Условия реакции для реакции HDS
Реакция HDS на нефтеперерабатывающих заводах осуществляется в реакторах с тонким струйным слоем. Эти реакторы обычно работают при температурах в диапазоне 300–450 ° C и при H 2 давлениях 3,0–5,0 МПа, обычно с CoMo / Al 2 O 3 или NiMo / A1 2 O 3 катализаторы. 7,23 В этих суровых условиях олефины гидрируются, что приводит к потере октанового числа и чрезмерному расходу водорода.В мягких условиях HDS H 2 S может реагировать с олефинами в реакторе с образованием рекомбинантных меркаптанов, которые представляют собой линейные или разветвленные тиолы, обычно содержащие 5–12 атомов углерода. Образование рекомбинантных меркаптанов вызывает удержание серы в продукте, что ограничивает эффективность процесса HDS. Дальнейшие исследования в области HDS-катализа и технологических процессов проводятся, чтобы увеличить удаление серы и при этом сохранить качество топлива на уровне некоторых минимальных требований.В системах топливных элементов реакции HDS предпочтительно проводить при атмосферном давлении. Поскольку водород является ценным реагентом в топливном элементе, желательно проводить реакцию HDS с низким соотношением H 2 / топливо. HDS адаптирован для систем топливных элементов на основе фосфорной кислоты (PAFC), которые работают на природном газе. 24 HDS также был исследован для использования в сочетании с прямым карбонатным топливным элементом. 25 Механизм HDS обсуждается в следующем разделе.При атмосферном давлении реакция HDS протекает только по пути гидрогенолиза, а не по маршруту 26 гидрирования (HYD), который считается эффективным путем обессеривания тугоплавких соединений серы, таких как 4,6-DMDBT.
При атмосферном давлении и температуре> 300 ° C гидрирование ароматических колец термодинамически ограничено. Это выгодно тем, что активные центры катализатора не заняты для гидрирования ароматических соединений.Однако было замечено ингибирование в присутствии ароматических углеводородов, даже если они не гидрогенизированы. Поэтому исследования по определению оптимального рабочего давления для блока HDS для топливных элементов представляют интерес для дальнейших исследований.
4.3. Механизм HDS
Принято считать, что HDS протекает через реакционную сеть, предложенную Houalla et al. 27–28 В целом, механизм реакции DBT и 4,6-DMDBT через процесс HDS, как предполагается, осуществляется двумя основными путями.Один из них — это DDS или путь гидрогенолиза, при котором сера удаляется, не затрагивая ароматические кольца. Другой — через путь гидрогенизационной десульфуризации (HYD), в котором ароматические кольца соединений DBT предпочтительно гидрируются до промежуточных соединений 4H- или 6H-DBT, а затем десульфуризируются. 20Механизм реакции HDS DBT при 300 ° C и 102 атм показан на рис. 1. 28 Реакция водорода с DBT дает бифенил (BiPh) в качестве преобладающего органического продукта.В механизме пути HYD первичными продуктами реакции, образующимися непосредственно из DBT, являются тетрагидродибензотиофен (THDBT) и / или гексагидродибензотиофен (HHDBT). И THDBT, и HHDBT являются очень реактивными промежуточными продуктами, и их трудно выделить для обнаружения. Эти соединения подвергаются дальнейшей десульфуризации с образованием циклогексилбензола (ЦГБ) в качестве вторичного продукта. Этот путь называется путем HYD, так как соединение серы гидрируется перед десульфуризацией. Гидрогенолиз ДБТ по прямой связи C – S дает бифенил по пути DDS.Последовательное гидрирование бифенила дает CHB. Бициклогексил (BiCh) — это третичный продукт, образующийся в следовых количествах в результате медленного гидрирования CHB, образованного любым из двух путей.
| Рис.1 Пути для HDS DBT при 300 ° C и 102 атм в присутствии CoMo / Al 2 O 3 . 28 | ||
Реакция DDS быстрее, чем HYD.Однако путь HYD становится относительно быстрым с увеличением концентрации H 2 S и / или H 2 в реакционной смеси; с увеличением метильных групп в 4 или 4 и 6 положениях; и с более активным катализатором гидрирования e. г. NiMo / Al 2 O 3 по сравнению с CoMo / Al 2 O 3 . 27–29 Houalla et al. 27–28 обнаружили, что активность катализатора NiMo / Al 2 O 3 (на единицу площади поверхности) была примерно вдвое выше, чем активность CoMo / Al 2 O 3 .Выход CHB при данной конверсии был примерно в три раза выше с катализаторами NiMo / Al 2 O 3 , чем с CoMo / Al 2 O 3 . Это указывает на то, что HYD является лучшим способом увеличения степени обессеривания тугоплавких соединений. Скорость обессеривания затрудненных соединений значительно увеличивается при использовании HYD-метода. Без одного или обоих колец молекула серы становится намного более гибкой, и атом серы намного легче приближается к поверхности катализатора и удаляется.
В общем, когда неспаренные электроны серы могут резонировать с пи-электронами органической структуры, энергия связи углерод-сера (C – S) становится практически идентичной энергии связи углерод-углерод (C – C). облигация. 30 Это приводит к снижению селективности процесса HDS, и происходит гидрирование углерод-углеродных связей. Насыщенные углеводороды приводят к получению топлива более низкого качества и требуют дополнительных стадий обработки.
4.4. Влияние тугоплавких сероорганических соединений на HDS
. Эффективность процесса HDS зависит от типа соединения серы. Nag et al. 31 провели ГДС различных сероорганических соединений с использованием сульфидированного CoO – MoO 3 / γ – Al 2 O 3 в качестве катализатора. Они обнаружили, что следующий порядок реакционной способности для HDS: TH> BTH> бензонафтотиофен> тетрагидробензонафтотиофен> DBT. Замещение этих соединений циклическим алкилированием дополнительно влияет на реакционную способность.Килановски и др. 32 провели ГДС метилзамещенных ДБТ (ДБТ) при атмосферном давлении с использованием сульфидов CoMo / γ – A1 2 O 3 . Они показали, что реакционная способность ДБТ с замещением метила в различных положениях уменьшается в следующем порядке: 2,8-диметилДБТ (2, 8-DMDBT)> DBT (DBT)> 4-метилдибентотиофен (4-MDBT)> 4, 6-диметилДБТ (4,6-ДМДБТ). Было обнаружено, что тренды реакционной способности для DBT, 4-MDBT и 4,6-DMDBT аналогичны в промышленных условиях с сульфидированным CoMo / Al 2 O 3 , 27 CoMo / Al 2 O 3 — цеолит, 33 и NiMo / Al 2 O 3 . 34 Присутствие ароматических соединений в топливе дополнительно подавляло активность по отношению к HDS. Также известно, что полярные соединения, такие как азот- и кислородсодержащие соединения, оказывают сильное ингибирующее действие на реакции HDS. 35–36 Егорова и Принс 35 сообщили, что даже следовые количества нафталина оказывают ингибирующее действие на HDS DBT и 4,6-DMDBT при 340 ° C и 5 МПа. Сообщалось, что H 2 S, полученный самой реакцией HDS, ингибирует реакцию HDS в углеводородном топливе, особенно в реакции прямого извлечения серы. 37–39 Однако ингибирующее действие H 2 S на реакции HDS зависит от содержания серы в сырье. Ингибирование процесса HDS связано с конкуренцией между ингибиторами и сероорганическими соединениями за адсорбцию на активных центрах катализатора.Таким образом, можно сказать, что реакционная способность сероорганических соединений с высокой точкой кипения, таких как BTH и DBT, которые присутствуют в промежуточных дистиллятах, таких как дизельное топливо, по отношению к реакции HDS значительно ниже, чем у соединений с низкой точкой кипения, таких как тиолы, сульфиды и дисульфиды. которые присутствуют в природном газе и легком сырье. 7,23,40 Ароматические, циклические и конденсированные полициклические соединения также считаются более сложными для удаления. 41 Следовательно, стерически затрудненные BTH и DBT являются целевыми соединениями для HDS в большинстве настоящих исследований. Поэтому DBT, 4-метил-DBT (4-MDBT) и 4,6-DMDBT и т. Д. Необходимо удалить, чтобы снизить содержание серы в топливе. 42
4.5. Катализаторы для HDS
В таблице 3 обобщены недавние исследования, проведенные для оптимизации процессов HDS с использованием различных катализаторов и конфигураций реакторов. 43–57 HDS с катализаторами на основе Mo, Ni или W широко используются для восстановления сероорганических соединений, таких как меркаптаны, тиоэфиры и дисульфиды. Наиболее распространенными катализаторами, используемыми в HDS, являются промотированный кобальтом или никелем сульфид молибдена. Недавние исследования HDS направлены на разработку катализатора, который может эффективно удалять тугоплавкие сероорганические соединения. В следующем разделе мы обсудим различные катализаторы, разработанные для HDS, их синтез, характеристики, активацию и рабочие условия. Таблица 3 Удаление серы с помощью HDS при оптимальных условиях| Процесс | Соединение серы | Масло | Катализатор | Система | S Конц. C o (частей на миллион) | Оптимальные условия | % S Удаление | Номер ссылки | |
|---|---|---|---|---|---|---|---|---|---|
| Темп.(° С) | Давление (МПа) | ||||||||
| Глубокий HDS | Алкильные ДБЦ | Легкое масло | Co-Mo / Al 2 O 3 | Кровать с уплотнением | 4000 | 300 | – | 67% | 43 |
| Трехступенчатый HDS | Алкильные ДБЦ | Дизель | CoMo + NiMo | Кровать с уплотнением | 7060 | 250 | 2.9 | 97% | 44 |
| HDS | Алкильные ДБЦ | Тяжелый газойль | Co-Mo-A1 | Подсос | 1800 | 360 | 5,5 | 20% | 45 |
| Глубокий HDS | Алкильные ДБЦ | Газойль | Co-Mo / γ – A1 2 O 3 | Фиксированная кровать | 13200 | 350 | 3 | 96% | 46 |
| HDS | Алкильные ДБЦ | Тяжелый газойль | Co, Ni, Mo, W на основе Al 2 O 3 / SiO | Кровать для струйки | 13300 | 320 | 5.4 | 80% | 47 |
| In situ | |||||||||
Глава 9 — Органические соединения кислорода — Химия
Глава 9 — Органические соединения кислорода
Вступительное эссе
9.1 Введение в соединения, содержащие кислород
9.2 Спирты и фенолы
Классификация спиртов
Свойства спиртов
Гликоли
Фенолы
9.3 эфира
Свойства эфиров
9,4 Альдегиды и кетоны
Свойства альдегидов и кетонов
Альдегиды
Кетоны
Точки кипения и растворимость
Альдегиды и кетоны в природе
9,5 Карбоновые кислоты и сложные эфиры
Свойства карбоновых кислот и сложных эфиров
Карбоновые кислоты
Сложные эфиры
Точки кипения, точки плавления и растворимость
Обычно используемые карбоновые кислоты и сложные эфиры
9.6 Реакции кислородсодержащих соединений
Спирты
Реакции обезвоживания (устранения)
Реакции окисления
Альдегиды и кетоны
Реакции окисления
Реакции восстановления
Реакции присоединения со спиртами (полуацетали и гемикетали)
Реакции с образованием ацеталей или кетов
Карбоновые кислоты
9.8 источников
Вступительное эссе
Фото: А. Савин
Вернуться к началу
9.1 Введение в соединения, содержащие кислород
В этой главе вы познакомитесь с основными органическими функциональными группами, содержащими кислород. Сюда входят спирты, фенолы, простые эфиры, альдегиды, кетоны, карбоновые кислоты и сложные эфиры. На рисунке 9.1 представлены основные органические функциональные группы этих соединений и суффикс ИЮПАК, который используется для обозначения этих соединений.Хотя вам не нужно официально называть полные структуры, вы должны иметь возможность идентифицировать функциональные группы, содержащиеся в соединениях, на основе их названий IUPAC. Например, спирт представляет собой органическое соединение с гидроксильной (-ОН) функциональной группой на алифатическом атоме углерода. Поскольку -ОН является функциональной группой всех спиртов, мы часто представляем спирты общей формулой ROH, где R представляет собой алкильную группу. В рекомендациях по номенклатуре ИЮПАК суффикс «-ол» используется для обозначения простых соединений, содержащих спирты.Примером может служить этанол (CH 3 CH 2 OH).
Рис. 9.1 Общие органические функциональные группы, содержащие кислород. Суффиксы ИЮПАК, используемые для обозначения простых органических молекул, отмечены в таблице
.Вернуться к началу
9.2 Спирты и фенолы
Классификация спиртов
Некоторые свойства и реакционная способность спиртов зависят от числа атомов углерода, присоединенных к конкретному атому углерода, который присоединен к группе -ОН.На этом основании спирты можно разделить на три класса.
- Первичный (1 °) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к одному другому атому углерода (синему). Его общая формула — RCH 2 OH.
- Вторичный (2 °) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к двум другим атомам углерода (синим цветом). Его общая формула: R 2 CHOH.
- Третичный (3 °) спирт — это спирт, в котором атом углерода (красный) с группой ОН присоединен к трем другим атомам углерода (синим цветом).Его общая формула: R 3 COH.
Свойства спиртов
Спирты можно рассматривать как производные воды (H 2 O; также обозначается как HOH).
Как и связь H – O – H в воде, связь R – O – H изогнута, а часть -OH в молекулах спирта полярна. Эта взаимосвязь особенно очевидна для небольших молекул и отражается в физических и химических свойствах спиртов с низкой молярной массой. Замена атома водорода в алкане на группу ОН позволяет молекулам связываться посредством водородных связей (рис.9.2).
Рисунок 9.2 Межмолекулярная водородная связь в метаноле. Группы ОН молекул спирта делают возможным образование водородных связей.
Напомним, что физические свойства в значительной степени определяются типом межмолекулярных сил. В таблице 9.1 перечислены молярные массы и точки кипения некоторых распространенных соединений. Из таблицы видно, что вещества с одинаковой молярной массой могут иметь совершенно разные точки кипения.
Таблица 9.1 Сравнение молярной массы и температуры кипения
Алканынеполярны и поэтому связаны только через относительно слабые лондонские дисперсионные силы (LDF). Температуры кипения алканов с одним-четырьмя атомами углерода настолько низки, что все эти молекулы при комнатной температуре являются газами. Напротив, если мы проанализируем соединения, содержащие функциональную группу спирта, даже метанол (только с одним атомом углерода) будет жидкостью при комнатной температуре. Поскольку спирты обладают способностью образовывать водородные связи, их точки кипения значительно выше по сравнению с углеводородами сопоставимой молярной массы.Температура кипения — это грубая мера количества энергии, необходимой для отделения молекулы жидкости от ближайших соседей. Если молекулы взаимодействуют посредством водородных связей, для разрушения этого межмолекулярного притяжения необходимо подавать относительно большое количество энергии. Только тогда молекула может перейти из жидкости в газообразное состояние.
Другая интересная тенденция очевидна в таблице 9.1: поскольку молекулы спирта содержат больше атомов углерода, они также имеют более высокие температуры кипения.Это потому, что молекулы могут иметь более одного типа межмолекулярных взаимодействий. В дополнение к водородным связям, молекулы спирта также имеют LDF, которые возникают между неполярными частями молекул. Как мы видели с алканами, чем больше углеродная цепь, тем больше LDF присутствует в молекуле. Как и в случае с алканами, повышенное количество ЛДФ в спиртосодержащих молекулах также вызывает повышение температуры кипения.
Помимо образования водородных связей между собой, спирты также могут вступать в водородные связи с молекулами воды (Рисунок 9.3). Таким образом, тогда как углеводороды нерастворимы в воде, небольшие спирты с одним-тремя атомами углерода полностью растворимы. Однако по мере увеличения длины цепи растворимость спиртов в воде снижается; молекулы становятся больше похожими на углеводороды и менее на воду. Спирт 1-деканол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH), содержащий 10 атомов углерода практически не растворяется в воде.Мы часто обнаруживаем, что граница растворимости в семействе органических соединений находится у четырех или пяти атомов углерода.
Рисунок 9.3 Водородная связь между молекулами метанола и молекулами воды. Водородная связь между ОН метанола и молекулами воды определяет растворимость метанола в воде.
Вернуться к началу
Гликоли
Молекулы, содержащие две функциональные группы спирта, часто называют гликолями .Этиленгликоль, один из простейших гликолей, имеет два основных коммерческих применения. Он используется в качестве сырья при производстве полиэфирных волокон и составов антифризов. Добавление двух или более групп -ОН к углеводороду существенно увеличивает температуру кипения и растворимость спирта. Например, для этиленгликоля температура кипения составляет 197,3 o ° C, по сравнению с этанолом, который имеет точку кипения 78 o ° C. Таким образом, этиленгликоль является полезным охлаждающим веществом для автомобильных двигателей.
Рисунок 9.4 Свойства этиленгликоля. Этиленгликоль часто используется в качестве охлаждающего агента в смесях антифризов из-за его низкой температуры замерзания и высокой температуры кипения.
Этиленгликоль ядовит для людей и других животных, с ним следует обращаться осторожно и утилизировать надлежащим образом. Как прозрачная жидкость со сладким вкусом, она может привести к случайному проглатыванию, особенно домашними животными, или может быть преднамеренно использована в качестве орудия убийства. Этиленгликоль трудно обнаружить в организме, и он вызывает симптомы, в том числе интоксикацию, тяжелую диарею и рвоту, которые можно спутать с другими болезнями или заболеваниями.Его метаболизм производит оксалат кальция, который кристаллизуется в головном мозге, сердце, легких и почках, повреждая их; в зависимости от уровня воздействия, накопление яда в организме может длиться недели или месяцы, прежде чем вызвать смерть, но смерть от острой почечной недостаточности может наступить в течение 72 часов, если человек не получит надлежащего лечения от отравления. Некоторые смеси антифризов на основе этиленгликоля содержат горький агент, такой как денатоний, для предотвращения случайного или преднамеренного употребления.Типичные смеси антифризов также содержат флуоресцентный зеленый краситель, который упрощает обнаружение и удаление пролитого антифриза.
Фенолы
Соединения, в которых группа -ОН присоединена непосредственно к ароматическому кольцу, называются фенолами и в химических уравнениях могут называться АРОН. Фенолы отличаются от спиртов слабой кислотностью в воде. Подобно реакциям кислотно-щелочной нейтрализации двойного вытеснения, они реагируют с водным гидроксидом натрия (NaOH) с образованием соли и воды.
ArOH (водн.) + NaOH (водн.) → ArONa (водн.) + H 2 O
Простейшее фенолсодержащее соединение, C 6 H 5 OH, само называется фенолом. (Старое название, подчеркивающее его легкую кислотность, было карболовой кислоты ). Фенол — это белое кристаллическое соединение, имеющее характерный («больничный запах») запах.
Рисунок 9.5 (Слева) Структура фенола. (справа) Примерно два грамма фенола в стеклянном флаконе.Фото В. Оэлена.Для вашего здоровья: фенолы и мы
Фенолы широко используются как антисептики (вещества, убивающие микроорганизмы на живых тканях) и как дезинфицирующие средства (вещества, предназначенные для уничтожения микроорганизмов на неодушевленных предметах, таких как мебель или полы). Первым широко применяемым антисептиком был фенол. Джозеф Листер использовал его для антисептической хирургии в 1867 году. Фенол, однако, токсичен для человека и может вызвать серьезные ожоги при нанесении на кожу.В кровотоке это системный яд , что означает, что он проникает во все части тела и поражает их. Его серьезные побочные эффекты привели к поискам более безопасных антисептиков, ряд из которых был найден.
Рис. 9.6 Операция 1753 г. перед применением антисептиков. Картина написана Гаспаре Траверси.
В настоящее время фенол используется только в очень малых концентрациях в некоторых безрецептурных медицинских продуктах, таких как хлорасептик для горла.
Рис. 9.7 Фенол все еще используется в низких концентрациях в некоторых медицинских препаратах, таких как хлоразептик.
Более сложные соединения, содержащие фенольные функциональные группы, обычно встречаются в природе, особенно в виде растительных натуральных продуктов. Например, одними из основных метаболитов, обнаруженных в зеленом чае, являются полифенольные катехиновые соединения, представленные на рис. 9.8А эпигаллокатехин галлатом (ЭКГК) и эпикатехином. Было показано, что зеленый чай обладает химиопрофилактическими свойствами на лабораторных животных.Считается, что биологическая активность катехинов как антиоксидантных агентов способствует этой активности и другим преимуществам для здоровья, связанным с потреблением чая. Некоторые из биологически активных компонентов марихуаны, такие как тетрагидроканнабинол (THC) и каннабидиол (CBD), также являются фенольными соединениями (рис. 9B).
Рис. 9.8 Натуральные продукты растительного происхождения, содержащие фенольные функциональные группы. (A) Зеленый чай содержит соединения катехина, такие как галлат эпигаллокатехина (ECGC), и эпикатехины, которые, как считается, обеспечивают некоторые из противораковых преимуществ для здоровья, присущих зеленому чаю.(B) Марихуана содержит множество биологически активных фенольных соединений, включая галлюциногенный компонент марихуаны, тетрагидроканнабинол (THC) и метаболит каннабидиол (CBD). Каннабидиол не обладает психоактивными свойствами и в настоящее время изучается в качестве потенциального лекарственного средства для лечения синдромов рефракционной эпилепсии.
Упражнения по обзору концепции
Почему этанол (CH 3 CH 2 OH) более растворим в воде, чем 1-гексанол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 OH) ?
Почему 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH) имеет более низкую точку кипения, чем 1-гексанол (CH 3 CH 2 CH 2 CH 2 СН 2 СН 2 ОН)?
Ответы
Этанол имеет группу -ОН и только 2 атома углерода; 1-гексанол имеет одну группу -ОН для 6 атомов углерода и, таким образом, больше похож на (неполярный) углеводород, чем на этанол.
1-гексанол имеет более длинную углеродную цепь, чем у 1-бутанола, и, следовательно, больше LDF, которые способствуют более высокой температуре кипения.
Упражнения
Ответьте на следующие упражнения, не обращаясь к таблицам в тексте.
Расположите эти спирты в порядке возрастания точки кипения: 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH), 1-гептанол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) и 1-пропанол (CH 3 CH 2 CH 2 OH).
Что имеет более высокую точку кипения — бутан (CH 3 CH 2 CH 2 CH 3 ) или 1-пропанол (CH 3 CH 2 CH 2 OH)?
Расположите эти спирты в порядке увеличения растворимости в воде: 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH), метанол (CH 3 OH) и 1-октанол (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH).
Расположите эти соединения в порядке увеличения растворимости в воде: 1-бутанол (CH 3 CH 2 CH 2 CH 2 OH), этанол (CH 3 CH 2 OH) и пентан. (Канал 3 Канал 2 Канал 2 Канал 2 Канал 3 ).
Ответы на нечетные вопросы
1-пропанол <1-бутанол <1-гептанол
1-октанол <1-бутанол <метанол
Вернуться к началу
9.3 эфира
Простые эфиры — это класс органических соединений, которые содержат кислород между двумя алкильными группами. Они имеют формулу R-O-R ’, где R’s представляют собой алкильные группы. эти соединения используются в красителях, парфюмерии, маслах, восках и в промышленности.
Свойства эфиров
Связи C — O в простых эфирах полярны, и, следовательно, эфиры имеют чистый дипольный момент. Слабая полярность эфиров не оказывает заметного влияния на их точки кипения, сравнимые с температурами кипения алкенов сопоставимой молекулярной массы.Эфиры имеют гораздо более низкие температуры кипения по сравнению с изомерными спиртами. Это связано с тем, что молекулы спиртов связаны водородными связями, в то время как молекулы эфира не могут образовывать водородные связи с другими молекулами эфира. Например, диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) имеет точку кипения 34,6 o C, тогда как н-бутанол, (CH 3 CH 2 CH 2 CH 2 OH), четырехуглеродный спирт, имеет пионт кипения 117.7 o С.
Эфиры могут образовывать водородные связи с водой, однако, поскольку вода содержит частично положительные атомы водорода, необходимые для образования водородных связей. Таким образом, простые эфиры, содержащие до 3 атомов углерода, растворимы в воде из-за образования Н-связей с молекулами воды.
Растворимость эфиров снижается с увеличением числа атомов углерода. Относительное увеличение углеводородной части молекулы снижает тенденцию образования Н-связи с водой.Эфиры в значительной степени растворимы в более неполярных органических растворителях и фактически могут использоваться в качестве растворителя для растворения неполярных и умеренно полярных молекул. Кроме того, простые эфиры очень неактивны. Фактически, за исключением алканов, циклоалканов и фторуглеродов, простые эфиры, вероятно, являются наименее химически активным обычным классом органических соединений. Таким образом, простые эфиры меньшего размера, такие как диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ), широко используются химиками-органиками в качестве растворителей для различных органических реакций.Инертность эфиров по отношению к спиртам, несомненно, связана с отсутствием реакционной связи О – Н.
Для вашего здоровья — Ethers and Us
В середине 1800-х — начале 1900-х годов диэтиловый эфир использовался в качестве анестетика во время хирургических операций, в значительной степени заменяя хлороформ из-за снижения токсичности. Общий анестетик действует на мозг, вызывая бессознательное состояние и общую нечувствительность к ощущениям или боли.Диэтиловый эфир (CH 3 CH 2 OCH 2 CH 3 ) был первым широко используемым анестетиком общего назначения.
Рис. 9.9 Уильям Мортон, стоматолог из Бостона, ввел диэтиловый эфир в хирургическую практику в 1846 году. На этой картине изображена операция в Бостоне в 1846 году, в которой диэтиловый эфир использовался в качестве анестетика. Вдыхание паров эфира вызывает потерю сознания, подавляя активность центральной нервной системы. Источник: Картина Уильяма Мортона Эрнеста Борта.
Диэтиловый эфир относительно безопасен, поскольку существует довольно большой разрыв между дозой, обеспечивающей эффективный уровень анестезии, и смертельной дозой. Однако, поскольку он легко воспламеняется и имеет дополнительный недостаток, вызывающий тошноту, его заменили более новыми ингаляционными анестетиками, включая фторсодержащие соединения галотан и галогенированные эфиры, десфлуран, изофлуран и севофлуран. Галогенированные эфиры, изофлуран, десфлуран и севофлуран демонстрируют меньшие побочные эффекты по сравнению с диэтиловым эфиром.К сожалению, безопасность этих соединений для персонала операционной была поставлена под сомнение. Например, женщины, работающие в операционной, подвергшиеся воздействию галотана, чаще страдают выкидышами, чем женщины в целом.
Простые эфиры также являются общими функциональными группами, обнаруженными в натуральных продуктах, и могут обладать уникальной биологической активностью. Фактически, было обнаружено, что некоторые очень большие соединения, содержащие несколько простых эфиров, называемые полиэфирами , вызывают нейротоксическое отравление моллюсками.В этом примере динофлаггелат, Karina brevis , который является возбудителем цветения водорослей красного прилива, производит класс высокотоксичных полиэфиров, называемых бреватоксинами. Бреватоксин А изображен на рисунке 9.10. Симптомы отравления включают рвоту и тошноту, а также различные неврологические симптомы, такие как невнятная речь.
Рисунок 9.10 Нейротоксическое отравление моллюсками. Динофлаггелат, Karina brevis , показанный в верхнем левом углу, является возбудителем вредоносного цветения водорослей красного прилива.Цветение морских водорослей может быть довольно обширным, как показано на фотографии красного прилива (вверху справа), происходящего недалеко от Сан-Диего, Калифорния. K. brevis производит класс полиэфиров, называемых бреватоксинами. Бреватоксин А показан в качестве примера. Моллюски и мышцы, питающиеся фильтром, заражаются динофлаггелатом и могут вызвать нейротоксическое отравление моллюсками при употреблении в пищу. Красные приливы могут иметь серьезные экономические издержки, поскольку рыболовство и промысел моллюсков должны быть закрыты до тех пор, пока уровни токсинов в коммерческих продуктах не вернутся к приемлемым уровням.
Вернуться к началу
9,4 Альдегиды и кетоны
Альдегиды и кетоны характеризуются наличием карбонильной группы (C = O), и их реакционную способность обычно можно понять, признав, что карбонильный углерод содержит частичный положительный заряд (δ +), а карбонильный кислород содержит частичный отрицательный заряд. (δ−). Альдегиды обычно более реакционноспособны, чем кетоны.
Карбонильная группа
A карбонильная группа представляет собой химически органическую функциональную группу, состоящую из атома углерода, связанного двойной связью с атомом кислорода -> [ C = O ] Простейшими карбонильными группами являются альдегиды и кетоны, обычно связанные с другим углеродным соединением.Эти структуры можно найти во многих ароматических соединениях, влияющих на запах и вкус.
Прежде чем углубляться в подробности, обязательно поймите, что сама сущность C = O известна как « c арбонильная группа », в то время как члены этой группы называются « карбонильные соединения ». «.
Как обсуждалось ранее, мы понимаем, что у кислорода есть две неподеленные пары электронов. Эти электроны делают кислород более электроотрицательным, чем углерод.Тогда углерод является частично положительным (или электрофильным = «любящим электроны»), а кислород частично отрицательным ( нуклеофильным = «любящим ядро или протонами»). Поляризуемость обозначается дельтой в нижнем регистре и положительным или отрицательным верхним индексом в зависимости от атома. Например, углерод будет иметь δ + , а кислород — —.
Свойства альдегидов и кетонов
Альдегиды
В альдегидах к карбонильной группе присоединен атом водорода вместе с
- второй атом водорода
- или, чаще, углеводородная группа, которая может быть алкильной группой или группой, содержащей бензольное кольцо.
В этом разделе мы игнорируем те, которые содержат бензольные кольца. Ниже приведены некоторые примеры альдегидов
Обратите внимание, что все они имеют один и тот же конец молекулы. Все, что отличается, — это сложность другой присоединенной углеродной группы. Когда вы пишете формулы для них, альдегидная группа (карбонильная группа с присоединенным атомом водорода) всегда записывается как -CHO — никогда как COH. Его легко спутать с алкоголем.Ethanal, например, записывается как CH 3 CHO; метанал как HCHO.
Кетоны
В кетонах к карбонильной группе присоединены две углеродные группы. Опять же, это могут быть либо алкильные группы, либо группы, содержащие бензольные кольца. Обратите внимание, что к карбонильной группе кетонов никогда не присоединен атом водорода.
Пропанон обычно обозначается как CH 3 COCH 3 .
Точки кипения и растворимость
Метаналь, также известный как формальдегид (HCHO), представляет собой газ при комнатной температуре (точка кипения -21 ° C), а этаналь, также известный как ацетальдегид, имеет температуру кипения + 21 ° C. Это означает, что этаналь кипит при температуре, близкой к комнатной. Более крупные альдегиды и кетоны являются жидкостями, температура кипения которых повышается по мере увеличения размера молекул. Величина точки кипения определяется силой межмолекулярных сил.В этих молекулах обнаружены две основные межмолекулярные силы:
- Лондонские силы дисперсии : Эти притяжения тем сильнее, чем длиннее молекулы и чем больше электронов. Это увеличивает размеры устанавливаемых временных диполей. Вот почему точки кипения увеличиваются с увеличением числа атомов углерода в цепях — независимо от того, говорите ли вы об альдегидах или кетонах.
- Диполь-дипольное притяжение : И альдегиды, и кетоны являются полярными молекулами из-за наличия двойной связи углерод-кислород.Помимо дисперсионных сил, между постоянными диполями на соседних молекулах также будет существовать притяжение. Это означает, что точки кипения будут выше, чем у углеводородов аналогичного размера, которые обладают только дисперсионными силами. Интересно сравнить три молекулы одинакового размера. Они имеют одинаковую длину и одинаковое (хотя и не одинаковое) количество электронов.
Поляризация карбонильных групп также влияет на температуру кипения альдегидов и кетонов, которая выше, чем у углеводородов аналогичного размера.Однако, поскольку они не могут образовывать водородные связи, их температуры кипения обычно ниже, чем у спиртов аналогичного размера. В таблице 9.2 приведены некоторые примеры соединений одинаковой массы, но содержащих разные типы функциональных групп. Обратите внимание, что соединения с более сильными межмолекулярными силами имеют более высокие температуры кипения.
Алканы <Альдегиды <Кетоны <Спирты
Таблица 9.2 Сравнение точек кипения и межмолекулярных сил
Из-за полярности карбонильной группы атом кислорода альдегида или кетона вступает в водородную связь с молекулой воды.
Таким образом, растворимость альдегидов и кетонов примерно такая же, как у спиртов и простых эфиров. Формальдегид (HCHO), ацетальдегид (CH 3 CHO) и ацетон ((CH 3 ) 2 CO) растворимы в воде. По мере увеличения длины углеродной цепи растворимость в воде уменьшается. Граница растворимости находится примерно при четырех атомах углерода на атом кислорода. Все альдегиды и кетоны растворимы в органических растворителях и, как правило, менее плотны, чем вода.
Вернуться к началу
Альдегиды и кетоны в природе
Подобно другим кислородсодержащим функциональным группам, обсуждавшимся до сих пор, альдегиды и кетоны также широко распространены в природе и часто сочетаются с другими функциональными группами. Примеры встречающихся в природе молекул, которые содержат функциональную группу альдегида или кетона, показаны на следующих двух рисунках. Соединения на рисунке 9.11 обнаруживаются в основном в растениях или микроорганизмах, а также в соединениях на рисунке 9.12 имеют животное происхождение. Многие из этих молекулярных структур хиральны и имеют четкую стереохимию.
Когда хиральные соединения встречаются в природе, они обычно являются энантиомерно чистыми, хотя разные источники могут давать разные энантиомеры. Например, карвон обнаружен как его левовращающий (R) -энантиомер в масле мяты курчавой, тогда как семена тмина содержат правовращающий (S) -энантиомер. В этом случае изменение стереохимии вызывает резкое изменение воспринимаемого запаха.Альдегиды и кетоны известны своим сладким, а иногда и резким запахом. Запах ванильного экстракта исходит от молекулы ванилина. Точно так же бензальдегид обеспечивает сильный запах миндаля. Благодаря приятным ароматам молекулы, содержащие альдегиды и кетоны, часто встречаются в парфюмерии. Однако не все ароматы приятны. В частности, 2-гептанон обеспечивает часть резкого запаха голубого сыра, а (R) -Muscone является частью мускусного запаха гималайской кабарги.Наконец, кетоны присутствуют во многих важных гормонах, таких как прогестерон (женский половой гормон) и тестостерон (мужской половой гормон). Обратите внимание, как тонкие различия в структуре могут вызвать резкие изменения в биологической активности. Функциональность кетонов также проявляется в противовоспалительном стероиде кортизоне.
Рис. 9.11 Примеры молекул, содержащих альдегид и кетон, выделенных из растительных источников.
Рисунок 9.12 Примеры молекул, содержащих альдегид и кетон, выделенных из животных источников.
Для вашего здоровья: кетоны в крови, моче и дыхании
Кетоны образуются в организме человека как побочный продукт липидного обмена. Два общих метаболита, продуцируемых в организме человека, — это кетонсодержащая ацетоуксусная кислота и метаболит спирта, β-гидроксибутират. Ацетон также производится как продукт распада ацетоуксусной кислоты. Затем ацетон может выводиться из организма с мочой или в виде летучего продукта через легкие.
Обычно кетоны не попадают в кровоток в заметных количествах. Например, нормальная концентрация ацетона в организме человека составляет менее 1 мг / 100 мл крови. Вместо этого кетоны, которые образуются в процессе метаболизма липидов внутри клеток, обычно полностью окисляются и расщепляются на углекислый газ и воду. Это потому, что глюкоза является основным источником энергии для тела, особенно для мозга. Глюкоза в контролируемых количествах попадает в кровоток печенью, где она распространяется по всему телу, обеспечивая энергию.Для мозга это основной источник энергии, так как гематоэнцефалический барьер блокирует транспорт больших липидных молекул. Однако во время голодания, когда глюкоза недоступна или при определенных болезненных состояниях, когда метаболизм глюкозы нарушен, например, при неконтролируемом сахарном диабете, концентрации кетонов в крови повышаются до более высоких уровней, чтобы обеспечить мозг альтернативным источником энергии. Однако, поскольку ацетоуксусная кислота и β-гидроксибутират содержат функциональные группы карбоновых кислот, добавление этих молекул в кровь вызывает закисление, которое, если его не контролировать, может вызвать опасное состояние, называемое кетоацидозом.Кетоацидоз может быть опасным для жизни событием. Кетоны легко обнаружить, поскольку ацетон выводится с мочой. В тяжелых случаях запах ацетона также может ощущаться в дыхании.
Вернуться к началу
9,5 Карбоновые кислоты и сложные эфиры
Карбоновые кислоты можно легко распознать, поскольку они имеют карбонильный углерод, который также непосредственно связан с функциональной группой спирта. Таким образом, карбонильный углерод также присоединен непосредственно к спирту.В сложноэфирной функциональной группе карбонильный углерод также непосредственно присоединен как часть простой эфирной функциональной группы.
Свойства карбоновых кислот и сложных эфиров
Карбоновые кислоты
Карбоновые кислоты — это органические соединения, которые включают карбоксильную функциональную группу, CO 2 Н. Название карбоксил происходит от того факта, что карбонильная и гидроксильная группы присоединены к одному и тому же атому углерода.
Карбоновые кислоты названы так потому, что они могут отдавать водород для образования карбоксилатного иона.Факторы, влияющие на кислотность карбоновых кислот, будут обсуждены позже.
Сложные эфиры
Сложный эфир — это органическое соединение, которое является производным карбоновой кислоты, в которой атом водорода гидроксильной группы заменен на алкильную группу. Структура является продуктом карбоновой кислоты (R-часть) и спирта (R’-часть). Общая формула сложного эфира показана ниже.
Группа R может представлять собой водород или углеродную цепь.Группа R ‘должна быть углеродной цепью, поскольку атом водорода сделает молекулу карбоновой кислотой. Шаги по названию сложных эфиров вместе с двумя примерами показаны ниже.
Точки кипения, точки плавления и растворимость
Карбоновые кислоты могут образовывать димеры с водородными связями, температура кипения которых выше, чем у спиртов аналогичного размера (таблица 9.3).
Таблица 9.3 Сравнение точек кипения соединений аналогичного размера
Мелкие сложные эфиры имеют температуру кипения ниже, чем у альдегидов и кетонов с аналогичной массой (Таблица 9.3). Сложные эфиры, как и альдегиды и кетоны, являются полярными молекулами. однако их диполь-дипольные взаимодействия слабее, чем у альдегидов и кетонов, и они не могут образовывать водородные связи. Таким образом, их температуры кипения выше, чем у простых эфиров, и ниже, чем у альдегидов и кетонов аналогичного размера.
Карбоновые кислоты с низким молекулярным весом обычно находятся в жидком состоянии при комнатной температуре, тогда как более крупные молекулы образуют воскообразные твердые вещества. Карбоновые кислоты с длиной углеродной цепи от 12 до 20 атомов углерода обычно называют жирными кислотами, поскольку они обычно содержатся в жирах и маслах.По сравнению с другими кислородсодержащими молекулами, карбоновые кислоты с короткой цепью обычно растворимы в воде из-за их способности образовывать водородные связи. По мере увеличения длины углеродной цепи растворимость карбоновой кислоты в воде снижается. Сложные эфиры также могут связываться водородом с водой, хотя и не так эффективно, как карбоновые кислоты, и поэтому они немного менее растворимы в воде, чем карбоновые кислоты аналогичного размера.
Карбоновые кислоты обычно имеют неприятный, резкий и даже прогорклый запах.Например, запах уксуса возникает из-за этановой кислоты (также известной как уксусная кислота). Запах тренажерных залов и немытых носков в значительной степени вызван бутановой кислотой, а гексановая кислота отвечает за сильный запах лимбургского сыра. Из-за своей кислой природы карбоновые кислоты также имеют кислый вкус, как это отмечается для уксуса и лимонной кислоты, содержащихся во многих фруктах. С другой стороны, сложные эфиры обладают приятным ароматом и ответственны за аромат многих фруктов и цветов. Сложные эфиры также могут иметь фруктовый привкус.
Практические задачи:
Какое соединение имеет более высокую точку кипения — CH 3 CH 2 CH 2 OCH 2 CH 3 или CH 3 CH 2 CH 2 COOH? Объясни.
Какое соединение имеет более высокую точку кипения — CH 3 CH 2 CH 2 CH 2 CH 2 OH или CH 3 CH 2 CH 2 COOH? Объясни.
Какое соединение более растворимо в воде — CH 3 COOH или CH 3 CH 2 CH 2 CH 3 ? Объясни.
Какое соединение более растворимо в воде — CH 3 CH 2 COOH или CH 3 CH 2 CH 2 CH 2 CH 2 COOH? Объясни.
ответы
CH 3 CH 2 CH 2 COOH из-за водородной связи (Нет межмолекулярной водородной связи с CH 3 CH 2 CH 2 OCH 2 CH 3 .)
Обычно используемые карбоновые кислоты и сложные эфиры
Карбоновые кислоты и сложные эфиры широко распространены в природе и используются для множества целей. Например, муравьи из семейства Formicidae используют простейшую карбоновую кислоту, муравьиную кислоту, как в качестве химической защиты, так и в качестве атаки, чтобы подчинить добычу (рис.9.13А). Разбавленный раствор уксусной кислоты (5%) содержится в уксусе и отвечает за кислый и резкий вкус. Уксусная кислота также придает хлебу на закваске острый вкус и отвечает за кислый привкус вина. Лимонная кислота содержится во многих фруктах и является причиной их кислого вкуса. Другие карбоновые кислоты, такие как ПАБК и гликолевая кислота, используются в косметической промышленности. ПАБК, которая вырабатывается растениями, грибами и бактериями, является обычным компонентом пищи и по структуре связана с витамином фолиевой кислоты.В 1943 году ПАБК был запатентован как одно из первых соединений, используемых при производстве солнцезащитного крема. Однако с середины 1980-х его использование перестало быть популярным из-за опасений, что он может увеличить клеточное УФ-повреждение, а также способствовать возникновению аллергии. Гликолевая кислота является наименьшей из кислот класса α-гидроксикислот, и она нашла применение как в пищевой, так и в косметической промышленности. В пищевой промышленности он используется в качестве консерванта, а в индустрии ухода за кожей он чаще всего используется в качестве химического пилинга для уменьшения рубцов на лице от прыщей.
Рис. 9.13 Источники и использование обычных карбоновых кислот. (A) Муравьиная кислота — это защитный токсин, используемый муравьями семейства Formicidae. Фото Мухаммада Махди Карима (B) Уксус — это 5% раствор уксусной кислоты. На фотографии слева показаны разные сорта уксуса на рынке во Франции. Фото Жоржа Сегена (C) Лимонная кислота — обычный компонент фруктов, придающий им кислый вкус. Фотография лимонов, сделанная Андре Карватом (D). Пара-аминобензойная кислота (ПАБК) — карбоновая кислота, обычно встречающаяся в растениях и пищевых культурах, включая цельное зерно.Он был запатентован в 1943 году для использования в солнцезащитных средствах. Однако из-за опасений по поводу безопасности и аллергической реакции использование ПАБК для этой цели было прекращено. Фотография солнцезащитного крема предоставлена HYanWong (E) Гликолевая кислота обычно используется в косметике в качестве химического пилинга, используемого для уменьшения рубцов от прыщей. На фото слева — до лечения, а справа — после нескольких процедур с гликолевой кислотой. Исследование гликолей предоставлено Джайшри Шарад.
Сложные эфиры легко синтезируются и в большом количестве от природы способствуют вкусу и аромату многих фруктов и цветов.Например, сложный эфир метилсалицилата также известен как масло грушанки (рис. 9.14). Фруктовый аромат ананасов, груш и клубники обусловлен сложными эфирами, а также сладким ароматом рома.
Рис. 9.14. Фруктовые и приятные ароматы сложных эфиров можно найти в (A) масле грушанки, (B) аромате ананасов и (C) сладости рома. Фотография (A) Gaultheria procumbens , производителя масла грушанки предоставлена: LGPL (B) фото ананаса предоставлено: David Monniaux, и (C) Фотография рома предоставлена: Summerbl4ck
Сложные эфиры также составляют основную часть животных жиров и растительных масел в виде триглицеридов.Образование липидов и жиров будет более подробно описано в главе 11.
Вернуться к началу
9.6 Реакции кислородсодержащих соединений
Спирты
Функциональные группы спирта могут участвовать в нескольких различных типах реакций. В этом разделе мы обсудим два основных типа реакций. Первые — это реакции дегидратации, а вторые — реакции окисления.Спирты также могут участвовать в реакциях присоединения и замещения с другими функциональными группами, такими как альдегиды, кетоны и карбоновые кислоты. Эти типы реакций будут обсуждаться более подробно в разделах, посвященных альдегидам, кетонам и карбоновым кислотам.
Реакции обезвоживания (устранения)
В главе 8 мы узнали, что спирты могут образовываться в результате гидратации алкенов во время реакций присоединения. Мы также узнали, что может произойти и обратная реакция.Спирты могут быть удалены или удалены из молекул посредством процесса дегидратации (или удаления воды). Результатом реакции элиминирования является образование алкена и молекулы воды.
Реакции элиминирования, которые происходят с более сложными молекулами, могут привести к более чем одному возможному продукту. В этих случаях алкен образуется в более замещенном положении (у углерода, который имеет больше атомов углерода и меньше атомов водорода).Например, в реакции ниже спирт не является симметричным. Таким образом, существует два возможных продукта реакции элиминирования, вариант 1 и вариант 2. В варианте 1 алкен образуется с углеродом, который имеет наименьшее количество присоединенных атомов водорода, тогда как в варианте 2 алкен образуется с углеродом, имеющим большинство атомов водорода присоединены. Таким образом, вариант 1 будет основным продуктом реакции, а вариант 2 — второстепенным.
Реакции отщепления спирта с использованием небольших 1 o спиртов также могут быть использованы для получения простых эфиров.Для получения эфира, а не алкена, температура реакции должна быть снижена, и реакция должна проводиться с избытком спирта в реакционной смеси. Например:
| 2 канала 3 канала 2 -OH + H 2 SO 4 | 130 ºC | CH 3 CH 2 -O-CH 2 CH 3 + H 2 O |
| CH 3 CH 2 -OH + H 2 SO 4 | 150 ºC | CH 2 = CH 2 + H 2 O |
В этой реакции необходимо использовать избыток спирта и поддерживать температуру около 413 К.Если спирт не используется в избытке или температура выше, спирт предпочтительно подвергнется дегидратации с образованием алкена. Дегидратация вторичных и третичных спиртов для получения соответствующих эфиров неэффективна, поскольку в этих реакциях слишком легко образуются алкены.
Реакции окисления
Некоторые спирты также могут подвергаться реакциям окисления. Помните, что в окислительно-восстановительных реакциях компонент реакции, который окисляется, теряет электроны (LEO), в то время как молекула, получающая электроны, восстанавливается (GER).В органических реакциях поток электронов обычно следует за потоком атомов водорода. Таким образом, молекула, теряющая водород, обычно также теряет электроны и является окисленным компонентом. Молекула, набирающая электроны, сокращается. Для спиртов могут быть окислены как первичные, так и вторичные спирты. С другой стороны, третичные спирты не окисляются. Во многих реакциях окисления окислитель показан над стрелкой реакции как [O]. Окислитель может быть металлом или другой органической молекулой.В реакции окислителем является молекула, которая восстанавливается или принимает электроны.
В реакциях окисления спирта водород из спирта и водород, связанный с углеродом, к которому присоединен спирт, вместе со своими электронами удаляются из молекулы окислителем. Удаление атомов водорода и их электронов приводит к образованию карбонильной функциональной группы. В случае первичного спирта результатом является образование альдегида.В случае вторичного спирта результатом является образование кетона. Обратите внимание, что для третичного спирта углерод, присоединенный к спиртовой функциональной группе, не имеет присоединенного к нему атома водорода. Таким образом, он не может подвергаться окислению. Когда третичный спирт подвергается воздействию окислителя, реакции не происходит.
Обратите внимание, что для первичного спирта, который подвергается окислению, он все еще сохраняет атом водорода, который присоединен к карбонильному углероду во вновь образованном альдегиде.Эта молекула может подвергаться вторичной реакции окисления с окислителем и водой, чтобы добавить еще один атом кислорода и удалить карбонильный атом водорода. Это приводит к образованию карбоновой кислоты.
Для вашего здоровья: физиологические эффекты спиртов
Метанол довольно ядовит для человека. Проглатывание всего 15 мл метанола может вызвать слепоту, а 30 мл (1 унция) — смерть. Однако обычная смертельная доза составляет от 100 до 150 мл.Основная причина токсичности метанола заключается в том, что у нас есть ферменты печени, которые катализируют его окисление до формальдегида, простейшего члена семейства альдегидов:
Формальдегид быстро вступает в реакцию с компонентами клеток, коагулируя белки почти так же, как при варке яйца. Это свойство формальдегида объясняет большую часть токсичности метанола.
Органические и биохимические уравнения часто записываются, показывая только органические реагенты и продукты.Таким образом, мы фокусируем внимание на исходном органическом материале и продукте, а не на балансировании сложных уравнений.
Этанол окисляется в печени до ацетальдегида:
Ацетальдегид, в свою очередь, окисляется до уксусной кислоты (HC 2 H 3 O 2 ), нормальной составляющей клеток, которая затем окисляется до диоксида углерода и воды. Даже в этом случае этанол потенциально токсичен для человека. Быстрое употребление 1 pt (около 500 мл) чистого этанола убило бы большинство людей, а от острого отравления этанолом ежегодно умирает несколько сотен человек — часто тех, кто участвует в каком-то соревновании по выпивке.Этанол свободно проникает в мозг, где он угнетает центр контроля дыхания, что приводит к отказу дыхательных мышц в легких и, как следствие, к удушью. Считается, что этанол действует на мембраны нервных клеток, вызывая ухудшение речи, мышления, познания и суждения.
Медицинский спирт обычно представляет собой 70% водный раствор изопропилового спирта. Он имеет высокое давление пара, а его быстрое испарение с кожи производит охлаждающий эффект. При проглатывании он токсичен, но, по сравнению с метанолом, хуже всасывается через кожу.
Напишите уравнение окисления каждого спирта. Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции не происходит, напишите «нет реакции» после стрелки.
- Канал 3 Канал 2 Канал 2 Канал 2 Канал 2 ОН
Решение
Первый шаг — определить класс каждого алкоголя как первичный, вторичный или третичный.
Этот спирт имеет группу ОН на атоме углерода, который присоединен только к одному другому атому углерода , так что это первичный спирт. При окислении сначала образуется альдегид, а при дальнейшем окислении образуется карбоновая кислота.
Этот спирт имеет группу ОН на атоме углерода, который присоединен к трем другим атомам углерода, поэтому это третичный спирт. Никакой реакции не происходит.
Этот спирт имеет группу ОН на атоме углерода, который присоединен к двум другим атомам углерода, так что это вторичный спирт; окисление дает кетон.
Напишите уравнение окисления каждого спирта. Используйте [O] над стрелкой, чтобы указать окислитель. Если реакции не происходит, напишите «нет реакции» после стрелки.
Вернуться к началу
Альдегиды и кетоны
В этом разделе мы обсудим первичные реакции альдегидов и кетонов. К ним относятся реакции окисления и восстановления, а также реакции сочетания со спиртами.
Реакции окисления
Как показано выше в разделе, посвященном спиртам, альдегиды могут подвергаться окислению с образованием коарбоновой кислоты. Это связано с тем, что карбонильный атом углерода все еще сохраняет атом водорода, который можно удалить и заменить атомом кислорода. Кетоны, с другой стороны, не содержат атом водорода, связанный с карбонильным атомом углерода. Таким образом, они не могут подвергаться дальнейшему окислению. Как отмечалось выше, кетоны, которые подвергаются воздействию окислителя, не вступают в реакцию.
Реакции восстановления
В результате реакций восстановления с альдегидами и кетонами эти соединения превращаются в первичные спирты в случае альдегидов и вторичные спирты в случае кетонов. По сути, это реакции, обратные реакциям окисления спирта.
Например, с альдегидом этанал получается первичный спирт, этанол:
Обратите внимание, что это упрощенное уравнение, где [H] означает «водород из восстановителя».В общем, восстановление альдегида приводит к первичному спирту.
Восстановление кетона, такого как пропанон, даст вам вторичный спирт, такой как 2-пропанол:
Восстановление кетона приводит к вторичному спирту.
Реакции присоединения со спиртами
Альдегиды и кетоны могут реагировать с функциональными группами спирта в реакциях присоединения (комбинации).Эти типы реакций обычны по своей природе и очень важны в процессе циклизации молекул сахара. Мы вернемся к этому вопросу в главе 11 во введении к основным макромолекулам организма.
Когда к альдегиду добавляется спирт, получается полуацеталь ; когда к кетону добавляют спирт, получается полукеталь .
В приведенной выше реакции B: относится к основанию, которое присутствует в растворе и может действовать как акцептор протонов.В этой реакции обычное основание активирует спирт в реакции (кислород спирта показан красным). Кислород спирта тогда заряжается отрицательно, потому что он переносит лишние электроны от водорода. Теперь он может действовать как нуклеофил и атаковать карбонильный углерод альдегида или кетона. Когда кислород спирта образует связь с карбонильным углеродом альдегида или кетона, это замещает одну из двойных связей карбонильной группы. Оксиен из карбонила затем вытягивает водород из обычной кислоты, присутствующей в растворе.На этой диаграмме обычная кислота обозначена как H-A. При этом образуется спирт на месте карбонильной группы альдегида или кетона. Исходная спиртовая группа теперь выглядит как эфирная функциональная группа. Таким образом, вы можете распознать полуацетали и гемикетали в натуральных продуктах как атом углерода, который одновременно связан как со спиртовой, так и с простой эфирной функциональной группой. Если этот углерод также имеет водородную связь с ним, он происходит из альдегида и называется полуацеталем .Если центральный углерод связан с двумя другими атомами углерода (обозначенными выше R 1 и R 3 выше) в дополнение к атомам кислорода, молекула произошла от кетона и называется полукеталем .
Приставка « hemi» (половина) используется в каждом термине, потому что, как мы вскоре увидим, может произойти второе добавление нуклеофила спирта, что приведет к образованию видов, называемых ацеталей и кеталей .
Образование полуацеталей и полукеталей в биологических системах является обычным явлением и часто происходит спонтанно (без присутствия катализатора или фермента), особенно в случае простых молекул сахара.Из-за спонтанности реакций они также очень обратимы: полуацетали и гемикетали легко превращаются обратно в альдегиды и кетоны плюс спирт. Механизм обратного превращения полуацеталя в альдегид показан ниже:
Практические задачи:
Реакции с образованием ацеталей или кеталов
Когда полуацеталь (или гемикеталь) подвергается нуклеофильной атаке со стороны второй молекулы спирта, результат называется ацеталем (или кеталем ).
В то время как образование полуацеталя из альдегида и спирта (шаг 1 выше) является нуклеофильным присоединением, образование ацеталя из полуацеталя (шаг 2 выше) представляет собой реакцию нуклеофильного замещения с исходным карбонилом кислород (показан синим) выходит в виде молекулы воды. Поскольку вода покидает молекулу во второй реакции (стадия 2), эта реакция также известна как реакция дегидратации . Реакция замещения, происходящая на второй стадии, не происходит спонтанно и не является легко обратимой.Внутри биологических систем для образования ацеталя или кеталя потребуется фермент. Обратите внимание, что и ацеталь, и кеталь выглядят как центральный углерод, связанный с двумя функциональными группами простого эфира. Если этот центральный углерод также связан с водородом, то это ацталь, а если он связан с двумя атомами углерода, это кеталь. Обратная реакция могла бы включать разрушение ацеталя или кеталя с использованием гидролиза или проникновения воды в молекулу.
Практические задачи:
Вернуться к началу
Карбоновые кислоты
Кислотность карбоновых кислот
Согласно определению кислоты как «вещества, которое отдает протоны (ионы водорода) другим вещам», карбоновые кислоты являются кислыми, потому что водород в группе -COOH может быть передан другим молекулам.В растворе в воде ион водорода передается от группы -COOH к молекуле воды. Например, с этановой кислотой (как показано ниже) вы получаете этаноат-ион, образованный вместе с ионом гидроксония, H 3 O + .
CH 3 COOH + H 2 O ⇌ CH 3 COO — + H 3 O +
Эта реакция обратима, и в случае этановой кислоты (уксусной кислоты) не более 1% кислоты прореагировало с образованием ионов в любой момент времени.
Таким образом, карбоновые кислоты являются слабыми кислотами.
Карбоновые кислоты и образование солей
Из-за своей кислой природы карбоновые кислоты могут реагировать с более химически активными металлами с образованием ионных связей и образованием солей. Реакции такие же, как и с кислотами, такими как соляная кислота, за исключением того, что они, как правило, довольно медленнее.
2CH 3 COOH (водн.) + Mg (s) → (CH 3 COO) 2 Mg + H 2
В указанной выше реакции разбавленная этановая кислота реагирует с магнием.Магний реагирует с образованием бесцветного раствора этаноата магния, и выделяется газообразный водород. Если вы используете магниевую ленту, реакция будет менее интенсивной, чем такая же реакция с соляной кислотой, но с порошком магния обе протекают так быстро, что вы, вероятно, не заметите большой разницы.
Пример проблемы:
Напишите уравнение для каждой реакции.
- ионизация пропионовой кислоты (CH 2 CH 2 COOH) в воде (H 2 O)
- нейтрализация пропионовой кислоты водным гидроксидом натрия (NaOH)
Решение:
Пропионовая кислота ионизируется в воде с образованием пропионат-иона и иона гидроксония (H 3 O + ).
CH 3 CH 2 COOH (водн.) + H 2 O (ℓ) → CH 3 CH 2 COO — (водн.) + H 3 O + (водн.)
Пропионовая кислота реагирует с NaOH (водн.) С образованием пропионата натрия и воды.
CH 3 CH 2 COOH (водн.) + NaOH (водн.) → CH 3 CH 2 COO — Na + (водн.) + H 2 O (ℓ)
Образование сложных эфиров из карбоновых кислот и спиртов
Сложный эфир может быть образован путем объединения карбоновой кислоты со спиртом в присутствии сильной кислоты или в присутствии фермента в биологических системах.В реакции этерификации гидроксильная группа карбоновой кислоты действует как уходящая группа и образует молекулу воды в конечном продукте. Он заменен группой -OR из спирта.
Реакция обратимая. В качестве конкретного примера реакции этерификации бутилацетат может быть получен из уксусной кислоты и 1-бутанола.
Более подробно: конденсационные полимеры
Коммерчески важной реакцией этерификации является конденсационная полимеризация, при которой происходит реакция между дикарбоновой кислотой и двухатомным спиртом (диолом) с удалением воды.Такая реакция дает сложный эфир, который содержит свободную (непрореагировавшую) карбоксильную группу на одном конце и свободную спиртовую группу на другом конце. Затем происходят дальнейшие реакции конденсации с образованием полиэфирных полимеров.
Самый важный полиэфир, полиэтилентерефталат (ПЭТ), производится из мономеров терефталевой кислоты и этиленгликоля:
Из молекул полиэстера получаются отличные волокна, которые используются во многих тканях. Вязаная полиэфирная трубка, которая является биологически инертной, может использоваться в хирургии для восстановления или замены пораженных участков кровеносных сосудов.ПЭТ используется для изготовления бутылок для газировки и других напитков. Из него также образуются пленки, называемые майларом. В магнитном покрытии майларовая лента используется в аудио- и видеокассетах. Синтетические артерии могут быть изготовлены из ПЭТ, политетрафторэтилена и других полимеров.
Практические задачи:
Завершите следующие реакции:
Гидролиз сложных эфиров
Обратную реакцию образования сложного эфира можно использовать для разложения сложных эфиров на карбоновую кислоту и спирт.Эта реакция требует включения воды в сложноэфирную связь, и поэтому называется реакцией гидролиза .
Сложный эфир нагревают с большим избытком воды, содержащей сильный кислотный катализатор. Как и при этерификации, реакция обратима и не доходит до завершения.
В качестве конкретного примера бутилацетат и вода реагируют с образованием уксусной кислоты и 1-бутанола. Реакция обратима и не доходит до завершения.
Практические задачи:
Вернуться к началу
9.7 Краткое содержание главы
Гидроксильная группа (ОН) является функциональной
Анализ серы позволяет определить время появления кислорода
Марк Торрес. Предоставлено: Университет Райса.Ученые долгое время считали, что кислород появился в нижних слоях атмосферы Земли 2,7 миллиарда лет назад, сделав возможной жизнь, которую мы знаем. Исследователь из Университета Райса добавил доказательства, подтверждающие это число.
Рекорд по содержанию серы, установленный древними породами, знаменует резкие изменения в атмосфере планеты, которые привели к возникновению сложной жизни, но камни являются местным индикатором.Для большей картины, биогеохимик Райса Марк Торрес использовал воду, которая течет и размывает скалы в качестве прокси.
Торрес, доцент кафедры Земли, окружающей среды и планетных наук Райс, и его коллеги сообщают в Nature Geoscience , что баланс аномалий изотопов серы в архейских породах, маркер «великого события оксигенации», также можно распознать и измеряется в реках, размывающих его.
Исследователи взяли пробы воды в двух из немногих мест на Земле, где архейские породы обнажены в изобилии: в Верхнем кратоне в Канаде и в Южной Африке.Они определили, что, хотя отдельные образцы горных пород могут по-прежнему демонстрировать дисбаланс (аномалии) изотопов серы, тщательный анализ воды, которая диффундирует и переносит серу из тысячи миль породы в океан, показывает, что содержание в конечном итоге соответствует объему. Подпись серы Земли.
«Изменения в химии могут кое-что сказать вам об окружающей среде, а камни могут сказать вам, был ли кислород в определенное время», — сказал Торрес. «В начале нашей истории аномалии изотопов серы встречаются повсюду.Затем, примерно 2,7 миллиарда лет назад, они исчезают и больше не возвращаются ».
Сера является маркером, потому что четыре стабильных изотопа, известные своими молекулярными массами 32, 33, 34 и 36, могут демонстрировать различное поведение, когда присутствуют в атмосфере. «Большая часть серы имеет массу 32, но есть небольшие количества других масс», — сказал Торрес.
Ультрафиолетовый свет солнца вступил в реакцию с серным газом и разделил его на отдельные соединения с более тяжелыми и более легкими изотопами. В конце концов, эти соединения погрузились в образовавшуюся в то время породу и остаются в ней.
«Но есть одна странность: на самом деле в старых породах содержится больше серы-33, чем мы ожидали, исходя из относительных масс», — сказал Торрес. «Поскольку 33 на единицу тяжелее 32, мы легко сможем предсказать их относительное содержание, используя физическую химию. Но мы обнаруживаем, что 33 намного больше, чем ожидалось. Вот почему мы называем это аномалией».
Когда появился кислород, он поглощал ультрафиолетовый свет и подавлял реакцию серы, как это видно на скале. Это все хорошо, сказал Торрес, но теория не учитывает аномальную серу, которая продолжала вымываться из архейской породы в поверхностные воды, переноситься в океан, а затем конденсироваться в новую породу, которая также может иметь аномалию.
«Эта переработка древней породы была способом увековечить аномалию даже после того, как появился кислород», — сказал он. Исследователи подозревали, что наличие аномалии может размыть представление о времени подъема кислорода на целых 100 миллионов лет.
Они обнаружили, что нет, но это было непросто. В команду вошли исследователи из Калифорнийского технологического института и Центра петрографических и геохимических исследований в Нанси, Франция. Члены собрали множество образцов на канадских участках, чтобы соответствовать образцам из Южной Африки, которые у них уже были, и проверили их сигнатуру серы после устранения воздействия загрязняющих веществ от сернисто-кислотных дождей, таяния льда дорожной соли и пыли от местных горных работ.Но их окончательные расчеты показали устойчивый баланс серы-33, собранной речным стоком на большой территории.
«Наши усилия позволяют нам быть уверенными, что у нас есть время для этого великого окислительного события, поэтому теперь мы можем начать понимать механизмы», — сказал Торрес. «Если вы думаете о всей истории Земли, 100 миллионов лет — это мало, но на временной шкале эволюции организмов это имеет значение».
Моделирование серы в атмосфере архея
Дополнительная информация: Марк А.Торрес и др., Риверин, свидетельство изотопного баланса массы в раннем цикле серы Земли, Nature Geoscience (2018). DOI: 10.1038 / s41561-018-0184-7 Предоставлено Университет Райса
Ссылка : Анализ серы позволяет определить время появления кислорода (23 июля 2018 г.) получено 12 января 2021 г. с https: // физ.org / news / 2018-07-sulf-analysis -xygen.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
демонстраций — Сжигание в чистом кислороде
Демонстрационные выступления — Сжигание в чистом кислороде — Горящая сера Горение в чистом кислороде,
Часть 3:
Горящая сера — огонь и сера
Сера легко воспламеняется при нормальных атмосферных условиях, но не чистый кислород, он горит очень красивым голубым пламенем.Продукция горение — диоксид серы и триоксид серы:
S (т) + O 2 (г) ——> SO 2 (г)
2S (s) + 3O 2 (g) ——> 2SO 3 (г)
Эти вещества реагируют с водой в воздухе с образованием серы и серная кислота соответственно:
SO 2 (г) + H 2 O (г) ——> H 2 SO 3 (г) [сернистая кислота]
SO 3 (г) + H 2 O (г) ——> H 2 SO 4 (г) [серная кислота]
Это может быть продемонстрировано путем гашения горящей серы небольшим количеством дистиллированной воды и добавлением соответствующего кислотно-основного индикатора, такого как метиловый апельсин.
В следующей демонстрации небольшое количество серы помещается в ложка для дефлаграции, нагретая в горелке Бунзена до тех пор, пока она не начнет гореть, а затем опускают в банку с чистым кислородом. Затем сера вспыхивает, превращаясь в более яркое синее пламя, и со временем начинает выбрасывать пары диоксида серы и триоксид.
Видеоклип: РЕАЛЬНЫЙ, 4.20 МБ
!!! Опасности !!!
Используйте длинную ложку для дефлаграции, чтобы удержать серу в кислородном баллоне.
Образуются пары диоксида серы и триоксида серы; эти пары должны их следует избегать, так как они будут гидролизоваться до серной и серной кислоты при воздействии влажность.
Процедуры
н / д
Список литературы
Джон Эмсли, Элементы, 3-е изд. Оксфорд, Кларендон Пресс, 1998, стр.148-149, 198-199.
Дэвид Л. Хейзерман, Исследование химических элементов и их Соединения. Нью-Йорк: TAB Books, 1992, стр. 32-36, 65-69.
.

 Теперь невозможно отделить эти вещества от смеси. Такие смеси, в которых компоненты смешиваются друг с другом равномерно, называются гомогенными смесями .
Теперь невозможно отделить эти вещества от смеси. Такие смеси, в которых компоненты смешиваются друг с другом равномерно, называются гомогенными смесями .