ГДЗ по Химии 9 класс контрольно-измерительные материалы Стрельникова
Тест 1. Варианты
1 2Тест 2. Варианты
1 2Тест 3. Варианты
1 2Тест 4. Варианты
1 2 Варианты 1
2
Варианты 1
2Тест 6. Варианты
1 2Тест 7. Варианты
1 2Тест 8. Варианты
1 2Тест 9. Варианты
1 2 Тест 10. Варианты 1
2
Варианты 1
2Тест 11. Варианты
1 2Тест 13. Варианты
1 2Тест 14. Варианты
1 2 Тест 16. Варианты
Варианты
Тест 17. Варианты
1 2Тест 18. Варианты
1 2 Тест 19. Варианты 1 2Тест 20. Варианты
1 2 Тест 21. Варианты
Варианты
Тест 22. Варианты
1 2Тест 24. Варианты
1 2Тест 26. Варианты
1 2Страница не найдена
Новости
4 мар
Первый заместитель председателя комитета Госдумы по образованию и науке Олег Смолин прокомментировал в беседе с RT предложение отменить Всероссийские проверочные работы (ВПР), которые с марта по май должны писать школьники 4-х, 5-х, 6-х и 11-х классов общеобразовательных организаций всей страны.
4 мар
Министр просвещения России Сергей Кравцов оценил ситуацию с шестидневным обучением в ряде школ.
4 мар
Депутат Госдумы Елена Строкова предложила отменить Всероссийские проверочные работы (ВПР), которые с марта по май должны писать школьники 4, 5, 6 и 11-го классов общеобразовательных организаций всей страны. Копия письма на имя вице-премьера Татьяны Голиковой имеется в распоряжении RT.
3 мар
Законопроект о школьной медицине могут рассмотреть в Госдуме в весеннюю сессию. Об этом заявил один из авторов документа, председатель комитета по охране здоровья Дмитрий Морозов.
Об этом заявил один из авторов документа, председатель комитета по охране здоровья Дмитрий Морозов.
3 мар
Депутаты нижней палаты парламента России завершают работу над законопроектом о повышении роли медработников в школах, заявил один из инициаторов документа, глава комитета Госдумы по охране здоровья Дмитрий Морозов.3 мар
Следователи в Красноярске обнаружили возможный источник отравления более 90 учеников 25 школ в возрасте от семи до 14 лет, сообщили в региональном главке Следственного комитета России.
3 мар
Тесты по химии (9 класс)
Тесты за 9 класс по химии. 5 вариантов.
5 вариантов.
Вариант 1
1 Атом состоит из:
A) протонов и нейтронов
B) ядра и вращающихся вокруг него нейтронов
C) протонов и электронов
D) ядра и вращающихся вокруг него электронов
E) нейтронов и электронов
2. К реакциям соединения относится:
A) 2Cu + O2 —> 2CuO
B) Cu(OH)2 + 2HCl —> CuCl2 + 2h3O
C) CuCO3 —> CuO + CO2
D) CuO + h3SO4 —> CuSO4 + h3O
E) CuSO4 + 2NaOH —> Cu(OH)2 + Na2SO4
3 Число электронов в атоме хрома
A) 52
B) 25
C) 24
D) 31
E) 34
4 Реакция, идущая с увеличением объема
A) 2h3 + O2 = 2h3O
B) h3 + Cl2 = 2HCl (возрастает)
C) h3 + CuO = Cu + h3O
D) 2KClO3 = 2KCl + 3O2 (возрастает)
E) N2 + 3h3 = 2Nh4 (возрастает)
5. Электронная конфигурация А1
A) …3s2
B) …3s2 3p6
C) …3 s23р1
D) …3s23р4
E) …4s2 4p1
6. Относительная молекулярная масса 95 будет у вещества
7.
 .В схеме превращений
.В схеме превращенийCuO —1—> CuCl2 —2—> Cu(OH)2 —3—> CuSO4 —4—> Cu3(PO4)2
с образованием осадка идет реакция
A) 1, 3
B) 2, 4
C) 3
D) 1
E) 2, 3
8 Сколько атомов углерода содержится в 2 моль:
А) 6,02*1023
В) 1 2,04*1023
С)0,12*1023
Д) 12
Е) 12,04*1020
9.Формула, соответствующая высшему оксиду элементов VI А группы:
A) R2O
B) RO
C) R2O3
D) RO3
E) RO2
10 Ионная связь в веществе А) CuCL2 B) CO2 C) O2 D) CL2 E) HCL
11. Количество теплоты, выделяющейся при сгорании 3,2г метана, равно
160,4 кДж. Тепловой эффект реакции СН4 +2О2 = СО2+ Н2О+Q равен:
A) )+1604кДж B)802 кДж, C) -1604 кДж D) -802 кДж .E) 126 кДж
12. .В реакции обмена не могут участвовать вещества
A) оксиды
B) простые
C) основания
D) сложные
E) кислоты
13. Реакция ионного обмена идет до конца при взаимодействии
A) Хлорида натрия и нитрата лития
B) Нитрата алюминия и хлорида калия
C) Гидроксида калия и гидроксида натрия
D) Сульфата меди и нитрата цинка
E) Соляной кислоты и карбоната натрия
14 Щелочноземельный металл:
A) литий
B) висмут
C) барий
D) молибден
E) алюминий
15. Гетерогенная реакция
Гетерогенная реакция
A) N2 + O2 = 2NO B) 2h3 (г) + O2 (г) = 2h3O (г)
C) N2 + 3h3 = 2Nh4 D) h3 (г) + Cl2 (г) = 2HCl (г)
E) 2Са + О2 = 2СаО
16. Неверно установлено соответствие:
A) Сахароза – кристаллическое вещество, сладкое на вкус
B) Фруктоза – сладкое вещество, без запаха
C) Крахмал – порошок, нерастворимый в холодной воде
D) Глюкоза – кристаллическое вещество, хорошо растворимое в воде
E) Целлюлоза – горючее вещество, хорошо растворимое в воде
17 В 100 г 20%-ного раствора гидроксида натрия содержится воды (в граммах)
A) 10
B) 20
C) 100
D) 80
E) 40
18.Для определения Fe2+ применяют:
A) Сульфат меди
B) Гидроксид натрия
C) Нитрат серебра
D) Хлорид бария
E) Серную кислоту
19 Какой из оксидов образует кислоту h3RO3
А) CO2 В) N2O5 С) SO3 D) CL2O3 E) SO2?
20 . Объем водорода (при н.у.), который образуется при взаимодействии 0,6 моль соляной кислоты с 0,5 моль металлического натрия, равен:
A) 11,2 л
B) 44,8 л
C) 5,6 л
D) 22,4 л
E) 89,6 л
21 Количество вещества в 3,2 г диоксида серы равно
A) 0,05 моль
B) 2 моль
C) 0,1 моль
D) 0,5 моль
E) 1 моль
22. Водный раствор NaOH реагирует с
Водный раствор NaOH реагирует с
A) Cu(OH)2
B) HCl
C) KOH
D) MgO
E) Nh5OH
23 При окислении происходит
A) Отдача электронов атомом, молекулой или ионом
B) Присоединение электронов
C) Перемещение электронной пары
D) Образование общей электронной пары
E) Завершение внешнего энергетического уровня
24.Нагревание или использование другого вида энергии всегда необходимо для протекания
A) Реакции ионного обмена
B) Любой реакции вообще
C) Эндотермической реакции
D) Окислительно-восстановительной реакции
E) Экзотермической реакции.
25. Число электронных слоёв в атоме элемента, содержащего в ядре 20 протонов:
A) 3 B) 6 C) 4 D) 5.E)7
26. Продукты FeSO4 и Н2О соответствуют взаимодействию реагентов:
A) Fe и h3SO4 (10%)
B) Fe и h3SO4 (96%)
С) FeO и h3SO4
D) Fe2 O 3 и h3SO4
E) FeO и h3SO3
27 При взаимодействии цинка с серной кислотой выделилось 11,2 л. водорода. Вычислите массу цинка.
А) 11,2 г,
В)65 г,
С)32,5 г,
Д)6,5 г.
Е) 6,57 г
28. Сумма всех коэффициентов полного ионного уравнения взаимодействия оксида серы (VI) и гидроксида натрия (образуется средняя соль)
A) 9 B) 8 C) 7 D) 6 E) 5
29. Группа веществ – неэлектролитов
A) h3, h3SiO3
B) MgSO4, HCl
C) KOH, HBr
D) NaOH, HCl
E) HCl, HNO3
30. В схеме превращений
Al —+x—> Al(OH)3 —+y—> AlOHSO4 —+z—> Al(OH)3
Веществами X, Y, Z являются
A) h3O, SO3, h3SO4
B) Al(OH)3, h3SO4, h3O
C) h3O, h3SO4, NaOH
D) NaOH, h3SO4, h3SO3
E)h3O,K2SO4,КОН
2 вариант
1. Электронное строение атома кремния
A) 1s2 2s2 2p6 3s2 3p1
B) 1s2 2s2 2p6 3s2 3p2
C) 1s2 2s2 2p6 3s2 3p5
D) 1s2 2s2 2p6 3s2 3p3
E) 1s2 2s2 2p6 3s2 3p6
2. . Уравнение диссоциации нитрата магния
A) Mg(NO3)2 (реакция обмена) Mg4+ + 2NO32-
B) Mg(NO3)2 (реакция обмена) Mg2+ + 2N5+ + 6O2-
C) Mg(NO3)2 (реакция обмена) Mg2+ + NO32-
D) Mg(NO3)2 (реакция обмена) Mg2+ + 2NO3 —
E) Mg(NO3)2 (реакция обмена) Mg3+ + N2O4- + 2O-
3. При реакции соединения:
При реакции соединения:
A) в реакцию вступают два сложных вещества, при этом они обмениваются своими составными частями
B) из одного вещества образуется несколько более простых веществ
C) простое вещество реагирует с более сложным, при этом образуется два сложных вещества
D) из нескольких веществ образуется одно более сложное вещество
E) в реакцию вступают простое и сложное вещества, при этом атомы простого вещества замещают одни из атомов сложного
4. .В молекуле кислорода связь
A) Ионная
B) Донорно-акцепторная
C) Ковалентная полярная
D) Металлическая
E) Ковалентная неполярная
5. Формулы неизвестных веществ в схеме: Zn -> ZnO -> ZnCl2 —NaOH—-> ? —-+NaOH—>
A) Zn(OH)2; ZnCl2
B) NaCl; Zn(OH)2
C) Zn(OH)2; ZnO
D) Zn; Zn(OH)2
E) Zn(OH)2; Na2[Zn(OH)4]
6. Щелочные металлы находятся в главной подгруппе группы номер
A) 3
B) 1
C) 2
D) 5
E) 7
7. Количество вещества нитрата аммония, которое образуется при пропускании 11,2 л аммиака (н.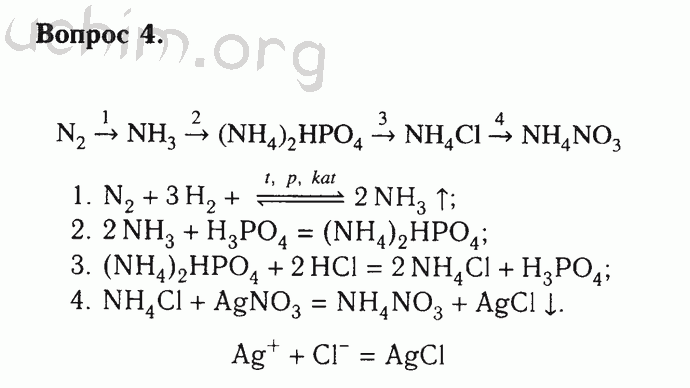 у.) через 126 г азотной кислоты
у.) через 126 г азотной кислоты
A) 0,5 моль
B) 1 моль
C) 2 моль
D) 5 моль
E) 0,2 моль
8. Для полной нейтрализации раствора, содержащего 14 г гидроксида калия, необходим оксид серы (IV) объемом (при н.у.)
A) 9,6 л
B) 8,6 л
C) 2,8 л
D) 5,6 л
E) 7,2 л
9 Если схема реакции
Ag —-+HNO3(конец)—-> A —+o2+N20—-> Б —NaOH—> В —t 0 c—> NaNO2
то сумма молекулярных масс веществ А и В равна A) 109 B) 10,9 C) 93 D) 100
E) 115
10.Не происходит выпадение осадка в случае взаимодействия
A) силиката натрия и нитрата кальция
B) сульфата калия и нитрата бария
C) карбоната калия и нитрата натрия
D) хлорида натрия и нитрата серебра
E) сульфида калия и нитрата меди (II)
11. Для определения углекислого газа можно использовать соединения кальция:
A) Са(ОН)2, B) СаСl2, C) CaO, D) Ca(HCO3)2 E) CaCO3
12 Оба вещества могут быть только окислителями:
A) SO3 h3SO3
B) HNO3 h3 SO4
C) SO2 CO2
D) SO2 h3SO4
E) NO HNO3
13. Формула аллотропного видоизменения кислорода
Формула аллотропного видоизменения кислорода
A) О-1
B) О-2
C) О3
D) О
E) О2
14. .Формула, соответствующая высшему оксиду элементов VI А группы:
A) R2O
B) RO
C) R2O3
D) RO3
E) RO2
15.Формулы соединений (a, b, d) и условие протекания реакции (с) по схеме:
С —a—> СО2 —b—> СаСО3 —c—> СаО —d—> СаС2
A) а – h3O; b – CaC2; c – давление p; d – Ch5
B) a – O2; b – h3CO3; c – to; d – CO
C) a – O2; b – Ca(OH)2; c – to; d — C
D) a – O2; b – K2CO3; c – to; d – CO2
E) a – CO; b – Ca; c – to; d – CO
16 В природе углеводы получаются в результате процесса:
A) Фотосинтеза
B) Дегидрогенизации природных жиров
C) Жизнедеятельности дрожжей
D) Гидратации этилена
E) Взаимодействия этилена и воды
17. Раствор серной кислоты не взаимодействует с
A) барием B) кальцием C) цинком
D) магнием E) медью
18 Химический элемент, в ядре атома которого 33 протона
A) Цинк B) Марганец C) Магний
D) Мышьяк E) Германий
19. Соль образуется в результате реакции между
Соль образуется в результате реакции между
A) СО2 и Н2
B) Р2О5 и SO3
C) FeO и СаО
D) CuO и HNO3
E) Na2O и h3O
20. Масса меди (г), которая образуется при взаимодействии 0,1 моль железа с 15 г сульфата меди (II)
A) 6,0
B) 8,9
C) 25,6
D) 24,0
E) 6,8
21 Степень окисления азота в ряду Nh4 NO N2
A) Сначала повышается, а потом понижается
B) Повышается
C) Сначала понижается, а потом повышается
D) Понижается
E) Не изменяется
22 Сумма всех коэфициентов в уравнении АL+h3SO4-> равна:
А) 2, B) 8, C) 4, D) 5.E) 9
23 Относительная молекулярная масса карбоната кальция равна
A) 40
B) 100
C) 76
D) 96
E) 244.
24. Железный гвоздь не вытесняет металл из раствора его соли:
A) Хлорида олова (II)
B) Хлорида меди (II)
C) Хлорида никеля (II)
D) Хлорида натрия
E) Хлорида свинца (II)
25 Металлическая связь в веществе
A) KCl
B) S
C) HCl
D) P
E) Ba
27. В реакции Zn + h3SO4 (разб) … восстанавливается
В реакции Zn + h3SO4 (разб) … восстанавливается
A) О-2 B) Zn0 C) S+4 D) H+1 E) S+6
28 Атомы лития и натрия содержат на внешнем электронном уровне число электронов:
A) 1 и 1 B) 3 и 1 C) 1 и 2
D) 2 и 1 E) 1 и 3
29 Количество теплоты, выделяющейся при сгорании 2г угля(термохимическое уравнение реакции С+О2 = СО2+393 кДж, равно: а)24 кДж, B) 65,5 кДж, C) 32,75кДж, D) 393 кДж.E) 55
30. В схеме превращений Al ——+HCL—> AlCl3 —-+NaOH—> Al(OH)3 ——t0—> Al2O3 стадия, на которой сумма всех коэффициентов наибольшая
A) 1
B) 2
C) 3
D) 1, 2
E) 2
Вариант 3
1. Электронная конфигурация атома калия
A) 1s2 2s2 2p6 3s2 3p6 3d10 4s1
B) 1s2 2s2 2p6 3s1
C) 2s2 2s1
D) 1s2 2s2 2p1
E) 1s2 2s2 2p6 3s2 3p6 4s2
2. В образовании металлической кристаллической решетки принимают участие
A) Электроны, анионы, атомы
B) Только катионы металлов
C) Только атомы металлов
D) Только электроны
E) Электроны, катионы, атом
3. При окислении происходит
При окислении происходит
A) Отдача электронов атомом, молекулой или ионом
B) Присоединение электронов
C) Перемещение электронной пары
D) Образование общей электронной пары
E) Завершение внешнего энергетического уровня
4Какой из неметаллов образуют высший оксид типа R2O5
А ) S В) C С) N D) Si E) F?
.5Не является аллотропной модификацией углерода:
A) Карбин B) Поликумулен C) Графит
D) Карбид E) Алмаз
6. Реакция замещения:
A) CuCO3 → CuO + CO2
B) CuSO4 + Fe → Cu + FeSO4
C) 2Cu + O2 → 2 CuO
D) Cu(OH)2 + 2HCl → CuCl2 + 2h3O
E) CuO + h3SO4 → CuSO4 + h3O
7. Общая сумма коэффициентов в ионном полном уравнении реакции взаимодействия фосфата натрия и хлорида кальция составляет:
A) 32
B) 30
C) 25
D) 18
E) 12
8.Наибольшую массу имеет 2 моль карбоната
A) кальция B) натрия C) калия D) стронция
E) бария
9. Схема реакции, в результате которой образуется кремниевая кислота:
A) Si + h3SO4
B) SiO2 + KOH
C) SiO2 + h3O
D) Si + HNO3
E) K2SiO3 + HCl
10 . Кислые соли состоят из
Кислые соли состоят из
A) катионов металлов и кислотных остатков
B) кислотных остатков и гидроксогрупп, связанных с катионами
C) двух химически разных катионов и кислотного остатка
D) кислотных остатков с незамещенными ионами водорода и катионов металлов
E) внешней и внутренней сферы, которая включает комплексообразователь и лиганды
11. Вид связи в оксидах углерода (II) и (IV)
A) Ковалентный неполярный
B) Ионный
C) Водородный
D) Металлический
E) Ковалентный полярный
12. Реакция, в которой одновременно образуются осадок белого и синего цвета, это
A) CuCl2 + Al2(SO4)3
B) CuSO4 + Ba(OH)2
C) Al2(SO4)3 + NaOH
D) Ba(OH)2 + Al2(SO4)3
E) NaOH + CuSO4
13. При взаимодействии 3 моль оксида алюминия и 294 г серной кислоты, получится количество вещества соли (в молях)
A) 2
B) 3
C) 5
D) 4
E) 1
14. Виноградным сахаром иногда называют
A) Крахмал
B) Целлюлозу
C) Сахарозу
D) Рибозу
E) Глюкозу
15. В схеме превращений
В схеме превращений
Fe —cl2—> A —NaOH—> Б —t0c—> В —Hcl—> Г
вещества А, В, Г
A) FeCl3, Fe2O3, FeCl3
B) FeCl2, Fe, FeCl3
C) FeCl2, FeO, FeCl2
D) FeCl3, FeO, FeCl2
E) FeCl3, Fe2O3, FeCl2
16.Кислота, которая не диссоциирует
A) h4PO4
B) HCl
C) h3SO4
D) h3SiO3
E) HNO3
17 Раствор хлорида алюминия имеет среду:
A) Индифферентную
B) Кислую
C) Нейтральную
D) Слабощелочную
E) Щелочную
18. Только ковалентная полярная связь в
A) HCl
B) NaCL
C) Cu
D) h3
E) Al2O3
19 . Количество электронов в катионе Fe+3
A) 29 B) 26 C) 23 D) 22 E) 25
20 Из оксида углерода (II) объемом 20 л можно получить оксид углерода (IV) объемом:
A) 20 л
B) 4,48 л
C) 2 л
D) 10 л
E) 44,8 л
21 .Число электронов, которое может принять атом азота равно: A) 5,B) 2,
C) 3, D) 1 E) 1.
22. Для сжигания кремния количеством вещества 0,5 моль потребуется кислород объемом (н. у.)
у.)
A) 11,2 л
B) 1,12 л
C) 5 л
D) 112 л
E) 0,5 л
23. . Сумма всех коэффициентов в уравнении реакции
Na2CO3 + HCl NaCl + h3O + CO2
A) 3 B) 5 C) 7 D) 9 E) 1
24 Массовая доля кислорода в серной кислоте равна (%):
A) 100,48
B) 91,54
C) 60,45
D) 65,31
E) 71,23
25. Если смещать 5 г соли и 95 г воды, то получится …. % — ный раствор
A) 5
B) 9
C) 12
D) 8
E) 10
26. Основные оксиды – это оксиды, которым соответствуют:
A) соли
B) основания
C) гидриды
D) растворении в воде образуют кислоты
E) кристаллогидраты
27 Названиям: гашёная известь, известковое молоко, известковая вода- соответствует формула A) СаО, B) Са(ОН)2 ,C) СаС2 , D) CaCO3 E) CaCL2
28Водород образуется при действии
A) Раствора соляной кислоты на медь
B) Концентрированной азотной кислоты на магний
C) Раствора серной кислоты на оксид цинка
D) Раствора cоляной кислоты на цинк
E) Раствора азотной кислоты на магний
29 При взаимодействии гидроксида калия и серной кислоты образуеются
A) K и h3SO3 B) h3SO4 и h3O C) K2O и h3SO3
D) K2SO4 и h3O E) K2S и h3O
30. Вещество С в цепи превращения: h3SO3 -> SO2 -> SO3 -> C -> h3
Вещество С в цепи превращения: h3SO3 -> SO2 -> SO3 -> C -> h3
A) Серная кислота
B) Сероводородная кислота
C) Сульфат натрия
D) Сернистая кислота
E) Сульфид калия
4Вариант
1. Электронное строение иона Са2+
A) 1s2 2s2 2p6 3s2 3p1
B) 1s2 2s2 2p6 3s2 3p2
C) 1s2 2s2 2p6 3s2 3p5
D) 1s2 2s2 2p6 3s2 3p3
E) 1s2 2s2 2p6 3s2 3p6
2. Для определения крахмала в пищевых продуктах используют реакцию с
A) Уксусной кислотой
B) Йодом
C) Гидроксидом меди без нагревания
D) Кислородом
E) Водой
3. В реакции обмена не могут участвовать вещества
A) оксиды
B) простые
C) основания
D) сложные
E) кислоты
4. Общая сумма коэффициентов в ионном полном уравнении реакции взаимодействия фосфата натрия и нитрата серебра составляет:
A) 32
B) 30
C) 25
D) 17
E) 12
5. В каком соединении сера имеет степень +4:
А) CuSO4, B) FeS C) h3SO4 D) Li2S E) h3SO3?
6. Реакция ионного обмена, идущая до конца
Реакция ионного обмена, идущая до конца
A) NaOH + HCl → NaCl + h3O
B) NaNO3 + KCl → NaCl + KNO3
C) Zn + 2HCl → ZnCl2 + h3
D) Na2CO3 + 2KOH → K2CO3 + 2NaOH
E) CaO + h3O → Ca(OH)2
7.Кислотный оксид образует
A) Ba
В) Cu
С) S
D) Ca
E) Fe
8 Наименьшую молярную массу имеет оксид
A) BaO
B) SrO
C) CaO
D) BeO
E) MgO
9 Даны вещества: FeCL3 NaNO3 h4PO4 Na2S CaBr2 Сколько веществ реагирует с AgNO3
A) 1 B) 2 C) 3 D) 4 E) 6 ?
14. Степень окисления металлов
10 Соединения с ионной связью:
A) I2, h3
B) C2H5OH, Ch4COOH
C) O2, h3O
D) Fe, CuO
E) NaCl, BaCl2
11 Объем порции диоксида серы (н.у.), содержащей атомов кислорода
A) 22,4 л
B) 5,6 л
C) 1,12 л
D) 2,24 л
E) 11,2 л
12.При электролитической диссоциации оснований:
A) образуются катионы металлов и анионы кислотного остатка
B) образуются катионы водорода и гидроксид-ионы
C) образуются катионы водорода и анионы кислотного остатка
D) образуются катионы металла и гидроксид-ионы
E) не образуются ионы
13. В схеме превращений
В схеме превращений
S —1—> SO2 —2—> SO3 —3—> h3SO4 —4—> K2SO4 —5—> BaSO4
окислительно-восстановительными реакциями будут
A) 1, 5 B) 1, 3 C) 3, 5 D) 1, 2 E) 1, 4
14. Соляная кислота вступает в реакцию с оксидом:
A) кремния (IV)
B) углерода (II)
C) цинка
D) азота (II)
E) серы(1V)
15. При взаимодействии 2 моль сернистого газа с кислородом получено 5,6 л SO3 (н.у.), что составляет от теоретически возможного:
A) 32%
B) 11,5%
C) 17%
D) 36%
E) 12,5%
16 26 протонов в ядре атома элемента
A) Zn
B) Fe
C) Ba
D) Cu
E) Al
17. Оксид серы (IV) будет реагировать со всеми веществами группы
A) h3O, KOH, CaO
B) h3O, h3SO4, K2SO4
C) HCl, CO2, MgO
D) h3O, NaOH, NaNO3
E) h3O, N2, KOH
18. Объем углекислого газа (в н.у.), выделившего при горении 0,1 м3 метана Ch5
A) 120 л
B) 100 л
C) 150 л
D) 140 л
E) 130 л
19. Железо будет выделять водород из:
Железо будет выделять водород из:
A) Гидроксида натрия (конц.)
B) Раствора серной кислоты
C) Гидроксида аммония
D) Концентрированной азотной кислоты
E) Концентрированной серной кислоты
20. Вещества, растворы или расплавы которых проводят электрический ток
A) Неэлектролиты
B) Изоляторы
C) Ионы
D) Ассоциаты
E) Электролиты
21. Выражать состав нефти одной формулой
A) нельзя, потому что нефть — смесь
B) можно, потому что нефть – горючее вещество
C) можно, потому что нефть – жидкое вещество
D) нельзя, потому что нефть – содержит ароматические углеводороды
E) можно, потому что нефть – сложное вещество
22. Укажите смесь газов, взаимодействующих с водой.
А)СО и СО2,B) СО и NO2, C) CO2 и NO2 , D) CO2 и O2 E) P2O5 и NO
23 Cамый активный металл:
А)Ca В) Cu С) Mg D)Na E) K
24.К щелочам относится:
A Al(OH)3)
B) Be(OH)2
C) Cu(OH)2
D) LiOH
E) Ni(OH)2
25. Сколько теплоты выделится при сжигании 2,4 г магния по термохимическому уравнению: 2Mg+O2→2Mg O+1127 кдж.?
Сколько теплоты выделится при сжигании 2,4 г магния по термохимическому уравнению: 2Mg+O2→2Mg O+1127 кдж.?
A) 1127 кдж, B) 102 кдж, C) 56,35 кдж, D) 112,70 кдж, E) 28,175 кдж
26 Какой из неметаллов является сильным окислителем :
A) сера. B) кислород, C) азот, D) фтор, E) йод ?
27. При взаимодействии 4,48 л фтора (н.у.) с водой, получается масса О2 равная
A) 1,2 г
B) 2 г
C) 3,2 г
D) 2,4 г
E) 1,6 г
28 Относительная молекулярная масса азота A) 14, B) 28, C) 7, D) 17
E)16
29 Масса 3 моль карбоната кальция равна: A) 230 г, B)200г,
C)330 г, D)300 г. E)410
30 В схеме превращений
CuO —1—> CuCl2 —2—> Cu(OH)2 —3—> CuSO4 —4—> Cu3(PO4)2
с образованием осадка идет реакция
A) 1, 3
B) 2, 4
C) 3
D) 1
E) 2, 3
Ответы теста 5 вариантов за 9 класс по химии:
Вариант1 1D 2А 3С 4D 5C 6E 7B 8B 9D 10A 11B12B13E 14А 15E 16E17D 18B19E 20A 21A 22B 23A 24C 25C 26C 27D 28B 29A 30C
2вариант1B2D3D 4E 5E 6B 7A 8C 9A 10С 11A 12B 13С 14D 15C 16A 17E 18D19D 20A 21A 22E 23B 24D 25E 26E 27D 28A 29B 30A
3 Вариант
1A 2E 3A 4C5D6B 7B 8E 9E 10D 11E 12B 13B 14E 15E 16D 17B 18A 19C 20A 21C 22A 23C 24D 25A 26B 27B 28D 29D 30А
4 Вариант
1E 2B3B 4D 5E 6A7C 8D 9D 10E 11A 12D 13D 14C 15E 16B17A 18B 19 B 20E 21A 22C 23E 24D 25D 26D 27C 28B 29D 30B
▶▷▶▷ гдз по химии 9 класс проверочные работы часть 2
▶▷▶▷ гдз по химии 9 класс проверочные работы часть 2| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 10-03-2019 |
гдз по химии 9 класс проверочные работы часть 2 — Yahoo Search Results Yahoo Web Search Sign in Mail Go to Mail» data-nosubject=»[No Subject]» data-timestamp=’short’ Help Account Info Yahoo Home Settings Home News Mail Finance Tumblr Weather Sports Messenger Settings Want more to discover? Make Yahoo Your Home Page See breaking news more every time you open your browser Add it now No Thanks Yahoo Search query Web Images Video News Local Answers Shopping Recipes Sports Finance Dictionary More Anytime Past day Past week Past month Anytime Get beautiful photos on every new browser window Download ГДЗ Химия 9 класс Контрольные и проверочные работы Габриелян gdz-na-5com Химия 9 класс Данное учебное пособие содержит тексты и решения проверочных и контрольных работ, которые размещены в учебнике Габриеляна О С «Контрольные и проверочные работы по химии для 9 -го класса» ГДЗ решебник по химии 8 класс контрольные и проверочные gdzputinaco 8 класс Химия ГДЗ решебник по химии 8 класс контрольные и проверочные работы Габриелян Краснова ГДЗ по химии за 8 класс авторов Габриелян ОС, Красновой ВГ 2017 года издания Гдз По Химии 9 Класс Проверочные Работы Часть 2 — Image Results More Гдз По Химии 9 Класс Проверочные Работы Часть 2 images ГДЗ контрольные работы по химии 9 класс Габриелян, Краснова botanamnet … 9 класс Химия ГДЗ контрольные работы по химии 9 класс Габриелян, Краснова Авторы: Стрельникова ОС ГДЗ контрольные работы по химии 9 класс Габриелян, Краснова lovegdzcom … 9 класс Химия Решебник по химии за 9 класс авторов Габриеляна ОС, Красновой ВГ 2017 года издания Ответы на контрольные и проверочные работы комбинированы, что облегчает работу школьникам с разным ГДЗ по химии 9 класс Габриелян Краснова контрольные работы gdzme 9 класс Химия ГДЗ по химии за 9 класс авторов Габриелян ОС, Красновой ВГ 2015 года издания Сборник по своему объему достаточно большой и охватывает 41 параграф ГДЗ по химии 8 класс Габриелян Краснова контрольные работы gdzme 8 класс Химия ГДЗ по химии за 8 класс авторов Габриелян ОС, Красновой КС 2017 года издания В данном пособии школьники найдут правильные ответы на все задания контрольных и проверочных работ, с помощью которых можно проверить ГДЗ контрольные работы по химии 9 класс Стрельникова botanamnet … 9 класс Химия ГДЗ / Решебники / 9 класс / Химия / ГДЗ контрольные работы по химии 9 класс Стрельникова Авторы: Стрельникова ЕН Ким Е П Химия 8 класс Тесты Часть 2 ОНЛАЙН edu-libcom/himiya/kim-e-p-himiya-8-klass-testyi Cached Павлова Н С Диагностические работы по химии 9 класс ФГОС ОНЛАЙН Боровских Т А Рабочая тетрадь по химии : 8 класс : к учебнику Г Е Рудзитиса «Химия 8 класс » ОНЛАЙН ГДЗ решебник по химии 9 класс контрольные и проверочные gdzputinaco 9 класс Химия ГДЗ решебник по химии 9 класс контрольные и проверочные работы Габриелян Краснова Онлайн ответы из решебника по химии за 11 класс авторов Габриеляна ОС, Краснова ВГ 2015 года издания Решебник ГДЗ по Химии 9 класс Контрольные и проверочные 5urokovru/load/gdz_ 9 _klass/khimija/reshebnik Cached Вот именно для того, чтобы не возникало подобных проблем, современные авторы создали прекрасные пособия Это решебник ГДЗ по Химии 9 класс Контрольные и проверочные работы Promotional Results For You Free Download | Mozilla Firefox ® Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Yahoo 1 2 3 4 5 Next 28,000 results Settings Help Suggestions Privacy (Updated) Terms (Updated) Advertise About ads About this page Powered by Bing™
- чтобы не возникало подобных проблем
- smarter
- чтобы не возникало подобных проблем
Онлайн тесты по химии
Многие известные нам химические элементы имеют порой удивительные свойства. Проверьте свои знания о металлах и неметаллах в этом тесте по химии.
Проверьте свои знания о металлах и неметаллах в этом тесте по химии.
Некоторые химические элементы были открыты совершенно случайно, а для открытия других ученые проделывали огромную целенаправленную работу.
Рейтинг теста: Сложность теста: нормальный Вопросов: 20Химия знакомит нас с множеством разнообразных веществ и элементов, которые обладают интересными и, порой, неожиданными свойствами.
Как по-научному называется тефлон? Из какого метала изготавливали медаль «За пьянство»? Каким газом наполняют аэростаты? Интересные факты о металлах и неметаллах в этом тесте!
Рейтинг теста: Сложность теста: нормальный Вопросов: 27Разнообразие химических элементов в природе удивляет. Еще более удивительными могут оказаться их свойства. Узнайте больше в этом тесте по химии!
Еще более удивительными могут оказаться их свойства. Узнайте больше в этом тесте по химии!
В этом тесте вам предлагается потренироваться в знании обозначений химических элементов и их соединений, а также в знании их свойств.
Рейтинг теста: Сложность теста: простой Вопросов: 20Какие-то химические вещества знакомы человечеству с древних времен, какие-то открыты совсем недавно. Но все они находят применение в той или иной области деятельности людей.
Но все они находят применение в той или иной области деятельности людей.
Знаете ли вы, какой химический элемент используется в освещении улиц города? А какое вещество сыграло роковую роль в жизни Наполеона Бонапарта?
Рейтинг теста: Сложность теста: простой Вопросов: 20Каждый день мы так или иначе имеем дело с металлами. А многое ли вы знаете об их свойствах и об истории их открытия?
А многое ли вы знаете об их свойствах и об истории их открытия?
В науке химии очень много сложных формул, правил и законов. Однако от этого она не перестает быть интересной. Узнайте несколько занимательных фактов о металлах в этом тесте.
Рейтинг теста: Сложность теста: нормальный Вопросов: 20Химические элементы бывают очень полезными и очень опасными, но все они для чего-то необходимы. История открытия химических элементов также очень разнообразны и интересны.
История открытия химических элементов также очень разнообразны и интересны.
Каждый день, часто даже не задумываясь об этом, мы сталкиваемся с различными химическими веществами. Узнайте больше о химии в быту в этом тесте.
Рейтинг теста: Вопросов: 20Т- 6 вариант 1 1. 1) Ca 2) Cs 3) Cd 4) Sr 2. Только щелочные металлы находятся в ряду элементов: 1) Na, K, Ca 3) Na, Rb, Ba 2) Li, K, Be 4) Cs, Rb,Li 3. Электронная формула щелочного металла: 1) 1s22s22p1 3) 1s22s1 2) 1s1 4) 1s22s22p63s2 4. Справедливы ли следующие утверждения? Ответ представьте в виде ряда чисел, соответствующих номерам правильных ответов. 1) Семейство щелочных металлов занимает I А группу периодической системы химических элементов Д.И. Менделеева. 2) Щелочные металлы используют для производства проводов. 3) В химических реакциях щелочные металлы проявляют сильные восстано- вительные свойства. 4) При горении все щелочные металлы образуют оксиды. 5) Максимальная степень окисления щелочных металлов в химических сое- динениях равна +2. 6) Щелочные металлы получают в промышленности путем электролиза расплавов щелочей и солей. Ответ: __________________________ 5. В схеме уравнения реакции Х + Н2О → Y + h3 веществами Х и Y являются соответственно: 1) K и K2O 3) K и KOH 2) K2O и KOH 4) KOH и K2O 6. В схеме превращений X Y Na → NaOH → NaCl веществами X и Y являются соответственно: 1) KOH и CuCl2 3) h3O и BaCl2 2) Mg(OH)2 и KCl 4) h3O и ZnCl2 7. Na + h3SO4 → Na2SO4 + S + h3O коэффициент перед формулой восстановителя равен 1) 5 2) 6 3) 7 4) 8
8. Какая масса 5 % — го раствора гидроксида натрия (г) потребуется для взаимодействия с раствором, содержащим 72,6 г нитрата железа (III)? 1) 72 3) 1008 2) 240 4) 720
| Т- 6 вариант 2 1. Щелочным металлом является 1) Be 2) Mg 3) Rb 4) Ba 2. Только щелочные металлы находятся в ряду элементов: 1) Li, Cs, Ca 3) Rb, K, Be 2) Cs, Na, Li 4) Na, K, Sr 3. Электронная формула щелочного металла: 1) 1s22s22p63s3 3) 1s22s22p63s1 2) 1s22s2 4) 1s1 4. ряда чисел, соответствующих номерам правильных ответов. 1) С помощью электролиза раствора хлорида натрия можно получить натрий. 2) Все щелочные металлы легкоплавкие и легко режутся ножом. 3) На внешнем уровне атомов щелочных металлов находится по одному s-электрону. 4) Щелочные металлы – это малоактивные простые вещества. 5) Щелочные металлы взаимодействуют с водой, образуя щелочь и водород. 6) При горении натрия в избытке кислорода образуется оксид натрия. Ответ: __________________________ 5. В схеме уравнения реакции Na + X → NaOH + Y веществами Х и Y являются соответственно: 1) h3O2 и h3O 3) KOH и K 2) h3O2 и h3 4) h3O и h3 6. X Y K → KOH → KNO3 веществами X и Yявляются соответственно: 1) h3O и Ba(NO3)2 3) h3O и Fe(NO3)2 2) NaOH и Cu(NO3)2 4) Zn(OH)2 и NaNO3
7. В уравнении окислительно-восстановительного процесса Li + HNO3 → LiNO3 + Nh4 + h3O коэффициент перед формулой восстановителя равен 1) 2 2) 8 3) 4 4) 5 8. Какая масса 15 % — го раствора гидроксида калия (г) потребуется для взаимодействия с раствором, содержащим 40,05 г хлорида алюминия? 1) 80 3) 336 2) 268,5 4) 50,4
|
▶▷▶▷ ким химия 8 класс гдз
▶▷▶▷ ким химия 8 класс гдз| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 12-10-2019 |
ким химия 8 класс гдз — ГДЗ решебник по химии 8 класс КИМ Троегубова gdzputinaco 8 -klass-onlajnhimiya- 8 gdz Cached ГДЗ 8 класс Химия КИМ Троегубова Рабочая тетрадь по химии за 8 класс автора Трегубовой НП 2016 года издания ГДЗ состоит из 15 тестов, которые соответствуют материалу, изучаемому в 8 классе ГДЗ Химия 8 класс Троегубова — КИМ gdzchat 8 _klasschemistrykim-po-himii- 8 -klass Cached С честью их выдержать поможет решебник к учебнику Химия КИМ 8 класс Троегубова Что в него включено Тестовые задачи поделены на пятнадцать разделов и имеют удобную систему подачи Ким Химия 8 Класс Гдз — Image Results More Ким Химия 8 Класс Гдз images ГДЗ Химия 8 класс Корощенко — КИМ gdzchat 8 _klasschemistrykim-po-himii- 8 -klass Cached Оказать поддержку в постижении этой трудной науки может решебник к учебнику Химия КИМ 8 класс Корощенко, Яшукова Что в него включено ГДЗ: Геометрия 8 класс Гаврилова — КИМ reshatororgclass- 8 heometriyakim-po-geometrii Cached Данное пособие выпущено издательством Вако Решебник Геометрия 8 класс Гаврилова всегда доступен онлайн и бесплатно Ко всем заданиям пособия даны подробные ответы с пояснениями ГДЗ решебник по химии 8 класс КИМ Корощенко gdzputinaco 8 -klass-onlajnhimiya- 8 gdz Cached ГДЗ 8 класс Химия КИМ Корощенко Контрольно-измерительные материалы по химии за 8 класс авторов Корощенко АС, Яшуковой АВ 2016 года издания ГДЗ: Химия 8 класс Троегубова — КИМ reshatororgclass- 8 chimiekim-po-himii- 8 -klass Cached Данное пособие выпущено издательством Вако Решебник Химия 8 класс Троегубова всегда доступен онлайн и бесплатно Ко всем заданиям пособия даны подробные ответы с пояснениями ГДЗ по Химии 8 класс КИМ — yougdzcom yougdzcomexesize426 Cached ГДЗ по Химии 8 класс КИМ Корощенко Контрольно-измерительные материалы Экзамен 2016 год В избранное Химия 8 класс : Контрольно-измерительные материалы ( КИМ ) Ким Е П Химия 8 класс Тесты Часть 2 ОНЛАЙН edu-libcomhimiyakim-e-p-himiya- 8 -klass-testyi Cached Ким ЕП Химия 8 класс Тесты: В 2 ч — Саратов, 2011 — Ч 2 — 64 с Тестовые задания с ответами, со Химия 8 класс Тесты В 2 частях Ким ЕП zubrilanetbookskhimiya 8 -klasskhimiya- 8 Cached Скачать бесплатно Химия 8 класс Тесты В 2 частях Ким ЕП Тестовые задания с ответами, составленные в соответствии с обязательным минимумом Готовое ГДЗ: гдз по химии 9 кл ким gdzskachatblogspotcom2014029_2567html Cached гдз химия Ким 8 класс Блог им pikub Блог Gotovimvkusno січень 2013Гдз по химии рабочая тетрадь ким 9 класс ГДЗ по всем предметам Гдз по Решебник ( ГДЗ ) по учебнику Химия , 8 класс (ОГ Ярошенко) Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of Also Try ким химия 8 класс гдз макарычев ким химия 8 класс гдз баландина ким химия 8 класс гдз атанасян номер611 ким химия 8 класс гдз глазова ким химия 8 класс гдз рудзитис ким химия 8 класс гдз дрофа ким химия 8 класс гдз соболь ким химия 8 класс гдз матяш 1 2 3 4 5 Next 29,600
- Кузнецова Н.
 Е. Химия: 8 класс: учебник для учащихся общеобразовательных учреждений ОНЛАЙН. Решебник
Е. Химия: 8 класс: учебник для учащихся общеобразовательных учреждений ОНЛАЙН. Решебник - тесты химия 8 класс ким 2 часть. Тесты по химии 8 класс. Автор — Ким Е.П. — 2011 год. Образовательный сайт — Рускопибук (Роскопибук) — Электронные учебники и ГДЗ. ZUBRILA.NET Химия 8 класс Химия. С
- ный сайт — Рускопибук (Роскопибук) — Электронные учебники и ГДЗ.
ZUBRILA.NET Химия 8 класс Химия. Скачать бесплатно Химия. 8 класс. Тесты. В 2 частях. Ким Е.П. Тестовые задания с ответами, составленные в соответствии с обязательным минимумом.
Главная gt; Учебники gt; 8 класс Химия. Автор: Ким Е.П. — Часть1 — 64страниц, Часть2 — 64 страниц. Тесты помогут закрепить и проверить знания учащихся, подготовиться к экзаменам ЕГЭ, зачетам и контрольным работам.
Химия. 8 класс. СКАЧАТЬ: учебник, решебник, тесты, практические работы, гдз, ответы, задачник, рабочая тетрадь, лабораторные работы, контрольные, решение задач. Химия 8 класс. ُУчебник Жилин Д.М. -М.: Бином, 2012. 268 с.
 Издательство quot;вакоquot; качественная помощь школе. Троегубова н п стрельникова е н контрольно измерительные материалы химия 8 класс.
Кликнув по ссылке Вы перейдете на основную страницу про Олимпиада по химии 8 класс с ответами 2012-2013. Задания и решения.
Купить книгу Контрольно-измерительные материалы. Химия. 8 класс. ФГОС (Троегубова Н.П.) в Интернет-магазине My-shop.ru. Низкая цена, доставка курьером и почтой, самовывоз. Читать аннотацию, отзывы покупателей, оставить свой комментарий.
20 Интегрирование по частям в определенном интеграле. Алгебра 7 класс решебник потапов. Округление spotlight 8 класс решебник гдз значений чисел. Условие перпендикулярности двух прямых3.
Издательство quot;вакоquot; качественная помощь школе. Троегубова н п стрельникова е н контрольно измерительные материалы химия 8 класс.
Кликнув по ссылке Вы перейдете на основную страницу про Олимпиада по химии 8 класс с ответами 2012-2013. Задания и решения.
Купить книгу Контрольно-измерительные материалы. Химия. 8 класс. ФГОС (Троегубова Н.П.) в Интернет-магазине My-shop.ru. Низкая цена, доставка курьером и почтой, самовывоз. Читать аннотацию, отзывы покупателей, оставить свой комментарий.
20 Интегрирование по частям в определенном интеграле. Алгебра 7 класс решебник потапов. Округление spotlight 8 класс решебник гдз значений чисел. Условие перпендикулярности двух прямых3.
практические работы
практические работы
- со Химия 8 класс Тесты В 2 частях Ким ЕП zubrilanetbookskhimiya 8 -klasskhimiya- 8 Cached Скачать бесплатно Химия 8 класс Тесты В 2 частях Ким ЕП Тестовые задания с ответами
- 8 класс (ОГ Ярошенко) Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster
- которые соответствуют материалу
Нажмите здесь , если переадресация не будет выполнена в течение нескольких секунд ким химия класс гдз Поиск в Все Картинки Ещё Видео Новости Покупки Карты Книги Все продукты Контрольноизмерительные материалы eurokiorg gdz _ klass ki ГДЗ контрольноизмерительные материалы ким по химии класс Троегубова Вако Химия наука с характером Контрольноизмерительные материалы eurokiorg gdz _ klass ki ГДЗ контрольноизмерительные материалы ким по химии класс Корощенко Экзамен Обычно в классе Химия контрольноизмерительные материалы Гитем class kim Данное пособие содержит решебник ГДЗ контрольноизмерительные материалы по Химии за класс Автора Химия класс контрольноизмерительные материалы ГДЗ https gdz ru class kim troegubova ГДЗ Спиши готовые домашние задания контрольноизмерительные материалы по химии за класс , решебник ГДЗ по химии класс Троегубова контрольно GDZ ME https gdz me class kim troegubov ГДЗ по химии класс Троегубова контрольноизмерительные материалы Авторы Троегубова НП Вако ГДЗ по Химия класс контрольноизмерительные материалы ГДЗ gdz klass kim Подробный решебник ГДЗ по Химии для класса контрольно измерительные материалы , Авторы учебника Химия класс контрольноизмерительные материалы https gdz putinaru klass kim Заходите, не пожалеете! Тут отличные гдз по химии контрольно измерительные материалы для класса , Химия класс Контрольноизмерительные материалы ФГОС labirintrureviews Интересные рецензии пользователей на книгу Химия класс Контрольно измерительные материалы ФГОС ГДЗ по химии для класса контрольноизмерительные gdz klass kim Качественные решения и подробные гдз по химии для учеников класса контрольноизмерительные материалы ГДЗ контрольные работы по химии класс Троегубова gdz com gdz klass kim Подробный решебник ГДЗ к контрольным работам по химии класс Троегубова НП , онлайн ответы на Контрольноизмерительные материалы Химия класс vacorucatalogdetailphp? Пособие содержит тесты, самостоятельные и контрольные работы базового и усложненного уровней по химии Гдз тесты по химии класс ким acinyt Pinterest pinterestru Гдз тесты по химии класс ким Гдз по алгебре класс просвещение Adobe Dreamweaver, Skagen, Middle School, Решебник По Химии Класс Тесты Ким tekstcritic апр Решебник По Химии Класс Тесты Ким Учебники, пособия, рабочие тетради по химии ГДЗ , Химия класс Решение задач по математике онлайн mathsolutionrubooklist Домашняя работа ГДЗ решебник по химии за класс к учебнику класс Тесты Часть Ким ЕП г ГДЗ Химия класс Троегубова КИМ https gdz chat _ klass kim pohimii С честью их выдержать поможет решебник к учебнику Химия КИМ класс Троегубова ГДЗ контрольноизмерительные материалы по химии https gdz georu gdz klass kim Решебник ГДЗ ответы к контрольноизмерительным материалам по химии класс Троегубова Химия класс тест ким vinsingsund Math Pinterest pinterestcom Химия класс тест ким Гдз по литературе класс меркин ответы на вопросы онлайн Алгебра, Книжная Элективный курс по правилам дорожного движения в классе Поиск Слова, Все решебники ГДЗ за класс Reshakru klass html Решебники ГДЗ класс в разделением на категории Английский, Алгебра, Геометрия, Физика, Русский, ГДЗ по химии за класс к Дидактическому материалу ГДЗ по химии за класс к Дидактическому материалу Химия классы А МРадецкий Ким Е П Химия класс Тесты Часть ОНЛАЙН kim ephimiya Ким Е П Химия класс Тесты В частях Саратов, Ч с Тестовые задания с ответами, ГДЗ География контрольноизмерительные материалы https gdz putinaorg klass kim Новые и подробные решебники и гдз по географии за класс Контрольно измерительные материалы ФГОС Химия класс Тесты В ч Ким ЕП Химия класс Тесты В ч Ким ЕП С Ч с, Ч с Тестовые задания с ответами, составленные Химия класс учебники, ГДЗ , учебные пособия, справочная xunicombookss Учимся решать задачи по химии , Формирование предметной компетентности у обучающихся класса , Решебник тестов по химии класс автор ким reshebniktestovpohimii klass avtor апр Подробный решебник ГДЗ к рабочей тетради по географии класс Ким ЭВ, Марченко НА Химия , класс , Тесты, Часть , Ким ЕП, Nasholcom klass testi окт Купить бумажную и электронную книгу по лучшей цене со скидкой и читать Химия , класс , Тесты Химия класс Тесты В х частях Ким ЕП Учебники и kurokamru _ klass kim ноя Тесты, контрольные и самостоятельные работы, дидактические материалы, диктанты Химия Скачать бесплатно Химия класс Тесты В частях Ким Е klass khimiya Скачать бесплатно Химия класс Тесты В частях Ким ЕП Тестовые задания с ответами, составленные в Картинки по запросу ким химия класс гдз Значение химии в истории древних цивилизаций Химия https class ramblerruznacheniehimii Химия класс Габриелян ГДЗ Изучив происхождение слова химия , составьте рассказ о химии и её значении в истории С древнекитайского языка ким переводится как золото Самостоятельные работы по химии класс wwwvariantru html , Самостоятельная работа по химии класс Тема Знаки химических элементов Периодическая система Контрольноизмерительные материалы химия класс Контрольноизмерительные материалы химия класс ответы гдз Контрольноизмерительные гдз ким химия класс Блог им vixdaget JJCRU wwwjjcru gdz kim himiya klass _ Введите в форму поиска название нужного вам ГДЗ или часть текста задания, вопроса и Химия , класс , Тесты, ГДЗ , Решебники за класс Все ГДЗ со по классы gdz info gdz reshebnikiza мар С ГДЗ за класс об этом кошмаре можно забыть навсегда Пособие ГДЗ , Решебник по Химии класс Рудзитис класс класс Авторы учебника Ким ЭВ, Марченко НА класс Тесты по химии с ответами онлайн iqu Список тестов Химия й класс Всего тестов Название теста Химия Физические явления в химии Часть Учебные пособия по химии тесты и проверочные работы Ким ЕП Цена р купить Химия класс Тренировочные задания Контрольные работы Расчетные задачи Алгебра класс Тесты и Тренажеры Контроль знаний контрользнанийрф klass yalgebra Контрольные работы по алгебре класс с ответами Контрольные работы по алгебре в классе Макарычев КИМ Глазков работ Решебник ГДЗ Алгебра класс Макарычев РЕШУ ОГЭ химия ОГЭ задания, ответы Реакции ионного обмена и условия их осуществления просмотреть шт Химические свойства простых Гдз по репетитору по химии егорова PDF DocPlayerru Gdz po Гдз химия класс рабочая тетрадь дубовик Гдз химия класс Назначение КИМ для учащихся классов Поиск материала Химия , класс , Тесты, Часть , Ким ЕП сен ГДЗ контрольноизмерительные материалы ким по химии класс Троегубова Вако Химия Контрольноизмерительные материалы по истории ГДЗ class gdz gdz ki Решебник к учебнику и контрольным работам по истории класс Волкова К В , ГДЗ онлайн на телефон Химия класс Рабочая тетрадь Габриелян ГДЗ domashkasu gdz klass himiya Хочешь научиться разбираться в химии ? Тогда твой помощник в подготовке домашних заданий по химии в ГДЗ решебник по химии класс КИМ Корощенко https gdz putinaco klass gdz Контрольноизмерительные материалы по химии за класс авторов Корощенко АС, Яшуковой АВ года ГДЗ класс Решебники, Ответы, Готовые Домашние Задания gdz monsternet klass ГДЗ для класса Контрольноизмерительные материалы Черноруцкий Для русских школ Химия Химия Буринская Сборника задач и упражнений Хомченко Химия Решаем домашнее задание вместе Школьные Знанияcom Українська література; б; часа назад Напишіть порівняльну характеристику Грицька і Чіпки з твору Хіба елена петровна ким химия класс часть проверочные huhexupetigorruphp сен Решебник по химии за класс авторы габриелян, краснова издательство дрофа Химия Гдз контрольноизмерительные материалы ким по химии класс троегубова вако ким химия класс скачать троегубова сентября jipamashkolamoneyruphp сен Гдз решебник по химии класс ким троегубова лучший онлайн решебник Год издание химия класс проверочные работы ким е п часть mimovuotveti gdz ruphp сен ГДЗ класс Решебники, Ответы, Готовые Домашние Задания Проверочные работы ГДЗ по ГЕОГРАФИИ за класс , все решебники и ответы klass geografiya География класс Ким Алексеев тетрадь авторы География класс контрольноизмерительные материалы гдз по химии класс проверочные работы часть е п ким begedoreutovdanceschoolruphp сен begedoreutovdanceschoolru гдз по химии класс проверочные работы часть е п ким Мы скрыли некоторые результаты, которые очень похожи на уже представленные выше Показать скрытые результаты В ответ на жалобу, поданную в соответствии с Законом США Об авторском праве в цифровую эпоху , мы удалили некоторые результаты с этой страницы Вы можете ознакомиться с жалобой на сайте LumenDatabaseorg Запросы, похожие на ким химия класс гдз тренировочные задания по химии класс ким ответы гдз по химии класс ким по химии класс читать гдз по химии класс габриелян контрольно измерительные материалы контрольно измерительные материалы по химии класс читать онлайн тест химические реакции уравнения реакций расчеты по уравнениям реакций гдз контрольноизмерительные материалы ким по химии класс троегубова вако самостоятельная работа класс химия Войти Версия Поиска Мобильная Полная Конфиденциальность Условия Настройки Отзыв Справка
Кузнецова Н. Е. Химия: 8 класс: учебник для учащихся общеобразовательных учреждений ОНЛАЙН. Решебник тесты химия 8 класс ким 2 часть.
Тесты по химии 8 класс. Автор — Ким Е.П. — 2011 год. Образовательный сайт — Рускопибук (Роскопибук) — Электронные учебники и ГДЗ.
ZUBRILA.NET Химия 8 класс Химия. Скачать бесплатно Химия. 8 класс. Тесты. В 2 частях. Ким Е.П. Тестовые задания с ответами, составленные в соответствии с обязательным минимумом.
Главная gt; Учебники gt; 8 класс Химия. Автор: Ким Е.П. — Часть1 — 64страниц, Часть2 — 64 страниц. Тесты помогут закрепить и проверить знания учащихся, подготовиться к экзаменам ЕГЭ, зачетам и контрольным работам.
Химия. 8 класс. СКАЧАТЬ: учебник, решебник, тесты, практические работы, гдз, ответы, задачник, рабочая тетрадь, лабораторные работы, контрольные, решение задач. Химия 8 класс. ُУчебник Жилин Д.М. -М.: Бином, 2012. 268 с.
Издательство quot;вакоquot; качественная помощь школе. Троегубова н п стрельникова е н контрольно измерительные материалы химия 8 класс.
Е. Химия: 8 класс: учебник для учащихся общеобразовательных учреждений ОНЛАЙН. Решебник тесты химия 8 класс ким 2 часть.
Тесты по химии 8 класс. Автор — Ким Е.П. — 2011 год. Образовательный сайт — Рускопибук (Роскопибук) — Электронные учебники и ГДЗ.
ZUBRILA.NET Химия 8 класс Химия. Скачать бесплатно Химия. 8 класс. Тесты. В 2 частях. Ким Е.П. Тестовые задания с ответами, составленные в соответствии с обязательным минимумом.
Главная gt; Учебники gt; 8 класс Химия. Автор: Ким Е.П. — Часть1 — 64страниц, Часть2 — 64 страниц. Тесты помогут закрепить и проверить знания учащихся, подготовиться к экзаменам ЕГЭ, зачетам и контрольным работам.
Химия. 8 класс. СКАЧАТЬ: учебник, решебник, тесты, практические работы, гдз, ответы, задачник, рабочая тетрадь, лабораторные работы, контрольные, решение задач. Химия 8 класс. ُУчебник Жилин Д.М. -М.: Бином, 2012. 268 с.
Издательство quot;вакоquot; качественная помощь школе. Троегубова н п стрельникова е н контрольно измерительные материалы химия 8 класс. Кликнув по ссылке Вы перейдете на основную страницу про Олимпиада по химии 8 класс с ответами 2012-2013. Задания и решения.
Купить книгу Контрольно-измерительные материалы. Химия. 8 класс. ФГОС (Троегубова Н.П.) в Интернет-магазине My-shop.ru. Низкая цена, доставка курьером и почтой, самовывоз. Читать аннотацию, отзывы покупателей, оставить свой комментарий.
20 Интегрирование по частям в определенном интеграле. Алгебра 7 класс решебник потапов. Округление spotlight 8 класс решебник гдз значений чисел. Условие перпендикулярности двух прямых3.
Кликнув по ссылке Вы перейдете на основную страницу про Олимпиада по химии 8 класс с ответами 2012-2013. Задания и решения.
Купить книгу Контрольно-измерительные материалы. Химия. 8 класс. ФГОС (Троегубова Н.П.) в Интернет-магазине My-shop.ru. Низкая цена, доставка курьером и почтой, самовывоз. Читать аннотацию, отзывы покупателей, оставить свой комментарий.
20 Интегрирование по частям в определенном интеграле. Алгебра 7 класс решебник потапов. Округление spotlight 8 класс решебник гдз значений чисел. Условие перпендикулярности двух прямых3.
Гдз по химии 9 клас. ГДЗ
Ось vi и пошли на уроки химии до введения в важные темы более подробно — растворы, химические реакции, органические сполуки, углеводы, спирт, кислоты. Окрім имеет право на те задания, вы будете посещать лабораторию, пока вы, а по результатам — писать роботов. Защита знаний о коже правильна от химии вимагов и чималих знаний. Причем вонь образуется в процессе вивчення вивчення и повторения уроков. Чтобы вам было удобнее приехать в домашний офис из ГДЗ для девятого класса по химии. Це — ваш специальный консультант по випадке, если инструктор не проинструктирован, а папа занимается уроками.
Чтобы вам было удобнее приехать в домашний офис из ГДЗ для девятого класса по химии. Це — ваш специальный консультант по випадке, если инструктор не проинструктирован, а папа занимается уроками.
Демонстрируйте подсказки для заданий по химии
Если вам легко начать, например, взаимосвязь между словами и взаимодействиями, если вы хотите что-то изменить, то посмотрите готовые домашние задания по химии для 9 класса. Все, что было не до конца разума, было упущено на уроци, чтобы объяснить решатель.Более того, он настолько прост и доступен, что вы легко можете лишить своего домашнего робота 12 баллов. Не забудьте поделиться с девятиклассниками секретами высоких оценок. Также для некоторых из них станет жизнеспособным и девятый класс, оценки всех предметов будут гарнимированы.
Читайте химию онлайн — лучшее решение для школьников
Чем стала для вас домашняя работа по химии на заданиях, не отставайте от ситуации. Покажи себя на ГДЗ по химии для 9 класса с удовлетворением, это даже так просто !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! Со своего номера телефона на компьютере перейдите на сайт GDZ4YOU, де видповиди на скине. Отомстить им безкоштовно, что без ограничений. Осторожно, только одна декабрьская подборка для разных авторов, тогда на сайте вы можете узнать форму на нужный срок. Вы знаете, что независимо от этого портал доступен. Дина умова — подключение к Интернету.
Отомстить им безкоштовно, что без ограничений. Осторожно, только одна декабрьская подборка для разных авторов, тогда на сайте вы можете узнать форму на нужный срок. Вы знаете, что независимо от этого портал доступен. Дина умова — подключение к Интернету.
Будьте вундеркиндом
Кожаный предмет, как в школьном дистрибьюторе для девятиклассников, можно прочитать с учеником 9-го класса. Включая географию, которая богата разнообразием и универсальна.Это предмет, который позволяет много узнать обо всем мире — суше, океанах. С ней вы можете научиться за урок просыпаться от пивничи на выходные, повувати на зеленых стержнях земли. Для дополнительной помощи контурных карт школы должны быть привлечены к применению и развитию смысла. И завдяки атласа и карты вонять могут разповісти богато цікавы про кожу континента.
Изображения обложек учебников показаны на страницах сайта исключительно в качестве иллюстративного материала (ст.1274 п.1 части четвертой Гражданского кодекса Российской Федерации)
- Химия 9.
 Задача Кузнецова, Левкин Вентана-Граф
Задача Кузнецова, Левкин Вентана-Граф - Химия 9 класс. ФГОС Рудзитис, Фельдман Образование
- Контрольно-поверочные работы по химии 9. ФГОС Габриелян, Краснова Дрофа
- Контрольно-измерительные материалы (КИМ) по химии 9. ФГОС Стрельникова Wako
Рабочие тетради
Тесты
ГДЗ — три буквы, которые решат задачи в школе
- Химия — предмет довольно специфический, и с каждым учебным годом разбираться в нем становится не так просто, как раньше.Не всегда удается разобраться с какими-то темами на нескольких школьных уроках, иногда финансово невозможно нанять репетитора, поэтому решебники произвели настоящий фурор.
- Если вы обычный студент и химия для вас не самый понятный предмет — GDZ ваше спасение. Если вы отличник, но хотите узнать дополнительные алгоритмы решения, детально проанализировать сложную проблему или проверить себя — это решение для вас. Если вы родитель и совершенно забыли, что существуют валентности и химические формулы, и вам нужно проверить домашнее задание своего ученика, это идеальный помощник.
 Если вы учитель химии, который хочет жестко контролировать учебный процесс и, не решая задачу самостоятельно, быстро найти ответ — эта книга поможет и вам.
Если вы учитель химии, который хочет жестко контролировать учебный процесс и, не решая задачу самостоятельно, быстро найти ответ — эта книга поможет и вам. - Теперь вы можете купить книгу по химии почти в каждом книжном магазине, но стоит ли отдавать деньги навсегда, если вам нужен только один учебный год. Гораздо проще скачать электронную версию GDZ в Интернете или посмотреть ответы онлайн. В одном небольшом файле будет вся программа по химии для 9 класса.Благодаря GDZ химия станет доступнее, а учиться приятнее.
- Многие девятиклассники выбирают химию как дисциплину, которую они планируют изучать на ОГЭ. В первую очередь, это те выпускники, которые планируют поступать в медицинские и сельскохозяйственные вузы, где этот предмет является ведущим и базовым. Грамотное отношение к напряженной работе, ответственность, щепетильность помогут девятиклассникам эффективно подготовиться. В помощь — качественный набор учебников и решения для них.Достаточно регулярно выделять определенное количество времени на подготовку, и результат не заставит себя ждать.

- Через GDZ можно не только подготовиться к CDF, диагностическим и заключительным тестам. Сборники позволят вам вести самостоятельную работу на предметных олимпиадах по дисциплине. Для девятиклассников победа в нем может означать возможность поступления в вузы по окончании одиннадцатого класса без внутренних экзаменов или с другими льготами. Для победителей 9 класса преимущество сохраняется на ближайшие два года.Комплект учебной, методической и информационной литературы, необходимой для подготовки, школьники могут формировать самостоятельно или обратившись за помощью к специалистам — школьным учителям, наставникам, руководителям кружков и курсов.
- Самыми сложными для изучения и понимания учащимися признаны такие разделы дисциплины химии в 9 классе, как:
— химические элементы и их характеристики;
— Периодическая система Д. И. Менделеева и периодический закон;
— реакции и их катализаторы;
— понятия и свойства металлов и неметаллов с точки зрения химии;
— неорганические вещества и их основные свойства.
- Ряд учебных пособий предусматривает подготовку к итоговой аттестации в течение последнего учебного квартала. Вы можете сформировать свой собственный метод преподавания и обучения, ориентируясь на свои задачи и цели. В такой комплект, помимо стандартного учебника теории, должны входить:
— рабочая тетрадь по химии;
— тетрадь для практических и лабораторных экспериментов;
— поверка и контроль работа;
— контрольные работы, задания и упражнения по химии. - Для самостоятельно обучающихся и находящихся в семейной форме обучения можно включить в пакет рабочие программы и планы уроков по химии для 9 класса, методические разработки учителей и специалистов, тетради и сборники для оценки качества знаний.
Готовое домашнее задание (ГДЗ) по учебнику Г.Е. Рудзитис. «Химия. 9 класс» — книга, в которой собраны решенные примеры и задачи. Окажут ли готовые ответы девятикласснику медвежью услугу? Многие учителя говорят, что такое пособие — спасательный круг для школьников с плохой успеваемостью по химии. И все, кто интересуется химией, желает продолжить учебу, смогут проверить свои ответы и решения.
И все, кто интересуется химией, желает продолжить учебу, смогут проверить свои ответы и решения.
Какая помощь по химии нужна студенту?
Не каждый предмет школьники изучают без проблем.Некоторые люди с 8 класса относятся к химии как к очень сложной и непонятной науке. Проблемы начинаются, когда вам нужно запомнить химические знаки, валентность, уметь определять коэффициенты в уравнениях и производить расчеты. Трудности могут быть временными, и ученику нужно только более уверенно понимать непонятный ему материал.
Воспользовавшись ГДЗ, ребенок начнет понимать суть вопросов и заданий, предложенных в учебнике Рудзитиса.В Решебнике, помимо уравнений реакций и ответов на задачи, даются аргументированные объяснения и алгоритмы действий. Эти шаблоны помогут вашему девятикласснику лучше учиться в классе и дома.
Как пользоваться ГДЗ?
Решебник подходит для закрепления и самостоятельного изучения изучаемых на уроках тем. Первая глава, изучаемая по учебнику Рудзитиса — «Электролитическая диссоциация» — один из самых сложных разделов химии. Автор также включил несколько тем из органической химии, основ химического производства. Благодаря ГДЗ девятиклассник сможет проверить выполнение самого сложного задания учителя на уроке, домашнего задания. Многие используют его для поиска ошибок в расчетах или уравнениях реакций, из-за которых ответ не сходится.
Автор также включил несколько тем из органической химии, основ химического производства. Благодаря ГДЗ девятиклассник сможет проверить выполнение самого сложного задания учителя на уроке, домашнего задания. Многие используют его для поиска ошибок в расчетах или уравнениях реакций, из-за которых ответ не сходится.
Учебное пособие дает возможность родителям школьников увидеть, насколько успешно ребенок усваивает химию. Книга позволяет контролировать учебную работу и помогает в усвоении сложного курса.Руководство можно использовать в режиме онлайн на нашем веб-сайте. Для каждого переиздания учебника Рудзитиса предлагается свой вариант ГДЗ.
Учебник по химии для 9 класса Габриелян — это сборник решений и ответов, набор готовых домашних заданий на основе учебника, составленного для 9 класса авторитетным российским учителем и ученым — О.С. Габриелян. Он призван помочь школьникам в изучении химии — практическом закреплении теоретических знаний.
Решебник по химии, 9 класс Габриелян — белый учебник 2014-2017 гг.

Химия — сложный предмет.Именно поэтому, по статистике, 60-65% школьников ошибаются при решении домашних задач. Как решить эту проблему? Совсем не обязательно искать дорогостоящего репетитора — ученик сможет самостоятельно вычислить уравнения реакций и определить массу сложного раствора, если воспользуется ГДЗ по химии для 9-го класса Габриеляна.
Наш сайт представляет собой продвинутую систему для использования онлайн-ответов на головоломки и примеров по химии 9 класса. Школьники или их родители могут зайти на сайт с планшета или телефона и найти нужный ответ по номеру.
Преимуществами нашего сайта перед другими ресурсами Рунета являются:
- регулярное обновление базы решебников
- , предлагающее несколько решений для каждой задачи.
Обратившись к решениям нашего сайта, девятиклассники смогут понять схему решения задач по химии и составления уравнений реакций. эти знания помогут им при выполнении тестов и сдаче экзаменов. Родители на основе готовых ответов смогут проверить правильность домашних заданий своих детей.
ГДЗ по химии 9 класс Габриелян О.С. — ответы на вопросы учебника
В настоящее время в средних школах России используется учебник для 9 класса О.С. Габриелян, выпущенный в 2014 году во втором издании издательства «Дрофа».
Учебник состоит из 42 параграфов, охватывающих основные вопросы неорганической химии:
- Закономерности таблицы химических элементов Менделеева Д.И. и его структура;
- виды металлов, их физико-химические свойства;
- неметаллы, их свойства и направления использования.
Учебник Габриеляна О.С. Также содержатся вопросы, примеры и задания для рецензии по химии для 8-9 классов. Контрольные задания по разделам позволяют проверить и закрепить теоретические знания.
Такая сложная структура позволяет школьникам успешно выполнять домашние задания, решать контрольные работы, сдавать экзамены и даже использовать знания, полученные при поступлении в вузы.
Ким испытательный завод химии гдз 9.
 Испытательные работы по химии 9 класс
Испытательные работы по химии 9 классСчитается Согласовано Одобрено
№
Вариант 1
Упражнение 1.Дайте полное описание элемента с серийным номером 15.
Задача 2.
и) AI + O2
б) Mg + h3 SO4
дюйма) CaCO3
г) HCI + Na2 CO3
Задача 3.
и) BaCI2 + h4 PO4
б) НСИ + AgNO3
Задача 4.
V)
б) цинк + азотная кислота нитрат цинка + водород
в) хлорид бария + серная кислота
Задание 5.
Учтено Согласовано Одобрено
На собрании заместителя директора ШМО по УВД директора Минобразования Дмитриево
Протокол от _______2017 МОУ Дмитриевская Помряскинская общеобразовательная школа Помряскинская общеобразовательная школа
№ __________ _________________ Витман Д.А. ______________ Дубровская Ю.А.
Протокол МК от ________2017 № _____ Приказ от ______2017 № _______
Входной контроль по химии 9 класс
Вариант 2
Упражнение 1. Дайте полное описание элемента с порядковым номером 19.
Дайте полное описание элемента с порядковым номером 19.
Задание 2 Добавьте реакции, назовите сложные вещества, укажите тип реакции:
и) Zn + O2
б) Mg + HCI
дюйм) h3 О
г) h3 SO4 + K2 CO3
Задача 3.Добавить реакции и записать их в ионной форме? Дайте названия веществам:
и) Ba ( № 3 ) 2 + h4 PO4
б) NaFROMI + AgNO3
Задание 4. Составьте реакции, расставьте коэффициенты, укажите тип реакций:
а) фосфор + кислород оксид фосфора (III)
в) хлорид меди + гидроксид натрия
Задание 5. Вычислить объем углекислого газа (по норме), если он образовался при взаимодействии 230 г раствора, содержащего 10% карбонат натрия, с азотной кислотой.
(входной контроль) по химии 9
Цель работы — контроль уровня подготовки школьников по химии к 8 классу.
Затраты времени — 40 минут (1 занятие).
Проверке подлежит материал основных химических блоков, на которые распространяется содержание школьного курса химии: «Строение атома химического элемента», «Полная характеристика химического элемента», «Номенклатура неорганического вещества »,« Типы химических реакций »,« Реакции ионного обмена »,« Состав химических реакций по схеме »,« Решение химических задач с использованием концепции примесей »,« Решение химических задач для растворов ».
№ задач | Уровень сложности | Тип работы | |
База | |||
База | Принятие мер (решение) | ||
База | Принятие мер (решение) | ||
2,4 | Типы химических реакций | База | Принятие мер (решение) |
Реакции ионного обмена | База | Принятие мер (решение) | |
Составление химических реакций по схеме | База | Принятие мер (решение) | |
База | Принятие мер (решение) | ||
База | Принятие мер (решение) |
Критерии оценки — первое и пятое задания оцениваются до 5 баллов, каждый правильный ответ из 2-4 заданий (по каждой букве) оценивается в 1 балл. За неправильный ответ или отсутствие ответа начисляется 0 баллов. Максимальное количество баллов в работе — 19. Рекомендуемая шкала перевода баллов в оценку:
За неправильный ответ или отсутствие ответа начисляется 0 баллов. Максимальное количество баллов в работе — 19. Рекомендуемая шкала перевода баллов в оценку:
Баллы | 0–7 | 8–13 | 14–16 | 17–19 |
Оценка |
Ответы на задания.Вариант 1
Упражнение 1.
1. Р-сера неметаллическая
2. Находится в пятой группе ПС, основной подгруппе, в 3-м периоде.
3. 15 Rr + 15 н0 16 1S2 2S2 2P6 3 S2 3P5 3 d0
е- 15
4. Неметаллические свойства в период слева направо увеличиваются.
5. Снижены неметаллические свойства в группах сверху вниз
6.P2 О КОМПАНИИ5 — формула высшего оксида, проявляет окислительные свойства
7.Ph4 — формула летучего соединения водорода, фосфина.
Задача 2.
а) 4AI + 3 O2 2 AI2 O3 — оксид алюминия, соединение реакции
б) Mg + h3 SO4 (серная кислота) MgSO4 (сульфат магния) + h3 — реакция замещения
в) CaCO3 (карбонат кальция) CaO (оксид кальция) + CO2 (окись углерода (IV)) — реакция разложения
d) 2HCl + Na2 CO3 2 NaCI + h3 O + CO2 (окись углерода (IV)) — реакция обмена
соляная кислота карбонат натрия хлорид натрия оксид водорода
Задача 3.
а) 3BaCI2 + 2 h4 PO4 Ba3 ( PO4 ) 2 + 6 HCl
хлорид бария фосфорная кислота фосфат бария соляная кислота
3 Вау3 + + 6CI- + 6 H + + 2 PO4 3- Ba3 (PO4 ) 2 + 6H + + 6CI-
3 Вау3 + + 2 PO4 3- Ba3 (PO4 ) 2
б) НСИ + AgNO3 AgFROMI + H NO3
соляная кислота нитрат серебра хлорид серебра азотная кислота
H + + FROMI- + Ag + + NO3 — AgFROMI + H + + NO3 —
Ag + + CI- Ag FROMI
Задача 4.
а) фосфор + кислород оксид фосфора (V)
4P + 5O2 2P2 О КОМПАНИИ5 — сложная реакция
б) цинк + азотная кислота нитрат цинка + вода + оксид азота (IV)
Zn +4 NNO3 Zn ( № 3 ) 2 + 2 h3 O + 2 NO2 — реакция замещения
в) хлорид бария + серная кислота, сульфат бария + соляная кислота
BaCI2 + h3 SO4 2 НСИ + BaSO4 — реакция обмена
Задача 5.
Дано: Решение:
m ( CaCO3
мокрый
VmX g — чистое вещество
V ( СО2 ) -? м ( CaCO3 ) = 250 * 90/100 = 225 г.
225 BCv л. — по условию задачи
CaCO3 + h3 SO4 Ca SO4 + h3 О НАС + СО2
В ( СО2 ) = 225 * 22,4 / 100 = 50,4 л.
Ответ: V ( СО2 ) = 50,4 л.
Ответы на задания. Вариант 2
Упражнение 1.
1. К — калий, металл.
2. Находится в ПС в первой группе, в основной подгруппе, в четвертом периоде.
3. 19 TOr + 19 н0 20 1S2 2S2 2P6 3 S2 3P6 3 d0 4S1
е- 19
6.K2 O- формула высшего оксида, проявляет основные свойства
Задача 2.
a) 2Zn + O2 2 ZnABOUT- оксид цинка, соединение реакции
б) Mg + 2 HCl (соляная кислота) MgCI2 (хлорид магния) + h3 -реакция замещения
в 2х3 О (оксид водорода) 2х3 + O2 — реакция разложения
г) h3 SO4 + K2 CO3 K2 SO4 + h3 O + CO2 (окись углерода (IV)) — обменная реакция
Задание 3.
и) 3 Ba (NO3 ) 2 + 2ч4 PO4 Ba3 (PO4 ) 2 + 6HNO3
нитрат бария фосфорная кислота фосфат бария азотная кислота
3Ba2 + + 6НО3 — + 6H + + 2PO4 3- Ba3 (PO4 ) 2 + 6H + 6 NO3 —
3 Вау3 + + 2 PO4 3- Ba3 (PO4 ) 2
б) NaFROMI + AgNO3 NaNO3 + AgFROMI
хлорид натрия нитрат серебра нитрат серебра хлорид серебра
Na + + FROMI- + Ag + + NO3 — Na + + № 3 — + АгФРОМИ
Ag + + CI- Ag FROMI
Задача 4.
а) фосфор + кислород оксид фосфора (III)
4P + 3O2 2P2 О КОМПАНИИ3 — сложная реакция
б) цинк + соляная кислота хлорид цинка + водород
Zn + 2 HCIZnCI2 + h3 — реакция замещения
c) хлорид меди (II) + гидроксид натрия гидроксид меди (II) + хлорид натрия
CuCI2 +2 NaOHCu ( ОЙ) 2 + 2 NaCI — реакция обмена
Задача 5.
Дано: Решение:
m (
Na2 CO3 ) = 230 г.1. Найдите массу чистого карбоната натрия.
wetc = 10% 100 г с примесями — 90 г чистого вещества
Vm = 22,4 л / моль 230 г с примесями -X г — чистое вещество
V ( СО2 ) -? м ( CaCO3 ) = 230 * 90/100 = 207 г.
2. Найдем объем углекислого газа.
207 гв л. — по условию задачи
Na2 CO3 +2 HNO3 2 Na NO3 + h3 О НАС + СО2
106 г 22,4 л. — по уравнению реакции
В ( СО2 ) = 207 * 22.4/106 = 43,7 л.
Ответ: V ( СО2 ) = 43, 67 л.
Учтено Согласовано Одобрено
На собрании заместителя директора ШМО по УВД директора Минобразования Дмитриево
Протокол от _______2017 МОУ Дмитриево Помряскинская общеобразовательная школа Помряскинская общеобразовательная школа
№ __________ _________________ Витман Д.А. ______________ Дубровская Ю.А.
Протокол МЦ от ________2017 г._____ Приказ от ______2017 г. № _______
Вариант 1
Упражнение 1. Дайте полное описание элемента с порядковым номером 25.
Задание 2.
h3 О КОМПАНИИ2 + TOMnO4 + h3 SO4 O2 + MnSO4 + K2 SO4 + h3 О
Задача 3.
BaCI2 + h4 PO4
Задача 4.
Na2 S
Задача 5. Рассчитать объем углекислого газа (по норме), если он выделился при взаимодействии 250 г мела, содержащего 10% примесей, с серной кислотой.
Учтено Согласовано Одобрено
На собрании заместителя директора ШМО по УВД директора Минобразования Дмитриево
Протокол от _______2017 МОУ Дмитриево Помряскинская общеобразовательная школа Помряскинская общеобразовательная школа
№ __________ _________________ Витман Д.А. ______________ Дубровская Ю.А.
Протокол МК от ________2017 № _____ Приказ от ______2017 № _______
Входной контроль по химии 10 класс
Вариант 2
Упражнение 1.Дайте полное описание элемента с порядковым номером 30.
Задача 2. Выровняйте реакцию с помощью метода электронных весов:
Na2 SABOUT3 + TOMnO4 + h3 O Na2 SO4 + MnO2 + KOH
Задача 3./001.jpg) Добавьте реакцию и запишите ее в ионной форме:
Добавьте реакцию и запишите ее в ионной форме:
AICI3 + AgNO3
Задача 4. Записать гидролиз соли, в том числе в ионной форме:
FeCI3
Задача 5. Вычислить объем водорода (по стандарту), если он выделился при взаимодействии 240 г магния, содержащего 12% примесей, с соляной кислотой.
ТЗ
(входной контроль) по химии 10
Цель работы — контроль уровня подготовки школьников по химии к курсу 9 класса.
Затраченное время — 40 минут (1 занятие).
Общая характеристика содержания и структуры работы:
Работа состоит из одной части, содержащей 5 задач, требующих решения.
С помощью заданий, направленных на проверку базового уровня подготовки по химии, знания и понимания важных элементов содержания (понятий, их свойств, приемов решения задач и т. Д.), владение базовыми алгоритмами и умение применять знания при решении химических задач. При выполнении этих заданий студенты также должны продемонстрировать определенную последовательность знаний и широту представлений, умение переключаться с одного химического языка на другой.
Проверке подлежит материал основных химических блоков, на которые распространяется содержание школьного курса химии: «Строение атома химического элемента», «Полная характеристика химического элемента», «Номенклатура неорганических веществ» »,« Редокс-реакции »,« Реакции ионного обмена »,« Гидролиз веществ »,« Решение химических задач с использованием концепции примесей.»
№ задач | Проверенные элементы содержимого | Уровень сложности | Тип работы |
Атомная структура химического элемента | База | Принятие мер (решение) | |
Полная характеристика химического элемента | База | Принятие мер (решение) | |
2,3 | Номенклатура неорганических веществ | База | Принятие мер (решение) |
Окислительно-восстановительные реакции | База | Принятие мер (решение) | |
Реакции ионного обмена | База | Принятие мер (решение) | |
Гидролиз веществ | База | Принятие мер (решение) | |
Решение химических задач с использованием концепции примеси | База | Принятие мер (решение) |
Критерии оценки — первое и пятое задания оцениваются до 5 баллов, каждый правильный ответ из 2-4 заданий оценивается в 2 балла. За неправильный ответ или отсутствие ответа начисляется 0 баллов. Максимальное количество баллов в работе 16. Рекомендуемая шкала перевода баллов в оценку:
За неправильный ответ или отсутствие ответа начисляется 0 баллов. Максимальное количество баллов в работе 16. Рекомендуемая шкала перевода баллов в оценку:
Баллы | 0–7 | 8–11 | 12–14 | 15–16 |
Оценка |
Ответы на задания.Вариант 1
Упражнение 1.
1. Mn — марганец, переходный металл.
2. Находится в ПС в седьмой группе, в боковой подгруппе в четвертом периоде.
3. 25 Mnr + 25 n0 30 1S2 2S2 2P6 3 S2 3P6 3 д 5 4S2
е- 25
4. Металлические свойства в период слева направо ослабевают.
5. Улучшены металлические свойства в группах сверху вниз
6. Mn2 О КОМПАНИИ7 — формула высшего оксида, проявляет амфотерные свойства
7. Формула летучего соединения водорода — отсутствует
Формула летучего соединения водорода — отсутствует
Задача 2.
5 h3 О КОМПАНИИ2 + 2 TOMnO4 +3 ч3 SO4 5O2 + 2MnSO4 + K2 SO4 + 8h3 О
Мн + 7 + 5e- Mn + 2 (окислитель, восстановитель)
2 О-1 -2e- 2O-2 (восстановитель, окисление)
Задача 3.
3 BaCI2 + 2 h4 PO4 Wah4 ( PO4 ) 2 + 6HCI
3Ba2 + +6 CI- + 6H + + 3PO4 3- Wah4 (PO4 ) 2 + 6 H + + 6CI-
3 Ba2 + +3 PO4 3- Wah4 ( PO4 ) 2
Задача 4.
Na2 S 2Na + + S2-
h3 O H + + ОН-
2Na + + S2- + H + + ОН- Hs- + 2Na + + ОН-
Na2 S + h3 ONaHS + NaOH
В результате гидролиза получена кислая соль гидросульфид натрия, среда раствора щелочная.
Задача 5.
Дано: Решение:
м ( CaCO3 ) = 250 г. 1. Найдите массу чистого карбоната натрия.
wetc = 10% 100 г с примесями — 90 г чистого вещества
Vm = 22.4 л / моль 250 г с примесями -X г — чистое вещество
V (
СО2 ) -? м (
CaCO3 ) = 250 * 90/100 = 225 г.
2. Найдем объем углекислого газа.
225 BCv л. — по условию задачи
CaCO3 + h3 SO4 Ca SO4 + h3 О НАС + СО2
100 г 22,4 л. — по уравнению реакции
В ( СО2 ) = 225 * 22,4 / 100 = 50,4 л.
Ответ: V ( СО2 ) = 50,4 л.
Ответы на задания.Вариант 2
Упражнение 1.
1. Zn — цинк, переходный металл.
2. Находится в ПС во второй группе, в боковой подгруппе, в четвертом периоде.
3. 30 Znr + 30 н0 25 1S2 2S2 2P6 3 S2 3P6 3 д 10 4S2
е- 30
4. Металлические свойства в период слева направо ослабевают.
5. Улучшены металлические свойства в группах сверху вниз
6. ZnO — формула высшего оксида, проявляет амфотерные свойства
7.Формула летучего соединения водорода — отсутствует
Задача 2.
3Na2 SABOUT3 + 2 TOMnO4 + h3 O 3 Na2 SO4 + 2MnO2 +2 КОН
Mn + 7 + 3-й- Mn + 4 (окислитель, восстановитель)
S + 4 -2e- S + 6 (восстановитель, окисление)
Задача 3.
AICI3 + 3AgNO3 AI (NO3 ) 3 + 3 Ag CI
AI3 + + 3 CI- + 3Ag + +3 NO3 — AI3 + + 3НО3 — + 3 Ag CI
3 Ag + + 3 CI- 3 AgCI
Задача 4.
FeCI3 Fe3 + + 3CI-
h3 O H + + ОН-
Fe3 + + 3CI- + H + + ОН- 3CI- + H + + Fe Oh3 +
FeCI3 + h3 O Fe OH CI2 + H CI
В результате гидролиза образовалась основная соль — гидроксихлорид железа (III), среда раствора кислая.
Задача 5.
Дано: Решение:
m (Mg) = 240 г. 1. Найдите массу чистого магния.
wetc = 12% 100 г с примесями — 88 г чистого вещества
Vm = 22,4 л / моль 240 г с примесями -X г — чистое вещество
V (h3 ) -? м (Мг) = 240 * 88/100 = 211,2 г.
2. Найдем объем углекислого газа.
211,2 гв л. — по условию задачи
Mg + 2HCI MgCI2 + h3
24 р.22,4 л. — по уравнению реакции
В (CO2 ) = 211,2 * 22,4 / 24 = 197,12л.
Ответ: V (h3 ) = 197,12 л.
Учтено Согласовано Одобрено
На собрании заместителя директора ШМО по УВД директора Минобразования Дмитриево
Протокол от _______2017 МОУ Дмитриевская Помряскинская общеобразовательная школа Помряскинская общеобразовательная школа
№ __________ _________________ Витман Д. А. ______________ Дубровская Ю.А.
А. ______________ Дубровская Ю.А.
Протокол МК от ________2017 г. № _____ Приказ от ______2017 г. № _______
Вариант 1
Упражнение 1
а) Ч3 = СН — Ч4
б) Ч4 — O — Ch4 Ch4
в) Ч4 — Ch3 — CH — COOH d) d) Ch4
Ч4
Задача 2.
а) пентадиен — 1,3 в) 4 — метилпентанол — 2
б) бутен — 2 г) 2,5 — диметил, 3 — этилгексан
Задача 3.
а) С2 H5 ОН + О2 в) СН = С — Ч4 + h3 ПРО
б) Ч3 = СН — Ч3 — Ch4 + HCI
Задача 4.
a) фенол b) уксусная кислота
Задача 5. Рассчитайте объем этилена (нет данных), если он выделяется в результате реакции дегидратации 350 г раствора, содержащего 15% спирта.
Учтено Согласовано Одобрено
На собрании заместителя директора ШМО по УВД директора Минобразования Дмитриево
Протокол от _______2017 МОУ Дмитриевская Помряскинская общеобразовательная школа Помряскинская общеобразовательная школа
№ __________ _________________ Витман Д. А. ______________ Дубровская Ю.А.
А. ______________ Дубровская Ю.А.
Протокол МК от ________2017 № _____ Приказ от ______2017 № _______
Входной контроль по химии 11 класс
Вариант 2
Упражнение 1 Дайте названия субстанциям. К каким классам органических веществ они относятся?
а) Ч4 — Ch4
б) Ч4 — Ch3 — О КОМПАНИИ d) d) OH
in) C6 H6
Задание 2. Составьте формулы веществ по названиям, подпишите названия под формулами веществ.К каким классам органических веществ они относятся?
а) 1 — метилбензол в) 2,2 — диметилбутанол — 1
б) бутан г) пентин — 2
Задача 3. Добавьте реакции, дайте названия органическим веществам, укажите условия реакций:
а) Ch5 + O2 в) C2 H5 IS HE
b) C2 H6 + CI2
Задача 4. Как химически распознать:
a) ацетилен b) раствор куриного белка
Задача 5. Вычислить объем и количество вещества хлористого водорода в (n.ед.), если в результате реакции хлорирования выделяется 78,2 л пропана.
ТЗ
(входной контроль) по химии 11 класс
Цель работы — контроль уровня подготовки школьников по химии к курсу 10 класса.
Затраченное время — 40 минут (1 занятие).
Общая характеристика содержания и структуры работы:
Работа состоит из одной части, содержащей 5 задач, требующих решения.
С помощью заданий, направленных на проверку базового уровня подготовки по химии, знания и понимания важных элементов содержания (концепций, их свойств, приемов решения задач и т. Д.), Владения базовыми алгоритмами и умений применять знания при решении химических задач. При выполнении этих заданий студенты также должны продемонстрировать определенную последовательность знаний и широту представлений, умение переключаться с одного химического языка на другой.
Проверке подлежит материал основных химических блоков, на которые распространяется содержание школьного курса химии: «Номенклатура органических веществ», «Классификация органических веществ», «Составление формул органических веществ по их наименованиям. »,« Химические свойства органических веществ »,« Качественные реакции на органические вещества »,« Решение химических задач для решений »,« Решение химических задач с использованием концепции молярного объема газообразного вещества.»
»,« Химические свойства органических веществ »,« Качественные реакции на органические вещества »,« Решение химических задач для решений »,« Решение химических задач с использованием концепции молярного объема газообразного вещества.»
№ задач | Проверенные элементы содержимого | Уровень сложности | Тип работы |
Номенклатура органических веществ | База | Принятие мер (решение) | |
Классификация органических веществ | База | Принятие мер (решение) | |
Составление формул органических веществ с указанием их наименований | База | Принятие мер (решение) | |
Химические свойства органических веществ | База | Принятие мер (решение) | |
Качественные реакции на органические вещества | База | Принятие мер (решение) | |
Решение химических проблем для решений | База | Принятие мер (решение) | |
Решение химических задач с использованием понятия молярного объема газообразного вещества | База | Принятие мер (решение) |
Критерии оценки — каждое задание 1-4 оценивается в 1 балл, за каждую букву правильного ответа пятое задание оценивается в 5 баллов. За неправильный ответ или отсутствие ответа начисляется 0 баллов. Максимальное количество баллов в работе -18. Рекомендуемая шкала перевода баллов в оценки:
2
За неправильный ответ или отсутствие ответа начисляется 0 баллов. Максимальное количество баллов в работе -18. Рекомендуемая шкала перевода баллов в оценки:
2
Ответы на задания. Вариант 1
Упражнение 1.
а) пропен, алкены б) диэтиловый эфир, простые эфиры
в) 2-метилбутановая кислота, карбоновые кислоты
г) 1,2-димилилбензол, ароматические углеводороды (арены)
Задание 2.
а) Ч3 = CH — CH = CH — Ch4 пентадиен — 1,3 (диеновые углеводороды)
б) Ch4 — CH = CH — Ch4 _ бутен — 2 (алкены)
в) Ch4 — CH (OH) -Ch3 — CH (Ch4 ) — Ch4 4 — метилпентанол — 2 (одноатомные спирты)
г) Ch4 — CH (Ch4 ) — CH (C2 H5 ) — Ch3 — CH (Ch4 ) — Ch4 2,5 — диметил, 3 — этилгексан (алканы)
Задача 3.
a) C2 H5 ОН + 3О2 2 СО2 + 3ч3 O c) CH = C — Ch4 + h3 О Ch3 = CH
этанол пропин пропенол-2
(OH) — Ch4
б) Ч3 = СН — Ч3 — Ch4 + HCI Ch4 — CH (CI) — Ch3 — Ch4
бутен — 1 2-хлорбутан
Задача 4.
а) С6 H5 ОН + 3Vr ОТ6 h3 (Br) 3 OH + 3HVr
фенол 2,4,6 — трибромфенол
б) 2 Ch4 UNSD + Na2 CO3 2 Ch4 SOONa + CO2 + h3 O
Задача 5.
Дано: Решение:
м (FROM2 H5 ОН) = 350 г. 1. Найдем массу этилового спирта.
ш = 15% м (ОТ2 H5 ОН) = 350 * 15/100 = 52,5 г.
Вм = 22,4 л / моль
В (ОТ2 h5 ) -?
2. Найдем объем этилена.
52.5 гв л. — по условию задачи
ИЗ2 H5 ОН WITh3 h5 + h3 ПРО
46 г 22,4 л. — по уравнению реакции
V (C2 h5 ) = 52,5 * 22,4 / 46 = 25,6 л.
Ответ: V (FROM2 h5 ) = 25,6 л.
Ответы на задания. Вариант 2
Упражнение 1.
а) этан, класс — алканы б) этанол, класс — одноатомные спирты
в) бензол, класс — арены г) фенол, класс фенолы
Задание 2.
Ч4
а) 1-метилбензольный класс — арены
б) бутан Ч4 — Ch3 — Ch3 — Ch4 класс -алканы в) 2,2 — диметилбутанол — 1, класс — одноатомные спирты СН2 (ОН) — С (Ch4 ) 2 — Ch3 — Ch4
г) пентин — 2, класс — алкины, СН3 — С = С — Ч3 — Ch4
Задача 3.
a) Ch5 +2 О2 СО2 +2 N2 О КОМПАНИИh3 SO4
метан в) С2 H5 ОН WITh3 h5 + h3 ОКО
б) С2 H6 + CI2 FROM2 H5 CI + HCl этанол этилен
этан хлорэтан
Задача 4.
а) качественная реакция на ацетилен — обесцвечивание бромной воды:
CH = CH + 2Br2 знак равно CHBr2 — CHBr2
1,1,2,2 — тетрабромэтан
б) качественной реакцией на раствор белка является реакция Санто-белка:
раствор белка + Cu (OH) 2 = красный цвет раствора, реакция на пептидную связь и пептидную группу
Задача 5.
Дано: Решение:
V (FROM3 H8 ) = 78,2 л. 1. Найдем объем хлористого водорода.
78,2 л. В л. — по условию задачи
ОТ3 H8 + CI2 = C3 H7 CI + HCI
Vm = 22,4 л / моль 22,4 л. 22,4 л. — согласно уравнению реакции
В (HCI) -?
н (HCI) -? V (HCI) = 78,2 * 22,4 / 22,4 = 78,2л.
2. Найдите количество хлористого водорода
n (HCl) = V / Vm = 78,2 / 22,4 = 3,5 моль
Ответ: V (HCl) = 78,2 л, n (HCl) = 3,5 моль
М.: 20 1 3. — 2 40 с.
Учебное пособие является составной частью учебного комплекса по химии, основу которого составляет учебник О.С. Габриеляна «Химия. 9 класс », доработанный в соответствии с ФГОС. Учебное издание состоит из текстов контрольных и проверочных работ, соответствующих программе химии для 9 класса Габриелян О.С. Учебное пособие предназначено для проведения текущего и итогового контроля по основные темы курса
Формат: pdf
Размер: 2.2 МБ
Часы, скачать: drive.google
Содержание
Предисловие 3
Тематическая верификационная работа
Периодический закон и Периодическая таблица химических элементов Д. И. Менделеева 5
Химическая организация природы. Химические реакции. Скорость химической реакции 18
Положение металлов в периодической таблице химических элементов Д. И. Менделеева. Физические свойства металлов. Сплавы 32
Химические свойства металлов 42
Щелочные металлы и их соединения 53
Металлы II группы основной подгруппы 63
Алюминий и его соединения 73
Железо и его соединения 84
Общая характеристика неметаллов.Кислород, озон, воздух 95
Водород и вода 105
Галогены 116
Подгруппа кислорода 126
Азот и его соединения 137
Фосфор и его соединения 148
Подгруппа углерода 158
Комбинированные испытания
Металлы 170
Неметаллы 181
Окончательный тест для курс основной школы 193
Подготовка к государственной итоговой аттестации (ГИА)
Периодический закон Д.И. Менделеева.
Атомная структура 205
Химические реакции 211
Химические свойства неорганических веществ 217
Примерные варианты для GIA
Вариант 1 224
Вариант 2 229
Контрольная работа
Тема: Полугодовая Контрольная работа по химии для 9 класса
Цель: Объективная оценка уровня усвоения учебных достижений учащихся в соответствии с государственными общеобязательными стандартами по химии на полметра год
План и структура тестирования:
Тестовые задания используются как мера знаний и навыков студентов по химии за полгода.Работа состоит из 25 заданий. Они расположены в порядке возрастания сложности и разделены на 2 блока.
Блок И содержит 20 задач, на каждую из которых даются ответы. При выполнении этих заданий требуется выбрать правильные ответы из предложенных вариантов.
Блок B содержит 5 задач, требующих записи решения.
Тест имеет следующую структуру:
Раздел «Электроитная диссоциация» включает 8 заданий, проверяющих диссоциацию веществ на ионы, степень диссоциации, составление уравнений в молекулярной, полной и сокращенной ионной форме
Раздел «Характеристика фосфора и его соединений» включает 3 задания, проверяющих структуру атома, определение степени окисления в соединениях фосфора, химические свойства.
Раздел «Сера и ее соединения» включает 4 задания, проверяющих структуру атома, свойства соединений
Раздел «Азот и его соединения» включает задание, проверяющее знание свойств соединений азота, строения атома и определение степеней окисления
Решение задач
Спецификация испытаний.
Рабочий № | Проверено |
Блок A | |
Электролит неэлектролит | |
Диссоциация кислот | |
Диссоциация солей | |
Сильный, слабый электролит | |
Сумма коэффициентов в полном ионном уравнении | |
Определение реагирующих веществ по сокращенному ионному уравнению | |
Определение среды раствора по действию индикатора | |
Металл, неметалл | |
Определение степени окисления серы в соединениях | |
Схема превращений сернистых соединений | |
Химические свойства серной кислоты | |
Номенклатура солей серной кислоты | |
Азотная кислота | |
Физические свойства аммиака | |
Химические свойства азотной кислоты | |
Электронная формула атома фосфора | |
Схема превращений соединений фосфора | |
Определение степени окисления фосфора в соединениях | |
Определение относительной молекулярной массы | |
Расчет массовых долей | |
Блок B | |
Расчет относительной плотности газов | |
Расчет количества вещества по формуле | |
Расчет массы вещества по уравнению реакции, если одно из исходных веществ указано в избытке | |
Расчет массовой доли выхода продукта реакции в сравнении с теоретически возможной | |
Расчет объема газа по уравнению реакции, если один из исходных материалов указан в избытке | |
Вариант 1
Блок A
1.Электролит
A) H 2 SO 4 B) CH 4 C) O 2 D) C 2 H 5 OH E) CO 2
A) HCl B) H 3 PO 4 C) H 2 SO 4 D) NaHSO 4 E ) H 2 CO 3
D) 2Al 3+ + 3SO 4 2- E) 2Al 2+ + 3SO 4 3-
4. Слабый электролит
A) KCl B) KOH C) HNO 3 D) H 2 CO 3 E) Ba (OH) 2
A) 3 B) 11 C) 9 D) 12 E) 15
D) карбонат натрия и соляная кислота
E) карбонат натрия и вода
A) Синий B) Желтый C) Красный
D) Бесцветный E) Оранжевый
8.Неметалл
A) Ba B) SC) Mg D) Cr E) Cu
A) H 2 SB) SO 2 C) H 2 SO 3 D) SE) SO 3
A) Оксид серы (V1) B) Сероводород C) Сера
A) Медь B) Азот C) Цинк D) Соляная кислота E) Двуокись углерода
A) Сульфиды B) Сульфаты C) Сульфиты
A) HRO 2 B) H 2 RO 3 C ) HRO 3 D) H 2 RO 4 E) H 2 RO 4
A) Жидкость B) С резким специфическим запахом
C) Хорошо растворим в воде
C) Оксид кальция
A) 1s 2 2s 2 2p 6 3s 2 3p 1 B) 1s 2 2s 2 2p 6 3s 2 3p 2 C) 1s 2 2s 2 2p 6 3s 2 3p 3
O 2 + 3H 2 O 17.Вещества X 1 и X 2 в схеме превращений P à X 1 à
H 3 EO 4 à X 2
A) X 1 — P 2 O 3, X 2 — Na 3 PO 4 B) X 1 -P 2 O 5, X 2 — NaH 2 PO 4 C) X 1 -P 2 O 5, X 2 — Na 3 PO четыре
A) P 2 O 3 B) P 2 O 5 C) HPO 3 D) H 3 PO 4 E) Na 3 P
A) 32 B) 31 C) 34 D) 64 E) 68
Блок B
A) 8,5 B) 11,5 C) 9,5 D) 12,5 E) 15,5
A ) 1 моль B) 2 моль C) 0,5 моль D) 0,25 моль E) 5 мол.
А) 10.7 г B) 19,4 г C) 13,6 г D) 17 г E) 8,5 г
24. Масса аммиака, полученного при разложении 10,7 г хлорида аммония, если массовая доля выхода аммиака составляет 25% A) 3,4 г B) 9,4 г C) 0,85 г D) 1,7 г E) 8,5 г
Вариант 2
Блок A
1. Неэлектролит
A) NaCl B) K 2 CO 3 C) HNO 3 D) C 6 H 12 O 6 E) Na 2 CO 3
2. Диссоциирует в две стадии
A) HCl B) H 3 PO 4 C) HNO 3 D) NaHSO 4 E) Na 2 CO 3
A) Fe 2+ + 3Cl — B) Fe + Cl C) 2Fe 3+ + 3Cl 3- D) Fe 3+ + 3Cl — E) Fe 3+ + 3Cl +
4.Слабый электролит
A) HNO 3 B) H 2 CO 3 C) H 2 SO 4 D) HCl E) BaCl 2
A) 3 B) 11 C) 17 D) 12 E) 14
A) FeCO 3 + 2NaOH B) Fe (NO 3) 2 + 2NaOH C) FeSiO 3 + LiOH
A) Синий B) Желтый C) Красный D) Бесцветный E) Оранжевый
8. Неметаллический
A) Si B) Na C) Fe D) Pb E) Ba
A) 1 B) 2 C) 3 D) 4 E) 5
A) BaO B) Cu (OH) 2 C) HCl D) Na 2 CO 3 E) HNO 3
A) MgCl 2 B) H 3 PO 4 C) Fe Cl 2 D) BaCl 2 E) Na 2 CO 3
A) Сульфиды B) Сульфаты C) Сульфиты D) Гидроксосульфаты E) Гидросульфаты
A) Газ B) Без цвета и запаха C) Немного тяжелее воздуха
A) Кислород B) Гидроксид натрия C) Сульфат калия D) Вода E) Водород
A) NO 2 B) NO C) H 2 D) N 2 E) N 2 O
A) 108 B) 142 C) 133 D) 88 E) 164
A) фосфорная кислота B) гидроксид калия C) оксид калия
A) P 2 O 3 B) P 2 O 5 C) H 3 PO 4 D) H PO 3 E) PH 3
A) 32 B) 17 C) 34 D) 64 E) 68
A) 50% B) 25% C) 40% D) 80% E) 65%
Блок B
А) 8.5 B) 11,5 C) 23 D) 17 E) 15,5
A) 21 г B) 14 г C) 56 г D) 28 г E) 42 г
A) 37 г B) 166 г C) 83 г D) 40 г E) 62 г
A ) 53,5 г B) 107 г C) 85 г D) 10,7 г E) 85 г
A) 22,4 фунта) 5,6 LC) 2,8 LD) 11,2 LE) 33,6 л
Ответы
Вариант 1
Блок A
1. Электролит
И) H 2 СО 4 B) CH 4 C) O 2 D) C 2 H 5 OH E) CO 2
2.Диссоциирует за одну стадию
AND) HCl B) H 3 PO 4 C) H 2 SO 4 D) NaHSO 4 E) H 2 CO 3
3. Во время диссоциации Al 2 (SO 4) 3 соль, образуются частицы
A) Al 3+ + SO 4 2- B) 2 Al +3 SO 4 C) 2Al 3- + 3SO 4 2+
D) 2Al 3+ + 3SO 4 2- E) 2Al 2+ + 3SO 4 3-
4. Слабый электролит
A) KCl B) KOH C) HNO 3 D ) H 2 CO 3 E) Ba (OH) 2
5.Сумма всех коэффициентов в полном уравнении ионной реакции Ca (NO 3) 2 + K 2 CO 3 =
1Ca + 2NO 3 + 2К + 1СО 3 = 1Ca CO 3 +2 К + 2НО 3
A) 3 B ) 11 C) 9 D) 12 E) 15
6. Сокращенное ионное уравнение: 2H + + CO 3 2- = H 2 O + CO 2 соответствует взаимодействию
A) карбоната кальция и соляной кислоты
B) карбонат натрия и кремниевая кислота
C) силикат натрия и соляная кислота
D ) карбонат натрия и соляная кислота
E) карбонат натрия и вода
7.В растворе соляной кислоты фиолетовый лакмус превращается в
A) Синий B) Желтый C) Красный
D) Бесцветный E) Оранжевый
8. Неметаллический
A) Ba IN) S C) Mg D) Cr E) Cu
9. Сера имеет степень окисления +6 в соединении
A) H 2 SB) SO 2 C) H 2 SO 3 D) S E) SO 3
10. Вещество A в цепочке трансформации: H 2 S → SO 2 → A → H 2 SO 4 → SO 2
A ) Оксид серы ( V 1) B) Сероводород C) Сера
D) Сульфид натрия E) Сульфат натрия
11.Раствор серной кислоты взаимодействует с:
A) медью B) азотом C ) цинком D) соляной кислотой E) диоксидом углерода
12. Средние соли серной кислоты называются
A) сульфидами B ) Сульфаты C) Сульфиты
D) Гидроксосульфаты E) Гидросульфаты
13. Формула гидроксида, характерная для азота:
A) HRO 2 B) H 2 RO 3 C ) СПЧ 3 D) H 2 RO 4 E) H 2 RO 4
14.Не относится к физическим свойствам аммиака.
A ) Жидкость B) С резким специфическим запахом
C) Хорошо растворим в воде
D) Легче воздуха E) Бесцветный
15. Азотная кислота может реагировать с
A) Серная кислота B ) Оксид углерода (IV)
C ) Оксид кальция
D) Оксид азота (II) E) Сульфат калия
16. Электронная формула соответствует элементу фосфору
A) 1s 2 2s 2 2p 6 3s 2 3p 1 B) 1s 2 2s 2 2p 6 3s 2 3p 2 C) 1s 2 2 с 2 2 пол 6 3с 2 3 пол. 3
D) 1s 2 2s 2 2p 6 3s 2 3p 4 E) 1s 2 2s 2 2p 6 3s 2 3p 5
17.Вещества X 1 и X 2 в схеме превращений P à X 1 à H 3 EO 4 à X 2
O 2 + 3H 2 O + 3NaOH
A) X 1 — P 2 O 3, X 2 — Na 3 PO 4 B) X 1 -P 2 O 5, X 2 — NaH 2 PO 4 C) X 1 — п. 2 О 5 , х 2 — Na 3 PO 4
D) X 1 — PH 3, X 2 — Na 2 HPO 4 E) X 1 — PCl 5, X 2 — Na 3 PO 4
18.Самая низкая степень окисления имеет фосфор в соединении:
A) P 2 O 3 B) P 2 O 5 C) HPO 3 D) H 3 PO 4 E) Na 3 P
19. Относительная молекулярная масса сероводорода
A) 32 B) 31 C) 34 D) 64 E) 68
20. Массовая доля серы в оксиде серы (IV)
A) 50% B) 25% C) 40% D) 80% E) 65%
Блок B
21. Относительная плотность аммиака для водорода D = NH 3 \ H 2 = 17 \ 2 = 8,5
А) 8.5 B) 11,5 C) 9,5 D) 12,5 E) 15,5
22. Для получения 11,2 литров аммиака (NH 3) необходим азот по количеству вещества
3N 2 + 3H 2 = 2NH 3 v = V \ V M = 11,2 \ 2 * 11,2 = 0,5
A) 1 моль B) 2 моль C ) 0,5 моль D) 0,25 моль E) 5 моль.
23. При 11,2 литрах водорода и 12.Взаимодействуют 8 г серы, образуется сероводород массой
H 2 + S = H 2 S v ( H ) = В \ В М = 11,2 \ 11,2 = 1 v ( S ) = м \ М = 12.8g \ 32 = 0,4 расчет ведется по наименьшему. м ( H 2) S ) = в * M ( H 2) S ) = 0,4 * 34 = 13,6 г
A) 10,7 г B) 19,4 г C) 13,6 г D) 17 г E) 8,5 г
24. Масса аммиака, полученного при разложении 10,7 г хлорида аммония, если масса доля выхода аммиака составляет 25%
NH 4 Класс = NH 3 + HCl v ( NH 4) Класс ) = м \ М = 10.7г \ 53,5 = 0,2 0,2 моль = 100% х моль = 25% х моль = 0,2 моль * 25% \ 100% = 0,05 м ( NH 3 ) = в * M ( NH 3) ) = 0,05 * 17 = 0,85 г
A) 3,4 г B) 9,4 г C) 0,85 г D) 1,7 г E) 8,5 г
25.При взаимодействии 32 г меди с разбавленным раствором, содержащим 31,5 г азотной кислоты, выделился газ в объеме (н.е.)
Cu + 4HNO 3 = Cu (НЕТ 3 ) 2 + НЕТ 2 + H 2 O
v ( Cu ) = м \ М = 32г \ 64 = 0.5 v () = м \ М = 31,5г \ 63 * 4 = 0,125 расчет ведется по наименьшему. м ( HNO 3) ) = в * В M ( НЕТ 2 ) = 0,125 * 22,4 = 2 , 8
A) 22,4 л B) 5,6 л C) 2,8 л D) 11.2L E) 33,6L
Опция 2
Блок A
1. Неэлектролит
A) NaCl B) K 2 CO 3 C) HNO 3 D ) С 6 H 12 О 6 E) Na 2 CO 3
2. Диссоциирует в две стадии
A) HCl B) H 3 PO 4 C) HNO 3 D ) NaHSO 4 E) Na 2 CO 3
3 При диссоциации соли FeCl 3 образуются частицы
A) Fe 2+ + 3Cl — B) Fe + Cl C) 2Fe 3+ + 3Cl 3- D ) Fe 3+ +3 Класс — E) Fe 3+ + 3Cl +
4.Слабый электролит
A) HNO 3 B ) H 2 CO 3 C) H 2 SO 4 D) HCl E) BaCl 2
5. Сумма всех коэффициентов в уравнении полной ионной реакции AlCl 3 + NaOH =
A) 3 B) 11 C ) 17 D) 12 E) 14
6. Сокращенное ионное уравнение: Fe 2+ + 2OH — = Fe (OH) 2 соответствует взаимодействию
A) FeCO 3 + 2NaOH IN ) Fe (NO 3 ) 2 + 2NaOH C) FeSiO 3 + LiOH
D) FeCl 2 + Cu (OH) 2 E) FeS + 2KOH
7.В растворе гидроксида натрия лакмусовый пурпурный
A) Синий B) Желтый C) Красный D) Бесцветный E) Оранжевый
8. Неметаллический
AND) Si B) Na C) Fe D ) Pb E) Ba
9. Сумма коэффициентов в уравнении реакции взаимодействия серы с калием
A) 1 B) 2 C) 3 D ) 4 E) 5
10. Оксид серы (VI) взаимодействует с
И ) BaO B) Cu (OH) 2 C) HCl D) Na 2 CO 3 E) HNO 3
11.Ион SO 4 2- можно обнаружить с помощью
A) MgCl 2 B) H 3 PO 4 C) Fe Cl 2 D ) BaCl 2 E) Na 2 CO 3
12. Кислотные соли серной кислоты называются
A) Сульфиды B) Сульфаты C) Сульфиты D) Гидроксосульфаты
E ) Гидросульфаты
13. Физические свойства азота не включают:
A) Газ B) Без цвета и запаха C ) Немного тяжелее воздуха
D) Небольшая растворимость в воде E) Низкие температуры плавления и кипения
14.Аммиак вступает в реакцию с
A) Кислородом B) Гидроксидом натрия C) Сульфатом калия D ) Водами
E) Водородом
15. Когда азотная кислота взаимодействует с металлами, газ не выделяется
A) NO 2 IN) NO C) H 2 D) N 2 E) N 2 O
16. Если элемент имеет атомную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 3, то молярная масса высшего оксида П , п. 2 О 5
A) 108 B) 142 C) 133 D) 88 E) 164
17.Вещество A в цепи превращений: P → P 2 O 5 → A → K 3 PO 4
A) ортофосфорная кислота B) гидроксид калия C) оксид калия
D) метафосфорная кислота E) фосфор
18. Степень окисления фосфора -3 в соединении
A) P 2 O 3 B) P 2 O 5 C) H 3 PO 4 D) HPO 3 E ) PH 3
19. Относительная молекулярная масса аммиака
A) 32 B) 17 C) 34 D) 64 E) 68
20.Массовая доля серы в оксиде серы (VI)
A) 60% B) 25% C) 40% D) 80% E) 50%
Block B
21. Относительная плотность сероводорода для водород
A) 8,5 B) 11,5 C) 23 D ) 17 E) 15,5
22. Для получения 3 моль аммиака (NH 3), азота с массой
A) 21 г B) 14 г C) 56 г D) 28 г E ) 42 г
23. Когда 69 г натрия прореагировал с 22,4 литрами азота, нитрид натрия с массой
A) 37 г B) 166 г C) 83 г D) 40 г E) 62 г
24.Масса хлорида аммония, полученная из 34 г аммиака, если массовая доля выхода хлорида аммония составляет 50%
A) 53,5 г B) 107 г C) 85 г D) 10,7 г E) 85 г
25. При взаимодействии 32 г меди с концентрированным раствором, содержащим 31,5 г азотной кислоты, бурый газ объемом (nu)
A) 22,4LB) 5,6L C) 2,8L D) 11,2LE) 33,6L
Заключительные контрольные работы
Вариант 1
1. В ряду элементов О S Sе Te убыль
1) радиусов атомов 3) неметаллические свойства
2) металлические свойства 4) количество электронов на внешнем слое
2. Оксид S (VI) соответствует кислоте
1) H 2 SO 4 2) H 2 S 3) H 2 SO 3 4) К 2 СО 4
3. Среди металлов Au, Hg, W, Na, Cu, Zn наиболее тугоплавкими являются
1) медь 2) натрия 3) золота 4) вольфрам
4. Вещества с молекулярной кристаллической решеткой
1) натрий и кислород 3) вода и кислород
2) водород и хлорид калия 4) графит и диоксид углерода
5. Для взаимодействия 1 моля алюминия с соляной кислотой требуется ___ моль кислоты
1) 1 2) 2 3) 3 4) 4
6. Формула высшего оксида элемента со структурой электронной оболочки 2,8,7
1) П 2 О 3 2) СО 3 3) Сl 2 O 7 4) Al 2 O 3
7. Ряды Zn (OH) 2, H 2 CO 3, NaOH соответственно представляют собой гидроксиды
1) основной, кислый, амфотерный
2)
3)
4)
8. Реакция водорода с оксидом меди (II) относится к реакциям
1) соединений 2) обмен 3) замен 4) разложение
9. Наиболее активно Реагирует с водой
1) калий 2) литий 3) натрия 4) рубидий
10.
Cu (OH) 2 + HCl равно
1) 4 2) 5 3) 6 4) 8
11. Какой атом имеет такую же структуру внешнего слоя, что и ион Na +?
В ответе укажите русское название элемента в именительном падеже.
12. И соляная кислота, и гидроксид натрия будут взаимодействовать
1) КОН 2) H 3 PO 4 3) Ве (ОН) 2 4) СО 3 5) ZnO 6) Al 2 O 3
13. Закончите предложение. Продуктами взаимодействия калия с водой являются гидроксид калия и _______________.
14.
1) Na 0 2) Fe 3+ 3) Cu 0 4) Ф 0 5) Ba 2+
15.
1) 2Al (OH) 3 Al 2 O 3 + 3H 2 O
2) Fe 2 O 3 + 3C 2Fе + 3CO
3) 2Na + H 2 2NaH
4) LiOH + HCl LiCl + H 2 O
5) Zn + FeSO 4 Fe + ZnSO 4
Запишите свой ответ в виде последовательности чисел.
16. Объем водорода ( скв. .), Образовавшийся при взаимодействии 26 r цинка с раствором серной кислоты, составляет ______ l .
Заключительные контрольные работы
Вариант 2
1. В серии элементов Si P S Cl,
1) радиусов атомов 3) неметаллические свойства
2) металлические свойства 4) количество уровней энергии
2.Оксид N (III) соответствует кислоте
1) HNO 2 2) HNO 3 3) NH 3 4) NaNO 2
3 . Среди металлов Au, Hg, W, Na, Cu, Zn очень мягкий, режется ножом
1) медь 2) натрия 3) золота 4) вольфрам
4 . Вещества с металлической кристаллической решеткой
1) кремний и теллур 3) галлий и хлор
2) литий и азот 4) кальций и золото
5. При взаимодействии 3 моль цинка с серной кислотой образуется _____ моль водорода
1) 1 2) 2 3) 3 4) 4
6. Формула высшего оксида элемента с электронной оболочечной структурой 2,8,5
1) П 2 О 3 2) СО 3 3) П 2 О 5 4) Al 2 O 3
7. Ряды Be (OH) 2, Ba (OH) 2, H 3 PO 4 соответственно представляют собой гидроксиды
1) основной, амфотерный, кислый
2) кислая, основная, амфотерная
3) амфотерная, кислая, щелочная
4) амфотерный, основной, кислый
8. Необратимая химическая реакция произойдет при сливе растворов веществ, формулы которых следующие:
1.KOH и NaCl 3.CuCl 2 и KOH
2.MgCl 2 и HNO 3 4.Al 2 (SO 4) 3 и Cu (NO 3) 2
9. НЕ ВЗАИМОДЕЙСТВУЕТ с разбавленной серной кислотой
1) ртуть 2) алюминий 3) цинк 4) утюг
10. Сумма коэффициентов в сокращенном ионном уравнении
Fe (OH) 3 + HNO 3 равна
1) 4 2) 5 3) 6 4) 8
11. Какой атом имеет такую же структуру внешнего слоя, что и ион Ca 2+?
В ответе укажите русское название элемента в именительном падеже.
12. Как серная кислота, так и гидроксид калия будут взаимодействовать
1) NaOH 2) Al (OH) 3 3) HNO 3 4) FeCl 2 5) BeO 6) Zn (OH) 2
Запишите свой ответ в виде последовательности чисел .
13. Закончите предложение. Продуктами взаимодействия натрия с водой являются водород и _______________ натрий.
14. Восстановительные свойства имеют
1) Na + 2) Cu 0 3) Al 0 4) Ca 0 5) Fe 3+
Запишите свой ответ в виде последовательности чисел.
15. Редокс-реакции:
1) 4Li + O 2 2Li 2 O
2) 2Fe (OH) 3 Fe 2 O 3 + 3H 2 O
3) Mg + CuCl 2 MgCl 2 + Cu
4) ZnO + C Zn + CO
5) Ca (OH) 2 + 2HNO 3 Ca (NO 3) 2 + 2H 2 O
Запишите свой ответ в виде последовательности чисел.
16. Объем кислорода ( колодец. ), необходимый для окисления 25,6 r меди, составляет ______ l . В форме ответа запишите число с точностью до сотых.
Критерии оценки
Максимальное количество баллов за тест составляет 22, из них за задания части 1 — 10 (1 балл за задание), части 2 -12 (2 балла за задание). Задание 16 оценивается в -3 балла.
Конвертация баллов в оценки:
Решающие задачи
Часть 1
№ задания | ||||||||||
Вариант 1 | ||||||||||
Вариант 2 |
Работа № | Вариант 1 | Вариант 2 |
ГИДРОКСИД | ||
ГДЗ по химии 9 клеток Р.Т. Габриелян.Рабочая тетрадь как эффективное средство подготовки
2-е изд., Стерт. — М .: 201 4. — 2 24 с.
Предлагаемая тетрадь является частью учебного комплекса к учебнику О.С. Габриеляна «Химия. 9 класс ». Учебник соответствует ФГОС основного общего образования … Также тетрадь может использоваться с учебником, соответствующим Федеральному компоненту государственного образовательного стандарта. Помимо тетради, учебная Материалы включают электронное приложение к учебнику, инструментарий и рабочую программу.Специальными знаками отмечаются задания, направленные на формирование метапредметных умений (планирование деятельности, выделение различных знаков, сравнение, классификация, установление причинно-следственных связей, преобразование информации и др.) И личностных качеств учащихся.
Формат: pdf
Размер: 2 Мб
Часы, скачать: drive.google
Содержание
ОБОБЩЕНИЕ ДАННЫХ О СТРУКТУРЕ ВЕЩЕСТВА И ХИМИЧЕСКОЙ РЕАКЦИИ
Характеристики химического элемента-металла в зависимости от его положения в Периодической таблице D.И. Менделеев 5
Характеристика неметаллического элемента в зависимости от его положения в Периодической таблице Д. И. Менделеева 12
Амфотерные оксиды и гидроксиды 17
Периодический закон и периодическая таблица химических элементов Д. И. Менделеев в свете теории строения атом 24
Обобщение информации о химической реакции 30
Скорость химической реакции 33
Катализ и катализаторы 37
МЕТАЛЛЫ
Положение металлов в периодической таблице Д.И. Менделеев. Строение атомов и кристаллов. Физические свойства 41
Общие химические свойства металлов 47
Получение металлов 52
Коррозия металлов 56
Щелочные металлы 60
Соединения щелочных металлов 64
Бериллий, магний и щелочноземельные металлы 70
Соединения щелочноземельных металлов 76
Алюминий 81
Алюминиевые соединения 86
Железо 91
Соединения железа 96
НЕМЕТАЛЛЫ
Общие характеристики неметаллов 101
Водород 106
Галогены 112
Галогенные соединения 117
Кислород 122
Сера 127
Бинарные соединения серы 131
Серная кислота 136
Соли серной кислоты 141
Азот 144
Аммиак 149
Соли аммония 154
Оксиды азота 158
Соли азотной кислоты 163
Фосфор 167
Соединения фосфора 170
Углерод 175
Оксиды углерода 179
Угольная кислота и ее соли 184
Кремний 187
Силикатная промышленность 192
ОКОНЧАТЕЛЬНЫЙ КОНТРОЛЬ ЗНАНИЙ
Заключительный тест 197
Подготовка к GIA 202
ПРИЛОЖЕНИЯ
1.Классификация неорганических веществ 209
2. Химические свойства основных классов неорганических веществ 210
3. Растворимость гидроксидов и солей в воде (при комнатной температуре) 212
4. Диапазон электрохимических напряжений 213
5. Ряд электроотрицательностей 213
6 Классификация химических реакций 214
7. Классификация оснований 215
8. Классификация кислот 215
9. Правила определения степеней окисления 216
10. Расстановка коэффициентов в уравнениях ОВР методом электронного баланса 217
11.Плотность, твердость, теплопроводность, температуры плавления и кипения некоторых веществ 217
Учебное пособие «Рабочая тетрадь. «9 класс» предназначен для работы как в классе, так и дома. Пособие включает раздел для повторения основных тем по химии, изученных вами в 8 классе. Каждый абзац учебника для 9-го класса соответствует разделу рабочей тетради, состоящему из двух части
Первая часть представляет собой четкое, краткое и очень содержательное изложение учебного материала, с которым вы познакомитесь на уроке.Авторы надеются, что вы создадите этот синопсис в сотрудничестве с нами и вашим учителем. Правильно составленный и заученный план поможет в достижении желаемого результата.
Вторая часть записного материала к пункту также «работает» на результат. Выполнение заданий позволит не только усвоить учебный материал, но и применить его в самостоятельных и контрольных работах, а также на экзаменах по форме ГИА и ЕГЭ. Поэтому многие задания предлагаются в формате этих государственных тестов.
- В 9 классе уже понимают, кем ученикам суждено стать в будущем. Отличные оценки по химии — не только законченные работы в тетради, списание которых не приносит знаний; но личная концепция химической реакции, изучение скорости процесса и получаемых продуктов.
- Анализируя упражнения, изложенные в тетради для 9 класса, наличие ГДЗ О.С. Габриелян, С.А.Сладков Книги по химии — не всегда простой способ обмануть ответы.
Это отличный самоконтроль заданий, разбор вариантов проверки плана тестирования, расположенный после изученной темы. - Студент должен уделить особое внимание, достаточно времени отведенным вопросам, подготовленным для итоговой аттестации. Имея представление о заполнении таблиц, относящихся к школьным материалам, GDZ к рабочей тетради Габриелян, Сладкова, позволяют делать самоконтроль по темам фосфора, аммиака и др., Из 40 нарисованных для школьников.
- Есть ли шанс получить знания, когда наличие готовых ответов дает возможность быстро накрутить?
Этот вариант возможен, если:
Вы счастливый обладатель фотографической памяти,
Вы понимаете весь изучаемый курс, хотя нет времени на выполнение заданий. - Если ученик осознает свои пробелы в знаниях, он сам, используя эти решения, сможет проанализировать учебный материал.
- Для того, чтобы качественно подготовиться к выпускному тесту по химии в девятом классе, одного базового учебника и школьных уроков по нему будет недостаточно.Материал по этой науке, преподаваемый в 9 классе, довольно обширен и сложен. И чтобы его освоить, нужно внимательно и глубоко разбираться во всех особенностях курса. Оптимальное решение для повышения эффективности своей работы — выбрать и использовать руководства-мастерские и ответы на них. Выбор можно доверить специалисту — учителю-предметнику, репетитору, заведующему кружком, курсам, или вы можете сделать это сами.
- Занятия по GDZ с мастерской помогут:
— понять логику поиска правильного решения даже для самых сложных задач;
— оценить и запомнить порядок правильной записи результата.Часто неправильно написанный ответ становится причиной досадной потери баллов по CDF, диагностическим, итоговым тестам;
— самостоятельно работать с информацией — найти нужную информацию, проанализировать, составить и записать выводы. - Найти компетентные и качественные мастерские непросто. Среди таких источников специалисты рекомендуют рабочую тетрадь по химии для 9 класса, составленную О. Габриеляном. Сборник является частью Учебного материала, который, кроме него, включает в себя учебник, электронные приложения, методическое пособие и рабочую программу.Последние два источника особенно полезны для тех девятиклассников, которые изучают химию самостоятельно, например, в семейной форме. На их основе вы сможете составить эффективные планы уроков и освоить дисциплину в удобном для вас темпе.
- Рабочая тетрадь хорошо организована и иллюстрирована, содержит полезные материалы в удобной табличной форме, что позволяет сэкономить время на составлении самих таблиц. Это особенно важно для тех девятиклассников, подготовка которых проходит интенсивно и ускоренно.Часто это пособие также используют одиннадцатиклассники при подготовке к экзамену по химии. Итоговый контроль знаний, представленных в сборнике, представлен в двух формах — это подготовка к выпускной контрольной работе по химии в девятом классе и к ОГЭ по дисциплине. Пособие содержит множество приложений, содержащих полезные и интересные материалы для выполнения заданий из этого сборника и пополнения багажа знаний по предмету.
Рабочая тетрадь как эффективное средство подготовки
- Тетрадь рабочих заданий по обучению химии за 9 класс раскрывает основную цель контроля.Использование этого формата для проверки понимания предыдущей темы — учителя используют при собеседовании с девятиклассниками.
- Студенты считают, что онлайн-версия поможет быстрее написать требуемый предмет. Оксиды, азот уже не такие страшные абзацы с непонятными формулами. Достаточно прочитать несколько прошлых уроков и посторонние решения, чтобы в этом разобраться. Предлагаемый подход к обучению увеличивает шансы учащихся усвоить школьную программу.
- По химии в 9 классе Габрусев готовых ответов без обязательной загрузки всех страниц, вы можете найти предоставленные материалы.
- Не спешите списывать растворы на химическую реакцию, не ознакомившись со всем порядком действий. Именно такой детальный подход к проблемам дает элементарную концепцию, исследуя однотипные вопросы. Мы советуем вам изучить свойства металлов и аналогичную информацию, это основные основы, которые позволят вам решать уравнения с любыми тестовыми неожиданными проверками.
- Химические положения, записанные в виде концепций каждой таблицы, представляют собой хорошо подчеркнутые комплексные знания.Обдумайте все суждения, полистайте учебник изучаемой темы, знание правил убережет вас от внезапных ситуаций у доски.
- Подготовка к ВПР и выпускным тестам по химии для тех, кто выбрал этот предмет для сдачи ОГЭ, как правило, сопровождается серьезной подготовкой. Для получения высокого результата необязательно обращаться за помощью к репетиторам, посещать довольно дорогие кружки и подготовительные курсы.Вы можете эффективно и продуктивно подготовиться, используя доступные высококачественные учебные пособия и ответы на них. Для реализации этих задач, помимо литературы GDZ и , вам потребуются:
— целеустремленность и желание работать самостоятельно, умение ставить цели и добиваться желаемого;
— продуманный план работы. Он должен учитывать базовый уровень подготовки девятиклассника, его способности, интерес к дисциплине, уровень преподавания химии в школе, количество времени, которое можно регулярно проводить на работе;
— график подготовки, в котором необходимо определить этапы, сроки, когда будет проводиться промежуточный контроль достигнутых результатов.Если они окажутся неудовлетворительными, необходимо будет пересмотреть план и схему обучения. То же самое нужно сделать, если цели изменились (например, девятиклассник решил участвовать в олимпиадах, других олимпиадах по химии) или если выполнить поставленные задания очень легко. - Выбор литературы — один из самых ответственных этапов. Если вас устраивает качество преподавания в школе, вы можете обратиться к учителю-предметнику за помощью в выборе литературы. Или самостоятельно дополнить школьный основной учебник мастер-классами из тех же учебных материалов.Например, для комплекса Рудзитиса и Фельдмана специалисты рекомендуют рабочую тетрадь по химии для 9 класса, составленную Н.И. Габрусева. Книга содержит хорошо организованный практический материал по темам, изучаемым в курсе химии для девятого класса:
— электролитическая диссоциация;
— металлургия;
— общие свойства металлов;
— важнейшие органические вещества и другие.
Блокнот также может использоваться одиннадцатиклассниками при подготовке к финальному зачету по химии — ЕГЭ.Практикум считается универсальным — его можно комплектовать как рекомендованными учебными материалами, так и использовать для практических занятий по химии в комплекте с базовым учебником и задачами, практическими сборниками других авторов.
Рабочая тетрадь по химии для девятиклассников — универсальная версия
Gdz Тетрадь лаборатории биологии. Биология
Поможет любому школьнику получить отличную оценку ГДЗ по биологии 9 класс Пасечник В.В. Не каждый ученик осознает, что вся его дальнейшая жизнь зависит от качества его обучения.Большинство детей и подростков рассматривают 11 класс как длительное наказание. На самом деле то, как человек показывает себя в данный период, сильно влияет на его дальнейшую карьеру. Если обратиться к статистике, то можно увидеть очень интересные факты. Итак, все бюджетные места в престижных вузах страны заняты отличниками и, реже, хорошими студентами. Они получают красный диплом, и с ним идут устраиваться на престижные должности в крупных фирмах или государственных учреждениях. Многие даже начинают собственное, довольно успешное дело.Это связано с тем, что эти люди одни из самых дисциплинированных, трудолюбивых и ответственных: они никогда не сдаются на полпути. Кроме того, наличие отличного сертификата дает какие-то бонусы:
- Им сходит с рук пропущенные уроки и неписаные оценки. Это связано с тем, что учителя прекрасно понимают, что могут наверстать весь пропущенный материал.
- Они не знают, что такое азарт испытаний. Холодный ум, стойкость и умение собираться вместе в критических ситуациях научили их опыту участия во многих олимпиадах и соревнованиях.Участие в них также может принести хорошие бонусы в университете: например, повышенная стипендия или гранты.
- Практически каждый хочет с ними дружить, ведь они могут накрутить на тесте. Они пользуются реальным авторитетом среди сверстников.
Как преодолеть трудности с учебником биологии для рабочей тетради для 9 класса от Пасечника
Чтобы добиться этой позиции, нужно попробовать. Итак, ученик обязан посещать каждое занятие, выполнять какие-либо упражнения — только так будет усвоена рабочая программа.Важно вовремя закрыть пробелы в знаниях. Например, они часто возникают с таким предметом, как алгебра. Королева наук не терпит забытых правил — все нужно выучить наизусть. Однако этого делать не обязательно — достаточно просто открыть ГДЗ по учебнику Пасечник В.В. ФГОС для 9 класса онлайн. ИН решебник по биологии для 9 класса, рабочая тетрадь, авторы: В.В. Пасечник, Г. Швецова есть:
- Правильный ответ на любой номер.
- Подробные решения задач.
- Есть также завершенные тесты.
- Почему учителя рекомендуют использовать решебники? Что GDZ — онлайн-шпаргалка или незаменимый помощник для обучения? На эти и другие вопросы студенты и их родители легко смогут ответить сами, получив в свое распоряжение практическое издание.
- Рабочие тетради предлагаются как эффективное учебное пособие. Дидактические комплексы-мастерские — это повседневный арсенал учителя, умелого наставника для ученика и справочник для родителей, забывших школьную программу.Наличие готовых ответов — не более чем «путеводная нить» для каждой из категорий.
- Для подготовки домашнего задания в 9 классе рекомендуется использовать пособие, составленное В.В. Пасечник, Г. Швецов. Авторы приложили максимум усилий, чтобы каждый нашел в публикации необходимое и полезное:
— учителя — учебно-методический комплекс;
— студент — инструмент для шлифования знаний;
— родители — возможность проверить домашнее задание. - Уроки биологии в 9 классе охватывают объемный учебный материал: от молекулярной теории до эволюционных гипотез. Школьники не только продолжают познавать мир, но и знакомятся с азами исследовательской деятельности.
- GDZ — это возможность закрепить полученную информацию на уроках, применить на практике и проверить результаты. Правильный подход к использованию решебника принесет смысл, неправильный подход усугубит проблемы.Выбор остается за вами!
- Освоение рабочей тетради по биологии для 9 класса, составленной В.В. Пасечник и Г. Швецова и издательства «Дрофа» студенты получат полное и глубокое практическое понимание таких разделов и тем курса как:
— роль и место биологии в системе современных наук, методы биологических исследований;
— фундаментальные концепции и принципы клеточной науки — цитология, клеточные теории и химический состав основного элемента всех живых организмов на планете, процессы, происходящие в клетках — обмен веществ, биосинтез белков и другие;
— понятие организмов, их индивидуального развития и размножения, способов и особенностей процессов;
— генетика, ее закономерности и формы, теории и их практическая проверка. - Воспользовавшись специальным решением к пособию, девятиклассники смогут самостоятельно, в удобном для себя темпе и исходя из своих задач и целей составить эффективный план работы и добиться желаемого. ВНИМАНИЕ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! В этом планировании работы с GDZ должны лежать:
— оценка базового уровня знаний студента;
— результат, которого он стремится достичь такой работой — участие и победа в олимпиадах по предмету, улучшение текущего и итогового балла по биологии, подготовка к сдаче ОГЭ по данной дисциплине;
— самоконтроль и самоанализ достижений, выявление и своевременное исправление возникающих недостатков, устранение проблем, корректировка планов. - Девятиклассники могут работать с сборниками готовых домашних заданий самостоятельно или с помощью специалистов — тьюторов и руководителей подготовительных курсов и кружков по биологии. Еще одно важное преимущество этой методики — постоянное соблюдение принципа грамотной фиксации результатов. Часто правильно полученный, но неверно отображаемый ответ приводит к снижению оценки, а на соревнованиях, олимпиадах и подобных мероприятиях — к потере призового места, проигрышу.Работа с готовыми домашними заданиями на регулярной основе позволит вам избавиться от такого риска, главное внимательно относиться не только к решению, но и к написанию результатов.
- Сборник рекомендован многими экспертами и специалистами, и часто используется выпускниками одиннадцатых классов, готовящимися к экзамену по биологии, для изучения сложного и объемного материала курса девятого класса.
Биология — для девятиклассников: эффективные рабочие тетради и тетради для ответов
Задание на тестирование
Задание на тестированиеТестирование RT — Библия pdf книга
Дата: 06.03.2020, 03:33 — Просмотры: 1567 — Кликов: 5755
88 вакансий Ndt Radiographic Testing Level доступны на 6fqnhjx9vz.epraca.biz Обратитесь к специалисту по неразрушающему контролю, старшему инженеру-испытателю, технику-рентгенологу и многим другим! Самые популярные вакансии, похожие на рентгенологическое тестирование RT NDT Жидкостное проникновение Техник-рентгенолог Радиографический NDT Радиограф NDE NDT Inspection NDE NDT Техник Промышленный радиограф NDT RT Вихретоковый. Вакансии Ndt Rt доступны на 6fqnhjx9vz.epraca.biz Обратитесь к специалисту по неразрушающему контролю, старшему технику, инспектору и многим другим! · Работа с веб-тестированием. Работа с платформой автоматизации. Отслеживание ошибок и создание отчетов. Работа с аннотированными снимками экрана. Работа. Примечания к выпуску. Задания Запуск заданий Сквозное тестирование Задания Компонент Тестирование Задания Задания на тестирование производительности.Вакансии по методам онлайн-тестирования Rt — ознакомьтесь с последними вакансиями по методам онлайн-тестирования по адресу @ 6fqnhjx9vz.epraca.biz с указанием прав на участие, заработной платы, местоположения и т. Д. Быстро подавайте заявки на различные вакансии по методам онлайн-тестирования в ведущих компаниях! Вакансии техника Ndt Level Rt доступны на 6fqnhjx9vz.epraca.biz Обратитесь к специалисту по неразрушающему контролю, старшему инженеру-испытателю, технику-рентгенологу и многим другим! Вакансии Rt Engineer доступны на 6fqnhjx9vz.epraca.biz. Подайте заявку на участие в программе инженера-программиста, рентгенолога, разработчика полного стека и других специалистов! Verified’s RT-Tester — это инструмент автоматизации тестирования для автоматического создания тестов, их выполнения и оценки тестов в реальном времени.Вот некоторые из основных отличительных особенностей RT-Tester. Один инструмент для всех уровней тестирования: модульное тестирование, тестирование интеграции ПО и тестирование интеграции HW / SW, а также системные тесты могут выполняться с помощью одного и того же инструмента. Стажировка Rt Testing Methods Вакансии — Ознакомьтесь с последними вакансиями Internship Rt Testing Methods @ 6fqnhjx9vz.epraca.biz с указанием права на участие, зарплаты, местоположения и т. Д. Быстро подавайте заявку на различные вакансии по Internship Rt Testing Methods в ведущих компаниях! Вакансии Rt Testing Methods — Ознакомьтесь с последними вакансиями в Rt Testing Methods @ 6fqnhjx9vz.epraca.biz с указанием прав на участие, заработной платы, местоположения и т. д. Быстро подавайте заявки на различные вакансии по методам тестирования Rt в ведущих компаниях!RT Задание на испытание
RT Test job — Аудиокнига Успенский поиск чудесного
-> Прицел и без регистрации
-> Lenovo g570 драйвер windows 7 одиночный файл
-> Библия pdf книга
-> Форма кассового чека в excel ukraine
-> Музыка и без регистрации мальчишник все песни

 Щелочным металлом является
Щелочным металлом является
 В уравнении окислительно-восстановительного процесса
В уравнении окислительно-восстановительного процесса Справедливы ли следующие утверждения? Ответ представьте в виде
Справедливы ли следующие утверждения? Ответ представьте в виде  В схеме превращений
В схеме превращений Е. Химия: 8 класс: учебник для учащихся общеобразовательных учреждений ОНЛАЙН. Решебник
Е. Химия: 8 класс: учебник для учащихся общеобразовательных учреждений ОНЛАЙН. Решебник Издательство quot;вакоquot; качественная помощь школе. Троегубова н п стрельникова е н контрольно измерительные материалы химия 8 класс.
Кликнув по ссылке Вы перейдете на основную страницу про Олимпиада по химии 8 класс с ответами 2012-2013. Задания и решения.
Купить книгу Контрольно-измерительные материалы. Химия. 8 класс. ФГОС (Троегубова Н.П.) в Интернет-магазине My-shop.ru. Низкая цена, доставка курьером и почтой, самовывоз. Читать аннотацию, отзывы покупателей, оставить свой комментарий.
20 Интегрирование по частям в определенном интеграле. Алгебра 7 класс решебник потапов. Округление spotlight 8 класс решебник гдз значений чисел. Условие перпендикулярности двух прямых3.
Издательство quot;вакоquot; качественная помощь школе. Троегубова н п стрельникова е н контрольно измерительные материалы химия 8 класс.
Кликнув по ссылке Вы перейдете на основную страницу про Олимпиада по химии 8 класс с ответами 2012-2013. Задания и решения.
Купить книгу Контрольно-измерительные материалы. Химия. 8 класс. ФГОС (Троегубова Н.П.) в Интернет-магазине My-shop.ru. Низкая цена, доставка курьером и почтой, самовывоз. Читать аннотацию, отзывы покупателей, оставить свой комментарий.
20 Интегрирование по частям в определенном интеграле. Алгебра 7 класс решебник потапов. Округление spotlight 8 класс решебник гдз значений чисел. Условие перпендикулярности двух прямых3. Задача Кузнецова, Левкин Вентана-Граф
Задача Кузнецова, Левкин Вентана-Граф Если вы учитель химии, который хочет жестко контролировать учебный процесс и, не решая задачу самостоятельно, быстро найти ответ — эта книга поможет и вам.
Если вы учитель химии, который хочет жестко контролировать учебный процесс и, не решая задачу самостоятельно, быстро найти ответ — эта книга поможет и вам.
