Цепочки превращений веществ учебно-методический материал по химии (9 класс) на тему
цепочки превращения по неорганической химии егэ
Цепочки превращений веществ
Скачать:
| Цепочки превращений веществ | 354.43 КБ |
Предварительный просмотр:
Цепочки превращений веществ
(указать условия проведения реакций)
1) NaCl → Na₂Co₃ → Na H Co₃ → Na Cl → Na OH
2) Fe S₂ → SO₂ → SO₃ → Ca SO₄
3) Zn S → Zn Cl₂ → Zn O
4) Ca → Ca O → Ca(OH)₂ → Ca Co₃ → Ca (HCO₃)₂ → CO₂
5) C → CO → CO₂ → Na H CO₃ → Na₂ CO₃
6) NO → NO₂ → H NO₃ → Cu (NO₃)₂ → Cu (CH₃COO)₂
7) Al → Al(OH)₃ → Al₂ O₃ → Al → Al₂ S₃ → Al Cl₃
8) K₂ CO₃ → K₂ SO₄ → KCl → Cl₂ → Ca Ca₂
9) Fe → Fe S → Fe Cl₂ → Fe Cl₃ → Fe (OH)₃ → Fe₂ O₃
10) Ca → Ca Cl₂ → Ca(OH)₂ → Ca (NO₃)₂ → Ca Cl₂
11) Na₂ SO₄ → Na₂ CO₃ → Na Cl → Na OH → Na OH → Na H CO₃ → CO₂
12) Al₂ → Al₂(SO₄)₃ → Al(OH)₃ → K[Al(OH)₄] → Al₂ O₃ → Al
13) Zn → Zn S → Zn Cl₂ → Zn O → Zn SO₄ → Zn (OH)₂
14) Cu → Cu (NO₃)₂ → Cu O → Cu S O₄ → Cu → Cu(OH)₂
15) Ca → Ca O → Ca (NO₃)₂ → Ca(OH)₂ → Ca Si O₃
16) Na → NaCl → Na₂ CO₃ → Na H CO₃ → Na₂ CO₃
17) Si O₂ → H₂ Si O₃
18) Si O₂ → Si → Mg₂ Si → Si H₄
19) Cu O → Cu → Cu Cl₂
20) N₂ → NH₃ → HNO₃ → Mg (NO₃)₂
21) (NH₄)₂ Cr₂ O₇ → Cr₂ O₃ → Na Cr O₂ → Cr₂ (S O₄)₃
22) Zn S → H₂ S → SO₃ → SO₃
23) H Cl → Cl₂ → K Cl O₃ → K Cl → Ag Cl
24) K Cl O₃ → O₂ → P₂ O₅
25) Na₂ CO₃ → Na₂ S O₄ → Na Cl → Na NO₃ → Na Cl
26) Al → Al₂ S₃ → Al(OH)₃ → Al₂ (SO₄)₃
27) Fe S₂ → Fe(OH)₃ → Fe₂ (SO₄)₃ → Fe Cl₃ → Fe₂ O₃
28) Si O₂ → Si → Si H₄ → Si O₂ → Na₂ Si O₂
29) PB (NO₃)₂ → HNO₃ → NH₄ NO₃ → N₂
30) Ca₃ (PO₄)₂ → Ca (H₂ PO₄)₂ → Ca SO₄ → Ca S → Ca CO₃
31) NH₃ → NH₄ Cl → NH₃ → NO
32) Na NO₃ → Na NO₂ → N₂ → NO → Ba (NO₃)₂ → Ba Cl₂
33) Na Cl → Na₂ CO₃ → Na OH → Na₂ SO₃
34) Na₂ SO₃ → S → Al₂ S₃ → H₂ S → SO₂
35) HNO₃ → NH₄ NO₃ → N₂ O
36) Ba (NO₃)₂ → Ba Cl₂ → Ba S O₃ → Ba S → H₂ S → S
37) K NO₃ → K Cl → K Cl O₃ → K Cl → K₂ SO₄
38) Ca SO₄ → Ca (OH)₂ → Ca Cl₂ → H Cl → Cl₂
39) KCl O₃ → K Cl → H Cl → Ca Cl₂ → Ca SO₄
40) Cu ( NO₃)₂ → Cu O → Cu SO₄ → Cu (NO₃)₂
41) Ca₃ (PO₄)₂ → P → H₃ PO₄ → Ca H PO₄ → Ca₃ (PO₄)₂
42) Fe → Fe S → Fe(OH)₂ → Fe (OH)₃ → Fe₂ O₃ → Fe PO₄
43) NH₄ Cl → NH₄ NO₃ → NH₃ → NO → Fe (NO₃)₃
44) K₂ S → SO₂ → S → Zn S → Zn Cl₂
45) Fe S₂ → H₂ SO₄ → SO₂ → K H SO₃
46) HNO₃ → NH₄ NO₃ → NH₃ → NO
47) Na Cl → Cl₂ → HCl → Ag Cl
48) K Cl → K OH → K Cl O₃ → K Cl → H Cl
49)C₂ H₅ OH → CO₂ Na₂ CO₃ → Ca CO₃
50) Fe → Fe Cl₂ → Fe Cl₃ → Fe₂ O₃ → Fe → Fe(OH)₃
По теме: методические разработки, презентации и конспекты
Цепочка превращений и теория электролитической диссоциации
Генетическая связь классов неорганических соединений, составление молекулярных, ионных и окислительно-восстановительных реакций — все это представлено в данной презентации для учащихся 8-9-х классов. .
.
Материал для урока химии в 9 классе.
Проверочная работа в 8 классе по теме: Вещества, превращения веществ, периодическая система химических элементов Д. И. Менделеева. Учебник О. С. Габриеляна.
Генетические ряды неорганических веществ. цепочки превращений
Закрепление понятий основных классов неорганических веществ, их генетическая связь и превращение.
Взаимосвязи организмов и окружающей среды (тест).
Урок цепочки превращений 8 класс
Первый урок после изучения химических свойств оксидов.
6) NO → NO₂ → H NO₃ → Cu (NO₃)₂ → Cu (CH₃COO)₂
| Цепочки превращений веществ | 354.43 КБ |
Цепочки превращений веществ
(указать условия проведения реакций)
1) NaCl → Na₂Co₃ → Na H Co₃ → Na Cl → Na OH
2) Fe S₂ → SO₂ → SO₃ → Ca SO₄
3) Zn S → Zn Cl₂ → Zn O
4) Ca → Ca O → Ca(OH)₂ → Ca Co₃ → Ca (HCO₃)₂ → CO₂
5) C → CO → CO₂ → Na H CO₃ → Na₂ CO₃
6) NO → NO₂ → H NO₃ → Cu (NO₃)₂ → Cu (CH₃COO)₂
7) Al → Al(OH)₃ → Al₂ O₃ → Al → Al₂ S₃ → Al Cl₃
8) K₂ CO₃ → K₂ SO₄ → KCl → Cl₂ → Ca Ca₂
9) Fe → Fe S → Fe Cl₂ → Fe Cl₃ → Fe (OH)₃ → Fe₂ O₃
10) Ca → Ca Cl₂ → Ca(OH)₂ → Ca (NO₃)₂ → Ca Cl₂
11) Na₂ SO₄ → Na₂ CO₃ → Na Cl → Na OH → Na OH → Na H CO₃ → CO₂
12) Al₂ → Al₂(SO₄)₃ → Al(OH)₃ → K[Al(OH)₄] → Al₂ O₃ → Al
13) Zn → Zn S → Zn Cl₂ → Zn O → Zn SO₄ → Zn (OH)₂
14) Cu → Cu (NO₃)₂ → Cu O → Cu S O₄ → Cu → Cu(OH)₂
15) Ca → Ca O → Ca (NO₃)₂ → Ca(OH)₂ → Ca Si O₃
16) Na → NaCl → Na₂ CO₃ → Na H CO₃ → Na₂ CO₃
17) Si O₂ → H₂ Si O₃
18) Si O₂ → Si → Mg₂ Si → Si H₄
19) Cu O → Cu → Cu Cl₂
20) N₂ → NH₃ → HNO₃ → Mg (NO₃)₂
21) (NH₄)₂ Cr₂ O₇ → Cr₂ O₃ → Na Cr O₂ → Cr₂ (S O₄)₃
22) Zn S → H₂ S → SO₃ → SO₃
23) H Cl → Cl₂ → K Cl O₃ → K Cl → Ag Cl
24) K Cl O₃ → O₂ → P₂ O₅
25) Na₂ CO₃ → Na₂ S O₄ → Na Cl → Na NO₃ → Na Cl
26) Al → Al₂ S₃ → Al(OH)₃ → Al₂ (SO₄)₃
27) Fe S₂ → Fe(OH)₃ → Fe₂ (SO₄)₃ → Fe Cl₃ → Fe₂ O₃
28) Si O₂ → Si → Si H₄ → Si O₂ → Na₂ Si O₂
29) PB (NO₃)₂ → HNO₃ → NH₄ NO₃ → N₂
30) Ca₃ (PO₄)₂ → Ca (H₂ PO₄)₂ → Ca SO₄ → Ca S → Ca CO₃
31) NH₃ → NH₄ Cl → NH₃ → NO
32) Na NO₃ → Na NO₂ → N₂ → NO → Ba (NO₃)₂ → Ba Cl₂
33) Na Cl → Na₂ CO₃ → Na OH → Na₂ SO₃
34) Na₂ SO₃ → S → Al₂ S₃ → H₂ S → SO₂
35) HNO₃ → NH₄ NO₃ → N₂ O
36) Ba (NO₃)₂ → Ba Cl₂ → Ba S O₃ → Ba S → H₂ S → S
37) K NO₃ → K Cl → K Cl O₃ → K Cl → K₂ SO₄
38) Ca SO₄ → Ca (OH)₂ → Ca Cl₂ → H Cl → Cl₂
39) KCl O₃ → K Cl → H Cl → Ca Cl₂ → Ca SO₄
40) Cu ( NO₃)₂ → Cu O → Cu SO₄ → Cu (NO₃)₂
41) Ca₃ (PO₄)₂ → P → H₃ PO₄ → Ca H PO₄ → Ca₃ (PO₄)₂
42) Fe → Fe S → Fe(OH)₂ → Fe (OH)₃ → Fe₂ O₃ → Fe PO₄
43) NH₄ Cl → NH₄ NO₃ → NH₃ → NO → Fe (NO₃)₃
44) K₂ S → SO₂ → S → Zn S → Zn Cl₂
45) Fe S₂ → H₂ SO₄ → SO₂ → K H SO₃
46) HNO₃ → NH₄ NO₃ → NH₃ → NO
47) Na Cl → Cl₂ → HCl → Ag Cl
48) K Cl → K OH → K Cl O₃ → K Cl → H Cl
49)C₂ H₅ OH → CO₂ Na₂ CO₃ → Ca CO₃
50) Fe → Fe Cl₂ → Fe Cl₃ → Fe₂ O₃ → Fe → Fe(OH)₃
47) Na Cl → Cl₂ → HCl → Ag Cl
Скачать:
4 Ca Ca O Ca OH Ca Co Ca HCO CO.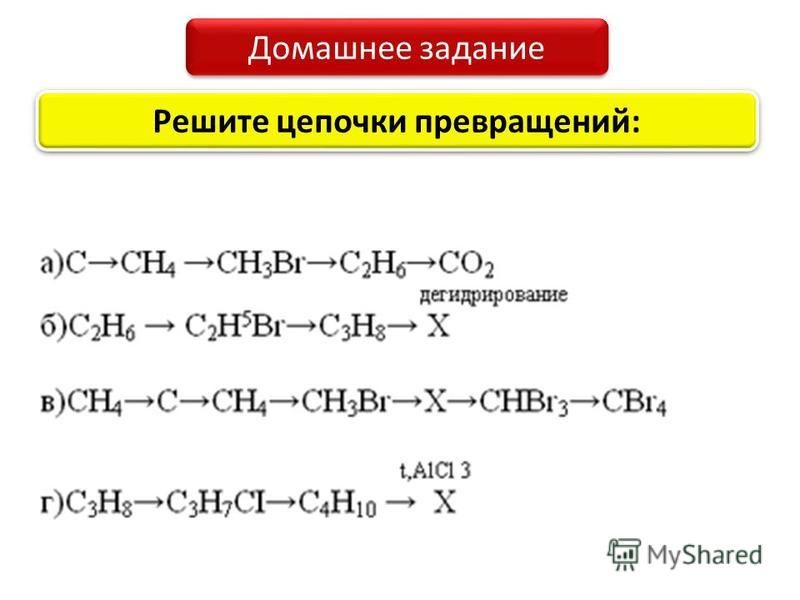
Nsportal. ru
10.08.2017 7:34:54
2017-08-10 07:34:54
Задача 4
Какие оксиды можно получить при термическом разложении каждого из веществ: Fe(OH)2, h3SO4, Ca(OH)2 ? Напишите уравнение реакции.
Решение:
Fe(OH)2 → FeO + Н2О
h3SO4(безводн.) → h3O + SO3
Ca(OH)2 → CaO + Н2О
Задача 5
Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили, и полученный продукт сплавили с карбонатом натрия. Записать уравнения.
Решение:
2Al + 2NaOH + 2h3O → 2NaAlO2 + 3h3↑
NaAlO2 + CO2 + 2 h3O → Al(OH)3↓ + NaHCO3
2Al(OH)3 → Al2O3 + 3h3O
Al2O3 + Na2CO3 → 2NaAlO2 + CO2↑
Задача 6
Be →Be(NO3)2→ Be(OH)2→K2BeO2→BeSO4
Решение:
3Be + 8HNO3 = 3Be(NO3)2 + 2NO↑ + 4h3O
Be(NO3)2 + 2KOH = Be(OH)2↓ + 2KNO3
Be(OH)2 + 2KOH = K2BeO2 + 2h3O
K2BeO2 + 2h3SO4 = BeSO4↓ + K2SO4 + 2h3O
Задача 7
Cl2 → HClO → NaClO → NaClO3 → KClO3 → KClO4 → HClO4 → Cl2O7
Решение:
 ) → NaCl + NaClO + h3O
) → NaCl + NaClO + h3OHClO + NaOH (разб.) → NaClO + h3O
3NaClO -(30-50°С)→ NaClO3 + 2NaCl
NaClO3 + KOH -(0°С)→ KClO3 + NaOH
KClO3 + h3O -(электролиз)→ KClO4 + Н2↑
KClO4 + h3SO4 (конц.) → НClO4↑ + К2SO4
3НClO4 (безводн.) -(0-20°С)→ Cl2O7 + НClO4∙h3O↓
Решение:
Зайди на сайт Нигмы, запиши в поисковой строке цепочку превращений (можно = вместо стрелок), нажми «найти» — получишь уравнения реакций. Если не получается, пиши каждую реакцию отдельно, напр, N2 = Nh4. Ссылка:
Http://nigma. ru/?s=N2=Nh4=NO&t=web&rg=t=%D0%9..
Задача 9
MgCO3 → MgCl2 → Mg(OH)2 → MgSО4
Задача 10
CuSO4 → Cu(OH)2 → CuO → Cu
Задача 11
ZnCl2 → Zn(OH)2 → ZnCl2
Zn(OH)2 → Na2ZnO2
Задача 12
N2h3 что за вещество?
Ответ:
А-3, б-1, в-4, г-2
Сполучення (соединения) — из нескольких веществ получается только одно,
Замiщення (замещения) — из простого и сложного — другие простое и сложное,
Обмiну (обмена) — из двух сложных — другие два сложных.

Задача 14
Ланцюжок
Кальцій сульфід→каліцій нітрат→кальцій нітрит→кальцій сульфат
Решение:
CaS → Ca(NO3)3 → Ca(NO2)3 → CaSO4
1. CaS + 4НNO3 (конц.) → Ca(NO3)3 + S↓ + 2NO2↑ + 2h3O
2. Ca(NO3)2 -(400-500°C) → Ca(NO2)2 + O2↑
3. Ca(NO2)2 (насыщ.) + h3SO4 (конц.) → CaSO4↓ + NO2↑ + NO↑ + h3O
Задача 15
Напишите уравнения реакций, в результате которых можно осуществить следующие превращения:
Алюминий → нитрат алюминия → алюминат натрия → гидроксид алюминия → оксид алюминия → метаалюминат магния;
Решение:
Al + 6 HNO3(конц.) → Al(NO3)3 + 3 NO2↑ + 3 h3O
Al(NO3)3 (тв.) + 4NaOH (тв.) → NaAlO2 + 3NaNO3 + 2h3O (при сплавлении, ок. 1000°C)
2Al(OH)3 → Al2O3 + 3h3O (ок. 600°C)
MgO + Al2O3 → Mg(AlO2)2
Задача 16
Напишите уравнения реакций, в результате которых можно осуществить следующие превращения:
Силикат кальция → оксид кремния (IV) → силикат натрия → кремний → тетрафторид кремния.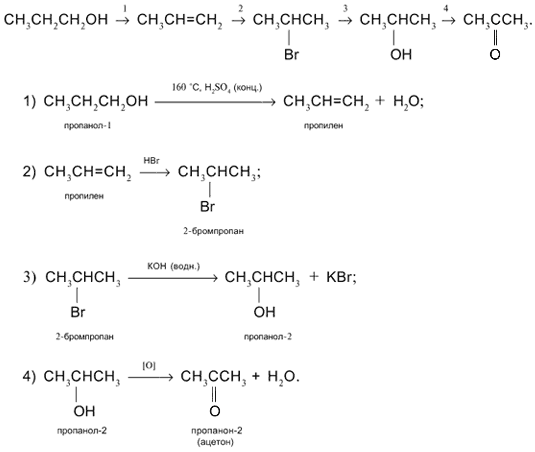
Решение:
Есть несколько силикатов кальция с общей формулой хCaO∙уSiO2, в школе, как правило, обозначается как метасиликат CaSiO3.
CaSiO3 + 2HCl → CaCl2 + SiO2 + h3O (при нагревании)
SiO2+2NaOH(расплав или гор. конц.) → Na2SiO3+h3O
Na2SiO3 → Si?? не знаю такой реакции, но можно в 2 стадии:
1) Na2SiO3 + 2HCl → NaCl + SiO2↓ + h3O
2) SiO2 + 2Mg → Si + 2MgO (ок. 1000°C без доступа воздуха)
Si + 2F2 (г) → SiF4 (горение кремния во фторе)
Ответ:
Замещение, ОВР, экзотермическая, гетерогенная.
Задача 18
Решение:
Чтобы не загрязнить меченый сульфид железа (II) другими изотопами серы, нельзя применять никакие серосодержащие реагенты, кроме имеющегося медного купороса.
Поэтому реакции типа CuSO4 + Н2S не подойдут — Н2S содержит высокий процент распространенного в природе изотопа серы S32 и др. изотопы.
изотопы.
Можно так, например:
CuSO4 + ВаСl2 = ВаSO4↓ + CuСl2
ВаSO4 + 4CО = ВаS + 4СО2↑ (600°С)
ВаS +2НСl = ВаСl2 + Н2S↑
h3S + FeO = FeS + h3O (500°C)
Задача 19
Сколько простых веществ указано в следующим перечне:
Озон, азот, вода, пирит, сажа, графит, карбин, карбид?
A)1. Б)5, В)3, Г)2
Ответ:
Б) озон, азот, сажа, графит, карбин = 5
Решение:
Чтобы не загрязнить меченый сульфид железа (II) другими изотопами серы, нельзя применять никакие серосодержащие реагенты, кроме имеющегося медного купороса.
Задача 4
Какие оксиды можно получить при термическом разложении каждого из веществ: Fe(OH)2, h3SO4, Ca(OH)2 ? Напишите уравнение реакции.
Решение:
Fe(OH)2 → FeO + Н2О
h3SO4(безводн.) → h3O + SO3
Ca(OH)2 → CaO + Н2О
Задача 5
Металлический алюминий растворили в растворе гидроксида натрия. Через полученный раствор пропустили избыток углекислого газа. Выпавший осадок прокалили, и полученный продукт сплавили с карбонатом натрия. Записать уравнения.
Записать уравнения.
Решение:
2Al + 2NaOH + 2h3O → 2NaAlO2 + 3h3↑
NaAlO2 + CO2 + 2 h3O → Al(OH)3↓ + NaHCO3
2Al(OH)3 → Al2O3 + 3h3O
Задача 6
Be →Be(NO3)2→ Be(OH)2→K2BeO2→BeSO4
Решение:
3Be + 8HNO3 = 3Be(NO3)2 + 2NO↑ + 4h3O
Be(NO3)2 + 2KOH = Be(OH)2↓ + 2KNO3
Be(OH)2 + 2KOH = K2BeO2 + 2h3O
K2BeO2 + 2h3SO4 = BeSO4↓ + K2SO4 + 2h3O
Задача 7
Cl2 → HClO → NaClO → NaClO3 → KClO3 → KClO4 → HClO4 → Cl2O7
Решение:
Cl + 2NaOH (хол.) → NaCl + NaClO + h3O
HClO + NaOH (разб.) → NaClO + h3O
3NaClO -(30-50°С)→ NaClO3 + 2NaCl
NaClO3 + KOH -(0°С)→ KClO3 + NaOH
KClO3 + h3O -(электролиз)→ KClO4 + Н2↑
KClO4 + h3SO4 (конц.) → НClO4↑ + К2SO4
3НClO4 (безводн.) -(0-20°С)→ Cl2O7 + НClO4∙h3O↓
Решение:
Зайди на сайт Нигмы, запиши в поисковой строке цепочку превращений (можно = вместо стрелок), нажми «найти» — получишь уравнения реакций. Если не получается, пиши каждую реакцию отдельно, напр, N2 = Nh4. Ссылка:
Ссылка:
Задача 9
MgCO3 → MgCl2 → Mg(OH)2 → MgSО4
Задача 10
CuSO4 → Cu(OH)2 → CuO → Cu
Задача 11
ZnCl2 → Zn(OH)2 → ZnCl2
Zn(OH)2 → Na2ZnO2
Задача 12
N2h3 что за вещество?
Ответ:
А-3, б-1, в-4, г-2
Сполучення (соединения) — из нескольких веществ получается только одно,
Розкладу (разложения) — из одного получается несколько,
Замiщення (замещения) — из простого и сложного — другие простое и сложное,
Обмiну (обмена) — из двух сложных — другие два сложных.
Задача 14
Ланцюжок
Кальцій сульфід→каліцій нітрат→кальцій нітрит→кальцій сульфат
Решение:
CaS → Ca(NO3)3 → Ca(NO2)3 → CaSO4
1. CaS + 4НNO3 (конц.) → Ca(NO3)3 + S↓ + 2NO2↑ + 2h3O
2. Ca(NO3)2 -(400-500°C) → Ca(NO2)2 + O2↑
3. Ca(NO2)2 (насыщ.) + h3SO4 (конц.) → CaSO4↓ + NO2↑ + NO↑ + h3O
Задача 15
Напишите уравнения реакций, в результате которых можно осуществить следующие превращения:
Алюминий → нитрат алюминия → алюминат натрия → гидроксид алюминия → оксид алюминия → метаалюминат магния;
Решение:
Al + 6 HNO3(конц. ) → Al(NO3)3 + 3 NO2↑ + 3 h3O
) → Al(NO3)3 + 3 NO2↑ + 3 h3O
Al(NO3)3 (тв.) + 4NaOH (тв.) → NaAlO2 + 3NaNO3 + 2h3O (при сплавлении, ок. 1000°C)
NaAlO2 + 2h3O(гор.) → NaOH + Al(OH)3↓
2Al(OH)3 → Al2O3 + 3h3O (ок. 600°C)
MgO + Al2O3 → Mg(AlO2)2
Задача 16
Напишите уравнения реакций, в результате которых можно осуществить следующие превращения:
Силикат кальция → оксид кремния (IV) → силикат натрия → кремний → тетрафторид кремния.
Решение:
Есть несколько силикатов кальция с общей формулой хCaO∙уSiO2, в школе, как правило, обозначается как метасиликат CaSiO3.
CaSiO3 + 2HCl → CaCl2 + SiO2 + h3O (при нагревании)
SiO2+2NaOH(расплав или гор. конц.) → Na2SiO3+h3O
Na2SiO3 → Si?? не знаю такой реакции, но можно в 2 стадии:
1) Na2SiO3 + 2HCl → NaCl + SiO2↓ + h3O
2) SiO2 + 2Mg → Si + 2MgO (ок. 1000°C без доступа воздуха)
Si + 2F2 (г) → SiF4 (горение кремния во фторе)
Ответ:
Замещение, ОВР, экзотермическая, гетерогенная.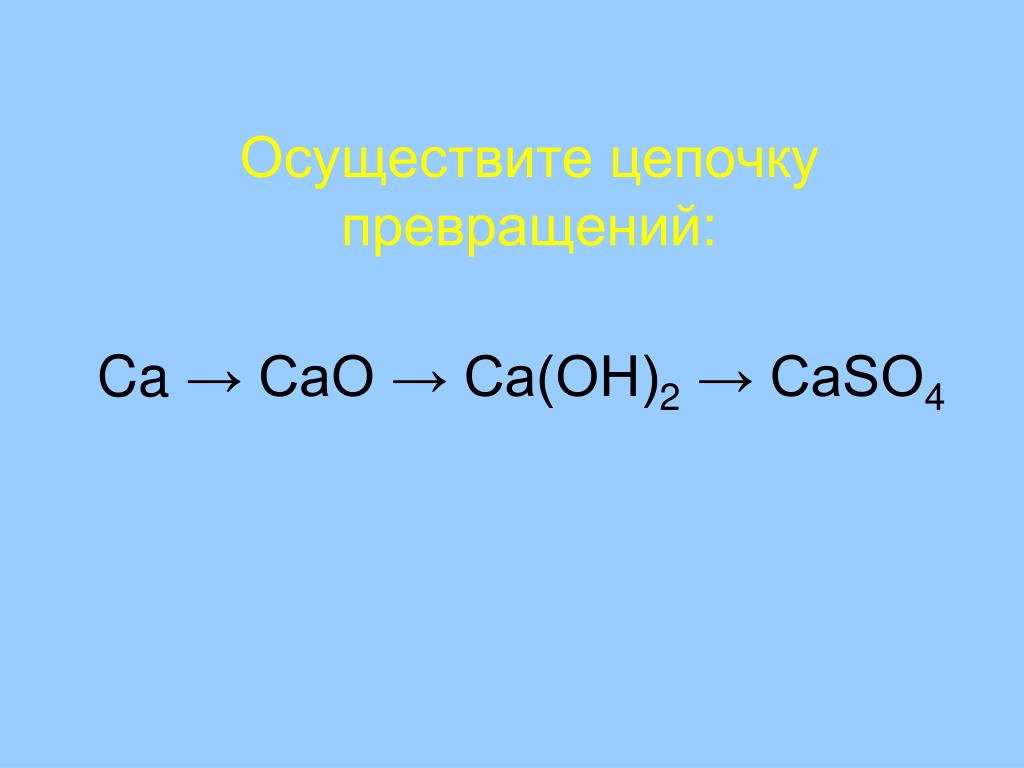
Задача 18
Как из образца медного купороса, содержащего радиоактивный изотоп серы S35, получить меченый этой серой сульфид железа (II), не загрязняя его другими изотопами? Написать уравнения реакций.
Решение:
Чтобы не загрязнить меченый сульфид железа (II) другими изотопами серы, нельзя применять никакие серосодержащие реагенты, кроме имеющегося медного купороса.
Поэтому реакции типа CuSO4 + Н2S не подойдут — Н2S содержит высокий процент распространенного в природе изотопа серы S32 и др. изотопы.
Можно так, например:
CuSO4 + ВаСl2 = ВаSO4↓ + CuСl2
ВаSO4 + 4CО = ВаS + 4СО2↑ (600°С)
ВаS +2НСl = ВаСl2 + Н2S↑
h3S + FeO = FeS + h3O (500°C)
Задача 19
Сколько простых веществ указано в следующим перечне:
Озон, азот, вода, пирит, сажа, графит, карбин, карбид?
A)1. Б)5, В)3, Г)2
Ответ:
Б) озон, азот, сажа, графит, карбин = 5
Решение:
3Be + 8HNO3 = 3Be(NO3)2 + 2NO↑ + 4h3O
Be(NO3)2 + 2KOH = Be(OH)2↓ + 2KNO3
Be(OH)2 + 2KOH = K2BeO2 + 2h3O
K2BeO2 + 2h3SO4 = BeSO4↓ + K2SO4 + 2h3O
1000 C без доступа воздуха Si 2F2 г SiF4 горение кремния во фторе.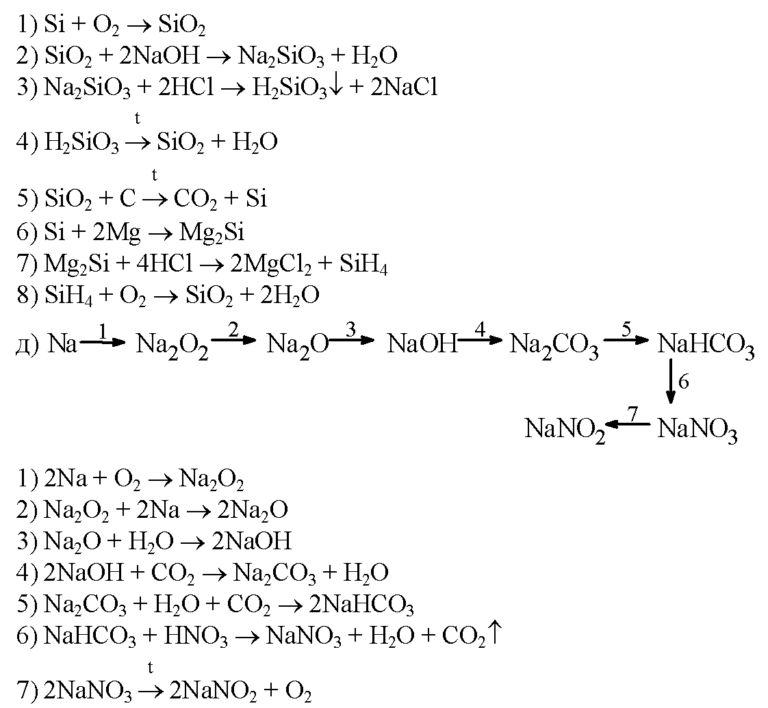
M. vk. com
18.10.2019 4:03:34
2019-10-18 04:03:34
Задачи для практики
Задача 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $3CH_2=CH_2 + 2KMnO_4 + 4H_2O → 3CH_2(OH)–CH_2OH + 2MnO_2 + 2KOH$
2) $CH_2(OH)–CH_2OH + 2HCl → CH_2Cl–CH_2Cl + 2H_2O$
3) $CH_2Cl–CH_2Cl + 2KOH_ → CH≡CH + 2KCl + 2H_2O$
4) $CH≡CH + H_2O →↖>$
5) $CH_3CHO$ + $2[Ag(NH_3)_2]OH$ → 2Ag + $4NH_3$ + $H_2O$ + $CH_3COOH$
Задача 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_6H_O_6 →↖ 2C_2H_5OH + 2CO_2$
2) $C_2H_5OH →↖ 140 °C> CH_2=CH_2 + H_2O$
3) $CH_2=CH_2 +$ $→↖$
4) $Cl_2 +$ $→↖ HCl +$
5) $12KMnO_4 + 18H_2SO_4 +$ $→ 12MnSO_4 + 6K_2SO_4 + 28H_2O + 5CO_2 +$
$12KMnO_4 + 18H_2SO_4 +$ $→ 12MnSO_4 + 6K_2SO_4 + 28H_2O + 5CO_2 +$
Задача 3
Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
$н-гептан →↖ Х_1 →↖$ $→↖, t°> X_2 →↖ X_3 →↖, t°> X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.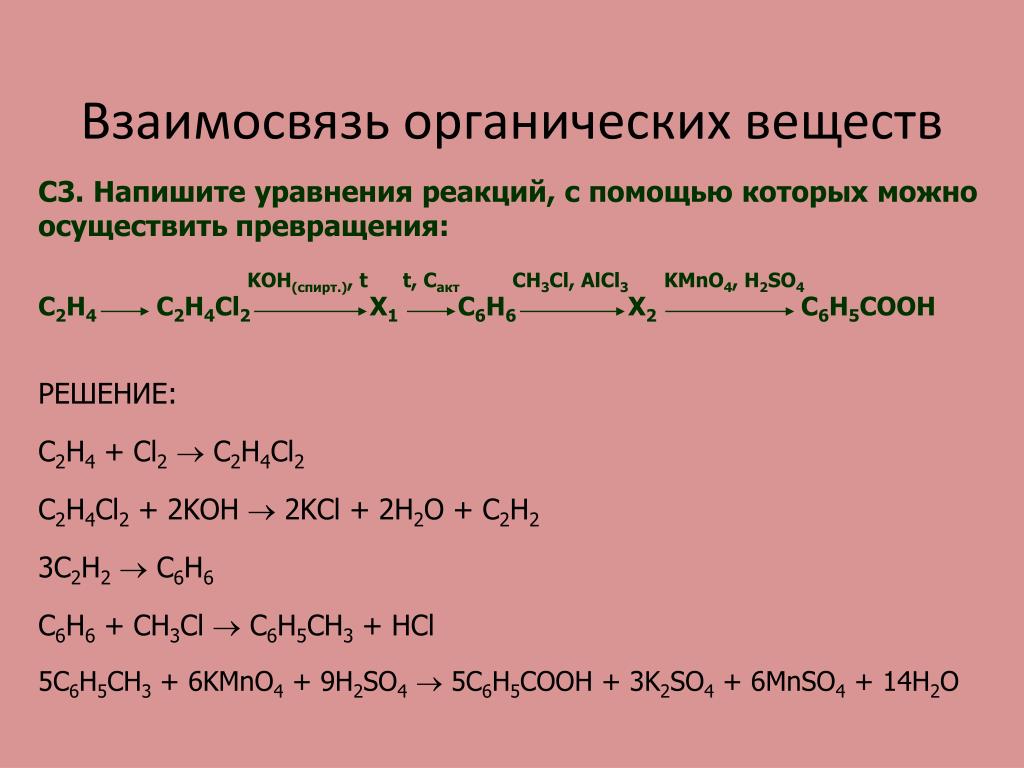
Решение
1) $CH_3CH_2CH_2CH_2CH_2CH_2CH_3 →↖ 4H_2 +$
2) $+ 2Cl_2 →↖ 2HCl +$
3) $+2КOH → 2КCl + H_2O +$
4) 5 $+ 2KMnO_4 + 3H_2SO_4 →5$ C6H5COOH$+ 2MnSO_4 + K_2SO_4 + 3H_2O$
5) С6H5COOH $+ CH_3–CH(OH)–CH_3 → H_2O +$
Задача 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$ацетилен →↖, t°> Х_1 →↖ Х_2 →↖$ $–Cl →↖, t°> X_3 →↖ X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $3CH≡CH →↖, t°>$
2) $+ 3H_2 →↖$
3) $+ Cl_2 →↖ HCl +$
4) $+ KOH_ →↖ KCl + H_2O +$
5) 3 $+ 2KMnO_4 + 4H_2O → 3$ $+ 2MnO_2 + 2KOH$
Задача 5
Приведите уравнения химических реакций, которые позволяют осуществить следующие превращения:
$C_2H_5OH → CH_2=CH_2 →↖ X_1 →$$→↖ X_2 →↖ X_3$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_2H_5OH →↖, t > 140 °C> CH_2=CH_2 + H_2O$
2) $CH_2=CH_2 + HCl → CH_3–CH_2Cl$
3) $CH_3–CH_2Cl +$ $→↖ HCl +$
4) $5C_6H_5C_2H_5 + 12KMnO_4 + 18H_2SO_4 → 5C_6H_5COOH + 5CO_2 + 6K_2SO_4 + 12MnSO_4 + 28H_2O$
5) $+ HONO_ →↖, t°> H_2O +$
Задача 6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.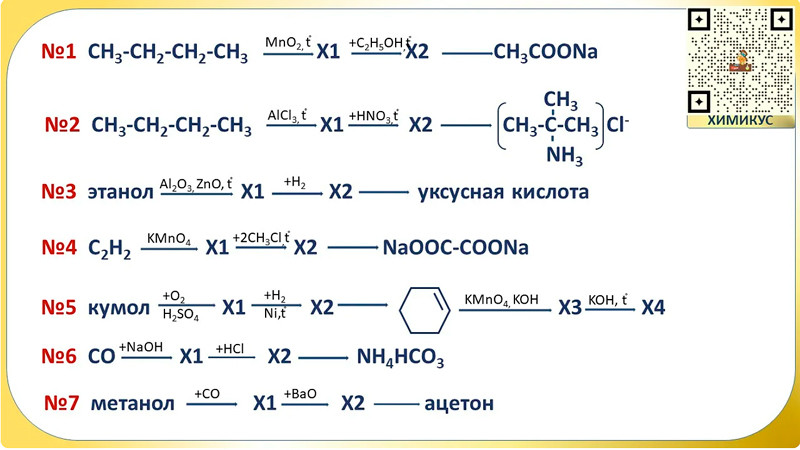
Решение
1) $CH≡CH + H_2O → CH_3–CHO$
2) $3CH_3CHO + K_2Cr_2O_7 + 4H_2SO_4 → 3CH_3COOH + K_2SO_4 + Cr_2(SO_4)_3 + 4H_2O$
3) $CH_3COOH + NaHCO_3 → CH_3COONa + H_2O + CO_2$
4) $CH_3COONa + CH_3I → CH_3COOCH_3 + NaI$
5) $CH_3COOCH_3 + H_2O ⇄ CH_3COOH + CH_3OH$
Задача 7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3–CH_2–CH_3 + Cl_2 →↖$ $+ HCl$
2) 2$+ 2Na →↖ 2NaCl +$
3) $+ Cl_2 →↖ HCl +$
4) $+ NaOH_ →↖ NaCl + H_2O +$
5) $+ 2KMnO_4 + 4H_2O →$ $+ 2MnO_2 + 2KOH$
Задача 8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $+ 3H_2 →↖$
2) $+ Cl_2 →↖ HCl +$
3) $+ NaOH_ →↖ NaCl +$
4) $→↖, t > 140 °C> H_2O +$
5) $+ 8KMnO_4 + 12H_2SO_4 → 8MnSO_4 + 4K_2SO_4 + 12H_2O + 5HOOC–(CH_2)_4–COOH$
Задача 9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3CH_2CH_2CH_2OH → CH_3CH_2–CH=CH_2 + H_2O$
2) $CH_3CH_2–CH=CH_2 + HBr → CH_3CH_2–CHBr–CH_3$
3) $CH_3CH_2–CHBr–CH_3 + KOH_ → CH_3CH_2–CH(OH)–CH_3 + KBr$
4) $CH_3CH_2–CH(OH)–CH_3 → CH_3–CH=CH–CH_3 + H_2O$
5) $5CH_3–CH=CH–CH_3 + 8KMnO_4 + 12H_2SO_4 → 10CH_3–COOH + 4K_2SO_4 + 8MnSO_4 + 12H_2O$
Задача 10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$пропан →↖ Х_1 → 1.2-дибромпропан →↖, t°> Х_2 →↖ Х_3 →↖$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3–CH_2–CH_3 → CH_3–CH=CH_2 + H_2$
2) $CH_3–CH=CH_2 + Br_2 → CH_3–CHBr–CH_2Br$
3) $CH_3–CHBr–CH_2Br + 2NaOH_ → CH_3–C≡CH + 2NaBr + 2H_2O$
4) $3CH_3–C≡CH →↖, t°>$
5) $18KMnO_4 + 27H_2SO_4 + 5$ $→ 18MnSO_4 + 9K_2SO_4 + 42H_2O + 5$
Задача 11
Напишите уравнения реакций, которые позволяют осуществить следующие превращения:
$Al_4C_3 → X_1 → нитрометан →↖ X_2 →↖ X_3 →↖ X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.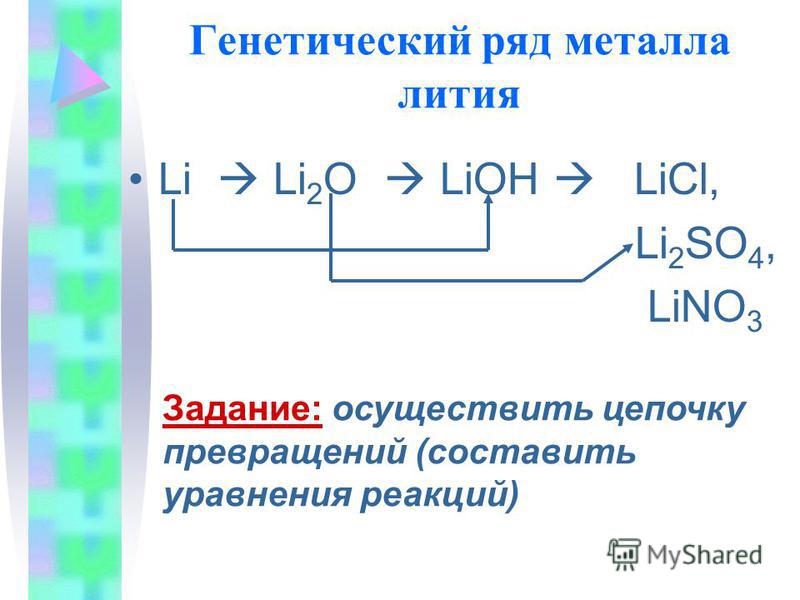 + NaOH → CH_3NH_2 + NaI + H_2O$
+ NaOH → CH_3NH_2 + NaI + H_2O$
Задача 12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$C_6H_5COOK →↖ X_1 →↖ X_2 →↖ X_3 →$ $→↖ X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $+ KOH_ → K_2CO_3 +$
3) $–CH_2–CH_3 + Cl_2 →↖$ $+ HCl$
4) $C_6H_5–CH(Cl)–CH_3 + KOH_ → C_6H_5–CH=CH_2 + KCl + H_2O$
5) $C_6H_5–CH=CH_2 + 2KMnO_4 + 3H_2SO_4 → K_2SO_4 + 2MnSO_4 + 4H_2O + CO_2 +$
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Задача 1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $3CH_2=CH_2 + 2KMnO_4 + 4H_2O → 3CH_2(OH)–CH_2OH + 2MnO_2 + 2KOH$
2) $CH_2(OH)–CH_2OH + 2HCl → CH_2Cl–CH_2Cl + 2H_2O$
3) $CH_2Cl–CH_2Cl + 2KOH_ → CH≡CH + 2KCl + 2H_2O$
4) $CH≡CH + H_2O →↖>$
5) $CH_3CHO$ + $2[Ag(NH_3)_2]OH$ → 2Ag + $4NH_3$ + $H_2O$ + $CH_3COOH$
Задача 2
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_6H_O_6 →↖ 2C_2H_5OH + 2CO_2$
2) $C_2H_5OH →↖ 140 °C> CH_2=CH_2 + H_2O$
3) $CH_2=CH_2 +$ $→↖$
4) $Cl_2 +$ $→↖ HCl +$
5) $12KMnO_4 + 18H_2SO_4 +$ $→ 12MnSO_4 + 6K_2SO_4 + 28H_2O + 5CO_2 +$
$12KMnO_4 + 18H_2SO_4 +$ $→ 12MnSO_4 + 6K_2SO_4 + 28H_2O + 5CO_2 +$
Задача 3
Напишите уравнения химических реакций, с помощью которых можно осуществить следующие превращения:
$н-гептан →↖ Х_1 →↖$ $→↖, t°> X_2 →↖ X_3 →↖, t°> X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3CH_2CH_2CH_2CH_2CH_2CH_3 →↖ 4H_2 +$
2) 2Cl_2 →↖ 2HCl +$
3) 2КOH → 2КCl + H_2O +$
4) 5 2KMnO_4 + 3H_2SO_4 →5$ C6H5COOH 2MnSO_4 + K_2SO_4 + 3H_2O$
5) С6H5COOH CH_3–CH(OH)–CH_3 → H_2O +$
Задача 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$ацетилен →↖, t°> Х_1 →↖ Х_2 →↖$ $–Cl →↖, t°> X_3 →↖ X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $3CH≡CH →↖, t°>$
2) 3H_2 →↖$
3) Cl_2 →↖ HCl +$
4) KOH_ →↖ KCl + H_2O +$
5) 3 2KMnO_4 + 4H_2O → 3$ 2MnO_2 + 2KOH$
Задача 5
Приведите уравнения химических реакций, которые позволяют осуществить следующие превращения:
$C_2H_5OH → CH_2=CH_2 →↖ X_1 →$$→↖ X_2 →↖ X_3$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $C_2H_5OH →↖, t > 140 °C> CH_2=CH_2 + H_2O$
2) $CH_2=CH_2 + HCl → CH_3–CH_2Cl$
3) $CH_3–CH_2Cl +$ $→↖ HCl +$
4) $5C_6H_5C_2H_5 + 12KMnO_4 + 18H_2SO_4 → 5C_6H_5COOH + 5CO_2 + 6K_2SO_4 + 12MnSO_4 + 28H_2O$
5) HONO_ →↖, t°> H_2O +$
Задача 6
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH≡CH + H_2O → CH_3–CHO$
2) $3CH_3CHO + K_2Cr_2O_7 + 4H_2SO_4 → 3CH_3COOH + K_2SO_4 + Cr_2(SO_4)_3 + 4H_2O$
3) $CH_3COOH + NaHCO_3 → CH_3COONa + H_2O + CO_2$
4) $CH_3COONa + CH_3I → CH_3COOCH_3 + NaI$
5) $CH_3COOCH_3 + H_2O ⇄ CH_3COOH + CH_3OH$
Задача 7
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.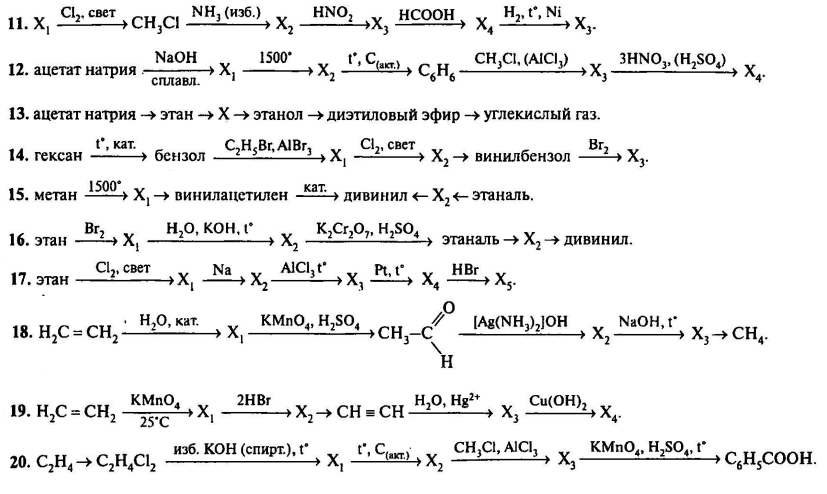
Решение
1) $CH_3–CH_2–CH_3 + Cl_2 →↖$ HCl$
2) 2 2Na →↖ 2NaCl +$
3) Cl_2 →↖ HCl +$
4) NaOH_ →↖ NaCl + H_2O +$
5) 2KMnO_4 + 4H_2O →$ 2MnO_2 + 2KOH$
Задача 8
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) 3H_2 →↖$
2) Cl_2 →↖ HCl +$
3) NaOH_ →↖ NaCl +$
4) $→↖, t > 140 °C> H_2O +$
5) 8KMnO_4 + 12H_2SO_4 → 8MnSO_4 + 4K_2SO_4 + 12H_2O + 5HOOC–(CH_2)_4–COOH$
Задача 9
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) $CH_3CH_2CH_2CH_2OH → CH_3CH_2–CH=CH_2 + H_2O$
2) $CH_3CH_2–CH=CH_2 + HBr → CH_3CH_2–CHBr–CH_3$
3) $CH_3CH_2–CHBr–CH_3 + KOH_ → CH_3CH_2–CH(OH)–CH_3 + KBr$
4) $CH_3CH_2–CH(OH)–CH_3 → CH_3–CH=CH–CH_3 + H_2O$
5) $5CH_3–CH=CH–CH_3 + 8KMnO_4 + 12H_2SO_4 → 10CH_3–COOH + 4K_2SO_4 + 8MnSO_4 + 12H_2O$
Задача 10
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$пропан →↖ Х_1 → 1.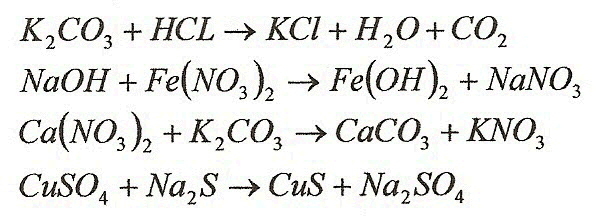 + NaOH → CH_3NH_2 + NaI + H_2O$
+ NaOH → CH_3NH_2 + NaI + H_2O$
Задача 12
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
$C_6H_5COOK →↖ X_1 →↖ X_2 →↖ X_3 →$ $→↖ X_4$
При написании уравнений реакций используйте структурные формулы органических веществ.
Решение
1) KOH_ → K_2CO_3 +$
3) $–CH_2–CH_3 + Cl_2 →↖$ HCl$
4) $C_6H_5–CH(Cl)–CH_3 + KOH_ → C_6H_5–CH=CH_2 + KCl + H_2O$
5) $C_6H_5–CH=CH_2 + 2KMnO_4 + 3H_2SO_4 → K_2SO_4 + 2MnSO_4 + 4H_2O + CO_2 +$
3) $CH_3COOH + NaHCO_3 → CH_3COONa + H_2O + CO_2$
Решение
При написании уравнений реакций используйте структурные формулы органических веществ.
Egeturbo. ru
21.03.2020 21:00:55
2020-03-21 21:00:55
Источники:
Https://nsportal. ru/shkola/khimiya/library/2015/01/03/tsepochki-prevrashcheniy-veshchestv
Https://m. vk. com/topic-8603567_27780924
Https://egeturbo. ru/ege/chem/tasks/33
App Store: Химия
Описание
Решайте химические уравнения, Таблица Менделеева 2022, Таблица Растворимости и другие — и всё в одном приложении! Незаменимый помощник по химии! Химия — это просто!
Приложение находит Химические Реакции и химические уравнения с одним и несколькими неизвестными. У вас всегда будет под рукой Таблица Менделеева и Таблица Растворимости. И даже калькулятор молярных масс!
У вас всегда будет под рукой Таблица Менделеева и Таблица Растворимости. И даже калькулятор молярных масс!
Добавляйте виджеты с химическими элементами на рабочий стол – запоминайте полезную информацию подсознательно.
Находит уравнения химических реакций, даже если неизвестна правая или левая часть, поможет с органической и неорганической химией. Вам будут отображен список найденных реакций в обычном и ионном виде и нарисованы формулы органической химии.
Удобная интерактивная Таблица Менделеева с поиском и информацией о всех химических элементах доступной оффлайн. Нажмите на химический элемент в таблице, чтобы посмотреть справочную информацию.
Запоминайте химические элементы подсознательно с использованием виджетов для рабочего стола. Разместите один или несколько виджетов и время от времени смотрите информацию о химических элементах: порядковый номер и расположение в Таблице Менделеева, фотографии химических веществ, даты открытия элементов.
Калькулятор молярных масс. Введите правильно химическое соединение и калькулятор покажет молярные массы и процентные содержания элементов в заданном химическом веществе.
Введите правильно химическое соединение и калькулятор покажет молярные массы и процентные содержания элементов в заданном химическом веществе.
Таблица растворимости будет всегда под рукой, и вы сможете понять какая реакция идет, а какая нет. Теперь не придется открывать учебник, чтобы узнать нужную информацию.
Самый лучший решатель химических уравнений для iPhone и iPad.
* Таблица Менделеева
* Атомы в дополненной реальности AR
* Таблица растворимости
* Поиск химических реакций
* Оффлайн доступ к информации о химических элементах
* Калькулятор молярных масс химических веществ
* Ряд электроотрицательности элементов
* Молекулярные массы органических веществ
* Электрохимический ряд активности металлов
* Ряд активности кислот
* Стандартный электродный потенциал
* Виджеты для легкого изучения Химии
И все эти таблицы и калькуляторы в бесплатном приложении Химия.
Подробнее про условия использовани приложения можно прочитать по следующим ссылкам:
Terms of Use: http://getchemistry. io/terms-and-conditions/ios/
io/terms-and-conditions/ios/
Privacy policy: http://getchemistry.io/privacy-policy/ios/
Версия 7.28
* Поддержка обновлённой операционной системы
* Новый виджет для экрана блокировки
Вам приносит пользу приложение? Уделите пару секунд, чтобы поставить оценку
Оценки и отзывы
Оценок: 4,9 тыс.
Очень хорошее приложение.
Очень удобное и простое приложение , а главное полезное . В любой момент можно проверить та или иную реакцию, разработчикам спасибо.
Химия: оценка пять!!!
Постоянно пользуюсь на уроках химии и постоянно пятёрки, я думаю что это приложение тоже заслужило пятерку!!!5️⃣5️⃣5️⃣
Спасибо!!
Спасибо огромное разроботчикам, очень полезное, красивое и удобное приложение! ❤️
Спасибо за Ваш отзыв 🤗
Разработчик Denis Chaschin указал, что в соответствии с политикой конфиденциальности приложения данные могут обрабатываться так, как описано ниже. Подробные сведения доступны в политике конфиденциальности разработчика.
Подробные сведения доступны в политике конфиденциальности разработчика.
Связанные с пользователем данные
Может вестись сбор следующих данных, которые связаны с личностью пользователя:
Не связанные с пользователем данные
Может вестись сбор следующих данных, которые не связаны с личностью пользователя:
- Данные об использовании
- Диагностика
Конфиденциальные данные могут использоваться по-разному в зависимости от вашего возраста, задействованных функций или других факторов. Подробнее
Информация
- Провайдер
- Denis Chaschin
- Размер
- 81,4 МБ
- Категория
- Образование
- Возраст
- 4+
- Copyright
- © 2012-2022 diniska
- Цена
- Бесплатно
- Сайт разработчика
- Поддержка приложения
- Политика конфиденциальности
Поддерживается
Другие приложения этого разработчика
Вам может понравиться
Тесты по химии онлайн | Online Test Pad
ЕГЭ ОГЭ 11 класс 10 класс 9 класс 8 класс
-
Таблица Менделеева
15.
 07.2021
15452
07.2021
15452
Тест на проверку знаний Таблицы Менделеева. Предмет — химия
-
Символы и названия химических элементов
16.11.2020 5561 0
Тест по химии для 7-8 классов на тему «Символы и названия химических элементов»
-
Химические и физические явления
04.02.2017 20057
Тест по общей химии. Рассмотрены вопросы по теме «Химические и физические явления» 8 класс
-
Химическая связь.
 Виды химической связи.
Виды химической связи.
10.11.2017 20317
Тест содержит вопросы по 4-ем видам химической связи, клторые позваляют закремить тему.
-
Предмет химии. Вещества. Вариант 1
26.08.2012 56252
Тест для учеников 8-го класса по теме «Предмет химии. Вещества.».
-
Органическая химия. Алканы
06.09.2013 63818
В этом тесте вы можете проверить свои знания в сфере алканов. Тест состоит из 13 вопросов. Максимальный балл — 18. Удачи!
-
Понятия: химический элемент и простое вещество.

05.12.2021 442 0
Тест предназначен для обучающихся 8-9 классов с целью отработки понятий — химический элемент и простое вещество
-
Химия 8 класс ВПР 2020
10.05.2020 5991 0
Проверочная работа по химии Демоверсии ВПР 2020 года для 8 класса Образец
-
Уравнения хим. реакций (8 класс)
20.01.2021 15290
Этот тест позволяет закрепить навык расставления индексов в химический уравнениях реакций
-
Электролитическая диссоциация.
 Ионные уравнения.
Ионные уравнения.
14.06.2020 626 0
Тест предназначен для проверки знаний по теме «Теория электролитической диссоциации. Реакции ионного обмена».
-
Органы и системы органов человека
10.06.2022 1476
Обобщающий тест по теме «Органы и системы органов», включащий вопросы по пройденным ранее разделам.
-
9 класс. Скорость химических реакций
23.11.2020 2053 0
Тестовая работа преназначена для контроля знаний по теме.
 Можно использовать при дистанционном обучении.
Можно использовать при дистанционном обучении.
-
Химия 8 класс. Валентность
10.10.2021 2062 0
Тест для текущего контроля знаний по теме «Валентность» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020
-
Тест по химии «Оксиды»
08.04.2020 16129
Тест по предмету «Химия» на проверку знаний по изученной теме «Основные классы неорганических соединений — ОКСИДЫ»
-
Органическая химия.
 Алкены
Алкены
26.09.2013 40750
Этот тест проверит ваши общие знания по теме «Алканы». Во время работы не рекомендуется пользоваться дополнительными материалами кроме калькулятора и Периодической системы.
-
Типы химических реакций
17.03.2017 14541 0
Тест предназначен для проверки знания типов химических реакций для учащихся 8 классов
-
Тепловой эффект химической реакции
21.03.2013 6438
Тест предназначен для учащихся 8 класса общеобразовательной школы, может служить для закрепления указанной в названии темы.

-
Окислительно-восстановительная реакция
06.02.2017 19802
Тест содержит вопросы по темам: «Степень окисления», «Окислительная-восстановительная реакция».
-
Химия 8 класс. Знаки химических элементов. Периодическая таблица Д.И. Менделеева. Относительная атомная масса
22.09.2021 498 0
Тест для текущего контроля знаний по теме «Знаки химических элементов. Периодическая таблица Д.И. Менделеева» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020
-
Химия.
 8 класс. 1-2.Атомы. Молекулы. Вещества. Строение атома.
8 класс. 1-2.Атомы. Молекулы. Вещества. Строение атома.
09.05.2019 3123
Образовательный тест проверяет усвоенный материал по химии в школе за определённый класс.Вы можете протестироваться,указав верный вариант и другие методы.Тест абсолютно бесплатный и не требует регистрации.Также доступен сертификат при результате выше 70%.Сертификат бесплатный.Его можно скачать в форме JPG или PDF.Доступна статистика теста.Разрешены комментарии.Желаем успехов!
-
Подготовка к ЕГЭ — реакции ионного обмена
13.01.2017 1103 0
При выполнении заданий можно пользоваться черновиком. Записи в черновике не учитываются при оценивании работы. При выполнении работы используйте Периодическую систему химических элементов Д.
 И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов. -
9 класс ОГЭ. Электролиты и неэлектролиты. Теория электролитической диссоциации.
03.12.2020 121 0
Для успешной сдачи основного государственного экзамена по химии вам необходимо обладать определенным набором знаний, умений, навыков.
-
Электролитическая диссоциация.
 Реакции ионного обмена.
Реакции ионного обмена.
08.11.2016 12797
Тест предназначен для проверки знаний по теме электролитическая диссоциация и реакции ионного обмена .Содержит вопросы как по теории так и практические задания.
-
Кислоты неорганическая химия
24.11.2014 44868
Тест представлен для 8-го класса неорганической химии теме кислоты. Туда входит разнообразие вопросов, связаных с формулами и химическими свойствами, а также просто для общего развития.
-
Материалы Аддитивного синтеза 2
25.06.2022 67 0
Тест, в котором Богданович превзошла саму себя.
 Удачи вам, зубрята, в зубрении этой ахинеи.
Тест по предмету Материалы Аддитивного Синтеза для гр. ПИТТ-21. Второй тест.
Удачи вам, зубрята, в зубрении этой ахинеи.
Тест по предмету Материалы Аддитивного Синтеза для гр. ПИТТ-21. Второй тест. -
08кл Типы химических связей (общий тест)
22.11.2020 3878
Тренировочный тест по теме «Типы химических связейг» составлен для учащихся 8 класса.
-
химические свойства кислот как электролитов
11.04.2020 3952 0
ТЕСТ ПО ТЕМЕ КИСЛОТЫ КАК ЭЛЕКТРОЛИТЫ ВКЛЮЧАЕТ В СЕБЯ ТАКИЕ ВОПРОСЫ КАК КЛАССИФИКАЦИЯ КИСЛОТ, ДИССОЦИАЦИЯ И ХИМИЧЕСКИЕ СВОЙСТВА
-
ЕГЭ по химии.
 Гидролиз (тренажер)
Гидролиз (тренажер)
12.07.2017 1536
Данный тест является тренажером задания 23 ЕГЭ по химии. Тест рассматривает вопросы по теме: Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
-
Тест на профориентацию
07.03.2018 10649
Пройдя этот тест вы узнаете, к какой професии вы близки по вашим интересам. Предупреждение: Результаты не являются единственно верными. Только пройдя несколько подобных тестов можно сделать выводы и выйти на максимально близкий результат.
-
Химия 9 класс. Химические свойства оснований как электролитов
03.
 10.2021
227
0
10.2021
227
0
Тест для текущего контроля знаний по теме «Химические свойства оснований как электролитов» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Электролитическая диссоциация
03.12.2019 4419 0
Задания ориентированно на обучающихся 8-9 классов по УМК Химия 8-9. О.С. Габриеляна.
-
Тест по химии. Химия. 8 класс. Олимпиадные задания. Задания основного типа и повышенной трудности. Тестовая часть
28.11.2020 547 0
Тест по химии.
 Химия. 8 класс. Олимпиадные задания. Задания основного типа и повышенной трудности. Тестовая часть
Химия. 8 класс. Олимпиадные задания. Задания основного типа и повышенной трудности. Тестовая часть -
Химия. 8 класс. Строение атома. Периодический закон.
21.04.2021 923 0
Тестовые задания предлагаются для проверки знаний по химии учащихся 8 класса по теме «Строение атома. Периодический закон и периодическая система химических элементов Д.И. Менделеева»
-
Растворы. 2 вариант.
04.10.2016 662 0
Тест предназначен для проверки уровня знаний по теме: «Растворы. Массовая доля вещества в растворе».
-
08кл Химические уравнения (Расставьте коэффициенты) общий тест
19.
 12.2020
8188
0
12.2020
8188
0
Для повторения темы Химические уравнения. Задания для закрепления навыков расставления коэффициентов.
-
Тест по теме «Классы неорганических соединений». 1 вариант
23.10.2012 8058
Тест из 9-ти вопросов по химии для учеников 9-го класса по теме «Классы неорганических соединений». По окончании теста — правильные ответы.
-
Cтроение атома.Периодический закон и периодическая система Д.И. Менделеева.
18.11.2015 8759
Tест составлен на основе сборника типовых тестов для подготовки к ОГЭ, включает в себя 33 задания уровня «А».

-
номенклатура органических соединений
07.04.2022 259 0
Номенклатура органических соединений Вопрос предполагает не более одного ответа. По времени прохождения ограничений нет.
-
Сера и её соединения
26.08.2012 19448
Тест по химии для 9-го класса по теме «Сера и её соединения».
-
Химия. 10 класс. Углеводы.
30.12.2020 3534 0
Тестовые задания предлагаются для проверки знаний по химии учащихся 10 классов по теме «Углеводы»
-
Химия 9 класс.
 Химические свойства кислот как электролитов
Химические свойства кислот как электролитов
24.09.2021 489 0
Тест для текущего контроля знаний по теме «Химические свойства кислот как электролитов» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия. 10 класс. Сложные эфиры. Жиры.
13.03.2021 2369 0
Тестовые задания предлагаются для проверки знаний по химии учащихся 10 класса по теме «Сложные эфиры. Жиры».
-
Товары бытовой химии
03.10.2019 1043 0
Тест предназначен для ознакомления с темой Бытовой химии, как с практической точки зрения, так и со стороны химии как науки
-
Номенклатура кислот и солей
16.
 03.2016
4970
03.2016
4970
Тест может быть применен как в индивидуальном, так и в групповом исполнении. Но в отличие от группового в индивидуальном исследовании используется еще один важный прием: просят прочесть вслух написанные ответы.
-
Строение атома
10.04.2017 14930
Тест по теме: «Строение атома» .В тесте вопросы об открытии строения атома, и умении работать с данными об атоме.
-
Структурная организация живых организмов
20.01.2018 1010
Структурная организация живых организмовпатчвап ьтчвар ьсвпь рпчсрьваьр смчит чапоаыпоаыпи васмитчатоаыптамитаптоыерывипавимчси чтораыерыенркыертиатмтчвеартоаимт чсрвкаыкваприачвтчаптывачмичаыераыпчи
-
Скорость химической реакции, её зависимость от различных факторов
07.
 01.2019
2865
0
01.2019
2865
0
Скорость химической реакции означает скорость, с которой расходуются реагенты при протекании химической реакции
-
Строение атома. Периодический закон и периодическая система элементов Д.И. Менделеева.
15.04.2020 17437
Тест обобщения и систематизации знаний по теме «Периодический закон и ПСХЭ Д.И. Менделеева. Строение атома».
-
Химия 8 класс. Химические формулы
03.10.2021 281 0
Тест для текущего контроля знаний по теме «Химические формулы» к учебнику О.
 С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020
С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020 -
Химия 9 класс. Основные положения теории электролитической диссоциации
23.09.2021 499 0
Тест для текущего контроля знаний по теме «Основные положения теории электролитической диссоциации» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Типы химических реакций
22.03.2013 55024
Тест предназначен для проверки знания типов химических реакций.
-
Тривиальные названия неорганических веществ
28.
 05.2020
1162
0
05.2020
1162
0
Представляю вам тест, состоящий из 30 вопросов. Желаю удачи и успехов в изучении химии
-
10-SINF O‘QUVCHILARI UCHUN KIMYO FANIDAN ONLAYN OLIMPIADA
11.01.2022 145
10-SINF O‘QUVCHILARI UCHUN KIMYO FANIDAN ONLAYN OLIMPIADA
-
Подготовка к ЕГЭ — электронная конфигурация атома
24.03.2016 2014
При выполнении заданий можно пользоваться черновиком. Записи в черновике не учитываются при оценивании работы. При выполнении работы используйте Периодическую систему химических элементов Д.
 И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов. -
Загадки Амтхауэра. Интеллектуальный тест.
05.04.2018 4153 0
Тест показывает насколько вы эрудированы. Пройти тест без ошибок не может практически никто. 21 вопрос, по 5 вариантов ответа на вопрос. Вопросы усложняются по мере прохождения теста.
-
Химия. 8 класс. Основные классы неорганических соединений
22.
 02.2021
445
0
02.2021
445
0
Тестовые задания предлагаются для проверки знаний по химии учащихся 8 класса по теме «Основные классы неорганических соединений».
-
Химия основы
11.03.2019 1622 0
Тест проверяет знания основных понятий химии. Строение атома. Химическая связь. Степень окисления. Основные классы неорганических соединений.
-
10 класс. Нефть и способы ее переработки
22.11.2020 968 0
Работа предназначена для проверки применения знаний при дистанционном обучении
-
ВПР по химии — 8 класс
15.
 12.2020
1575
0
12.2020
1575
0
Всероссийские проверочные работы (ВПР) проводятся с учетомнационально-культурной и языковой специфики многонациональногороссийского общества в целях осуществления мониторинга результатовперехода на ФГОС и направлены на выявление качества подготовкиобучающихся. Назначение ВПР по учебному предмету «Химия» – оценить качествообщеобразовательной подготовки обучающихся 8 классов в соответствии стребованиями ФГОС. ВПР позволяют осуществить диагностику достиженияпредметных и метапредметных результатов, в том числе овладениемежпредметными понятиями и способность использования универсальныхучебных действий (УУД) в учебной, познавательной и социальной практике. Результаты ВПР в совокупности с имеющейся в общеобразовательнойорганизации информацией, отражающей индивидуальные образовательныетраектории обучающихся, могут быть использованы для оценки личностныхрезультатов обучения. Результаты ВПР могут быть использованы общеобразовательнымиорганизациями для совершенствования методики преподавания химии впроцессе обучения предмету, муниципальными и региональными органамиисполнительной власти, осуществляющими государственное управление всфере образования, для анализа текущего состояния муниципальных ирегиональных систем образования и формирования программ их развития.
 Не предусмотрено использование результатов ВПР для оценкидеятельности общеобразовательных организаций, учителей, муниципальныхи региональных органов исполнительной власти, осуществляющихгосударственное управление в сфере образования.
Не предусмотрено использование результатов ВПР для оценкидеятельности общеобразовательных организаций, учителей, муниципальныхи региональных органов исполнительной власти, осуществляющихгосударственное управление в сфере образования. -
Химия 11 класс. Контрольная работа №1 Периодический закон. Периодическая система Д. И. Менделеева. Строение атома
20.09.2021 902 0
Контрольная работа для проверки знаний по теме «Периодический закон. Периодическая система Д. И. Менделеева. Строение атома» к УМК О.С. Габриелян, Химия 11 класс. Базовый уровень, М.: «Дрофа», 2016 год
-
Физические и химические свойства воды. Растворы.
14.
 02.2020
4128
0
02.2020
4128
0
С помощью этого теста можно проверить знания полученные на уроке о воде.
-
8 класс. Химия. Введение
29.07.2017 16090
Тема: Введение. Основные химические понятия. Вещество и тела. Свойства вещества.чистые вещества и смеси, химический элемент
-
08кл Массовая доля химического элемента (общий тест)
19.12.2020 1102 0
Тестовая работа для закрепления знаний на массовою долю химического элемента в веществе.
-
Химия 10 класс.
 Проверочная работа по органической химии. Введение. Предмет органической химии
Проверочная работа по органической химии. Введение. Предмет органической химии
28.09.2021 206 0
Тест предназначен для контроля знаний в общеобразовательных классах по теме «Введение. Предмет органической химии», базовый уровень.
-
Строение атома
21.07.2021 63 0
В этом тесте вы можете проверить свои знания по теме «Строение атома». Тест состоит из 15 заданий с множественным выбором ответов. Максимальный балл — 15. Удачи!
-
Тест 1 Строение молекулы. Химическая связь: ковалентная, ионная, металлическая. Вопрос А3
23.
 05.2013
4615
05.2013
4615
Тест предложен из учебно-методического пособия для подготовки к базовому, повышенному и высокому уровню сложностей.
-
Закономерности изменения химических свойств элементов
13.06.2020 683 0
Тест предназначен для проверки понимания закономерностей Периодической системы химических элементов Д.И.Менделеева.
-
Химия 8 класс. Строение электронных оболочек атомов
27.03.2021 1331 0
Тест для текущего контроля знаний по теме «Строение электронных оболочек атомов» к учебнику О.
 С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020
С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020 -
Химия 10 класс. Алкины
08.11.2021 377 0
Тест предназначен для контроля знаний в общеобразовательных классах по теме «Алкины», базовый уровень
-
Тест по теме «Амфотерные оксиды и гидроксиды», 8 класс
21.04.2020 1092 0
Тест включает 13 вопросов разных типов. Содержание вопросов отражает состав, свойства и получение амфотерных оксидов и гидроксидов.
-
Химическое равновесие
16.
 03.2016
3407
0
03.2016
3407
0
Тест может быть применен как в индивидуальном, так и в групповом исполнении. Но в отличие от группового в индивидуальном исследовании используется еще один важный прием: просят прочесть вслух написанные ответы.
-
Классификация химических реакций
10.05.2020 191 0
Данный тест предназначен для проверки темы»Классификация химических реакций»
-
Комплексные соединения.
12.06.2020 607 0
Данный тест проверяет знания состава, номенклатуры, свойств и способов получения комплексных соединений.

-
БОХ 3 ЧАСТЬ(40-60 стр)
07.01.2022 13 0
бла бла бла бла бла бла бла бла бла бл а бальабал алб ала лба ла а аблал лбал лб албалбабблаба блал
-
Химические свойства металлов
01.11.2012 18322
Мини-тест по теме: «Химические свойства металлов», 1 вариант с ответами.
-
ЕГЭ по химии; Задание 1; 10 заданий
23.03.2017 4387 0
10 тестов по первому заданию в ЕГЭ по химии.
 Выполнение заданий типовых экзаменационных вариантов предоставляет обучающимся возможность самостоятельно подготовиться к государственной итоговой аттестации в форме ЕГЭ, а также объективно оценить уровень своей подготовки к экзамену.
►Теорию к заданию бесплатно можно найти у нас на сайте:
CHEM-MIND.com
►Таблица Менделеева и таблица растворимости как в ЕГЭ:
http://www.chem-mind.com/2017/03/20/справочный-материал-для-егэ-и-огэ/
Выполнение заданий типовых экзаменационных вариантов предоставляет обучающимся возможность самостоятельно подготовиться к государственной итоговой аттестации в форме ЕГЭ, а также объективно оценить уровень своей подготовки к экзамену.
►Теорию к заданию бесплатно можно найти у нас на сайте:
CHEM-MIND.com
►Таблица Менделеева и таблица растворимости как в ЕГЭ:
http://www.chem-mind.com/2017/03/20/справочный-материал-для-егэ-и-огэ/ -
Органическая химия 1 курс
24.11.2017 6528 0
Тест для промежуточной аттестации студентов 1 курса химических специальностей. Даны разные виды заданий
-
Химия.7 класс.1-2.Простые вещества.Валентность.
30.
 04.2019
14827
04.2019
14827
Данный тест проверяет усвоенный курс химии за 7 класс по темам «Простые вещества»,»Валентность».
-
Химическое равновесие и способы его смещения. 9 класс.
16.06.2020 505 0
Данный тест определяет знания по теме «Химическое равновесие и способы его смещения» и умение использовать правило Ле Шателье для определения направления смещения химического равновесия».
-
Ионная химическая связь
30.10.2020 775 0
Тест «Ионная связь» может быть использован для закрепления знаний по теме, для домашнего задания
-
ЕГЭ по химии; Задание 4; 10 заданий
24.
 03.2017
504
0
03.2017
504
0
10 тестов по четвертому заданию в ЕГЭ по химии. Выполнение заданий типовых экзаменационных вариантов предоставляет обучающимся возможность самостоятельно подготовиться к государственной итоговой аттестации в форме ЕГЭ, а также объективно оценить уровень своей подготовки к экзамену. ►Теорию к заданию бесплатно можно найти у нас на сайте: CHEM-MIND.com ►Таблица Менделеева и таблица растворимости как в ЕГЭ: http://www.chem-mind.com/2017/03/20/справочный-материал-для-егэ-и-огэ/
-
Итоговый тест по химии 8 класс
14.05.2019 16195 0
Данный тест поможет проверить знания ученика по химии за весь 8 класс. 25 вопросов точно определят насколько хорошо вы освоили материал. Надеюсь наша качественная подборка материалов и заданий не составит слишком больших проблем! 20 вопросов, 3 задачи и 2 определения — быстрая и качественная проверка ваших знаний.
 Желаем удачи!
Желаем удачи! -
Органическая химия (изомеры, гомологи)
03.04.2020 166 0
Тест предназначен для повторения и обобщения по теме:»Изомеры и гомологи» . Можно использовать на уроках и для подготовке к ЕГЭ по химии.
-
Строение электронных оболочек атомов элементов первых четырех периодов: s-, p- и d-элементы
12.06.2020 67 0
Тест предназначен для проверки знаний по теме «Строение электронных оболочек атомов первых четырех периодов Периодической системы химических элементов Д.И.Менделеева»
-
Символы химических элементов.
 Относительная молекулярная масса. Массовая доля.
Относительная молекулярная масса. Массовая доля.
05.12.2020 416 0
Тестовые задания для закрепления знаний и отработки первоначальных умений по курсу химии 7 класса. Задания рассчитаны для школьников, начинающих изучение химии. Выполнение теста поможет подготовиться к проверочной работе по теме «Первоначальные химические понятия».
-
Химия 10 класс. Природный газ. Алканы
11.10.2021 49 0
Тест предназначен для контроля знаний в общеобразовательных классах по теме «Природный газ. Алканы», базовый уровень.
-
Хлор. Соединения хлора
07.
 12.2021
375
0
12.2021
375
0
Тест для проверки знаний учеников 9 класса по теме «Хлор. Соединения хлора»
-
7 сынып химия
06.04.2022 337 0
Бұл жетінші сыныпқа химия пәнінен арналған тест. Үй тапсырмасын сұрау мақсатында.
-
Тест по химии №2
11.01.2013 37995
За последнее время наиболее актуальной становится такая форма проверки знаний, как тесты. Кроме того в учреждениях вводятся ЕГЭ и ГИА.Именно с этой целью я создал тест, чтобы вы проверили свой уровень знаний.
-
Тест по геологии Земли
02.
 01.2018
2429
0
01.2018
2429
0
Тест по геологии для школьников, студентов, учителей. Тест состоит из 30 вопросов. С его помощью вы можете оценить свои знания в геологиии.
-
Подготовка к ОГЭ «Строение атома» (общий тест)
03.01.2018 246 0
Темы: строение электронных оболочек атомов, закономерности изменения химических свойств элементов и их соединений, электроотрицательность, степень окисления, валентность химических элементов
-
Тест «Соли», 8 класс
19.05.2020 2504
В содержание теста включены вопросы о составе, растворимости, химических свойствах солей.
 Тест состоит из 20 вопросов разных типов.
Тест состоит из 20 вопросов разных типов. -
Химия 11 класс. Полимеры
20.10.2021 599 0
Тестовая проверочная работа для проверки знаний по теме «Полимеры» к УМК О.С. Габриелян, Химия 11 класс. Базовый уровень, М.: «Дрофа», 2016 год
-
Подготовка к ЕГЭ — вещества молекулярного и немолекулярного строения. Кристаллические решетки.
28.03.2016 1028 0
При выполнении заданий можно пользоваться черновиком. Записи в черновике не учитываются при оценивании работы. При выполнении работы используйте Периодическую систему химических элементов Д.
 И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Заголовок
И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Заголовок -
Тест по биологии и химии
19.04.2018 1764
Определение знания учащихся 11 класса по биологии и химии
-
Химия. 8 класс. Химическая связь.
29.12.2020 833 0
Тестовые задания предлагаются для проверки знаний учащихся 8 классов по химии по теме «Химическая связь»
-
Химические реакции
05.
 10.2014
7116
10.2014
7116
Тест позволит проверить ваши знания о химической кинетике, классификации химических реакций, а также ваши умения составлять ионные уравнения реакций, окислительно-восстановительный баланс, умение проводить расчет по уравнению химической реакции
-
10 задание ОГЭ. Химические свойства оксидов (15 вопросов)
25.03.2017 1805 0
Химические свойства оксидов: оснόвных, амфотерных, кислотных. Вновь открытый тест содержит другие вопросы из банка вопросов. Обязательные ответы на все вопросы.
-
Обратимые и необратимые химические реакции. Химическое равновесие. Смещение равновесия под действием различных факторов
13.
 06.2020
357
0
06.2020
357
0
Тест предназначен для проверки знаний по теме «Обратимые реакции. Смещение химического равновесия».
-
Химия. 8 класс. Кислоты. Химические свойства кислот.
22.01.2021 1153 0
Тест предлагается для проверки знаний учащихся 8 класса по теме «Кислоты. Химические свойства кислот»
Цепная реакция – роль потенциальной энергии, история, примеры и типы
В химии, физике и биологии преобладают различные типы реакций, одна из наиболее часто используемых реакций – цепная реакция. Давайте обсудим определение цепной реакции. Цепная реакция — это серия реакций, в которых реактивное вещество или побочный продукт инициирует дальнейшие реакции. Положительная обратная связь в цепной реакции вызывает самоусиливающуюся цепочку событий.
Положительная обратная связь в цепной реакции вызывает самоусиливающуюся цепочку событий.
Из вышеприведенного определения значение цепной реакции становится более понятным. Это дает нам представление о термодинамической стабильности реакции.
Например, устройство может быть неспособно достичь более низкого энергетического состояния, высвобождая энергию в окружающую среду, потому что ему мешают или не позволяют выбрать путь, который каким-то образом приведет к высвобождению энергии. Если реакция приводит к ограниченному выделению энергии, устройство обычно взрывается до того, как будет высвобождена большая часть или вся накопленная энергия.
Роль потенциальной энергии в цепной реакции
Снежный ком, вызывающий появление еще большего снежного кома до возникновения лавины, является макроскопическим термином для обозначения цепных реакций («эффект снежного кома»). Это связано с тем, что гравитационная потенциальная энергия сохраняется и находит направление высвобождения при трении. Искра, вызвавшая лесной пожар, является химическим эквивалентом снежной лавины. Один рассеянный нейтрон может вызвать быстрое критическое событие в ядерной физике, которое в конечном итоге может быть достаточно энергичным, чтобы вызвать отказ ядерного реактора или (в случае бомбы) ядерный взрыв.
Искра, вызвавшая лесной пожар, является химическим эквивалентом снежной лавины. Один рассеянный нейтрон может вызвать быстрое критическое событие в ядерной физике, которое в конечном итоге может быть достаточно энергичным, чтобы вызвать отказ ядерного реактора или (в случае бомбы) ядерный взрыв.
[Изображение будет загружено в ближайшее время]
Химия цепной реакции
Ниже приведены наиболее распространенные формы фаз цепной реакции.
Инициация (образование активных частиц или носителей цепи, часто свободных радикалов, на термической или фотохимической стадии)
Распространение (может включать множество элементарных или простых реакция образует другую реактивную частицу, которая продолжает цепь реакции, переходя на следующую элементарную или простую стадию). Кроме того, активная частица действует как катализатор всей реакции цикла распространения.
 Ниже приведены примеры особых случаев:
Ниже приведены примеры особых случаев:
Разветвление цепи — Это фаза процесса распространения, когда входит одна реактивная частица и образуются две или более.
Передача цепи (этап распространения, на котором активная частица представляет собой растущую полимерную цепь, которая вступает в реакцию с образованием неактивного полимера, рост которого прекращается, а активный малый радикал, например, представляет собой частицу, которая может реагировать с образованием нового полимера цепь
Длина цепи равна общей скорости реакции, деленной на скорость инициации, и определяется как среднее число повторений цикла распространения
Уравнения комплексной скорости дробного порядка или кинетики смешанного порядка могут использоваться в некоторых цепных реакциях.
Примеры цепных реакций
1. Образование бромида водорода из газообразного водорода и брома. Реакция H\[_{2}\] + BR\[_{2}\] → 2HBr протекает по следующему механизму:
Инициирование
Br\[_{2}\] → 2Br• (Этот шаг требует тепловой энергии)
или
Br\[_{2}\] + hv → 2Br• (Этот шаг происходит в присутствии фотонов)
каждый атом Br является свободным радикалом, обозначенным символом (• ), обозначающим неспаренный электрон.
Br• + H\[_{2}\] → HBr + H•
H• + Br\[_{2}\] → HBr + Br•
Сумма двух вышеуказанных стадий реакции соответствует общая реакция как: H\[_{2}\] + Br\[_{2}\] → 2HBr, с катализом Br•, который участвует на первой стадии и регенерируется на второй стадии. Замедление (ингибирование)
H• + HBr → H\[_{2}\] + Br•
Этот этап уникален для данного примера и соответствует обратному первому этапу распространения.
В этом случае рекомбинация двух радикалов соответствует обратному инициированию.
Термическая реакция имеет начальную скорость дробного порядка (3/2) и уравнение полной скорости с двучленным знаменателем, как показано в стационарном приближении (кинетика смешанного порядка).
2. Разветвление цепи показано в реакции 2H\[_{2}\] + O\[_{2}\] → 2H\[_{2}\]O. Распространение представляет собой двухстадийный процесс, который приводит к замене атома H другим атомом H плюс двумя радикалами OH. При определенных условиях температуры и давления это приводит к взрыву.
При определенных условиях температуры и давления это приводит к взрыву.
H + O\[_{2}\] → OH
O + H\[_{2}\] → OH + H
Стадия роста полимеризации с ростом цепи соответствует удлинению растущего полимера цепь. Передача цепи относится к передаче работы от растущей цепи, которая достигла конца своего цикла роста, к другой молекуле, которая может быть второй растущей полимерной цепью. Вышеуказанная длина кинетической цепи может варьироваться от степени полимеризации макромолекулы продукта в процессе полимеризации.
Полимеразная цепная реакция (ПЦР) представляет собой метод молекулярной биологии, в котором используется ДНК-полимераза для амплификации (создания нескольких копий) фрагмента ДНК in vitro.
3. Пиролиз ацетальдегида и уравнение скорости
Процесс Райса-Герцфельда используется в пиролизе (термическом разложении) ацетальдегида, CH\[_{3}\]CHO(g) → CH\[_{4}\ ](g) + CO(g) :
CH\[_{3}\]CHO(g) → •CH\[_{3}\](g) + •CHO(g)k1
Свободные радикалы представляют собой метильную и CHO-группы.
•СН\[_{3}\](ж) + СН\[_{3}\]СНО(ж) → СН\[_{4}\](ж) + •СН\[_{3 }\]СО(г) k2
Метан, один из двух ключевых продуктов, образуется на этой стадии реакции.
•CH\[_{3}\]CO(g) → CO(g) + •CH\[_{3}\](g) k3
Продукт предыдущего шага •CH\[_{3} \]CO(g) производит монооксид углерода (CO), который является вторым основным продуктом.
Суммарная реакция CH\[_{3}\]CHO(г) → CH\[_{4}\](г) + CO(г), катализируемая метильным радикалом •CH\[_{3} \], равно количеству двух шагов распространения.
Завершение:
•CH\[_{3}\](g) + •CH\[_{3}\](g) → C\[_{2}\]H\[_{6}\] (g) k4
Эта реакция дает только этан (второстепенный продукт) и считается последней стадией основной цепи.
В то время как этот процесс описывает основные продукты, другие, такие как ацетон (CH\[_{3}\]COCH\[_{3}\]) и пропаналь, имеют второстепенную форму (CH\[_{ 3}\]CH\[_{2}\]CHO). Закон скорости образования метана и порядок реакции были найдены с использованием приближения стационарного состояния для промежуточных частиц CH\[_{3}\](g) и CH\[_{3}\]CO(g).
Закон скорости образования метана и порядок реакции были найдены с использованием приближения стационарного состояния для промежуточных частиц CH\[_{3}\](g) и CH\[_{3}\]CO(g).
Типы цепной реакции
Цепная ядерная реакция (управляемая цепная реакция)
Лео Силард предложил цепную ядерную реакцию в 1933 году, сразу после открытия нейтрона, но более чем за пять лет до открытия ядерного деления. Сцилард был знаком с цепными химическими реакциями и недавно прочитал о демонстрации Джоном Кокрофтом и Эрнестом Уолтоном в 1932 году ядерной реакции с выделением энергии, в которой протоны высокой энергии бомбардируют литий. Теперь Сцилард предлагает, чтобы нейтроны, теоретически высвобождаемые в результате некоторых ядерных реакций в более легких изотопах, использовались для вызова дальнейших реакций с образованием нейтронов в более легких изотопах. Теоретически это приведет к цепной реакции на стадии ядра. Поскольку в то время он не знал о делении, он не думал о нем как об одной из тех реакций, производящих нейтроны.
Позже, после открытия деления в 1938 году, Сциллард понял, что деление, вызванное нейтронами, можно использовать в качестве специфической ядерной реакции, необходимой для создания цепной реакции, поскольку при делении также испускаются нейтроны. Сцилард продемонстрировал эту реакцию размножения нейтронов в уране с Энрико Ферми в 1939 году. Нейтрон плюс делящийся атом вызывают деление в этой реакции, в результате чего количество нейтронов, поглощаемых в начальной реакции, превышает количество нейтронов, поглощаемых одним. Благодаря механизму деления ядер, индуцированного нейтронами, родилась практическая цепная ядерная реакция.
Если один или несколько из испускаемых нейтронов взаимодействуют с другими делящимися ядрами, и эти ядра также делятся, есть шанс, что макроскопическая общая реакция деления не закончится, а будет продолжаться в реакционном материале. В результате цепная реакция становится саморазвивающейся и, таким образом, самоподдерживающейся. Так работают ядерные реакторы и атомные бомбы.
Так работают ядерные реакторы и атомные бомбы.
Энрико Ферми и другие продемонстрировали самоподдерживающуюся цепную ядерную реакцию в ходе успешной эксплуатации первого искусственного ядерного реактора Chicago Pile-1 в конце 19 века.42.
Электронная лавина в газах
Когда электрическое поле достигает определенного порога, между двумя несоединенными электродами в газе возникает электронная лавина. В процессе, известном как ударная ионизация, случайные тепловые столкновения атомов газа могут привести к образованию нескольких свободных электронов и положительно заряженных ионов газа. Когда эти свободные электроны ускоряются в сильном электрическом поле, они получают энергию, и эта энергия вызывает высвобождение новых свободных электронов и ионов (ионизация), что подпитывает тот же процесс. Если этот механизм происходит быстрее, чем он естественно гасится рекомбинацией ионов, новые ионы размножаются в последовательных циклах до тех пор, пока газ не распадется на плазму и ток в разряде не будет течь свободно.
Механизм пробоя диэлектрика в газах основан на электронных лавинах. Коронные разряды, стримеры, лидеры, искра или непрерывная электрическая дуга, полностью перекрывающая разрыв, — все это возможные результаты операции. Стримеры в разряде молнии распространяются путем образования электронных лавин в высоком градиенте потенциала перед продвигающимися концами стримеров, и этот механизм может распространять массивные искры. Создание фотоэлектронов, индуцированное УФ-излучением, испускаемым атомами возбужденной среды в заднем конце поля, часто усиливает лавины после их начала. Невероятно высокая температура образующейся плазмы разрушает молекулы окружающего газа, позволяя свободным ионам рекомбинироваться с образованием новых химических соединений.
Поскольку прохождение одиночной частицы может усиливаться до массивных разрядов, этот процесс можно также использовать для обнаружения излучения, инициирующего процесс. Вот как работает счетчик Гейгера, а также как можно визуализировать искровую камеру и другие проволочные камеры.
Лавинный пробой в полупроводнике
В полупроводниках, проводящих электричество в некоторой степени подобно слегка ионизированному газу, может происходить процесс лавинного пробоя. Проводимость в полупроводниках основана на свободных электронах, выбиваемых из кристалла тепловыми колебаниями. В результате, в отличие от металлов, полупроводники улучшают свою проводимость при повышении температуры. Здесь настроена такая же форма положительной обратной связи; тепло от протекающего тока вызывает повышение температуры, что увеличивает количество носителей заряда, снижает сопротивление и позволяет протекать большему току. Это может продолжаться до тех пор, пока обычное сопротивление на полупроводниковом переходе полностью не исчезнет, что приведет к отказу системы (это может быть временным или постоянным в зависимости от физического повреждения кристалла). Некоторые приборы, такие как лавинные диоды, специально используют этот эффект.
История цепной химической реакции
Макс Боденштейн, немецкий химик, впервые предложил концепцию цепной химической реакции в 1913 году. Когда две молекулы реагируют, образуются не только молекулы конечных продуктов реакции, но и некоторые нестабильные молекулы, которые гораздо более высокая вероятность реакции с исходными молекулами, чем с исходными реагентами.
Когда две молекулы реагируют, образуются не только молекулы конечных продуктов реакции, но и некоторые нестабильные молекулы, которые гораздо более высокая вероятность реакции с исходными молекулами, чем с исходными реагентами.
Чтобы понять явление квантового выхода, Вальтер Нернст предположил в 1918 году, что фотохимическая реакция между водородом и хлором является цепной реакцией. Это означает, что один фотон света приведет к образованию до 106 молекул вещества HCl. Согласно Нернсту, фотон расщепляет молекулу Cl2 на два атома Cl, каждый из которых запускает длинную цепочку реакций, приводящих к образованию HCl.
В статье 1923 года об образовании полимеров датские и голландские ученые Кристиан Кристиансен и Хендрик Энтони Крамерс указали, что цепная реакция не обязательно должна начинаться с возбуждения молекулы светом, а вместо этого может начаться с сильного столкновения двух молекул из-за тепловой энергии. как предложил Вант-Гофф для инициирования химической реакции.
Кристиансен и Крамерс также отметили, что если в одном звене реакционной цепи образуются две или более нестабильных молекулы, то реакционная цепь будет разветвляться и расширяться. Эффект имеет экспоненциальный рост, что приводит к взрывным изменениям скоростей реакций и, в некоторых случаях, к химическим взрывам. Таким образом впервые был предложен механизм химических взрывов.
Знаете ли вы?
В 1934 году советский физик Николай Семенов создал количественную теорию цепных химических реакций. В 1956 году Семенов разделил Нобелевскую премию с сэром Сирилом Норманом Хиншелвудом, который независимо сформулировал многие из одних и тех же количественных принципов.
В своей лаборатории под трибунами Стэгг-Филд в Чикагском университете Энрико Ферми, итальянец, лауреат Нобелевской премии по физике, направляет и контролирует первую цепную ядерную реакцию, открывающую ядерную эру.

4.3: Цепные реакции I — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 35459
Цели обучения
- Объяснить механизмы цепных реакций с точки зрения элементарных стадий.
- Дайте определение этим терминам: радикал, носитель цепи.
- Классифицируйте элементарные стадии как инициацию, распространение цепи, разветвление цепи, ингибирование цепи и обрыв цепи.
Цепные реакции обычно состоят из множества повторяющихся элементарных стадий, каждая из которых имеет носитель цепи. Однажды начавшись, цепные реакции продолжаются до тех пор, пока не будут исчерпаны реагенты. Пожары и взрывы — некоторые из явлений, связанных с цепными реакциями. Держатель цепи — это некоторые промежуточные продукты, которые появляются в повторяющихся элементарных шагах. Обычно это свободных радикалов .
Пожары и взрывы — некоторые из явлений, связанных с цепными реакциями. Держатель цепи — это некоторые промежуточные продукты, которые появляются в повторяющихся элементарных шагах. Обычно это свободных радикалов .
После запуска повторяющиеся элементарные шаги продолжаются до тех пор, пока не будут исчерпаны реагенты. Когда повторяющиеся шаги генерируют больше носителей цепи, они называются цепными реакциями ветвления , что приводит к взрывам. Если повторяющиеся элементарные стадии не приводят к образованию нового продукта, их называют 90–190 цепными реакциями ингибирования 90–191 . Добавление других материалов в реакционную смесь может привести к реакции ингибирования для предотвращения реакции продолжения цепи. Когда носители цепи реагируют друг с другом с образованием стабильного продукта, элементарные стадии называются реакции обрыва цепи .
Взрывы, полимеризация и порча пищевых продуктов часто связаны с цепными реакциями. Механизм цепной реакции задействован в ядерных реакторах; в этом случае носителями цепи являются нейтроны. Механизмы, описывающие цепные реакции, являются полезными моделями для описания химических реакций. Большинство химических цепных реакций имеют очень реакционноспособные промежуточные продукты, называемые 90–190 свободными радикалами 90–191. Промежуточный продукт, поддерживающий цепную реакцию, называется 9019.0 цепной носитель. Эти атомы или фрагменты обычно образуются из стабильных молекул в результате фото- или тепловой диссоциации.
Механизм цепной реакции задействован в ядерных реакторах; в этом случае носителями цепи являются нейтроны. Механизмы, описывающие цепные реакции, являются полезными моделями для описания химических реакций. Большинство химических цепных реакций имеют очень реакционноспособные промежуточные продукты, называемые 90–190 свободными радикалами 90–191. Промежуточный продукт, поддерживающий цепную реакцию, называется 9019.0 цепной носитель. Эти атомы или фрагменты обычно образуются из стабильных молекул в результате фото- или тепловой диссоциации.
Обычно свободный радикал помечается точкой рядом с символом (\(\ce{*}\)), который представляет собой нечетный электрон, присутствующий в частице. Этот нечетный электрон делает промежуточное соединение очень реактивным. Например, радикалы кислорода, хлора и этила представлены \(\ce{O*}\), \(\ce{Cl*}\) и \(\ce{C2H5*}\) соответственно. Радикалы \(\ce{Cl*}\) могут образовываться в результате реакции гомолитической фотодиссоциации:
\[\ce{Cl2 + h\nu \rightarrow Cl* + *Cl}\]
Механизм цепных реакций
Элементарные стадии, используемые для механизмов цепных реакций, можно сгруппировать в следующие категории:
- начальный этап
- шагов распространения цепочки
- ступени разветвления цепи
- шагов ингибирования цепи
- ступени завершения цепи
Например, хлорирование этана является цепной реакцией, и ее механизм объясняется следующим образом.
Если мы смешаем хлор \(\ce{Cl2}\) и этан \(\ce{Ch4Ch4}\) вместе при комнатной температуре, не будет заметной реакции. Однако, когда смесь подвергается воздействию света, реакция внезапно начинается и взрывается. Для объяснения этого предлагается следующий механизм.
Стадия инициации
Свет (\(\ce{h\nu}\)) часто можно использовать для инициации цепных реакций, поскольку они могут генерировать свободнорадикальные промежуточные соединения посредством реакции фотодиссоциации. Шаг инициации можно записать как:
\[\ce{Cl2 + h\nu \rightarrow Cl* + *Cl}\]
Этап распространения цепи
Элементарные этапы, на которых количество потребляемых свободных радикалов равно количеству образующихся свободных радикалов, называются шагов распространения цепочки. После инициирования следующие этапы развития цепи повторяются бесконечно или до тех пор, пока не будут исчерпаны реагенты:
\[\ce{Cl* +\; h4CCh4 \rightarrow Clh3CCh4 +\; H*}\]
\[\ce{Cl* +\; h4CCh4 \стрелка вправо h4CCh3* +\; HCl}\]
\[\ce{H* +\; Cl_2 \rightarrow HCl + Cl*}\]
и многие другие возможности.
На каждом из этих этапов расходуется один радикал и образуется другой радикал. Таким образом, цепные реакции продолжаются, выделяя тепло и свет. Тепло и свет вызывают образование большего количества радикалов. Таким образом, этапы развития цепи вызывают 90–190 реакций разветвления цепи 90–191 .
Стадии разветвления цепи
Реакции разветвления — это элементарные стадии, которые генерируют больше свободных радикалов, чем они потребляют. Разветвленные реакции приводят к взрыву. Например, при реакции между водородом и кислородом может протекать следующая реакция:
\[\ce{H* +\; O2 \rightarrow HO* + *O*}\]
где \(\ce{*O*}\) — ди-радикал, так как атом \(\ce{O}\) имеет электронную конфигурацию 2 S 2 2 P x 2 2 P Y 1 2 P 3 Z 99777777999999999999999999999999999999999999999999999999999999999999999999999тели 9 7777799999999999999999999999999999999999999999999999999999999999999999999979н.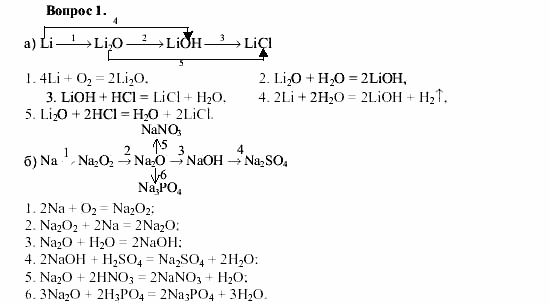 На этом элементарном этапе образуются три радикала, тогда как расходуется только один.
На этом элементарном этапе образуются три радикала, тогда как расходуется только один.
Ди-радикал может реагировать с молекулой \(\ce{h3}\) с образованием двух радикалов.
\[\ce{*O* +\, h3 \rightarrow HO* +\, H*}\]
Таким образом, совместно цепные реакции разветвления увеличивают количество носителей цепи. Реакции разветвления способствуют быстрому взрыву водородно-кислородных смесей, особенно если смеси имеют правильные пропорции.
Стадии ингибирования цепи
Стадии, не ведущие к образованию продуктов, называются реакциями ингибирования или стадиями. Например, следующие стадии представляют собой реакции ингибирования.
\[\ce{Cl* +\; Clh3CCh4 \rightarrow h4CCh3* +\; Cl2}\]
\[\ce{Cl* +\; HCl \стрелка вправо H* +\; Cl2}\]
\[\ce{H* +\; Clh3CCh4 \rightarrow h4CCh4 + Cl*}\]
Кроме того, иногда в систему может быть добавлено другое реактивное вещество \(\ce{*A}\) для уменьшения количества носителей цепи и ингибирования цепных реакций.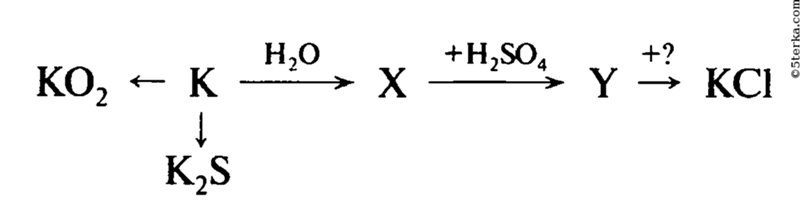
\(\ce{Cl* + *A \rightarrow ClA\: (не\: реактивный)}\)
Вид \(\ce{A*}\) часто называют поглотителем радикалов. В пищевой промышленности добавляют поглотители радикалов для предотвращения порчи из-за окисления; они называются биологическими окислителями.
Механизмы цепных реакций часто довольно сложны. При обнаружении промежуточных продуктов можно предложить разумный механизм. Добавление поглотителя радикалов для предотвращения порчи пищевых продуктов является важным применением в пищевой химии. Это приложение пришло из применения модели цепной реакции к природным явлениям.
Этапы обрыва цепи
Этапы обрыва цепи являются элементарными этапами, которые потребляют радикалы. Когда реагенты исчерпываются, свободные радикалы объединяются друг с другом, образуя стабильные молекулы (поскольку неспаренные электроны становятся парными). Эти элементарные шаги ответственны за прекращение цепных реакций:
\[\ce{Cl* + *Cl \rightarrow Cl-Cl}\]
\[\ce{H* + *H \rightarrow H-H}\]
\[\ce{H* + *Cl \rightarrow H-Cl}\]
\[\ce{h4CCh3* + *h3CCh4 \rightarrow Ch4Ch3-Ch3Ch4\: (образуя\: a\: димер)}\]
и другие возможности
В цепных реакциях производится много продукции.
Вопросы
- Является ли атом аргона \(\ce{Ar}\) свободным радикалом? (да/нет)
- Как бы вы назвали эту элементарную реакцию при хлорировании этана?
\(\ce{Cl* +\, Clh3CCh4 \rightarrow h4CCh3* +\, Cl2}\)
- начальный этап
- шаг распространения цепи
- ступенька разветвления цепи
- цепная реакция ингибирования
- ступенька окончания цепи
Навык —
Определите шаги для имен в нескольких вариантах. - Навыки —
Предсказание промежуточного продукта по природе реагентов. - Что из следующего не является реакцией продолжения цепи при хлорировании этана?
- \(\ce{Cl* +\; h4CCh4 \rightarrow Clh3CCh4 + H*}\)
- \(\ce{Cl* +\; h4CCh4 \rightarrow h4CCh3* +\; HCl}\)
- \(\ce{H* +\; Cl2 \rightarrow HCl + Cl*}\)
- \(\ce{Cl* +\; HCl \rightarrow H* +\; Cl2}\)
Растворы
- Нет, атомы аргона являются одноатомными молекулами.

Обсуждение —
Аргон существует в виде одноатомного газа. Все благородные газы имеют одноатомные молекулы. - д.
- \(\ce{Br*}\)
- д.
Обсуждение —
Реагент \(\ce{HCl}\) на стадии является продуктом общей реакции. Когда \(\ce{HCl}\) реагирует с \(\ce{Cl*}\), реакция замедляется. \(\ce{Cl*}\) атакует одну из молекул продукта \(\ce{HCl}\), вызывая обращение реакции.
Авторы и авторство
4.3: Chain Reactions I распространяется по недекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или страница
- Показать страницу TOC
- нет на странице
- Метки

Цепная реакция Определение и значение
- Основные определения
- Викторина
- Родственный контент
- Примеры
- Британский
- Культурно-медицинский
- Научный
- 20022
- Идиомы и фразы
Показывает уровень сложности слова.
Сохрани это слово!
См. синонимы слова «цепная реакция» на сайте Thesaurus.com
Показывает уровень обучения в зависимости от сложности слова.
сущ.
Физика. самоподдерживающаяся реакция, при которой при делении ядер одного поколения ядер образуются частицы, вызывающие деление по меньшей мере равного числа ядер следующего поколения.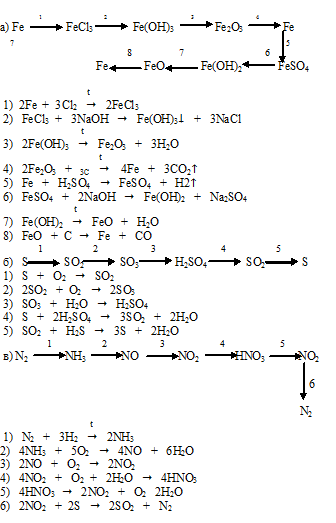
Химия. реакция, в результате которой образуется продукт, необходимый для продолжения реакции.
ряд событий, в которых каждое событие является результатом предыдущего и причиной последующего.
ВИКТОРИНА
Сыграем ли мы в «ДОЛЖЕН» ПРОТИВ. «ДОЛЖЕН» ВЫЗОВ?
Следует ли вам пройти этот тест на «должен» или «должен»? Это должно оказаться быстрым вызовом!
Вопрос 1 из 6
Какая форма обычно используется с другими глаголами для выражения намерения?
Происхождение цепной реакции
Впервые записано в 1925–30 гг. цепной выстрел, цепщик
Dictionary.com Unabridged На основе Random House Unabridged Dictionary, © Random House, Inc. 2022
Слова, относящиеся к цепной реакции
химическая реакция, порочный круг, причина и следствие, эффект домино
Как использовать цепную реакцию в предложении
Будут доступны быстрые тесты на антиген и более чувствительные тесты полимеразной цепной реакции или ПЦР.

Варианты коронавируса в Южной Африке и Великобритании обнаружены в округе Колумбия; В Мэриленде откроется третий пункт массовой вакцинации|Эрин Кокс, Джули Заузмер, Рэйчел Чейсон|11 февраля 2021 г.|Washington Post
вытер 9процентов от промышленного индекса Доу-Джонса за считанные минуты.
Безумие GameStop оставляет после себя беспорядок для регулирующих органов Уолл-стрит|Тори Ньюмайер, Дэвид Дж. Линч|3 февраля 2021 г.|Washington Post
Каждый пин может быть повторно закреплен другими пользователями, а затем обнаружен их последователей, создавая цепную реакцию активности.
SEO-гид Pinterest: восемь советов по удобным для поиска пинам|Алексей Борисевич|26 января 2021 г.|Search Engine Watch
Выбранным тестом был тест полимеразной цепной реакции, который проверяет генетический материал от SARS-CoV-2, от Curative, калифорнийского биотехнологического стартапа, который дает результаты примерно через 12 часов.
Оптимальная стратегия тестирования на Covid-19 для открытия офиса|Кэтрин Эллен Фоули|8 января 2021 г.
 |Quartz
|Quartz
Этот первоначальный тест будет использовать полимеразную цепную реакцию в реальном времени или ОТ-ПЦР для исследования мокроты образцы в поисках уникального генетического материала вируса.
Неудачная гонка CDC против covid-19: угроза недооценена и слишком сложный тест|Дэвид Уиллман|26 декабря 2020 г.|Washington Post
У нас еще не было реальной реакции фанатов, но мы скрестим пальцы .
Создатель «Лучника» Адам Рид раскрывает секреты 6-го сезона: от сюрреалистических сюжетных линий до жизни после ИГИЛ|Марлоу Стерн|8 января 2015 г.|DAILY BEAST опять комедия.
‘Галавант’: Пьяная, Похотливая Музыкальная Сказка|Мелисса Леон|5 января 2015|DAILY BEAST
Ваша общая реакция примерно такая: «Когда же эти чудики бросят все и пойдут в торговый центр ходить или что-то в этом роде?»
Самая сложная политическая викторина в мире|Джефф Гринфилд|31 декабря 2014 г.|DAILY BEAST
Вы ожидаете, что солдаты всех рангов поймут необходимость уважать субординацию, независимо от личных чувств.

Нам нужно, чтобы наша полиция была лучше, чем эта|Ник Гиллеспи|31 декабря 2014|DAILY BEAST
Джундулла и Джайш уль-Адл возникли «в ответ на такого рода притеснения», сказал он.
Опасная тайная война между Ираном и Пакистаном, финансируемая наркотиками|Умар Фарук|29 декабря 2014|DAILY BEAST
Она стояла в своей юной чистоте на одном конце цепочки лет, а миссис Чепстоу— она действительно стояла на другом?
Белла Донна|Роберт Хиченс
Пока длилась эта реакция, он отмахивался от улик и искренне считал, что преувеличивает пустяки.
Волна|Алджернон Блэквуд
Обычно диазо появляется немного раньше, чем реакция Видаля, примерно на четвертый или пятый день, но может быть и с задержкой.
Руководство по клинической диагностике|Джеймс Кэмпбелл Тодд
Затем он с щелчком захлопнул пружину, и она позволила ему еще раз продеть цепь через свою руку.
Розмари в поисках отца|C.
 Н. Уильямсон
Н. УильямсонИбо Летиция — нежная женщина, с которой он впервые познакомился, — явно испытала момент реакции.
The Wave|Algernon Blackwood
Определения цепной реакции из Британского словаря
цепная реакция
сущ. которые вызывают расщепление других ядер
химическая реакция, в которой продукт одной стадии является реагентом на следующей стадии
ряд быстро происходящих событий, каждое из которых ускоряет следующее
Collins English Dictionary — Complete & Unabridged 2012 Digital Edition © William Collins Sons & Co. Ltd., 1979, 1986 © HarperCollins Publishers 1998, 2000, 2003, 2005, 2006, 2007, 2009, 2012
Медицинские определения цепной реакции
цепная реакция
н.
Серия событий, в которых каждое вызывает следующее или влияет на него.
Ряд химических реакций, в которых один продукт реагирующего набора является реагентом в следующем наборе.
Многостадийная ядерная реакция, особенно самоподдерживающаяся серия делений, в которой высвобождение нейтронов при расщеплении одного атома приводит к расщеплению других.
Медицинский словарь Стедмана The American Heritage® Copyright © 2002, 2001, 1995, компания Houghton Mifflin. Опубликовано компанией Houghton Mifflin.
Научное определение цепной реакции
цепная реакция
Процесс, в котором результат одного события запускает другое событие, обычно того же типа, которое, в свою очередь, запускает еще одно событие, так что общая реакция имеет тенденцию быть самопроизвольной. -поддерживающий. Реакции ядерного деления представляют собой цепные реакции, в которых при расщеплении атомного ядра высвобождаются нейтроны, которые проникают в другие ядра, вызывая их расщепление. Распространение тепла через вещество также является цепной реакцией, так как быстро движущиеся молекулы в горячей части вещества сталкиваются с соседними молекулами, передавая им свою кинетическую энергию, тем самым нагревая большую часть вещества. Смотрите больше на расщеплении. См. Примечание на ядерном реакторе. См. также кинетическую теорию.
Научный словарь American Heritage®
Авторские права © 2011. Опубликовано издательством Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Опубликовано издательством Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Культурные определения цепной реакции
цепная реакция
В химии и физике самоподдерживающийся ряд реакций. Например, в цепной реакции в ядерном реакторе на основе урана один нейтрон вызывает деление ядра атома урана. При этом высвобождаются еще два-три нейтрона. Эти нейтроны начинают больше делений, которые производят больше нейтронов, и так далее.
примечания для цепной реакции
Образно говоря, любую группу событий, связанных таким образом, что одно является причиной другого, можно назвать «цепной реакцией».
Новый словарь культурной грамотности, третье издание Авторское право © 2005 г., издательство Houghton Mifflin Harcourt Publishing Company. Опубликовано издательством Houghton Mifflin Harcourt Publishing Company. Все права защищены.
Другие идиомы и фразы с цепной реакцией
цепная реакция
Ряд событий, каждое из которых влияет или приводит к следующему событию, например, если одно лицо получает существенный ущерб, подав в суд на компанию, вы можете ожидать цепочку реакцию на такие иски.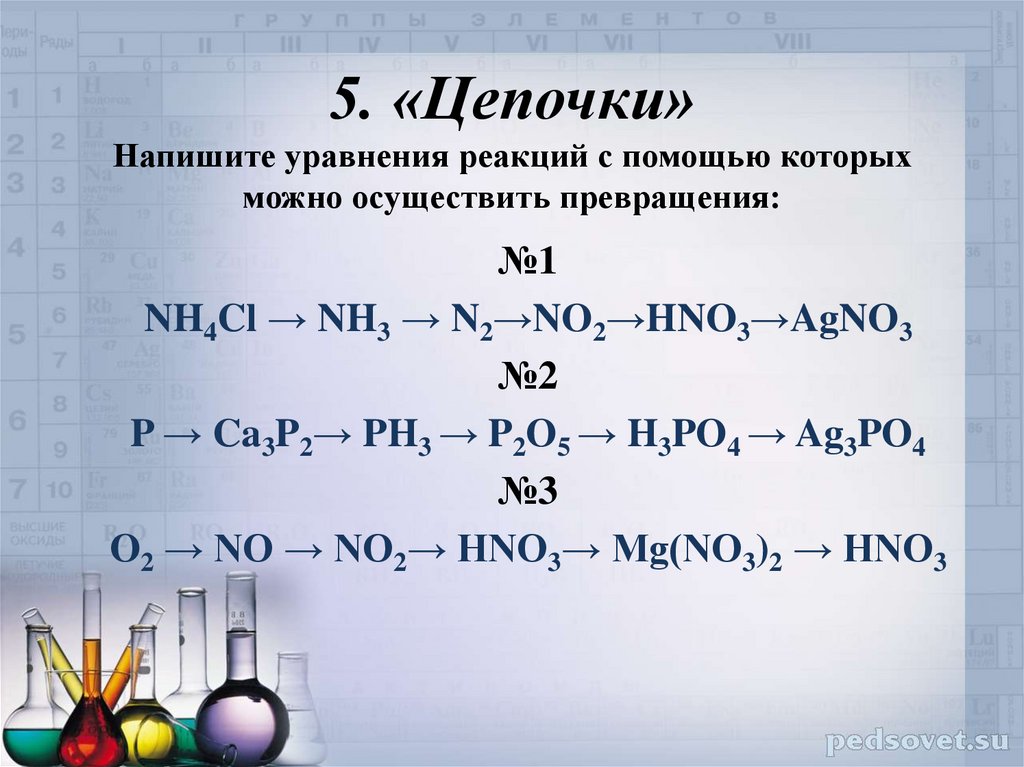

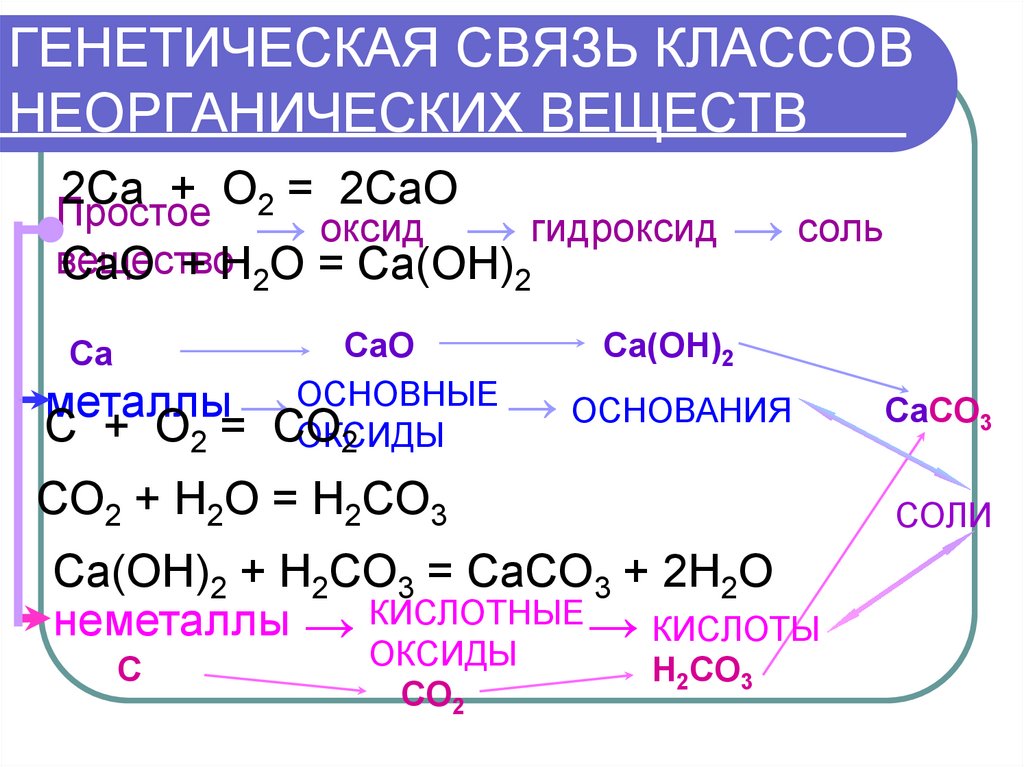 07.2021
15452
07.2021
15452
 Виды химической связи.
Виды химической связи.

 Ионные уравнения.
Ионные уравнения.
 Можно использовать при дистанционном обучении.
Можно использовать при дистанционном обучении. Алкены
Алкены

 8 класс. 1-2.Атомы. Молекулы. Вещества. Строение атома.
8 класс. 1-2.Атомы. Молекулы. Вещества. Строение атома.
 И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов. Реакции ионного обмена.
Реакции ионного обмена.
 Удачи вам, зубрята, в зубрении этой ахинеи.
Тест по предмету Материалы Аддитивного Синтеза для гр. ПИТТ-21. Второй тест.
Удачи вам, зубрята, в зубрении этой ахинеи.
Тест по предмету Материалы Аддитивного Синтеза для гр. ПИТТ-21. Второй тест. Гидролиз (тренажер)
Гидролиз (тренажер)
 10.2021
227
0
10.2021
227
0
 Химия. 8 класс. Олимпиадные задания. Задания основного типа и повышенной трудности. Тестовая часть
Химия. 8 класс. Олимпиадные задания. Задания основного типа и повышенной трудности. Тестовая часть 12.2020
8188
0
12.2020
8188
0

 Химические свойства кислот как электролитов
Химические свойства кислот как электролитов
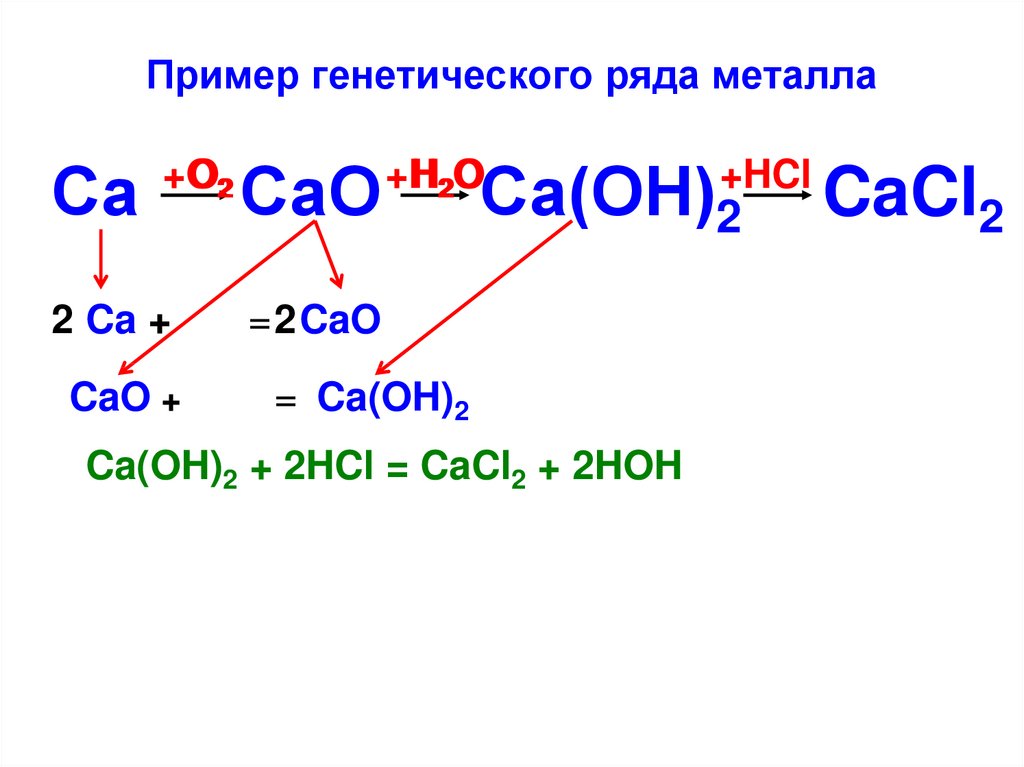 03.2016
4970
03.2016
4970
 01.2019
2865
0
01.2019
2865
0
 С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020
С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020 И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.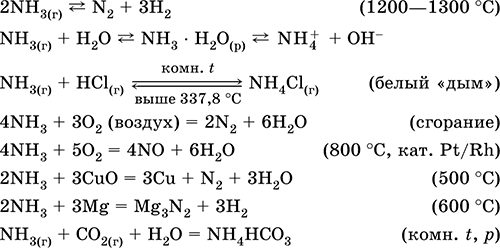 02.2021
445
0
02.2021
445
0
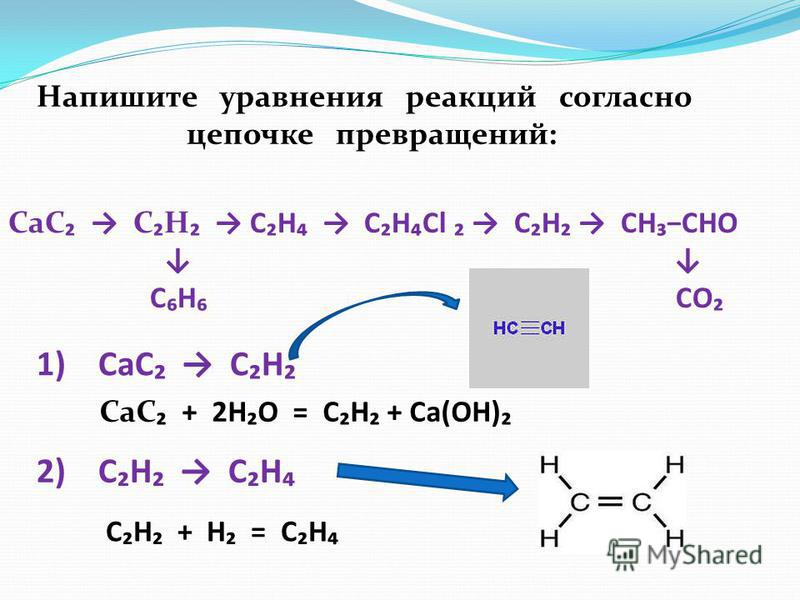 12.2020
1575
0
12.2020
1575
0
 Не предусмотрено использование результатов ВПР для оценкидеятельности общеобразовательных организаций, учителей, муниципальныхи региональных органов исполнительной власти, осуществляющихгосударственное управление в сфере образования.
Не предусмотрено использование результатов ВПР для оценкидеятельности общеобразовательных организаций, учителей, муниципальныхи региональных органов исполнительной власти, осуществляющихгосударственное управление в сфере образования. 02.2020
4128
0
02.2020
4128
0
 Проверочная работа по органической химии. Введение. Предмет органической химии
Проверочная работа по органической химии. Введение. Предмет органической химии
 05.2013
4615
05.2013
4615
 С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020
С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 8 класс, М.: Просвещение, 2020 03.2016
3407
0
03.2016
3407
0
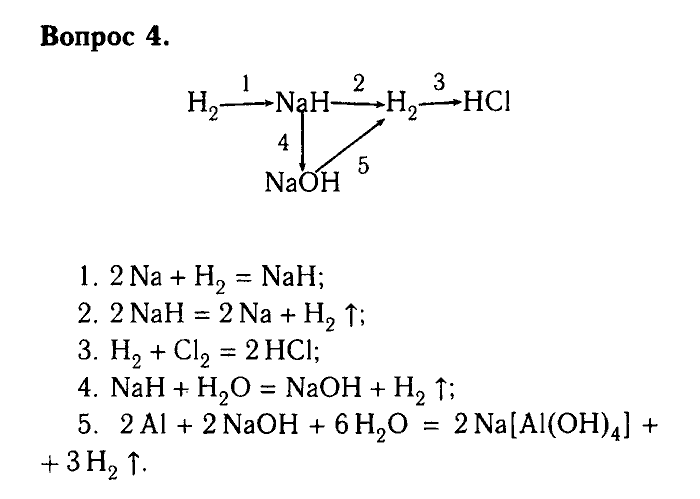
 Выполнение заданий типовых экзаменационных вариантов предоставляет обучающимся возможность самостоятельно подготовиться к государственной итоговой аттестации в форме ЕГЭ, а также объективно оценить уровень своей подготовки к экзамену.
►Теорию к заданию бесплатно можно найти у нас на сайте:
CHEM-MIND.com
►Таблица Менделеева и таблица растворимости как в ЕГЭ:
http://www.chem-mind.com/2017/03/20/справочный-материал-для-егэ-и-огэ/
Выполнение заданий типовых экзаменационных вариантов предоставляет обучающимся возможность самостоятельно подготовиться к государственной итоговой аттестации в форме ЕГЭ, а также объективно оценить уровень своей подготовки к экзамену.
►Теорию к заданию бесплатно можно найти у нас на сайте:
CHEM-MIND.com
►Таблица Менделеева и таблица растворимости как в ЕГЭ:
http://www.chem-mind.com/2017/03/20/справочный-материал-для-егэ-и-огэ/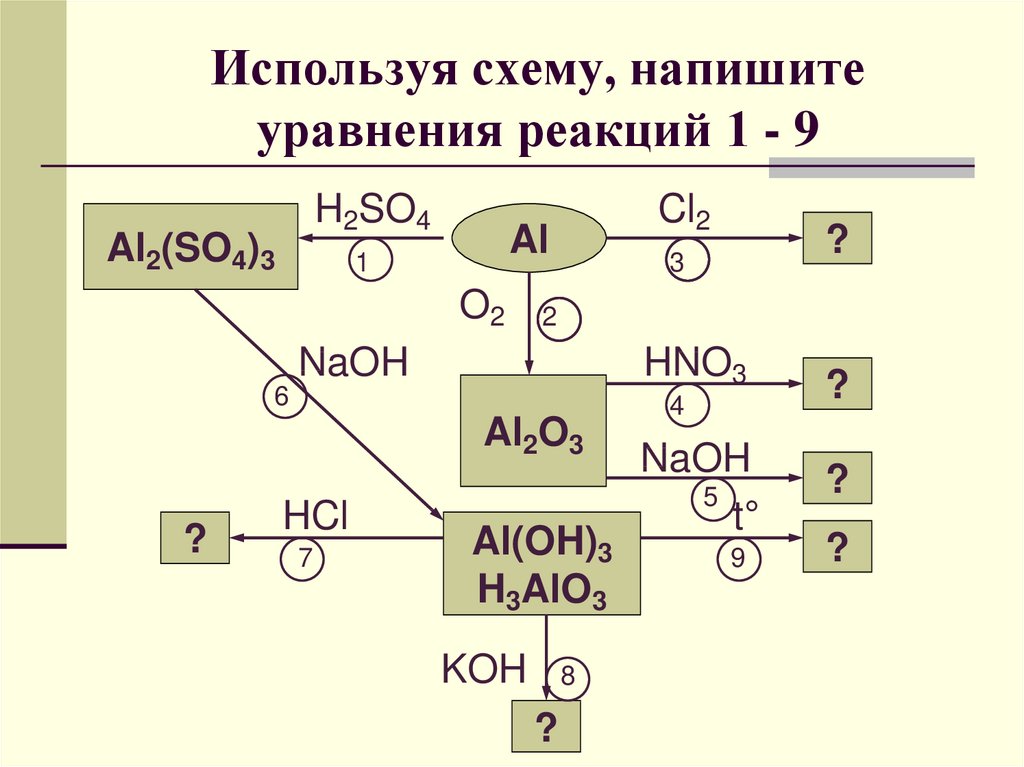 04.2019
14827
04.2019
14827
 03.2017
504
0
03.2017
504
0
 Желаем удачи!
Желаем удачи! Относительная молекулярная масса. Массовая доля.
Относительная молекулярная масса. Массовая доля.
 12.2021
375
0
12.2021
375
0
 01.2018
2429
0
01.2018
2429
0
 Тест состоит из 20 вопросов разных типов.
Тест состоит из 20 вопросов разных типов.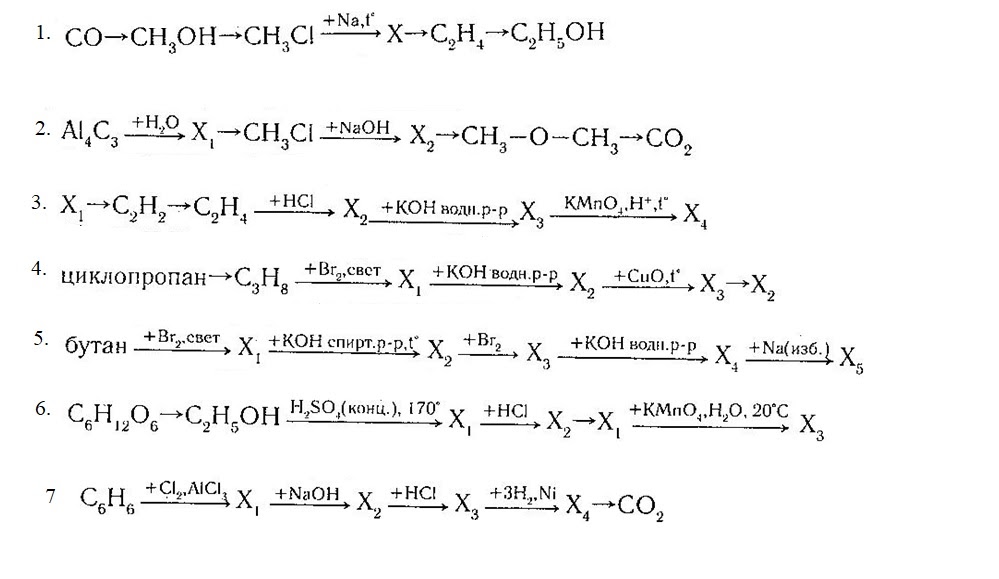 И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Заголовок
И. Менделеева; таблицу растворимости солей, кислот и оснований в воде; электрохимический ряд напряжений металлов. Эти сопроводительные материалы прилагаются к тексту работы. Для вычислений используйте непрограммируемый калькулятор. Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Заголовок 10.2014
7116
10.2014
7116
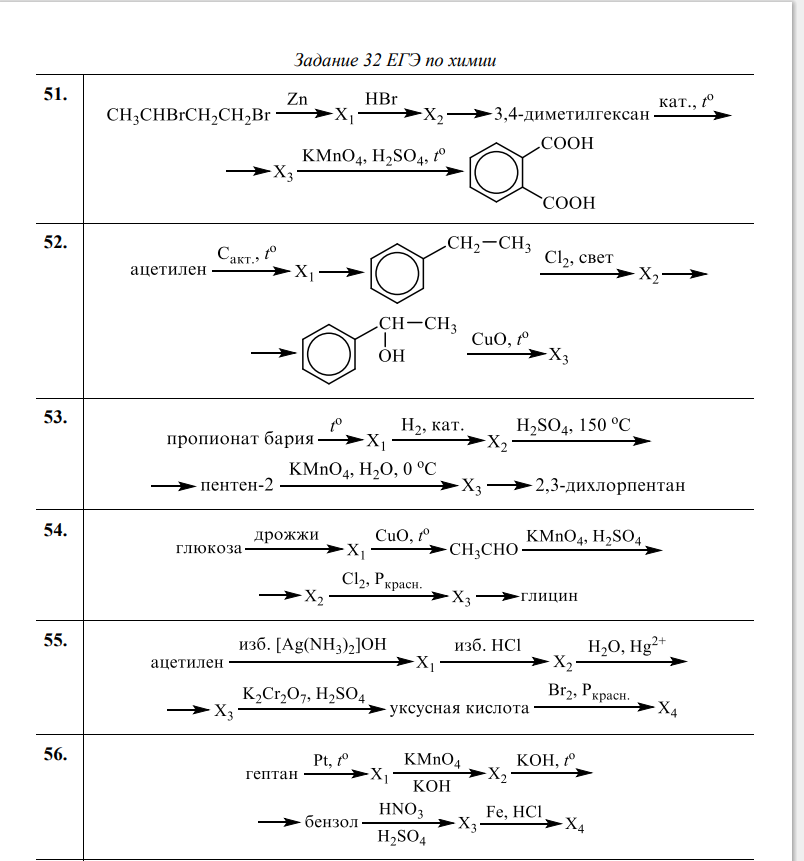 06.2020
357
0
06.2020
357
0
 Ниже приведены примеры особых случаев:
Ниже приведены примеры особых случаев: 


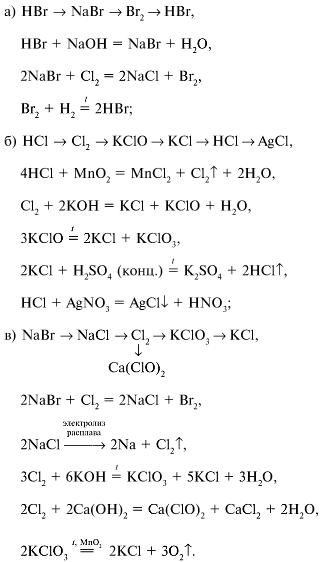
 |Quartz
|Quartz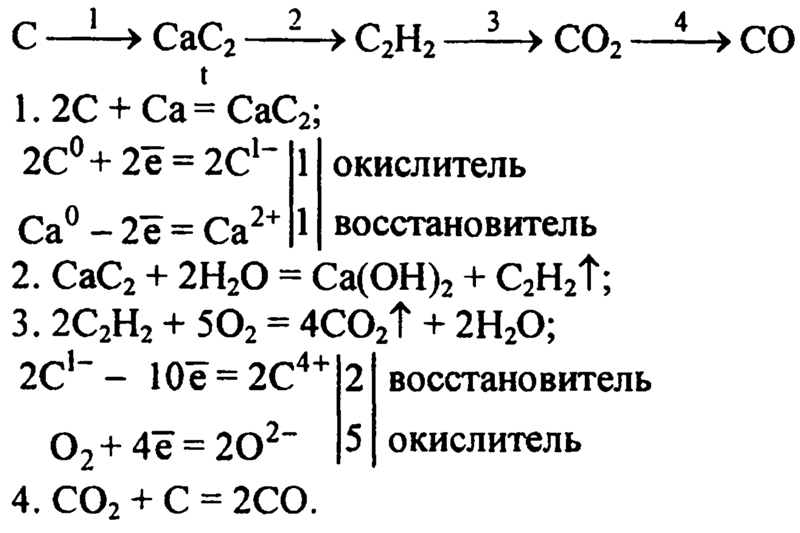
 Н. Уильямсон
Н. Уильямсон