Решение задач «Моль, молярная масса, молярный объем» | Тест по химии (8 класс) по теме:
Решение задач «Моль, молярная масса, молярный объем»
Вариант 1.
1. Какой объем будет занимать 0,5 моль водорода
1) 11,2 л | 2) 22,4 л | 3) 5,6 л | 4) 13,5 л |
2. Какой объем будет занимать 6 грамм водорода
1) 22,4 л | 2) 44,8 л | 3) 67,2л | 4) 56 л |
3. Дано 1,5 ∙ 10 23 молекул кислорода, какой объем будут занимать данные молекулы
1) 2,24 л | 2) 5,6 л | 3) 3,36 л | 4) 1,12 л |
4. Сколько моль вещества находится в 224 л водорода
1) 10 моль | 2) 8 моль | 3) 5 моль | 4) 6 моль |
5. Сколько весит 5,6 литров азота
Сколько весит 5,6 литров азота
1) 14 грамм | 2) 7 грамм | 3) 35 грамм | 4) 28 грамм |
6.Какую массу будут составлять 3 ∙ 10 23 молекул SiО2
1) 60 грамм | 2) 30 грамм | 3) 15 грамм | 4) 40 грамм |
7.Сколько грамм воды образуется, если прореагировало 5 моль кислорода
Н2 + О2 → Н2O
1) 90 гр | 2) 180 гр | 3) 60 гр | 4) 240 гр |
8.Сколько литров кислорода необходимо для получения 1 моль оксида алюминия.
АL + О2 → АL2О3
1) 33,6 | 2) 22,4 | 3) 56 | 4) 44,8 |
9. Сколько литров углекислого газа выделится при полном разложении 25 гр СаСО3
Сколько литров углекислого газа выделится при полном разложении 25 гр СаСО3
СаСО3 → СаО + СО2
1) 44,8 | 2) 22,4 | 3) 5,6 | 4) 11,2 |
———————————————————————————————————————
Решение задач «Моль, молярная масса, молярный объем»
Вариант 2.
1.Какой объем будет занимать 1,5 моль кислорода
1) 11,2 л | 2) 22,4 л | 3) 33,6 л | 4) 44,8 л |
2. Какой объем будет занимать 8 грамм кислорода
1) 56л | 2) 22,4л | 3) 5,6л | 4) 11,2л |
3. Дано 15 ∙ 10 23 молекул хлора, какой объем будут занимать данные молекулы
1) 5,6 л | 2) 56 л | 3) 22,4 л | 4) 11,2 л |
4. Сколько моль вещества находится в 5,6 литров кислорода
Сколько моль вещества находится в 5,6 литров кислорода
1) 1 моль | 2) 0,5 моль | 3) 0,25 моль | 4) 0,125 моль |
5.Сколько весит 16,8 л метана СН4
1) 16 грамм | 2) 20 грамм | 3) 12 грамм | 4) 8 грамм |
6.Какую массу будут составлять 9 ∙ 10 23 молекул СО2
1) 22 грамма | 2) 44 грамм | 3) 66 грамм | 4) 11 грамм |
7.Сколько грамм сульфида железа образуется, если полностью прореагирует 2 моль серы
Fе + S → Fе S
1) 88 | 2) 44 | 3) 176 | 4) 134 |
8.Сколько литров водорода выделится, если прореагирует 3 моль хлороводорода.
Zn + НСL → ZnСL2 + Н2
1) 44,8 | 2) 22,4 | 3) 33,6 | 4) 11,2 |
9.Сколько литров водорода выделится при полном разложении 45 гр воды
Н2O → Н2 + О2
1) 44,8 | 2) 56 | 3) 22,4 | 4) 33,6 |
Решение задач «Моль, молярная масса, молярный объем»
Вариант 3.
1. Какой объем будет занимать 0,1 моль хлора
1) 5,6 | 2) 2,24 | 3) 22,4 | 4) 33,6 |
2. Какой объем будет занимать 35 грамм азота
1) 22,4 л | 2) 11,2 л | 3) 28 л | 4) 33,6 л |
3. Дано 3 ∙ 10 23 молекул азота, какой объем будут занимать данные молекулы
1) 11,2л | 2) 22,4 л | 3) 56 л | 4) 16,8 л |
4. Сколько моль вещества находится в объеме 2,8 литра хлора
Сколько моль вещества находится в объеме 2,8 литра хлора
1) 0,25моль | 2) 0,5 моль | 3) 0,125 моль | 4) 0,1 моль |
5.Сколько весит 67,2 литров водорода
1) 4 грамм | 2) 6 грамм | 3) 8 грамм | 4) 10 грамм |
6. Какую массу будут составлять 15 ∙ 10 23 молекул СО
1) 28грамма | 2) 70 грамм | 3) 35 грамм | 4) 42 грамм |
7. Сколько грамм оксида кальция образуется при полном сгорании 0,5 моль кальция
Са + О2 → СаО
1) 56 | 2) 28 | 3) 14 | 4) 46 |
8. Сколько литров водорода необходимо для получения 4 моль НВr.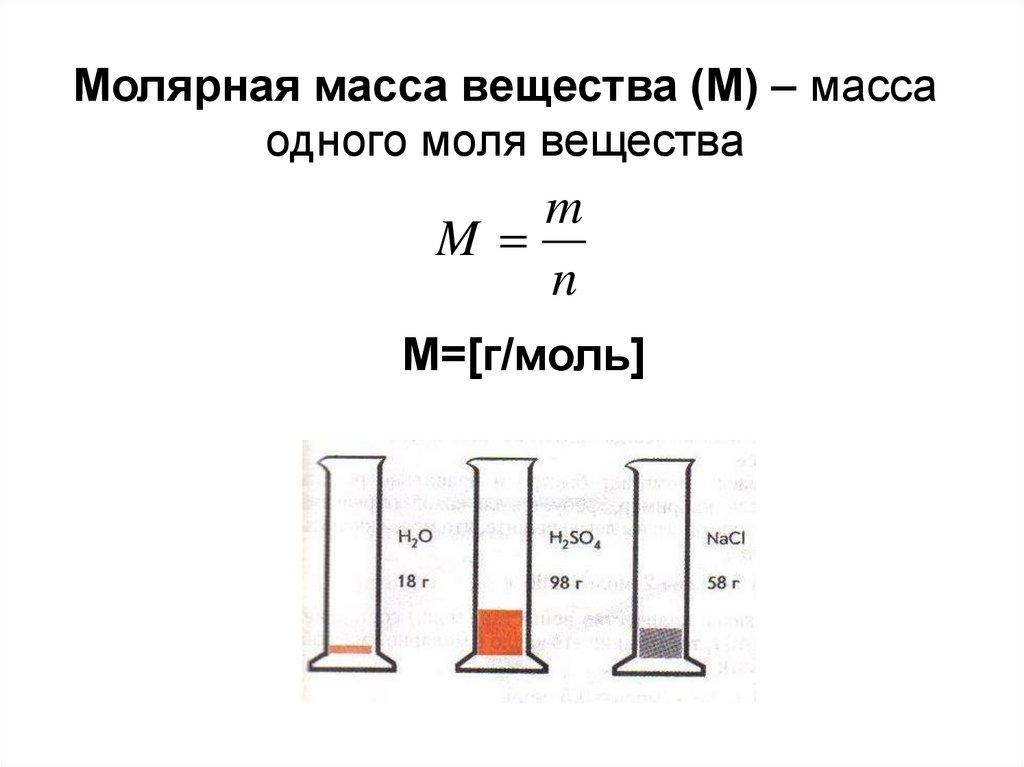
Н2 + Вr2 → НВr
1) 44,8 | 2) 33,6 | 3) 67,2 | 4) 56 |
9.Сколько литров водорода выделится при полном взаимодействии 69 гр натрия
Nа + Н2O → NаОН + Н2
1) 22,4 | 2) 56 | 3) 33,6 | 4) 22,4 |
________________________________________________________________________
Решение задач «Моль, молярная масса, молярный объем»
Вариант 4.
1. Какой объем будет занимать 2 моль углекислого газа
1) 22,4 л | 2) 44,8 л | 3) 67,2л | 4) 56 л |
2. Какой объем будет занимать 35 грамм хлора
1) 22,4 л | 2) 11,2 л | 3) 5,6 л | 4) 33,6 л |
3. Дано 9 ∙ 10 23 молекул азота, какой объем будут занимать данные молекулы
Дано 9 ∙ 10 23 молекул азота, какой объем будут занимать данные молекулы
1) 11,2л | 2) 22,4 л | 3) 33,6л | 4) 44,8 л |
4. Сколько моль вещества находится в объеме 16,8 литров
1) 1 моль | 2) 1,125 моль | 3) 1,5 моль | 4) 0,75 моль |
5.Сколько весит 5,6 литров кислорода
1) 18 грамм | 2) 8 грамм | 3) 16 грамм | 4) 20 грамм |
6.Какую массу будут составлять 6 ∙ 10 23 молекул NО
1) 30 грамм | 2) 15 грамм | 3) 45 грамм | 4) 60 грамм |
7. Сколько грамм оксида натрия образуется при полном взаимодействии 2 моль натрия
Nа + О2 → Nа2 О
1) 62 | 2) 31 | 3) 93 | 4) 54 |
8. Сколько литров кислорода необходимо для получения 3 моль СО.
Сколько литров кислорода необходимо для получения 3 моль СО.
С + О2 → СО
1) 56 | 2) 44,8 | 3) 33,6 | 4) 22,4 |
9.Сколько литров углекислого газа образуется при разложении 93 гр Н2СО3
Н2СО3 → Н2O + СО2
1) 67,2 | 2) 56 | 3) 44,8 | 4) 33,6 |
Молярная масса. Молярный объём. Решение задач 8 класс онлайн-подготовка на Ростелеком Лицей
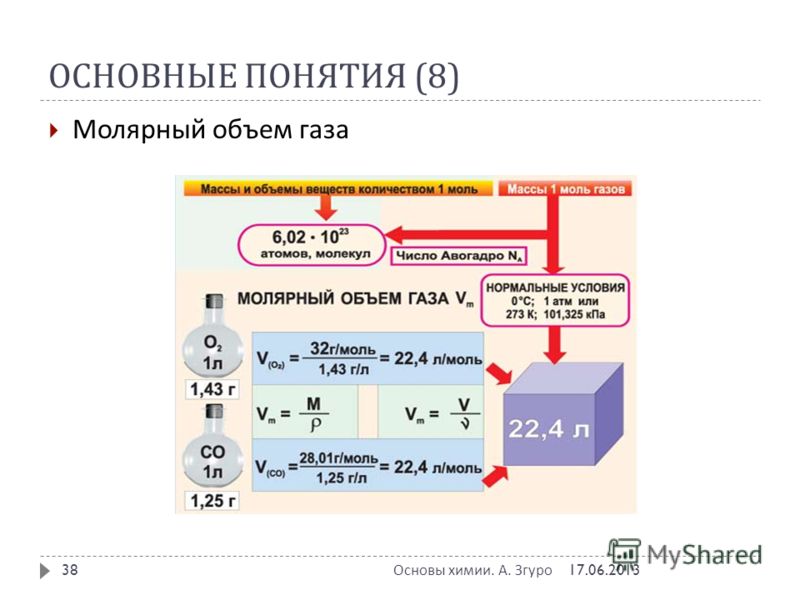
Количество вещества и молярная масса
В процессе химических реакций атомы (или молекулы) вещества друг с другом взаимодействуют, образуя новые молекулы. Но определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооруженным глазом. Для определения числа структурных частиц вещества в химии применяют особую величину – количество вещества (n – «эн»).
Единицей количества вещества является моль (от слова «молекула»).
1 моль любого вещества содержит 6,02·1023 частиц (например, молекул). Это число называют числом Авогадро.
Постоянная Авогадро: Nа = 6,02·1023 1/моль.
Используя постоянную Авогадро, можно находить количество вещества, если известно число молекул в нем, и наоборот. Количество вещества равно отношению общего числа его молекул к постоянной Авогадро.
В равных количествах веществ содержится равное число их структурных частиц (например, молекул).
Установлено, что масса одного моля вещества численно равна его относительной молекулярной массе. Такая величина называется молярной массой вещества, М. Молярная масса измеряется в г/моль. Например, молярная масса азота N2 равна 28 г/моль.
Количество вещества можно вычислить, разделив массу порции вещества на молярную массу этого вещества: n = m/М.
Задача 1
Условие. Какое количество оксида кальция содержится в 112 г этого вещества?
Дано:
m (СаО ) = 112г
Найти:
n (СаО) – ?
Решение.
Химическая формула оксида кальция – СаО.
n (CaO) = m(CaO) / М(СаО)
Mr (CaO) = 40 + 16 = 56
n (CaO) = 112 г / (56г/моль) = 2 моль
Ответ: 2 моль СаО.
Задача 2
Условие. Вычислите массу порции воды, в которой содержится столько же молекул, сколько их в 22 г углекислого газа.
Дано:
m(CO2) = 22 г
n(CO2) = n(H2O)
Найти:
m(H2O) – ?
Алгоритм решения
Зная массу углекислого газа, рассчитывают его количество. Затем находят количество воды (оно будет равно количеству углекислого газа). А потом, зная количество воды, вычисляют ее массу:
m(CO2) → n(CO2) → n(H2O) → m(H2O)
Решение
1. n(CO2) = m(CO2)/М(СО2)
n(CO2) = m(CO2)/М(СО2)
Mr(CO2) = 12 + 16·2 = 44
n(CO2) = 22 г/44 г/моль = 0,5 моль
2. n(H2O) = n(CO2) = 0,5 моль
3. m(H2O) = n(H2O)·M(H2O)
Mr(H2O) = 1·2+16 = 18
m(H2O) = 0,5 моль·18 г/моль = 9 г
Ответ: 9 г Н2О.
Молярный объем
В 1811 году итальянский ученый Амедео Авогадро (рис. 1) сформулировал основной газовый закон, который назвали его именем. Закон Авогадро звучит так:
В равных объемах газов при одинаковых условиях содержится равное число молекул.
Следовательно, при одинаковых условиях равные количества различных газов занимают равные объемы.
При нормальных условиях (при температуре 0 °С и давлении 1 атм.) 1 моль любого газа занимает объем 22,4 л. Эта физическая постоянная – молярный объем газа при н. у.:
у.:
Vm = 22,4 л/моль при нормальных условиях.
Количество газообразного вещества равно отношению объема порции газа к молярному объему газа при данных условиях.
Рис. 1. Амедео Авогадро (1776–1856)
Задача 3
Условие. Вычислите массу метана СН4, объем которого при н. у. составляет 67,2 л.
Дано:
V(CН4) = 67,2 л
Найти:
m(CН4) – ?
Решение.
Алгоритм решения
V(CН4) → n(CН4) → m(CН4)
1) n(CН4) = V(CН4)/Vn = 67,2 л/ 22,4 (л/моль) = 3 моль
2) m(CН4) = n(CН4)·M(CН4)
Mr(CН4) = 12 + 1·4 =16
m(CН4) = 3 моль·16 г/моль = 48 г
Ответ: 48 г CН4.
Подведение итогов урока
В ходе урока вы узнали, что такое молярная масса и молярный объем вещества и как использовать эти понятия при решении расчетных задач.
Список литературы
- Оржековский П. А. Химия: 8 класс: учеб для общеобр. учрежд. / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. (§15)
- Рудзитис Г. Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§17)
- Хомченко И. Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с. 10)
- Энциклопедия для детей. Том 17. Химия / Глав. ред. В. А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
- Интернет-портал «hemi.nsu.ru» (Источник)
- Интернет-портал «hemi.nsu.ru» (Источник)
- Интернет-портал «alhimikov.net» (Источник)
- Интернет-портал «cde.osu.ru» (Источник)
Домашнее задание
- с.
 86 №№ 3–5 из учебника П. А. Оржековского «Химия: 8 класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
86 №№ 3–5 из учебника П. А. Оржековского «Химия: 8 класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013. - Какой объем при н. у. займут 5 моль кислорода О2?
- Какая масса соответствует 3,36 л (н. у.) хлора Cl2?
Расчет молярного объема газа Учебное пособие по химии
Расчет молярного объема газа Учебное пособие по химииКлючевые понятия
- 1 моль идеального газа (1) занимает определенный объем при определенной температуре и давлении.
- Это называется молярным объемом газа и обозначается символом V м
- Единицы, наиболее часто используемые для молярного объема газа, V m , литров на моль, л моль -1
- Примеры молярного объема для идеальных газов (V м ) приведены в таблице ниже:
Температура Давление Молярный объем газа °С (К) кПа (атм) (В м )/л моль -1 0°C (273,15K) 100 кПа (0,987 атм) 22,71 25°C (298,15 К) 100 кПа (0,987 атм) 24,79 0 ° C (273,15 K) и 100 кПа (0,987 атм) известны как стандартные температура и давление и часто обозначаются аббревиатурой STP 9.

25°C (298,15 K) и 100 кПа (0,987 атм) иногда называют стандартной температурой и давлением окружающей среды, SATP, или даже стандартными лабораторными условиями, SLC. (3)
- Расчеты с молярными объемами газа:
n (газ) = моли идеального газа
V(газ) = объем идеального газа (при определенной температуре и давлении)
В м = молярный объем идеального газа (при определенной температуре и давлении)
Для расчета молей газа: н(газ) = В (газ)
В мДля расчета объема газа: В(газ) = н(газ) × В м
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Молярный объем газа (V
м ) Концепция Молярный объем идеального газа, V м , равен , определяемому как объем 1 моля идеального газа при заданных температуре и давлении.
Молярный объем газа, В м , следовательно, представляет собой объем газа на моль газа, поэтому единицы молярного объема газа:
единица объема/моль
или
единица объема ÷ моль
Метрическая единица (4) для объема – это литр, л, поэтому молярный объем газа равен объему в л ÷ моль
| В м дюйм л моль -1 | = | объем газа в литрах 1 моль газа | (при указанной температуре и давлении) |
Мы можем использовать это соотношение для молярного объема идеального газа (V м ), чтобы написать уравнение для объема (V в литрах) любого количества газа (n в молях)
| В м дюйм л моль -1 | = | объем газа в литрах количество газа в молях | (при указанной температуре и давлении) |
| В м дюйм л моль -1 | = | V (л) n (моль) | (при указанной температуре и давлении) |
Чтобы использовать это соотношение, нам нужно знать V m .
Ниже приведен список некоторых способов описания условий, при которых V м составляет 22,71 л.
В м = 22,71 л моль -1 при 0°C и 100 кПа
В м = 22,71 л моль -1 при 273,15 К и 100 кПа
В м = 22,71 л моль -1 при стандартной температуре и давлении
В м = 22,71 л моль -1 при нормальных условиях
Когда В м = 22,71 л·моль -1 , соотношение между объемом газа V (л) и количеством газа n (моль) становится следующим:
| В м дюйм л моль -1 | = | V (л) n (моль) | (на СТП) | |
| 22,71 л моль -1 | = | V (л) n (моль) | (на СТП) |
Это математическое уравнение можно изменить, чтобы найти объем известного количества газа, умножив обе части уравнения на количество газа в молях, n (моль),
| n ( | = | В (л) × | (на СТП) | |
| n × 22,71 | = | В (Д) | (на СТП) |
Это соотношение показывает нам, что если мы увеличим количество молей газа n, добавив больше газа при сохранении той же температуры и давления, объем газа V также увеличится.
Аналогичным образом, если мы уменьшим количество молей газа n, удалив часть газа при сохранении той же температуры и давления, объем газа V также уменьшится.
Вышеприведенное математическое уравнение можно преобразовать, чтобы найти количество газа в молях, учитывая его объем в литрах, путем деления обеих частей уравнения на молярный объем газа (22,71 л моль -1 при нормальных условиях),
| n (моль) × | = | В ( 22,71 ( | (на СТП) | ||
| н (моль) | = | В 22,71 | (на СТП) | ||
Это соотношение показывает нам, что единственный способ увеличить объем газа V при сохранении той же температуры и давления — это увеличить количество молей газа n, которые присутствуют, то есть добавить больше газа.
Точно так же единственный способ уменьшить объем газа V при сохранении той же температуры и давления — это уменьшить количество молей газа n, которые присутствуют, то есть удалить часть газа.
Рабочие примеры расчета молей газа с использованием молярного объема газа
Рабочий пример 1. Образец чистого газообразного гелия занимает объем 6,8 л при 0°C и 100 кПа.
Сколько молей газообразного гелия содержится в образце?
- Какой вопрос просит вас сделать?
Рассчитайте количество молей газообразного гелия.
n(He (g) ) = моли газообразного гелия = ? моль
- Какая информация (данные) была дана в вопросе?
V (He (g) ) = объем газообразного гелия = 6,8 л.
Условия: STP (стандартная температура и давление, 0°C и 100 кПа)
So V м = молярный объем газа = 22,71 л моль -1 (имеется в паспорте)
- Проверить согласованность в единицах, все тома в одних и тех же единицах?
В(Не (г)
) дается в лВ м дается в л (моль -1 )
Оба объема выражены в одних и тех же единицах измерения, л, поэтому преобразование не требуется.

- Какая связь между молями газообразного гелия и объемом газообразного гелия при заданных температуре и давлении?
н(Не (г) ) (моль) = В(Не (г) )
В м - Подставьте значения в уравнение и решите моли газообразного гелия:
n(He (г) ) (моль) = 6,8
22,71= 0,30 моль (на СТП)
Рабочий пример 2: Образец газообразного азота N 2(g) имеет объем 956 мл при 273,15 К и 100 кПа.
Сколько молей газообразного азота содержится в образце?
- Какой вопрос просит вас сделать?
Рассчитайте количество молей газообразного азота.
n(N 2(g) ) = моли газообразного азота = ? моль
- Какая информация была дана в вопросе?
V(N 2(g) ) = объем газообразного азота = 956 мл
Условия: 273,15 К и 100 кПа (стандартная температура и давление, STP)
So, V м = молярный объем газа = 22,71 л моль -1 (имеется в паспорте)
- Проверить согласованность в единицах, все тома в одних и тех же единицах?
V(N 2(g) ) дается в мл
В м дается в л (моль -1 )
Переведите объем газа, V(N 2(g) ), из объема в миллилитрах, мл, в объем в литрах, л.
V(N 2(g) ) = 956 мл = 956 мл ÷ 1000 мл л -1 = 956 × 10 -3 л = 0,956 л
- Какая связь между молями газообразного азота и объемом газообразного азота при заданной температуре и давлении?
n(N 2(г) ) (моль) = В(N 2(г) )
В м - Подставьте значения в уравнение и решите для молей газообразного азота:
n(N 2(г) ) (моль) = 0,956
22,71(на СТП) = 0,0421 моль (на СТП)
Рабочие примеры расчета объема газа с использованием молярного объема газа
Рабочий пример 1. Баллон содержит 0,50 моль чистого газообразного гелия при стандартной температуре и давлении.
Баллон содержит 0,50 моль чистого газообразного гелия при стандартной температуре и давлении.
Каков объем воздушного шара?
- Какой вопрос просит вас сделать?
Рассчитайте объем газообразного гелия в баллоне.
В(Не (г) ) = объем газообразного гелия = ? л
- Какая информация (данные) была дана в вопросе?
н (Не (г) ) = моли газообразного гелия = 0,50 моль
Условия: стандартная температура и давление (STP, 0°C и 100 кПа)
So V м = молярный объем газа = 22,71 л моль -1
- Согласованы ли единицы измерения?
n(He (g) ) в молях
В м в молях на литр
Таким образом, единицы измерениясогласованы и не требуют преобразования.
- Каково соотношение между объемом газообразного гелия V(He (г) ) и молями газообразного гелия n(He (г) ) при заданных температуре и давлении?
В(Не (г) ) = n(He (г) ) × V м
- Подставить значения и найти объем газообразного гелия:
V(He (г) ) = n(He (г) ) × 22,71 (при СТП)
= 0,50 × 22,71
= 11,4 л
Рабочий пример 2. Какой объем занимают 3,70 моля N 2 газ на СТП?
Какой объем занимают 3,70 моля N 2 газ на СТП?
- Какой вопрос просит вас сделать?
Рассчитайте объем газа N 2 .
V(N 2(g) ) = объем газа N 2 = ? л
- Какая информация (данные) была дана в вопросе?
n(N 2(г) ) = моли газа N 2 = 3,70 моль
9Условия 0022: STP (стандартная температура и давление, 0°C и 100 кПа)So, V м = молярный объем газа = 22,71 л моль -1 (имеется в паспорте)
- Согласованы ли единицы измерения?
количество N 2(г) газа, n(N 2(г) ), указано в молях
молярный объем газа, V м дано в молях на литр
Единицы согласованы, поэтому преобразование не требуется.
- Какая связь между объемом газа N 2 , V(N 2(г) ), и молями газа N 2 , n(N 2(г) ), при заданной температуре и давление?
V(N 2(g) ) = n(N 2(g) ) × V м
- Подставьте значения и найдите объем газообразного азота:
V(N 2(g) ) = n(N 2(g) ) × 22,71 (при НТП)
= 3,70 × 22,71
= 84,0 л
Решение задач с использованием молярного объема газа
Проблема: Химик Крис работает в лаборатории, в которой поддерживается постоянная температура 25°C, а давление всегда равно 100 кПа. Крису нужно проанализировать немного карбоната кальция, CaCO 3 (s), чтобы определить, является ли он чистым или загрязненным.
Крис проанализирует карбонат кальция, взяв небольшой образец 0,00500 моль и добавляя к нему соляную кислоту, HCl (водн.), до тех пор, пока весь карбонат кальция не исчезнет и больше не будет образовываться углекислый газ, CO 2 (г).
По мере добычи газ будет собираться водовытесняющим методом.
Крису нужно проанализировать немного карбоната кальция, CaCO 3 (s), чтобы определить, является ли он чистым или загрязненным.
Крис проанализирует карбонат кальция, взяв небольшой образец 0,00500 моль и добавляя к нему соляную кислоту, HCl (водн.), до тех пор, пока весь карбонат кальция не исчезнет и больше не будет образовываться углекислый газ, CO 2 (г).
По мере добычи газ будет собираться водовытесняющим методом.
Известно, что сбалансированное химическое уравнение этой реакции выглядит следующим образом:
CaCO 3 (т) + 2HCl(водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O(л)
Если образец чистый, какой объем углекислого газа будет собран?
Решение проблемы с использованием модели StoPGoPS для решения проблемы:
| Сформулируйте вопрос. | Какой вопрос просит вас сделать? Определите объем углекислого газа, если карбонат кальция чистый. V(CO 2(g) ) = объем углекислого газа = ? л | |
| План. | Какой химический принцип вам нужно применить? Применение стехиометрии (V (г) = n (г) × V м ) Какую информацию (данные) вам предоставили? Какие шаги необходимо предпринять для решения проблемы? Этап 1: Расчет количества молей углекислого газа CO 2 (г), произведенного Предположим, что CaCO 3 имеет 100% чистоту (без примесей). Используйте сбалансированное химическое уравнение для определения количества молей CO 2 произведенного CaCO 3 (т) + 2HCl(водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O(л) Этап 2: Расчет объема CO 2 (г) Предположим, что потери CO 2 (g) отсутствуют, т. V(CO 2(g) ) = n(CO 2(g) ) × V m | |
| Следуйте плану. | Этап 1: Расчет количества молей углекислого газа CO 2 (г), произведенного Предположим, что CaCO 3 имеет 100% чистоту (без примесей). Используйте сбалансированное химическое уравнение для определения молей CO 2 произведено CaCO 3 (т) + 2HCl(водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O(л) Шаг 2: Рассчитать объем CO 2 (г) Предположим, что потери CO 2 (g) отсутствуют, т. V(CO 2(g) ) = n(CO 2(g) ) × V m | |
| Подумайте о правдоподобии. | Вы ответили на заданный вопрос? Да, мы определили объем углекислого газа, который будет собираться. Разумно ли ваше решение вопроса? При 25°C и 100 кПа объем 1 моля газа составит 24,79 л (V м из техпаспорта) Мы достаточно уверены, что наше решение проблемы правильное. | |
| Укажите решение. | Какой объем углекислого газа будет собран, если образец представляет собой чистый карбонат кальция? В(CO 2(г) ) = 0,124 л при 25°C и 100 кПа. |
Сноски:
(1) Вы можете использовать уравнение идеального газа PV = nRT, чтобы найти объем 1 моля идеального газа (молярный объем газа) при 100 кПа и других температурах.
(2) До 1982 г. стандартные температура и давление определялись как 0°C (273,15 K) и 1 атм (101,3 кПа), поэтому 1 моль газа занимает объем 22,41 л.
(3) При 25°C (298,15 K) и 1 атм (101,3 кПа) 1 моль газа занимает объем 24,47 л.
(4) Литр является метрической единицей, но не базовой единицей СИ. Единицей объема в СИ будет кубический метр (м 3 ).
Первоначально 1 л определялся как объем, занимаемый 1 кг воды при температуре 3,98°С.
В 1964 году 1 л был переопределен как один кубический дециметр (дм 3 ), поэтому теперь это производная единица СИ (1 л = 1 дм 3 ).
Полезно отметить, что это означает, что 1 мл = 1 см 3
www.ausetute.com.au
Формула молярного объема— GeeksforGeeks
Молярный объем определяется как объем одного моля элемента или соединения при стандартной температуре и давлении. Другими словами, это отношение молярной массы и плотности. Она прямо пропорциональна массе вещества, но изменяется обратно пропорционально плотности вещества. Молярный объем идеальных газов следует уравнению идеального газа.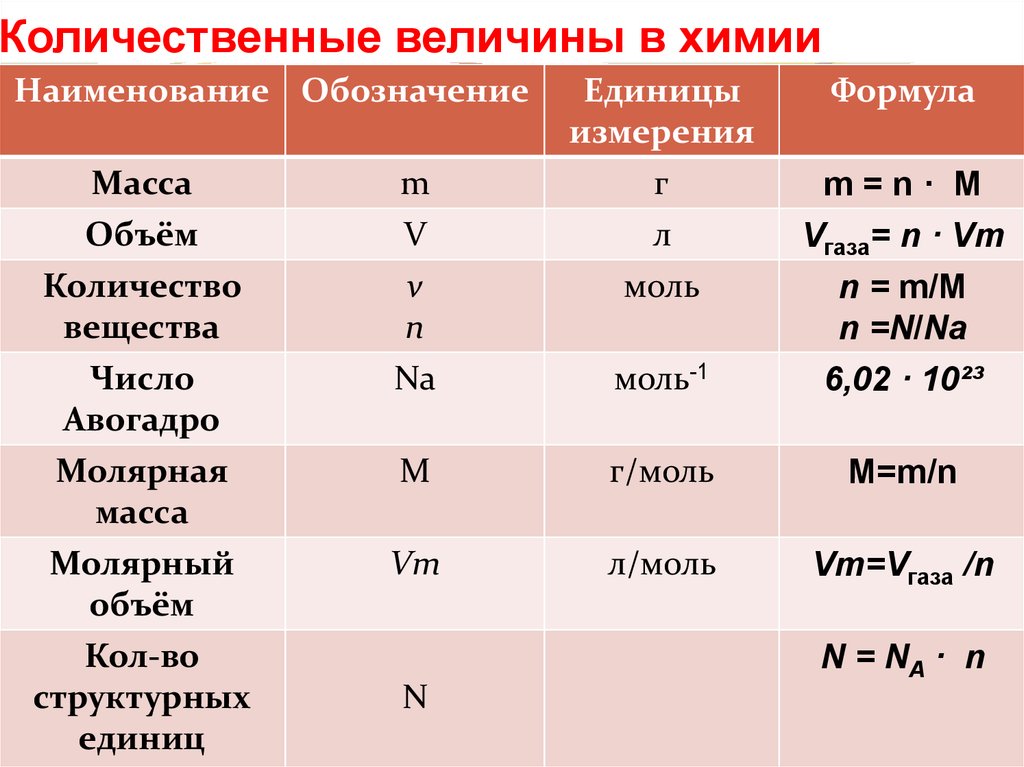 Если образец представляет собой смесь двух или более компонентов, плотность смеси используется для аппроксимации молярного объема путем добавления молярных объемов отдельных компонентов.
Если образец представляет собой смесь двух или более компонентов, плотность смеси используется для аппроксимации молярного объема путем добавления молярных объемов отдельных компонентов.
Формула
V M = M/ρ
, где,
V M — молярная объем,
M — Molar Frass of Gas 40073 9007 22 22 22 22 22 22 22 22. газ.
Известно, что 1 моль газа имеет объем 22,4 л при нормальных условиях. В терминах количества молей формула выражается как
В м = 22,4 н
, где
В м — молярный объем,
n — количество молей газа.
Например,
Двуокись углерода образуется при взаимодействии углерода с воздухом.
C (т) + O 2 (г) → CO 2 (г)
Предположим, нам нужно найти молярный объем углекислого газа, образующегося при взаимодействии 2 г углерода с воздухом.
Из реакции видно, что 1 моль углерода дает 1 моль углекислого газа.
Число молей 2 г углерода = 2/12 = 0,166 моль
SO, количество молей диоксида углерода (n) = 0,166 моль
с использованием формулы, которую мы получаем,
В M = 22,4 N
= 22,4 (0,166)
= 3,73 л
44 9
69669 2= 3,73 л
44 9
666669 2= 3,73 л
44 259
.Задача 1. Рассчитайте молярный объем кислорода, если плотность газа равна 1,4291 г/л?
Решение:
Имеем,
M = 32
D = 1,4291
В м = M/D
= 32/1,4291
= 22,39 л
Задача 2. Вычислить молярный объем диоксида серы, если плотность газа равна 2,6288 г/л?
Solution:
We have,
M = 32 + 2 (16) = 64
D = 2.6288
V m = M/D
= 64/2.
6288
= 24.34 L
Задача 3. Вычислите плотность газа, если его молярный объем 22,40 л, а молярная масса 28 г.
Решение:
Мы имеем,
VM = 22,40
M = 28
V M = M/D
=> D = M/V M 9
2
=> D = M/V M 9
2
2
=> D = M/V M 9
=> D = M/V M 9
=> D = M/V M 9
=> D = M/V 11111119
=> D = M/V 11111119
. = 28/22,40
=> D = 1,25 г/л
Задача 4. Вычислить молярный объем 3 молей газа.
Решение:
Имеем,
n = 3
Используя формулу, имеем,
В м = 22,4 n
= 22,4 (3)
= 67,2 л
Задача 5.

 86 №№ 3–5 из учебника П. А. Оржековского «Химия: 8 класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.
86 №№ 3–5 из учебника П. А. Оржековского «Химия: 8 класс» / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. – М.: Астрель, 2013.


 е. весь производимый газ собирается.
е. весь производимый газ собирается.  е. весь производимый газ собирается.
е. весь производимый газ собирается.  25 л
25 л 
 6288
6288