ГДЗ геометрія 8 клас Істер
алгебра
геометрія
українська мова
англійська мова
всесвітня історія
історія України
фізика
хімія
- Вы здесь:
- Главная
- ГДЗ
- 8 клас
- Геометрія
- Істер
- Вправа 122 геометрія Істер гдз 8 клас
Обери свій клас
Вийшло
оновлення:
ГДЗ 8 клас
Істер 2021
Список номерів:
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 284 285 286 287 288 289 290 291 292 293 294 295 296 297 298 299 300 301 302 303 304 305 306 307 308 309 310 311 312 313 314 315 316 317 318 319 320 321 322 323 324 325 326 327 328 329 330 331 332 333 334 335 336 337 338 339 340 341 342 343 344 345 346 347 348 349 350 351 352 353 354 355 356 357 358 359 360 361 362 363 364 365 366 367 368 369 370 371 372 373 374 375 376 377 378 379 380 381 382 383 384 385 386 387 388 389 390 391 392 393 394 395 396 397 398 399 400 401 402 403 404 405 406 407 408 409 410 411 412 413 414 415 416 417 418 419 420 421 422 423 424 425 426 427 428 429 430 431 432 433 434 435 436 437 438 439 440 441 442 443 444 445 446 447 448 449 450 451 452 453 454 455 456 457 458 459 460 461 462 463 465 466 467 468 469 470 471 472 473 474 475 476 477 478 479 480 482 483 484 485 486 487 488 489 490 491 492 493 494 495 496 497 498 499 500 501 502 503 504 505 506 507 508 509 510 511 512 513 514 515 516 517 518 519 520 521 522 523 524 525 526 527 528 529 530 531 532 533 534 535 536 537 538 539 540 541 542 543 544 545 546 547 548 549 550 551 552 553 554 555 556 557 558 559 560 561 562 563 564 565 566 567 568 569 570 571 572 573 574 575 576 577 578 579 580 581 582 583 584 585 586 587 588 592 593 594 595 596 597 598 599 600 601 602 603 604 605 606 607 608 609 610 611 612 613 614 615 616 618 619 620 621 622 623 624 625 626 627 628 629 630 631 632 633 634 635 636 637 638 639 640 641 642 643 644 645 646 647 648 649 650 651 652 653 654 655 656 657 658 659 660 661 662 663 664 665 666 667 668 669 670 671 672 673 674 675 676 677 678 679 681 682 683 684 685 686 687 688 689 690 691 692 693 694 695 696 697 698 699 700 701 702 703 704 705 706 707 708 709 710 711 712 713 714 715 716 717 718 719 720 721 722 723 724 725 726 727 728 729 730 731 732 733 734 735 736 737 738 739 740 741 742 743 744 745 746 747 748 749 750 751 752 753 754 755 756 757 758 759 760 761 762 763 764 765 766 767 768 769 770 771 772 773 774 775 776 777 778 779 780 781 782 783 784 785 786 787 788 789 790 791 792 793 794 795 796 797 798 799 800 801 802 803 804 805 806 807 808 809 820 821 822 823 824 825 826 827 828 829 830 831 832 833 834 835 836 837 838 839 840 841 842 843 844 845 846 847 848 850 851 852 853 854 855 856 857 858 859 860 861 862 863 864 865 866 867 868 869 870 871 872 873 874 875 876 877 878 879 881 882 883 884 885 886 887 888 889 890 891 892 893 894 895 896 897 898 899 900 901 902 903 904 905 906 907 908 909 910 911 912 913 914 915 916 917 918 919 920 921 922 923 924 925 926 927 928 929 930 931 932 933 934 935 936 937 938 940 941 942 943 944 945 946 947 948 949 950 951 952 953 954 955 956 957 958 959 960 961 962 963 964 965 966 967 968 969 970 971 972 973 974 975 978 979 980 981 982 983 984 985 986 987 988 989 990 991 992 993 994 995 996 997 998 999 1000 1001 1002 1003 1004 1005 1006 1007 1008 1009 1010 1011 1012 1013 1014 1015 1016 1017 1018 1019 1020 1021 1022 1023 1024 1025 1026 1027 1028 1029 1030 1031 1032 1033 1034 1035 1036 1037 1038 1039 1040 1041 1042 1043 1044 1045 1046 1047 1048 1049 1050 1051
Онлайн решебники (гдз) по Геометрии
7 класс
Геометрия 7 класс дидактические материалы Б.Г. Зив
Авторы: Б.Г. Зив В.М. Мейлер
Геометрия 7-9 класс Л.С. Атанасян
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 7-9 класс А.
 В. Погорелов
В. ПогореловАвтор: А.В. Погорелов
Геометрия 7 класс В.В. Шлыков
Автор: В.В. Шлыков
Геометрия 7 класс рабочая тетрадь Л.С. Атанасян
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 7 класс Г.П. Бевз
Авторы: Г.П. Бевз В.Г. Бевз
Геометрия 7 класс М.
 И. Бурди
И. БурдиАвторы: М. И. Бурди Н. А. Тарасенкова
Геометрия 7 класс О.С. Истер
Автор: О.С. Истер
Геометрия 7 класс Мерзляк A.Г.
Авторы: Мерзляк A.Г. Полонский B.Б.
Геометрия 7 класс сборник задач A.Г. Мерзляк
Авторы: A.Г. Мерзляк Ю.М. Рабинович
Геометрия 7-9 класс Погорєлов О.
 В.
В.Автор: Погорєлов О.В.
Геометрия 7 класс дидактические материалы Гусев В.А.
Авторы: Гусев В.А. Медяник А.И.
Геометрия 7 класс рабочая тетрадь Мерзляк А.Г.
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 7 класс рабочая тетрадь Бутузов В.Ф.
Авторы: Бутузов В.Ф. Кадомцев С.Б.
Геометрия 7 класс дидактические материалы Мерзляк А.
 Г.
Г.Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 7 класс Мерзляк А.Г.
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 7 класс Казаков В.В.
Автор: Казаков В.В.
Геометрия 7 класс рабочая тетрадь Глазков Ю.А.
Авторы: Глазков Ю.А. Камаев П.М.
Геометрия 7-9 класс самостоятельные и контрольные работы Иченская М.
 А.
А.Автор: Иченская М.А.
Геометрия 7 класс контрольно-измерительные материалы Гаврилова Н.Ф.
Автор: Гаврилова Н.Ф.
Геометрия 7 класс Мерзляк А.Г. Углубленный уровень
Авторы: Мерзляк А.Г. Поляков В.М.
Геометрия 7 класс рабочая тетрадь Мищенко Т.М.
Автор: Мищенко Т.М.
Геометрия 7 класс рабочая тетрадь Универсальные учебные действия Глазков Ю.
 А.
А.Авторы: Глазков Ю.А. Егупова М.В.
Геометрия 7 класс рабочая тетрадь Дудницын Ю.П.
Автор: Дудницын Ю.П.
Геометрия 7 класс контрольные работы Мельникова Н.Б.
Автор: Мельникова Н.Б.
Геометрия 7 класс Шыныбеков А.Н.
Авторы: Шыныбеков А.Н. Шыныбеков Д.А.
Геометрия 7 класс Смирнов В.
 А.
А.Авторы: Смирнов В.А. Туяков Е.А.
Геометрия 7 класс тесты Л.И. Звавич
Авторы: Л.И. Звавич Е.В. Потоскуев
Геометрия 7 класс тесты А. В. Фарков
Автор: А. В. Фарков
Геометрия 7 класс тесты А. В. Фарков
Автор: А. В. Фарков
Геометрия 7 класс контрольные измерительные материалы А.
 Р. Рязановский
Р. РязановскийАвторы: А.Р. Рязановский Д.Г. Мухин
8 класс
Геометрия 8 класс дидактические материалы Б.Г. Зив
Авторы: Б.Г. Зив В.М. Мейлер
Геометрия 7-9 класс Л.С. Атанасян
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 7-9 класс А.В. Погорелов
Автор: А.В. Погорелов
Геометрия 8 класс В.
 В. Шлыков
В. ШлыковАвтор: В.В. Шлыков
Геометрия 8 класс рабочая тетрадь Л.С. Атанасян
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 8 класс опорные конспекты Казаков В.В.
Автор: Казаков В.В.
Геометрия 8 класс Г.В. Апостолова
Автор: Г.В. Апостолова
Геометрия 8 класс Г.
 П. Бевз
П. БевзАвторы: Г.П. Бевз В.Г. Бевз
Геометрия 8 класс А.П. Ершова
Авторы: А.П. Ершова В.В. Голобородько
Геометрия 8 класс М.І. Бурда
Авторы: М.І. Бурда Н.А. Тарасенкова
Геометрия 8 класс Мерзляк А.Г.
Авторы: Мерзляк А.Г. Полонський В.Б.
Геометрия 8 класс В.
 Б. Полонський
Б. ПолонськийАвторы: В.Б. Полонський Ю.М. Рабінович
Геометрия 8 класс углубленное изучение Мерзляк А.Г. Углубленный уровень
Авторы: Мерзляк А.Г. Полонський В.Б.
Геометрия 7-9 класс Погорєлов О.В.
Автор: Погорєлов О.В.
Геометрия 8 класс рабочая тетрадь Дудницын Ю.П.
Автор: Дудницын Ю.П.
Геометрия 8 класс А.
 Г. Мерзляк
Г. МерзлякАвторы: А.Г. Мерзляк В.Б. Полонский
Геометрия 8 класс дидактические материалы Мерзляк А.Г.
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 8 класс рабочая тетрадь Мерзляк А.Г.
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 8 класс рабочая тетрадь Глазков Ю.А.
Авторы: Глазков Ю.А. Камаев П.М.
Геометрия 7-9 класс самостоятельные и контрольные работы Иченская М.
 А.
А.Автор: Иченская М.А.
Геометрия 8 класс контрольно-измерительные материалы Гаврилова Н.Ф.
Автор: Гаврилова Н.Ф.
Геометрия 8 класс Казаков В.В.
Автор: Казаков В.В.
Геометрия 8 класс Мерзляк А.Г. Углубленный уровень
Авторы: Мерзляк А.Г. Поляков В.М.
Геометрия 8 класс рабочая тетрадь Мищенко Т.
 М.
М.Автор: Мищенко Т.М.
Геометрия 8 класс рабочая тетрадь Универсальные учебные действия Глазков Ю.А.
Авторы: Глазков Ю.А. Егупова М.В.
Геометрия 8 класс тестовый контроль знаний Гальперина А.Р.
Автор: Гальперина А.Р.
Геометрия 8 класс контрольные работы Мельникова Н.Б.
Автор: Мельникова Н.Б.
Геометрия 8 класс Шыныбеков А.
 Н.
Н.Авторы: Шыныбеков А.Н. Шыныбеков Д.А.
Геометрия 8 класс Смирнов В.А.
Авторы: Смирнов В.А. Туяков Е.А.
Геометрия 8 класс Солтан Г.Н.
Авторы: Солтан Г.Н. Солтан А.Е.
Геометрия 8 класс тесты А. В. Фарков
Автор: А. В. Фарков
Геометрия 8 класс тесты Л.
 И. Звавич
И. ЗвавичАвторы: Л.И. Звавич Е.В. Потоскуев
Геометрия 8 класс контрольные измерительные материалы А. Р. Рязановский
Авторы: А. Р. Рязановский Д. Г. Мухин
9 класс
Геометрия 9 класс дидактические материалы Б.Г. Зив
Автор: Б.Г. Зив
Геометрия 7-9 класс Л.С. Атанасян
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 7-9 класс А.
 В. Погорелов
В. ПогореловАвтор: А.В. Погорелов
Геометрия 9 класс В.В. Шлыков
Автор: В.В. Шлыков
Геометрия 9 класс рабочая тетрадь Л.С. Атанасян
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 9 класс Апостолова Г.В.
Автор: Апостолова Г.В.
Геометрия 9 класс М.
 И. Бурда
И. БурдаАвторы: М.И. Бурда Н.А. Тарасенкова
Геометрия 9 класс Ершова A.П.
Авторы: Ершова A.П. Голобородько B.В.
Геометрия 9 класс A.Г. Мерзляк
Авторы: A.Г. Мерзляк B.Б. Полонский
Геометрия 9 класс сборник задач А.Г. Мерзляк
Авторы: А.Г. Мерзляк В.Б. Полонський
Геометрия 9 класс углубленное изучение Мерзляк А.
 Г. Углубленный уровень
Г. Углубленный уровеньАвторы: Мерзляк А.Г. Полонський В.Б.
Геометрия 7-9 класс Погорєлов О.В.
Автор: Погорєлов О.В.
Геометрия 9 класс дидактические материалы Гусев В.А.
Авторы: Гусев В.А. Медяник А.И.
Геометрия 9 класс рабочая тетрадь Дудницын Ю.П.
Автор: Дудницын Ю.П.
Геометрия 9 класс дидактические материалы Мерзляк А.
 Г.
Г.Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 9 класс А.Г. Мерзляк
Авторы: А.Г. Мерзляк В.Б. Полонский
Геометрия 9 класс рабочая тетрадь Мерзляк А.Г.
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 9 класс рабочая тетрадь Глазков Ю.А.
Авторы: Глазков Ю.А. Камаев П.М.
Геометрия 7-9 класс самостоятельные и контрольные работы Иченская М.
 А.
А.Автор: Иченская М.А.
Геометрия 9 класс контрольно-измерительные материалы Рурукин А.Н.
Автор: Рурукин А.Н.
Геометрия 9 класс рабочая тетрадь Мищенко Т.М.
Автор: Мищенко Т.М.
Геометрия 9 класс тестовый контроль знаний Гальперина А.Р.
Автор: Гальперина А.Р.
Геометрия 9 класс контрольные работы Мельникова Н.
 Б.
Б.Автор: Мельникова Н.Б.
Геометрия 9 класс Казаков В.В.
Автор: Казаков В.В.
Геометрия 9 класс Мерзляк А.Г. Углубленный уровень
Авторы: Мерзляк А.Г. Поляков В.М.
Геометрия 9 класс Шыныбеков А.Н.
Авторы: Шыныбеков А.Н. Шыныбеков Д.А.
Геометрия 9 класс тесты А.
 В. Фарков
В. ФарковАвтор: А. В. Фарков
Геометрия 9 класс тесты А. В. Фарков
Автор: А. В. Фарков
Геометрия 9 класс контрольные измерительные материалы А. Р. Рязановский
Авторы: А. Р. Рязановский Д. Г. Мухин
Геометрия 9 класс Солтан Г.Н.
Авторы: Солтан Г.Н. Солтан А.Е.
Геометрия 9 класс Смирнов В.
 А.
А.Авторы: Смирнов В.А. Туяков Е.А.
10 класс
Геометрия 10-11 класс Атанасян Л.С.
Авторы: Атанасян Л.С. Бутузов В.Ф.
Геометрия 10-11 класс А.В. Погорелов
Автор: А.В. Погорелов
Геометрия 10 класс дидактические материалы Б.Г. Зив
Автор: Б.Г. Зив
Геометрия 10 класс В.
 В. Шлыков
В. ШлыковАвтор: В.В. Шлыков
Геометрия 10 класс рабочая тетрадь Глазков Ю.А. Базовый и углубленный уровень
Авторы: Глазков Ю.А. Юдина И.И.
Геометрия 10 класс Бурда М.І.
Авторы: Бурда М.І. Тарасенкова Н.А.
Геометрия 10 класс Біляніна О.Я.
Авторы: Біляніна О.Я. Біляніна Г.І.
Геометрия 10 класс Бевз Г.
 П.
П.Авторы: Бевз Г.П. Бевз В.Г.
Геометрия 10-11 класс Погорєлов О.В.
Автор: Погорєлов О.В.
Геометрия 10 класс Мерзляк А.Г.
Автор: Мерзляк А.Г.
Геометрия 10 класс самостоятельные и контрольные работы Ершова А.П.
Авторы: Ершова А.П. Голобородько В.В.
Геометрия 10 класс Мерзляк А.
 Г. Базовый уровень
Г. Базовый уровеньАвторы: Мерзляк А.Г. Номировский Д.А.
Геометрия 10 класс Мерзляк А.Г. Углубленный уровень
Авторы: Мерзляк А.Г. Номировский Д.А.
Геометрия 10 класс комплексная тетрадь для контроля знаний Роганин О.М. Уровень стандарта
Автор: Роганин О.М.
Геометрия 10 класс Шыныбеков А.Н.
Авторы: Шыныбеков А.
 Н. Шыныбеков Д.А.
Н. Шыныбеков Д.А.Геометрия 10 класс Латотин Л.А. Базовый и повышенный уровни
Авторы: Латотин Л.А. Чеботаревский Б.Д.
Геометрия 10-11 класс Солтан Г.Н. Общественно-гуманитарное направление
Авторы: Солтан Г.Н. Солтан А.Е.
Геометрия 10 класс Смирнов В.А. Общественно-гуманитарное направление
Авторы: Смирнов В.
 А. Туяков Е.А.
А. Туяков Е.А.
11 класс
Геометрия 11 класс дидактические материалы Б.Г. Зив
Автор: Б.Г. Зив
Геометрия 10-11 класс Атанасян Л.С.
Авторы: Атанасян Л.С. Бутузов В.Ф.
Геометрия 10-11 класс А.В. Погорелов
Автор: А.В. Погорелов
Геометрия 11 класс В.В. Шлыков
Автор: В.
 В. Шлыков
В. ШлыковГеометрия 10-11 класс Погорєлов О.В.
Автор: Погорєлов О.В.
Геометрия 11 класс Бевз Г.П.
Авторы: Бевз Г.П. Бевз В.Г.
Геометрия 11 класс Апостолова Г.В.
Автор: Апостолова Г.В.
Геометрия 11 класс рабочая тетрадь Бутузов В.Ф. Базовый и углубленный уровень
Авторы: Бутузов В.
 Ф. Глазков Ю.А.
Ф. Глазков Ю.А.Геометрия 11 класс Мерзляк А.Г. Базовый уровень
Авторы: Мерзляк А.Г. Номировский Д.А.
Геометрия 11 класс Мерзляк А.Г. Углубленный уровень
Авторы: Мерзляк А.Г. Номировский Д.А.
Геометрия 11 класс комплексная тетрадь для контроля знаний Роганин О.М. Уровень стандарта
Автор: Роганин О.М.
Геометрия 11 класс комплексная тетрадь для контроля знаний Роганин О.
 М. Академический уровень
М. Академический уровеньАвтор: Роганин О.М.
Геометрия 11 класс Гусев В.
Авторы: Гусев В. Кайдасов Ж.
Геометрия 10-11 класс Солтан Г.Н. Общественно-гуманитарное направление
Авторы: Солтан Г.Н. Солтан А.Е.
Геометрия 11 класс Солтан Г.Н. Естественно-математическое направление
Авторы: Солтан Г.
 Н. Солтан А.Е.
Н. Солтан А.Е.Геометрия 11 класс Латотин Л.А. Базовый и повышенный уровни
Авторы: Латотин Л.А. Чеботаревский Б.Д.
С первых дней, начиная изучать геометрию, становится ясно, что самым трудновыполнимым заданием является совсем не математические расчеты, а пошаговое расписывание метода своего решения. И наверное, такая проблематика ожидает каждого ученика без исключения, будь то старшеклассник или к примеру семиклассник. По сути решить задание удается за считанные минуты, куда дольше приходиться расписывать этот процесс поэтапно и справляются с этим всего лишь некоторые школьники, что безусловно не может не отразиться на их текущих оценках.
В таком случае наиболее приемлемым вариантом будет пользоваться сборником ГДЗ по геометрии для решения работы, заданной на дом. При сравнении итоговых ответов пояснение к ним можно тут же переписать из решебника. Этим можно сократить время потраченное на выполнение задания и обеспечить себя стабильно высоким оценочным баллом. Даже в случае несовпадении ответов, можно заглянуть в любое время в пособие и отыскать в нем ошибку. Когда ребенка вызовут к доске отвечать, он уже с такой проблемой вряд ли столкнется.
Пособие соответствует нормам стандарта и утверждено Министерством образования и науки РФ, поэтому с ним ученик сможет получить хорошую подготовку перед сдачей выпускных экзаменов. Используя учебно-практического материал данного решебника, школьник приобретает потенциальную возможность за несколько дней повторить буквально всю школьную программу или ее самые важные элементы.
При сравнении итоговых ответов пояснение к ним можно тут же переписать из решебника. Этим можно сократить время потраченное на выполнение задания и обеспечить себя стабильно высоким оценочным баллом. Даже в случае несовпадении ответов, можно заглянуть в любое время в пособие и отыскать в нем ошибку. Когда ребенка вызовут к доске отвечать, он уже с такой проблемой вряд ли столкнется.
Пособие соответствует нормам стандарта и утверждено Министерством образования и науки РФ, поэтому с ним ученик сможет получить хорошую подготовку перед сдачей выпускных экзаменов. Используя учебно-практического материал данного решебника, школьник приобретает потенциальную возможность за несколько дней повторить буквально всю школьную программу или ее самые важные элементы.
ГДЗ онлайн по Геометрии, решебник и ответы
- ГДЗ org/ListItem» itemscope=»» itemprop=»itemListElement»> Геометрия
7 класс
Геометрия 7-9 класс
Автор: А.В. Погорелов
Геометрия 7-9 класс
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 7 класс дидактические материалы
Авторы: Гусев В.А. Медяник А.И.
Геометрия 7 класс дидактические материалы
Авторы: Б.Г. Зив В.М. Мейлер
Геометрия 7 класс рабочая тетрадь
Авторы: Л.
 С. Атанасян В.Ф. Бутузов
С. Атанасян В.Ф. БутузовГеометрия 7 класс рабочая тетрадь
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 7 класс сборник задач
Авторы: A.Г. Мерзляк Ю.М. Рабинович
Геометрия 7 класс
Авторы: Александров А.Д. Вернер А.Л.
Геометрия 7 класс
Авторы: Бутузов В.Ф. Кадомцев С.Б.
Геометрия 7-9 класс
Автор: Шарыгин И.
 Ф.
Ф.Геометрия 7 класс рабочая тетрадь
Авторы: Бутузов В.Ф. Кадомцев С.Б.
Геометрия 7 класс дидактические материалы
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 7 класс
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 7 класс
Автор: Казаков В.В.
Геометрия 7-9 класс задачи на готовых чертежах для подготовки к ОГЭ и ЕГЭ
Автор: Балаян Э.
 Н.
Н.Геометрия 7 класс рабочая тетрадь
Авторы: Глазков Ю.А. Камаев П.М.
Геометрия 7-9 класс самостоятельные и контрольные работы
Автор: Иченская М.А.
Геометрия 7 класс контрольно-измерительные материалы
Автор: Гаврилова Н.Ф.
Геометрия 7 класс
Авторы: Мерзляк А.Г. Поляков В.М.
Геометрия 7 класс тематические тесты ОГЭ
Авторы: Бутузов В.
 Ф. Кадомцев С.Б.
Ф. Кадомцев С.Б.Геометрия 7 класс рабочая тетрадь
Авторы: Смирнова И.М. Смирнов В.А.
Геометрия 7 класс дидактические материалы
Авторы: Мельникова Н.Б. Захарова Г.А.
Геометрия 7 класс рабочая тетрадь
Автор: Мищенко Т.М.
Геометрия 7 класс дидактические материалы
Авторы: Бутузов В.Ф. Кадомцев С.Б.
Геометрия 7 класс рабочая тетрадь Универсальные учебные действия
Авторы: Глазков Ю.
 А. Егупова М.В.
А. Егупова М.В.Геометрия 7 класс рабочая тетрадь
Автор: Дудницын Ю.П.
Геометрия 7 класс тематические тесты ОГЭ
Авторы: Мищенко Т.М. Блинков А.Д.
Геометрия 7 класс сборник заданий для тематического и итогового контроля
Автор: Ершова А.П.
Геометрия 7 класс контрольные работы
Автор: Мельникова Н.Б.
Геометрия 7 класс
Авторы: Шыныбеков А.
 Н. Шыныбеков Д.А.
Н. Шыныбеков Д.А.
Геометрия 7 класс
Авторы: Смирнов В.А. Туяков Е.А.
Геометрия 7 класс
Авторы: Берсенев А.А. Сафонова Н.В.
Геометрия 7 класс тетрадь-экзаменатор
Авторы: Сафонова Н.В. Голубева С.А.
Геометрия 7 класс тетрадь-тренажёр
Авторы: Сафонова Н.В. Ковалева Г.И.
Геометрия 7 класс тетрадь контрольных тестовых работ
Автор: Парфентьева О.
 Н.
Н.Геометрия 7 класс тесты
Авторы: Л.И. Звавич Е.В. Потоскуев
Геометрия 7 класс тесты
Автор: А. В. Фарков
Геометрия 7 класс тесты
Автор: А. В. Фарков
Геометрия 7 класс контрольные измерительные материалы
Авторы: А.Р. Рязановский Д.Г. Мухин
Геометрия 7-11 класс задачник
Авторы: Зив Б.
 Г. Мейлер В.М.
Г. Мейлер В.М.Геометрия 7-8 класс задачник
Автор: Волчкевич М.А.
Геометрия 7 класс Математические диктанты, Контрольные работы (из Методического пособия)
Авторы: Буцко Е.В. Мерзляк А.Г.
8 класс
Геометрия 8 класс дидактические материалы
Авторы: Б.Г. Зив В.М. Мейлер
Геометрия 7-9 класс
Автор: А.В. Погорелов
Геометрия 8 класс рабочая тетрадь
Авторы: Л.
 С. Атанасян В.Ф. Бутузов
С. Атанасян В.Ф. БутузовГеометрия 7-9 класс
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 8 класс дидактические материалы
Авторы: Гусев В.А. Медяник А.И.
Геометрия 8 класс рабочая тетрадь
Автор: Дудницын Ю.П.
Геометрия 8 класс
Авторы: А.Г. Мерзляк В.Б. Полонский
Геометрия 8 класс
Авторы: Бутузов В.
 Ф. Кадомцев С.Б.
Ф. Кадомцев С.Б.Геометрия 8 класс
Автор: В.В. Шлыков
Геометрия 7-9 класс
Авторы: И. М. Смирнова В. А. Смирнов
Геометрия 8 класс опорные конспекты
Автор: Казаков В. В.
Геометрия 8 класс
Автор: Г.В. Апостолова
Геометрия 7-9 класс
Автор: Шарыгин И.Ф.
Геометрия 8 класс
Авторы: А.
 Д. Александров А.Л. Вернер
Д. Александров А.Л. ВернерГеометрия 8 класс дидактические материалы
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 7-9 класс задачи на готовых чертежах для подготовки к ОГЭ и ЕГЭ
Автор: Балаян Э.Н.
Геометрия 8 класс рабочая тетрадь
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 8 класс рабочая тетрадь
Авторы: Глазков Ю.
 А. Камаев П.М.
А. Камаев П.М.
Геометрия 7-9 класс самостоятельные и контрольные работы
Автор: Иченская М.А.
Геометрия 8 класс контрольно-измерительные материалы
Автор: Гаврилова Н.Ф.
Геометрия 8 класс
Автор: Казаков В.В.
Геометрия 8 класс
Авторы: Мерзляк А.Г. Поляков В.М.
Геометрия 8 класс рабочая тетрадь
Автор: Мищенко Т.
 М.
М.Геометрия 8 класс рабочая тетрадь
Авторы: Бутузов В.Ф. Кадомцев С.Б.
Геометрия 8 класс рабочая тетрадь
Авторы: Смирнова И.М. Смирнов В.А.
Геометрия 8 класс рабочая тетрадь Универсальные учебные действия
Авторы: Глазков Ю.А. Егупова М.В.
Геометрия 8 класс дидактические материалы
Авторы: Мельникова Н.
 Б. Захарова Г.А.
Б. Захарова Г.А.Геометрия 8 класс тестовый контроль знаний
Автор: Гальперина А.Р.
Геометрия 8 класс сборник заданий
Автор: Ершова А.П.
Геометрия 8 класс тематические тесты ОГЭ
Авторы: Мищенко Т.М. Блинков А.Д.
Геометрия 8 класс контрольные работы
Автор: Мельникова Н.Б.
Геометрия 8 класс тематические тесты ОГЭ
Авторы: Бутузов В.
 Ф. Кадомцев С.Б.
Ф. Кадомцев С.Б.Геометрия 8 класс дидактические материалы
Авторы: Бутузов В.Ф. Кадомцев С.Б.
Геометрия 8 класс
Авторы: Шыныбеков А.Н. Шыныбеков Д.А.
Геометрия 8 класс
Авторы: Смирнов В.А. Туяков Е.А.
Геометрия 8 класс тетрадь контрольных тестовых работ
Автор: Стокоз В.И.
Геометрия 8 класс тетрадь-тренажёр
Авторы: Сафонова Н.
 В. Ковалева Г.И.
В. Ковалева Г.И.Геометрия 8 класс тетрадь-экзаменатор
Авторы: Сафонова Н.В. Корзун Т.В.
Геометрия 8 класс
Авторы: Солтан Г.Н. Солтан А.Е.
Геометрия 8 класс тесты
Автор: А. В. Фарков
Геометрия 8 класс тесты
Авторы: Л.И. Звавич Е.В. Потоскуев
Геометрия 8 класс контрольные измерительные материалы
Авторы: А.
 Р. Рязановский Д. Г. Мухин
Р. Рязановский Д. Г. Мухин
Геометрия 7-11 класс задачник
Авторы: Зив Б.Г. Мейлер В.М.
Геометрия 7-8 класс задачник
Автор: Волчкевич М.А.
Геометрия 8 класс Математические диктанты, Контрольные работы (из Методического пособия)
Авторы: Буцко Е.В. Мерзляк А.Г
Геометрия 8 класс
Авторы: Берсенев А.А. Сафонова Н.
 В.
В.
9 класс
Геометрия 9 класс рабочая тетрадь
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 7-9 класс
Автор: А.В. Погорелов
Геометрия 9 класс дидактические материалы
Авторы: Гусев В.А. Медяник А.И.
Геометрия 7-9 класс
Авторы: Л.С. Атанасян В.Ф. Бутузов
Геометрия 9 класс рабочая тетрадь
Автор: Дудницын Ю.
 П.
П.Геометрия 9 класс дидактические материалы
Автор: Б.Г. Зив
Геометрия 7-9 класс
Авторы: И. М. Смирнова В. А. Смирнов
Геометрия 9 класс
Автор: В.В. Шлыков
Геометрия 7-9 класс
Автор: Шарыгин И.Ф.
Геометрия 9 класс дидактические материалы
Авторы: Мерзляк А.
 Г. Полонский В.Б.
Г. Полонский В.Б.Геометрия 9 класс
Авторы: Александров А.Д. Вернер А.Л.
Геометрия 9 класс
Авторы: Бутузов В.Ф. Кадомцев С.Б.
Геометрия 9 класс
Авторы: А.Г. Мерзляк В.Б. Полонский
Геометрия 7-9 класс задачи на готовых чертежах для подготовки к ОГЭ и ЕГЭ
Автор: Балаян Э.Н.
Геометрия 9 класс рабочая тетрадь
Авторы: Мерзляк А.
 Г. Полонский В.Б.
Г. Полонский В.Б.Геометрия 9 класс рабочая тетрадь
Авторы: Глазков Ю.А. Камаев П.М.
Геометрия 7-9 класс самостоятельные и контрольные работы
Автор: Иченская М.А.
Геометрия 9 класс контрольно-измерительные материалы
Автор: Рурукин А.Н.
Геометрия 9 класс рабочая тетрадь
Авторы: Бутузов В.Ф. Кадомцев С.
 Б.
Б.Геометрия 9 класс рабочая тетрадь
Автор: Мищенко Т.М.
Геометрия 9 класс
Авторы: Ершова A.П. Голобородько B.В.
Геометрия 9 класс сборник заданий для тематического и итогового контроля
Автор: Ершова А.П.
Геометрия 9 класс рабочая тетрадь Универсальные учебные действия
Авторы: Глазков Ю.А. Егупова М.В.
Геометрия 9 класс тематические тесты ОГЭ
Авторы: Мищенко Т.
 М. Блинков А.Д.
М. Блинков А.Д.
Геометрия 9 класс тестовый контроль знаний
Автор: Гальперина А.Р.
Геометрия 9 класс дидактические материалы
Авторы: Бутузов В.Ф. Кадомцев С.Б.
Геометрия 9 класс тематические тесты ОГЭ
Авторы: Бутузов В.Ф. Кадомцев С.Б.
Геометрия 9 класс контрольные работы
Автор: Мельникова Н.Б.
Геометрия 9 класс
Автор: Казаков В.
 В.
В.Геометрия 9 класс
Авторы: Мерзляк А.Г. Поляков В.М.
Геометрия 9 класс самостоятельные и контрольные работы
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 9 класс
Авторы: Шыныбеков А.Н. Шыныбеков Д.А.
Геометрия 9 класс тесты
Автор: А. В. Фарков
Геометрия 9 класс тесты
Автор: А.
 В. Фарков
В. ФарковГеометрия 9 класс тетрадь контрольных тестовых работ
Авторы: Покатаева Г.В. Сайткулова О.В.
Геометрия 9 класс контрольные измерительные материалы
Авторы: А. Р. Рязановский Д. Г. Мухин
Геометрия 9 класс
Авторы: Солтан Г.Н. Солтан А.Е.
Геометрия 9 класс
Авторы: Смирнов В.А. Туяков Е.А.
Геометрия 7-11 класс задачник
Авторы: Зив Б.
 Г. Мейлер В.М.
Г. Мейлер В.М.Геометрия 9 класс Математические диктанты, Контрольные работы (из Методического пособия)
Авторы: Буцко Е.В. Мерзляк А.Г
10 класс
Геометрия 10-11 класс
Авторы: Атанасян Л.С. Бутузов В.Ф.
Геометрия 10 класс дидактические материалы
Автор: Б.Г. Зив
Геометрия 10-11 класс
Автор: А.В. Погорелов
Геометрия 10 класс
Автор: В.
 В. Шлыков
В. ШлыковГеометрия 10 класс рабочая тетрадь
Авторы: Глазков Ю.А. Юдина И.И.
Геометрия 10 класс
Авторы: Александров А.Д. Вернер А.Л.
Геометрия 10 класс самостоятельные и контрольные работы
Авторы: Ершова А.П. Голобородько В.В.
Геометрия 10-11 класс математика: алгебра и начала математического анализа, геометрия
Авторы: Александров А.
 Д. Вернер А.Л.
Д. Вернер А.Л.Геометрия 10 класс
Авторы: Мерзляк А.Г. Номировский Д.А.
Геометрия 10 класс контрольно-измерительные материалы
Автор: Рурукин А.Н.
Геометрия 10 класс
Авторы: Мерзляк А.Г. Номировский Д.А.
Геометрия 10-11 класс
Авторы: Бутузов В.Ф. Прасолов В.В.
Геометрия 10-11 класс
Автор: Смирнова И.
 М.
М.Геометрия 10 класс
Авторы: Смирнова И.М. Смирнов В.А.
Геометрия 10 класс комплексная тетрадь для контроля знаний
Автор: Роганин О.М.
Геометрия 10 класс дидактические материалы
Авторы: Бутузов В.Ф. Прасолов В.В.
Геометрия 10-11 класс
Авторы: Смирнова И.М. Смирнов В.А.
Геометрия 10 класс самостоятельные и контрольные работы
Авторы: Мерзляк А.
 Г. Полонский В.Б.
Г. Полонский В.Б.
Геометрия 10 класс самостоятельные работы
Автор: Иченская М.А.
Геометрия 10-11 класс контрольные работы
Автор: Иченская М.А.
Геометрия 10 класс дидактические материалы
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 10 класс
Авторы: Шыныбеков А.Н. Шыныбеков Д.А.
Геометрия 10 класс
Авторы: Латотин Л.
 А. Чеботаревский Б.Д.
А. Чеботаревский Б.Д.Геометрия 10-11 класс
Авторы: Солтан Г.Н. Солтан А.Е.
Геометрия 7-11 класс задачник
Авторы: Зив Б.Г. Мейлер В.М.
Геометрия 10 класс
Авторы: Смирнов В.А. Туяков Е.А.
Геометрия 10 класс Контрольные работы (из Методического пособия)
Авторы: Буцко Е.В. Мерзляк А.Г.
Геометрия 10 класс Контрольные работы (из Методического пособия)
Авторы: Буцко Е.
 В. Мерзляк А.Г.
В. Мерзляк А.Г.Геометрия 10 класс
Авторы: Смирнов В.А. Туяков Е.А.
11 класс
Геометрия 11 класс дидактические материалы
Автор: Б.Г. Зив
Геометрия 10-11 класс
Авторы: Атанасян Л.С. Бутузов В.Ф.
Геометрия 10-11 класс
Автор: А.В. Погорелов
Геометрия 11 класс рабочая тетрадь
Авторы: Бутузов В.
 Ф. Глазков Ю.А.
Ф. Глазков Ю.А.Геометрия 11 класс
Автор: В.В. Шлыков
Геометрия 10-11 класс математика: алгебра и начала математического анализа, геометрия
Авторы: Александров А. Д. Вернер А.Л.
Геометрия 11 класс
Авторы: Александров А.Д. Вернер А.Л.
Геометрия 11 класс контрольно-измерительные материалы
Автор: Рурукин А.Н.
Геометрия 10-11 класс
Авторы: Бутузов В.
 Ф. Прасолов В.В.
Ф. Прасолов В.В.Геометрия 11 класс
Авторы: Мерзляк А.Г. Номировский Д.А.
Геометрия 10-11 класс
Автор: Смирнова И.М.
Геометрия 11 класс
Авторы: Мерзляк А.Г. Номировский Д.А.
Геометрия 11 класс комплексная тетрадь для контроля знаний
Автор: Роганин О.М.
Геометрия 11 класс комплексная тетрадь для контроля знаний
Автор: Роганин О.
 М.
М.Геометрия 10-11 класс
Авторы: Смирнова И.М. Смирнов В.А.
Геометрия 11 класс
Авторы: Гусев В. Кайдасов Ж.
Геометрия 11 класс дидактические материалы
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 11 класс самостоятельные и контрольные работы
Авторы: Мерзляк А.Г. Полонский В.Б.
Геометрия 10-11 класс контрольные работы
Автор: Иченская М.
 А.
А.Геометрия 11 класс самостоятельные работы
Автор: Иченская М.А.
Геометрия 10-11 класс
Авторы: Солтан Г.Н. Солтан А.Е.
Геометрия 7-11 класс задачник
Авторы: Зив Б.Г. Мейлер В.М.
Геометрия 11 класс задачник, учебник
Авторы: Потоскуев Е.В. Звавич Л.И.
Геометрия 11 класс
Авторы: Солтан Г.
 Н. Солтан А.Е.
Н. Солтан А.Е.
Геометрия 11 класс
Авторы: Латотин Л.А. Чеботаревский Б.Д.
Геометрия 11 класс Контрольные работы (из Методического пособия)
Авторы: Буцко Е.В. Мерзляк А.Г.
Геометрия 11 класс Контрольные работы (из Методического пособия)
Авторы: Буцко Е.В. Мерзляк А.Г.
ГДЗ Геометрія 8 клас Істер 2021
Розділ 1. Чотирикутники № 1 — 444
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 122 123 124 125 126 127 128 129 130 131 132 133 134 135 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 154 155 156 157 158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186 187 188 189 190 191 192 193 194 195 196 197 198 199 200 201 202 203 204 205 206 207 208 209 210 211 212 213 214 215 216 217 218 219 220 221 222 223 224 225 226 227 228 229 230 231 232 233 234 235 236 237 238 239 240 241 242 243 244 245 246 247 248 249 250 251 252 253 254 255 256 257 258 259 260 261 262 263 264 265 266 267 268 269 270 271 272 273 274 275 276 277 278 279 280 281 282 283 284 285 286 287 288 289 290 291 292 293 294 295 296 297 298 299 300 301 302 303 304 305 306 307 308 309 310 311 312 313 314 315 316 317 318 319 320 321 322 323 324 325 326 327 328 329 330 331 332 333 334 335 336 337 338 339 340 341 342 343 344 345 346 347 348 349 350 351 352 353 354 355 356 357 358 359 360 361 362 363 364 365 366 367 368 369 370 371 372 373 374 375 376 377 378 379 380 381 382 383 384 385 386 387 388 389 390 391 392 393 394 395 396 397 398 399 400 401 402 403 404 405 406 407 408 409 410 411 412 413 414 415 416 417 418 419 420 421 422 423 424 425 426 427 428 429 430 431 432 433 434 435 436 437 438 439 440 441 442 443 444
Розділ 2.
 Подібність трикутників
№ 445 — 647
Подібність трикутників
№ 445 — 647445 446 447 448 449 450 451 452 453 454 455 456 457 458 459 460 461 462 463 464 465 466 467 468 469 470 471 472 473 474 475 476 477 478 479 480 481 482 483 484 485 486 487 488 489 490 491 492 493 494 495 496 497 498 499 500 501 502 503 504 505 506 507 508 509 510 511 512 513 514 515 516 517 518 519 520 521 522 523 524 525 526 527 528 529 530 531 532 533 534 535 536 537 538 539 540 541 542 543 544 545 546 547 548 549 550 551 552 553 554 555 556 557 558 559 560 561 562 563 564 565 566 567 568 569 570 571 572 573 574 575 576 577 578 579 580 581 582 583 584 585 586 587 588 589 590 591 592 593 594 595 596 597 598 599 600 601 602 603 604 605 606 607 608 609 610 611 612 613 614 615 616 617 618 619 620 621 622 623 624 625 626 627 628 629 630 631 632 633 634 635 636 637 638 639 640 641 642 643 644 645 646 647
Розділ 3. Розв’язування прямокутних трикутників № 648 — 838
648 649 650 651 652 653 654 655 656 657 658 659 660 661 662 663 664 665 666 667 668 669 670 671 672 673 674 675 676 677 678 679 680 681 682 683 684 685 686 687 688 689 690 691 692 693 694 695 696 697 698 699 700 701 702 703 704 705 706 707 708 709 710 711 712 713 714 715 716 717 718 719 720 721 722 723 724 725 726 727 728 729 730 731 732 733 734 735 736 737 738 739 740 741 742 743 744 745 746 747 748 749 750 751 752 753 754 755 756 757 758 759 760 761 762 763 764 765 766 767 768 769 770 771 772 773 774 775 776 777 778 779 780 781 782 783 784 785 786 787 788 789 790 791 792 793 794 795 796 797 798 799 800 801 802 803 804 805 806 807 808 809 810 811 812 813 814 815 816 817 818 819 820 821 822 823 824 825 826 827 828 829 830 831 832 833 834 835 836 837 838
Розділ 4.
 Многокутники. Площі многокутників
№ 839 — 1043
Многокутники. Площі многокутників
№ 839 — 1043839 840 841 842 843 844 845 846 847 848 849 850 851 852 853 854 855 856 857 858 859 860 861 862 863 864 865 866 867 868 869 870 871 872 873 874 875 876 877 878 879 880 881 882 883 884 885 886 887 888 889 890 891 892 893 894 895 896 897 898 899 900 901 902 903 904 905 906 907 908 909 910 911 912 913 914 915 916 917 918 919 920 921 922 923 924 925 926 927 928 929 930 931 932 933 934 935 936 937 938 939 940 941 942 943 944 945 946 947 948 949 950 951 952 953 954 955 956 957 958 959 960 961 962 963 964 965 966 967 968 969 970 971 972 973 974 975 976 977 978 979 980 981 982 983 984 985 986 987 988 989 990 991 992 993 994 995 996 997 998 999 1000 1001 1002 1003 1004 1005 1006 1007 1008 1009 1010 1011 1012 1013 1014 1015 1016 1017 1018 1019 1020 1021 1022 1023 1024 1025 1026 1027 1028 1029 1030 1031 1032 1033 1034 1035 1036 1037 1038 1039 1040 1041 1042 1043
Домашні самостійні роботи 1 — 5
Домашня самостійна робота № 1 (§§ 1 — 5) № 1 — 12
1 2 3 4 5 6 7 8 9 10 11 12
Домашня самостійна робота № 2 (§§ 6 — 11) № 1 — 12
1 2 3 4 5 6 7 8 9 10 11 12
Домашня самостійна робота № 3 (§§ 12 — 17) № 1 — 12
Домашня самостійна робота № 4 (§§ 18 — 21) № 1 — 12
Домашня самостійна робота № 5 (§§ 22 — 26) № 1 — 12
Завдання для перевірки знань
Завдання для перевірки знань до §§ 1 — 5 № 1 — 11
1 2 3 4 5 6 7 8 9 10 11
Завдання для перевірки знань до §§ 6 — 11 № 1 — 11
1 2 3 4 5 6 7 8 9 10 11
Завдання для перевірки знань до §§ 12-17 № 1 — 11
Завдання для перевірки знань до §§ 18 — 21 № 1 — 11
Завдання для перевірки знань до §§ 22 — 26 № 1 — 11
Завдання для перевірки знань за курс геометрії 8 класу № 1 — 9
1 2 3 4 5 6 7 8 9
Задачі підвищеної складності № 1044 — 1085
1044 1045 1046 1047 1048 1049 1050 1051 1052 1053 1054 1055 1056 1057 1058 1059 1060 1061 1062 1063 1064 1065 1066 1067 1068 1069 1070 1071 1072 1073 1074 1075 1076 1077 1078 1079 1080 1081 1082 1083 1084 1085
Решебник (ГДЗ) для учебника Геометрія 8 класс О.
 С. Істер (2016 рік)
С. Істер (2016 рік)| Авторы: О.С. Істер | ||
| Год: 2016 | Класс: 8 | Предмет: Геометрія |
Готуємося до ЗНО
Завдання для перевірки знань за курс геометрії 8 класу
Задачі підвищеної складності
Розділ 1.
 Чотирикутники
Чотирикутники§ 1. Чотирикутник, його елементи. Сума кутів чотирикутника — Розділ 1. Чотирикутники
§ 2. Паралелограм, його властивості й ознаки — Розділ 1. Чотирикутники
§ 3. Прямокутник і його властивості — Розділ 1. Чотирикутники
§ 4. Ромб і його властивості — Розділ 1. Чотирикутники
§ 5. Квадрат і його властивості — Розділ 1.
 Чотирикутники
Чотирикутники§ 6. Трапеція — Розділ 1. Чотирикутники
§ 7. Вписані та центральні кути — Розділ 1. Чотирикутники
§ 8. Вписані та описані чотирикутники — Розділ 1. Чотирикутники
§ 9. Теорема Фалеса — Розділ 1. Чотирикутники
§ 10. Середня лінія трикутника, її властивості — Розділ 1.
 Чотирикутники
Чотирикутники§ 11. Середня лінія трапеції, її властивості — Розділ 1. Чотирикутники
Вправи для повторення розділу 1 — Розділ 1. Чотирикутники
Домашня самостійна робота № 1 — Розділ 1. Чотирикутники
Домашня самостійна робота № 2 — Розділ 1. Чотирикутники
Завдання для перевірки знань до § 1 — 5 — Розділ 1.
 Чотирикутники
ЧотирикутникиЗавдання для перевірки знань до § 6 — 11 — Розділ 1. Чотирикутники
Розділ 2. Подібність трикутників
§ 12. Узагальнена теорема Фалеса — Розділ 2. Подібність трикутників
§ 13. Подібні трикутники — Розділ 2. Подібність трикутників
§ 14. Ознаки подібності трикутників — Розділ 2.
 Подібність трикутників
Подібність трикутників§ 15. Середні пропорційні відрізки у прямокутному трикутнику — Розділ 2. Подібність трикутників
§ 16. Властивість бісектриси трикутника — Розділ 2. Подібність трикутників
§ 17. Застосування подібності трикутників до розв’язування задач — Розділ 2. Подібність трикутників
Вправи для повторення розділу 2 — Розділ 2. Подібність трикутників
Домашня самостійна робота № 3 — Розділ 2.
 Подібність трикутників
Подібність трикутниківЗавдання для перевірки знань до § 12 — 17 — Розділ 2. Подібність трикутників
Розділ 3. Розв’язування прямокутних трикутників
§ 18. Теорема Піфагора — Розділ 3. Розв’язування прямокутних трикутників
§ 19. Перпендикуляр і похила, їх властивості — Розділ 3. Розв’язування прямокутних трикутників
§ 20.
 Синус, косинус і тангенс гострого кута прямокутного трикутника. Співвідношення між сторонами і кутами прямокутного трикутника — Розділ 3. Розв’язування прямокутних трикутників
Синус, косинус і тангенс гострого кута прямокутного трикутника. Співвідношення між сторонами і кутами прямокутного трикутника — Розділ 3. Розв’язування прямокутних трикутників§ 21. Розв’язування прямокутних трикутників — Розділ 3. Розв’язування прямокутних трикутників
Вправи для повторення розділу 3 — Розділ 3. Розв’язування прямокутних трикутників
Домашня самостійна робота № 4 — Розділ 3. Розв’язування прямокутних трикутників
Завдання для перевірки знань до § 18 — 21 — Розділ 3.
 Розв’язування прямокутних трикутників
Розв’язування прямокутних трикутників
Розділ 4. Многокутники. Площі многокутників
§ 22. Многокутник і його елементи. Сума кутів опуклого многокутника. Многокутник, вписаний у коло, і многокутник, описаний навколо кола — Розділ 4. Многокутники. Площі многокутників
§ 23. Поняття площі многокутника. Площа прямокутника — Розділ 4. Многокутники. Площі многокутників
§ 24. Площа паралелограма — Розділ 4. Многокутники. Площі многокутників
§ 25.
 Площа трикутника — Розділ 4. Многокутники. Площі многокутників
Площа трикутника — Розділ 4. Многокутники. Площі многокутників§ 26. Площа трапеції — Розділ 4. Многокутники. Площі многокутників
Вправи для повторення розділу 4 — Розділ 4. Многокутники. Площі многокутників
Домашня самостійна робота № 5 — Розділ 4. Многокутники. Площі многокутників
Завдання для перевірки знань до § 22 — 26 — Розділ 4. Многокутники. Площі многокутників
В 8 классе школьники изучают такой предмет как Геометрія по учебнику авторов О. С. Істер 2016 г.
Решебник к нему поможет быстрее разобраться с “домашкой” и лучше усвоить материал:
С. Істер 2016 г.
Решебник к нему поможет быстрее разобраться с “домашкой” и лучше усвоить материал:
- сверить ответы;
- исправить ошибки;
- понять ход выполнения задания.
Дисциплина “Геометрія” не обязательно должна вызывать у ребенка трудности, чтобы прибегать к ГДЗ. Готовые домашние задания – это отличный способ контроля и для родителей, которым больше не придется ломать голову над упражнением или задачей.
Структура ГДЗ “Геометрія” за 8 класс О.С. Істер (2016 рік)
Решебник к пособию 2016 года разбит на следующие разделы:
- Готуємося до ЗНО
- Завдання для перевірки знань за курс геометрії 8 класу
- Задачі підвищеної складності
- Розділ 1.
 Чотирикутники
Чотирикутники - Розділ 2. Подібність трикутників
- Розділ 3. Розв’язування прямокутних трикутників
- Розділ 4. Многокутники. Площі многокутників
В каждом из них размещены оцифрованные подробные ответы к заданиям, включая исходное условие.
ГДЗ О.С. Істер (2016 рік) – это просто!
Чтобы пользоваться решебником “Геометрія” для 8 класса О.С. Істер 2016 г., не нужно скачивать книгу или специальные программы для ее просмотра. Все готовые решения к пособию доступны онлайн с любого устройства.
ГДЗ вправа 766 алгебра 8 класс Истер – Telegraph
➡➡➡ ПОДРОБНЕЕ ЖМИТЕ ЗДЕСЬ!
ГДЗ вправа 766 алгебра 8 класс Истер
Подробное решение вправа № 766 по алгебре для учащихся 8 класса , авторов Истер 2019 .
Розв’язки та відповіді вправ . Вправа 766 алгебра Істер гдз 8 клас . Вправа 766 алгебра Істер гдз 8 клас .
Подробный решебник (ГДЗ ) по Алгебре за 8 (восьмой ) класс — готовый ответ вправа — 766 . Авторы учебника: Истер . Издательство: Генеза 2019 .
ГДЗ 8 клас ГДЗ алгебра Істер . алгебра .
Розв’язок для завдання або номер, правильні відповіді та гдз онлайн вправа 766 алгебра 8 клас Істер . Перевіряй і правильно виконуй домашню роботу . У тебе є змога переглянути на цій сторінці повні відповіді та готові домашні завдання ГДЗ для восьмого класу з алгебри Істер . .
Відповіді Алгебра 8 клас Істер 2019 . ГДЗ . загрузка . . Ответы к учебник Алгебра 8 класс Истер — решебник .
На уроке в школе ГДЗ Алгебра 8 клас О .С . Істер будет с тобой . Ведь к нам на сайт можно зайти не только с компьютера, а еще и с мобильного телефона . На этом интернет ресурсе нет регистрации и оплаты, что сделает обучение в восьмом классе значительно приятнее .
Готові домашні роботи до підручника 8 клас Алгебра Істер О . , Генеза, 2019 рік . . .
, Генеза, 2019 рік . . .
Ищете решебник по алгебре за 8 класс? На нашем портале собраны решебники для всех учебников по В 8 классе математические науки изучаются основательно . Алгебра — одна из них . ГДЗ — не инструмент избавления от выполнения классных и домашних заданий .
«Алгебра . 8 клас .» ГДЗ . Iстер О . С . Відповіді до підручника з алгебри для 8 класу Істер . Ответы к учебнику по алгебре для 8 класса Истер . 766 .
ГДЗ по алгебре к учебнику Истер за 8 клас пользуются многие школьники . Особенно это необходимо в старших классах, ведь материал Такие подсказки полезны и для учеников, и для их родителей . В 8 классе родители очень часто проверяют еще правильность выполнения . .
Скачать ГДЗ Алгебра 8 класс О .С . Iстер вы можете на mydomashka .ru . Самые правильные ответы вы найдете здесь . О решебнике О .С . Iстер . Другие решебники по алгебре для 8 классa .
766 . Основи алгебри вивчаємо з ГДЗ . Якщо стандартна математика у початкових класах ще не була надто складною, то алгебра з 8 класу Алгебра та геометрія формують вищу математику . Другою частиною, яка формує математику для старшокласників, окрім алгебри є геометрія .
Другою частиною, яка формує математику для старшокласників, окрім алгебри є геометрія .
Мегарешеба — Белорусские ГДЗ и Решебник по Алгебре поможет Вам найти ответ на самое сложное задание для 8 класса . Решай онлайн домашку вместе с нами!
Готові домашні завдання з алгебри для 8 -х класів, автор Істер О . С . ГДЗ на домашні самостійні роботи і завдання для перевірки знань . Відповіді видані у 2019 році за новою програмою .
Подробное решение вправа № 766 по алгебре для учащихся 8 класса , авторов Истер 2019 .
Розв’язки та відповіді вправ . Вправа 766 алгебра Істер гдз 8 клас . Вправа 766 алгебра Істер гдз 8 клас .
Подробный решебник (ГДЗ ) по Алгебре за 8 (восьмой ) класс — готовый ответ вправа — 766 . Авторы учебника: Истер . Издательство: Генеза 2019 .
ГДЗ 8 клас ГДЗ алгебра Істер . алгебра .
Розв’язок для завдання або номер, правильні відповіді та гдз онлайн вправа 766 алгебра 8 клас Істер . Перевіряй і правильно виконуй домашню роботу . У тебе є змога переглянути на цій сторінці повні відповіді та готові домашні завдання ГДЗ для восьмого класу з алгебри Істер . .
У тебе є змога переглянути на цій сторінці повні відповіді та готові домашні завдання ГДЗ для восьмого класу з алгебри Істер . .
Відповіді Алгебра 8 клас Істер 2019 . ГДЗ . загрузка . . Ответы к учебник Алгебра 8 класс Истер — решебник .
На уроке в школе ГДЗ Алгебра 8 клас О .С . Істер будет с тобой . Ведь к нам на сайт можно зайти не только с компьютера, а еще и с мобильного телефона . На этом интернет ресурсе нет регистрации и оплаты, что сделает обучение в восьмом классе значительно приятнее .
Готові домашні роботи до підручника 8 клас Алгебра Істер О ., Генеза, 2019 рік . . .
Ищете решебник по алгебре за 8 класс? На нашем портале собраны решебники для всех учебников по В 8 классе математические науки изучаются основательно . Алгебра — одна из них . ГДЗ — не инструмент избавления от выполнения классных и домашних заданий .
«Алгебра . 8 клас .» ГДЗ . Iстер О . С . Відповіді до підручника з алгебри для 8 класу Істер . Ответы к учебнику по алгебре для 8 класса Истер . 766 .
766 .
ГДЗ по алгебре к учебнику Истер за 8 клас пользуются многие школьники . Особенно это необходимо в старших классах, ведь материал Такие подсказки полезны и для учеников, и для их родителей . В 8 классе родители очень часто проверяют еще правильность выполнения . .
Скачать ГДЗ Алгебра 8 класс О .С . Iстер вы можете на mydomashka .ru . Самые правильные ответы вы найдете здесь . О решебнике О .С . Iстер . Другие решебники по алгебре для 8 классa .
766 . Основи алгебри вивчаємо з ГДЗ . Якщо стандартна математика у початкових класах ще не була надто складною, то алгебра з 8 класу Алгебра та геометрія формують вищу математику . Другою частиною, яка формує математику для старшокласників, окрім алгебри є геометрія .
Мегарешеба — Белорусские ГДЗ и Решебник по Алгебре поможет Вам найти ответ на самое сложное задание для 8 класса . Решай онлайн домашку вместе с нами!
Готові домашні завдання з алгебри для 8 -х класів, автор Істер О . С . ГДЗ на домашні самостійні роботи і завдання для перевірки знань . Відповіді видані у 2019 році за новою програмою .
Відповіді видані у 2019 році за новою програмою .
ГДЗ § 21 1 история 7 класс рабочая тетрадь История России Данилов, Косулина
ГДЗ учебник 2015. упражнение 1187 (338) математика 5 класс Виленкин, Жохов
ГДЗ упражнение 565 русский язык 4 класс Рамзаева
ГДЗ задание 153 информатика 9 класс рабочая тетрадь Босова, Босова
ГДЗ самостоятельная работа / вариант 1 / С-33 1 алгебра 8 класс дидактические материалы Жохов, Макарычев
ГДЗ часть 1. вопросы и задания. страница 30 литература 2 класс Ефросинина
ГДЗ часть 2 (страница) 75 литература 2 класс Кац
ГДЗ упражнение 404 русский язык 7 класс Бунеев, Бунеева
ГДЗ номер / § 5 120 алгебра 11 класс Никольский, Потапов
ГДЗ по английскому языку 5 класс рабочая тетрадь Кузовлев, Лапа Решебник
ГДЗ сторінка 71 английский язык 4 класс Морська, Кучма
ГДЗ контрольная работа / контрольная работа №5 / подготовительный вариант 6 алгебра 7 класс дидактические материалы Феоктистов
ГДЗ глава 16 10 физика 9 класс Задачник Генденштейн, Кирик
ГДЗ номер 635 алгебра 7 класс Мерзляк, Полонский
ГДЗ приложение 49 математика 6 класс Мерзляк, Полонский
ГДЗ часть 2 / что узнали. чему научились / задания на страницах 67-71 17 математика 4 класс Моро, Бантова
чему научились / задания на страницах 67-71 17 математика 4 класс Моро, Бантова
ГДЗ упражнение 206 русский язык 5 класс Ладыженская, Баранов
ГДЗ параграф § 5–6 история 6 класс Пчелов, Лукин
ГДЗ по окружающему миру 4 класс проверочные и диагностические работы Потапов, Калинина Решебник
ГДЗ параграф 8 13 алгебра 7 класс рабочая тетрадь Колягин, Ткачева
ГДЗ часть 1 Ивченкова (страница) 111 окружающий мир 3 класс Потапов, Саплина
ГДЗ номер 1026 алгебра 7 класс Макарычев, Миндюк
ГДЗ номер 1477 физика 7‐9 класс сборник задач Лукашик, Иванова
ГДЗ упражнение 364 русский язык 3 класс Нечаева, Яковлева
ГДЗ учебник 2009 / упражнения / упражнение 50 1 физика 9 класс Перышкин, Гутник
ГДЗ задание 949 математика 5 класс Никольский, Потапов
ГДЗ часть 1 (страница) 84 литература 4 класс Климанова, Виноградская
ГДЗ часть №1 / упражнение 83 математика 2 класс Александрова
ГДЗ упражнение 328 русский язык 6 класс Разумовская, Львова
ГДЗ часть 2 (страница) 58 литература 3 класс Климанова, Виноградская
ГДЗ часть 2. страница 21 математика 2 класс Дорофеев, Миракова
страница 21 математика 2 класс Дорофеев, Миракова
ГДЗ часть 3. упражнение 39 русский язык 4 класс Каленчук, Чуракова
ГДЗ часть №1 / номер 39 русский язык 2 класс Канакина, Горецкий
ГДЗ вариант 1 35 геометрия 9 класс дидактические материалы Мерзляк, Полонский
ГДЗ упражнения 108 английский язык 8 класс сборник упражнений к учебнику Биболетовой Барашкова
ГДЗ задание 158 информатика 9 класс рабочая тетрадь Босова, Босова
ГДЗ упражнение 395 русский язык 4 класс Соловейчик, Кузьменко
ГДЗ вычислительный практикум 859 математика 6 класс Муравин, Муравина
ГДЗ вправа 60 алгебра 8 класс Истер
ГДЗ упражнение 73 русский язык 1 класс Климанова, Макеева
ГДЗ Unit 2 / section 1-4 4 английский язык 5 класс Биболетова, Денисенко
ГДЗ часть №2 / 3 7 химия 8‐9 класс задачник с помощником Гара, Габрусева
ГДЗ § 7 2 история 6 класс рабочая тетрадь Данилов, Косулина
ГДЗ страница 23 английский язык 8 класс Любченко, Любченко
ГДЗ вправа 696 алгебра 7 класс Истер
ГДЗ упражнение 381 русский язык 6 класс Ладыженская, Баранов
ГДЗ §12 7 химия 10 класс Рудзитис, Фельдман
ГДЗ параграф 9 4 алгебра 9 класс рабочая тетрадь Ткачева, Федорова
ГДЗ номер 50 математика 5 класс Дорофеев, Шарыгин
ГДЗ задание 801 математика 5 класс Никольский, Потапов
ГДЗ По Геометрии 7 Класс Мерзляк Вопросы
ГДЗ Класс Математика Мерзляк Решебник
Решебник По Английскому 5 Класс Тетрадь
ГДЗ страница 50 английский язык 3 класс рабочая тетрадь Brilliant Комарова, Ларионова
ГДЗ упражнение 336 русский язык 5 класс Разумовская, Львова
Альдегиды, кетоны, карбоновые кислоты и сложные эфиры
Результаты обучения
- Описать структуру и свойства альдегидов, кетонов, карбоновых кислот и сложных эфиров
Другой класс органических молекул содержит атом углерода, соединенный с атомом кислорода двойной связью, обычно называемой карбонильной группой. Тригональный плоский углерод в карбонильной группе может присоединяться к двум другим заместителям, что приводит к нескольким подсемействам (альдегиды, кетоны, карбоновые кислоты и сложные эфиры), описанным в этом разделе.
Тригональный плоский углерод в карбонильной группе может присоединяться к двум другим заместителям, что приводит к нескольким подсемействам (альдегиды, кетоны, карбоновые кислоты и сложные эфиры), описанным в этом разделе.
Альдегиды и кетоны
Альдегиды и кетоны содержат карбонильную группу , функциональную группу с двойной углерод-кислородной связью. Названия альдегидных и кетоновых соединений получены с использованием тех же правил номенклатуры, что и для алканов и спиртов, и включают суффиксы, идентифицирующие класс, -al и -one соответственно:
В альдегиде карбонильная группа связана с хотя бы один атом водорода. В кетонах карбонильная группа связана с двумя атомами углерода:
В тексте альдегидная группа представлена как –CHO; кетон представлен как –C(O)– или –CO–.
И в альдегидах, и в кетонах геометрия вокруг атома углерода в карбонильной группе тригонально-плоская; атом углерода проявляет sp 2 гибридизацию. Две из sp 2 орбиталей на атоме углерода в карбонильной группе используются для образования σ-связей с другими атомами углерода или водорода в молекуле. Остальные sp 2 гибридная орбиталь образует σ-связь с атомом кислорода. Негибридизованная орбиталь p атома углерода в карбонильной группе перекрывается с орбиталью p атома кислорода с образованием π-связи в двойной связи.
Две из sp 2 орбиталей на атоме углерода в карбонильной группе используются для образования σ-связей с другими атомами углерода или водорода в молекуле. Остальные sp 2 гибридная орбиталь образует σ-связь с атомом кислорода. Негибридизованная орбиталь p атома углерода в карбонильной группе перекрывается с орбиталью p атома кислорода с образованием π-связи в двойной связи.
Рисунок 1. Карбонильная группа полярна, а геометрия связей вокруг центрального атома углерода тригонально-плоская.
Подобно связи [латекс]\text{C}=\text{O}[/latex] в диоксиде углерода, связь [латекс]\text{C}=\text{O}[/latex] карбонила группа является полярной (напомним, что кислород значительно более электроотрицательный, чем углерод, и общие электроны притягиваются к атому кислорода и от атома углерода). Многие реакции альдегидов и кетонов начинаются с реакции между основанием Льюиса и атомом углерода на положительном конце полярной [латексной]\text{C}=\text{O}[/latex] связи с образованием нестабильной промежуточное соединение, которое впоследствии подвергается одной или нескольким структурным перестройкам с образованием конечного продукта (рис. 1).
1).
Важность молекулярной структуры для реакционной способности органических соединений иллюстрируется реакциями, в результате которых образуются альдегиды и кетоны. Мы можем получить карбонильную группу путем окисления спирта — для органических молекул говорят, что окисление атома углерода происходит, когда связь углерод-водород заменяется связью углерод-кислород. Обратная реакция — замена связи углерод-кислород на связь углерод-водород — представляет собой восстановление этого атома углерода. Напомним, что кислороду обычно присваивается степень окисления -2, если только он не является элементарным или не присоединен к фтору. Водороду обычно присваивается степень окисления +1, если он не связан с металлом. Поскольку для углерода нет определенного правила, его степень окисления определяется алгебраически путем факторизации атомов, к которым он присоединен, и общего заряда молекулы или иона. Как правило, атом углерода, присоединенный к атому кислорода, будет иметь более положительную степень окисления, а атом углерода, присоединенный к атому водорода, будет иметь более отрицательную степень окисления. Это должно хорошо соответствовать вашему пониманию полярности связей C–O и C–H. Другие реагенты и возможные продукты этих реакций выходят за рамки этой главы, поэтому мы сосредоточимся только на изменениях атомов углерода:
Это должно хорошо соответствовать вашему пониманию полярности связей C–O и C–H. Другие реагенты и возможные продукты этих реакций выходят за рамки этой главы, поэтому мы сосредоточимся только на изменениях атомов углерода:
Пример 1:
Окисление и восстановление в органической химииМетан представляет собой полностью восстановленную форму органической молекулы, содержащей один атом углерода. Последовательная замена каждой связи углерод-водород связью углерод-кислород приведет к спирту, затем к альдегиду, затем к карбоновой кислоте (обсуждается позже) и, наконец, к диоксиду углерода:
[латекс] {\ text { CH}}_{4}\rightarrow{\text{CH}}_{3}\text{OH}\rightarrow{\text{CH}}_{2}\text{O}\rightarrow{\text{HCO }}_{2}\text{H}\rightarrow{\text{CO}}_{2}[/латекс]
Каковы степени окисления атомов углерода в молекулах, показанных здесь?
Показать решение
Проверьте свои знания
Укажите, окисляются или восстанавливаются отмеченные здесь атомы углерода в трех молекулах по отношению к отмеченному атому углерода в этаноле:
В этом случае нет необходимости вычислять степени окисления; вместо этого просто сравните типы атомов, связанных с отмеченными атомами углерода:
Показать решение
Альдегиды обычно получают окислением спиртов, у которых функциональная группа –ОН расположена на атоме углерода в конце цепочки атомов углерода в спирте:
Спирты, содержащие группы –ОН в середине цепи, необходимы для синтеза кетона, для которого требуется, чтобы карбонильная группа была связана с двумя другими атомами углерода:
Спирт, группа –ОН которого связана с атомом углерода который не связан ни с одним другим атомом углерода или с одним другим атомом углерода, образует альдегид. Спирт, у которого группа –ОН присоединена к двум другим атомам углерода, образует кетон. Если к углероду, связанному с –ОН, присоединены три атома углерода, в молекуле не будет замещаемой связи С–Н, поэтому она не будет восприимчива к окислению.
Спирт, у которого группа –ОН присоединена к двум другим атомам углерода, образует кетон. Если к углероду, связанному с –ОН, присоединены три атома углерода, в молекуле не будет замещаемой связи С–Н, поэтому она не будет восприимчива к окислению.
Формальдегид, альдегид с формулой HCHO, представляет собой бесцветный газ с резким раздражающим запахом. Он продается в виде водного раствора, называемого формалином, который содержит около 37% формальдегида по весу. Формальдегид вызывает коагуляцию белков, поэтому он убивает бактерии (и любой другой живой организм) и останавливает многие биологические процессы, вызывающие разложение тканей. Так, формальдегид используется для консервации образцов тканей и бальзамирования тел. Он также используется для стерилизации почвы или других материалов. Формальдегид используется в производстве бакелита, твердого пластика, обладающего высокой химической и электрической стойкостью.
Диметилкетон, CH 3 COCH 3 , обычно называемый ацетоном, является простейшим кетоном. Его производят путем ферментации кукурузы или патоки или путем окисления 2-пропанола. Ацетон — бесцветная жидкость. Среди его многочисленных применений — растворитель для лака (включая лак для ногтей), ацетат целлюлозы, нитрат целлюлозы, ацетилен, пластмассы и лаки; как средство для снятия краски и лака; и как растворитель в производстве фармацевтических препаратов и химикатов.
Его производят путем ферментации кукурузы или патоки или путем окисления 2-пропанола. Ацетон — бесцветная жидкость. Среди его многочисленных применений — растворитель для лака (включая лак для ногтей), ацетат целлюлозы, нитрат целлюлозы, ацетилен, пластмассы и лаки; как средство для снятия краски и лака; и как растворитель в производстве фармацевтических препаратов и химикатов.
Вы можете просмотреть стенограмму «Альдегиды и кетоны: названия + свойства» здесь (откроется в новом окне).
Карбоновые кислоты и сложные эфиры
Запах уксуса обусловлен присутствием в уксусе карбоновой кислоты. Запах спелых бананов и многих других фруктов обусловлен наличием сложных эфиров, соединений, которые могут быть получены реакцией карбоновой кислоты со спиртом. Поскольку сложные эфиры не имеют водородных связей между молекулами, они имеют более низкое давление паров, чем спирты и карбоновые кислоты, из которых они получены (см. Рисунок 2).
Рисунок 2. Сложные эфиры отвечают за запахи, связанные с различными растениями и их плодами.
Обе карбоновые кислоты и сложные эфиры содержат карбонильную группу со вторым атомом кислорода, связанным с атомом углерода в карбонильной группе одинарной связью. В карбоновой кислоте второй атом кислорода также связан с атомом водорода. В сложном эфире второй атом кислорода связан с другим атомом углерода. Названия карбоновых кислот и сложных эфиров включают префиксы, которые обозначают длину углеродных цепей в молекулах, и получены в соответствии с правилами номенклатуры, аналогичными правилам для неорганических кислот и солей (см. эти примеры):
Функциональные группы кислоты и сложного эфира показаны в этих формулах красным цветом.
Атом водорода в функциональной группе карбоновой кислоты будет реагировать с основанием с образованием ионной соли:
Карбоновые кислоты являются слабыми кислотами (см. главу о кислотах и основаниях), что означает, что они не ионизированы в воде на 100%. . Обычно только около 1% молекул карбоновой кислоты, растворенной в воде, ионизируется в любой момент времени. Остальные молекулы не диссоциируют в растворе.
Остальные молекулы не диссоциируют в растворе.
Карбоновые кислоты получают окислением альдегидов или спиртов, у которых функциональная группа –ОН расположена на атоме углерода в конце цепочки атомов углерода в спирте:
Сложные эфиры получают реакцией кислот со спиртами. Например, этилацетатный эфир CH 3 CO 2 CH 2 CH 3 образуется при взаимодействии уксусной кислоты с этанолом: известен с 1670 года. Его название происходит от латинского слова formicus , что означает «муравей»; впервые он был выделен путем перегонки красных муравьев. Он частично отвечает за боль и раздражение от укусов муравьев и ос, а также за характерный запах муравьев, который иногда можно обнаружить в их гнездах.
Уксусная кислота, CH 3 CO 2 H, содержит 3–6% уксуса. Яблочный уксус получают, позволяя яблочному соку бродить без присутствия кислорода. Дрожжевые клетки, присутствующие в соке, осуществляют реакции брожения. Реакции брожения превращают сахар, присутствующий в соке, в этанол, а затем в уксусную кислоту. Чистая уксусная кислота имеет резкий запах и вызывает болезненные ожоги. Это отличный растворитель для многих органических и некоторых неорганических соединений, и он необходим для производства ацетата целлюлозы, компонента многих синтетических волокон, таких как искусственный шелк.
Реакции брожения превращают сахар, присутствующий в соке, в этанол, а затем в уксусную кислоту. Чистая уксусная кислота имеет резкий запах и вызывает болезненные ожоги. Это отличный растворитель для многих органических и некоторых неорганических соединений, и он необходим для производства ацетата целлюлозы, компонента многих синтетических волокон, таких как искусственный шелк.
Отличительные и привлекательные запахи и вкусы многих цветов, духов и спелых фруктов обусловлены присутствием одного или нескольких сложных эфиров (рис. 3). Среди наиболее важных природных сложных эфиров жиры (такие как сало, жир и сливочное масло) и масла (такие как льняное, хлопковое и оливковое масла), которые представляют собой сложные эфиры глицерина тригидроксильного спирта, C 3 H 5 (OH) 3 , с большими карбоновыми кислотами, такими как пальмитиновая кислота, CH 3 (CH 2 ) 14 CO 2 H, стеариновая кислота, CH 3 (CH 2 ) 16 CO 2 H, и олеиновая кислота, [латекс] {\ text {CH}}_ {3} \left({\text{CH}}_{2}\right)}_{7}\text{CH}=\text{CH}{\left({\text{CH}}_{2}\right )}_{7}{\text{CO}}_{2}\text{H}[/latex]. Олеиновая кислота является ненасыщенной кислотой; он содержит двойную связь [латекс]\текст{С}=\текст{С}[/латекс]. Пальмитиновая и стеариновая кислоты представляют собой насыщенные кислоты, не содержащие двойных или тройных связей.
Олеиновая кислота является ненасыщенной кислотой; он содержит двойную связь [латекс]\текст{С}=\текст{С}[/латекс]. Пальмитиновая и стеариновая кислоты представляют собой насыщенные кислоты, не содержащие двойных или тройных связей.
Рисунок 3. В клубнике было обнаружено более 350 различных летучих молекул (многие члены семейства сложных эфиров). (кредит: Ребекка Сигел)
Вы можете просмотреть стенограмму «Карбоновые кислоты: названия + свойства» здесь (откроется в новом окне).
Ключевые понятия и резюме
Функциональные группы, относящиеся к карбонильной группе, включают группу –CHO альдегида, группу –CO– кетона, группу –CO 2 H группы карбоновой кислоты и –CO 2 R группа сложного эфира. Карбонильная группа, двойная углерод-кислородная связь, является ключевой структурой в этих классах органических молекул: альдегиды содержат по крайней мере один атом водорода, присоединенный к карбонильному атому углерода, кетоны содержат две углеродные группы, присоединенные к карбонильному атому углерода, карбоновые кислоты содержат гидроксильную группу, присоединенную к карбонильному атому углерода, а сложные эфиры содержат атом кислорода, присоединенный к другой углеродной группе, связанной с карбонильным атомом углерода. Все эти соединения содержат окисленные атомы углерода по отношению к атому углерода спиртовой группы.
Все эти соединения содержат окисленные атомы углерода по отношению к атому углерода спиртовой группы.
Попробуйте
- Упорядочите следующие молекулы от наименее до наиболее окисленных в зависимости от отмеченного атома углерода:
- Предскажите продукты окисления молекул, показанных в этой задаче. В каждом случае определите продукт, который будет получен в результате минимального повышения степени окисления выделенного атома углерода:
- Предскажите продукты восстановления следующих молекул. В каждом случае определите продукт, который будет получен в результате минимального уменьшения степени окисления выделенного атома углерода:
- Объясните, почему невозможно получить кетон, содержащий только два атома углерода.
- Как изменяется гибридизация замещенного атома углерода при превращении спирта в альдегид? Альдегид карбоновой кислоты?
- Жирные кислоты представляют собой карбоновые кислоты, которые имеют длинные углеводородные цепи, присоединенные к карбоксилатной группе.
 Чем насыщенная жирная кислота отличается от ненасыщенной жирной кислоты? Чем они похожи?
Чем насыщенная жирная кислота отличается от ненасыщенной жирной кислоты? Чем они похожи? - Напишите сокращенную структурную формулу, например CH 3 CH 3 , и опишите молекулярную геометрию каждого атома углерода.
- пропилен
- 1-бутанол
- этилпропилпропиловый эфир
- цис -4-бром-2-гептен
- 2,2,3-триметилгексан
- формальдегид
- Напишите сокращенную структурную формулу, например CH 3 CH 3 , и опишите молекулярную геометрию каждого атома углерода.
- 2-пропанол
- ацетон
- диметиловый эфир
- уксусная кислота
- 3-метил-1-гексен
- Неприятный запах прогорклого масла вызывается масляной кислотой, CH 3 CH 2 CH 2 CO 2 H.
- Изобразите структуру Льюиса и определите степень окисления и степень гибридизации для каждого атома углерода в молекуле.

- Сложные эфиры, образующиеся из масляной кислоты, представляют собой приятно пахнущие соединения, содержащиеся во фруктах и используемые в парфюмерии. Изобразите структуру Льюиса сложного эфира, образующегося при взаимодействии масляной кислоты с 2-пропанолом.
- Изобразите структуру Льюиса и определите степень окисления и степень гибридизации для каждого атома углерода в молекуле.
- Напишите двухрезонансные структуры ацетат-иона.
- Напишите два полных сбалансированных уравнения для каждой из следующих реакций, одно с использованием сокращенных формул, а другое с использованием структур Льюиса:
- этанол реагирует с пропионовой кислотой
- бензойная кислота, C 6 H 5 CO 2 H, добавляется к раствору гидроксида натрия
- Напишите два полных сбалансированных уравнения для каждой из следующих реакций, одно с использованием сокращенных формул, а другое с использованием структур Льюиса.
- 1-бутанол реагирует с уксусной кислотой
- пропионовую кислоту наливают на твердый карбонат кальция
- Выходы в органических реакциях иногда низкие.
 Каков процентный выход процесса, который дает 13,0 г этилацетата из 10,0 г CH 3 CO 2 H?
Каков процентный выход процесса, который дает 13,0 г этилацетата из 10,0 г CH 3 CO 2 H? - Спирты A, B и C имеют состав C 4 H 10 O. Молекулы спирта A содержат разветвленную углеродную цепь и могут окисляться до альдегида; молекулы спирта Б содержат линейную углеродную цепь и могут окисляться до кетона; а молекулы спирта С не могут быть окислены ни до альдегида, ни до кетона. Напишите структуры Льюиса этих молекул.
Показать выбранные решения
Глоссарий
альдегид: органическое соединение, содержащее карбонильную группу, связанную с двумя атомами водорода, или атом водорода и углеродный заместитель
карбонильная группа: атом углерода, связанный двойной связью с атомом кислорода органическое соединение, содержащее карбонильную группу с присоединенной гидроксильной группой
сложный эфир: органическое соединение, содержащее карбонильную группу с присоединенным атомом кислорода, который связан с углеродным заместителем
кетон: органическое соединение, содержащее карбонильную группу с двумя присоединенными к ней углеродными заместителями
3.
 1: Функциональные группы — Химия LibreTexts
1: Функциональные группы — Химия LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 31398
Цели
После завершения этого раздела вы сможете
- объяснить, почему свойства данного органического соединения в значительной степени зависят от функциональной группы или групп, присутствующих в соединении.
- определяют функциональные группы, присутствующие в каждом из следующих типов соединений: алкены, алкины, арены, (алкил- и арил)галогениды, спирты, простые эфиры, альдегиды, кетоны, сложные эфиры, карбоновые кислоты, хлориды (карбоновых) кислот, амиды, амины, нитрилы, нитросоединения, сульфиды и сульфоксиды.

- идентифицируют функциональные группы, присутствующие в органическом соединении, учитывая его структуру.
- Учитывая структуру органического соединения, содержащего одну функциональную группу, определите, к какому из типов соединений, перечисленных выше в Задаче 2, оно принадлежит.
- нарисуйте структуру простого примера каждого из типов соединений, перечисленных в Задаче 2.
Ключевые термины
Убедитесь, что вы можете определить и использовать в контексте приведенный ниже ключевой термин.
- функциональная группа
Учебные заметки
Концепция функциональных групп очень важна. Мы ожидаем, что поначалу вам придется довольно часто обращаться к таблицам в конце раздела 3.1, поскольку на самом деле невозможно выучить названия и структуры всех функциональных групп и типов соединений за один присест. Постепенно они станут вам знакомы, и, в конце концов, вы узнаете их автоматически.
Функциональные группы представляют собой небольшие группы атомов, которые проявляют характерную реакционную способность. Конкретная функциональная группа почти всегда будет демонстрировать свое характерное химическое поведение, когда она присутствует в соединении. Из-за их важности для понимания органической химии функциональные группы имеют определенные названия, которые часто переносятся в названия отдельных соединений, включающих группы.
Конкретная функциональная группа почти всегда будет демонстрировать свое характерное химическое поведение, когда она присутствует в соединении. Из-за их важности для понимания органической химии функциональные группы имеют определенные названия, которые часто переносятся в названия отдельных соединений, включающих группы.
По мере того, как мы продвигаемся в изучении органической химии, становится чрезвычайно важным уметь быстро распознавать наиболее распространенные функциональные группы, поскольку они являются ключевыми структурными элементами, определяющими реакцию органических молекул. На данный момент мы будем беспокоиться только о рисовании и распознавании каждой функциональной группы, как показано Льюисом и линейными структурами. Большая часть оставшейся части вашего изучения органической химии будет посвящена изучению поведения различных функциональных групп в органических реакциях.
Рисование сокращенных органических структур
Часто при рисовании органических структур химики считают удобным использовать букву «R» для обозначения части молекулы за пределами интересующей области. Если мы просто хотим сослаться на функциональную группу в целом, не изображая конкретную молекулу, например, мы можем использовать «группы R», чтобы сосредоточить внимание на интересующей группе:
Если мы просто хотим сослаться на функциональную группу в целом, не изображая конкретную молекулу, например, мы можем использовать «группы R», чтобы сосредоточить внимание на интересующей группе:
Группа «R» — это удобный способ для сокращения структур больших биологических молекул, особенно когда нас интересует что-то, что происходит конкретно в одном месте молекулы.
Общие функциональные группы
В следующих разделах будут описаны многие из общих функциональных групп, встречающихся в органической химии. Таблицы этих функциональных групп можно найти внизу страницы.
Углеводороды
Простейшая функциональная группа в органической химии (которую часто игнорируют при перечислении функциональных групп) называется алкан , характеризующийся одинарными связями между двумя атомами углерода и между углеродом и водородом. Некоторые примеры алканов включают метан, CH 4 — это природный газ, который вы можете сжигать в печи или на плите. Октан, C 8 H 18 , является компонентом бензина.
Октан, C 8 H 18 , является компонентом бензина.
Алканы
Алкены (иногда называемые олефинами ) имеют углерод-углеродные двойные связи, а алкины имеют углерод-углеродные тройные связи. Этен, простейший пример алкена, представляет собой газ, который служит клеточным сигналом во фруктах, чтобы стимулировать созревание. (Если вы хотите, чтобы бананы созрели быстро, положите их в бумажный пакет вместе с яблоком — яблоко выделяет газ этен, запуская процесс созревания в бананах). Этин, обычно называемый ацетиленом, используется в качестве топлива в сварочных горелках.
Алкены и алкины
Алкены имеют тригональную плоскую электронную геометрию (из-за sp 2 гибридных орбиталей у алкеновых атомов углерода), в то время как алкины имеют линейную геометрию (из-за sp гибридных орбиталей у алкиновых атомов углерода). Кроме того, многие алкены могут принимать две геометрические формы: цис или транс (или Z и E, которые будут подробно описаны в главе 7) . цис и Транс-формы данного алкена представляют собой разные молекулы с разными физическими свойствами, существует очень высокий энергетический барьер для вращения вокруг двойной связи. В приведенном ниже примере очевидна разница между цис- и транс--алкенами.
цис и Транс-формы данного алкена представляют собой разные молекулы с разными физическими свойствами, существует очень высокий энергетический барьер для вращения вокруг двойной связи. В приведенном ниже примере очевидна разница между цис- и транс--алкенами.
Алканы, алкены и алкины классифицируются как углеводороды , поскольку они состоят исключительно из атомов углерода и водорода. Алканы называются насыщенными углеводородами , потому что углероды связаны с максимально возможным числом атомов водорода — другими словами, они насыщены атомами водорода. Углерод с двойной и тройной связью в алкенах и алкинах имеет меньше атомов водорода, связанных с ними, поэтому они называются ненасыщенными углеводородами . Как мы увидим в главе 7, водород может присоединяться к двойным и тройным связям в ходе реакции, называемой «гидрированием».
Ароматическая группа представлена бензолом (который раньше был широко используемым растворителем в органической лаборатории, но который оказался канцерогенным) и нафталином, соединением с характерным запахом «нафталина». Ароматические группы представляют собой плоские (плоские) кольцевые структуры и широко распространены в природе. Мы узнаем больше о строении и реакциях ароматических групп в главе 15.
Ароматические группы представляют собой плоские (плоские) кольцевые структуры и широко распространены в природе. Мы узнаем больше о строении и реакциях ароматических групп в главе 15.
Ароматические соединения
Функциональные группы с одинарными углеродными связями с другими атомами
Галогениды
галогеналкан . Наличие атома галогена (F, Cl, Br или I) часто обозначается буквой X из-за схожего химического состава галогенов. Хлороформ — полезный растворитель в лаборатории и один из первых анестетиков, использовавшихся в хирургии. Хлордифторметан использовался в качестве хладагента и в аэрозольных распылителях до конца двадцатого века, но его использование было прекращено после того, как было обнаружено, что он оказывает вредное воздействие на озоновый слой. Бромэтан представляет собой простой алкилгалогенид, часто используемый в органическом синтезе. Алкилгалогенидные группы довольно редко встречаются в биомолекулах.
Спирты и тиолы
В функциональной группе спирта углерод связан одинарной связью с группой ОН (группа ОН сама по себе называется гидроксилом ). За исключением метанола, все спирты можно разделить на первичные, вторичные и третичные. В первичном спирте углерод, связанный с группой ОН, также связан только с одним другим углеродом. Во вторичном спирте и третичном спирте углерод связан с двумя или тремя другими атомами углерода соответственно. Когда гидроксильная группа равна непосредственно присоединен к ароматическому кольцу, полученная группа называется фенолом .
За исключением метанола, все спирты можно разделить на первичные, вторичные и третичные. В первичном спирте углерод, связанный с группой ОН, также связан только с одним другим углеродом. Во вторичном спирте и третичном спирте углерод связан с двумя или тремя другими атомами углерода соответственно. Когда гидроксильная группа равна непосредственно присоединен к ароматическому кольцу, полученная группа называется фенолом .
Сернистый аналог спирта называется тиол (префикс тио , полученный из греческого, относится к сере).
Эфиры и сульфиды
В функциональной группе простого эфира центральный кислород связан с двумя атомами углерода. Ниже приведены линейная структура и структуры Льюиса диэтилового эфира, обычного лабораторного растворителя, а также одного из первых медицинских анестезирующих средств.
В сульфидов атом кислорода эфира заменен атомом серы.
Амины
Амины характеризуются атомами азота с одинарными связями с водородом и углеродом. Так же, как существуют первичные, вторичные и третичные спирты, существуют первичные, вторичные и третичные амины. Аммиак — это особый случай, в котором нет атомов углерода.
Одним из наиболее важных свойств аминов является то, что они являются основными и легко протонируются с образованием катионы аммония . В случае, когда азот имеет четыре связи с углеродом (что несколько необычно для биомолекул), его называют ионом четвертичного аммония.
Предупреждение
Не путайте термины «первичный», «вторичный» и «третичный» применительно к спиртам и аминам — определения разные. В спиртах важно, со сколькими другими атомами углерода связан углерод спирта , а в аминах важно, сколько атомов углерода связан с азотом .
Карбонил, содержащий функциональные группы
Альдегиды и кетоны
Существует ряд функциональных групп, содержащих двойную углерод-кислородную связь, которую обычно называют карбонилом . Кетоны и Альдегиды представляют собой две близкородственные функциональные группы на основе карбонила, которые реагируют очень похожим образом. В кетонах атом углерода карбонила связан с двумя другими атомами углерода. В альдегиде карбонильный углерод связан с одной стороны с водородом, а с другой стороны с углеродом. Исключением из этого определения является формальдегид, в котором карбонильный углерод связан с двумя атомами водорода.
Кетоны и Альдегиды представляют собой две близкородственные функциональные группы на основе карбонила, которые реагируют очень похожим образом. В кетонах атом углерода карбонила связан с двумя другими атомами углерода. В альдегиде карбонильный углерод связан с одной стороны с водородом, а с другой стороны с углеродом. Исключением из этого определения является формальдегид, в котором карбонильный углерод связан с двумя атомами водорода.
Карбоновые кислоты и производные кислот
Если карбонильный углерод связан одной стороной с углеродом (или водородом), а другой стороной с гетероатомом (в органической химии этот термин обычно относится к кислороду, азоту , сера или один из галогенов), считается, что функциональная группа представляет собой одну из « производных карбоновых кислот» , обозначение, которое описывает группу из нескольких функциональных групп. Одноименный член этой группировки — карбоновая кислота функциональная группа, в которой карбонил связан с гидроксильной (ОН) группой.
Как следует из названия, карбоновые кислоты являются кислыми, а это означает, что они легко депротонируются с образованием сопряженной основной формы, называемой карбоксилат (подробнее о карбоновых кислотах см. в главе 20).
В амидах карбонильный углерод связан с азотом. Азот в амиде может быть связан либо с водородом, либо с углеродом, либо с обоими. Другой способ думать об амиде состоит в том, что это карбонил, связанный с амином.
В сложных эфирах карбонильный углерод связан с кислородом, который сам связан с другим углеродом. Другой способ думать о сложном эфире состоит в том, что это карбонил, связанный со спиртом. Тиоэфиры аналогичны сложным эфирам, за исключением того, что вместо кислорода используется сера.
В ангидриде кислоты есть два карбонильных атома углерода с кислородом между ними. Ангидрид кислоты образуется из соединения двух карбоновых кислот с потерей воды (ангидрид).
В ацилфосфате карбонильный углерод связан с кислородом фосфата, а в хлорангидриде карбонильный углерод связан с хлором.
Нитрилы и имины
В группе нитрила углерод тройной связью с азотом. Нитрилы также часто называют цианогруппами .
Молекулы с двойными углерод-азотными связями называются иминами или оснований Шиффа .
Фосфаты
Фосфор является очень важным элементом в биологической органической химии и находится в качестве центрального атома в группе фосфатов . Многие биологические органические молекулы содержат фосфатные, дифосфатные и трифосфатные группы, которые связаны с атомом углерода функциональностью сложного эфира фосфорной кислоты .
Поскольку фосфаты широко распространены в биологической органической химии, их удобно обозначать аббревиатурой «P». Обратите внимание, что эта аббревиатура «P» включает атомы кислорода и отрицательные заряды, связанные с фосфатными группами.
Обратите внимание, что эта аббревиатура «P» включает атомы кислорода и отрицательные заряды, связанные с фосфатными группами.
Молекулы с несколькими функциональными группами
Одно соединение может содержать несколько различных функциональных групп. Например, шестиуглеродные молекулы сахара глюкозы и фруктозы содержат альдегидную и кетоновую группы соответственно, и обе содержат пять спиртовых групп (соединение с несколькими спиртовыми группами часто называют полиолом ).
Капсаицин, соединение, ответственное за жгучесть острого перца, содержит фенольные, эфирные, амидные и алкеновые функциональные группы.
Мужской половой гормон тестостерон содержит кетоновые, алкеновые и вторичные спиртовые группы, а ацетилсалициловая кислота (аспирин) содержит ароматические, карбоксильные и эфирные группы.
Хотя это и не полный список, этот раздел охватывает большинство важных функциональных групп, с которыми мы столкнемся в биологической и лабораторной органической химии. В приведенной ниже таблице представлены сводные данные обо всех группах, перечисленных в этом разделе, а также о некоторых других, которые будут представлены далее в тексте.
В приведенной ниже таблице представлены сводные данные обо всех группах, перечисленных в этом разделе, а также о некоторых других, которые будут представлены далее в тексте.
Упражнение \(\PageIndex{1}\)
Определите функциональные группы в следующих органических соединениях. Укажите, являются ли спирты и амины первичными, вторичными или третичными.
- Ответить
а) карбоксилатная, сульфидная, ароматическая, две амидные группы (одна из которых циклическая)
б) третичный спирт, тиоэфир
в) карбоксилат, кетон
г) эфир, первичный амин, алкен
2: Нарисуйте по одному примеру (верных ответов может быть много) соединений, соответствующих приведенным ниже описаниям, используя структуру линий. Обязательно укажите местонахождение всех ненулевых формальных сборов. Все атомы должны иметь полные октеты (фосфор может превышать правило октетов).
а) соединение с молекулярной формулой C 6 H 11 NO, включающее функциональные группы алкена, вторичного амина и первичного спирта
b) ион с молекулярной формулой C 3 H 5 O 6 P 2-, который включает альдегидные, вторичные спиртовые и фосфатные функциональные группы.
c) Соединение с молекулярной формулой C 6 H 9 NO, имеющее амидную функциональную группу, но не имеющее , а не , алкеновую группу.
Таблицы функциональных групп
Исключительно функциональные группы углерода
| Формула группы | Имя класса | Конкретный пример | Название ИЮПАК | Общее название |
|---|---|---|---|---|
| алкен | H 2 C=CH 2 | этен | этилен | |
| алкин | HC≡CH | этин | ацетилен | |
| арен | С 6 Н 6 | бензол | бензол |
Функциональные группы с одинарными связями с гетероатомами
| Формула группы | Название класса | Конкретный пример | Название ИЮПАК | Общее название |
|---|---|---|---|---|
| галогенид | H 3 C-I | йодметан | йодистый метил | |
| спирт | CH 3 CH 2 ОН | этанол | спирт этиловый | |
| эфир | CH 3 CH 2 OCH 2 CH 3 | диэтиловый эфир | эфир | |
| амин | H 3 C-NH 2 | аминометан | метиламин | |
| нитросоединение | H 3 C-NO 2 | нитрометан | ||
| тиол | H 3 C-SH | метантиол | метилмеркаптан | |
| сульфид | H 3 C-S-CH 3 | диметилсульфид |
Функциональные группы с кратными связями с гетероатомами
| Формула группы | Название класса | Конкретный пример | Название ИЮПАК | Общее название |
|---|---|---|---|---|
| нитрил | H 3 C-CN | этаннитрил | ацетонитрил | |
| альдегид | H 3 CCHO | этаналь | ацетальдегид | |
| кетон | H 3 CCOCH 3 | пропанон | ацетон | |
| карбоновая кислота | H 3 CCO 2 H | Этановая кислотауксусная кислота | ||
| сложный эфир | H 3 CCO 2 CH 2 CH 3 | этилэтанолат | этилацетат | |
| галогенангидрид | H 3 CCOCl | этанолилхлорид | ацетилхлорид | |
| амид | H 3 CCON(CH 3 ) 2 | N,N-диметилэтанамид | N,N-диметилацетамид | |
| Ангидрид кислоты | (H 3 CCO) 2 O | этановый ангидрид | уксусный ангидрид |
Упражнения
Вопросы
Q3. 1.1
1.1
Ниже представлена молекула АТФ, или молекула, ответственная за энергию в клетках человека. Определите функциональные группы АТФ.
Решения
S3.1.1
3.1: Functional Groups распространяется под лицензией CC BY-SA 4.0, авторами, ремиксами и/или кураторами являются Стивен Фармер, Дитмар Кеннеполь, Лейн Морш, Криста Каннингем, Тим Содерберг и Тим Содерберг.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- СС BY-SA
- Версия лицензии
- 4,0
- Показать страницу Содержание
- нет на странице
- Теги
- автор@Дитмар Кеннеполь
- автор @ Криста Каннингем
- автор@Лейн Морш
- автор@Стивен Фармер
- автор @ Тим Содерберг
- функциональная группа
Геометрия комплексных чисел — Infinity Learn
Ганс Швердтфегер написал эту книгу, впервые опубликованную в 1962 году как том 13 серии Mathematical Expositions издательства University of Toronto Press. В 1979 году Dover Publications выпустила исправленное издание серии Dover Books on Advanced Mathematics. Комитет по списку основных библиотек Математической ассоциации рекомендовал включить его в математические библиотеки для студентов.
В 1979 году Dover Publications выпустила исправленное издание серии Dover Books on Advanced Mathematics. Комитет по списку основных библиотек Математической ассоциации рекомендовал включить его в математические библиотеки для студентов.
Присоединяйтесь к программе регулярных занятий Infinity Learn!
Загрузите БЕСПЛАТНО PDF-файлы, решенные вопросы, работы за предыдущий год, викторины и головоломки!
+91
Проверьте код OTP (обязательно)
класс
— Класс 6CLASS 7CLASS 9CLASS 9CLASS 10CLASS 11CLASS 12
КУРС
— CBSEIIT-JEENEET
Школа/Колледж название
SRI CHAITANEA?
НетДа
Я согласен с условиями и политикой конфиденциальности.
Геометрическое представление комплексного числа является одним из основных законов алгебры. Комплексное число, например z = + I, можно представить в виде точки P(,) на плоскости Аргана, где — действительная часть, а — мнимая часть. I = 1 — это значение i. Студенты узнают о представлении модуля Z в плоскости Аргана, формуле сечения, полярной форме и многих других важных темах геометрии комплексных чисел.
Студенты узнают о представлении модуля Z в плоскости Аргана, формуле сечения, полярной форме и многих других важных темах геометрии комплексных чисел.
Термин «комплексное число» определяется как «число, равное
Комплексное число состоит из действительных и мнимых элементов. Формула для комплексного числа: a+ib, где an — действительное число, а ib — мнимое число. Кроме того, a, b — действительные числа, а I = -1.
В результате комплексное число представляет собой просто сумму двух целых чисел, а именно действительного и мнимого числа. Одна сторона полностью реальна, а другая полностью выдумана.
Действительные числаДействительные числа — это любые числа, существующие в системе счисления, такие как положительные, отрицательные, нулевые, целые, рациональные, иррациональные, дроби и т. д. Re является символом для него (). Примерами являются 12, -45, 0, 1/7, 2,8, 5 и другие действительные числа.
Воображаемые числа Воображаемые числа — это числа, которые не являются действительными. Мы получаем отрицательный результат, когда возводим в квадрат мнимое число. Im является символом для него (). Например, числа -2, -7 и 11 вымышлены.
Мы получаем отрицательный результат, когда возводим в квадрат мнимое число. Im является символом для него (). Например, числа -2, -7 и 11 вымышлены.
Чтобы ответить на уравнение x2+1 = 0, были введены комплексные числа. Корни уравнения имеют вид x = -1, и истинных корней нет. В результате сложения комплексных чисел у нас теперь есть мнимые корни.
Символ I, обозначающий йоту, используется для обозначения -1. (мнимое число).
Алгебраические операции с комплексными числами Существует четыре различных типа алгебраических операций, которые можно выполнять над комплексными числами, как указано ниже. Более подробную информацию об этих алгебраических операциях, а также решенные примеры можно найти в связанной статье. Четыре операции над комплексными числами следующие:
Сложение
Вычитание
Умножение
Деление
Когда мы решаем квадратное уравнение формы ax2 +bx+c = 0, мы можем найти корни уравнений тремя способами:
Существует два типа действительных корней: различные действительные корни и подобные действительные корни.
Объединяйте сопоставимые фразы, выполняя сложные арифметические операции с числами, такие как сложение и вычитание. Это означает, что вы должны складывать действительные числа с действительными числами и мнимые числа с мнимыми числами.
Сложение (a + ib) + (c + id) + (a + c) + i(b + d) = (a + c) + i(b + d)
Вычесть (a + ib) из ( c + id), чтобы получить (a – c) + i(b – d).
УмножениеКогда два комплексных целых числа умножаются друг на друга, техника должна быть идентична биномиальному умножению. Это означает применение метода FOIL (процедура дистрибутивного умножения).
(ac – bd) + i(ad + bc) = (c + id)
ДелениеМетод FOIL можно использовать для деления двух комплексных чисел путем умножения числителя и знаменателя на сопряженное значение знаменателя и затем применяя метод FOIL.
(a + ib) / (c + id) = (ac+bd) / (c2 + d2) + i(bc – ad)
Геометрическое представление комплексного числа.
Одним из фундаментальных законов алгебры является геометрическое представление комплексного числа. Комплексное число z = + I может быть представлено в виде точки P(,) на плоскости Аргана, были и являются действительной и мнимой частями соответственно.
Комплексные числа обладают следующими свойствами: Если сложить вместе два сопряженных комплексных числа, получится действительное число.
Умножение двух сопряженных комплексных чисел дает действительное число.
Если x и y — действительные числа и x+yi = 0, то x и y должны быть равны.
Если p, q, r и s — действительные числа, то p+qi = r+si, p = r и q=s.
Коммутативный закон сложения и умножения применим к комплексным числам.
z1 + z2 = z1 + z2
z1 x z2 = z2 x z1 x z2 x z1 x z2
Ассоциативный закон сложения и умножения применим к комплексным числам.
(z1+z2) +z3 = (z2+z3) + z1
(z1. z2).z3 = (z1.z2).z3 = (z1.z2).z3 = (z1.z2) ).
z2).z3 = (z1.z2).z3 = (z1.z2).z3 = (z1.z2) ).
(z2.z3)
Закон распределения z1.(z2+z3) = z1.z2 + z1.z3 применяется к комплексным числам.
Если сумма двух комплексных чисел действительна и произведение двух комплексных чисел также вещественно, то эти числа сопряжены.
|z1+z2|
Результатом умножения двух комплексных чисел на их сопряженное значение должно быть еще одно комплексное число с положительным значением.
Читайте также: Что такое взаимоисключающие события в вероятности?
Часто задаваемые вопросыКаково геометрическое представление комплексного числа?
Одним из основных законов алгебры является геометрическое представление комплексного числа. Комплексное число z = + I может быть представлено точкой P (,) на плоскости Аргана, где — действительная часть, а — мнимая часть. I = квадрат -1
Как лучше всего представить 0 в виде комплексного числа?
Как мы все знаем, 0 — это действительное число. Действительные числа также входят в категорию комплексных чисел. В результате 0 является комплексным числом и может быть записан как 0+0i. Изучите оси на графике ниже, чтобы увидеть, как представлены комплексные числа. Ось x представляет реальную часть, а ось y представляет мнимую часть.
Действительные числа также входят в категорию комплексных чисел. В результате 0 является комплексным числом и может быть записан как 0+0i. Изучите оси на графике ниже, чтобы увидеть, как представлены комплексные числа. Ось x представляет реальную часть, а ось y представляет мнимую часть.
Сопутствующая информация
Основные макромолекулы – химия
11.1 Введение: четыре основные макромолекулы Во всех формах жизни на Земле, от мельчайшей бактерии до гигантского кашалота, всегда присутствуют четыре основных класса органических макромолекул, которые необходимы для жизни. Это углеводы, липиды (или жиры), белки и нуклеиновые кислоты. Все основные классы макромолекул схожи в том, что они представляют собой большие полимеры, собранные из небольших повторяющихся мономерных субъединиц. В главе 6 вы познакомились с полимерами жизни и структурами их строительных блоков, как показано ниже на рис. 11.1. Напомним, что мономерными единицами для построения нуклеиновых кислот, ДНК и РНК, являются нуклеотидные основания, тогда как мономерами для белков являются аминокислоты, для углеводов — остатки сахаров, а для липидов — жирные кислоты или ацетильные группы.
В этой главе основное внимание будет уделено введению в структуру и функцию этих макромолекул. Вы обнаружите, что основные макромолекулы удерживаются вместе теми же химическими связями, которые вы изучали в главах 9 и 10, и в значительной степени зависят от дегидратационного синтеза для их образования и гидролиза для их распада.
Рисунок 11.1. Молекулярные строительные блоки жизни состоят из органических соединений.
Изменено с: Boghog
Забавный видеоурок, посвященный основным макромолекулам
Биологические молекулы. Вы то, что вы едите: ускоренный курс биологии №3.
11.2 Структура и функция белков Аминокислоты и первичная структура белков
Основные строительные блоки белков называются альфа-аминокислотами. Как следует из их названия, они содержат функциональную группу карбоновой кислоты и функциональную группу амина. Обозначение альфа используется для обозначения того, что эти две функциональные группы отделены друг от друга одной углеродной группой. В дополнение к амину и карбоновой кислоте альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может различаться по размеру и длине. На схеме ниже эта группа обозначена как R-группа. В живых организмах в качестве строительных блоков белков используются 20 аминокислот. Они отличаются друг от друга только положением R-группы. Базовая структура аминокислоты показана ниже:
В дополнение к амину и карбоновой кислоте альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может различаться по размеру и длине. На схеме ниже эта группа обозначена как R-группа. В живых организмах в качестве строительных блоков белков используются 20 аминокислот. Они отличаются друг от друга только положением R-группы. Базовая структура аминокислоты показана ниже:
Рисунок 11.2 Общая структура альфа-аминокислоты
В клеточных системах белки связаны между собой сложной системой РНК и белков, называемой рибосомой. Таким образом, поскольку аминокислоты связаны друг с другом, образуя определенный белок, они располагаются в совершенно определенном порядке, который диктуется генетической информацией, содержащейся в РНК. Этот специфический порядок аминокислот известен как первичная последовательность белка 9.0014 . Первичная последовательность белка связывается вместе с помощью синтеза дегидратации, при котором карбоновая кислота расположенной выше аминокислоты объединяется с функциональной группой амина расположенной ниже аминокислоты с образованием амидной связи. В белковых структурах эта амидная связь известна как пептидная связь. Последующие аминокислоты будут присоединены к концевой карбоксильной кислоте растущего белка. Таким образом, белки всегда синтезируются направленно, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Кроме того, поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в транс конформация. Конформация цис предпочтительна только с одной конкретной аминокислотой, известной как пролин.
В белковых структурах эта амидная связь известна как пептидная связь. Последующие аминокислоты будут присоединены к концевой карбоксильной кислоте растущего белка. Таким образом, белки всегда синтезируются направленно, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Кроме того, поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в транс конформация. Конформация цис предпочтительна только с одной конкретной аминокислотой, известной как пролин.
Рис. 11.3 Формирование пептидной связи. Добавление двух аминокислот для образования пептида требует дегидратационного синтеза.
Белки представляют собой очень большие молекулы, содержащие множество аминокислотных остатков, связанных друг с другом в очень определенном порядке. Размер белков варьируется от 50 аминокислот в длину до самого большого из известных белков, содержащего 33 423 аминокислоты. Макромолекулы, содержащие менее 50 аминокислот, известны как 9.0013 пептиды.
Размер белков варьируется от 50 аминокислот в длину до самого большого из известных белков, содержащего 33 423 аминокислоты. Макромолекулы, содержащие менее 50 аминокислот, известны как 9.0013 пептиды.
Рис. 11.4 Пептиды и белки представляют собой макромолекулы, построенные из длинных цепочек аминокислот, соединенных вместе посредством амидных связей.
Идентичность и функция пептида или белка определяются первичной последовательностью аминокислот в его структуре. Всего в белковые структуры обычно входят 20 альфа-аминокислот (рис. 11.5).
Рис. 11.5 Структура 20 альфа-аминокислот, используемых в синтезе белка.
Благодаря большому количеству аминокислот, которые могут быть включены в каждую позицию в белке, существуют миллиарды различных возможных комбинаций белков, которые можно использовать для создания новых белковых структур! Например, подумайте о трипептиде, полученном из этого пула аминокислот. В каждой позиции есть 20 различных опций, которые могут быть включены. Таким образом, общее количество возможных трипептидов будет 20 X 20 X 20 или 20 3 , что соответствует 8000 различных вариантов трипептидов! А теперь подумайте, сколько вариантов было бы для небольшого пептида, содержащего 40 аминокислот. Было бы 20 40 вариантов или умопомрачительные 1,09 X 10 52 потенциальных вариантов последовательности! Каждый из этих вариантов будет различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой. Таким образом, полезно немного узнать об общих характеристиках боковых цепей аминокислот.
В каждой позиции есть 20 различных опций, которые могут быть включены. Таким образом, общее количество возможных трипептидов будет 20 X 20 X 20 или 20 3 , что соответствует 8000 различных вариантов трипептидов! А теперь подумайте, сколько вариантов было бы для небольшого пептида, содержащего 40 аминокислот. Было бы 20 40 вариантов или умопомрачительные 1,09 X 10 52 потенциальных вариантов последовательности! Каждый из этих вариантов будет различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой. Таким образом, полезно немного узнать об общих характеристиках боковых цепей аминокислот.
Различные боковые цепи аминокислот можно сгруппировать в разные классы на основе их химических свойств (рис. 11.5). Например, боковые цепи некоторых аминокислот содержат только углерод и водород и поэтому очень неполярны и гидрофобны. Другие содержат электроотрицательные функциональные группы с кислородом или азотом и могут образовывать водородные связи, образуя более полярные взаимодействия. Третьи содержат функциональные группы карбоновой кислоты и могут действовать как кислоты, или они содержат амины и могут действовать как основания, образуя полностью заряженные молекулы. Характер аминокислот во всем белке помогает белку складываться и формировать его трехмерную структуру. Именно эта трехмерная форма необходима для функциональной активности белка (т. е. форма белка = функция белка). Для белков, находящихся внутри водной среды клетки, гидрофобные аминокислоты часто будут находиться внутри белковой структуры, тогда как водолюбивые гидрофильные аминокислоты будут находиться на поверхности, где они могут образовывать водородные связи и взаимодействовать с молекулами воды. Пролин уникален тем, что он имеет единственную R-группу, которая образует циклическую структуру с функциональной группой амина в основной цепи. Именно эта циклизация заставляет пролин принимать цис--конформация, а не -транс--конформация внутри остова.
Другие содержат электроотрицательные функциональные группы с кислородом или азотом и могут образовывать водородные связи, образуя более полярные взаимодействия. Третьи содержат функциональные группы карбоновой кислоты и могут действовать как кислоты, или они содержат амины и могут действовать как основания, образуя полностью заряженные молекулы. Характер аминокислот во всем белке помогает белку складываться и формировать его трехмерную структуру. Именно эта трехмерная форма необходима для функциональной активности белка (т. е. форма белка = функция белка). Для белков, находящихся внутри водной среды клетки, гидрофобные аминокислоты часто будут находиться внутри белковой структуры, тогда как водолюбивые гидрофильные аминокислоты будут находиться на поверхности, где они могут образовывать водородные связи и взаимодействовать с молекулами воды. Пролин уникален тем, что он имеет единственную R-группу, которая образует циклическую структуру с функциональной группой амина в основной цепи. Именно эта циклизация заставляет пролин принимать цис--конформация, а не -транс--конформация внутри остова. Этот сдвиг структуры часто будет означать, что пролины представляют собой положения, в которых внутри белка происходят изгибы или изменения направления. Метионин уникален тем, что служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и поэтому могут окисляться другими цистеиновыми остатками с образованием дисульфидных связей в структуре белка (рис. 11.6). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто необходимы для правильного фолдинга и функционирования белка (рис. 11.6).
Этот сдвиг структуры часто будет означать, что пролины представляют собой положения, в которых внутри белка происходят изгибы или изменения направления. Метионин уникален тем, что служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и поэтому могут окисляться другими цистеиновыми остатками с образованием дисульфидных связей в структуре белка (рис. 11.6). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто необходимы для правильного фолдинга и функционирования белка (рис. 11.6).
Рисунок 11.6 Дисульфидные связи. Дисульфидные связи образуются между двумя остатками цистеина в пептидной или белковой последовательности или между различными пептидными или белковыми цепями. В приведенном выше примере изображены две пептидные цепи, образующие гормон инсулин. Дисульфидные мостики между двумя цепями необходимы для правильного функционирования этого гормона и регулирования уровня глюкозы в крови.
Форма и функция белка
Первичная структура каждого белка приводит к уникальному паттерну укладки, характерному для этого конкретного белка. Напомним, что это линейный порядок аминокислот, так как они связаны друг с другом в белковой цепи (рис. 11.7).
Рис. 11.7 Первичная структура белка представляет собой линейную последовательность аминокислот.
(кредит: модификация работы Национального научно-исследовательского института генома человека)
В каждом белке небольшие участки могут принимать специфические схемы складывания. Эти специфические мотивы или узоры называются вторичная конструкция . Общие вторичные структурные особенности включают альфа-спираль и бета-складчатый лист (рис. 11.8). Внутри этих структур внутримолекулярные взаимодействия, особенно водородные связи между основной аминной и карбонильной функциональными группами, имеют решающее значение для поддержания трехмерной формы. На каждый спиральный виток альфа-спирали приходится 3,6 аминокислотных остатка. Группы R (вариантные группы) полипептида выступают из цепи α спирали. В β -складчатый лист, «складки» образованы водородными связями между атомами в основной цепи полипептида. Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова. α -спираль и β -складчатые листовые структуры обнаруживаются в большинстве белков и играют важную структурную роль.
На каждый спиральный виток альфа-спирали приходится 3,6 аминокислотных остатка. Группы R (вариантные группы) полипептида выступают из цепи α спирали. В β -складчатый лист, «складки» образованы водородными связями между атомами в основной цепи полипептида. Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты располагаются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе пептидного остова. α -спираль и β -складчатые листовые структуры обнаруживаются в большинстве белков и играют важную структурную роль.
Рис. 11.8 Вторичные структурные признаки в структуре белка. Альфа-спираль и бета-складчатый лист являются общими структурными мотивами, обнаруженными в большинстве белков. Они удерживаются вместе водородными связями между амином и карбонильным кислородом в основной цепи аминокислоты.
Пристальный взгляд: вторичная структура белка в шелке
В древнем мире было много торговых путей. Самый посещаемый и культурно значимый из них назывался Шелковый путь. Шелковый путь пролегал от китайского города Чанъань через Индию к Средиземному морю и Египту. Причина того, что Шелковый путь имел такое культурное значение, заключалась в том, что он преодолевал большое расстояние. По сути, весь древний мир был связан одним торговым путем.
Рисунок 11.9 Тутовые шелкопряды
По пути торговали многими вещами, включая шелк, специи, рабов, идеи и порох. Шелковый путь оказал поразительное влияние на создание многих обществ. Он смог принести экономическое богатство в районы вдоль маршрута, а новые идеи распространились далеко и повлияли на многие вещи, включая искусство. Примером этого является буддийское искусство, обнаруженное в Индии. В картине есть много западных влияний, которые можно идентифицировать в ней, например, реалистичная мускулатура изображаемых людей. Кроме того, торговля порохом на Западе повлияла на ведение войны и, в свою очередь, сформировала современный мир. Настоящая причина, по которой Шелковый путь был запущен, заключалась в продукте, от которого он получил свое название: Шелк.
Кроме того, торговля порохом на Западе повлияла на ведение войны и, в свою очередь, сформировала современный мир. Настоящая причина, по которой Шелковый путь был запущен, заключалась в продукте, от которого он получил свое название: Шелк.
Рис. 11.10 Сухопутный маршрут отмечен красным цветом, морской путь отмечен синим цветом
Шелк ценился королями и королевами европейского и ближневосточного общества. Шелк показал, что правители обладали властью и богатством, потому что шелк было нелегко достать, и поэтому он определенно не был дешевым. Шелк был впервые разработан в Китае и производится путем сбора шелка из коконов тутового шелкопряда. Сам шелк называют натуральным белковым волокном, потому что он состоит из набора аминокислот во вторичной белковой структуре. Вторичная структура шелка представляет собой бета-плиссированный лист. Первичная структура шелка содержит аминокислоты глицина, аланина, серина в определенной повторяющейся схеме. Эти три аминокислоты составляют 90% белка в шелке. Последние 10% состоят из аминокислот глутаминовой кислоты, валина и аспарагиновой кислоты. Эти аминокислоты используются в качестве боковых цепей и влияют на такие вещи, как эластичность и прочность. они также различаются у разных видов. Бета-складчатый лист шелка соединен водородными связями. Водородные связи в шелке образуют бета-складчатые листы, а не альфа-спирали из-за того, где возникают связи. Водородные связи идут от атомов водорода амида в одной белковой цепи к соответствующему карбонильному кислороду на противоположном пути в другой белковой цепи. Это отличается от альфа-спирали, потому что в этой структуре связи идут от амида к карбонильному кислороду, но они не являются смежными. Карбонильный кислород находится на аминокислоте, которая находится на четыре остатка раньше.
Эти три аминокислоты составляют 90% белка в шелке. Последние 10% состоят из аминокислот глутаминовой кислоты, валина и аспарагиновой кислоты. Эти аминокислоты используются в качестве боковых цепей и влияют на такие вещи, как эластичность и прочность. они также различаются у разных видов. Бета-складчатый лист шелка соединен водородными связями. Водородные связи в шелке образуют бета-складчатые листы, а не альфа-спирали из-за того, где возникают связи. Водородные связи идут от атомов водорода амида в одной белковой цепи к соответствующему карбонильному кислороду на противоположном пути в другой белковой цепи. Это отличается от альфа-спирали, потому что в этой структуре связи идут от амида к карбонильному кислороду, но они не являются смежными. Карбонильный кислород находится на аминокислоте, которая находится на четыре остатка раньше.
Рис. 11.11 Параллельные и антипараллельные бета-складчатые листы
Шелк является прекрасным примером бета-складчатой листовой структуры. Формирование этой вторичной структуры в протеине шелка позволяет ему иметь очень высокую прочность на растяжение. Шелк также помог сформировать один из величайших торговых путей в истории, позволив обмениваться идеями, продуктами и культурами, одновременно продвигая вовлеченные общества. Шелк содержит как антипараллельное, так и параллельное расположение бета-листов. Однако, в отличие от α-спирали, боковые цепи сжаты довольно близко друг к другу в виде складок. Вследствие этого очень объемные боковые цепи делают структуру нестабильной. Это объясняет, почему шелк почти полностью состоит из глицина, аланина и серина — трех аминокислот с наименьшими боковыми цепями. Некоторые виды тутового шелкопряда производят различное количество объемных боковых цепей, но эти шелка не так ценятся, как шелк тутового шелкопряда (у которого нет объемных боковых цепей аминокислот), потому что шелк с объемными боковыми цепями слабее и не имеет такого количества аминокислот. предел прочности.
Формирование этой вторичной структуры в протеине шелка позволяет ему иметь очень высокую прочность на растяжение. Шелк также помог сформировать один из величайших торговых путей в истории, позволив обмениваться идеями, продуктами и культурами, одновременно продвигая вовлеченные общества. Шелк содержит как антипараллельное, так и параллельное расположение бета-листов. Однако, в отличие от α-спирали, боковые цепи сжаты довольно близко друг к другу в виде складок. Вследствие этого очень объемные боковые цепи делают структуру нестабильной. Это объясняет, почему шелк почти полностью состоит из глицина, аланина и серина — трех аминокислот с наименьшими боковыми цепями. Некоторые виды тутового шелкопряда производят различное количество объемных боковых цепей, но эти шелка не так ценятся, как шелк тутового шелкопряда (у которого нет объемных боковых цепей аминокислот), потому что шелк с объемными боковыми цепями слабее и не имеет такого количества аминокислот. предел прочности.
Полная трехмерная форма всего белка (или суммы всех вторичных структур) известна как третичная структура белка и является уникальной и определяющей чертой этого белка (рис. 11.12). Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот располагаются внутри белка, тогда как гидрофильные R-группы располагаются снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственная ковалентная связь, образующаяся при сворачивании белка.
11.12). Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в вовлеченных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот располагаются внутри белка, тогда как гидрофильные R-группы располагаются снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственная ковалентная связь, образующаяся при сворачивании белка.
Рисунок 11.12 Третичная структура белка. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионная связь, водородная связь и дисульфидные связи.
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка. Когда белок теряет свою трехмерную форму, он обычно перестает быть функциональным.
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичная структура. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, которые заставляют его в основном слипаться в шарообразную форму. Инсулин начинается как один полипептид и теряет некоторые внутренние последовательности во время клеточного процессинга, которые образуют две цепи, удерживаемые вместе дисульфидными связями, как показано на рис. 11.6. Затем три из этих структур группируются, образуя неактивный гексамер (рис. 11.13). Гексамерная форма инсулина позволяет организму хранить инсулин в стабильной и неактивной конформации, чтобы он был доступен для высвобождения и реактивации в мономерной форме.
Рис. 11.13 Гормон инсулина является хорошим примером четвертичной структуры. Инсулин вырабатывается и хранится в организме в виде гексамера (единицы из шести молекул инсулина), а активной формой является мономер. Гексамер представляет собой неактивную форму с долговременной стабильностью, которая служит способом защиты высокореактивного инсулина, но в то же время легкодоступного.
Рисунок: Исаак Йонемото
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) представлены на рис. 11.14.
Рисунок 11.14 На этих иллюстрациях можно наблюдать четыре уровня структуры белка. (кредит: модификация работы Национального научно-исследовательского института генома человека)
Гидролиз представляет собой расщепление первичной белковой последовательности путем добавления воды для преобразования мономерных звеньев отдельных аминокислот.
Рисунок 11.15 Гидролиз белков. В реакции гидролиза вода добавляется через амидную связь, включающую группу -ОН с карбонильным углеродом, и преобразует карбоновую кислоту. Водород из воды преобразует амин.
Если белок подвергается изменениям температуры, pH или воздействию химических веществ, структура белка может разворачиваться, теряя свою форму без нарушения первичной последовательности в результате так называемой денатурации (рис. 11.16). Денатурация отличается от гидролиза тем, что первичная структура белка не затрагивается. Денатурация часто бывает обратимой, поскольку первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, что позволяет белку рефолдироваться и возобновить свою функцию. Однако иногда денатурация бывает необратимой и приводит к необратимой потере функции. Одним из примеров необратимой денатурации белка является жарка яиц. Белок альбумин в жидком яичном белке денатурирует, когда его помещают на горячую сковороду. Обратите внимание, что не все белки денатурируют при высоких температурах; например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Белок альбумин в жидком яичном белке денатурирует, когда его помещают на горячую сковороду. Обратите внимание, что не все белки денатурируют при высоких температурах; например, бактерии, которые выживают в горячих источниках, имеют белки, функционирующие при температурах, близких к температуре кипения. Желудок также очень кислый, имеет низкий pH и денатурирует белки в процессе пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Рис. 11.16 Денатурация белка. На рисунке (1) изображен правильно свернутый интактный белок. На этапе (2) к системе применяется тепло, превышающее порог поддержания внутримолекулярных белковых взаимодействий. Шаг (3) показывает развернутый или денатурированный белок. Окрашенные области в денатурированном белке соответствуют окрашенным областям нативно свернутого белка, показанного на (1).
Диаграмма предоставлена: Scurran15
Сворачивание белка имеет решающее значение для его функции. Первоначально считалось, что сами белки ответственны за процесс фолдинга. Только недавно было обнаружено, что часто они получают помощь в процессе фолдинга от белков-помощников, известных как 9.0019 шапероны (или шаперонины) , которые связываются с целевым белком в процессе фолдинга. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и диссоциируют от белка, как только целевой белок свернут.
Первоначально считалось, что сами белки ответственны за процесс фолдинга. Только недавно было обнаружено, что часто они получают помощь в процессе фолдинга от белков-помощников, известных как 9.0019 шапероны (или шаперонины) , которые связываются с целевым белком в процессе фолдинга. Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и диссоциируют от белка, как только целевой белок свернут.
Белки участвуют во многих клеточных функциях. Белки могут действовать как ферменты, которые увеличивают скорость химических реакций. Фактически 99% ферментативных реакций внутри клетки опосредованы белками. Таким образом, они являются неотъемлемой частью процессов построения или разрушения клеточных компонентов. Белки также могут действовать как структурные леса внутри клетки, помогая поддерживать клеточную форму. Белки также могут участвовать в клеточной передаче сигналов и коммуникации, а также в транспорте молекул из одного места в другое. В экстремальных условиях, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
В экстремальных условиях, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
1. Какой тип белка облегчает или ускоряет химические реакции?
- фермент
- гормон
- мембранный транспортный белок
- молекула тРНК
2. Как называются мономеры, из которых состоят белки?
- аминокислоты
- сопровождающие
- дисахариды
- нуклеотидов
3. Где образуется связь, соединяющая две аминокислоты?
- между группой R одной аминокислоты и группой R второй
- между карбоксильной группой одной аминокислоты и аминогруппой другой
- между 6 атомами углерода обеих аминокислот
- между атомами азота аминогрупп в аминокислотах
4. Частью какой белковой структуры являются альфа-спираль и бета-складчатый лист?
- основная конструкция
- вторичная структура
- третичная структура
- четверичная структура
5. Что из следующего может вызвать денатурацию белка?
Что из следующего может вызвать денатурацию белка?
- изменения pH
- высокие температуры
- все вышеперечисленное
- добавление некоторых химических веществ
6. Как различия в аминокислотных последовательностях приводят к различным функциям белков?
- Различные аминокислоты производят разные белки на основе связей, образованных между ними.
- Различия в аминокислотах приводят к повторному использованию белков, в результате чего образуются другие функциональные белки.
- Различные аминокислоты вызывают перегруппировку аминокислот с образованием функционального белка.
- Различия в аминокислотах вызывают посттрансляционную модификацию белка, который повторно собирается с образованием функционального белка.
7. Что вызывает изменения в структуре белка через три или четыре уровня структуры?
- Первичная цепь образует вторичную α-спираль и β-складчатые листы, которые складываются друг на друга, образуя третичную структуру.

- Первичная структура подвергается альтернативному сплайсингу с образованием вторичных структур, которые складываются на других белковых цепях с образованием третичных структур.
- Первичная структура образует вторичные α-спирали и β-складчатые листы. Далее он подвергается фосфорилированию и ацетилированию с образованием третичной структуры.
- Первичная структура подвергается альтернативному сплайсингу с образованием вторичной структуры, а затем дисульфидные связи уступают место третичным структурам.
Липиды, также известные как жиры, состоят в основном из углерода и водорода. Благодаря этому липиды представляют собой преимущественно гидрофобные молекулы, не растворяющиеся в воде. Молекулы липидов могут также содержать ограниченное количество кислорода, азота, серы и фосфора. Липиды служат многочисленным и разнообразным целям в структуре и функциях организмов. Они могут быть источником питательных веществ, формой хранения углерода, молекулами для хранения энергии, структурными компонентами мембран и участвовать в химической передаче сигналов и коммуникации. Липиды включают широкий класс многих химически различных соединений, наиболее распространенные из которых обсуждаются в этом разделе.
Липиды включают широкий класс многих химически различных соединений, наиболее распространенные из которых обсуждаются в этом разделе.
Жирные кислоты – это липиды, которые содержат углеводороды с длинной цепью, оканчивающиеся функциональной группой карбоновой кислоты. Из-за длинной углеводородной цепи жирные кислоты являются гидрофобными («водобоязненными») или неполярными. Жирные кислоты с углеводородными цепями, которые содержат только одинарные связи, называются насыщенными жирными кислотами, поскольку они имеют максимально возможное количество атомов водорода и, следовательно, являются «насыщенными» водородом. Жирные кислоты с углеводородными цепями, содержащими по крайней мере одну двойную связь, называются ненасыщенными жирными кислотами, поскольку в них меньше атомов водорода. Насыщенные жирные кислоты имеют прямую гибкую углеродную основу, в то время как ненасыщенные жирные кислоты имеют «перегибы» в углеродном скелете, поскольку каждая двойная связь вызывает жесткий изгиб углеродного скелета. Эти различия в структуре насыщенных и ненасыщенных жирных кислот приводят к различным свойствам соответствующих липидов, в которые включены жирные кислоты. Например, липиды, содержащие насыщенные жирные кислоты, представляют собой твердые вещества при комнатной температуре, тогда как липиды, содержащие ненасыщенные жирные кислоты, представляют собой жидкости.
Эти различия в структуре насыщенных и ненасыщенных жирных кислот приводят к различным свойствам соответствующих липидов, в которые включены жирные кислоты. Например, липиды, содержащие насыщенные жирные кислоты, представляют собой твердые вещества при комнатной температуре, тогда как липиды, содержащие ненасыщенные жирные кислоты, представляют собой жидкости.
Триацилглицерин или триглицерид образуется, когда три жирные кислоты химически связаны с молекулой глицерина (рисунок). Триглицериды являются основными компонентами жировой ткани (жировых отложений) и основными составляющими кожного сала (кожного жира). Они играют важную метаболическую роль, выступая в качестве эффективных молекул-аккумуляторов энергии, которые могут обеспечить более чем вдвое большую калорийность как углеводов, так и белков.
Триглицериды состоят из молекулы глицерина, присоединенной к трем жирным кислотам в результате реакции синтеза дегидратации.
ПРИМЕЧАНИЕ
- Объясните, почему жирные кислоты с углеводородными цепями, содержащими только одинарные связи, называются насыщенными жирными кислотами.

Триглицериды классифицируются как простые липиды, поскольку они образуются всего из двух типов соединений: глицерина и жирных кислот. Напротив, сложные липиды содержат по крайней мере один дополнительный компонент, например, фосфатную группу (фосфолипид s ) или углеводную часть (гликолипид с ). На рисунке изображен типичный фосфолипид, состоящий из двух жирных кислот, связанных с глицерином (диглицерид). Две углеродные цепи жирных кислот могут быть обе насыщенными, обе ненасыщенными или по одной каждой из них. Вместо другой молекулы жирной кислоты (как у триглицеридов) третье положение связывания на молекуле глицерина занимает модифицированная фосфатная группа.
На этой иллюстрации показан фосфолипид с двумя разными жирными кислотами, насыщенной и ненасыщенной, связанными с молекулой глицерина. Ненасыщенная жирная кислота имеет небольшой изгиб в своей структуре из-за двойной связи.
Молекулярная структура липидов обеспечивает уникальное поведение в водной среде. На рисунке показана структура триглицерида. Поскольку все три заместителя в основной цепи глицерина представляют собой длинные углеводородные цепи, эти соединения неполярны и незначительно притягиваются к полярным молекулам воды — они гидрофобны. И наоборот, фосфолипиды, подобные показанному на рисунке, имеют отрицательно заряженную фосфатную группу. Поскольку фосфат заряжен, он способен сильно притягиваться к молекулам воды и, таким образом, является гидрофильным или «любящим воду». Гидрофильную часть фосфолипида часто называют полярной «головой», а длинные углеводородные цепи — неполярными «хвостами». Говорят, что молекула, содержащая гидрофобную часть и гидрофильную часть, является амфипатической. Обратите внимание на обозначение «R» внутри гидрофильной головки, изображенное на рисунке, которое указывает на то, что полярная головная группа может быть более сложной, чем простая фосфатная группа. Гликолипиды являются примерами, в которых углеводы связаны с головными группами липидов.
На рисунке показана структура триглицерида. Поскольку все три заместителя в основной цепи глицерина представляют собой длинные углеводородные цепи, эти соединения неполярны и незначительно притягиваются к полярным молекулам воды — они гидрофобны. И наоборот, фосфолипиды, подобные показанному на рисунке, имеют отрицательно заряженную фосфатную группу. Поскольку фосфат заряжен, он способен сильно притягиваться к молекулам воды и, таким образом, является гидрофильным или «любящим воду». Гидрофильную часть фосфолипида часто называют полярной «головой», а длинные углеводородные цепи — неполярными «хвостами». Говорят, что молекула, содержащая гидрофобную часть и гидрофильную часть, является амфипатической. Обратите внимание на обозначение «R» внутри гидрофильной головки, изображенное на рисунке, которое указывает на то, что полярная головная группа может быть более сложной, чем простая фосфатная группа. Гликолипиды являются примерами, в которых углеводы связаны с головными группами липидов.
Амфипатическая природа фосфолипидов позволяет им образовывать уникальные функциональные структуры в водной среде. Как уже упоминалось, полярные головки этих молекул сильно притягиваются к молекулам воды, а неполярные хвосты — нет. Из-за своей значительной длины эти хвосты действительно сильно притягиваются друг к другу. В результате формируются энергетически стабильные крупномасштабные сборки молекул фосфолипидов, в которых гидрофобные хвосты собираются в замкнутых областях, экранированных от контакта с водой полярными головками (рис.). Самая простая из этих структур — мицелла 9.0013 s , сферические сборки, содержащие гидрофобную внутреннюю часть фосфолипидных хвостов и внешнюю поверхность полярных головных групп. Более крупные и сложные структуры создаются из липидно-двухслойных листов или единичных мембран, которые представляют собой большие двумерные сборки фосфолипидов, собранных хвост к хвосту. Клеточные мембраны почти всех организмов состоят из двухслойных липидных слоев, как и мембраны многих внутриклеточных компонентов. Эти листы могут также образовывать липидно-двухслойные сферы, которые являются структурной основой везикул и липосом, субклеточных компонентов, играющих роль в многочисленных физиологических функциях.
Как уже упоминалось, полярные головки этих молекул сильно притягиваются к молекулам воды, а неполярные хвосты — нет. Из-за своей значительной длины эти хвосты действительно сильно притягиваются друг к другу. В результате формируются энергетически стабильные крупномасштабные сборки молекул фосфолипидов, в которых гидрофобные хвосты собираются в замкнутых областях, экранированных от контакта с водой полярными головками (рис.). Самая простая из этих структур — мицелла 9.0013 s , сферические сборки, содержащие гидрофобную внутреннюю часть фосфолипидных хвостов и внешнюю поверхность полярных головных групп. Более крупные и сложные структуры создаются из липидно-двухслойных листов или единичных мембран, которые представляют собой большие двумерные сборки фосфолипидов, собранных хвост к хвосту. Клеточные мембраны почти всех организмов состоят из двухслойных липидных слоев, как и мембраны многих внутриклеточных компонентов. Эти листы могут также образовывать липидно-двухслойные сферы, которые являются структурной основой везикул и липосом, субклеточных компонентов, играющих роль в многочисленных физиологических функциях.
Фосфолипиды склонны располагаться в водном растворе, образуя липосомы, мицеллы или липидные двухслойные листы. (кредит: модификация работы Марианы Руис Вильярреал)
ПРИМЕЧАНИЕ
- Какое значение имеет амфипатическая природа фосфолипидов?
Изопреноиды – это разветвленные липиды, также называемые терпеноидами, которые образуются в результате химических модификаций молекулы изопрена (рисунок). Эти липиды играют самые разнообразные физиологические роли в растениях и животных и используются во многих технологических целях в качестве фармацевтических препаратов (капсаицин), пигментов (например, оранжевый бета-каротин, ксантофиллы) и ароматизаторов (например, ментол, камфора, лимонен [лимонный аромат], и пинен [сосновый аромат]). Изопреноиды с длинной цепью также содержатся в гидрофобных маслах и восках. Воски, как правило, водостойкие и твердые при комнатной температуре, но они размягчаются при нагревании и разжижаются при достаточном нагревании. У людей основное производство воска происходит в сальных железах волосяных фолликулов кожи, в результате чего секретируется материал, называемый кожным салом, который состоит в основном из триацилглицерина, эфиров воска и углеводородного сквалена. В микробиоте кожи много бактерий, которые питаются этими липидами. Одной из наиболее известных бактерий, питающихся липидами, является Propionibacterium acnes , который использует липиды кожи для образования короткоцепочечных жирных кислот и участвует в развитии акне.
У людей основное производство воска происходит в сальных железах волосяных фолликулов кожи, в результате чего секретируется материал, называемый кожным салом, который состоит в основном из триацилглицерина, эфиров воска и углеводородного сквалена. В микробиоте кожи много бактерий, которые питаются этими липидами. Одной из наиболее известных бактерий, питающихся липидами, является Propionibacterium acnes , который использует липиды кожи для образования короткоцепочечных жирных кислот и участвует в развитии акне.
Молекулы пятиуглеродного изопрена химически модифицируют различными способами для получения изопреноидов.
Другим типом липидов являются стероиды s , сложные кольцевые структуры, встречающиеся в клеточных мембранах; некоторые действуют как гормоны. Наиболее распространенными типами стероидов являются стерол s , которые представляют собой стероиды, содержащие группу ОН. В основном это гидрофобные молекулы, но они также имеют гидрофильные гидроксильные группы. Наиболее распространенным стеролом, обнаруженным в тканях животных, является холестерин. Его структура состоит из четырех колец с двойной связью в одном из колец и гидроксильной группой в определяющем стерол положении. Функция холестерина заключается в укреплении клеточных мембран эукариот и бактерий без клеточных стенок, таких как Микоплазма . Прокариоты обычно не продуцируют холестерин, хотя бактерии продуцируют аналогичные соединения, называемые гопаноидами, которые также представляют собой многокольцевые структуры, укрепляющие бактериальные мембраны (рисунок). Грибы и некоторые простейшие производят аналогичное соединение, называемое эргостерол, которое укрепляет клеточные мембраны этих организмов.
Наиболее распространенным стеролом, обнаруженным в тканях животных, является холестерин. Его структура состоит из четырех колец с двойной связью в одном из колец и гидроксильной группой в определяющем стерол положении. Функция холестерина заключается в укреплении клеточных мембран эукариот и бактерий без клеточных стенок, таких как Микоплазма . Прокариоты обычно не продуцируют холестерин, хотя бактерии продуцируют аналогичные соединения, называемые гопаноидами, которые также представляют собой многокольцевые структуры, укрепляющие бактериальные мембраны (рисунок). Грибы и некоторые простейшие производят аналогичное соединение, называемое эргостерол, которое укрепляет клеточные мембраны этих организмов.
Холестерин и гопен (соединение гопаноида) представляют собой молекулы, укрепляющие структуру клеточных мембран у эукариот и прокариот соответственно.
ЛИПОСОМЫВ этом видео предоставляется дополнительная информация о фосфолипидах и липосомах.
ПРИМЕЧАНИЕ
- Как изопреноиды используются в технике?
ЧАСТЬ 2
Увлажняющий крем, прописанный врачом Пенни, представлял собой крем для местного применения с кортикостероидами, содержащий гидрокортизон. Гидрокортизон представляет собой синтетическую форму кортизола, кортикостероидного гормона, вырабатываемого в надпочечниках из холестерина. При нанесении непосредственно на кожу он может уменьшить воспаление и временно облегчить незначительные кожные раздражения, зуд и сыпь за счет снижения секреции гистамина, соединения, вырабатываемого клетками иммунной системы в ответ на присутствие патогенов или других чужеродных веществ. Поскольку гистамин вызывает воспалительную реакцию организма, способность гидрокортизона снижать локальное производство гистамина в коже эффективно подавляет иммунную систему и помогает ограничить воспаление и сопутствующие симптомы, такие как зуд (зуд) и сыпь.
Гидрокортизон представляет собой синтетическую форму кортизола, кортикостероидного гормона, вырабатываемого в надпочечниках из холестерина. При нанесении непосредственно на кожу он может уменьшить воспаление и временно облегчить незначительные кожные раздражения, зуд и сыпь за счет снижения секреции гистамина, соединения, вырабатываемого клетками иммунной системы в ответ на присутствие патогенов или других чужеродных веществ. Поскольку гистамин вызывает воспалительную реакцию организма, способность гидрокортизона снижать локальное производство гистамина в коже эффективно подавляет иммунную систему и помогает ограничить воспаление и сопутствующие симптомы, такие как зуд (зуд) и сыпь.
ПРИМЕЧАНИЕ
- Лечит ли кортикостероидный крем причину сыпи Пенни или только симптомы?
Перейти к следующему полю «Клинический фокус». Вернитесь к предыдущему окну «Клинический фокус».
- Липиды состоят в основном из углерода и водорода, но могут также содержать кислород, азот, серу и фосфор.
 Они обеспечивают питательные вещества для организмов, хранят углерод и энергию, играют структурную роль в мембранах и функционируют как гормоны, фармацевтические препараты, ароматизаторы и пигменты.
Они обеспечивают питательные вещества для организмов, хранят углерод и энергию, играют структурную роль в мембранах и функционируют как гормоны, фармацевтические препараты, ароматизаторы и пигменты. - Жирные кислоты представляют собой длинноцепочечные углеводороды с функциональной группой карбоновой кислоты. Их относительно длинные неполярные углеводородные цепи делают их гидрофобными . Жирные кислоты без двойных связей являются насыщенными ; те, у которых есть двойные связи, являются ненасыщенными .
- Жирные кислоты химически связываются с глицерином с образованием структурно незаменимых липидов, таких как триглицериды и фосфолипиды. Триглицериды включают три жирные кислоты, связанные с глицерином, образуя гидрофобную молекулу. Фосфолипиды содержат как гидрофобные углеводородные цепи, так и полярные группы, что делает их амфипатический и способный формировать уникально функциональные крупномасштабные структуры.

- Биологические мембраны представляют собой крупномасштабные структуры, основанные на двойных слоях фосфолипидов, которые обеспечивают гидрофильные внешние и внутренние поверхности, подходящие для водной среды, разделенные промежуточным гидрофобным слоем. Эти бислои являются структурной основой клеточных мембран большинства организмов, а также субклеточных компонентов, таких как везикулы.
- Изопреноиды – это липиды, полученные из молекул изопрена, которые выполняют множество физиологических функций и имеют множество коммерческих применений.
- Воск представляет собой изопреноид с длинной цепью, обычно водостойкий; Примером вещества, содержащего воск, является кожное сало, вырабатываемое сальными железами кожи. Стероиды представляют собой липиды со сложной кольцевой структурой, которые функционируют как структурные компоненты клеточных мембран и как гормоны. Стерины представляют собой подкласс стероидов, содержащих гидроксильную группу в определенном месте на одном из колец молекулы; одним из примеров является холестерин.

- Бактерии производят гопаноиды, структурно сходные с холестерином, для укрепления бактериальных мембран. Грибы и простейшие производят укрепляющий агент, называемый эргостеролом.
Что из следующего описывает липиды?
A. источник питательных веществ для организмов
B. молекулы-аккумуляторы энергии
C. молекулы, играющие структурную роль в мембранах
D. молекулы, входящие в состав гормонов и пигментов
E. все вышеперечисленное
Е
Молекулы, содержащие как полярные, так и неполярные группы, называются какими из следующих?
A. гидрофильный
B. амфипатический
C. гидрофобный
D. полифункциональный
Липиды представляют собой встречающуюся в природе группу веществ, не растворимых в воде, но легко растворимых в органических растворителях.
Ложь
Жирные кислоты, не имеющие двойных связей, называются «ненасыщенными».
Правда
Триглицерид образуется путем присоединения трех молекул глицерина к основной цепи жирной кислоты в реакции дегидратации.
Воски содержат сложные эфиры, образованные длинноцепочечными __________ и насыщенными __________, а также могут содержать замещенные углеводороды.
спирты; жирные кислоты
Холестерин — наиболее распространенный член группы __________, обнаруженный в тканях животных; он имеет тетрациклическую систему углеродных колец с __________ связью в одном из колец и одной свободной __________ группой.
стероид; двойной; гидроксил
Микроорганизмы могут развиваться в самых разных условиях, в том числе в условиях высокой температуры, например, в горячих источниках. Для правильного функционирования клеточные мембраны должны находиться в жидком состоянии. Как, по вашему мнению, содержание жирных кислот (насыщенных по сравнению с ненасыщенными) бактерий, живущих в высокотемпературной среде, может сравниться с содержанием бактерий, живущих при более умеренных температурах?
Опишите структуру типичного фосфолипида. Являются ли эти молекулы полярными или неполярными?
- Последнее обновление
- 16:43, 4 мар 2017
 Они необходимы для самого источника жизни (например, сахара рибозы в ДНК и РНК) или для поддержания самой жизни (например, метаболическое преобразование углеводов в пригодную для использования биохимическую энергию, АТФ). Другая важная роль углеводов — структурная (например, целлюлоза в растениях). Общие названия углеводов включают сахара, крахмалы, сахариды и полисахариды. Термин сахарид происходит от латинского слова «sacchararum» от сладкого вкуса сахаров. Название «углевод» означает «гидрат углерода». Название происходит от общей формулы углевода C x (H 2 O) y – x и y могут быть равны или не равны и могут принимать значения от 3 до 12 и более. Например, глюкоза: C 6 (H 2 O) 6 или чаще пишется C 6 H 12 O 6 . Углеводы являются наиболее распространенным классом органических соединений, встречающихся в живых организмах. организмы. Они возникают как продукты фотосинтеза , эндотермической восстановительной конденсации двуокиси углерода, требующей световой энергии и пигмента хлорофилла.
Они необходимы для самого источника жизни (например, сахара рибозы в ДНК и РНК) или для поддержания самой жизни (например, метаболическое преобразование углеводов в пригодную для использования биохимическую энергию, АТФ). Другая важная роль углеводов — структурная (например, целлюлоза в растениях). Общие названия углеводов включают сахара, крахмалы, сахариды и полисахариды. Термин сахарид происходит от латинского слова «sacchararum» от сладкого вкуса сахаров. Название «углевод» означает «гидрат углерода». Название происходит от общей формулы углевода C x (H 2 O) y – x и y могут быть равны или не равны и могут принимать значения от 3 до 12 и более. Например, глюкоза: C 6 (H 2 O) 6 или чаще пишется C 6 H 12 O 6 . Углеводы являются наиболее распространенным классом органических соединений, встречающихся в живых организмах. организмы. Они возникают как продукты фотосинтеза , эндотермической восстановительной конденсации двуокиси углерода, требующей световой энергии и пигмента хлорофилла.
| N CO 2 + N H 2 O + Energy C N H 2N O N + N O 2 |
Введение
Формулы многих углеводов могут быть записаны как гидраты углерода, C n (H 2 O) n , отсюда и их название. Углеводы являются основным источником метаболической энергии как для растений, так и для животных, которые зависят от растений в качестве пищи. Помимо сахаров и крахмалов, которые выполняют эту жизненно важную роль в питании, углеводы также служат структурным материалом (целлюлозой), компонентом соединения для переноса энергии АТФ, сайтами узнавания на клеточных поверхностях и одним из трех основных компонентов ДНК и РНК.
Углеводы называются сахаридами или, если они относительно небольшие, сахарами. Несколько классификаций углеводов оказались полезными и представлены в следующей таблице.
| ||||||
| ||||||
| ||||||
|
Глюкоза
Углеводам даны несистематические названия, хотя суффикс 9Обычно используется 0013 ose . Наиболее распространенным углеводом является глюкоза (C 6 H 12 O 6 ). Применяя термины, определенные выше, глюкоза представляет собой моносахарид, альдогексозу (обратите внимание, что классификация функции и размера объединены одним словом) и восстанавливающий сахар. Общее строение глюкозы и многих других альдогексоз было установлено простыми химическими реакциями. Следующая диаграмма иллюстрирует тип рассматриваемых доказательств, хотя некоторые из показанных здесь реагентов отличаются от тех, которые использовались первоначальными учеными.
Общее строение глюкозы и многих других альдогексоз было установлено простыми химическими реакциями. Следующая диаграмма иллюстрирует тип рассматриваемых доказательств, хотя некоторые из показанных здесь реагентов отличаются от тех, которые использовались первоначальными учеными.
Горячая иодистоводородная кислота (HI) часто использовалась для восстановительного удаления кислородных функциональных групп из молекулы, а в случае глюкозы эта обработка давала гексан (с низким выходом). Отсюда был сделан вывод, что шесть атомов углерода находятся в неразветвленной цепи. Присутствие альдегидной карбонильной группы было выведено из образования циангидрина, его восстановления до гексаспиртового сорбита, также называемого глюцитолом, и мягкого окисления до монокарбоновой кислоты, глюкуроновой кислоты. Несколько более сильное окисление разбавленной азотной кислотой дало двухосновную кислоту, глюкаровую кислоту, что подтверждает предположение о шестиуглеродной цепи. Считалось, что пять атомов кислорода, оставшихся в глюкозе после учета альдегида, находятся в гидроксильных группах, поскольку можно было получить производное пентаацетата. Эти гидроксильные группы были присвоены, по одной, последним пяти атомам углерода, поскольку геминальные гидроксильные группы обычно нестабильны по сравнению с карбонильным соединением, образующимся при потере воды. При нажатии на приведенную выше диаграмму она изменится для отображения предлагаемых продуктов и общей структуры глюкозы. Четыре средних атома углерода в цепи глюкозы являются центрами хиральности и окрашены в красный цвет.
Считалось, что пять атомов кислорода, оставшихся в глюкозе после учета альдегида, находятся в гидроксильных группах, поскольку можно было получить производное пентаацетата. Эти гидроксильные группы были присвоены, по одной, последним пяти атомам углерода, поскольку геминальные гидроксильные группы обычно нестабильны по сравнению с карбонильным соединением, образующимся при потере воды. При нажатии на приведенную выше диаграмму она изменится для отображения предлагаемых продуктов и общей структуры глюкозы. Четыре средних атома углерода в цепи глюкозы являются центрами хиральности и окрашены в красный цвет.
Глюкоза и другие сахариды в значительной степени расщепляются йодной кислотой благодаря обилию вицинальных диольных фрагментов в их структуре. Это окислительное расщепление, известное как реакция Малапрада , особенно полезно для анализа селективных O-замещенных производных сахаридов, поскольку эфирные функции не вступают в реакцию. Стехиометрия расщепления альдогексозы показана в следующем уравнении.
| НОСН 2 (СНОН) 4 СНО + 5 НИО 4 | —— > | H 2 C=O + 5 HCO 2 H + 5 HIO 3 |
Конфигурация глюкозы
Четыре хиральных центра в глюкозе указывают на то, что может существовать до шестнадцати (2 4 ) стереоизомеров, имеющих такое строение. Они должны были существовать в виде восьми диастереомерных пар энантиомеров, и первоначальной задачей было определить, какая из восьми соответствует глюкозе. Этот вызов был принят и выполнен в 189 г.1 немецкого химика Эмиля Фишера. Его успешное преодоление стереохимического лабиринта, представленного альдогексозами, было логическим проявлением силы, и вполне уместно, что он получил Нобелевскую премию по химии 1902 года за это достижение. Одной из первых задач, стоявших перед Фишером, была разработка метода однозначного представления конфигурации каждого хирального центра. С этой целью он изобрел простую технику рисования цепочек хиральных центров, которую мы теперь называем формулой проекции Фишера. Нажмите на эту ссылку для обзора.
С этой целью он изобрел простую технику рисования цепочек хиральных центров, которую мы теперь называем формулой проекции Фишера. Нажмите на эту ссылку для обзора.
В то время, когда Фишер занимался проектом по глюкозе, было невозможно установить абсолютную конфигурацию энантиомера. Следовательно, Фишер сделал произвольный выбор для (+)-глюкозы и установил сеть родственных альдозных конфигураций, которую он назвал D -семейством. Зеркальные отображения этих конфигураций были затем обозначены как L -семейство альдоз. Чтобы проиллюстрировать использование современных знаний, проекционные формулы Фишера и названия для семейства D-альдоз (от трех до шести атомов углерода) показаны ниже, а асимметричные атомы углерода (хиральные центры) окрашены в красный цвет. Последний хиральный центр в альдозной цепи (самый дальний от альдегидной группы) был выбран Фишером в качестве сайта-обозначения D/L. Если гидроксильная группа в проекционной формуле указывала вправо, она определялась как член D-семейства. Направленная влево гидроксильная группа (зеркальное отображение) тогда представляла L-семейство. Первоначальное определение Фишером D-конфигурации имело 50:50 шансов быть правильным, но все его последующие выводы относительно относительных конфигураций различных альдоз были основательно обоснованы. В 1951 рентгенофлуоресцентное исследование (+)-винной кислоты, проведенное в Нидерландах Йоханнесом Мартином Бийвоетом (произносится «бай фут»), доказало правильность выбора Фишера.
Направленная влево гидроксильная группа (зеркальное отображение) тогда представляла L-семейство. Первоначальное определение Фишером D-конфигурации имело 50:50 шансов быть правильным, но все его последующие выводы относительно относительных конфигураций различных альдоз были основательно обоснованы. В 1951 рентгенофлуоресцентное исследование (+)-винной кислоты, проведенное в Нидерландах Йоханнесом Мартином Бийвоетом (произносится «бай фут»), доказало правильность выбора Фишера.
Важно понимать, что знак удельного вращения соединения (экспериментальное число) не коррелирует с его конфигурацией (D или L). Измерить оптическое вращение с помощью поляриметра несложно. Для определения абсолютной конфигурации обычно требуется химическое взаимопревращение с известными соединениями по стереоспецифическим путям реакции.
Модели репрезентативных альдоз можно изучить, щелкнув формулы Фишера для глицеральдегида, эритрозы, треозы, рибозы, арабинозы, аллозы, альтрозы, глюкозы или маннозы на приведенной выше диаграмме.
Важные реакции
Эмиль Фишер использовал несколько ключевых реакций в ходе своих исследований углеводов. Они описаны здесь вместе с информацией, которую предоставляет каждый из них.
Окисление
Как отмечалось выше, сахара можно классифицировать как восстанавливающие или невосстанавливающие в зависимости от их реакционной способности с реактивами Толленса, Бенедикта или Фелинга. Если сахар окисляется этими реагентами, он называется восстанавливающим , так как окислитель (Ag (+) или Cu (+2) ) восстанавливается в реакции, о чем свидетельствует образование серебряного зеркала или осаждение из закиси меди. Тест Толленса обычно используется для обнаружения альдегидных функций; и из-за легкого взаимопревращения кетоз и альдоз в основных условиях этого теста кетозы, такие как фруктоза, также реагируют и классифицируются как восстанавливающие сахара.
Когда альдегидная функция альдозы окисляется до карбоновой кислоты, продукт называется альдоновой кислотой . Из-за того, что в этих соединениях также присутствуют 2º-гидроксильные функции, для этого превращения необходимо использовать мягкий окислитель, такой как гипобромит (уравнение 1). Если оба конца альдозной цепи окисляются до карбоновых кислот, продукт называется альдаровой кислотой . При превращении альдозы в соответствующее производное альдаровой кислоты концы цепи становятся идентичными (это также может быть достигнуто путем восстановления альдегида до CH 2 OH, как указано ниже). Такая операция обнаружит любую скрытую симметрию в оставшейся молекуле. Так, рибоза, ксилоза, аллоза и галактоза дают ахиральные альдаровые кислоты, которые, конечно, оптически не активны. Окисление рибозы показано в уравнении 2 ниже.
Из-за того, что в этих соединениях также присутствуют 2º-гидроксильные функции, для этого превращения необходимо использовать мягкий окислитель, такой как гипобромит (уравнение 1). Если оба конца альдозной цепи окисляются до карбоновых кислот, продукт называется альдаровой кислотой . При превращении альдозы в соответствующее производное альдаровой кислоты концы цепи становятся идентичными (это также может быть достигнуто путем восстановления альдегида до CH 2 OH, как указано ниже). Такая операция обнаружит любую скрытую симметрию в оставшейся молекуле. Так, рибоза, ксилоза, аллоза и галактоза дают ахиральные альдаровые кислоты, которые, конечно, оптически не активны. Окисление рибозы показано в уравнении 2 ниже.
| 1. | |
|---|---|
| 2. | |
| 3. |
Другие альдозные сахара могут давать идентичные хиральные продукты альдаровой кислоты, что подразумевает уникальное конфигурационное родство. Примеры арабинозы и ликсозы, показанные в уравнении 3 выше, иллюстрируют этот результат. Помните, формулу проекции Фишера можно повернуть на 180º в плоскости проекции без изменения ее конфигурации.
Примеры арабинозы и ликсозы, показанные в уравнении 3 выше, иллюстрируют этот результат. Помните, формулу проекции Фишера можно повернуть на 180º в плоскости проекции без изменения ее конфигурации.
Восстановление
Восстановление альдозы боргидридом натрия делает концы полученной цепи альдита идентичной, HOCH 2 (CHOH) n CH 2 OH, тем самым достигая того же изменения конфигурации альдаровая кислота. Таким образом, аллит и галактит от восстановления аллозы и галактозы являются ахиральными, а альтроза и талоза восстанавливаются до такого же хирального альдита. Краткое изложение этих окислительно-восстановительных реакций и номенклатура производных приведены в следующей таблице.
| Производные HOCH 2 (CHOH) n CHO | ||
|---|---|---|
| HOBr Окисление | —— > | HOCH 2 (CHOH) n CO 2 H Альдоновая кислота |
| HNO 3 Окисление | —— > | H 2 OC(CHOH) n CO 2 H альдаровая кислота |
| NaBH 4 Сокращение | —— > | HOCH 2 (CHOH) n CH 2 OH и алдитол |
- Последнее обновление
- 15:05, 8 авг.
 2015
2015
- Сохранить как PDF
Кетозы
Если моносахарид имеет карбонильную функцию на одном из внутренних атомов углеродной цепи, он классифицируется как кетоза . Дигидроксиацетон может и не быть сахаром, но он входит в состав глицеральдегида как кетозный аналог. Карбонильная группа обычно находится при С-2, как показано в следующих примерах (хиральные центры окрашены в красный цвет). Как и ожидалось, карбонильная функция кетозы может быть восстановлена боргидридом натрия, обычно до смеси эпимерных продуктов. D-фруктоза, самый сладкий из обычных природных сахаров, восстанавливается, например, до смеси D-глюцита (сорбита) и D-маннита, названных в честь альдогексоз, из которых они также могут быть получены путем аналогичного восстановления. Маннитол сам по себе является обычным природным углеводом.
D-фруктоза, самый сладкий из обычных природных сахаров, восстанавливается, например, до смеси D-глюцита (сорбита) и D-маннита, названных в честь альдогексоз, из которых они также могут быть получены путем аналогичного восстановления. Маннитол сам по себе является обычным природным углеводом.
Хотя кетозы представляют собой различные изомеры моносахаридов альдоз, химия обоих классов связана из-за их легкого взаимопревращения в присутствии кислотных или основных катализаторов. Это взаимное превращение и соответствующая эпимеризация в сайтах альфа до карбонильных функций происходит посредством ендиола таутомерного промежуточного соединения. При нажатии на диаграмму будет отображаться уравнение, иллюстрирующее эти изомеризации.
Из-за такого рода изомеризации, катализируемой основаниями, реактив Толленса не подходит для различения альдоз от кетоз или для специфического окисления альдоз до соответствующих альдоновых кислот. Окисление HOBr является предпочтительным для последней конверсии.
Аномерные формы глюкозы
Блестящее разъяснение Фишером конфигурации глюкозы не устранило всей неопределенности относительно ее структуры. В 1895 году сообщалось о двух различных кристаллических формах глюкозы. Каждая из них давала все характерные реакции глюкозы и при растворении в воде уравновешивалась одной и той же смесью. Это уравновешивание происходит в течение многих минут, и происходящее изменение оптической активности называется мутаротацией 9.0014 . Эти факты суммированы на диаграмме ниже.
Когда глюкоза была преобразована в ее пентаметиловый эфир (реакция с избытком CH 3 I и AgOH), были выделены два различных изомера, и ни один из них не проявлял ожидаемых альдегидных реакций. Однако кислотно-катализируемый гидролиз производных пентаметилового эфира дает тетраметилпроизводное, которое окисляется реактивом Толлена и восстанавливается боргидридом натрия, как и ожидалось для альдегида. Эти реакции будут отображаться выше, если щелкнуть диаграмму.
Поиск научной истины часто протекает поэтапно, и хорошим примером служит структурное выяснение глюкозы. Из новых данных, представленных выше, должно быть ясно, что структура пентагидроксигексаналя с открытой цепью, нарисованная выше, должна быть модифицирована. Каким-то образом должен быть создан новый стереогенный центр, а альдегид должен быть дезактивирован в пентаметилпроизводном. Простое решение этой дилеммы достигается путем преобразования открытой альдегидной структуры глюкозы в циклический полуацеталь, называемый глюкопиранозы , как показано на следующей диаграмме. Линейный альдегид наклонен на бок, а вращение вокруг связи C4-C5 приближает C5-гидроксильную функцию к углероду альдегида. Для удобства просмотра шестичленная полуацетальная структура нарисована в виде плоского шестиугольника, но на самом деле она принимает конформацию стула. Полуацетальный атом углерода (C-1) становится новым стереогенным центром, обычно называемым аномерным углеродом , а α- и β-изомеры называются аномерами .
Теперь мы можем рассмотреть, как эта модификация структуры глюкозы объясняет загадочные факты, отмеченные выше. Во-первых, мы знаем, что полуацетали находятся в равновесии со своими карбонильными и спиртовыми компонентами в растворе. Следовательно, свежие растворы кристаллов альфа- или бета-глюкозы в воде должны образовывать равновесную смесь обоих аномеров плюс форма с открытой цепью. Это будет показано выше, если щелкнуть диаграмму. Обратите внимание, что, несмотря на очень низкую концентрацию альдегида с открытой цепью в этой смеси, типичные химические реакции альдегидов протекают быстро.
Во-вторых, производное пентаметилового эфира со структурой пиранозы преобразует полуацетальную функцию в ацеталь. Ацетали устойчивы к основаниям, поэтому этот продукт не должен реагировать с реактивом Толлена или восстанавливаться боргидридом натрия. Кислотный гидролиз ацеталей регенерирует карбонильный и спиртовой компоненты, а в случае производного глюкозы это будет тетраметиловый эфир полуацеталя пиранозы. Это соединение, конечно, будет подвергаться типичным альдегидным реакциям. Если щелкнуть диаграмму второй раз , эта связь будет отображаться выше.
Это соединение, конечно, будет подвергаться типичным альдегидным реакциям. Если щелкнуть диаграмму второй раз , эта связь будет отображаться выше.
5. Циклические формы моносахаридов
Как отмечалось выше, предпочтительной структурной формой многих моносахаридов может быть форма циклического полуацеталя. Пяти- и шестичленные кольца предпочтительнее колец других размеров из-за их малого угла и деформации затмения. Циклические структуры такого типа называются фураноза (пятичленная) или пираноза (шестичленная), что отражает отношение размера кольца к обычным гетероциклическим соединениям фурану и пирану, показанным справа. Рибоза, важная альдопентоза, обычно принимает фуранозную структуру, как показано на следующем рисунке. По соглашению для D-семейства пятичленное фуранозное кольцо нарисовано в проекции на ребро, а кислород кольца расположен вдали от наблюдателя. Аномерный атом углерода (выделенный здесь красным цветом) расположен справа. Верхняя связь с этим углеродом определяется как бета, а нижняя связь — альфа .
Верхняя связь с этим углеродом определяется как бета, а нижняя связь — альфа .
Нажмите на следующую диаграмму, чтобы увидеть модель β-D-рибофуранозы.
Циклические пиранозные формы различных моносахаридов часто изображаются в плоской проекции, известной как формула Хаворта , в честь британского химика Нормана Хаворта. Как и в случае с фуранозным кольцом, аномерный углерод расположен справа, а кольцевой кислород — сзади на виде сбоку. В D-семействе альфа- и бета-связи имеют одинаковую ориентацию, определенную для фуранозного кольца (бета вверху и альфа внизу). Эти формулы Хаворта удобны для отображения стереохимических взаимосвязей, но не отражают истинную форму молекул. Мы знаем, что эти молекулы на самом деле сморщены так, что мы называем это конформацией кресла. Примеры четырех типичных структур пиранозы показаны ниже как в виде проекций Хаворта, так и в виде более репрезентативных конформеров кресла. Аномерные углероды окрашены в красный цвет.
Аномерные углероды окрашены в красный цвет.
Модели этих структур глюкозы, галактозы, маннозы и аллозопиранозы можно просмотреть, нажав здесь.
Практическая страница для изучения конфигураций альдогексоз может быть просмотрена, нажав здесь.
Размер циклического полуацетального кольца, используемого данным сахаром, не является постоянным, но может варьироваться в зависимости от заместителей и других структурных особенностей. Альдолгексозы обычно образуют пиранозные кольца, а их пентозные гомологи предпочитают фуранозную форму, но есть много противоположных примеров. Образование производных ацеталя показывает, как тонкие изменения могут изменить эту селективность. Нажав на приведенную выше схему. дисплей изменится, чтобы проиллюстрировать это. Структура пиранозы для D-глюкозы показана в розовой рамке слева. Производные ацеталя были получены катализируемыми кислотами реакциями с бензальдегидом и ацетоном. Как правило, бензальдегид образует шестичленные циклические ацетали, тогда как ацетон предпочитает образовывать пятичленные ацетали. Верхнее уравнение показывает образование и некоторые реакции ацеталя 4,6-O-бензилидена, обычно используемой защитной группы. Производное метилгликозида этого соединения (см. ниже) оставляет гидроксильные группы C-2 и C-3 подверженными таким реакциям, как периодическое расщепление кислотой, показанное как последняя стадия. Образование изопропилиденацеталя в С-1 и С-2, центральной структуре, оставляет гидроксил С-3 как единственную незащищенную функцию. Тогда возможно селективное окисление до кетона. Наконец, прямая ди-O-изопропилиденовая дериватизация глюкозы реакцией с избытком ацетона приводит к изменению структуры на фуранозную, в которой гидроксил С-3 снова не защищен. Однако та же самая реакция с D-галактозой, показанная в голубом прямоугольнике, дает продукт пиранозы, в котором гидроксил C-6 не защищен. Оба производных не реагируют с реактивом Толленса. Это различие в поведении объясняется цис-ориентацией гидроксильных групп С-3 и С-4 в галактозе, что позволяет образовывать менее напряженный пятичленный циклический ацеталь по сравнению с транс-С-3 и С-4.
Верхнее уравнение показывает образование и некоторые реакции ацеталя 4,6-O-бензилидена, обычно используемой защитной группы. Производное метилгликозида этого соединения (см. ниже) оставляет гидроксильные группы C-2 и C-3 подверженными таким реакциям, как периодическое расщепление кислотой, показанное как последняя стадия. Образование изопропилиденацеталя в С-1 и С-2, центральной структуре, оставляет гидроксил С-3 как единственную незащищенную функцию. Тогда возможно селективное окисление до кетона. Наконец, прямая ди-O-изопропилиденовая дериватизация глюкозы реакцией с избытком ацетона приводит к изменению структуры на фуранозную, в которой гидроксил С-3 снова не защищен. Однако та же самая реакция с D-галактозой, показанная в голубом прямоугольнике, дает продукт пиранозы, в котором гидроксил C-6 не защищен. Оба производных не реагируют с реактивом Толленса. Это различие в поведении объясняется цис-ориентацией гидроксильных групп С-3 и С-4 в галактозе, что позволяет образовывать менее напряженный пятичленный циклический ацеталь по сравнению с транс-С-3 и С-4. гидроксильные группы в глюкозе. Дериватизации такого рода позволяют проводить селективные реакции в разных местах этих сильно функционализированных молекул.
гидроксильные группы в глюкозе. Дериватизации такого рода позволяют проводить селективные реакции в разных местах этих сильно функционализированных молекул.
Размер кольца этих циклических моносахаридов определяли путем окисления и расщепления цепи их производных тетраметилового эфира. Чтобы увидеть, как это было сделано для глюкозы, нажмите здесь.
6. Гликозиды
Производные ацеталя, образующиеся при реакции моносахарида со спиртом в присутствии кислотного катализатора, называются гликозидами . Эта реакция проиллюстрирована для глюкозы и метанола на диаграмме ниже. При наименовании гликозидов суффикс «оза» в названии сахара заменяется на «озид», а на первое место ставится название группы спиртов. Как обычно верно для большинства ацеталей, образование гликозидов связано с потерей эквивалента воды. Диэфирный продукт устойчив к основным и щелочным окислителям, таким как реактив Толлена. Поскольку альдолизация, катализируемая кислотой, обратима, гликозиды могут гидролизоваться обратно до их спиртовых и сахарных компонентов водной кислотой.
Аномерные метилглюкозиды образуются в равновесном соотношении 66% альфа к 34% бета. Из структур на предыдущей диаграмме видно, что пиранозные кольца предпочитают конформации кресла, в которых наибольшее число заместителей являются экваториальными. В случае глюкозы все заместители бета-аномера являются экваториальными, тогда как заместитель С-1 в альфа-аномере меняется на аксиальный. Поскольку заместители в циклогексановых кольцах предпочтительнее экваториального расположения, чем аксиального (метоксициклогексан на 75 % экваториальнее), предпочтение образования альфа-гликопиранозида является неожиданным и упоминается как аномерный эффект .
Гликозиды изобилуют биологическими системами. Путем присоединения сахарного фрагмента к липидной или бензоидной структуре можно существенно изменить растворимость и другие свойства соединения. Из-за важного модифицирующего влияния такой дериватизации были разработаны многочисленные ферментные системы, известные как гликозидазы, для присоединения и удаления сахаров из спиртов, фенолов и аминов. Химики называют сахарный компонент природных гликозидов гликон и спиртовой компонент в виде агликона . Два примера встречающихся в природе гликозидов и один пример аминопроизводного будут показаны выше, если щелкнуть диаграмму. Салицин, одно из старейших известных растительных лекарственных средств, послужил образцом для синтетического анальгетика аспирина. Большой класс гидроксилированных ароматических катионов оксония, называемых антоцианами , обеспечивает красный, фиолетовый и синий цвета многих цветов, фруктов и некоторых овощей. Пеонин является одним из примеров этого класса природных пигментов, которые демонстрируют ярко выраженную цветовую зависимость от pH. Оксониевая часть стабильна только в кислой среде, а цвет меняется или исчезает при добавлении основания. Сложные изменения, происходящие при брожении и хранении вина, частично связаны с гликозидами антоцианов. Наконец, аминопроизводные рибозы, такие как цитидин, играют важную роль в биологических фосфорилирующих агентах, коферментах и материалах для переноса и хранения информации.
Химики называют сахарный компонент природных гликозидов гликон и спиртовой компонент в виде агликона . Два примера встречающихся в природе гликозидов и один пример аминопроизводного будут показаны выше, если щелкнуть диаграмму. Салицин, одно из старейших известных растительных лекарственных средств, послужил образцом для синтетического анальгетика аспирина. Большой класс гидроксилированных ароматических катионов оксония, называемых антоцианами , обеспечивает красный, фиолетовый и синий цвета многих цветов, фруктов и некоторых овощей. Пеонин является одним из примеров этого класса природных пигментов, которые демонстрируют ярко выраженную цветовую зависимость от pH. Оксониевая часть стабильна только в кислой среде, а цвет меняется или исчезает при добавлении основания. Сложные изменения, происходящие при брожении и хранении вина, частично связаны с гликозидами антоцианов. Наконец, аминопроизводные рибозы, такие как цитидин, играют важную роль в биологических фосфорилирующих агентах, коферментах и материалах для переноса и хранения информации.
Для обсуждения аномерного эффекта нажмите здесь. Чтобы посмотреть примеры структурно и функционально модифицированных сахаров, нажмите здесь.
Дисахариды
Когда спиртовой компонент гликозида образован гидроксильной функцией другого моносахарида, такое соединение называется дисахаридом . На следующей диаграмме показаны четыре примера дисахаридов, состоящих из двух единиц глюкозы. Отдельные кольца глюкопиранозы обозначены А и В, а гликозидная связь обведена голубым. Обратите внимание, что гликозидная связь может быть альфа, как в мальтозе и трегалозе, или бета, как в целлобиозе и гентиобиозе. Кислотно-катализируемый гидролиз этих дисахаридов дает глюкозу в качестве единственного продукта. Катализируемый ферментами гидролиз селективен в отношении специфической гликозидной связи, поэтому альфа-гликозидаза расщепляет мальтозу и трегалозу до глюкозы, но не расщепляет целлобиозу или гентиобиозу. Бета-гликозидаза имеет противоположную активность.
Чтобы нарисовать репрезентативную структуру целлобиозы, одно из колец глюкопиранозы должно быть повернуто на 180º, но эту функцию часто опускают, чтобы сохранить обычную перспективу для отдельных колец. Связь между кольцами глюкопиранозы в целлобиозе и мальтозе осуществляется от аномерного углерода в кольце A до гидроксильной группы C-4 в кольце B. Это оставляет аномерный углерод в кольце B свободным, поэтому целлобиоза и мальтоза могут иметь альфа- и бета-аномеры. на этом сайте (бета-форма показана на диаграмме). Гентиобиоза имеет бета-гликозидную связь, начинающуюся на С-1 в кольце А и заканчивающуюся на С-6 в кольце В. Его альфа-аномер изображен на диаграмме. Поскольку целлобиоза, мальтоза и гентиобиоза являются полуацеталями, все они являются восстанавливающими сахарами (окисляются реактивом Толлена). Трегалоза, дисахарид, обнаруженный в некоторых грибах, является бис-ацеталем и, следовательно, невосстанавливающим сахаром. Систематическая номенклатура дисахаридов существует, но, как показывают следующие примеры, она часто бывает длинной.
- Целлобиоза : 4-O-β-D-глюкопиранозил-D-глюкоза (нарисован бета-аномер)
- Мальтоза : 4-O-α-D-глюкопиранозил-D-глюкоза (бета-аномер нарисован)
- Gentiobiose : 6-O-β-D-глюкопиранозил-D-глюкоза (нарисован альфа-аномер)
- Трегалоза : α-D-глюкопиранозил-α-D-глюкопиранозид
Хотя все показанные здесь дисахариды состоят из двух колец глюкопиранозы, их свойства интересным образом различаются. Мальтоза, иногда называемая солодовым сахаром, получается в результате гидролиза крахмала. Он примерно на треть слаще тростникового сахара (сахарозы), легко усваивается человеком и ферментируется дрожжами. Целлобиозу получают гидролизом целлюлозы. Он практически не имеет вкуса, не переваривается человеком и не ферментируется дрожжами. У некоторых бактерий есть ферменты бета-глюкозидазы, которые гидролизуют гликозидные связи в целлобиозе и целлюлозе. Наличие таких бактерий в пищеварительном тракте коров и термитов позволяет этим животным использовать клетчатку в пищу. Наконец, можно отметить, что трегалоза имеет ярко выраженный сладкий вкус, а гентиобиоза горький.
Наконец, можно отметить, что трегалоза имеет ярко выраженный сладкий вкус, а гентиобиоза горький.
Известны дисахариды, состоящие из других сахаров, но часто одним из компонентов является глюкоза. Два важных примера таких смешанных дисахаридов будут показаны выше, если щелкнуть диаграмму. Лактоза, также известная как молочный сахар, представляет собой соединение галактозы и глюкозы, соединенное в виде бета-гликозида. Это восстанавливающий сахар из-за того, что полуацетальная функция остается в глюкозном фрагменте. Многие взрослые, особенно из регионов, где молоко не является основным продуктом питания, имеют метаболическую непереносимость лактозы. У младенцев есть пищеварительный фермент, расщепляющий бета-гликозидную связь в лактозе, но выработка этого фермента прекращается при отлучении от груди. Сыр менее подвержен проблеме непереносимости лактозы, так как большая часть лактозы удаляется с сывороткой. Сахароза, или тростниковый сахар, является наиболее часто используемым подсластителем. Это невосстанавливающий дисахарид, состоящий из глюкозы и фруктозы, соединенных у аномерного углерода каждого гликозидными связями (одной альфа и одной бета). В приведенной здесь формуле кольцо фруктозы повернуто на 180º относительно его обычной точки зрения.
Это невосстанавливающий дисахарид, состоящий из глюкозы и фруктозы, соединенных у аномерного углерода каждого гликозидными связями (одной альфа и одной бета). В приведенной здесь формуле кольцо фруктозы повернуто на 180º относительно его обычной точки зрения.
Чтобы изучить модель сахарозы, нажмите здесь
Дополнительные темы
Для краткого обсуждения подсластителей нажмите здесь. Чтобы посмотреть примеры некоторых более крупных олигомеров сахаридов, нажмите здесь.
Полисахариды
Как следует из названия, полисахариды представляют собой большие высокомолекулярные молекулы, построенные путем соединения моносахаридных звеньев вместе гликозидными связями. Иногда их называют гликанами . Наиболее важные соединения этого класса, целлюлоза, крахмал и гликоген, являются полимерами глюкозы. Это легко продемонстрировать с помощью катализируемого кислотой гидролиза до моносахарида. Поскольку частичный гидролиз целлюлозы дает различные количества целлобиозы, мы заключаем, что единицы глюкозы в этой макромолекуле соединены бета-гликозидными связями между участками C-1 и C-4 соседних сахаров. Частичный гидролиз крахмала и гликогена дает дисахарид мальтозу вместе с низкомолекулярными декстранами, полисахаридами, в которых молекулы глюкозы соединены альфа-гликозидными связями между С-1 и С-6, а также альфа-С-1 до С-4. ссылки найдены в мальтозе. Также известны полисахариды, построенные из других моносахаридов (например, маннозы, галактозы, ксилозы и арабинозы), но здесь они обсуждаться не будут.
Частичный гидролиз крахмала и гликогена дает дисахарид мальтозу вместе с низкомолекулярными декстранами, полисахаридами, в которых молекулы глюкозы соединены альфа-гликозидными связями между С-1 и С-6, а также альфа-С-1 до С-4. ссылки найдены в мальтозе. Также известны полисахариды, построенные из других моносахаридов (например, маннозы, галактозы, ксилозы и арабинозы), но здесь они обсуждаться не будут.
Более половины всего органического углерода в биосфере Земли содержится в целлюлозе . Волокна хлопка по существу представляют собой чистую целлюлозу, а древесина кустарников и деревьев примерно на 50% состоит из целлюлозы. Как полимер глюкозы целлюлоза имеет формулу (C 6 H 10 O 5 ) n , где n находится в диапазоне от 500 до 5000, в зависимости от источника полимера. Звенья глюкозы в целлюлозе связаны линейным образом, как показано на рисунке ниже. Бета-гликозидные связи позволяют этим цепям растягиваться, и эта конформация стабилизируется внутримолекулярными водородными связями. Параллельной ориентации соседних цепей также способствуют межмолекулярные водородные связи. Хотя отдельная водородная связь относительно слаба, многие такие связи, действующие вместе, могут придавать большую стабильность определенным конформациям больших молекул. Большинство животных не могут переваривать целлюлозу как пищу, а в рационе человека эта часть потребляемых нами овощей функционирует как грубый корм и выводится практически без изменений. У некоторых животных (например, у коров и термитов) кишечные микроорганизмы расщепляют целлюлозу на моносахаридные питательные вещества с помощью ферментов бета-гликозидазы.
Параллельной ориентации соседних цепей также способствуют межмолекулярные водородные связи. Хотя отдельная водородная связь относительно слаба, многие такие связи, действующие вместе, могут придавать большую стабильность определенным конформациям больших молекул. Большинство животных не могут переваривать целлюлозу как пищу, а в рационе человека эта часть потребляемых нами овощей функционирует как грубый корм и выводится практически без изменений. У некоторых животных (например, у коров и термитов) кишечные микроорганизмы расщепляют целлюлозу на моносахаридные питательные вещества с помощью ферментов бета-гликозидазы.
Целлюлоза обычно сопровождается разветвленным аморфным полимером с более низкой молекулярной массой, называемым гемицеллюлозой . В отличие от целлюлозы, гемицеллюлоза структурно слаба и легко гидролизуется разбавленной кислотой или основанием. Также многие ферменты катализируют его гидролиз. Гемицеллюлозы состоят из многих D-пентозных сахаров, основным компонентом которых является ксилоза. Часто присутствуют манноза и маннуроновая кислота, а также галактоза и галактуроновая кислота.
Часто присутствуют манноза и маннуроновая кислота, а также галактоза и галактуроновая кислота.
Крахмал представляет собой полимер глюкозы, обнаруженный в корнях, корневищах, семенах, стеблях, клубнях и клубнелуковицах растений в виде микроскопических гранул, имеющих характерные формы и размеры. Большинство животных, включая людей, зависят от этих растительных крахмалов для питания. Структура крахмала сложнее, чем у целлюлозы. Неповрежденные гранулы нерастворимы в холодной воде, но их измельчение или набухание в теплой воде приводит к их разрыву.
Выпускаемый крахмал состоит из двух фракций. Около 20% составляет водорастворимый материал, называемый амилоза . Молекулы амилозы представляют собой линейные цепи из нескольких тысяч единиц глюкозы, соединенных альфа-гликозидными связями от С-1 до С-4. Растворы амилозы на самом деле представляют собой дисперсии гидратированных спиральных мицелл. Большая часть крахмала представляет собой вещество с гораздо более высокой молекулярной массой, состоящее почти из миллиона единиц глюкозы и называемое амилопектином . Молекулы амилопектина представляют собой разветвленные сети, построенные из гликозидных звеньев от С-1 до С-4 и от С-1 до С-6, и практически нерастворимы в воде. Репрезентативные структурные формулы для амилозы и амилопектина будут показаны выше, если щелкнуть диаграмму. Чтобы увидеть расширенную структуру амилопектина, нажмите еще раз на диаграмму. Ветвление на этой диаграмме преувеличено, так как в среднем разветвления происходят только через каждые двадцать пять единиц глюкозы.
Молекулы амилопектина представляют собой разветвленные сети, построенные из гликозидных звеньев от С-1 до С-4 и от С-1 до С-6, и практически нерастворимы в воде. Репрезентативные структурные формулы для амилозы и амилопектина будут показаны выше, если щелкнуть диаграмму. Чтобы увидеть расширенную структуру амилопектина, нажмите еще раз на диаграмму. Ветвление на этой диаграмме преувеличено, так как в среднем разветвления происходят только через каждые двадцать пять единиц глюкозы.
Гидролиз крахмала, обычно с помощью ферментативных реакций, дает сиропообразную жидкость, состоящую в основном из глюкозы. Когда исходным сырьем является кукурузный крахмал, этот продукт известен как кукурузный сироп . Он широко используется для смягчения текстуры, придания объема, предотвращения кристаллизации и улучшения вкуса пищевых продуктов.
Гликоген – полимер для хранения глюкозы, используемый животными. Он имеет структуру, аналогичную амилопектину, но еще более разветвленную (примерно каждая десятая единица глюкозы). Степень разветвленности этих полисахаридов можно измерить ферментативным или химическим анализом.
Степень разветвленности этих полисахаридов можно измерить ферментативным или химическим анализом.
Для примеров химического анализа разветвления нажмите здесь.
Синтетическая модификация целлюлозы
Хлопок, вероятно, самое полезное натуральное волокно, почти чистая целлюлоза. Производство текстиля из хлопка включает физические манипуляции с сырьем путем прочесывания, расчесывания и прядения выбранных волокон. Для тканей лучший хлопок имеет длинные волокна, а короткие волокна или хлопковая пыль удаляются. Сырая целлюлоза также может быть получена из древесной массы путем растворения лигнановой матрицы, окружающей ее. Эти менее желательные источники целлюлозы широко используются для изготовления бумаги.
Чтобы расширить возможности практического использования целлюлозы, химики разработали методы приготовления растворов производных целлюлозы, которые можно прясть в волокна, намазывать в пленку или отливать в различных твердых формах. Ключевым фактором в этих превращениях являются три свободные гидроксильные группы на каждом звене глюкозы в цепи целлюлозы, –[C 6 H 7 O(OH) 3 ] n –. Этерификация этих функций приводит к полимерным продуктам, обладающим совершенно другими свойствами по сравнению с самой целлюлозой.
Этерификация этих функций приводит к полимерным продуктам, обладающим совершенно другими свойствами по сравнению с самой целлюлозой.
Нитрат целлюлозы , впервые полученный более 150 лет назад путем обработки целлюлозы азотной кислотой, является первым синтетическим полимером, получившим широкое распространение. Полностью азотированное соединение –[C 6 H 7 O(ONO 2 ) 3 ] n – называемое пироксилин, взрывоопасно и является компонентом бездымного пороха. Частично нитрованная целлюлоза называется пироксилин . Пироксилин растворим в эфире и одно время использовался для фотопленки и лаков. Высокая воспламеняемость пироксилина стала причиной многих трагических пожаров в кинотеатрах за время его использования. Кроме того, медленный гидролиз пироксилина дает азотную кислоту, процесс, который способствует порче ранних кинопленок при хранении.
Ацетат целлюлозы , –[C 6 H 7 O(OAc) 3 ] n – менее горюч, чем пироксилин, и заменил его в большинстве применений. Его получают реакцией целлюлозы с уксусным ангидридом и кислотным катализатором. Свойства продукта зависят от степени ацетилирования. В препаратах неизбежно происходит некоторое укорочение цепи. Раствор ацетата целлюлозы в ацетоне можно пропустить через фильеру для образования нитей, называемых 9.0013 ацетатный искусственный шелк , который можно вплетать в ткань.
Его получают реакцией целлюлозы с уксусным ангидридом и кислотным катализатором. Свойства продукта зависят от степени ацетилирования. В препаратах неизбежно происходит некоторое укорочение цепи. Раствор ацетата целлюлозы в ацетоне можно пропустить через фильеру для образования нитей, называемых 9.0013 ацетатный искусственный шелк , который можно вплетать в ткань.
Вискоза производится путем образования растворимого в щелочи производного ксантогената, из которого можно формовать волокно, преобразующее полимер целлюлозы путем кислотного гашения. Следующее общее уравнение иллюстрирует эти преобразования. Волокно продукта называется вискозный шелк .
| РОХ | NaOH | RO (-) Na (+) + S=C=S | RO-CS 2 (-) Нет данных (+) | Н 3 О (+) | РОХ | |
| целлюлоза | раствор вискозы | район |
- Последнее обновление
- 16:39, 4 сен 2015
- Сохранить как PDF
 Эта молекула лежит в основе обозначения изомеров всех углеводов.
Эта молекула лежит в основе обозначения изомеров всех углеводов.Введение
Глицеральдегид может существовать в двух изомерных формах, которые являются зеркальными отображениями друг друга, как показано ниже. Абсолютная конфигурация определяется молекулой в крайнем левом положении как D-глицеральдегид. С альдегидной группой в направлении «вверх», группа -ОН должна выступать с правой стороны молекулы для D-изомера. Химики использовали эту конфигурацию D-глицеральдегида для определения семейств оптических изомеров остальных углеводов. Все встречающиеся в природе моносахариды принадлежат к оптическому семейству D. Примечательно, что химия и ферменты всех живых существ могут определить разницу между геометрией одного оптического изомера по сравнению с другим.
Моносахариды относятся к D-семейству в соответствии с проекцией группы -ОН на справа на хиральном углероде, наиболее удаленном от карбонильной (альдегидной) группы. Это на углероде № 5, если карбонильный углерод № 1.
Примечание. По какой-то причине модель шара и стержня не полностью соответствует проекциям групп -ОН на атомах углерода № 2 и 4. Это мешает что плоская модель Фишера была определена.
Сколько хиральных атомов углерода вы можете найти? Перечислите их. При необходимости просмотрите хиральные соединения, чтобы найти определения. Затем проверьте ответ в раскрывающемся меню.
Сравните глюкозу и галактозу
Внимательно изучите структуру глюкозы и галактозы. Какая группа -ОН определяет, что они оба являются изомерами D? Затем проверьте ответ в раскрывающемся меню.
Изомеры имеют разное расположение атомов. Какая углеродная связь с -OH и -H отличается в глюкозе и галактозе? Это единственное отличие образует изомеры глюкозы и галактозы. Затем проверьте ответ в раскрывающемся меню.
- Последнее обновление
- 12:36, 4 мар 2017
- Сохранить как PDF
Введение
Химический состав углеводов наиболее близок к химическому составу спиртовых, альдегидных и кетоновых функциональных групп. В результате современное определение УГЛЕВОДА состоит в том, что соединения представляют собой полигидроксиальдегиды или кетоны. Химия углеводов усложняется тем, что почти на каждом углероде есть функциональная группа (спирт). Кроме того, углевод может иметь либо прямую цепь, либо кольцевую структуру. Кольцевые структуры включают две дополнительные функциональные группы: полуацеталь и ацеталь.
В результате современное определение УГЛЕВОДА состоит в том, что соединения представляют собой полигидроксиальдегиды или кетоны. Химия углеводов усложняется тем, что почти на каждом углероде есть функциональная группа (спирт). Кроме того, углевод может иметь либо прямую цепь, либо кольцевую структуру. Кольцевые структуры включают две дополнительные функциональные группы: полуацеталь и ацеталь.
Большая часть углеродного цикла происходит в результате превращения углекислого газа в углеводы посредством фотосинтеза. Углеводы используются животными и людьми в обмене веществ для производства энергии и других соединений.
Фотосинтез представляет собой сложную серию реакций, осуществляемых водорослями, фитопланктоном и листьями растений, которые используют энергию солнца. Упрощенная версия этой химической реакции заключается в использовании молекул углекислого газа из воздуха и молекул воды, а также энергии солнца для производства простого сахара, такого как глюкоза и молекулы кислорода, в качестве побочного продукта. Затем простые сахара превращаются в другие молекулы, такие как крахмал, жиры, белки, ферменты и ДНК/РНК, то есть во все остальные молекулы живых растений. Вся «материя/вещество» растения в конечном итоге производится в результате этой реакции фотосинтеза.
Затем простые сахара превращаются в другие молекулы, такие как крахмал, жиры, белки, ферменты и ДНК/РНК, то есть во все остальные молекулы живых растений. Вся «материя/вещество» растения в конечном итоге производится в результате этой реакции фотосинтеза.
Ди- и полиуглеводы
- Моносахариды содержат одну единицу сахара, такую как глюкоза, галактоза, фруктоза и т. д.
- Дисахариды содержат две единицы сахара. Почти во всех случаях одним из сахаров является глюкоза, а другим сахаром является галактоза, фруктоза или другая глюкоза. Распространенными дисахаридами являются мальтоза, лактоза и сахароза.
- Полисахариды содержат много сахарных звеньев в длинных полимерных цепях из множества повторяющихся звеньев. Наиболее распространенной сахарной единицей является глюкоза. Обычными полисахаридами являются крахмал, гликоген и целлюлоза.
Таблица 1: Общие углеводы
| Имя | Производное название и источник |
|---|---|
| Моносахариды | |
| Глюкоза | От греческого слова, обозначающего сладкое вино; виноградный сахар, сахар крови, декстроза. |
| Галактоза | Греческое слово, обозначающее молоко – «галакт», обнаруженное как компонент лактозы в молоке. |
| Фруктоза | Латинское слово, обозначающее фрукт – «фруктус», также известное как левулеза, встречается во фруктах и меде; самый сладкий сахар. |
| Рибоза | Рибоза и дезоксирибоза находятся в основной структуре РНК и ДНК соответственно. |
| Дисахариды – содержат два моносахарида | |
| Сахароза | Французское слово, обозначающее сахар – «sucre», дисахарид, содержащий глюкозу и фруктозу; столовый сахар, тростниковый сахар, свекловичный сахар. |
| Лактоза | Латинское слово, обозначающее молоко – «лак»; дисахарид, содержащийся в молоке, содержащий глюкозу и галактозу. |
| Мальтоза | французское слово, означающее «солод»; дисахарид, содержащий две единицы глюкозы; содержится в проросших зернах, используемых для приготовления пива. |
| Общие полисахариды | |
| Крахмал | Растения запасают глюкозу в виде полисахарида крахмала. Зерновые злаки (пшеница, рис, кукуруза, овес, ячмень), а также клубни, такие как картофель, богаты крахмалом. |
| Целлюлоза | Основным компонентом жестких клеточных стенок растений является целлюлоза, представляющая собой линейный полисахаридный полимер с большим количеством моносахаридных звеньев глюкозы. |
| Гликоген | Это форма хранения глюкозы у животных и человека, аналогичная крахмалу в растениях. Гликоген синтезируется и запасается в основном в печени и мышцах. |
Метаболизм
Метаболизм происходит у животных и людей после приема органических продуктов растительного или животного происхождения. В клетках происходит ряд сложных реакций с кислородом для превращения, например, сахара-глюкозы в продукты двуокиси углерода и воды и ЭНЕРГИИ. Эта реакция также осуществляется бактериями при разложении/разложении отходов на суше и в воде.
Эта реакция также осуществляется бактериями при разложении/разложении отходов на суше и в воде.
Горение происходит, когда любой органический материал реагирует (сгорает) в присутствии кислорода с выделением продуктов двуокиси углерода, воды и ЭНЕРГИИ. Органическим материалом может быть любое ископаемое топливо, такое как природный газ (метан), нефть или уголь. Другими горючими органическими материалами являются дерево, бумага, пластик и ткань.
Целью обоих процессов является преобразование химической энергии в другие формы энергии, такие как тепло.
- Последнее обновление
- 13:23, 1 июл 2014
- Сохранить как PDF
 Шаг 1 : Нарисуйте проекцию Фишера ациклической формы D-глюкозы. (См. условное обозначение D, L) Шаг 2 : Пронумеруйте углеродную цепь цифрой 1, начиная сверху. Этап 3 : Для создания пиранозного кольца атом кислорода на C-5 в 1 должен быть присоединен к C-1 одинарной связью. В 1 C-1 находится за плоскостью бумаги и гидроксильной группой. на С-5 впереди. Чтобы пиранозное кольцо было плоским, как С-1, так и гидроксильная группа на С-5 должны быть либо позади, либо впереди плоскости бумаги. C-5 является хиральным центром. Чтобы перенести гидроксильную группу C-5 на место, занятое Ch3OH
Шаг 1 : Нарисуйте проекцию Фишера ациклической формы D-глюкозы. (См. условное обозначение D, L) Шаг 2 : Пронумеруйте углеродную цепь цифрой 1, начиная сверху. Этап 3 : Для создания пиранозного кольца атом кислорода на C-5 в 1 должен быть присоединен к C-1 одинарной связью. В 1 C-1 находится за плоскостью бумаги и гидроксильной группой. на С-5 впереди. Чтобы пиранозное кольцо было плоским, как С-1, так и гидроксильная группа на С-5 должны быть либо позади, либо впереди плоскости бумаги. C-5 является хиральным центром. Чтобы перенести гидроксильную группу C-5 на место, занятое Ch3OHбез изменения абсолютной конфигурации в С-5, поверните три лиганда H, OH и Ch3OH на С-5 по часовой стрелке, не перемещая четвертый лиганд. (См. проекцию Фишера)
1 и 2 представляют D-глюкозу, но в 2, в отличие от 1, C-1 и гидроксильная группа на C-5 находятся на одной стороне плоскости бумаги.
Шаг 4 : Не обращайте внимания на то, что 2 — это проекция Фишера, и поверните ее по часовой стрелке на 90º.
Шаг 5 : Перерисуйте цепочку атомов вдоль горизонтальной оси следующим образом.
Шаг 6 : Добавьте лиганды от C-2 до C-5 в 4. Лиганды, указывающие вверх в 3, указывают вверх в 4; те, которые указывают вниз в 3, указывают вниз в 4.
Шаг 7 : Удалите атом водорода и атом кислорода на C-1 и атом водорода в гидроксильной группе на C-5 в 5 и соедините два атомов одинарной связью.
Этап 8 : Добавьте две оставшиеся связи к C-1 в 6.
Этап 10: Замените атом водорода и гидроксильную группу на C-1 в 8.
формулы Ha пиранозы D-глюкозы. Если в ациклической форме моносахарида гидроксильная группа, реагирующая с карбонильным углеродом, находится не на хиральном углероде (например, D-фруктоза → пиранозы), пропустите шаг 3.
ЛИПИДЫ
- Последнее обновление
- 20:27, 2 мар 2017
 Длина углеводородной цепи может варьироваться от 10 до 30 атомов углерода (чаще всего 12-18). Неполярная углеводородная алкановая цепь является важным противовесом функциональной группе полярной кислоты. В кислотах с небольшим числом атомов углерода преобладает кислотная функциональная группа, которая придает всей молекуле полярный характер. Однако в жирных кислотах неполярная углеводородная цепь придает молекуле неполярный характер.
Длина углеводородной цепи может варьироваться от 10 до 30 атомов углерода (чаще всего 12-18). Неполярная углеводородная алкановая цепь является важным противовесом функциональной группе полярной кислоты. В кислотах с небольшим числом атомов углерода преобладает кислотная функциональная группа, которая придает всей молекуле полярный характер. Однако в жирных кислотах неполярная углеводородная цепь придает молекуле неполярный характер.- Последнее обновление
- 20:27, 2 мар 2017
- Сохранить как PDF

Введение
Перечислены наиболее распространенные жирные кислоты. Обратите внимание, что существует две группы жирных кислот – насыщенные и ненасыщенные. Напомним, что термин «ненасыщенный» относится к наличию одной или нескольких двойных связей между атомами углерода, как в алкенах. В насыщенной жирной кислоте все положения связей между атомами углерода заняты атомами водорода. Точки плавления насыщенных жирных кислот следуют принципу точки кипения, наблюдавшемуся ранее. Принцип точки плавления: по мере увеличения молекулярной массы температура плавления увеличивается. Это наблюдается в ряду лауриновой (С12), пальмитиновой (С16), стеариновой (С18). Комнатная температура 25 o C, лауриновая кислота, которая плавится при 44 o , все еще остается твердой, в то время как арахидоновая кислота уже давно плавится при -50 o , поэтому она является жидкостью при комнатной температуре.
| Название кислоты | Структура | Точка плавления | |
|---|---|---|---|
| НАСЫЩЕННЫЙ | |||
| Лаурик | CH 3 (CH 2 ) 10 COOH | +44 | |
| Пальмитиновая | СН 3 (СН 2 ) 14 СООН | +63 | |
| Стеариновая | СН 3 (СН 2 ) 16 СООН | +70 | |
| НЕНАСЫЩЕННЫЙ | |||
| Олеик | СН 3 (СН 2 ) 7 СН=СН(СН 2 ) 7 СООН | +16 | |
| Линолевая | CH 3 (CH 2 ) 4 (CH=CHCH 2 ) 2 (CH 2 ) 6 COOH | -5 | |
| Линоленовая | СН 3 СН 2 (СН=СНСН 2 ) 3 (СН 2 ) 6 СООН | -11 | |
| Арахидоновый | СН 3 (СН 2 ) 4 (СН=СНСН 2 ) 4 (СН 2 ) 2 СООН | -50 |
Температуры плавления насыщенных и ненасыщенных жирных кислот
Обратите внимание, что как группа ненасыщенные жирные кислоты имеют более низкие температуры плавления, чем насыщенные жирные кислоты . Причину этого явления можно найти путем тщательного рассмотрения молекулярной геометрии. Тетраэдрические валентные углы на углероде приводят к молекулярной геометрии насыщенных жирных кислот, которая является относительно линейной, хотя и с зигзагами. См. рисунок слева. Эта молекулярная структура позволяет многим молекулам жирных кислот быть довольно плотно «уложенными» вместе. В результате тесные межмолекулярные взаимодействия приводят к относительно высоким температурам плавления.
Причину этого явления можно найти путем тщательного рассмотрения молекулярной геометрии. Тетраэдрические валентные углы на углероде приводят к молекулярной геометрии насыщенных жирных кислот, которая является относительно линейной, хотя и с зигзагами. См. рисунок слева. Эта молекулярная структура позволяет многим молекулам жирных кислот быть довольно плотно «уложенными» вместе. В результате тесные межмолекулярные взаимодействия приводят к относительно высоким температурам плавления.
С другой стороны, введение одной или нескольких двойных связей в углеводородную цепь ненасыщенных жирных кислот приводит к одному или нескольким «изгибам» в молекуле. Геометрия двойной связи почти всегда является цис-конфигурацией в природных жирных кислотах. и эти молекулы не очень хорошо «укладываются». Межмолекулярные взаимодействия гораздо слабее, чем у насыщенных молекул. В результате точки плавления ненасыщенных жирных кислот намного ниже.
| Жир или масло | Насыщенный | Ненасыщенный | |||
|---|---|---|---|---|---|
| Пальмитик | Стеариновая | Олеик | линолевая | Другое | |
| Животное происхождение | |||||
| Сливочное масло | 29 | 9 | 27 | 4 | 31 |
| Лард | 30 | 18 | 41 | 6 | 5 |
| Говядина | 32 | 25 | 38 | 3 | 2 |
| Растительного происхождения | |||||
| Кукурузное масло | 10 | 4 | 34 | 48 | 4 |
| Соя | 7 | 3 | 25 | 56 | 9 |
| Арахис | 7 | 5 | 60 | 21 | 7 |
| Оливковый | 6 | 4 | 83 | 7 | – |
- Последнее обновление
- 14:45, 2 мая 2017
- Сохранить как PDF
 Это приведет к ишемической болезни сердца, которая приводит к затвердению и сужению артерий, что приводит к сердечному приступу. В конечном итоге жиры были разделены на 2 категории: «здоровые жиры» и «нездоровые жиры». Нездоровые жиры считаются насыщенных жиров и полезных жиров воспринимаются как ненасыщенных жиров. Вывод мета-анализа был следующим: «В отличие от текущих рекомендаций, этот систематический обзор не обнаружил доказательств того, что насыщенные жиры повышают риск ишемической болезни или что полиненасыщенные жиры обладают кардиозащитным эффектом».[1] Пищевые жиры играют важную роль. решающую роль в здоровье человека. Они помогают поддерживать здоровье клеток, помогают в развитии мозга, помогают использовать жирорастворимые витамины и помогают смягчать органы, защищая их от тупых травм. Жиры бывают разных форм: насыщенные, ненасыщенные и транс-жиры, и это лишь некоторые из них. Насыщенные жиры остаются твердыми при комнатной температуре из-за своей молекулярной формы.
Это приведет к ишемической болезни сердца, которая приводит к затвердению и сужению артерий, что приводит к сердечному приступу. В конечном итоге жиры были разделены на 2 категории: «здоровые жиры» и «нездоровые жиры». Нездоровые жиры считаются насыщенных жиров и полезных жиров воспринимаются как ненасыщенных жиров. Вывод мета-анализа был следующим: «В отличие от текущих рекомендаций, этот систематический обзор не обнаружил доказательств того, что насыщенные жиры повышают риск ишемической болезни или что полиненасыщенные жиры обладают кардиозащитным эффектом».[1] Пищевые жиры играют важную роль. решающую роль в здоровье человека. Они помогают поддерживать здоровье клеток, помогают в развитии мозга, помогают использовать жирорастворимые витамины и помогают смягчать органы, защищая их от тупых травм. Жиры бывают разных форм: насыщенные, ненасыщенные и транс-жиры, и это лишь некоторые из них. Насыщенные жиры остаются твердыми при комнатной температуре из-за своей молекулярной формы. Термин «насыщенный» относится к sp 3 углеродная цепь, у которой оставшиеся sp 3 орбитали связаны с атомами водорода. Таким образом, термин «насыщенный». Он «насыщен» водородом. Насыщенные жиры имеют цепочечную структуру, которая позволяет им очень хорошо складываться, образуя твердое вещество при комнатной температуре. Ненасыщенные жиры не являются линейными из-за углеродов с двойными связями, что приводит к другой молекулярной форме, потому что атомы углерода sp 2 являются треугольными, плоскими, а не тетраэдрическими (углероды sp 3 ), как в насыщенных жирах. Это изменение в структуре приведет к тому, что молекулы жира не будут очень хорошо складываться, что приведет к тому, что жиры будут жидкими при комнатной температуре. Сливочное масло в основном состоит из насыщенных жиров, поэтому оно твердое при комнатной температуре. Оливковое масло жидкое при комнатной температуре, поэтому это ненасыщенный жир. Ненасыщенный жир можно превратить в насыщенный жир с помощью реакций гидрогенизации.
Термин «насыщенный» относится к sp 3 углеродная цепь, у которой оставшиеся sp 3 орбитали связаны с атомами водорода. Таким образом, термин «насыщенный». Он «насыщен» водородом. Насыщенные жиры имеют цепочечную структуру, которая позволяет им очень хорошо складываться, образуя твердое вещество при комнатной температуре. Ненасыщенные жиры не являются линейными из-за углеродов с двойными связями, что приводит к другой молекулярной форме, потому что атомы углерода sp 2 являются треугольными, плоскими, а не тетраэдрическими (углероды sp 3 ), как в насыщенных жирах. Это изменение в структуре приведет к тому, что молекулы жира не будут очень хорошо складываться, что приведет к тому, что жиры будут жидкими при комнатной температуре. Сливочное масло в основном состоит из насыщенных жиров, поэтому оно твердое при комнатной температуре. Оливковое масло жидкое при комнатной температуре, поэтому это ненасыщенный жир. Ненасыщенный жир можно превратить в насыщенный жир с помощью реакций гидрогенизации.
Реакция гидрогенизации
Ненасыщенные жирные кислоты могут быть преобразованы в насыщенные жирные кислоты с помощью относительно простой реакции гидрогенизации. Напомним, что присоединение водорода к алкену (ненасыщенному) дает алкан (насыщенный). Простая реакция гидрирования:
h3C=Ch3+h3→Ch4Ch4
алкен плюс водород дает алкан
Растительные масла обычно называют «полиненасыщенными». Это просто означает, что присутствует несколько двойных связей. Растительные масла могут быть преобразованы из жидкостей в твердые вещества с помощью реакции гидрирования. Таким образом, маргарины и шортенинги «затвердевают», чтобы сделать их твердыми или полутвердыми.
Рисунок 1: Гидрирование олеиновой жирной кислоты
Растительные масла, которые были частично гидрогенизированы, теперь частично насыщены, поэтому температура плавления повышается до точки, при которой твердое вещество присутствует при комнатной температуре. Степень гидрогенизации ненасыщенных масел определяет конечную консистенцию продукта. Что случилось с полезностью продукта, который был преобразован из ненасыщенных жиров в насыщенные?
Степень гидрогенизации ненасыщенных масел определяет конечную консистенцию продукта. Что случилось с полезностью продукта, который был преобразован из ненасыщенных жиров в насыщенные?
Трансжиры
Основной проблемой для здоровья в процессе гидрогенизации является образование трансжиров. Трансжиры являются результатом побочной реакции с катализатором процесса гидрогенизации. Это результат ненасыщенного жира, который обычно обнаруживается, когда цис-изомер превращается в транс-изомер ненасыщенного жира. Изомеры — это молекулы, которые имеют одинаковую молекулярную формулу, но связаны друг с другом по-разному. Сосредоточившись на атомах углерода с двойными связями sp 2 , цис-изомер имеет атомы водорода на одной стороне. Благодаря дополнительной энергии процесса гидрогенизации достигается энергия активации для преобразования цис-изомеров ненасыщенного жира в транс-изомер ненасыщенного жира. Эффект заключается в том, чтобы поместить один из атомов водорода на противоположную сторону одного из атомов углерода. Это приводит к транс-конфигурации атомов углерода с двойной связью. Организм человека не распознает трансжиры.
Это приводит к транс-конфигурации атомов углерода с двойной связью. Организм человека не распознает трансжиры.
Хотя трансжирные кислоты являются химически «мононенасыщенными» или «полиненасыщенными», они считаются настолько отличными от цис-мононенасыщенных или полиненасыщенных жирных кислот, что их нельзя юридически обозначать как ненасыщенные для целей маркировки. Большинство трансжирных кислот (хотя химически все еще ненасыщенных), полученных в процессе частичной гидрогенизации, теперь классифицируются в той же категории, что и насыщенные жиры.
Основным недостатком является то, что трансжиры имеют тенденцию повышать уровень «плохого» холестерина ЛПНП и снижать уровень «хорошего» холестерина ЛПВП, хотя и не так сильно, как насыщенные жиры. Трансжиры содержатся в маргарине, хлебобулочных изделиях, таких как пончики и датская выпечка, жареных во фритюре продуктах, таких как жареная курица и картофель по-французски, закусочных чипсах, имитации сыра и кондитерских жирах.
- Последнее обновление
- 12:51, 21 янв. 2014
- Сохранить как PDF
Введение
Простагландины представляют собой ненасыщенные карбоновые кислоты, состоящие из скелета из 20 атомов углерода, который также содержит пятичленное кольцо. Они биохимически синтезируются из жирной кислоты, арахидоновой кислоты. См. рисунок слева. Уникальная форма арахидоновой кислоты, обусловленная рядом двойных цис-связей, помогает поставить ее в положение, в котором образуется пятичленное кольцо. См. простагландин на следующей панели
См. простагландин на следующей панели
Структура простагландинов
Простагландины представляют собой ненасыщенные карбоновые кислоты, состоящие из 20-углеродного скелета, который также содержит пятичленное кольцо и основан на жирной кислоте, арахидоновой кислоте. Существуют различные структуры с одной, двумя или тремя двойными связями. В пятичленном кольце также могут быть двойные связи, кетоновые или спиртовые группы. Типичная структура показана на левом рисунке.
Функции простагландинов
Существует множество физиологических эффектов, включая:
- Активация воспалительной реакции, возникновение боли и лихорадки. Когда ткани повреждены, лейкоциты приливают к месту повреждения, пытаясь свести к минимуму разрушение ткани. В результате образуются простагландины.
- Сгустки крови образуются при повреждении кровеносного сосуда. Тип простагландина, называемый тромбоксаном, стимулирует сокращение и свертывание тромбоцитов. И наоборот, PGI2 оказывает противоположное действие на стенки кровеносных сосудов, где не должны образовываться сгустки.

- Некоторые простагландины участвуют в индукции родов и других репродуктивных процессах. PGE2 вызывает сокращения матки и используется для стимуляции родов.
- Простагландины участвуют в некоторых других органах, таких как желудочно-кишечный тракт (ингибируют синтез кислоты и увеличивают секрецию защитной слизи), увеличивают кровоток в почках, а лейкотриены способствуют сужению бронхов, связанному с астмой.
Эффекты аспирина и других болеутоляющих средств
Когда вы видите, что простагландины вызывают воспаление, боль и лихорадку, что приходит на ум, но не аспирин. Аспирин блокирует фермент циклооксигеназу, ЦОГ-1 и ЦОГ-2, который участвует в замыкании кольца и добавлении кислорода к арахидоновой кислоте, превращая ее в простагландины. Ацетильную группу аспирина гидролизуют, а затем связывают со спиртовой группой серина в виде сложного эфира. Это приводит к блокировке канала в ферменте, и арахидоновая кислота не может попасть в активный центр фермента. Ингибируя или блокируя этот фермент, блокируется синтез простагландинов, что, в свою очередь, снимает некоторые последствия боли и лихорадки. Также считается, что аспирин ингибирует синтез простагландинов, связанных с нежелательным свертыванием крови при ишемической болезни сердца. В то же время травма при приеме аспирина может вызвать более обширное кровотечение.
Ингибируя или блокируя этот фермент, блокируется синтез простагландинов, что, в свою очередь, снимает некоторые последствия боли и лихорадки. Также считается, что аспирин ингибирует синтез простагландинов, связанных с нежелательным свертыванием крови при ишемической болезни сердца. В то же время травма при приеме аспирина может вызвать более обширное кровотечение.
- Последнее обновление
- 20:41, 2 мар 2017
- Последнее обновление
- 21:30, 2 мар 2017
- Сохранить как PDF

Введение
Поскольку глицерин имеет три спиртовые функциональные группы, три жирные кислоты должны реагировать, чтобы образовать три сложноэфирные функциональные группы. Три жирные кислоты могут быть или не быть идентичными. Фактически могут присутствовать три разные жирные кислоты. Синтез триглицерида — еще одно применение реакции синтеза сложного эфира. Чтобы написать структуру триглицерида, вы должны знать структуру глицерина и получить или найти структуру жирной кислоты в таблице.
| Жир или масло | Насыщенный | Ненасыщенный | |||
|---|---|---|---|---|---|
| Пальмитик | Стеариновая | Олеик | линолевая | Другое | |
| Животное происхождение | |||||
| Сливочное масло | 29 | 9 | 27 | 4 | 31 |
| Лард | 30 | 18 | 41 | 6 | 5 |
| Говядина | 32 | 25 | 38 | 3 | 2 |
| Растительного происхождения | |||||
| Кукурузное масло | 10 | 4 | 34 | 48 | 4 |
| Соя | 7 | 3 | 25 | 56 | 9 |
| Арахис | 7 | 5 | 60 | 21 | 7 |
| Оливковый | 6 | 4 | 83 | 7 | – |
Синтез триглицеридов
Поскольку глицерин (название IUPAC — 1,2,3-пропантриол) имеет три спиртовые функциональные группы, три жирные кислоты должны вступить в реакцию с образованием трех сложноэфирных функциональных групп. Три жирные кислоты могут быть или не быть идентичными. Фактически могут присутствовать три разные жирные кислоты. nСинтез триглицеридов является еще одним применением реакции синтеза сложного эфира. Чтобы написать структуру триглицерида, вы должны знать структуру глицерина и получить или найти структуру жирной кислоты в таблице — найти лауриновую кислоту.
Три жирные кислоты могут быть или не быть идентичными. Фактически могут присутствовать три разные жирные кислоты. nСинтез триглицеридов является еще одним применением реакции синтеза сложного эфира. Чтобы написать структуру триглицерида, вы должны знать структуру глицерина и получить или найти структуру жирной кислоты в таблице — найти лауриновую кислоту.
Глицерин
Упрощенная реакция показывает процесс разрыва некоторых связей и образования сложного эфира и побочного продукта, воды. Обратитесь к графику слева для синтеза трилауроилглицерина . Во-первых, разрывается связь -ОН (красная) в кислоте, а также -Н (красная) связь в спирте. Оба соединения образуют HOH, молекулу воды. Во-вторых, кислород спирта образует связь (зеленый) с кислотой на углероде с кислородом двойной связи. Это образует сложноэфирную функциональную группу. Этот процесс проводится три раза, чтобы получить три сложноэфирные группы и три молекулы воды.
Структура триглицерида
Как видно из рисунка слева, реальная молекулярная модель триглицерида совсем не похожа на линейный рисунок. Причина этого различия кроется в представлениях молекулярной геометрии. Трилауроилглицерин. Все вышеперечисленные факторы способствуют кажущейся Т-образной форме молекулы.
Причина этого различия кроется в представлениях молекулярной геометрии. Трилауроилглицерин. Все вышеперечисленные факторы способствуют кажущейся Т-образной форме молекулы.
Задачи
| Тест: Какая кислота (короткоцепочечная или жирная) наиболее вероятно будет растворима в воде? |
| … в гексане? |
1 Потренируйтесь писать триглицерид стеариновой кислоты. Снова найдите формулу стеариновой кислоты и используйте структуру глицерина.
2. Запишите свои ответы. Затем проверьте ответы в раскрывающемся меню.
| Какова молекулярная геометрия всех трех атомов углерода в глицерине (см. модель выше)? |
| Какова молекулярная геометрия углерода в центре сложноэфирной группы? | |
| Какова молекулярная геометрия кислорода с простой связью? |
- Последнее обновление
- 20:40, 2 мар 2017
- Сохранить как PDF
 Фосфолглицериды представляют собой сложные эфиры только двух жирных кислот, фосфорной кислоты и трехфункционального спирта – глицерина (название ИЮПАК – 1,2,3-пропантриол). Жирные кислоты присоединены к глицерину в положениях 1 и 2 глицерина посредством сложноэфирных связей. В составе фосфолипидов могут быть различные жирные кислоты, как насыщенные, так и ненасыщенные.
Фосфолглицериды представляют собой сложные эфиры только двух жирных кислот, фосфорной кислоты и трехфункционального спирта – глицерина (название ИЮПАК – 1,2,3-пропантриол). Жирные кислоты присоединены к глицерину в положениях 1 и 2 глицерина посредством сложноэфирных связей. В составе фосфолипидов могут быть различные жирные кислоты, как насыщенные, так и ненасыщенные.Введение
Третий кислород на глицерине связан с фосфорной кислотой посредством связи эфира фосфорной кислоты (кислород двойной связи кислород-фосфор). Кроме того, обычно имеется сложный аминоспирт, также присоединенный к фосфату через вторую фосфатно-эфирную связь. Сложные аминоспирты включают холин, этаноламин и аминокислоту-серин. Свойства фосфолипида характеризуются свойствами цепи жирной кислоты и фосфата/аминоспирта. Длинные углеводородные цепи жирных кислот, конечно, неполярны. Фосфатная группа имеет отрицательно заряженный кислород и положительно заряженный азот, что делает эту группу ионной. Кроме того, есть другие кислородные группы сложного эфира, которые делают весь конец молекулы сильно ионным и полярным.
Кроме того, есть другие кислородные группы сложного эфира, которые делают весь конец молекулы сильно ионным и полярным.
Фосфолипиды являются основными компонентами липидных бислоев клеточных мембран. Есть два общих фосфолипида:
- Лецитин содержит аминоспирт, холин.
- Цефалины содержат аминоспирты серин или этаноламин
Лецитин
Лецитин, вероятно, является наиболее распространенным фосфолипидом. Он содержится в яичных желтках, зародышах пшеницы и соевых бобах. Лецитин извлекают из соевых бобов для использования в качестве эмульгатора в пищевых продуктах. Лецитин является эмульгатором, поскольку он обладает как полярными, так и неполярными свойствами, что позволяет ему вызывать смешивание других жиров и масел с водными компонентами. См. больше обсуждения этого свойства в мылах. Лецитин также является основным компонентом липидных бислоев клеточных мембран.
Лецитин содержит аммониевую соль холина, соединенную с фосфатом сложноэфирной связью. Азот имеет положительный заряд, как и ион аммония. В холине азот имеет положительный заряд и к нему присоединены четыре метильные группы.
Азот имеет положительный заряд, как и ион аммония. В холине азот имеет положительный заряд и к нему присоединены четыре метильные группы.
Цефалины
Цефалины представляют собой фосфоглицериды, которые содержат этаноламин или аминокислоту серин, присоединенную к фосфатной группе через фосфатно-эфирные связи. Остальную часть молекулы составляют различные жирные кислоты. Цефалины обнаружены в большинстве клеточных мембран, особенно в тканях головного мозга. Они также играют важную роль в процессе свертывания крови, так как находятся в тромбоцитах.
Примечание. Окраска MEP электростатического потенциала не показывает сильного красного цвета для фосфатно-аминоспиртовой части молекулы, как это должно отражать сильное полярное свойство этой группы.
- Последнее обновление
- 23:53, 2 мар 2017
 Главной особенностью стероидов является кольцевая система из трех циклогексанов и одного циклопентана в конденсированной кольцевой системе, как показано ниже. Существует множество функциональных групп, которые могут быть присоединены. Главной особенностью, как и всех липидов, является большое количество атомов углерода-водорода, которые делают стероиды неполярными.
Главной особенностью стероидов является кольцевая система из трех циклогексанов и одного циклопентана в конденсированной кольцевой системе, как показано ниже. Существует множество функциональных групп, которые могут быть присоединены. Главной особенностью, как и всех липидов, является большое количество атомов углерода-водорода, которые делают стероиды неполярными.Введение
Стероиды включают такие хорошо известные соединения, как холестерин, половые гормоны, противозачаточные таблетки, кортизон и анаболические стероиды.
Холестерин
Наиболее известным и наиболее распространенным стероидом в организме является холестерин. Холестерин образуется в тканях головного мозга, нервной ткани и кровотоке. Это основное соединение, обнаруженное в желчных камнях и желчных солях. Холестерин также способствует образованию отложений на внутренних стенках сосудов. Эти отложения затвердевают и препятствуют току крови. Это состояние, известное как атеросклероз, приводит к различным сердечным заболеваниям, инсультам и высокому кровяному давлению.
В настоящее время проводится множество исследований, чтобы определить, существует ли корреляция между уровнем холестерина в крови и диетой. Холестерин не только поступает с пищей, но и синтезируется в организме из углеводов и белков, а также жиров. Следовательно, исключение из рациона продуктов, богатых холестерином, не обязательно снижает уровень холестерина в крови. Некоторые исследования показали, что если определенные ненасыщенные жиры и масла заменить насыщенными жирами, уровень холестерина в крови снижается. Исследования по этой проблеме неполные.
Структуры половых гормонов
Половые гормоны также являются стероидами. Основной мужской гормон тестостерон отвечает за развитие вторичных половых признаков. Два женских половых гормона, прогестерон и эстроген или эстрадиол, контролируют цикл овуляции. Обратите внимание, что мужские и женские гормоны имеют лишь незначительные различия в структуре, но при этом имеют очень разные физиологические эффекты.
Тестостерон способствует нормальному развитию мужских половых органов и синтезируется из холестерина в яичках. Он также способствует развитию вторичных мужских половых признаков, таких как низкий голос, волосы на лице и теле.
Эстроген вместе с прогестероном регулирует изменения, происходящие в матке и яичниках, известные как менструальный цикл. Для получения более подробной информации см. Контроль над рождаемостью. Эстроген синтезируется из тестостерона путем превращения первого кольца в ароматическое, что приводит к образованию двойных связей молей, потере метильной группы и образованию спиртовой группы.
Адренокортикоидные гормоны
Адренокортикоидные гормоны являются продуктами надпочечников («надпочечники» означает и от 9 до почечный (почечный). Наиболее важным минералокритикоидом является альдостерон , который регулирует реабсорбцию ионов натрия и хлора в почечных канальцах и увеличивает потерю ионов калия. Альдостерон секретируется, когда уровень ионов натрия в крови слишком низок, чтобы заставить почки удерживать ионы натрия. Если уровень натрия повышен, альдостерон не секретируется, поэтому некоторое количество натрия теряется с мочой. Альдостерон также контролирует отек тканей.
Альдостерон секретируется, когда уровень ионов натрия в крови слишком низок, чтобы заставить почки удерживать ионы натрия. Если уровень натрия повышен, альдостерон не секретируется, поэтому некоторое количество натрия теряется с мочой. Альдостерон также контролирует отек тканей.
Кортизол, самый важный глюкокортиноид, имеет функцию повышения концентрации глюкозы и гликогена в организме. Эти реакции завершаются в печени путем извлечения жирных кислот из клеток-хранилищ липидов и аминокислот из белков организма с образованием глюкозы и гликогена.
Кроме того, кортизол и его кетоновое производное, кортизон , обладают способностью к воспалительному действию. Кортизон или аналогичные синтетические производные, такие как преднизолон, используются для лечения воспалительных заболеваний, ревматоидного артрита и бронхиальной астмы. Существует много побочных эффектов при использовании препаратов кортизона, поэтому их использование необходимо тщательно контролировать.
Цели обучения
К концу этого раздела вы сможете:
- Опишите, каким образом углерод имеет решающее значение для жизни
- Объясните влияние незначительных изменений аминокислот на организмы
- Опишите четыре основных типа биологических молекул
- Понимать функции четырех основных типов молекул
Большие молекулы, необходимые для жизни, построенные из более мелких органических молекул, называются биологическими макромолекул . Существует четыре основных класса биологических макромолекул (углеводы, липиды, белки и нуклеиновые кислоты), каждый из которых является важным компонентом клетки и выполняет широкий спектр функций. В совокупности эти молекулы составляют большую часть массы клетки. Биологические макромолекулы являются органическими, а это означает, что они содержат углерод. Кроме того, они могут содержать водород, кислород, азот, фосфор, серу и дополнительные микроэлементы.
Часто говорят, что жизнь основана на углероде. Это означает, что атомы углерода, связанные с другими атомами углерода или другими элементами, образуют фундаментальные компоненты многих, если не большинства, молекул, встречающихся только в живых существах. Другие элементы играют важную роль в биологических молекулах, но углерод определенно считается «основным» элементом для молекул живых существ. Именно связывающие свойства атомов углерода ответственны за его важную роль.
Углерод содержит четыре электрона на внешней оболочке. Следовательно, он может образовывать четыре ковалентные связи с другими атомами или молекулами. Простейшей органической молекулой углерода является метан (CH 4 ), в котором четыре атома водорода связаны с атомом углерода.
Рис. 2.12. Углерод может образовывать четыре ковалентные связи, образуя органическую молекулу. Простейшей молекулой углерода является метан (Ch5), изображенный здесь. Однако более сложные конструкции изготавливаются из углерода. Любой из атомов водорода может быть заменен другим атомом углерода, ковалентно связанным с первым атомом углерода. Таким образом можно получить длинные и разветвленные цепи углеродных соединений (рис. 2.13.9).0013 и ). Атомы углерода могут связываться с атомами других элементов, таких как азот, кислород и фосфор (рис. 2.13 b ). Молекулы также могут образовывать кольца, которые сами могут соединяться с другими кольцами (рис. 2.13 c ). Это разнообразие молекулярных форм объясняет разнообразие функций биологических макромолекул и в значительной степени основано на способности углерода образовывать множественные связи с самим собой и другими атомами.
Любой из атомов водорода может быть заменен другим атомом углерода, ковалентно связанным с первым атомом углерода. Таким образом можно получить длинные и разветвленные цепи углеродных соединений (рис. 2.13.9).0013 и ). Атомы углерода могут связываться с атомами других элементов, таких как азот, кислород и фосфор (рис. 2.13 b ). Молекулы также могут образовывать кольца, которые сами могут соединяться с другими кольцами (рис. 2.13 c ). Это разнообразие молекулярных форм объясняет разнообразие функций биологических макромолекул и в значительной степени основано на способности углерода образовывать множественные связи с самим собой и другими атомами.
 (c) Глюкоза, сахар, имеет кольцо из атомов углерода и один атом кислорода.
(c) Глюкоза, сахар, имеет кольцо из атомов углерода и один атом кислорода.Углеводы представляют собой макромолекулы, с которыми большинство потребителей знакомы. Чтобы похудеть, некоторые люди придерживаются «низкоуглеводной» диеты. Спортсмены, напротив, часто «загружаются углеводами» перед важными соревнованиями, чтобы убедиться, что у них достаточно энергии для соревнований на высоком уровне. Углеводы, по сути, являются неотъемлемой частью нашего рациона; злаки, фрукты и овощи являются естественными источниками углеводов. Углеводы обеспечивают организм энергией, в частности, через глюкозу, простой сахар. Углеводы также выполняют другие важные функции в организме человека, животных и растений.
Углеводы можно представить формулой (CH 2 O) n , где n — число атомов углерода в молекуле. Другими словами, отношение углерода к водороду и кислороду составляет 1:2:1 в молекулах углеводов. Углеводы делятся на три подтипа: моносахариды, дисахариды и полисахариды.
Моносахариды (моно- = «один»; сахар- = «сладкий») представляют собой простые сахара, наиболее распространенным из которых является глюкоза. В моносахаридах число атомов углерода обычно колеблется от трех до шести. Большинство названий моносахаридов заканчиваются суффиксом -ose. В зависимости от количества атомов углерода в сахаре они могут быть известны как триозы (три атома углерода), пентозы (пять атомов углерода) и гексозы (шесть атомов углерода).
Моносахариды могут существовать в виде линейных цепочек или кольцеобразных молекул; в водных растворах они обычно находятся в кольцевой форме.
Химическая формула глюкозы C 6 H 12 O 6 . У большинства живых организмов глюкоза является важным источником энергии. Во время клеточного дыхания энергия высвобождается из глюкозы, и эта энергия используется для производства аденозинтрифосфата (АТФ). Растения синтезируют глюкозу, используя углекислый газ и воду в процессе фотосинтеза, а глюкоза, в свою очередь, используется для энергетических потребностей растения. Избыток синтезированной глюкозы часто откладывается в виде крахмала, который расщепляется другими организмами, питающимися растениями.
Избыток синтезированной глюкозы часто откладывается в виде крахмала, который расщепляется другими организмами, питающимися растениями.
Галактоза (часть лактозы или молочного сахара) и фруктоза (содержится во фруктах) являются другими распространенными моносахаридами. Хотя глюкоза, галактоза и фруктоза имеют одинаковую химическую формулу (C 6 H 12 O 6 ), они отличаются структурно и химически (и известны как изомеры) из-за различного расположения атомов в углеродной цепи. .
Рисунок 2.14. Глюкоза, галактоза и фруктоза являются изомерными моносахаридами, что означает, что они имеют одинаковую химическую формулу, но немного различаются по структуре. Дисахариды (ди- = «два») образуются, когда два моносахарида подвергаются реакции дегидратации (реакция, при которой происходит удаление молекулы воды). В ходе этого процесса гидроксильная группа (-OH) одного моносахарида соединяется с атомом водорода другого моносахарида, высвобождая молекулу воды (H 2 O) и образуя ковалентную связь между атомами в двух молекулах сахара.
Общие дисахариды включают лактозу, мальтозу и сахарозу. Лактоза – это дисахарид, состоящий из мономеров глюкозы и галактозы. В природе содержится в молоке. Мальтоза, или солодовый сахар, представляет собой дисахарид, образующийся в результате реакции дегидратации между двумя молекулами глюкозы. Наиболее распространенным дисахаридом является сахароза или столовый сахар, который состоит из мономеров глюкозы и фруктозы.
Длинная цепь моносахаридов, связанных ковалентными связями, известна как полисахарид (поли- = «много»). Цепь может быть разветвленной или неразветвленной, и она может содержать различные типы моносахаридов. Полисахариды могут быть очень большими молекулами. Крахмал, гликоген, целлюлоза и хитин являются примерами полисахаридов.
Крахмал представляет собой запасенную форму сахаров в растениях и состоит из амилозы и амилопектина (оба полимеры глюкозы). Растения способны синтезировать глюкозу, а избыток глюкозы откладывается в виде крахмала в различных частях растения, включая корни и семена. Крахмал, потребляемый животными, расщепляется на более мелкие молекулы, такие как глюкоза. Затем клетки могут поглощать глюкозу.
Крахмал, потребляемый животными, расщепляется на более мелкие молекулы, такие как глюкоза. Затем клетки могут поглощать глюкозу.
Гликоген представляет собой запасную форму глюкозы у людей и других позвоночных и состоит из мономеров глюкозы. Гликоген является животным эквивалентом крахмала и представляет собой сильно разветвленную молекулу, обычно хранящуюся в клетках печени и мышц. Всякий раз, когда уровень глюкозы снижается, гликоген расщепляется с выделением глюкозы.
Целлюлоза – один из самых распространенных природных биополимеров. Клеточные стенки растений в основном состоят из целлюлозы, которая обеспечивает структурную поддержку клетки. Древесина и бумага в основном целлюлозные по своей природе. Целлюлоза состоит из мономеров глюкозы, которые связаны связями между определенными атомами углерода в молекуле глюкозы.
Все остальные мономеры глюкозы в целлюлозе перевернуты и плотно упакованы в виде вытянутых длинных цепей. Это придает целлюлозе жесткость и высокую прочность на растяжение, что так важно для растительных клеток. Целлюлоза, проходящая через нашу пищеварительную систему, называется пищевыми волокнами. В то время как глюкозо-глюкозные связи в целлюлозе не могут быть разрушены пищеварительными ферментами человека, травоядные животные, такие как коровы, буйволы и лошади, способны переваривать траву, богатую целлюлозой, и использовать ее в качестве источника пищи. У этих животных некоторые виды бактерий обитают в рубце (часть пищеварительной системы травоядных) и выделяют фермент целлюлазу. Аппендикс также содержит бактерии, расщепляющие целлюлозу, что придает ей важную роль в пищеварительной системе жвачных животных. Целлюлазы могут расщеплять целлюлозу на мономеры глюкозы, которые могут использоваться животным в качестве источника энергии.
Это придает целлюлозе жесткость и высокую прочность на растяжение, что так важно для растительных клеток. Целлюлоза, проходящая через нашу пищеварительную систему, называется пищевыми волокнами. В то время как глюкозо-глюкозные связи в целлюлозе не могут быть разрушены пищеварительными ферментами человека, травоядные животные, такие как коровы, буйволы и лошади, способны переваривать траву, богатую целлюлозой, и использовать ее в качестве источника пищи. У этих животных некоторые виды бактерий обитают в рубце (часть пищеварительной системы травоядных) и выделяют фермент целлюлазу. Аппендикс также содержит бактерии, расщепляющие целлюлозу, что придает ей важную роль в пищеварительной системе жвачных животных. Целлюлазы могут расщеплять целлюлозу на мономеры глюкозы, которые могут использоваться животным в качестве источника энергии.
Углеводы выполняют другие функции у разных животных. Членистоногие, такие как насекомые, пауки и крабы, имеют внешний скелет, называемый экзоскелетом, который защищает их внутренние части тела. Этот экзоскелет состоит из биологической макромолекулы хитина , азотсодержащего углевода. Он состоит из повторяющихся звеньев модифицированного сахара, содержащего азот.
Этот экзоскелет состоит из биологической макромолекулы хитина , азотсодержащего углевода. Он состоит из повторяющихся звеньев модифицированного сахара, содержащего азот.
Таким образом, благодаря различиям в молекулярной структуре углеводы могут выполнять очень разные функции накопления энергии (крахмал и гликоген) и структурной поддержки и защиты (целлюлоза и хитин).
Рис. 2.15. Хотя их структура и функции различны, все полисахаридные углеводы состоят из моносахаридов и имеют химическую формулу (Ch3O)n. Зарегистрированный диетолог: ожирение является проблемой для здоровья во всем мире, и многие заболевания, такие как диабет и болезни сердца, становятся все более распространенными из-за ожирения. Это одна из причин, почему все чаще обращаются за советом к зарегистрированным диетологам. Зарегистрированные диетологи помогают планировать продукты питания и программы питания для людей в различных условиях. Они часто работают с пациентами в медицинских учреждениях, разрабатывая планы питания для профилактики и лечения заболеваний. Например, диетологи могут научить пациента с диабетом, как управлять уровнем сахара в крови, употребляя углеводы правильного типа и количества. Диетологи также могут работать в домах престарелых, школах и частных практиках.
Например, диетологи могут научить пациента с диабетом, как управлять уровнем сахара в крови, употребляя углеводы правильного типа и количества. Диетологи также могут работать в домах престарелых, школах и частных практиках.
Чтобы стать зарегистрированным диетологом, необходимо получить как минимум степень бакалавра в области диетологии, питания, пищевых технологий или в смежных областях. Кроме того, зарегистрированные диетологи должны пройти стажировку под наблюдением и сдать национальный экзамен. Те, кто занимается диетологией, проходят курсы по питанию, химии, биохимии, биологии, микробиологии и физиологии человека. Диетологи должны стать экспертами в области химии и функций пищи (белков, углеводов и жиров).
Липиды включают разнообразную группу соединений, объединенных общим признаком. Липиды гидрофобны («водобоязненные») или нерастворимы в воде, поскольку являются неполярными молекулами. Это потому, что они представляют собой углеводороды, которые включают только неполярные связи углерод-углерод или углерод-водород. Липиды выполняют множество различных функций в клетке. Клетки хранят энергию для длительного использования в виде липидов, называемых жирами . Липиды также обеспечивают изоляцию растений и животных от окружающей среды. Например, они помогают держать водоплавающих птиц и млекопитающих сухими из-за их водоотталкивающей природы. Липиды также являются строительными блоками многих гормонов и важным компонентом плазматической мембраны. Липиды включают жиры, масла, воски, фосфолипиды и стероиды.
Липиды выполняют множество различных функций в клетке. Клетки хранят энергию для длительного использования в виде липидов, называемых жирами . Липиды также обеспечивают изоляцию растений и животных от окружающей среды. Например, они помогают держать водоплавающих птиц и млекопитающих сухими из-за их водоотталкивающей природы. Липиды также являются строительными блоками многих гормонов и важным компонентом плазматической мембраны. Липиды включают жиры, масла, воски, фосфолипиды и стероиды.
Молекула жира, такая как триглицерид, состоит из двух основных компонентов — глицерина и жирных кислот. Глицерин представляет собой органическое соединение с тремя атомами углерода, пятью атомами водорода и тремя гидроксильными (-ОН) группами. Жирные кислоты имеют длинную цепь углеводородов, к которой присоединена кислая карбоксильная группа, отсюда и название «жирная кислота». Число атомов углерода в жирной кислоте может составлять от 4 до 36; наиболее распространены те, которые содержат 12–18 атомов углерода. В молекуле жира жирная кислота присоединена ковалентной связью к каждому из трех атомов кислорода в группах –ОН молекулы глицерина.
Число атомов углерода в жирной кислоте может составлять от 4 до 36; наиболее распространены те, которые содержат 12–18 атомов углерода. В молекуле жира жирная кислота присоединена ковалентной связью к каждому из трех атомов кислорода в группах –ОН молекулы глицерина.
Во время образования этой ковалентной связи высвобождаются три молекулы воды. Три жирные кислоты в жире могут быть похожими или разными. Эти жиры также называют триглицеридами , потому что они содержат три жирные кислоты. Некоторые жирные кислоты имеют общие названия, указывающие на их происхождение. Например, пальмитиновую кислоту, насыщенную жирную кислоту, получают из пальмы. Арахиновая кислота получается из Arachis hypogaea , научное название арахиса.
Жирные кислоты могут быть насыщенными или ненасыщенными. В цепи жирных кислот, если между соседними атомами углерода в углеводородной цепи имеются только одинарные связи, жирная кислота является насыщенной. Насыщенные жирные кислоты насыщены водородом; другими словами, число атомов водорода, присоединенных к углеродному скелету, максимально.
Насыщенные жирные кислоты насыщены водородом; другими словами, число атомов водорода, присоединенных к углеродному скелету, максимально.
Когда углеводородная цепь содержит двойную связь, жирная кислота представляет собой ненасыщенная жирная кислота .
Большинство ненасыщенных жиров являются жидкими при комнатной температуре и называются маслами . Если в молекуле есть одна двойная связь, то он известен как мононенасыщенный жир (например, оливковое масло), а если имеется более одной двойной связи, то он известен как полиненасыщенный жир (например, масло канолы).
Насыщенные жиры имеют тенденцию к плотной упаковке и остаются твердыми при комнатной температуре. Животные жиры со стеариновой и пальмитиновой кислотами, содержащиеся в мясе, и жиры с масляной кислотой, содержащиеся в сливочном масле, являются примерами насыщенных жиров. Млекопитающие хранят жиры в специализированных клетках, называемых адипоцитами, где шарики жира занимают большую часть клетки. У растений жир или масло хранится в семенах и используется в качестве источника энергии во время эмбрионального развития.
У растений жир или масло хранится в семенах и используется в качестве источника энергии во время эмбрионального развития.
Ненасыщенные жиры или масла обычно имеют растительное происхождение и содержат ненасыщенные жирные кислоты. Двойная связь вызывает изгиб или «перегиб», который препятствует плотной упаковке жирных кислот, сохраняя их жидкими при комнатной температуре. Оливковое масло, кукурузное масло, масло канолы и масло печени трески являются примерами ненасыщенных жиров. Ненасыщенные жиры помогают улучшить уровень холестерина в крови, тогда как насыщенные жиры способствуют образованию бляшек в артериях, что увеличивает риск сердечного приступа.
В пищевой промышленности масла искусственно гидрогенизируют, чтобы сделать их полутвердыми, что снижает их порчу и увеличивает срок хранения. Проще говоря, газообразный водород пропускают через масла, чтобы они затвердели. Во время этого процесса гидрирования двойные связи цис -конформации в углеводородной цепи могут быть преобразованы в двойные связи транс -конформации. Это образует транс--жир из цис--жир. Ориентация двойных связей влияет на химические свойства жира.
Это образует транс--жир из цис--жир. Ориентация двойных связей влияет на химические свойства жира.
Маргарин, некоторые виды арахисового масла и шортенинг являются примерами искусственно гидрогенизированных транс -жиров. Недавние исследования показали, что увеличение транс -жиров в рационе человека может привести к увеличению уровня липопротеинов низкой плотности (ЛПНП) или «плохого» холестерина, что, в свою очередь, может привести к отложению бляшек в артерии, что приводит к сердечно-сосудистым заболеваниям. Многие рестораны быстрого питания недавно отказались от использования транс -жиры, и теперь на этикетках пищевых продуктов в США требуется указывать содержание транс -жиров.
Незаменимые жирные кислоты — это жирные кислоты, которые необходимы, но не синтезируются человеческим организмом. Следовательно, они должны быть дополнены через диету. Омега-3 жирные кислоты попадают в эту категорию и являются одной из двух известных незаменимых жирных кислот для человека (другой является омега-6 жирная кислота). Они представляют собой тип полиненасыщенных жиров и называются омега-3 жирными кислотами, потому что третий углерод с конца жирной кислоты участвует в двойной связи.
Следовательно, они должны быть дополнены через диету. Омега-3 жирные кислоты попадают в эту категорию и являются одной из двух известных незаменимых жирных кислот для человека (другой является омега-6 жирная кислота). Они представляют собой тип полиненасыщенных жиров и называются омега-3 жирными кислотами, потому что третий углерод с конца жирной кислоты участвует в двойной связи.
Лосось, форель и тунец являются хорошими источниками омега-3 жирных кислот. Жирные кислоты омега-3 важны для работы мозга, нормального роста и развития. Они также могут предотвратить сердечные заболевания и снизить риск развития рака.
Как и углеводы, жиры получили много дурной славы. Это правда, что чрезмерное употребление жареной и другой «жирной» пищи приводит к увеличению веса. Однако жиры выполняют важные функции. Жиры служат долгосрочным хранилищем энергии. Они также обеспечивают теплоизоляцию тела. Поэтому «здоровые» ненасыщенные жиры в умеренных количествах следует употреблять на регулярной основе.
Фосфолипиды являются основным компонентом плазматической мембраны. Как и жиры, они состоят из цепочек жирных кислот, прикрепленных к глицерину или аналогичному остову. Однако вместо трех присоединенных жирных кислот имеются две жирные кислоты, а третий углерод основной цепи глицерина связан с фосфатной группой. Фосфатную группу модифицируют добавлением спирта.
Фосфолипид имеет как гидрофобные, так и гидрофильные участки. Цепи жирных кислот гидрофобны и исключают себя из воды, тогда как фосфаты гидрофильны и взаимодействуют с водой.
Клетки окружены мембраной, которая имеет двойной слой фосфолипидов. Жирные кислоты фосфолипидов обращены внутрь, от воды, тогда как фосфатная группа может быть обращена либо к внешней среде, либо внутрь клетки, которые оба являются водными.
Стероиды и воски
В отличие от фосфолипидов и жиров, обсуждавшихся ранее, стероиды имеют кольцевую структуру. Хотя они не похожи на другие липиды, их объединяют с ними, поскольку они также являются гидрофобными. Все стероиды имеют четыре связанных углеродных кольца, и некоторые из них, как и холестерин, имеют короткий хвост.
Все стероиды имеют четыре связанных углеродных кольца, и некоторые из них, как и холестерин, имеют короткий хвост.
Холестерин – это стероид. Холестерин в основном синтезируется в печени и является предшественником многих стероидных гормонов, таких как тестостерон и эстрадиол. Он также является предшественником витаминов Е и К. Холестерин является предшественником солей желчных кислот, которые способствуют расщеплению жиров и их последующему усвоению клетками. Хотя о холестерине часто говорят в негативном ключе, он необходим для правильного функционирования организма. Это ключевой компонент плазматических мембран клеток животных.
Воски состоят из углеводородной цепи со спиртовой (-ОН) группой и жирной кислоты. Примеры восков животного происхождения включают пчелиный воск и ланолин. У растений также есть воск, например, покрытие на листьях, которое помогает предотвратить их высыхание.
Концепция в действии
Чтобы получить дополнительную информацию о липидах, изучите «Биомолекулы: липиды» с помощью этой интерактивной анимации.
Белки являются одними из самых распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить при транспортировке, хранении или мембранах; или они могут быть токсинами или ферментами. Каждая клетка в живой системе может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структура, как и их функции, сильно различаются. Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности.
Функции белков очень разнообразны, потому что существует 20 различных химически различных аминокислот, которые образуют длинные цепи, и аминокислоты могут располагаться в любом порядке. Например, белки могут функционировать как ферменты или гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Ферменты могут разрушать молекулярные связи, перестраивать связи или образовывать новые связи. Примером фермента является слюнная амилаза, расщепляющая амилозу, компонент крахмала.
Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Ферменты могут разрушать молекулярные связи, перестраивать связи или образовывать новые связи. Примером фермента является слюнная амилаза, расщепляющая амилозу, компонент крахмала.
Гормоны представляют собой химические сигнальные молекулы, обычно белки или стероиды, секретируемые эндокринной железой или группой эндокринных клеток, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, обмен веществ и размножение. Например, инсулин — это белковый гормон, поддерживающий уровень глюкозы в крови.
Белки имеют различную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин представляет собой глобулярный белок, а коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок. Форма белка имеет решающее значение для его функции. Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции или денатурации (более подробно это будет обсуждаться позже). Все белки состоят из различных комбинаций одних и тех же 20 видов аминокислот.
Изменения температуры, рН и воздействие химических веществ могут привести к необратимым изменениям формы белка, что приведет к потере функции или денатурации (более подробно это будет обсуждаться позже). Все белки состоят из различных комбинаций одних и тех же 20 видов аминокислот.
Аминокислоты представляют собой мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, связанного с аминогруппой (-NH 2 ), карбоксильной группы (-COOH) и атома водорода. Каждая аминокислота также имеет другой вариабельный атом или группу атомов, связанных с центральным атомом углерода, известную как группа R. Группа R — единственное различие в структуре между 20 аминокислотами; в остальном аминокислоты идентичны.
Рис. 2.19. Аминокислоты состоят из центрального атома углерода, связанного с аминогруппой (–Nh3), карбоксильной группы (–СООН) и атома водорода. Четвертая связь центрального углерода варьируется в зависимости от аминокислот, как видно из этих примеров аланина, валина, лизина и аспарагиновой кислоты.
Химическая природа группы R определяет химическую природу аминокислоты в ее белке (то есть, является ли она кислой, основной, полярной или неполярной).
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка. Каждая аминокислота связана с другой аминокислотой ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа второй аминокислоты соединяются, высвобождая молекулу воды. Образующаяся связь является пептидной связью.
Продукты, образованные такой связью, называются полипептидами . Хотя термины «полипептид» и «белок» иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин «белок» используется для полипептида или полипептидов, которые объединены вместе, имеют четкую форму и выполняют уникальную функцию.
Эволюция в действии
Эволюционное значение цитохрома с Цитохром с является важным компонентом молекулярного механизма, который собирает энергию из глюкозы. Поскольку роль этого белка в производстве клеточной энергии имеет решающее значение, она очень мало изменилась за миллионы лет. Секвенирование белков показало, что между молекулами цитохрома с разных видов существует значительное сходство последовательностей; эволюционные отношения можно оценить, измерив сходства или различия между белковыми последовательностями разных видов.
Поскольку роль этого белка в производстве клеточной энергии имеет решающее значение, она очень мало изменилась за миллионы лет. Секвенирование белков показало, что между молекулами цитохрома с разных видов существует значительное сходство последовательностей; эволюционные отношения можно оценить, измерив сходства или различия между белковыми последовательностями разных видов.
Например, ученые определили, что цитохром с человека содержит 104 аминокислоты. Для каждой молекулы цитохрома с, которая была секвенирована на сегодняшний день из разных организмов, 37 из этих аминокислот появляются в одном и том же положении в каждом цитохроме с. Это указывает на то, что все эти организмы произошли от общего предка. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях обнаружено не было. При сравнении последовательностей человека и макаки-резус было обнаружено единственное различие в одной аминокислоте. Напротив, сравнение человека и дрожжей показывает разницу в 44 аминокислотах, что позволяет предположить, что люди и шимпанзе имеют более позднего общего предка, чем люди и макаки-резусы или люди и дрожжи.
Белковая структура
Как обсуждалось ранее, форма белка имеет решающее значение для его функции. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный , вторичный, третичный и четвертичный .
Уникальная последовательность и количество аминокислот в полипептидной цепи является ее первичной структурой. Уникальная последовательность для каждого белка в конечном итоге определяется геном, который кодирует белок. Любое изменение в последовательности гена может привести к добавлению другой аминокислоты к полипептидной цепи, вызывая изменение структуры и функции белка. При серповидноклеточной анемии β-цепь гемоглобина имеет единственную аминокислотную замену, вызывающую изменение как структуры, так и функции белка. Что наиболее примечательно, так это то, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот. Молекула, следовательно, имеет около 600 аминокислот. Структурное различие между молекулой нормального гемоглобина и молекулой серповидно-клеточной анемии, которое резко снижает продолжительность жизни у пораженных людей, заключается в одной аминокислоте из 600.
Молекула, следовательно, имеет около 600 аминокислот. Структурное различие между молекулой нормального гемоглобина и молекулой серповидно-клеточной анемии, которое резко снижает продолжительность жизни у пораженных людей, заключается в одной аминокислоте из 600.
Из-за этого изменения одной аминокислоты в цепи, обычно двояковогнутые или дискообразные эритроциты принимают серповидную или «серповидную» форму, которая закупоривает артерии. Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у тех, у кого есть это заболевание.
Паттерны укладки, возникающие в результате взаимодействий между частями аминокислот, не относящимися к R-группе, приводят к вторичной структуре белка. Наиболее распространены альфа-(α)-спиральные и бета-(β)-складчатые листовые структуры. Обе структуры удерживаются в форме водородными связями. В альфа-спирали связи образуются между каждой четвертой аминокислотой и вызывают поворот в аминокислотной цепи.
В β-складчатом листе «складки» образуются за счет водородных связей между атомами в основной цепи полипептида. Группы R присоединены к атомам углерода и простираются выше и ниже складок складки. Складчатые сегменты выстраиваются параллельно друг другу, а водородные связи образуются между одними и теми же парами атомов на каждой из выровненных аминокислот. Структуры α-спирали и β-складок обнаружены во многих глобулярных и волокнистых белках.
Уникальная трехмерная структура полипептида известна как его третичная структура. Эта структура обусловлена химическими взаимодействиями между различными аминокислотами и областями полипептида. Прежде всего, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Могут быть ионные связи, образованные между группами R на разных аминокислотах, или водородные связи помимо тех, которые участвуют во вторичной структуре. Когда происходит сворачивание белка, гидрофобные R-группы неполярных аминокислот располагаются внутри белка, тогда как гидрофильные R-группы располагаются снаружи. Первые типы взаимодействий также известны как гидрофобные взаимодействия.
Первые типы взаимодействий также известны как гидрофобные взаимодействия.
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, гемоглобин представляет собой комбинацию четырех полипептидных субъединиц.
Рисунок 2.20. На этих иллюстрациях можно наблюдать четыре уровня структуры белка. (кредит: модификация работы Национального исследовательского института генома человека) Каждый белок имеет свою уникальную последовательность и форму, скрепленные химическими взаимодействиями. Если белок подвергается изменениям температуры, pH или воздействию химических веществ, структура белка может измениться, потеряв свою форму, что известно как денатурация , как обсуждалось ранее. Денатурация часто бывает обратимой, поскольку первичная структура сохраняется при удалении денатурирующего агента, что позволяет белку возобновить свою функцию. Иногда денатурация необратима и приводит к потере функции. Один из примеров денатурации белка можно увидеть, когда жарят или варят яйцо. Белок альбумин в жидком яичном белке денатурирует при помещении на горячую сковороду, превращаясь из прозрачного вещества в непрозрачное белое вещество. Не все белки денатурируют при высоких температурах; например, бактерии, выживающие в горячих источниках, имеют белки, адаптированные для работы при таких температурах.
Иногда денатурация необратима и приводит к потере функции. Один из примеров денатурации белка можно увидеть, когда жарят или варят яйцо. Белок альбумин в жидком яичном белке денатурирует при помещении на горячую сковороду, превращаясь из прозрачного вещества в непрозрачное белое вещество. Не все белки денатурируют при высоких температурах; например, бактерии, выживающие в горячих источниках, имеют белки, адаптированные для работы при таких температурах.
Концепция в действии
Чтобы получить дополнительную информацию о белках, изучите «Биомолекулы: белки» с помощью этой интерактивной анимации.
Нуклеиновые кислоты являются ключевыми макромолекулами в непрерывности жизни. Они несут генетический план клетки и инструкции по ее функционированию.
Двумя основными типами нуклеиновых кислот являются дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК) . ДНК — это генетический материал, присутствующий во всех живых организмах, от одноклеточных бактерий до многоклеточных млекопитающих.
Другой тип нуклеиновой кислоты, РНК, в основном участвует в синтезе белка. Молекулы ДНК никогда не покидают ядро, а вместо этого используют РНК-посредника для связи с остальной частью клетки. Другие типы РНК также участвуют в синтезе белка и его регуляции.
ДНК и РНК состоят из мономеров, известных как нуклеотидов . Нуклеотиды объединяются друг с другом, образуя полинуклеотид, ДНК или РНК. Каждый нуклеотид состоит из трех компонентов: азотистого основания, пентозного (пятиуглеродного) сахара и фосфатной группы. Каждое азотистое основание в нуклеотиде связано с молекулой сахара, которая присоединена к фосфатной группе.
Рис. 2.21. Нуклеотид состоит из трех компонентов: азотистого основания, пентозного сахара и фосфатной группы.ДНК
имеет двойную спиральную структуру. Он состоит из двух нитей или полимеров нуклеотидов. Нити образованы связями между фосфатными и сахарными группами соседних нуклеотидов. Нити соединены друг с другом у основания водородными связями, а нити закручиваются друг вокруг друга по всей длине, отсюда и название «двойная спираль», что означает двойную спираль.
Чередующиеся сахарные и фосфатные группы располагаются снаружи каждой нити, образуя основу ДНК. Азотистые основания сложены внутри, как ступени лестницы, и эти основания спарены; пары связаны друг с другом водородными связями. Основания спариваются таким образом, что расстояние между остовами двух цепей одинаково на всем протяжении молекулы. Правило состоит в том, что нуклеотид А соединяется с нуклеотидом Т, а G с С, см. раздел 9..1 для более подробной информации.
Живые существа основаны на углероде, потому что углерод играет такую заметную роль в химии живых существ. Четыре положения ковалентной связи атома углерода могут привести к большому разнообразию соединений со многими функциями, что объясняет важность углерода в живых существах. Углеводы представляют собой группу макромолекул, которые являются жизненно важным источником энергии для клетки, обеспечивают структурную поддержку многих организмов и могут быть обнаружены на поверхности клетки в качестве рецепторов или для распознавания клетками. Углеводы классифицируются как моносахариды, дисахариды и полисахариды в зависимости от количества мономеров в молекуле.
Углеводы классифицируются как моносахариды, дисахариды и полисахариды в зависимости от количества мономеров в молекуле.
Липиды представляют собой класс макромолекул, неполярных и гидрофобных по своей природе. Основные типы включают жиры и масла, воски, фосфолипиды и стероиды. Жиры и масла представляют собой накопленную форму энергии и могут включать триглицериды. Жиры и масла обычно состоят из жирных кислот и глицерина.
Белки представляют собой класс макромолекул, которые могут выполнять разнообразные функции в клетке. Они помогают в обмене веществ, обеспечивая структурную поддержку и действуя как ферменты, носители или гормоны. Строительными блоками белков являются аминокислоты. Белки организованы на четырех уровнях: первичном, вторичном, третичном и четвертичном. Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменениями температуры, pH или химическим воздействием, может привести к денатурации белка и потере функции.
Нуклеиновые кислоты представляют собой молекулы, состоящие из повторяющихся единиц нуклеотидов, которые управляют клеточной активностью, такой как деление клеток и синтез белка. Каждый нуклеотид состоит из пентозного сахара, азотистого основания и фосфатной группы. Существует два типа нуклеиновых кислот: ДНК и РНК.
Каждый нуклеотид состоит из пентозного сахара, азотистого основания и фосфатной группы. Существует два типа нуклеиновых кислот: ДНК и РНК.
Глоссарий
аминокислота: мономер белка
углевод: биологическая макромолекула, в которой отношение углерода к водороду к кислороду составляет 1:2:1; углеводы служат источником энергии и структурной опорой в клетках
целлюлоза: полисахарид, из которого состоят клеточные стенки растений и обеспечивает структурную поддержку клетки стенки грибов
денатурация: потеря формы в белке в результате изменений температуры, pH или воздействия химических веществ
дезоксирибонуклеиновая кислота (ДНК): двухцепочечный полимер нуклеотидов, несущий наследственная информация клетки
дисахарид: два мономера сахара, соединенные пептидной связью кислоты и глицерин (триглицерид), который обычно существует в твердой форме при комнатной температуре
гликоген: запасной углевод у животных
гормон: химическая сигнальная молекула, обычно белок или стероид, секретируемый эндокринной железой или группу эндокринных клеток; действует, чтобы контролировать или регулировать определенные физиологические процессы
липиды: класс макромолекул, неполярных и нерастворимых в воде
макромолекула: большая молекула, часто образованная полимеризацией более мелких мономеров нуклеиновая кислота: биологическая макромолекула, несущая генетическую информацию клетки и несущая инструкции для функционирования клетки
нуклеотид: мономер нуклеиновой кислоты; содержит пентозный сахар, фосфатную группу и азотистое основание
масло: ненасыщенный жир, который является жидкостью при комнатной температуре
фосфолипид: основной компонент мембран клеток; состоит из двух жирных кислот и фосфатной группы, присоединенных к глицериновому остову
полипептид: длинная цепь аминокислот, связанных пептидными связями
полисахарид: длинная цепь моносахаридов; может быть разветвленным или неразветвленным
белок: биологическая макромолекула, состоящая из одной или нескольких цепей аминокислот
рибонуклеиновая кислота (РНК): одноцепочечный полимер нуклеотидов, участвующий в синтезе белка
насыщенная жирная кислота: а длинноцепочечный углеводород с одинарными ковалентными связями в углеродной цепи; максимальное количество атомов водорода, присоединенных к углеродному скелету
крахмал: запасной углевод в растениях
стероид: тип липидов, состоящий из четырех конденсированных углеводородных колец связь
триглицерид: молекула жира; состоит из трех жирных кислот, связанных с молекулой глицерина
ненасыщенная жирная кислота: углеводород с длинной цепью, имеющий одну или более двойных связей в углеводородной цепи
Каталожные номера:
- Молнар, К.
 и Гейр, Дж. (2012) 2.3 Глава «Биологические молекулы» в «Концепциях биологии», Учебники колледжей OpenStax, British Comumbia. Получено 22 декабря 2018 г. с: https://opentextbc.ca/biology/chapter/2-3-biological-molecules/ .
и Гейр, Дж. (2012) 2.3 Глава «Биологические молекулы» в «Концепциях биологии», Учебники колледжей OpenStax, British Comumbia. Получено 22 декабря 2018 г. с: https://opentextbc.ca/biology/chapter/2-3-biological-molecules/ .
Артикул
Ophardt, C. (2015) Углеводы. В Биологическая химия. Либретексты. Доступно по адресу: https://chem.libretexts.org/Core/Biological_Chemistry
.Гунавардена, Г. (2014) Проекции Хаворта. В Биологическая химия . Либретексты. Доступно по адресу: https://chem.libretexts.org/Core/Biological_Chemistry
.Снелл, Фостер Д. «Мыло и глицерин». J. Chem. Образовательный 1942 , 19 , 172.
OpenStax, Белки. OpenStax CNX. 30 сентября 2016 г. http://cnx.org/contents/bf17f4df-605c-4388-88c2-25b0f000b0ed@2.
OpenStax, Микробиология. Либретексты. 14 декабря 2015 г. Доступно по адресу: https://bio.libretexts.org/TextMaps/Map%3A_Microbiology_(OpenStax)
Эд Витц (Университет Куцтауна), Джон В. Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан. (2016) Образцы и тематические исследования. Либретексты. Доступно по адресу: https://chem.libretexts.org/Exemplars_and_Case_Studies/Exemplars/Culture/Secondary_Protein_Structure_in_Silk
Мур (UW-Мэдисон), Джастин Шорб (Колледж Хоуп), Ксавьер Прат-Ресина (Университет Миннесоты в Рочестере), Тим Вендорф и Адам Хан. (2016) Образцы и тематические исследования. Либретексты. Доступно по адресу: https://chem.libretexts.org/Exemplars_and_Case_Studies/Exemplars/Culture/Secondary_Protein_Structure_in_Silk
Салициловая кислота – использование, структура, свойства и способ получения
Салициловая кислота представляет собой неорганическое соединение, представляющее собой разновидность бета-гидроксикислоты (ВНА) и фенольной кислоты с химической формулой \[C_{7}H_{6} О_{3}\]. Салициловая кислота, также известная как орто-гидроксибензойная кислота, представляет собой кристаллическое твердое вещество белого цвета, которое используется для приготовления многих фармацевтических продуктов, и одним из ее основных продуктов является аспирин. Это свободная кислота, которая содержится в небольших количествах во многих растениях и в основном была выделена из коры ивы (Salix spp. ), откуда и получила свое название. Он считается растительным гормоном и внесен в список Закона о контроле за токсичными веществами Агентства по охране окружающей среды (TSCA).
), откуда и получила свое название. Он считается растительным гормоном и внесен в список Закона о контроле за токсичными веществами Агентства по охране окружающей среды (TSCA).
Метиловый эфир, который является основным компонентом масла грушанки, также широко встречается в природе. Итальянский химик по имени Раффаэле Пириа в 1838 году вывел салициловую кислоту из салицилового альдегида. Позднее немецкие химики Герман Кольбе и Эдуард Лаутеманн открыли синтетическую салициловую кислоту на основе фенола и двуокиси углерода. Сегодня это соединение в основном получают из феноксида динатрия, также известного как фенолят натрия, и диоксида углерода путем обработки его кислотой.
(Изображение будет обновлено в ближайшее время)
Салициловая кислота — это небольшая ароматическая кислота, химическое название которой — моногидроксибензойная кислота. Он липофилен по своей природе. Впервые он был получен из коры ивы. Он получил свое общее название из множества источников, связанных с ним с похожим названием, например, он получен как продукт метаболизма салицина (спиртовой β-гликозид, полученный из растений), а также является активным метаболитом, полученным из ацетилсалициловой кислоты. (аспирин). В природе встречается в виде прозрачных и бесцветных кристаллов органической кислоты. Солевые и эфирные производные этого соединения также широко используются в органической химии и известны как салицилаты. В растениях он встречается естественным образом как гормон роста.
(аспирин). В природе встречается в виде прозрачных и бесцветных кристаллов органической кислоты. Солевые и эфирные производные этого соединения также широко используются в органической химии и известны как салицилаты. В растениях он встречается естественным образом как гормон роста.
Структура салициловой кислоты
Ее структурная формула \[C_{6}H_{4}(OH)COOH,\], которая также может быть записана как \[C_{7}H_{6}O_{3}\ ] в сжатом виде. Его название IUPAC — 2-гидроксибензойная кислота. Он содержит гидроксильную группу (группу –OH), присоединенную в орто-положении по отношению к функциональной группе карбоновой кислоты (группа –COOH), присутствующей в бензольном кольце. Молекулярная масса (или молярная масса) салициловой кислоты составляет 138,12 г/моль. Различные формы, в которых может быть представлена молекулярная структура салициловой кислоты, приведены ниже: 9{-}\]) вступает в межмолекулярное взаимодействие с атомом водорода гидроксильной группы (–ОН), что приводит к образованию внутримолекулярной водородной связи.
Свойства салициловой кислоты
Физические свойства салициловой кислоты
Салициловая кислота существует в виде прозрачных или бесцветных и без запаха кристаллов иглы при комнатной температуре
. Вкус салицилальной кислоты-
. Вкус салицилальной кислоты-
. Вкус салицилальной кислоты-
. Вкус салицилальной кислоты. температура кипения и плавления салициловой кислоты 211 °С и 315 °С соответственно
Салициловая кислота содержит в своей молекуле два донора водородной связи и три акцептора водородной связи
Салициловая кислота растворима в органических растворителях, таких как четыреххлористый углерод, бензол, пропанол, этанол и ацетон
Плотность салициловой кислоты составляет 1,44 при 20 °C
Его давление пара составляет 8,2 x 10 -5 мм ртутного столба при 25 °C
Его LogP составляет 2,26
При разложении выделяет раздражающие пары и дым с едким запахом
Его теплота сгорания составляет 3,026 МДж/моль при 25 °C
pH насыщенного раствора салициловой кислоты равен
Его pKa (константа диссоциации) составляет 2,97
Химические свойства салициловой кислоты (реакции салициловой кислоты)
Образование аспирина.
 кислота является производством аспирина (ацетилсалициловой кислоты), одного из наиболее часто используемых анальгетиков и средств, разжижающих кровь. В этой реакции салициловая кислота реагирует с уксусным ангидридом в кислой среде, что приводит к ацетилированию гидроксильной группы, присутствующей в салициловой кислоте, что приводит к образованию ацетилсалициловой кислоты (аспирина). В качестве побочного продукта этой реакции образуется уксусная кислота, которая также присутствует в качестве одной из примесей при крупномасштабном производстве аспирина и должна быть удалена из полученной смеси продуктов с помощью нескольких процессов очистки.
кислота является производством аспирина (ацетилсалициловой кислоты), одного из наиболее часто используемых анальгетиков и средств, разжижающих кровь. В этой реакции салициловая кислота реагирует с уксусным ангидридом в кислой среде, что приводит к ацетилированию гидроксильной группы, присутствующей в салициловой кислоте, что приводит к образованию ацетилсалициловой кислоты (аспирина). В качестве побочного продукта этой реакции образуется уксусная кислота, которая также присутствует в качестве одной из примесей при крупномасштабном производстве аспирина и должна быть удалена из полученной смеси продуктов с помощью нескольких процессов очистки.
Реакция этерификации: Поскольку салициловая кислота является органической кислотой, она может вступать в реакцию с группами органических спиртов с образованием нового класса органических соединений, называемых сложными эфирами. При взаимодействии салициловой кислоты с метанолом в кислой среде (предпочтительно серной) в присутствии тепла происходит реакция дегидратации с потерей воды (ион –ОН — теряется из функциональной группы карбоновой кислоты, присутствующей в салициловой молекула кислоты и H 9ион 0031 + теряется при депротонировании молекулы метанола), что приводит к образованию метилсалицилата (сложного эфира).

Few of the Properties of Salicylic Acid is as Follows
Properties | Values | |||||||
Chemical formula | \[C_{7}H_{ 6}O_{3}\] | |||||||
Молярная масса | 9{3} (20 ° C) \]||||||||
Печата плавления | 158,6 ° C (317,5 ° F; 431,8 K) | |||||||
1,24 г/л (0 °C) 2,48 г/л (25 °C) 4,14 г/л (40 °C) 17,41 г/л (75 °C) 77,79 г/л (100 °C) | Растворим в эфире, CCL 4 , бензол, пропанол, ацетон, этанол, масло скинара, толуол | |||||||
растворимость в бензоле | 9. 0,775 г/100 г (25 °C) 0,991 г/100 г (30,5 °C) 2,38 г/100 г (49.4 °C) 4.4 g/100 g (64.2 °C) | |||||||
Solubility in chloroform | 2.22 g/100 mL (25 °C) 2.31 g/100 mL (30.5 ° C) | |||||||
Solubility in methanol | 40.67 g/100 g (−3 °C) 62.48 g/100 g (21 °C) | |||||||
Log P | 2,26 | |||||||
Давление пара | 10,93B MPA | |||||||
Кислотность (PK A ) | 2,97 (25 ° C) 13,82 (20 ° C) | 13,82 (20 ° C) | 13,82 (20 ° C) 9079. | 210 нм, 234 нм, 303 нм (4 мг /дл в этаноле) | ||||
|---|---|---|---|---|---|---|---|---|
Магнитная восприимчивость | −72. –72.23 · -6 –72.23 · -6 –72.23 · -6 –72.23 · -6 –72,23 · -6 1,565 (20 °C) | |||||||
Дипольный момент | 2,65 D | |||||||
Станд. энтальпия образования | −589,9 кДж/моль | |||||||
Станд. энтальпия сгорания | 3,025 МДж/моль |
Методы получения салициловой кислоты
Существует два наиболее распространенных метода получения салициловой кислоты. Эти методы обсуждаются ниже:
Из фенола: при взаимодействии фенола с гидроксидом натрия образуется феноксид натрия, который затем подвергают дистилляции и дегидратации.
 Далее следует реакция карбоксилирования углекислым газом, в результате которой образуется салицилат натрия (соль салициловой кислоты). Затем эту солевую форму вводят в реакцию с кислотой (или ионом гидроксония или любым соединением, обозначающим протон) с получением салициловой кислоты.
Далее следует реакция карбоксилирования углекислым газом, в результате которой образуется салицилат натрия (соль салициловой кислоты). Затем эту солевую форму вводят в реакцию с кислотой (или ионом гидроксония или любым соединением, обозначающим протон) с получением салициловой кислоты.
Из метилсалицилата: Метилсалицилат (масло грушанки) также является широко известным анальгетиком в фармацевтической промышленности. Его можно использовать для приготовления салициловой кислоты. В этой реакции метилсалицилат реагирует с гидроксидом натрия, что приводит к образованию промежуточного соединения натриевой соли салициловой кислоты, называемого динатриевым салицилатом, который при дальнейшей реакции с серной кислотой приводит к образованию салициловой кислоты.
Применение салициловой кислоты
Салициловая кислота находит множество применений, особенно в фармацевтической промышленности.
 Наиболее распространенное и известное применение салициловой кислоты – это приготовление анальгетика под названием аспирин, который представляет собой ацетилированное производное салициловой кислоты. Еще одним анальгетиком, образующимся из салициловой кислоты, является метилсалицилат (также широко известный как масло грушанки), этерифицированный продукт салициловой кислоты. Оба эти анальгетика широко используются для лечения головной боли и других болей в теле.
Наиболее распространенное и известное применение салициловой кислоты – это приготовление анальгетика под названием аспирин, который представляет собой ацетилированное производное салициловой кислоты. Еще одним анальгетиком, образующимся из салициловой кислоты, является метилсалицилат (также широко известный как масло грушанки), этерифицированный продукт салициловой кислоты. Оба эти анальгетика широко используются для лечения головной боли и других болей в теле.Салициловая кислота также используется как кератолитическое средство. Эти средства используются в виде масок для химического пилинга кожи для лечения различных типов кожных поражений и наростов из самого верхнего слоя кожи, называемого эпидермисом. Он используется в качестве наружного агента линьки кожи. Однако его следует использовать только по рекомендации дерматолога, так как у некоторых людей он может вызвать сильное раздражение кожи, приводящее к покраснению, зуду и кожной сыпи.

Салициловая кислота также находит применение при лечении акне и псориаза. Механизм, с помощью которого салициловая кислота используется при лечении этих состояний, заключается в том, что она ослабляет содержание кератина в коже, разрывая межмолекулярные связи между двумя молекулами кератина. Это приводит к размягчению рогового слоя кожи, вызывая снижение ее рН. При угревой сыпи он помогает открыть закупоренные поры и помогает удерживать больше влаги в коже, благодаря чему кожа становится лучше и здоровее.
Салициловая кислота используется для лечения бородавок. Механизм, с помощью которого он лечит инфекцию бородавок, очень похож на его кератолитическое действие. Он обезвоживает клетки кожи, пораженные бородавками, при нанесении на нее и тем самым постепенно приводит к ее отшелушиванию из организма. Кроме того, он также активировал иммунную реакцию организма на вирусную инфекцию бородавок, инициируя легкую воспалительную реакцию.
 Тем не менее, агентства здравоохранения не рекомендуют использовать препараты салициловой кислоты для лечения генитальных бородавок или бородавок, содержащих рост волос.
Тем не менее, агентства здравоохранения не рекомендуют использовать препараты салициловой кислоты для лечения генитальных бородавок или бородавок, содержащих рост волос.Салициловая кислота является одним из компонентов, используемых в шампунях против перхоти. Это связано с тем, что салициловая кислота предотвращает отложение кожного сала в порах кожи и вокруг волосяных фолликулов. Это помогает очистить кожу головы от мертвых и шелушащихся клеток, тем самым предотвращая появление перхоти.
Салициловая кислота также обладает легким антисептическим действием, так как является известным бактериостатическим средством. Он не убивает существующие бактерии (и, следовательно, не является антибактериальным средством), но предотвращает рост бактерий, где бы он ни применялся.
Салициловая кислота также помогает в удалении угрей и белых точек.
 Это делается салициловой кислотой по тем же механизмам, что и профилактика акне. Он не позволяет порам кожи забиваться, а те, которые уже забиты, можно открыть, нанеся салициловую кислоту на эту конкретную область. Поры кожи в основном забиваются, когда кератин соединяется с натуральным маслом, выделяемым нашей кожей, и откладывается в открытых фолликулах. Салициловая кислота, благодаря своим кератолитическим свойствам, помогает расщеплять кератин, тем самым ослабляя заблокированные фолликулы кожи, которые затем можно легко очистить водой. Однако не следует наносить слишком много салициловой кислоты на кожу, поскольку она может вызвать гиперпигментацию у людей с темным оттенком кожи.
Это делается салициловой кислотой по тем же механизмам, что и профилактика акне. Он не позволяет порам кожи забиваться, а те, которые уже забиты, можно открыть, нанеся салициловую кислоту на эту конкретную область. Поры кожи в основном забиваются, когда кератин соединяется с натуральным маслом, выделяемым нашей кожей, и откладывается в открытых фолликулах. Салициловая кислота, благодаря своим кератолитическим свойствам, помогает расщеплять кератин, тем самым ослабляя заблокированные фолликулы кожи, которые затем можно легко очистить водой. Однако не следует наносить слишком много салициловой кислоты на кожу, поскольку она может вызвать гиперпигментацию у людей с темным оттенком кожи.Салициловая кислота также используется для лечения некоторых инфекций стригущего лишая и влажной формы инфекции стопы (также известной как микоз стопы). Салициловая кислота также используется для лечения очень редкого генетического заболевания кожи, называемого ихтиозом, при котором кожа становится сухой, чешуйчатой и толстой.
 Один и тот же механизм действия (проявленный салициловой кислотой) кератолиза и отслоения кожи полезен при лечении всех этих состояний.
Один и тот же механизм действия (проявленный салициловой кислотой) кератолиза и отслоения кожи полезен при лечении всех этих состояний.
Детская книжная премия Джорджии — Педагогический колледж Мэри Фрэнсис
- Предстоящие события
- Поздравляем наших победителей 2022 года!
- Скачать финалисты книг 2023
- Запрос 2023 плакаты GCBA от BTSB
- Ресурсы преподавателей
- Прошлые победители
- Архив и другие ресурсы
- О награде
- и голосование
- .
Детская книжная премия Джорджии была учреждена в 1968 году Шелдоном Рутом, профессором факультета языкового образования Педагогического колледжа Университета Джорджии. Цель премии — привить детям Грузии любовь к чтению и познакомить их с произведениями литературного мастерства. Ежегодная награда присуждается в двух категориях: книжки с картинками и книги для среднего класса. В процессе отбора участвуют учителя, специалисты по средствам массовой информации школьных библиотек, публичные библиотеки и десятки тысяч молодых людей со всего штата.

Книжная премия также тесно связана с ежегодной конференцией Джорджии по детской литературе. . Есть вопрос? Свяжитесь с нами по электронной почте !
Предстоящие события
Запрос списка событий…
В настоящее время нет предстоящих событий.
Поздравляем наших победителей 2022 года!
Я тигрНаписано Карлом Ньюсоном
Проиллюстрировано Россом Коллинзом(книга с картинками, победитель классов K-4)
Когда звезды рассеяныНаписано Омаром Мохамедом
и Виктория Джеймисон(Книга, победитель 4-8 классов)
Загрузить финалистов Книги 2023
Книга (4-8 классы) Финалисты
Альбом с картинками (Класс K-4) Финалисты
Запросить плакаты 202 BA 202 BTSB(Пока есть в наличии.)
Отправить запросРесурсы для преподавателей
Ресурсы для иллюстрированных книг
Книжные ресурсы
Учебные материалы Библиотека Ресурсы
Встреча с комитетами
Победители прошлых лет0011GCBA Winners 1968-Present
2020-2021- Book Award:
They Called Us Enemy
by George Takei, Justin Eisinger, Steven Scott,
and Harmony Becker - Picturebook Award:
Hair Love
Мэтью А. Черри
Черри
и Вашти Харрисон
- Награда за книгу:
Сопротивление
Награда Дженнифер А. Нильсен6 Фото:
- 6 0013 Мы не едим наших одноклассников
от Райана Т. Хиггинс - Book Award:
- Награда книги:
A Dog Like Daisy
от Кристин О’Доннелл TUBB - 1513
. Не совсем narwhal
от Джесси Сима
- Book Award:
Projekt 1065
By Alan Gratz - Picture Book:
.0020
от Ben Clanton
- Book Award:
Fuzzy Mud
от Louis Sachar - Награда в сфере картинок:
Gaston
MAIPLY GASTON
MAIPLY GASTON 1414
. 2016- Книжная премия:
Сникер Магии
Натали Ллойд0006
- Book Award:
Michael Vey: The Fineing of Cell 25
Ричарда Пола Эванса - Премия с картинками:
OL ‘Clip-Clop: Again Story
на PATRIA. МакКиссак
МакКиссак
и Эрик Веласкес
- Книжная премия:
Чудо
Р.Дж. Palacio - Награда за книгу с картинками:
Сильви
Дженнифер Саттлер
- Book Award:
Hero
by Mike Lupica - Picturebook Award:
When a Dragon Moves In
by Jodi Moore
and Howard McWilliam
- Награда за книгу:
Голодные игры
Сюзанны Коллинз - Награда за книгу с картинками:
Мне нужен мой монстр
Аманда Нолл
и Говард МакУиллиам 0007
Архивы и другие ресурсы
История лидерства
Прошлые плакаты
Хелен Раффин Ридинг Боул
О наградах
Основана в 1968 году Шелдоном Рутом, профессором кафедры языкового образования Педагогического колледжа Университета Джорджия, цель вручения премии «Детская книга Джорджии» — привить детям Грузии любовь к чтению и познакомить их с произведениями литературного мастерства.

Награда присуждается в двух номинациях – книжки с картинками и романы для среднего класса. Книги номинированы на награды педагогами, специалистами в области СМИ и другими энтузиастами детской литературы из штата Джорджия. Окончательные списки из 20 номинантов выбираются комитетом, состоящим из учителей, школьных специалистов по СМИ и публичных библиотек (под председательством преподавателя Департамента языкового образования и грамотности).
В течение года учителям и специалистам по СМИ предлагается представить номинантов в привлекательной и осмысленной форме, прочитать книги вслух и разработать мероприятия, которые свяжут литературу с учебной программой. Студенты по всему штату будут голосовать за книги, которые, по их мнению, должны победить в отдельных категориях.
Книги, получившие наибольшее количество голосов от детей в классах K-4 (категория иллюстраций) и 4-8 (категория романов), становятся победителями. Авторы и иллюстраторы книг-победителей часто выступают спикерами на ежегодной конференции по детской литературе, проводимой в Центре непрерывного образования Джорджии в Афинах, штат Джорджия, которая проводится в марте.

- Книжная премия:

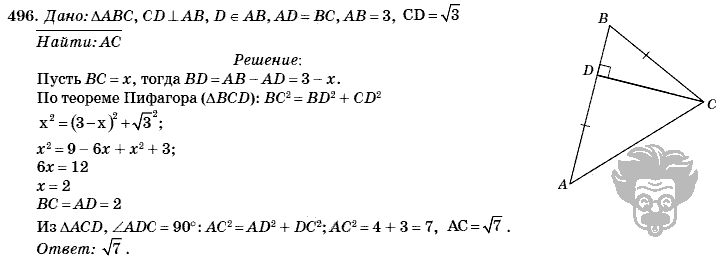 В. Погорелов
В. Погорелов И. Бурди
И. Бурди