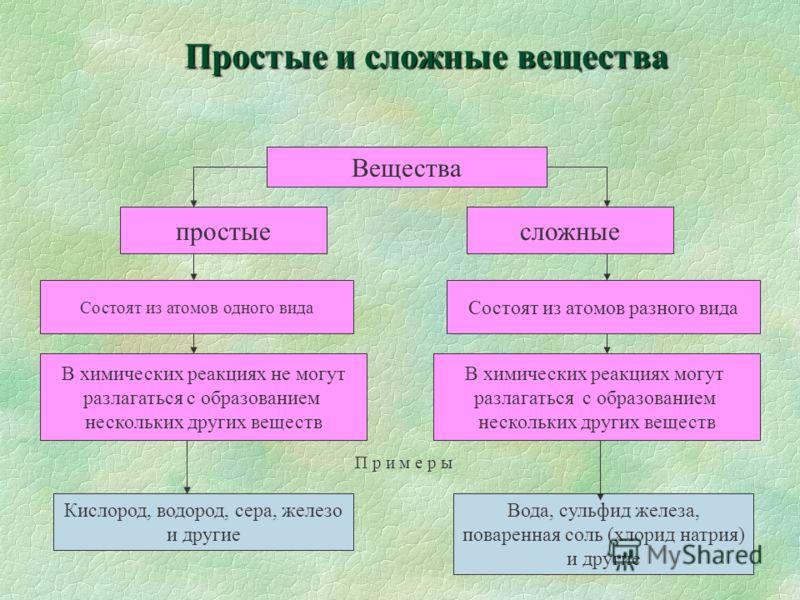
Простые и сложные вещества
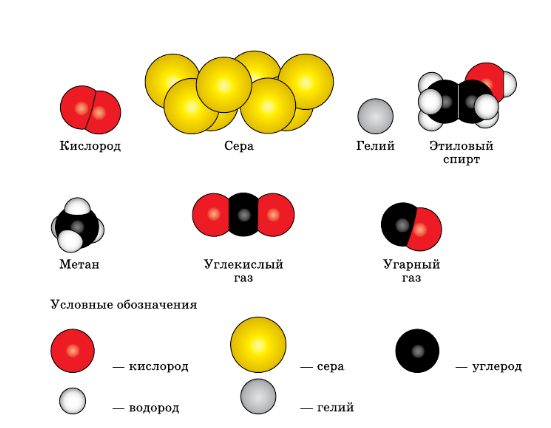
Простые вещества: молекулы состоят из атомов одного вида (атомов одного элемента).
Пример: h3, O2,Cl2, P4, Na, Cu, Au.
Сложные вещества (или химические соединения): молекулы состоят из атомов разного вида (атомов различных химических элементов).
Пример: h3O, Nh4, OF2, h3SO4, MgCl2, K2SO4.
Аллотропия — способность одного химического элемента образовывать несколько простых веществ, различающихся по строению и свойствам.
Пример:
- С — алмаз, графит, карбин, фуллерен.
- O — кислород, озон.
- S — ромбическая, моноклинная, пластическая.
- P — белый, красный, чёрный.
Явление аллотропии вызывается двумя причинами:
- Различным числом атомов в молекуле, например кислород O2 и озон O3.
- Образованием различных кристаллических форм, например алмаз, графит, карбин и фуллерен (смотри рисунок выше).

Основные классы неорганических веществ
Бинарные соединения
Вещества, состоящие из двух химических элементов называются бинарными (от лат. би – два) или двухэлементными.
Названия бинарных соединений образуют из двух слов – названий входящих в их состав химических элементов.
Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже.
Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название стоит в родительном падеже, затем указывается степень окисления (только в том случае, если она переменная):
Запомни!
Bh4 — боран
B2H6 — диборан
Ch5 — метан
Sih5 — силан
Nh4 — аммиак
Ph4 — фосфин
Ash4 — арсин
Оксиды
Оксиды — сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2.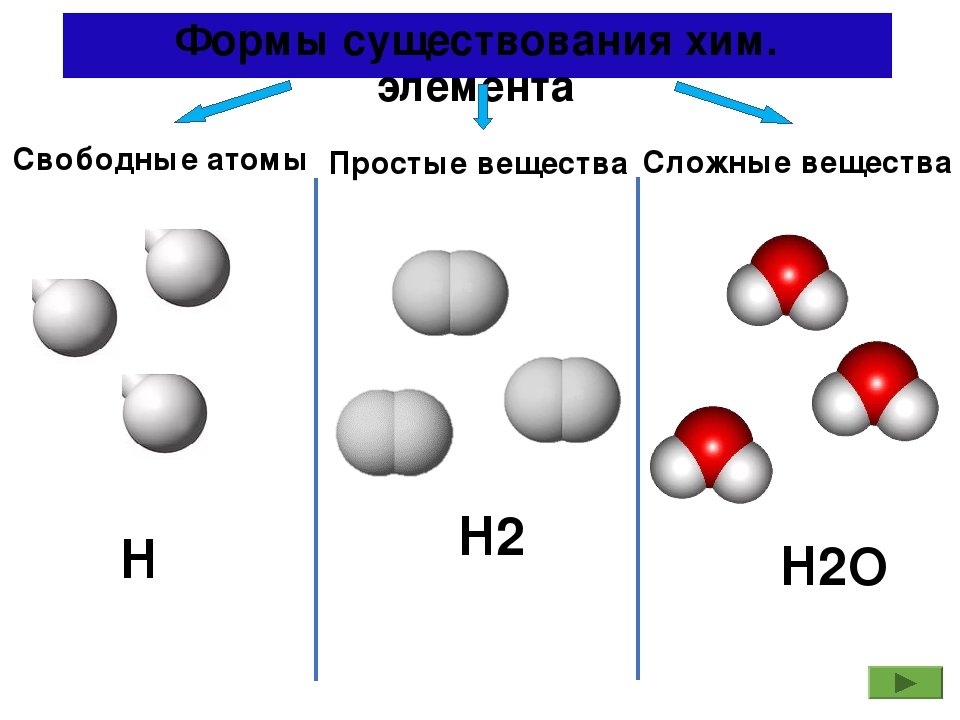
Общая формула оксидов: ЭхОу
Основные оксиды
Основные оксиды — оксиды, которым соответствуют основания.
Основные оксиды образованы металлом со степенью окисления +1, +2.
Пример
Соответствие основных оксидов и оснований
- Na2O — Na2(+1)O(-2) — NaOH
- MgO — Mg(+2)O(-2) — Mg(OH)2
- FeO — Fe(+2)O(-2) — Fe(OH)2
- MnO — Mn(+2)O(-2) — Mn(OH)2
Амфотерные оксиды
Амфотерные оксиды — оксиды, которые в зависимости от условий проявляют либо основные, либо кислотные свойства.
Амфотерные оксиды образованы металлом со степенью окисления +3, +4, а также некоторыми металлами (Zn, Be) со степенью окисления +2.
Пример
Al2(+3)O3(-2), Fe2(+3)O3(-2), Mn(+4)O2(-2), Zn(+2)O(-2), Be(+2)O(-2)
Кислотные оксиды
Кислотные оксиды — оксиды, которым соответствуют кислоты.
Кислотные оксиды образованы неметаллом, а также металлом со степенью окисления +5, +6, +7.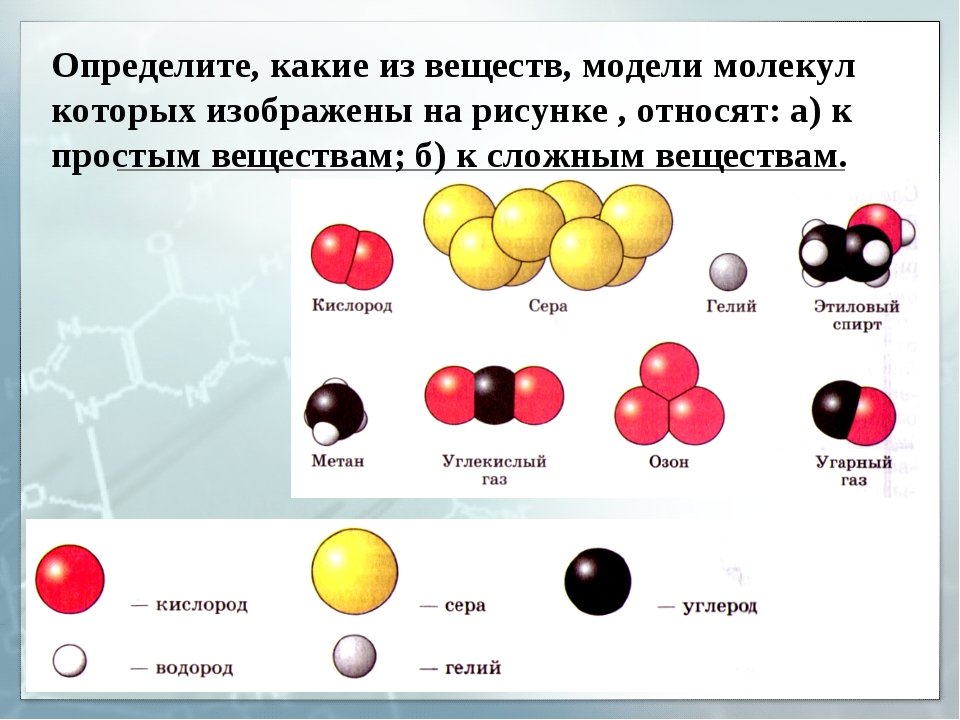
Пример
Соответствие кислотных оксидов и кислот
- SO3 — S(+6)O3(-2) — h3SO4
- N2O5 — N2(+5)O5(-2) — HNO3
- CrO3 — Cr(+6)O3(-2) — h3CrO4
- Mn2O7 — Mn2(+7)O7(-2) — HMnO4
Гидроксиды
Гидроксиды — сложные вещества, состоящие из трех элементов, два из которых водород со степенью окисления +1 и кислород со степенью окисления -2.
Общая формула гидроксидов: ЭхОуНz
Основания
Основания — сложные вещества, состоящие из ионов металла и одной или нескольких гидроксо-групп (ОН-).
В основаниях металл имеет степень окисления +1, +2 или вместо металла стоит ион аммония Nh5+
Пример
NaOH, Nh5OH, Ca(OH)2
Амфотерные гидроксиды
Амфотерные гидроксиды — сложные вещества, которые в зависимости от условий проявляют свойства оснований или кислот.
Амфотерные гидроксиды имеют металл со степенью окисления +3, +4, а также некоторые металлы (Zn, Be) со степенью окисления +2.
Пример
Zn(OH)2, Be(OH)2, Al(OH)3, Cr(OH)3
Кислоты
Кислоты — сложные вещества, состоящие из атомов водорода и кислотных остатков.
В состав кислот входит неметалл или металл со степенью окисления +5, +6, +7.
Пример
h3SO4, HNO3, h3Cr2O7, HMnO4
Соли
Соли- соединения, состоящие из катионов металлов (или Nh5+) и кислотных остатков.
Общая формула солей: MexAcy
- Me — металл
- Ac — кислотный остаток
Пример
KNO3 — нитрат калия
(Nh5)2SO4 — сульфат аммония
Mg(NO3)2 — нитрат магния
Названия кислот и кислотных остатков
| Кислота | Кислотный остаток | ||
| Название | Формула | Название | Формула |
| Соляная (хлороводородная) | HCl | Хлорид | Cl(-) |
| Плавиковая (фтороводородная) | HF | Фторид | F(-) |
| Бромоводородная | HBr | Бромид | Br(-) |
| Иодоводородная | HI | Иодид | I(-) |
| Азотистая | HNO2 | Нитрит | NO2(-) |
| Азотная | HNO3 | Нитрат | NO3(-) |
| Сероводородная | h3S | Сульфид Гидросульфид | S(2-) HS(-) |
| Сернистая | h3SO3 | Сульфит Гидросульфит | SO3(2-) HSO3(-) |
| Серная | h3SO4 | Сульфат Гидросульфат | SO4(2-) HSO4(-) |
| Угольная | h3CO3 | Карбонат Гидрокарбонат | СО3(2-) НСО3(-) |
| Кремниевая | h3SiO3 | Силикат | SiO3(2-) |
| Ортофосфорная | h4PO4 | Ортофосфат Гидроортофосфат Дигидроортофосфат | РО4(3-) НРО4(2-) Н2РО4(-) |
| Муравьиная | НСООН | Формиат | НСОО(-) |
| Уксусная | СН3СООН | Ацетат | СН3СОО(-) |
Полезные ссылки
Источник материала
Классификация неорганических веществ (видео)
Классификация неорганических веществ. Сложные вопросы (видео)
Сложные вопросы (видео)
Кислотные оксиды (видео)
Основные оксиды (видео)
Основания (видео)
Характеристика солей (видео)
Дополнительные материалы
Классификация и номенклатура неорганических веществ (видео)
Классификация соединений (видео)
Аллотропные формы углерода (видео)
Тест Простые и сложные вещества (8 класс) по химии
Последний раз тест пройден 5 часов назад.
Для учителя
Вопрос 1 из 10
Только сложные вещества перечислены в списке:
вода, железо, бронза
воздух, вода, сероводород
поваренная соль, сахар, сода
сода, азот, алмаз
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 2 из 10
Простое вещество – это вещество,
содержащее атомы разных химических элементов
содержащее атомы одного химического элемента
которое не содержит примеси
которое редко встречается в природе
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 3 из 10
Какие из приведенных признаков не характерны для сложных веществ:
состав соединения постоянен
состоит из атомов одного химического элемента
состоит из атомов нескольких химических элементов
состав можно изобразить одной химической формулой
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 4 из 10
Сложное вещество – это вещество,
которое содержит примеси
содержащее атомы разных химических элементов
содержащее атомы одного химического элемента
которое не встречается в природе
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 5 из 10
Только простые вещества перечислены в списке:
азот, алмаз, вода
железо, графит, водород
сахар, поваренная соль, вода
медь, спирт, водород
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 6 из 10
Три молекулы хлора можно обозначить так:
Cl3
3Cl
3Cl2O5
3Cl2
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 7 из 10
Молекула какого вещества содержит наименьшее число атомов?
CH4
HNO3
СО
О3
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 8 из 10
Какие из приведенных признаков не характерны для простых веществ:
состав можно изобразить одной химической формулой
состоит из атомов нескольких химических элементов
состоит из атомов одного химического элемента
состав соединения постоянен
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 9 из 10
В записи 4СО
2 коэффициент равен:2
6
4
8
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Вопрос 10 из 10
В записи 7С
4Н8 индексами являются:7
4, 8
7,4
7, 4, 8
Правильный ответ
Неправильный ответ
В вопросе ошибка?
Доска почёта
Чтобы попасть сюда — пройдите тест.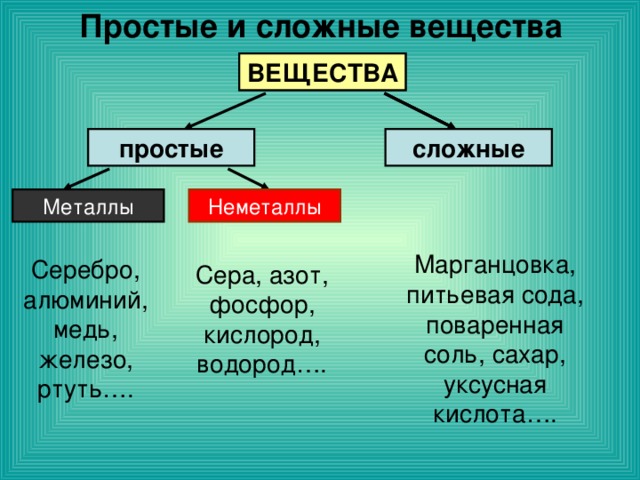
Елена Зуйкова
10/10
Саша Игнатьев
7/10
Елизавета Горбунова
9/10
Руслан Даутов
9/10
Kristina Grishina
9/10
Илья Шматков
9/10
Рейтинг теста
4.2
Средняя оценка: 4.2
Всего получено оценок: 887.
А какую оценку получите вы? Чтобы узнать — пройдите тест.
Элементы, соединения и смеси
Элементы, Соединения и смеси
| Элементы | Атомы | Соединения | Характеристики соединений |
| Определение Ионные Против. Ковалентный | Молекулы | Смеси по сравнению с Соединения | |
Элементы
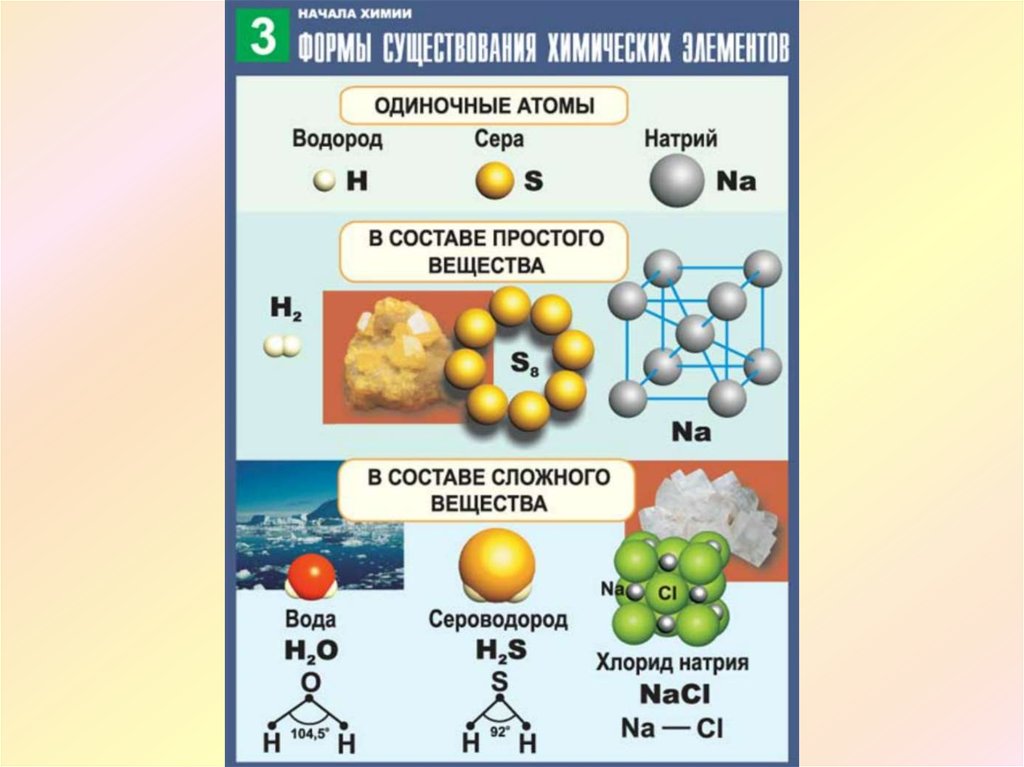
Известно любое вещество, содержащее атом только одного вида. как элемент . Поскольку атомы не могут быть созданы или
разрушаются в химической реакции такие элементы, как фосфор (P 4 )
или сера (S 8 ) не может быть разбита на более простые
веществ в результате этих реакций.
как элемент . Поскольку атомы не могут быть созданы или
разрушаются в химической реакции такие элементы, как фосфор (P 4 )
или сера (S 8 ) не может быть разбита на более простые
веществ в результате этих реакций.
Пример: вода разлагается на смесь водорода и кислорода при пропускании электрического тока через жидкость. Водород и кислород, с другой стороны, не могут быть разложены на более простые вещества. Следовательно, они являются элементарными или простейшие, химические вещества — элементы.
Каждый элемент представлен уникальным символом. Обозначение для каждого элемента можно найти в периодической таблице элементов.
Элементы можно разделить на три категории, которые имеют
характерные свойства: металлы, неметаллы и полуметаллы.
Большинство элементов — это металлы, которые находятся слева и ближе к
нижней части периодической таблицы. Горстка неметаллов
сгруппированы в правом верхнем углу таблицы Менделеева.
полуметаллы можно найти вдоль разделительной линии между
металлов и неметаллов.
Атомы
Элементы состоят из атомов, мельчайших частица, обладающая любым из свойств элемента.Джон Дальтон в 1803 году предложил современную теорию атома, основанную на следующие предположения.
1. Материя составлена неделимых и неразрушимых атомов. |
2. Все атомы элемента идентичный. |
3. Атомы различных элементов имеют разный вес и разные химические свойства. |
4. Атомы различных элементов соединяются в простые целые числа, образуя соединения. |
5. Атомы не могут быть созданы или
уничтожен. При разложении соединения атомы
восстановлен без изменений. |
| Перейти к атомам против. Ионы |
Соединения
Элементы объединяются в химические соединения, которые часто разделить на две категории.
Металлы часто реагируют с неметаллами с образованием ионных соединений . Эти соединения состоят из положительных и отрицательных ионов, образованных путем добавления или вычитания электронов из нейтральных атомов и молекулы.
Неметаллы соединяются друг с другом, образуя ковалентных соединения , существующие в виде нейтральных молекул.
Сокращенное обозначение соединения описывает количество
атомов каждого элемента, что обозначается нижним индексом, написанным
после символа элемента. По соглашению индекс не
пишется, когда молекула содержит только один атом элемента.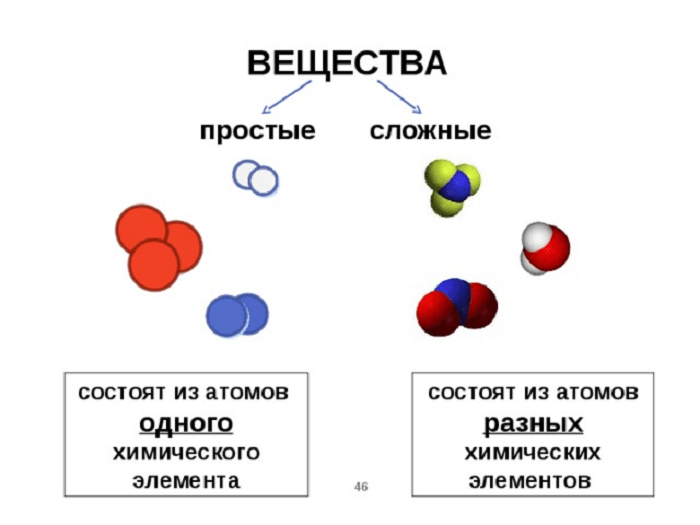 Таким образом, вода — это H 2 O, а углекислый газ — CO 2 .
Таким образом, вода — это H 2 O, а углекислый газ — CO 2 .
Характеристики Ионные и ковалентные соединения
Ионная Соединения | Ковалентные соединения | |
Содержит положительные и отрицательные ионы (Na + Cl — ) | Существовать как нейтральный молекулы (C 6 H 12 O 2 ) | |
Твердые вещества например, поваренная соль (NaCl (s) ) | Твердые вещества, жидкости или газы (C 6 H 12 O 6(s) , H 2 O (l) , СО 2(г) ) | |
Высокий температуры плавления и кипения | Нижняя плавка и
точки кипения (т. | |
Сильный сила притяжения между частицами | Относительно слабая сила притяжения между молекулами | |
Отдельный на заряженные частицы в воде, чтобы получить раствор, который проводит электричество | Оставаться той же молекулой в воде и не проводит электричество | |
Определение наличия Соединение является ионным или ковалентным
Рассчитайте разницу между электроотрицательностями
два элемента в соединении и среднее их
электроотрицательности, и найти пересечение этих значений на
рисунок, показанный ниже, поможет определить, является ли соединение ионным
или ковалентный, или металлический.
| Практическая задача 1: Для каждого из следующих соединений, предскажите, будете ли вы можно было бы ожидать, что он будет ионным или ковалентным. (а) оксид хрома(III), Cr 2 O 3 (b) четыреххлористый углерод, CCl 4 (c) метанол, CH 3 OH (d) фторид стронция, SrF 2 Нажмите здесь чтобы проверить свой ответ на практическое задание 1 |
| Практическая задача 2: Использование
следующие данные, чтобы предложить способ различения
между ионными и ковалентными соединениями.
Нажмите здесь, чтобы проверить свой ответ на практическое задание 2 |
| Практическая задача 3: Какой из следующих соединений должны проводить электрический ток ток при растворении в воде? (а) метанол, CH 3 OH (b) фторид стронция, SrF 2 Нажмите здесь чтобы проверить свой ответ на практическое задание 3 |
Формулы
свойства соединения.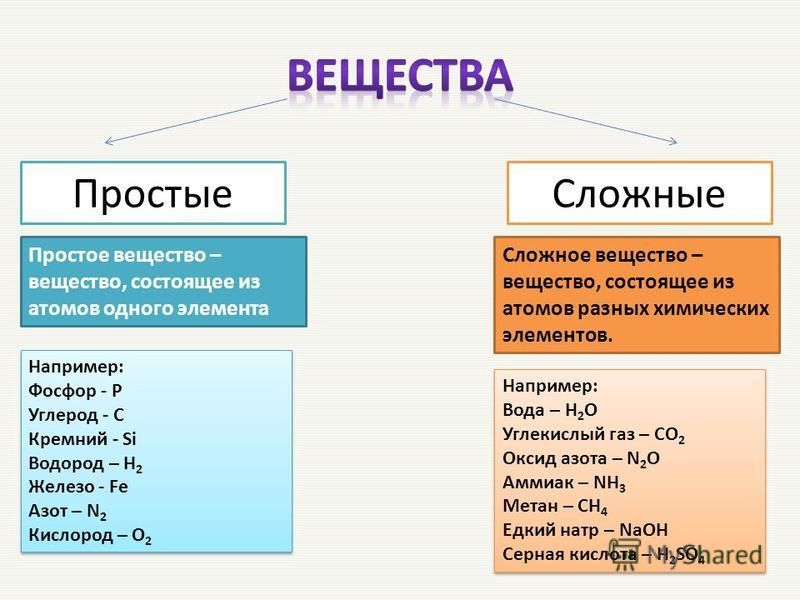 Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться числу отрицательных зарядов.
Формула молекулы должна быть
нейтральный. При написании формулы ионного соединения
заряды на ионах должны уравновешиваться, количество положительных зарядов
должно равняться числу отрицательных зарядов.
Примеры:
| CaCl 2 | Сбалансированная формула имеет 2 положительных заряда (1 кальций ион с зарядом +2) и 2 отрицательных заряда (2 хлорида ионы с зарядом -1) |
| Ал 2 (СО 4 ) 3 | Сбалансированная формула имеет 6 положительных зарядов (2 алюминиевых ионов с зарядом +3) и 6 отрицательных зарядов (3 сульфата ионы с зарядом -2) |
Смеси Против. Соединения
Закон постоянного состава гласит, что
соотношение по массе элементов в химическом соединении равно
всегда одинаковы, независимо от источника соединения.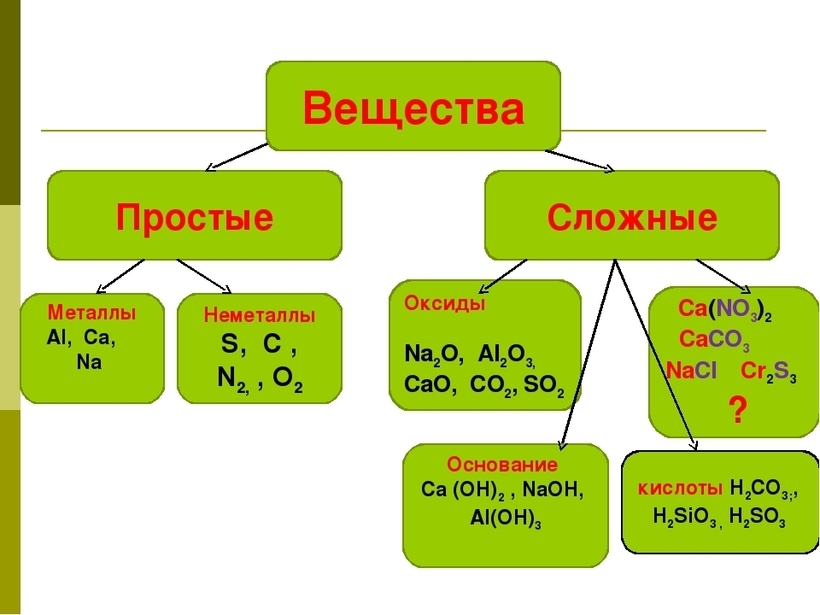 Закон постоянного состава можно использовать для различения
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по весу независимо от его источника. Латунь
пример смеси двух элементов: меди и цинка. Оно может
содержат всего 10% или целых 45% цинка.
Закон постоянного состава можно использовать для различения
соединения и смеси элементов: Соединения имеют
постоянный состав; смеси не . Вода всегда
88,8% O и 11,2% H по весу независимо от его источника. Латунь
пример смеси двух элементов: меди и цинка. Оно может
содержат всего 10% или целых 45% цинка.
Другое различие между соединениями и смесями элементов это легкость, с которой элементы могут быть разделены. Смеси, например, атмосфера, содержат два или более веществ, относительно легко отделить. Отдельные компоненты смеси могут быть физически отделены друг от друга.
Химические соединения сильно отличаются от смесей: элементы в химическом соединении можно разделить только разрушая состав. Некоторые различия между химическими соединения и смеси элементов иллюстрируются следующий пример с использованием изюмных отрубей и «Crispix».
Изюмные отруби обладают следующими характерными свойствами смеси .
- Крупа не имеет постоянного состава; в
соотношение изюма и отрубей меняется от образца к образцу.
 образец.
образец. - Легко физически разделить два «элементы», чтобы выбрать изюм, для Например, и есть их отдельно.
Crispix обладает некоторыми характерными свойствами соединения .
- Соотношение рисовых хлопьев и кукурузных хлопьев постоянно; Это составляет 1:1 в каждом образце.
- Нет возможности разделить «элементы» не разрывая узы, удерживающие их вместе.
Q2 Дайте определение элементам, соединениям, смесям, чтобы показать их основное различие…
Перейти к
- Упражнение
- Вопросы объективного типа
- Иметь значение
- Физические и химические изменения
- Элементы, соединения и смеси
- Атомная структура
- Язык химии
- Химические реакции
- Водород
- Вода
- Углерод и его соединения
Главная >
Союзные решения
Класс 8
Химия
>
Глава 3. Элементы, соединения и смеси
>
Упражнение
>
Вопрос 2
Элементы, соединения и смеси
>
Упражнение
>
Вопрос 2
Вопрос 2 Упражнение
Q2) Дайте определение терминам элементы, соединения и смеси, чтобы показать их основное различие.
Ответ:
Решение:
Элемент —
Это основная единица материи, которая никаким образом не может быть разбита на субстанции, но может быть объединена для образования новых субстанций.
Это чистое вещество.
Классифицируется на металлы, неметаллы, металлоиды и инертные газы.
Пример – водород, углерод, кислород
Соединения –
Это комбинация двух или более элементов.
Это чистое вещество.
В результате химических реакций их можно разложить на металлы.
Пример — Вода, Двуокись углерода
Смеси —
Это комбинация двух или более элементов или соединений или того и другого.
Вещества, объединенные в смеси, находятся в определенном соотношении.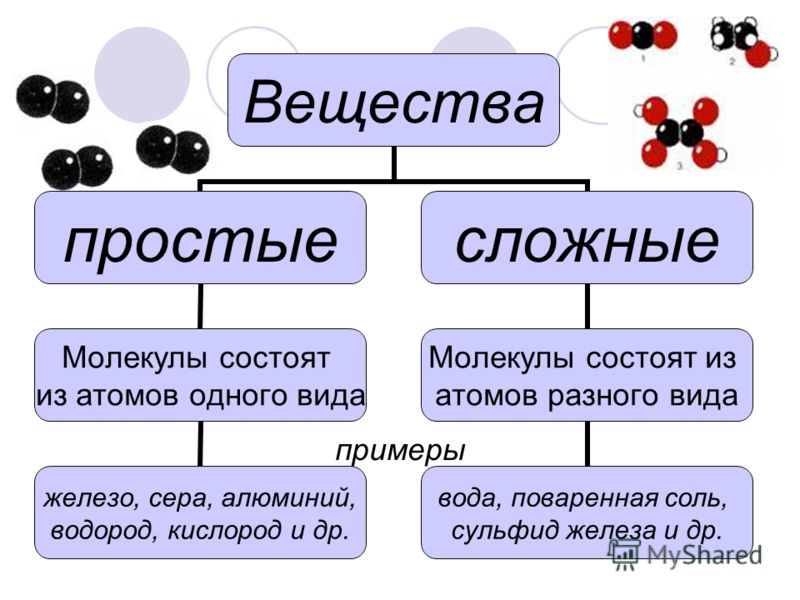
Пример — меловой порошок, стиральная сода
Стенограмма видео
«всем привет
сегодняшний вопрос — определить термины
элементы
соединения и смеси с целью
показать их основные отличия
так что в этом вопросе сначала будем
определение
что означает элемент что такое
подразумевается под соединением
а что подразумеваются под смесями и то
мы будем смотреть на
основные отличия теперь давайте посмотрим на
что такое элемент как мы определяем
элемент элемент является основным
форма материи, которая не может быть разрушена
вниз
в более простое вещество даже
химические реакции
вот как мы определяем, что такое
элемент теперь давайте двигаться дальше
определить, что понимается под соединением
соединение это комбинация
из двух и более элементов, которые
можно разбить на элементы
химическим или электрохимическим
реакции вот как мы определяем
смеси соединений теперь давайте двигаться дальше
определить, что такое смесь
смесь – это сочетание двух
или соединения нескольких элементов, или и то, и другое
то есть элементы являются соединениями
просто смешать вместе, чтобы сформировать смесь
и никаких новых веществ
получает новое соединение
сформированный
это определение того, что
это элемент, что является соединением и
что такое смесь
теперь элемент всегда чистый
соединение веществ
также также чистые вещества
но смеси, поскольку это комбинация
два и более элемента
имеет переменный состав
элемент имеет классификацию классифицированную
в металлы неметаллы металлоиды и
благородные очки
когда я смотрю на соединения соединения
представляет собой комбинацию каждого нового вещества
всегда фиксировано, и новое вещество
который формируется
как разные свойства, но в смесях
оно имеет
переменный состав и вещество
сочетаются в смеси
находятся в определенном соотношении
это еще одно различие между
элементы
соединения и смеси, когда я вижу на
следующие различия мы можем видеть, что
элементы
нельзя разбить на более простые
вещества, а соединения, которые могут быть
сломанный
на элементы химическим или
электрохимический
реакции и смеси компонентов
можно довольно легко отделить
физические методы, поэтому
представляют собой соединения трех составных элементов
и смеси, и это основные
различия
между ними теперь давайте посмотрим на
Примеры
когда я смотрю на примеры, я говорю
этот элемент на самом деле чистый
вещество
так примерами элементов являются водород
углерод кислород следующий
соединения соединения в основном
сочетание двух и более элементов
так и это тоже чистое вещество
поэтому в этом случае я могу сказать, что соединения
примерами являются вода, которая является h3o
углекислый газ, который является сахаром СО2
смеси метана и др.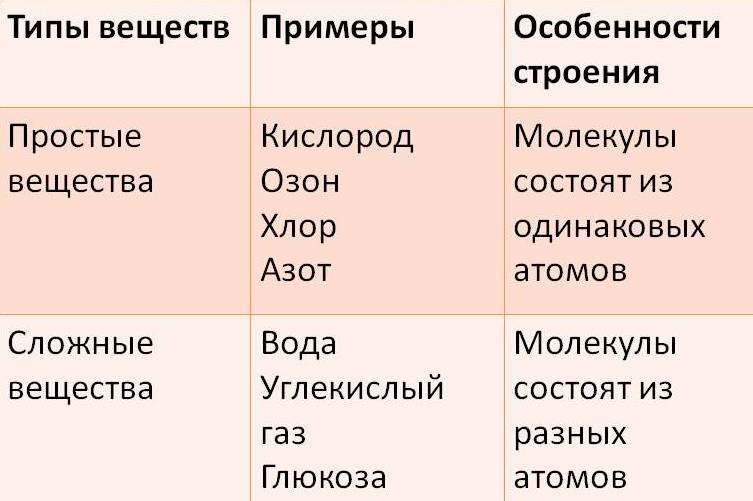 это в основном комбинация двух или
соединения большего количества элементов или и то, и другое
поэтому в этом случае, когда я смотрю на пример
смесей
можно сказать, что примером смесей являются
меловой порошок
и смотреть газировку так вот как в этом
вопрос
мы сначала определяем, что такое элемент, который мы
определил, что такое соединения
и мы определили, что такое смеси и
затем мы рассмотрели основные отличия
соответственно мы также указали примеры
соединений и смесей элементов
Спасибо
это в основном комбинация двух или
соединения большего количества элементов или и то, и другое
поэтому в этом случае, когда я смотрю на пример
смесей
можно сказать, что примером смесей являются
меловой порошок
и смотреть газировку так вот как в этом
вопрос
мы сначала определяем, что такое элемент, который мы
определил, что такое соединения
и мы определили, что такое смеси и
затем мы рассмотрели основные отличия
соответственно мы также указали примеры
соединений и смесей элементов
Спасибо
Связанные вопросы
Q1) Изобразите с помощью простой схемы, как материя классифицируется на чистую или нечистую субстанцию…
Q3) «Атом — это основная единица элемента». Нарисуйте схему атома — делимого, как это видно сегодня.
Q4) «Современная периодическая таблица состоит из элементов, расположенных в порядке возрастания их атомного числа.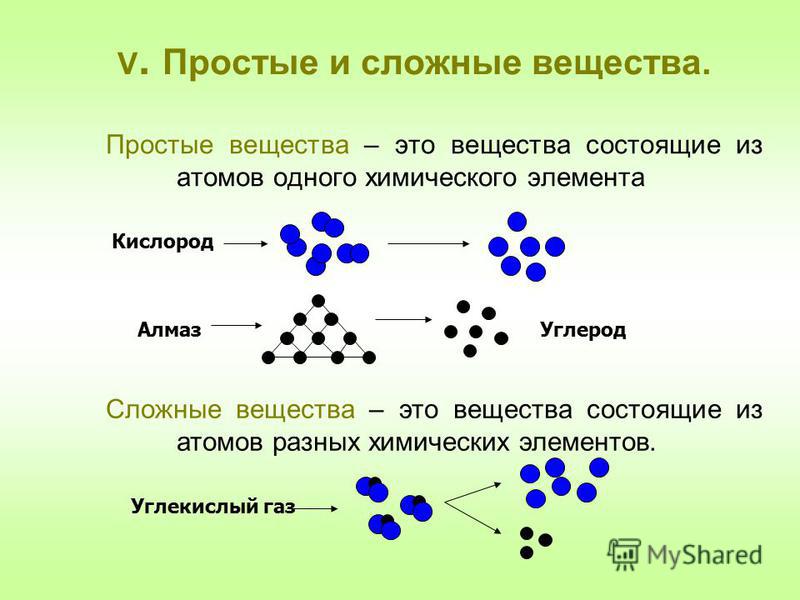


 е. часто существуют в виде жидкости или газа при
комнатной температуры)
е. часто существуют в виде жидкости или газа при
комнатной температуры)
 образец.
образец.