Номер №293 — ГДЗ по Математике 6 класс: Мерзляк А.Г.
войтирегистрация
- Ответкин
- Решебники
- 6 класс
- Математика
- Мерзляк
- Номер №293
НАЗАД К СОДЕРЖАНИЮ
2014г.ВыбранВыбрать ГДЗ (готовое домашние задание из решебника) на Номер №293 по учебнику Математика. 6 класс. Учебник для учащихся общеобразовательных организаций / А.Г. Мерзляк, В.Б. Полонский, М.С. Якир. Вентана-Граф. 2014г.
2019г.ВыбранВыбрать
ГДЗ (готовое домашние задание из решебника) на Номер №293 по учебнику Математика. 6 класс. Учебник / А.Г. Мерзляк, В.Б. Полонский, М.С. Якир, под редакцией В.Е. Подольского. Вентана-Граф. 4 издание, дополненное. 2019г.
2019г.
Условие 20142019г.
Cменить на 2014 г.
Cменить на 2019 г.
Выполните действия:
1) 5 5/9+3 1/6−6 4/27 ;
2) 1 5/7+3 11/14−2 1/4 ;
3) 12 13/48−(9 17/32−4 5/24) ;
4) (18−10 18/35)−(3 9/28+2 3/20).
В трех ящиках было 36 9/16 кг апельсинов. В первом и втором ящиках было 28 7/8 кг апельсинов, а в первом и третьем − 24 3/4 кг. Сколько килограммов апельсинов было в каждом ящике?
Решение 1
Решение 1
Решение 2
Решение 2
Решение 3
Решение 3
Решение 4
Решение 4
Решение 5
Решение 5
Решение 6
Решение 6
ГДЗ по Математике 6 класс: Виленкин Н. Я.
Я.
Издатель: Виленкин Н.Я. Жохов В.И. Чесноков А.С. Шварцбурд С.И. 2013/2019г.
ГДЗ по Математике 6 класс: Мерзляк А.Г.
Издатель: А.Г. Мерзляк, В.Б. Полонский, М.С. Якир. 2014г. / 2019г.
ГДЗ по Математике 6 класс: Никольский С.М.
Издатель: С.М. Никольский, М.К, Потапов, Н.Н. Решетников, А.В. Шевкин. 2015-2018
ГДЗ по Математике 6 класс: Зубарева, Мордкович
Издатель: И.И. Зубарева, А.Г. Мордкович. 2014-2019г.
ГДЗ по Математике 6 класс: Дорофеев Г.В.
Издатель: Г.В. Дорофеев, И.Ф. Шарыгин, С.Б. Суворова. 2016-2019г.
Сообщить об ошибке
Выберите тип ошибки:
Решено неверно
Опечатка
Плохое качество картинки
Опишите подробнее
в каком месте ошибка
Ваше сообщение отправлено
и скоро будет рассмотрено
ОК, СПАСИБО
[email protected]
© OTVETKIN. INFO
INFO
Классы
Предметы
Ответы Задание 293 . ГДЗ по математике 6 класс Мерзляк Полонский Якир учебник
11. Решаем устно2345678910111213141516171819202122232425262728293031323334353637383939. Решаем устно40414243444546474849505152535455565758596061626364656667686970717272. Решаем устно737475767778798081828384858687888990919293949596979899100101102103103. Решаем устно104105106107108109110111112113114115116117118119120121122123124125126127128129130131132133134135136137137. Решаем устно138139140141142143144145146147148149150151152153154155156157158159160161162162. Решаем устно163164165166167168169170171172173174175176177178179180181182183184185186186. Решаем устно187188189190191192193194195196197198199200201202203204205206207208209209. Решаем устно210211212213214215216217218219220221222223224225226227228229230231232233234235235. Решаем устно236237238239240241242243244245246247248249250251252253254255256257258259260261262263264265266267267.

 Решаем устно846847848849850851852853854855856857858859860861862863864865866867868869870870. Решаем устно871872873874875876877878879880881882883884885886887888889890891892893893. Решаем устно894895896897898899900901902903904905906907908909910911912913914915916917918918. Решаем устно919920921922923924925926927928929930931932933934935936937938939940941942943944945946947948949950951951. Решаем устно952953954955956957958959960961962963964965966967968969970971972973974975975. Решаем устно976977978979980981982983984985986987988989990991992992. Решаем устно9939949959969979989991000100110021003100410051006100710081009101010111012101310141015101610171018101910201021102210231023. Решаем устно10241025102610271028102910301031103210331034103510361037103810391040104110421043104410451046104710481049105010511052105310541054. Решаем устно105510561057105810591060106110621063106410651066106710681069107010711072107310741074. Решаем устно10751076107710781079108010811082108310841085108610871088108910901091109210931094109510961097109810991100110111021103110411051106110711081109111011111112111311141114.
Решаем устно846847848849850851852853854855856857858859860861862863864865866867868869870870. Решаем устно871872873874875876877878879880881882883884885886887888889890891892893893. Решаем устно894895896897898899900901902903904905906907908909910911912913914915916917918918. Решаем устно919920921922923924925926927928929930931932933934935936937938939940941942943944945946947948949950951951. Решаем устно952953954955956957958959960961962963964965966967968969970971972973974975975. Решаем устно976977978979980981982983984985986987988989990991992992. Решаем устно9939949959969979989991000100110021003100410051006100710081009101010111012101310141015101610171018101910201021102210231023. Решаем устно10241025102610271028102910301031103210331034103510361037103810391040104110421043104410451046104710481049105010511052105310541054. Решаем устно105510561057105810591060106110621063106410651066106710681069107010711072107310741074. Решаем устно10751076107710781079108010811082108310841085108610871088108910901091109210931094109510961097109810991100110111021103110411051106110711081109111011111112111311141114.

Красная флуоресцентная клеточная линия HEK-293
Ссылка: P20308
Красная флуоресцентная клеточная линия HEK-293 (также известная как VAMPIRO HEK-293) была разработана путем стабильной трансфекции клеточной линии HEK-293 с помощью tFP602. Эта клеточная линия экспрессирует последовательности генов красного флуоресцентного белка в виде свободных цитоплазматических белков. Каждый флакон с клетками содержит более 3 миллионов жизнеспособных клеток, стабильно экспрессирующих tFP602 с геном устойчивости к пуромицину:
Линия клеток VAMPIRO HEK-293 готова к использованию в клеточных анализах. Эта стабильно трансфицированная клональная клеточная линия обеспечивает стабильные уровни экспрессии, что упрощает интерпретацию результатов. Красный флуоресцентный HEK-293 Cell Line также позволяют создавать модели in vitro для скрининга с высокой пропускной способностью и высоким содержанием.
950,00€
Красная флуоресцентная клеточная линия HEK-293 количество
Категория: Красные флуоресцентные клеточные линии Теги: Клеточная линия HEK-293 Красные флуоресцентные клеточные линии
Сопутствующие товары:
Вам также может понравиться…
- Описание продукта
- Технические характеристики
- Характеристика
- Похожие
- Публикации
- Технические ресурсы и протоколы
Линия красных флуоресцентных клеток HEK-293 подходит для экспериментов in vitro и in vivo .
О клеточной линии НЕК-293:
Эмбриональные клетки почек человека, также известные как клетки НЕК, клетки НЕК 293 или просто клетки 293, представляют собой клеточную линию, которая, как следует из названия, изначально происходит от эмбриона человека. почка. 29 НЕК3 популярны из-за легкости роста и трансфекции, что делает их распространенной клеточной культурой в исследованиях рака. Кроме того, высокая эффективность трансфекции клеток HEK293 позволяет продуцировать экзогенные белки или вирусы для целей фармацевтических и биомедицинских исследований. Клетки HEK-293 пригодны для многих экспериментов по трансфекции, особенно для размножения векторов на основе аденовирусов и ретровирусов.
почка. 29 НЕК3 популярны из-за легкости роста и трансфекции, что делает их распространенной клеточной культурой в исследованиях рака. Кроме того, высокая эффективность трансфекции клеток HEK293 позволяет продуцировать экзогенные белки или вирусы для целей фармацевтических и биомедицинских исследований. Клетки HEK-293 пригодны для многих экспериментов по трансфекции, особенно для размножения векторов на основе аденовирусов и ретровирусов.
О белке turboFP602:
Белок TurboFP602 представляет собой сдвинутый в красную сторону вариант красного флуоресцентного белка TurboRFP актинии Entacmaea quadricolor [Merzlyak et al., 2007]. Он обладает истинно красной флуоресценцией (макс. возбуждение/испускание = 574/602 нм), что оптимально для обнаружения с помощью большинства популярных наборов фильтров. TurboFP602 демонстрирует быстрое созревание, а также высокую стабильность pH. TurboFP602 полезен для приложений, где решающее значение имеет быстрое появление яркой флуоресценции. Он также полезен для мечения клеток и органелл и отслеживания активности промотора.
Он также полезен для мечения клеток и органелл и отслеживания активности промотора.
- Ссылка: P20308
- Размер/Количество: 3×10 6 Клетки/Vial
- Ген сопротивления: Puromycin
- Red Fluorescent Protein: TFP602 (экстрагистрация/эмиссия. Использование: Только для исследовательских целей
- Условия доставки: Сухой лед
- Технический паспорт
- Руководство по культивированию клеток
Клеточная линия HEK-293 | Красные флуоресцентные клеточные линии
Ксенородопсин с помпой H+ внутрь: механизм и альтернативный оптогенетический подход
1. Эрнст О. П., Лодовски Д. Т., Эльстнер М., Хегеманн П., Браун Л. С., Кандори Х., Микробные и животные родопсины: структуры, функции и молекулярные механизмы. хим. преп. 114, 126–163 (2014). [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Митчелл П.,
Хемиосмотическое взаимодействие в окислительном и фотосинтетическом фосфорилировании. биол. преп.
41,
445–501 (1966). [PubMed] [Google Scholar]
биол. преп.
41,
445–501 (1966). [PubMed] [Google Scholar]
3. Остерхельт Д., Стокениус В., Родопсинподобный белок пурпурной мембраны Halobacterium halobium. Нац. Новая биол. 233, 149–152 (1971). [PubMed] [Google Scholar]
4. Иноуэ К., Ито С., Като Ю., Номура Ю., Шибата М., Учихаши Т., Цунода С. П., Кандори Х., Внутренний протонный насос, управляемый естественным светом. Нац. коммун. 7, 13415 (2016). [Бесплатная статья PMC] [PubMed] [Google Scholar]
5. Угальде Дж. А., Поделл С., Нарасингарао П., Аллен Э. Э., Ксенородопсины, загадочный новый класс микробных родопсинов, горизонтально переносимых между археями и бактериями. биол. Прямой 6, 52 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
6. Вогелей Л., Синещеков О. А., Триведи В. Д., Сасаки Дж., Спудич Дж. Л., Люке Х., Сенсорный родопсин Anabaena: фотохромный датчик цвета на 2,0 Å. Наука 306, 1390–1393 (2004 г.). [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Гай Р., Пашич Л., Фернандес А. Б., Мартин-Куадрадо А.-Б., Мизуно К. М., МакМахон К. Д., Папке Р. Т., Степанаускас Р., Родригес -Брито Б., Ровер Ф., Санчес-Порро К., Вентоса А., Родригес-Валера Ф.,
Новые многочисленные микробные группы в водных гиперсоленых средах. науч. Респ.
1,
135 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
Б., Мартин-Куадрадо А.-Б., Мизуно К. М., МакМахон К. Д., Папке Р. Т., Степанаускас Р., Родригес -Брито Б., Ровер Ф., Санчес-Порро К., Вентоса А., Родригес-Валера Ф.,
Новые многочисленные микробные группы в водных гиперсоленых средах. науч. Респ.
1,
135 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Вавуракис С. Д., Гай Р., Родригес-Валера Ф., Сорокин Д. Ю., Тринге С. Г., Хугенхольц П., Муйзер Г., Метагеномное понимание некультивируемого разнообразия и физиологии микробов в рассолах четырех гиперсоленых содовых озер. Передний. микробиол. 7, 211 (2016). [PMC free article] [PubMed] [Google Scholar]
9. Nagel G., Szellas T., Huhn W., Kateriya S., Adeishvili N., Berthold P., Ollig D., Hegemann P., Bamberg E. ., Каналродопсин-2 , катион-селективный мембранный канал, непосредственно управляемый светом. проц. Натл. акад. науч. США. 100, 13940–13945 (2003). [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Huang K. S., Bayley H., Khorana H. G.,
Делипидирование бактериородопсина и восстановление экзогенным фосфолипидом.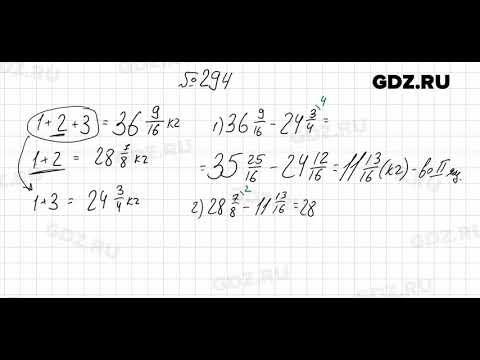 проц. Натл. акад. науч. США.
77,
323–327 (1980). [Бесплатная статья PMC] [PubMed] [Google Scholar]
проц. Натл. акад. науч. США.
77,
323–327 (1980). [Бесплатная статья PMC] [PubMed] [Google Scholar]
11. Racker E., Stoeckenius W., Восстановление фиолетовых мембранных везикул, катализирующих поглощение протонов под действием света и образование аденозинтрифосфата. Дж. Биол. хим. 249, 662–663 (1974). [PubMed] [Академия Google]
12. Мойзе А.Р., Кукса В., Иманиши Ю., Пальчевский К., Идентификация all- транс--ретинол: All- транс--13,14-дигидроретинолсатураза. Дж. Биол. хим. 279, 50230–50242 (2004 г.). [PMC free article] [PubMed] [Google Scholar]
13. Горделий В.И., Шлезингер Р., Ефремов Р., Бюльдт Г., Хеберле Дж., in Membrane Protein Protocols , Селинский Б.С., Под ред. (Humana Press, 2003), т. 1, с. 228, стр. 305–316. [PubMed] [Google Scholar]
14. Luecke H., Schobert B., Richter H.-T., Cartailler J.-P., Lanyi J.K., Структура бактериородопсина при разрешении 1,55 Å. Дж. Мол. биол. 291, 899–911 (1999). [PubMed] [Google Scholar]
15. Гущин И., Черваков П., Кузьмичев П., Попов А. Н., Круглый Е., Борщевский В., Ищенко А., Петровская Л., Чупин В., Долгих Д. А., Арсеньев А. С., Кирпичников М., Горделий В.,
Структурное понимание перекачки протонов необычным протеородопсином неморских бактерий. проц. Натл. акад. науч. США.
110,
12631–12636 (2013). [PMC free article] [PubMed] [Google Scholar]
Гущин И., Черваков П., Кузьмичев П., Попов А. Н., Круглый Е., Борщевский В., Ищенко А., Петровская Л., Чупин В., Долгих Д. А., Арсеньев А. С., Кирпичников М., Горделий В.,
Структурное понимание перекачки протонов необычным протеородопсином неморских бактерий. проц. Натл. акад. науч. США.
110,
12631–12636 (2013). [PMC free article] [PubMed] [Google Scholar]
16. Балашов С. П., Петровская Л. Е., Лукашев Е. П., Имашева Е. С., Дюмаев А. К., Ван Ж. М., Сычев С. В., Долгих Д. А., Рубин А. Б., Кирпичников М. П., Ланьи Ж. К., Аспартат-гистидиновое взаимодействие в ретинальном шиффовом противоионе светоуправляемого протонного насоса Exiguobacterium sibiricum. Биохимия 51, 5748–5762 (2012). [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Градинару В., Чжан Ф., Рамакришнан С., Мэттис Дж., Пракаш Р., Диестер И., Гошен И., Томпсон К. Р., Дейссерот К., Молекулярные и клеточные подходы к диверсификации и расширению оптогенетики. Клетка 141, 154–165 (2010). [PMC free article] [PubMed] [Google Scholar]
18. Кузьмич А. И., Введенский А. В., Копанцев Е. П., Виноградова Т. В.,
Количественное сравнение коэкспрессии генов в бицистронном векторе, содержащем IRES или кодирующую последовательность пептида свиного тешовируса 2A. Русь. Дж. Биоорг. хим.
39,
406–416 (2013). [Google Scholar]
Кузьмич А. И., Введенский А. В., Копанцев Е. П., Виноградова Т. В.,
Количественное сравнение коэкспрессии генов в бицистронном векторе, содержащем IRES или кодирующую последовательность пептида свиного тешовируса 2A. Русь. Дж. Биоорг. хим.
39,
406–416 (2013). [Google Scholar]
19. Щербо Д., Мерзляк Е. М., Чепурных Т. В., Фрадков А. Ф., Ермакова Г. В., Соловьева Е. А., Лукьянов К. А., Богданова Е. А., Зарайский А. Г., Лукьянов С., Чудаков Д. М., Яркий дальнекрасный флуоресцентный белок для визуализации всего тела. Нац. Методы 4, 741–746 (2007). [PubMed] [Google Scholar]
20. Гунайдин Л. А., Йижар О., Берндт А., Сохал В. С., Дейссерот К., Хегеманн П., Сверхбыстрый оптогенетический контроль. Нац. Неврологи. 13, 387–392 (2010). [PubMed] [Академия Google]
21. Кляйнлогель С., Терпиц У., Легрум Б., Гёкбугет Д., Бойден Э. С., Баманн К., Вуд П. Г., Бамберг Э.,
Стратегия слияния генов для стехиометрической и совместно локализованной экспрессии светозависимых мембранных белков. Нац. Методы
8,
1083–1088 (2011). [PubMed] [Google Scholar]
Нац. Методы
8,
1083–1088 (2011). [PubMed] [Google Scholar]
22. Гущин И., Шевченко В., Половинкин В., Ковалев К., Алексеев А., Раунд Е., Борщевский В., Баландин Т., Попов А., Генш Т. , Фальке К., Баманн К., Уиллболд Д., Бюлдт Г., Бамберг Э., Горделий В., Кристаллическая структура светового натриевого насоса. Нац. Структура Мол. биол. 22, 390–395 (2015). [PubMed] [Google Scholar]
23. Studier F. W., Производство белка путем аутоиндукции при встряхивании культур с высокой плотностью. Белок Экспр. Очист. 41, 207–234 (2005). [PubMed] [Google Scholar]
24. Ричи Т. К., Гринькова Ю. В., Байбурт Т. Х., Денисов И. Г., Золнерцикс Ю. К., Аткинс В. М., Слигар С. Г., Глава 11 – Восстановление мембранных белков в фосфолипидных бислойных нанодисках. Методы Энзимол. 464, 211–231 (2009). [Бесплатная статья PMC] [PubMed] [Google Scholar]
25. Чижов И., Чернавский Д. С., Энгельхард М., Мюллер К.-Х., Зубов Б. В., Гесс Б.,
Спектрально молчащие переходы в фотоцикле бактериородопсина. Биофиз. Дж.
71,
2329–2345 (1996). [PMC free article] [PubMed] [Google Scholar]
Биофиз. Дж.
71,
2329–2345 (1996). [PMC free article] [PubMed] [Google Scholar]
26. Горделий В. И., Лабан Дж., Мухаметцианов Р., Ефремов Р., Гранзин Дж., Шлезингер Р., Бюльдт Г., Савопол Т., Шайдиг А. Дж., Клэр Дж. П., Энгельхард М., Молекулярные основы трансмембранной передачи сигналов сенсорным комплексом родопсин II-преобразователь. Природа 419, 484–487 (2002). [PubMed] [Google Scholar]
27. Кабш В., XDS. Акта Кристаллогр. Д биол. Кристаллогр. 66, 125–132 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
28. Winn M.D., Ballard C.C., Cowtan K.D., Dodson E.J., Emsley P., Evans P.R., Keegan R.M., Krissinel E.B., Leslie A.G.W., McCoy A., McNicholas S.J. , Муршудов Г. Н., Панну Н. С., Поттертон Э. А., Пауэлл Х. Р., Рид Р. Дж., Вагин А., Уилсон К. С., Обзор пакета CCP 4 и текущих разработок. Акта Кристаллогр. Д биол. Кристаллогр. 67, 235–242 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
29. Вагин А., Лебедев А., MoRDa , трубопровод автоматической молекулярной замены. Акта Кристаллогр. Найдено. Доп.
71,
с19 (2015). [Google Scholar]
Акта Кристаллогр. Найдено. Доп.
71,
с19 (2015). [Google Scholar]
30. Адамс П. Д., Афонин П. В., Бункоци Г., Чен В. Б., Дэвис И. В., Эколс Н., Хедд Дж. Дж., Хунг Л.-В., Капрал Г. Дж., Гроссе-Кунстлеве Р. В., Маккой А. Дж., Мориарти Н. В., Оффнер Р., Рид Р. Дж., Ричардсон Д. К., Ричардсон Дж. С., Тервиллигер Т. С., Цварт П. Х., PHENIX : Комплексная система на основе Python для решения макромолекулярной структуры. Акта Кристаллогр. Д биол. Кристаллогр. 66, 213–221 (2010). [Бесплатная статья PMC] [PubMed] [Google Scholar]
31. Муршудов Г. Н., Скубак П., Лебедев А. А., Панну Н. С., Штайнер Р. А., Николс Р. А., Винн М. Д., Лонг Ф., Вагин А. А., REFMAC 5 для уточнения макромолекулярных кристаллических структур. Акта Кристаллогр. Д биол. Кристаллогр. 67, 355–367 (2011). [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Emsley P., Cowtan K., Coot : Инструменты для построения моделей для молекулярной графики. Акта Кристаллогр. Д биол.
