ГДЗ по Химии для 10 класса тетрадь для практических работ Борушко И.И. на 5
Автор: Борушко И.И..
Издательство: Сэр-Вит 2020
Химия сложная наука и вызывает массу трудностей у школьников при ее изучении. В этом предмете знать правила не достаточно, нужно уметь применять теорию на практике и правильно проводить лабораторные работы. Школьник при её изучении должен использовать надежные и проверенные источники информации, так как задания довольно сложные и требуют много знаний для их решения. Ученику, его родителям и учителям будет полезно иметь в наличии «ГДЗ по Химии для 10 класса тетрадь для практических работ базовый уровень Борушко (Сэр-Вит)», которые подскажут верный ответ при выполнении домашнего задания, помогут проверить пройденный материал и закрепить все сведения.
Химия как фундаментальная наука
Этот предмет подразумевает освоение большого объема информации, так как необходимо уметь смешивать разные реактивы, наизусть знать много формул, таблиц и правил.
Как решебник по Химии для 10 класса тетрадь для практических работ базовый уровень Борушко поможет старшекласснику
В этом году для изучения дисциплины потребуется максимум концентрации, ведь игнорирование данного предмета со стороны ученика может иметь негативные последствия. Наши ГДЗ помогут восполнить недостаток знаний, так как каждое задание, упражнение имеет подробное разъяснение и комментарий, которые не вызовут дополнительных вопросов при решении примера.
- Полные ответы на все задания.
- 4 практические работы, каждая разбита на 4 варианта и 8 лабораторных опытов. Все номера имеют подробное описание решения.
- Разные варианты практических занятий и проведения испытаний.
- Доступный веб-интерфейс, возможность выхода, как с компьютера, так и с телефона или другого устройства.
Используя «ГДЗ по Химии для 10 класса тетрадь для практических работ базовый уровень Борушко И.И. (Сэр-Вит)», старшеклассник сможет эффективно подготовиться к ЕГЭ, потратив минимум времени.
ГДЗ по химии 10-11 класс Цветков Органическая химия решебник
Практические работы1 2 3 4 5 6 7
Лабораторные опыты2 3 4 5 6 7 8 9 10 11 12 13 14 15
1. Теория химического строения органических соединений
Теория химического строения органических соединений
§ I. Предпосылки теории строения:Vopr_1 Vopr_2
§ 2. Теория химического строения:Vopr_3 Vopr_4 Vopr_5
§ 3. Изометрия:6 7 8 9
§ 4. Электронное строение атомов элементов малых периодов.:10 11 12 13 14 15 16
2. Предельные углеводороды
§ 5. Метан, его строение:1 2 3
§ 6. Строение и номенклатура углеводородов ряда метана:4 5 6 7 8 9 10 11 12 13 14 15 16 17
§ 7. Химические свойства предельных углеводородов:18 19 20 21 22 23 24 25 26 27
§ 8. Получение и применение предельных углеводородов:28 29 30 31 32 33 34 35
3. Непредельные углеводороды
§ 10. Этилен, его строение:1 2 3 4
§ 11. Строение и номенклатура углеводородов ряда этилена:5 6 7 8 9 10 11 12 13 14
§ 12. Химические свойства углеводородов ряда этилена:15
16
17
18
19
20
21
22
23
24
25
Химические свойства углеводородов ряда этилена:15
16
17
18
19
20
21
22
23
24
25
§ 13. Применение и получение этиленовых углеводородов:26 27 28 29 30 31
§ 14. Диеновые углеводороды:32 33 34 35 36 37 38
§ 15. Каучук:39 40 41 42
§ 16. Ацетилен и его гомологи:43 44 45 46 47 49 50 51 52 53 54 55 56
4. Ароматические углеводороды
§17. Бензол:1 2 3 4 5 6 7 8
§ 18. Гомологи бензола:9 10 11 12 13 14 15 16 17
§ 19. Многообразие углеводородов.:18 19 20 21 22 23 24
5. Природные источники углеводородов
§ 20. Природный и попутный нефтяной газы:1 2 3 4
§ 21. Нефть. Нефтепродукты:5 6 7 8 9
§ 22. Переработка нефти:10 11 12 13 14 15 16 17 18 19
§ 23. Коксохимическое производство:20
21
22
23
24
25
26
Коксохимическое производство:20
21
22
23
24
25
26
6. Спирты и фенолы
§ 24. Строение предельных одноатомных спиртов:1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
§ 25. Химические свойства и применение предельных одноатомных спиртов:7 8 9 10 11 12 13 14 15 16 17 18
§ 26. Спирты как производные углеводородов. Промышленный синтез метанола:19 20 21 22 23 24 25 26
§ 27. Многоатомные спирты:27 28 29 30 31 32
§ 28. Фенолы:33 34 35 36 37 38
7. Альдегиды и карбоновые кислоты
§ 29. Альдегиды:1 2 3 4 5 6 7 8 9 10
§ 30. Одноосновные карбоновые кислоты:11 12 13 14 15 16 17 18 19
§ 31. Представители одноосновных карбоновых кислот:20 21 22 23 24 25 26 27 28
§ 32. Связь между углеводородами, спиртами, альдегидами и кислотами:29
30
31
32
33
34
35
36
37
38
Связь между углеводородами, спиртами, альдегидами и кислотами:29
30
31
32
33
34
35
36
37
38
8. Сложные эфиры. Жиры
§ 33. Сложные эфиры:1 2 3 4 5 6 7
§ 34. Жиры:8 9 10 11 12 13 14 15 16
9. Углеводы
§ 35. Глюкоза:1 2 3 4 5 6 7 8
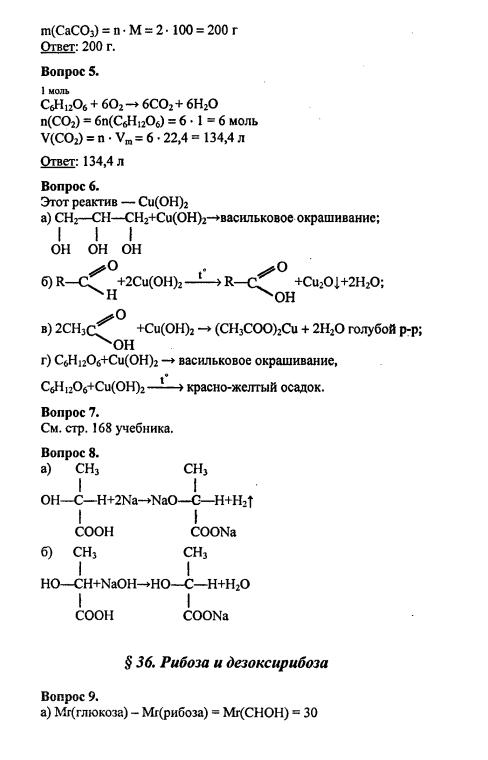
§ 36. Рибоза и дезоксирибоза:9 10 11 12
§ 37. Сахароза:13 14 15 16
§ 38 Крахмал:17 18 19 20 21
§ 39. Целлюлоза:22 23 24 25 26 27 28
10. Амины. Аминокислоты. Азотсодержащие гетероциклические соединения
§ 40. Амины:1 2 3 4 5 6 7 8 9 10 11 12
§ 41. Аминокислоты:13 14 15 16 17 18
§ 42. Азотсодержащие гетероциклические соединения:19 20 21 22 23 24
§ 43. Примидиновые и пуриновые основания:25 26
11.
§ 44. Белки:1 2 3 4 5 6 7 8
§ 45. Нуклеиновые кислоты:9 10 11 12 13
12. Синтетические высокомолекулярные вещества и полимерные материалы на их основе
§ 46. Общая характеристика синтетических высокомолекулярных веществ:1 2 3 4 5 6 7 8 9 10 11
§ 47. Пластмассы:12 13 14 15 16 17 18
§ 48. Пластмассы {продолжение):19 20 21 22 23 24 25 26 27 32
§ 49. Синтетические волокна:27 28 29 30 31 32
§ 50. Синтетические каучуки:33 34 35 36 37 38 39 40
Selina Химия Класс 10 Решения для практических работ Скачать PDF
Селина Химия Класс 10 Решения для практических работ созданы нашими экспертами в предметной области с надлежащими исследованиями, чтобы учащиеся не застряли при решении любого из вопросов. С помощью книги решений учащиеся могут исправить ошибки, а также разрешить сомнения относительно практической работы 10 класса, соответственно, они могут получить хорошие оценки.
С помощью книги решений учащиеся могут исправить ошибки, а также разрешить сомнения относительно практической работы 10 класса, соответственно, они могут получить хорошие оценки.
Практическая работа Selina Chemistry Class 10 PDF можно легко найти на веб-сайте Selfstudys; соответственно, студенты могут получить возможность практиковать все больше и больше вопросов. После практики студенты также могут обратиться к решениям практической работы, так как ответы расположены пошагово; благодаря этому они могут правильно понять объясненные ответы.
Где учащиеся могут найти Selina Chemistry Class 10 Практические решения для работы?Учащиеся могут найти практическую работу Selina Chemistry Class 10 на веб-сайте Selfstudys. Порядок загрузки описан ниже:
Посетите веб-сайт Selfstudys.
Наведите стрелку на раздел «Книги и решения», который можно увидеть на панели навигации.
В раскрывающемся меню выберите Selina Solutions.
Появится новая страница, выберите 10-й класс из списка классов.
Выберите Химия из списка предметов.
Снова появится новая страница, и теперь нажмите Практическая работа из списка предметов.
Атрибуты решения для практической работы Selina Chemistry Class 10Атрибуты практической работы Selina Chemistry Class 10 считаются наиболее важным качеством, которое отличает ее от других учебных ресурсов. Некоторые атрибуты обсуждаются ниже:
- Даются различные типы вопросов: В 10 практических работах класса Селина даются решения, различные типы вопросов; который включает в себя заполнение пробелов, определение следующего, исправление следующего и многое другое.
- Доступно в формате PDF: Решения Selina класса 10 для практической работы сохранены в формате PDF; благодаря которому макет, а также формат сохраняются и могут быть легко доступны.

- Диаграммы даны: Диаграммы являются визуальными представлениями, которые обычно поддерживают аргумент; к некоторым вопросам Практики схемы даны в решениях Selina Chemistry.
- Даны подсказки и решения: Как мы все знаем, после решения вопросов практической работы по химии в 10 классе учащиеся должны обратиться к ответам. Поэтому для практической работы предусмотрены подсказки и решения по химии для класса 10, чтобы учащиеся могли развеять все сомнения.
- Вопросы, основанные на концепции: Вопросы практической работы в классе 10 Selina Chemistry основаны на концепции; благодаря этому студенты могут легко понять передовые концепции.
- Доступно бесплатно: Обычно человека привлекают бесплатные вещи, то же самое относится к вопросам Практикума по химии 10 класса, вопросам решения Selina.
 Мы предоставили это бесплатно.
Мы предоставили это бесплатно.
- Может разрешить сомнения: В процессе выполнения практической работы 10 класса вполне нормально возникают сомнения, и также важно избавиться от сомнений, тогда только учащиеся могут улучшить процесс подготовки. Таким образом, чтобы избавиться от сомнений относительно практической работы по химии в 10 классе, учащимся необходимо обратиться к решениям Селины, так как в них все вопросы объяснены должным образом.
- Дает ответы на важные вопросы: Учащимся очень важно получить представление о важных вопросах практической работы 10 класса. Поэтому для этого учащимся необходимо начинать решать вопросы практической работы с решений Selina Chemistry, так как в них должным образом объясняются важные вопросы.

- Повышение уверенности: Учащиеся должны быть уверены в себе при подготовке к практической работе по химии в 10 классе, только тогда они смогут получить высокие баллы. Для повышения уверенности учащимся рекомендуется начать решать простые вопросы практической работы с решений Selina Chemistry; затем постепенно повышайте уровень.
- Помогает получить прочные знания: Путем решения вопросов о решениях Selina Практическая работа 10 класса на регулярной основе может помочь учащимся получить прочные знания по всем понятиям; соответственно может хорошо забить.
- Помогает запомнить понятия: Если учащиеся сталкиваются с какими-либо трудностями при запоминании тем практической работы, они могут обратиться к решениям Селины по химии для 10 класса и приступить к их решению, поскольку вопросы основаны на понятиях.
Учащиеся могут начать использовать решения Selina для практической работы 10 класса в любое время, но рекомендуется следовать общим рекомендациям:
- Чтобы понять тему: лучше понять темы, так как в нем решения объясняются в соответствии с понятиями.

- Повторение понятий: После изучения понятий Практической работы учащимся важно повторить эти понятия. Для этого студенты могут обратиться к решениям Selina Class 10 Практическая работа, так как в нем задаются различные вопросы из разных концепций.
- Для практики Дополнительные вопросы: Учащиеся могут использовать решения Selina для практической работы 10 класса, чтобы практиковать все больше и больше вопросов, связанных с каждой концепцией. Соответственно, учащиеся могут повысить уровень своей уверенности в практической работе по химии в 10 классе.
- Для подготовки к тесту: Если учащиеся плохо подготовились к практическому тесту 10 класса, единственный оставшийся вариант для хорошей подготовки — начать решать вопросы из решений Selina; соответственно они могут повысить свой счет.
- Для повышения точности: Очень важно, чтобы учащиеся поддерживали уровень точности, только тогда он будет полезен для понимания концепций Практической работы 10 класса.
 Таким образом, в процессе поддержания уровня точности вопросов, связанных с практической работой, студенты могут обращаться к Selina Chemistry Solutions.
Таким образом, в процессе поддержания уровня точности вопросов, связанных с практической работой, студенты могут обращаться к Selina Chemistry Solutions.
- Для заполнения рабочих листов: Очевидно, что учащиеся получают вопросы в рабочих листах, связанные с практической работой 10 класса; поэтому, чтобы завершить его эффективно, они могут воспользоваться помощью Selina Class 10 Chemistry Solution .
Влияние практической работы Selina Solutions Class 10 обычно зависит от того, как учащиеся готовы завершить подготовку, некоторые из значительных воздействий обсуждаются ниже:
- Обеспечивает всесторонний охват: Всеобъемлющий охват означает полный охват практической работы по химии для класса 10, не пропуская ни одной темы. Таким образом, чтобы всесторонне охватить темы, учащиеся могут обратиться к Решениям для практической работы Selina Class 10, поскольку вопросы в нем охватывают широкий спектр концепций.

- Экономия времени: Студенты могут легко обращаться к решениям после решения вопросов практической работы, не тратя много времени на поиск; сэкономленное время может быть реализовано в понимании концепций.
- Содержит задачи для практики: Решения Selina Class 10 для практической работы содержат задачи с разными уровнями вопросов. Соответственно, студенты могут научиться применять концепции практической работы при попытке ответить на различные вопросы.
- Улучшает оценки: Регулярная практика практических заданий из решений Selina Chemistry Class 10 может помочь учащимся улучшить свои оценки.
- Обеспечивает самостоятельное обучение: С помощью решений Selina Class 10 Chemistry учащиеся могут практиковать вопросы в своем собственном темпе; соответственно, они также могут улучшить свой прогресс в своей зоне комфорта.

- Мгновенная обратная связь: Практические задачи практической работы 10 класса обеспечивают мгновенную обратную связь, поэтому учащиеся могут учиться и исправлять свои ошибки.
Чтобы получить отличные результаты в практических заданиях Selina Chemistry Class 10, учащимся рекомендуется выполнить следующие шаги:
- Понимание концепций: Чтобы получить отличные результаты в решениях практических работ Selina Class 10, учащиеся должны сначала понять как простые, так и сложные темы, а не запоминать их.
- Сосредоточьтесь на важных темах: Студенты должны определить важные темы практической работы, а затем сосредоточиться на этих темах; соответственно, они могут блестяще ответить на вопросы практической работы Selina Chemistry Class 10.

- Диаграммы и примеры использования: Некоторые темы практической работы могут считаться сложными; для этого учащиеся могут давать диаграммы и примеры, чтобы они могли успешно выполнить практическую работу Selina Chemistry Class 10.
- Оставайтесь организованными: Учащиеся должны вести отдельный и организованный блокнот для отработки практических заданий, чтобы они могли следить за своим прогрессом.
- Проверьте ответы: После решения вопросов Практической работы учащимся рекомендуется пересмотреть ответы и решения, чтобы не пропустить ни одного шага.
- Сотрудничество со сверстниками: Учащиеся могут сотрудничать со своими сверстниками при решении задач, связанных с практической работой, и могут усилить процесс обучения.
Исправление ошибок и ответ после решения практических заданий Selina Chemistry Class 10 можно выполнить следующими способами:
- Просмотрите ответы: После выполнения задач практической работы Селины 10 класса учащиеся должны определить ошибки и определить причину ошибки.

- Практика Аналогичные задачи: Если учащиеся допустили конкретную ошибку из-за отсутствия практики, им рекомендуется попрактиковаться в аналогичном наборе вопросов практической работы Селины для 10 класса по химии.
- Обзор конкретной концепции: После выявления ошибок в решениях Selina Class 10 учащиеся должны просмотреть конкретную концепцию практической работы, где они ошиблись; соответственно, они могут глубже понять концепцию.
- Дважды проверьте ответы: После попытки ответить на каждый вопрос Практической работы учащиеся должны дважды проверить данные ответы, чтобы не пропустить ни одного шага.
- Постарайтесь не пропустить ни одного шага: Им рекомендуется не пропускать ни одного шага при попытке ответить на вопросы практической работы по химии 10-го класса Селины; соответственно студенты могут минимизировать ошибки в будущем.

- Используйте разные подходы: Если учащиеся делают одни и те же ошибки при решении вопросов практической работы от Selina Class 10 Chemistry, они могут попробовать использовать разные подходы и исправить ошибки.
Часто задаваемые вопросы
Нужны ответы? Найдите их здесь…
Учащиеся могут использовать практическую работу Selina Chemistry Class 10 для сдачи экзаменов, решая задачи, регулярно повторяя концепции, сосредотачиваясь на важных темах и т. д. уже объяснил на этой странице.
Учащиеся могут разрешить свои сомнения относительно вопросов практической работы с помощью Selina Chemistry Class 10.
Некоторые из важных преимуществ Selina Solutions Class 10 Практическая работа: предлагает пошаговые решения, может разрешить сомнения, дает понимание важные вопросы, помогает запомнить темы и многое другое.
Учащимся важно практиковать больше вопросов, связанных с практической работой, так как это помогает им изучить различные подходы к решению вопросов.
Практическая работа ICSE Class-10 Краткая химия Selina Solutions
Практическая работа ICSE Class-10 Краткая химия Selina Solutions Chapter-13. Мы предоставляем пошаговые ответы на вопросы Exe-13 и вопросы предыдущего года главы 13 Практическая работа ICSE Class-10 . Посетите официальный веб-сайт CISCE для получения подробной информации о ICSE Board Class-10.
-: Выберите темы :-
Упражнение -13 ,
Вопрос предыдущего года Exe-13
Значение для практической работы по химии ICSE
Эта глава представляет собой комбинацию многие главы, такие как аналитическая химия, реакции химических свойств соли, испытание химического соединения. Идентификация газов, уважение с реакцией. Отсюда Практическая работа очень важна в 10-м классе ICSE по химии.
Как решить Практическая работа в ICSE Class-10Chemistry Перед просмотром Solutions of Selina Concise Chemistry Chapter-13 Практическая работа. Внимательно прочитайте главу -13 Практическая работа и аналитическая химия, чтобы лучше понять концепцию. После прочтения главы -13 Практическая работа и аналитическая химия решите все примеры из этих глав учебника. Для большей практики по Практическая работа попробуйте решить упражнение из других публикаций, таких как Goyal Brothers Prakshan / new Simplified Dr Dalal Chemistry.
Внимательно прочитайте главу -13 Практическая работа и аналитическая химия, чтобы лучше понять концепцию. После прочтения главы -13 Практическая работа и аналитическая химия решите все примеры из этих глав учебника. Для большей практики по Практическая работа попробуйте решить упражнение из других публикаций, таких как Goyal Brothers Prakshan / new Simplified Dr Dalal Chemistry.
Упражнение -13 Практическая работа ICSE Class-10
Вопрос 1
(a) Проведите только один подходящий химический тест, чтобы определить следующее газы.
(i) Аммиак
(ii) Диоксид серы
(iii) Хлороводород
(iv) Хлор
(v) Двуокись углерода
(vi) Кислород
(vii) Водород
(b) Выберите основной газ, указанный в Q.1 (a). Как подозревается основная природа?
(c) Выберите кислые газы из газов, указанных в Q. 1 (a). Как подозревается кислая природа?
1 (a). Как подозревается кислая природа?
(d) Два газа A и B являются отбеливающими агентами. A имеет зеленовато-желтый цвет и обесцвечивается из-за своих окислительных свойств, тогда как B представляет собой бесцветный газ, который обесцвечивается из-за восстановления. Определить А и Б?
(e) Какой газ делает синюю бумагу из хлорида кобальта светло-розовой?
Укажите одно сходство в тесте между (i)Cl 2 и HCl (ii) SO 2 и CO 2 .
Ответ 1(a)
(i) Химический тест на аммиак:0388 4 Кл) образуются.
(ii) Химическое испытание на диоксид серы:
Обесцвечивает раствор перманганата калия розового цвета.
(iii) Химический тест на HCl:
При пропускании газообразного HCl через раствор AgNO 3 образуются белые осадки AgCl, которые растворяются в избытке NH 4 OH.
(iv) Химический тест на хлор:
Делает влажную йодкрахмальную бумагу (KI + раствор крахмала) сине-черной.
(v) Химический тест на углекислый газ:
Когда этот газ пропускают через известковую воду, он становится молочного цвета из-за образования белого осадка CaCO 3 и при прохождении избытка углекислого газа эта молочность исчезает.
(vi) Химический тест на кислород:
Этот газ поглощается бесцветным щелочным раствором пирогаллола и окрашивает его в темно-коричневый цвет
(vii) Химический тест на водород:
приблизил к нему.(b) Аммиак является основным газом, и его основная природа предполагается с помощью теста с лакмусовой бумагой, поскольку он меняет цвет красной лакмусовой бумаги на синий.
(c) Хлор, двуокись углерода, хлористый водород, сероводород и двуокись серы являются кислыми газами, поскольку они превращают синий лакмус в красный.
(d)A – хлор, B – двуокись серы.
(e)Водяной пар.
Вопрос 2Назовите газы, которые
а) Тушат горящую деревянную щепку.
б) Делает влажный красный лакмус синим.
c) Не действует на влажный лакмус.
d) Воздействует на подкисленный K 2 Cr 2 O 7 бумаги, а также делает известковую воду грязно-молочной.
Ответ 2(a)O 2
(b)NH 3
(c)Водяной пар
(d)SO 9 0388 2
Вопрос 3Имя:
(a) Два карбоната, которые не выделяют двуокись углерода при нагревании.
(b) Бесцветный газ, который отбеливает.
(c) Газы с кислым вкусом.
(d) Зеленовато-желтый газ, который также отбеливает.
(e) Газ с запахом тухлых яиц.
Ответ 3(a) Na 2 CO 3 и K 2 CO 3
(b) SO 2
(c) CO 2
(d ) Cl 2
(e) H 2 S
Вопрос 4 Из следующего списка веществ выберите те, которые соответствуют описанию, данному в части (a) ниже. Хлорид аммония, нитрат аммония, хлор, разбавленная соляная кислота, железо, нитрат свинца, оксид марганца (IV), нитрат серебра, нитрат натрия, нитрит натрия и сера.
Хлорид аммония, нитрат аммония, хлор, разбавленная соляная кислота, железо, нитрат свинца, оксид марганца (IV), нитрат серебра, нитрат натрия, нитрит натрия и сера.
Два соединения, водные растворы которых дают белый осадок с разбавленной соляной кислотой.
Ответ 4Нитрат серебра и нитрат аммония.
Вопрос 5Назовите анион, присутствующий в каждом из следующих соединений:
(a) Соединение А при нагревании с концентрированной серной кислотой дает газ, который дымит во влажном воздухе, а с аммиаком дает густой белый дым.
(b) При добавлении раствора хлорида бария к раствору соединения B образуется белый осадок, нерастворимый в разбавленной соляной кислоте.
(c) Воздействие тепла на нерастворимое соединение C приводит к образованию газа, который делает известковую воду мутной.
(d) Соединение D при нагревании с разбавленной серной кислотой дает газ, который окрашивает подкисленный раствор дихромата в зеленый цвет.
(a) Cl –
(b) SO 4 2-
(c) CO 9 0388 3 2-
(г) SO 3 2-
Вопрос 6Данную белую кристаллическую соль тестировали следующим образом:
(a) Она растворялась в воде, и полученный раствор соли окрашивался в синий лакмусово-красный цвет.
(b) Добавление раствора хлорида бария в этот раствор дало белый осадок.
(c) Испытание пламенем соли показало стойкую золотисто-желтую окраску.
Какие выводы можно сделать по каждому наблюдению?
Ответ 6(a) Поскольку раствор соли окрасил лакмус в синий цвет, следовательно, соль может быть кислотой.
(b) Поскольку добавление хлорида бария в раствор соли дает белый осадок, соль может содержать SO 4 2-, SO 3 2-, CO 3 2 – анион.
(c) Испытание соли пламенем дает стойкую золотисто-желтую окраску, которая предполагает присутствие ионов Na + .
Вопрос 7(a) К раствору А добавляют раствор гидроксида натрия. Образуется белый осадок, нерастворимый в избытке раствора гидроксида натрия. Какой ион металла присутствует в растворе А?
(b) При добавлении раствора гидроксида аммония к раствору B образуется бледно-голубой осадок. Этот бледно-голубой осадок растворяется в избытке гидроксида аммония, образуя раствор чернильно-синего цвета. Какой катион присутствует в растворе Б?
(c) При нагревании соли аммония с раствором гидроксида натрия выделяется газообразный аммиак. Назовите три способа, которыми вы могли бы идентифицировать этот газ.
Ответ 7(a) Ca 2+
(b) Cu +
(c) Три способа:
Газообразный аммиак окрашивает влажную красную лакмусовую бумагу в синий цвет.
Если к газу поднести стержень, смоченный в концентрированной HCl, образуются густые белые пары NH 4 Cl.
Газ окрашивает реактив Несслера в бесцветный цвет, т. е. K 2 HgI 4 в коричневый цвет.
Вопрос 8Заполните следующую таблицу и запишите свои наблюдения.
| Сероводород | Аммиак | Диоксид серы | Хлористый водород | |
| Встряхните газ с раствором красной лакмуса | ||||
| Встряхните газ с раствором синей лакмуса | ||||
| Наложить горящую лучину на газ |
| Сероводород | Аммиак | Диоксид серы | Хлористый водород | |
| Встряхните газ с раствором красной лакмуса | Без изменения окраски лакмусового раствора | Красный лакмусовый раствор окрашивается в синий цвет. | Без изменения окраски лакмусового раствора | Без изменения окраски лакмусового раствора |
| Встряхните газ с раствором синей лакмуса | Раствор синего лакмуса становится красным. | Отсутствие изменения окраски синего лакмусового раствора. | Раствор синего лакмуса становится красным. | Раствор синего лакмуса становится красным |
| Наложить горящую лучину на газ | Нет реакции. | реакция ноль. | реакция.не возможно | Нет реакции. |
Используйте информацию, приведенную в пунктах (a)–(h), чтобы определить вещества от P до W, выбирая ответы из данного списка.
Список: Кислород кальция Оксид меди (II)
Углерод Гидроксид кальция Медь (II) Нитрат
Оксид свинца (II) Хлористый водород Хлор
Нитрат свинца (II) Оксид кальция Хлорид аммония
(a) P представляет собой белое твердое вещество. При нагревании образует белый дым (возвышенный).
(b) P и R при нагревании выделяют щелочной газ.
(c) При добавлении воды к T выделяется тепло и образуется R.
(d) Q ярко горит на воздухе с образованием T.
(e) При нагревании S выделяет коричневые пары и оставляет черный осадок U.
(f) Раствор S образуется путем нагревания U с разбавленной азотной кислотой.
(g) V – газообразный неметаллический элемент, реагирующий с водородом с образованием W.
(h) Раствор W нейтрализует раствор R.
(Q) Кальций
(R) Гидроксид кальция
(S) Свинец (II) Нитрат
(T) Оксид кальция
(U) Оксид свинца (II)
(V) Хлор
(W) Хлористый водород
Вопрос 10Скопируйте и заполните следующую таблицу, в которой говорится о действии тепла на некоторые карбонаты:
| Карбонат | Цвет остатка при охлаждении |
| Карбонат цинка | |
| Карбонат свинца | |
| Карбонат меди |
| Карбонат | Цвет остатка при охлаждении |
| Карбонат цинка | белый |
| Карбонат свинца | желтый |
| Карбонат меди | черный |
Различают с помощью химического теста,
(a) Карбонат натрия и сульфит натрия
(b) Хлорид натрия и сульфит натрия
(c) Раствор гидроксида натрия и раствор гидроксида аммония.
(d) Сульфат аммония и сульфат натрия
(e) Серная кислота из азотной кислоты и соляной кислоты.
Ответ 11(a)
Карбонат натрия и сульфит натрия можно отличить с помощью подкисленного K 2 Cr 2 O 7 : 9 0003
Возьмите небольшое количество соли в пробирку; добавить разл. H 2 SO 4 .и подогреть при необходимости. Теперь, если приносить фильтровальную бумагу, смоченную подкисленным К 2 Cr 2 O 7 рядом с газом выделился оранжевый цвет бумаги, который стал зеленым, значит, это сульфит натрия.
(b)
Тиосульфат натрия и сульфит натрия:
Соли можно отличить с помощью ацетата серебра. К соли серебра уксуснокислой и разб. HNO 3 добавлены. Если образуется белый осадок, который медленно чернеет, то это тиосульфат-анион, так как образуется ацетат серебра Ag 2 S 2 O 3 нестабильный в растворе кислоты превращается в черный Ag 2 S.
(c)
Раствор гидроксида натрия и раствор гидроксида аммония:
Эти соли можно отличить по катиону металла, такому как кальций . Когда мы добавляем соль кальция к гидроксиду натрия и гидроксиду аммония, тогда белый творожистый ppt. образуется только в случае гидроксида натрия.
(d)
Сульфат аммония и сульфат натрия:
Эти соли можно отличить по КОН. При добавлении КОН к сульфату аммония выделяется газообразный аммиак. В то время как в случае сульфата натрия выделение газообразного аммиака отсутствует.
(e)
Добавьте раствор хлорида бария к серной, азотной и соляной кислотам. В разбавленной серной кислоте образуется белый осадок, а в азотной и соляной кислотах такой осадок не образуется.
BaCl 2(водн.) + H 2 SO 4(водн.) → BaSO 4(т) + 2HCl (водн.)
9 0032 Вопрос 12 Сначала добавляется раствор гидроксида натрия в небольшом количестве, затем в избытке к водному солевому раствору сульфата меди (II), нитрата цинка, нитрата свинца, хлорида кальция и сульфата железа (III). Скопируйте следующую таблицу и запишите цвет осадка в пунктах (i)–(v) и характер осадка (растворимый или нерастворимый) в пунктах (vi)–(x).
Скопируйте следующую таблицу и запишите цвет осадка в пунктах (i)–(v) и характер осадка (растворимый или нерастворимый) в пунктах (vi)–(x).
| Водный раствор соли | Цвет осадка при добавлении небольшого количества NaOH | Характер (растворимый или нерастворимый) при добавлении NaOH в избытке |
| сульфат меди (II) нитрат цинка нитрат свинца хлорид кальция Сульфат железа (III) | (я) (ii) (iii) (iv) (в)
| (ви) (vii) (viii) (икс) (х) |
| Водный раствор соли | Цвет осадка при добавлении небольшого количества NaOH | Характер (растворимый или нерастворимый) при добавлении NaOH в избытке |
| сульфат меди (II) нитрат цинка нитрат свинца хлорид кальция железа (III) сульфат | (i) Бледно-голубой (ii) Белый студенистый (iii) Белый мел (iv) Белый творог (v) Красновато-коричневый
| (vi) Нерастворимый (viii)Растворимый (viii)Растворимый (ix)Нерастворимый (x)Нерастворимый |
Изложите свое наблюдение, когда:
(a) Раствор нитрата свинца и раствор хлорида натрия смешаны.
(b) раствор хлорида цинка, раствор нитрата цинка и растворы сульфата цинка добавляют по отдельности к
(i) раствору хлорида бария
(ii) раствору нитрата свинца.
(c) Разложение бикарбонатов разбав. H 2 SO 4
2NaHCO 3 + H 2 SO 4 → NaSO 4 + 2H 9 0388 2 O + 2CO 2
2KHCO 3 + H 2 SO 4 → K 2 SO 4 + 2H 2 O + 2CO 2
Ответ 13(a) Образуются хлорид свинца в виде осадка и нитрит натрия.
(б)
| хлорид цинка | нитрат цинка | сульфат цинка | |
| Хлорид бария | № – | нет | Белый стр. получается |
| Нитрат свинца | реакция отсутствует | Нет реакции | реакция не найдена |
(c) Разбавленная серная кислота высвобождает диоксид углерода из карбонатов и бикарбонатов металлов. Углекислый газ при попадании в пробирку с раствором гидроксида кальция придает ей молочный оттенок.
Углекислый газ при попадании в пробирку с раствором гидроксида кальция придает ей молочный оттенок.
Вопросы с (i) по (v) относятся к следующим растворам солей, перечисленным от A до F
A. Нитрат меди
B. Сульфат железа (II)
C. Железо (III) хлорид
D. Нитрат свинца
E. Сульфат магния
F. Хлорид цинка
(I) Какие два раствора дадут белый осадок при обработке разбавленной соляной кислотой, а затем раствором хлорида бария?
(II) Какие два раствора дадут белый осадок при обработке разбавленной азотной кислотой, а затем раствором нитрата серебра?
(III) Какой раствор даст белый осадок при добавлении к нему разбавленной соляной или разбавленной серной кислоты?
(IV) Какой раствор приобретает глубокий/чернильно-синий цвет при добавлении к нему избытка гидроксида аммония?
(V) Какой раствор дает белый осадок при избытке раствора гидроксида аммония?
Ответ 14(I) Сульфат железа (II) и сульфат магния
(II) Хлорид железа (III) и хлорид цинка
(III) Нитрат свинца
(IV) ) нитрат меди.
(V) Нитрат свинца.
Вопрос 15Укажите изменения цвета, наблюдаемые при добавлении следующих индикаторов:
| Решение | Кислоты | Щелочи |
| (a) Щелочной раствор фенолфталеина (b) Раствор метилового оранжевого (c) Нейтральный раствор лакмуса |
| Решение | Кислоты | Щелочи |
| (a) Щелочной раствор фенолфталеина (b) Раствор метилового оранжевого (c) Нейтральный раствор лакмуса | Бесцветный Розовый Красный | Розовый Желтый Синий |
Соли A, B, C, D и E вступают в реакции с (i) по (v) соответственно. Определите анион, присутствующий в этих солях, на основе этих реакций.
(а) При добавлении раствора нитрата серебра к раствору А образуется белый осадок, нерастворимый в разбавленной азотной кислоте.
(b) При добавлении разбавленной соляной кислоты к B образуется газ, который превращает ацетат свинца в черную бумагу.
(c) При добавлении свежеприготовленного раствора сульфата железа к раствору С и осторожном приливании со стороны пробирки концентрированной серной кислоты образуется коричневое кольцо.
(d) При добавлении разбавленной серной кислоты к D образуется газ, который окрашивает подкисленный раствор дихромата калия из оранжевого в зеленый.
(e) Добавление разбавленной соляной кислоты к E приводит к вскипанию. Образовавшийся газ окрашивает известковую воду в молочный цвет, но не влияет на подкисленный раствор бихромата калия.
Ответ 16| Соль | Анион |
| А | Класс – |
| Б | С 2- |
| С | № 3 – |
| Д | SO 3 2- |
| Е | CO 3 2- |
Вопросы предыдущего года Практическая работа ICSE Class-10 Selina Solutions
Вопрос 2008
(a) Соль, которая в растворе дает бледно-зеленый осадок с раствором гидроксида натрия и белый осадок с раствором хлорида бария:
(i) Сульфат железа (III) (II) сульфат
(iii) Железа (II) хлорид (iv) Железа (III) хлорид
(b) Определите следующие вещества:
(i) Щелочный газ А, образующий густые белые пары с хлористым водородом.
(ii) Разбавленная кислота B, которая обычно не дает водорода при реакции с металлами, но дает газ при реакции с медью.
(iii) Газ C имеет неприятный запах тухлых яиц
(iv) Газ D — бесцветный газ, который можно использовать в качестве отбеливателя
(v) Жидкость E можно дегидратировать для получения этилена
Ответ 2008(a) (ii) Сульфат железа[II]
(b) (i) Газ A представляет собой газообразный аммиак.
(ii) Кислота B представляет собой азотную кислоту.
(iii) Газ C представляет собой сероводород.
(iv) Газ D представляет собой диоксид серы.
(v) Жидкость E представляет собой этанол.
Вопрос 2009(a) Углекислый газ и газообразный диоксид серы можно различить с помощью
(i) Влажной синей лакмусовой бумаги
(ii) Известковой воды
(iii) Подкисленный дихромат калия бумага
( iv) Ничего из вышеперечисленного
(b) Идентифицируйте вещество «R» на основании приведенной ниже информации:
Бледно-зеленое твердое вещество «R» становится красновато-коричневым при нагревании. Его водный раствор дает белый осадок с раствором хлорида бария. Осадок нерастворим в минеральных кислотах.
Его водный раствор дает белый осадок с раствором хлорида бария. Осадок нерастворим в минеральных кислотах.
(c) Приведите один химический тест, чтобы различать следующие пары соединений.
(i) Раствор сульфата цинка и раствор хлорида цинка.
(ii) Раствор хлорида железа (II). и раствор хлорида железа (III).
(iii) Раствор нитрата кальция. и раствор хлористого кальция.
Ответ 2009(a) (iii) Подкисленная бихроматно-калиевая бумага
(b) R – сульфат железа.
(c) (i) При добавлении раствора BaCl 2 к данному раствору ZnSO 4 дает белый ppt. сульфата бария, а не ppt. получается с раствором ZnCl 2 .
(ii) Когда к данному раствору добавляется раствор NaOH, хлорид железа (II) дает грязно-зеленый ppt. гидроксида железа, а красновато-коричневый ppt. гидроксида железа(III) получают из хлорида железа(III).
(iii) При добавлении раствора AgNO 3 к данному раствору раствор CaCl 2 дает белый ppt. , тогда как с раствором нитрата кальция изменений не наблюдается.
, тогда как с раствором нитрата кальция изменений не наблюдается.
(a) Выберите правильный ответ из A, B, C и D. сульфат
D Хлорид свинца (II).
(i) Соединение, ответственное за зеленый цвет, образующийся при барботировании SO 2 через подкисленный раствор бихромата калия.
(ii) Соединение, отвечающее за коричневое кольцо.
(б) Изложите свое наблюдение
(i) Кусок влажной синей лакмусовой бумажки.
(ii) Бумагу, пропитанную раствором перманганата калия, в каждом случае помещают в банку с диоксидом серы.
(c) Напишите уравнение реакции раствора сульфата магния с раствором хлорида бария.
Ответ 2010(a)
(i) C. Сульфат хрома
(ii) A. Нитрозосульфат железа (II)
(b) (i) Лакмус окрашивается в синий цвет , а затем получает отбеленный.
(ii) Бумага меняет цвет с розового на белый.
(c) MgSO 4 + BaCl 2 → MgCl 2 + BaSO 4
Вопрос 2011 90 035 (а) Выберите из списка веществ – ацетиленовый газ, фортис, кокс, латунь, хлорид бария, бронза, платина.
Водный раствор соли, используемый для тестирования сульфатного радикала
Ответ 2011(a) Хлорид бария
Вопрос 2012(a) Назовите газ, который окрашивает подкисленный раствор дихромата калия в зеленый цвет.
(b) Определите анион, присутствующий в следующих соединениях.
(i) Соединение X при нагревании с медной стружкой и конц. серная кислота выделяет красновато-коричневый газ.
(ii) При обработке раствора соединения Y раствором нитрата серебра образуется белый осадок, растворимый в избытке раствора гидроксида аммония.
(iii) Соединение Z, которое при взаимодействии с разбавленной серной кислотой выделяет газ, который делает известковую воду мутной, но этот газ не действует на подкисленный раствор дихромата калия.
(iv) Соединение L при взаимодействии с раствором хлорида бария дает белый осадок, нерастворимый в разбавленной соляной кислоте или разбавленной азотной кислоте.
(c) Укажите один химический тест между каждой из следующих пар:
(i) Карбонат натрия и сульфит натрия
(ii) Нитрат железа и нитрат свинца
(iii) Диоксид марганца и оксид меди (II)
(d) Изложите свое наблюдение: гранулы цинка добавляют в раствор сульфата меди.
(e) Приведите сбалансированное уравнение реакции: Раствор нитрата серебра и раствор хлорида натрия
Ответ 2012(a) Диоксид серы
(b) (i) Нитрат-ион, NO 3 – (ii) Ион хлора, Cl 007 (iii) Карбонат-ион, CO 3 2 –
(iv) Сульфат-ион, SO 4 2-
(c)
(i) При добавлении разб. серной кислоты в карбонат натрия выделяется бесцветный газ без запаха, который не действует на подкисленную бихроматно-калиевую бумагу.
Na 2 CO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 O + CO 2
Сульфит натрия при добавлении разб. серная кислота выделяет бесцветный газ с запахом горелой серы и окрашивает подкисленную бихроматно-калиевую бумагу из оранжевой в зеленую.
Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 9038 9 O + SO 2
K 2 Cr 2 O 7 + 3SO 2 + H 2 SO 4 → K 2 SO 4 + Cr 2 (SO 9038 8 4 ) 3 + H 2 O
(оранжевый ) (Зеленый)
(ii) Реакция нитрата железа с небольшим количеством NaOH дает грязно-зеленый осадок, нерастворимый в избытке. Нитрат свинца при взаимодействии с небольшим количеством NaOH дает белый осадок, растворимый в избытке.
Нитрат свинца при взаимодействии с небольшим количеством NaOH дает белый осадок, растворимый в избытке.
(iii) Добавить немного разбав. серную кислоту до оксида меди и диоксида марганца и осторожно нагревают. Оксид меди вступает в реакцию с образованием синего раствора сульфата меди. Диоксид марганца дает бесцветный раствор.
CuO + h3SO 4 → CuSO 4 + H 2 O
(синий)
MnO 2 + 2H 9038 8 2 SO 4 → MnSO 4 + 2H 2 O
(Бесцветный)
(d) Виден синий цвет выделений раствора медного купороса и красновато-коричневый слой меди.
(e) AgNO 3 + NaCl → AgCl + NaNO 3
Вопрос 2013(a) Проведите химический тест, чтобы отличить
( i) Раствор хлорида натрия. и раствор нитрата натрия.
(ii) Газообразный хлороводород и газообразный сероводород
(iii) Раствор нитрата кальция..png) и раствор нитрата цинка.
и раствор нитрата цинка.
(iv) Газообразный диоксид углерода и газообразный диоксид серы
(b) Какое из следующих веществ не образует кислоту при взаимодействии с водой?
(i) Монооксид углерода (ii) Диоксид углерода
(iii) Диоксид азота (iv) Триоксид серы
Ответ 2013(a)
(i) Добавить серебро нитратного раствора к обоим растворам. Хлорид натрия образует творожистую белую массу, в то время как нитрат натрия не вступает в реакцию.
(ii) Газообразный хлористый водород дает густые белые пары хлорида аммония, когда раствор аммиака в стеклянной палочке находится рядом с парами кислоты, тогда как в случае газообразного сероводорода белых паров не наблюдается.
(iii). Нитрат кальция не образует ppt. даже при добавлении избытка NH 4 OH, тогда как нитрат цинка образует белую желеобразную массу. который растворяется в избытке NH 4 OH.
(iv) Углекислый газ не действует на подкисленный KMnO 4 или K 2 Cr 2 O 7 , но диоксид серы превращает перманганат калия из розового в бесцветный.
(b) (i) Окись углерода
Вопрос 2014(a) Проведите различие между
нитратом натрия и сульфитом натрия [с использованием разбавленной серной кислоты]
(b) Изложите свое наблюдение: когда влажную йодкрахмальную бумагу помещают в газообразный хлор.
(c) Испытание пламенем с солью P дало пламя кирпично-красного цвета. Какой катион в P?
(d) Газ Q окрашивает влажную бумагу из ацетата свинца в серебристо-черный цвет. Определите газ Q.
(e) рН жидкости R равно 10. Что за вещество такое R?
Ответ 2014(a) Нитрат натрия при обработке разбавленной серной кислотой дает бисульфат натрия и азотную кислоту.
NaNO 3 + H 2 SO 4 → NaHSO 4 + HNO 3
Сульфит натрия при обработке с разбавленной серной кислотой дает сульфат натрия и диоксид серы.
Na 2 SO 3 + H 2 SO 4 → Na 2 SO 4 + H 2 90 389 О + SO 2
(b) Когда влажную йодкрахмальную бумагу вводят в газообразный хлор, хлор окисляет йодид до йода, который в комплексе с крахмалом проявляется синим цветом.


 Мы предоставили это бесплатно.
Мы предоставили это бесплатно.

 Таким образом, в процессе поддержания уровня точности вопросов, связанных с практической работой, студенты могут обращаться к Selina Chemistry Solutions.
Таким образом, в процессе поддержания уровня точности вопросов, связанных с практической работой, студенты могут обращаться к Selina Chemistry Solutions.



