Практикум по химии 10 класс
Практическая работа №1.
Практическая работа № 2.
Практическая работа №1.
Цель: распознать органические вещества с помощью качественных реакций.
С правилами ТБ ознакомлен(-а). Роспись.
В вашем распоряжении имеется спиртовка и набор реактивов:
1) водный раствор NаОН;
2) Н2SO4 разбавленная;
3) водный раствор Nа2С03;
4) водный раствор КМn04;
5) бромная вода;
6) водный раствор СuSO4;
7) аммиачный раствор оксида серебра;
8) вода.
В двух пробирках содержатся следующие вещества:
1. а) глюкоза;
2. а) уксусная кислота;
3. а) глюкоза;
С помощью минимального числа реагентов (указанных в начале работы) определите содержимое в каждой паре пробирок. Напишите уравнения соответствующих реакций.
Работу оформите по следующему образцу:
1. Распознавание глюкозы и сахарозы2. Распознавание уксусной кислоты и этилового спирта
3. Распознавание глюкозы и глицерина
Сделайте общий вывод

Характеристика некоторых органических веществ
1.Метан | Бесцветный газ без запаха, химическая формула — CH4. Малорастворим в воде, легче воздуха. При использовании в быту, промышленности в метан обычно добавляют одоранты (обычно меркаптаны) со специфическим «запахом газа». |
2.Этилен | Бесцветный горючий газ со слабым запахом. Частично растворим в воде. Наркотик. Формула С2Н4. |
3.Ацетилен | Ненасыщенный углеводород, C2H2, бесцветный газ, малорастворим в воде, легче воздуха. При сжатии разлагается со взрывом, хранят в баллонах, заполненных активированным углем, пропитанным ацетоном, в котором ацетилен растворяется под давлением в больших количествах. Взрывоопасный. Нельзя выпускать на открытый воздух. |
4.Метанол | Бесцветная ядовитая жидкость с запахом, напоминающим запах этилового спирта, но более слабым, с воздухом образует взрывоопасные смеси, смешивается в любых соотношениях с водой и большинством органических растворителей. Горит синеватым пламенем CH3-OH |
5.Бензол | C6H6, бесцветная жидкость с своеобразным резким запахом. Входит в состав бензина, широко применяется в промышленности, является исходным сырьём для производства лекарств, пластмасс, резины, красителей. Токсичен, канцерогенен. С воздухом образует взрывоопасные смеси, хорошо смешивается с эфирами, бензином и другими органическими растворителями. |
6. Этанол | Одноатомный спирт с формулой CH3-CH2-OH, летучая, горючая, бесцветная прозрачная жидкость. |
7. Метаналь (формальдегид) | Бесцветный газ с резким запахом, хорошо растворимый в воде, спиртах и полярных растворителях, токсичен. Формула: HCOH |
8. Этаналь | Бесцветная жидкость с резким запахом, хорошо растворяется в воде, спирте, эфире. Формула: CH3-CHO. Ацетальдегид токсичен при действии на кожу, и, возможно, канцероген. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. |
9.Муравьиная кислота | Бесцветная жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом. При контакте с кожей 100 %-ная жидкая муравьиная кислота вызывает сильные химические ожоги. Попадание даже небольшого её количества на кожу причиняет сильную боль, поражённый участок сначала белеет, как бы покрываясь инеем, потом становится похожим на воск, вокруг него появляется красная кайма. Формула: HCOOH |
10. Уксусная кислота | Органическое вещество с формулой CH3COOH, бесцветная жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многими растворителями; в уксусной кислоте хорошо растворимы органические соединения и газы. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты». |
11. Бензойная кислота | C6H5СООН — простейшая одноосновная карбоновая кислота ароматического ряда. Бесцветные кристаллы, плохо растворимые в воде, хорошо — в этаноле и диэтиловом эфире. Бензойная кислота является, подобно большинству других органических кислот, слабой кислотой. |
12. Этиленгликоль | Простейший представитель многоатомных спиртов с формулой HO-CH2-CH2-OH, прозрачная бесцветная жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом. Токсичен. Попадание этиленгликоля или его растворов внутрь организма человека может привести к необратимым изменениям в организме и к летальному исходу |
13. Глицерин | Химическое соединение с формулой HOCH2-CH(OH)-CH2OH; бесцветная, вязкая, гигроскопичная жидкость, неограниченно растворимая в воде. Сладкий на вкус, отчего и получил своё название (гликос — сладкий). Хорошо растворяет многие вещества. |
14. Глюкоза | Бесцветное кристаллическое вещество сладкого вкуса, растворимое в воде и органических растворителях. Глюкозу используют при интоксикации, вводят внутривенно, так как она является универсальным антитоксическим средством. С6Н12О6. |
15. Сахароза | C12H22O11. Бесцветные кристаллы. При застывании расплавленной сахарозы образуется аморфная прозрачная масса — карамель. Сахароза является весьма распространённым в природе дисахаридом, она встречается во многих фруктах,плодах и ягодах. |
16. Крахмал | (C6H10O5)n. Безвкусный, аморфный порошок белого цвета, нерастворимый в холодной воде. Под микроскопом видно, что это зернистый порошок; при сжатии порошка крахмала в руке он издаёт характерный «скрип», вызванный трением частиц. В горячей воде набухает (растворяется), образуя коллоидный раствор — клейстер; с раствором йода образует соединение-включение, которое имеет синюю окраску. В воде, при добавлении кислот (разбавленная H2SO4 и др.) как катализатора, постепенно гидролизуется. При действии ферментов или нагревании с кислотами подвергается гидролизу. |
17. Анилин | Соединение с формулой C6H5NH2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. |
18. Аминокислоты | Бесцветные кристаллические вещества, хорошо растворимые в воде. Многие из них обладают сладким вкусом. |
Практическая работа №2.
«Распознавание пластмасс и волокон»
Цель: распознать органические вещества с помощью качественных реакций.
С правилами ТБ ознакомлен(-а). Роспись.
Оборудование и реактивы: образцы пластмасс и волокон под номерами, спиртовка, спички, стеклянные палочки, тигельные щипцы, асбестовые сетки.
Ход работы:
1. Распознавание пластмасс
В разных пакетах под номерами имеются образцы пластмасс. Пользуясь при веденными ниже данными, определите, под каким номером какая пластмасса находится.
Полиэтилен. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит сине ватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пла менем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса. Темных тонов (от коричневого до чер ного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
2. Распознавание волокон
В разных пакетах под номерами содержатся образцы волокон. Пользуясь приведенными ниже данными, определите, под каким номером какое волокно находится.
Хлопок. Горит быстро, распространяя запах жженой бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк. Горит медленно, с запахом жженых перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно. Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
Оформление работы:
Цвет, внешний вид.Горит или нет. Характер горения. Запах.
Вывод
1. Распознавание пластмасс
1.
2.
2. Распознавание волокон
1.
2.
Общий вывод: на какие группы делятся пластмассы? волокна?
10 класс
Лабораторные опыты
Тема лабораторного опыта
Инструкция
Л.о. №1. Изготовление моделей молекул углеводородов
Модель молекулы метана. Соберите модель молекулы метана, используя для этого заводской набор моделей атомов. Если он в школе отсутствует, соберите ее из пластилиновых шариков. Для этого из пластилина светлых тонов изготовьте четыре небольших шарика, а из пластилина темных тонов — один шарик, который примерно в два раза больше предыдущих. В качестве стержней можно использовать спички. Учтите, что в молекуле метана угол между химическими связями С—Н составляет 109°, т. е. молекула имеет тетраэдрическое строение (см. рис. 11 на с. 25).
Модели молекул бутана и изобутана. Соберите модель молекулы н-бутана, используя для этого заводской набор моделей атомов или пластилин. Аналогично соберите модель молекулы изобутана. Учтите, что в бутане атомы углерода расположены по отношению друг к другу под углом 109°, т. е. углеродная цепь должна иметь зигзагообразное строение. В молекуле изобутана все связи центрального атома углерода направлены к вершинам правильного тетраэдра. Сравните строение этих углеводородов.
Л.о. №2. Обнаружение непредельных соединений в жидких нефтепродуктах
Выданные вещества разделите на две части и исследуйте их отношение к растворам иода и перманганата калия. Наблюдайте за изменением окраски растворов. Внесите наблюдения в таблицу и сделайте выводы.
Л.о. №3. Получение и свойства ацетилена | В пробирку налейте около 1 мл воды и поместите в нее кусочек карбида кальция величиной со спичечную головку. Быстро закройте пробирку пробкой с газоотводной трубкой и выделяющийся газ пропустите в другую пробирку с раствором перманганата калия. Что наблюдаете? О чем свидетельствует изменение окраски раствора? Запишите уравнения проведенных реакций. |
Л.о. №4. Свойства этилового спирта |
|
Л.о. №5. Свойства глицерина |
|
Л.о. №6. Свойства формальдегида |
|
Л.о. №7. Свойства уксусной кислоты |
|
Л.о. №8. Свойства жиров |
3. Практически докажите, что в состав выданного вам растительного жира входят остатки непредельных кислот. Объясните свои действия. |
Л.о. №9. Свойства глюкозы |
|
Л.о. №10. Свойства белков |
|
infourok.ru
Практическая работа №2 по химии 10 класс
Урок №16. Практическая работа № 2. Получение этилена и изучение его свойств.
Инструкция по выполнению практической работы
1. Загрузите и внимательно просмотрите видео – опыты
«Получение этилена, опыты с ним»
«Горение этилена»
«Взаимодействие этилена с бромной водой»
«Взаимодействие этилена с раствором перманганата калия»
2. Оформите отчёт на двойном листе в клетку
3. Сдайте отчёт на проверку учителю
Цель работы:
Получить этилен путём нагревания смеси этилового спирта с концентрированной серной кислотой и изучить его свойства.
Реактивы и оборудование:
Прибор для получения газов, водный раствор перманганата калия, раствор брома в воде (бромная вода), реакционная смесь этилового спирта и серной концентрированной кислоты (1:3), спиртовка, спички.
Ход работы:
1. Получение этилена
Получите готовую реакционную смесь у учителя. Соберите прибор для получения газов.
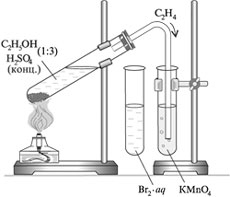
Осторожно, равномерно нагрейте смесь.
Внимание!!!
Соблюдайте осторожность. Вы работаете с концентрированной серной кислотой.
2. Окисление этилена кислородом перманганата калия
Пропустите выделяющийся газ в пробирку с водным раствором перманганата калия, подкисленного серной кислотой.
3. Взаимодействие этилена с бромной водой
Выделяющийся этилен пропустим через раствор брома в воде, который называют бромной водой.
4. Окисление этилена кислородом воздуха (горение)
Поверните газоотводную трубку отверстием вверх и подожгите выделяющийся газ.
5. Оформите работу в тетради в виде таблицы:
Название опыта, рисунок
Ваши наблюдения
Уравнение реакции, выводы
1
Какой газ выделяется?
Закончите уравнение реакции:
CH3-CH2-OH t>140°C, h3SO4(конц.)→
Укажите тип реакции, назовите продукты реакции?
2
Что происходит с раствором марганцовки?
Закончите уравнение реакции:
CH2=CH2 + [O] + H2O KMnO4→
Назовите продукты и тип реакции?
3
Что происходит с бромной водой?
Закончите уравнение реакции:
CH2=CH2
Назовите продукты и тип реакции?
4
Почему этилен горит более светящимся пламенем, чем этан?
Закончите уравнение реакции:
C2H4 + O2 t →
Назовите тип реакции и продукты?
5. Вывод: (из цели)
infourok.ru
Практическая работа по химии №4 10 класс
Конспект урока по органической химии
Практическая работа №4 «Решение экспериментальных задач по органической химии»
Класс:10 Дата_____
УМК: Рудзитис Г.Е., ФельдманФ.Г.
Цель:1)закрепить и применить знания курса химии в области химических свойств кислородосодержащих органических веществ;
2)оценить уровень овладения экспериментальными умениями.
Задачи:
-образовательные:
1)обобщить и систематизировать знания по классам «Кислоты», «Спирты» через экспериментальные задачи;
2)научить учащихся применять знания по качественному анализу на распознавание органических веществ;
3)закрепить умения по составлению уравнений реакций по качественному распознанию органических веществ;
4)закрепить знания правил поведения в химическом кабинете, при выполнении работы.
-развивающие:
1)развивать умения учащихся выполнять конкретные задачи по органической химии;
2)формировать умения у учащихся извлекать нужную информацию при слушании, умения повторять за учителем практические действия.
-воспитательные:
воспитывать у учащихся аккуратность, четкость при выполнении эксперимента, организации рабочего места;
воспитание навыков сотрудничества и коммуникабельности при работе в группе:
повышение уровня бытовой химической грамотности.
Оборудование: штатив с пробирками, держатель, спиртовка, химический стакан, спички, растворы реактивов: C₂H₂O₄,C₆H₅OH,CH₃COOH,C₂H₅OH, CH₃–(CH₂)₇–CH₌ CH− (CH₂)₇– CH₃– COOH, C₃H₈O₃, таблица «Качественные реакции»
Вид урока: закрепление знаний, умений, навыков.
Форма: урок применения знаний.
Тип урока: практическая работа
Методы: химический эксперимент, словесный, наглядный.
Методы контроля и самоконтроля: устный, письменный, наблюдение.
Методы организации деятельности: репродуктивный, самостоятельная работа, химический эксперимент.
Планируемые результаты:
— знать ПТБ при работе в химическом кабинете, методы и приемы обращения с реактивами, классификацию и качественные реакции органических веществ, их признаки.
-уметь обращаться с лабораторным оборудованием, составлять уравнения реакций, грамотно выстраивать четкую последовательность при качественном определении органического вещества, наблюдать и делать выводы.
Образовательные технологии: беседа, самостоятельная работа, технология практико- ориентированного обучения.
Ход урока:
1. Организация и мотивация учащихся
2. Актуализация знаний:(Подготовка учащихся к усвоению материала, актуализация учащимися собственных знаний.)
Сегодня на уроке мы должны применить теоретические знания и умения для решения практических задач. Знаний у вас достаточно, чтобы применять их для решения реальных задач повседневной жизни и доказать, что вы умеете ориентироваться в полученной информации, обращаться с химическими веществами, окружающими вас в быту.
Вспомним ПТБ при работе в кабинете, с органическими веществами.
Объявляю тему, цель урока. Практическая работа №4 «Решение экспериментальных задач по распознаванию органических веществ».
Открываем учебник на странице 120. Вам предстоит решить практически задачу2 и3 .
Аспект: целеполагание и планирование деятельности
Для успешного решения каждой задачи надо продумать все возможные пути решения, но не забывайте, что у нас практическая работа. Органические вещества имеют специфические свойства: запах, цвет, поэтому один из путей может быть визуальным или органолептическим.
Напоминаю об оформлении практической работы, необходимых записях в тетрадях для практических работ.
Для подтверждения полученных результатов определения органических веществ нам поможет таблица
3. Овладение содержанием учебного материала
Задание: Прочтите внимательно задачу и предложите последовательные шаги по решению данной задачи.
Интересные факты о веществах: все эти вещества находят применение в медицине. Фенол используют для производства препарата от туберкулеза, этиловый спирт для производства настоек, обработки медицинского инструментария, глицерин входит в состав мазей. В пищевой промышленности глицерин под кодом Е-422.
Все вещества в больших концентрациях ядовиты!
Задача №2
Задача: Какие сходства и особенности для веществ: C₆H₅OH, C₂H₅OH, C₃H₈O₃
Модельный ответ к задаче №2Возможные варианты взаимопревращений:
Дано:
фенол
этиловый спирт
глицерин
Определить-?
Решение: Возможные варианты взаимопревращений
Во все пробирки приливаем FеCL₃ (хлорид железа(III). С фенолом
появится фиолетовое окрашивание с образованием фенолята железа(III)- качественная реакция на фенол . К двум оставшимся растворам приливаем Cu(OH)2 (гидроксид меди (II).В случае образования раствора темно-синего цвета свидетельствует о образовании комплексного соединения глицерата меди(II) – качественная реакция на глицерин..
Методом исключения остается этиловый спирт.
Задача №3
Задание: Прочти внимательно задачу №3 и предложи последовательные шаги по решению данной задачи.
Интересные факты о веществах: уксусная кислота – одна из самых древних кислот ,которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты. Щавелевая кислота содержится в щавеле, соли – оксалаты- в ревене, продукты питания с щавелевой кислотой и её солями необходимо включать в рацион питания для полноценного функционирования сердечно — сосудистой системы.
Задача: Какие сходства и особенности для веществ: :
C₂H₂O₄,CH₃COOH, CH₃–(CH₂)₇–CH₌ CH− (CH₂)₇– CH₃– COOH
Модельный ответ к задаче №3
Дано:
Щавелевая кислота
Уксусная кислота
Олеиновая кислота
Определить-?
Решение: Возможные варианты взаимопревращений
Щавелевая кислота среди предложенных веществ является двухосновной, слабой, термически неустойчивой. При нагревании всех образцов, только в случае, где щавелевая кислота, будет выделение углекислого газа CO
₂, который легко доказать с помощью помутнения известковой водыCa(OH)2 + CO2 = CaCO3(белый осадок) + h3O.
В две оставшие пробирки с растворами приливаем KMnO₄, перманганат калия, обесцвечивание раствора –качественная реакция на наличие кратных связей в веществе – в нашем случае в олеиновой кислоте.
Методом исключения остается уксусная кислота
4. Рефлексия
Оценка собственного продвижения (рефлексия)
Указывает на сильные и слабые стороны своей деятельности
Определите сильные и слабые стороны собственного продвижения в изучении темы «Классы кислородсодержащих органических соединений»
Умею (сильная сторона)
Не умею (слабая сторона)/ надо повторить
Закрепление знаний
Экспресс – опрос
5. Итог урока и Д/З Что запомнили? Что поняли? Чему научились? Самооценка, взаимооценка, оформить записи в тетрадях для практических работ.
Домашнее задание: повторить качественные реакции на распознавание органических в-в.
Выставление оценок после проверки практических тетрадей.
infourok.ru
Инструктивные карточки по химии для проведения практических работ 10 класс
ИНСТРУКТИВНЫЕ КАРТОЧКИ
практических работ
по химии
10 класс
Автор: учитель высшей категории
Артемьева В.И.
МКОУ «Школа № 38»
Нижний Новгород, 2018
Инструктивная карточка
Практическая работа.
«Углеводы»
Обнаружение глюкозы в меде.
Техника безопасности: Все вопросы рассматриваются по таблице «Правила по технике безопасности в кабинете химии»
Цель: Доказать с помощью качественных реакций присутствие глюкозы в меде.
Ход работы: В пробирке смешайте смешайте 2 мл раствора меда и 1 мл раствора гидроксида натрия, затем по каплям добавьте раствор сульфата меди(II). Образующийся в начале голубой осадок гидроксида меди(II) при встряхивание растворяется получается синий прозрачный раствор комплексного алкоголята (сахарата) меди (II).
Пробирку закрепите в пробиркодержателе и держа над пламенем спиртовки, осторожно прогрейте верхний слой синего раствора до изменения.
Как изменяется окраска? Какая происходит реакция в этом случае?
Примечание: Образование синего раствора при взаимодействии глюкозы с гидроксидом меди (II) при комнатной температуре доказывает присутствие в молекуле глюкозы несколько гидроксидных групп. При нагревании происходит окисление, характерное для альдегидов.
Инструктивная карточка
Практическая работа
«Углеводы»
Проверка качества натурального меда.
Техника безопасности: Все вопросы рассматриваются по таблице «Правила по технике безопасности в кабинете химии»
Цель: Доказать с помощью качественных реакций качества натурального меда.
Ход работы: В состав меда входит фруктоза и лактоза в виде 80-85%-ного раствора. В меде содержится также незначительное количество муравьиной кислоты, белков и воска. Прозрачность меда зависит от содержанием в нем воска: чем воска меньше, тем мед прозрачнее. В загустевшем прозрачном меде образуются мелкие кристаллы, в первую очередь фруктозы. Если при растворение меда в воде раствор получается мутным, это означает, что в меде много воска.
Мед примерно в 1,5 раза тяжелее воды ( плотность 1,40-1,44 г/см3)
Для определения чистоты натурального меда можно провести опыты.
Опыт 1
2 г меда растворите в 20 мл воды. Отфильтруйте и разделите части: в первую пробирку добавьте раствор нитрата серебра, во вторую — раствор хлорида бария. Вам понятны химические реакции, которые вы наблюдали?
Натуральный мед не дает осадков с этими реактивами.
Опыт 2
3 г меда растворите в 10 мл воды. Разделите полученный раствор на 2 части. В первую пробирку добавьте 1 мл нашатырного спирта (раствор аммиака в воде), во вторую — несколько капель концентрированной соляной кислоты.
Появление окраски свидетельствует о том что в меде есть органические краситель. Натуральный мед их не содержит.
Опыт 3
3 г меда растворите в 10 мл воды. В полученный раствор добавьте несколько капель йодной текстуры ( спиртового раствора йода)
Появление синего окрашивания свидетельствует о содержание в меде крахмала (его иногда добавляют в мед для придания густоты)
Вопросы:
Что вы наблюдаете
объясните появление синего окрашивания?
Инструктивная карточка
Практическая работа
«Белки»
Исследование пищевых продуктов.
Определение свежести мяса.
Техника безопасности: Все вопросы рассматриваются по таблице «Правила по технике безопасности в кабинете химии»
Цель работы: определение сероводорода.
Ход работы: В раствор нитрата свинца (II) (4%-ного) приливают 30%-ный раствор гидроксида калия до растворения образующегося белого осадка. В небольшой химический стакан кладут кусочек испытуемого мяса. Стакан покрывают фильтровальной бумагой, которую в середине пропитывают 2-3 каплями полученного реактива. В случае присутствия сероводорода, через 10-15 минут на бумаге, где был нанесён реактив, появится бурое пятно. Это указывает на выделение сероводорода, который образуется при гниении мяса.
Вопросы:
Какое вещество образовалось при взаимодействии H2S с реактивом?
Напишите уравнение реакций.
Какие качественные реакции на ион S2-используются в аналитической химии?
Определение свежести рыбы.
Опыт 1. Испытание индикаторной бумагой.
В теле рыбы делают глубокий надрез, в который помещают индикаторную бумагу, смоченную в дистиллированной воде. Бумагу прижимают стеклянной палочкой. Свежая и мороженная рыба имеют нейтральную или слабокислую реакцию. Если реакция щелочная или сильно кислая, это означает, что рыба недоброкачественная.
Опыт 2. Проба на сероводород.
Кусочек испытуемой рыбы кладут в пробирку, в которую опускают полоску фильтровальной бумаги, смоченную раствором ацетата свинца (бумага не должна касаться кусочка рыбы). Пробирку слегка прикрывают корковой пробкой. Если в течение 125 минут бумага потемнеет, то рыба считается испорченной.
Опыт 3.
В большую круглодонную колбу с отводной трубкой налейте 15-20 мл селёдочного рассола, добавьте 6-7 мл концентрированного раствора едкого натра. К отводной трубке колбы поднесите влажную лакмусовую бумажку. Поднесите стеклянную палочку, смоченную конц. HCl образуется белое облачко хлороводороных солей аминов. Поджигают пары аминов у отводной трубки, они горят бледным пламенем. Пропускают пары в раствор хлорида железа (III), образуется осадок гидроксида железа (III).
Вопросы:
Почему темнеет бумага в опыте?
Напишите уравнение реакции.
Что происходит с лакмусовой бумажкой в опыте 3?
Инструктивная карточка
Практическая работа
«Обнаружение витаминов»
Техника безопасности: Все вопросы рассматриваются по таблице «Правила по технике безопасности в кабинете химии»
Цели: закрепить знания учащихся о качественных реакциях неорганических соединений; отработать навыки экспериментального определения качественного состава неорганических веществ.
Реактивы и оборудование:
Подсолнечное масло, хлорид железа (III), яблочный сок, крахмальный клейстер, рыбий жир, бром.
Определение витамина А в подсолнечном масле.
В пробирку налейте 1 мл подсолнечного масла и добавьте 2-3 капли 1% раствора хлорида железа (III). Что вы наблюдаете?
Определение витамина С в яблочном соке.
В пробирку налейте 2 мл сока и добавьте воды на 10 мл. Затем влейте немного крахмального клейстера. Далее по каплям добавляйте 5% раствор йода до появления устойчивого синего окрашивания, не исчезающего 5-10 с.
Молекулы аскорбиновой кислоты легко окисляются йодом. Как только йод окислит всю аскорбиновую кислоту, следующая же капля, прореагировав с крахмалом, окрасит раствор в синий цвет.
Определение витамина D в рыбьем жире или курином желтке.
В пробирку с 1 мл рыбьего жира прилейте 1 мл раствор брома. Что вы наблюдаете?
Инструктивная карточка
Практическая работа.
«Решение экспериментальных задач»
Исследование состава молока
Цель работы: Исследовать состав молока (разделить молоко на составные части, исследовать их). Молоко содержит сразу три ценных питательных вещества: 1) жир; 2) белок- — казеин; 3) углевод — лактозу (восстанавливающий дисахарид, со-стоящий из двух гексоз — глюкозы и галактозы).
Оборудование: Колба коническая (2 шт.), химический стакан на 400 мл, воронка, фильтровальная бумага, марля, горелка, пробирки.
Реактивы: молоко, уксусная кислота, карбонат кальция (мел), азотная кислота (конц.), растворы гидроксида натрия (т= 10%), сульфата меди (II) (ш =2%).
Порядок работы:
1. Налейте в колбу 40 мл молока. Для отделения белка прилейте несколько капель уксусной кислоты. При этом казеин сворачивается и образует творожистый осадок (творог).
2. Натяните на стакан марлю, сложенную в четыре слоя, и отфильтруйте через нее казеин. Собранный в марле казеин немного отожмите над стаканом и промойте его через марлю струей воды.
3. Фильтрат в стакане содержит лактозу и уксусную кислоту. Чтобы нейтрализовать кислоту, добавляйте понемногу мел и перемешивайте содержимое стакана до тех пор, пока не перестанет выделяться газ (уравнение реакции?).
4. Профильтруйте раствор через бумажный фильтр в колбу. Докажите, что фильтрат содержит углевод лактозу (разделите раствор на порции и проведите качественные реакции).
5. Теперь вернемся к казеину. Поместите немного белка в пробирки и проведите ка-чувственные реакции на белок.
Обнаружение этанола в кефире, молочной сыворотке.
Лактоза молока при гидролизе образует β-галактозу и глюкозу. Последняя под влиянием ферментов дрожжей может сбраживаться, окисляться до этилового спирта и оксида углерода (IV):
Для открытия этанола кефир и молочную сыворотку фильтруют. В пробирки наливают по 5 капель фильтрата кефира и молочной сыворотки и добавляют по 5 капель 10%-ного раствора гидроксида натрия, а также несколько капель раствора йода в йодиде калия. В присутствии этанола жидкость мутнеет, появляется запах йодоформа.
Вопросы:
1. Что вы наблюдаете?
2. Напишите уравнения реакций?
Докажите что лактоза восстанавливающий дисахарид.
Инструктивная карточка
Практическая работа
« Решение экспериментальных задач»
Распознавание пластмасс
НазваниеХарактер горения
1. . Полиэтилен
Легче воды, жирный на ощупь, при нагревании быстро размягчается, горит голубым пламенем, запах расплавленного парафина.
2. Полихлорвинил (винилхлорид)
Горит в пламени с обильным выделением копоти. При нагревании в пробирке отщепляется хлороводород.
3. Политетрафторэтилен
Жирный на ощупь, матового цвета, напоминает воск, не горит, плавится лишь в сильном пламени.
4. Полистирол
Легко размягчается при нагревании, горит коптящим пламенем, выделяя запах стирола, хрупкий, изделия при постукивании звенят.
5. Органическое стекло
Нехрупкий, изделия из него при постукивании не звенят, горит голубым пламенем без копоти с характерным потрескиванием.
6. Фенолформальдегидные
Обычно темного цвета, не плавится, горит только в пламени.
7. Аминопласты
Не плавятся, разлагаются при нагревании с выделением неприятного запаха аммиака и аминов. Горят в пламени с трудом, при это обугливаются.
Инструктивная карточка
Практическая работа
Решение экспериментальных задач
Определение волокон
НазваниеХарактер горения
1. Вискозное
Горит быстро, запах жженой бумаги. После горения остаются следы золы.
2. Ацетатное
Горит быстро, образуя нехрупкий спекшийся шарик темно-бурого цвета.
3. Хлопчатобумажное
Горит быстро, запах жженой бумаги. После горения остается серый пепел.
4. Шелк натуральный, шерсть
Горит медленно, запах жженых перьев. После горения остается хрупкий шарик черного цвета, растирающийся в порошок.
5. Капрон
Плавится, образуя твердый блестящий шарик темного цвета, распространяя неприятный запах.
6. Лавсан
Горит коптящим пламенем, образуя темный блестящий шарик.
7. Нитрон
Горит, образуя темный рыхлый неблестящий шарик.
8. Хлорин
Горит небольшим коптящим пламенем, образуя черный хрупкий шарик. Вне пламени не горит.
infourok.ru
Урок по химии в 10 классе «Практическая работа «Получение этилена и изучение его свойств»
10 класс
Урок № 33.
Тема урока: Практическая работа №2
«Получение этилена и изучение его свойств».
Цели и задачи урока:
Образовательные: экспериментально повторить получение и химические свойства алкенов на примере этилена;
Развивающие: развивать у учащихся умение сравнивать, анализировать и применять информацию из других областей знаний, развивать коммуникативные способности, умение предъявлять результаты групповой деятельности.
Воспитательные: способствовать воспитанию у учащихся активной жизненной позиции.
Здоровьесберегающие технологии: следить за осанкой учащихся; проводить упражнения для снятия напряжения глаз; проветривание помещения.
Оборудование: ИКТ
Ход урока:
Организационный момент.
Проверка знаний: Проверочная работа по темам «Получение и химические свойства Алкенов»
.
Основная часть.
Практическая работа №2 №Получение этилена и изучение его свойств»
Стр 299
Название опытаХод работы
наблюдения
Уравнения реакции и выводы
Получение этилена
В пробирку помещаем 2 мл конц. серной кислоты, 1 мл этилового спирта и несколько крупинок оксида алюминия (Аl2O3)
Закрываем пробирку пробкой с газоотводной трубкой и нагреваем пробирку в пламени горелки.
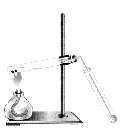
Выделяется газ
H2SO4 (конц)
CH3 – CH2 – OH CH2 = CH2 + H2O
этанол этен
Вывод: Концентрированная серная кислота забирает воду из молекулы спирта и в результате образуется этилен.
Этен в лаборатории можно получить
1) дегидратацией спиртов (см. выше),
2) дегидрогалогенированием галогенэтана спиртовым раствором щелочи
спирт
CH3–CH2Br + KOH CH2 = CH2 +H2O+KBr
3) дегидрогалогенированием дигалогенэтана
BrCH2–CH2Br + Mg CH2 = CH2 +MgBr2
Этен в промышленности получают:
крекингом бутана
крекинг
CH3–CH2–CH2–CH3 CH2=CH2 + CH3 — CH3
бутан этен этан
2) дегидрированием этана
CH3 – CH3 CH2 = CH2 + H2
этан этен
Изучение свойств этилена
Выделяющийся газ пропускаем в отдельные пробирки с бромной водой и раствором перманганата калия, подкисленным серной кислотой.
Подожгем газ у конца газоотводной трубки
бромная вода и раствор перманганата калия быстро обесцвечиваются
Этен горит светящимся пламенем
Обесцвечивание бромной воды и раствора перманганата калия доказывает наличие в этене двойной связи:
CH2 = CH2 +Br2 BrCH2–CH2Br
этен 1,2-дибромэтан
Происходит окисление этилена бромной водой по двойной связи.
5С2Н4 + 12KMnO4 + 18H2SO4 = 12MnSO4 + 6K2SO4 + 10CO2↑ + 28H2O
Раствор KMnO4 обесцвечивается.
Этен горит ярким светящимся пламенем, это отличает его от этана, который горит несветящимся пламенем
С2Н4 + 3О2  2СО2 + 2Н2О
2СО2 + 2Н2О
Д/з: §12 повторить, задачи 5,6 из карточки
Практическая работа №2 «Получение этилена и изучение его свойств»
Название опытаХод работы
наблюдения
Уравнения реакции и выводы
Получение этилена
В пробирку помещаем 2 мл конц. серной кислоты, 1 мл этилового спирта и несколько крупинок оксида алюминия (Аl2O3)
Закрываем пробирку пробкой с газоотводной трубкой и нагреваем пробирку в пламени горелки.

Выделяется газ
Изучение свойств этилена
Выделяющийся газ пропускаем в отдельные пробирки с бромной водой и раствором перманганата калия, подкисленным серной кислотой.
Подожгем газ у конца газоотводной трубки
бромная вода и раствор перманганата калия быстро обесцвечиваются
Этен горит светящимся пламенем
infourok.ru
Тетрадь для лабораторных и практических работ по химии 10 класс (базовый уровень).
учени 10 класса
_____________________________
Лабораторные опыты
Лабораторный опыт №1 Дата _________
Определение элементарного состава органических соединений
Цель: научиться определять элементарный состав органических веществ.
Оборудование и реактивы: химический стакан, парафиновая свеча, лучинка, известковая вода.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.174.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт №2 Дата _________
Изготовление моделей молекул углеводородов.
Цель: научиться собирать модели простейших углеводородов.
Оборудование и реактивы: пластилин 2 –х цветов, спички.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.174.
Ход работы:
Рисунок
Описание строения
Модель молекулы метана
Модель молекулы бутана
Модель молекулы изобутана
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 3 Дата _________
Обнаружение непредельных соединений в жидких нефтепродуктах.
Цель: научиться обнаруживать непредельные соединения в жидких нефтепродуктах.
Оборудование и реактивы: жидкие нефтепродукты, раствор йода, раствор перманганата калия.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.175.
Ход работы
№
п/п
Реагенты для распознавания веществ
Наблюдения
Выводы
Раствор перманганата калия
Раствор йода
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 4 Дата _________
Получение и свойства ацетилена.
Цель: изучить лабораторный способ получения ацетилена, выяснить его свойства.
Оборудование и реактивы: пробирки, пробка с газоотводной трубкой, штатив, вода, карбид кальция, раствор перманганата калия.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.175.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 5 Дата _________
Ознакомление с коллекцией «Нефть и продукты ее переработки».
Цель: ознакомление с коллекцией «Нефть и продукты ее переработки».
Оборудование и реактивы: коллекция «Нефть и продукты ее переработки».
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.175- 176.
Ход работы
№ п/п
Образец
Цвет
Формула
Процессы, лежащие в основе производства
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 6 Дата _________
Свойства этилового спирта.
Цель: изучить свойства этилового спирта.
Оборудование и реактивы: этиловый спирт, дистиллированная вода, подсолнечное масло, медная проволока, пробирки, спиртовка, фильтровальная бумага.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.176.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 7 Дата _________
Свойства глицерина.
Цель: изучить свойства глицерина.
Оборудование и реактивы: дистиллированная вода, глицерин, раствор щелочи (NaOH), раствор медного купороса (сульфат меди (II)), пробирки.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.174.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 8 Дата _________
Свойства формальдегида.
Цель: изучить свойства формальдегида.
Оборудование и реактивы: аммиачный раствор оксида серебра, формалин, раствор щелочи (NaOH), раствор медного купороса (сульфат меди (II)), пробирки, стакан с горячей водой.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.177.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 9 Дата _________
Свойства уксусной кислоты.
Цель: изучить свойства уксусной кислоты.
Оборудование и реактивы: раствор уксусной кислоты, раствор лакмуса, раствор щелочи (NaOH), цинк (гранулы), оксид меди (II), мел или сода, пробирки.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.177.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций:
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 10 Дата _________
Свойства жиров.
Цель: изучить свойства жиров.
Оборудование и реактивы: дистиллированная вода, спирт, бензин, подсолнечное масло, пробирки, фильтровальная бумага,
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.177 — 178.
Ход работы
Что делали
Что наблюдали
Вывод
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 11 Дата _________
Сравнение свойств растворов мыла и стирального порошка.
Цель: сравнить свойства растворов мыла и стирального порошка.
Оборудование и реактивы: раствор мыла, раствор стирального порошка, раствор фенолфталеина, жесткая вода (раствор хлорида кальция), пробирки.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.178.
Ход работы
Что делали
Что наблюдали
Вывод
В каком случае приходится прибавлять больше раствора для образования устойчивой пены? ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Какой препарат не утрачивает своей моющей способности в жесткой воде? Почему? ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 12 Дата _________
Свойства глюкозы.
Цель: изучить свойства глюкозы.
Оборудование и реактивы: раствор глюкозы, раствор медного купороса (сульфат меди (II)), раствор щелочи (NaOH), аммиачный раствор оксида серебра, пробирки, спиртовка.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.178.
Ход работы
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций: ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 13 Дата _________
Свойства крахмала.
Цель: изучить свойства крахмала.
Оборудование и реактивы: порошок крахмала, вода, стакан с горячей водой, спиртовой раствор йода, пробирки, спиртовка.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.179.
Ход работы
Что делали
Что наблюдали
Вывод
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 14 Дата _________
Свойства белков.
Цель: изучить свойства белков.
Оборудование и реактивы: раствор белка, раствор щелочи (NaOH), раствор медного купороса (сульфат меди (II)), раствор азотной кислоты, раствор нашатырного спирта, шерстяные нитки, вода, пробирки, спиртовка.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.179.
Ход работы
Что делали
Что наблюдали
Вывод
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Лабораторный опыт № 15 Дата _________
Ознакомление с образцами пластмасс и каучуков.
Цель: ознакомление с образцами пластмасс и каучуков.
Оборудование и реактивы: образцы пластмасс, волокон, каучуков.
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.179.
Ход работы
Группы веществ
Образец
Реакция получения
полимеризации
поликонденсации
Природные
Искусственные
Синтетические
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Практические работы
Практическая работа №1 Дата __________
Идентификация органических веществ.
Цель:…………………………………………………………………………………………..……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.180 -181.
Задание 1.
Вариант № ____
Оборудование и реактивы: ………………………………………………………………………………….
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Ход работы:
Что делали
Что наблюдали
Вывод
Запишите уравнения проведенных реакций: ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Задание 2.
Оборудование и реактивы: раствор глюкозы, …………………………………………………………….
…………………………………………………………………………………………………………………
Ход работы:
Что делали
Что наблюдали
Вывод
Задание 3.
Оборудование и реактивы: раствор глицерина, формальдегида, глюкозы, ……………………………
…………………………………………………………………………………………………………………
Ход работы:
Что делали
Что наблюдали
Вывод
Задание 4.
Оборудование и реактивы: картофель, белый хлеб, спелое яблоко, ……………………………………..
…………………………………………………………………………………………………………………
Ход работы:
Что делали
Что наблюдали
Вывод
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Отметка ___________
Практическая работа № 2 Дата __________
Распознавание пластмасс и волокон.
Цель:…………………………………………………………………………………………..……………………………………………………………………………………………………………………………………………………………………………………………………
Содержание и порядок выполнения опыта см. учебник О.С.Габриеляна Химия 10 (базовый уровень) с.181 — 182.
Задание 1.
Оборудование и реактивы: полиэтилен, поливинилхлорид.
Ход работы:
Формула
Описание
Полиэтилен
Поливинилхлорид
Задание 2.
Оборудование и реактивы: хлопок, шерсть, ацетатное волокно, капрон, ………………………………………………………………………………………………………………..
Ход работы:
Формула
Описание
Хлопок
Шерсть
Ацетатное волокно
Капрон
Вывод………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………..
Отметка ___________
Автор и составитель: Гамзина Л.Г. учитель химии МБОУ Стеклозаводская СОШ
Использованная литература:
О.С.Габриелян «Химия.10 кл.» базовый уровень, Москва.: Дрофа, 2012
infourok.ru
Статья по теме «Демонстрационные, лабораторные и практические работы по химии» 10-12 класс
Предмет: ХИМИЯ
Класс: 10
Демонстрационные и лабораторные опыты. Практические работы.
Раздел ОРГАНИЧЕСКАЯ ХИМИЯ
Тема 1. Введение
Урок 7. Предмет органической химии.
Д. Образцы органических веществ, материалов и изделий из них.
Учитель демонстрирует органические вещества: уксусную кислоту, нефть, глюкозу, сахарозу, целлюлозу, крахмал. Затем демонстрирует слайд в презентации «Роль органических веществ в нашей жизни, на котором изображены материалы и изделия производимые из органических веществ. А так же обращает внимание учащихся на рис. 1 «Природные органические соединения» и рис.2 «Изделия и материалы, изготовленные на основе искусственных органических соединений» в учебнике О.С. Габриеляна Химия 10 класс (базовый уровень) §1.
Тема 2. Теория строения органических соединений
Урок 10 Понятие о изомерии и изомерах
Л.о.№ 1 Изготовление молекул органических соединений
Учащиеся работают парами.
Оборудование: пластилин и спички.
Собирают модель молекулы метана. Для этого из пластилина светлых тонов изготавливают четыре небольших шарика, а из пластилина темных тонов – один шарик, который примерно в два раза больше предыдущих. В качестве стержней используют спички. Учитывая, что в молекуле метана угол между химическими связями С-Н составляет 109°, собирают молекулы в виде тетраэдра.
Собирают молекулы бутана и изобутана. Используют пластилин и спички.
Тема 3.Углеводороды и их природные источники
Урок 14 Природный газ. Алканы. Циклоалканы
Л.о. №2 Качественное определение углерода и водорода в органических веществах.
Выполняют группами по 4-6 человек под руководством учителя.
Оборудование и реактивы: химический стакан, парафиновая свеча, спички, раствор известковой воды.
В химический стакан помещают небольшой кусочек парафиновой свечи и поджигают его с помощью спичек. Наблюдают. Через некоторое время на стенках стакана появятся капельки воды. Делают самостоятельно вывод о наличии водорода в парафине. Затем свечу тушат и вынимают из стакана. В стакан наливают небольшое количество прозрачной известковой воды и взбалтывают. Наблюдают помутнение известковой воды. Делают самостоятельно вывод о наличии углерода в парафине.
Урок 15 Алкены: гомологический ряд, номенклатура и изомерия. Этилен. Полиэтилен, его свойства и применение. Поливинилхлорид его применение.
Д. Получение этилена. Качественные реакции на кратные связи
Учитель демонстрирует опыты на видео
№ 0007 Получение этилена из этанола и взаимодействие его с бромной водой. и № 0003 Взаимодействие этилена с раствором перманганата калия.
Урок 17 Алкины.
Д. Получение ацетилена, качественные реакции на кратные связи
Учитель демонстрирует опыты на видео
№ 0004 Получение ацетилена и его горение
№ 0001 Взаимодействие ацетилена с бромной водой
№ 0052 Взаимодействие ацетилена с раствором перманганата калия
Урок 20 Нефть и способы ее переработки. РКМесторождения Тюменской области
Л.о. № 3 ознакомление с коллекцией нефть и продукты ее переработки
Выполняют по рядам, под руководством учителя.
Каждому ряду выдается коллекция «Нефть и продукты ее переработки»
Учащимся необходимо рассмотреть коллекцию и объяснить, почему все нефтепродукты (кроме мазута) называют светлыми. Записать формулы углеводородов, образующих фракции светлых нефтепродуктов. И ответить устно на вопрос: Какие физические процессы лежат в основе их получения?
Тема 4. Кислородсодержащие органические соединения.
Урок 24 Предельные одноатомные спирты.
Л.о. Свойства этилового спирта. (демонстрационно)
Оборудование и реактивы: штатив с пробирками, пипетка, фильтровальная бумага, раствор этанола, дистиллированная вода, растительное масло.
Класс делится на три группы. Из каждой группы по одному ученику под руководством учителя, демонстрируют опыты для всего класса:
Описывает физические свойства этанола и проводит опыт растворение этанола в воде. Учащиеся делают вывод о агрегатном состоянии и о растворимости этилового спирта в воде.
В одной пробирке налито 1 мл этанола, в другой 1 мл воды. Ученик капает из пипетки в каждую пробирку по 1-2 капле растительного масла. Учащиеся делают вывод о свойствах этанола как растворителя.
На фильтровальную бумагу капает 1 каплю этанола и чуть подальше 1 каплю воды. Учащиеся наблюдают за испарением капель. Совместно делают вывод о свойствах спирта на основании этого опыта.
Урок 25 Многоатомные спирты
Л.о. № 4 свойства глицерина. Качественная реакция на глицерин
Свойства глицерина. Качественная реакция на глицерин
Оборудование и реактивы: штатив с пробирками, дистиллированная вода, растворы: глицерина, медного купороса, гидроксида натрия.
Выполняют группами по 4-6 человек под руководством учителя.
К одному мл дистиллированной воды в пробирке приливают 1 мл глицерина. Смесь перемешивают. Делают вывод о растворимости глицерина в воде.
К 2 мл раствора гидроксида натрия приливают несколько капель раствора медного купороса. Наблюдают выпадение ярко синего осадка гидроксида меди. К полученному осадку приливают по каплям глицерин и смесь взбалтывают. Наблюдают растворение осадка. Цвет раствора становится синим.
Урок 27 Альдегиды
Л.о. № 5 Качественная реакция на альдегиды
Оборудование и реактивы: штатив с пробирками, стакан с горячей водой, растворы: формальдегида, аммиачного раствора оксида серебра.
Выполняют группами по 4-6 человек под руководством учителя.
В пробирку наливают 1-2 мл аммиачного раствора оксида серебра и добавляют по стенке пробирке 4-5 капель раствора глюкозы. Помещают пробирку в стакан с горячей водой. Наблюдают выпадение серебра на стенках пробирки.
Урок 29 Практическая работа № 1 Идентификация органических соединений.
Выполняют группами по 4-6 человек после того как учитель одобрит предложенный группой способ распознавания выданного вещества.
Приборы: штатив для пробирок, пробирки, держатель для пробирок, стакан с горячей водой.
Реактивы: растворы: гидроксид натрия, сульфат меди (II), хлорид железа (III), аммиачный раствор оксида серебра
Каждой группе выдана пробирка с раствором:
Этанола
Формальдегида
Глицерина
При помощи качественных реакций учащиеся должны определить выданные вещества. Отчет о проделанной работе сдают учителю.
11 класс
Тема 4. Кислородосодержащие органические соединения
Урок 5. Предельные одноосновные карбоновые кислоты. Химические свойства предельных одноосновных карбоновых кислот.
Л.о.№1 Свойства уксусной кислоты
Выполняют группами по 4-6 человек под руководством учителя.
Оборудование и реактивы: Штатив с пробирками, гранулы цинка, порошок оксида меди, растворы: лакмус фиолетового, гидроксид натрия, кусочки мела.
У каждой группы в штативе находятся 4 пробирки с 0,1н раствором уксусной кислоты
Учащиеся осторожно нюхают этот раствор. Делают вывод о запахе уксусной кислоты.
В одну пробирку с раствором уксусной кислоты приливают 1 каплю лакмуса. Наблюдают появление красного окрашивания. Делают вывод о среде раствора уксусной кислоты. Затем в эту же пробирку добавляют по каплям раствор гидроксида натрия. Наблюдают исчезновение окраски индикатора. Делают вывод о реакции, которая произошла в пробирке. Записывают уравнения химических реакций в тетрадь.
В оставшиеся три пробирки с раствором уксусной кислоты добавляют в одну – гранулу цинка, в другую – несколько крупинок оксида меди, в третью кусочек мела. Наблюдают за происходящим в пробирках. Делают соответствующие выводы о химических свойствах уксусной кислоты и записывают уравнения реакций в тетрадь.
Урок 6 Сложные эфиры. Жиры. Мыла. Химия в повседневной жизни. Правила безопасной работы со средствами бытовой химии.
Л.о.№2 Свойства жиров
Выполняют группами по 4-6 человек под руководством учителя.
Оборудование и реактивы: штатив с пробирками, фильтровальная бумага, пипетка, дистиллированная вода, бензин, раствор этанола, подсолнечное масло.
У каждой группы в штативе находятся пробирки с растворами.
В три пробирки налито по 1мл дистиллированной воды этанола и бензина добавляют в них по 2 капле подсолнечного масла. Содержимое пробирок встряхивают. Делают вывод в какой жидкости жиры растворяются лучше.
Несколько капель раствора жира в этаноле и бензине наносят на фильтровальную бумагу. Наблюдают. Делают вывод о скорости испарения капель.
Л.о.№3 Сравнение свойств растворов мыла и стирального порошка.
Выполняют группами по 4-6 человек под руководством учителя.
Оборудование и реактивы: штатив с пробирками, растворы мыла и стирального порошка, жесткая вода.
К 1-2 мл раствора мыла и стирального порошка добавляют по 1-2, капли фенолфталеина. Отмечают интенсивность окраски фенолфталеина. Делают вывод какое моющее средство лучше применять для стирки тканей.
В двух пробирках находится жесткая вода ( с солями карбоната и хлорида кальция) В одну пробирку приливают раствор мыла, в другую раствор стирального порошка. Раствор взбалтывают. Делают вывод в каком случае моющего средства тратится больше для образования устойчивой пены.
Урок 7. Углеводы: классификация, представители, свойства. Глюкоза
Л.о.№4 Свойства глюкозы.
Выполняют группами по 4-6 человек под руководством учителя.
Оборудование и реактивы: Штатив с пробирками, держатель для пробирок, сухое горючее, растворы: сульфат меди, гидроксид натрия, глюкозы.
В пробирку с 2-3 каплями раствора медного купороса приливают 2-3 мл раствора гидроксида натрия. Наблюдают выпадение осадка ярко синего цвета- гидроксида меди (II). Затем добавляют в пробирку 2мл раствора глюкозы. Наблюдают.
Затем нагревают содержимое пробирки по очереди на сухом горючем, которое находится на столе у учителя. Наблюдают изменение окраски. Делают вывод о наличии альдегидной группы в молекуле глюкозы.
Урок 8 Дисахариды. Полисахариды
Л.о. №5 Качественная реакция на крахмал
Выполняют группами по 4-6 человек под руководством учителя.
Оборудование и реактивы: свежий картофель, пипетка, раствор йода.
На свежий срез картофеля капают из пипетки 1 каплю раствора йода. Наблюдают появление фиолетового окрашивания.
Тема 5. Азотсодержащие органические соединения.
Урок 16 Аминокислоты. Белки
Л.о.№ 6 Свойства белков
Выполняют группами по 4-6 человек под руководством учителя.
Оборудование и реактивы: штатив с пробирками, спички, шерстяные нитки, раствор белка, азотной кислоты, сульфата меди, гидроксида натрия.
У каждой группы на столе находится штатив с пробирками, в которых налит раствор белка куриного яйца.
В одну пробирку учащиеся добавляют раствор гидроксида натрия, а затем несколько капель медного купороса. Наблюдают за происходящим.
В другую пробирку добавляют несколько капель раствора азотной кислоты. Наблюдают. Делают вывод о реакции денатурации белка.
Поджигают несколько шерстяных нитей. Характеризуют запах горящей шерсти.
Урок 18 Химия и здоровье. Витамины.
Д. фотографий животных с различной формой авитаминоза.
Учитель демонстрирует на экране при помощи мультимедийного проектора картинки больных животных в презентации Microsoft PowerPoint
Тема 6. Искусственные и синтетические органические соединения
Урок 21 Искусственные и синтетические полимеры
Л.о.№ 7 Ознакомление с образцами пластмасс
(Учащиеся работают по рядам. На каждый ряд выданы образцы пластмасс)
Учитель предлагает учащимся рассмотреть образцы пластмасс: (резину, крахмал, вискоза, полиэтилен, поливинилхлорид). Просит их распределить на три группы: природные, искусственные, синтетические. Перечислить какие из предложенных веществ получают в результате реакции: полимеризации, а какие -поликонденсации.
Л.о. № 8 Ознакомление с образцами волокон.
(Учащиеся работают по рядам. На каждый ряд выданы образцы волокон)
Учитель предлагает учащимся рассмотреть образцы волокон: (шерсть, хлопок, шелк, капрон, лавсан). Просит их распределить на три группы: природные, искусственные, синтетические. Перечислить какие из предложенных веществ получают в результате реакции: полимеризации, а какие -поликонденсации.
Урок 23 Практическая работа № 1 Распознавание пластмасс и волокон
Выполняют группами по 4-6 человек после того как учитель одобрит предложенный группой способ распознавания выданного вещества.
Каждой группе выданы образца пластмассы и волокон. ( полиэтилен и хлопок, поливинилхлорид и шелк, полистирол и шерсть)
Учащимся необходимо используя таблицы: Свойства волокон и свойства пластмасс на стр. 181-182 из учебника О.С Габриеляна Химия 10 класс определить выданное вещество. Написать структурные формулы этих веществ. Сдать отчет учителю.
Тема 7. Химия и жизнь
Урок 28 Бытовая химическая грамотность
Л.о № 9 Знакомство с образцами моющих и чистящих средств. Изучение инструкций по их применению
Выполняют группами по 4-6 человек.
Учащимся предлагаются этикетки с инструкцией по составу и использованию
Стирального порошка, средства для мытья посуды- фери, чистящего средства -пемолюкс, средства для мытья стекол. Учащиеся после изучения инструкций делают вывод о безопасности применения этих веществ.
12 класс
Тема 3. Вещество
Урок 8 Вещества молекулярного и немолекулярного строения. Кристаллические решетки.
Д. Модели кристаллических решеток
Учитель демонстрирует сборные модели кристаллических решеток веществ: хлорида натрия, углекислого газа, алмаза, графита.
Урок 10 Чистые вещества и смеси. Состав смесей. Разделение смесей.
Д. растворение окрашенных веществ в воде (сульфата меди (II), хлорида железа (III).
Оборудование и реактивы: штатив с пробирками, дистиллированная вода, соли: сульфат меди (II) и хлорида железа (III).
Учитель демонстрирует опыты: растворение в воде сульфата меди (II) и хлорида железа (III).
Урок 11 Истинные растворы. Способы выражения концентрации растворов. Дисперсные системы. Коллоиды (золи и гели)
Д. образцы пищевых, косметических, биологических и медицинских золей и гелей.
Учитель демонстрирует пищевые гели: мармелад, зефир, косметические гели: гель после бритья, медицинские – мазь, биологические – волосы и золи –белок куриного яйца.
Тема 4. Химические реакции
Урок № 14 Реакции ионного обмена
Л.о. № 1 Проведение реакций ионного обмена для характеристики свойств электролитов.
Выполняют группами по 4-6 человек, под руководством учителя.
Оборудование и реактивы: Штатив с пробирками, растворы: сульфат меди, хлорид бария, нитрат серебра, хлорид кальция, карбонат кальция, соляная кислота.
Учащиеся приливают в пробирку 1мл. раствора сульфата меди и добавляют в эту же пробирку по каплям раствор хлорида бария. Наблюдают выпадение белого молочного осадка.
Учащиеся приливают в пробирку 1 мл раствора хлорида бария и добавляют в эту же пробирку по каплям раствор нитрата серебра. Наблюдают выпадение белого творожистого осадка.
Учащиеся приливают в пробирку 1 мл. раствора карбоната кальция и приливают в эту же пробирку по каплям раствор соляной кислоты. Наблюдают выделение газа.
Записывают уравнения реакции в полной и сокращенной ионной формах в тетрадь.
Урок 15 Гидролиз неорганических и органических соединений. Среда водных растворов.
Л.о.№ 2 Определение характера среды с помощью универсального индикатора.
Выполняют группами по 4-6 человек, под руководством учителя.
Оборудование и реактивы: штатив с пробирками, растворы солей ацетата натрия, нитрата аммония, сульфата калия, универсальный индикатор.
Учащиеся проверяют индикаторной полоской среду водного раствора каждой соли. Делают вывод о рН раствора. Записывают уравнения гидролиза солей в тетрадь.
Раздел 3. Неорганическая химия
Урок 21 Классификация неорганических соединений.
Д. Образцы металлов и неметаллов.
Учитель демонстрирует образцы металлов: алюминиевая проволока, железный гвоздь, цинковые гранулы и медную пластинку; образцы неметаллов: серу, графит, водород, кислород.
Урок 22. Металлы. Электрохимический ряд напряжений металлов Общие способы получения металлов
Л о: Ознакомление с образцами металлов
Выполняют группами по 4-6 человек, под руководством учителя.
Каждой группе выданы образцы металлов: алюминий, медь, цинк, железо.
Учащиеся предлагается описать физические свойства выданных веществ по плану: 1) агрегатное состояние при комнатной температуре, 2) цвет, 3) блеск, 4) пластичность, 5) электропроводность и теплопроводность, 3) твердость (по справочнику), плотность (по справочнику), температуру кипения и плавления (по справочнику). Далее учащиеся должны сформулировать вывод, об общих физических свойствах металлов.
Урок 23 Неметаллы и их свойства. Благородные газы Общая характеристика галогенов
Л.о. Ознакомление с образцами неметаллов
Выполняют группами по 4-6 человек, под руководством учителя.
Каждой группе выданы образцы неметаллов: сера, графит, углерод.
Учащиеся предлагается описать физические свойства выданных веществ по плану: 1) агрегатное состояние при комнатной температуре, 2) цвет, 3) блеск, 4) пластичность, 5) электропроводность и теплопроводность, 3) твердость (по справочнику), плотность (по справочнику), температуру кипения и плавления (по справочнику). Далее учащиеся должны сформулировать вывод, об общих физических свойствах неметаллов
Урок 24 Кислоты
Л.о. Ознакомление с образцами некоторых кислот.
У учителя на столе находятся в закрытых склянках с этикетками растворы соляной, серной, уксусной кислот. Учащимся предлагается разделить эти кислоты на две группы: неорганические и органические.
Записать формулы всех кислот.
Затем класс делится на три группы и каждая группа дает полную характеристику по всем изученным классификациям одной из предложенных кислот.
Урок 25. Основания
Л.о. Ознакомление с образцами некоторых оснований
У учителя на столе находятся в закрытых склянках с этикетками гидроксиды: гидроксид натрия, гидроксид меди, гидроксид цинка. Учащимся предлагается разделить эти основания на две группы: растворимые и нерастворимые.
Записать формулы всех кислот.
Затем класс делится на три группы и каждая группа дает полную характеристику по всем изученным классификациям однго из предложенных оснований.
Урок 26 Соли. Генетическая связь между классами неорганических и органических соединений.
Д: Осуществление цепочки превращений
Оборудование и реактивы: штатив с пробирками, держатель для пробирок, порошок оксида меди, сухое горючее, растворы серной кислоты, гидроксида натрия.
Учитель демонстрирует химические опыты по осуществлению цепочки генетических превращений.
К порошку оксида меди приливает раствор серной кислоты, нагревает.
К полученному раствору добавляет раствор щелочи.
Получившийся во втором опыте осадок нагревает.
Учащиеся наблюдают за происходящим и вместе с учителем записывают уравнения химической реакции.
Урок 27 Практическая работа № 1 «Получение, собирание и распознавание газов»
Получение, собирание и распознавание газов.
Выполняют группами по 4-6 человек после того как учитель одобрит предложенный группой способ получения газов
Оборудование и реактивы: штатив с пробирками, спички, гранулы цинка, кристаллы оксида марганца, кусочки мрамора или мела, растворы: соляной кислоты, пероксида водорода, гидроксида кальция.
Получение, собирание и распознавание газов.
Учащиеся помещают в пробирку одну гранулу цинка и приливают 1-2 мл. раствора соляной кислоты. Наблюдают выделение собирание водорода. Накрывают пробирку пробиркой большего размера, ждут некоторое время. Затем к пробирке большего размера подносят зажжённую спичку (пробирку не переворачивают), слышат глухой хлопок. Делают вывод о наличии водорода в пробирке.
Получение, собирание и распознавание кислорода.
Учащиеся в пробирку объёмом 20 мл приливают 5-7 мл раствора перекиси водорода. Готовят тлеющую лучинку (поджигают ее, и когда она загорится, взмахом руки гасят ее). Подносят потухшую лучинку к пробирке с пероксидом водорода, предварительно насыпав в нее немного (на кончике шпателя) оксида марганца (IV). Наблюдают вспыхивание лучинки. Делают вывод о наличии кислорода.
Получение, собирание и распознавание углекислого газа.
Учащиеся в пробирку помещают небольшой кусочек мрамора и приливают раствор уксусной кислоты. Наблюдают выделение газа. Через некоторое время к пробирке подносят горящую лучинку. Она тухнет. Делают вывод о наличии углекислого газа
В другую пробирку, наливают прозрачный раствор известковой воды. Через стеклянную трубочку осторожно вдувают выдыхаемы воздух. Наблюдают за происходящим. Делают вывод о газе, который они выдыхают.
Оформляют отчет и сдают учителю.
Урок 28 Практическая работа № 2 «Идентификация неорганических соединений»
Выполняют группами по 4-6 человек после того как учитель одобрит предложенный группой способ распознавания выданного веществаПриборы и реактивы: Штатив с пробирками, растворы: нитрата серебра, хлорида бария, хлорида кальция, индикатор универсальный.
Учащимся выданы пробирки без этикеток с растворами
хлорида натрия, карбоната натрия, сульфата натрия.
С помощью качественных реакций ученики должны определить
выданные вещества.
Учащимся выданы неподписанные пробирки с растворами солей:
ацетата натрия, нитрата аммония, сульфата калия.
С помощью индикаторной бумажки ученики должны определить
какое вещество находится в каждой из пробирок.
Оформить отчет и сдать учителю.
infourok.ru
