ГДЗ по Химии 10 класс Габриелян Углубленный уровень Вертикаль
Ученикам нравятся гуманитарные дисциплины, другим – точные науки. Но наблюдать за опытами, которые выполняют учителя физики и химии, интересно каждому подростку. Другое дело – когда необходимо учить формулы и решать сложные задачи. Химия всегда была одним из самых трудных предметов всей школьной программы. А углубленный уровень сравним с курсом первого курса любого Вуза. Поможет старшекласснику разобраться с программой надежный онлайн-консультант – ГДЗ по химии за 10 класс Габриелян углубленный уровень. Безусловно, ученики старших классов редко рассчитывают на поддержку родителей в выполнении домашнего задания. Справиться с задачей по химии сможет только тот взрослый, для кого эта наука является часть его профессии. Но большинство людей не вспомнит ни единой формулы через двадцать лет после окончания своей учебы. Помощь профессионального репетитора вполне может выручить при любых трудностях в учебе – кроме одной проблемы: старшеклассникам катастрофически не хватает времени, а дополнительные занятия с репетитором потребуют лишние часы, которые придется отнимать у работы с другими предметами. Но существует помощник, готовый подсказать нужное решение в любую минуту – решебник.
Но существует помощник, готовый подсказать нужное решение в любую минуту – решебник.
Что включено в пособие по химии за 10 класс Габриелян углубленный уровень
Издание содержит тридцать два тематических параграфа и десять практических работ. В заданиях отражены все темы основного учебника химии для десятого класс:
- Строение органических соединений.
- Углеводороды.
- Карбоновые кислоты.
- Альдегиды и кетоны.
- Качественный анализ органических соединений.
- Биологически активные соединения.
Каждое задание в решебнике сопровождается не только правильным ответом, но и подробным описанием всего решения., помогая ученику понять и запомнить алгоритм работы. Решебник по химии за 10 класс углубленный уровень авторы: Габриелян О.С., Остроумов И.Г., Пономарев С.Ю. выполняет функции персонального консультанта – можно узнать ответ на любой вопрос, не затрачивая ни минуты лишнего времени. Регулярная и вдумчивая работа с пособием открывает перед старшеклассниками широкие возможности: разобраться в любой теме за минимальный отрезок времени, в спокойной домашней остановке подготовиться к контрольной проверке в классе, поддерживать стабильно высокую успеваемость. Если ученик намерен продолжить дальнейшее послешкольное образование в Вузе с химическим уклоном, ГДЗ станет надёжным помощником в подготовке к вступительным экзаменам.
Регулярная и вдумчивая работа с пособием открывает перед старшеклассниками широкие возможности: разобраться в любой теме за минимальный отрезок времени, в спокойной домашней остановке подготовиться к контрольной проверке в классе, поддерживать стабильно высокую успеваемость. Если ученик намерен продолжить дальнейшее послешкольное образование в Вузе с химическим уклоном, ГДЗ станет надёжным помощником в подготовке к вступительным экзаменам.
Дополнительное ГДЗ
- С.» itemscope=»itemscope» itemtype=»https://schema.org/Book» data-v-0f1b3b60=»»>
Вопросы в конце параграфа
Практические работы
Практическая работа №1
Практическая работа №2
Практическая работа №3
- 1
- 2
- 3
- 4
Практическая работа №4
- 1
- 2
- 3
- 4
Практическая работа №5
Практическая работа №6
- 1
- 2
- 3
- 4
Практическая работа №7
- 1
- 2
- 3
- 4
- 5
- 6
- 7
Практическая работа №8
Практическая работа №10
Решебник по химии за 10 класс, ответы онлайн
Химия 10 класс рабочая тетрадь, тестовые задания ЕГЭ
Авторы: Габриелян О.С. Яшукова А.В.
Химия 10-11 класс дидактический материал
Автор: Радецкий А.М.
Химия 10-11 класс
Автор: Цветков Л.
 А.
А.Химия 10 класс
Авторы: Гузей Л.С. Суровцева Р.П.
Химия 8-11 класс задачник
Авторы: Гольдфарб Я.Л. Ходаков Ю.В.
Авторы: Рудзитис Г.Е. Фельдман Ф.Г.
Химия 10 класс
Авторы: И.И. Новошинский Н.С. Новошинская
Химия 8-11 класс сборник задач и упражнений
Автор: Хомченко И.
 Г.
Г.Химия 10 класс
Автор: О.С. Габриелян
Химия 10 класс
Авторы: И.Е. Шиманович Е.И. Василевская
Химия 10 класс сборник задач
Авторы: В.Н. Хвалюк В.И. Резяпкин
Химия 10 класс лабораторные работы
Авторы: Шарапа Е.И. Ельницкий А.П.
Химия 10 класс рабочая тетрадь
Авторы: Т.
 Н. Мякинник Н.В. Манкевич
Н. Мякинник Н.В. МанкевичХимия 10 класс химический эксперимент
Автор: И.И. Борушко
Химия 10 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 10 класс
Авторы: Ерёмин В.В. Кузьменко Н.Е.
Химия 10 класс
Авторы: Кузнецова Н.Е. Гара Н.Н.
Химия 10 класс
Авторы: Кузнецова Н.
Е. Гара Н.Н.
Химия 10 класс
Авторы: Еремин В.В. Кузьменко Н.Е.
Химия 10 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 10 класс рабочая тетрадь
Автор: Ахметов М.А.
Химия 10 класс
Авторы: Рудзитис Г.Е. Фельдман Ф.Г.
Автор: Рябов М.
 А.
А.Химия 10 класс контрольно-измерительные материалы
Автор: Стрельникова Е.Н.
Химия 10 класс рабочая тетрадь
Авторы: Габриелян О.С. Сладков С.А.
Химия 10 класс
Авторы: Габриелян О.С. Остроумов И.Г.
Химия 10 класс контрольные и проверочные работы
Авторы: Габриелян О.С. Березкин П.Н.
Химия 10 класс задачник
Авторы: Кузнецова Н.
 Е. Левкин А.Н.
Е. Левкин А.Н.Химия 10 класс контрольные и проверочные работы
Авторы: Габриелян О.С. Сладков С.А.
Химия 10 класс контрольные работы
Авторы: Габриелян О.С. Сладков С.А.
Химия 10 класс тетрадь для практических работ
Авторы: Матулис В.Э. Матулис В.Э.
Химия 10 класс тетрадь для практических работ
Авторы: Матулис В.
 Э. Матулис В.Э.
Э. Матулис В.Э.Химия 10 класс
Авторы: Колевич Т.А. Матулис В.Э.
Химия 10-11 класс сборник задач и упражнений
Авторы: Червина В.В. Варламова А.В.
Химия 10 класс тематические тесты
Автор: Т.А. Боровских
Химия 10 класс тетрадь для практических работ
Автор: Борушко И.И.
Тесты по учебнику Габриеляна О.
 С. Химия. 10 класс. Профильный уровень — вопросы с ответами
С. Химия. 10 класс. Профильный уровень — вопросы с ответами- Главная
- Тесты
- Учебные тесты
- Тесты для школы
- Тесты для школы по классам
- Тесты для 10 класса
- Тесты по химии для 10 класса
- Тесты по химии профильного уровня для 10 класса
Популярности Новизне
Выбрать сбросить выбранное
Тест «Ашока»Выводить по:
- 8
- 16
- 24
- 32
 Сахароза. Полисахариды. Крахмал и целлюлоза (Габриелян, 10 класс, профильная)
Тест по химии: Изомерия и её виды (Габриелян, 10 класс, профильная)
Тест по химии: Карбоновые кислоты (Габриелян, 10 класс, профильная)
Тест по химии: Классификация органических соединений (Габриелян, 10 класс, профильная)
Тест по химии: Основы номенклатуры органических соединений (Габриелян, 10 класс, профильная)
Тест по химии: Предмет органической химии. Органические вещества (Габриелян, 10 класс, профильная)
Тест по химии: Природные источники углеводородов (Габриелян, 10 класс, профильная)
Тест по химии: Сложные эфиры.
Сахароза. Полисахариды. Крахмал и целлюлоза (Габриелян, 10 класс, профильная)
Тест по химии: Изомерия и её виды (Габриелян, 10 класс, профильная)
Тест по химии: Карбоновые кислоты (Габриелян, 10 класс, профильная)
Тест по химии: Классификация органических соединений (Габриелян, 10 класс, профильная)
Тест по химии: Основы номенклатуры органических соединений (Габриелян, 10 класс, профильная)
Тест по химии: Предмет органической химии. Органические вещества (Габриелян, 10 класс, профильная)
Тест по химии: Природные источники углеводородов (Габриелян, 10 класс, профильная)
Тест по химии: Сложные эфиры. Жиры (Габриелян, 10 класс, профильная)
Тест по химии: Спирты (Габриелян, 10 класс, профильная)
Тест по химии: Строение атома углерода (Габриелян, 10 класс, профильная)
Тест по химии: Теория строения органических соединений А. М. Бутлерова (Габриелян, 10 класс, профильная)
Тест по химии: Типы реакционноспособных частиц и механизмы реакций в органической химии. Взаимное влияние атомов в молекулах органических соединений (Габриелян, 10 класс, профильная)
Тест по химии: Типы химических реакций в органической химии (Габриелян, 10 класс, профильная)
Тест по химии: Углеводы, их классификация и значение (Габриелян, 10 класс, профильная)
Тест по химии: Фенолы (Габриелян, 10 класс, профильная)
Тест по химии: Циклоалканы (Габриелян, 10 класс, профильная)
Жиры (Габриелян, 10 класс, профильная)
Тест по химии: Спирты (Габриелян, 10 класс, профильная)
Тест по химии: Строение атома углерода (Габриелян, 10 класс, профильная)
Тест по химии: Теория строения органических соединений А. М. Бутлерова (Габриелян, 10 класс, профильная)
Тест по химии: Типы реакционноспособных частиц и механизмы реакций в органической химии. Взаимное влияние атомов в молекулах органических соединений (Габриелян, 10 класс, профильная)
Тест по химии: Типы химических реакций в органической химии (Габриелян, 10 класс, профильная)
Тест по химии: Углеводы, их классификация и значение (Габриелян, 10 класс, профильная)
Тест по химии: Фенолы (Габриелян, 10 класс, профильная)
Тест по химии: Циклоалканы (Габриелян, 10 класс, профильная)ГДЗ за 10 класс по Химии Габриелян О.
 С., Остроумов И.Г. Углубленный уровень
С., Остроумов И.Г. Углубленный уровеньОписание решебника
авторы: Габриелян О.С., Остроумов И.Г., Пономарев С.Ю..
В 10 классе школьнику очень важно сохранять активность и усидчивость. Учебник по Химии Габриелян, Остроумов(зеленый) может казаться сложным, но опускать руки, все же, не стоит.
Углубленный уровень может напугать многих. Уже позади у учеников время, когда приходилось особенно активно и напряженно изучать переходной курс Химии, ведь теперь в расписании в дневнике есть отдельные графы: Химия по нескольку раз в неделю. Все правильно, ведь подросток развивается и нуждается в том, чтобы заниматься более углубленно и усложнять выполняемые задачи — только по такому принципу школьники может умнеть, совершенствоваться и развиваться, находя ответы на вопросы и выполняя упражнения и лабораторные работы.
Стоит ли говорить о том, насколько такой прием эффективен и как активно применяется современной школьной программы? Однако, есть и негативные стороны относительно данного вопроса, которые состоят в том, что далеко не каждый ребенок, а особенно за 10 класс, способен не только воспринимать такое развитие, но и вписываться в контекст требуемых от него результатов.
Вот почему так важно обеспечить своему ребенку нужную базу в виде сборника ГДЗ. Именно такой прием поможет ученику самостоятельно контролировать собственное время и занятость.
Рекомендуемые решебники
О.С. Габриелян, Дрофа рабочая тетрадь Габриелян О.С., Дрофа рабочая тетрадь, тестовые задания ЕГЭ Габриелян О.С., ДрофаОтветы к вопросам в конце параграфа
§ 1
1 2 3 4 5 6 7 8 9 10§ 2
1 2 3 4 5 6 7 8 9§ 3
1 2 3 4 5 6 7§ 4
1 2 3 4 5 6 7 8§ 5
1 2 3 4 5 6§ 6
1 2 3 4 5 6 7§ 7
1 2 3 4 5 6 7 8 9 10§ 8
1 2 3 4 5§ 9
1 2 3 4 5 6 7 8 9§ 10
1 2 3 4 5 6 7 8 9 10 11§ 11
1 2 3 4 5 6 7 8 9 10 11 12§ 12
1 2 3 4 5 6 7 8 9§ 13
1 2 3 4 5 6 7 8 9 10§ 14
1 2 3 4 5 6 7 8§ 15
1 2 3 4 5 6 7 8 9 10 11 12 13§ 16
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15§ 17
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16§ 18
1 2 3 4 5 6 7 8 9 10 11§ 19
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15§ 20
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20§ 21
1 2 3 4 5 6 7 8 9 10 11 12 13§ 22
1 2 3 4 5 6 7 8§ 23
1 2 3 4 5 6 7 8 9 10 11 12§ 24
1 2 3 4 5 6 7 8 9§ 25
1 2 3 4 5 6 7 8 9 10 11 12§ 26
1 2 3 4 5 6 7 8 9 10§ 27
1 2 3 4 5 6 7 8 9 10 11§ 28
1 2 3 4 5 6 7 8 9§ 29
1 2 3 4 5 6 7§ 30
1 2 3 4 5 6 7 8 9§ 31
1 2 3 4 5 6 7 8 9 10§ 32
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16Ответы к практическим работам
Практическая работа №1
1 2Практическая работа №2
1 2 3Практическая работа №3
1 2 3 4Практическая работа №4
1 2 3 4Практическая работа №5
1 2 3Практическая работа №6
1 2 3 4Практическая работа №7
1 2 3 4 5 6 7Практическая работа №8
1Практическая работа №9
1 2 3Практическая работа №10
1 2Гдз химия 10 класс габриелян остроумов :: quarfisophmo
Вся органика и не органика. Уравняй реакцию, реши цепочку реакций и многое другое. Скачать решебник «Химия.10 класс» О. С. Габриелян. В решебнике за 10 класс к учебнику О. С. Габриеляна даны ответы на контрольные вопросы ко всем 7 главам и 32 параграфам. Российские учебники и решебники ГДЗ онлайн. Учебники за 10 класс Химия О. С. Габриелян, И. Г. Остроумов, С. Ю. Пономарев. Хотите быстро выполнить химию за 10 класс — к учебнику? Тогда спишите готовые решения к заданиям Габриеляна со страниц номер №5-94 базовый уровень и № профильный уровень. Мобильное готовое домашнее задание Моби ГДЗ к учебнику по химии за 10 класс. Решебник и ответы на углубленный уровень химии Габриелян Остроумов Пономарев. 10 класс.» ГДЗ. Габриелян О. С. Похожие. Мы нашли для вас 7 похожих решебников. Химия.10 класс. Габриелян О. С., Маскаев Ф. Н., Пономарев С. Ю., Теренин В. И., 2000г. 10 класс. Базовый уровень: учеб. Для общеобразоват. Учреждений О. С. Габриелян.— 6-е изд., стереотип. Решебники гдз по химии за 10 класс. Химия 10 класс, Рудзитис Г.
Уравняй реакцию, реши цепочку реакций и многое другое. Скачать решебник «Химия.10 класс» О. С. Габриелян. В решебнике за 10 класс к учебнику О. С. Габриеляна даны ответы на контрольные вопросы ко всем 7 главам и 32 параграфам. Российские учебники и решебники ГДЗ онлайн. Учебники за 10 класс Химия О. С. Габриелян, И. Г. Остроумов, С. Ю. Пономарев. Хотите быстро выполнить химию за 10 класс — к учебнику? Тогда спишите готовые решения к заданиям Габриеляна со страниц номер №5-94 базовый уровень и № профильный уровень. Мобильное готовое домашнее задание Моби ГДЗ к учебнику по химии за 10 класс. Решебник и ответы на углубленный уровень химии Габриелян Остроумов Пономарев. 10 класс.» ГДЗ. Габриелян О. С. Похожие. Мы нашли для вас 7 похожих решебников. Химия.10 класс. Габриелян О. С., Маскаев Ф. Н., Пономарев С. Ю., Теренин В. И., 2000г. 10 класс. Базовый уровень: учеб. Для общеобразоват. Учреждений О. С. Габриелян.— 6-е изд., стереотип. Решебники гдз по химии за 10 класс. Химия 10 класс, Рудзитис Г. Е., Фельдман Ф. Г., 1999. Правильный ответ подскажет гдз по химии 10 класс Габриелян, включающий в себя подробный анализ большинства присутствующих в школьных учебниках заданий. Успех на учебе и дома обеспечен. Решебник и ГДЗ по предмету Химия за 10 класс. Химию можно смело отнести к непростым предметам. Для того, чтобы иметь хорошие знания по этому предмету, нужно учить его хорошо и регулярно всегда. ГДЗ, решебники по химии.10 класс: Учебное пособие для общеобразовательных учреждений О. С. Габриелян, И. Г. Остроумов, Е. Е. Остроумова.— М., 2003. Пользователь Настя Савчук задал вопрос в категории Школы и получил на него 2 ответа Полный и качественный учебник Химия 10 класс О. С. Габриелян, И. Г. Остроумов, С. Ю. Пономарев 2014 Углубленный уровень скачать онлайн. Решебник гдз по химии 10 класс Габриелян, ответы для старых изданий учебников РешебникГДЗ по Химии за 10 класс О. С. Габриелян. ГДЗ по химии за 10 класс к учебнику «Химия.10 класс» О. С. Габриелян. «Химия.10 класс.» ГДЗ. Габриелян О.
Е., Фельдман Ф. Г., 1999. Правильный ответ подскажет гдз по химии 10 класс Габриелян, включающий в себя подробный анализ большинства присутствующих в школьных учебниках заданий. Успех на учебе и дома обеспечен. Решебник и ГДЗ по предмету Химия за 10 класс. Химию можно смело отнести к непростым предметам. Для того, чтобы иметь хорошие знания по этому предмету, нужно учить его хорошо и регулярно всегда. ГДЗ, решебники по химии.10 класс: Учебное пособие для общеобразовательных учреждений О. С. Габриелян, И. Г. Остроумов, Е. Е. Остроумова.— М., 2003. Пользователь Настя Савчук задал вопрос в категории Школы и получил на него 2 ответа Полный и качественный учебник Химия 10 класс О. С. Габриелян, И. Г. Остроумов, С. Ю. Пономарев 2014 Углубленный уровень скачать онлайн. Решебник гдз по химии 10 класс Габриелян, ответы для старых изданий учебников РешебникГДЗ по Химии за 10 класс О. С. Габриелян. ГДЗ по химии за 10 класс к учебнику «Химия.10 класс» О. С. Габриелян. «Химия.10 класс.» ГДЗ. Габриелян О. С. Ваши друзья не знают про этот решебник. Рассказать вконтакте. Выберите подходящее издание решебника. Химия 7-10 класс Задачник. Авторы: Габриелян О. С. Контрольные и проверочные работы. Химия 8 класс. Авторы: Габриелян О. С., Остроумов И. Г. Химия, 10 класс, Базовый уровень, Габриелян О. С., 2007 Химия, 10 класс, углубленный уровень, учебник, Габриелян О. С., Остроумов И. Г., ГДЗ по химии для 10 класса к «Учебник. Химия.10 класс, Габриелян О. С., 2007». Наконец стали доступны ответы к учебнику по химии 7 класс Габриелян Остроумов Ахлебинин. Получайте только отличные оценки на уроках при. Фотострана Интересные страницы Гдз по химии 10 класс габриелян остроумов карцова онлайн. Фотострана Интересные страницы Гдз по химии. Где найти ГДЗ по органической химии за 10 класс авторы: габриелян, остроумов, карцова. AnnA Знаток 298, Вопрос решён 3 года назад. Нравится Зубрилка.орг — подробные гдз и решебник по Химии для 10 класса О. С. Габриелян на год. Готовые домашние задания ГДЗ по химии для 7, 8, 9, 10, 11 классов.
С. Ваши друзья не знают про этот решебник. Рассказать вконтакте. Выберите подходящее издание решебника. Химия 7-10 класс Задачник. Авторы: Габриелян О. С. Контрольные и проверочные работы. Химия 8 класс. Авторы: Габриелян О. С., Остроумов И. Г. Химия, 10 класс, Базовый уровень, Габриелян О. С., 2007 Химия, 10 класс, углубленный уровень, учебник, Габриелян О. С., Остроумов И. Г., ГДЗ по химии для 10 класса к «Учебник. Химия.10 класс, Габриелян О. С., 2007». Наконец стали доступны ответы к учебнику по химии 7 класс Габриелян Остроумов Ахлебинин. Получайте только отличные оценки на уроках при. Фотострана Интересные страницы Гдз по химии 10 класс габриелян остроумов карцова онлайн. Фотострана Интересные страницы Гдз по химии. Где найти ГДЗ по органической химии за 10 класс авторы: габриелян, остроумов, карцова. AnnA Знаток 298, Вопрос решён 3 года назад. Нравится Зубрилка.орг — подробные гдз и решебник по Химии для 10 класса О. С. Габриелян на год. Готовые домашние задания ГДЗ по химии для 7, 8, 9, 10, 11 классов. Химия. Учебник для 9 класс общеобразовательных учреждений Габриелян О. С. У нас вы можете скачать Гдз по химии 10 класс габриелян остроумов карцова. Не забывайте оставлять свои комментарии и ставить оценки! Помните. 7 класс. Габриелян О. С., Остроумов И. Г., Ахлебинин А. К.2013, 160с. Химия.7 класс.10 класс: к учебнику Габриеляна О. С. Химия.10 кл. Базовый. Химия в тестах, задачах и упражнениях О. С. Габриелян, Г. Г. Лысова 10 класс Габриелян Олег Сергеевич, Остроумов Игорь Геннадьевич, Пономарев. ГДЗ ответы на вопросы учебника по химии 7 класс Габриелян Остроумов Ахлебинин ФГОС от Путина. Решебник готовое домашнее задание. ГДЗ ХИМИЯ 10 КЛАСС ГАБРИЕЛЯН ОСТРОУМОВ КАРЦОВА. Автор: admin Добавлено: , 18:30 Комментариев 0 Добавить. Алкины ➔ Органическая Химия, В тестах, задачах, упражнениях, Учебное пособие, Габриелян, Остроумов, Остроумова, 10 класс, Химия, Учебное пособие для Учебники, ГДЗ, решебники, ЕГЭ, ГИА, экзамены, книги. Химия, 9 класс, Габриелян О. С., Остроумов И. Г., 2010 Книги и учебники ГДЗ по химии, 11 класс, 2015, к учебнику по химии за 11 класс, Габриелян О.
Химия. Учебник для 9 класс общеобразовательных учреждений Габриелян О. С. У нас вы можете скачать Гдз по химии 10 класс габриелян остроумов карцова. Не забывайте оставлять свои комментарии и ставить оценки! Помните. 7 класс. Габриелян О. С., Остроумов И. Г., Ахлебинин А. К.2013, 160с. Химия.7 класс.10 класс: к учебнику Габриеляна О. С. Химия.10 кл. Базовый. Химия в тестах, задачах и упражнениях О. С. Габриелян, Г. Г. Лысова 10 класс Габриелян Олег Сергеевич, Остроумов Игорь Геннадьевич, Пономарев. ГДЗ ответы на вопросы учебника по химии 7 класс Габриелян Остроумов Ахлебинин ФГОС от Путина. Решебник готовое домашнее задание. ГДЗ ХИМИЯ 10 КЛАСС ГАБРИЕЛЯН ОСТРОУМОВ КАРЦОВА. Автор: admin Добавлено: , 18:30 Комментариев 0 Добавить. Алкины ➔ Органическая Химия, В тестах, задачах, упражнениях, Учебное пособие, Габриелян, Остроумов, Остроумова, 10 класс, Химия, Учебное пособие для Учебники, ГДЗ, решебники, ЕГЭ, ГИА, экзамены, книги. Химия, 9 класс, Габриелян О. С., Остроумов И. Г., 2010 Книги и учебники ГДЗ по химии, 11 класс, 2015, к учебнику по химии за 11 класс, Габриелян О. С. Готовые Скачать и читать Решебник по химии, 10 класс, Габриелян, 2002. Спиши сейчас онлайн! Решебник по химии 10 класс. Габриелян О. С.. Химия 10 класс: учебник для общеобразовательных учреждений. Контрольные и проверочные работы к учебнику Габриеляна О. С. Скачать бесплатно Задачник по химии.10 класс. Кузнецова Н. В., Левкин А. Н.
С. Готовые Скачать и читать Решебник по химии, 10 класс, Габриелян, 2002. Спиши сейчас онлайн! Решебник по химии 10 класс. Габриелян О. С.. Химия 10 класс: учебник для общеобразовательных учреждений. Контрольные и проверочные работы к учебнику Габриеляна О. С. Скачать бесплатно Задачник по химии.10 класс. Кузнецова Н. В., Левкин А. Н.
Вместе с гдз химия 10 класс габриелян остроумов часто ищут
Гдз органическая химия 10 класс габриелян остроумов карцова.
Гдз по химии 10 класс габриелян остроумов профильный уровень.
Гдз по химии 10 класс габриелян остроумов пономарев.
Гдз по химии 10 класс габриелян профильный уровень 2014.
Гдз по химии 10 класс габриелян профильный уровень 2013.
Гдз по химии 10 класс габриелян 2009.
Гдз по химии 10 класс рудзитис фельдман 2012 базовый уровень.
Гдз по химии 10-11 класс новошинский
Читайте также:
Cкачать решебник по математике по редакцией яковлева
Cкачать решебник по математике по редакцией яковлева
Cкачать решебник по математике по редакцией яковлева
Решебник и ГДЗ по Химии за 10 класс , авторы Габриелян О.
 С., Остроумов И.Г., Пономарев С.Ю. Углубленный уровень
С., Остроумов И.Г., Пономарев С.Ю. Углубленный уровеньВопросы в конце параграфа
§ 1
1 2 3 4 5 6 7 8 9 10§ 2
1 2 3 4 5 6 7 8 9§ 3
1 2 3 4 5 6 7§ 4
1 2 3 4 5 6 7 8§ 5
1 2 3 4 5 6§ 6
1 2 3 4 5 6 7§ 7
1 2 3 4 5 6 7 8 9 10§ 8
1 2 3 4 5§ 9
1 2 3 4 5 6 7 8 9§ 10
1 2 3 4 5 6 7 8 9 10 11§ 11
1 2 3 4 5 6 7 8 9 10 11 12§ 12
1 2 3 4 5 6 7 8 9§ 13
1 2 3 4 5 6 7 8 9 10§ 14
1 2 3 4 5 6 7 8§ 15
1 2 3 4 5 6 7 8 9 10 11 12 13§ 16
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15§ 17
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16§ 18
1 2 3 4 5 6 7 8 9 10 11§ 19
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15§ 20
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20§ 21
1 2 3 4 5 6 7 8 9 10 11 12 13§ 22
1 2 3 4 5 6 7 8§ 23
1 2 3 4 5 6 7 8 9 10 11 12§ 24
1 2 3 4 5 6 7 8 9§ 25
1 2 3 4 5 6 7 8 9 10 11 12§ 26
1 2 3 4 5 6 7 8 9 10§ 27
1 2 3 4 5 6 7 8 9 10 11§ 28
1 2 3 4 5 6 7 8 9§ 29
1 2 3 4 5 6 7§ 30
1 2 3 4 5 6 7 8 9§ 31
1 2 3 4 5 6 7 8 9 10§ 32
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16Практические работы
Практическая работа №1
1 2Практическая работа №2
1 2 3Практическая работа №3
1 2 3 4Практическая работа №4
1 2 3 4Практическая работа №5
1 2 3Практическая работа №6
1 2 3 4Практическая работа №7
1 2 3 4 5 6 7Практическая работа №8
1Практическая работа №9
1 2 3Практическая работа №10
1 2Таблица молекулярных масс.
 Относительная молекулярная масса
Относительная молекулярная массаВ химии чрезвычайно важно понятие «молекулярная масса». Молекулярную массу часто путают с молярной массой. Чем отличаются эти значения, и какими свойствами они обладают?
Молекулярная масса
Атомы и молекулы — мельчайшие частицы любых химических веществ. Если попытаться выразить их массу в граммах, то получится число, в котором до запятой будет около 20 нулей. Поэтому неудобно измерять массу в таких единицах, как граммы. Чтобы выйти из этого положения, следует принять за единицу какую-то очень малую массу, а все остальные массы выразить по отношению к ней. Эта единица составляет 1/12 массы атома углерода.
Относительная молекулярная масса – это масса молекулы вещества, которая измеряется в атомных единицах массы. Молекулярная масса равна отношению массы молекулы вещества к 1/12 массы атома углерода. Он показывает, во сколько раз масса молекулы определенного вещества больше 1/12 массы атома углерода.
Рис. 1. Таблица молекулярных масс органических веществ.
1. Таблица молекулярных масс органических веществ.
атомная единица массы (а.е.м.) равна 1,66*10 до -24 градусов и представляет собой 1/12 массы атома углерода, то есть атома изотопа элемента углерода, массовое число которого равно 12. Химический элемент в природе может иметь несколько стабильных изотопов, поэтому, когда говорят об относительной атомной массе элемента или, как часто говорят, об атомной массе элемента А, то обязательно учитывают атомную массу всех стабильных нуклидов.
Молекулярную массу часто путают с молярной массой, единицей которой является г/моль. И действительно, численно эти две величины совершенно одинаковы, но их размерность совершенно различна.
Относительную молекулярную массу можно найти, сложив атомные массы
Для расчета молекулярной массы простых и сложных веществ необходимо найти сумму относительных атомных масс атомов, входящих в состав молекулы. Например, относительная молекулярная масса воды Mr(H 2 O), которая, как известно, состоит из двух атомов водорода и одного атома кислорода, равна 1*2+16=18.
Это означает, что масса молекулы воды в 18 раз больше, чем 1/12 массы атома углерода. А молекулярная масса воздуха 29.
Рис. 2. Формула относительной молекулярной массы.
Атомная масса
Атомная масса химического элемента также является одним из важнейших обозначений в химии. Атомная масса – это среднее значение атомных масс стабильных природных изотопов этого элемента с учетом их относительной распространенности в природе (их естественного распространения). Итак, в природе существует два стабильных изотопа элемента хлора Cl с массовыми числами 35 и 37:
Ar(Cl)=(34,97*0,7553)+(36,95*0,2447)=35,45 — это значение, принятое для элемента хлора в качестве его относительной атомной массы.
Впервые расчеты атомных масс произвел Д. Дальтон. Он приписал атомный вес элементов атомному весу водорода, приняв его за единицу. Однако рассчитанные в соответствии с его принципом «наибольшей простоты» массы атома кислорода и некоторых других элементов оказались неверными.
Рис. 3. Д. Дальтон.
Истинные массы атомов ничтожны. Атом водорода весит от 1,674*10 до -24 грамма, кислорода от 26,67*10 до -24 грамма и углерода от 19,993*10 до -24 грамма.
стенограмма1 Е.В. Савинкина Г.П. Логинова ХИМИЯ В ТАБЛИЦАХ И СХЕМАХ Справочник занятий Издательство АСТ Москва
2 УДК 373:54 ВВС 24я721 С13 С13 Савинкина Елена Владимировна. Химия в таблицах и схемах: справочник: классы / Е.В. Савинкина, Г.П. Логинова. Москва: Издательство АСТ, (1) с. ISBN (ООО Издательство АСТ) (Новая школьная программа) ISBN (ООО «Издательство АСТ») (Подготовка к ЕГЭ) В справочнике в виде доступных схем и таблиц представлен школьный курс химии. Наглядное, простое и удобное изложение материала способствует его лучшему усвоению и запоминанию. Книга будет действенной помощью при изучении новых и повторении пройденных тем, а также при подготовке к ЕГЭ по курсу химии. Учителя химии могут использовать его в классе в качестве эталонной схемы. УДК 373:54 ББК 24я721 ISBN (ООО «Издательство АСТ») (Новая школьная программа) ISBN (ООО «Издательство АСТ») (Подготовка к ЕГЭ) Савинкина Е.В., Логинова Г.П. ООО «Издательский дом АСТ»
УДК 373:54 ББК 24я721 ISBN (ООО «Издательство АСТ») (Новая школьная программа) ISBN (ООО «Издательство АСТ») (Подготовка к ЕГЭ) Савинкина Е.В., Логинова Г.П. ООО «Издательский дом АСТ»
3 СОДЕРЖАНИЕ Предисловие ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ Строение атома Таблица 1. Атом Таблица 2. Основные положения квантовой теории строения атома Таблица 3. Энергетические уровни и подуровни Электронные конфигурации нейтральных атомов в основном состоянии для элементов первых четырех периодов Периодический закон Д.И. Менделеева Таблица 7. Номера периодов и групп Таблица 8. Закономерности изменения свойств по группам Таблица 9. Закономерности изменения свойств по периодам Таблица 10. Изменения состава и свойств водородных соединений, высших оксидов и гидроксидов элементов 3-й период периодической системы
4 4 Химическая связь Таблица 11. Типы химической связи Таблица 12. Описание ковалентной связи Таблица 13. Механизмы образования ковалентной связи Таблица 14. Схема кратных связей 3. Орбитальное перекрытие Таблица 15. Формулы молекул Таблица 16. Параметры химической связи Таблица 17. Валентность. Степень окисления Таблица 18. Определение степени окисления Таблица 19. Типы кристаллических решеток Классификация химических реакций Таблица 20. Классификация по изменению состава веществ Таблица 21. Классификация веществ по агрегатному состоянию Таблица 22. Классификация по признаку обратимости Таблица 23. Классификация по тепловому эффекту Скорость химической реакции Таблица 24. Основные величины Таблица 25. Зависимость скорости реакции от концентрации Таблица 26. Изменение скорости химической реакции Химическое равновесие Таблица 27. Принцип Ле Шателье Таблица 28. Смещение химическое равновесие Электролитическая диссоциация Таблица 29. Продукты диссоциации
Формулы молекул Таблица 16. Параметры химической связи Таблица 17. Валентность. Степень окисления Таблица 18. Определение степени окисления Таблица 19. Типы кристаллических решеток Классификация химических реакций Таблица 20. Классификация по изменению состава веществ Таблица 21. Классификация веществ по агрегатному состоянию Таблица 22. Классификация по признаку обратимости Таблица 23. Классификация по тепловому эффекту Скорость химической реакции Таблица 24. Основные величины Таблица 25. Зависимость скорости реакции от концентрации Таблица 26. Изменение скорости химической реакции Химическое равновесие Таблица 27. Принцип Ле Шателье Таблица 28. Смещение химическое равновесие Электролитическая диссоциация Таблица 29. Продукты диссоциации
5 Таблица 30. Некоторые сильные кислоты и основания Таблица 31. Степень диссоциации обменных реакций в растворе Таблица 32. Правила Бертолле Таблица 33. Молекулярные и ионные уравнения Гидролиз Таблица 34. Гидролиз неорганических веществ Таблица 35. Обратимый гидролиз солей Таблица 36. Среда в растворах солей кислот окислительно-восстановительные реакции электронный баланс Таблица 44. Замедление коррозии Электролиз Таблица 45. Электроды Таблица 46. Электролиз расплавов Таблица 47. Электролиз растворов Механизмы реакций в органической химии Таблица 48. Основные механизмы реакций
Обратимый гидролиз солей Таблица 36. Среда в растворах солей кислот окислительно-восстановительные реакции электронный баланс Таблица 44. Замедление коррозии Электролиз Таблица 45. Электроды Таблица 46. Электролиз расплавов Таблица 47. Электролиз растворов Механизмы реакций в органической химии Таблица 48. Основные механизмы реакций
6 Таблица 49. Механизм реакции замещения Таблица 50. Правило Марковникова НЕОРГАНИЧЕСКАЯ ХИМИЯ Классы неорганических веществ Таблица 51. Неорганические вещества Таблица 52. Простые вещества Таблица 53. Положение неметаллов в периодической системе элементов Таблица 54. Сложные вещества Таблица 55. Орто- и метаформы гидроксидов Таблица 56. Тривиальные названия некоторых кислородсодержащих кислот и их анионов Таблица 57. Классификация гидроксидов и оксидов Таблица 58. Классификация солей Схема 4. Общая классификация неорганических веществ Металлы Таблица 59. Реакции металлов Неметаллы Таблица 60. Реакции оксидов неметаллов Таблица 61. Реакции основных оксидов Таблица 62. Реакции кислотных оксидов Таблица 63. Реакции амфотерных оксидов Основания и амфотерные гидроксиды Таблица 64. Реакции оснований Таблица 65. Реакции амфотерных гидроксиды
Реакции кислотных оксидов Таблица 63. Реакции амфотерных оксидов Основания и амфотерные гидроксиды Таблица 64. Реакции оснований Таблица 65. Реакции амфотерных гидроксиды
7 кислот комплексные соли (гидроксокомплексы) Таблица 72. Разложение нитратов (в зависимости от положения металлов в ряду напряжений) Таблица 73. Разложение солей аммония Взаимосвязь классов неорганических веществ Таблица 74. Превращения неорганических веществ ОРГАНИЧЕСКИЕ ХИМИЯ Строение органических веществ Таблица 75. Теория строения органических веществ А. М. Бутлеров Таблица 76. Типы органических соединений Таблица 77. Углерод-углеродные связи Таблица 78. Атом углерода Таблица 79. Виды гибридизации Таблица 80. Состав органических молекул Таблица 81. Классы органических соединений.. 73 Таблица 82. Изомеры Таблица 83. Взаимное влияние атомов в молекулах
8 8 Номенклатура органических веществ Таблица 84. Компоненты названий органических соединений Таблица 85. Названия углеродных цепей Таблица 86. Обозначение степени насыщения связей Таблица 87. Названия характеристических групп органических соединений Таблица 88. Названия некоторых ароматических соединений Таблица 89. Названия некоторых углеводородных радикалов Таблица 90 Числовые префиксы (указывают количество одинаковых структурных элементов) Таблица 91. Состав названия вещества Углеводороды Таблица 92. Классификация углеводородов Таблица 93. Реакции предельных углеводородов Таблица 94. Реакции непредельных углеводородов Таблица 95 ароматических углеводородов Таблица 96. Реакции галогеналканов Кислородсодержащие органические соединения Таблица 97. Спирты и фенолы Таблица 98. Реакции спиртов и фенолов Таблица 99. Карбонильные соединения Таблица 100. Реакции альдегидов и кетонов Таблица 101. Карбоновые кислоты Таблица 102. Реакции карбоновых кислот Азотсодержащие органические соединения Таблица 103. Амины Таблица 104. Реакции аминов
Названия характеристических групп органических соединений Таблица 88. Названия некоторых ароматических соединений Таблица 89. Названия некоторых углеводородных радикалов Таблица 90 Числовые префиксы (указывают количество одинаковых структурных элементов) Таблица 91. Состав названия вещества Углеводороды Таблица 92. Классификация углеводородов Таблица 93. Реакции предельных углеводородов Таблица 94. Реакции непредельных углеводородов Таблица 95 ароматических углеводородов Таблица 96. Реакции галогеналканов Кислородсодержащие органические соединения Таблица 97. Спирты и фенолы Таблица 98. Реакции спиртов и фенолов Таблица 99. Карбонильные соединения Таблица 100. Реакции альдегидов и кетонов Таблица 101. Карбоновые кислоты Таблица 102. Реакции карбоновых кислот Азотсодержащие органические соединения Таблица 103. Амины Таблица 104. Реакции аминов
9 Таблица 105. Названия некоторых природных аминокислот Таблица 106. Свойства аминокислот Биологически важные вещества Схема 5. Жиры Таблица 107. Карбоновые кислоты, входящие в состав жиров Таблица 108. Углеводы Таблица 109. Структурные уровни белковых молекул Таблица 110. Химические свойства белков Таблица 111. Цветные реакции белков Связь органических соединений Таблица 112. Катализаторы, применяемые в органической химии Схема 6. Генетическая связь органических соединений МЕТОДЫ ЗНАНИЙ В ХИМИИ Работа с веществами и химическим оборудованием Таблица 113 Химическая лаборатория Таблица 114. Химическая посуда и оборудования Таблица 115. Основные приемы работы в химической лаборатории Таблица 116. Правила применения веществ в быту Научные методы исследования химических веществ и превращений Таблица 117. Методы исследования Таблица 118. Методы разделения смесей
Карбоновые кислоты, входящие в состав жиров Таблица 108. Углеводы Таблица 109. Структурные уровни белковых молекул Таблица 110. Химические свойства белков Таблица 111. Цветные реакции белков Связь органических соединений Таблица 112. Катализаторы, применяемые в органической химии Схема 6. Генетическая связь органических соединений МЕТОДЫ ЗНАНИЙ В ХИМИИ Работа с веществами и химическим оборудованием Таблица 113 Химическая лаборатория Таблица 114. Химическая посуда и оборудования Таблица 115. Основные приемы работы в химической лаборатории Таблица 116. Правила применения веществ в быту Научные методы исследования химических веществ и превращений Таблица 117. Методы исследования Таблица 118. Методы разделения смесей
10 Таблица 119. Цвета индикаторов Таблица 120. Качественные реакции на катионы Таблица 121. Качественные реакции на анионы Таблица 122. Обнаружение газов Таблица 123. Распознавание органических соединений Методы получения веществ Таблица 124. Методы получения простых веществ Таблица 125. Способы получения оксидов Таблица 126. Способы получения оснований и амфотерных гидроксидов Таблица 127. Способы получения кислот Таблица 128. Способы получения солей Таблица 129. Способы получения предельных углеводородов Таблица 130. Способы получения алкенов Таблица 131. Способы получения алкинов (ацетилена) Таблица 132. Способы получения аренов (бензола) Таблица 133. Способы получения одноатомных спиртов Таблица 134 многоатомных спиртов Таблица 135. Способы получения фенолов Таблица 136. Способы получения альдегидов и кетонов Таблица 137. Способы получения карбоновых кислот Промышленное производство веществ Таблица 138. Способы получения металлов Таблица 139. Металлургические методы Схема 7. Доменный процесс
Способы получения оксидов Таблица 126. Способы получения оснований и амфотерных гидроксидов Таблица 127. Способы получения кислот Таблица 128. Способы получения солей Таблица 129. Способы получения предельных углеводородов Таблица 130. Способы получения алкенов Таблица 131. Способы получения алкинов (ацетилена) Таблица 132. Способы получения аренов (бензола) Таблица 133. Способы получения одноатомных спиртов Таблица 134 многоатомных спиртов Таблица 135. Способы получения фенолов Таблица 136. Способы получения альдегидов и кетонов Таблица 137. Способы получения карбоновых кислот Промышленное производство веществ Таблица 138. Способы получения металлов Таблица 139. Металлургические методы Схема 7. Доменный процесс
11 Таблица 140. Некоторые промышленные процессы Таблица 141. Продукты фракционной перегонки нефти Таблица 142. Химическая переработка нефти Таблица 143. Получение высокомолекулярных соединений (полимеров) Таблица 144. Классификация полимеров по химическим формулам и уравнения реакций физические условия Таблица 150. Стехиометрические законы Таблица 151. Расчеты уравнений реакций Таблица 152. Нахождение молекулярных формул веществ ПРИЛОЖЕНИЯ Таблица 1. Элементы периодической системы Д.И. Менделеева Таблица 2. Химические элементы: порядковый номер, атомная масса (округлено), электроотрицательность Таблица 3. Растворимость неорганических соединений в воде
Стехиометрические законы Таблица 151. Расчеты уравнений реакций Таблица 152. Нахождение молекулярных формул веществ ПРИЛОЖЕНИЯ Таблица 1. Элементы периодической системы Д.И. Менделеева Таблица 2. Химические элементы: порядковый номер, атомная масса (округлено), электроотрицательность Таблица 3. Растворимость неорганических соединений в воде
12 ПРЕДИСЛОВИЕ В помощь школьникам и учителям предлагается пособие, представляющее собой обобщенное изложение в наглядных таблицах и схемах всех основных правил, законов, формул и расчетов в курсе органической и неорганической химии. Включены все основные разделы химии, изучаемые на уроках. Это строение атома, периодический закон Д. И. Менделеева, строение химических элементов периодической системы, виды химических связей, вещества и смеси, классы неорганических соединений, классификация химических реакций, скорости химических реакций и химическое равновесие, механизмы реакций в органической химии, металлы и неметаллы и их свойства, химические свойства сложных веществ, взаимосвязь классов неорганических веществ, органические вещества и их строение, состав органических молекул, изомеры, номенклатура органических веществ, углеводороды, их классификация и свойства, азотсодержащие органические соединения, биологически важные вещества, строение и свойства белковых молекул, углеводов, взаимосвязь органических соединений. Кроме того, в пособии описаны основные правила и приемы работы в химической лаборатории, даны характеристики химических
Кроме того, в пособии описаны основные правила и приемы работы в химической лаборатории, даны характеристики химических
13 судов и оборудования, приведены примеры расчетов на основе формул и уравнений реакций, а также примеры качественных реакций. Приложение к пособию содержит периодическую таблицу элементов Д. И. Менделеева, таблицу растворимости неорганических соединений в воде. Краткое и лаконичное изложение материала поможет учащимся самостоятельно или с помощью учителя повторить школьный курс химии и успешно подготовиться к ЕГЭ в 11 классе. Структура пособия соответствует структуре кодификатора содержание элементов по химии для составления контрольных замеров материалов ЕГЭ и соответствует логике изучения и повторения школьного курса химии. В руководстве приняты следующие сокращения: конц. концентрированный раствор, н. у. в нормальных условиях, о. разб. очень разбавленный раствор, практ. практичный, разб. разбавленный раствор, теор. теоретический.
14 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ СТРОЕНИЕ АТОМА Атом Таблица 1 Электроны (д) Ядро протоны (р+) нейтроны (n 0) Массовое число (А) общее число протонов и нейтронов в атомном ядре Заряд ядра атома (Z) равно числу протонов в ядре и числу электронов в атоме A = N (n 0) + N (p +) Z = N (p +) = N (e ) невозможность определения траектории электрона (принцип неопределенности) 14
15 Энергетические уровни и подуровни Таблица 3 Энергетические уровни (ЭУ) Энергетические подуровни (ЭПУ) Число электронов 1 1s 2 2 2s 2p 3 3s 3p 3d 4 4s 4p 4d 4f атомный орбиталь (АО) характеризует область пространства, в которой вероятность пребывания электрона, обладающего определенной энергией, наибольшая. Орбитальные формы Схема 1 s-орбитальная p-орбитальная 15
Орбитальные формы Схема 1 s-орбитальная p-орбитальная 15
ЕГЭ по ХИМИИ классификатор элементов содержания и требований к уровню подготовки выпускников организаций образования к ЕГЭ по химии
Содержание Предисловие редактора… 3 Введение… 5 Часть I. ОСНОВЫ ОБЩЕЙ ХИМИИ Раздел 1. Основные понятия и законы химии 1.1. Определение и предмет химии…9 1.2. Исходные сведения о строении атомов.
РЕЗУЛЬТАТЫ ЕГЭ ПО ХИМИИ (11 июня 2009 г.)) Королев 2009 1
Единый государственный экзамен по ХИМИИ измерительные материалы ЕГЭ 2000 по химии подготовлен Федеральным государственным научным учреждением
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ образовательное учреждение высшего профессионального образования «Северо-Кавказское государственное гуманитарно- Технологическая
Министерство образования и науки Российской Федерации ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «СИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ»
ВСТУПИТЕЛЬНАЯ ПРОГРАММА ПО ХИМИИ Программа по химии для абитуриентов состоит из четырех частей. В первой части представлены основные теоретические понятия химии, которые следует
В первой части представлены основные теоретические понятия химии, которые следует
СОДЕРЖАНИЕ ПРОГРАММЫ Раздел 1. Химический элемент Тема 1. Строение атомов. Периодический закон и периодическая система химических элементов Д.И. Менделеев. Современные представления о строении атомов.
УДК 373.167.1:54 БАК 24й7 М 55 М 55 Мешкова О.В. ÅÝ. Химия: универсальный справочник / О.В. Мешков. Я. : Сузуза-пресс, 2013. 352 с. (ЕАÝ. Универсальный справочник). ISBN 978-5-99550-658-4 Справочник
БИЛЕТЫ ПО ХИМИИ 10-11 КЛАСС. БИЛЕТ 1 1. Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атомов. Значение периодического закона для
Билет 1 1. Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки. 2. Ограничение углеводородов,
Муниципальное автономное образовательное учреждение Калининградская городская средняя общеобразовательная школа 38 РАССМОТРЕН на заседании Минобороны протокол 09. 08.06 «СОГЛАСОВАНО» на заседании ПС протокол
08.06 «СОГЛАСОВАНО» на заседании ПС протокол
Отчет о репетиции ЕГЭ по химии в Красногвардейском районе Санкт-Петербурга 1. Структура работы Каждый вариант работы состоит из трех частей и включает 43 задания. Часть 1 содержит
ПРОЕКТ ВСЕРОССИЙСКОЙ ПРОВЕРОЧНОЙ РАБОТЫ ПО ХИМИИ ОПИСАНИЕ ВСЕРОССИЙСКОЙ ПРОВЕРОЧНОЙ РАБОТЫ ПО ХИМИИ 11 класс подготовлен ФГБНУ «ФЕДЕРАЛЬНЫЙ ИНСТИТУТ
СТАНДАРТ СРЕДНЕГО (ПОЛНОГО) ОБЩЕГО ОБРАЗОВАНИЯ ПО ХИМИИ БАЗОВЫЙ УРОВЕНЬ Изучение химии на основном уровне среднего (полного) общего образования направлено на достижение следующих целей: усвоение знаний
Вопросы к промежуточной аттестации по химии в классах 10-11 за 2012-2013 учебный год Учебник Г.Э., Рудзитис Ф.Г. Фельдмана «Химия 10 класс», «Химия 11 класс» Москва 2010 1. Периодический закон и периодический
Пояснительная записка Рабочая программа по химии составлена на основании: федерального компонента государственного образовательного стандарта среднего (полного) общего образования . М.: «Просвещение» 2004,
М.: «Просвещение» 2004,
ХИМИЧЕСКАЯ ПРОГРАММА ТЕОРИЯ СТРОЕНИЯ ВЕЩЕСТВА. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Теория строения вещества Атом. Молекула. Химический элемент. Вещество. Молекулярные и структурные формулы. Составные атомные ядра. Структура
«УТВЕРЖДЕНО» Руководитель Федеральной службы по надзору в сфере образования и науки «СОГЛАСОВАНО» Председатель Научно-методического совета ФИПИ по химии ЕГЭ по ХИМИИ СПЕЦИФИКАЦИЯ
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ХИМИИ теоретические позиции химии как одной из важнейших естественных наук, лежащих в основе научного понимания
План реферата на тему Алканы (предельные или предельные углеводороды, парафины) Фамилия, имя, группа Алканы выписать определение Гомологический ряд алканов: составить таблицу первых десяти представителей
Планируемые по предмету результаты разработки предмета В результате изучения химии на базовом уровне студент должен знать/понимать важнейшие химические понятия: вещество, химический элемент , атом,
Отдел образования Артемовского городского округа Коммунальное автономное общеобразовательное учреждение Артемовского городского округа «Средняя общеобразовательная школа 56 с углубленным изучением
ХИМИЯ, класс Спецификация контрольно-измерительных материалов для проведения единого государственного экзамена по ХИМИИ в 0 год ЕГЭ по ХИМИИ Спецификация контрольных средств измерений
Химия 10 класс 11 ФК СЭС (базовый уровень) Основное содержание предмета Методы познания по химии Научные методы познания веществ и химических явлений Роль эксперимента и теория по химии. Моделирование
Моделирование
ХИМИЯ, класс Спецификация контрольно-измерительных материалов для проведения ЕГЭ по ХИМИИ в 0 год ЕГЭ по ХИМИИ Спецификация контрольных средств измерений
ХИМИЯ, класс ЕГЭ по ХИМИИ
Департамент образования город Москва Государственное бюджетное профессиональное образовательное учреждение города Москвы «МОСКОВСКИЙ АВТОМОБИЛЬНО-ДОРОЖНЫЙ КОЛЛЕДЖ ИМ. А.А. НИКОЛАЕВА» РАБОЧАЯ ПРОГРАММА
Анализ предмета HSC Химия. Параллельные 8 занятий Контрольная тема: «Исходные химические понятия» Дата: ноябрь 2014 г. 8А/1 18 5 8 5 0 100% 72% 4,0 8Б/1 15 0 8 6 1 93% 53% 3,5 8Б/1 21 1 11 8 1 95 %
АНАЛИТИЧЕСКИЙ ОТЧЕТ ПРЕДМЕТНОЙ КОМИССИИ ПО РЕЗУЛЬТАТАМ ИСПОЛЬЗОВАНИЯ В ХИМИИ 1 Отчет подготовлен А.Н. Левкин, заместитель председателя предметной комиссии по химии 2 1. ПОДГОТОВКА К ЕДИНОМУ ГОСУДАРСТВУ
Пояснительная записка Рабочая программа составлена на основе Федерального компонента государственного стандарта среднего (полного) общего образования по химии (базовый уровень) , программа использовалась
ПРОГРАММА вступительных испытаний по химии для иностранных граждан, поступающих на программы бакалавриата и специалитета Программа предназначена для поступающих по направлениям:
Атомно-молекулярное учение. Молекулы. Атомы. Химический элемент, простое вещество, сложное вещество. Знаки химических элементов и химические формулы. Расчет массовой доли химического элемента в веществе
Молекулы. Атомы. Химический элемент, простое вещество, сложное вещество. Знаки химических элементов и химические формулы. Расчет массовой доли химического элемента в веществе
Приложение 10 к приказу 311/1 от 28.08.2015 «Об утверждении основных общеобразовательных программ основного общего образования (ФГОС), основного общего образования, среднего общего образования» Рабочая
Химия 1. Исходные химические понятия. Предмет химии. тела и вещества. Основные методы познания: наблюдение, измерение, описание, эксперимент. Физические и химические явления. Правила техники безопасности
1 Пояснительная записка Настоящая программа разработана на основании Примерных программ основного общего образования по химии (базовый уровень), соответствующих федеральному компоненту ГОСТ
Календарно-тематическое планирование Предмет: Химия Класс: 11 часов в неделю: 2 Всего часов в год: 68 I триместр. Всего недель: 10,6, всего часов: 22. Сек. Тема урока Тема 1. Строение атома периодическое
Строение атома периодическое
ПРОГРАММА ПО ХИМИИ Программа основана на обязательном минимуме среднего (полного) общего образования и состоит из трех разделов. Первый раздел посвящен теоретическим основам химии. В
2 Спецификация контрольных измерительных материалов к ЕГЭ по ХИМИИ в 2016 году ЕГЭ по ХИМИИ Спецификация контрольных средств измерений
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ХИМИИ В САРАТОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ В 2009 году1. Предмет химии, ее задачи. Место химии среди естественных наук, связь наук с химией.
ЭКЗАМЕНАЦИОННЫЕ БИЛЕТЫ ГОСУДАРСТВЕННОЙ ИТОГОВОЙ АТТЕСТАЦИИ ПО ХИМИИ ПО ПРОГРАММАМ ОСНОВНОГО ОБЩЕОБРАЗОВАНИЯ Билет 1 1. Периодическая система химических элементов Д.И.Менделеева и строение атомов:
планирование урока по химии, 11 класс, ( 1 час в неделю, всего 34 часа), методические материалы О. С. Габриелян Тема урока Элементы содержания Требования к уровню подготовленности учащихся Эксперимент Домашнее задание дата
Структура рабочей программы: 1. Пояснительная записка к рабочей программе 2. Календарно-тематические планы на 10-11 классы 3. Требования к уровню усвоения знаний обучающимися 4. Формы проверки знаний
Пояснительная записка к рабочей программе 2. Календарно-тематические планы на 10-11 классы 3. Требования к уровню усвоения знаний обучающимися 4. Формы проверки знаний
Тест программы по химии Предмет и задачи по химии. Место химии среди естественных наук. Атомно-молекулярное учение. Молекулы. Атомы. Постоянство состава вещества. относительный атомный и относительный
ЕГЭ по ХИМИИ ПРОЕКТ ХИМИЯ, 11 класс 2 Спецификация контрольно-измерительных материалов к ЕГЭ по ХИМИИ в 2017 г. Спецификация контрольных
2 Плановые результаты освоения предмета В результате изучения химии студент должен знать/понимать: химические символы: знаки химических элементов, формулы химических веществ и уравнения химических веществ
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ПРЕДМЕТУ «ХИМИЯ» На экзамене по химии при поступлении в вуз необходимо: — показать знание основных теоретических положений ; — уметь применять теоретические
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ХИМИИ Программа основана на обязательном минимуме среднего (полного) общего образования и состоит из трех разделов. Первый раздел посвящен теоретическим
Первый раздел посвящен теоретическим
Рабочая программа элективного курса «Химия» для 11 класса на 2016-2017 учебный год автор: учитель биологии и химии Колосницына С.В. с.зубово 2016 Пояснительная записка по элективному курсу «Химия» предназначена
ХИМИЯ Теория строения вещества Атом. Состав атомных ядер. Химический элемент. Постоянство состава вещества. Относительная атомная и относительная молекулярная масса. Закон сохранения массы, его значение
Тематическое планирование на 2015-2016 учебный год химия 10 класс Учебник О.С. Урок Габриелян Дата Название раздела, тема занятия (с указанием количества часов) Формируемые знания, умения. Направления деятельности
ЕГЭ по ХИМИИ
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УРФ В 2014 ГОДУ При подготовке к ЕГЭ абитуриенты должны показать знание основных теоретических положений химии как одной из важнейших естественных наук .
ПРОГРАММА ПО ХИМИИ ОБЩИЕ УКАЗАНИЯ На экзамене по химии поступающие в академию должны показать: 1) четкое знание основных законов химии и положений теории строения вещества, на которых основаны все современные
СТАНДАРТ ОСНОВНОГО ОБЩЕГО ОБРАЗОВАНИЯ ПО ХИМИИ Изучение химии на уровне основного общего образования направлено на достижение следующих целей: овладение важнейшими знаниями об основных понятиях и законах
Перечень элементов содержания, проверяемых на вступительном экзамене по ХИМИИ Предметное тестирование позволяет оценить уровень общеобразовательной подготовки по химии выпускников IX классов общеобразовательной школы
ПРОГРАММА Вступительных испытаний по химии в ПГУ в 2016 году ПО ХИМИИ для абитуриентов Раздел 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ Современные представления о строении
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ Современные представления о строении
Пояснительная записка для 0 класса. Программа отличается в соответствии с Федеральным компонентом государственного образовательного стандарта среднего общего образования и базируется на программе общее образование
2 Пояснительная записка Программа разработана на основе обязательного минимума содержания среднего (полного) общего образования по химии. Содержание программы 1. Предмет и задачи по химии. физические явления
Поступающие в вуз должны показать знание основных теоретических положений химии как одной из важнейших естественных наук, лежащих в основе научного понимания природы. Кандидат должен уметь подать заявку
 Ядерная модель строения атома. Состояние электрона в атоме. Электронное заполнение орбиталей, принцип наименьшей энергии, правило Клечковского, принцип Паули, правило Хунда
Ядерная модель строения атома. Состояние электрона в атоме. Электронное заполнение орбиталей, принцип наименьшей энергии, правило Клечковского, принцип Паули, правило Хунда Валентные электроны, понятие валентности, понятие электроотрицательности
Валентные электроны, понятие валентности, понятие электроотрицательности Правило Вант-Гоффа. Обратимые и необратимые химические реакции. химический баланс. Принцип Ле Шателье. Катализ
Правило Вант-Гоффа. Обратимые и необратимые химические реакции. химический баланс. Принцип Ле Шателье. КатализМ.: 20 1 4. — 2 40 с.
Весь школьный курс химии представлен в виде логических схем и информативных таблиц. Наглядное, наглядное и схематичное изложение материала позволяет быстро усваивать большой объем информации, облегчает понимание сложных законов, понятий, определений, обобщает и систематизирует знания. Книга поможет учащимся эффективно подготовиться к сдаче ЕГЭ по химии.
Книга поможет учащимся эффективно подготовиться к сдаче ЕГЭ по химии.
Формат: pdf
Размер: 7,6 МБ
Смотреть, скачать: drive.google
Содержание
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
1.1. Химический элемент 8
1.1.1. Современные представления о строении атома. Строение электронных оболочек атомов
элементов первых четырех периодов: s-, p- и d-элементов. Электронная конфигурация атома. Атомы в основном и возбужденном состоянии 8
1.1.2. Периодический закон и Периодическая система химических элементов Д. И. Менделеева.
Радиусы атомов, их периодические изменения в системе химических элементов. Закономерности изменения химических свойств элементов и их соединений по периодам и группам 30
1.2. Химическая связь и строение вещества 33
1.2.1. ковалентная химическая связь, ее разновидности (полярная и неполярная), механизмы образования. Характеристики ковалентной связи (длина связи и энергия). Ионная связь. металлическое соединение. водородная связь 33
Ионная связь. металлическое соединение. водородная связь 33
1.2.2. Электроотрицательность. Степень окисления и валентность химических элементов 40
1.2.3. Вещества молекулярного и немолекулярного строения. Зависимость свойств веществ от особенностей их кристаллической решетки 41
1.3. Неорганическая химия 45
1.3.1. Классификация и номенклатура неорганических веществ 45
1.3.2. общая характеристика металлов основных подгрупп групп I-III в связи с их положением в Периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов 46
1.3.3. Характерные переходные элементы — медь, цинк, хром, железо — по их положению в Периодической системе химических элементов Д.И. Менделеев и особенности строения их атомов 47
1.3.4. Общая характеристика неметаллов основных подгрупп IV-VII групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеев и особенности строения их атомов 49
1.3.5. Характеристика химических свойств простых веществ — металлов: щелочных, щелочноземельных, алюминиевых, переходных металлов (медь, цинк, хром, железо) 53
1. 3.6. Характерные химические свойства простых веществ — неметаллов: водород, галогены, кислород, сера, азот, фосфор, углерод, кремний 71
3.6. Характерные химические свойства простых веществ — неметаллов: водород, галогены, кислород, сера, азот, фосфор, углерод, кремний 71
1.3.7. Характеристика химических свойств оксидов: основные, амфотерные, кислотные 106
1.3.8. Характеристика химических свойств оснований и амфотерных гидроксидов 109
1.3.9. Характеристика химических свойств кислот 113
1.3.10. Характерные химические свойства солей: средние, кислые, основные; сложные (на примере соединений алюминия и цинка). . . 118
1.4. Органическая химия 128
1.4.1. Теория строения органических соединений. Изомерия — структурная и пространственная. Гомологи и гомологические ряды 128
1.4.2. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикальный. Функциональная группа 133
1.4.3. Классификация и номенклатура органических соединений 135
1.4.4. Характерные химические свойства углеводородов: алканы, циклоалканы, алкены, диены, алкины 138
1.4. 5. Характеристика химических свойств ароматических углеводородов: бензола и толуола 148
5. Характеристика химических свойств ароматических углеводородов: бензола и толуола 148
1.4.6. Характеристика химических свойств предельных одноатомных и многоатомных спиртов; фенол 152
1.4.7. Характеристика химических свойств альдегидов, предельных карбоновых кислот, сложных эфиров 157
1.4.8. Характеристика химических свойств азотсодержащих органических соединений: амины и аминокислоты 163
1.4.9. Биологически важные вещества: жиры, белки, углеводы (моносахариды, дисахариды, полисахариды) 166
1.5. Химическая реакция 172
1.5.1. Классификация химических реакций в неорганической и органической химии 172
1.5.2. Тепловой эффект химической реакции. Термохимические уравнения 174
1.5.3. Скорость реакции, ее зависимость от различных факторов 175
1.5.4. Обратимые и необратимые химические реакции. химический баланс. Смещение химического равновесия под влиянием различных факторов 177
1.5.5. Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты 179
Сильные и слабые электролиты 179
1.5.6. Ионообменные реакции 182
1.5.7. Гидролиз солей. Среда водные растворы: кислые, нейтральные, щелочные 183
1.5.8. Окислительно-восстановительные реакции. Коррозия металлов и методы защиты от нее. . 185
1.5.9. Электролиз расплавов и растворов (солей, щелочей, кислот) 188
1.5.10. Механизмы реакций замещения и присоединения в органической химии. Правило В. В. Марковникова 189
1.5.11. Реакции, подтверждающие родство различных классов 191
2. МЕТОДЫ ПОЗНАНИЯ ВЕЩЕСТВ И ХИМИЧЕСКИЕ РЕАКЦИИ
2.1. Экспериментальная Основы химии 193
2.1.1. Правила работы в лаборатории. Правила безопасности при работе с едкими, легковоспламеняющимися и ядовитыми веществами, бытовой химией 193
2.1.2. Научные методы изучения химических веществ и превращений. Методы разделения смесей и очистки веществ 195
2.1.3. Определение характера среды водных растворов веществ. Показатели 196
2.1.4. качественные реакции на неорганические вещества и ионы. Идентификация органических соединений 196
Идентификация органических соединений 196
2.2. Общие методы получения веществ 203
2.2.1. Общие методы получения металлов. Общенаучные основы химического производства (например, промышленное производство аммиака, серной кислоты, метанола) 204
2.2.2. природные источники и переработка углеводородов 207
2.2.3. Высокомолекулярные соединения. Реакции полимеризации и поликонденсации. Полимеры. Пластмассы, волокна, каучуки 209
2.2.4. Реакции, характеризующие основные свойства и способы получения 212
2.3. Расчеты по химическим формулам и уравнениям реакций 217
2.3.1. Расчет массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей 224
2.3.2. Расчеты: объемные отношения газов в химических реакциях 225
2.3.3. Расчет массы вещества или объема газов по известному количеству вещества, массы или объема одного из веществ, участвующих в реакции 226
2.3.4. Расчет реакций теплового эффекта 229
2.3. 5. Расчет массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) 231
5. Расчет массы (объема, количества вещества) продуктов реакции, если одно из веществ дано в избытке (имеет примеси) 231
2.3.6. Расчет массы (объема, количества вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества 233
2.3.7. Нахождение молекулярной формулы вещества. 234
2.3.8. Расчет массового или объемного выхода продукта реакции из теоретически возможного 236
2.3.9. Расчет массовой доли (массы) химического соединения в смеси 238
Настоящий справочник содержит изложенные в сжатой и доступной форме основные материалы школьного курса химии: общая химия, неорганическая химия, органическая химия. Пособие оформлено в виде таблиц и диаграмм. Рекомендуется для школьников, абитуриентов и школьных учителей.
Периодический закон.
Свойства химических элементов, а также формы и свойства соединений элементов находятся в периодической зависимости от заряда ядер их атомов.
1. Порядковый номер элемента — равен заряду ядра и количеству электронов.
2. Номер периода — количество уровней.
3. Номер группы — валентность (максимально положительная степень окисления).
4. Элементы свойств металла увеличиваются сверху вниз и справа налево. Этими свойствами обладают элементы с небольшим числом валентных электронов.
ОБЩАЯ ХИМИЯ
Основные понятия и законы химии.
Атомно-молекулярное учение.
Мотылек. Молярная масса вещества.
Химические реакции.,
Закон сохранения массы вещества.
Закон постоянства состава вещества.
газовых законов.
Периодический закон Д.И. Менделеев.
Строение атома.
Модель состояния электрона в атоме.
Периодический закон.
Химическая связь. ковалентная связь
.
Ионная связь.
полярных молекул. неполярные молекулы.
Металлическое соединение.
Водородная связь.
Кристаллическая кювета. Типы кристаллических решеток.
Структурные формулы.
Степень окисления.
Валентность.
Скорость химических реакций, химическое равновесие.
Энергия активации.
Понятие о катализе и катализаторах.
Обратимые и необратимые реакции.
химический баланс. Принцип Ле Шателье.
Решения. Теория электролитической диссоциации.
Численное выражение состава растворов.
Растворимость веществ в воде.
Тепловые явления при растворении.
Электролиты и неэлектролиты.
Теория электролитической диссоциации. Механизм.
Диссоциация кислот, оснований и солей в водных растворах.
Степень диссоциации. Ионообменные реакции.
диссоциация воды.
Важнейшие классы неорганических соединений.
Оксиды.
Кислоты.
Гидроксиды.
Соль.
Окислительно-восстановительные реакции.
Теория окислительно-восстановительных реакций.
Составление уравнений окислительно-восстановительных реакций.
Влияние окружающей среды на характер реакций.
Классификация.
Электролиз.
НЕОРГАНИЧЕСКАЯ ХИМИЯ.
Водород.
Соединения водорода.
щелочных металлов. я группирую. Основная подгруппа.
щелочноземельных металлов. группа ИИА. (Кальций).
Элементы группы III A (алюминий).
Элементы группы IV A (углерод, кремний).
Элементы группы UA (азот, фосфор).
Элементы группы VIA. Халькогены (кислород, сера).
Элементы группы VIIA. Галогены (хлор).
Элементы второстепенных подгрупп.
Подгруппа хрома.
подгруппа железа.
ОРГАНИЧЕСКАЯ ХИМИЯ.
Углеводороды.
Ограничение углеводородов.
ненасыщенных углеводородов.
ароматических углеводородов.
Кислородсодержащие органические соединения.
Спирты.
Фенолы.
Альдегиды.г.
Поликонденсация.
Кетоны.
карбоновые кислоты.
Сложные эфиры.
Азотсодержащие органические соединения.
Амины.
Анилин.
Аминокислоты.
Белки.
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу Химия в таблицах и схемах, Курмашева К. К., 2002 — fileskachat.com, скачать быстро и бесплатно.
К., 2002 — fileskachat.com, скачать быстро и бесплатно.
- Классный учебник английского языка для начинающих и начинающих, Драгункин А.Н., 2002 г. — Сегодня произошло событие, которое, видимо, через некоторое время тоже назовут этапным, «цивилизационным». Это событие… Книги по английскому языку
- Новый справочник химика и технолога Основные свойства неорганических, органических и элементоорганических соединений, 2002
Органика в таблицах и схемах. Алгоритм нахождения химической формулы вещества
стенограмма1 Е.В. Савинкина Г.П. Логинова ХИМИЯ В ТАБЛИЦАХ И СХЕМАХ Справочник занятий Издательство АСТ Москва
2 УДК 373:54 ВВС 24я721 С13 С13 Савинкина Елена Владимировна. Химия в таблицах и схемах: справочник: классы / Е.В. Савинкина, Г.П. Логинова. Москва: Издательство АСТ, (1) с. ISBN (ООО Издательство АСТ) (Новая школьная программа) ISBN (ООО «Издательство АСТ») (Подготовка к ЕГЭ) Справочник представляет школьный курс химии в виде доступных схем и таблиц. Наглядное, простое и удобное изложение материала способствует его лучшему усвоению и запоминанию. Книга будет действенной помощью при изучении новых и повторении пройденных тем, а также при подготовке к ЕГЭ по курсу химии. Учителя химии могут использовать его в классе в качестве справочных таблиц. УДК 373:54 ББК 24я721 ISBN (ООО «Издательство АСТ») (Новая школьная программа) ISBN (ООО «Издательство АСТ») (Подготовка к ЕГЭ) Савинкина Е.В., Логинова Г.П. ООО «Издательский дом АСТ»
Наглядное, простое и удобное изложение материала способствует его лучшему усвоению и запоминанию. Книга будет действенной помощью при изучении новых и повторении пройденных тем, а также при подготовке к ЕГЭ по курсу химии. Учителя химии могут использовать его в классе в качестве справочных таблиц. УДК 373:54 ББК 24я721 ISBN (ООО «Издательство АСТ») (Новая школьная программа) ISBN (ООО «Издательство АСТ») (Подготовка к ЕГЭ) Савинкина Е.В., Логинова Г.П. ООО «Издательский дом АСТ»
3 СОДЕРЖАНИЕ Предисловие ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ Строение атома Таблица 1. Атом Таблица 2. Основные положения квантовой теории строения атома Таблица 3. Энергетические уровни и подуровни Схема 1. Формы орбиталей Таблица 4. Правила заполнения атомных орбиталей (в основное состояние атома) Схема 2. Последовательность заполнения АО электронами Таблица 5. Блоки элементов Таблица 6. Электронные конфигурации нейтральных атомов в основном состоянии для элементов первых четырех периодов Периодический закон DI. Менделеева Таблица 7. Номера периодов и групп Таблица 8. Закономерности изменения свойств в группах Таблица 9. Закономерности изменения свойств по периодам Таблица 10. Изменения состава и свойств водородных соединений, высших оксидов и гидроксидов элементов 3-го периода периодической системы
Менделеева Таблица 7. Номера периодов и групп Таблица 8. Закономерности изменения свойств в группах Таблица 9. Закономерности изменения свойств по периодам Таблица 10. Изменения состава и свойств водородных соединений, высших оксидов и гидроксидов элементов 3-го периода периодической системы
4 4 Химическая связь Таблица 11. Виды химической связи Таблица 12. Описание ковалентной связи Таблица 13. Механизмы образования ковалентной связи Таблица 14. Множественные связи Схема 3. Орбитальное перекрытие Таблица 15. Формулы молекул Таблица 16. Параметры химической связи Таблица 17. Валентность. Степень окисления Таблица 18. Определение степени окисления Таблица 19. Типы кристаллических решеток Классификация химических реакций Таблица 20. Классификация по изменению состава веществ Таблица 21. Классификация по агрегатному состоянию веществ Таблица 22. Классификация по признаку обратимости Таблица 23. Классификация по тепловому эффекту Скорость химической реакции Таблица 24. Основные величины Таблица 25. Зависимость скорости реакции от концентрации Таблица 26. Изменение скорости химической реакции Химическое равновесие Таблица 27. Принцип Ле Шателье Таблица 28. Сдвиг химического равновесия Электролитическая диссоциация Таблица 29. Продукты диссоциации
Зависимость скорости реакции от концентрации Таблица 26. Изменение скорости химической реакции Химическое равновесие Таблица 27. Принцип Ле Шателье Таблица 28. Сдвиг химического равновесия Электролитическая диссоциация Таблица 29. Продукты диссоциации
5 Таблица 30. Некоторые сильные кислоты и основания Таблица 31. Степень диссоциации обменных реакций в растворе Таблица 32. Правила Бертолле Таблица 33. Молекулярные и ионные уравнения Гидролиз Таблица 34. Гидролиз неорганических веществ Таблица 35. Обратимый гидролиз солей Таблица 36. Среда в растворах кислых солей Окислительно-восстановительные реакции Таблица 37. Функции окислителя и восстановителя Таблица 38. Окисленные и восстановленные формы некоторых веществ Таблица 39. Типы окислительно-восстановительных реакций Таблица 40. Электрохимические ряды напряжений металлов Таблица 41. Ряд неметаллов Таблица 42. Примеры окислителей и восстановителей Таблица 43. Баланс электронного метода Таблица 44. Замедление коррозии Электролиз Таблица 45. Электроды Таблица 46. Электролиз расплавов Таблица 47. Электролиз растворов Механизмы реакций в органической химии Таблица 48. Основные механизмы реакции
Электроды Таблица 46. Электролиз расплавов Таблица 47. Электролиз растворов Механизмы реакций в органической химии Таблица 48. Основные механизмы реакции
6 Таблица 49. Механизм реакции замещения Таблица 50. Правило Марковникова НЕОРГАНИЧЕСКАЯ ХИМИЯ Классы неорганических веществ Таблица 51. Неорганические вещества Таблица 52. Простые вещества Таблица 53. Положение неметаллов в периодической системе элементов Таблица 54. Сложные вещества Таблица 55. Орто- и метаформы гидроксидов Таблица 56. Тривиальные названия некоторых кислородсодержащих кислот и их анионов Таблица 57. Классификация гидроксидов и оксидов Таблица 58. Классификация солей Схема 4. Общая классификация неорганических веществ Металлы Таблица 59. Реакции металлов Неметаллы Таблица 60. Реакции оксидов неметаллов Таблица 61. Реакции основных оксидов Таблица 62. Реакции кислотных оксидов Таблица 63. Реакции амфотерных оксидов Основания и амфотерные гидроксиды Таблица 64. Реакции оснований Таблица 65. Реакции амфотерные гидроксиды
7 Кислоты Таблица 66. Реакции кислот Таблица 67. Продукты восстановления в водных растворах анионов кислот-окислителей (азотной и концентрированной серной) различными металлами Соли металлов в ряду напряжений) Таблица 73. Разложение солей аммония Взаимосвязь классов неорганических веществ Таблица 74. Превращения неорганических веществ ОРГАНИЧЕСКАЯ ХИМИЯ Строение органических веществ Таблица 75. Теория строения органических веществ А.М. Бутлеров Таблица 76. Типы органических соединений Таблица 77. Связи углерод-углерод Таблица 78. Атом углерода Таблица 79. Виды гибридизации Таблица 80. Состав органических молекул Таблица 81. Классы органических соединений.. 73 Таблица 82. Изомеры Таблица 83. Взаимное влияние атомов в молекулах
Реакции кислот Таблица 67. Продукты восстановления в водных растворах анионов кислот-окислителей (азотной и концентрированной серной) различными металлами Соли металлов в ряду напряжений) Таблица 73. Разложение солей аммония Взаимосвязь классов неорганических веществ Таблица 74. Превращения неорганических веществ ОРГАНИЧЕСКАЯ ХИМИЯ Строение органических веществ Таблица 75. Теория строения органических веществ А.М. Бутлеров Таблица 76. Типы органических соединений Таблица 77. Связи углерод-углерод Таблица 78. Атом углерода Таблица 79. Виды гибридизации Таблица 80. Состав органических молекул Таблица 81. Классы органических соединений.. 73 Таблица 82. Изомеры Таблица 83. Взаимное влияние атомов в молекулах
8 8 Номенклатура органических веществ Таблица 84. Компоненты названий органических соединений Таблица 85. Названия углеродных цепей Таблица 86. Обозначение степени насыщения связей Таблица 87. Названия характеристических групп органических соединений Таблица 88. Названия некоторых ароматических соединений Таблица 89. Названия некоторых углеводородных радикалов Таблица 90 Числовые префиксы (указывают количество одинаковых структурных элементов) Таблица 91. Состав названия вещества Углеводороды Таблица 92. Классификация углеводородов Таблица 93. Реакции предельных углеводородов Таблица 94 Ненасыщенные углеводороды Таблица 95. Реакции ароматических углеводородов Таблица 96. Реакции галогеналканов Кислородсодержащие органические соединения Таблица 97. Спирты и фенолы Таблица 98. Реакции спиртов и фенолов Таблица 99. Карбонильные соединения Таблица 100. Реакции альдегидов и кетонов Таблица 101. Карбоновые кислоты Таблица 102. Реакции карбоновых кислот Азотсодержащие органические соединения Таблица 103. Амины Таблица 104. Реакции аминов
Названия некоторых углеводородных радикалов Таблица 90 Числовые префиксы (указывают количество одинаковых структурных элементов) Таблица 91. Состав названия вещества Углеводороды Таблица 92. Классификация углеводородов Таблица 93. Реакции предельных углеводородов Таблица 94 Ненасыщенные углеводороды Таблица 95. Реакции ароматических углеводородов Таблица 96. Реакции галогеналканов Кислородсодержащие органические соединения Таблица 97. Спирты и фенолы Таблица 98. Реакции спиртов и фенолов Таблица 99. Карбонильные соединения Таблица 100. Реакции альдегидов и кетонов Таблица 101. Карбоновые кислоты Таблица 102. Реакции карбоновых кислот Азотсодержащие органические соединения Таблица 103. Амины Таблица 104. Реакции аминов
9 Таблица 105. Названия некоторых природных аминокислот Таблица 106. Свойства аминокислот Биологически важные вещества Схема 5. Жиры Таблица 107. Карбоновые кислоты, входящие в состав жиров Таблица 108. Углеводы Таблица 109. Структурные уровни белковых молекул Таблица 110. Химические свойства белков Таблица 111. Цветные реакции белков Связь органических соединений Таблица 112. Катализаторы, применяемые в органической химии Схема 6. Генетическая связь органических соединений МЕТОДЫ ЗНАНИЙ В ХИМИИ Работа с веществами и химическим оборудованием Таблица 113 Химическая лаборатория Таблица 114. Химическая посуда и оборудование Таблица 115. Основные приемы работы в химической лаборатории Таблица 116. Правила применения веществ в быту Методы научных исследований химических веществ и превращений Таблица 117. Методы исследований Таблица 118. Методы разделения смесей
Химические свойства белков Таблица 111. Цветные реакции белков Связь органических соединений Таблица 112. Катализаторы, применяемые в органической химии Схема 6. Генетическая связь органических соединений МЕТОДЫ ЗНАНИЙ В ХИМИИ Работа с веществами и химическим оборудованием Таблица 113 Химическая лаборатория Таблица 114. Химическая посуда и оборудование Таблица 115. Основные приемы работы в химической лаборатории Таблица 116. Правила применения веществ в быту Методы научных исследований химических веществ и превращений Таблица 117. Методы исследований Таблица 118. Методы разделения смесей
10 Таблица 119. Окраска индикаторов Таблица 120. Качественные реакции на катионы Таблица 121. Качественные реакции на анионы Таблица 122. Обнаружение газов Таблица 123. Распознавание органических соединений Методы получения веществ Таблица 124. Методы получения простых веществ Таблица 125 .Способы получения оксидов Таблица 126. Способы получения оснований и амфотерных гидроксидов Таблица 127. Способы получения кислот Таблица 128. Способы получения солей Таблица 129. Способы получения предельных углеводородов Таблица 130. Способы получения алкенов Таблица 131. Способы получения алкинов (ацетилена) Таблица 132. Способы получения аренов (бензола) Таблица 133. Способы получения одноатомных спиртов Таблица 134. Способы для производства многоатомных спиртов Таблица 135. Способы получения фенолов Таблица 136. Способы получения альдегидов и кетонов Таблица 137. Способы получения карбоновых кислот Промышленное производство веществ Таблица 138. Способы получения металлов Таблица 139. Металлургические методы Схема 7. Доменный процесс
Способы получения солей Таблица 129. Способы получения предельных углеводородов Таблица 130. Способы получения алкенов Таблица 131. Способы получения алкинов (ацетилена) Таблица 132. Способы получения аренов (бензола) Таблица 133. Способы получения одноатомных спиртов Таблица 134. Способы для производства многоатомных спиртов Таблица 135. Способы получения фенолов Таблица 136. Способы получения альдегидов и кетонов Таблица 137. Способы получения карбоновых кислот Промышленное производство веществ Таблица 138. Способы получения металлов Таблица 139. Металлургические методы Схема 7. Доменный процесс
11 Таблица 140. Некоторые промышленные процессы Таблица 141. Продукты фракционной перегонки нефти Таблица 142. Химическая переработка нефти Таблица 143. Получение высокомолекулярных соединений(полимеров) Таблица 144. Классификация полимеров Таблица 145. Полимеры на основе этилена и его производных Расчеты по химическим формулам и уравнениям реакций Таблица 146. Соотношения между величинами в растворе Таблица 147. Приготовление растворов Таблица 148. Важные для расчетов величины Таблица 149. Соотношения между величинами Нормальные физические условия Таблица 150. Стехиометрические законы Таблица 151. Расчеты по уравнениям реакций Таблица 152. Нахождение молекулярной формулы вещества ПРИЛОЖЕНИЯ Таблица 1. Элементы периодической системы Д.И. Менделеева Таблица 2. Химические элементы: порядковый номер, атомная масса (округлено), электроотрицательность Таблица 3. Растворимость неорганических соединений в воде
Приготовление растворов Таблица 148. Важные для расчетов величины Таблица 149. Соотношения между величинами Нормальные физические условия Таблица 150. Стехиометрические законы Таблица 151. Расчеты по уравнениям реакций Таблица 152. Нахождение молекулярной формулы вещества ПРИЛОЖЕНИЯ Таблица 1. Элементы периодической системы Д.И. Менделеева Таблица 2. Химические элементы: порядковый номер, атомная масса (округлено), электроотрицательность Таблица 3. Растворимость неорганических соединений в воде
12 ПРЕДИСЛОВИЕ В помощь школьникам и учителям предлагается пособие, представляющее собой обобщенное изложение в наглядных таблицах и схемах всех основных правил, законов, формул и расчетов по курсу органической и неорганической химии. Включены все основные разделы химии, изучаемые на уроках. Это строение атома, периодический закон Д. И. Менделеева, строение химических элементов периодической системы, виды химических связей, вещества и смеси, классы неорганических соединений, классификация химических реакций, скорость химических реакций и химическое равновесие , механизмы реакций в органической химии, металлы и неметаллы и их свойства, химические свойства сложных веществ, соотношение классов неорганических веществ, органические вещества и их строение, состав органических молекул, изомеры, номенклатура органических веществ, углеводороды, их классификация и свойства, азотсодержащие органические соединения, биологически важные вещества, строение и свойства белковых молекул, углеводов, взаимосвязь органических соединений. Кроме того, в пособии описаны основные правила и приемы работы в химической лаборатории, даны характеристики химических
Кроме того, в пособии описаны основные правила и приемы работы в химической лаборатории, даны характеристики химических
13 судов и оборудования, приведены примеры расчетов на основе формул и уравнений реакций, а также примеры качественных реакций. Приложение к пособию содержит периодическую таблицу элементов Д. И. Менделеева, таблицу растворимости неорганических соединений в воде. Краткое и лаконичное изложение материала поможет учащимся самостоятельно или с помощью учителя повторить школьный курс химии и успешно подготовиться к ЕГЭ в 11 классе. Структура пособия соответствует структуре кодификатора содержание элементов по химии для составления контрольных замеров материалов ЕГЭ и соответствует логике изучения и повторения школьного курса химии. В руководстве приняты следующие сокращения: конц. концентрированный раствор, н. у. в нормальных условиях, о. разб. очень разбавленный раствор, практ. практичный, разб. разбавленный раствор, теор. теоретический.
14 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ СТРОЕНИЕ АТОМА Атом Таблица 1 Электроны (д) Ядро протоны (р+) нейтроны (n 0) Массовое число (А) общее число протонов и нейтронов в атомном ядре Заряд ядра атома (Z) равно числу протонов в ядре и числу электронов в атоме A = N (n 0) + N (p +) Z = N (p +) = N ( д) Таблица 2 Основные положения квантовой теории строения атома дискретность энергии электрона дуальная (корпускулярно-волновая) природа электрона невозможность определения траектории электрона (принцип неопределенности) 14
15 Энергетические уровни и подуровни Таблица 3 Энергетические уровни (ЭУ) Энергетические подуровни (ЭПУ) Число электронов 1 1s 2 2 2s 2p 3 3s 3p 3d 4 4s 4p 4d 4f атомная орбиталь (АО) характеризует область пространства, в которой вероятность пребывания электрона с определенной энергией наибольшая. Орбитальные формы Схема 1 s-орбиталь p-орбиталь 15
Орбитальные формы Схема 1 s-орбиталь p-орбиталь 15
ЕГЭ по ХИМИИ классификатор элементов содержания и требований к уровню подготовки выпускников организаций образования к ЕГЭ по химии
Содержание Предисловие редактора… 3 Введение… 5 Часть I. ОСНОВЫ ОБЩЕЙ ХИМИИ Раздел 1. Основные понятия и законы химии 1.1. Определение и предмет химии…9 1.2. Исходные сведения о строении атомов.
РЕЗУЛЬТАТЫ ЕГЭ ПО ХИМИИ (11.06.2009) Королев 2009 1
ЕГЭ по ХИМИИ измерительные материалы ЕГЭ 2000 по химии подготовлены ФГБУ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ образовательное учреждение высшего профессионального образования «Северо-Кавказское государственное гуманитарно-технологическое»
ВСТУПИТЕЛЬНАЯ ПРОГРАММА ПО ХИМИИ Программа по химии для абитуриентов состоит из четырех частей.В первой части представлены основные теоретические концепции химии, которые должны
СОДЕРЖАНИЕ ПРОГРАММЫ Раздел 1. Химический элемент Тема 1. Строение атомов. Периодический закон и периодическая система химических элементов Д.И. Менделеев. Современные представления о строении атомов.
Химический элемент Тема 1. Строение атомов. Периодический закон и периодическая система химических элементов Д.И. Менделеев. Современные представления о строении атомов.
УДК 373.167.1:54 БАК 24й7 М 55 М 55 Мешкова О.В. ÅÝ. Химия: универсальный справочник / О.В. Мешков. Я. : Сузуза-пресс, 2013. 352 с. (ЕАÝ. Универсальный справочник). ISBN 978-5-99550-658-4 Ссылка
БИЛЕТЫ ПО ХИМИИ 10-11 КЛАСС. БИЛЕТ 1 1. Периодический закон и периодическая система химических элементов Д.И. Менделеева на основе представлений о строении атомов. Значение периодического закона для
Билет 1 1. Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки. 2. Лимит углеводородов,
Муниципальное автономное образовательное учреждение города Калининграда СОШ 38 ОБСУЖДЕНО на заседании Минобороны протокол «9» 06 августа «СОГЛАСОВАНО» на заседании ПС протокол
Отчет о репетиционный экзамен по химии в Красногвардейском районе Санкт-Петербурга 1. Структура работы Каждый вариант работы состоит из трех частей и включает 43 задания. Часть 1 содержит
Структура работы Каждый вариант работы состоит из трех частей и включает 43 задания. Часть 1 содержит
ПРОЕКТ ВСЕРОССИЙСКОЙ ПРОВЕРОЧНОЙ РАБОТЫ ПО ХИМИИ ОПИСАНИЕ ВСЕРОССИЙСКОЙ ПРОВЕРОЧНОЙ РАБОТЫ ПО ХИМИИ 11 класс подготовлен ФГБНУ «ФЕДЕРАЛЬНЫЙ ИНСТИТУТ
СТАНДАРТ СРЕДНЕГО (ПОЛНОГО) ОБЩЕГО ОБРАЗОВАНИЯ ПО ХИМИИ Изучение химии на основной ступени среднего (полного) общего образования направлено на достижение следующих целей: усвоение знаний
Вопросы к промежуточной аттестации по химии в 10-11 классах на 2012-2013 учебный год Учебник Г.Е., Рудзитис, Ф.Г.Фельдман «Химия 10 класс», «Химия 11 класс» Москва 2010 1. Периодический закон и периодический
Пояснительная записка Рабочая программа по химии составляется на основе: федерального компонента государственного образовательного стандарта среднего (полного) общего образования. М.: «Просвещение» 2004,
ХИМИЧЕСКАЯ ПРОГРАММА ТЕОРИЯ СТРОЕНИЯ ВЕЩЕСТВА. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ Теория строения вещества Атом. Молекула. Химический элемент. Вещество. Молекулярные и структурные формулы. Составные атомные ядра. Структура
Молекула. Химический элемент. Вещество. Молекулярные и структурные формулы. Составные атомные ядра. Структура
«УТВЕРЖДЕНО» Руководитель Федеральной службы по надзору в сфере образования и науки «СОГЛАСОВАНО» Председатель Научно-методического совета ФИПИ по химии ЕГЭ по ХИМИИ СПЕЦИФИКАЦИЯ
ПРОГРАММА ВСТУПИТЕЛЬНОГО ЭКЗАМЕНА ПО ХИМИИ теоретические позиции химии как одной из важнейших естественных наук, лежащих в основе научного понимания определение гомологического ряда алканов: составить таблицу первых десяти представителей
Планируемые предметные результаты развития предмета В результате изучения химии на базовом уровне студент должен знать/понимать важнейшие химические понятия: вещество, химический элемент, атом,
Отдел образования Артемовского городского округа Коммунальное автономное общеобразовательное учреждение Артемовского городского округа «Средняя общеобразовательная школа 56 с углубленным изучением
ХИМИЯ, класс Спецификация контрольно-измерительных материалов для проведения единого государственного экзамена по ХИМИИ в 0 год ЕГЭ по ХИМИИ Спецификация контрольных средств измерений
Химия 10 11 класс ФК ГОС ( базовый уровень) Основное содержание предмета Методы познания по химии Научные методы познания веществ и химических явлений Роль эксперимента и теории в химии Моделирование
ХИМИЯ, класс Спецификация контрольно-измерительных материалов для проведения ЕГЭ по ХИМИИ в 0 год ЕГЭ по ХИМИИ Спецификация контрольных средств измерений
ХИМИЯ, класс ЕГЭ по ХИМИИ
Департамент образования город Москва Государственное бюджетное профессиональное образовательное учреждение города Москвы «МОСКОВСКИЙ АВТОМОБИЛЬНО-ДОРОЖНЫЙ КОЛЛЕДЖ ИМ. А.А. НИКОЛАЕВА» РАБОЧАЯ ПРОГРАММА
А.А. НИКОЛАЕВА» РАБОЧАЯ ПРОГРАММА
Анализ предмета HSC Химия. Параллельные 8 классов Контрольная тема: «Начальные химические понятия» Дата: ноябрь 2014 г. 8А/1 18 5 8 5 0 100% 72% 4,0 8Б/1 15 0 8 6 1 93% 53% 3,5 8В/1 21 1 11 8 1 95 %
АНАЛИТИЧЕСКИЙ ОТЧЕТ ПРЕДМЕТНОЙ КОМИССИИ ПО РЕЗУЛЬТАТАМ ИСПОЛЬЗОВАНИЯ В ХИМИИ 1 Отчет подготовлен А.Н. Левкин, заместитель председателя предметной комиссии по химии 2
Пояснительная записка Рабочая программа составлена на основе Федерального компонента государственного стандарта среднего (полного) общего образования по химии (базовый уровень), использована программа
Программа вступительных испытаний по химии для иностранных граждан, поступающих на программы бакалавриата и специалитета Программа предназначена для поступающих по направлениям:
Атомно-молекулярная доктрина. Молекулы. Атомы. Химический элемент, простое вещество, сложное вещество. Знаки химических элементов и химические формулы. Расчет массовой доли химического элемента в веществе
Расчет массовой доли химического элемента в веществе
Приложение 10 к приказу 311/1 от 28 августа 2015 г. «Об утверждении основных общеобразовательных программ основного общего образования (ФГОС), основного общего образования, среднего общего образования «Рабочий
Химия 1. Исходные химические понятия. Предмет химии. тела и вещества. Основные методы познания: наблюдение, измерение, описание, эксперимент. Физические и химические явления. Правила техники безопасности
1 Пояснительная записка Настоящая программа разработана на основе Примерных программ основного общего образования по химии (базовый уровень), соответствующих федеральному компоненту государственного стандарта
Календарно-тематическое планирование Предмет: Химия Класс: 11 часов в неделю: 2 Всего часов в год: 68 I триместр. Всего недель: 10,6, всего часов: 22. Сек. Тема урока Тема 1. Строение атома периодическое
ПРОГРАММА ПО ХИМИИ Программа основана на обязательном минимуме среднего (полного) общего образования и состоит из трех разделов. Первый раздел посвящен теоретическим основам химии. В
Первый раздел посвящен теоретическим основам химии. В
2 Спецификация контрольно-измерительных материалов к ЕГЭ по ХИМИИ в 2016 году ЕГЭ по ХИМИИ Спецификация контрольно-измерительных приборов
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ХИМИИ В САРАТОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ В 2009 году1. Предмет химии, ее задачи. Место химии среди естественных наук, связь наук с химией.
ЭКЗАМЕНАЦИОННЫЕ БИЛЕТЫ ГОСУДАРСТВЕННОЙ ИТОГОВОЙ АТТЕСТАЦИИ ПО ХИМИИ ПО ПРОГРАММАМ ОСНОВНОГО ОБЩЕОБРАЗОВАНИЯ Билет 1 1. Периодическая система химических элементов Д.И.Менделеева и строение атомов:
планирование урока по химии, 11 класс, ( 1 час в неделю, всего 34 часа), методические материалы О. С. Габриелян Тема урока Элементы содержания Требования к уровню подготовленности учащихся Эксперимент Домашнее задание дата
Структура рабочей программы: 1. Пояснительная записка к рабочей программе 2. Календарно-тематические планы на 10-11 классы 3. Требования к уровню усвоения знаний обучающимися 4. Формы проверки знаний
Требования к уровню усвоения знаний обучающимися 4. Формы проверки знаний
Тест программы по химии Предмет и задачи по химии. Место химии среди естественных наук. Атомно-молекулярное учение. Молекулы. Атомы. Постоянство состава вещества. относительный атомный и относительный
ЕГЭ по ХИМИИ ПРОЕКТ ХИМИЯ, 11 класс 2 Спецификация контрольно-измерительных материалов к ЕГЭ по ХИМИИ в 2017 г. Спецификация контрольных
2 Плановые результаты освоения предмета В результате изучения химии студент должен знать/понимать: химические символы: знаки химических элементов, формулы химических веществ и уравнения химических веществ
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ПРЕДМЕТУ «ХИМИЯ» На экзамене по химии при поступлении в вуз необходимо: — показать знание основных теоретических положений ; — уметь применять теоретические
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ХИМИИ Программа основана на обязательном минимуме среднего (полного) общего образования и состоит из трех разделов. Первый раздел посвящен теоретическому
Первый раздел посвящен теоретическому
Рабочая программа элективного курса «Химия» для 11 класса на 2016-2017 учебный год автор: учитель биологии и химии Колосницына С.В. с.зубово 2016 Пояснительная записка Элективный курс «Химия» предназначен
ХИМИЯ Теория строения вещества Атом. Состав атомных ядер. Химический элемент. Постоянство состава вещества. Относительная атомная и относительная молекулярная масса. Закон сохранения массы, его значение
Тематическое планирование на 2015-2016 учебный год химия 10 класс Учебник О.С. Урок Габриелян Дата Название раздела, тема занятия (с указанием количества часов) Формируемые знания, умения. Направления деятельности
ЕГЭ по ХИМИИ
ПРОГРАММА ВСТУПИТЕЛЬНЫХ ЭКЗАМЕНОВ ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УРФ В 2014 ГОДУ При подготовке к ЕГЭ абитуриенты должны показать знание основных теоретических положений химии как одной из важнейших естественных наук .
ПРОГРАММА ПО ХИМИИ ОБЩИЕ УКАЗАНИЯ На экзамене по химии поступающие в академию должны показать: 1) четкое знание основных законов химии и положений теории строения вещества, на которых основаны все современные
СТАНДАРТ ОСНОВНОГО ОБЩЕГО ОБРАЗОВАНИЯ ПО ХИМИИ Изучение химии на уровне основного общего образования направлено на достижение следующих целей: овладение важнейшими знаниями об основных понятиях и законах
Перечень элементов содержания, проверяемых на вступительном экзамене по ХИМИИ Предметное тестирование позволяет оценить уровень общеобразовательной подготовки по химии выпускников IX классов общеобразовательной школы
ПРОГРАММА Вступительных испытаний по химии в ПГУ в 2016 году ПО ХИМИИ для абитуриентов Раздел 1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ Современные представления о строении
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ Современные представления о строении
Пояснительная записка для 0 класса. Программа отличается в соответствии с Федеральным компонентом государственного образовательного стандарта среднего общего образования и базируется на программе общее образование
2 Пояснительная записка Программа разработана на основе обязательного минимума содержания среднего (полного) общего образования по химии. Содержание программы 1. Предмет и задачи по химии. физические явления
Поступающие в вуз должны показать знание основных теоретических положений химии как одной из важнейших естественных наук, лежащих в основе научного понимания природы. Кандидат должен уметь подать заявку
М.: 20 0 7. — 1 10 с.
Данное пособие содержит в наглядной форме курс органической химии, изучаемый в 10-11 классах общеобразовательной школы. Пособие может быть использовано при изучении, обобщении и повторении учебного материала, а также может быть полезно при организации систематического повторения при подготовке к выпускным или вступительным экзаменам.
Формат: djvu/zip
Размер: 1,5 МБ
Скачать: ifolder.ru
Содержание
I. Теория химического строения органических соединений
1 Возникновение органической химии как науки (1807 г. Я. Берцелиус) 3
2. Органические и неорганические вещества. Состав и некоторые свойства органических веществ 4
3. Доструктурные теории 5
4. Связь между понятиями теории химического строения 6
5. Предпосылки возникновения теории химического строения органических веществ 7
6 , Теория химического строения. Основные положения (1,2) 8
7. Теория химического строения. Основные положения (3.4) 9
8. Теория химического строения. Ключевые моменты (5) 10
9. Алгоритм поиска возможных изомеров алканов (изомерия углеродного скелета) 11
10. Классификация химических соединений, характерных для органических соединений (по типу химических превращений) 12
11. Классификация химические соединения типичные для органических соединений (по типу разрыва связи) 13
12. Классификация углеводородов 14
Классификация углеводородов 14
II. Ограничение по углеводородам
1. Метан. Физические свойства. Строение молекулы 15
2. Sp3-гибридизация 16
3. Алканы 17
4. Изомеры и гомологи 18
5. Алканы (неразветвленное строение) и алкилы 19
6. Номенклатура (рациональная) 20
7. Номенклатура (систематическая) 76 8 90 8 .Определение качественного состава органических соединений 22
9. Химические свойства алканов 23
10. Получение алканов 24
11. Применение алканов 25
12. Циклоалканы (циклопарафины, нафтены) 26
III. Ненасыщенные углеводороды
1. Этилен (этен). Строение молекулы. sp2 — гибридизация 27
2. Алкены (олефины, этиленовые углеводороды) 28
3. Свойства алкенов 29
4. Свойства алкенов 30
5. Использование алкенов 31
6. Получение алкенов 32
7. Диеновые углеводороды (алкадиены) 33
8. Химические свойства алкадиенов (с сопряженными связями) Получение 34
9. Общая характеристика каучуков. Их строение и свойства 35
Их строение и свойства 35
10. Ацетилен (этин). Строение молекулы sp-гибритизации 36
11. Сравнение строения молекулярной массы этана, этилена и ацетилена. Сравнение о и ц соединений 37
12. Алкины (ацетиленовые углеводороды) 38
13. Химические свойства алкинов 39
14. Химические свойства алкинов 40
15. Применение ацетилена 41
16. Получение ацетилена и его гомологов 42
IV. ароматические углеводороды
1. Бензол. физические свойства. Формула Кекуле 43
2. Электронное строение бензола 44
3. Химические свойства бензола 45
4. Химические свойства бензола 46
5. Арены (Ароматические углеводороды. Алкилбензолы) 47
6. Толуол. Химические свойства. Взаимное влияние атомов в молекуле толуола 48
7. Правила ориентации в бензольном кольце..49
8. Использование бензола. Получение арен 50
9. Стирол. Нафталин. Антрацен 51
10. Генетическая связь между группами углеводородов 52
11. Общие сведения об углеводородных группах 53
12. Общие сведения о углеводородных группах 54
Общие сведения о углеводородных группах 54
V. Спирты и фенолы
1. Предельные одноатомные спирты 55
2. Химические свойства спиртов 56
3. Этанол (Этиловый спирт) 57
4. Применение предельных одноатомных спиртов 58
5. Способы получения спиртов 59
6. Предельные многоатомные спирты 60
7. Эфиры 61
8. Фенолы 62
9. Химические свойства фенола (по гидроксигруппе) 63
10. Химические свойства фенола (по бензольному кольцу) 64
VI. Альдегиды и карбоновые кислоты
1. Альдегиды. Структура. Номенклатура. Изомерия 65
2. Формальдегид. Чек. Свойства 66
3. Свойства альдегидов 67
4. Свойства альдегидов 60
5. Кетоны G9
6. Получение альдегидов и кетонов 70
7. Карбоновые кислоты. Гомологичный ряд 71
8. Некоторые насыщенные одноосновные кислоты 72
9. Карбоновые кислоты. Свойства 73
10. Химические свойства предельных одноосновных карбоновых кислот 74
11. Химические свойства предельных одноосновных карбоновых кислот 15
12. Получение карбоновых кислот 76
Получение карбоновых кислот 76
13,0 отдельные представители карбоновых кислот. Классификация 77
14. Отдельные представители карбоновых кислот 78
VII. Сложные эфиры. Жиры
1. Сложные эфиры 79
2. Химические свойства сложных эфиров 80
3. Жиры. Классификация. Получение 81
4. Химические свойства жиров 82
5. Мыла 83
6. Синтетические моющие средства(КМЦ) 84
VIII. углеводороды
1. Углеводы. Сложный. Классификация 85
2. Глюкоза. Структура. Фруктоза 86
3. Глюкоза. Химические свойства 87
4. Глюкоза. Особые свойства. Заявка 88
5. Сахароза. Структура. Свойства 89
6. Полисахариды (CeH-mOsJn. природные полимеры 90
7. Крахмал и целлюлоза. Химические свойства 91
IX. Амины. Аминокислоты. Белки
1. Амины. Сложный. Номенклатура. Изомерия 92
2. Амины. Химические свойства 93
3. Анилин. Структура. Свойства 94
4. Аминокислоты. Номенклатура. Изомерия 95
5. Аминокислоты. Свойства 96
Аминокислоты. Свойства 96
6. Некоторые аминокислоты белков 97
7. Получение и использование аминокислот 98
8. Белки. Сложный. Корпус 99
9. Структуры белков 100
10. Химические свойства белков 101
11. Изомерия классов соединений 102
12. Генетическая связь органических веществ 103
Х Применение
1. Качественные реакции органических соединений 104
2. Качественные реакции органических соединений 105
3. Периодическая система химических элементов 106
4. Соглашения 107
Данное пособие содержит в наглядной форме курс органической химии, изучаемый в 10-11 классах общеобразовательной школы. Пособие может быть использовано при изучении, обобщении и повторении учебного материала, а также может быть полезно при организации систематического повторения при подготовке к выпускным или вступительным экзаменам.
Теория радикалов (30-е годы XIX в. Я. Берцелиус, И. Либих, Я. Дюма)
а) органические вещества содержат радикалы;
б) радикалы всегда постоянны, не претерпевают изменений, переходят из одной молекулы в другую;
в) радикалы могут существовать в свободной форме.
Понятие «радикал» прочно вошло в химию. Впоследствии эта теория была отвергнута.
Теория типов (40-50-е годы 19 в. К. Герард, А. Кекуле и др.)
а) все органические вещества — производные простейших неорганических веществ — таких как водород, вода, аммиак и др.
б) формулы выражают не внутреннее строение молекулы, а способы образования, свойства определяют все атомы молекулы.
в) строение материи знать невозможно, у каждой субстанции столько формул, сколько и превращений.
Теория позволяла классифицировать органические вещества, предсказывать и открывать некоторые, Особое внимание— химические превращения, но не могла предсказать, указать пути синтеза новых веществ.
Содержание
I. Теория химического строения органических соединений
1 Возникновение органической химии как науки (1807 г. Я. Берцелиус) 3
2. Органические и неорганические вещества. Состав и некоторые свойства органических веществ 4
3. Доструктурные теории 5
4. Связь между понятиями теории химического строения 6
Связь между понятиями теории химического строения 6
5. Предпосылки возникновения теории химического строения органических веществ 7
6 , Теория химического строения. Основные положения (1,2) 8
7. Теория химического строения. Основные положения (3.4) 9
8. Теория химического строения. Ключевые моменты (5) 10
9. Алгоритм поиска возможных изомеров алканов (изомерия углеродного скелета) 11
10. Классификация химических соединений, типичных для органических соединений (по типу химических превращений) 12
11. Классификация химических соединений, типичных для органических соединений (по типу разрыва связи) 13
12. Классификация углеводородов 14
II. Ограничение по углеводородам
1. Метан. физические свойства. Строение молекулы 15
2. Sp3-гибридизация 16
3. Алканы 17
4. Изомеры и гомологи 18
5. Алканы (неразветвленное строение) и алкилы 19
6. Номенклатура (рациональная) 20
7. Номенклатура (систематическая) 76 8 90 8 . Определение качественного состава органических соединений 22
Определение качественного состава органических соединений 22
9. Химические свойства алканов 23
10. Получение алканов 24
11. Применение алканов 25
12. Циклоалканы (циклопарафины, нафтены) 26
III. Ненасыщенные углеводороды
1. Этилен (этен). Строение молекулы. sp2-гибридизация 27
2. Алкены (олефины, этиленовые углеводороды) 28
3. Свойства алкенов 29
4. Свойства алкенов 30
5. Применение алкенов 31
6. Получение алкенов 32
7. Диеновые углеводороды (алкадиены) 33
8. Химические свойства алкадиенов (с сопряженными связями) Препарат 34
9. Общая характеристика каучуков. Их строение и свойства 35
10. Ацетилен (этин). Строение молекулы sp-гибритизации 36
11. Сравнение строения молекулярной массы этана, этилена и ацетилена. Сравнение о и ц соединений 37
12. Алкины (ацетиленовые углеводороды) 38
13. Химические свойства алкинов 39
14. Химические свойства алкинов 40
15. Применение ацетилена 41
16. Получение ацетилена и его гомологов 42
Получение ацетилена и его гомологов 42
IV. ароматические углеводороды
1. Бензол. физические свойства. Формула Кекуле 43
2. Электронное строение бензола 44
3. Химические свойства бензола 45
4. Химические свойства бензола 46
5. Арены (Ароматические углеводороды. Алкилбензолы) 47
6. Толуол. Химические свойства. Взаимное влияние атомов в молекуле толуола 48
7. Правила ориентации в бензольном кольце 49
8. Использование бензола. Получение арен 50
9. Стирол. Нафталин. Антрацен 51
10. Генетическая связь между группами углеводородов 52
11. Общие сведения об углеводородных группах 53
12. Общие сведения о углеводородных группах 54
V. Спирты и фенолы
1. Предельные одноатомные спирты 55
2. Химические свойства спиртов 56
3. Этанол (Этиловый спирт) 57
4. Применение предельных одноатомных спиртов 58
5. Способы получения спиртов 59
6. Предельные многоатомные спирты 60
7. Эфиры 61
Эфиры 61
8. Фенолы 62
9. Химические свойства фенола (по гидроксигруппе) 63
10. Химические свойства фенола (по бензольному кольцу) 64
VI. Альдегиды и карбоновые кислоты
1. Альдегиды. Структура. Номенклатура. Изомерия 65
2. Формальдегид. Чек. Свойства 66
3. Свойства альдегидов 67
4. Свойства альдегидов 60
5. Кетоны G9
6. Получение альдегидов и кетонов 70
7. Карбоновые кислоты. Гомологичный ряд 71
8. Некоторые насыщенные одноосновные кислоты 72
9. Карбоновые кислоты. Свойства 73
10. Химические свойства предельных одноосновных карбоновых кислот 74
11. Химические свойства предельных одноосновных карбоновых кислот 15
12. Получение карбоновых кислот 76
13,0 отдельные представители карбоновых кислот. Классификация 77
14. Отдельные представители карбоновых кислот 78
VII. Сложные эфиры. Жиры
1. Сложные эфиры 79
2. Химические свойства сложных эфиров 80
3. Жиры. Классификация. Получение 81
Жиры. Классификация. Получение 81
4. Химические свойства жиров 82
5. Мыла 83
6. Синтетические моющие средства (КМЦ) 84
VIII. углеводороды
1. Углеводы. Сложный. Классификация 85
2. Глюкоза. Структура. Фруктоза 86
3. Глюкоза. Химические свойства 87
4. Глюкоза. Особые свойства. Заявка 88
5. Сахароза. Структура. Свойства 89
6. Полисахариды (CeH-mOsJn. Природные полимеры 90
7. Крахмал и целлюлоза. Химические свойства 91
IX. Амины. Аминокислоты. Белки
1. Амины. Сложный. Номенклатура. Изомерия 92
2. Амины. Химические свойства 93
3. Анилин. Структура. Свойства 94
4. Аминокислоты. Номенклатура. Изомерия 95
5. Аминокислоты. Свойства 96
6. Некоторые аминокислоты белков 97
7. Получение и использование аминокислот 98
8. Белки. Сложный. Корпус 99
9. Структуры белков 100
10. Химические свойства белков 101
11. Изомерия классов соединений 102
12. Генетическая связь органических веществ 103
Генетическая связь органических веществ 103
Х Применение
1. Качественные реакции органических соединений 104
2. Качественные реакции органических соединений 105
3. Периодическая система химических элементов 106
4. Символы 107.
Бесплатно скачать электронную книгу в удобном формате, смотреть и читать:
Скачать книгу Химия в таблицах и схемах, 10-11 класс, Ковалевская Н.Б., 2007 — fileskachat.com, скачать быстро и бесплатно.
СИБИРСКИЙ ПОЛИТЕХНИЧЕСКИЙ КОЛЛЕДЖ
СПРАВОЧНИК ДЛЯ СТУДЕНТОВ
по ОРГАНИЧЕСКОЙ ХИМИИ
для специальностей технико-экономического профиля
Составитель: преподаватель
2012
Структура « ПОСОБИЕ ДЛЯ СТУДЕНТОВ ПО ОРГАНИЧЕСКОЙ ХИМИИ»
ПОЯСНИТЕЛЬНОЕ ЗАМЕЧАНИЕ
КС по органической химии призвана помочь студентам создать научную картину мира через химическое содержание, с учетом межпредметных и внутрипредметных связей, логики учебного процесса.
ГО по органической химии представляет минимальное по объему, но функционально полное содержание для освоения ГОСТ химическое образование.
КК по органической химии выполняет две основные функции:
I. Информационная функция позволяет участникам образовательного процесса получить представление о содержании, структуре предмета, взаимосвязи понятий посредством схем, таблиц и алгоритмов.
II. Организационно-планирующая функция предусматривает выделение этапов обучения, структурирование учебного материала, формирует представления о содержании промежуточной и итоговой аттестации.
СС предполагает формирование системы знаний, умений и способов деятельности, развивает умение студентов работать со справочными материалами.
Имя | Имя | ||
Хронологическая таблица «Развитие органической химии». | Химические свойства алкенов (этиленовых углеводородов). | ||
Основные положения теории строения органических соединений | Химические свойства алкинов (ацетиленовых углеводородов). | ||
Изомеры и гомологи. | Химические свойства аренов (ароматических углеводородов). | ||
Значение TSOS | |||
Классификация углеводородов. | Генетическая связь органических веществ. | ||
гомологический ряд АЛКАНЫ (ОГРАНИЧЕННЫЕ УГЛЕВОДОРОДЫ). | Отношения «Структура — свойства — приложение». | ||
гомологический ряд РАДИКАЛЫ, ОБРАЗОВАННЫЕ ИЗ АЛКАНОВ. | Относительная молекулярная масса органических веществ | ||
Словарь терминов по органической химии. Номинальные реакции. | |||
Изомерия классов органических веществ. | Алгоритм решения задач. Физические величины для решения задач. | ||
Химические свойства алканов (насыщенных углеводородов). | Вывод формул соединений. Примеры решения задач. |
ХРОНОЛОГИЧЕСКАЯ ТАБЛИЦА «РАЗВИТИЕ ОРГАНИЧЕСКОЙ ХИМИИ»
Период/год. Кто? | Характер открытия | |
Древний Ши | древний человек | Варить пищу, дублить кожу, делать лекарства |
Парацельс и другие | Изготовление более сложных лекарственных средств, изучение свойств веществ орг. происхождения, т.е. отходы | |
XY-XYIII c. в. | Непрерывный процесс | Накопление знаний о различных веществах. Превосходство «виталистических взглядов» |
Взрыв научной мысли, детонатором которого стали потребности людей в красках, одежде, продуктах питания. | ||
Йонс Якоб Берцелиус (шведский химик) | Термин «органическая химия» | |
Фридрих Вёлер (немецкий) | Синтез щавелевой кислоты | |
концепция | Органическая химия — раздел химической науки, изучающий соединения углерода. | |
Фридрих Вёлер (немецкий) | Синтез мочевины | |
Синтез анилина | ||
Адольф Кульбе (немецкий) | Синтез уксусной кислоты из углерода | |
Э. | Понятие «соединительная система» — валентность | |
Пьер Бертло (французский) | этанол синтезированный этилен гидратация. Синтез жиров. «Химии не нужна живучесть!» | |
Синтез сахарного вещества | ||
На основе различных теорий (Франкленд, Джерард, Кекуле, Купер) создан TSOS | ||
Учебное пособие «Введение в полное изучение органической химии». Органическая химия — раздел химии, изучающий углеводороды и их производные. . |
ОСНОВНЫЕ ПОЛОЖЕНИЯ
ТЕОРИИ СТРОЕНИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
А. М. Бутлерова
М. Бутлерова
1. А. М. Бутлерова
2. Свойства веществ зависят не только от качественного и количественного состава, но и от химического строения. Изомеры. Изомерия.
3. А. и А. группы взаимно влияют друг на друга.
4. По свойствам вещества можно определить строение, а по строению — свойства.
Изомеры и гомологи.
Величина ТСОС
1. Объяснил строение М. известных веществ и их свойства.
2. Позволил предвидеть существование неизвестных веществ и найти способы их синтеза.
3. Объясните разнообразие органических веществ.
Классификация углеводородов.
https://pandia.ru/text/78/431/images/image003_147.gif»>
гомологический ряд
АЛКАН (ОГРАНИЧЕННЫЕ УГЛЕВОДОРОДЫ)
66
66
МЕТАН
C2H6
ЭТАН
С3Н8
ПРОПАН
БУТАН
ПЕНТАН
ГЕКСАН
ГЕПТАН
ОКТАН
НОНАН
С10Н22
ДЕКАНА
гомологический ряд
РАДИКАЛЫ, ОБРАЗОВАННЫЕ ИЗ АЛКАНОВ
МЕТИЛ | |
C2H5 | ЭТИЛ |
С3Н7 | ПРОПИЛЬ |
БУТИЛ | |
ПЕНТИЛЬ | |
ХЕКСИЛ | |
ГЕПТИЛ | |
ОКТИЛ | |
НЕИЛ | |
С10х31 | ДЕКИЛ |
Общие сведения об углеводородах.
https://pandia.ru/text/78/431/images/image005_61.jpg» align=»left»>
Химические свойства алканов
(предельные углеводороды).
https://pandia.ru/text/78/431/images/image007_73.gif»>
Химические свойства алкинов
(ацетиленовые углеводороды).
https://pandia.ru/text/78/431/images/image009_68.gif»>
Генетическая связь углеводородов.
https://pandia.ru/text/78/431/images /image011_36.jpg»>
Связь «Структура — свойства — приложение». | Пути прием | ||
Структура | |||
Соединение | Находка в природе | ||
Недвижимость | Применение | ||
МОЛЕКУЛЯРНАЯ ВЕСА НЕКОТОРЫХ ОРГАНИЧЕСКИХ ВЕЩЕСТВ.
Алканы | ||||||||
Производные галогенов | ||||||||
Спирты и фенолы | ||||||||
Эфиры | ||||||||
Альдегиды | ||||||||
карбоновые кислоты | ||||||||
Нитросоединения | ||||||||
Алгоритм решения задач
1. Внимательно изучите условия задачи: определите, с какими величинами должны производиться расчеты, обозначьте их буквами, установите их единицы измерения, числовые значения, определите, какое значение является искомой величиной.
Внимательно изучите условия задачи: определите, с какими величинами должны производиться расчеты, обозначьте их буквами, установите их единицы измерения, числовые значения, определите, какое значение является искомой величиной.
2. Запишите эти задания в виде кратких условий.
3. Если в условиях рассматриваемой задачи о взаимодействии веществ запишите уравнение реакции (реакций) и уравняйте его (их) коэффициенты.
4. выяснить количественные соотношения между данными задачи и искомым значением. Для этого разбейте свои действия на этапы, начиная с вопроса о проблеме, выяснения закономерностей, с помощью которых можно определить искомое значение на последнем этапе расчетов. Если в исходных данных отсутствуют какие-либо значения, подумайте, как их можно рассчитать, т. е. определите предварительные этапы расчета. Таких шагов может быть несколько.
5. Определите последовательность всех этапов решения задачи, запишите необходимые формулы расчетов.
6. Подставьте соответствующие числовые значения величин, проверьте их размерность и выполните расчеты.
Вывод формул соединений.
Этот вид расчета чрезвычайно важен для химической практики, так как позволяет на основе экспериментальных данных определить формулу вещества (простую и молекулярную).
На основе качественного и количественного анализа химик сначала находит соотношение атомов в молекуле (или другой структурной единице вещества), то есть ее простейшую формулу.
Например, анализ показал, что вещество представляет собой углеводород
CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Для определения соотношения атомов элементов достаточно определить их количества вещества (количество молей): Целые числа (1 и 3) получаются делением числа 0,2 на число 0,0666. За 1 примем число 0,0666. Число 0,2 в 3 раза больше числа 0,0666. Итак, Ch4 равен 9. 0265 простейшая формула данного вещества. Соотношение атомов С и Н, равное 1:3, соответствует бесчисленному числу формул: С2Н6, С3Н9, С4h22 и т. д., но только одна формула из этого ряда является молекулярной для данного вещества, т. е. отражающей истинное число атомов в его молекуле. Для расчета молекулярной формулы, помимо количественного состава вещества, необходимо знать его молекулярную массу.
0265 простейшая формула данного вещества. Соотношение атомов С и Н, равное 1:3, соответствует бесчисленному числу формул: С2Н6, С3Н9, С4h22 и т. д., но только одна формула из этого ряда является молекулярной для данного вещества, т. е. отражающей истинное число атомов в его молекуле. Для расчета молекулярной формулы, помимо количественного состава вещества, необходимо знать его молекулярную массу.
Значение часто используется для определения этого значения. относительная плотность газа D. Итак, для приведенного выше случая Dh3 = 15. Тогда M(CxHy) = 15µM(h3) = 152 г/моль = 30 г/моль.
Поскольку M(Ch4) = 15, для соответствия истинной молекулярной массе необходимо удвоить индексы в формуле. Отсюда молекулярная формула вещества: C2H6 .
Определение формулы вещества зависит от точности математических расчетов.
При нахождении значения n элемента следует учитывать не менее двух знаков после запятой и тщательно округлять числа.
Например, 0,8878 ≈ 0,89, а не 1. Соотношение атомов в молекуле не всегда определяется простым делением полученного числа на меньшее число.
по массовым долям элементов.
Задание 1. Установите формулу вещества, состоящего из углерода (w=25%) и алюминия (w=75%).
Разделите 2,08 на 2. Полученное число 1,04 не вписывается целое число раз в число 2,78 (2,78:1,04=2,67:1).
Теперь разделим 2,08 на 3.
В этом случае получается число 0,69, которое ровно 4 раза подходит к числу 2,78 и 3 раза к числу 2,08.
Таким образом, индексы x и y в формуле AlxCy равны 4 и 3 соответственно.
Ответ: Al4C3 (карбид алюминия).
Алгоритм нахождения химической формулы вещества
по его плотности и массовым долям элементов.
Более сложным вариантом задачи на вывод формул соединений является случай, когда состав вещества дается через продукты сгорания оных.
Задача 2. При сжигании углеводорода массой 8,316 г образовалось 26,4 г СО2. Плотность вещества при нормальных условиях составляет 1,875 г/мл. Найдите его молекулярную формулу.
Плотность вещества при нормальных условиях составляет 1,875 г/мл. Найдите его молекулярную формулу.
Общие сведения об углеводородах.
(продолжение)
https://pandia.ru/text/78/431/images/image025_32.gif»>
Природные источники углеводородов. — ископаемое, жидкое топливо, сложная смесь органических веществ: предельные углеводороды, парафины, нафтены, ароматические соединения и др. Нефть обычно содержит кислород-, серо- и азотсодержащие вещества.
Маслянистая жидкость с характерным запахом, темного цвета, светлее воды. Важнейший источник топлива, смазочных масел и других нефтепродуктов. Основной (первичный) процесс переработки — перегонка, в результате которой получают бензин, нафту, керосин, солярки, мазут, вазелин, парафин, гудрон. Вторичные процессы переработки (крекинг , пиролиз ) позволяют дополнительно получать жидкое топливо, ароматические углеводороды (бензол, толуол и др.) и др.
Нефтяные газы — смесь различных газообразных углеводородов, растворенных в нефти; они высвобождаются во время добычи и обработки. Они используются в качестве топлива и химического сырья.
Они используются в качестве топлива и химического сырья.
Бензин — бесцветная или желтоватая жидкость, состоит из смеси углеводородов ( C5 — C11 ). Применяется в качестве моторного топлива, растворителя и др.
Нафта — прозрачная желтоватая жидкость, смесь жидких углеводородов. Применяется в качестве дизельного топлива, растворителя, гидравлической жидкости и т. д.
Керосин — прозрачная бесцветная или желтоватая жидкость с голубым оттенком. Применяется в качестве топлива для реактивных двигателей, для бытовых нужд и т.п.
Солнечная — желтоватая жидкость. Используется для производства смазочных масел.
мазут – мазут, смесь парафинов. Применяются в производстве масел, мазута, битума, для переработки в легкое моторное топливо.
Бензол Бесцветная жидкость с характерным запахом. Применяется для синтеза органических соединений, как сырье для производства пластмасс, как растворитель, для производства взрывчатых веществ, в анилиновой промышленности
Толуол — аналог бензола. Применяется в производстве капролактама, взрывчатых веществ, бензойной кислоты, сахарина, в качестве растворителя, в анилиново-красочной промышленности и др.
Применяется в производстве капролактама, взрывчатых веществ, бензойной кислоты, сахарина, в качестве растворителя, в анилиново-красочной промышленности и др.
Масла смазочные — Применяются в различных областях техники для уменьшения трения мех. деталей, для защиты металлов от коррозии, в качестве смазочно-охлаждающей жидкости.
Деготь — черная смолистая масса. Используется для смазки и т.д.
Вазелин — смесь минерального масла и парафинов. Применяются в электротехнике, для смазки подшипников, для защиты металлов от коррозии и т. д.
Парафин — смесь твердых предельных углеводородов. Используется как электрический изолятор, в хим. промышленность — для получения высших кислот и спиртов и др.
Пластмассы — материалы на основе высокомолекулярных соединений. Используется для производства различных технических изделий и предметов быта.
асфальтовая руда — смесь окисленных углеводородов. Применяется для изготовления лаков, в электротехнике, для асфальтирования улиц.
Воск горный — минерал из группы нефтяных битумов. Применяется как электроизолятор, для приготовления различных смазок и мазей и др.
воск искусственный — воск горный очищенный.
Уголь — твердое топливо заводского происхождения черного или черно-серого цвета. Содержит 75–97% углерода. Используется как топливо и как сырье для химической промышленности.
Кокс — спеченный твердый продукт, образующийся при нагревании некоторых углей в коксовых печах до 900–1050° C. Используется в доменных печах.
Газ коксовый – газообразные продукты коксования ископаемых углей. Состоит из Ч5, х3, СО и др., также содержит негорючие примеси. Используется как высококалорийное топливо.
Вода аммиачная — жидкий продукт сухой перегонки каменного угля. Применяется для получения солей аммония (азотных удобрений), аммиака и др.
Каменноугольная смола — густая темная жидкость с характерным запахом, продукт сухой перегонки угля. Используется как сырье для химической промышленности.
Используется как сырье для химической промышленности.
Бензол — бесцветная подвижная жидкость с характерным запахом, один из продуктов каменноугольной смолы. Применяются для синтеза органических соединений, как взрывчатые вещества, как сырье для производства пластмасс, как краситель, как растворитель и др.
Нафталин — твердое кристаллическое вещество с характерным запахом, одно из продукты каменноугольной смолы. Производные нафталина используются для получения красителей, взрывчатых веществ и др.
Медикаменты — Коксохимическая промышленность выпускает целые линейки лекарственных средств (карболовая кислота, фенацитин, салициловая кислота, сахарин и др.).
Пек — твердая (вязкая) масса черного цвета, остаток от перегонки каменноугольной смолы. Применяется в качестве гидроизоляционного агента, для производства топливных брикетов и др.
Толуол — аналог бензола, один из продуктов каменноугольной смолы. Используется для производства взрывчатых веществ, капролактама, бензойной кислоты, сахарина, в качестве красителя и др.
Красители — один из продуктов коксохимического производства, получаемый в результате переработки бензола, нафталина и фенола. Используется в народном хозяйстве.
Анилин — бесцветная маслянистая жидкость, ядовитая. Применяется для получения различных органических веществ, анилиновых красителей, различных азокрасителей, синтеза лекарственных средств и др.
Сахарин — твердое белое кристаллическое вещество сладкого вкуса, получаемое из толуола. Используется вместо сахара при сахарном диабете и др.
ВВ — производные угля, полученные в процессе сухой перегонки. Применяются в военной промышленности, горнодобывающей и других отраслях народного хозяйства.
Фенол — белое кристаллическое вещество розового цвета с характерным резким запахом. Применяется в производстве фенолоформальдегидных пластмасс, полиамидного синтетического волокна, красителей, лекарственных средств и др.
Пластмассы – материалы на основе высокомолекулярных соединений. Используется для производства различных технических изделий и предметов быта.
Используется для производства различных технических изделий и предметов быта.
Для новых программ и учебников этот вопрос становится наиболее острым. Наша школа перешла на новые учебники О.С. Габриеляна и новой программы, как и у большинства школ Заволжского района, поэтому представляем календарно-тематическое планирование по курсу «Органическая химия» 10 класс. Тематическое планирование составляется по программе, разработанной Департаментом образовательных программ и…
Деятельность. Поиск методов и форм обучения, способствующих воспитанию творческой личности, привел к появлению некоторых специфических способов обучения, одним из которых являются игровые методы. Внедрение игровых методов обучения при изучении химии с точки зрения соблюдения дидактических и психолого-педагогических особенностей повышает уровень подготовленности учащихся. Слово «игра» по-русски…
Во-вторых, в настоящее время известно достаточное количество соединений, нерастворимых в неполярных растворителях или, наоборот, хорошо растворимых в воде, которые, тем не менее, относят к липидам. В современной органической химии определение термина «липиды» основано на биосинтетической связи этих соединений — к липидам относятся жирные кислоты и их производные. При этом по биохимии…
В современной органической химии определение термина «липиды» основано на биосинтетической связи этих соединений — к липидам относятся жирные кислоты и их производные. При этом по биохимии…
Работа предназначена для преподавателей химии, а также может быть полезна студентам педагогических вузов и колледжей. 2.2. ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Необходимость разработки элективного курса для учащихся 10-х классов «Решение задач по органической химии повышенной сложности» обусловлена рядом причин. В соответствии с основным учебным планом полную среднюю школу по изучению химии за 2…
НАУКА — ВЫБОР КУРСА CHCI
КЛАСС | КУРС | ПРЕДВАРИТЕЛЬНОЕ ТРЕБОВАНИЕ | ОПИСАНИЕ |
09 | SNC1WI | Нет | Этот курс позволяет учащимся развить понимание концепций, связанных с биологией, химией, физикой, науками о Земле и космосе, а также связать науку с технологиями, обществом и окружающей средой. |
10 | SNC2DI | SNC1DI | Учащиеся расширяют свои знания в таких областях науки, как биология, химия, наука о Земле и космосе и физика. Они развивают понимание клеток, клеточного деления, клеточной специализации и организации систем у животных. Они исследуют различные типы соединений с помощью химических реакций и начинают изучать природные и человеческие факторы, влияющие на климат Земли. Наконец, учащиеся развивают понимание различных характеристик и свойств света. |
10 | SNC2PI | SNC1DI/1PI | Студенты продолжают изучение упрощенного обзора в области биологии, химии, науки о Земле и космосе и физики. Студенты начинают развивать понимание организации клеток, тканей, органов и систем у животных. Они исследуют характеристики простых химических реакций и начинают понимать различные природные и человеческие факторы, способствующие глобальному потеплению. Наконец, учащиеся анализируют, как свойства света и цвета применяются в технологии. Этот курс предназначен для успешных студентов SNC1PI или для студентов, которые боролись с SNC1DI. |
КЛАСС | КУРС | ПРЕДВАРИТЕЛЬНОЕ ТРЕБОВАНИЕ | ОПИСАНИЕ |
11 | SBI3CI | SNC2DI/2PI | Этот курс посвящен процессам, происходящим в биологических системах. |
11 | SBI3UI | СНК2ДИ/2ДВ | Студенты будут изучать теорию и проводить исследования в области биоразнообразия, эволюции и генетических процессов, строения и функций животных и анатомии, роста и функций растений. Курс фокусируется на теоретических аспектах тем и помогает студентам усовершенствовать навыки научных исследований в будущих курсах биологии. Применяется необязательная плата за рассечение. |
11 | SBI3UW | SNC2DW | Этот курс биологии более высокого уровня IB (взимается плата) разделен на 11-й и 12-й классы. |
11 | СЧ4УИ | SNC2DI/W | Фундаментальные концепции химии подробно изучаются, чтобы заложить основу для будущих курсов химии. Темы включают свойства химических веществ и химических связей, химические реакции, растворы и растворимость, а также химию атмосферы. |
11 | СЧ4УВ | SNC2DW | Этот курс химии более высокого уровня IB (взимается плата) разделен на 11-й и 12-й классы. |
11 | СЧ4UX | SNC2DW | На этом курсе химии стандартного уровня IB (взимается плата) учащиеся изучают фундаментальные понятия химии, такие как свойства химических веществ и химических связей, химические реакции, растворы и растворимость, скорость реакции, окислительно-восстановительная химия, органическая химия, равновесие и измерение и обработка данных. |
11 | SPh4UI | SNC2DI/W | Учащиеся знакомятся с основными понятиями физики через законы движения Ньютона и изучение различных форм энергии. |
11 | SPh4UX | SNC2DW | Этот курс физики стандартного уровня IB (за дополнительную плату) предлагает учащимся стать частью самых фундаментальных экспериментальных наук, поскольку физика стремится объяснить Вселенную от мельчайших частиц до огромных расстояний между галактиками. Основные изучаемые темы включают измерения и неопределенности, механику, теплофизику, волны, электричество и магнетизм, круговое движение и гравитацию, атомную, ядерную физику и физику элементарных частиц и производство энергии. |
11 | SVN3EI | SNC1PI/1DI | Для тех студентов, которые не собираются получать высшее образование, но интересуются наукой. |
КЛАСС | КУРС | ПРЕДВАРИТЕЛЬНОЕ ТРЕБОВАНИЕ | ОПИСАНИЕ |
12 | SBI4UI | СБИ3УИ/3УВ | Углубленное изучение биологических систем, включая гомеостаз, молекулярную биологию, метаболические процессы, биохимию и популяционную динамику. SCH 3UI/W — это актив. Применяется необязательная плата за рассечение. |
12 | SBI4UW | СБИ3УВ | Этот курс является продолжением курса биологии более высокого уровня IB (SBI 3UW) и должен быть выбран в 12 классе. |
12 | СЧ5ЦИ | SNC2DI/2PI/2DW | Разнообразные лабораторные методы и навыки, необходимые для сбора данных и научного анализа, развиваются в таких темах, как органическая химия, электрохимия, химические расчеты и роль химии в окружающей среде. |
12 | СЧ5УИ | SCH- | Учащиеся расширяют свои знания в области химии с помощью новых концепций органической химии и строения атома. Исследуются химические системы и равновесие, изучается электрохимия. Лабораторные навыки получают дальнейшее развитие при подготовке к поступлению в университет. MCF3MI или MCR3UI/W также являются преимуществом. |
12 | СЧ5УХ | СЧ 3UX | Этот курс является продолжением курса химии стандартного уровня IB (SCH 3UX). |
12 | СЧ5УВ | СЧ4УВ | Этот курс является продолжением курса химии IB более высокого уровня (SCH 3UW) и выбирается для 12 класса. Взимается плата. |
12 | SNC4MI | СНЦ2ДИ/В | Для тех студентов, которые заинтересованы в расширении своего понимания общих наук, но не намерены заниматься наукой на уровне послесреднего образования. Темы включают различные медицинские технологии, патогены и болезни, науку о питании, проблемы общественного здравоохранения и биотехнологии. |
12 | SPh5UI | SPh4UI/3UX | Студенты углубляют свои знания и понимание основных теорий физики. |
12 | SPh5UX | SPh4UX | Этот курс является продолжением курса физики стандартного уровня IB (SPH 3UX). Учащиеся IB, выбравшие этот факультативный предмет, должны делать это во втором семестре 11-го класса. Взимается плата. |
LHS Научный класс 10 | LHS Curriculum Guide
Advanced Placement Chemistry — № курса: 4004
КЛАССЫ: 10*, 11, 12 ПРОДОЛЖИТЕЛЬНОСТЬ: Полный год КРЕДИТ: 1,5 ДРУГОЕ: Этот курс включает 1,5 урока каждый день.
 Обычно предлагается одна секция «ранняя пташка». (CN: 4004EB)
Обычно предлагается одна секция «ранняя пташка». (CN: 4004EB) Advanced Placement Chemistry обеспечивает углубленное и количественное изучение молекулярной структуры, химических реакций, стехиометрии, термохимии, поведения состояний вещества, равновесия, химической кинетики, термодинамики, окислительно-восстановительной химии и других тем, таких как ядерная и органическая химия. Темы разрабатываются с помощью многих форм обучения, включая лабораторные работы, мероприятия, демонстрации, проекты и онлайн-симуляции. Этот курс эквивалентен лекции по общей химии и лабораторному компоненту для первокурсников колледжа.
ПРЕДВАРИТЕЛЬНЫЕ ТРЕБОВАНИЯ: Алгебра II (можно сдавать одновременно) и один год химии. * Обычно требуется пройти курс химии в летней школе между 9 и 10 классами.
Биология — № курса: 4020
КЛАССЫ: 9, 10, 11, 12 ПРОДОЛЖИТЕЛЬНОСТЬ: Полный год КРЕДИТ: 1.0
Биология — это первый курс, изучаемый старшеклассниками. Подчеркнуты важные темы: поток энергии через биосферу, основные биологические процессы, эволюция и генетическая преемственность. Индивидуальные проекты, лабораторные работы, совместные учебные группы, лекции/дискуссии и исследовательские проекты используются для того, чтобы дать каждому студенту необходимые научные знания и навыки для будущего успеха.
Индивидуальные проекты, лабораторные работы, совместные учебные группы, лекции/дискуссии и исследовательские проекты используются для того, чтобы дать каждому студенту необходимые научные знания и навыки для будущего успеха.
ПРЕДВАРИТЕЛЬНЫЕ ТРЕБОВАНИЯ: Зачисление
Биология с отличием — № курса: 4022
КЛАССЫ: 9, 10, 11, 12 ПРОДОЛЖИТЕЛЬНОСТЬ: Полный год КРЕДИТ: 1.0
Биология с отличием — это курс, который использует макро- и микроскопический научный подход понимание фундаментальных понятий и процессов биологии. Рассматриваемые темы основаны на пяти темах: наука как процесс, взаимозависимость в природе, взаимосвязь структуры и функции, передача энергии и эволюция. По сравнению с биологией, эта учебная программа преподается в ускоренном темпе и более глубоко. Акцент делается на лабораторной работе.
ПРЕДВАРИТЕЛЬНЫЕ ТРЕБОВАНИЯ: Зачисление
Химия — Курс №: 4026
КЛАССЫ: 10, 11, 12 ПРОДОЛЖИТЕЛЬНОСТЬ: Полный год ЗАЧЁТ: 1.0 ДРУГОЕ: Рекомендуется завершение или параллельное зачисление на Алгебру II.

Химия — это лабораторный курс, изучающий природу и состав материи, законы, описывающие ее поведение, и теории, объясняющие и объясняющие эти наблюдения. Темы включают основы научных исследований, атомную теорию, связи и межмолекулярные силы, химические уравнения, стехиометрию, энергию и равновесие. Понятия рассматриваются как с качественной, так и с количественной точек зрения, поэтому курс подходит для студентов, которые продемонстрировали мастерство в алгебре.
ПРЕДВАРИТЕЛЬНЫЕ ТРЕБОВАНИЯ: Алгебра (зачисление в 10-й класс)
Химия с отличием — Курс №: 4028
КЛАССЫ: 10, 11, 12 ПРОДОЛЖИТЕЛЬНОСТЬ: Полный год ЗАЧЕТ: 1.0 ДРУГОЕ: Рекомендуется завершение или одновременное зачисление на Алгебру II.
С отличием Химия — это лабораторный курс, который проходит быстрее и затрагивает больше математических понятий, чем химия. Дополнительные понятия и математическая строгость делают этот курс подходящим для студентов, преуспевших в алгебре. Курс рассматривает природу и состав материи, законы, описывающие ее поведение, и теории, объясняющие и объясняющие эти наблюдения. Темы включают основы научных исследований, атомную теорию и периодические тенденции, связи и межмолекулярные силы, стехиометрию, термодинамику, кинетику, равновесие, окислительно-восстановительный потенциал и ядерную химию.
Темы включают основы научных исследований, атомную теорию и периодические тенденции, связи и межмолекулярные силы, стехиометрию, термодинамику, кинетику, равновесие, окислительно-восстановительный потенциал и ядерную химию.
ПРЕДВАРИТЕЛЬНЫЕ ТРЕБОВАНИЯ: Алгебра (зачисление в 10 класс)
Концептуальная биология – Курс №: 4024
КЛАССЫ: 9, 10, 11, 12 ПРОДОЛЖИТЕЛЬНОСТЬ: Полный год КРЕДИТ: 1.0 важные темы биологии. Курс сосредоточен вокруг четырех областей обучения: экология, изучение живых организмов, физиология человека и генетика. Материалы представлены с использованием практического подхода, чтобы приспособить широкий диапазон чтения и аналитических способностей.
ПРЕДВАРИТЕЛЬНЫЕ ТРЕБОВАНИЯ: Зачисление
Науки о Земле — № курса: 4030
КЛАССЫ: 10, 11, 12 ПРОДОЛЖИТЕЛЬНОСТЬ: Полный год КРЕДИТ: 1.0
Науки о Земле — это подготовительный курс для колледжа, ориентированный на лабораторные работы, который обычно преподается во втором год четырехлетней научной программы, включая биологию, науки о Земле, химию и физику. Этот курс включает в себя основные разделы астрономии, геологии, метеорологии и физической географии. Акцент сделан на изучении природных циклов в каждой из вышеперечисленных областей и взаимосвязей между ними.
Этот курс включает в себя основные разделы астрономии, геологии, метеорологии и физической географии. Акцент сделан на изучении природных циклов в каждой из вышеперечисленных областей и взаимосвязей между ними.
ПРЕДВАРИТЕЛЬНЫЕ ТРЕБОВАНИЯ: Нет
Науки о Земле с отличием — № курса: 4032
ОЦЕНКИ: 10*, 11, 12 ПРОДОЛЖИТЕЛЬНОСТЬ: / ЗАЧЕТ за весь год: 1.0 ДРУГОЕ:
Двойной зачет возможность для учащихся, которые зачисляются и получают зачет за ESC120 в Колледже округа Лейк. Науки о Земле с отличием — это лабораторно-ориентированный курс, охватывающий те же основные темы, что и Науки о Земле, но преподаваемый с соблюдением строгости и содержания, необходимых для согласования с классом CLC, по которому учащиеся могут получить кредит колледжа. Это включает в себя более глубокое изучение астрономии, геологии, метеорологии и океанографии, а также более высокие требования к дизайну лаборатории и анализу данных. Также потребуются индивидуальные проекты, отчеты и сторонние чтения.

 А.
А. Г.
Г. Н. Мякинник Н.В. Манкевич
Н. Мякинник Н.В. Манкевич
 А.
А. Е. Левкин А.Н.
Е. Левкин А.Н. Э. Матулис В.Э.
Э. Матулис В.Э.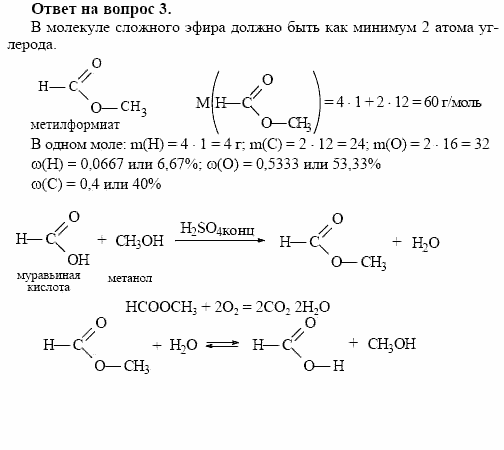



 Франкленд
Франкленд На протяжении всего курса студенты будут развивать и совершенствовать свои навыки STEM, используя научные исследования, научные эксперименты и процессы инженерного проектирования для изучения концепций и применения своих знаний в ситуациях, имеющих отношение к их жизни и сообществам. Студенты будут продолжать развивать передаваемые навыки, поскольку они становятся научно грамотными гражданами мира.
На протяжении всего курса студенты будут развивать и совершенствовать свои навыки STEM, используя научные исследования, научные эксперименты и процессы инженерного проектирования для изучения концепций и применения своих знаний в ситуациях, имеющих отношение к их жизни и сообществам. Студенты будут продолжать развивать передаваемые навыки, поскольку они становятся научно грамотными гражданами мира.
 На протяжении всего курса исследуются приложения биологии в повседневной жизни. Темы включают генетику, микробиологию, клеточную биологию, анатомию млекопитающих и природу растений. Применяется необязательная плата за рассечение.
На протяжении всего курса исследуются приложения биологии в повседневной жизни. Темы включают генетику, микробиологию, клеточную биологию, анатомию млекопитающих и природу растений. Применяется необязательная плата за рассечение. В течение двух лет студенты изучают клеточную и молекулярную биологию, метаболические процессы, нуклеиновые кислоты, генетику и ее связь с эволюцией и биоразнообразием, экологией, растениями, физиологией человека и животных. ** Пожалуйста, поговорите со своим 9 классомили 10 учителей pre-IB, если вы заинтересованы в биологии более высокого уровня IB. **
В течение двух лет студенты изучают клеточную и молекулярную биологию, метаболические процессы, нуклеиновые кислоты, генетику и ее связь с эволюцией и биоразнообразием, экологией, растениями, физиологией человека и животных. ** Пожалуйста, поговорите со своим 9 классомили 10 учителей pre-IB, если вы заинтересованы в биологии более высокого уровня IB. **  В течение двух лет студенты изучают аналогичные фундаментальные концепции химии SL, но более глубоко и подробно. Темы включают химические свойства и связывание, химические реакции, растворы и растворимость, скорость реакции, окислительно-восстановительную химию, органическую химию, равновесие, а также измерения и обработку данных.
В течение двух лет студенты изучают аналогичные фундаментальные концепции химии SL, но более глубоко и подробно. Темы включают химические свойства и связывание, химические реакции, растворы и растворимость, скорость реакции, окислительно-восстановительную химию, органическую химию, равновесие, а также измерения и обработку данных.  Студенты развивают свои навыки научного исследования, предсказывая и проверяя принятые законы и решая проблемы, возникающие в ходе исследований и повседневной жизни.
Студенты развивают свои навыки научного исследования, предсказывая и проверяя принятые законы и решая проблемы, возникающие в ходе исследований и повседневной жизни. Темы могут включать: влияние деятельности человека на окружающую среду; здоровье человека и окружающая среда; энергосбережение; наука о ресурсах и управление; а также безопасность и экологическая ответственность на рабочем месте.
Темы могут включать: влияние деятельности человека на окружающую среду; здоровье человека и окружающая среда; энергосбережение; наука о ресурсах и управление; а также безопасность и экологическая ответственность на рабочем месте. Взимается плата.
Взимается плата. Учащиеся IB, выбравшие этот факультативный предмет, должны делать это во втором семестре 11-го класса. Взимается плата.
Учащиеся IB, выбравшие этот факультативный предмет, должны делать это во втором семестре 11-го класса. Взимается плата. Студенты дополнительно развивают свои навыки научного исследования, поскольку они не только предсказывают и проверяют принятые законы и решают проблемы, возникающие в ходе исследований и повседневной жизни; но также узнайте, как интерпретация экспериментальных данных может предоставить доказательства в поддержку разработки научной модели. MCF3MI или MCR3UI/W также являются преимуществом.
Студенты дополнительно развивают свои навыки научного исследования, поскольку они не только предсказывают и проверяют принятые законы и решают проблемы, возникающие в ходе исследований и повседневной жизни; но также узнайте, как интерпретация экспериментальных данных может предоставить доказательства в поддержку разработки научной модели. MCF3MI или MCR3UI/W также являются преимуществом.