Гдз по химии 11 класс Габриелян. Учебник Базовый Дрофа
Решебники, ГДЗ
- 1 Класс
- Математика
- Русский язык
- Английский язык
- Информатика
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- 2 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
- Информатика
- Украинский язык
- Французский язык
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- Испанский язык
- 3 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
ГДЗ по Химии 11 класс рабочая тетрадь Габриелян Базовый уровень
Решебники, ГДЗ
- 1 Класс
- Математика
- Русский язык
- Английский язык
- Информатика
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- 2 Класс
- Математика
- Русский язык
- Английский язык
- Информатика
- Украинский язык
- Французский язык
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Технология
- Испанский язык
- 3 Класс
- Математика
- Русский язык
- Белорусский язык
ГДЗ по Химии 11 класс Габриелян Базовый уровень
Решебники, ГДЗ
- 1 Класс
- Математика
- Русский язык
- Английский язык
- Информатика
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- 2 Класс
- Математика
- Русский язык
- Белорусский язык
- Английский язык
- Информатика
- Украинский язык
- Французский язык
- Немецкий язык
- Литература
- Человек и мир
- Природоведение
- Основы здоровья
- Музыка
- Окружающий мир
- Технология
- Испанский язык
- 3 Класс
- Математика
- Русский язык
ГДЗ глава 1 / § 10. Твёрдые вещества 2 химия 11 класс Габриелян
Твёрдые вещества 2 химия 11 класс Габриелян
Решение есть!- 1 класс
- Математика
- Английский язык
- Русский язык
- Музыка
- Литература
- Окружающий мир
- 2 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Технология
- 3 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Музыка
- Литература
- Окружающий мир
- Казахский язык
- 4 класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Музыка
- Литература
- Окружающий мир
ГДЗ рабочая тетрадь по химии 11 класс Габриелян, Сладков
ГДЗ и решебники.
-
1 класс
- Английский язык
- Информатика
- Литература
- Математика
- Окружающий мир
- Русский язык
-
2 класс
- Английский язык
- Информатика
- История
- Литература
- Математика
- Немецкий язык
- Окружающий мир
- Русский язык
-
3 класс
- Английский язык
- Информатика
- История
- Литература
- Математика
- Окружающий мир
- Русский язык
-
4 класс
- Английский язык
- Информатика
- История
- Литература
- Математика
- Немецкий язык
- Окружающий мир
- Русский язык
-
5 класс
- Английский язык
- Биология
- География
- Информатика
- История
- Математика
- Немецкий язык
- Обществознание
- Окружающий мир
- Русский язык
- Физика
-
6 класс
- Английский язык
- Биология
- География
- Информатика
- История
- Математика
- Немецкий язык
- Обществознание
- Русский язык
- Физика
- Химия
-
7 класс
- Алгебра
- Английский язык
- Биология
- География
- Геометрия
- Информатика
- История
- Литература
- Немецкий язык
- Обществознание
- Русский язык
- Физика
- Химия
-
8 класс
- Алгебра
- Английский язык
- Биология
- География
- Геометрия
- Информатика
- История
- Литература
- Немецкий язык
- Обществознание
- Русский язык
- Физика
- Химия
-
9 класс
- Алгебра
- Английский язык
- Биология
- География
- Геометрия
- История
- Литература
- Немецкий язык
- Обществознание
- Русский язык
- Физика
- Химия
-
10 класс
- Алгебра
- Английский язык
- Биология
- География
- Геометрия
- Немецкий язык
- Русский язык
- Физика
- Химия
-
11 класс
- Алгебра
- Английский язык
- Биология
- География
- Геометрия
- Немецкий язык
- Русский язык
- Физика
- Химия
11 класс по химии
Блок I: Некоторые основные понятия химии
Значение и сфера химии.
Природа материи, законы химического сочетания, атомная теория Дальтона: концепция элементов, атомов и молекул.
Атомные и молекулярные массы, молярная концепция и молярная масса, процентный состав, эмпирические и молекулярные формулы, химические реакции, стехиометрия и расчеты, основанные на стехиометрии.
Блок II: Структура атома
Открытие электрона, протона и нейтрона, атомного номера, изотопов и изобар.Модель Томсона и ее ограничения. Модель Резерфорда и ее ограничения, модель Бора и ее ограничения, концепция оболочек и подоболочек, двойственная природа материи и света, отношение де Бройля, принцип неопределенности Гейзенберга, концепция орбиталей, квантовые числа, формы s-, p- и d-орбиталей, правила для заполнения электронами орбиталей — принцип Ауфбау, принцип исключения Паули и правило Хунда, электронная конфигурация атомов, стабильность наполовину заполненных и полностью заполненных орбиталей.
Блок III: Классификация элементов и периодичность свойств
Значение классификации, краткая история развития периодической таблицы, современный периодический закон и современная форма периодической таблицы, периодические тенденции в свойствах элементов — атомные радиусы, ионные радиусы, радиусы инертного газа, энтальпия ионизации, энтальпия усиления электронов, электроотрицательность, валентность. Номенклатура элементов с атомным номером больше 100.
Номенклатура элементов с атомным номером больше 100.
Блок IV: Химическая связь и молекулярная структура
Валентные электроны, ионная связь, ковалентная связь; параметры связи, структура Льюиса, полярный характер ковалентной связи, ковалентный характер ионной связи, теория валентной связи, резонанс, геометрия ковалентных молекул, теория VSEPR, концепция гибридизации, включающая s, p и d орбитали и формы некоторых простых молекул, теория молекулярных орбиталей гомоядерных двухатомных молекул (только качественное представление), водородная связь.
Блок V: Состояния вещества: газы и жидкости
Три состояния вещества, межмолекулярные взаимодействия, типы связи, точки плавления и кипения, роль законов газа в объяснении концепции молекулы, закон Бойля, закон Шарля, закон Гей-Люссака, закон Авогадро, идеальное поведение, эмпирический вывод газа уравнение, число Авогадро, уравнение идеального газа. Отклонение от идеального поведения, сжижение газов, критическая температура, кинетическая энергия и скорости молекул (элементарная идея) Состояние жидкости — давление пара, вязкость и поверхностное натяжение (только качественное представление, без математических выводов)
Блок VI: Химическая термодинамика
Понятия Системы и типы систем, окружение, работа, тепло, энергия, экстенсивные и интенсивные свойства, функции состояния.
Первый закон термодинамики — внутренняя энергия и энтальпия, теплоемкость и удельная теплоемкость, измерение ΔU и ΔH, закон суммирования постоянной теплоты Гесса, энтальпия диссоциации связи, горения, образования, атомизации, сублимации, фазового перехода, ионизации, растворения и разведение. Второй закон термодинамики (краткое введение)
Введение энтропии как функции состояния, изменение энергии Гибба для спонтанных и несамопроизвольных процессов, критерии равновесия.
Третий закон термодинамики (краткое введение).
Блок VII: Равновесие
Равновесие в физических и химических процессах, динамический характер равновесия, закон действия масс, константа равновесия, факторы, влияющие на равновесие — принцип Ле Шателье, ионное равновесие — ионизация кислот и оснований, сильные и слабые электролиты, степень ионизации, ионизация многоосновных кислоты, сила кислоты, понятие pH, уравнение Хендерсона, гидролиз солей (элементарная идея), буферный раствор, произведение растворимости, общий ионный эффект (с иллюстративными примерами).
Установка VIII: окислительно-восстановительная реакция
Понятие окисления и восстановления, окислительно-восстановительных реакций, степени окисления, уравновешивания окислительно-восстановительных реакций, с точки зрения потери и увеличения количества электронов и изменения степени окисления, применения окислительно-восстановительных реакций.
Установка IX: Водород
Положение водорода в периодической таблице, возникновение, изотопы, получение, свойства и применение водорода, гидриды — ионные, ковалентные и межузельные; физико-химические свойства воды, тяжелой воды, получения перекиси водорода, реакции, строение и использование; водород в качестве топлива.
Установка X: s — Блочные элементы (щелочные и щелочноземельные металлы)
Элементы группы 1 и 2
Общее введение, электронная конфигурация, возникновение, аномальные свойства первого элемента каждой группы, диагональные отношения, тенденции изменения свойств (таких как энтальпия ионизации, атомные и ионные радиусы), тенденции химической реактивности с кислородом, водой, водородом и галогены, использует.
Получение и свойства некоторых важных соединений:
Карбонат натрия, хлорид натрия, гидроксид натрия и гидрокарбонат натрия, биологическое значение натрия и калия.Оксид кальция и карбонат кальция и их промышленное использование, биологическое значение магния и кальция.
Блок XI: Некоторые элементы p-блока
Общее введение в p — блочные элементы
Элементы группы 13: общее введение, электронная конфигурация, возникновение, изменение свойств, степени окисления, тенденции химической реакционной способности, аномальные свойства первого элемента группы, бор — физические и химические свойства, некоторые важные соединения, бура, борная кислота, Гидриды бора, алюминий: реакции с кислотами и щелочами, использование.
Группа 14 Элементы: Общее введение, электронная конфигурация, возникновение, изменение свойств, степени окисления, тенденции химической реакционной способности, аномальное поведение первых элементов. Катенация углерода, аллотропные формы, физические и химические свойства; использование некоторых важных соединений: оксидов. Важные соединения кремния и несколько применений: тетрахлорид кремния, силиконы, силикаты и цеолиты, их применение.
Важные соединения кремния и несколько применений: тетрахлорид кремния, силиконы, силикаты и цеолиты, их применение.
Раздел XII: Органическая химия — некоторые основные принципы и методы
Общее введение, методы очистки, качественный и количественный анализ, классификация и номенклатура органических соединений IUPAC.Электронные смещения в ковалентной связи: индукционный эффект, электромерный эффект, резонанс и гиперспряжение. Гомолитическое и гетеролитическое деление ковалентной связи: свободные радикалы, карбокатионы, карбанионы, электрофилы и нуклеофилы, типы органических реакций.
Блок XIII: Углеводороды
Классификация углеводородов
Алифатические углеводороды:
Алканы — номенклатура, изомерия, конформация (только этан), физические свойства, химические реакции, включая свободнорадикальный механизм галогенирования, горения и пиролиза.
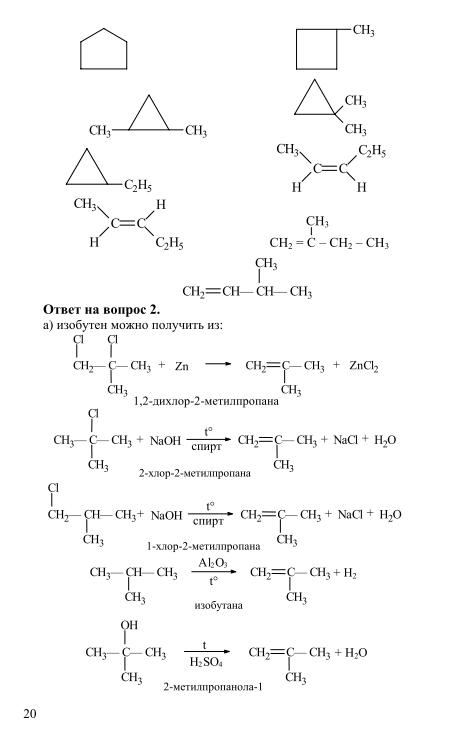
Алкены — Номенклатура, структура двойной связи (этен), геометрическая изомерия, физические свойства, методы получения, химические реакции: присоединение водорода, галогена, воды, галогенидов водорода (присоединение Марковникова и пероксидный эффект), озонолиз, окисление, механизм электрофильного добавления.
Алкины — Номенклатура, структура тройной связи (этин), физические свойства, методы получения, химические реакции: кислотный характер алкинов, реакция присоединения — водорода, галогенов, галогенидов водорода и воды.
Ароматические углеводороды: Введение, номенклатура IUPAC, бензол: резонанс, ароматичность, химические свойства: механизм электрофильного замещения. нитрование, сульфирование, галогенирование, алкилирование и ацилирование Фриделя Крафт, направленное влияние функциональной группы в монозамещенном бензоле. Канцерогенность и токсичность.
Раздел XIV: Химия окружающей среды
Загрязнение окружающей среды — загрязнение воздуха, воды и почвы, химические реакции в атмосфере, смог, основные атмосферные загрязнители, кислотные дожди, озон и его реакции, эффекты истощения озонового слоя, парниковый эффект и глобальное потепление — загрязнение промышленными отходами, зеленые химия как альтернативный инструмент для уменьшения загрязнения, стратегии контроля загрязнения окружающей среды.
химия | Определение, темы и история
Химия , наука, изучающая свойства, состав и структуру веществ (определяемых как элементы и соединения), превращения, которым они подвергаются, и энергию, которая выделяется или поглощается во время этих процессов. Каждое вещество, будь то природное или искусственно созданное, состоит из одного или нескольких из ста с лишним видов атомов, которые были идентифицированы как элементы. Хотя эти атомы, в свою очередь, состоят из более элементарных частиц, они являются основными строительными блоками химических веществ; нет кислорода, ртути или золота, например, меньше, чем атом этого вещества.Поэтому химия занимается не субатомной областью, а свойствами атомов и законами, управляющими их комбинациями, и тем, как знание этих свойств может быть использовано для достижения определенных целей.
Популярные вопросы
Что такое химия?
Химия — это отрасль науки, изучающая свойства, состав и структуру элементов и соединений, то, как они могут изменяться, и энергию, которая выделяется или поглощается при изменении.
Как связаны химия и биология?
Химия изучает вещества, то есть элементы и соединения, а биология изучает живые существа.Однако эти две области науки встречаются в дисциплине биохимии, которая изучает вещества в живых существах и то, как они изменяются в организме.
Большой задачей в химии является разработка последовательного объяснения сложного поведения материалов, почему они выглядят такими, как они есть, что придает им долговечные свойства и как взаимодействия между различными веществами могут приводить к образованию новых веществ и разрушение старых. С самых первых попыток понять материальный мир в рациональных терминах химики изо всех сил пытались разработать теории материи, которые удовлетворительно объясняли бы как постоянство, так и изменение.Упорядоченная сборка неразрушимых атомов в маленькие и большие молекулы или расширенные сети перемешанных атомов обычно считается основой постоянства, в то время как реорганизация атомов или молекул в различные структуры лежит в основе теорий изменений. Таким образом, химия включает изучение атомного состава и структурной архитектуры веществ, а также различных взаимодействий между веществами, которые могут привести к внезапным, часто бурным реакциям.
Таким образом, химия включает изучение атомного состава и структурной архитектуры веществ, а также различных взаимодействий между веществами, которые могут привести к внезапным, часто бурным реакциям.
Химия также занимается использованием природных веществ и созданием искусственных.Кулинария, ферментация, производство стекла и металлургия — все это химические процессы, восходящие к истокам цивилизации. Сегодня винил, тефлон, жидкие кристаллы, полупроводники и сверхпроводники представляют собой плоды химической технологии. В 20-м веке произошел значительный прогресс в понимании удивительной и сложной химии живых организмов, и молекулярная интерпретация здоровья и болезней открывает большие перспективы. Современная химия, опираясь на все более совершенные инструменты, изучает материалы размером с отдельные атомы и такие большие и сложные, как ДНК (дезоксирибонуклеиновая кислота), которая содержит миллионы атомов.Можно даже разработать новые вещества, которые обладают желаемыми характеристиками, а затем синтезировать. Скорость, с которой продолжают накапливаться химические знания, впечатляет. С течением времени было охарактеризовано и произведено более 8 000 000 различных химических веществ, как природных, так и искусственных. Еще в 1965 году их было меньше 500 000.
Скорость, с которой продолжают накапливаться химические знания, впечатляет. С течением времени было охарактеризовано и произведено более 8 000 000 различных химических веществ, как природных, так и искусственных. Еще в 1965 году их было меньше 500 000.
С интеллектуальными проблемами химии тесно связаны проблемы, связанные с промышленностью. В середине XIX века немецкий химик Юстус фон Либих заметил, что богатство нации можно измерить по количеству производимой серной кислоты.Эта кислота, необходимая для многих производственных процессов, остается сегодня ведущим химическим продуктом в промышленно развитых странах. Как признал Либих, страна, производящая большое количество серной кислоты, — это страна с сильной химической промышленностью и сильной экономикой в целом. Производство, распространение и использование широкого спектра химических продуктов характерно для всех высокоразвитых стран. Фактически, можно сказать, что «железный век» цивилизации сменяется «полимерным веком», поскольку в некоторых странах общий объем производимых полимеров превышает объем железа.
Область химии
Давно прошли те дни, когда один человек мог надеяться получить детальные знания во всех областях химии. Те, кто преследует свои интересы в определенных областях химии, общаются с другими людьми, разделяющими те же интересы. Со временем группа химиков со специализированными исследовательскими интересами становится членами-основателями области специализации. Области специализации, возникшие в начале истории химии, такие как органическая, неорганическая, физическая, аналитическая и промышленная химия, а также биохимия, по-прежнему представляют наибольший общий интерес.Однако в XX веке произошел значительный рост в области полимерной, экологической и медицинской химии. Более того, продолжают появляться новые специальности, например, пестициды, судебная медицина, компьютерная химия.
Заметки по физической химии 11 класс, книга, электронная книга, руководство
Получить заметки по физической химии 11 класса, книгу, электронную книгу, руководство — скачать бесплатно в формате PDF в разделе Научные (немедицинские) заметки 11 класса, раздел электронных книг в формате PDF на Studynama. com.
com.
Основные темы / главы, затронутые в Быстрая редакция урока 11 по физической химии, PDF-заметки, книга, электронная книга, руководство:
- РАЗДЕЛ 1: НЕКОТОРЫЕ БАЗОВЫЕ КОНЦЕПЦИИ ХИМИИ — Классификация веществ, базовые единицы СИ и значимые цифры , Законы химического сочетания, концепция крота, условия концентрации
- РАЗДЕЛ 2: СТРУКТУРА АТОМА — Теория атома Дальтона, характеристики электронов, протонов, модель атома Томсона, модель атома Резерфорда, нейтроны, атомная масса и атомные числа, фотоэлектрический эффект и особенности атомных спектров, модель атома Бора, Де Бройль соотношение и принцип неопределенности Гейзенберга, Орбитали и квантовые числа, Электронные конфигурации атомов.

- РАЗДЕЛ 3: КЛАССИФИКАЦИЯ ЭЛЕМЕНТОВ И ПЕРИОДИЧНОСТЬ СВОЙСТВ — Периодическая классификация элементов, Характеристики s блочных элементов, Характеристики p блочных элементов, Характеристики d блочных элементов, Характеристики f блочных элементов, Атомный и ионный радиус, Ионизационная энтальпия , Энтальпия электронного усиления и электроотрицательность
- РАЗДЕЛ 4: ХИМИЧЕСКАЯ СВЯЗЬ И МОЛЕКУЛЯРНАЯ СТРУКТУРА — Подход Косселя-Льюиса к химическому связыванию и формальному заряду, параметры связи, теория VSEPR, резонанс, теория валентной связи, гибридизация, теория молекулярных орбиталей
- РАЗДЕЛ 5: СОСТОЯНИЕ ВЕЩЕСТВА — Межмолекулярные силы, газовые законы, поведение газов
- РАЗДЕЛ 6: ТЕРМОДИНАМИКА — Термодинамика и типы процессов, переменные состояния, законы термодинамики, различные изменения энтальпии, энтальпия решетки и цикл Борна Габера, закон постоянного суммирования тепла Гесса, энергия Гиббса и спонтанность
- РАЗДЕЛ 7: РАВНОВЕСИЕ — Равновесие в физических процессах, равновесие в химических процессах, закон химического равновесия и константа равновесия, приложения константы равновесия, факторы, влияющие на равновесие, кислоты, основания и соли, ионное равновесие в растворе, ионизация кислот и Основы, гидролиз солей, буферные растворы

- Заметки по физической химии класса 11.pdf Всего загрузок: 1,805
Размер файла: 8.7 МБ
Последний раз редактировал модератор:
Отличная акция для студентов естественных наук 11 класса — заметки по физической химии.Благодарю.
IB Chemistry 11 — Ms. K’s Chemistry Class
Тема 5: Энергетика
С весенними каникулами!
Чт, 12 марта:
Энергетика Unit Test
Вт, 10 мар:
- IA Критерии и контрольная точка № 1
- Energy Review
Пт, 6 марта:
- Лаборатория: Закон Гесса: Теплота сгорания Mg
- Напоминания:
- Лаборатория 1: NaOH + HCl Теплота нейтрализации — с понедельника / вторник
- Лаборатория 2: Теплота сгорания Mg — с четверга / пятницы (формально лабораторный отчет, цифровые графики и экстраполяция)
- Energetics Unit Test — Thu, 12 Mar
Wed, Mar 4:
- Примечания: Закон Гесса
- Теплоты образования и горения
- Напоминание:
- Загрузите Neulog для следующей лаборатории в пятницу.

- Загрузите Neulog для следующей лаборатории в пятницу.
Пн, 2 марта:
Чт, 27 февраля:
- Примечания: вопросы калориметрии
- Примечания: энтальпии связи
Вт, 25 февраля:
- Обзор теста блока склеивания
- Примечания: Калориметрия
Пт, 21 февраля:
- Демонстрации: Вонючая ледяная реакция против смерти мармеладного медведя
- Примечания: Введение в эндотермические и экзотермические реакции
Тема 4: Химическая связь и структура
Ср, 19 февраля:
Единичный тест соединения и структуры
Пн, 17 февраля: День семьи — без уроков
Пт, 14 февраля: Pro-D Day — Без занятий
Чт, 13 февраля:
- Лаборатория: хроматография Кул (блоки A и B)
- Review (ABC)
Вт, 11 февраля:
- Примечания: продолжение МВФ
- Обзор
- Напоминание: Испытание блока связи — 19 февраля
Пт, 7 февраля:
- Аллотропы углерода и кремния — Групповые презентации
- Напоминание: Испытание блока связывания — 19 февраля
Среда, 5 февраля: День сотрудничества (только на компакт-диске)
Пн, 3 февраля:
- Лаборатория: Полярность различных жидкостей
- Напоминание:
- Презентации Allotropes — Пт, 7 февраля
- Испытание блока склеивания — 19 февраля
Чт, 30 января:
- Тест 5: Гибридизация и резонанс
- Примечания: МВФ
Вт, 28 января:
- Примечания: Полярность
- Напоминания:
- Тест 5 — Резонанс и гибридизация — Четверг, 30 января
- Тест 6 — Полярность — Пн, 3 февраля
Переходная неделя
Вт, 21 января:
- Примечания: гибридизация и резонанс
Пт, 17 января:
Ср, 15 января:
Занятия отменены из-за суровой погоды.
Напоминание: Викторина VSEPR в пятницу
Пн, 13 января:
- Тест 3: Lewis Structures
- Примечания: VSEPR
- Практика создания моделей
Чт, 9 января:
- Тест 2: Ионная связь
- Примечания: Формальные обвинения
- Практика
- Напоминание: Тест 3 — Lewis Structures (понедельник, 13 января)
Вт, 7 января:
- Примечания: Ковалентное связывание
- Примечания: Lewis Structures
- Практика:
С праздником!
Пт, 20 декабря:
День кино
Ср, 18 декабря:
- Тест 1 — Именование соединений
- Упражнение по ионному связыванию — ключ
Пн, 16 декабря:
youtube.com/embed/QXT4OVM4vXI?version=3&rel=1&showsearch=0&showinfo=1&iv_load_policy=1&fs=1&hl=en&autohide=2&wmode=transparent» allowfullscreen=»true» sandbox=»allow-scripts allow-same-origin allow-popups allow-presentation»/>
- Примечания: Ионное связывание
- Практика:
- Напоминание:
- Тест 1 — Именование: среда, 18 декабря
- Тест 2 — Ионное связывание: пт, 20 декабря
Чт, 12 декабря
- Обзор теста ATP Обзор
- : присвоение имен бинарным соединениям
Темы 2 и 3: Атомная теория и периодичность
Вт, 10 дек:
Единичный тест ATP
Пт, 6 дек:
- Quiz 2 Review
- Kahoot! Обзор
- Напоминание: ATP Unit Test — Вт, 10 декабря
Среда, 4 декабря:
Пн, 2 дек:
- Тест 2: Периодические тенденции
- Примечания: Переходные металлы
Чт, 28 ноября:
- Примечания: Продолжение периодических тенденций
- Групповые презентации (обзор PT)
- Напоминание: Тест 2 ATP — Периодические тенденции: понедельник, 2 декабря
Вт, 26 ноября:
- Тест 1: Электронная конфигурация (снова)
- Примечания: Периодические тенденции (1-3)
youtube.com/embed/10y5_wfyrE8?version=3&rel=1&showsearch=0&showinfo=1&iv_load_policy=1&fs=1&hl=en&autohide=2&wmode=transparent» allowfullscreen=»true» sandbox=»allow-scripts allow-same-origin allow-popups allow-presentation»/>
Пт, 22 ноября:
- Тест 1: Электронная конфигурация
- Задание: Быть Менделеевым
Ср, 20 ноября:
- Примечания: Энергии переходов
- Примечания: Электронные конфигурации
- Практика: Ключ EC
- Напоминание: Тест 1 Электронные конфигурации — Пт, 22 ноября
Понедельник, 18 ноября:
youtube.com/embed/thnDxFdkzZs?version=3&rel=1&showsearch=0&showinfo=1&iv_load_policy=1&fs=1&hl=en&autohide=2&wmode=transparent» allowfullscreen=»true» sandbox=»allow-scripts allow-same-origin allow-popups allow-presentation»/>
- Примечания: модель атома Бора
- Практика:
- Примечания: электронные переходы
Чт, 14 ноября:
- Обзор теста стехиометрии
- Примечания: Введение в атомную теорию
- Примечания: Изотопы
- Практика: Относительная атомная масса
Вторник, 12 ноября: День Pro-D — Без занятий.
Пн, 11 ноября: День памяти — без уроков.
Тема 1: Стехиометрия
Пт, 8 ноября:
- A:
- Лабораторная деятельность: Изготовление объемных растворов и разведений
- B:
- C:
- Лаборатория 5: Титрование HCl против NaOH
Среда, 6 ноября: 9000
Единичный тест стехиометрии
Пн, 4 ноября:
- AB:
- Лаборатория 5: Титрование HCl против NaOH
- Напоминание: Единичный тест стехиометрии — среда, 6 ноября
- C:
- Примечания:% Atom Economy
- Примечания: титрование
- Обзор: Клавиша обзора Stoich (игнорировать Q.
 10)
10) - Напоминание: Единичный тест стехиометрии — среда, 6 ноября
Чт, 31 октября: Happy Halloween
- AB:
- Взрывы тыквы
- Практика: ключ обзора Stoich (игнорировать Q.10)
- Напоминание:
- Лаборатория титрования — понедельник, 4 ноября
- Единичный тест стехиометрии — среда, 6 ноября
- C:
- Взрывы тыквы
- Mole Quiz 3: Solutions and Stoich
Вт, 29 октября:
- AB:
- Примечания:% Atom Economy
- Примечания: титрование
- Mole Quiz 3: Solutions and Stoich
- C:
- Примечания: ограничение и превышение
- Примечания:% доходности и% чистоты
- Практика : Ограничение WS Key
- Напоминание: Кротовая викторина 3 — Решения и Стоич — Чт, 31 октября
- Напоминание: принесите тыквы на четверг!
Чт, 24 октября:
- AB:
- Примечания: ограничение и превышение
- Практика: ограничение WS Key
- Примечания:% доходности и% чистоты
- Практика: (ответы на обратной стороне WS)
- Напоминание:
- Mole Quiz 3: Решения и расчеты стехиометрии (29 октября)
- Единичный тест стехиометрии — 4 (или 6 ноября)
- C:
- Примечания: Решения (продолжение)
- Практика:
- Примечания: Стехиометрические расчеты
- Практика
- Напоминание:
- Mole Quiz 3: Решения и расчеты стоихов (31 октября)
- Единичный тест стехиометрии — 4 или 6 ноября
Вт, 22 октября:
- AB:
- Примечания: стехиометрические расчеты
- Практика
- Примечания: ограничение и превышение
- Напоминание:
- Тест на моле 3: решения и расчеты стехиометрии (29 октября)
- Единичный тест стехиометрии — 4 ноября (или 6 ноября) )
- C:
- Тест 2: Газовые законы
- Примечания: Растворы
- Напоминание:
- Лабораторная проверка молярного объема должна быть выполнена 24 октября
9ri0002, 9 октября
- AB:
- Тест 2: Законы о газе
- Примечания: Решения
- Практика:
- Напоминание: лабораторный молярный объем должен быть сдан вт, 22 октября
- C:
- Газовые законы и идеальные газы
- Практика: Газ Ключ Laws WS
- Напоминание: викторина по законам о газе — вторник, 22 октября
Среда, 16 октября:
- Лаборатория 4: Определение молярного объема газа
- Напоминания:
- Mole Quiz 2: Газовые законы — пт, 18 октября (AB) и вторник, 22 октября (C)
Mon, Oct 14: День Благодарения. Нет классов
Нет классов
Пт, 11 октября:
- AB:
- C:
- Тест на крот 1
- Примечания: Молярный объем
- Практика (ключи ответов см. Ниже)
- Напоминания:
- Лаборатория по гидратации: сдача: среда, 16 октября
- Тест на крот 2 : Газовые законы — пт, 18 октября (AB), подлежит уточнению для блока C
Среда, 9 октября: День сотрудничества (только AB)
- Mole Quiz 1
- Примечания: Молярный объем
- Практика:
Понедельник, 7 октября:
- Лаборатория 3: Определение формулы неизвестного гидрата
- Напоминание:
- Тест на кротов 1: среда, 9 октября (AB) / пт, 11 октября (C).
Чт, 3 октября:
- Примечания: Эмпирическая формула
- Примечания: Молекулярная формула
- Практика: Ключ рабочего листа
Вт, 1 октября:
- Примечания: Молярная масса
- Примечания:% состав
- Практика:
Пт, 27 сентября: Climate Strike
- Лабораторная работа: Определение массы крота
Среда, 25 сентября:
- Тест по измерениям 2
- Задание: Введение в родинки
Тема 11: Измерение
Пн, 23 сентября: День Pro-D. Нет классов
Нет классов
Пт, 20 сентября:
:- Распространение неопределенностей
- Практика
Напоминание: Измерение «Тест» / Тест 2 — среда, 25 сентября.
Пн, 16 сентября:
Чт, 12 сентября:
- Лаборатория 1: Измерение массы и объема для определения плотности.
- Вот файл Excel со всеми данными. Щелкните вкладки в левом нижнем углу, чтобы получить доступ к листу для блока A, B или C.
- Напоминание:
- Тест по измерениям 1 — понедельник, 16 сентября
Вт, 10 сентября:
Пт, 6 сентября:
- Научная нотация
- Значимые цифры
- Практические расчеты
Среда, 4 сентября :
- Введение
- Краткое содержание курса
- Digital Scavenger Hunt
- Безопасность в лаборатории
Нравится:
Нравится Загрузка.

 Твёрдые вещества 2 химия 11 класс Габриелян
Твёрдые вещества 2 химия 11 класс Габриелян

 10)
10)