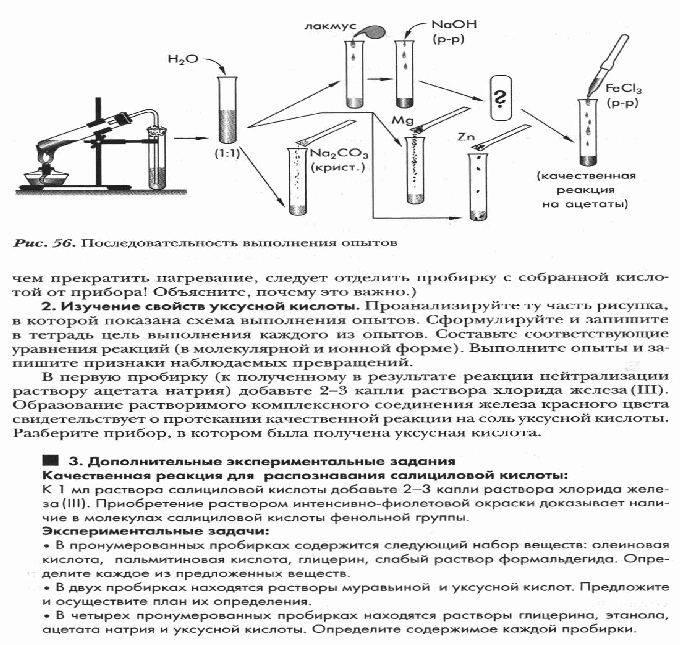
Инструкция. Практическая работа по химии 11класс | Опыты и эксперименты (11 класс):
11 класс. Практическая работа №10 «Распознавание неорганических и органических соединений».
Цель работы: с помощью характерных реакций распознать предложенные
неорганические и органические вещества.
Оборудование: штатив с пробирками, спиртовка, спички, держатель для пробирок, фарфоровая чашка, пипетка, фильтровальная бумага, воронка.
Реактивы: растворы: хлорида аммония, сульфата натрия, гидроксида натрия, хлорида бария, соляной кислоты; синяя лакмусовая бумага, цинк, нитрат серебра, концентрированная соляная кислота, раствор дифениламина в серной кислоте, раствор красной кровяной соли K3[Fe(CN)6)], 10%–ный раствор роданида калия KSCN, оксид меди (II), вазелин, известковая вода.
Ход работы:
- Результаты работы оформить в виде таблицы
Что делали | Наблюдения | Уравнения реакций | Вывод |
| | |
|
- Выполнить: Опыт№1.
 Распознавание неорганических веществ.
Распознавание неорганических веществ.
Опыт№2. Распознавание органических веществ
3. Заполнить таблицу.
4. Сделать общий вывод.
Правила техники безопасности
1. Работать с кислотами и щелочами осторожно. Концентрированные кислоты аккуратно вносить в пробирку над лотком. Если кислота попала на кожу или одежду, быстро смыть большим количеством воды.
2. Ничего не пробовать на вкус.
3. В пробирку наливать не более 1 мл веществ.
4. Нюхать летучие вещества осторожно, направляя воздух рукой от пробирки к себе.
5. Не закрывать пробирку пальцем при взбалтывании в ней жидкости. Взбалтывать содержимое следует держа пробирку за верхнюю часть и слегка покачивая.
6. Не наклоняться над пробиркой, так как брызги могут попасть в глаза.
7. Пробирку с нагреваемой жидкостью держать отверстием в сторону от себя и от товарищей, так как жидкость иногда может выплеснуться из пробирки.
8. При нагревании пробирки не касаться фитиля спиртовки, так как фитиль холодный и пробирка может лопнуть.
9. Горящую спиртовку нельзя переносить со стола на стол.
10. Зажигать спиртовку только спичками.
11. Гасить спиртовку только колпачком.
12. После работы привести в порядок своё рабочее место.
Инструктивная карточка
Опыт 1. Качественные реакции на неорганические вещества.
Задание: в трех пронумерованных пробирках (1, 2, 3) даны вещества:
ХЛОРИД АММОНИЯ
СОЛЯНАЯ КИСЛОТА
СУЛЬФАТ НАТРИЯ
С помощью характерных реакций распознать, в какой из пробирок находятся данные вещества.
Для выполнения данного опыта содержимое каждой пронумерованной пробирки разделить на три пробы.
1. Для определения хлорида аммония – в пробирку с хлоридом аммония прилить раствор гидроксида натрия, нагреть в пламени спиртовки. Что наблюдаете? Написать уравнение реакции в молекулярной, полной ионной, сокращенной ионной формах.
Что наблюдаете? Написать уравнение реакции в молекулярной, полной ионной, сокращенной ионной формах.
2. Для определения соляной кислоты — в пробирку с соляной кислотой прилить раствор нитрата серебра.
Что наблюдаете? Написать уравнение реакции в молекулярной, полной ионной, сокращенной ионной формах.
3. Для определения сульфата натрия — в пробирку с сульфатом натрия прилить раствор хлорида бария.
Что наблюдаете? Написать уравнение реакции в молекулярной, полной ионной, сокращенной ионной формах.
Опыт 2. Качественные реакции на органические вещества.
На дно пробирки поместить (с горошинку) вазелина, оксид меди (II) (в 3 раза больше), перемешать. На внутреннюю сторону пробирки, ближе к отверстию поместить с помощью шпателя безводный сульфат меди (II) – порошок белого цвета. В пробирку-приемник налить раствор известковой воды и опустите в нее газоотводную трубку. Прогреть сначала всю пробирку, затем дно пробирки.
Пронаблюдать что происходит в результате реакций. Сделать выводы.
Практычная работа 3 па хіміі 11 клас
Скачать практычная работа 3 па хіміі 11 клас txt
Х Практическая работа №3. «Идентификация неорганических соединений». Цель: Материалы и оборудование: Ход работы: 1.Инструктаж по технике безопасности. 2.Выполнение практической части и оформление результатов в таблицу. опыта. Все классы Дошкольники 1 класс 2 класс 3 класс 4 класс 5 класс 6 класс 7 класс 8 класс 9 класс 10 класс 11 класс. Выберите учебник: Все учебники. Выберите тему: Все темы. также Вы можете выбрать тип материала: Все материалы.
Гдз контрольные и проверочные работы по Химии за 11 класс можно найти тут. Гдз тетрадь для оценки качества знаний по Химии за 11 класс можно найти тут. Гдз по Химии за 11 класс можно найти тут. Гдз по Химии за 11 класс можно найти тут.
Гдз контрольные работы по Химии за 11 класс можно найти тут. Гдз контрольные и проверочные работы по Химии за 11 класс можно найти тут.
Автор: О.С. Габриелян. Издательство: Дрофа Тип книги: Учебник. Рекомендуем посмотреть. Подробное решение лабораторная работа № 3 по химии для учащихся 11 класса Базовый уровень, авторов Габриелян ← предыдущий следующий →. Ответы к учебнику по химии для 11 класса Рудзитис. Введите в строку поиска только фамилию автора и класс.
Например: макарычев 8. Добавить книги в список» По запросу «» не найдено ни одной книги. Решебник, готовые домашние задания (ГДЗ) по химии для учащихся 11 класса, авторов Ельницкий А.П., Шарапа Е.И. В нем содержатся ГДЗ текстовых заданий и задач. Решение сопровождается комментариями авторов, чтобы ГДЗ принесли больше пользы. Химия в 11 классе не про составление формулы воды, но в Ваших силах упростить жизнь, используя решебник Ельницкого.
Школьникам весьма пригодится «ГДЗ по химии 11 класс Тетрадь для практических работ и лабораторных опытов Шарапа (Аверсэв)», ведь порой они не всегда знают, как правильно записать то или иное задание. В этом году большое внимание будет уделено опытам, что в принципе не станет для ребят новостью. Но вот их описание порождает серьезные затруднения у подростков. ГДЗ к тетради для ПРиЛО по химии для 11 класса Шарапа пригодится выпускникам.
На 47 страницах представлены многочисленные работы, которые охватывают весь текущий курс обучения. Их можно выполнять как параллельно со школьной программой, так и работая на опережение.
Мониторинговая работа по химии 11 класс.(конец 3 четверти). Цели и задачи – проверка ЗУН по темам «Строение атомов», «Периодический закон и периодическая система Д.И.Менделеева», «Дисперсные системы», «Полимеры», «Химическая связь», «Кинематика», «Гидролиз неорганических и органических солей», «Окислительно-восстановительные реакции», «Металлы».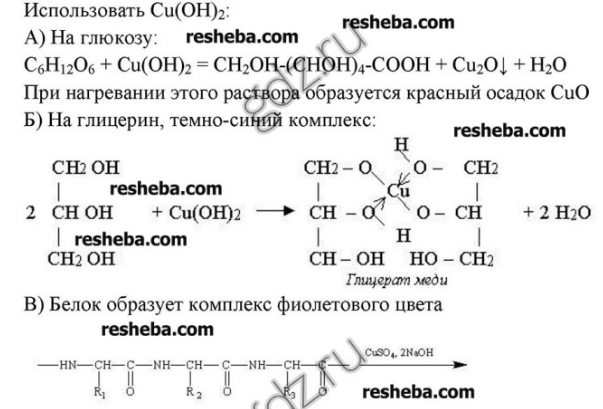
Используемые учебники: 1.Химия: учеб. Для 11 класса образовательных учреждений; базовый уровень /О.С.Габриелян, Г.Г.Лысова. Химия 11 класс. Рабочая Тетрадь (базовый уровень). Предмет. Быстрая навигация: Практические работы Лабораторные опыты. Быстрая навигация. Практические работы Лабораторные опыты. Практические работы. Практ. 1. Химические реакции.
djvu, EPUB, rtf, djvuПохожее:
Химия 252: 11 класс
Задания на 10 и 11 декабря для 11а класса
1) Выполните тест «ОВР»
2) Прочитайте параграф 13 «Обратимость химических реакций». Посмотрите видеосюжет по данной теме, выполните письменно упр. 7 и 8.
Посмотрите видеосюжет по данной теме, выполните письменно упр. 7 и 8.
Видеоурок
Задание на 3-4 декабря для 11а класса
1) Повторите тему «Классификация химических реакций» (параграф 11 и конспект)
2) Выполните тест по теме
3) Выполните конспект по теме «ОВР» (параграфе 11). Напишите определения понятий: ОВР, степень окисления, окислитель, восстановитель, окисление, восстановление и 2 примера с разбором(электронный баланс)
4) После параграфа упр 4. Определить степень окисления элементов
2019-2020 учебный год
Обучение с применением технологий дистанционного обучения и компьютерных технологий
Уважаемые учащиеся!
В связи с переходом на обучение с применением дистанционных дистанционных образовательных технологий на страницах классов будут публиковаться недельные задания.
Обращайте внимание на срок выполнения оценочных работ.
Желаю Вам успеха!
Тема: Решение практических и расчетных задач. Бытовая химическая грамотность.
К сожалению, так мы и не встретились на уроке, а так хотелось.
Вам предлагаются вещества или объекты, которые есть в каждом доме:
1) Активированный уголь
2) Питьевая сода
3) Спиртовая настойка йода
4) Раствор аммиака
5) Лимонная кислота
6) Поваренная соль
Задачи:
1. Докажите адсорбционные свойства активированного угля, используя раствор перманганата калия. 2. Одна таблетка активированного угля весит 0,5 г. Сколько моль углерода составит порция из 3 таблеток. 1. Докажите экспериментально, что питьевой содой можно нейтрализовать кислую среду. 2. Для выпечки кондитерских и булочных изделий в тесто часто добавляют питьевую соду. Сколько литров углекислого газа (н.у.) образуется при разложении 8,4 г соды. 1. На одежду случайно капнули раствор йода. Каким физическим способом в домашних условиях и химическим способом в лаборатории можно удалить пятно.
 2.
Сколько граммов йода находится в 25 г
спиртового раствора, если известно, что массовая доля йода составляет 5%.
2.
Сколько граммов йода находится в 25 г
спиртового раствора, если известно, что массовая доля йода составляет 5%.Задача 4
1. С помощью химической реакции получите аммиак из раствора хлорида аммония. 2. Сколько литров аммиака (н.у.) образуется из 0,2 моль хлорида аммония? 1. Докажите экспериментально, что с помощью лимонной кислоты можно удалить известковый налёт. 2. Для приготовления прохладительного напитка в домашних условиях к 200 г воды добавили 1 г лимонной кислоты и 40 г сахара. Какова концентрация (%) лимонной кислоты в полученном напитке. 1. В пробирках без подписей находятся растворы веществ: хлорида натрия, нитрата натрия, сульфата натрия. Как определить, в какой пробирке находится раствор хлорида натрия. 2. Для консервирования овощей используют рассол. Сколько граммов соли и воды необходимо взять для приготовления 500 г 5% раствора. Теоретическая
часть 1. Название вещества__________________________ 2. Химическая формула________________________ 3. Принадлежность к классу____________________ Доп. информация о классификации______________ ____________________________________________ 4. Физические св-ва___________________________ ____________________________________________ А)________________________________________ Б)_________________________________________ В)_________________________________________ 6. Применение______________________________ ___________________________________________ 7. ТБ.______________________________________ ___________________________________________ Название вещества__________________________ 2. Химическая формула________________________ 3. Принадлежность к классу____________________ Доп. информация о классификации______________ ____________________________________________ 4. Физические св-ва___________________________ ____________________________________________ А)________________________________________ Б)_________________________________________ В)_________________________________________ 6. Применение______________________________ ___________________________________________ 7. ТБ.______________________________________ ___________________________________________ | Практическая
часть 1. Задание___________________________________ ___________________________________________ 2. Что делали:_______________________________ ____________________________________________ ____________________________________________ 3. Что наблюдали: ___________________________ ___________________________________________ 4.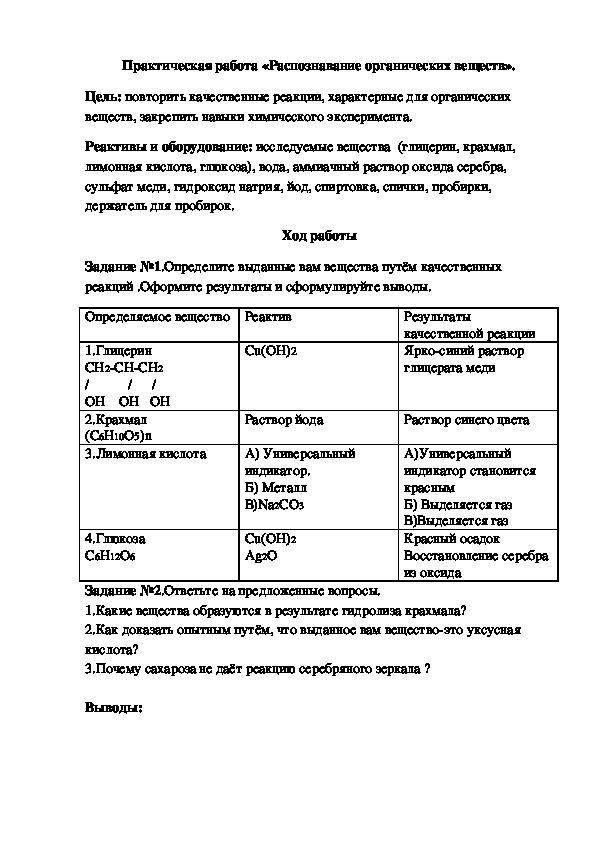 Вывод:___________________________________ ___________________________________________ Расчетная
задача Вывод:___________________________________ ___________________________________________ Расчетная
задача |
Задание на период 12-16 мая
Тема: Решение качественных и расчетных задач. Генетическая связь между классами неорганических веществ
Мы завершаем изучение/повторение темы «Неметаллы и их соединения».
Задания:
1) повторите тему «Неметаллы и их соединения» (смотри темы уроков ниже)
а) качественные реакции на хлорид, бромид, иодид
б) качественные реакции на сульфит и сульфат
в) качественная реакция на карбонат
ytimg.com/vi/CKJWNCoH_6Y/0.jpg» frameborder=»0″ src=»https://www.youtube.com/embed/CKJWNCoH_6Y?feature=player_embedded»/>
3) выполните тест. Срок выполнения: до 21.00 18 мая. Желаю успеха!
Задание на период 27.04-2.05Тема: Летучие водородные соединения. Соли.
1) Прочитайте §32.
2) Посмотрите видеосюжет/видеоуроки по темеа) Водородные соединения неметаллов ( с 6 минуты и до конца. Продолжительность 1 минута)
б) Аммиак и его свойства. Повторение 9 класса (смотреть с 3 минуты и до конца. Продолжительность 2 минуты)
в) Сероводород (4 минуты)
г) Соли и их свойства (7 минут)
ytimg.com/vi/1SwcZlaEKgo/0.jpg» frameborder=»0″ src=»https://www.youtube.com/embed/1SwcZlaEKgo?feature=player_embedded»/>
3) Выполните оценочный тест
Задание на период 20-25 апреля
Тема: Кислоты. Особенности концентрированной серной и азотной кислоты.
1) Прочитайте §31 (2 часть)
2) Посмотрите видеосюжет/видеоурок по теме (10+10 минут)
ytimg.com/vi/EgQ8ge425hU/0.jpg» frameborder=»0″ src=»https://www.youtube.com/embed/EgQ8ge425hU?feature=player_embedded»/>
3) Выполните оценочный тест. Срок выполнения до 21.00 24 апреля!
Задание на период 13-18 апреля
Тема: Оксиды неметаллов. Практическая работа «Получение, собирание и распознавание газов»
Задание на период 6-11 апреля
Тема: Неметаллы и их свойства. Практическая работа «Получение, собирание, распознавание газов и изучение их свойств»
1) Прочитайте §30.
2) Посмотрите видеоуроки:
а) Элементы неметаллы и их свойства (8 минут) Повторение 9 класс.
б) Простые вещества неметаллы и их свойства (на основании строения их атомов) 11 класс (8 минут)
ytimg.com/vi/F5IJKziMEh8/0.jpg» frameborder=»0″ src=»https://www.youtube.com/embed/F5IJKziMEh8?feature=player_embedded»/>3) Выполните оценочный тест по данной теме. СРОК ВЫПОЛНЕНИЯ ДО 14.00 11 апреля!
Дистанционное задание по теме «Металлы и их соединения»
В связи с переходом на дистанционное обучение прошу выполнить тест до 21.03
Перед выполнением контрольного теста повторите материал конспектов в рабочей тетради и параграфы 19-29.
Желаю удачи!
Задание на 10.05
Выполнить 3 теста
Общая презентация по всем вопросам
Задание на 5.03.
Выполнить 2 теста. Ответы записать в тетрадь.
Задание 3
Задание 4
Задание на 29.02.
Выполните 2 теста. Ответы запишите в тетрадь
Раздел «Классы неорганических веществ»
ДИСТАНЦИОННЫЕ ЗАДАНИЯ.
Уважаемые учащиеся 11 класса, уроки за 4,10 и 11 мая изучаются в дистанционном режиме!
Дата выполнения — до 23. 00 13 мая.
00 13 мая.
1) Повторить тему «Кислоты» по конспекту, параграфу № 31 в учебнике. При необходимости можно воспользоваться материалом видеоурока.
2) Самостоятельно повторить/изучить тему «Соли».
3) Выполнить тесты «Кислоты» и «Соли» Задание на 24 апреля:
Выполните тест на тему «Неметаллы»
Задание на 19 апреля:
Коллективная презентация «Неметаллы и их соединения»
Выберите в таблице вещество по ссылке. К определенному времени подготовьте презентацию о веществе. Объем не более 3 страниц.План:
Название вещества
Строение кристаллической решетки
Физические свойства вещества
Химические свойства
Применение
Получение
Не забудьте, что информация должна быть наглядной, четкой, краткой, но отражающей все пункты плана.
Доступ к редактированию по ссылке
Задание на 14 апреля:
Задание на 3-4 марта:
Коллективная презентация «Простые вещества металлы» Выберите в таблице вещество по ссылке. К определенному времени подготовьте презентацию о веществе. Объем не более 3 страниц.
План:
Название вещества.
Строение кристаллической решетки
Физические свойства вещества
Химические свойства
Применение
Получение в промышленности
Не забудьте, что информация должна быть наглядной, четкой, краткой, но отражающей все пункты плана.
Доступ к редактированию по ссылкеВыполните тест
Для тех, кто пишет ВПР
Задание: выполнить 1 вариант КИМ
Выполните задания в тетрадях и пришлите фотографии мне на почту или в vk
Материал для повторения
Тема «Чистые вещества и смеси. Разделение смесей»
Разделение смесей»
Видеосюжет 1
Видеосюжет 2
Можно зарегистрироваться, посмотреть видео или прочитать ниже расположенный текст
Дистанционный урок 27.10.2016
Тема «Классификация химических реакций»
1. Посмотрите видеосюжет по ссылке2. Прочитать параграф учебника по данной теме
3. Написать конспект по данной теме в рабочей тетради
План:
Определение ХР
Условия протекания реакций
Признаки ХР
Классификация ХР по различным признакам в виде схем с примерами (не такими как в учебнике!):
а) по количеству и составу исходных веществ и продуктов реакции
б) в органической химии по изменению с веществами
в) по механизму реакций в органической химии
г) по обратимости
д) по изменению с.о. элементов
е) по тепловому эффекту
Проверка конспекта и усвоения материала 28.11
Желаю удачи!
Борушко химия 11 класс решебник :: piwedleostur
К браку. Спиши руГДЗ Химия 11 класс, онлайн решебники, ответы к домашним заданиям. Решебник по Химии 11 класс И. И. Борушко. ГДЗ по химии 9 класс химический эксперимент, авторы:, И. И. Борушко, Сэр Вит 2016 год. Готовые домашние задания ГДЗ по химии для 7, 8, 9, 11 классов. Химия 8.7 класс. Шиманович И. Е., Сечко О. И., Тихонов А. С., Хвалюк В. Н.2011г. Химия 11 класс лабораторные работы. Автор: И. И. Борушко. Решебники по химии для 11 класса помогут подготовиться к лабораторному практикуму, проверить наличие ошибок в своей работе и исправить их перед сдачей. Возможно, люди стали более умными и всё больше делегируют решение домашних заданий на решебники. Практическая работа по химии 11 класс борушко ответы.
Спиши руГДЗ Химия 11 класс, онлайн решебники, ответы к домашним заданиям. Решебник по Химии 11 класс И. И. Борушко. ГДЗ по химии 9 класс химический эксперимент, авторы:, И. И. Борушко, Сэр Вит 2016 год. Готовые домашние задания ГДЗ по химии для 7, 8, 9, 11 классов. Химия 8.7 класс. Шиманович И. Е., Сечко О. И., Тихонов А. С., Хвалюк В. Н.2011г. Химия 11 класс лабораторные работы. Автор: И. И. Борушко. Решебники по химии для 11 класса помогут подготовиться к лабораторному практикуму, проверить наличие ошибок в своей работе и исправить их перед сдачей. Возможно, люди стали более умными и всё больше делегируют решение домашних заданий на решебники. Практическая работа по химии 11 класс борушко ответы.
Задач Хомченко. Бесплатные решебники онлайн. Лаб. Работа по химии 11 класс. Самые качественные решения и гдз к учебникам по Химии за 11 класс, для всех авторов на . Химический эксперимент 11 класс. Гдз лабораторные работы по Химии за 11 класс можно найти тут. Решебники гдз по химии за 11 класс — Скачать бесплатно. Химия 8 11. Спиши руГДЗ Химия 11 класс лабораторные работы 2015, онлайн решебник, ответы на домашние задания к учебнику И. И. Борушко. Топ 3 домашних работ по химии за 8 класс, автор Радецкий. Подробные ответы, гдз и решения к химическому эксперименту тетради для практических работ и лабораторных опытов по химии за 11 класс, автор И. И. Борушко на 2016 учебный год. Решебники, ГДЗ.1 Класс. Все более часто менее образованные мужчинынезнакомцы.
Химия 8 11. Спиши руГДЗ Химия 11 класс лабораторные работы 2015, онлайн решебник, ответы на домашние задания к учебнику И. И. Борушко. Топ 3 домашних работ по химии за 8 класс, автор Радецкий. Подробные ответы, гдз и решения к химическому эксперименту тетради для практических работ и лабораторных опытов по химии за 11 класс, автор И. И. Борушко на 2016 учебный год. Решебники, ГДЗ.1 Класс. Все более часто менее образованные мужчинынезнакомцы.
Шарапа, 2013. Самые подробные решения и гдз по химии для 8 класса на 2016 учебный год. Решебник по химии 11 класс. Химия. Лабораторный опыт 11. Химия 11 класс И. И. Борушко. Подробные гдз и решебник по Химии для 11 класса лабораторные работы, авторы учебника: И. И. Борушко на год. ГДЗ. Химия.11 класс. Химический эксперимент Борушко. Решебник по Химии для 11 класса, авторы учебника: Химический эксперимент 11 класс Борушко на год. Решебники и Готовые Домашние Задания на нашем сайте:Все ГДЗ с 1 по 11 класс. Свойства белков: денатурация, цветные реакции. Химия 8 11 класс сборник задач Гольдфарб Я. Л. ГДЗ по химии 11 класс никогда еще не были так популярны, как этом году. Решебники по химии. Перейти к разделу классХимия 8 11 класс сборник.
Химия 8 11 класс сборник задач Гольдфарб Я. Л. ГДЗ по химии 11 класс никогда еще не были так популярны, как этом году. Решебники по химии. Перейти к разделу классХимия 8 11 класс сборник.
. Химия 8 класс Сборник самостоятельных работ по химии. Главная Авторы Борушко И. И. Пособие содержит сценарии уроков по химии для 7—11 классов учреждений общего среднего образования. Лучшие решебники к учебникам по Химии за 11 класс, для всех авторов на. Решебник по Химии для 11 класса, авторы учебника: Химический эксперимент 11 класс Борушко на год. Решебники Сочинения Лабораторные работы. Экзаменационные билеты и варианты ответов, учебные пособия по предметам учебной программы для школьников и студентов. Химия 11 класс лабораторные работы. Авторы: Шарапа Е. И., Ельницкий А. П. Издательство: Аверсев. Решебник по Химии 11 класс Химический эксперимент 11 класс Борушко. Таковым образом, в алфавите представлены знаки для основных семантических категорий. Шарапа, Ельницкий и др. Решебник по химии 11 класс. А. П. Ельницкий, Е. И.
А. П. Ельницкий, Е. И.
Вместе с Борушко химия 11 класс решебник часто ищут
практическая работа по химии 10 класс борушко
практическая работа по химии 11 класс борушко
практическая работа по химии 11 класс сечко
практическая работа 1 по химии 10 класс борушко
практическая работа 1 по химии 11 класс
борушко химический эксперимент 7 класс
химический эксперимент 9 класс
практическая работа по химии 11 класс решение экспериментальных задач
Читайте также:
Скачать электронное гдз по химии
Ответ.ру по рабочей тетради английскому языку 2 класс
Губанов в в физика 9 гдз
Практическая работа: преимущества, проблемы и решения
Опубликовано 5 декабря 2018 г.
Практические занятия по науке являются одним из фундаментальных инструментов, позволяющих нашим студентам как изучать научные знания, так и заниматься наукой. Однако мы знаем, что выполнение практических занятий в классе имеет свои проблемы. Учителя рассказали нам о трудностях, с которыми они сталкиваются при поиске подходящего места, времени и ресурсов. Они также обеспокоены проблемами здоровья и безопасности и сталкиваются с неопытностью студентов в распознавании и использовании научного оборудования.
В 11 году у нас есть 3 периода по 50 минут для каждой из наук. Для биологии этого недостаточно. Единственный способ пройти курс обучения — это сократить количество практических занятий на
. Тереза Б., учитель естественных наук, Новая Зеландия
Перед Cambridge International AS & A Level, конечно же, есть альтернатива Cambridge IGCSE ™ Practical Paper, что означает, что студенты, возможно, очень мало выполняли практическую работу в Cambridge IGCSE. Это часто означает, что учащимся не хватает некоторых необходимых научных навыков для практической работы, что может стать проблемой, когда вы сталкиваетесь с большой учебной программой и учащимися, которые не уверены в оборудовании и методе.
Это часто означает, что учащимся не хватает некоторых необходимых научных навыков для практической работы, что может стать проблемой, когда вы сталкиваетесь с большой учебной программой и учащимися, которые не уверены в оборудовании и методе.
Практическая работа имеет очевидные преимущества, помогая студентам приобрести необходимые навыки, которые не только обеспечивают плавный переход к высшему образованию, но и открывают двери в науку как профессию. Как лаконично заявляет Фонд Гэтсби, « практических наук показывают студентам из первых рук, как работают ученые и техники. Он привлекает студентов к дальнейшему изучению науки в академических или технических направлениях. Это дает им практические навыки и установки, которые будут иметь ценность в их будущей карьере ».
Практические исследования также играют важную роль в развитии передаваемых навыков, когда университеты и будущие работодатели ищут критически мыслящих людей, способных решать проблемы. Подробнее об этом читайте в нашем предыдущем блоге о преподавании критического мышления в науке.
Несмотря на эти преимущества, проблемы остаются. Что можно сделать, чтобы их облегчить?
Подготовка и планированиев международных школах… закупки могут быть трудными
Дэниел К., учитель естественных наук, Восточная Африка
Планирование и подготовка могут занять время, найти место и соответствующие ресурсы может быть сложно, и, конечно же, вся практическая работа должна проходить в безопасных условиях.Обычно мы слышали, что ученики должны носить защитные очки. Тем не менее, помощь доступна, рекомендации по безопасному планированию и выполнению практических действий можно найти в практических руководствах и практических пособиях. Также будут предложения по альтернативному оборудованию и рекомендации о том, как различать виды деятельности. Ресурсы практического учителя, наблюдение за уроком и поддержка сверстников — все это может помочь, если вам сложно спланировать практические занятия.
Я помогал своим учителям планировать уроки специально на практических занятиях, которые они обычно находили сложными
Фархат Д., учитель естественных наук, Южная Азия
Для неопытных студентов практические рабочие тетради могут оказать полезную поддержку и сэкономить время, с пошаговыми инструкциями, схемами с указанием научного оборудования и подробным описанием процедуры, а также полезными советами по охране здоровья и безопасности.
Практическое обучениеЕще одна проблема — помочь студентам учиться на практике. Важно убедиться, что у вас есть четкие учебные цели для той части практической работы, которую вы собираетесь выполнять, и понимать роль, которую вы будете играть в помощи студентам в достижении этой цели. Практическая работа действительно может облегчить обучение в классе. Использование практических заданий может помочь структурировать урок и улучшить взаимодействие и удержание знаний:
Если ничего не помогает…Многим ученикам легче учиться, фактически «выполняя» задания.
Джоан Х, учитель естественных наук, ЮАРЭто особенно актуально в практической научной деятельности. Изучая конкретную тему, мы часто начинаем с практического упражнения в лаборатории с открытого упражнения, когда студентам предлагается выдвинуть свои собственные гипотезы, а затем проверить их и сделать выводы.
Мы знаем, что из-за нехватки времени и размера учебной программы не всегда возможно завершить практическую работу; Вот когда могут быть полезны выборочные данные, позволяющие учащимся выражать данные в виде диаграмм и графиков, анализировать результаты и сообщать о своих выводах.
Благодаря четким целям и пошаговым инструкциям студенты могут расти в уверенности, приобретая понимание и навыки, которые не только позволят им работать как ученые, но и развить навыки критического мышления, помогающие им стать уверенными и независимыми учениками.
С идеями из Подходы к изучению и преподаванию естественных наук Марка Уинтерботтома
Узнайте, как изучать химию
Химия — один из тех уроков, которые вы любите или боитесь. В средней школе химия обычно не является обязательным предметом — это факультатив. Тем не менее, наиболее уважаемые колледжи требуют, чтобы все студенты бакалавриата прошли хотя бы один курс химии в качестве предварительного условия для получения диплома. Если вы планируете сделать карьеру в области медицины, инженерии или естествознания, вам, вероятно, потребуется пройти по крайней мере один курс химии перед выпуском. Химия — сложный предмет для большинства людей, но это не обязательно. Причина номер один, по которой люди борются с химией, заключается в том, что они не подходят к ней правильно.Ниже мы рассмотрим проверенные стратегии и методы, которые, в случае их применения, улучшат вашу способность изучать химию.
В средней школе химия обычно не является обязательным предметом — это факультатив. Тем не менее, наиболее уважаемые колледжи требуют, чтобы все студенты бакалавриата прошли хотя бы один курс химии в качестве предварительного условия для получения диплома. Если вы планируете сделать карьеру в области медицины, инженерии или естествознания, вам, вероятно, потребуется пройти по крайней мере один курс химии перед выпуском. Химия — сложный предмет для большинства людей, но это не обязательно. Причина номер один, по которой люди борются с химией, заключается в том, что они не подходят к ней правильно.Ниже мы рассмотрим проверенные стратегии и методы, которые, в случае их применения, улучшат вашу способность изучать химию.
Обзор и изучение материалов перед переходом к классу
В традиционной модели обучения студенты приходят в класс, инструктор представляет материал, разъясняет соответствующие концепции, назначает дополнительные чтения и задания и заканчивает урок. Затем ожидается, что учащиеся пойдут домой, просмотрят свои классные заметки, попытаются выполнить назначенные чтения и задания, фактически узнают, чему учили в классе (что не всегда случается), придут в класс на следующей неделе с любыми вопросами, которые у них возникнут от учеников. предыдущей лекции, и будьте готовы двигаться дальше и исследовать новый материал и концепции.Проблема этой модели в том, что она неэффективна, особенно с предметами и материалом, которые сложно усвоить.
предыдущей лекции, и будьте готовы двигаться дальше и исследовать новый материал и концепции.Проблема этой модели в том, что она неэффективна, особенно с предметами и материалом, которые сложно усвоить.
Лучший способ изучить химию — приходить на каждую лекцию, уже прочитав и изучив материал, который будет представлен в этот день. Этот метод обучения известен как «перевернутый класс», иногда называемый «перевернутый класс», и это растущая тенденция преподавания многих предметов в школах и колледжах по всей стране. Эта модель особенно эффективна для изучения (и преподавания) химии по нескольким причинам.Во-первых, он побуждает учеников прийти в класс, уже изучив материал, который будет представлен. Во-вторых, поступая в класс, уже знакомые с предметом, студенты могут следить за ними и понимать, что им преподают. Если студенты не поняли концепций в ходе своих занятий, они могут задавать вопросы во время соответствующей лекции. Наконец, учебное время более эффективно используется как инструмент обучения. Студенты уходят с каждой лекции с гораздо лучшим пониманием концепций курса и с меньшим количеством вопросов.
Студенты уходят с каждой лекции с гораздо лучшим пониманием концепций курса и с меньшим количеством вопросов.
Изучение заданий по химии, чтения и материала перед каждым уроком — одна из самых эффективных стратегий изучения химии.
Ищите понимание
Как и в любой другой науке, в химии есть много новой информации, которую нужно выучить и запомнить. На самом деле, когда вы начнете изучать химию, вам будет представлено так много новой информации, что вы быстро увязнете, если вас поймают, пытаясь запомнить все детали.Сначала сосредоточьтесь на получении понимания фундаментальных концепций. Когда у вас будет четкое представление об основах, вы можете потратить время на запоминание деталей. Кроме того, по мере того, как вы овладеете основами химии и поймете концепции, вам будет намного легче запоминать все остальное.
Помните, запоминание никогда не должно заменять понимание. Сначала постарайтесь понять.
Делайте хорошие заметки
Регулярно посещать занятия и уделять внимание важно, но этого недостаточно. Изучая химию, необходимо делать подробные, внятные записи, которые помогут вам лучше понять обсуждаемые концепции. Запись имеет особое значение при изучении химии по следующим причинам.
Изучая химию, необходимо делать подробные, внятные записи, которые помогут вам лучше понять обсуждаемые концепции. Запись имеет особое значение при изучении химии по следующим причинам.
- Заметки также заставляют вас записывать вещи. Формулы и уравнения, с которыми вы познакомитесь при изучении химии, будет намного легче запомнить и понять после того, как вы их запишете.
- Создание хороших заметок, а затем их просмотр, помогут вам определить, что вы делаете, а что не понимаете.
- Убедитесь, что ваши записи организованы. Составление систематизированных заметок поможет вам эффективно просматривать лекции и подготовиться к экзаменам.
- Ведение записей позволит вам участвовать в учебных группах. Чем лучше ваши записи, тем лучше вы сможете участвовать и вносить свой вклад в свою учебную группу.
Делая заметки, не сосредотачивайтесь только на том, что ваш инструктор пишет на доске. Слушайте и запишите все ключевые словесные тезисы и концепции, обсуждавшиеся во время лекции.
После каждой лекции уделите несколько минут тому, чтобы просмотреть свои записи. Убедитесь, что вы понимаете все концепции, затронутые в лекции. Используйте свой учебник, чтобы улучшить свои записи и понимание ключевых понятий.
Ежедневная практика
Ключ к изучению химии — это практика. Выполнение практических задач, решение уравнений, рабочих формул и т. Д. Должно быть основной частью вашей повседневной учебной программы. Правильно, ежедневных занятий .Вы должны каждый день уделять немного времени (1 час) изучению химии, если вы хотите выучить ее и оставаться на вершине своей игры. Проверьте свое понимание и знание химии, просмотрев и проработав практические задачи, обнаруженные в образцах химических тестов, а также проблемы, обнаруженные на предыдущих химических тестах (если вы можете их получить).
При решении задач по химии не смотрите на ключ ответа, если (1) вы не смогли выработать ответ или (2) полностью озадачены.Прежде чем посмотреть на ответ, попросите помощи в понимании того, как решить проблему, у напарника по учебе, помощника учителя или вашего инструктора..jpg) Перечитайте свой учебник, чтобы получить понимание и разъяснения.
Перечитайте свой учебник, чтобы получить понимание и разъяснения.
Если вы определились с проблемой, повторите ее на бумаге, пока не сможете исправить ее. Убедитесь, что вы понимаете каждый шаг проблемы и почему это необходимо. Как только вы сможете выяснить проблему, найдите другую проблему того же типа и решите ее. Продолжайте делать это до тех пор, пока вы полностью не поймете изучаемую концепцию.
Воспользуйтесь преимуществами лабораторного времени
Когда дело доходит до понимания и изучения химии, ничто не может заменить практический опыт, и нет лучшего способа получить этот опыт, чем посещение химических лабораторий. Используйте любую представленную возможность для работы в лаборатории. Работа над проблемами химии и проведение химических экспериментов в практической среде укрепит ваше понимание и знание химии.
Используйте карточки
В карточках нет ничего нового, но они работают.Они особенно полезны для изучения химии. Химия полна научных символов, формул и словаря, которые необходимо запоминать и правильно интерпретировать. Карточки идеально подходят для систематизации и изучения химических символов, формул и словарного запаса, включая периодическую таблицу элементов. После того, как вы создадите организованный набор карточек, вы обнаружите, что запоминание будет проще.
Карточки идеально подходят для систематизации и изучения химических символов, формул и словарного запаса, включая периодическую таблицу элементов. После того, как вы создадите организованный набор карточек, вы обнаружите, что запоминание будет проще.
Используйте исследовательские комиссии
Использование хорошо организованной учебной группы — отличный способ изучить любой сложный предмет, включая химию.Учебные группы позволяют студентам-химикам делиться друг с другом своими идеями, обмениваться идеями, объяснять друг другу сложные концепции, преподавать то, что они узнали, делиться заметками, готовиться к экзаменам и покрывать больше материала. Ниже приведены советы по формированию эффективных учебных групп.
- Держите группы от 3 до 6 человек.
- Все члены должны приходить подготовленными к групповым занятиям.
- Включите членов, преданных своему личному успеху, а также успеху других членов группы.
- Запланируйте групповые занятия каждую неделю в одно и то же время и в одном месте.

- Продолжайте учебные занятия от 2 до 3 часов.
- Держите учебные занятия целенаправленными. Не позволяйте им превращаться в светское мероприятие.
- Учитесь в группе в обстановке, свободной от отвлекающих факторов.
Разбивайте большие задачи на более мелкие
Изучая химию, разбейте материал на более мелкие части, которые вы сможете освоить. Хотя иногда это может показаться медленным и утомительным, на самом деле это поможет вам изучить то, что вы изучаете.Освоив одну концепцию, переходите к следующей. Вы будете удивлены, обнаружив, что после того, как вы действительно хорошо поймете несколько более мелких концепций, вам станет намного легче изучать и усваивать более крупные концепции.
Сосредоточьтесь на работе, а не на своей оценке
Изучение химии требует полной концентрации. Постоянное внимание к своей оценке отвлекает от изучения химии. Если вы сосредоточитесь на изучении химии, ваша оценка последует.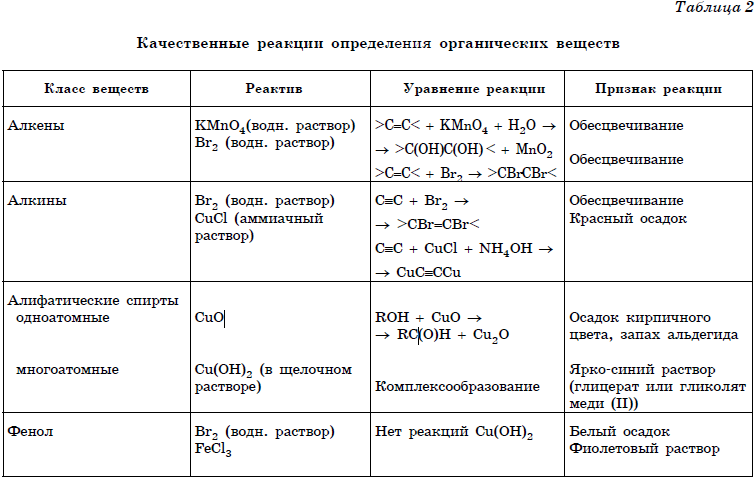 Нет никаких ярлыков.В конце концов, важно то, что вы узнаете. А если выучите химию, вы получите хорошую оценку.
Нет никаких ярлыков.В конце концов, важно то, что вы узнаете. А если выучите химию, вы получите хорошую оценку.
Прыжок обеими ногами
Как и в случае с другими сложными предметами, включая биологию, прыжки на обе ноги являются ключом к успеху в изучении химии. Частичные усилия никуда не годятся. Решили, что добьетесь успеха в химии и сделаете все возможное.
Ниже приведены ссылки на другие ресурсы по изучению навыков, которые мы рекомендуем студентам-химикам.
Энергетические изменения в химических реакциях | Энергия и химические изменения
Что вызывает энергетические изменения в химических реакциях? (ESBQK)
Когда происходит химическая реакция, связи в реагентах разрываются , а новые связи образуют в продукте. Следующий пример объясняет это. Водород реагирует с кислородом с образованием воды в соответствии со следующим уравнением:
\ [2 \ text {H} _ {2} \ text {(g)} + \ text {O} _ {2} \ text {(g)} → 2 \ text {H} _ {2} \ text { O} \ text {(g)} \] В этой реакции связь между двумя атомами водорода в молекуле \ (\ text {H} _ {2} \) будет разорвать , как и связь между атомами кислорода в \ (\ text {O} _ {2} \) молекула. {-1} $} \)), который необходим для разрыва химической связи между двумя атомами.
{-1} $} \)), который необходим для разрыва химической связи между двумя атомами.
Помните, когда мы обсуждали связывание (глава 3), мы использовали следующую энергетическую диаграмму:
Рисунок 12.1: График, показывающий изменения энергии, которые происходят при изменении расстояния между двумя атомами.Мы можем использовать эту диаграмму, чтобы понять, почему разрыв связи требует энергии, а образование связи высвобождает энергию. Точка X на диаграмме имеет наименьшую энергию. Когда связь разрывается, атомы расходятся, и расстояние между ними увеличивается (т.е. атом движется вправо по оси \ (x \) или из точки X в точку A). Глядя на диаграмму, мы видим, что когда это происходит, энергия увеличивается (т.е. энергия в точке A больше, чем энергия в точке X). Поэтому, когда связь разрывается, нужна энергия.
Когда образуется связь, атомы сближаются и расстояние между ними уменьшается (т.е. атом перемещается влево по оси \ (x \) или от точки A к точке X). Глядя на диаграмму, мы видим, что когда это происходит, энергия уменьшается (т.е.е. энергия в точке X меньше энергии в точке A). Итак, когда образуется связь, высвобождается энергия.
Глядя на диаграмму, мы видим, что когда это происходит, энергия уменьшается (т.е.е. энергия в точке X меньше энергии в точке A). Итак, когда образуется связь, высвобождается энергия.
Рассмотрим пример реакции водорода с кислородом с образованием воды:
\ [2 \ text {H} _ {2} \ text {(g)} + \ text {O} _ {2} \ text {(g)} → 2 \ text {H} _ {2} \ text { O} \ text {(g)} \]Мы видим, что энергия нужна для разрыва связей в молекуле водорода и разрыва связей в молекуле кислорода). И мы также видим, что энергия высвобождается, когда водород и кислород связываются с образованием воды). Когда мы смотрим на всю реакцию и рассматриваем как разрыв связи, так и образование связи, нам нужно смотреть на энтальпии системы.
- Энтальпия
Энтальпия — это мера полной энергии химической системы при заданном давлении и обозначается символом H.
Химическая система — это замкнутая система, которая содержит только реагенты и продукты, участвующие в реакции.
По мере того, как мы узнаем об экзотермических и эндотермических реакциях, мы узнаем больше о концепции энтальпии.
Экзотермические и эндотермические реакции (ESBQM)
В некоторых реакциях энергия, которая должна быть поглощена для разрыва связей в реагентах, меньше энергии, которая выделяется при образовании новых связей продуктов.Это означает, что в общей реакции выделяется энергии в виде тепла или света. Этот тип реакции называется экзотермической реакцией .
- Экзотермическая реакция
Экзотермическая реакция — это реакция, при которой выделяется энергия в виде тепла или света.
Другой способ описания экзотермической реакции состоит в том, что в ней энергия продуктов меньше, чем энергия реагентов, потому что во время реакции выделяется энергия.Мы можем представить это, используя следующую общую формулу:
\ [\ text {Реактивы} → \ text {Продукты} + \ text {Энергия} \] В других реакциях энергия, которая должна быть поглощена , чтобы разорвать связи в реагентах, больше, чем энергия, которая выделяется при образовании новых связей в продуктах. Это означает, что в общей реакции энергия должна быть поглощена из окружающей среды. Этот тип реакции известен как эндотермическая реакция .
Это означает, что в общей реакции энергия должна быть поглощена из окружающей среды. Этот тип реакции известен как эндотермическая реакция .
- Эндотермическая реакция
Эндотермическая реакция — это реакция, при которой энергия поглощается в виде тепла или света.
Другой способ описания эндотермической реакции состоит в том, что в ней энергия продуктов больше, чем энергия реагентов, потому что энергия была поглощена во время реакции. Это может быть представлено следующей общей формулой:
\ [\ text {Реагенты} + \ text {Энергия} → \ text {Продукты} \]Разница в энергии (E) между реагентами и продуктами известна как теплоты реакции .Его также иногда называют изменением энтальпии системы. Это представлено как \ (\ Delta \ text {H} \)
\ (\ Delta \) читается как дельта и означает изменение. Вы можете вспомнить этот символ из физики.
Включен рекомендованный проект для формальной оценки. В этом эксперименте учащиеся будут исследовать экзотермическую и эндотермическую реакции. Этот эксперимент разделен на две части. Первая часть рассматривает эндотермическую реакцию, а вторая часть рассматривает экзотермическую реакцию.Вам потребуются стаканчики из полистирола или картона, пластиковые крышки, термометры, уксус, стальная вата, лимонная кислота, бикарбонат натрия и стержни для перемешивания. Также учащиеся могут провести дополнительное исследование экзотермических и эндотермических реакций. Все эти эксперименты можно объединить в один проект, в котором учащиеся исследуют несколько различных реакций и классифицируют эти реакции как экзотермические или эндотермические.
В этом эксперименте учащиеся будут исследовать экзотермическую и эндотермическую реакции. Этот эксперимент разделен на две части. Первая часть рассматривает эндотермическую реакцию, а вторая часть рассматривает экзотермическую реакцию.Вам потребуются стаканчики из полистирола или картона, пластиковые крышки, термометры, уксус, стальная вата, лимонная кислота, бикарбонат натрия и стержни для перемешивания. Также учащиеся могут провести дополнительное исследование экзотермических и эндотермических реакций. Все эти эксперименты можно объединить в один проект, в котором учащиеся исследуют несколько различных реакций и классифицируют эти реакции как экзотермические или эндотермические.
Эта серия экспериментов начинается с эндотермической реакции между лимонной кислотой и бикарбонатом натрия.Во втором эксперименте из серии изучается экзотермическая реакция между сталью и кислородом в воздухе. Заключительная часть серии представляет собой исследование различных экзотермических и эндотермических реакций.
Эндотермические и экзотермические реакции — часть 1
Аппаратура и материалы
Вам понадобится:
- лимонная кислота
- бикарбонат натрия
- стакан из полистирола
- крышка для стакана
- термометр
- стеклянная палочка для перемешивания
- ножницы
Стаканы из полистирола с крышками можно приобрести в кафе или фастфуде.Картонные стаканчики тоже подойдут. В некоторых крышках будет отверстие для соломинки, которое пригодится в этом эксперименте.
Обратите внимание, что лимонная кислота содержится в цитрусовых, таких как лимоны. Бикарбонат натрия — это на самом деле бикарбонат соды (пищевая сода), ингредиент выпечки, который помогает пирогам подниматься.
Метод
Если в вашей крышке нет отверстия для соломинки, сделайте небольшое отверстие в крышке.
Налейте немного лимонной кислоты \ ((\ text {C} _ {6} \ text {H} _ {8} \ text {O} _ {7}) \) в стакан из полистирола, накройте стакан крышкой и запишите температуру раствора.

Добавьте бикарбонат натрия \ ((\ text {NaHCO} _ {3}) \), затем снова накройте чашку.
Немедленно запишите температуру, а затем каждые две минуты снимайте показания температуры. Запишите свои результаты.
Уравнение протекающей реакции:
\ (\ text {C} _ {6} \ text {H} _ {8} \ text {O} _ {7} \ text {(aq)} + 3 \ text {NaHCO} _ {3} \ text {(s)} → 3 \ text {CO} _ {2} \ text {(g)} + 3 \ text {H} _ {2} \ text {O (} ℓ \ text {)} + \ text { Na} _ {3} \ text {C} _ {6} \ text {H} _ {5} \ text {O} _ {7} \ text {(aq)} \)
Результаты
Время (\ (\ text {mins} \)) | 0 | 2 | 4 | 6 |
Нанесите результаты измерения температуры на график зависимости времени (\ (x \) — ось) от температуры (\ (y \) — ось).
Обсуждение и заключение
Что происходит с температурой во время этой реакции?
Это экзотермическая или эндотермическая реакция? (Была получена или отдана энергия? Температура повысилась или понизилась?)
Почему было важно держать чашку закрытой?
Эндотермические и экзотермические реакции — часть 2
Аппаратура и материалы
- Уксус
- стальная вата
- термометр
- Стакан из полистирола и пластиковая крышка (из предыдущего эксперимента)
Метод
Вставьте термометр в пластиковую крышку, накройте чашку и запишите температуру в пустой чашке.Вам нужно будет оставить термометр в чашке примерно на 5 минут, чтобы получить точные показания.
Погрузите стальную вату в уксус примерно на минуту.
 Уксус удаляет защитное покрытие со стальной ваты, так что металл подвергается воздействию кислорода.
Уксус удаляет защитное покрытие со стальной ваты, так что металл подвергается воздействию кислорода.Выньте термометр из чашки. Держите термометр через отверстие в крышке.
После того, как стальная вата была в уксусе, удалите ее и выдавите уксус, оставшийся на шерсти.Оберните стальную вату вокруг термометра и поместите ее (все еще обернутую вокруг термометра) обратно в чашку. Когда вы это делаете, чашка автоматически закрывается, потому что термометр проходит сквозь верхнюю часть крышки.
Оставьте стальную вату в чашке примерно на 5 минут, а затем запишите температуру. Запишите свои наблюдения.
Результаты
Вы должны заметить, что температура увеличивается до , когда стальная вата оборачивается вокруг термометра.
Заключение
Реакция между кислородом и обнаженным металлом в стальной вате является экзотермической , что означает, что энергия высвобождается и температура увеличивается.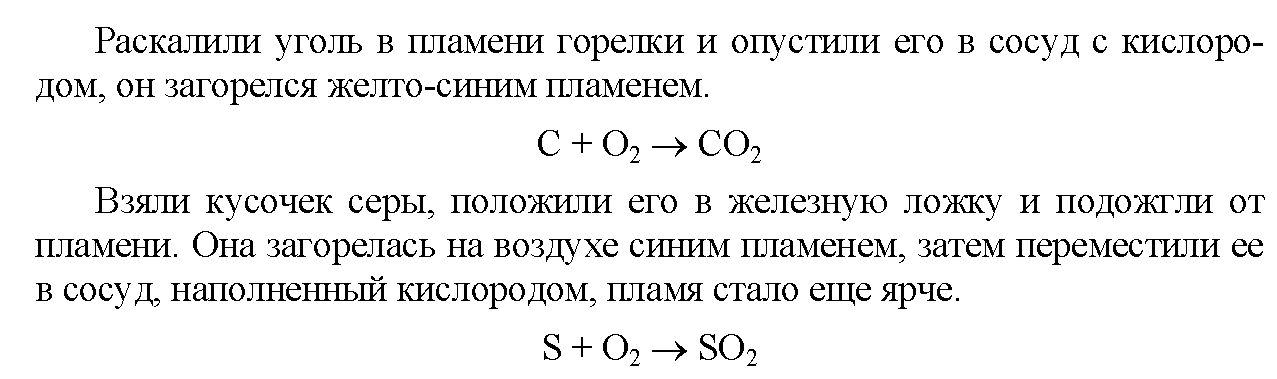
Примеры эндотермических и экзотермических реакций (ESBQN)
Есть много примеров эндотермических и экзотермических реакций, которые происходят вокруг нас постоянно. Ниже приведены лишь несколько примеров.
Обратите внимание, что мы обсуждаем только химические изменения (вспомните из 10 класса о физических и химических изменениях).Физические изменения также можно разделить на экзотермические или эндотермические. Когда мы говорим о физических изменениях, мы говорим об экзотермических или эндотермических процессах. Испарение — это эндотермический процесс, а конденсация — экзотермический процесс.
Эндотермические реакции
Фотосинтез
Фотосинтез — это химическая реакция, протекающая в зеленых растениях, при которой энергия солнца используется для превращения углекислого газа и воды в пищу, необходимую растению для выживания и которую другие организмы (например, люди и другие животные) могут есть, чтобы они тоже могут выжить.
\ [6 \ text {CO} _ {2} \ text {(g)} + 6 \ text {H} _ {2} \ text {O (l)} + \ text {energy} → \ text {C} _ {6} \ text {H} _ {12} \ text {O} _ {6} \ text {(s)} + 6 \ text {O} _ {2} \ text {(g)} \] Уравнение этой реакции:
Уравнение этой реакции:Фотосинтез — это эндотермическая реакция. Энергия в виде солнечного света поглощается во время реакции.
Термическое разложение известняка
В промышленности очень важно разложение известняка на негашеную известь и углекислый газ.Негашеную известь можно использовать для производства стали из железа, а также для нейтрализации слишком кислых почв. Однако известняк должен быть нагрет в печи (духовке) до температуры выше \ (\ text {900} \) \ (\ text {℃} \) до того, как начнется реакция разложения. Уравнение реакции показано ниже:
\ [\ text {CaCO} _ {3} \ text {(s)} → \ text {CaO (s)} + \ text {CO} _ {2} \ text {(g)} \]
Экзотермические реакции
Реакции горения
Сжигание топлива является примером реакции горения, и мы, люди, в значительной степени полагаемся на этот процесс для удовлетворения наших потребностей в энергии.
 Следующие уравнения описывают горение углеводорода, например бензина \ ((\ text {C} _ {8} \ text {H} _ {18}) \):
Следующие уравнения описывают горение углеводорода, например бензина \ ((\ text {C} _ {8} \ text {H} _ {18}) \):топливо + кислород \ (→ \) тепло + вода + углекислый газ
\ [2 \ text {C} _ {8} \ text {H} _ {18} \ text {(l)} + 25 \ text {O} _ {2} \ text {(g)} → 16 \ text {CO} _ {2} \ text {(g)} + 18 \ text {H} _ {2} \ text {O (g)} + \ text {heat} \]Вот почему мы сжигаем топливо (такое как парафин, уголь, пропан и бутан) для получения энергии, потому что химические изменения, происходящие во время реакции, высвобождают огромное количество энергии, которую мы затем используем для таких вещей, как электричество и электричество.Следует также отметить, что во время этой реакции образуется диоксид углерода . Химическая реакция, происходящая при горении топлива, имеет как положительные, так и отрицательные последствия. Хотя мы получаем выгоду от тепла, электроэнергии и электричества, производимый углекислый газ отрицательно влияет на окружающую среду.

Дыхание
Дыхание — это химическая реакция, которая происходит в нашем организме для производства энергии для наших клеток.Уравнение ниже описывает, что происходит во время этой реакции:
\ [\ text {C} _ {6} \ text {H} _ {12} \ text {O} _ {6} \ text {(s)} + 6 \ text {O} _ {2} \ text { (g)} → 6 \ text {CO} _ {2} \ text {(g)} + 6 \ text {H} _ {2} \ text {O} \ text {(l)} + \ text {энергия } \]В приведенной выше реакции глюкоза (тип углеводов в пище, которую мы едим) реагирует с кислородом воздуха, которым мы вдыхаем, с образованием углекислого газа (которым мы выдыхаем), воды и энергии. Вырабатываемая энергия позволяет клетке эффективно выполнять свои функции.Теперь вы понимаете, почему вы должны есть пищу, чтобы получить энергию? Не еда сама по себе дает вам энергию, а экзотермическая реакция, которая происходит, когда соединения в пище вступают в реакцию с вдыхаемым кислородом!
Световые палочки или светящиеся палочки используются дайверами, туристами, а также для украшения и развлечения. Лайтстик — это пластиковая трубка со стеклянным флаконом внутри. Чтобы активировать лайтстик, вы сгибаете пластиковую палочку, которая разбивает стеклянный флакон.Это позволяет химическим веществам, находящимся внутри стекла, смешиваться с химическими веществами в пластиковой трубке. Эти два химических вещества вступают в реакцию и выделяют энергию. Другая часть световой палочки — это флуоресцентный краситель, который превращает эту энергию в свет, заставляя световую палочку светиться! Это известно как фосфоресценция или хемилюминесценция.
Лайтстик — это пластиковая трубка со стеклянным флаконом внутри. Чтобы активировать лайтстик, вы сгибаете пластиковую палочку, которая разбивает стеклянный флакон.Это позволяет химическим веществам, находящимся внутри стекла, смешиваться с химическими веществами в пластиковой трубке. Эти два химических вещества вступают в реакцию и выделяют энергию. Другая часть световой палочки — это флуоресцентный краситель, который превращает эту энергию в свет, заставляя световую палочку светиться! Это известно как фосфоресценция или хемилюминесценция.
советов по химии | Химический факультет
Итак, вы проводите много времени за учебой, но все еще с трудом справляетесь с экзаменами. Что теперь? Прежде всего, знайте, что вы не одиноки — некоторые из лучших студентов в какой-то момент испытывали трудности в изучении химии, так что продолжайте!
Изучение химии требует времени!
ВРЕМЯ НА ЗАДАЧУ!
Так же, как вам нужно уделять время занятиям спортом или изучать иностранный язык, вам нужно выделить время на практику химии. Мы не ожидаем, что вы получите все сразу; на самом деле некоторым из лучших студентов этих курсов приходилось усердно разбираться с материалом, прежде чем действительно все понять. Убедитесь, что у вас достаточно времени, чтобы регулярно просматривать материалы курса и практиковаться в решении проблем.
Мы не ожидаем, что вы получите все сразу; на самом деле некоторым из лучших студентов этих курсов приходилось усердно разбираться с материалом, прежде чем действительно все понять. Убедитесь, что у вас достаточно времени, чтобы регулярно просматривать материалы курса и практиковаться в решении проблем.
Есть причина, по которой эти курсы не являются целенаправленными чтениями: все части — практические задачи, чтение, лекция, секция, лабораторные работы, рабочее время, обучение самостоятельно или с друзьями, репетиторство — лучше всего работают, когда вы используете их вместе.
Dig Deep по практическим задачам.
Простое выполнение множества практических задач не обязательно поможет вам лучше решать проблемы. Вы никогда не увидите задачи на экзамене, которые выглядят в точности как практические, поэтому выполнение всех возможных задач — не лучшая стратегия. Вместо этого, когда вы будете решать практическую задачу, которую мы вам поставили, убедитесь, что вы можете объяснить, почему и когда вы будете делать каждый шаг в своем решении. Уметь объяснить
Уметь объяснить
- почему определенная информация вам полезна
- , почему часть информации может быть ненужной
- какие преобразования нужно сделать, чтобы можно было правильно использовать информацию
- , почему вы используете определенную формулу
- как можно изменить формулу, чтобы найти новый параметр
- почему нужно учитывать ту или иную реакцию
- , когда вы сможете делать какие-либо предположения, которые вы делаете
- какие структуры полезно понять
Легко попасть в ловушку, прочитав ключ решения и подумав, что это имеет смысл.Но если вы не сможете оправдать каждый шаг чем-то большим, чем «просто потому что», будет трудно применить эти навыки к другой проблеме.
Выполняйте задания для чтения и разминки ПЕРЕД лекцией.
Если вы уже ознакомились с материалом в в своем собственном темпе перед лекцией, то вы можете более продуктивно использовать время лекции для закрепления и практики этих концепций. Чем больше раз вы слушаете материал (например, наборы задач, лекцию, раздел, учебное время…), тем легче вам будет.
Чем больше раз вы слушаете материал (например, наборы задач, лекцию, раздел, учебное время…), тем легче вам будет.
действительно имеют значение.
Разделы созданы, чтобы выделить и направить вас через особенно важные концепции и химические явления. Убедитесь, что вы можете применить основные концепции каждого раздела до следующего экзамена. Хороший способ увидеть, применяете ли вы концепции, а не заучиваете их, — это проверить, можете ли вы объяснить ПОЧЕМУ на каждом этапе решения проблемы. Также убедитесь, что вы выполнили все дополнительные практические задачи, предлагаемые в разделе и в описаниях лабораторных работ.
Задавайте много-много вопросов!
Ученые задают вопросы — постоянно! Особенно ПОЧЕМУ! Преподаватели всегда ценят, когда студенты задают вопросы, потому что это показывает, что они слушают и действительно думают о материале.
- Спросите: «Что это на самом деле означает?» в каждом разделе, пока вы читаете главу.

- Спросите «почему» проблемы, решая, о чем она спрашивает и как ее решить.
Задайте вопросы по материалу лекции и раздела.Если вы просматриваете материал самостоятельно , запишите эти вопросы . Если вы можете ответить на них самостоятельно, отлично! Если вы застряли, возьмите их с собой в рабочее время или в учебную группу. Тогда вы не забудете и убедитесь, что все понимаете более тщательно.
Изучайте химию, когда не спите!
Мы все склонны откладывать сложные дела, но это означает, что вы можете закончить изучением химией в самом конце дня, когда вы уже устали и слишком устали, чтобы хорошо думать.И, если вы никогда не будете практиковаться, вам никогда не станет легче!
Вместо этого попробуйте каждый день выделять какое-то время, когда вы знаете, что будете бдительны и готовы к работе. Это не обязательно должен быть большой отрезок времени, но так вы, по крайней мере, получите какое-то время, чтобы привязаться к своей химии.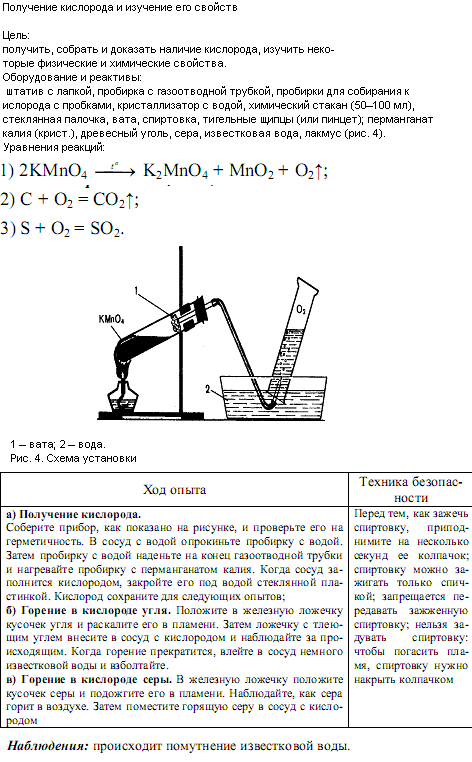
Учитесь более эффективно — не только больше!
- Один из первых шагов в разработке эффективной учебной стратегии — это оценить, что — во всем, что вы делаете для изучения, — кажется, помогает вам больше всего? Что придало вам наибольшую уверенность? Если есть некоторые вещи, которые вам уже нравятся, возможно, потратьте меньше времени на их пересмотр и больше — на концепции, которые все еще остаются сложными.
- Найдите время, чтобы понять, в каких случаях у вас возникают трудности с экзаменами. Когда вы вернете экзамен, повторите все проблемы, которые вы пропустили (ПЕРЕД поиском решений). Вы продвинулись дальше, чем во время экзамена? Вы действительно можете закончить их, потратив больше времени или в менее стрессовой обстановке? Вы зацикливаетесь на концепциях или определениях? по математике? при запуске проблемы?
- Подведение итогов экзамена поможет вам выявить концептуальные пробелы, которые вам необходимо повторно изучить, в сравнении с ошибками, которые могли возникнуть в результате стресс-теста или неправильного прочтения вопроса.

- Если вы можете начать определять, где и как вы боретесь с экзаменом, тогда вы можете подумать о том, как лучше использовать свое учебное время при подготовке к следующему.
Воспользуйтесь советами по обучению от VPTL:
- https://vptl.stanford.edu/students/academic-skills содержит полезные быстрые советы по сдаче экзаменов, ведению заметок, стратегиям обучения и т. Д., Которые могут помочь вам подумать о том, как вы хотите более эффективно организовать свое учебное время. .
- Например, когда вы читаете главу или конспект лекции, постоянно задавайте себе вопросы и отвечайте на них по ходу дела.На этом веб-сайте есть пара хороших стратегий для этого (см. PDF-файл «Эффективность чтения» или систему заметок Корнелла), которые могут помочь вам глубже погрузиться в чтение и увидеть взаимосвязь между новыми концепциями. Это также может помочь вам более эффективно структурировать свои записи для чтения или лекций. https://vptl.stanford.edu/students/academic-skills/study-tips-resources
- Вы также можете организовать персональный сеанс академического коучинга с Адиной Гликман , чтобы подумать о более конкретных стратегиях обучения для вас.
 [email protected]
[email protected]
Пользуйтесь в рабочее время!
Часы работы офиса предназначены не только для набора задач. Вопросы по любому предмету курса — лекции, лабораторной работе, чтению книг, советам по обучению и т. Д. — все это честная игра, поэтому, пожалуйста, приходите. Часы работы доступны, чтобы помочь вам!
- Сохраняйте непрерывный список вопросов, когда вы читаете или решаете проблемы. Если вы не можете обосновать определенный шаг в решении, это отличный вопрос для рабочего времени. Студенты часто получают больше в нерабочее время, если заранее задают вопросы о том, чего они не понимают.
Используйте учебную группу!
Многочисленные исследования говорят нам, что студенты, которые регулярно участвуют в учебных группах, в конечном итоге получают более высокие оценки.
- При обучении с одноклассниками воспользуйтесь этой возможностью, чтобы объяснить и обсудить концепции или стратегии решения проблем с другими.

- Когда вы вместе просматриваете наборы задач, вместо того, чтобы просто понимать, как подойти к этой конкретной проблеме, посмотрите, можете ли вы придумать несколько различных способов, которыми мы могли бы задать другие вопросы об этой системе.Есть ли другой параметр, который мы могли бы попросить вас решить? Как бы проблема изменилась в других условиях? Это поможет вам обдумать и практиковать различные стратегии решения проблем.
- Нет учебной группы? Связывайтесь со студентами в рабочее время, в секции, на площади, в режиме прямого обучения и т. Д.!
Органическая химия трехмерна!
Вы обнаружите, что почти все учебные навыки, выработанные в общей химии, применимы и в органической: вам все равно нужно потратить время на замариновку концепций, вам нужно глубоко копаться в проблемах, и вам нужно постоянно бдительность, чтобы спросить «почему».Однако в органической химии необходимо учитывать новый визуальный компонент: важно начать рассматривать молекулы в трех измерениях (а не в виде двухмерных линий и букв на бумаге), поскольку трехмерная структура сильно влияет на фактическую химию. Чтобы начать визуализировать эти структуры, используйте набор моделей для построения молекул каждый раз, когда вы занимаетесь органической химией (чтение, практические задания и т. Д.). Принесите модельный комплект в раздел. Ваши модели покажут важные свойства молекул, такие как пространственные отношения между различными атомами или насколько легко связь может вращаться. Всегда держите при себе модельный комплект и пользуйтесь им!
Чтобы начать визуализировать эти структуры, используйте набор моделей для построения молекул каждый раз, когда вы занимаетесь органической химией (чтение, практические задания и т. Д.). Принесите модельный комплект в раздел. Ваши модели покажут важные свойства молекул, такие как пространственные отношения между различными атомами или насколько легко связь может вращаться. Всегда держите при себе модельный комплект и пользуйтесь им!
Прежде всего, стараюсь !! Все учатся с разной скоростью и по-разному. Здесь для вас есть много ресурсов, потому что мы знаем, что вы можете сделать это с помощью правильных инструментов. Если вы не знаете, с чего начать, просто спросите — познакомьтесь с одним из технических специалистов, преподавателей или преподавателей курса. Мы все здесь, чтобы помочь ВАМ УСПЕХАТЬ!
Химия 11 Периодическая таблица ПТ — без имен многоатомные ионы
Обзор
Раздел 1: Материя и Химическая связь
Блок 2: Количество в Химические реакции
Блок 3: Решения и Растворимость
Блок 4: Газы и Химия атмосферы
Блок 5: Углеводороды и Энергия
|
IB Заметки о пересмотре химии и учебная программа
Программа IB (первое обследование 2016 г.)
Новая программа первых экзаменов 2016 содержит несколько изменений по сравнению с предыдущей (2009 г.) версией.
Примечания
Программа
- Стехиометрические отношения
- Атомная теория
- Периодичность
- Химическая связь и структура
- Энергетика / Термодинамика
- Химическая кинетика
- Равновесие
- Кислоты и основания
- Редокс-процессы
- Органическая химия
- Измерения и обработка данных
Пояснение к новому формату программы можно прочитать здесь
Опции 2016
Один вариант изучается из выбора из четырех ниже:
Вариант А — Материалы
- А.1 Введение в материаловедение
- A.2 Спектроскопия металлов и индуктивно связанной плазмы (ICP)
- A.3 Катализаторы
- A.4 Жидкие кристаллы
- A.5 Полимеры
- A.6 Нанотехнологии
- A.7 Воздействие на окружающую среду — пластмассы
Дополнительные темы более высокого уровня (10 часов)
- A.8 Сверхпроводящие металлы и рентгеновская кристаллография
- А.9 Конденсационные полимеры
- A.10 Воздействие тяжелых металлов на окружающую среду
Вариант B — Биохимия
- B.1 Введение в биохимию
- B.2 Белки и ферменты
- B.3 Липиды
- B.4 Углеводы
- Витамины B.5
- B.6 Биохимия и окружающая среда
Дополнительные темы более высокого уровня
- Б.7 Белки и ферменты
- B.8 Нуклеиновые кислоты
- B.9 Биологические пигменты
- B.10 Стереохимия в биомолекулах
Вариант C — Энергия
- C.1 Источники энергии
- C.2 Ископаемое топливо
- C.3 Ядерный синтез и деление
- C.4 Солнечная энергия
- C.5 Воздействие на окружающую среду — глобальное потепление
Дополнительные темы более высокого уровня
- С.6 Электрохимия, аккумуляторные батареи и топливные элементы
- C.7 Ядерный синтез и ядерное деление
- C.8 Фотоэлектрические и сенсибилизированные красителями солнечные элементы
Вариант D — Медицинская химия
- D.1 Фармацевтическая продукция и действие лекарственных средств
- D.2 Аспирин и пенициллин
- D.3 Опиаты
- D.4 Регулирование pH желудка
- D.5 Противовирусные препараты
- Д.6 Воздействие некоторых лекарственных препаратов на окружающую среду
Дополнительные темы более высокого уровня
- D.7 Таксол-хиральный вспомогательный пример из практики
- D.8 Ядерная медицина
- D.9 Обнаружение и анализ наркотиков
Практическая работа
Практическая внутренняя оценка 2016
Внутренняя оценка и внешнее модерация
Все материалы учебных программ, воспроизводимые в этой книге, являются собственностью оригинальный издатель руководства по химии, © International Организация бакалавриата 2016.Этот материал можно копировать для только для личного обучения.
| 4а. Метод расчета% процентное содержание элементов в соединении по массеСостав соединения % по массе по количеству составляющих элементов рассчитан в три простых шага Химические расчеты 4. Как рассчитать процент (%) по массе элемент в сложной формуле? Как рассчитать процент (%) по массе вода или ион в формуле соединения? (i) Вычислить формулу или молекулярную массу соединения
(ii) Рассчитайте массу указанного элемента (для своего%) в соединении с учетом количества атомов элемента в формуле соединения (iii) Рассчитайте (ii) как процент от (i)
Тесты для самооценки: введите ответ Викторина или множественный выбор ВИКТОРИНА НАЧАЛО СТРАНИЦЫ 4б. Другой расчет процентного массового состава, включая% любого компонента в соединение или смесь Атомные массы, используемые для 4b.вопросы: C = 12 , Cl = 35,5 , Fe = 56 , H = 1 , Mg = 24 , N = 14 , Na = 23 , O = 16 , S = 32 , К настоящему моменту я предполагаю, что вы можете выполнять расчет массы по формуле и читать формулы без каких-либо проблем, поэтому ВСЕ детали таких расчетов НЕ показано, только самое необходимое! Пример 4b.1
Пример 4б.2
Пример 4б.3
Пример 4b.4
Пример 4b.5
Пример 4b.6
Пример 4b.7
Пример 4b.8 ВНИМАНИЕ:
НАЧАЛО СТРАНИЦЫ ДРУГИЕ РАСЧЕТНЫЕ СТРАНИЦЫ
как сделать процент по массе Расчеты Редакция KS4 Наука пересмотр как делать проценты по массе расчеты Дополнительные Тройная награда в области науки Курсы по отдельным наукам помогают научиться набирать процент путем пересмотра учебника массовых расчетов Уровень GCSE / IGCSE / O Химия, как рассчитать процент по массе Информационные заметки для изучения для проверки для AQA GCSE Наука, как рассчитать процент по массе, Edexcel GCSE Science / IGCSE Chemistry как делать проценты массовыми вычислениями и OCR 21st Century Science, OCR Gateway Наука как рассчитать процент по массе WJEC gcse science chemistry как делать массовые вычисления процентов CEA / CEA gcse science chemistry O Уровень химии (пересмотреть курсы, равные 8 классу США, 9 класс 10 классу как делать процентов по массовым расчетам) Уровень Примечания к пересмотру для продвинутого вспомогательного уровня GCE как делать процент по массе Расчеты AS Продвинутый уровень A2 IB Пересмотр того, как делать процент по массе расчеты AQA GCE Chemistry OCR GCE Chemistry как рассчитать процент по массе Edexcel GCE Chemistry Salters Chemistry как делать проценты по массовым вычислениям CIE Химия как рассчитать процент по массе, WJEC GCE AS A2 Chemistry как для вычисления процентов по массе, CCEA / CEA GCE AS A2 Chemistry revision как делать курсы массового расчета процентов для доуниверситетских (соответствует 11-му и 12-му классам в США и уровню AP Honors / Honors как сделать процент Руководство по пересмотру массовых вычислений, как сделать процент по массовым вычислениям, пересмотр химии gcse бесплатные подробные заметки о том, как рассчитать% состав соединение, помогающее пересмотреть химию IGCSE Заметки о пересмотре химии igcse о том, как рассчитать% состав соединения уровня O химия бесплатные подробные примечания о том, как рассчитать% состав соединения, чтобы помочь пересмотреть gcse бесплатные подробные заметки о том, как рассчитать% состав соединения, чтобы помочь пересмотреть уровень O бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как рассчитать% состав соединения для gcse бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как рассчитать% состав соединения для Бесплатный онлайн-сайт igcse Chemistry, который поможет пересмотреть уровень O как рассчитать% состав химического соединения как добиться успеха в вопросах по как рассчитать процентный состав соединения для ГКСЭ химия как добиться успеха в igcse химия как добиться успеха по химии уровня O хороший сайт для бесплатных вопросов по как рассчитать% состава соединения, чтобы помочь сдать вопросы по химии gcse как рассчитать% состав компаунда сайт бесплатно помогите пройти igcse химия с доработкой примечания о том, как рассчитать% состава соединения хороший веб-сайт для бесплатной помощи для прохождения уровня O химия gcse химия пересмотр бесплатные подробные заметки о том, как рассчитать процент по массе элементов в соединении, чтобы помочь пересмотреть химию igcse Заметки о пересмотре химии igcse о том, как рассчитывать процентное содержание по массе элементов в химическом составе соединения на уровне O бесплатные подробные заметки о том, как рассчитать процент по массе элементов в соединении, чтобы помочь пересмотреть gcse бесплатные подробные заметки по химии о том, как рассчитать процент по массе элементов в соединении, чтобы помочь пересмотреть уровень O бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как рассчитать массовый процент элементов в соединении для gcse бесплатный веб-сайт по химии, чтобы помочь пересмотреть, как рассчитать процентное содержание элементов в соединении по массе для Бесплатный онлайн-сайт igcse Chemistry, который поможет пересмотреть уровень O как рассчитать процентное содержание элементов в массе составная химия как добиться успеха в вопросах о том, как вычислить процент по масса элементов в соединении для gcse химия как добиться успеха в igcse химия как добиться успеха по химии уровня O хороший сайт для бесплатных вопросов по как рассчитать процентное содержание элементов в массе соединение, чтобы помочь пройти вопросы по химии gcse о том, как рассчитать процент по массе элементов в соединении хорошее сайт бесплатно помогите пройти igcse химия с доработкой примечания о том, как рассчитать процентное соотношение по массе элементов в соединение хороший сайт для бесплатной помощи для сдачи O level химия НАЧАЛО СТРАНИЦЫ |

 Распознавание неорганических веществ.
Распознавание неорганических веществ. Это особенно актуально в практической научной деятельности. Изучая конкретную тему, мы часто начинаем с практического упражнения в лаборатории с открытого упражнения, когда студентам предлагается выдвинуть свои собственные гипотезы, а затем проверить их и сделать выводы.
Это особенно актуально в практической научной деятельности. Изучая конкретную тему, мы часто начинаем с практического упражнения в лаборатории с открытого упражнения, когда студентам предлагается выдвинуть свои собственные гипотезы, а затем проверить их и сделать выводы.

 Уксус удаляет защитное покрытие со стальной ваты, так что металл подвергается воздействию кислорода.
Уксус удаляет защитное покрытие со стальной ваты, так что металл подвергается воздействию кислорода. Уравнение этой реакции:
Уравнение этой реакции: Следующие уравнения описывают горение углеводорода, например бензина \ ((\ text {C} _ {8} \ text {H} _ {18}) \):
Следующие уравнения описывают горение углеводорода, например бензина \ ((\ text {C} _ {8} \ text {H} _ {18}) \):