Химия. Тетрадь для лабораторных опытов и практических работ по химии для 11 класса. Базовый уровень
444 ₽
+ до 66 баллов
Бонусная программа
Итоговая сумма бонусов может отличаться от указанной, если к заказу будут применены скидки.
Купить
Цена на сайте может отличаться от цены в магазинах сети. Внешний вид книги может отличаться от изображения на сайте.
Последний экземпляр
Нет в наличии в магазинах сети
1
Цена на сайте может отличаться от цены в магазинах сети. Внешний вид книги может отличаться от изображения на сайте.
В этом учебном году авторы учебного пособия «Химия» предлагают выполнить новые, очень интересные опыты и посмотреть с другой стороны на уже известные вам реакции. Для рационального выполнения химического эксперимента, быстрого и аккуратного составления отчета о выполненной работе автор предлагает эту тетрадь.
Описание
Характеристики
В этом учебном году авторы учебного пособия «Химия» предлагают выполнить новые, очень интересные опыты и посмотреть с другой стороны на уже известные вам реакции. Для рационального выполнения химического эксперимента, быстрого и аккуратного составления отчета о выполненной работе автор предлагает эту тетрадь.
Аверсэв
На товар пока нет отзывов
Поделитесь своим мнением раньше всех
Как получить бонусы за отзыв о товаре
1
Сделайте заказ в интернет-магазине
2
Напишите развёрнутый отзыв от 300 символов только на то, что вы купили
3
Дождитесь, пока отзыв опубликуют.
Если он окажется среди первых десяти, вы получите 30 бонусов на Карту Любимого Покупателя. Можно писать неограниченное количество отзывов к разным покупкам – мы начислим бонусы за каждый, опубликованный в первой десятке.
Правила начисления бонусов
Если он окажется среди первых десяти, вы получите 30 бонусов на Карту Любимого Покупателя. Можно писать неограниченное количество отзывов к разным покупкам – мы начислим бонусы за каждый, опубликованный в первой десятке.Правила начисления бонусов
Книга «Химия. Тетрадь для лабораторных опытов и практических работ по химии для 11 класса. Базовый уровень» есть в наличии в интернет-магазине «Читай-город» по привлекательной цене.
Если вы находитесь в Москве, Санкт-Петербурге, Нижнем Новгороде, Казани, Екатеринбурге, Ростове-на-Дону или любом
другом регионе России, вы можете оформить заказ на книгу
«Химия. Тетрадь для лабораторных опытов и практических работ по химии для 11 класса. Базовый уровень» и выбрать удобный способ его получения: самовывоз, доставка курьером или отправка
почтой. Чтобы покупать книги вам было ещё приятнее, мы регулярно проводим акции и конкурсы.
Тетрадь для лабораторных опытов и практических работ по химии для 11 класса. Базовый уровень» и выбрать удобный способ его получения: самовывоз, доставка курьером или отправка
почтой. Чтобы покупать книги вам было ещё приятнее, мы регулярно проводим акции и конкурсы.
Лабораторные работы 10-11 класс ЕМН | Опыты и эксперименты по химии:
Лабораторная работа №1
Изучение влияния строения веществ на их свойства
- Изготовление моделей молекул.
Задание. Постройте шаростержневые и масштабные модели молекул.
Выполнение опыта. Для построения молекул используйте пластилин или палочки. Для изготовления моделей, состоящих из различных атомов, используйте пластилин разных цветов.
Соберите шаростержневые и масштабные модели молекул фтороводорода, хлороводорода, йодоводорода, воды и сероводорода. Сделайте выводы.
- Свойства веществ, имеющих разные кристаллические решетки.
Задание. Исследуйте отношение к нагреванию веществ с ионной, атомной и молекулярной кристаллическими решетками.
Выполнение опыта. В четыре пробирки поместите около 0,5 г каждого вещества: кристаллической поваренной соли, чистого речного песка (SiO2), сахара и кристаллического йода. Пробирки с сахаром и йодом закройте кусочками ваты. Нагревайте пробирки в пламени горелки 2-3 мин. Какие изменения произошли в каждой пробирке? Сделайте выводы о физических свойствах каждого вещества, о строении их кристаллических решеток. Схематично изобразите строение кристаллов этих веществ.
Лабораторная работа №2
Получение гидроксидов и изучение их свойств.
Гидролиз солей.
Задание 1. На опытах исследуйте химические свойства щелочей, нерастворимых оснований, амфотерных гидроксидов и кислот.
Выполнение опыта. 1. В пробирку поместите 0,5 г оксида кальция и налейте 3-4мл воды. Полученный раствор разделите на три части и в каждую добавьте по одной капле различных индикаторов.
Растворы в двух пробирках нейтрализуйте растворами различных кислот.
Через раствор, находящийся в третьей пробирке, с помощью стеклянной трубочки продуйте воздух (осторожно, чтобы не разбрызгать раствор!). Что происходит в каждой трубке? Объясните наблюдаемые изменения и запишите уравнения протекающих реакций.
Что происходит в каждой трубке? Объясните наблюдаемые изменения и запишите уравнения протекающих реакций.
2. В чистую пробирку налейте 1-2 мл гидроксида натрия и добавьте несколько капель сульфата меди до образования осадка.
Полученное основание разделите на две части. Проверьте, как ведут себя не растворимые в воде основания при добавлении раствора кислоты и при нагревании. Запишите уравнения реакций. Сравните химические свойства щелочей и нерастворимых в воде оснований.
3. Налейте в пробирку 1 мл хлорида цинка и по каплям добавляйте раствор гидроксида натрия до образования студенистого осадка. Разделите осадок на две части. К одной добавьте раствор кислоты, а ко второй – раствор щелочи. Объясните наблюдаемые явления. Запишите уравнения протекающих реакций. Сделайте вывод о свойствах гидроксидов: щелочей, нерастворимых оснований, амфотерных гидроксидов и кислот.
Задание 2.Гидролиз солей. С помощью индикаторов определите среды растворов различных солей.
Выполнение опыта. 1. В пробирки налейте по 1 мл растворов хлорида натрия, карбоната натрия и сульфата алюминия. Проверьте, как изменится цвет красного и синего лакмуса при погружении в различные растворы.
1. В пробирки налейте по 1 мл растворов хлорида натрия, карбоната натрия и сульфата алюминия. Проверьте, как изменится цвет красного и синего лакмуса при погружении в различные растворы.
2. Добавьте в пробирки по одной капле фенолфталеина. Что наблюдаете? Результаты наблюдений оформите в виде таблицы.
3. Составьте уравнения реакций протекания гидролиза. Сделайте выводы.
Раствор соли | Фенолфталеин | Лакмус |
NaCl | ||
Na2CO3 | ||
Al2(SO4)3 |
Лабораторная работа №3
Химические свойства типичных металлов, неметаллов и амфотерных элементов.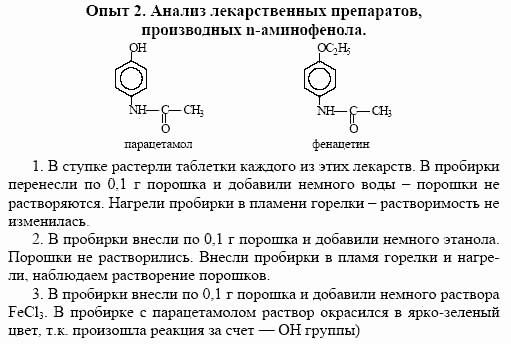
Задание. Исследуйте химические свойства металлов, неметаллов и амфотерных элементов.
Опыт 1. Взаимодействие магния с кислотами и щелочами.
Выполнение опыта.
Поместите в две пробирки стружки магния.
В одну пробирку добавьте 10капель 1 М раствора серной кислоты, а в другую – 10 капель 1 М раствора гидроксида натрия.
Запись наблюдений и результатов опыта.
1. Запись наблюдения.
2. Напишите уравнения протекающих реакций
3. Запишите уравнения реакций взаимодействия магния с разбавленным и концентрированным растворами азотной кислоты, с концентрированным раствором серной кислоты. Расставьте коэффициенты методом электронного баланса.
Опыт 2. Взаимодействие алюминия с кислотами и щелочами.
Выполнение опыта.
Налейте в одну пробирку 10 капель 1 М раствора серной кислоты, а во вторую – 10 капель 1 М раствора гидроксида натрия. Опустите в них по грануле алюминия (или по кусочку алюминиевой фольги одинакового размера).
Запись наблюдений и результатов опыта.
1. Запись наблюдения.
2. Напишите уравнения протекающих реакций
3. Запишите уравнения реакций взаимодействия алюминия с разбавленной азотной кислотой. Расставьте коэффициенты методом электронного баланса.
Лабораторная работа №4.
6.1 Ознакомление с образцами важнейших солей натрия, калия, кальция и магния, сравнение химической активности металлов.
Задание. Ознакомьтесь с выданными образцами важнейших солей натрия, калия, кальция и магния и заполните таблицу.
Название | Формула | Внешний вид | Находится в природе или получают химическим путем | Применение |
6.2 Окрашивание пламени солями щелочных и щелочноземельных металлов.
Задание. Научитесь химическими методами определять наличие (или отсутствие) ионов калия, натрия, кальция. (Эти ионы можно идентифицировать по окраске пламени.)
Выполнение опыта. 1. В пробирку налейте 1 мл соляной кислоты и опустите в нее на несколько секунд проволоку. Затем внесите проволоку в пламя и прокаливайте до тех пор, пока пламя не перестанет окрашиваться в неестественный для него цвет.
2. Остудите проволоку и возьмите ею крупинку сухой соли. Внесите проволоку в соляную кислоту и прокаливайте в пламени.
Чтобы лучше рассмотреть окрашивание пламени ионами калия, возьмите синее стекло. Результаты исследования оформите в тетради в виде таблицы.
Ионы | Соли | Окраска пламени |
Li+ | ||
Na+ | ||
K+ | ||
Ca+ |
6. 3 Получение известковой воды и ее взаимодействие с оксидом углерода (VI).
3 Получение известковой воды и ее взаимодействие с оксидом углерода (VI).
Задание. Изучите на опыте свойства соединения кальция.
Выполнение опыта. 1. В пробирку поместите немного оксида кальция и прилейте 3-4 мл воды. Полученный раствор испытайте раствором индикатора.
2. Часть жидкости отфильтруйте от осадка. Полученный прозрачный фильтрат разделите на две части.
3. Оставшуюся жидкость (с осадком) и фильтрат в одной из пробирок нейтрализуйте раствором соляной кислоты.
4. Через фильтрат, находящийся в третьей пробирке, с помощью стеклянной трубки продуйте воздух (осторожно, чтобы не разбрызгать раствор!). Объясните все явления, которые вы наблюдали. Запишите уравнения происходивших реакций.
Лабораторная работа №5
Качественные реакции на распознование ионов
Cu2+, Fe2+, Fe3+, Zn2+.
Задание. Проведите качественные реакции на ионы меди, железа, цинка.
Выполнение опыта.
1. Налейте в пробирку 1 мл раствора гидроксида натрия и добавьте несколько капель раствроа соли меди до выпадения осадка.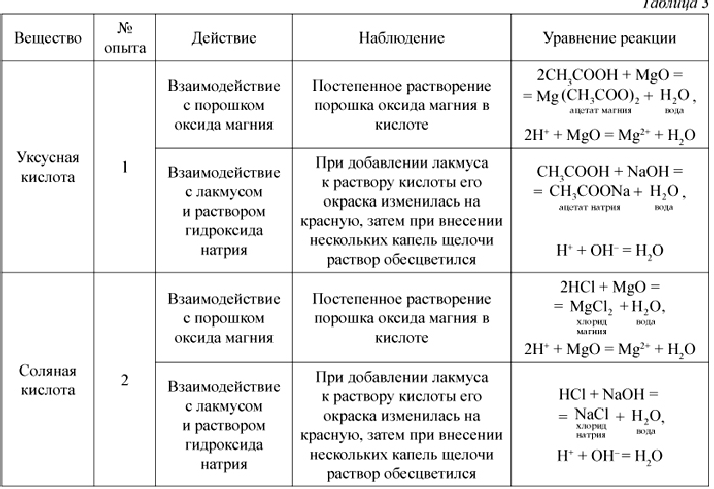 Напишите ионное уравнение реакции. Отметьте признак протекания этой реакции.
Напишите ионное уравнение реакции. Отметьте признак протекания этой реакции.
2. К 4-5 каплям раствора хлорида или сульфата железа (III) добавьте 1-2 капли раствора тиоцианата калия. Как изменилась окраска раствора? Напишите ионное уравнение реакции, учитывая, что образовавшаяся соль – тиоцианат железа Fe(CNS)3 – малодиссоциирующее соединение.
3. К нескольким каплям раствора хлорида железа (II) добавьте 1-2 капли раствора красной кровяной соли. Какого цвета выпавший осадок? Напишите ионное уравнение реакции, учитывая, что осадок (турнбулева синь) имеет состав Fe3[Fe(CN)6]2.
4. Налейте в пробирку 1 мл раствора соли цинка и по каплям добавляйте раствор щелочи до выпадения студенистого бесцветного осадка. Напишите уравнение этой реакции в ионном виде.
Лабораторная работа №6
Составление шаростержневых моделей молекул метана, пропана, этилена, ацетилена, аммиака, воды, уксусной кислоты.
Необходимые материалы и приспособления: пластилин светлого и темного цвета (или пластмассовые шары), палочки и спички.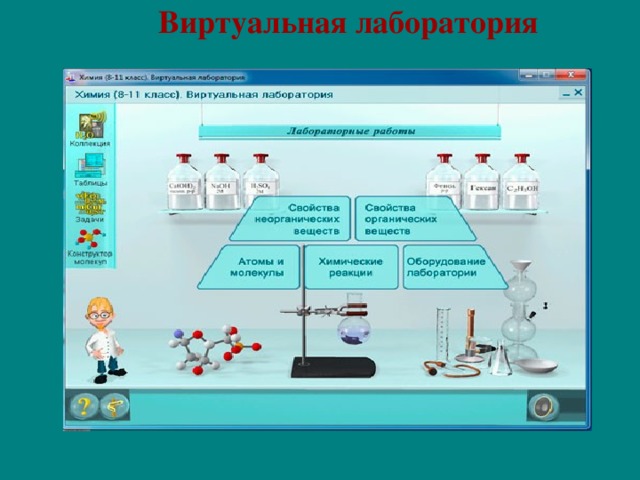
Модель молекуля метана Ch5
Из белого или светло-голубого пластилина (или из другого материала) изготовьте четыре небольших шарика одинакового размера, из пластилина темного цвета – один шарик, диаметр которого в 1,5раза больше предыдущих, что приблизительно правильно передает соотношение размеров атомов углерода и водорода. Наметьте на поверхности темного шарика, изображающего углерод, четыре равноудаленные друг от друга токи, вставьте в этих местах палочки (спички) и с помощью них присоедините светлые шарики, изображающие водород.
Модель молекулы пропана C3H8
Из белого или светло-голубого пластилина изготовьте 8 шариков одинакового размера (атомы водорода) и из темного пластилина – три шарика (атомы углерода). Как и в предыдущем случае, темные шарики должны бать больше светлых в 1,5 раза. Три темных шарика (атомы углерода) соедините между собой с помощью палочек или спичек таким образом, чтобы угол между ними составлял 109°. Теперь к каждому «атому углерода» присоедините, как и в предыдущем случае, «атомы водорода».
Модели молекул этана, этилена и ацетилена.
Аналогичным способом (как и в случаях изготовления моделей молекул (Ch5 и C3H8) постройте модели молекул этана (C2H6), этилена (C2h5) и ацетилена (C2h3).
Модель молекулы уксусной кислоты СН3СООН.
Изготовив из пластилина красного цвета атомы кислорода, постройте модель молекулы уксусной кислоты.
Модель молекулы аммиака Nh4.
Из пластилина зеленого цвета изготовьте шарик (атом азота), который должен быть в 2 раза больше, чем «атомы водорода». Поместив «атом азота» в вершину, постройте треугольную пирамиду, основание пирамиды образуют «атомы водорода» соединенные между собой с помощью палочек или спичек.
Модель молекулы воды Н2О.
Соедините два светлых шарика – «атомы водорода» с «атомом кислорода» (красный шарик) так, чтобы между «атомами водорода» образовался угол, равный 104°.
Лабораторная работа № 7
Получение этилена и изучение его свойств
Реактивы и оборудование: металлический штатив с лапкой, спиртовка (горелка), пробирка с газоотводной трубкой, две пробирки (поменьше), осколки фарфоровой посуды, этиловый спирт, серная кислота, бромная (йодная) вода (2-3 капли брома или йода в 50 мл воды), раствор перманганата калия, подкисленный серной кислотой, спички.
Собрав установку для получения газа, проверьте ее герметичность.
Выполнение работы.
Получение этилена дегидратацией этилового спирта. В сухую пробирку налейте 3-4 мл готовой смеси этилового спирта и концентрированной серной кислоты и поместите в нее несколько осколков фарфоровой чашки (для равномерного кипения).
Закройте пробирку пробкой с газоотводной трубкой и укрепите в лапке штатива. Смесь нагревайте осторожно, соблюдая правила техники безопасности.
Взаимодействие этилена с бромной (йодной) водой. Конец газоотводной трубки погрузите в пробирку, где находится 1,5 мл бромной (йодной) воды, пропускайте этилен до тех пор, пока раствор на обесцветится.
Взаимодействие этилена с раствором перманганата калия. Не прекращая нагревания смеси, опустите конец газоотводной трубки в пробирку с подкисленным раствором перманганата калия. Пропускайте этилен до обесцвечивания раствора.
Горение этилена. Не прекращая нагревания смеси, поверните газоотводную трубку отверстием вверх и подожгите выделяющийся газ, обратите внимание на горение этилена.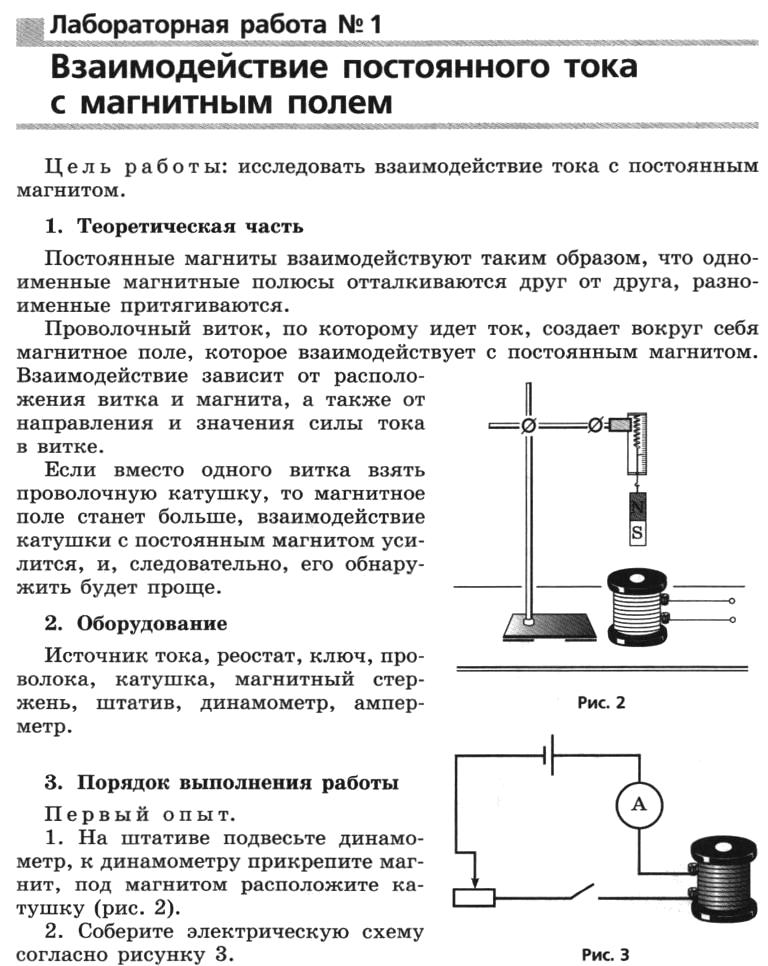 Прекратите нагревание, уберите рабочее место.
Прекратите нагревание, уберите рабочее место.
Ответьте на следующие вопросы:
А) Какой газ выделяется при нагревании смеси этилового спирта и серной кислоты?
Б) Что вы заметили при пропускании этилена через бромную (йодную) воду и раствор перманганата калия?
В) Почему этилен горит более светящимся пламенем, чем метан?
Г) Чем отличаются свойства этилена от свойств насыщенных углеводородов?
Написав уравнения соответствующих реакций, объясните замеченные вами изменения.
Лабораторная работа №8
Растворение глицерина в воде и его реакция
с гидроксидом меди(II)
Реактивы и оборудование: глицерин, дистиллированная вода, 2 %-ный раствор сульфата меди (II), 10 %-ный раствор гидроксида натрия, пробирки.
Выполнение работы
1. В пробирку налейте 2-3 мл дистиллированной воды и добавьте 0,5-1 мл глицерина, тщательно перемешайте смесь. Обратите внимание, глицерин, как более тяжелая жидкость, образует нижний слой.
2. В пробирку налейте 3-4 мл раствора сульфата меди (II) и добавьте раствор гидроксида натрия до выпадения осадка. Чтобы опыт удался, нужно взять избыток щелочи. Полученную смесь разделите в две пробирки, в одну внесите несколько капель глицерина и сравните с содержимым второй пробирки. Смесь с глицерином хорошенько взболтайте и снова сравните с содержимым второй пробирки. Осадок в пробирке с глицерином растворяется и образуется раствор синего цвета.
Чтобы опыт удался, нужно взять избыток щелочи. Полученную смесь разделите в две пробирки, в одну внесите несколько капель глицерина и сравните с содержимым второй пробирки. Смесь с глицерином хорошенько взболтайте и снова сравните с содержимым второй пробирки. Осадок в пробирке с глицерином растворяется и образуется раствор синего цвета.
Объяснив наблюдаемые явления, напишите уравнения реакции.
Лабораторная работа №9
Цветные реакции белков.
Реактивы и оборудование: штатив, пробирка, пипетка, фильтровальная бумага, воронка, колба, нагревательный прибор, белок яйца, 10 %-ный раствор гидроксида натрия, 5 %-ный раствор сульфата меди (II), 10 %-ный раствор гидроксида аммония, ацетат свинца, концентрированная азотная кислота, формалин, этанол.
Выполнение работы
1. Биуретовая реакция. В пробирку налейте 2 мл раствора белка и 2 мл раствора гидроксида натрия, добавьте 2-3 капли раствора сульфата меди (II). При встряхивании смеси образуется красно-фиолетовое окрашивание, что свидетельствует о наличии в смеси белка. Такая качественная реакция называется биуретовой.
Такая качественная реакция называется биуретовой.
2. Ксантопротеиновая реакция. В пробирку налейте 4 мл раствора белка и 1 мл концентрированной азотной кислоты, осторожно нагрейте смесь. При этом выпадет осадок. Какой он имеет цвет?
Если в обезжиренное молоко добавить несколько капель азотной кислоты, то начинается свертывание белка. Какая реакция при этом происходит?
3. Выпадение белка в осадок в присутствии солей тяжелых металлов.
Возьмите две пробирки, в каждую налейте по 2 мл раствора белка, затем внесите несколько капель в первую пробирку раствора сульфата меди (II), во вторую – раствора ацетата свинца (II). В пробирках образуются творожистые осадки, так как в растворах солей белки плохо растворяются. Объясните происходящие в пробирках изменения.
4. Действие формалина и спирта на белки. Возьмите две пробирки, налейте в одну этиловый спирт, во вторую — формалин. Добавьте в пробирки по 1 мл раствора белка. В обеих пробирках выпадает осадок. Почему осадки не растворяется в воде?
5. Свертывание (денатурация) белков при нагревании. Налейте в пробирку раствор яичного белка и нагревайте до кипения. Растворяется ли полученный осадок при добавлении воды? Объясните, почему осадок не растворяется.
Свертывание (денатурация) белков при нагревании. Налейте в пробирку раствор яичного белка и нагревайте до кипения. Растворяется ли полученный осадок при добавлении воды? Объясните, почему осадок не растворяется.
Лабораторная работа №10
Распознавание пластмасс и волокон
Оборудование и реактивы: образцы пластмасс и волокон под номерами, спиртовка, спички, стеклянные палочки, тигельные щипцы, асбестовые сетки.
В разных пакетах под номерами имеются образцы пластмасс. Пользуясь приведенными ниже данными, определите, под каким номером какая пластмасса находится.
Полиэтилен. Полупрозрачный, эластичный, жирный на ощупь материал. При нагревании размягчается, из расплава можно вытянуть нити. Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Поливинилхлорид. Эластичный или жесткий материал, при нагревании быстро размягчается, разлагается с выделением хлороводорода. Горит коптящим пламенем, вне пламени не горит.
Полистирол. Может быть прозрачным и непрозрачным, часто хрупок. При нагревании размягчается, из расплава легко вытянуть нити. Горит коптящим пламенем, распространяя запах стирола, продолжает гореть вне пламени.
Полиметилметакрилат. Обычно прозрачен, может иметь различную окраску. При нагревании размягчается, нити не вытягиваются. Горит желтоватым пламенем с синей каймой и характерным потрескиванием, распространяя эфирный запах.
Фенолформальдегидная пластмасса. Темных тонов (от коричневого до черного). При нагревании разлагается. Загорается с трудом, распространяя запах фенола, вне пламени постепенно гаснет.
Распознавание волокон.
В разных пакетах под номерами содержатся образцы волокон. Пользуясь приведенными ниже данными, определите, под каким номером какое волокно находится.
Хлопок. Горит быстро, распространяя запах жженной бумаги, после сгорания остается серый пепел.
Шерсть, натуральный шелк. Горит медленно, с запахом жженных перьев, после сгорания образуется черный шарик, при растирании превращающийся в порошок.
Ацетатное волокно. Горит быстро, образуя нехрупкий, спекшийся шарик темно-бурого цвета. В отличие от других волокон растворяется в ацетоне.
Капрон. При нагревании размягчается, затем плавится, из расплава можно вытянуть нити. Горит, распространяя неприятный запах.
Лавсан. При нагревании плавится, из расплава можно вытянуть нити. Горит коптящим пламенем с образованием темного блестящего шарика.
экспериментов в химической лаборатории | ЛЦСС
Инструкции. Нажмите на ссылку «Название эксперимента», чтобы перейти к лабораторной работе, которую вы хотите просмотреть. На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.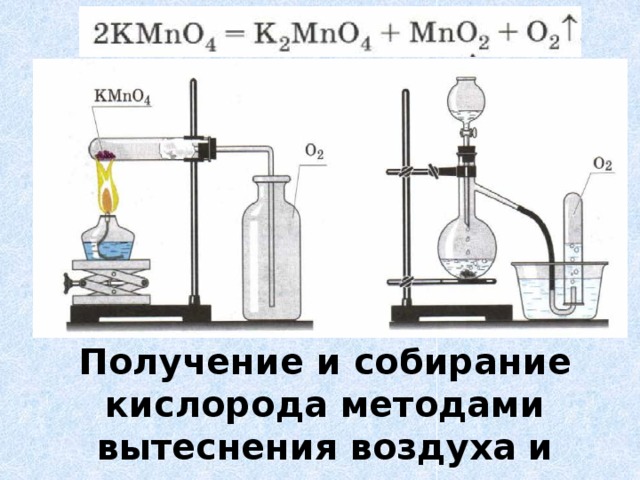
Химия с нониусом
| 1 | Эндотермические и экзотермические реакции | Go Direct ® Датчик температуры |
| 2 | Замерзание и таяние воды | Go Direct ® Датчик температуры |
| 3 | Еще один взгляд на температуру замерзания | Go Direct ® Датчик температуры (2) |
| 4 | Тепло плавления льда | Go Direct ® Датчик температуры |
| 5 | Найдите взаимосвязь: упражнение по графическому анализу | |
| 6 | Закон Бойля: зависимость давления от объема в газах | Go Direct ® Датчик давления газа |
| 7 | Зависимость давления от температуры в газах | Go Direct ® Датчик давления газа, Go Direct ® Датчик температуры |
| 8 | Фракционная перегонка | Go Direct ® Датчик температуры |
| 9 | Испарение и межмолекулярные притяжения | Go Direct ® Датчик температуры (2) |
| 10 | Давление паров жидкостей | Go Direct ® Датчик давления газа, Go Direct ® Датчик температуры |
| 11 | Определение концентрации раствора: закон Бера | Go Direct ® Колориметр |
| 12 | Влияние температуры на растворимость соли | Go Direct ® Датчик температуры |
| 13 | Свойства растворов: электролиты и неэлектролиты | Go Direct ® Датчик проводимости |
| 14 | Проводимость растворов: влияние концентрации | Go Direct ® Датчик проводимости |
| 15 | Использование депрессии точки замерзания для определения молекулярного веса | Go Direct ® Датчик температуры |
| 16 | Содержание энергии в пищевых продуктах | Go Direct ® Датчик температуры |
| 17 | Содержание энергии в топливе | Go Direct ® Датчик температуры |
| 18 | Аддитивность теплот реакции: закон Гесса | Go Direct ® Датчик температуры |
| 19 | Теплота сгорания: Магний | Go Direct ® Датчик температуры |
| 20 | Химическое равновесие: нахождение константы, K c | Go Direct ® Колориметр |
| 21 | Бытовые кислоты и щелочи | Go Direct ® Датчик pH |
| 22 | Кислотный дождь | Go Direct ® Датчик pH |
| 23 | Кривые титрования сильных и слабых кислот и оснований | Go Direct ® Датчик pH |
| 24 | Кислотно-основное титрование | Go Direct ® Датчик pH, Go Direct ® |
| 25 | Титрование двухосновной кислоты: выявление неизвестного | Go Direct ® Датчик pH, Go Direct ® Счетчик капель |
| 26 | Использование проводимости для поиска точки эквивалентности | Go Direct ® Датчик проводимости, Go Direct ® Счетчик капель |
| 27 | Константа кислотной диссоциации, K a | Прямой путь ® Датчик pH |
| 28 | Составление таблицы восстановительных потенциалов: микроэлектрические элементы | Go Direct ® Датчик напряжения |
| 29 | Свинцовые аккумуляторные батареи | Go Direct ® Датчик напряжения |
| 30 | Определение закона скорости реакции кристаллического фиолетового | Прямой путь ® Колориметр |
| 31 | Витамин С пролонгированного действия в таблетках | Go Direct ® Датчик pH |
| 32 | Буфер в лимонаде | Go Direct ® Датчик pH |
| 33 | Определение содержания свободного хлора в воде плавательного бассейна | Go Direct ® Колориметр |
| 34 | Определение количества железа в витаминной таблетке | Go Direct ® Колориметр |
| 35 | Определение содержания фосфорной кислоты в безалкогольных напитках | Go Direct ® Датчик pH |
| 36 | Микромасштабное кислотно-щелочное титрование | Go Direct ® Датчик pH |
Инструкции. Нажмите на ссылку «Название эксперимента», чтобы перейти к лабораторной работе, которую вы хотите просмотреть. На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
Нажмите на ссылку «Название эксперимента», чтобы перейти к лабораторной работе, которую вы хотите просмотреть. На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
Вернье Изучение химии через исследование
| 1 | Физические свойства воды | Go Direct ® Датчик температуры |
| 2 | Исследования пищевой соды и уксуса | Go Direct ® Датчик температуры |
| 3 | Исследование охлаждающих компрессов, содержащих мочевину | Go Direct ® Датчик температуры |
| 4 | Проводимость водных растворов | Go Direct ® Датчик проводимости |
| 5 | Идентификация чистого вещества | Go Direct ® Датчик температуры |
| 6 | Исследование энергетической ценности пищевых продуктов | Go Direct ® Датчик температуры |
| 7 | Исследование содержания энергии в топливе | Go Direct ® Датчик температуры |
| 8 | Испарение и межмолекулярные притяжения | Go Direct ® Датчик температуры (2) |
| 9 | Изменения энтальпии | Go Direct ® Датчик температуры |
| 10 | Стехиометрия реакции | Go Direct ® Датчик температуры |
| 11 | Расследования закона Бера | Go Direct ® Колориметр |
| 12 | Коллигативные свойства растворов | Go Direct ® Датчик температуры |
| 13 | Долгосрочный мониторинг воды | Go Direct ® Датчик температуры, Go Direct ® Датчик pH, Go Direct ® Датчик проводимости |
| 14 | Исследования давления пара и теплоты испарения | Go Direct ® Датчик температуры Go Direct ® Датчик давления газа |
| 15 | Кислотно-основные свойства бытовых товаров | Прямой путь ® Датчик pH |
| 16 | Влияние кислотного осаждения на водные системы | Датчик pH Go Direct ® , датчик проводимости Go Direct ® |
| 17 | Кислотно-основное титрование | Go Direct ® Датчик pH |
| 18 | Кондуктометрическое титрование | Go Direct ® Датчик проводимости |
| 19 | Окислительно-восстановительное титрование | Go Direct ® Датчик ОВП |
| 20 | Исследование гальванических элементов | Go Direct ® Датчик напряжения |
| 21 | Новый взгляд на исследования пищевой соды и уксуса | Go Direct ® Датчик температуры, Go Direct ® Датчик давления газа, Go Direct ® Датчик pH |
| 22 | Скорость реакции | Go Direct ® Датчик температуры Go Direct ® Датчик давления газа |
| 23 | Ферментативная активность | Go Direct ® Датчик температуры Go Direct ® Датчик давления газа |
| 24 | Ферментация сахара дрожжами | Go Direct ® Датчик температуры, Go Direct ® Датчик давления газа |
| 25 | Ядерное излучение | Go Direct ® Радиационный монитор |
Инструкции. Нажмите на ссылку «Название эксперимента», чтобы перейти к лабораторной работе, которую вы хотите просмотреть. На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
Нажмите на ссылку «Название эксперимента», чтобы перейти к лабораторной работе, которую вы хотите просмотреть. На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
Усовершенствованная химия с ручными экспериментами в лаборатории Вернье
| 1 | Определение химической формулы | |
| 2 | Определение процентного содержания воды в соединении | |
| 3 | Молярная масса летучей жидкости | Go Direct ® Датчик температуры, Go Direct ® Датчик давления газа |
| 4 | Использование депрессии точки замерзания для определения молекулярного веса | Go Direct ® Датчик температуры |
| 5 | Молярный объем газа | Go Direct ® Датчик давления газа, Go Direct ® Датчик температуры |
| 6 | Стандартизация раствора гидроксида натрия | Go Direct ® Датчик pH, Go Direct ® Счетчик капель |
| 7 | Кислотно-основное титрование | Go Direct ® Датчик pH, Go Direct ® Счетчик капель |
| 8 | Окислительно-восстановительное титрование: реакция Fe 2+ и Ce 4+ | Go Direct ® Датчик ОВП, Go Direct ® Счетчик капель |
| 9 | Определение молярных отношений в химической реакции | Go Direct ® Датчик температуры |
| 10 | Определение константы равновесия | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 11 | Исследование индикаторов | Напрямую ® Датчик pH, Go Direct ® Счетчик капель |
| 12 | Разложение перекиси водорода | Go Direct ® Датчик давления газа, Go Direct ® Датчик температуры |
| 13 | Определение энтальпии химической реакции | Go Direct ® Датчик температуры |
| 14А | Разделение и качественный анализ катионов | Go Direct ® Датчик pH |
| 14Б | Разделение и качественный анализ анионов | Go Direct ® Датчик pH |
| 15А | Синтез квасцов | Go Direct ® Датчик температуры |
| 15Б | Анализ квасцов | Go Direct ® Датчик температуры |
| 16 | Кондуктометрическое титрование и гравиметрическое определение осадка | Go Direct ® Датчик проводимости, Go Direct ® Счетчик капель |
| 17 | Определение концентрации раствора: закон Бера | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 18 | Жидкостная хроматография | |
| 19 | Буферы | Go Direct ® Датчик pH |
| 20 | Электрохимия: гальванические элементы | Go Direct ® Датчик напряжения |
| 21 | Гальваника | Go Direct ® Система постоянного тока |
| 22 | Синтез и анализ аспирина | Go Direct ® Плавильная станция, Go Direct ® SpectroVis ® Plus Spectrophotometer |
| 23 | Определение K sp гидроксида кальция | Go Direct ® Датчик pH |
| 24 | Определение K a полутитрованием слабой кислоты | Go Direct ® Датчик pH |
| 25 | Скорость и порядок химической реакции | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 26 | Энтальпия нейтрализации фосфорной кислоты | Go Direct ® Датчик температуры |
| 27 | α, β и γ | Go Direct ® Радиационный монитор |
| 28 | Радиационная защита | Go Direct ® Радиационный монитор |
| 29 | Основной гидролиз этилацетата | Платиновый датчик проводимости, датчик температуры из нержавеющей стали |
| 30 | Изучение свойств газов | Go Direct ® Датчик давления газа, Go Direct ® Датчик температуры |
| 31 | Определение числа Авогадро | Go Direct ® Система постоянного тока |
| 32 | Потенциометрическое титрование перекиси водорода | Go Direct ® Датчик ОВП, Go Direct ® Счетчик капель |
| 33 | Определение периода полураспада изотопа | Go Direct ® Радиационный монитор |
| 34 | Давление пара и теплота парообразования | Go Direct ® Датчик давления газа, Go Direct ® Датчик температуры |
| 35 | Определение скорости и энергии активации | Go Direct ® Датчик температуры, Go Direct ® SpectroVis ® Plus Спектрофотометр |
Инструкции: Нажмите на ссылку «Название эксперимента», чтобы перейти к лабораторной работе, которую вы хотите просмотреть. На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
Vernier Chemistry Исследования для использования с AP Chemistry
| 1 | Исследование пищевых красителей в спортивных напитках | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 2 | Определение содержания меди в латуни | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 3 | Исследование жесткости воды | Go Direct ® Датчик проводимости, Go Direct ® Датчик pH, держатель электрода |
| 4 | Кислотность соков и безалкогольных напитков | Go Direct ® Датчик pH, Go Direct ® Счетчик капель |
| 5 | Разделяющие молекулы | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 6 | Идентификация неизвестного вещества | Go Direct ® Плавильная станция, Go Direct ® Датчик pH, Go Direct ® Датчик проводимости, держатель электрода |
| 7 | Исследование чистоты смеси | Go Direct ® Датчик проводимости, Go Direct ® Датчик давления газа |
| 8 | Определение процентного содержания пероксида в коммерческом продукте | Go Direct ® Датчик ОВП, Go Direct ® Счетчик капель |
| 9 | Исследование компонентов коммерческого планшета | Go Direct ® Плавильная станция |
| 10 | Влияние кислотного дождя на мраморную конструкцию | Прямой путь ® Датчик давления газа |
| 11 | Исследование кинетики реакции кристаллического фиолетового | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 12 | Исследование коммерческих грелок для рук | Go Direct ® Датчик температуры, держатель электрода |
| 13 | Исследование принципа Ле-Шателье | Go Direct ® SpectroVis ® Plus Спектрофотометр, Go Direct ® Датчик pH |
| 14 | Исследование кислотно-щелочного титрования | Go Direct ® Датчик pH, Go Direct ® Счетчик капель |
| 15 | Буферная способность коммерческих продуктов | Датчик pH Go Direct ® , Go Direct ® Счетчик капель |
| 16 | Проверка эффективности буфера | Go Direct ® Датчик pH, Go Direct ® Счетчик капель |
Инструкции: Нажмите на ссылку «Название эксперимента», чтобы перейти к лабораторной работе, которую вы хотите просмотреть. На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
Ядерная химия с верньером Лаборатория ручных экспериментов
Ядерное излучение с верньером содержит шесть бесплатных экспериментов для сбора данных с помощью радиационного монитора, включая расстояние и излучение, статистику подсчета, измерение продолжительности жизни, источники фонового излучения, радиационную защиту и альфа, бета , и Гамма.
Эксперименты включены
- α, β и γ
- Расстояние и излучение
- Измерение срока службы
- Подсчет статистики
- Источники фонового излучения
- Радиационная защита
Бесплатная загрузка: доступна по адресу https://www. vernier.com/product/nuclear-radiation-with-vernier/ предварительный просмотр. На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
vernier.com/product/nuclear-radiation-with-vernier/ предварительный просмотр. На веб-странице представлено описание эксперимента с сопоставлением с государственными и национальными научными стандартами. После отправки SIM-запроса на аренду оборудования или получения услуг Mobile Educator вам будут отправлены версии эксперимента для учащихся и учителей по электронной почте в формате Word. Вы можете отредактировать лабораторную работу в соответствии со своими потребностями и сделать копии для использования в своих классах.
Органическая химия с нониусом
| 1 | Определение температуры плавления | Go Direct ® Плавильная станция |
| 2 | Перекристаллизация | Go Direct ® Плавильная станция Go Direct ® Широкодиапазонный датчик температуры |
| 3 | Определение температуры кипения | Прямой путь ® Широкодиапазонный датчик температуры |
| 4 | Идентификация неизвестного анальгетика тремя методами | Go Direct ® Плавильная станция, спектрофотометр Vernier UV-VIS |
| 5 | Разделение органических соединений методами кислотно-основной экстракции | Go Direct ® Плавильная станция |
| 6 | Понимание поляриметрии | Go Direct ® Поляриметр |
| 7 | Идентификация неизвестных органических веществ с помощью поляриметрии | Go Direct ® Поляриметр |
| 8 | Исследование газовой хроматографии | Go Direct ® Мини-ГХ ™ |
| 9 | Фракционная перегонка сложных эфиров | Go Direct ® Mini GC ™ , Go Direct ® Широкодиапазонный датчик температуры |
| 10 | Понимание межмолекулярных сил с помощью газового хроматографа: энтальпия испарения | Go Direct ® Мини-ГХ ™ |
| 11 | Исследование термодинамических взаимосвязей замещенных углеводородов | Go Direct ® Mini GC ™ |
| 12 | Экстракция пигментов шпината и анализ с помощью электронной абсорбционной спектроскопии | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 13 | S N 1: Синтез трет-бутилхлорида | Go Direct ® Мини-ГХ ™ |
| 14 | С Н 2: Синтез 1-бромбутана | Go Direct ® Mini GC ™ , Go Direct ® Широкодиапазонный датчик температуры |
| 15 | Наблюдение за кинетикой реакции сахарозы с помощью поляриметрии | Go Direct ® Поляриметр |
| 16 | Синтез и анализ аспирина | Go Direct ® Плавильная станция, Vernier UV-VIS Spectrophotometer, Go Direct ® Широкодиапазонный датчик температуры |
| 17 | Выделение R -(+)-лимонена из апельсинов с использованием паровой дистилляции | Go Direct ® Поляриметр Go Direct ® Широкодиапазонный датчик температуры |
| 18 | Синтез этилацетата методом этерификации по Фишеру | Go Direct ® Мини-ГХ ™ |
| 19 | Синтез дибензалацетона альдольной конденсацией | Go Direct ® Плавильная станция, Vernier UV-VIS Spectrophotometer, Go Direct ® Широкодиапазонный датчик температуры |
| 20 | Реакция Дильса-Альдера антрацена с малеиновым ангидридом | Go Direct ® Плавильная станция, Vernier UV-VIS Spectrophotometer, Go Direct ® Широкодиапазонный датчик температуры |
| 21 | Ацилирование ферроцена по Фриделю-Крафтсу | Go Direct ® Плавильная станция, Vernier UV-VIS Spectrophotometer, Go Direct ® Широкодиапазонный датчик температуры |
| 22 | Формация Гриньяра Кристалл Фиолетовый | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 23 | Синтез флуоресцеина | Go Direct ® SpectroVis ® Plus Спектрофотометр Go Direct ® Широкодиапазонный датчик температуры |
| 24 | Синтез метилоранжа и его применение в текстиле | Go Direct ® SpectroVis ® Plus Спектрофотометр |
| 25 | Анализ натуральных продуктов | Go Direct ® Поляриметр |
| 26 | Использование газового хроматографа: идентификация неизвестного соединения | Go Direct ® Мини-ГХ ™ |
Демонстрации химии для 11 класса – Химический блог Villanova College
У наших 11-классников есть текущие проекты по химии, где они могут продемонстрировать концепцию химии или нарисовать на нашей большой стене таблицы Менделеева.
Стена еще не завершена, и учащиеся должны проявить творческий подход и добавить 2 изображения, относящиеся к их элементу, где они могут рисовать прямо на стене!
Демонстрации на самые разные темы. Ниже приведены некоторые выдержки, в которых учащиеся представляют концепцию своей работы, задают классу несколько вопросов и продолжают демонстрировать свои взрывоопасные химические знания (часто в буквальном смысле).
Зубная паста Elephant
Rainbow Density Tower
Плотность: Масса, деленная на объем
- По мере добавления сахара в воду все больше и больше молекул сахара будут занимать пространство, делая воду более плотной. Чашка с наибольшим количеством столовых ложек сахара будет самой плотной, чашка без столовых ложек будет наименее плотной.
- 1. Поставьте четыре стакана сахара с разным количеством сахара
- 2. Налейте в каждую чашку по полстакана горячей воды и перемешайте, чтобы сахар растворился
- 3.
 Добавьте пищевой краситель разного цвета в каждую чашку
Добавьте пищевой краситель разного цвета в каждую чашку - 4. Налейте первую чашку в мерный цилиндр. С помощью шприца осторожно налейте воду из второй чашки, затем из третьей и, наконец, из четвертой. (самая плотная внизу)
В этом коротком видео вы найдете демонстрацию плотности радуги.
Танцующая монета:
______________
Стехиометрические шарики
Вот демонстрация добавления различных количеств пищевой соды к постоянному объему уксуса, чтобы продемонстрировать взаимосвязь молей образовавшегося углекислого газа. В какой-то момент соотношение не очевидно, поскольку количество выделяемого газа ограничивается количеством уксуса:
В какой-то момент соотношение не очевидно, поскольку количество выделяемого газа ограничивается количеством уксуса:
Метановые пузыри
Вот демонстрация взрыва метановых пузырей, выполненная в наших научных лабораториях Villanova:
Не только это крутая демонстрация — это возможность обсудить влияние метана на окружающую среду.
Рисунок 1. Пузырьки метана в озере Банф, Альберта [фото предоставлено Кэти Уолтер]- Как видно на рис.
 1 пузырьков метана, образовавшихся в озере Национальный парк Банф в Альберте, Канада
1 пузырьков метана, образовавшихся в озере Национальный парк Банф в Альберте, Канада - Пузырьки образуются из-за того, что органические вещества потребляются микробами на дне озера летом
__________
Взрыв водорода
Другой громкой реакцией горения является взрыв газообразного водорода. Газообразный водород привел ко многим из крупнейших взрывов в мире, включая взрыв Гинденберга.
Вот видеозапись классной демонстрации, на которой учащийся 11-го класса поджигает водородный шар:
____________________________
Взрыв тыквы: 93023 Около 90 тыква с помощью ацетилена.

 Добавьте пищевой краситель разного цвета в каждую чашку
Добавьте пищевой краситель разного цвета в каждую чашку 1 пузырьков метана, образовавшихся в озере Национальный парк Банф в Альберте, Канада
1 пузырьков метана, образовавшихся в озере Национальный парк Банф в Альберте, Канада