Практическая работа № 1 Качественное определение углерода, водорода и хлора в органических веществах. (10 класс)
Нечаев Дмитрий Валерьевич, учитель химии
ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ»
Практическая работа № 1
Качественное определение углерода, водорода и хлора в органических веществах.
Цель: научиться осуществлять качественный анализ органических веществ, совершенствовать навыки работ с лабораторным оборудованием.
Оборудование: лабораторный штатив, пробирки, пробка с газоотводной пробкой, спиртовая горелка.
Реактивы: CuO, C23H48 (парафин), CuSO4 безводный, Ca(OH)2, CCl4, медная проволока.
Ход работы
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
Смесь парафина и CuO поместили в пробирку. Безводный CuSO4 внесли ближе к отверстию. Закрепили пробирку с содержимым в горизонтальном положении. Пробирку закрыли пробкой с газоотводной трубкой, конец которой опустили во вторую пробирку с Са(ОН)Парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород — в воду:
С23Н48+70СuO→23CO2↑+24H2O+70Cu.
Выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды, вследствие образования нерастворимого карбоната кальция:
CO2+Ca(OH)2→CaCO3↓+H2O.
Безводный сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат:
CuSO4+5H2O→ CuSO4*5H2O.
По продуктам окисления парафина CO2 и H2O установили, что в его состав входит углерод и водород.
2.
Качественное определение хлора в молекулах галогенпроизводных углеводоровов.
Конец медной проволоки согнули в виде спирали и прокалили в пламени горелки до исчезновения окраски пламени. Затем охладили спираль и нанесли на нее каплю тетрахлорметана и снова внесли в пламя.
Пламя окрашивается в изумрудно-зеленый цвет.
Данная реакция является качественной для определения хлора в органических соединениях. Следовательно, в исходном веществе содержится хлор.
Общий вывод: на данной практической работе мы научились осуществлять качественный анализ органических веществ, а именно, химическим путем определили углерод и водород в предельных углеводородах и хлор в молекулах галогенпроизводных углеводоровов. А также усовершенствовали навыки работ с лабораторным оборудованием.
Задание учителя:
I вариант
Относительная плотность паров дихлоралкана по водороду равна 49,5. Установите формулу дихлоралкана.
Решение:
D(H2)=49,5
CnH2nCl2
М (CnH2nCl2)= D(H2) · М (H2) = 49,5 · 2 = 99 г/моль
М (CnH2nCl2) = 12n + 2n + 2 · 35,5= 99 г/моль
14n=28
n=2
C2H4Cl2 искомый дихлоралкан
II вариант
Один из бромалканов содержит 65,04% брома. Установите молекулярную формулу этого вещества.
Решение:
ω(Br)=65,04%
CnH2n+1Br-?
М (CnH2n+1Br) = 12n + 2n + 1 + 80 = 123 г/моль
14n=42
n=3
C3H7Br искомый бромалкан
infourok.ru
Практическая работа №1. Качественное определение углерода и водорода в органических веществах
Практическая работа №1
Качественное определение углерода и водорода в органических веществах
Реактивы и оборудования: лабораторный штатив, спиртовка, химический стаканчик, пробка с газоотводной трубкой, большая пробирка; порошок CuO (II), 0,2г парафина, безводн CuSO4 , известковая вода Ca(OH)2.
ЧТО ДЕЛАЛИ?
ЧТО НАБЛЮДАЛИ?
Собираем установку изображенную на рис.7 стр.27.
В пробирку засыпаем 0,2г парафина и 1г CuO. Недалеко от пробки с газоотводной трубкой помещаем чуть-чуть безводного CuSO4. Свободный конец газоотводной трубки опускаем в химический стаканчик с р-ром известковой воды — Ca(OH)2. Пробирку осторожно нагреваем.
( Рисунок установки со всеми обозначениями)
Воду обнаруживают безводным сульфатом меди (II). Под действием воды белый сульфат меди (II) переходит в голубой кристаллогидрат — медный купорос
CuSO4 + 5H2O = CuSO4 * 5 H2O
кристаллогидрат
голубого цвета
При нагревании парафина углерод окисляется до углекислого газа, а водород до воды. Оксид меди (II) восстанавливается до меди или до оксида одновалентной меди, имеющих красный цвет
С18Н38 + СuО = 18СО2 + 19 Н2О + 55Сu
Известковая вода мутнеет от углекислого газа.
Ca (OH)2 + CO2 = CaCO3 ↓ + H2O
Вывод: выполнив данную работу, мы убедились, что парафин состоит из С и Н. Значит парафин – углеводород.
infourok.ru
Практическая работа № 1. Качественное определение углерода, водорода и хлора в органических веществах. ГДЗ Химия 10-11 класс Цветков.
Как тут сделать?
1. Качественный состав жидких и твердых углеводородов можно установить путем окисления их оксидом меди (II).
Поместите в сухую пробирку 1 г порошка оксида меди (II) и очень немного (0,2 г) парафина, керосина или вазелинового масла. Жидкие нефтепродукты должны пропитать оксид меди (II). Пробирку с парафином для этой цели следует подогреть, чтобы твердый нефтепродукт расплавился.
Придав пробирке горизонтальное положение, внесите в нее немного обезвоженного медного купороса и закройте пробкой с газоотводной трубкой так, чтобы порошок сульфата меди (II) находился возле пробки. Конец газоотводной трубки опустите в пробирку с известковой водой (рис. 62).
Нагревайте несильно смесь веществ. Что замечаете на стенках пробирки? Какие изменения происходят с сульфатом меди (II) и известковой водой?
Прекратите опыт. После того как пробирка остынет, удалите из нее сульфат меди (II) и извлеките продукты реакции. Во что превратился оксид меди (II) при окислении углеводородов?
Какой вывод можно сделать о качественном составе взятых для исследования нефтепродуктов на основании проведенного опыта? Составьте уравнение реакции полного окисления оксидом меди (II) предельного углеводорода, в состав молекулы которого входят 14 атомов углерода.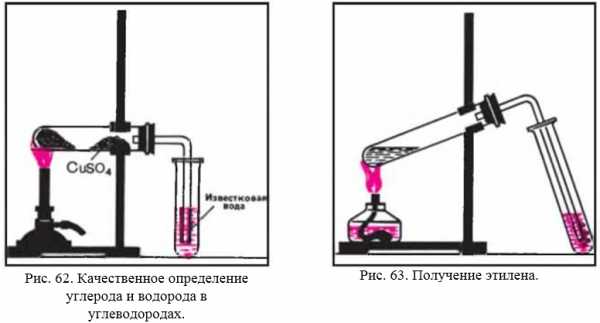
2. Наличие хлора можно установить при нагревании органического вещества с медью: хлор образует с медью летучую соль, окрашивающую пламя в характерный зеленый цвет.
Сделайте спираль на конце медной проволочки и прокалите ее в пламени горелки до тех пор, пока пламя от спирали уже не будет окрашиваться.
Прикоснитесь спиралью к испытуемой жидкости (например, к 2—3 каплям дихлорэтана или тетрахлорметана) и затем вновь поместите спираль в пламя горелки.
Наблюдайте зеленое окрашивание пламени, свидетельствующее о наличии хлора во взятом органическом растворителе.
Таким же способом проверьте, содержится ли хлор в другом выданном вам для исследования образце.
class.rambler.ru
Практическое занятие № 7. Качественное определение углерода и водорода в органических веществах
Задание. Установите наличие элементов углерода и водорода в составе любого предложенного углеводорода (парафина, метана).
Оборудование. Штатив с пробирками, пробки с газоотводными трубками, лабораторный штатив, стеклянная палочка, химические стаканы (2 шт.) емкостью не менее 150 мл, горелка (спиртовка), спички.
Вещества. Парафин, вазелин, хлороформ (или дихлорэтан), сульфат меди (II) безводный, раствор гидроксида кальция, оксид меди (II), спирт и галогенопроизводные органические вещества — склянки № 1 и № 2.
Выполнение работы
1. Зажгите газовую горелку (спиртовку). Подержите 2—3 с над пламенем сухой стакан в перевернутом состоянии. Почему запотел стакан?
Смочите (сполосните) стакан раствором гидроксида кальция и снова в таком же состоянии подержите над пламенем. Объясните причину появления белых пятен на стенках стакана.
На основании обнаруженных воды и оксида углерода (IV) сделайте вывод о качественном составе Crоревшего вещества.
2. Зажгите парафиновую свечу и аналогичным путем установите качественный состав парафина. Проведите опыт по обнаружению свободного углерода в пламени свечи.
Составьте уравнение реакции горения парафина свечи, приняв, что в его молекуле содержится 16 атомов углерода.
Примечание: опыты 1 или 2 проводятся по выбору учащихся.
3. Соберите прибор, как указано на рисунке 22.5, и испытайте его на герметичность.
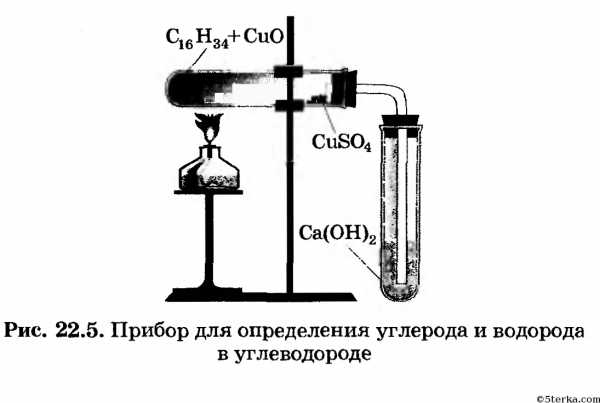
В сухую пробирку поместите 2— 2,5 г оксида меди и немного вазелина, чтобы его хватило только для пропитки подогретого оксида меди (II). Закрепите пробирку в штативе горизонтально и внесите в нее не более 0,5 г сульфата меди (II), разместив около отверстия пробирки. Закройте пробирку пробкой с газоотводной трубкой, конец которой
опустите в пробирку с известковой водой. Нагревайте пламенем горелки (спиртовки) смесь оксида меди (II) с вазелином.
Наблюдайте, какие изменения происходят с известковой водой. По окончании опыта, прежде чем погасить пламя горелки, поднимите вверх лапку штатива с прибором и выньте газоотводную трубку из пробирки. (Почему это надо проделать?)
На основании результатов опыта сделайте вывод о качественном составе вазелина. Составьте уравнение реакции полного окисления оксидом меди предельного углеводорода, в состав которого входит 16 атомов углерода.
Из опыта следует, что в сгоревшем веществе есть углерод и водород.
б) Эксперимент проводится аналогично опыту а). Уравнение реакции горения парафина:
Для обнаружения свободного углерода в пламени свечи нужно подержать чистое стекло над пламенем. Стекло постепенно закоптится. Это и есть свободный углерод.
в) Уравнение реакции:
5terka.com
Учебно-методический материал на тему: Практическая работа№1, Определение углерода и водорода в ууглеводородах
ПРАКТИЧЕСКАЯ РАБОТА №1
«Определение углерода, водорода, хлора в органических веществах»
Цели. Знать химические реакции, лежащие в основе данной работы; правила техники
безопасности.
Уметь в лабораторных условиях устанавливать качественный состав жидких и
твердых углеводородов путем окисления их оксидом меди (II), монтировать
прибор для исследования образцов органических веществ на содержание в них
углерода, водорода и хлора
Оборудование и реактивы :металлический штатив, штатив с пробирками, газоотводная трубка, спиртовка, спички; парафин, оксид меди(2), сульфат меди(2) безводный, известковая вода.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
Осторожно обращайтесь с химическим оборудованием!
а б в г д
Поместите в сухую пробирку 1г порошка оксида меди (II) и очень немного вазелинового масла (0,3мл) или другого углеводорода.
- Придав пробирке горизонтальное положение, внесите в неё немного обезвоженного медного купороса и закройте пробкой с газоотводной трубкой так, чтобы порошок сульфата меди (II) находился возле пробки. Конец газоотводной трубки опустите в пробирку с известковой водой.
- Нагревайте несильно смесь веществ. Что замечаете на стенках пробирки? Какие изменения происходят с сульфатом меди (II) и известковой водой?
- Выньте из известковой воды конец газоотводной трубки и после этого прекратите нагревание. Из остывшей пробирки удалите сульфат меди (II) и извлеките продукты реакции. Во что превратился оксид меди (II) при окислении углеводородов?
- Оформите работу в соответствии с образцом (табл.1)
Этапы работы | Наблюдения. | Рисунок с надписями. Уравнения реакций |
Выводы |
Качественное определение хлора в органических веществах
(проба Бельштейна)
Оборудование: медная проволочка на конце со спиралью, стеклянная пластинка, пипетка, спиртовка, тигельные щипцы.
Реактивы: дихлорэтан.
Ход выполнения
- Прокалите в пламени спиртовки медную проволоку, держа её тигельными щипцами, до тех пор, пока не перестанет окрашиваться пламя. Дайте ей остыть.
- Поместите на стекло каплю дихлорэтана, прикоснитесь к ней концом проволоки и быстро внесите снова в пламя горелки, внимательно наблюдайте за его окраской.
- Что наблюдаете? Объясните свои наблюдения.
- Оформите работу в соответствии с образцом (табл.1)
Сделайте вывод о практической работе, исходя из цели
Приведите рабочее место в порядок
Сдайте тетради на проверку.
nsportal.ru
План-конспект урока по химии (10 класс) на тему: Методическая разработка урока по органической химии «Качественное определение углерода, водорода и хлора в органических соединений»
ПРАКТИЧЕСКАЯ РАБОТА №1.
Название работы: ________________________________________________
Цель работы: _____________________________________________________
__________________________________________________________________
С техникой безопасности знаком (а) ___________________________
Действия | Наблюдения | Уравнения реакций. Выводы |
Опыт №1. Определение углерода и водорода | Ca(OH)2 + CO2 → CuSO4 + 5h3O → C16h44 + CuO | |
Опыт №2. Определение хлора |
Вывод:___________________________________________________________________________________________________________________________________________________________________________________________________________________
Приведите рабочее место в порядок. Оценка ______________
ИНСТРУКЦИЯ К ПРАКТИЧЕСКОЙ РАБОТЕ № 1
КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ УГЛЕРОДА, ВОДОРОДА И ХЛОРА В ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ
ЦЕЛЬ РАБОТЫ:научиться определять углерод, водород и хлор в органических соединениях.
ОБОРУДОВАНИЕ И РЕАКТИВЫ:
лабораторный штатив, нагревательный прибор, простейший прибор для получения газов, держатель, фарфоровая чашка, парафин, оксид меди(II), известковая вода, прокаленный сульфат меди(II), медная проволочка 10 см., раствор тетрахлорметана.
ИНСТРУКЦИЯ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ:
1.Пробирка закреплена правильно, если она не выпадает из лапки и может быть слегка повернута вокруг своей оси.
2.Нагревайте осторожно сначала всю пробирку, а затем, не вынимая ее из пламени, ту часть, где находится вещество.
3.Направляйте отверстие нагреваемой пробирки в сторону от себя и соседей, избегая выбрасывания жидкости.
4.Не наклоняйтесь над нагреваемой пробиркой.
5.При пользовании нагревательным прибором запрещается:
— передача зажженного нагревательного прибора.
— зажигание одного нагревательного прибора от другого.
6.Гасите только накрывая пламя колпачком.
7.Выньте газоотводную трубку из пробирки с водой, не прекращая нагревания пробирки с веществом , в противном случае воду из пробирки может перебросить в раскаленную пробирку с веществом!
ХОД РАБОТЫ:
Опыт № 1. Обнаружение углерода и водорода окислением оксидом меди (II)
Соберите прибор, как показано на рисунке.
Смесь 1 — 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция) Нагрейте пробирку в течении 2-3 мин. Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить (что и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения.
После изменения окраски сульфата меди (П) следует прекратить нагревание.
При протекании реакции:
– парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород – в воду:
– выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды вследствие образования нерастворимого карбоната кальция:
– сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат CuSO4 · 5Н2О.
Опыт №2. Качественное определение хлора в молекулах галогенопроизводных углеводородов
Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в держатель.
Прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди (П), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки.
nsportal.ru
ГДЗ №1 по химии, Химия 10 класс. Рудзис Г.Е.. Готовое домашнее задание
Наш робот распознал:Практическая работа 1
Качественное определение утлероди. водорода н хлора в органических соединениях
Что делаю Ншчимкчшн . равнение реакцш Кыш
Задача 1. Качественное определение углерода и водорода
В сухую про- Практичсскн -;.:- 13л1СвО- Безводный суль-
бирку гюме1идю бесцветный -ПС0;-П11Н;0- фат мели II по-
1 г порошка сульфат меди Зп1Си глощает воду и
оксида челн II II приобре- прекращается в
и 0.2 г вазелина. тет голубую о крисшллолирш.
Закрепляю про- ОКрСИу. Из- СлН..+51СиО -> Кн образовалась
бирку В ШГ41МВ вестковая -20СО;+21Н;051Си вола, значит в
в гориюнталь- пода мутне- исходном веше-
ноч положении ет. На про- Например: сгяе был водород.
Окаю отвер- бирке Обра- Си50 — 5НлО — Известковая вода
С1ия помешаю зуется — СиЗО, — 5Н;0 мутнеет в при-
немного без- медное зер- СаГОН; СО; — сутствии углеки-
водного суль- кало — СаСО,4 Н-0 слого газа Раз
Чпюйсшю Наблюдения Уравнение реакции Вывод
срата меди II. Закрываю про- обрлювапся угле-кислый гаг, та-
бирку газоот- чит в исходном
водной трубкой, коней которой ВСШСС1ВС был углерод. Оксид
опуикн п иг меди И восста-
вестковую волу, Нагреваю. навливается до свободной меди. окисляя при этом углеводород.
Задача 2- Качественное опредс ление хлора
Прокаливаю пламя окра- Данная реакция
спираль т шивается в является каче-
медной прово- кзумрулно- ственной Х1Я
локи в пламени зеленый цвет определения
спиртовки. Прокаленную хлора в органических соедине-
спираль опускаю в пробирку ниях. Следовательно, в исход-
с тетрахлорче- ном веществе
таном.а затем содержался
вношу в пламя хлор
спиртовки
Наливаю я пробирку 2-3 мм этилового спирта, добавляю 6-9 мл концентриро- реакционная смесь темнеет, пробирка заполняется парами Н50 к; 0140е С;КОН — этиловый спирт — сн.-
ванной серной зуется этилен
кислоты.
Всыпаю прока- бромная вода СН;СН;-ЭГ -> Т.к. этилен от-
ленный песок. обесцвечи- вода носится к не-
Закрываю пробирку газоот-водной трубкой вается ВГ ВГ 1 1 — СН: СН- предельным углеводородам. то для него ха-
и нагреваю. 1,2-либроыэтан рактерны реак-
Коней ГЯ100Т- ции присоеди-
воднойтрубки нения. Вследст-
опускаю в пробирку с броч-ной водой и вие чего происходит обесцвечивание броч-
Чтодешю НаАлюдения равнение реакции Вывод
пропускаю че- ной воды ороч 1
рез нее выде- присоединяется
ляющийся газ. к молекулам .и идеи а
Пропускаю выделяющийся таз через подкисленный раствор перманга- раствор пер-манганата калия обесцвечивается /, СН.СН; 1 бКМпО, + 9Н.-504 —6Кп50 14Н-0 — ьсо; зк-зо, упрощенная Из-за наличия п-связн в молекуле этилена он легко окисляется различными окис-
нзта калия. схема реакции: КМг.О; Н СИ -СН- -> СО-Ь С лителями. са-пример, перыан-танаточ калия
Переворачиваю газ сгорает С;Н,30.-2СО;2Н:0 Как и для боль-
газоотводную ярким све- шинства орга-
трубку огвер- тящимся нических со-
стием вверх и пламенеч единений, для
поджигаю вы- этилена харак-
деляющийся терна реакция
гаэ. горения, в результате которой он окисляется до углекислого гата и оды. Пламя при горении этилена более светящееся, чем при горении метана, т.к. в этилене боль-
шее содержание углерода.
Примечание: В кислой среде этилен окисляется до Вывод: Для
СО:: /ДО бККпО, 9Н;50 — 6Я>
1 1 ОН ОН В главе IV 1 дано упрощенное уравнение для рсак- для этилена и его гомологов —
Что делаю 11аенин решение реакции ЙЫ
цнн в нейтральной среде, а по условию практической работы 2 реакция должна проводиться в кислой среде. реакции присоединения по месту разрыва двойной связи.
www.mygdz.com
