Белорусский государственный университет транспорта — БелГУТ (БИИЖТ)
Как поступить в БелГУТ
Как получить место
в общежитии БелГУТа
Как поступить иностранному гражданину
События
Все события
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
1 | 2 | |||||
3 | 4 Дата : 2022-10-04 | 5 | 6 Дата : 2022-10-06 | 7 | 8 | 9 |
10 | 11 Дата : 2022-10-11 | 12 | 13 Дата : 2022-10-13 | 14 Дата : 2022-10-14 | 15 | 16 |
17 | 18 | 19 | 20 Дата : 2022-10-20 | 21 | 22 | 23 |
24 | 25 | 26 Дата : 2022-10-26 | 27 Дата : 2022-10-27 | 28 | 29 Дата : 2022-10-29 | 30 |
31 | ||||||
Все анонсы
- 12 ноября — ДЕНЬ ОТКРЫТЫХ ДВЕРЕЙ ЭЛЕКТРОТЕХНИЧЕСКО.
 ..
.. - Онлайн турнир по Dota 2
- Билеты на фестиваль по бальным танцам «GOMEL OPEN»…
- I международная научно-техническая конференция сту…
- 29 октября — ДЕНЬ ОТКРЫТЫХ ДВЕРЕЙ ФАКУЛЬТЕТА ПГС…
- Вакцинация от гриппа
- 1 тур серии игр «ЧТО? ГДЕ? КОГДА?» среди студентов…
- Открытая лекция Евдокимовича Владислава Евгеньевич…
- Лига дебатов в БелГУТе
- Курсы самообороны
Анонсы
Университет
Абитуриентам
Студентам
Конференции
Приглашения
12 ноября — ДЕНЬ ОТКРЫТЫХ ДВЕРЕЙ ЭЛЕКТРОТЕХНИЧЕСКО…
Онлайн турнир по Dota 2
Билеты на фестиваль по бальным танцам «GOMEL OPEN»…
I международная научно-техническая конференция сту…
Новости
Университет
Международные связи
Спорт
Воспитательная работа
Жизнь студентов
Новости подразделений
- Воспитательная работа
Чистый город – наше общее дело!
31 октября 2022
- Университет
Командный чемпионат по программированию среди учреждений высшего обра.
31 октября 2022
- Университет
День открытых дверей факультета ПГС
31 октября 2022
- Воспитательная работа
Встречаем участников акции «Символ единства — 2022″…
29 октября 2022
- Студенческая жизнь
Лига дебатов в БелГУТе
28 октября 2022
- Университет
Поздравляем с присвоением ученой степени кандидата технических наук! …
28 октября 2022
- Университет
Научный семинар оппонирующей организации…
28 октября 2022
- Университет
IV Отчетно-выборная конференция первичной организации РГОО «Белорусск. ..
..
28 октября 2022
- Воспитательная работа
Спасибо, Доноры!
27 октября 2022
Другие новости
- СИЛА ЗАКОНА
- Поздравляем с присвоением степени кандидата технических наук…
- Студенты на телепрограмме «Черное и белое» Беларусь-4…
- Встреча школьников-таможенников со студентами-спортсменами сборной Бел…
- Встреча с представителями силового блока…
- «Крылья надежды» в КСУП «Брилево»
- Волшебная неделя ФРАНЦУЗСКОГО ЯЗЫКА
- К 30-летнему юбилею специальности «АВТОМОБИЛЬНЫЕ ДОРОГИ» в УО «БЕЛОРУ…
- Диалоговая площадка с представителями Гомельской таможни…
- Волейбольная встреча БелГУТа и БТЭУ
- Неделя родительской любви глазами участников автопоезда #Беларусь.Моло…
КУДА ПОСТУПАТЬ
Все факультеты
БелГУТ на Доске почета
Достижения университета
Предложения
Все предложения
Видеотека
Все видео
Фотогалерея
Все фото
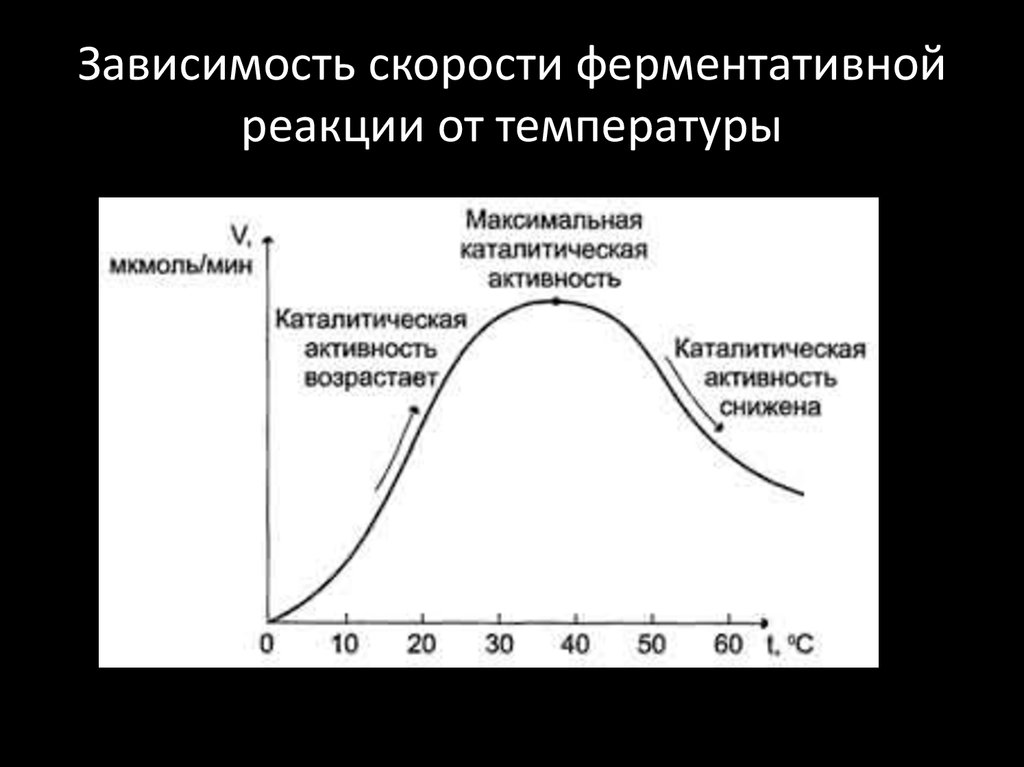
Практическая работа 1 по теме «Скорость химических реакций»
Класс: Дата________
Практическая работа №1 «Изучение влияния условий проведения химической реакции на ее скорость»
Цель работы: исследовать зависимость скорости протекания химической реакции от природы реагирующих веществ, площади поверхности соприкосновения реагирующих веществ, концентрации, температуры, катализатора.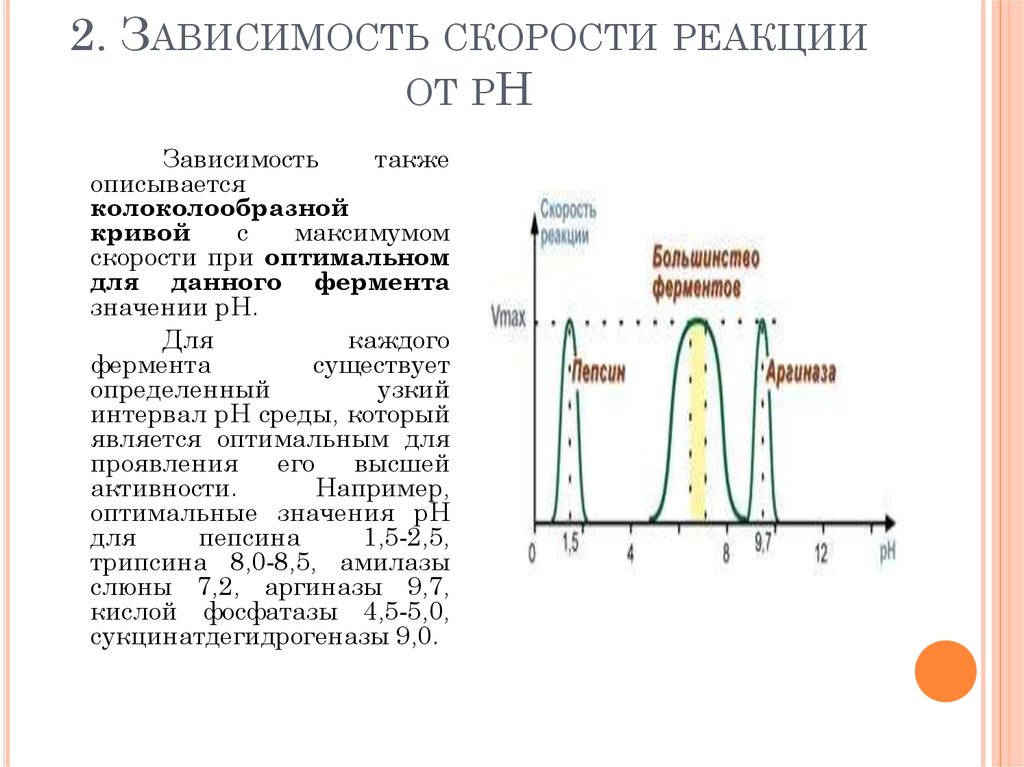
Оборудование: лабораторный штатив, шпатель, пробирки, нагревательный прибор. (виртуальная лаборатория)
Реактивы: H2SO4 (конц.), H2SO4 (разбавл 1:5 и 1:10), Zn гранулы, мел, СН3СООН, H2O2, MnO2 (виртуальная лаборатория)
Ход работы:
I. Инструктаж по технике безопасности перед началом работы
II. Выполнение работы
Влияние природы реагирующих веществ.
Уравнение реакции: 2СН3СООН + Zn = H2 + ( CH3COO)2 Zn
Zn+ H2SO4=ZnSO4+H2
Наблюдения: Так как серная кислота сильнее уксусной, то с ней взаимодействие протекает быстрее.
2. Влияние концентрации реагирующих веществ.
Уравнение реакции: Zn+H2SO4=ZnSO4+H2
Наблюдения: В случае концентрированной кислоты реакция идет интенсивнее, так как скорость пропорциональна концентрации.
3.Влияние поверхности соприкосновения реагирующих веществ.
Уравнение реакции: CaCO₃+H₂SO₄=CaSO₄+H₂O+CO₂
Наблюдения: Порошок мела быстрее растворится в кислоте, чем цельный кусок.
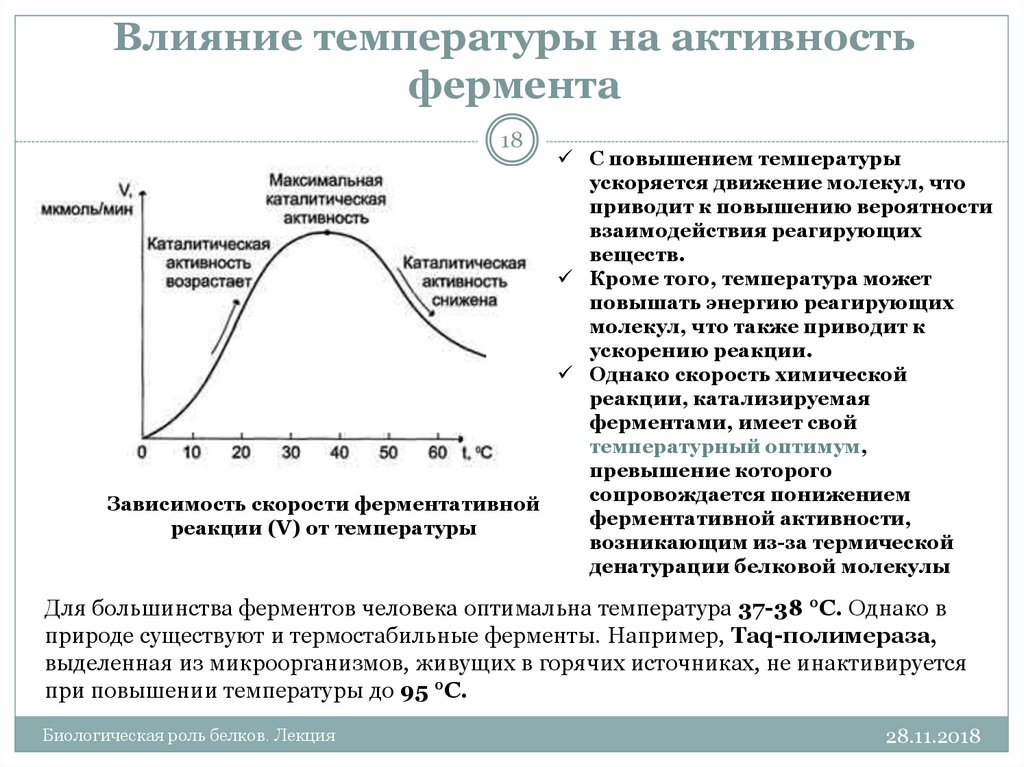
4. Влияние температуры
Уравнение реакции: Zn+H2SO4=ZnSO4+H2
Наблюдения:В пробирке с подогретой кислотой до 50ºС, реакция идет быстрее
5. Влияние катализатора
Уравнение реакции: 2Н2О2 = 2Н2О + О2↑
Наблюдения: После того, как добавим в перекись МnO2, внесенная тлеющая лучинка вспыхнет, т.к МnO2катализирует разложение перекиси водорода, а выделяющийся при этом кислород поддерживает горение.
Вывод: на скорость реакции влияют природа, концентрация, поверхность реагирующих веществ, температура и наличие катализатора.
Цели урока: исследовать зависимость скорости протекания химической реакции от природы реагирующих веществ, площади поверхности соприкосновения реагирующих веществ, концентрации, температуры, катализатора; закрепить понятие скорости химической реакции. через проведение практической работы.
Коррекционные цели: развитие и коррекция связной устной речи, письменной речи, логического мышления. Развитие устной и письменной химической речи учащихся.
выбор наиболее эффективных способов решения задач в зависимости от условий;
извлекать необходимую информацию, анализ, синтез, установление причинно-следственных связей.
Оборудование: Таблица растворимости веществ, ПСХЭ Д.И.Менделеева, ПК, проектор, использование (виртуальная лаборатория).
Оборудование и реактивы: лабораторный штатив, шпатель, пробирки, нагревательный прибор, H2SO4 (конц.), H2SO4 (разбавл 1:5 и 1:10), Zn гранулы, СН3СООН, H2O2, MnO2 (виртуальная лаборатория)
На столах учащихся: Инструкция по проведению практической работы
Тип урока: урок-практикум
Методы обучения: практическая (химический эксперимент)
Ход урока:
1. Орг. момент. Постановка цели и задач деятельности обучающихся.
Орг. момент. Постановка цели и задач деятельности обучающихся.
2. Познакомить с содержанием работы на стр ______ учебника. Составить план работы. Какие задачи стоят перед вами?
3.Объявление и запись темы практической работы.
4. Самостоятельно сформулируйте цель проведения практической работы, исходя из названия работы и её содержания. (Цель работы: исследовать зависимость скорости протекания химической реакции от природы реагирующих веществ, площади поверхности соприкосновения реагирующих веществ, концентрации, температуры, катализатора.)
5.Записать название оборудования и необходимых реактивов. Сделайте запись: «Правила ТБ знаю и обязуюсь выполнять»
6.Приступите к выполнению работы.
7. Отчёт оформить.
8. Сделать вывод.
9. Подведение итогов
Цель работы: исследовать зависимость скорости протекания химической реакции от природы реагирующих веществ, площади поверхности соприкосновения реагирующих веществ, концентрации, температуры, катализатора.
Оборудование: лабораторный штатив, шпатель, пробирки, нагревательный прибор. (виртуальная лаборатория)
Реактивы: H₂SO₄ (конц.), H₂SO₄ (разбавл 1:5 и 1:10), Zn гранулы, мел, СН₃СООН, H₂O₂, MnO₂ (виртуальная лаборатория)
Ход работы:
I. Инструктаж по технике безопасности перед началом работы
II. Выполнение работы
1. Влияние природы реагирующих веществ.
Уравнение реакции: ____________________________
Наблюдения: ____________________________
2. Влияние концентрации реагирующих веществ.
Уравнение реакции: ____________________________
Наблюдения: ____________________________
3.Влияние поверхности соприкосновения реагирующих веществ.
Уравнение реакции: ____________________________
Наблюдения: ____________________________.
4. Влияние температуры
Уравнение реакции: ____________________________
Наблюдения: ____________________________
5. Влияние катализатора
Влияние катализатора
Уравнение реакции: ____________________________
Наблюдения: ____________________________
Вывод: ____________________________
2.5: Скорость реакции — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1438
В ходе реакции, показанной ниже, расходуются реагенты A и B, а концентрация продукта AB увеличивается. Скорость реакции можно определить, измерив, насколько быстро уменьшается концентрация А или В или насколько быстро увеличивается концентрация АВ.
\[ \ A + B \ longrightarrow AB \]
Рисунок \(\PageIndex{1}\): На приведенном выше рисунке показан гипотетический профиль реакции, в котором концентрация реагентов (красный цвет) уменьшается по мере увеличения концентрации продуктов (синий цвет).
Для стехиометрически сложной реакции:
\[ aA + bB \longrightarrow cC + dD \label{1} \]
\[ \text{Скорость} = \dfrac{-1}{a}\dfrac{d[A]}{dt} = \dfrac{-1}{b} \dfrac{d[B]}{dt} = \dfrac{1}{c}\dfrac{d[C]}{dt} = \dfrac{1}{d}\dfrac{d[D]}{dt} \]
Глядя на рисунок \(\PageIndex{1}\) выше, мы видим, что скорость может быть измерена либо по реагенту (A или B), либо по любому продукту (C или D). Не все переменные необходимы для определения скорости. Следовательно, если у вас есть значение «А», а также значение «а», вы можете найти скорость реакции.
Вы также можете заметить из уравнения \ref{1}, что изменение реагентов по сравнению с изменением во времени должно стоять перед ними со знаком минус. Причина этого в том, что количество реагентов уменьшается с течением времени, поэтому скорость будет отрицательной (потому что это обратная скорость). Таким образом, если перед переменной поставить знак минус, решение будет иметь положительную скорость.
Химические реакции сильно различаются по скорости, с которой они происходят. Некоторые из них сверхбыстрые, в то время как другим могут потребоваться миллионы лет, чтобы достичь равновесия.
Некоторые из них сверхбыстрые, в то время как другим могут потребоваться миллионы лет, чтобы достичь равновесия.
Определение скорости реакции
Скорость реакции для данной химической реакции является мерой изменения концентрации реагентов или изменения концентрации продуктов в единицу времени. Скорость химической реакции можно определить как изменение концентрации вещества, деленное на интервал времени, в течение которого наблюдается это изменение:
\[ \text{скорость}=\dfrac{\Delta \text{концентрация}}{\Delta \text{время}} \label{2-1}\]
Для реакции вида \(A + B \rightarrow C\), скорость может быть выражена через изменение концентрации любого из ее компонентов
\[\text{rate}=-\dfrac{\Delta [A]}{\Delta t} \]
\[\text{rate}=-\dfrac{\Delta [B]}{\Delta t}\]
\[\text{rate}=\dfrac{\Delta [C]}{\ Delta t}\]
где \(Δ[A]\) — разница между концентрациями \(A\) за интервал времени \(t_2 – t_1\):
\[ \Delta [A] = [A]_2 – [A]_1 \label{2-2}\]
Обратите внимание на знаки минус в первых двух примерах выше. Концентрация реагента всегда уменьшается со временем, поэтому \(\Delta [A]\) и \(\Delta [A]\) оба отрицательны. Поскольку отрицательные скорости не имеют особого смысла, скорости, выраженные в терминах концентрации реагента, равны , всегда перед ставится знак минус, чтобы скорость была положительной.
Концентрация реагента всегда уменьшается со временем, поэтому \(\Delta [A]\) и \(\Delta [A]\) оба отрицательны. Поскольку отрицательные скорости не имеют особого смысла, скорости, выраженные в терминах концентрации реагента, равны , всегда перед ставится знак минус, чтобы скорость была положительной.
Рассмотрим теперь реакцию, в которой коэффициенты различны:
\[A + 3B \rightarrow 2D\]
Понятно, что \([B]\) убывает в три раза быстрее, чем \([A]\), поэтому во избежание двусмысленности при выражении скорости в по разным компонентам принято делить каждое изменение концентрации на соответствующий коэффициент:
\[\text{rate}= -\dfrac{\Delta [A]}{\Delta t} = -\dfrac{\ Delta [B]}{3\Delta t} = \dfrac{\Delta [D]}{2\Delta t} \label{2-3}\]
Пример \(\PageIndex{1}\): Окисление аммиака
При окислении аммиака
\[\ce{4 Nh4 + 3O2 -> 2 N2 + 6 h3O}\]
установлено, что скорость образования N 2 составляет 0,27 моль л –1 с –1 .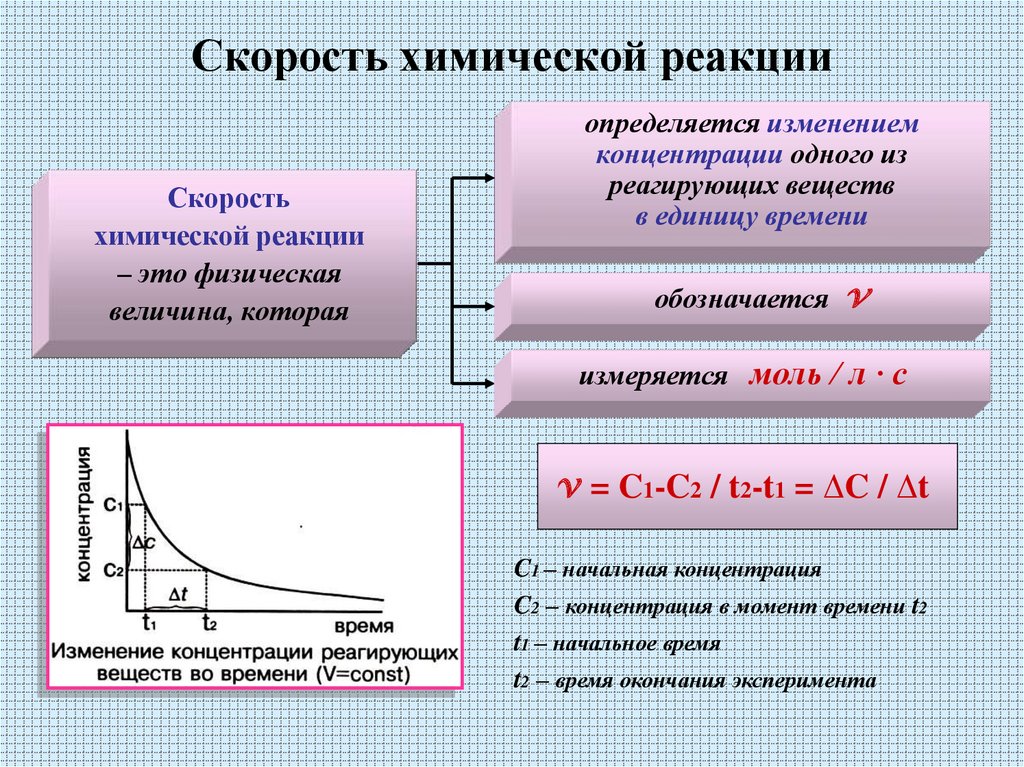
- С какой скоростью образовывалась вода?
- С какой скоростью расходовался аммиак?
а) Из уравнения стехиометрии Δ[H 2 O] = 6/2 Δ[N 2 ], поэтому скорость образования H 2 O is
3 × (0,27 моль л –1 с –1 ) = 0,81 моль л –1 с –1 .
б) на каждые 2 моля образовавшегося N 2 расходуется 4 моля NH 3 , поэтому скорость исчезновения аммиака составляет = 0,54 моль л –1 с –1 .
Комментарий : Из-за того, как сформулирован этот вопрос, было бы приемлемо выразить это последнее значение как отрицательное число.
Мгновенные скорости
Большинство реакций замедляются по мере расходования реагентов. Следовательно, скорости, даваемые приведенными выше выражениями, имеют тенденцию терять свое значение при измерении на более длительных интервалах времени Δ t .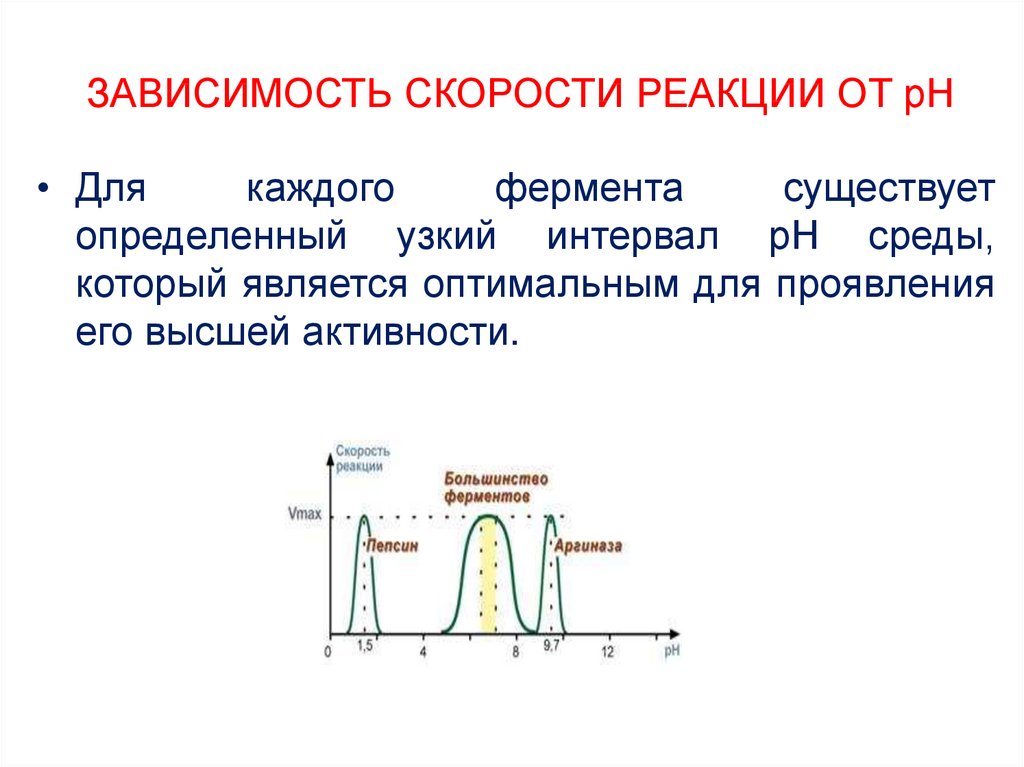 Примечание. Мгновенные ставки также известны как дифференциальные ставки.
Примечание. Мгновенные ставки также известны как дифференциальные ставки.
Таким образом, для реакции, протекание которой показано здесь, фактическая скорость (измеряемая увеличением концентрации продукта) постоянно меняется, достигая наибольшего значения в нулевой момент времени. мгновенная скорость реакции определяется наклоном касательной к кривой зависимости концентрации от времени.
Мгновенная скорость, полученная в начале реакции (t = 0), известна как начальная скорость (метка (1) здесь). Как мы вскоре увидим, начальные скорости играют важную роль в изучении кинетики реакций. Если вы изучали дифференциальное исчисление, то знаете, что эти наклоны касательных представляют собой 90 130 производных 90 131, значения которых могут различаться в каждой точке кривой, так что эти мгновенные скорости на самом деле равны предельные скорости определяются как
\[ \text{rate} = \lim_{\Delta t \rightarrow 0} \dfrac{-[A]}{\Delta T}\]
Если вы не знаете исчисления, иметь в виду, что чем больше временной интервал Δ t , тем меньшей будет точность мгновенной скорости.
Законы скорости и константы скорости
Закон скорости – это выражение, связывающее скорость реакции с константой скорости и концентрациями реагентов. Константа скорости \(k\) является константой пропорциональности для данной реакции. Общий закон скорости обычно выражается как: 9t \label{2}\]
Как видно из уравнения \ref{2} выше, скорость реакции зависит от концентрации реагентов, а также от константы скорости. Однако есть и другие факторы, влияющие на скорость реакции. Эти факторы включают температуру и катализаторы. Когда вы можете написать уравнение закона скорости для определенной реакции, вы можете определить порядок реакции на основе значений s и t.
Порядок реакции
Скорость реакции для данной реакции является важным инструментом, который позволяет нам рассчитать конкретный порядок реакции. Порядок реакции важен, поскольку он позволяет нам легко и эффективно классифицировать конкретные химические реакции. Знание порядка реакции позволяет быстро понять многочисленные факторы реакции, включая закон скорости, единицы константы скорости, период полураспада и многое другое.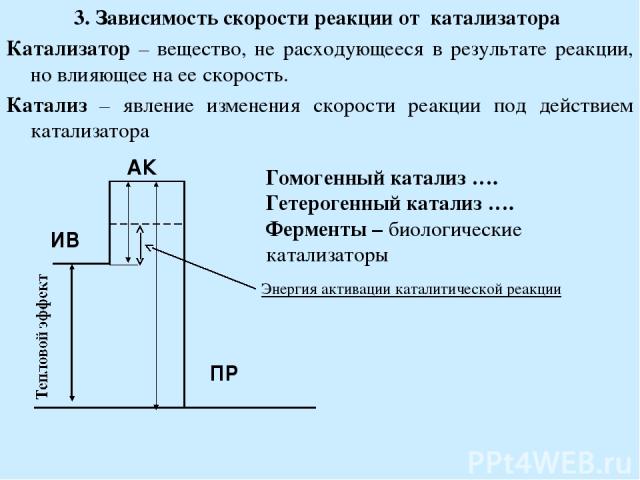
\[ \text{Порядок реакции} = s + t \label{5}\]
Важно отметить, что хотя порядок реакции можно определить из закона скорости, существует в общем, нет связи между порядком реакции и стехиометрическими коэффициентами в химическом уравнении.
ПРИМЕЧАНИЕ. Скорость реакции должна быть неотрицательной. Он может быть равен нулю и не обязательно должен быть целым числом.
Как показано в уравнении \ref{5}, полный порядок реакции равен сумме «s» и «t». Но что означает каждая из этих переменных? Каждая переменная представляет порядок реакции по отношению к реагенту, к которому она относится. В этой конкретной ситуации s — это порядок реакции по [A], а t — порядок реакции по [B].
Вот пример того, как вы можете посмотреть на это : Если порядок реакции по отношению к [A] равен 2 (s = 2), а [B] равен 1 (t = 1), то это в основном означает, что концентрация реагента A уменьшается в 2 раза, а концентрация [B] уменьшается в 1 раз.
Итак, если у вас нулевой порядок реакции (т. ), это в основном означает, что концентрация реагентов не влияет на скорость реакции. Вы можете удалить или добавить реагенты в смесь, но скорость не изменится.
Список различных уравнений скорости реакции для реакций нулевого, первого и второго порядка можно увидеть в таблице \(\PageIndex{1}\). Эта таблица также включает дополнительные уравнения, которые можно определить с помощью этого уравнения, если известен порядок реакции (период полураспада, интегральный закон скорости и т. д.).
| Закон об интегрированных ставках | \(\ {[A]_t} = \ {-kt + [A]_0}\) | \(\ {ln[A]_t} = \ {-kt + ln[A]_0}\) | \(\dfrac{1}{[A]_t} = +kt + \dfrac{1}{[A]_0} \) |
| Единицы постоянной скорости (k): | \(\ {моль л^{-1} с^{-1}}\) 9{-1}}\) | ||
| Линейный график для определения (k): | \([A] \) в зависимости от времени | \(\ln [A] \) в зависимости от времени | \(\dfrac{1}{[A]}\) в зависимости от времени |
| Отношение постоянной скорости к наклону прямой: | \(\ {наклон} = \ {-k}\) | \(\ {наклон} = \ {-k}\) | \(\ {наклон} = \ {k}\) |
| Период полураспада: | \(\dfrac{[A]_0}{2k}\) | \(\dfrac{\ln2}{k}\) | \(\dfrac{1}{k[A]_0}\) |
Примеры задач
1. Определите скорость реакции
Определите скорость реакции
2. ВЕРНО или НЕВЕРНО: изменения температуры или введение катализатора повлияют на константу скорости реакции
Для примеров задач 3-6 используйте Формула 6 для ответов на вопросы
\[ H_2O \longrightarrow 2H_2+ O_2 \label{6} \]
* Предположим, что реакция протекает при постоянной температуре
3. Для приведенной выше реакции сформулируйте закон скорости.
4. Укажите общий порядок реакции.
5. Найдите скорость, если k = 1,14 x 10 -2 и [H 2 O] = 2,04M
6. Найдите период полураспада реакции.
Ответы
1. Скорость реакции является мерой изменения концентрации исчезновения реагентов или изменения концентрации появления продуктов в единицу времени.
2. НЕВЕРНО. Константа скорости не зависит от присутствия катализатора. Однако катализаторы могут влиять на общую скорость реакции.
3. \(\ {Скорость} = \ {k[H_2O]}\)
4. Первый порядок
Первый порядок
5. 2,33 x 10 -2 с -1
6,60,8 с (t1/2 = ln 2 / k = ln 2 / 1,14 x 10 -2 = 60,8 с). CA: Университетские научные книги,
Авторы и авторство
2. 5: Reaction Rate распространяется по незаявленной лицензии и был создан, изменен и/или курирован LibreTexts.
5: Reaction Rate распространяется по незаявленной лицензии и был создан, изменен и/или курирован LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
Химия. Скорости реакций
Скорость реакции — мощный диагностический инструмент. Узнав, как быстро производятся продукты и что вызывает замедление реакции, мы можем разработать методы улучшения производства. Эта информация необходима для крупномасштабного производства многих химикатов, включая удобрения, лекарства и предметы домашнего обихода.
Эта информация необходима для крупномасштабного производства многих химикатов, включая удобрения, лекарства и предметы домашнего обихода.
Введение | Видео | В фокусе | Подкаст | Заключение | Следующие шаги |
Как мы контролируем скорость реакции?
Во-первых, важно понять, что такое скорость реакции. Когда происходит реакция, молекулы сталкиваются друг с другом с достаточной энергией, чтобы реагенты расщеплялись или превращались в новый вид, известный как продукт (часто существует более одного продукта). Таким образом, скорость реакции фактически представляет собой скорость образования продукта, а также скорость, с которой расходуется реагент. Поскольку реакции требуют, чтобы молекулы преодолели определенный энергетический барьер, чтобы успешно столкнуться, скорость реакции часто указывает, адекватны ли условия для этого. Например, низкая скорость реакции может указывать на то, что не так много столкновений происходит с достаточной силой, чтобы разорвать химические связи реагентов, поэтому продукт производится не так быстро. Если это известно, производители могут найти лучший способ увеличить количество успешных столкновений молекул, чтобы увеличить выход.
Например, низкая скорость реакции может указывать на то, что не так много столкновений происходит с достаточной силой, чтобы разорвать химические связи реагентов, поэтому продукт производится не так быстро. Если это известно, производители могут найти лучший способ увеличить количество успешных столкновений молекул, чтобы увеличить выход.
Итак, важно уметь измерять скорость реакции, но как мы это делаем? Было бы очень сложно контролировать производство или использование конкретного химического вещества, поскольку реакции часто представляют собой запутанную смесь, но довольно часто мы можем наблюдать очевидные побочные эффекты, которые легко измерить. Например, экзотермическая реакция может выделять тепло, и мы можем отслеживать изменение температуры с течением времени. Другие реакции, такие как добавление соляной кислоты к образцу магния, производят газообразный водород. Это производит шипение (шикарное слово для пузырей!). Пузырьки можно легко подсчитать, и сравнение количества пузырьков, образующихся за заданное время, когда вы меняете другой аспект реакции, такой как температура или концентрация кислоты, позволяет нам увидеть, как изменяется скорость реакции.
Еще один распространенный эксперимент уровня А, с которым вы можете столкнуться, — это часы с йодом. На этот раз за реакцией следят, записывая, сколько времени требуется, чтобы увидеть, как раствор меняет цвет, и это объясняется в видео ниже. Важно убедиться, что все в экспериментах одинаково, за исключением переменной, которую вы меняете, в данном случае концентрации тиосульфата, чтобы предотвратить ложные результаты. Может помочь работа в парах: один человек нажимает на таймер, а другой запускает реакцию, чтобы вы могли запускать часы в одном и том же месте для каждого эксперимента.
Зачем нам знать скорость реакции?
Скорость реакции
Уравнения скорости реакции
Это то, что заставляет всех нервничать; уравнения! Они могут выглядеть сложными и иногда напоминать совершенно другой язык, но на самом деле они очень полезны. Они позволяют нам выяснить, какие реагенты ответственны за скорость реакции, из очень простых экспериментальных измерений, таких как упомянутые выше.
Во время экзамена или в классе вам могут дать таблицу данных, показывающую, как изменяется скорость реакции при изменении концентрации каждого из реагентов. Из этой информации мы можем составить уравнение скорости.
Уравнения скорости принимают форму:
k – константа скорости. Это значение, которое говорит нам, насколько быстрой или медленной является реакция. Поскольку на скорость реакции может влиять ряд переменных, таких как температура или концентрация реагента, константа скорости также будет варьироваться. Все, что заключено в квадратные скобки ([]), просто означает, что мы имеем в виду концентрацию реагента в скобках, в данном случае концентрацию А и В. Последние две буквы, m и n, даны как степени концентрации . Числа, которые заменяют m и n, показывают, как скорость зависит от отдельного реагента. Это известно как порядок реакции для этого вида.
Если скорость реакции не меняется при изменении концентрации А, то мы знаем, что скорость не зависит от А.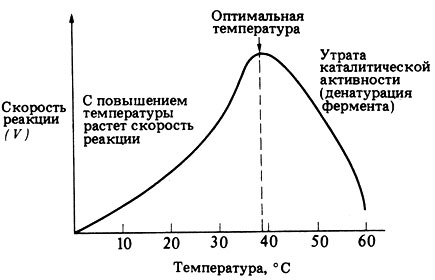 В этом случае мы можем записать m равным нулю и сказать, что порядок относительно А равен нулю. Все, что находится в нулевой степени, равно единице, поэтому мы можем удалить его, поскольку мы просто умножаем остальную часть уравнения скорости на единицу. Это легко!
В этом случае мы можем записать m равным нулю и сказать, что порядок относительно А равен нулю. Все, что находится в нулевой степени, равно единице, поэтому мы можем удалить его, поскольку мы просто умножаем остальную часть уравнения скорости на единицу. Это легко!
Для реакций первого порядка m равно единице. Поскольку A в степени 1, мы можем просто написать [A]. На практике это означает, что по мере увеличения концентрации А скорость реакции будет увеличиваться в той же пропорции, например, если вы удвоите количество А, скорость также удвоится. Тот же принцип применяется к реакции второго порядка, но на этот раз m равно 2, поэтому, если вы удвоите A, вы получите в два раза больше исходного количества A в степени 2, а 22 равно 4. Таким образом, если вы удвоите A, скорость реакции увеличится в четыре раза.
Отлично, А сделано, а Б? Что ж, удобно, это то же самое, что облегчает жизнь всем! Вам никогда не будет предложено заказать более двух реагентов, и если реагентов больше двух, не беспокойтесь, просто добавьте их, как вы сделали с A и B.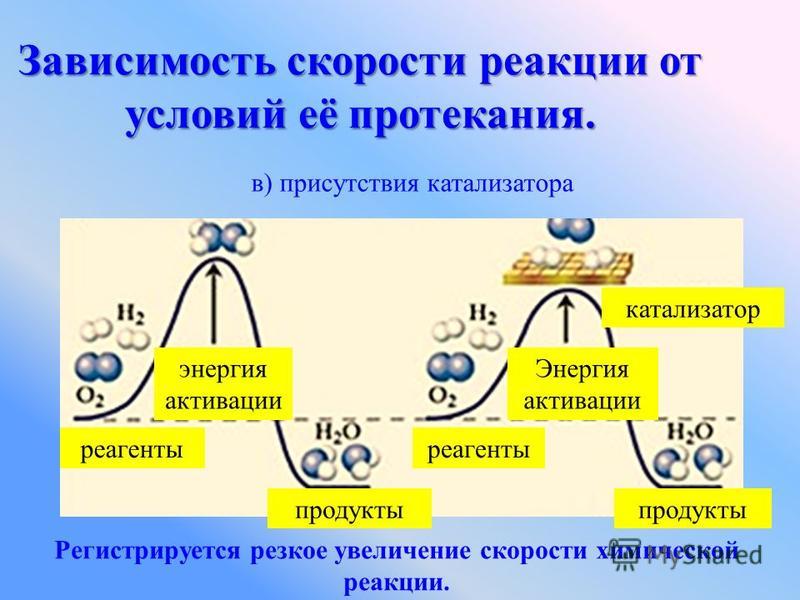
Лабораторные признания
В подкасте Labor Confessions исследователи рассказывают о своем лабораторном опыте в контексте практических оценок уровня A. В этом эпизоде мы рассмотрим подходящее оборудование для записи измерений и измерения скорости реакции методами непрерывного мониторинга и начальной скорости.
Скорости реакции в промышленности
Способность интерпретировать данные о скорости реакции необходима во многих областях производства и исследований. Одним из наиболее важных отраслевых приложений является процесс Хабера, который вы, возможно, изучали на GCSE или A Level. Это включает преобразование газообразного азота и водорода в аммиак, а аммиак имеет широкий спектр применений от чистящих средств до оружия.

 ..
..