«Железо и его соединения» — открытый урок по химии в 9 классе | Методическая разработка по химии (9 класс) по теме:
Урок «Железо и его соединения» подготовлен для 9 класса и проводится при изучении темы «Металлы и их соединения». В работе используется учебник «Химия-9» Новошинского И.Н. и Новошинской Н.С.
Урок разработан в форме исследования с целью получения новых знаний с использованием проблемного и дифференцированного подхода. Форма урока выбрана не случайно. Проблема использования железа и его соединений, их свойств достаточно сложна, но посильна для девятиклассников. Учитель направляет с помощью вопросов, заданий мысль учащихся, приводит к осуществлению вывода о необходимости теоретических знаний для объяснений различных природных явлений.
Основная цель урока – в процессе исследования изучить физические и химические свойства железа и его соединений, дать представление о роли железа и его соединений в жизни человека.
Содержание урока включает не только химический, но и исторический, биологический компоненты, которые соотнесены с интересами и возрастными особенностями детей.
На уроке планируется продолжить развитие умений и навыков проведения химического эксперимента, познавательного интереса к предмету. Для решения этой задачи на уроке запланировано проведение лабораторного эксперимента. Урок должен продолжить формирование бережного отношения к окружающей среде.
В процессе проведения урока учитель использует демонстрационный эксперимент:
Демонстрационный эксперимент:
№ 1.Взаимодействие железа с серой.
№ 2. Взаимодействие железа с соляной кислотой.
№ 3.Взаимодействие железа с раствором медного купороса.
№ 4. Взаимодействие сульфата железа (II) с гидроксидом натрия.
Лабораторный эксперимент:
Лабораторныйопыт 13. КАЧЕСТВЕННЫЕ РЕАКЦИИНА ДВУХ- И ТРЕХЗАРЯДНЫЕ ИОНЫ ЖЕЛЕЗА.
Оборудование: химическое оборудование и реактивы: растворы медного купороса, сульфата железа (II) и хлорида железа (III),соляной кислоты, гидроксида натрия, роданида калия; железо (3,5 г), сера (2 г), железный гвоздь на нитке; минералы — магнетит, гематит, лимонит, пирит.
Место проведения урока: кабинет химии.
Девиз урока: «Железо не только основа всего мира, самый главный металл окружающей нас природы, оно — основа культуры и промышленности, оно орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества» (А.Е.Ферсман).
Основная цель урока – в процессе исследования изучить физические и химические свойства железа и его соединений, дать представление о роли железа и его соединений в жизни человека.
Содержание урока включает не только химический, но и исторический, биологический компоненты, которые соотнесены с интересами и возрастными особенностями детей.
На уроке планируется продолжить развитие умений и навыков проведения химического эксперимента, познавательного интереса к предмету. Для решения этой задачи на уроке запланировано проведение лабораторного эксперимента.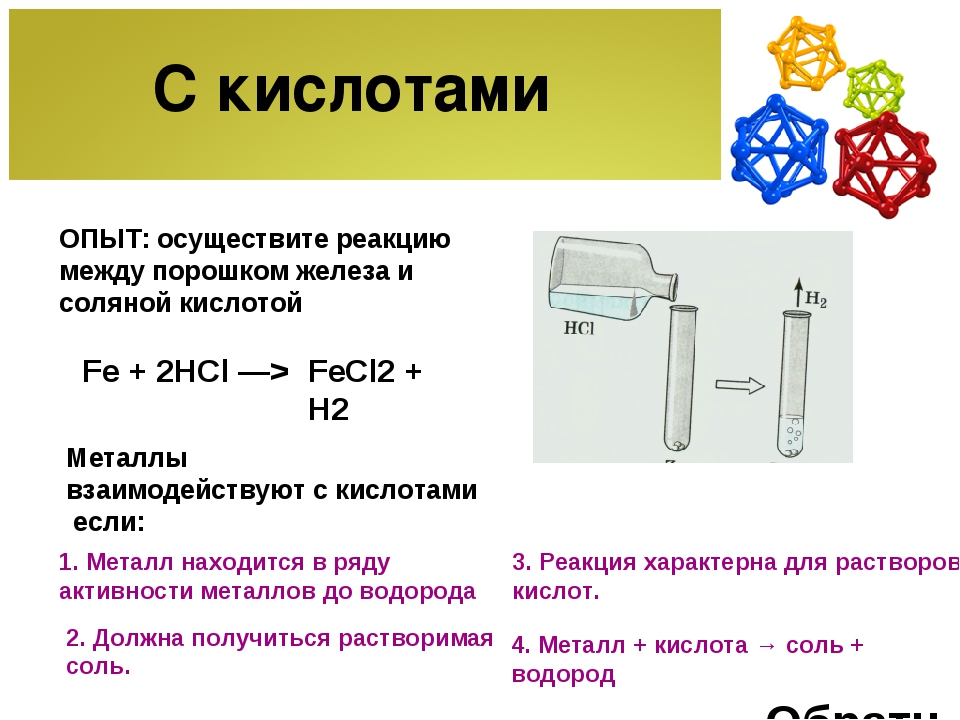 Урок должен продолжить формирование бережного отношения к окружающей среде.
Урок должен продолжить формирование бережного отношения к окружающей среде.
В процессе проведения урока учитель использует демонстрационный эксперимент:
Демонстрационный эксперимент:
№ 1.Взаимодействие железа с серой.
№ 2. Взаимодействие железа с соляной кислотой.
№ 3.Взаимодействие железа с раствором медного купороса.
№ 4. Взаимодействие сульфата железа (II) с гидроксидом натрия.
Лабораторный эксперимент:
Лабораторныйопыт 13. КАЧЕСТВЕННЫЕ РЕАКЦИИНА ДВУХ- И ТРЕХЗАРЯДНЫЕ ИОНЫ ЖЕЛЕЗА.
Оборудование: химическое оборудование и реактивы: растворы медного купороса, сульфата железа (II) и хлорида железа (III),соляной кислоты, гидроксида натрия, роданида калия; железо (3,5 г), сера (2 г), железный гвоздь на нитке; минералы — магнетит, гематит, лимонит, пирит.
Место проведения урока: кабинет химии.
Девиз урока: «Железо не только основа всего мира, самый главный металл окружающей нас природы, оно — основа культуры и промышленности, оно орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества» (А.Е.Ферсман).
И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества» (А.Е.Ферсман).
Железо — общая характеристика элемента, химические свойства железа и его соединений
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Обозначается символом Fe (лат. Ferrum). Один из самых распространённых в земной коре металлов (второе место после алюминия). Металл средней активности, восстановитель.
Основные степени окисления — +2, +3
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.
Химические свойства простого вещества — железа:
Ржавление и горение в кислороде
1) На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe + 3O2 + 6H2 O → 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа (II, III):
3Fe + 2O2 → Fe3O4
3Fe+2O2→(Fe IIFe2III)O4 (160 °С)
2) При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t°→ Fe3O4 + 4H2
3) Железо реагирует с неметаллами при нагревании:
2Fe+3Cl2→2FeCl3 (200 °С)
2Fe + 3Br2 –t°→ 2FeBr3
Fe + S –t°→ FeS (600 °С)
Fe+2S → Fe+2(S2-1) (700°С)
4) В ряду напряжений стоит левее водорода, реагирует с разбавленными кислотами НСl и Н2SO4, при этом образуются соли железа(II) и выделяется водород:
Fe + 2HCl → FeCl2 + H2 (реакции проводятся без доступа воздуха, иначе Fe+2 постепенно переводится кислородом в Fe+3 )
Fe + H2SO4(разб. ) → FeSO4 + H2
) → FeSO4 + H2
В концентрированных кислотах–окислителях железо растворяется только при нагревании, оно сразу переходит в катион Fе
2Fe + 6H2SO4(конц.) –t°→ Fe2(SO4)3 + 3SO2 + 6H2O
Fe + 6HNO3(конц.) –t°→ Fe(NO3)3 + 3NO2 + 3H2O
(на холоде концентрированные азотная и серная кислоты пассивируют железо).
Железный гвоздь, погруженный в голубоватый раствор медного купороса, постепенно покрывается налетом красной металлической меди
5) Железо вытесняет металлы, стоящие правее его в ряду напряжений из растворов их солей.
Fe + CuSO4 → FeSO4 + Cu
6)
Амфотерность железа проявляется только в концентрированных щелочах при кипячении:
Fе + 2NaОН (50 %) + 2Н2O= Nа2[Fе(ОН)4]↓+ Н2↑
и образуется осадок тетрагидроксоферрата(II) натрия.
Техническое железо — сплавы железа с углеродом: чугун содержит 2,06-6,67 % С, сталь 0,02-2,06 % С, часто присутствуют другие естественные примеси (S, Р, Si) и вводимые искусственно специальные добавки (Мn, Ni, Сr), что придает сплавам железа технически полезные свойства — твердость, термическую и коррозионную стойкость, ковкость и др.
Доменный процесс производства чугуна
Доменный процесс производства чугуна составляют следующие стадии:
а) подготовка (обжиг) сульфидных и карбонатных руд — перевод в оксидную руду:
FeS2→Fe2O3 (O2,800°С, -SO2) FeCO3→Fe2O3 (O2,500-600°С, -CO2)
б) сжигание кокса при горячем дутье:
С(кокс) + O2 (воздух) →СO2 (600—700°С) СO2 + С(кокс)
в) восстановление оксидной руды угарным газом СО последовательно:
Fe2O3→(CO) (FeIIFe2III)O4→(CO) FeO→(CO) Fe
г) науглероживание железа (до 6,67 % С) и расплавление чугуна:
Fе(т)→(C(кокс) 900—1200°С)Fе(ж) (чугун, t пл 1145°С)
В чугуне всегда в виде зерен присутствуют цементит Fe2С и графит.
Производство стали
Передел чугуна в сталь проводится в специальных печах (конвертерных, мартеновских, электрических), отличающихся способом обогрева; температура процесса 1700-2000 °С. Продувание воздуха, обогащенного кислородом, приводит к выгоранию из чугуна избыточного углерода, а также серы, фосфора и кремния в виде оксидов. При этом оксиды либо улавливаются в виде отходящих газов (СО 2, SО2), либо связываются в легко отделяемый шлак — смесь Са3(РO4)2 и СаSiO3. Для получения специальных сталей в печь вводят легирующие добавки других металлов.
Получение чистого железа в промышленности — электролиз раствора солей железа, например:
FеСl2→ Fе↓ + Сl2↑ (90°С) (электролиз)
(существуют и другие специальные методы, в том числе восстановление оксидов железа водородом).
Чистое железо применяется в производстве специальных сплавов, при изготовлении сердечников электромагнитов и трансформаторов, чугун — в производстве литья и стали, сталь — как конструкционный и инструментальный материалы, в том числе износо-, жаро- и коррозионно-стойкие.
Оксид железа(II) FеО
4FеО ⇌(FeIIFe2 III) + Fе (560—700 °С , 900—1000°С)
FеО + 2НС1 (разб.) = FеС12 + Н2O
FеО + 4НNO3 (конц.) = Fе(NO3)3 +NO2↑ + 2Н2O
FеО + 4NаОН =2Н2O + Nа4FеO3(красн.) триоксоферрат(II) (400—500 °С)
FеО + Н2 =Н2O + Fе (особо чистое) (350°С)
FеО + С(кокс) = Fе + СО (выше 1000 °С)
FеО + СО = Fе + СO2 (900°С)
4FеО + 2Н2O(влага) + O2(воздух) →4FеО(ОН) (t)
6FеО + O2 = 2(FeIIFe2III )O4 (300—500°С)
Получение в лаборатории: термическое разложение соединений железа (II) без доступа воздуха:
Fе(ОН)2 = FеО + Н2O (150-200 °С)
FеСОз = FеО + СO2 (490-550 °С)
Оксид дижелеза (III) – железа(II) (FeIIFe2III )O4 . Двойной оксид. Черный, имеет ионное строение Fe2+(Fе3+)2(O2-)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций:
Двойной оксид. Черный, имеет ионное строение Fe2+(Fе3+)2(O2-)4. Термически устойчив до высоких температур. Не реагирует с водой. Разлагается кислотами. Восстанавливается водородом, раскаленным железом. Участвует в доменном процессе производства чугуна. Применяется как компонент минеральных красок (железный сурик), керамики, цветного цемента. Продукт специального окисления поверхности стальных изделий (чернение, воронение). По составу отвечает коричневой ржавчине и темной окалине на железе. Применение брутто-формулы Fe3O4 не рекомендуется. Уравнения важнейших реакций:
2(FeIIFe2 III )O4 = 6FеО + O2 (выше 1538 °С)
(FeIIFe2III )O4 + 8НС1 (разб.) = FеС12 + 2FеС13 + 4Н2O
(FeIIFe2III )O4 +10НNO3 (конц. ) =3Fе(NO3)3 + NO2↑+ 5Н2O
) =3Fе(NO3)3 + NO2↑+ 5Н2O
(FeIIFe2III )O4 + O2 (воздух) = 6Fе2O3 (450-600°С)
(FeIIFe2III )O4 + 4Н2 = 4Н2O + 3Fе (особо чистое, 1000 °С)
(FeIIFe2III )O4 + СО =ЗFеО + СO2 (500—800°C)
(FeIIFe2 III )O4 + Fе ⇌4FеО (900—1000 °С , 560—700 °С)
Получение: сгорание железа (см.) на воздухе.
В природе — оксидная руда железа магнетит.
Оксид железа(III) Fе2О3. Амфотерный оксид с преобладанием основных свойств. Красно-коричневый, имеет ионное строение (Fе 3+)2(O2-)3. Термически устойчив до высоких температур. Не образуется при сгорании железа на воздухе. Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fе2O3 nН2О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с
Не реагирует с водой, из раствора выпадает бурый аморфный гидрат Fе2O3 nН2О. Медленно реагирует с кислотами и щелочами. Восстанавливается монооксидом углерода, расплавленным железом. Сплавляется с
Соляная кислота и её соли
I. Физические свойства
Cоляная кислота (также хлороводородная, хлористоводородная кислота, хлористый водород) — раствор хлороводорода в воде, сильная одноосновная кислота. Бесцветная, прозрачная, едкая жидкость, «дымящая» на воздухе (техническая соляная кислота желтоватого цвета из-за примесей железа, хлора и пр.). В концентрации около 0,5 % присутствует в желудке человека. Максимальная концентрация при 20 °C равна 38% по массе, плотность такого раствора 1,19 г/см³. Молярная масса 36,46 г/моль.
Опыт: “Дымящая соляная кислота”
II. Получение соляной кислоты
Опыт: “Получение соляной кислоты”
III. Химические свойства
Химические свойства
Опыт «Свойства дымящей соляной кислоты»
Опыт: “Действие соляной кислоты на различные вещества”
Раствор хлороводорода в воде — соляная кислота — сильная кислота:
1) Взаимодействие соляной кислоты с металлами, стоящими в ряду напряжений до водорода:
2Al + 6HCl → 2AlCl3 + 3H2
Интерактив: “Взаимодействие соляной кислоты с металлами”
2) Взаимодействие соляной кислоты с оксидами металлов:
MgO + 2HCl → MgCl2 + H2O
3) Взаимодействие соляной кислоты с основаниями и аммиаком:
HCl + KOH → KCl + H2O
Опыт: “Взаимодействие гидроксида натрия с соляной кислотой”
3HCl + Al(OH)3 → AlCl3 + 3H2O
HCl + NH3 → NH4Cl
4) Взаимодействие соляной кислотыс солями:
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
HCl + AgNO3 → AgCl↓ + HNO3
Анимация: “Качественная реакция на соляную кислоту и ее соли”
Образование белого осадка хлорида серебра — AgCl, нерастворимого в минеральных кислотах используется в качестве качественной реакции для обнаружения анионов Cl— в растворе.
Хлориды металлов — соли соляной кислоты, их получают взаимодействием металлов с хлором или реакциями соляной кислоты с металлами, их оксидами и гидроксидами; путем обмена с некоторыми солями
2Fe + 3Cl2 → 2FeCl3
Mg + 2HCl → MgCl2 + H2
CaO + 2HCl → CaCl2 + H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Pb(NO3)2 + 2HCl → PbCl2↓ + 2HNO3
Большинство хлоридов растворимы в воде (за исключением хлоридов серебра, свинца и одновалентной ртути).
IV. Применение соляной кислоты и ее солей
1. Соляная кислота входит в состав желудочного сока и способствует перевариванию белковой пищи у человека и животных.
2. Хлороводород и соляная кислота используются для производства лекарств, красителей, растворителей, пластмасс.
3. Применение основных солей соляной кислоты:
KCl (Рис. 1. Сильвинит) — удобрение, используется также в стекольной и химической промышленности.
1. Сильвинит) — удобрение, используется также в стекольной и химической промышленности.
Рис.1. Сильвинит
HgCl2 (Рис.2. Сулема) — яд, используется для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
Рис.2. Сулема
Hg2Cl2 (Рис.3. Каломель) – не ядовита, слабительное средство.
Рис.3. Каломель
NaCl — поваренная соль — сырье для производства соляной кислоты, гидроксида натрия, водорода, хлора, хлорной извести, соды. Применяется в кожевенной и мыловаренной промышленности, в кулинарии и консервировании.
ZnCl2— для пропитки древесины против гниения, в медицине, при паянии.
AgCl — применяется в черно-белой фотографии, так как обладает светочувствительностью — разлагается на свету с образованием свободного серебра:
2AgCl = 2Ag + Cl2
V. Задания для повторения и закрепления
Задание №1
Осуществите превращения по схеме:
HCl -> Cl2 -> AlCl3 — > Al(OH)3 -> Al2O3 -> AlCl3 -> Cl2
Задание №2
Расставьте коэффициенты методом электронного баланса в следующей реакции
HCl + KClO3 -> KCl + H2O + Cl2
Укажите окислитель и восстановитель; процессы окисления и восстановления.
Задание №3
Даны вещества:
Zn, Cu, Al, MgO, SiO2, Fe2O3, NaOH, Al(OH)3, Fe2(SO4)3, CaCO3, Fe(NO3)3
Какие из указанных веществ будут реагировать с соляной кислотой. Составьте уравнения химических реакций.
Задание №4
Решите задачу:
Какое количество алюминия прореагирует с избытком соляной кислоты для получения 5,6 л водорода (н.у.)?
VI. Тренажеры
Тренажёр №1 — Взаимодействие металлов с соляной кислотой
Тренажёр №2 — Взаимодействие оксидов металлов с соляной кислотой
ЦОРы
Опыт: “Дымящая соляная кислота”
Видео:“Получение соляной кислоты”
Опыт: «Свойства дымящей соляной кислоты»
Опыт: “Действие соляной кислоты на различные вещества”
Опыт:«Взаимодействие соляной кислоты с металлами»
Интерактив: “Взаимодействие соляной кислоты с металлами”
Опыт: «Взаимодействие соляной кислоты с оксидами металлов»
Опыт: “Взаимодействие гидроксида натрия с соляной кислотой”
Анимация: “Качественная реакция на соляную кислоту и ее соли”
Соляная кислота, химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Производство и нейтрализация HCl в желудочно-кишечном тракте
На этой диаграмме показано, как соляная кислота выводится в желудок в обмен на образование бикарбоната в крови. Образовавшийся бикарбонат затем поглощается из крови поджелудочной железой и выводится в тонкий кишечник с секретами поджелудочной железы, где нейтрализует HCl, попавшую в просвет двенадцатиперстной кишки при опорожнении желудка. Любая преграда желудочного или сычужного оттока (например, расширение заворота желудка у собак или смещение сычуга влево или вправо у жвачных) или рвота желудочным содержимым у мелких животных будут препятствовать попаданию HCl в двенадцатиперстную кишку, и вырабатываемый желудком бикарбонат в крови не будет нейтрализован. при гипохлоремии и метаболическом алкалозе (повышенное содержание бикарбоната в крови).Выделения из желудка / сычуга также могут содержать натрий и калий, что также приводит к потере этих электролитов (в гораздо меньшей степени, чем HCl).
1. Желудок: В париетальных клетках желудка водород и бикарбонат образуются из воды и углекислого газа (который свободно проникает в клетки из крови) с помощью карбоангидразы. Водород активно откачивается в просвет желудка через насос АТФазы водорода / калия на поверхности просвета. Хлорид также выходит в просвет желудка вместе с калием или натрием и соединяется с водородом, образуя соляную кислоту.Хлорид получается париетальной клеткой из крови и обменивается с бикарбонатом (генерируемым карбоангидразой) через базолатеральный хлорид / бикарбонатный обменник (энергия для которого поступает от базолатерального натриево-калиевого насоса). Большая часть натрия и калия резорбируется париетальными клетками. Таким образом, кровь, покидающая желудок, «богата» бикарбонатом.
2. Кишечник: При нормальном функционировании желудка секретируемый Hcl попадает в двенадцатиперстную кишку при опорожнении желудка.Экзокринные клетки поджелудочной железы поглощают бикарбонат из крови, покидающей желудок, в обмен на хлорид. Затем бикарбонат активно выводится с секретом поджелудочной железы. Как только они попадают в просвет двенадцатиперстной кишки, бикарбонат нейтрализует водород в соляной кислоте, образуя угольную кислоту, затем воду и диоксид углерода, и высвободившийся хлорид резорбируется.
Затем бикарбонат активно выводится с секретом поджелудочной железы. Как только они попадают в просвет двенадцатиперстной кишки, бикарбонат нейтрализует водород в соляной кислоте, образуя угольную кислоту, затем воду и диоксид углерода, и высвободившийся хлорид резорбируется.
Таким образом, бикарбонат «генерируется» в кровеносных сосудах желудка и «извлекается» в сосудах поджелудочной железы, что приводит к нейтральному pH крови, покидающей двенадцатиперстную кишку.Точно так же хлорид «извлекается» из крови в желудке и «возвращается» в кровь в двенадцатиперстной кишке. Неспособность организма нейтрализовать соляную кислоту приводит к задержке бикарбоната в крови (с одновременной потерей хлорида) и метаболическому алкалозу. Обратите внимание, рвота дуоденальным содержимым (содержащим секрецию, богатую бикарбонатом поджелудочной железы) приводит к ацидозу с гиперхлоремической потерей бикарбоната.
Предыдущее изображение Следующее изображение
Морская вода содержит примерно 1-3 частей на миллиард железа.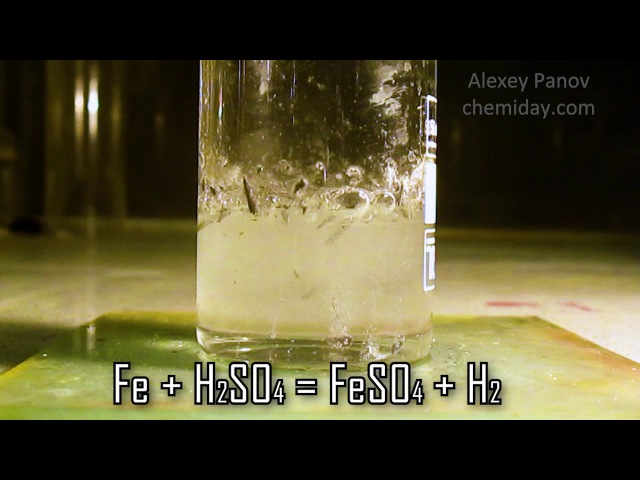 Количество сильно варьируется, и оно разное в Атлантическом и Тихом океане. Реки содержат примерно 0,5–1 частей на миллион железа, а грунтовые воды — 100 частей на миллион. Питьевая вода не может содержать более 200 частей на миллиард железа. Количество сильно варьируется, и оно разное в Атлантическом и Тихом океане. Реки содержат примерно 0,5–1 частей на миллион железа, а грунтовые воды — 100 частей на миллион. Питьевая вода не может содержать более 200 частей на миллиард железа. Большинство водорослей содержат от 20 до 200 частей на миллион железа, а некоторые бурые водоросли могут накапливать до 4000 частей на миллион. Фактор биоконцентрации водорослей в морской воде составляет примерно 10 4 — 10 5 . Морская рыба содержит примерно 10-90 частей на миллион, а ткани устриц — примерно 195 частей на миллион железа (все они представляют собой сухую массу). Растворенное железо в основном присутствует в виде Fe (OH) 2 + (водн.) В кислых и нейтральных, богатых кислородом условиях. В условиях недостатка кислорода он в основном встречается в виде двойного железа. Железо входит в состав многих органических и неорганических хелатирующих комплексов, которые обычно растворимы в воде.  Железо явно не изменяется в чистой воде или в сухом воздухе, но когда присутствуют и вода, и кислород (влажный воздух), железо подвергается коррозии.Его серебристый цвет меняется на красновато-коричневый из-за образования гидратированных оксидов. Растворенные электролиты ускоряют механизм реакции, который выглядит следующим образом: 4 Fe + 3 O 2 + 6 H 2 O -> 4 Fe 3+ + 12 OH — -> 4 Fe (OH) 3 или 4 FeO (OH) + 4 H 2 O Обычно оксидный слой не защищает железо от дальнейшей коррозии, а удаляется, чтобы образовалось больше оксидов металлов. Электролиты в основном представляют собой сульфат железа (II), который образуется при коррозии атмосферным SO 2 .В морских регионах важную роль в этом процессе могут играть частицы атмосферной соли. Элементарное железо растворяется в воде при нормальных условиях. Основными минералами железа, встречающимися в природе, являются магнетит, гематит, гетит и сидерит. Железо является диетической потребностью большинства организмов и играет важную роль в естественных процессах в бинарной и третичной форме.Окисленное третичное железо не может применяться организмами свободно, за исключением очень низких значений pH. Тем не менее, железо обычно находится в этой обычно нерастворимой в воде форме. Общее количество железа в организме человека составляет около 4 г, из которых 70% содержится в красных красителях крови. Удаление железа из воды в основном осуществляется при приготовлении питьевой воды, так как минеральная вода содержит большое количество ионов железа. Литература и другие элементы и их взаимодействие с водой |
Содержание железа в соляной кислоте
Не лекционный зал! — круглый стол с местом для вас.
60000 тем за 36 лет, образование, алоха и развлечения
тема 28861
Непрерывное обсуждение с 2004 по 2015 год.. .
2004 г.Q. Привет,
Мы используем травильный бак с соляной кислотой, чтобы протравить звено цепи перед нанесением цинка. процентное содержание кислоты в воде составляет от 14 до 17 процентов. Тест на содержание железа, который я провожу на баке с кислотой, дает примерную цифру 3,3%.
Мой вопрос в том, какое количество железа в баке слишком много и когда мне следует его изменить или сбросить, чтобы вернуть его ниже указанного числа. Что это за число, которое я слышал 4 и вплоть до 7%, пожалуйста, дайте мне хорошее представление о том, когда кислота начинает портиться после того, как содержание железа повышается до?
Спасибо,
Фрэнк Олексизвено цепи — Даллас, Техас
2004
А. Джентльмен,
Джентльмен,
Конечно, увеличение содержания железа увеличивает время травления из-за ингибирования. Как правило, необходимо зафиксировать 26 граммов на литр железа в травильной ванне для ее утилизации.
Shankara Narayanan N— Бангалор, Карнатака, Индия
2004
A. При цинковании возможно травление в железо-кислотном (соляная кислота с содержанием железа до 180-200 г / л), в зависимости от температуры травления. Фактически это становится травлением хлоридом железа.Хлорид железа растворяет оксиды железа лучше, чем кислота с низким содержанием железа. Большим преимуществом является то, что травление можно использовать гораздо дольше, и можно даже продавать старую травильную кислоту как хлорид железа. Это уже практика в Западной Европе!
Дольф ван ден Берг
— Леусден, Нидерланды
2004
A. Как сказал Дольф, содержание Fe не является проблемой. Мы начинаем наши «новые» резервуары примерно с 12% HCl, и это сделано примерно из 30% старой кислоты, чтобы содержание Fe было достаточно высоким! (Баланс воды) Мы доводим нашу кислоту до 220 граммов на литр хлорида железа, при этом содержание HCl составляет всего 1%. При этом он все еще хорошо солится.
При этом он все еще хорошо солится.
Crithwood Ltd.
Вестфилд, Шотландия, Великобритания
2005 г.
В. Я понимаю, что можно мариновать при таком повышенном уровне железа (180-200 грамм / литр), но насколько медленнее скорость травления, чем при более низких концентрациях железа около 30-50 граммов / литр?
Фил Шок— Кантон, Огайо
Анализ концентрации железа в ванне с HCl
2005 г.В. Какой метод анализа вы используете для определения концентрации железа в ваших ваннах?
Карла Джонс— Фредериксбург, Вирджиния
2005 г.
А.Мы используем метод титрования для проверки концентрации как кислоты, так и железа. Наш кислотный титрант — это карбонат натрия / гидроксид натрия. Наш титрант железа — это дихромат калия.
Фил Шок— Кантон, Огайо
Анализ концентрации железа и HCl в травильной ванне
8 августа 2012 г. В. Я хочу измерить точную концентрацию HCl в травильной кислоте, которая используется для травления стали.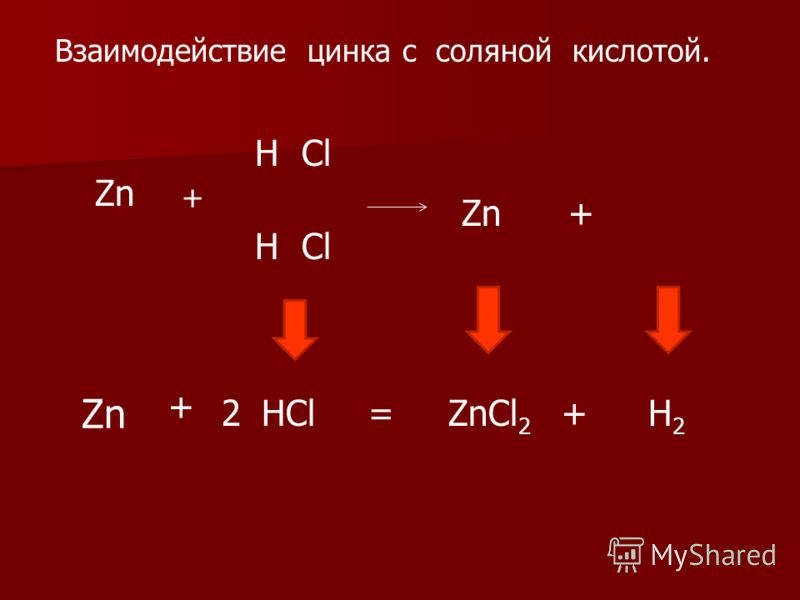 Я провел титрование образца травильной кислоты карбонатом натрия с использованием индикатора метилового оранжевого, он меняет цвет от красного до оранжевого в качестве конечной точки, но проблема в том, что цвет не может быть четко определен, поскольку трудно различить конечную точку красно-оранжевого цвета.
Я провел титрование образца травильной кислоты карбонатом натрия с использованием индикатора метилового оранжевого, он меняет цвет от красного до оранжевого в качестве конечной точки, но проблема в том, что цвет не может быть четко определен, поскольку трудно различить конечную точку красно-оранжевого цвета.
Обычно, когда я титрую 0,5 M раствор HCl 0,1 N раствором карбоната натрия, используя индикатор метилового оранжевого в конечной точке, цвет исчезает, поэтому в этом случае я могу легко различить конечную точку, пожалуйста, скажите мне, какой индикатор мне следует использовать так что я могу получить четко видимую конечную точку для определения концентрации HCl в травильной кислоте для стали.
Или какова наиболее точная или стандартная процедура для определения концентрации HCl и содержания железа в ванне для травления стали с HCl.
Каковы процедуры / методы лаборатории для измерения концентрации соляной кислоты (HCl) и содержания железа (Fe) в пробах травильной кислоты сталелитейной промышленности?
— Карачи, Пакистан
13 августа 2012 г.

A. Уважаемый Ахтар,
Мы используем метиловый апельсин в качестве индикатора при титровании для измерения% HCl в травильных ваннах и гидроксид натрия 1 N в качестве титранта в этом случае. Если в ванне для травления растворено много железа, конечной точкой является исчезновение красного цвета и появление зеленого осадка (железа) и образца светло-желтого цвета…
А для железа мы используем перманганат калия 0,1 Н. Это неселективно, если у вас есть окисляемые вещества в растворе, вы измеряете его как железо, и у вас будет избыточная разница. Но для качественного анализа полезно знать, можно ли использовать травильную ванну или ее нужно сбрасывать как отходы.
Надеюсь, это будет полезно. С уважением,
Daniel MontanesПроизводитель самосверлящих креплений — Буэнос-Айрес
15 августа 2012 г.
A. Да, эту конечную точку очень трудно увидеть.У меня есть два предложения:
1) Используйте очень маленький индикатор. 3 капли — это много.
2) Быстро титровать. Изменение цвета не очень резкое, и если вы сильно промахнетесь, вы всегда можете повторить его.
Изменение цвета не очень резкое, и если вы сильно промахнетесь, вы всегда можете повторить его.
Дэйв Уичерн
Консультант — Бронкс, Нью-Йорк
13 декабря 2012
В. Сэр,
Каков безопасный и точный процесс лабораторного анализа для определения содержания Fe в HCl?
Сколько железа в 20% HCl?
— Джамшедпур, Джаркханд, Индия
25 июня 2013 г.
А.Аналитическая процедура определения содержания железа в ВАННАХ С ВОДОХЛОРНОЙ КИСЛОТОЙ,
Возьмите 1 мл раствора для ванны, добавьте 50 мл D.M.WATER, добавьте 10 мл 50% серной кислоты для титрования с 0,1 н. Перманганатом калия. Конечная точка — от бесцветного до светло-розового цвета.
ЧТЕНИЕ БЮРЕТЫ * 5,56 = ——— г / л содержания железа
A.S.J. ПЕТР— Бангалор, Индия
27 апреля 2015
В. Я просто хотел спросить ваш совет о сроке службы травильной ванны. Исторически сложилось так, что мы всегда обновляли кислотный раствор обычно через 2 года или около того.
Когда уровень кислоты падает примерно до 70 г / л (7%), а содержание железа составляет около 25 г / л, мы обычно утилизируем и обновляем. Наш раствор не нагревается, и у нас есть один промывочный резервуар после травильного резервуара. Большую часть времени мы оцинковываем стальные профили длиной 3 м, и перед травлением сталь преимущественно очищается от ржавчины.
Итак, после прочтения вышеупомянутых сообщений я теперь думаю, что мы можем использовать наши травильные резервуары с более высоким уровнем железа и не утилизировать и обновлять так часто, как мы это делали. Мои вопросы:
С какими проблемами мы можем столкнуться, если мы это сделаем? Я читал, что мы можем столкнуться с сокращением времени травления, а также с увеличением образования шлака в ванне с цинком.Кто-нибудь может подтвердить, чего мы можем ожидать, если мы оценили уровень железа в 100 г / л или выше?
Фил РудландLegrand — Скарборо, Великобритания
21 мая 2015 г.
Q. В нашей компании мы соблюдаем множество процедур, одна из которых касается свободной кислотности (% HCl) травильных растворов.

 Многие соединения железа обладают этой характеристикой. Встречающиеся в природе оксид железа, гидроксид железа, карбид железа и пентакарбонил железа нерастворимы в воде. Растворимость в воде некоторых соединений железа увеличивается при более низких значениях pH.
Многие соединения железа обладают этой характеристикой. Встречающиеся в природе оксид железа, гидроксид железа, карбид железа и пентакарбонил железа нерастворимы в воде. Растворимость в воде некоторых соединений железа увеличивается при более низких значениях pH. Процессы выветривания выпускают элемент в воду. И минеральная вода, и питьевая вода содержат карбонат железа. В глубоководных районах вода часто содержит осколки железа размером с кулак, марганец и небольшое количество извести, диоксида кремния и органических соединений.
Процессы выветривания выпускают элемент в воду. И минеральная вода, и питьевая вода содержат карбонат железа. В глубоководных районах вода часто содержит осколки железа размером с кулак, марганец и небольшое количество извести, диоксида кремния и органических соединений. 
 Растворимость в соленой воде чрезвычайно низкая.
Растворимость в соленой воде чрезвычайно низкая.  Растения, которые используются в качестве корма для животных, могут содержать до 1000 частей на миллион железа, но это количество намного ниже в растениях, используемых для потребления человеком. Обычно растения содержат от 20 до 300 частей на миллион железа (сухая масса), но лишайники могут содержать до 5,5% железа. Когда в почве содержится мало железа или мало растворимого в воде железа, у растений могут возникнуть проблемы с ростом.Поглощающая способность растений сильно различается и зависит не только от концентрации железа в почве, но также от значений pH, концентрации фосфатов и конкуренции между железом и другими тяжелыми металлами. Известковые почвы часто испытывают дефицит железа, даже когда присутствует достаточное количество железа. Это связано с обычно высоким значением pH, которое приводит к осаждению железа.
Растения, которые используются в качестве корма для животных, могут содержать до 1000 частей на миллион железа, но это количество намного ниже в растениях, используемых для потребления человеком. Обычно растения содержат от 20 до 300 частей на миллион железа (сухая масса), но лишайники могут содержать до 5,5% железа. Когда в почве содержится мало железа или мало растворимого в воде железа, у растений могут возникнуть проблемы с ростом.Поглощающая способность растений сильно различается и зависит не только от концентрации железа в почве, но также от значений pH, концентрации фосфатов и конкуренции между железом и другими тяжелыми металлами. Известковые почвы часто испытывают дефицит железа, даже когда присутствует достаточное количество железа. Это связано с обычно высоким значением pH, которое приводит к осаждению железа.  Растения могут поглощать нерастворимые в воде соединения железа, выделяя ионы H + , вызывая его растворение. Микроорганизмы выделяют сидерохром железа, который напрямую усваивается растениями.
Растения могут поглощать нерастворимые в воде соединения железа, выделяя ионы H + , вызывая его растворение. Микроорганизмы выделяют сидерохром железа, который напрямую усваивается растениями.  Железо является диетической потребностью человека, как и многих других организмов. Мужчинам требуется около 7 мг железа в день, а женщинам — 11 мг. Разница определяется менструальными циклами. Когда люди кормят нормально, эти количества можно получить быстро. Организм усваивает примерно 25% всего железа, содержащегося в пище. Когда у кого-то дефицит железа, потребление железа в корме можно увеличить с помощью таблеток витамина С, потому что этот витамин восстанавливает третичное железо до бинарного железа. Фосфаты и фитаты уменьшают количество бинарного железа.
Железо является диетической потребностью человека, как и многих других организмов. Мужчинам требуется около 7 мг железа в день, а женщинам — 11 мг. Разница определяется менструальными циклами. Когда люди кормят нормально, эти количества можно получить быстро. Организм усваивает примерно 25% всего железа, содержащегося в пище. Когда у кого-то дефицит железа, потребление железа в корме можно увеличить с помощью таблеток витамина С, потому что этот витамин восстанавливает третичное железо до бинарного железа. Фосфаты и фитаты уменьшают количество бинарного железа. Железо входит в состав нескольких основных ферментов и участвует в синтезе ДНК. Нормальные функции мозга зависят от железа.
Железо входит в состав нескольких основных ферментов и участвует в синтезе ДНК. Нормальные функции мозга зависят от железа. Это может повредить эти жизненно важные органы. Здоровые люди, как правило, не подвержены передозировке железа, что также бывает редко.Это может произойти при употреблении воды с концентрацией железа более 200 частей на миллион.
Это может повредить эти жизненно важные органы. Здоровые люди, как правило, не подвержены передозировке железа, что также бывает редко.Это может произойти при употреблении воды с концентрацией железа более 200 частей на миллион.  Они влияют на цвет, запах и мутность воды.
Они влияют на цвет, запах и мутность воды.  Одним из примеров является применение сульфата железа для удаления фосфатов.
Одним из примеров является применение сульфата железа для удаления фосфатов.