Взаимодействие атомов элементов-неметаллов — Персональный сайт учителя химии Куликовой Надежды Владимировны
Взаимодействие атомов элементов-неметаллов между собой
I. Классификация химических связей
1. По механизму образования химической связи
а) обменный, когда оба атома, образующие связь, предоставляют для неё неспаренные электроны.
Например, образование молекул водорода Н2 и хлора Cl2:
б) донорно – акцепторный, когда один из атомов предоставляет для образования связи готовую пару электронов (донор), а второй атом – пустую свободную орбиталь.
Например, образование иона аммония (Nh5)+ (заряженная частица):
2. По способу перекрывания электронных орбиталей
а) σ — связь (сигма), когда максимум перекрывания лежит на линии, соединяющей центры атомов.
Например,
h3 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
б) π — связи (пи), если максимум перекрывания не лежит на линии, соединяющей центры атомов.
3. По способу достижения завершенной электронной оболочки
Каждый атом стремится завершить свою внешнюю электронную оболочку, при этом способов достижения такого состояния может быть несколько.
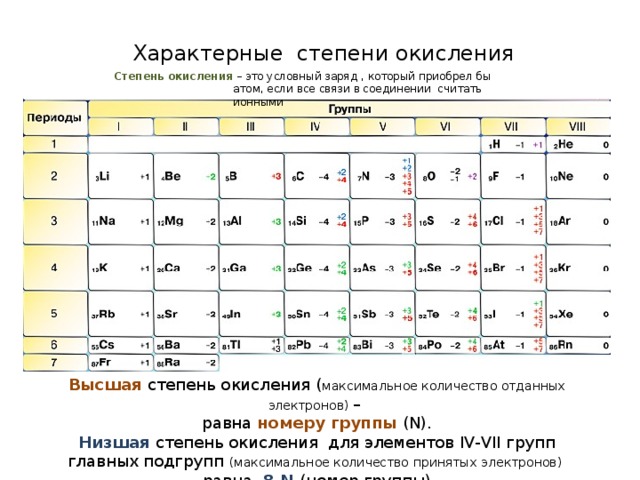
Признак сравнения | Ковалентная | Ионная | Металлическая | |
неполярная | полярная | |||
Как достигается завершенная электронная оболочка ? | Обобществление электронов | Обобществление электронов | Полная передача электронов, образование ионов (заряженных частиц). | Обобществление электронов всеми атомами в крист. решетке |
| Какие атомы участвуют? | немет – немет ЭО = ЭО | 1) Немет-Немет1
2)Мет–немет ЭО < ЭО | мет +[немет]- ЭО << ЭО | В узлах находятся катионы и атомы металла. |
∆c= ЭО1 – ЭО2 | 0 | < 1,7 | > 1,7 | 0 |
Примеры | простые вещества – неметаллы. | кислоты, оксиды | соли, щелочи, оксиды щелочных металлов. | простые вещества – металлы. Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке. |
II. Сущность ковалентной связи
Ковалентная связь — это связь, возникающая между атомами за счет образования общих электронных пар (Например, h3, HCl, h3O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
III. Ковалентная неполярная химическая связь
Ковалентная неполярная связь (КНС) — образуют атомы одного и того же химического элемента — неметалла (Например, h3, O2, О3).
Механизм образования связи
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Рассмотрим механизм образования молекулы хлора:
Cl2 – кнс.Электронная схема образования молекулы Cl2:
Структурная формула молекулы Cl2:
σ
Cl – Cl , σ (p – p) — одинарная связь
Демонстрация образования молекулы водорода
Рассмотрим механизм образования молекулы кислорода: О2 – кнс.
Электронная схема образования молекулы О2:
Структурная формула молекулы О2:
σ
О = О
π
В молекуле кратная, двойная связь:
Одна σ (p – p)
и одна π (р – р)
Демонстрация образования молекул кислорода и азота
IV. Задания для закрепления
Задания для закрепления
Задание №1. Определите виды химических связей в молекулах следующих веществ:
h3S, KCl, O2, Na2S, Na2O, N2, Nh4, Ch5, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.
Задание №2. Напишите механизм образования молекул h3S, KCl, O2, Na2S, Na2O, N2, Nh4, Ch5, BaF2, LiCl, CCl4, F2. В случае ковалентной связи определите тип перекрывания электронных облаков (π или σ), а так же механизм образования (обменный или донорно-акцепторный)
Задание №3. Решите ТЕСТ
Взаимодействие атомов элементов неметаллов между собой кратко. «Взаимодействие атомов элементов-неметаллов между собой» (8 класс). Взаимодействие с простыми веществами
Мы уже рассмотрели, как взаимодействуют атомы элементов-металлов с атомами элементов-неметаллов: одни отдают свои внешние электроны и превращаются при этом в положительные ионы, другие принимают электроны и превращаются при этом в отрицательные ионы. Ионы притягиваются друг к другу, образуя ионные соединения.
А как осуществляется связь между атомами элементов-неметаллов, которые имеют сходную тенденцию к присоединению электронов? Рассмотрим вначале, как осуществляется связь между атомами одного и того же химического элемента, например в веществах, имеющих двухатомные молекулы: азота N 2 , водорода Н 2 , хлора С1 2 .
Обратите внимание, что для отражения состава этих веществ с помощью химических знаков также используют индексы.
Два одинаковых атома элемента-неметалла могут объединяться в молекулу только одним способом: обобществив свои внешние электроны, т. е. сделав их общими для обоих атомов.
Рассмотрим, например, образование молекулы фтора F 2 .
Атомы фтора — элемента главной подгруппы VII группы (VIIA группы) Периодической системы химических элементов Д. И. Менделеева — имеют на внешнем энергетическом уровне семь электронов, и каждому атому не хватает до его завершения лишь одного электрона. Внешние электроны атома фтора образуют три электронные пары и один непарный электрон:
Если сближаются два атома и у каждого из них есть по одному внешнему неспаренному электрону, то эти электроны «объединяются» и становятся общими для обоих атомов, у которых тем самым сформируется завершённый внешний восьмиэлектронный уровень.
Образование молекулы фтора изображено на схеме:
Если обозначить общую электронную пару чёрточкой, то запись называют структурной формулой, например структурная формула молекулы фтора
Аналогично молекуле фтора образуется и двухатомная молекула водорода Н 2:
Следует учесть, что завершённым для атома водорода будет двухэлектронный уровень, подобный завершённому уровню атома гелия.
Структурная формула молекулы водорода
Уточним наши представления о ковалентной связи на примере образования молекулы водорода, используя понятие электронного облака (см. § 9). При сближении двух атомов водорода, имеющих по одному s-электронному облаку сферической формы, происходит перекрывание электронных облаков. При этом возникает область (место), где плотность отрицательного заряда наиболее высока и поэтому обладает повышенным отрицательным зарядом. Положительно заряженные ядра притягиваются к ней (это известно из курса физики), и образуется молекула. Таким образом, химическая связь — результат действия электрических сил.
Нужно отметить, что в основе образования ковалентной связи, так же как и при возникновении ионной связи, лежит взаимодействие противоположных зарядов.
В заключение рассмотрим алгоритм рассуждений, необходимых для того, чтобы записать схему образования ковалентной связи, например для молекулы азота N 2 .
1. Азот — это элемент главной подгруппы V группы (VA группы). Его атомы имеют по пять электронов на внешнем уровне. Чтобы определить число неспаренных электронов, воспользуемся формулой:
8 — N = число неспаренных электронов,
где N — номер группы химического элемента.
Следовательно, атомы азота будут иметь (8-5 = 3) три неспаренных электрона.
2. Запишем знаки химических элементов с обозначением внешних электронов так, чтобы неспаренные электроны были обращены к соседнему знаку:
3. Запишем электронную и структурную формулы образовавшейся молекулы:
Если атомы связаны между собой одной общей электронной парой, то такую ковалентную связь называют одинарной, если двумя — двойной, если тремя — тройной.
Чем больше общих электронных пар у атомов в молекуле, тем прочнее связаны они друг с другом и тем меньше расстояние между ядрами атомов, которое называют длиной связи. В молекулах фтора связь одинарная, и длина связи между ядрами атомов составляет 0,14 нанометра (1 нм = 10 -9 м, или 0,000000001 м). В молекулах азота связь тройная, и длина её составляет 0,11 нм. Чтобы разделить молекулу азота на отдельные атомы, необходимо затратить примерно в семь раз больше энергии, чем для разрыва одинарных связей в молекуле фтора.
Ключевые слова и словосочетания
- Атомная, или ковалентная, химическая связь.
- Одинарная, двойная и тройная ковалентные химические связи.
- Длина связи.
- Электронные и структурные формулы.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа.
 Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Все элементы главной подгруппы VII группы (VIIA группы) Периодической системы Д. И. Менделеева (подгруппы фтора) образуют простые вещества, состоящие из двухатомных молекул. Запишите электронную схему образования и структурную формулу таких молекул, пользуясь общим химическим знаком для всей подгруппы Г (галоген).
- Запишите схемы образования химических связей для веществ, состав которых отображают формулами КС1 и С1 2 .
- Сколько неспаренных электронов имеют атомы серы? Какая связь будет в молекулах S 2 ? Запишите схему образования химической связи в молекулах S 2 .
- Расположите в порядке увеличения прочности химической связи вещества с формулами S 2 , Cl 2 , N 2 и обоснуйте правильность своего решения. Как будет изменяться длина связи в молекулах составленного вами ряда?
- Разделите вещества на две группы по типу химической связи: N 2 , Li 2 О, КС1, О 2 , CaF 2 , Н 2 .

I. Классификация химических связей
1. По механизму образования химической связи
а) обменный , когда оба атома, образующие связь, предоставляют для неё неспаренные электроны.
Например, образование молекул водорода Н2 и хлора Cl2:
б) донорно — акцепторный , когда один из атомов предоставляет для образования связи готовую пару электронов (донор), а второй атом — пустую свободную орбиталь.
Например, образование иона аммония (Nh5)+ (заряженная частица):
2. По способу перекрывания электронных орбиталей
а) σ — связь (сигма) , когда максимум перекрывания лежит на линии, соединяющей центры атомов.
Например,
h3 σ(s-s)
Cl2 σ(p-p)
HCl σ(s-p)
б) π — связи (пи) , если максимум перекрывания не лежит на линии, соединяющей центры атомов.
3. По способу достижения завершенной электронной оболочки
Каждый атом стремится завершить свою внешнюю электронную оболочку, при этом способов достижения такого состояния может быть несколько.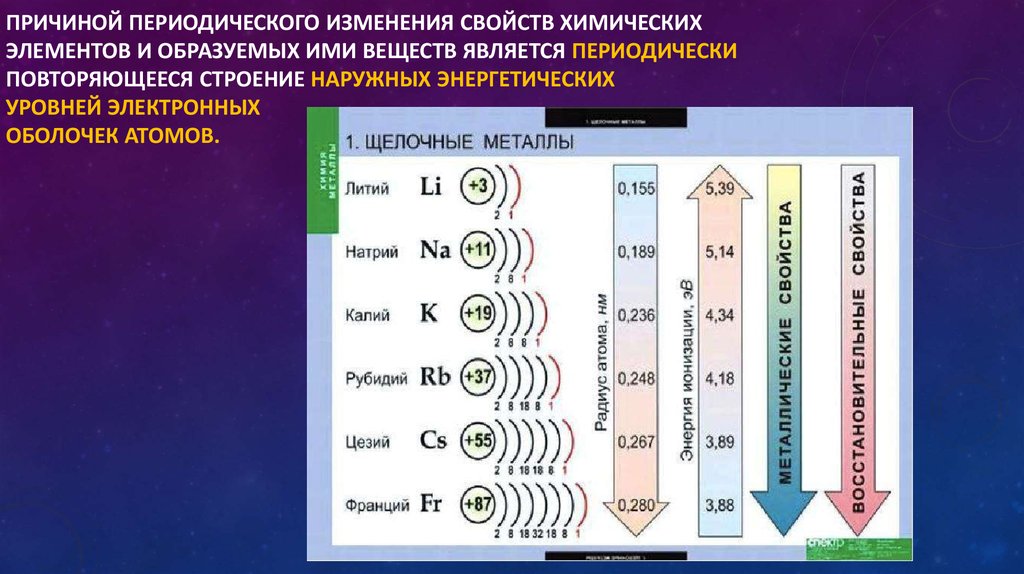
Признак сравнения | Ковалентная | Ионная | Металлическая | |
неполярная | полярная | |||
Как достигается завершенная электронная оболочка? | Обобществление электронов | Обобществление электронов | Полная передача электронов, образование ионов (заряженных частиц). | Обобществление электронов всеми атомами в крист. решетке |
Какие атомы участвуют? | немет — немет ЭО = ЭО | 1) Немет-Немет1 2)Мет-немет ЭО | мет +[немет]- ЭО | В узлах находятся катионы и атомы металла. Связь осуществляют свободно перемещающиеся в межузловом пространстве электроны. |
∆c= ЭО1 — ЭО2 | > 1,7 | |||
Примеры | простые вещества — неметаллы. | кислоты, оксиды | соли, щелочи, оксиды щелочных металлов. | простые вещества — металлы. Связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке. |
II. Сущность ковалентной связи
Ковалентная связь — это связь, возникающая между атомами за счет образования общих электронных пар (Например, h3, HCl, h3O, O2).
По степени смещенности общих электронных пар к одному из связанных ими атомов ковалентная связь может быть полярной и неполярной.
III. Ковалентная неполярная химическая связь
Ковалентная неполярная связь (КНС) — образуют атомы одного и того же химического элемента — неметалла (Например, h3, O2, О3).
Механизм образования связи
Каждый атом неметалла отдает в общее пользование другому атому наружные не спаренные электроны. Образуются общие электронные пары. Электронная пара принадлежит в равной мере обоим атомам.
Рассмотрим механизм образования молекулы хлора: Cl2 — кнс.
Электронная схема образования молекулы Cl2:
Структурная формула молекулы Cl2:
Cl — Cl , σ (p — p) — одинарная связь
Демонстрация образования молекулы водорода
Рассмотрим механизм образования молекулы кислорода: О2 — кнс.
Электронная схема образования молекулы О2:
Структурная формула молекулы О2:
О = О
π
В молекуле кратная, двойная связь:
Одна σ (p — p)
и одна π (р — р)
Демонстрация образования молекул кислорода и азота
IV. Задания для закрепления
Задание №1. Определите виды химических связей в молекулах следующих веществ:
h3S, KCl, O2, Na2S, Na2O, N2, Nh4, Ch5, BaF2, LiCl, O3, CO2, SO3, CCl4, F2.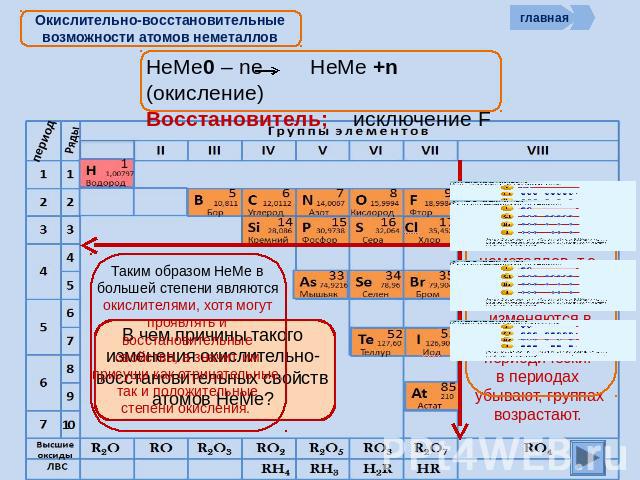
Задание №2. Напишите механизм образования молекул h3S, KCl, O2, Na2S, Na2O, N2, Nh4, Ch5, BaF2, LiCl, CCl4, F2. В случае ковалентной связи определите тип перекрывания электронных облаков (π или σ), а так же механизм образования (обменный или донорно-акцепторный)
Тема: Ковалентная неполярная связь
Задачи:
Сформировать представление о ковалентной связи, в частности ковалентной неполярной связи;
Показать механизм образования ковалентной неполярной связи;
Продолжить развитие умений анализировать, делать выводы;
Воспитывать культуру общения.
Мотивация и целеполагание:
Почему азот или водород существует в виде двухатомных молекул? В процессе беседы осуществляем совместное целеполагание и определяем тему урока.
Изучение нового материала:
Давайте рассмотрим, как образуется химическая связь в молекуле Cl 2.
Атом хлора находится в
VIIA
группе Периодической системы, значит, у него семь электронов на внешнем энергетическом уровне и ему не хватает всего одного электрона для его завершения.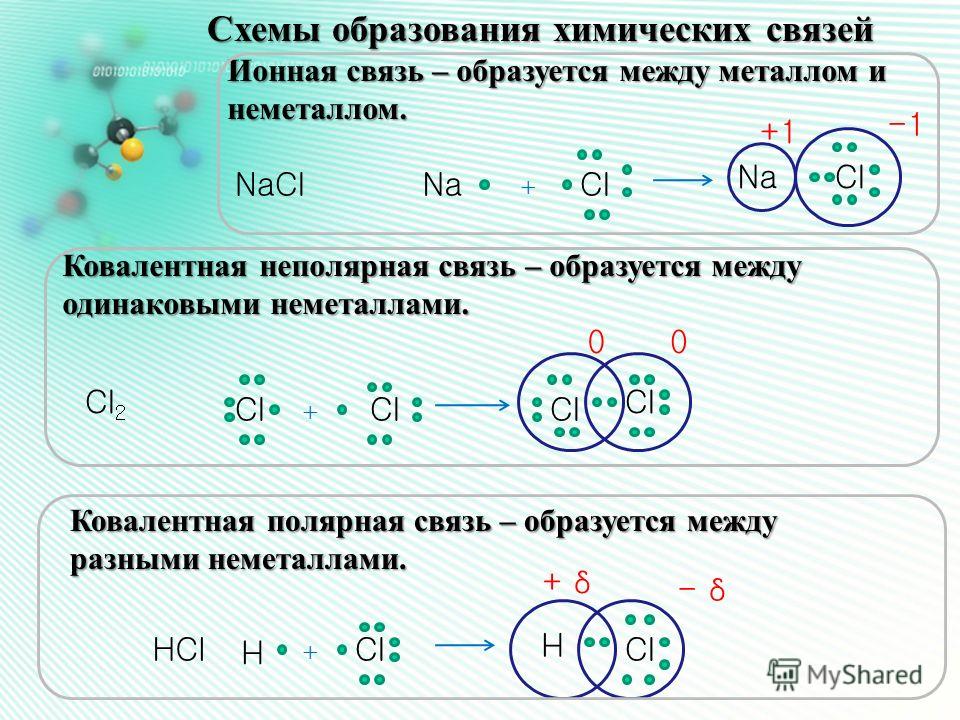 Шесть электронов внешнего уровня образуют пары, а один неспаренный. Два атома хлора, у которых есть по одному неспаренному электрону, сближаются, эти электроны «объединяются» и становятся общими для обоих атомов, уровень при этом становится завершенным – восьми электронным. Общую пару электронов можно обозначить просто черточкой.
Шесть электронов внешнего уровня образуют пары, а один неспаренный. Два атома хлора, у которых есть по одному неспаренному электрону, сближаются, эти электроны «объединяются» и становятся общими для обоих атомов, уровень при этом становится завершенным – восьми электронным. Общую пару электронов можно обозначить просто черточкой.
Поэтому, ковалентная связь, или атомная – это химическая связь, возникающая в результате образования общих электронных пар.
Эта химическая связь образуется между атомами одного и того же неметалла, при этом общие электронные пары, которые образовались, принадлежат обоим атомам в равной степени и ни на одном из них не будет ни избытка, ни недостатка отрицательного заряда, поэтому эта ковалентная связь называется неполярной.
Аналогично, образуется и молекула Н
2.
Однако атом водорода находится в
IA
группе, поэтому у каждого атома водорода только один электрон и до завершения внешнего энергетического уровня ему не хватает всего одного электрона (напомню, что для атомов водорода и гелия уровень считается завершенным, если на нем 2 электрона).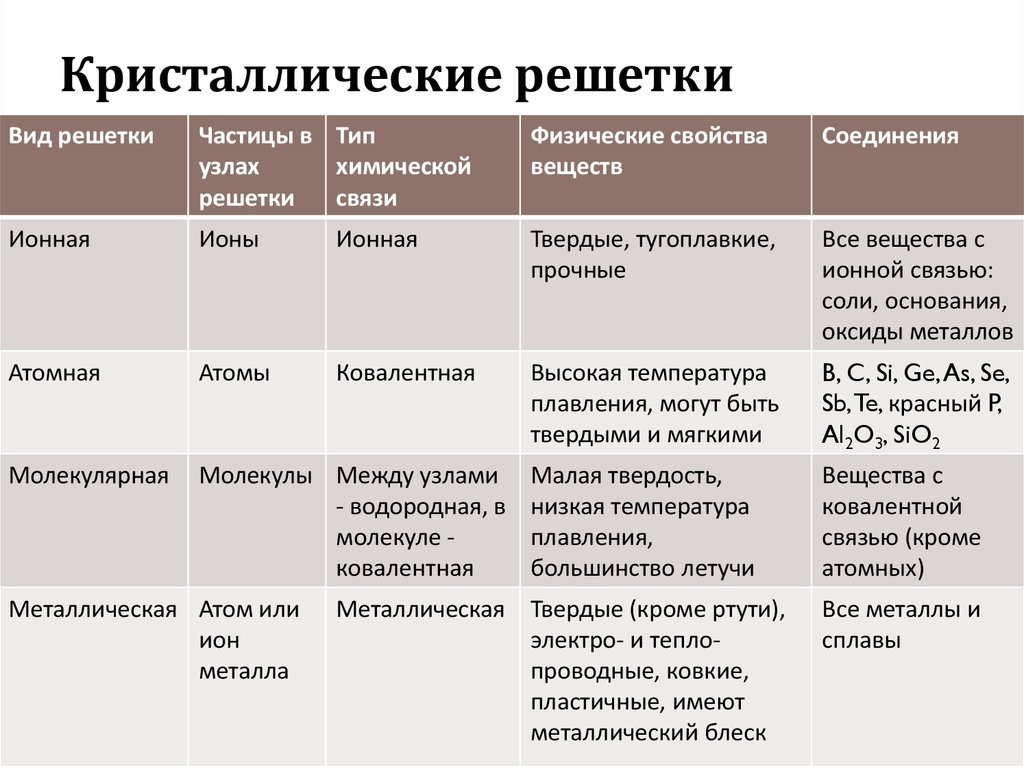 Каждый атом водорода имеет по одному электрону и эти неспаренные электроны объединяются, образуя общую электронную пару, которую также можно обозначить в виде черточки.
Каждый атом водорода имеет по одному электрону и эти неспаренные электроны объединяются, образуя общую электронную пару, которую также можно обозначить в виде черточки.
Кроме того, при сближении двух атомов водорода, каждый из которых имеет по одному s-электронному облаку сферической формы, происходит перекрывание этих электронных облаков. При этом образуется область, где плотность отрицательного заряда велика, положительно заряженные ядра притягиваются к ней, и образуется молекула.
Давайте рассмотрим механизм образования более сложной молекулы О 2 .
Кислород находится в
VIA
группе, следовательно, у него 6 электронов на внешнем уровне. А для того чтобы определить число неспаренных электронов, можно использовать формулу 8 –
N
, где
N
– номер группы. Поэтому у каждого атома кислорода будет по 2 неспаренных электрона, которые и будут участвовать в образовании химической связи. Эти два неспаренных электрона объединяются с двумя другими неспаренными электронами другого атома и образуется две общие электронные пары, что условно можно изобразить в виде двух черточек.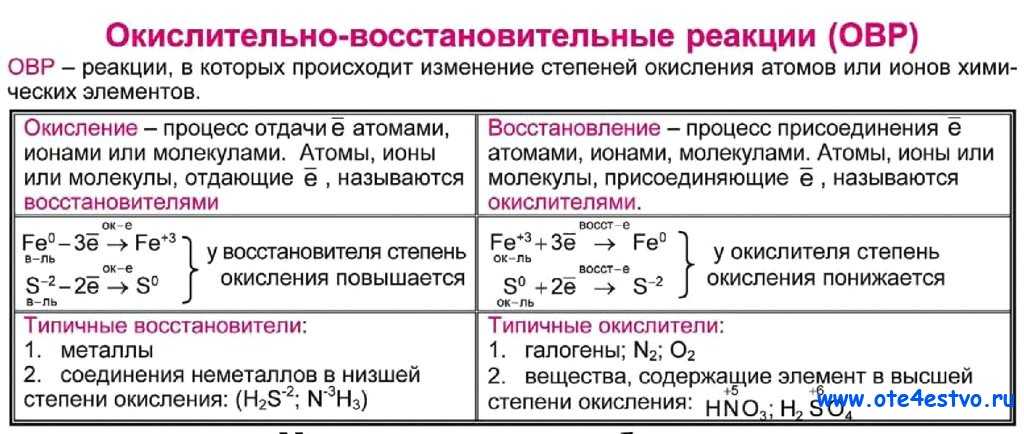
Так как, связь в молекуле кислорода состоит из двух электронных пар, ее называют еще двойной, она будет буде более прочной, чем одинарная, как в молекуле водорода. Но нужно понимать, чем прочнее связь между атомами в молекуле, тем меньше расстояние между ядрами атомов. Это расстояние называется длиной связи. Тройная связь еще короче двойной, но гораздо прочнее. Например, в молекуле азота тройная связь, для того чтобы разделить молекулу на два атома необходимо затратить в семь раз больше энергии, чем для разрыва одинарной связи в молекуле хлора.
Обобщение и систематизация знаний:
Какая химическая связь называется ковалентной?
Между атомами каких элементов образуется ковалентная неполярная связь?
В чем сущность образования ковалентной связи?
Чем одинарная связь отличается от двойной и тройной?
Что показывает длина связи и от чего она зависит?
Закрепление и контроль знаний:
Составьте схемы образования молекул веществ: а) брома; б) фтора; в) азота.
Исключите лишнее из каждого ряда:
а ) CO 2 , NH 3 , P 4 , P 2 O 5 ;
б ) Cl 2 , S, N 2 , CO 2 .
Ответ:
а) P 4 ; б) Cl 2 , S , N 2 . Это вещества с ковалентной неполярной связью.
Выберите вещества с ковалентной неполярной связью:
P 4 , H 2 S, NH 3 , P 2 O 3 , S, N 2 , O 2 , H 2 O, HCl, H 2 .
Ответ: вещества с ковалентной неполярной связью образованы одинаковыми атомами неметаллов, поэтому это будут P 4 , S , N 2 , O 2 , H 2 .
Рефлексия и подведение итогов:
Как вы считаете, как усвоен материал урока? а) отлично; б) хорошо; в) удовлетворительно; г) не усвоен.
Можете ли вы сейчас ответить на вопрос, который мы ставили в начале урока?
Домашнее задание:
I уровень: §11, упр. 1 – 3;
II уровень: тоже + упр. 4, 5.
Ионные и ковалентные связи — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 839
Существует множество типов химических связей и сил, связывающих молекулы вместе.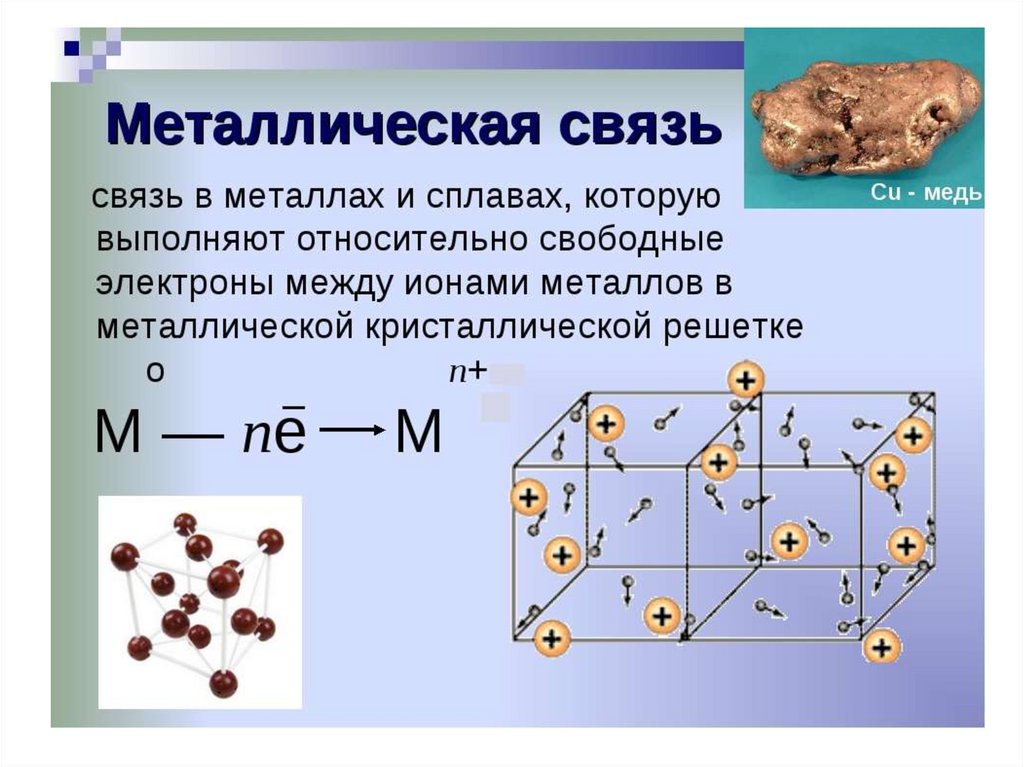 Два самых основных типа связей характеризуются как ионные или ковалентные. При ионной связи атомы передают друг другу электроны. Для ионных связей требуется как минимум один донор электронов и один акцептор электронов. Напротив, атомы с одинаковой электроотрицательностью имеют общие электроны в ковалентных связях, потому что ни один из атомов не притягивает и не отталкивает общие электроны.
Два самых основных типа связей характеризуются как ионные или ковалентные. При ионной связи атомы передают друг другу электроны. Для ионных связей требуется как минимум один донор электронов и один акцептор электронов. Напротив, атомы с одинаковой электроотрицательностью имеют общие электроны в ковалентных связях, потому что ни один из атомов не притягивает и не отталкивает общие электроны.
Введение
Ионная связь представляет собой полный перенос валентных электронов между атомами. Это тип химической связи, при которой образуются два противоположно заряженных иона. В ионных связях металл теряет электроны, становясь положительно заряженным катионом, тогда как неметалл принимает эти электроны, становясь отрицательно заряженным анионом. Ионные связи требуют донора электронов, часто металла, и акцептора электронов, неметалла.
Ионная связь наблюдается потому, что металлы имеют мало электронов на самых внешних орбиталях. Потеряв эти электроны, эти металлы могут достичь конфигурации благородного газа и удовлетворить правилу октета. Точно так же неметаллы, которые имеют около 8 электронов в своих валентных оболочках, склонны легко принимать электроны для достижения конфигурации благородного газа. При ионной связи можно отдать или получить более 1 электрона, чтобы удовлетворить правилу октетов. Заряды аниона и катиона соответствуют количеству отданных или полученных электронов. В ионных связях чистый заряд соединения должен быть равен нулю.
Точно так же неметаллы, которые имеют около 8 электронов в своих валентных оболочках, склонны легко принимать электроны для достижения конфигурации благородного газа. При ионной связи можно отдать или получить более 1 электрона, чтобы удовлетворить правилу октетов. Заряды аниона и катиона соответствуют количеству отданных или полученных электронов. В ионных связях чистый заряд соединения должен быть равен нулю.
Эта молекула натрия отдает одинокий электрон на своей валентной орбитали для достижения конфигурации октета. Это создает положительно заряженный катион из-за потери электрона.
Этот атом хлора получает один электрон для достижения конфигурации октета, что создает отрицательно заряженный анион.
Прогнозируемая общая энергия процесса ионной связи, которая включает энергию ионизации металла и сродство к электрону неметалла, обычно положительна, что указывает на то, что реакция является эндотермической и неблагоприятной. Однако эта реакция весьма благоприятна из-за электростатического притяжения между частицами. При идеальном межатомном расстоянии притяжение между этими частицами высвобождает достаточно энергии, чтобы облегчить реакцию. Большинство ионных соединений склонны диссоциировать в полярных растворителях, потому что они часто являются полярными. Это явление связано с противоположными зарядами каждого иона.
При идеальном межатомном расстоянии притяжение между этими частицами высвобождает достаточно энергии, чтобы облегчить реакцию. Большинство ионных соединений склонны диссоциировать в полярных растворителях, потому что они часто являются полярными. Это явление связано с противоположными зарядами каждого иона.
Пример \(\PageIndex{1}\): Соли хлорида
В этом примере атом натрия отдает свой 1 валентный электрон атому хлора. Это создает катион натрия и анион хлора. Обратите внимание, что суммарный заряд полученного соединения равен 0,
В этом примере атом магния отдает оба своих валентных электрона атомам хлора. Каждый атом хлора может принять только 1 электрон, прежде чем он сможет достичь своей конфигурации благородного газа; следовательно, 2 атома хлора необходимы, чтобы принять 2 электрона, пожертвованных магнием. Обратите внимание, что чистый заряд соединения равен 0,9.0024
Ковалентная связь
Ковалентная связь — это совместное использование электронов между атомами. Этот тип связи возникает между двумя атомами одного и того же элемента или элементов, близких друг к другу в периодической таблице. Эта связь происходит в основном между неметаллами; однако его также можно наблюдать между неметаллами и металлами.
Этот тип связи возникает между двумя атомами одного и того же элемента или элементов, близких друг к другу в периодической таблице. Эта связь происходит в основном между неметаллами; однако его также можно наблюдать между неметаллами и металлами.
Если атомы имеют одинаковую электроотрицательность (одинаковое сродство к электронам), наиболее вероятны ковалентные связи. Поскольку оба атома имеют одинаковое сродство к электронам и ни один из них не склонен отдавать их, они делят электроны, чтобы достичь конфигурации октетов и стать более стабильными. Кроме того, энергия ионизации атома слишком велика, а сродство атома к электрону слишком мало для возникновения ионной связи. Например: углерод не образует ионных связей, потому что у него 4 валентных электрона, половина октета. Для образования ионных связей молекулы углерода должны либо получить, либо потерять 4 электрона. Это крайне неблагоприятно; поэтому молекулы углерода делят свои 4 валентных электрона через одинарные, двойные и тройные связи, так что каждый атом может достигать конфигураций благородного газа.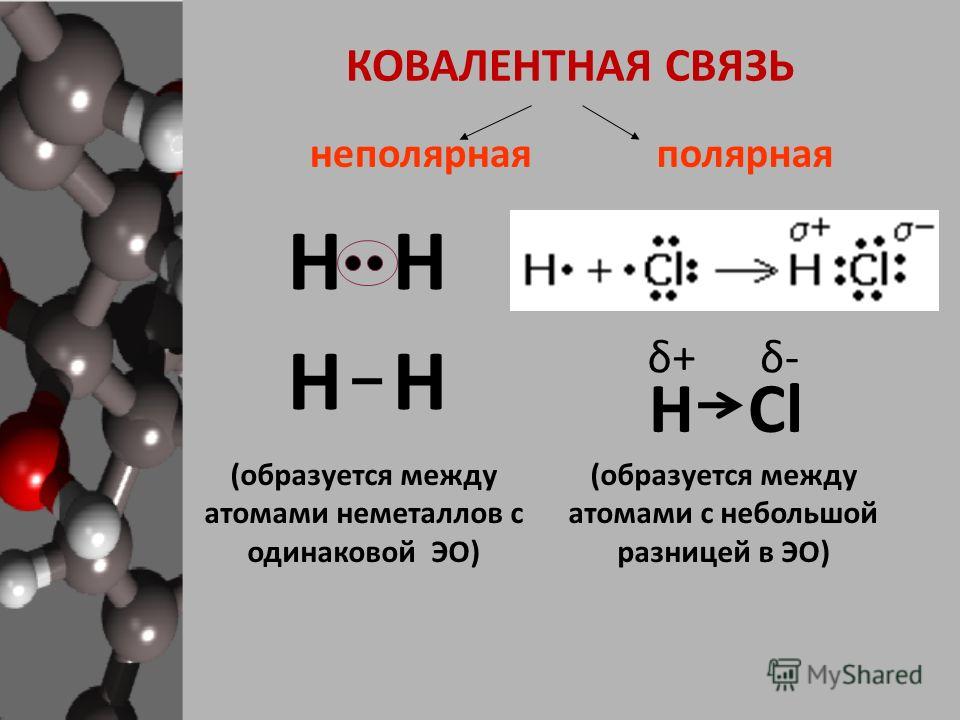 Ковалентные связи включают взаимодействия сигма- и пи-орбиталей; следовательно, ковалентные связи приводят к образованию одинарных, двойных, тройных и четверных связей.
Ковалентные связи включают взаимодействия сигма- и пи-орбиталей; следовательно, ковалентные связи приводят к образованию одинарных, двойных, тройных и четверных связей.
Пример \(\PageIndex{2}\): \(PCl_3\)
В этом примере атом фосфора делит свои три неспаренных электрона с тремя атомами хлора. В конечном продукте все четыре из этих молекул имеют 8 валентных электронов и удовлетворяют правилу октетов.
Связь в органической химии
Ионные и ковалентные связи являются двумя крайностями связи. Полярная ковалентная связь является промежуточным типом связи между двумя крайностями. Некоторые ионные связи содержат ковалентные характеристики, а некоторые ковалентные связи являются частично ионными. Например, большинство соединений на основе углерода связаны ковалентно, но также могут быть частично ионными. Полярность — это мера разделения зарядов в соединении. Полярность соединения зависит от симметрии соединения и различий в электроотрицательности между атомами.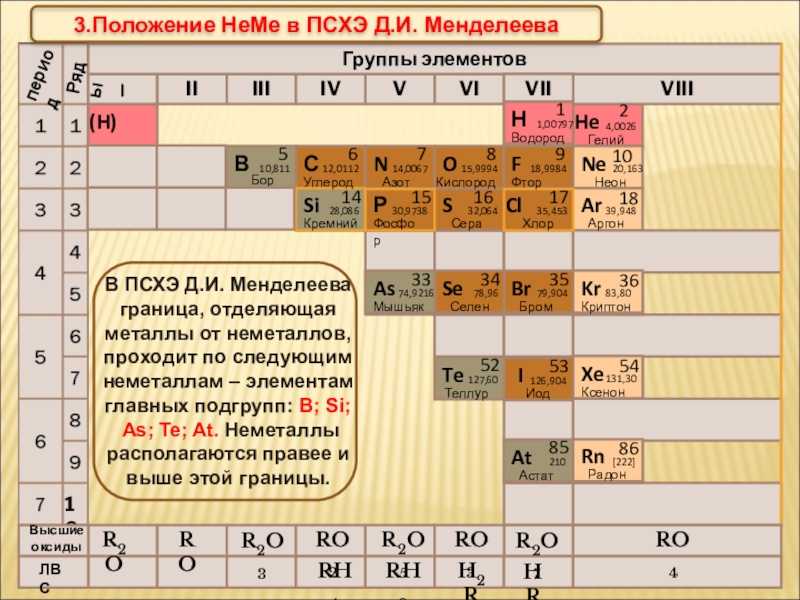 Полярность возникает, когда элементы, толкающие электроны, находящиеся в левой части таблицы Менделеева, обмениваются электронами с элементами, притягивающими электроны, в правой части таблицы. Это создает спектр полярности, с ионным (полярным) на одном конце, ковалентным (неполярным) на другом и полярно-ковалентным посередине.
Полярность возникает, когда элементы, толкающие электроны, находящиеся в левой части таблицы Менделеева, обмениваются электронами с элементами, притягивающими электроны, в правой части таблицы. Это создает спектр полярности, с ионным (полярным) на одном конце, ковалентным (неполярным) на другом и полярно-ковалентным посередине.
Обе эти связи важны в органической химии. Ионные связи важны, потому что они позволяют синтезировать определенные органические соединения. Ученые могут манипулировать ионными свойствами и этими взаимодействиями, чтобы формировать желаемые продукты. Ковалентные связи особенно важны, поскольку большинство молекул углерода взаимодействуют главным образом посредством ковалентных связей. Ковалентная связь позволяет молекулам делиться электронами с другими молекулами, создавая длинные цепочки соединений и усложняя жизнь.
Ссылки
- Фоллхардт, К. Питер С. и Нил Э. Шор. Органическая химия Структура и функции . Нью-Йорк: WH Freeman, 2007.
 .
. - Петруччи, Ральф Х. Общая химия: принципы и современные приложения . Река Аппер-Сэдл, Нью-Джерси: Pearson Education, 2007. .
- Браун, Теодор Л., Юджин Х. Лемей и Брюс Э. Берстен. Химия: основная наука . 6-е изд. Englewood Cliffs, NJ: Prentice Hall, 1994.
Проблемы
1. Являются ли эти соединения ионными или ковалентными?
2. В следующих реакциях укажите, связаны ли реагенты и продукты ионной или ковалентной связью.
а)
б) Пояснение: Какова природа связи между натрием и амидом? Какая связь образуется между углеродной цепью аниона и натрием?
c)
Растворы
- 1) Слева направо: Ковалентный, Ионный, Ионный, Ковалентный, Ковалентный, Ковалентный, Ионный.
- 2a) Все продукты и реагенты являются ионными.
- 2b) Слева направо: ковалентная, ионная, ионная, ковалентная, ионная, ковалентная, ковалентная, ионная.

- 2c) Все продукты и реагенты ковалентны.
Ionic and Covalent Bonds распространяется по незадекларированной лицензии, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
- ковалентная связь
- ионная связь
Части периодической таблицы
Когда элементы объединяются в соединения, существует два основных типа
склеивание, которое может возникнуть. Ионные связи образуются при наличии перенос электронов от одного вида к другому с образованием
заряженные ионы, которые очень сильно притягиваются друг к другу электростатическим
взаимодействия и ковалентных связей , которые возникают, когда атомы обмениваются электронами для образования нейтральных молекул. В общем металл и неметаллы объединяются, образуя ионные соединения , а неметаллы объединяются с другими неметаллами с образованием ковалентных соединений (молекулы).
Ионные связи образуются при наличии перенос электронов от одного вида к другому с образованием
заряженные ионы, которые очень сильно притягиваются друг к другу электростатическим
взаимодействия и ковалентных связей , которые возникают, когда атомы обмениваются электронами для образования нейтральных молекул. В общем металл и неметаллы объединяются, образуя ионные соединения , а неметаллы объединяются с другими неметаллами с образованием ковалентных соединений (молекулы).
Поскольку металлы находятся левее в таблице Менделеева, они имеют низкую энергию ионизации и низкое сродство к электрону, поэтому они относительно легко теряют электроны и с трудом приобретают их. У них также относительно мало валентных электронов, и они могут образовывать ионы (и тем самым удовлетворяют правилу октета) легче, теряя свою валентность электроны с образованием положительно заряженных катионы .
- Металлы основной группы обычно образуют заряды, такие же, как
номер их группы: то есть металлы группы 1А, такие как
натрий и калий образуют заряды +1, металлы группы 2А, такие как
магний и кальций образуют заряды 2+, а металлы группы 3А, такие как
так как алюминий образует заряды 3+.

- Металлы, которые следуют за переходными металлами (в сторону в нижней части групп 4A и 5A) могут потерять либо свои крайние с и p электронов, образующих заряды, идентичные их номер группы, или они могут потерять только p электронов, в то время как сохраняя свои два s электрона, образуя заряды, которые являются номер группы минус два. Другими словами, олово и свинец в Группе 4А может образовывать 4+ или 2+ заряда, тогда как висмут из группы 5А может образуют заряд 5+ или 3+.
- Переходные металлы обычно способны образовывать 2+ заряда потеряв свою валентность с электронов, но может и терять электроны со своих d орбиталей, чтобы сформировать другие заряды. Большинство переходных металлов могут образовывать более одного возможного заряда. в ионных соединениях.
Неметаллы находятся правее в периодической таблице и имеют
высокая энергия ионизации и
высокое сродство к электрону, поэтому
они относительно легко приобретают электроны и с трудом их теряют.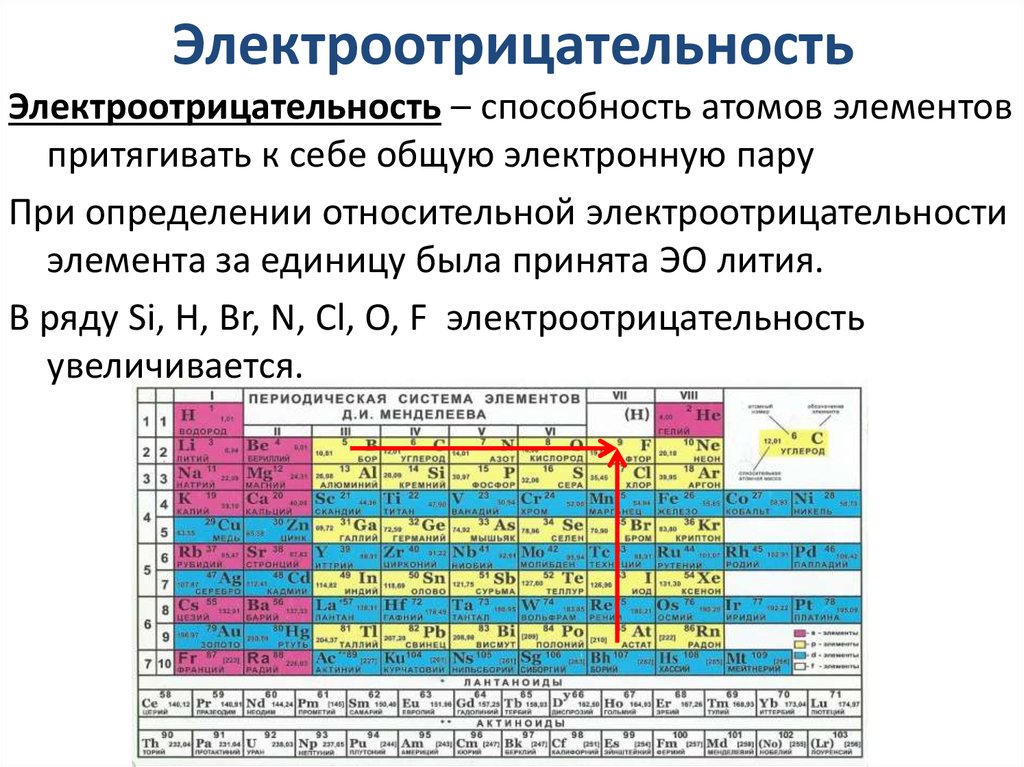 Они также имеют большее количество валентных электронов и уже
близко к полному октету из восьми электронов. неметаллы
приобретают электроны до тех пор, пока они не будут иметь такое же количество электронов, как
ближайший благородный газ (группа 8A), образующий отрицательно заряженный анионы которые имеют заряды, равные номеру группы минус восемь. То есть,
неметаллы группы 7А образуют заряды 1-, неметаллы группы 6А образуют заряды 2-
заряды, а металлы группы 5А образуют 3-заряды. Группа 8А
элементы уже имеют восемь электронов на своих валентных оболочках и имеют
мало склонны либо приобретать, либо терять электроны, и не легко
образуют ионные или молекулярные соединения.
Они также имеют большее количество валентных электронов и уже
близко к полному октету из восьми электронов. неметаллы
приобретают электроны до тех пор, пока они не будут иметь такое же количество электронов, как
ближайший благородный газ (группа 8A), образующий отрицательно заряженный анионы которые имеют заряды, равные номеру группы минус восемь. То есть,
неметаллы группы 7А образуют заряды 1-, неметаллы группы 6А образуют заряды 2-
заряды, а металлы группы 5А образуют 3-заряды. Группа 8А
элементы уже имеют восемь электронов на своих валентных оболочках и имеют
мало склонны либо приобретать, либо терять электроны, и не легко
образуют ионные или молекулярные соединения.
Ионные соединения удерживаются вместе в правильном порядке, называемом кристалл
решетки силами притяжения между противоположно заряженными
катионы и анионы. Эти силы притяжения очень сильны, и
поэтому большинство ионных соединений имеют очень высокие температуры плавления. (За
Например, хлорид натрия, NaCl, плавится при 80°С, а оксид алюминия,
Al 2 O 3 , плавится при 2054°C.) Ионные соединения
обычно твердые, жесткие и хрупкие. Ионные соединения не проводят
электричество, потому что ионы не могут свободно двигаться в твердой фазе,
но ионные соединения могут проводить электричество, когда они растворены в
вода.
(За
Например, хлорид натрия, NaCl, плавится при 80°С, а оксид алюминия,
Al 2 O 3 , плавится при 2054°C.) Ионные соединения
обычно твердые, жесткие и хрупкие. Ионные соединения не проводят
электричество, потому что ионы не могут свободно двигаться в твердой фазе,
но ионные соединения могут проводить электричество, когда они растворены в
вода.
Когда неметаллы объединяются с другими неметаллами, они, как правило, разделяют электроны в ковалентных связях вместо образования ионов, что приводит к образование нейтральных молекул. (Имейте в виду, что поскольку водород тоже неметалл, соединение водорода с другим неметаллом также будет образовывать ковалентную связь.) Молекулярные соединения могут быть газами, жидкостями или твердыми веществами с низкой температурой плавления и включают широкий спектр веществ. (См. Галерея молекул для примеры.)
Когда металлы соединяются друг с другом, связь обычно описывается
как металлическая связка (вы могли догадаться). В этом
В модели каждый атом металла отдает один или несколько своих валентных электронов
создать электронное море , которое окружает все атомы, удерживая
вещества вместе за счет притяжения между катионами металлов и
отрицательно заряженные электроны. Так как электроны в электроне
море может свободно двигаться, металлы очень легко проводят электричество, в отличие от
молекулы, где электроны более локализованы. Атомы металлов могут
двигаться мимо друг друга легче, чем в ионных соединениях (которые
удерживаются в фиксированных положениях за счет притяжения между катионами и
анионы), позволяя металлу забиваться в листы или вытягиваться в
провод. Различные металлы можно очень легко комбинировать, чтобы получить сплавы , которые могут иметь сильно отличающиеся физические свойства от их
составляющие металлы. Сталь представляет собой сплав железа и углерода,
что намного тверже самого железа; хром, ванадий, никель и
к железу также часто добавляют другие металлы для получения различных сталей.
В этом
В модели каждый атом металла отдает один или несколько своих валентных электронов
создать электронное море , которое окружает все атомы, удерживая
вещества вместе за счет притяжения между катионами металлов и
отрицательно заряженные электроны. Так как электроны в электроне
море может свободно двигаться, металлы очень легко проводят электричество, в отличие от
молекулы, где электроны более локализованы. Атомы металлов могут
двигаться мимо друг друга легче, чем в ионных соединениях (которые
удерживаются в фиксированных положениях за счет притяжения между катионами и
анионы), позволяя металлу забиваться в листы или вытягиваться в
провод. Различные металлы можно очень легко комбинировать, чтобы получить сплавы , которые могут иметь сильно отличающиеся физические свойства от их
составляющие металлы. Сталь представляет собой сплав железа и углерода,
что намного тверже самого железа; хром, ванадий, никель и
к железу также часто добавляют другие металлы для получения различных сталей.

 Связь осуществляют свободно перемещающиеся в межузловом пространстве электроны.
Связь осуществляют свободно перемещающиеся в межузловом пространстве электроны. Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Предложите учителю свою помощь в подготовке нового урока — сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.