Пероксид водорода. Задачи 797 — 801
Задача 797.
Указать способы получения пероксида водорода, привести уравнения реакций.
Решение:
В промышленности пероксид водорода получают электрохимическим методами, например, анодным окислением растворов H2SO4 или (NH4)HSO4 с последующим гидролизом образующейся при этом пероксодвусерной ислоты H2S2O8.
При электролизе H2SO4 (50% раствор) на катоде разряжаются ионы водорода Н+, а на аноде — HSО4—. Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н+ + 2 = Н2↑;
На аноде: 2HSО4— — 2 = H2S2O8,
или 2H2SO4 = H2S2O8 + 2H+ + 2.
Молекулярная форма:
2H2SO4 = H2S2O8 + Н2↑.
При электролизе (NH4)HSO4 на катоде разряжается молекулы воды, а на аноде — HSО4— . Последние, теряя свои заряды, соединяясь попарно, образуют перокусодвусерную кислоту:
На катоде: 2Н2О + 2 = Н2↑ +2ОН—;
На аноде: 2HSО4— — 2 = H2S2O8,
Молекулярная форма:
2(NH4)HSO4 + 2H2O = H2S2O8 + 2NH4OH + H2↑.
Далее перокидвусерная кислота подвергается гидролизу, сопровождающемуся образованием серной кислоты и пероксида водорода:
H2S2O8 + 2Н2О = 2H2SO4 + Н2О2.
Фактически электролиз протекает до тех пор пока в рабочем растворе не закончится или H 2SO4, или (NH4)HSO4.
Задача 798.
Можно ли получить Н2О2. непосредственным взаимодействием водорода и кислорода? Ответ обосновать.
Решение:
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода:
Н2 + О2 = Н2О2.
Но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород (2Н2О2 ) ⇔ 2Н2О + О2). Однако, если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода. Пероксид водорода можно получить при действии атомарного водорода на кислород.
2Н + О2 = Н2О2.
Таким образом, непосредственным взаимодействием водорода и кислорода пероксид водорода невыгодно получать ни в лаборатории, ни в промышленности.
Задача 799.
Описать строение молекулы Н2О2. Почему эта молекула полярна?
Почему эта молекула полярна?
Решение:
Молекула H2O2 неплоская, имеет строение H−O−O−H с -связью O−O на ребре и связями H—O на плоскостях двугранного угла:
Степень окисления кислорода равна −I, валентность атома O равна 2. Группу −O−O− называют пероксогруппой. Энергия связи О—О (210 кДж/моль) почти в 2 раза меньше энергии связи О—Н (468 кДж/моль), длина связи О—О равна 0,145нм. Из-за несимметричного распределения связей Н — О молекула Н2О2 сильно полярна. Между молекулами Н2О2 возникает довольно прочная водородная связь, поэтому в обычных условиях Н2О 2 – сиропообразная светло-голубая жидкость с высокой температурой кипения равной 150 °С. Температура плавления 0,41°С. Почти в 1.5 раза тяжелее воды, поверхностное натяжение ( ) больше, чем у Н2О.
Задача 800.
Написать уравнение реакции разложения пероксида водорода. К какому типу окислительно-восстановительных реакций она относится?
К какому типу окислительно-восстановительных реакций она относится?
Решение:
Уравнение реакции разложения пероксида водорода имеет вид:
2Н2О2 ⇔ 2Н2О + О2.
Данная реакция относится к окислительно-восстановительным реакциям самоокисления-самовосстановления, потому что пероксид водорода в реакции разложения является и восстановителем, и окислителем одновременно. Степень окисления кислорода изменяется от -1 до -2 (восстановление) и от -1 до 0 (окисление), потому что кислород в пероксиде водорода находится в своей промежуточной степени окисления (-1).
Ионно-молекулярная форма:
4О—= О20 + 2О2-
Задача 801.
К 150 г раствора Н2О2 прибавили немного диоксида марганца. Выделившийся кислород при нормальных условиях занял объем 10-3м3. Вычислить массовую долю Н2О2 в исходном растворе.
Вычислить массовую долю Н2О2 в исходном растворе.
Решение:
Уравнение реакции имеет вид:
М(Н2О2) = 34г/моль; m(H2O2) = 34г.
Находим массу разложившегося пероксида водорода из пропорции:
х : 68 = 1 : 22,4;
х = (1,68)/22,4 = 3,04г.
Массовую долю пероксида водорода находим из уравнения:
где w% — массовая доля вещества В; m(B) – масса вещества В; m(р-ра) – масса раствора.
Отсюда
Ответ: 2,02%.
Опыт 5 ПОЛУЧЕНИЕ КИСЛОРОДА ИЗ ПЕРОКСИДА ВОДОРОДА. Химия 10 класс Гузей Л.С., Суровцева Р.П. ГДЗ. – Рамблер/класс
Опыт 5 ПОЛУЧЕНИЕ КИСЛОРОДА ИЗ ПЕРОКСИДА ВОДОРОДА. Химия 10 класс Гузей Л.С., Суровцева Р.П. ГДЗ. – Рамблер/классИнтересные вопросы
Школа
Подскажите, как бороться с грубым отношением одноклассников к моему ребенку?
Новости
Поделитесь, сколько вы потратили на подготовку ребенка к учебному году?
Школа
Объясните, это правда, что родители теперь будут информироваться о снижении успеваемости в школе?
Школа
Когда в 2018 году намечено проведение основного периода ЕГЭ?
Новости
Будет ли как-то улучшаться система проверки и организации итоговых сочинений?
Вузы
Опыт 5
ПОЛУЧЕНИЕ КИСЛОРОДА
ИЗ ПЕРОКСИДА ВОДОРОДА
Задания.
1. Для получения кислорода из пероксида во-
дорода проведите реакцию его каталитического разложения.
2. Напишите уравнение проведенной реакции, объяс-
ните наблюдаемые явления.
ответы
Опыт 5
Получение кислорода из пероксида водорода
Результат: 1) уравнение реакции: 2Н2O2 → 2Н2O + O2↓.
2) При внесении порошка МnO2 происходит бурное выделение газа.
Тлеющая лучина загорается при ее поднесении к раствору. Оксид мар-
ганца является в данной реакции катализатором, т.е. он резко увели-
чивает скорость реакции разложения пероксида водорода.
ваш ответ
Можно ввести 4000 cимволов
отправить
дежурный
Нажимая кнопку «отправить», вы принимаете условия пользовательского соглашения
похожие темы
ЕГЭ
9 класс
11 класс
Физика
похожие вопросы 5
Почему сейчас школьники такие агрессивные ?
Читали новость про 10 классника который растрелял ? как вы к этому относитесь
Новости10 классБезопасность
ГДЗ Тема 21 Физика 7-9 класс А. В.Перышкин Задание №476 Изобразите силы, действующие на тело.
В.Перышкин Задание №476 Изобразите силы, действующие на тело.
Привет всем! Нужен ваш совет, как отвечать…
Изобразите силы, действующие на тело, когда оно плавает на поверхности жидкости. (Подробнее…)
ГДЗФизикаПерышкин А.В.Школа7 класс
4Т. При движении в группе сверху вниз… Вопросы к параграфу 24.10. Гузей Л.С., Суровцева Р.П. 10 класс Химия ГДЗ.
4Т. При движении в группе сверху вниз (в ряду О → S →
→ Sе → Те → Ро) окислительная способность элементов
А) (Подробнее…)
ГДЗХимия10 классГузей Л.С.Суровцева Р.П.
Опыт 22 ГИДРОЛИЗ СОЛЕЙ АЛЮМИНИЯ. Гузей Л.С., Суровцева Р.П. Химия 10 класс ГДЗ.
Опыт 22
ГИДРОЛИЗ СОЛЕЙ АЛЮМИНИЯ
Задания. 1. Исследуйте среду растворов солей алюми- (Подробнее…)
ГДЗХимия10 классСуровцева Р.П.Гузей Л.С.
Здравствуйте.
(Подробнее…)
Химия
Разложение перекиси водорода
Перекись водорода (H 2 O 2 ) повсюду. Он содержится в вашем отбеливателе, краске для волос, чистящем шкафу и даже в ваших отбеливателях для зубов. Чего вы можете не знать, так это того, что это химическое вещество постоянно разлагается. Это происходит очень медленно, но с помощью магии науки мы можем ускорить это.
Он содержится в вашем отбеливателе, краске для волос, чистящем шкафу и даже в ваших отбеливателях для зубов. Чего вы можете не знать, так это того, что это химическое вещество постоянно разлагается. Это происходит очень медленно, но с помощью магии науки мы можем ускорить это.
В этом посте:
Почему разлагается перекись водорода?Когда дело доходит до точного определения того, почему перекись водорода так легко разлагается, мы должны взглянуть на химическую структуру H 2 O 2 молекула.
Перекись водорода содержит одинарную связь кислород-кислород. Иначе известная как перекисная связь, она невероятно слабая и нестабильная.
При разрыве связи кислород-кислород перекись водорода разлагается на воду и кислород. Когда это происходит, он высвобождает свободные радикалы, которые вступают в реакцию с другими веществами.
Хотя эту реакцию разложения можно ускорить с помощью катализатора, нестабильность пероксидной связи означает, что разложение также происходит естественным образом.
От косметических до промышленных применений перекись водорода используется для самых разных целей. Но у этих отраслей всегда есть одна общая черта: как хранится перекись водорода.
Перекись водорода имеет ограниченный срок хранения, поскольку со временем она естественным образом разлагается на воду и газообразный кислород. Хотя это займет некоторое время, ультрафиолетовые лучи солнечного света, а также теплые условия могут фактически катализировать реакцию разложения.
Вот почему перекись водорода обычно хранят в темных пластиковых контейнерах. Непрозрачный цвет защищает химическое вещество от солнечного света, а пластиковый материал приспосабливается к любому накоплению газообразного кислорода, которое может возникнуть.
Стеклянный контейнер, например, может разбиться при повышении давления. Именно поэтому на контейнеры с перекисью водорода устанавливаются вентилируемые крышки, поскольку они обеспечивают выход любого выделяющегося кислорода.
Реакции с перекисью водорода
Перекись водорода вступает в химическую реакцию несколькими способами:
- Разложение : Как разлагается перекись водорода? Он термодинамически нестабилен. При более высоких температурах и концентрациях он разлагается с образованием воды и кислорода. Разложение перекиси водорода может катализироваться другими соединениями, такими как переходные металлы, такие как серебро и платина.
- Окислительно-восстановительные реакции: В зависимости от уровня pH перекись водорода обладает сильными восстановительными и окислительными (окислительно-восстановительными) свойствами. Как окислитель он может отбирать электроны у других веществ. В качестве восстановителя он может восстанавливать различные неорганические ионы.
- Предшественник других пероксидных соединений: Будучи слабой кислотой, перекись водорода образует гидроперекись в сочетании с различными металлами и их соединениями.

Какой катализатор используется при разложении перекиси водорода?
Солнечный свет — не единственное, что может ускорить реакцию разложения перекиси водорода. В лаборатории можно использовать несколько катализаторов для ускорения реакции. К ним относятся:
- Оксид марганца (IV)
- Йодид калия
- Хлорид железа (III)
- Двуокись свинца
- Каталаза
В организме фермент каталаза катализирует разложение перекиси водорода на воду и газообразный кислород. Этот процесс происходит практически во всех живых организмах, в том числе и в пчелах.
При проведении реакции в лаборатории предпочтительным катализатором обычно является оксид марганца (IV). Однако существует широкий выбор катализаторов, и каждый из них будет иметь разную эффективность.
Почему катализаторы ускоряют реакции? Катализаторы способны снизить энергию активации, необходимую для реакции. Это означает, что они могут увеличить скорость реакции, не израсходовавшись.
Таким образом, в конце реакции оставшийся катализатор можно использовать повторно. Это очень удобно для коммерческих или промышленных процессов, поскольку потребляется меньше продукта.
Как перекись водорода разлагается в химических реакциях?Когда вы добавляете небольшое количество катализатора в колбу с водным раствором перекиси водорода, первое, что вы заметите, это мгновенное изменение цвета.
В присутствии оксида марганца (IV) или хлорида железа (III) прозрачный раствор немедленно становится черным. Поскольку катализатор творит чудеса, перекись водорода начнет очень быстро разлагаться.
Когда это произойдет, раствор начнет быстро шипеть. Это вызвано двумя причинами:
- Быстрое разложение означает образование большого количества газообразного кислорода в виде пузырьков
- Реакция разложения высвобождает тепловую энергию, что делает ее экзотермической и шипящей реакцией
По мере того, как разложение перекиси водорода продолжается, в колбе быстро нарастает большое давление из-за объема образующегося газообразного кислорода. Реакция завершится бурным выбросом смеси вверх из колбы.
Реакция завершится бурным выбросом смеси вверх из колбы.
Эту химическую реакцию можно превратить в веселый эксперимент для детей (и взрослых!). Если добавить немного жидкости для мытья посуды в раствор H 2 O 2 , конечный продукт представляет собой густую пену, которая выливается из контейнера, как слоновья зубная паста.
Присутствие мыльной воды способно улавливать кислород, выделяющийся при разложении. Это создает густую пену, которая вытесняется из контейнера из-за повышения давления.
Наиболее распространенным катализатором, используемым в этом эксперименте, является йодид калия, но большинство катализаторов достигают того же эффекта, если добавить средство для мытья посуды.
Измерение реакции Добавляя катализатор в водный раствор H 2 O 2 и записывая скорость реакции через определенные промежутки времени, вы можете контролировать общий объем образующегося газообразного кислорода. . Вот как это сделать:
. Вот как это сделать:
- Налейте немного водного раствора перекиси водорода в вертикальную колбу
- Добавьте в раствор небольшое количество катализатора
- Быстро закройте колбу пробкой, чтобы предотвратить утечку выделяющегося кислорода
- Запишите объем кислорода через определенные промежутки времени на протяжении всей реакции
- Используя график, постройте объем произведенного кислорода в зависимости от определенного времени
Когда вы закончите свой график, у вас должна остаться кривая. Чтобы вычислить скорость реакции, просто выберите точку на кривой и проведите к ней касательную.
Вычисление градиента касательной даст вам скорость разложения в конкретный момент времени. Чем круче градиент, тем выше скорость реакции.
ReAgent не только продает перекись водорода высшего качества в различных растворах, но и различные катализаторы для продажи в нашем интернет-магазине. От йодида калия до хлорида железа (III) — у нас есть ингредиенты, которые вам понадобятся, чтобы сделать собственную зубную пасту для слонов!
Заявление об ограничении ответственности
Блог на сайтеchemicals. co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
co.uk и все, что в нем публикуется, предоставляется только в качестве информационного ресурса. Блог, его авторы и аффилированные лица не несут ответственности за любые несчастные случаи, травмы или ущерб, вызванные частично или непосредственно в результате использования информации, представленной на этом веб-сайте. Мы не рекомендуем использовать какие-либо химические вещества без предварительного ознакомления с Паспортом безопасности материала, который можно получить у производителя, и следуя советам по безопасности и мерам предосторожности, указанным на этикетке продукта. Если у вас есть какие-либо сомнения по поводу вопросов охраны здоровья и безопасности, обратитесь в Управление по охране труда и технике безопасности (HSE).
18. Кинетика разложения пероксида водорода
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 73589
CHEM 174 Лаборатория физической химии II
Разложение перекиси водорода
Введение
Состав нашего мира контролируется подробными химическими механизмами и их скоростью. Чрезвычайно сложные механизмы определяют характеристики всего, от живых клеток до атмосферы. Например, химики создают механизмы реакций органических соединений в загрязненной городской атмосфере, включающие почти два миллиона элементарных реакций. Цель химической кинетики — лучше понять механизмы и скорости химических реакций. В этой лаборатории вы изучите некоторые методы, которые можно применять для понимания механизмов многих видов реакций.
Чрезвычайно сложные механизмы определяют характеристики всего, от живых клеток до атмосферы. Например, химики создают механизмы реакций органических соединений в загрязненной городской атмосфере, включающие почти два миллиона элементарных реакций. Цель химической кинетики — лучше понять механизмы и скорости химических реакций. В этой лаборатории вы изучите некоторые методы, которые можно применять для понимания механизмов многих видов реакций.
Перекись водорода является окислителем, повсеместно присутствующим в окружающей среде, которая образуется в результате атмосферных процессов (Stockwell et al., 1997). Перекись водорода вредна для клеток, потому что она воздействует на ненасыщенные жирные кислоты (липиды), содержащиеся в клеточных мембранах, и, следовательно, клетки вырабатывают мощный катализатор, каталазу, которая разлагает h3O2 (Кеуш). Каталаза является катализатором (а не просто еще одним реагентом), потому что она реагирует и как донор электронов, и как акцептор электронов. Каталаза является примером фермента, биологического катализатора. 9{-} \right ] \) — концентрация йодида, \( \left [H_{2} O_{2}\right ] \) — концентрация перекиси водорода, \( a \) и \( b \) — концентрация порядок реакции по йодиду и перекиси водорода соответственно. Мы узнаем кое-что о кинетике, экспериментально определив a и b и оценив k как псевдокоэффициент скорости. Эта лаборатория основана на подобном эксперименте (Hutton, 1968).
Каталаза является примером фермента, биологического катализатора. 9{-} \right ] \) — концентрация йодида, \( \left [H_{2} O_{2}\right ] \) — концентрация перекиси водорода, \( a \) и \( b \) — концентрация порядок реакции по йодиду и перекиси водорода соответственно. Мы узнаем кое-что о кинетике, экспериментально определив a и b и оценив k как псевдокоэффициент скорости. Эта лаборатория основана на подобном эксперименте (Hutton, 1968).
Измерение порядка реакции по концентрациям йодида и водорода, «а» и «б» 9{a} \label{EQ5}\]
Типичный экспериментальный «трюк» состоит в том, чтобы найти способ линеаризации эксперимента, чтобы его результаты можно было аппроксимировать прямой линией, заданной уравнением (6).
\[ y = наклон \cdot x + константа \label{EQ6}\]
где y — зависимая переменная, а x — независимое значение. В этом случае для определения экспериментального значения можно использовать линейную регрессию. Мы сделаем это здесь, взяв натуральные логарифмы обеих частей уравнения (6). {-} \право ]_{о} } \право ) \] 9{-} \right ]_{o} } \right ) \) наклон будет равен \( a \), порядок реакции по концентрации йодида.
{-} \право ]_{о} } \право ) \] 9{-} \right ]_{o} } \right ) \) наклон будет равен \( a \), порядок реакции по концентрации йодида.
Мы можем следовать аналогичным рассуждениям, чтобы измерить \( b \), порядок реакции по отношению к концентрации перекиси водорода.
\[ \ln \left ( \frac{Rate}{Rate_{o}} \right ) = b \ln \left ( \frac{\left [H_{2}O_{2} \right ]}}{\ left [ H_{2}O_{2} \right ]_{o} } \right ) \]
Измерение скорости реакции
Как можно измерить скорость реакции (1)? Ион тиосульфата реагирует с йодом, превращая его обратно в йодид, как показано в реакции (9) и не реагирует в какой-либо значительной степени ни с чем другим в растворе.
I 2 + 2 S 2 O 3 = → 2 I — + S 4 O 6 =
IODIN в растворе. После того, как тиосульфат израсходован, концентрация йода увеличится, и в присутствии крахмала образуется комплекс синего цвета. Мы можем измерить скорость реакции (1), добавив к реагирующему раствору известное количество стандартного раствора тиосульфата натрия и немного крахмала. Измеряют время, необходимое для того, чтобы раствор стал синим. Скорость определяется уравнением (10).
Измеряют время, необходимое для того, чтобы раствор стал синим. Скорость определяется уравнением (10).
Скорость = моль H 2 O 2 прореагировавший / время (с) = моль прореагировавший тиосульфат / время, чтобы стать синим Тиосульфат натрия может поглощать воду или реагировать с примесями в растворе. Поэтому для точного измерения коэффициента скорости необходимо провести несколько различных титрований раствора тиосульфата натрия, чтобы точно установить его концентрацию. Однако мы можем сделать оценки, просто приняв формулу для расчета концентрации тиосульфата. Эта неопределенность никак не влияет на определение порядка реакции, но влияет на определение коэффициента скорости. 9{b} \), то \( {k}» \) можно определить по наклону.
Зависимость коэффициентов скорости от температуры
Зависимость коэффициентов скорости многих реакций от температуры дается уравнением Аррениуса:
\[ k = A \exp \left ( \frac{-E_{a}}{RT} \ справа ) \]
где \( A \) — предэкспоненциальный множитель, \( E_{a} \) — энергия активации, \( R \) — постоянная идеального газа и \( T \) — температура. Применяя это уравнение, убедитесь, что единицы \(E_{a}\) и \(R\) согласованы. Подставляя уравнение Аррениуса в общее уравнение скорости реакции пероксида водорода с йодидом, получаем 9{b} \right ) \]
Применяя это уравнение, убедитесь, что единицы \(E_{a}\) и \(R\) согласованы. Подставляя уравнение Аррениуса в общее уравнение скорости реакции пероксида водорода с йодидом, получаем 9{b} \right ) \]
Следовательно, если мы измерим скорость реакции при нескольких температурах при одной и той же концентрации йодида и перекиси водорода, а затем построим \( \ln \left ( Rate \right ) \) как зависимую ось (y -ось) и \( \frac{1}{T} \) в качестве независимой оси (ось x) наклон будет равен \( \frac{-E_{a}}{R} \).
Процедура, часть 1:
Приготовьте раствор KI с концентрацией около 0,3 М. Используйте аналитические весы, чтобы точно взвесить 25 г KI. Используйте мерную колбу, чтобы разбавить до 500 мл. Вычислите концентрацию.
Приготовьте раствор H 2 O 2 с концентрацией около 0,1 М. Растворите около 6 мл 30% перекиси водорода в 500 мл дистиллированной воды. Вам не нужно рассчитывать концентрацию.
Приготовьте раствор тиосульфата натрия с концентрацией примерно 0,02 М. S 2 O 3 = Используйте аналитические весы для точного взвешивания 1,5 г Na 2 S 2 0 5 O Используйте мерную колбу, чтобы разбавить до 500 мл. Рассчитайте примерную концентрацию.
S 2 O 3 = Используйте аналитические весы для точного взвешивания 1,5 г Na 2 S 2 0 5 O Используйте мерную колбу, чтобы разбавить до 500 мл. Рассчитайте примерную концентрацию.
Приготовьте 500 мл буферного раствора с 0,5 М уксусной кислоты и 0,5 М ацетата натрия.
Чтобы увидеть цвета продуктов реакции, выполните следующие действия:
Запишите свои наблюдения, выполняя следующие действия. Поместите около 5 мл раствора KI в пробирку. Добавьте несколько капель раствора перекиси водорода.
Распределить смесь KI и перекиси водорода по трем пробиркам. Обозначьте как I, 2 и 3.
Пробирка 1) Сохраните для справки.
Пробирка 2) Добавьте пару капель раствора крахмала.
Пробирка 3) Добавьте пару капель раствора тиосульфата натрия и наблюдайте. Добавьте пару капель раствора крахмала и снова наблюдайте.
Сохраняйте эти пробирки в качестве эталона при проведении кинетических измерений.
| (1) Дистиллированная Вода (мл) | (2) Буфер (мл) | (3) КИ Раствор (мл) | (4) Крахмал Раствор (мл) | (5) Na2S2O3 Раствор (мл) | (6) Больше Дистиллированная Вода (мл) | (7) H 2 O 2 Раствор (мл) | |
|---|---|---|---|---|---|---|---|
| Вариант КИ | |||||||
| А | 300 | 25 | 5 | 2 | 25 | Сделать 475 | 25 |
| Б | 300 | 25 | 10 | 2 | 25 | Сделать 475 | 25 |
| С | 300 | 25 | 15 | 2 | 25 | Сделать 475 | 25 |
| Д | 300 | 25 | 20 | 2 | 25 | Сделать 475 | 25 |
| Е | 300 | 25 | 25 | 2 | 25 | Сделать 475 | 25 |
| H 2 O 2 Вариант | |||||||
| Е | 300 | 25 | 25 | 2 | 25 | Сделать 475 | 25 |
| Ф | 300 | 25 | 25 | 2 | 25 | Сделать 450 | 50 |
| Г | 300 | 25 | 25 | 2 | 25 | Сделать 425 | 75 |
| Н | 300 | 25 | 25 | 2 | 25 | Сделать 400 | 100 |
| я | 300 | 25 | 25 | 2 | 25 | Сделать 375 | 125 |
Сначала отметьте температуру растворов и запишите в тетради. Смешайте растворы 1–6, чтобы получился раствор А, но не добавляйте перекись водорода. Как можно точнее измерьте объемы KI и тиосульфата натрия. Перелейте раствор в стакан на 500 мл. Точно измерьте объем раствора перекиси водорода. Смешайте раствор А и раствор перекиси водорода и определите время от смешивания до тех пор, пока раствор не станет светло-голубым. Запишите время с точностью до секунды. Повторите для всех растворов в Таблице 1. Вам не нужно повторять раствор E, он указан в Таблице 1, чтобы указать, что он является частью обоих вариантов перекиси водорода и йодида калия.
Смешайте растворы 1–6, чтобы получился раствор А, но не добавляйте перекись водорода. Как можно точнее измерьте объемы KI и тиосульфата натрия. Перелейте раствор в стакан на 500 мл. Точно измерьте объем раствора перекиси водорода. Смешайте раствор А и раствор перекиси водорода и определите время от смешивания до тех пор, пока раствор не станет светло-голубым. Запишите время с точностью до секунды. Повторите для всех растворов в Таблице 1. Вам не нужно повторять раствор E, он указан в Таблице 1, чтобы указать, что он является частью обоих вариантов перекиси водорода и йодида калия.
Сводная таблица данных
| Время (мин) | Измерено Температура C° | |
| А | ||
| Б | ||
| С | ||
| Д | ||
| Е | ||
| Ф | ||
| Г | ||
| Н | ||
| я |
Часть 2 Изменение температуры В таблице 2 приведен состав реакционной смеси.

Температура С° | Дистиллированная Вода (мл) | Буфер (мл) | KI Раствор (мл) | Крахмал Раствор (мл) | Na2S2O3 Раствор (мл) | Больше Дистиллированная Вода (мл) | h3O2 Раствор (мл) | |
|---|---|---|---|---|---|---|---|---|
| Е1 | 25 | 300 | 25 | 25 | 2 | 25 | Сделать 475 | 25 |
| Е2 | 30 | 300 | 25 | 25 | 2 | 25 | Сделать 475 | 25 |
| Е3 | 35 | 300 | 25 | 25 | 2 | 25 | Сделать 475 | 25 |
| Е4 | 40 | 300 | 25 | 25 | 2 | 25 | Сделать 475 | 25 |
| Е5 | 45 | 300 | 25 | 25 | 2 | 25 | Сделать 475 | 25 |
| Е6 | 50 | 300 | 25 | 25 | 2 | 25 | Сделать 475 | 25 |
Сначала проведите эксперимент при комнатной температуре. Повторите эксперимент при температуре 30, 35, 40, 45 и 50 °C. Для всех измерений смешивайте растворы 1–6 вместе, но не добавляйте перекись водорода. Как можно точнее измерьте объемы KI и тиосульфата натрия. Перелейте раствор в колбу на 500 мл. Либо выполняйте при комнатной температуре, либо поместите на водяную баню, чтобы нагреть до нужной температуры. Там будет три ванны с теплой водой. Не нагревайте перекись водорода, чтобы избежать разложения.
Повторите эксперимент при температуре 30, 35, 40, 45 и 50 °C. Для всех измерений смешивайте растворы 1–6 вместе, но не добавляйте перекись водорода. Как можно точнее измерьте объемы KI и тиосульфата натрия. Перелейте раствор в колбу на 500 мл. Либо выполняйте при комнатной температуре, либо поместите на водяную баню, чтобы нагреть до нужной температуры. Там будет три ванны с теплой водой. Не нагревайте перекись водорода, чтобы избежать разложения.
Точно измерьте объем раствора перекиси водорода. Смешать раствор и раствор перекиси водорода и определить время от смешивания до окрашивания раствора в светло-голубой-коричневый цвет. Запишите время с точностью до секунды. Запишите температуру конечного раствора и запишите в тетрадь.
Каждая группа проведет измерение при комнатной температуре и температуре около 30, 35, 40, 45 и 50 °C (всего пять измерений на группу).
Сводная таблица данных для части 2.
| Время (мин) | Измерено Температура C° | |
| Е1 | ||
| Е2 | ||
| Е3 | ||
| Е4 | ||
| Е5 | ||
| Е6 |
Расчеты и графики
В своем отчете сведите результаты расчетов в таблицы и покажите примеры расчетов.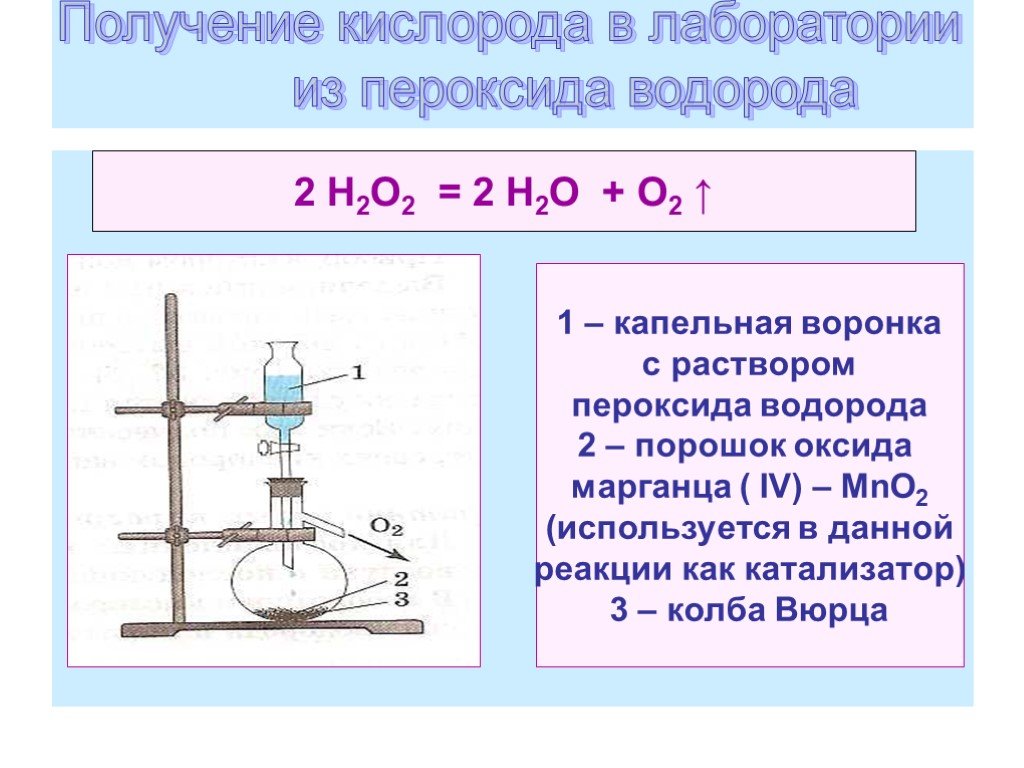
Вариант йодида
Используйте раствор E в качестве исходного раствора. Обратите внимание, что отношения [I — ]/[I — ] o , для растворов А – Е 1, 2, 3, 4 и 5 соответственно. Рассчитайте отношение измеренных скоростей (измеренное время, в течение которого растворы становятся синими (Норма/Коэффициент o ). Возьмите естественные логарифмы и постройте график ln([I — ]/[I — ] o ) в качестве независимой переменной (ось x) и график ln(Rate/Rate o ) в качестве зависимой переменной (ось y).Выполните линейную регрессию, используя Excel или аналогичную программу, чтобы определить порядок реакции по отношению к йодиду от уклона.Определить также r 2 (общая дисперсия) посадки.
Вариант перекиси водорода
Используйте раствор E в качестве базового раствора. Обратите внимание, что отношения [H 2 O 2 ]/[H 2 O 2 ] o для растворов E – I равны 1, 2, 3, 4 и 5 соответственно. Рассчитайте отношение измеренных скоростей (измеренное время, когда растворы станут синими (скорость/скорость o ). Возьмите натуральные логарифмы и постройте график ln([H 2 O 2 ]/[H 2 O 2 ] o ) в качестве независимой переменной (ось x) и график ln(Rate/Rate o ) в качестве зависимой переменной (ось y). Выполните линейную регрессию, используя Excel или аналогичную программу, чтобы определить порядок реакции относительно перекиси водорода по наклону. Также определите r 2 (общая дисперсия) подгонки.
Рассчитайте отношение измеренных скоростей (измеренное время, когда растворы станут синими (скорость/скорость o ). Возьмите натуральные логарифмы и постройте график ln([H 2 O 2 ]/[H 2 O 2 ] o ) в качестве независимой переменной (ось x) и график ln(Rate/Rate o ) в качестве зависимой переменной (ось y). Выполните линейную регрессию, используя Excel или аналогичную программу, чтобы определить порядок реакции относительно перекиси водорода по наклону. Также определите r 2 (общая дисперсия) подгонки.
Оцените коэффициенты псевдоскорости
Для растворов A – E рассчитайте скорость реакции (Rate) в молях перекиси водорода в секунду и рассчитайте [I —] и . Постройте [I — ] a как независимую переменную (ось x) и постройте скорость как зависимую переменную (ось y). Выполните линейную регрессию, используя Excel или аналогичную программу, чтобы определить коэффициент псевдоскорости по наклону. Также определите r 2 (общая дисперсия) подгонки.
Также определите r 2 (общая дисперсия) подгонки.
Для растворов E – I рассчитайте скорость реакции (Rate) в молях перекиси водорода в секунду и рассчитайте [H 2 O 2 ] б . Постройте [H 2 O 2 ] b как независимую переменную (ось x) и постройте скорость как зависимую переменную (ось y). Выполните линейную регрессию, используя Excel или аналогичную программу, чтобы определить коэффициент псевдоскорости по наклону. Также определите r 2 (общая дисперсия) подгонки.
Изменение температуры
Для части 2 постройте натуральный логарифм времени реакции как функцию 1/T, чтобы определить энергию активации коэффициента скорости. Используйте Кельвин (К) в качестве единицы измерения температуры.
Отчет
Структурируйте отчет так, как обсуждалось в классе, и включите обсуждение следующих вопросов в раздел выводов.
- Для определения порядка реакции KI или H 2 O 2 почему не нужно знать ни начальную, ни фактическую концентрацию KI или H 2 O 2 в ходе эксперимента?
- Каковы основные неопределенности в результатах для порядков реакции? Каковы основные источники ошибок для коэффициента псевдоскорости.
 Каковы r и общая дисперсия (r 2 )?
Каковы r и общая дисперсия (r 2 )? - Предложите механизм реакции на основе данных. Можете ли вы на основании ваших данных различить следующие два элементарных механизма реакции?
| Схема I | Схема II | |
| Шаг 1: | H 2 O 2 + H + → H 3 O 2 + | Н 2 О 2 + И — → ОИ — + Н 2 О |
| Шаг 2: | H 3 O 2 + + I — → HOI + H 2 O | OI — + H + → HOI |
| Шаг 3: | HOI + I — → I 2 + OH — | HOI + I — → I 2 + ОН — |
| Шаг 4: | OH — + H + → H 2 O | OH — + H + → H 2 O |
- Почему ионная сила поддерживается постоянной?
- Какие уроки можно перенести из этого лабораторного исследования в исследования в области наук о жизни?
Ссылки
Хаттон, В.


 Каковы r и общая дисперсия (r 2 )?
Каковы r и общая дисперсия (r 2 )?