| Урок «Получение, собирание и распознавание газов». Практическая работа № 5
Цели урока: Обучающие: проверить правильность усвоения знаний о газообразных веществах, способах их получения и распознавания; Развивающие: продолжить формировать умения проводить эксперимент, наблюдать за ходом реакций и делать выводы.
Оборудование: компьютер, презентация урока, пробирки, спиртовка, спички, лучинки, стеклянные трубки; растворы: соляной кислоты, уксусной кислоты, пероксида водорода, известковой воды; цинк, мрамор,
Ход урока. 1. Актуализация знаний: у учащихся на столах рабочие листы с заданиями: Определяем цели и задачи урока: способы получения и распознавания газов. 1 вариант: определить по свойствам, о каком газе идет речь — самый распространенный элемент на нашей планете образует молекулу этого газа, это газ без цвета и запаха, поддерживает горение, необходим для дыхания; (кислород) — это самый легкий газ, он в 14 раз легче воздуха, не растворим в воде, смесь с воздухом горит с характерным лающим звуком. 2 вариант: определить по свойствам, о каком газе идет речь — бесцветный, не имеющий запаха, примерно в 1,5 раза тяжелее воздуха, растворим в воде, при испарении образуется «сухой лед»; (углекислый газ) — бесцветный газ с резким запахом, почти в 2 раза легче воздуха, хорошо растворим в воде, раствор которого применяется в медицине; (аммиак) 2. Подготовка к уроку (проверить готовность к уроку групп учащихся, оборудования, класса; сообщение темы и цели урока).
3. Инструктаж по технике безопасности. / Беседа по ПТБ 1. Какое воздействие на кожу человека и ткань оказывают кислоты? (При попадании на кожу человека или ткань, кислоты разрушают их). 2. Какое воздействие на кожу человека и ткань оказывают щелочи? (При попадании на кожу человека или ткань, щелочи разрушают их). 3. Таким образом, как необходимо обращаться с кислотами и щелочами? (Кислоты и щелочи необходимо брать аккуратно, пользуясь пипеткой и только в нужном количестве). 4. От чьей спиртовки можно зажечь свою? (Спиртовку нельзя зажигать от другой спиртовки. Её можно зажигать только спичкой). 5. Как нужно обращаться со стеклянной посудой при сборе газообразных веществ? Напоминаю, что обращаться со стеклянной посудой нужно очень осторожно, чтобы не раздавить или разбить её. Сколы при разрушении стеклянной посуды очень острые и могут вызвать очень глубокие порезы.
4. Инструктаж по работе. Практическую работу вы будете выполнять по инструкции и по вариантам. В соответствии с вашим вариантом:
Оформление работы
По окончании работы навести порядок на рабочем месте, и сдать оборудование и материалы.
5. Выполнение работы. Задание №1 для 1 варианта. «Получение, собирание и распознавание водорода». 1. В пробирку поместить две гранулы цинка. 2. Прилить 2 мл раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции с точки зрения окислительно-восстановительного процесса. 3. Накрыть пробирку-реактор пробиркой большего диаметра. 4. Через 4 минуты поднимите большую пробирку и, не переворачивая, поднесите её к пламени спиртовки. Что наблюдаете? Запишите уравнение реакции. 5. Что можно сказать о чистоте собранного водорода? Чистый водород взрывается с глухим хлопком. 6. Почему водород собирают в перевернутую пробирку? Задание №2 для 1 варианта «Получение, собирание и распознавание кислорода». Собрали прибор для получения кислорода и проверили его на герметичность. Укрепили пробирку в лапке штатива так, чтобы конец газоотводной трубки доходил почти до дна сосуда, в котором будет собираться кислород. Внесите тлеющую лучину в пробирку с газом. Что наблюдаете? Запишите уравнение реакции с точки зрения окислительно-восстановительного процесса. Задание №1 для 2 варианта «Получение, собирание и распознавание углекислого газа». 1. В пробирку поместить кусочек мрамора. 2. Прилить к мрамору 4 мл. раствора соляной кислоты. Что наблюдаете? Запишите уравнение химической реакции в молекулярной и ионной форме. 3. Приготовьте тлеющую лучину. 4. Внесите тлеющую лучину в пробирку-реактор. Что наблюдаете? 5. В пробирку налейте 2 мл. раствора известковой воды. 6. Используя стеклянную трубку, осторожно пропустите через неё полученный газ в пробирку с известковой водой. Эта реакция является качественной на углекислый газ. «Получение, собирание и распознавание аммиака». 1. В пробирку поместить смесь хлорида аммония и гидроксида кальция. 2. Закрыть пробирку пробкой с газоотводной трубкой, дпругой конец которой помести в пустую перевернутую пробирку. 2. Укрепить пробирку на лапке штатива, нагреть 4. Для обнаружения используйте стеклянную палочку смоченную соляной кислотой или фенолфталеиновую бумажку.
7. В ходе урока учащиеся заполняют оценочный лист
8. Задание на дом: повторить материал по теме «Неметаллы» 9. Подведение итогов урока | |||||||||||||||||||||||||||||||||||||||||||||
Практическая работа №6 9 класс Тема «Получение оксида углерода (. .. ..Цель: Получить оксид углерода (IV) и изучить его свойства. Научиться распознавать карбонаты | Урок на тему: «Наша Земля- магнит» Этот урок урок над темой, урок мировоззренческий, урок философский. Я убеждена в том, что знания о среде своего обитания каждый образованный… | ||||||||||||||||||||||||||||||||||||||||||||
| Урок Типы ясновидения Урок Тренинг по развитию ясновидения Урок Простейшие способы задать вопрос и получить ответ из Информационного поля | Урок на тему: «Кислоты, их химические свойства, получение.» Цель урока: расширение знания учащихся о кислотах, их химических свойствах, способах получения,значении | ||||||||||||||||||||||||||||||||||||||||||||
| Урок по фгос: отличия и особенности Современный урок урок по фгос… Педагог не только признает право учащегося на собственное суждение, но и заинтересован в нем | Урок; limb Корум получает урок и теряет руку; to learn — учиться, узнавать; to learn a lesson /from/ — извлекать урок; limb — конечность | ||||||||||||||||||||||||||||||||||||||||||||
| Урок; limb Корум получает урок и теряет руку; to learn — учиться, узнавать; to learn a lesson /from/ — извлекать урок; limb — конечность | Урок по теме «Белки» Это урок изучения нового материала, форма его проведения семинар.  Урок проводят учителя химии и биологии. В качестве девиза взяты… Урок проводят учителя химии и биологии. В качестве девиза взяты… | ||||||||||||||||||||||||||||||||||||||||||||
| Мониторинг энергопотребления и выбросов парниковых газов для выбранного… Целью настоящей работы является получение достоверной информации по динамике потребления в 2009-2011 годах электроэнергии и выбросов… | Урок по теме: «Литература оттепели» Урок предназначен для 11 класса социально-гуманитарного профиля | ||||||||||||||||||||||||||||||||||||||||||||
| Документация о запросе цен без предварительной квалификации на Разработку… Пдв, получение действующих справок о фоновых концентрациях в Росгидромет, получение утвержденных экспертных и санитарно-эпидемиологических… | Памятка снайперу вступление. Кто такой снайпер Охватывает зерна пороха. Весь заряд пороха загорается почти одновременно. Образующееся при сгорании пороха большое количество газов… | ||||||||||||||||||||||||||||||||||||||||||||
| Инструкция по обследованию шаровых резервуаров и газгольдеров для хранения сжиженных Лвж), сжиженных газов (суг, спг), сжатых газов, агрессивных продуктов (кислот) и игристых вин под давлением от 0,25 до 1,8 мпа при.  .. .. | Карта-инструкция Практическая работа №4 «Получение водорода» Цель работы Цель работы: закрепить знания учащихся о способах получения водорода, продолжить формировать умения и навыки пользования лабораторным… | ||||||||||||||||||||||||||||||||||||||||||||
| Распознавание сигналов обмана в интервью Кандидат психологических наук, доцент кафедры психологии здоровья и отклоняющегося поведения | Урок Практическая работа №4 «Получение аммиака и изучение его свойств» Цели урока Цели урока: получения аммиака изучение его свойства через проведение практической работы | ||||||||||||||||||||||||||||||||||||||||||||
Конспект урока по Химии «Получение, собирание и распознавание газов» 11 класс
Кудрявцева Ирина Александровна
учитель химии
первой квалификационной категории
БОУ г.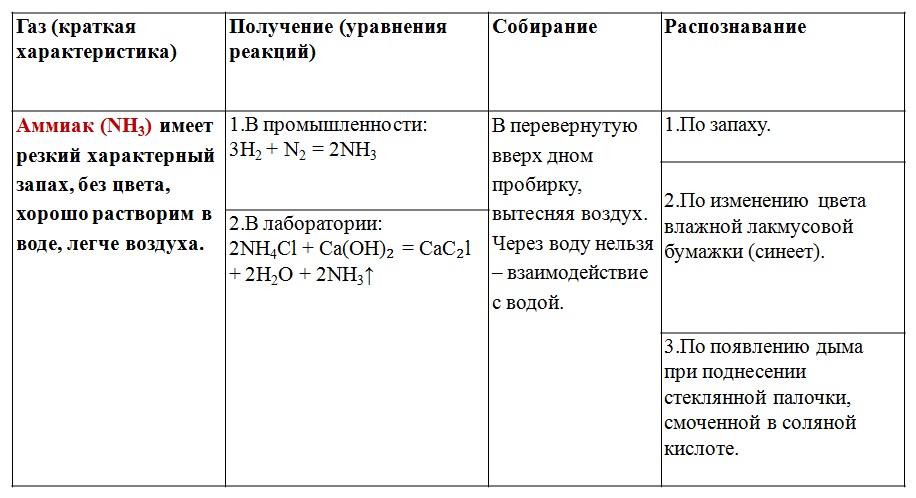 Омска «СОШ № 53»
Омска «СОШ № 53»
Конспект урока химии в 11 классе, 1 час, базовый уровень
Урок «Получение, собирание и распознавание газов».
Практическая работа № 1.
Цели урока: закрепить знания учащихся выполнять химический эксперимент по получению, собиранию и распознаванию газообразных веществ (водорода, углекислого газа, кислорода, аммиака, этилена).
Требования к уровню подготовки учащихся:
Знать:
Способы получения, собирания, распознавания, свойства и применение газообразных веществ;
Правила безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием;
Уметь:
Выполнять химический эксперимент по распознаванию газообразных веществ.
Оборудование и реактивы: пробирки, спиртовка, спички, лучинки, стеклянные трубки; растворы: соляной кислоты, уксусной кислоты, пероксида водорода, известковой воды; цинк, мрамор,
Ход урока.
Организационный момент (проверить готовность к уроку учащихся; отметить в журнале отсутствующих учащихся; сообщить тему и цели урока).
Инструктаж по технике безопасности.
1. Какое воздействие на кожу человека и ткань оказывают кислоты? (При попадании на кожу человека или ткань, кислоты разрушают их).
2. Какое воздействие на кожу человека и ткань оказывают щелочи? (При попадании на кожу человека или ткань, щелочи разрушают их).
3. Как необходимо обращаться с кислотами и щелочами? (Кислоты и щелочи необходимо брать трубкой и только в нужном количестве).
4. Каким образом нужно обращаться со спиртовкой?
Напоминаю, что обращаться со стеклянной посудой нужно очень осторожно, чтобы не раздавить или разбить её. Сколы при разрушении стеклянной посуды очень острые и могут вызвать очень глубокие порезы.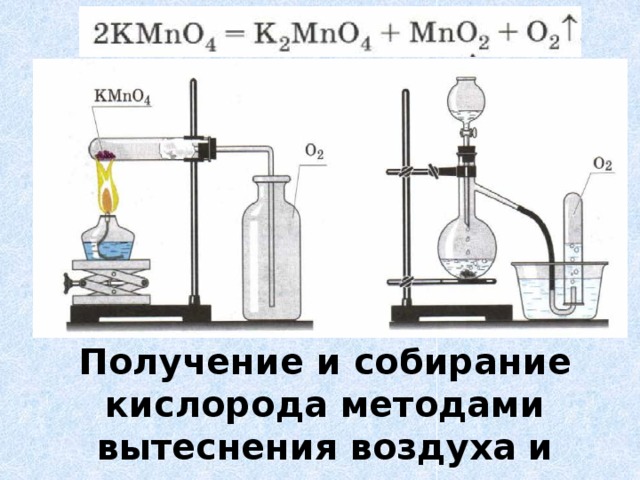
Инструктаж по работе.
Практическую работу вы будете выполнять по инструкции и по вариантам.
В соответствии с вашим вариантом:
дайте название практической работе,
сформулируйте цель,
определите оборудование и реактивы,
при оформлении работы обязательно опишите свои действия и наблюдения,
запишите уравнения химических реакций,
сделайте рисунок установки для получения указанного вам газа,
запишите вывод по работе.
По окончании работы навести порядок на рабочем месте, и сдать микролаборатории.
Выполнение практической работы.

Учащиеся разбиваются на группы для выполнения работы по вариантам:
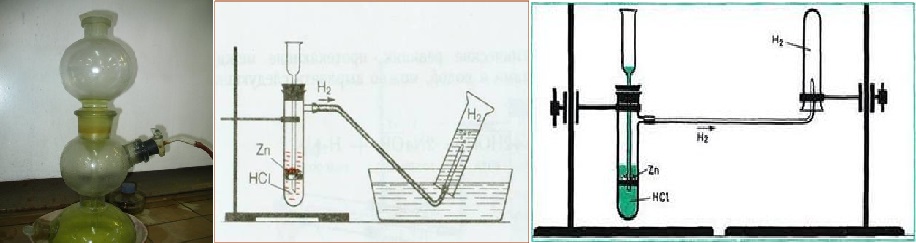
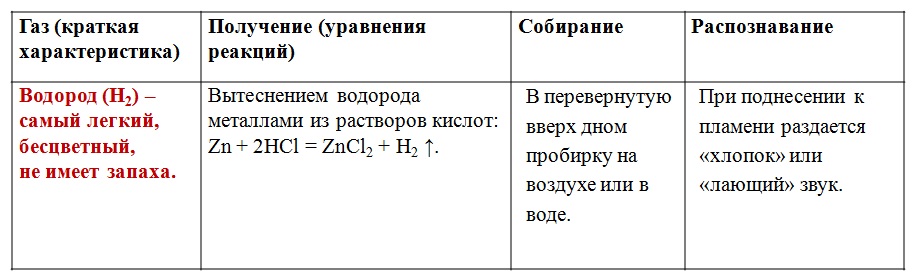
Вариант 1. Получение, собирание и распознавание водорода
Вариант 2. Получение, собирание и распознавание кислорода
Вариант 3. Получение, собирание и распознавание углекислого газа
Вариант 4. Получение, собирание и распознавание аммиака
Вариант 5. Получение, собирание и распознавание этилена
См. Приложение: Инструкции по выполнению практической работы по вариантам
Задание на дом: повторить § 8.
Источники:
Габриелян О.С. Химия. 11 класс. Базовый уровень: метод. Пособие. – М.: Дрофа, 2009
Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для общеобразоват. Учреждений. – М.: Дрофа, 2009
ПРИЛОЖЕНИЕ
Практическая работа № 1
«Получение, собирание и распознавание газов»
Вариант 1. Получение, собирание и распознавание водорода
Получение, собирание и распознавание водорода
В соответствии с вашим вариантом, сформулируйте цель, определите оборудование и реактивы. При оформлении работы обязательно опишите свои действия и наблюдения, запишите уравнения химических реакций, сделайте рисунок установки для получения указанного вам газа, напишите вывод по работе.
Цель:
Оборудование и реактивы:
Ход работы
1. В пробирку поместить две гранулы цинка.
2. Прилить 2 мл раствора соляной кислоты. Что наблюдаете? Запишите уравнение реакции с точки зрения окислительно-восстановительного процесса.
3. Накрыть пробирку-реактор пробиркой большего диаметра.
4. Через 1 – 2 минуты поднимите большую пробирку и, не переворачивая, поднесите её к пламени спиртовки. Что наблюдаете? 5. Что можно сказать о чистоте собранного водорода?
6. Почему водород собирают в перевернутую пробирку?
Почему водород собирают в перевернутую пробирку?
Задания
Запишите уравнение реакции получения водорода в лабораторных условиях.
Опишите способ собирания водорода.
Опишите физические свойства водорода, наблюдаемые при проведении опыта.
Опишите способ распознавания водорода.
Вывод:
По окончании работы наведите порядок на рабочем месте.
Практическая работа № 1
«Получение, собирание и распознавание газов»
Вариант 2. Получение, собирание и распознавание кислорода
В соответствии с вашим вариантом, сформулируйте цель, определите оборудование и реактивы. При оформлении работы обязательно опишите свои действия и наблюдения, запишите уравнения химических реакций, сделайте рисунок установки для получения указанного вам газа, напишите вывод по работе.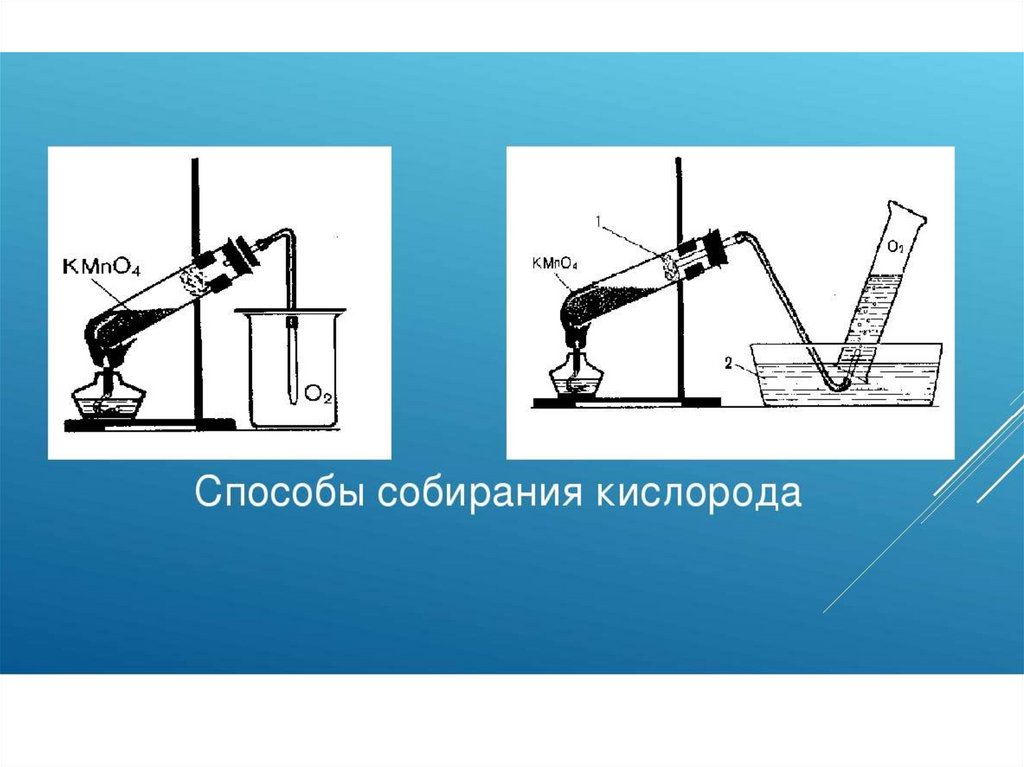
Цель:
Оборудование и реактивы:
Ход работы
1. В пробирку прилить 5 мл раствора пероксида водорода.
2. Подготовьте тлеющую лучину (подожгите ее и, когда она загорится, взмахами руки погасите).
3. Добавьте в пробирку несколько крупинок оксида марганца (IV). Что наблюдаете?
4. Внесите тлеющую лучину в пробирку с раствором пероксида водорода. Что наблюдаете?
Задания
Запишите уравнение реакции получения кислорода в лабораторных условиях.
Опишите способы собирания кислорода.
Опишите физические свойства кислорода, наблюдаемые при проведении опыта.
Опишите способ распознавания кислорода.
Вывод:
По окончании работы наведите порядок на рабочем месте.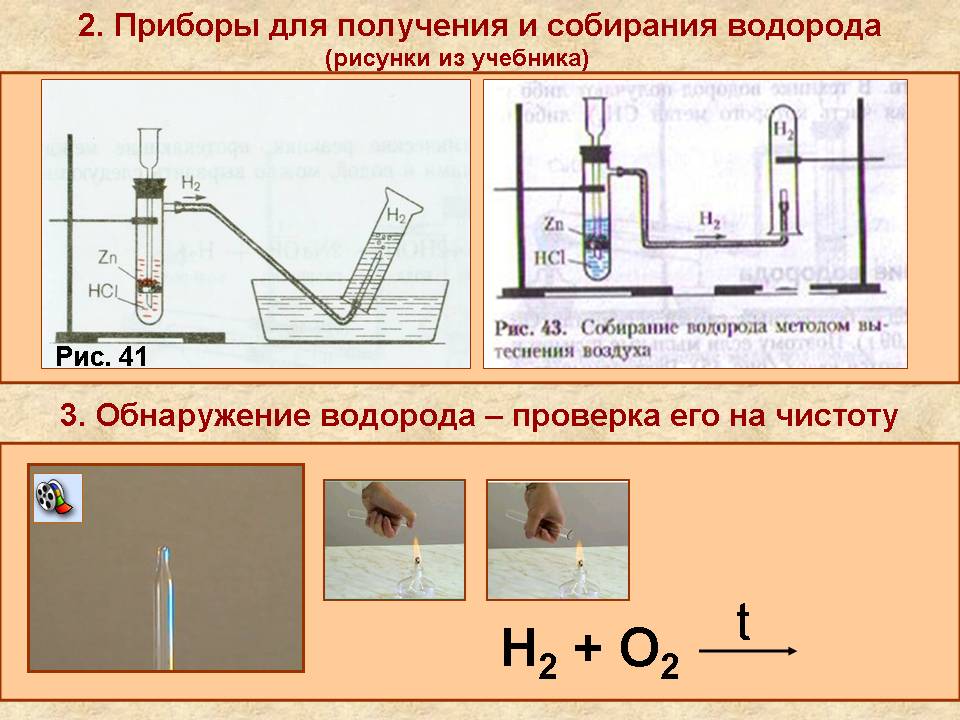
Практическая работа № 1
«Получение, собирание и распознавание газов»
Вариант 3. Получение, собирание и распознавание углекислого газа
В соответствии с вашим вариантом, сформулируйте цель, определите оборудование и реактивы. При оформлении работы обязательно опишите свои действия и наблюдения, запишите уравнения химических реакций, сделайте рисунок установки для получения указанного вам газа, напишите вывод по работе.
Цель:
Оборудование и реактивы:
Ход работы
1. В пробирку поместить кусочек мрамора.
2. Прилить к мрамору 4 мл раствора уксусной кислоты. Что наблюдаете?
3. Приготовьте тлеющую лучину.
4. Внесите тлеющую лучину в пробирку-реактор. Что наблюдаете?
5. В пробирку налейте 2 мл раствора известковой воды.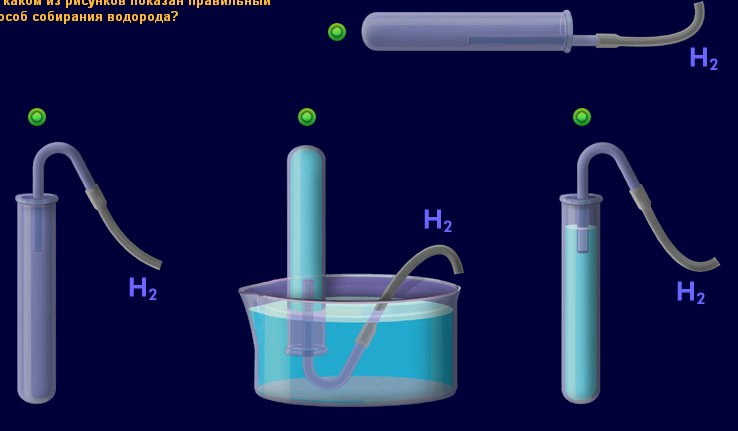
6. Используя чистую стеклянную трубку, осторожно продувайте через неё выдыхаемый воздух. Что наблюдаете?
Задания
Запишите уравнение реакции получения углекислого газа в лабораторных условиях.
Опишите способ собирания углекислого газа.
Опишите физические свойства углекислого газа, наблюдаемые при проведении опыта.
Опишите не менее двух способов распознавания углекислого газа.
Напишите уравнения реакций, происходящих при пропускании углекислого газа через известковую воду в молекулярном и ионном видах.
Вывод:
По окончании работы наведите порядок на рабочем месте.
Практическая работа № 1
«Получение, собирание и распознавание газов»
Вариант 4. Получение, собирание и распознавание аммиака
В соответствии с вашим вариантом, сформулируйте цель, определите оборудование и реактивы. При оформлении работы обязательно опишите свои действия и наблюдения, запишите уравнения химических реакций, сделайте рисунок установки для получения указанного вам газа, напишите вывод по работе.
При оформлении работы обязательно опишите свои действия и наблюдения, запишите уравнения химических реакций, сделайте рисунок установки для получения указанного вам газа, напишите вывод по работе.
Цель:
Оборудование и реактивы:
Ход работы
В пробирку прилейте 1-2 мл хлорида аммония.
Прилейте 1 – 2 мл щелочи.
Закрепите пробирку в держателе и осторожно нагрейте в пламени спиртовки. Что наблюдаете?
Поднесите к отверстию пробирки влажную красную лакмусовую бумажку. Что наблюдаете?
Осторожно понюхайте выделяющийся газ. Что ощущаете?
Задания
Запишите уравнение реакции получения аммиака в лабораторных условиях:
А) из гидроксида кальция и хлорида аммония;
Б) из гидроксида натрия и сульфата аммония..jpg)
Опишите способ собирания аммиака.
Опишите физические свойства аммиака, наблюдаемые при проведении опыта.
Опишите не менее двух способов распознавания аммиака.
Вывод:
По окончании работы наведите порядок на рабочем месте.
Практическая работа № 1
«Получение, собирание и распознавание газов»
Вариант 5. Получение, собирание и распознавание этилена
В соответствии с вашим вариантом, сформулируйте цель, определите оборудование и реактивы. При оформлении работы обязательно опишите свои действия и наблюдения, запишите уравнения химических реакций, сделайте рисунок установки для получения указанного вам газа, напишите вывод по работе.
Цель:
Оборудование и реактивы:
Ход работы
Соберите прибор для получения этилена.
 Проверьте его на герметичность.
Проверьте его на герметичность.В пробирку поместите несколько кусочков или гранул полиэтилена.
Закройте пробкой с газоотводной трубкой и закрепите прибор в лапке штатива, как показано на рисунке.
Нагрейте содержимое пробирки. Что наблюдаете?
Пропустите выделяющийся этилен через йодную (бромную) воду. Что наблюдаете?
Задания
Запишите уравнение реакции получения этилена в лабораторных условиях.
Опишите физические свойства этилена, наблюдаемые при проведении опыта.
Опишите не менее двух способов распознавания этилена.
Напишите уравнение реакций, происходящих при пропускании этилена через йодную (бромную) воду.
Вывод:
По окончании работы наведите порядок на рабочем месте.
Производство, сбор и тестирование газов | Эксперимент
- Три из пяти
Газы представляют особую опасность, поэтому при подготовке, сборе или тестировании необходимо соблюдать особую осторожность
Газы представляют особую опасность, поэтому при их подготовке, сборе или тестировании необходимо соблюдать особую осторожность.
То, как будет использоваться газ, будет отличаться от эксперимента к эксперименту — важно внимательно прочитать конкретные инструкции, данные или упомянутые в экспериментальной процедуре, и любые сопутствующие технические примечания. Это особенно важно, если газ необходимо осушать.
Газы могут собираться путем подачи вверх или вниз или над водой. См. конкретную информацию по каждому газу ниже.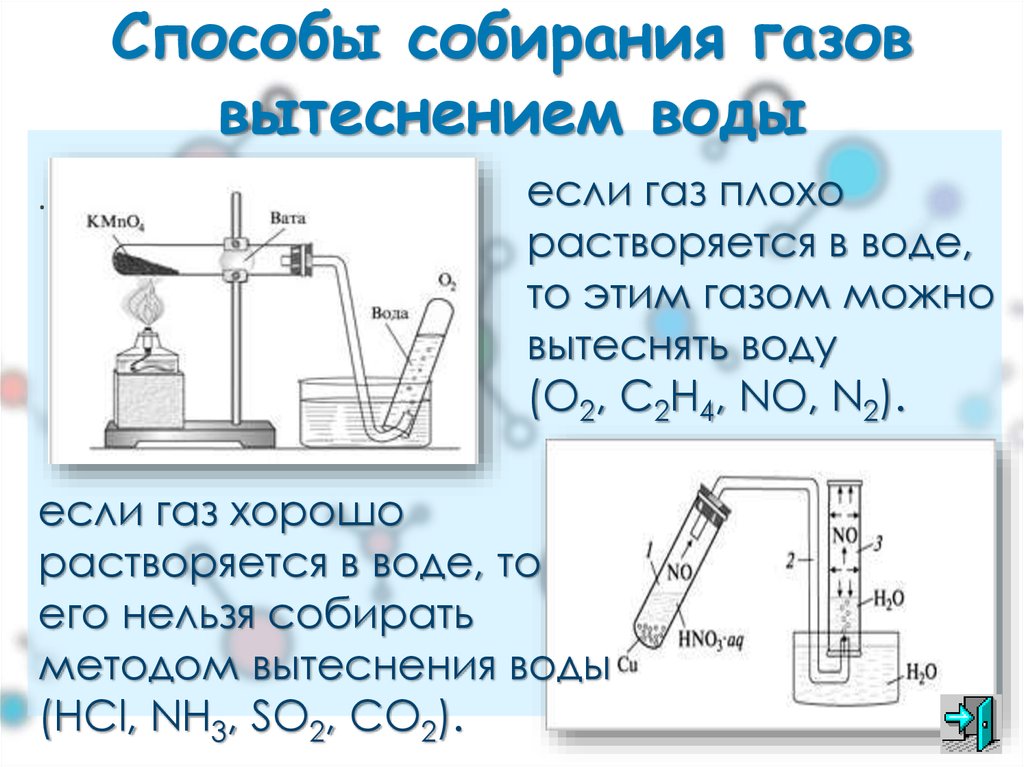
Примечание
В дополнение к приведенным ниже инструкциям, пожалуйста, обратитесь к нашему стандартному руководству по охране труда и технике безопасности и к CLEAPSS Лабораторный справочник , раздел 13.2.2.
Общая подготовка газов
На приведенной ниже диаграмме показан стандартный набор аппаратов, которые можно использовать для подготовки ряда газов.
Источник: Королевское химическое общество
Типовое устройство, используемое для подготовки ряда газов
Методы сбора газа
На приведенных ниже схемах показаны три различных метода сбора газа.
Источник: Королевское химическое общество
Три метода сбора газов
Подготовка определенных газов
Носите соответствующие средства защиты глаз. Приведенных ниже количеств достаточно для образования 1 литра (1 дм 3 ) каждого из названных газов.
Углекислый газ, CO
2 Медленно добавьте 42 см 3 2 М соляной кислоты (РАЗДРАЖАЮЩЕЕ) к избытку мраморной крошки. Соберите газ путем подачи вниз или над водой (слабо растворимой).
Соберите газ путем подачи вниз или над водой (слабо растворимой).
См. карты опасности CLEAPSS HC020a и HC047a, а также книгу рецептов CLEAPSS RB021.
Водород, H
2Медленно добавьте 28 см 3 3 М соляной кислоты (КОРРОЗИОННОЕ ВЕЩЕСТВО) к избытку гранул цинка и 1 г гидратированного сульфата меди (ВРЕДНО). Соберите газ путем подачи вверх или над водой.
См. карты опасности CLEAPSS HC048, HC047a, HC107 и HC027c, а также книгу рецептов CLEAPSS RB044.
Газообразный водород ЧРЕЗВЫЧАЙНО ОГНЕОПАСЕН – убедитесь, что нет открытого огня.
Кислород, O
2Медленно добавить 50 см 3 20 об. перекиси водорода (РАЗДРАЖАЮЩИЙ) в порошок оксида марганца (IV) (ВРЕДНЫЙ). Соберите газ над водой.
См. карту опасности CLEAPSS HC069, HC050 и HC060, а также книгу рецептов CLEAPSS RB064.
Кислород является ОКИСЛИТЕЛЕМ.
Хлор, Cl 2 Работа в вытяжном шкафу. Способ 2 безопаснее и рекомендуется, но медленнее.
Способ 2 безопаснее и рекомендуется, но медленнее.
Метод 1
Добавьте 14 см 3 концентрированной соляной кислоты (КОРРОЗИОННОЕ) к не менее 3 г манганата калия(VII) (ОКИСЛЯЮЩИЙ, ВРЕДНЫЙ И ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ).
Дважды проверьте, что кислота является соляной, а НЕ серной. См. карты опасностей CLEAPSS HC022a, HC047a и HC081, а также книгу рецептов CLEAPSS RB024.
Метод 2
Добавьте 5 М соляной кислоты (РАЗДРАЖАЮЩЕЕ СРЕДСТВО) в 30 см 3 недавно приобретенного (10–14% доступного хлора) раствора хлората натрия (I) (КОРРОЗИОННОЕ ВЕЩЕСТВО) при интенсивном перемешивании. Обратите внимание, что хлорат натрия (I) доступен только в виде раствора, который часто называют «гипохлоритом натрия»; его не следует путать с хлоратом натрия (V) (иногда его просто называют «хлорат натрия»), который представляет собой белое кристаллическое твердое вещество. Школьные образцы часто реагируют слишком медленно, потому что используется старый хлорат натрия(I).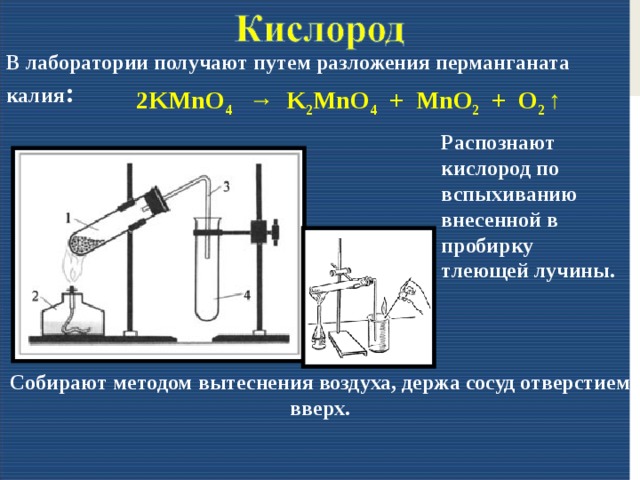 Это будет иметь меньше, чем требуемые 10% доступного хлора (как это применимо к обоим методам). См. карты опасности CLEAPSS HC022a, HC047a и HC089., а также книга рецептов CLEAPSS RB024.
Это будет иметь меньше, чем требуемые 10% доступного хлора (как это применимо к обоим методам). См. карты опасности CLEAPSS HC022a, HC047a и HC089., а также книга рецептов CLEAPSS RB024.
Источник: Королевское химическое общество
Оборудование, необходимое для подготовки газообразного хлора
Соберите газ путем подачи вниз. Хлор классифицируется как ТОКСИЧНЫЙ, РАЗДРАЖАЮЩИЙ и ОПАСНЫЙ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции. Практические занятия по химии сопровождают практические занятия по физике и практической биологии.
Этот ресурс также является частью курса непрерывного профессионального развития Королевского химического общества: Химия для неспециалистов.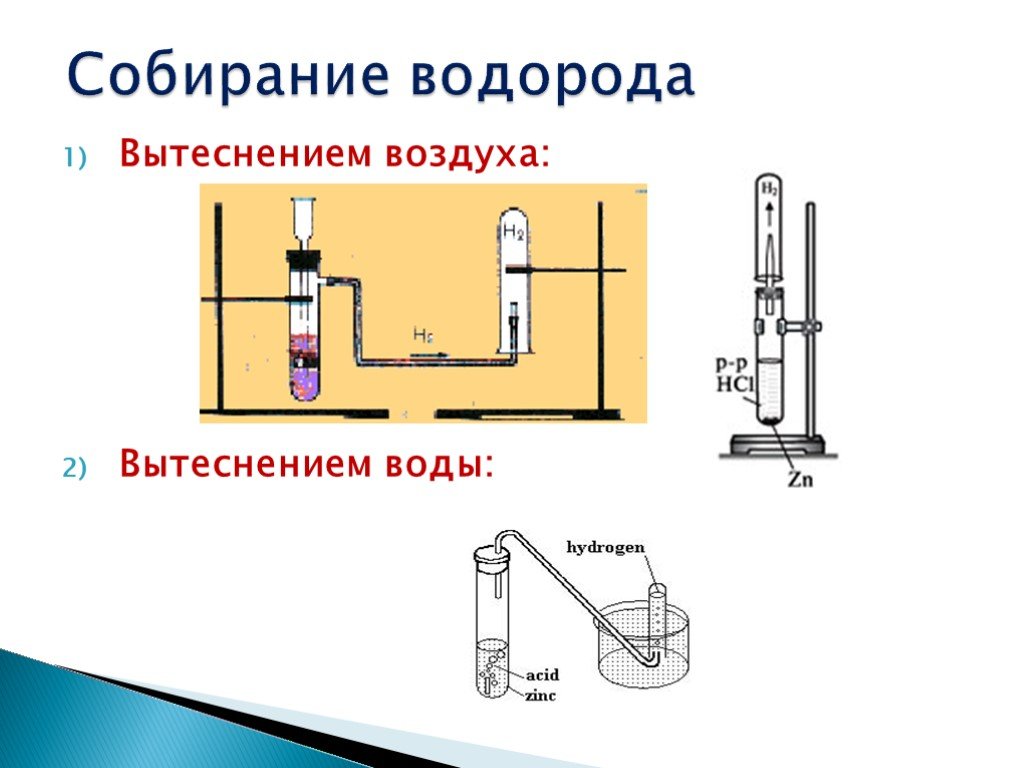
© Фонд Наффилда и Королевское химическое общество
Проверка здоровья и безопасности, 2016 г.
- Три из пяти
Цветовой спектр водорода | National Grid Group
Но разве водород не бесцветный газ?
Да, водород — невидимый газ. Таким образом, несколько сбивая с толку и несмотря на их красочные описания, между различными типами водорода нет видимой разницы.
Почему бесцветный газ назван так много красочно?
Зеленый водород, синий водород, коричневый водород и даже желтый водород, бирюзовый водород и розовый водород. По сути, это цветовые коды или прозвища, используемые в энергетической отрасли для различения типов водорода.
В зависимости от типа используемого производства водороду присваиваются разные цвета. Но не существует универсального соглашения об именах, и эти определения цветов могут меняться со временем и даже между странами.
Но не существует универсального соглашения об именах, и эти определения цветов могут меняться со временем и даже между странами.
В настоящее время мы привыкли к голубому пламени газа, так какого же цвета будет пламя водорода?
Промышленность еще не пришла к единому мнению по этому поводу, но это будет наиболее очевидной разницей для людей, которые привыкли видеть голубое пламя газа внутри своих котлов или при розжиге варочных панелей. Цвет пламени для водорода будет специально добавлен. Вы готовы к зеленому пламени?
Вот наше руководство по разблокировке текущего цветового кода водорода.
Зеленый водород
В калейдоскопе водородных цветов зеленый водород производится без вредных выбросов парниковых газов . Зеленый водород производится с использованием чистого электричества из избыточных возобновляемых источников энергии, таких как энергия солнца или ветра, для электролиза воды. Электролизеры используют электрохимическую реакцию для расщепления воды на компоненты водорода и кислорода, при этом не выделяется углекислый газ.
Зеленый водород в настоящее время составляет небольшой процент от общего количества водорода, потому что его производство дорого. Так же, как энергия ветра снизилась в цене, зеленый водород будет дешеветь по мере того, как он станет более распространенным.
Голубой водород
Голубой водород производится в основном из природного газа с использованием процесса, называемого паровым риформингом, который объединяет природный газ и нагретую воду в виде пара. На выходе получается водород, а также двуокись углерода в качестве побочного продукта. значит 9Улавливание и хранение углерода 0026 (CCS) необходимо для улавливания и хранения этого углерода.
Синий водород иногда называют «низкоуглеродистым водородом», поскольку процесс парового риформинга фактически не позволяет избежать образования парниковых газов.
Серый водород
В настоящее время это наиболее распространенная форма производства водорода. Серый водород создается из природного газа или метана с использованием паровой конверсии метана, но без улавливания парниковых газов сделал в процессе.
Черный и коричневый водород
При использовании черного угля или лигнита (бурого угля) в процессе производства водорода этот черный и коричневый водород являются полной противоположностью зеленого водорода в водородном спектре и наиболее вредны для окружающей среды.
Просто чтобы запутать вещи, любой водород, полученный из ископаемого топлива в процессе «газификации», иногда называют черным или коричневым водородом попеременно.
Недавно Япония и Австралия объявили о новом проекте по производству водорода из бурого угля. Этот проект будет использовать бурый уголь в Австралии для производства сжиженного водорода, который затем будет отправлен в Японию для использования с низким уровнем выбросов.
Розовый водород
Розовый водород получают путем электролиза с использованием ядерной энергии. Водород, произведенный в атомной энергетике, также может называться фиолетовым водородом или красным водородом.
Кроме того, очень высокие температуры ядерных реакторов можно использовать в других производствах водорода, производя пар для более эффективного электролиза или парового риформинга метана на основе ископаемого газа.
Бирюзовый водород
Это новая запись в диаграммах водородных цветов, производство которой еще предстоит опробовать в больших масштабах. Бирюзовый водород производится с использованием процесса, называемого пиролизом метана, для получения водорода и твердого углерода. В будущем бирюзовый водород может быть оценен как водород с низким уровнем выбросов, в зависимости от теплового процесса, работающего на возобновляемой энергии, и постоянного хранения или использования углерода.
Желтый водород
Желтый водород — относительно новое название водорода, полученного путем электролиза с использованием солнечной энергии .
Белый водород
Белый водород — природный геологический водород, обнаруженный в подземных месторождениях и созданный путем гидроразрыва пласта. В настоящее время нет никаких стратегий использования этого водорода.
Будущее водорода как источника энергии
В настоящее время в различных частях мира осуществляются проекты, изучающие возможности использования водорода в качестве источника энергии.
В Великобритании FutureGrid проводит испытания водородных смесей в автономных газопроводах, а Project Union изучает разработку водородной «основы», объединяющей промышленные кластеры по всей стране.
Аналогичным образом, проект HyGrid Project , один из первых и крупнейших проектов по производству чистого водорода в США, как ожидается, обеспечит отопление примерно 800 домов за счет смешивания зеленого водорода с существующей системой распределения.
Д-р Даниэль Стюарт, менеджер по долгосрочной стратегии передачи газа в National Grid, говорит: «Чтобы своевременно, честно и справедливо достичь нулевого уровня выбросов, нам необходимо изучить ряд решений. Расширение масштабов и выбор из палитры чистого водорода могут способствовать обезуглероживанию домов, транспорта, промышленности и энергетики. National Grid исследует и внедряет различные дополнительные технологии для обеспечения потребителей чистой, доступной, надежной и устойчивой энергией».

 (водород)
(водород)
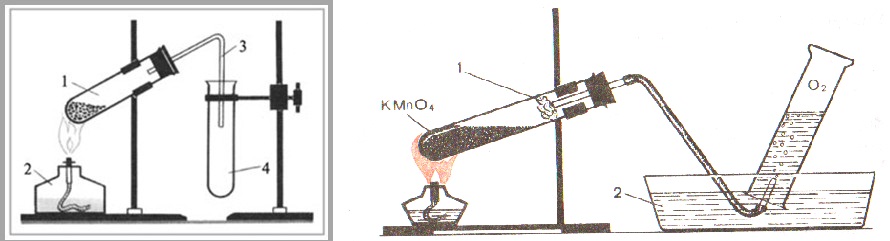
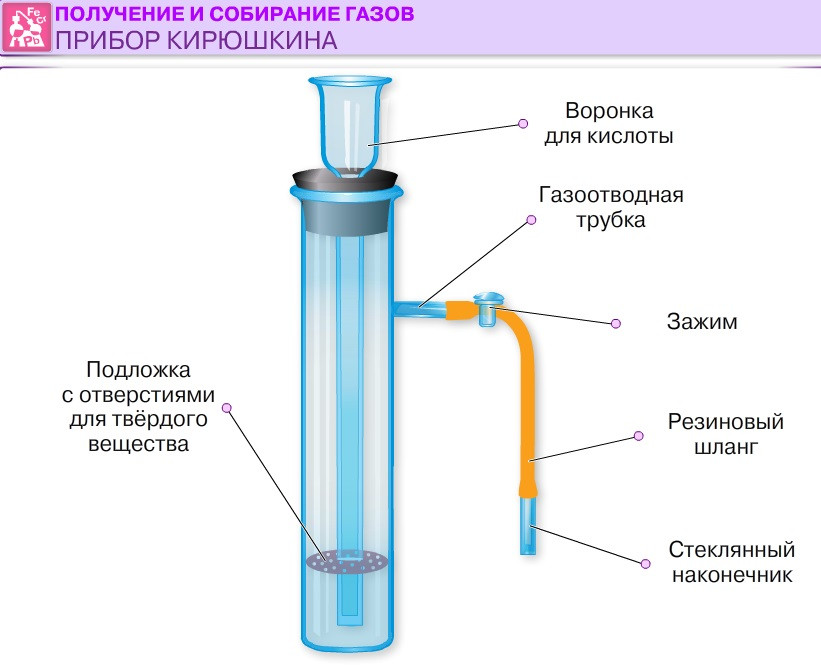 В пробирку насыпали примерно на 1/4 ее объема перманганата калия, отверстие пробирки закрыли пробкой с газоотводной трубкой.
В пробирку насыпали примерно на 1/4 ее объема перманганата калия, отверстие пробирки закрыли пробкой с газоотводной трубкой.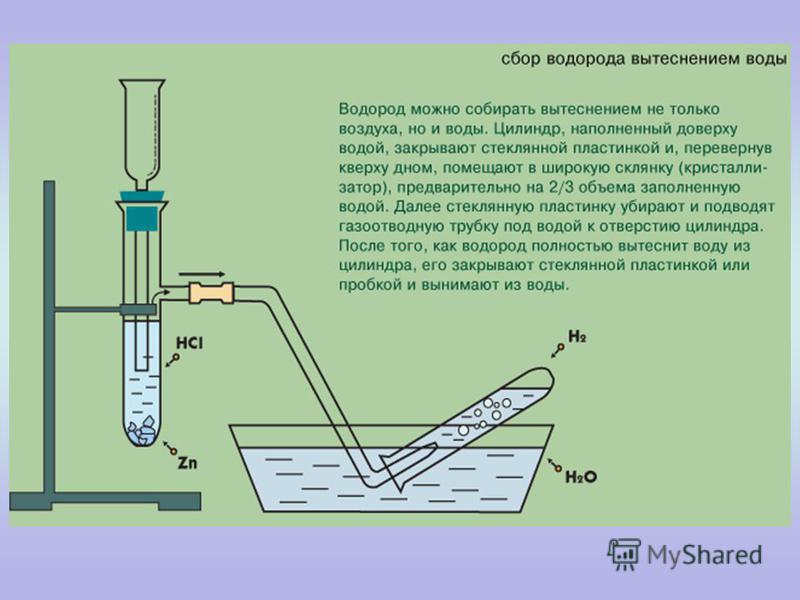 Что наблюдаете? Запишите уравнение химической реакции.
Что наблюдаете? Запишите уравнение химической реакции.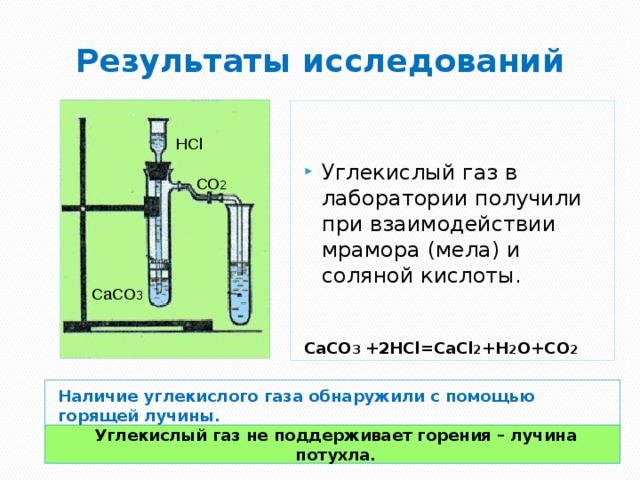
 Проверьте его на герметичность.
Проверьте его на герметичность.