Схемы превращений веществ в органической химии — УГЛЕВОДОРОДЫ | Презентация к уроку по химии (10 класс) по теме:
Слайд 1
СХЕМЫ ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ В ОРГАНИЧЕСКОЙ ХИМИИ УГЛЕВОДОРОДЫ: получение и свойства УЧИТЕЛЬ ХИМИИ : МАКАРКИНА М.А.Слайд 2
Осуществите превращения по схеме и назовите вещества: 1 . CH ₄→ CH₃Cl → C₂H₆ → C₂H₅Cl → C₂H₄ → C₂H₅Cl → → CH₃CH₂Cl 1) CH ₄ → CH₃Cl CH ₄ + Cl ₂ = CH₃Cl + HCl (h ν ) метан хлорметан 2) CH₃Cl → C₂H₆ 2CH₃Cl + 2Na = C₂H₆ + 2NaCl этан CH₃- Cl
Слайд 3
3) C₂H₆ → C₂H₅Cl C₂H₆ + Cl ₂ = C₂H₅Cl + HCl (h ν ) этан хлорэтан 4) C₂H₅Cl → C₂H₄ C₂H₅Cl + NaOH = C₂H₄ + NaCl ( спиртовой этен (этилен) раствор) 5) C₂H₄ → C₂H₅Cl C₂H₄ + HCl = C₂H₅Cl этилен хлорэтан CH ₂ = CH ₂ CH ₃-CH₂- Cl
Слайд 4
6 ) C₂H₅Cl → CH₃CHCl ₂ C₂H₅Cl + Cl ₂ = CH₃CHCl ₂ + HCl (h ν ) хлорэтан 1,1-дихлорэтан (CH₃- CH₂Cl ) CH₃-CH- Cl | Cl
Слайд 5
Осуществите превращение по схеме: напишите уравнения реакций в структурной форме. 1) CH ₃ — CH ₃ + Cl ₂ → CH₃- CH₂Cl + HCl (h ν ) э тан → хлорэтан → б утан → изобутан → 2 -метил- 2 -хлорпропан →2 -метилпропен- 1→ 2 -метилпропанол- 2 этан → хлорэтан хлорэтан → бутан 2) 2CH₃- CH₂Cl + 2Na → CH₃- CH₂ — CH₂- CH₃ + 2NaCl
Слайд 6
б утан → изобутан 2 -метил- 2 -хлорпропан изобутан → CH₃- CH₂ — CH₂- CH₃ → CH₃-CH-CH₃ ( kat . AlCl ₃) | CH₃ CH₃-CH-CH₃ + Cl ₂ → CH₃-C-CH₃ + HCl | / \ CH₃ CH₃ Cl
AlCl ₃) | CH₃ CH₃-CH-CH₃ + Cl ₂ → CH₃-C-CH₃ + HCl | / \ CH₃ CH₃ Cl
Слайд 7
2 -метил- 2 -хлорпропан → 2 -метилпропен- 1 CH₃-C-CH₃ + NaOH → / \ ( спиртовой CH₃ Cl раствор) CH₂=C-CH₃ + NaCl + H₂O | CH₃ 2 -метилпропанол- 2 2 -метилпропен- 1 → CH₂=C-CH₃ + H₂O → CH₃- CH-CH₃ | ( H₂SO₄) / \ CH₃ CH₃ OH
Слайд 8
Осуществите превращения по схеме: CH₃-CH₂-CH₃ А Б Br ₂ h ν Br ₂ h ν 2 NaOH спирт CH ₃ -CH ₂- CH ₃ + Br₂ = CH₃-CH-CH₃ + HBr | Br CH ₃ -CH ₂- CH ₃ A A Б CH₃- CHBr -CH₃ + Br₂ = CH₃ — C — CH₃ + HBr / \ Br Br В
Слайд 9
Б В 2 NaOH спирт CH₃ — C — CH₃ + 2NaOH = CH—C-CH₃ +2NaBr + 2H₂O / \ Br Br — —
Слайд 10
C ₂ H ₅ Cl А Б В Г Д Е NaOH спирт H ₂ O H ₃ PO ₄ Al ₂ O ₃, ZnO 425⁰C Br ₂ H ₂ O H ₂ kat , t ⁰C полимеризация Найдите соответствие: А 1) C ₂ H ₅ OH Б 2 ) C ₂ H ₄ В 3) ( — CH₂—CH=CH—CH₂—) n Г 4) CH ₂=CH—CH=CH₂ Д 5 ) CH ₂Br —CH=CH— CH₂Br Е 6 ) BrCH ₂ —CH₂—CH₂— CH₂Br А — 2; Б – 1; В — 4; Г — 5; Д — 6; Е — 3
Слайд 11
1) C ₂ H ₅ Cl + NaOH → C ₂ H ₄ + NaCl ( спирт ) C₂H₄ + H₂O → C₂H₅OH ( H₃PO₄) 3 ) C₂H₅OH → CH₂=CH—CH=CH₂ Al ₂ O ₃ 425⁰C 4) CH₂=CH—CH=CH₂ + Br₂ → CH₂Br —CH=CH— CH₂Br 5) CH₂Br -CH=CH- CH₂Br + H₂ → CH₂Br -CH₂-CH₂- CH₂Br kat,t ⁰C 6) CH₂=CH-CH=CH₂ → (-CH₂-CH=CH-CH₂-) n полимеризация CH₃-CH₂-OH
Слайд 12
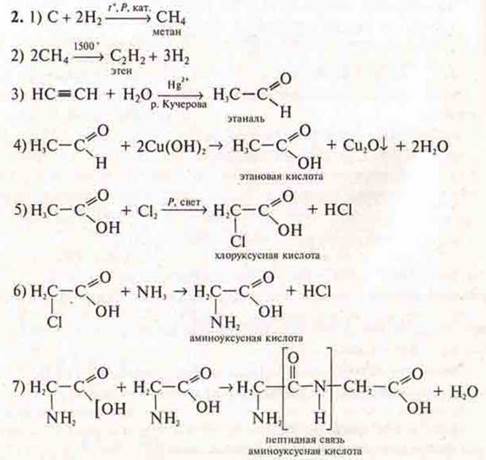
Напишите уравнения реакций согласно цепочке превращений: CaC ₂ → C ₂ H ₂ → C₂H₄ → C₂H₄Cl ₂ → C₂H₂ → CH₃−CHO ↓ ↓ C₆H₆ CO₂ 1) CaC ₂ → C₂H₂ CaC ₂ + 2H₂O = C₂H₂ + Ca(OH)₂ 2) C₂H₂ → C₂H₄ C₂H₂ + H₂ = C₂H₄
Слайд 13
3) C₂H₄ → C₂H₄Cl ₂ CH ₂= CH ₂ + Cl ₂ → CH₂−CH₂ | | Cl Cl 4) C₂H₄Cl ₂ → C₂H₂ условия: NaOH ( спирт .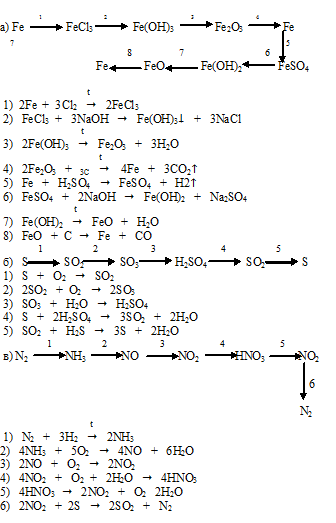 р-р ) C ₂ H ₄ Cl ₂ + 2NaOH → 2NaCl + 2H₂O + C₂H₂ C₂H₂ → CH₃−C=O | H C ₂ H ₂ + H ₂ O → CH₃−CHO ( kat ) 6) CH₃− CHO → CO₂ CH ₃−CHO + 3O₂ → 2CO₂ + 2H₂O
р-р ) C ₂ H ₄ Cl ₂ + 2NaOH → 2NaCl + 2H₂O + C₂H₂ C₂H₂ → CH₃−C=O | H C ₂ H ₂ + H ₂ O → CH₃−CHO ( kat ) 6) CH₃− CHO → CO₂ CH ₃−CHO + 3O₂ → 2CO₂ + 2H₂O
Слайд 14
СПАСИБО ЗА ВНИМАНИЕ 3C₂H₂ → C₆H₆ условия: t⁰C , kat .
Напишите, пожалуйста Как осуществить цепочку превращений в химии.и химические свойства
Классы неорганических веществ:простые вещества: H₂, O₂, S, P, Cl₂, Na, Fe, Al
сложные вещества: оксиды, соли, кислоты, основания(щелочи), соли.
Между классами неорганических (также и органических веществ)веществ существует генетическая связь. То есть на основе их химических свойств из одного класса веществ можно получить вещества другого класса
Кислотные оксиды могут взаимодействовать с щелочами, с основаниями оксидами,
Основные оксиды могут взаимодействовать с кислотами, с кислотными оксидами, с металлами.
Кислоты могут взаимодействовать с металлами, с основными оксидами, с основаниями, с солями.
Основания могут взаимодействовать с кислотами, щелочи могут взаимодействовать с кислотами, с кислотными оксидами
Соли могут взаимодействовать с кислотами, со щелочами, друг с другом
Например, нам надо осуществить превращение:
а) водород ⇒водаH₂O ⇒гидроксид натрия(щелочь)NaOH ⇒сульфат натрия(соль)Na₂SO₄⇒ сульфат бария(соль)BaSO₄
2H₂ + O₂= 2H₂O
2H₂O + 2Na = 2NaOH + H₂
2NaOH + H₂SO₄= Na₂SO₄ + 2H₂O
Na₂SO₄ + BaCl₂= BaSO₄ + 2NaCl
б) Na₂CO₃ ⇒ CO₂ ⇒ CO ⇒CO₂ ⇒ Na(HCO₃)
Na₂CO₃ + 2HCl = 2NaCl + CO₂ +H₂O
CO₂ + C = 2CO
2CO + O₂ = 2CO₂
CO₂ +Na₂CO₃ + H₂O = Na(HCO₃)
в) CO₂ ⇒ CaCO₃ ⇒ Ca(HCO₃)₂ ⇒ CaCO₃ ⇒ CaCl₂
CO₂ + Ca(OH)₂ = CaCO₃ + H₂O
CaCO₃ +2H-OH = Ca(HCO₃)₂ + Ca(OH)₂
Ca(HCO₃)₂ = CaCO₃ + CO₂ + H₂O или
Ca(HCO₃)₂ + Ca(OH)₂ = 2CaCO₃ + 2H₂O
CaCO₃ + 2HCl = CaCl₂ + CO₂ + H₂O
Превращение азота
N₂ ⇒ NH₃аммиак ⇒ (NH₄)₂SO₄сульфат аммония ⇒ NH₃аммиак ⇒ NOоксид азота(ll)
N₂ +3H₂ = 2NH₃
2NH₃ + H₂SO₄(конц.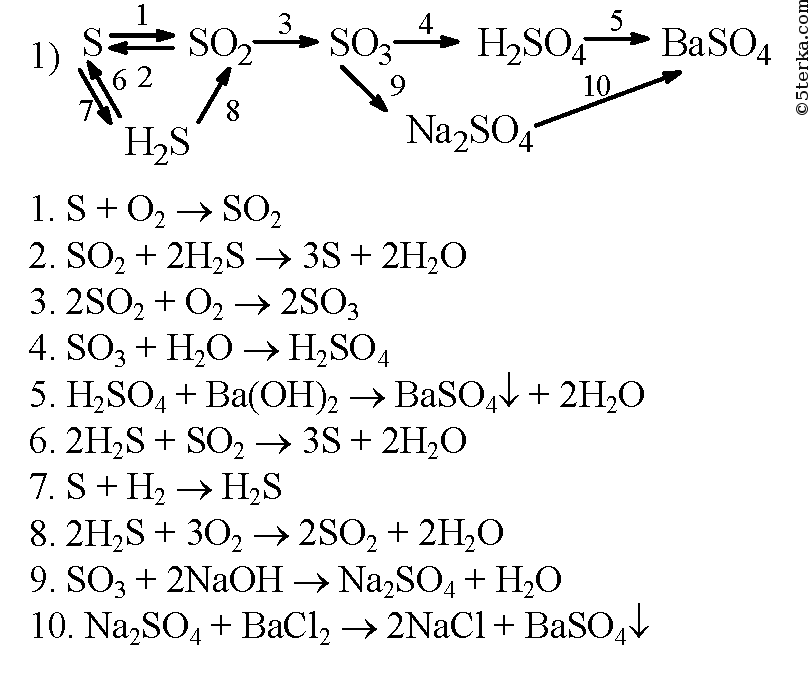 )= (NH₄)₂SO₄
)= (NH₄)₂SO₄
(NH₄)₂SO₄ + 2 NaOH + t = 2 NH₃+ Na₂SO₄ + 2 H₂O или
(NH₄)₂SO₄ + t(147⁰C) = NH₄HSO₄ + NH₃
NH₄HSO₄ + t(≥500⁰C) = NH₃ + SO₃ + H₂O (эти реакции возможны при повышенной
температуре)
4NH₃ + 5O₂ = 4NO + 6H₂O (эта реакция возможна при высокой
температуре и высоком давлении,
при участии Pt, Cr₂O₃ — катализаторы ).
Формализация схемы превращений углеводородов в процессе дегидрирования высших алканов С9-С14 на поверхности платиновых катализаторов
Please use this identifier to cite or link to this item: http://earchive.tpu.ru/handle/11683/2597
| Title: | Формализация схемы превращений углеводородов в процессе дегидрирования высших алканов С9-С14 на поверхности платиновых катализаторов |
| Authors: | Францина, Евгения Владимировна Афанасьева, Юлия Ивановна Функ, Андрей Андреевич Ивашкина, Елена Николаевна Кравцов, Анатолий Васильевич |
| Keywords: | дегидрирование; углеводороды; квантово-химические расчеты; термодинамика; моделирование; линейный алкилбензол |
| Issue Date: | 2009 |
| Publisher: | Томский политехнический университет |
| Citation: | Формализация схемы превращений углеводородов в процессе дегидрирования высших алканов С9-С14 на поверхности платиновых катализаторов / Е. В. Францина [и др.] // Известия Томского политехнического университета [Известия ТПУ]. — 2009. — Т. 314, № 3 : Химия. — [С. 85-89]. В. Францина [и др.] // Известия Томского политехнического университета [Известия ТПУ]. — 2009. — Т. 314, № 3 : Химия. — [С. 85-89]. |
| Abstract: | На основе квантово-химических расчетов показана термодинамическая вероятность протекания химических реакций в процессе дегидрирования высших алканов С9-С14 и предложен уровень формализации механизма превращений на платиновом катализаторе. Составленная схема превращений стала основой кинетической модели процесса дегидрирования высших алканов С9-С14 на платиновом катализаторе, позволяющей учесть влияние химического состава сырья на эффективность его работы. |
| URI: | http://earchive.tpu.ru/handle/11683/2597 |
| ISSN: | 1684-8519 |
| Appears in Collections: | Известия ТПУ |
Items in DSpace are protected by copyright, with all rights reserved, unless otherwise indicated.
Общая схема химических превращений — Справочник химика 21
Механизм образования сажи (дисперсного углерода) при горении реактивного топлива и в общем случае при химических превращениях углеродсодержащих веществ изучен еще недостаточно. Исследователи основную роль отводят полимеризации или цепным разветвленным реакциям. В последнем случае физико-химическая модель процесса включает разветвленные цепные реакции образования радикалов-зародышей, превращение их в зародыши твердой фазы (минимальные частицы, имеющие физическую поверхность) и дальнейший рост зародышей за счет гетерогенного разложения углеводородов на их поверхности. Сторонники полимеризационной схемы отмечают, что образование ацетилена наблюдается даже в метано Кисло-родном пламени. После достижения максимальной концентрации ацетилен превращается в моно- и полициклические ароматические углеводороды и полиацетилен. Экспериментально показано также, что в соответствующих условиях появлению сажевых частиц предшествует образование (в результате полимеризации) крупных углеводородных молекул с молекулярной массой примерно 500.
Исследователи основную роль отводят полимеризации или цепным разветвленным реакциям. В последнем случае физико-химическая модель процесса включает разветвленные цепные реакции образования радикалов-зародышей, превращение их в зародыши твердой фазы (минимальные частицы, имеющие физическую поверхность) и дальнейший рост зародышей за счет гетерогенного разложения углеводородов на их поверхности. Сторонники полимеризационной схемы отмечают, что образование ацетилена наблюдается даже в метано Кисло-родном пламени. После достижения максимальной концентрации ацетилен превращается в моно- и полициклические ароматические углеводороды и полиацетилен. Экспериментально показано также, что в соответствующих условиях появлению сажевых частиц предшествует образование (в результате полимеризации) крупных углеводородных молекул с молекулярной массой примерно 500. Химические процессы при электролизе. Электролиз представляет собой процесс, в котором химические реакции происходят под действием электрического тока.
 Химические превращения при электролизе могут быть весьма различными в зависимости главным образом от вида электролита и растворителя, а также от материала электродов и присутствия других веществ в растворе. Наиболее общей является следующая схема процесса. [c.443]
Химические превращения при электролизе могут быть весьма различными в зависимости главным образом от вида электролита и растворителя, а также от материала электродов и присутствия других веществ в растворе. Наиболее общей является следующая схема процесса. [c.443]ОБЩАЯ СХЕМА ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ [c.26]
Необходимо ПОМНИТЬ, что отдельные составляющие баланса суммируются алгебраически. Например, при эндотермической реакции теплоту химического превращения (тепловой эффект) нужно брать с отрицательным знаком. Отрицательной считается также теплота, переданная через стенки реактора, когда она подводится с внешней их стороны к реакционному пространству. Следовательно, включение этих двух членов уравнения в приход или расход общей схемы баланса условно. [c.293]
Рассмотрим схему химических превращений, где будем выделять исходные вещества и продукты и промежуточные вещества (в. . Общая схема химических превращений имеет вид [c.
Рассмотрение общей схемы химических превращений хлорсодержащих полимеров позволяет высказать предположение, что неграфитирующимися формами углерода должны оказаться также продукты карбонизации вицинального поливинилхлорида с 1,2-положением галоида в макромолекулярной цепи. [c.173]
Общая схема химических превращений (рис. И-1) включает двенадцать классов элементарных реакций первого или второго порядка, протекающих с участием частиц определенных групп. Механизм реакций каждого класса (с указанием их возможного числа), а также возможного числа реагирующих или образующихся компонентов, приводится в табл. 11,1. [c.29]
По существу, выделенные этапы синтеза технологической схемы составляют иерархию принятия решений и являются следствием применения принципов системного подхода. Не все из этапов поддаются строгой математической формализации, вследствие чего решение проблемы синтеза наиболее целесообразно вести в режиме активного диалога с возможной коррекцией каждого этана.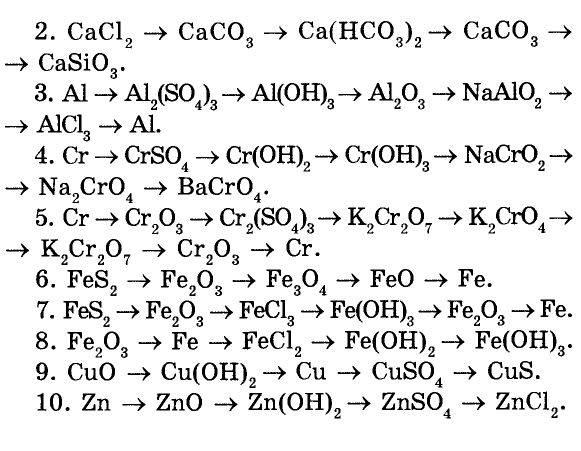
При исследовании сложных систем с неизвестной схемой химических превращений необходимо прежде всего идентифицировать все образующиеся продукты, в том числе и микропримеси, которые могут иногда играть важную роль как реакционноспособные промежуточные вещества. При составлении возможных схем превращения учитывают общие закономерности органической хи-
Для отдельных групп соединений схемы химических превращений, происходящих при крекинге и гидрогенизации, в общем виде представлены на фиг. 1 и 2, а более детальное освещение поведения отдельных групп соединений, являющееся необходимым для [c. 17]
17]
В заключение этого раздела нельзя не отметить, что при использовании представлений цепной теории для объяснения механизма сложных химических превращений в конденсированной фазе и в гетерогенном катализе применение простых радикальных схем зачастую сталкивается с почти непреодолимыми трудностями. Вместе с тем нет никаких оснований отвергать предложенное выше общее положение о том, что реакция и в этих случаях протекает по сложному механизму, обеспечивающему значительную скорость превращения (в отсутствие каких-либо инициирующих добавок или внешних источников нетепловой энергии) только, если этот механизм позволяет использовать энергию одного цикла реакции до превращения ее в тепло для облегчения другого цикла. [c.219]
Алгоритм сжатия кинетических моделей. Информационная избыточность математического описания при его применении для каждого частного случая, соответствующего превращению заданного состава сырья, является довольно общей проблемой при моделировании сложных химических превращений, включающих большое число компонентов и элементарных стадий, для которых в ряде случаев оказывается, что при определенных условиях (когда только одна или несколько начальных концентраций компонентов реакционной смеси отличны от нуля) часть компонентов не принимает участия в химических превращениях и некоторые элементарные стадии не протекают, тогда как основное число арифметических операций, приходящихся на вычисление правых частей кинетических уравнений (4.
Хотя описанная схема удовлетворительно объясняет причины разнообразия обнаруживаемых в природе форм нативных нефтяных ВМС и позволяет прогнозировать пх общие характеристики (макроструктуру и связанные с ней свойства, среднюю ароматичность и отдельные особенности фрагментного состава) по геохимическим данным и физико-химическим свойствам нефти, она отражает лишь самый общий характер п общую последовательность возможных превращений сложнейших компонентов нефти. Многие стороны и тонкие детали этих процессов (кинетические характеристики, количественные соотношения структурных фрагментов на разных стадиях превращений и т. д.) пока остаются не выясненными, и их познание требует выполнения огромной исследовательской работы но накоплению и творческому осмысливанию новых экспериментальных данных. [c.202]
д.) пока остаются не выясненными, и их познание требует выполнения огромной исследовательской работы но накоплению и творческому осмысливанию новых экспериментальных данных. [c.202]
Декомпозиция общей задачи синтеза на отдельные подзадачи (синтез стадии химического превращения, синтез стадии выделения продуктов, синтез теплообменной системы) существенно упрощает проблему разработки технологической схемы, однако снижается и вероятность получения действительно оптимального варианта вследствие неадекватного воспроизведения взаимосвязей между подзадачами. Поэтому процесс выбора технологической схемы является итерационным, с внесением изменений в стратегию поиска оптимального решения на каждой из стадий. [c.107]
Уровень стандартизации или общности модуля зависит от типа элементов. Например, модули типа химического превращения обычно специализируются по отношению к кинетическим характеристикам и к схеме теплообмена. Модули типа смешения и тина НАСОС легко сделать стандартизированными или общими для любых систем.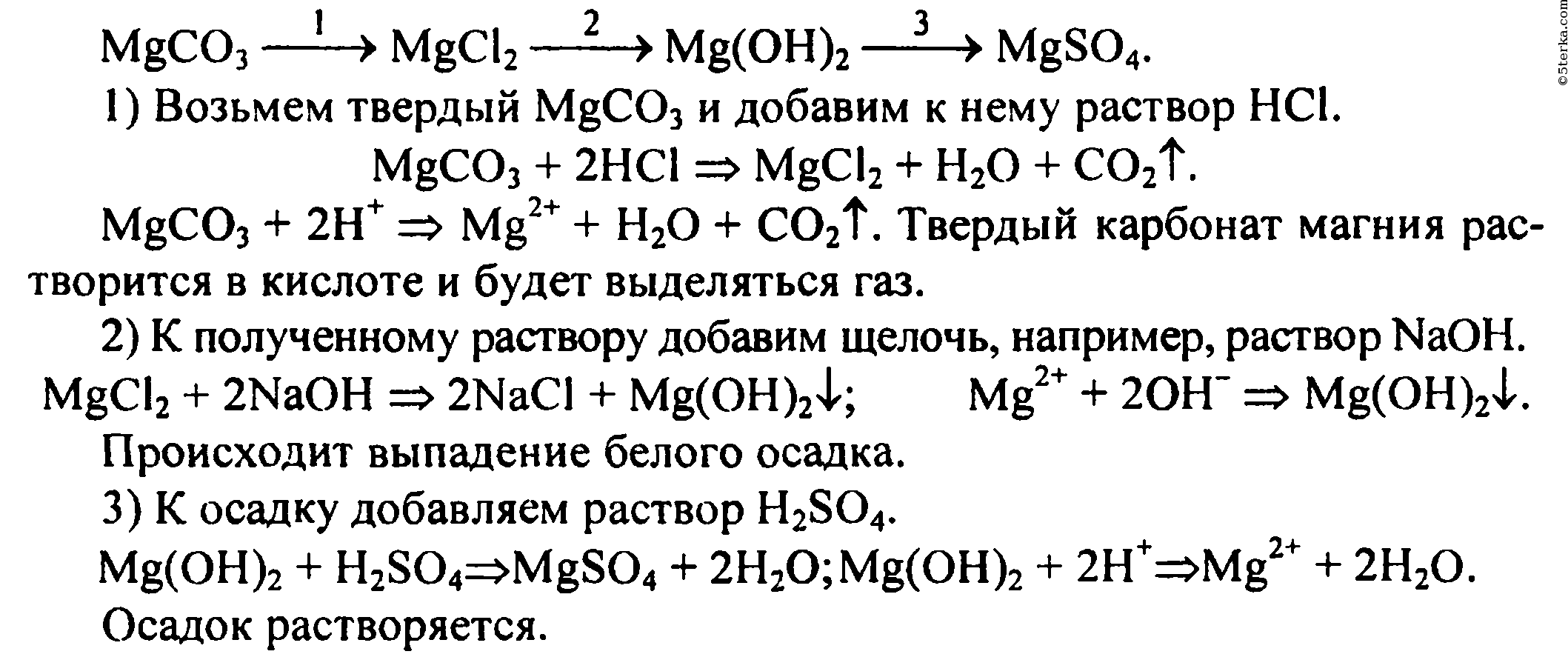 [c.328]
[c.328]
Общепринятая классификация всех реакций органических соединений, в том числе и реакций ароматического замещения, строится на несколько формальных брутто-схемах, в которых приводятся только исходные и конечные продукты химического превращения, и общих иредставлениях об образовании или разрыве химических связей. При этом реагирующие частицы условно разделяют на исходное соединение, считающееся субстратом, и атакующий реагент. Последний может быть электронодефицитным, электроноизбыточным или же содержать неспаренный электрон, т. е. являться свободным радикалом. Образование химической связи между субстратом и электронодефицитным реагентом происходит путем обобщения электронной пары, ранее полностью принадлежавшей субстрату. Такой реагент и реакции с его участием считают электрофильными. Наиример, рассматриваемые в настоящей главе реакции ароматического электрофильного замещения в первом приближении могут быть представлены брутто-схемой [c.33]
Реакторы.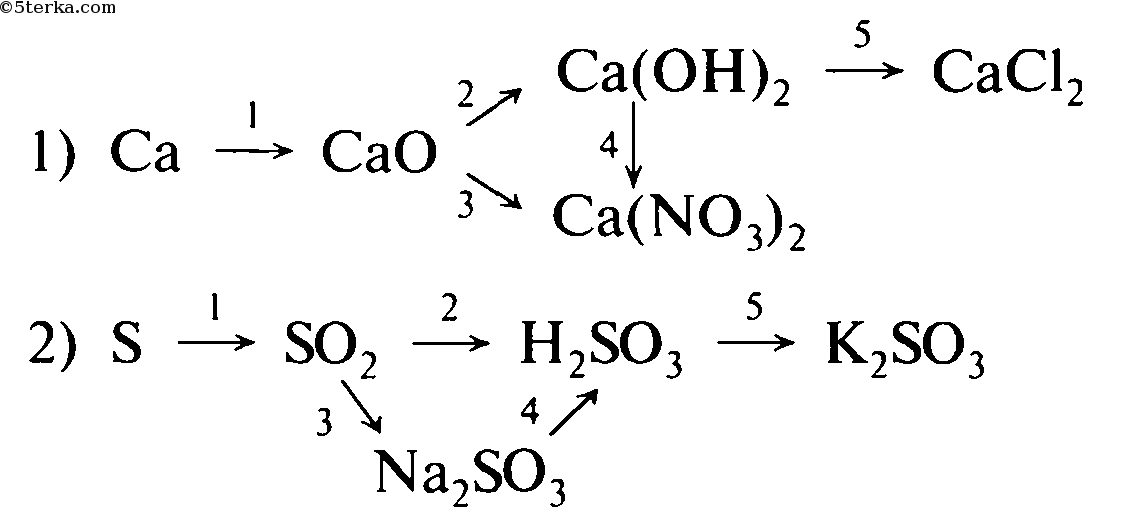 В биохимическом производстве широкое применение находят реакторы для проведения химических превращений. В большинстве своем химические реакторы используются для процессов подготовки сырья, питательной среды, химической обработки (обработка химическими реагентами — флоккулянтами культуральной жидкости), химической стерилизации среды. В настоящем разделе представляет интерес рассмотреть влияние условий гидродинамического смешения в реакторе на показатели процесса превращения вещества в связи с развиваемым системным подходом к анализу процессов на микро- и макроуровнях. Рассмотрим достаточно общий случай проведения реакции химического взаимодействия двух компонентов, раздельно поступающих в аппарат с мешалкой. Схема движения жидкостных потоков в реакторе изображена на рис. 3.6, а. [c.115]
В биохимическом производстве широкое применение находят реакторы для проведения химических превращений. В большинстве своем химические реакторы используются для процессов подготовки сырья, питательной среды, химической обработки (обработка химическими реагентами — флоккулянтами культуральной жидкости), химической стерилизации среды. В настоящем разделе представляет интерес рассмотреть влияние условий гидродинамического смешения в реакторе на показатели процесса превращения вещества в связи с развиваемым системным подходом к анализу процессов на микро- и макроуровнях. Рассмотрим достаточно общий случай проведения реакции химического взаимодействия двух компонентов, раздельно поступающих в аппарат с мешалкой. Схема движения жидкостных потоков в реакторе изображена на рис. 3.6, а. [c.115]
Все сказанное показывает, насколько многообразны химические превращения, происходящие при окислении циклогексана Несмотря на некоторые неясные и спорные детали общей схемы, основные пути его превращения можно считать доказанными Пренебрегая многочисленными побочными продуктами, образующимися в небольших количествах, упрощенно схему можно представить в следующем виде [c.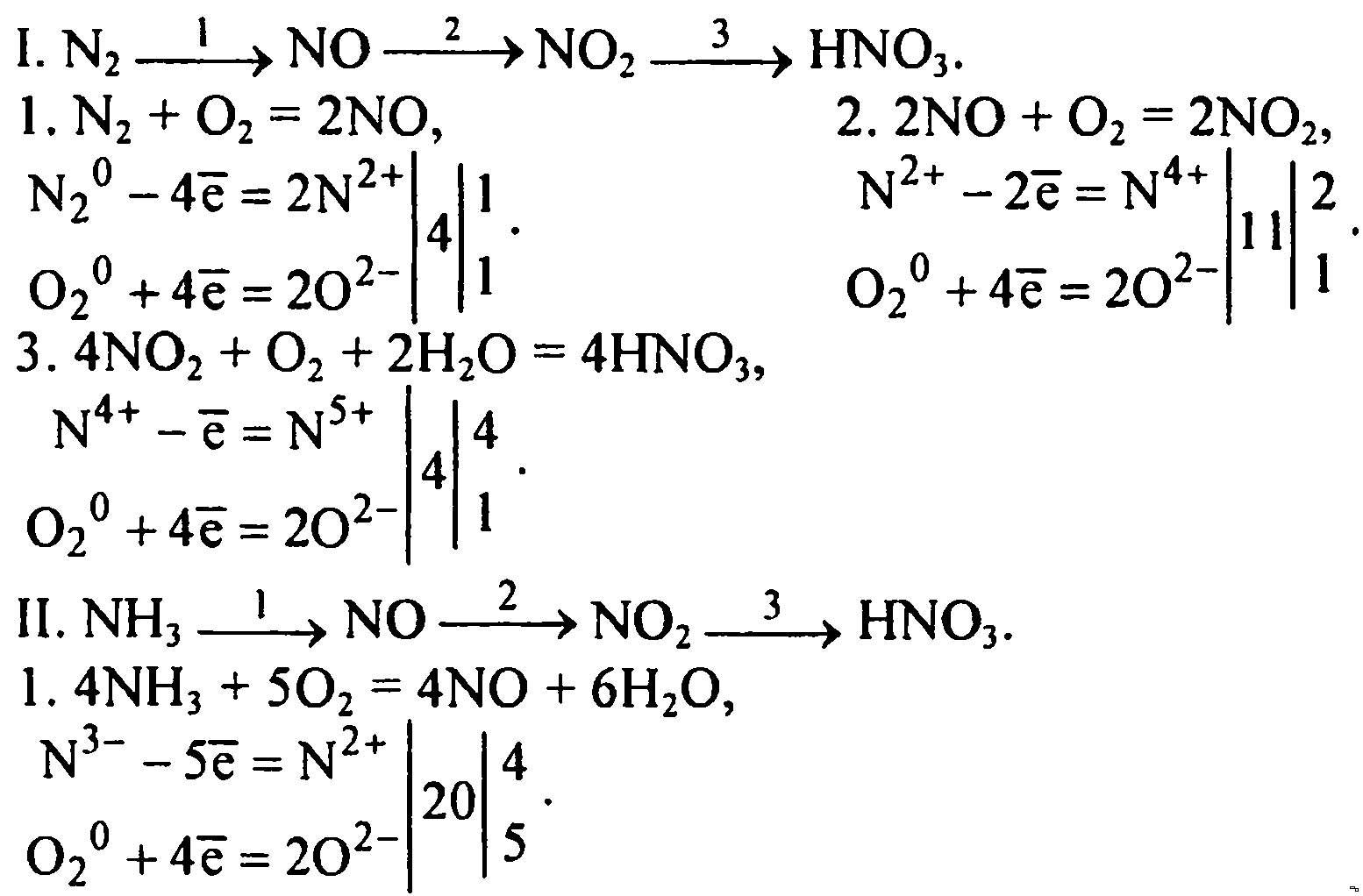 44]
44]
Исходя из сложности задачи и общей стратегии декомпозиции проблема синтеза технологической схемы обычно подразделяется на ряд подпроблем, а именно синтез стадий химического превращения и выделения продуктов реакций. Помимо этого возникает задача рационального объединения источников и стоков энергии внутри схемы для снижения внешнего энергопотребления. Каждая из стадий достаточно специфична в силу различной природы решаемых вопросов (например, нельзя говорить о технологической схеме, пока не определен набор исходных реагентов, не установлен механизм химических реакций и не определены условия их протекания, обеспечивающие получение требуемых продуктов), поэтому после определения совокупности элементов технологической схемы (4.39), возможно, в рамках отдельных подсистем необходимо [c.144]
Таким образом, наряду с химическими превращениями химическая технология использует многочисленные явления и процессы нехимического характера, требующие определенных способов организации и осуществляемые в соответствующих аппаратах и процессуально-технологических схемах. Протекание таких процессов (собственно химических — тоже, конечно) в той или иной мере связано с переносом какой-либо субстанции — количества движения (импульса), теплоты, вещества (массы), иногда нескольких субстанций одновременно. Этот перенос характеризуется (вызывается или сопровождается) изменением технологической ситуации (параметров процесса), в общем случае — во времени в рассматриваемой точке аппарата, а в самом аппарате — от одной точки к другой, в более простых случаях — только во времени или только от точки к точке. [c.38]
Протекание таких процессов (собственно химических — тоже, конечно) в той или иной мере связано с переносом какой-либо субстанции — количества движения (импульса), теплоты, вещества (массы), иногда нескольких субстанций одновременно. Этот перенос характеризуется (вызывается или сопровождается) изменением технологической ситуации (параметров процесса), в общем случае — во времени в рассматриваемой точке аппарата, а в самом аппарате — от одной точки к другой, в более простых случаях — только во времени или только от точки к точке. [c.38]
Температура потоков в элементах ХТС изменяется за счет внутренних источников (Сист). один из которых — химические превращения. Теплота реакции др равна изменению энтальпии вследствие изменения химического состава реакционной среды (9р = //вых — //вх) и приведена в справочниках. Если эта теплота пошла на нагрев реакционной среды, то, казалось бы, легко рассчитать ее нагрев из условия др = Онагр и уравнения (3.33). Но поскольку Н зависит от температуры, то и тепловой эффект зависит от Т, и такие данные приведены в справочниках. При какой температуре следует брать Ср Ведь Т сложным образом меняется в процессе. Зависимость 9р(Т ) есть изменение АН как в зависимости от химического состава, так и от температуры. Если учесть изменение др Т) в процессе, а затем использовать его в расчете разогрева по уравнению (3.33), это приведет к вторичному его учету. Избежать этого можно, если использовать правило эффект не зависит от пути . Воспользуемся следующей схемой процесса (рис. 3.11). Кривая линия изображает путь процесса, в котором протекает химическое превращение и меняется температура от Т до Тг. Проведем процесс по другому, гипотетическому пути в три этапа охладим исходную смесь до температуры Т, забрав у нее теплоту д -Т У, проведем при этой температуре реакцию, теплота которой 9р(Т ) нагреем образовавшуюся смесь теплом дг = д + др. Результат должен быть такой же — конечная температура будет равна Т2 и д2 = Ср2(Т2 -Т ). Интегральные теплоемкости исходной Ср и конечной Ср2 смесей в общем случае различны. [c.
При какой температуре следует брать Ср Ведь Т сложным образом меняется в процессе. Зависимость 9р(Т ) есть изменение АН как в зависимости от химического состава, так и от температуры. Если учесть изменение др Т) в процессе, а затем использовать его в расчете разогрева по уравнению (3.33), это приведет к вторичному его учету. Избежать этого можно, если использовать правило эффект не зависит от пути . Воспользуемся следующей схемой процесса (рис. 3.11). Кривая линия изображает путь процесса, в котором протекает химическое превращение и меняется температура от Т до Тг. Проведем процесс по другому, гипотетическому пути в три этапа охладим исходную смесь до температуры Т, забрав у нее теплоту д -Т У, проведем при этой температуре реакцию, теплота которой 9р(Т ) нагреем образовавшуюся смесь теплом дг = д + др. Результат должен быть такой же — конечная температура будет равна Т2 и д2 = Ср2(Т2 -Т ). Интегральные теплоемкости исходной Ср и конечной Ср2 смесей в общем случае различны. [c. 204]
204]
Хотя многие главы книги написаны совершенно заново, но общая схема, принятая в первом издании, была перенесена и сюда, как оправдавшая себя с методологической стороны. Таким образом материал разделен на главы применительно к методам химических превращений, но не к видам продуктов. [c.4]
Синтез красителей, ведется ли он в малых размерах в лаборатории или производится в больших заводских установках, во всех случаях может быть разделен на отдельные процессы химической переработки менее сложных химических веществ в более сложные. Наиболее просто и обще можно представить течение этого синтеза схемой сначала превращение органического сырья в сложные соединения, не имеющие характера красителей (такие соединения мы называем промежуточными продуктами), затем превращение промежуточных продуктов в красители. Практика организации производства красителей научила уже давно, что первая стадия — получение из сырых материалов промежуточных продуктов — является вообще значительно более сложной и трудной, чем вторая — получение красителей из промежуточных продуктов, что поэтому крайне важно на эту первую стадию обратить особое внимание и подвергнуть ее специальному изучению. [c.12]
[c.12]
Классификация способов получения простых веществ. Если подразделить способы производства простых веществ в соответ химическими свойствами, то получится схема, представленная в табл. 3.14. Замечательным примером технологического про цесса, не сопровождающегося химическими превращениями является способ разделения жидкого воздуха на азот, кислород и инертные газы путем перегонки. Процессы, включающие химические реакции, согласно общей классификации, учитывающей характер этих реакций, можно разбить на три класса восстановление, окисление и пиролитическое разложение (пи ролиз). Большую часть простых веществ получают с помощьк> реакций восстановления. Дальнейшая более детальная класси фикация позволяет распределить эти процессы по подклассам 2.1—2.5. Обычно большинство металлов встречается в виде ка тионов, да и многие неметаллы (за исключением галогенов) имеют положительные степени окисления, поэтому в результате передачи им электронов в процессе восстановления достигается нулевая степень окисления. [c.138]
[c.138]
Как известно, закон плотнейшей упаковки представляет собой геометрическое выражение более общего закона максимальной энергетической выгодности состояния вещества в земной коре и поэтому может быть использован при рассмотрении возможностей химической селекции минералов. Проблема связи и строения не может обсуждаться без рассмотрения изменений энергии, в связи с чем энергетический подход необходим и в данном случае. Заметим, что с таким подходом связана предложенная Н. М. Федоровским и имеющая большое будущее, как считал А. Ф. Капустин-ский, идея классификации минерального сырья по затратам энергии, необходимой на его переработку в полезные продукты. По существу, с этой же идеей связан предложенный В. Л. Райзманом фактор технологичности, величина которого прямо пропорциональна извлечению полезного компонента, обратно пропорциональна изменению стандартной энтропии комплекса химических превращений по технологической схеме в целом. Эта величина, рекомендуемая в качестве критерия при сравнительной оценке способов переработки минерального сырья, подтвердила предпочтительность гидрохимических способов переработки алюминийсодержащих руд и минералов по сравнению с обжигово-спекательными, что согласуется с тенденцией развития глиноземного производства [28]. [c.8]
[c.8]
В плане этих общих подходов электромиграционный метод близок к хроматографии (те же два основных направления повышения эффективности разделения) — поиск методических приемов лучшего разрешения зон при постоянных Кс и использование химических превращений с целью увеличения Кс. Похожи и основные схемы практического осуществления процесса разделения на колонке, на бумаге, в тонком слое. Возникший на заре развития электромиграции метод подвижной границы внешне аналогичен фронтальному анализу в хроматографии. В этом случае движение разделяемых ионов в электрическом поле происходит непосредственно из раствора их смеси. В наиболее распространенном случае зонного электрофореза просматривается общность с проявительным режимом элюирования в хроматографии. Узкая полоса исходной смеси веществ в среде определенного электролита разделяется на индивидуальные зоны. Существует внешняя аналогия противоточного и двухмерного электромиграционного разделения с соответствующими способами осуществления хроматографического процесса. Поэтому при всем принципиальном различии методов по природе химических процессов, лежащих в их основе, хроматографию и электрофорез иногда даже рассматривают как смежные методы [95]. [c.243]
Поэтому при всем принципиальном различии методов по природе химических процессов, лежащих в их основе, хроматографию и электрофорез иногда даже рассматривают как смежные методы [95]. [c.243]
Рассмотрим химическое превращение твердых частиц, реагирующих с ожижающим газом. Многочисленные реакции такого типа, широко применяемые в промышленности, протекают по общей схеме [c.407]
Автокаталитические реакции, т. е. реакции, индуцируемые одним из конечных или промежуточных. продуктов химического превращения, были рассмотрены Н. А. Шиловым еще в 1904 г., тогда же была дана,и общая схема механизма таких процессов. [c.11]
Предложенная схема получила полное подтверждение благодаря стабильности промежуточной формы (изоцианата), выделенной в чистом виде. Среди химических превращений промежуточные формы имеют весьма разнообразный характер это могут быть возбужденные молекулы, атомы, радикалы, ионы, причем их выделение или даже простая идентификация подчас бывают затруднены или невозможны.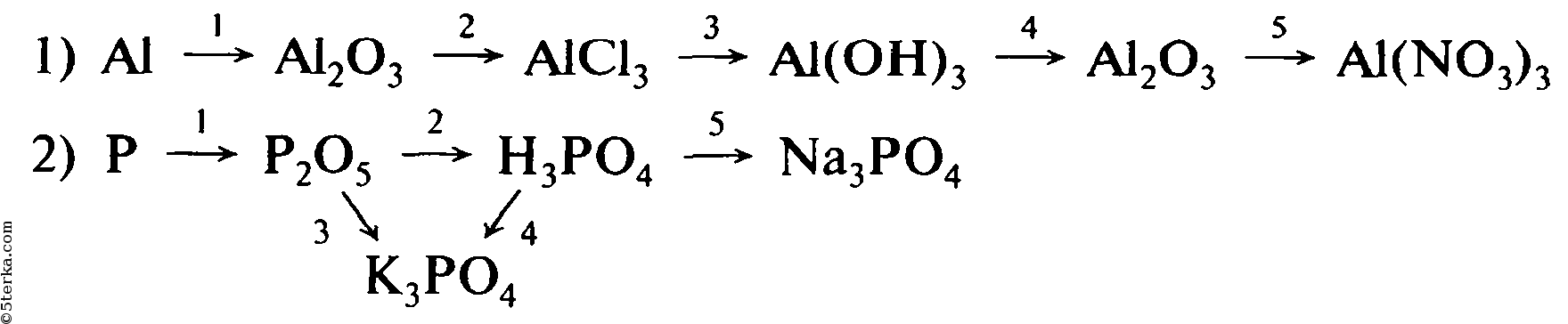 В таких случаях их роль приходится выявлять лишь кинетическим исследованием. Тогда, в общих чертах, следует идти по пути, который был рассмотрен в предыдущем разделе и будет проиллюстрирован в гл. IV, [c.342]
В таких случаях их роль приходится выявлять лишь кинетическим исследованием. Тогда, в общих чертах, следует идти по пути, который был рассмотрен в предыдущем разделе и будет проиллюстрирован в гл. IV, [c.342]
Одной из основных проблем гетерогенного ката.тиза является научно обоснованный подбор оптимальных каталитических систем с заданными параметрами активности и селективности [1, 2]. Согласно [3-5], селективность реакции определяется количественными соотношениями скоростей отдатьных стадий сложного каталитического процесса в общей схеме химических превращений реагирующих веществ. Изменение селективности под влиянием физикохимических свойств каталитической системы непосредственно связано с выходами и качеством целевых продуктов. [c.357]
Наблюдаемые скорости реакций гидрогенизации и вклады параллельных направлений общей схемы химических превращений замещенных 2-нитро-2 -гидроксиазобензолов определяются тем, что в ходе реакции молекулы реагирующих веществ взаимодействуют с водородом, адсорбированным на поверхности катализатора, одновременно, как по нитро-, так и азогруппе. При варьировании природы и состава растворителя скорости гидрогенизации каждой из функциональных групп реагирующих веществ изменяются различным образом. Так, если в водных растворах 2-пропанола и растворитаче, содержащем гидроксид натрия, скорости гидрогенизации нитро- и азогрупп отличаются не более, чем в 4 раза, то в том же растворителе с добавкой уксусной кислоты скорость присоединения водорода по азогруппе [c.368]
При варьировании природы и состава растворителя скорости гидрогенизации каждой из функциональных групп реагирующих веществ изменяются различным образом. Так, если в водных растворах 2-пропанола и растворитаче, содержащем гидроксид натрия, скорости гидрогенизации нитро- и азогрупп отличаются не более, чем в 4 раза, то в том же растворителе с добавкой уксусной кислоты скорость присоединения водорода по азогруппе [c.368]
Анализ протекания сложной химической реакции вдали от равновесия требует привлечения термодинамических характеристик. Таковыми являются термодинамические функции Ляпунова. Выше они использовались при анализе проблемы линеаризации вблизи равновесия. Как будет показано здесь, такие характеристики могут быть использованы при упрощении нестационарных кинетических моделей сложных химических реакций, протекающих в закрытых системах. Типичной является ситуация, когда для данных условий неизвестна минимальная совокупность стадий, ведущая процесс. Поэтому при решении задачи упрощения некой общей схемы химического превращения иногда целесообразно исходить из максимального в некотором смысле механизма. Например, в рамках заданного числа веществ и молекулярности элементарной стадии таким механизмом может быть комбинаторно максимальный механизм Мщах- В литературе уже имеется несколько достаточно полных механизмов различных реакций (окисление водорода см., например. [c.51]
Например, в рамках заданного числа веществ и молекулярности элементарной стадии таким механизмом может быть комбинаторно максимальный механизм Мщах- В литературе уже имеется несколько достаточно полных механизмов различных реакций (окисление водорода см., например. [c.51]
Любой из нефтеперерабатывающих или нефтехимических процессов основан на химических процессах превращений органического сырья в конечные продукты на соответствующих технологических установках. При этом конкретные предприатия имеют определенное назначение и в соответствии с этим — схемы переработки с набором необходимых производств и установок. При этом, по мнению автора, для четкого восприятия всех этих производств на конкретных предприятиях очень полезно познакомиться с общими схемами переработки сырья, пол> чаемь Х пояуиродутстов, конечных прод>1стов и их дальнейшего практического применения. [c.127]
Учебник состоит из девяти глав. Главы I—П1 содержат основные положения и предпосылки метода математического моделирования, общие принципы и схемы построения математических моделей, а также характеристику двух направлений в химической кибернетике, которые определяют исходные позиции при составлении математического описания.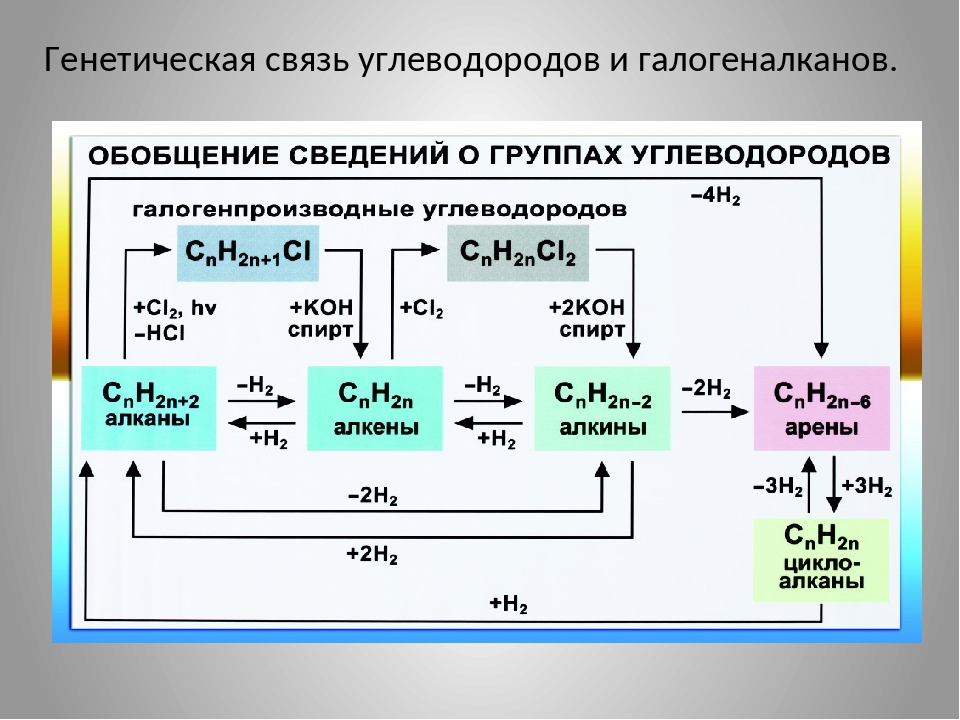 В главах IV, Vи VI подробно рассматривается методика построения кинетических, гидродинамических моделей и моделей некоторых химических реакторов (математическое описание детерминированных процессов). В главе VII приведены примеры составления математических моделей процессов без химического превращения, протекающих в аппаратах химической технологии. В главе VIII изложена методика построения статистических математических моделей (стохастические процессы), дана краткая характеристика наиболее распространенных методов составления статистических моделей и примеры к каждому из них. Поскольку основной целью математического моделирования является оптимизация хими-ко-технологических процессов, заключительная — IX глава содержит некоторые сведения об оптимизации и постановке задач оптимизации, смысл и содержание которых иллюстрируются на конкретных примерах. В приложения включены некоторые таблицы и специальные термины, используемые при разработке статистических моделей. [c.8]
В главах IV, Vи VI подробно рассматривается методика построения кинетических, гидродинамических моделей и моделей некоторых химических реакторов (математическое описание детерминированных процессов). В главе VII приведены примеры составления математических моделей процессов без химического превращения, протекающих в аппаратах химической технологии. В главе VIII изложена методика построения статистических математических моделей (стохастические процессы), дана краткая характеристика наиболее распространенных методов составления статистических моделей и примеры к каждому из них. Поскольку основной целью математического моделирования является оптимизация хими-ко-технологических процессов, заключительная — IX глава содержит некоторые сведения об оптимизации и постановке задач оптимизации, смысл и содержание которых иллюстрируются на конкретных примерах. В приложения включены некоторые таблицы и специальные термины, используемые при разработке статистических моделей. [c.8]
Однако, несмотря на значительное число полученных к настоящему времени работоспособных расчетных формул, применимых в отдельных частных случаях массотеплообмена реагирующих частиц с потоком, общая теория переноса вещества и тепла в дисперсных средах с учетом химических превращений далека от завершения. Такая теория должна базироваться на совместном рассмотрении уравнений гидродинамики, диффузии и теплопроводности, что связано с большими трудностями, которые не преодолены в настоящее время ни аналитическими, ни численными методами. Степень сложности проблемы Станет понятной, если учесть, что имеющиеся аналитические и численные решения значительно более простой задачи об обтекании сферической капли или твердой частицы ламинарным однородным на бесконечности потоком не являются исчерпывающими. Вместе с тем разработка новых и совершенствование существующих химико-технологических схем, описание природных явлений часто приводят к новым постановкам задач, требующим учета условий, не соответствующих области применимости найденных ранее закономерностей, так что становится необходимым более детальное рассмотрение механизма процесса массотеплообмена реагирующих частиц с потоком. [c.6]
Такая теория должна базироваться на совместном рассмотрении уравнений гидродинамики, диффузии и теплопроводности, что связано с большими трудностями, которые не преодолены в настоящее время ни аналитическими, ни численными методами. Степень сложности проблемы Станет понятной, если учесть, что имеющиеся аналитические и численные решения значительно более простой задачи об обтекании сферической капли или твердой частицы ламинарным однородным на бесконечности потоком не являются исчерпывающими. Вместе с тем разработка новых и совершенствование существующих химико-технологических схем, описание природных явлений часто приводят к новым постановкам задач, требующим учета условий, не соответствующих области применимости найденных ранее закономерностей, так что становится необходимым более детальное рассмотрение механизма процесса массотеплообмена реагирующих частиц с потоком. [c.6]
Химические превращения в золе по мере прогрева топлива имеют известную последовательность, которая в самых общих чертах может сводиться к следующей схеме. Выше 120 начинает терять свою кристаллизационную влагу гипс (Са504-2Н20). При более высокой температуре уходит конституционная влага из глинистого вещества (А120з-25102 X х2Н О). При дальнейшем повышении температуры начинают разлагаться карбонаты [c.37]
Выше 120 начинает терять свою кристаллизационную влагу гипс (Са504-2Н20). При более высокой температуре уходит конституционная влага из глинистого вещества (А120з-25102 X х2Н О). При дальнейшем повышении температуры начинают разлагаться карбонаты [c.37]
Чрезвычайная сложность химического состава продуктов коксования, определяемых как масла , смолы , аефальтены , позволяет раскрыть механизм их образования только в самом общем виде. Поэтому при моделировании мы принимали, в нулевом-приближении, масла, смолы, аефальтены за индивидуальные вещества и рассматривали их мономолекулярные превращения. Была выбрана следующая схема последовательного превращения веществ в процессе коксования гудрона [c.45]
Как видим, для описания превращений гремучей кислоты предлагалось несколько схем, которые, имея некоторое общее сходство, в то же время различаются между собой, в отдельных частях порой весьма существенно. Химические превращения гремучей кислоты, по-вндимому, нельзя описать одной фиксированной схемой, так как поведение этого первого члена ряда нитрилоксидов слишком чувствительно к условиям эксперимента, напрнмер, в полностью водной среде оно будет иным, чем во влажном тетрагидрофураие, а в кислой среде— иным, чем в нейтральном растворе. Не без последствий будет, видимо, и присутствие ионов ртути, часто оказывающих каталитическое влияние иа химические реакции. [c.165]
Не без последствий будет, видимо, и присутствие ионов ртути, часто оказывающих каталитическое влияние иа химические реакции. [c.165]
ЕГЭ по химии, подготовка к ЕГЭ по химии 2021 в Москве, сложность, оценки, задачи, шкала перевода баллов — Учёба.ру
Что требуется
Из предложенного перечня веществ необходимо выбрать те, между которыми возможно протекание окислительно-восстановительной реакции (ОВР), записать уравнение этой реакции и подобрать в ней коэффициенты методом электронного баланса, а также указать окислитель и восстановитель.
Особенности
Это одно из самых сложных заданий ЕГЭ по предмету, поскольку оно проверяет знание всей химии элементов, а также умение определять степени окисления элементов. По этим данным нужно определить вещества, которые могут быть только окислителями (элементы в составе этих веществ могут только понижать степень окисления), только восстановителями (элементы в составе этих веществ могут только повышать степень окисления) или же проявлять окислительно-восстановительную двойственность (элементы в составе этих веществ могут и понижать, и повышать степень окисления).
Также в задании необходимо уметь самостоятельно (без каких-либо указаний или подсказок) записывать продукты широкого круга окислительно-восстановительных реакций. Кроме того, нужно уметь грамотно оформить электронный баланс, после чего перенести полученные в балансе коэффициенты в уравнение реакции и дополнить его коэффициентами перед веществами, в которых элементы не изменяли степеней окисления.
Советы
Окислительно-восстановительные реакции основаны на принципе взаимодействия веществ противоположной окислительно-восстановительной природы. Согласно этому принципу любой восстановитель может взаимодействовать практически с любым окислителем. В задаче № 30 окислители и восстановители часто подобраны таким образом, что между ними точно будет протекать реакция.
Для нахождения пары окислитель/восстановитель нужно, прежде всего, обращать внимание на вещества, содержащие элементы в минимальной и максимальной степени окисления. Тогда вещество с минимальной степенью окисления будет являться типичным восстановителем, а вещество с максимальной степенью окисления с большой долей вероятности окажется сильным окислителем.
Если в списке только одно вещество (вещество 1) содержит элемент в максимальной или минимальной степени окисления, нужно найти ему в пару вещество, в котором элемент находится в промежуточной степени окисления и может проявлять свойства и окислителя, и восстановителя (вещество 2). Тогда вещество 1 определит окислительно-восстановительную активность вещества 2.
Когда пара окислитель/восстановитель определена, нужно обязательно проверить, в какой среде (кислой, нейтральной или щелочной) может протекать эта реакция. Если нет особенных правил, связанных со средой протекания выбранной реакции, то в качестве среды следует выбрать водный раствор того вещества (кислоты или щелочи), которое есть в предложенном списке реагентов.
Чтобы верно записать продукты окислительно-восстановительной реакции, нужно знать теоретические сведения о химии того или иного вещества и специфику его свойств. Однако запоминать все реакции наизусть — дело утомительное, да и не очень полезное. Для того чтобы упростить задачу, можно выявить некоторые общие закономерности в протекании ОВР и научиться предсказывать продукты реакций. Для этого нужно следовать трем простым правилам:
Для этого нужно следовать трем простым правилам:
1. Процессы окисления и восстановления — это две стороны единого процесса: процесса передачи электрона. Если какой-либо элемент (восстановитель) отдает электроны, то в этой же реакции обязательно должен быть какой-то элемент (окислитель), который принимает эти электроны.
2. Если в реакции участвует простое вещество, эта реакция — всегда окислительно-восстановительная.
3. При взаимодействии сильных окислителей с различными восстановителями обычно образуется один и тот же основной продукт окисления. Многие окислители при взаимодействии с различными восстановителями также часто восстанавливаются до какого-то одного продукта, соответствующего их наиболее устойчивой степени окисления.
Осуществление цепочки химических превращений. — онлайн-урок
В курсе классической химии встречаются задания, в которых нужно осуществить превращения веществ по схеме, где по одну сторону от стрелки, чаще всего слева, записано одно из исходных веществ в уравнении реакции, а по другую, правую часть от стрелки, показано вещество, которое нужно получить, то есть один из продуктов реакции. Цепочка химических превращений помогает закрепить знания по такой теме как генетическая связь между основными классами веществ, включая как неорганические, так и органические соединения. Для того, что бы легко решать цепочки химических превращений, нужно знать не только основные химические свойства веществ, но и понимать взаимосвязь между ними, иметь представление какими способами можно из одного вещества получить другое. Часто в цепочках химических реакций над стрелками указывают подсказки, например вещество, с которым должно вступить в реакцию или условия протекания этой реакции, среду раствора (кислая, нейтральная или щелочная), или температуру, катализатор. Поэтому при изучении химических свойств веществ и классов соединений нужно обращать внимание и запоминать условия, при которых протекает та или иная реакция. Рассмотрим механизм решения цепочки превращений на примере одного из заданий на эту тему.
Цепочка химических превращений помогает закрепить знания по такой теме как генетическая связь между основными классами веществ, включая как неорганические, так и органические соединения. Для того, что бы легко решать цепочки химических превращений, нужно знать не только основные химические свойства веществ, но и понимать взаимосвязь между ними, иметь представление какими способами можно из одного вещества получить другое. Часто в цепочках химических реакций над стрелками указывают подсказки, например вещество, с которым должно вступить в реакцию или условия протекания этой реакции, среду раствора (кислая, нейтральная или щелочная), или температуру, катализатор. Поэтому при изучении химических свойств веществ и классов соединений нужно обращать внимание и запоминать условия, при которых протекает та или иная реакция. Рассмотрим механизм решения цепочки превращений на примере одного из заданий на эту тему.
Задание. Составьте уравнения реакций, с помощью которых можно осуществить превращения:
Na2CO3 → BaCO3 → BaO → Ba(OH)2
Методика решения «цепочек превращений» в курсе химии
- Запишем «цепочку превращений», нумеруя реакции, параллельно оценивая, классы веществ, их генетическую связь, а так же возможно специфические свойства некоторых веществ, ищем подсказки в виде условий протекания реакций над стрелками.

Na2CO3 →1 BaCO3 →2 BaO →3 Ba(OH)2
На примере первого и второго уравнений реакции разберем один из методов рассуждения.
- Запишем первое уравнение реакции. В левой части от знака равно исходные вещества, в правой части известный нам продукт реакции, заменяя стрелку на знак равно.
Na2CO3 + ______= BaCO3 + Na+___
- Определим класс исходного вещества и вещества в продукте реакции, вспомним химическое свойство, которое дает возможность получить из одного другое. Определим тип химической реакции, это может помочь определить недостающие ионии в левой и правой части. Как мы видим Na2CO3 и BaCO3 соли, причем BaCO3 нерастворимое соединение, а значит, осадок и является признаком протекания этой реакции, делаем вывод, что второе вещество в продукте будет, скорее всего, растворимым, как и исходные вещества.

Na2CO3 + Ba2+__= BaCO3↓ + ______
- Вспомним правила получения соли из соли:
Соль1 + соль2 = соль3↓ + соль4
Соль1 + растворимое в воде основание1 = соль2↓ + растворимое в воде основание2
Применим одно из правил и подберем подходящие ионы по таблице растворимости.
Na2CO3 + Ba(OH)2= BaCO3↓ + NaOH
- Расставим коэффициенты в уравнении реакции.
1) Na2CO3 + Ba(OH)2= BaCO3↓ + 2NaOH
- Приступим ко второму превращению и так, пока не выполним все 6 превращений, вспоминая классы веществ, свойства веществ, где фигурируют эти классы, специфические свойства некоторых соединений, типы химических реакций. Все эти знания и опыт позволят быстрее ориентироваться в генетических взаимосвязях между классами веществ, а значит более легко и быстро осуществлять «цепочки превращений».

2) BaCO3 = BaO + CO2
3) BaO + H2O = Ba(OH)2
▶▷▶▷ осуществите превращения по схеме укажите типы реакций
▶▷▶▷ осуществите превращения по схеме укажите типы реакций| Интерфейс | Русский/Английский |
| Тип лицензия | Free |
| Кол-во просмотров | 257 |
| Кол-во загрузок | 132 раз |
| Обновление: | 05-04-2019 |
осуществите превращения по схеме укажите типы реакций — Осуществите превращения по схеме, укажите типы реакций znanijacomtask16879745 Cached Осуществите превращения по схеме, укажите типы реакций , назовите вещества 1AlAl2O3AlCl3Al(OH)3Al2O3 2 Осуществите превращения по схеме, укажите типы реакций shkolnikucomhimiyatask2611754html Cached Осуществите превращения по схеме, укажите типы реакций , назовите вещества 1AlAl2O3AlCl3Al(OH)3Al2O3 2 PP2O5h4PO4Na3PO4Ca3(PO4)2 3 Осуществите превращения по схеме , укажите типы реакций shkolnikucomhimiyatask2592333html Cached Осуществите превращения по схеме , укажите типы реакций , назовите вещества : 1) c—ch5—co2—h3co3 Помогите, кому не трудно! Осуществите превращения по схеме znanijacomtask16904794 Cached Помогите, кому не трудно! Осуществите превращения по схеме, укажите типы реакций , Осуществите цепочку химических превращений, составив wwwv-gdzcomhimiya5-9osyshestvite-cepochky Cached Cоставьте уравнения реакций , с помощью которых можно осуществить превращения по схеме : Fe — FeSO4 — Fe(OH)2 — FeO; 2) Запишите уравнения реакций для переходов: Fe — FeCL3 — Fe(OH)3 — Fe2O3 Осуществите превращения по схеме, укажите тип химической himianeznakaruanswer3577147_osusestvite Cached Осуществите превращения по схеме , укажите тип химической реакции карбид кальция ацетилен этан этилен 10-11 класс Урок 2 Основные классы неорганических соединений, Типы sitesgooglecom sitehimulacomzvonok-na-urok9 7 Осуществите превращения по схеме, укажите типы реакций , назовите вещества P P 2 O 5 H 3 PO 4 Na 3 PO 4 Ca 3 (PO 4) 2 ZnZnCl 2 Zn(OH) 2 ZnOZn(NO 3) 2 Al Al 2 O 3 AlCl 3 Al (OH) 3 Al 2 O 3 8 ХиМуЛяcom — Sites sitesgooglecom sitehimulacomzvonok-na-urok8 3 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: С С H 4 CO 2 H 2 CO 3 3 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: Al Al 2 O 3 Al Домашняя работа по химии срочно!!!! sprashivalkacomtqaq1048039 Cached 1 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: p—p2o5—h4po4 ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ по теме Кслород Водород docsgooglecom documentd1Ynt7j__Np_m5qjsySYHG 3 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: С СH 4 CO 2 H 2 CO 3 3 Осуществите превращения по схеме, укажите типы реакций , назовите вещества: Al Al 2 O 3 Al Promotional Results For You Free Download Mozilla Firefox Web Browser wwwmozillaorg Download Firefox — the faster, smarter, easier way to browse the web and all of 1 2 3 4 5 Next 1,690
- Ипользуя метод электроного баланса, составьте уравнение реакции SO2 Br2 h3Ogt; h3SO4 HBr.
 Осущест
Осущест - вить превращение по схеме, указать типы реакции, назвать вещества N2O5gt;HNO3gt;Fe(NO3)2gt;FeO. Напишите схемы реакции L-фруктозы: 1) с метиловым спиртом в присутствии кислоты; 2) с диметилсульфатом;
- ишите схемы реакции L-фруктозы: 1) с метиловым спиртом в присутствии кислоты; 2) с диметилсульфатом; 3) с уксусным ангидридом; 4) с фенилгидразином.
Напишите реакции, с помощью которых можно осуществить превращения по схеме NO2 HNO3 Nh5NO3 Ba(NO3)2 NO2. ) NaOH Металл I — — Металл II — Металл III Определите, какие металлы были исследованы, и напишите уравнения реакций 9.
Укажите типы реакций и названия всех участвующих в реакциях веществ. Найдите схему заполнения электронами энергетических уровней атома элемента с зарядом ядра 11.
При выполнении первого задания необходимо на основании схемы реакции, 3) Определен объем газообразного вещества, вступившего в реакцию: по уравнению реакции n (CuS) (Cu(NO3)2) 0,01 моль m(CuS)…
Новгородский государственный университет.
 Об университете и его подразделениях, телефонный справочник, расписания занятий, сведения для поступающих. Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Напишите уравнение реакции получения дипептида из валина и цистеина. Приведите уравнения реакций, с помощью которых можно осуществить превращения: Укажите, к какому типу относятся перечисленные амины:
Научно-образовательно-клинический комплекс. Образование, наука, лечебные работы. The requested URL perlpublicpublic.pl was not found on this server.
Реакции равна общей массе веществ, вступивших в реакцию, т.е. åmпродуктов åmреагентов, Расчет тепловых эффектов химических реакций по стандартным энтальпиям образования веществ ( следствие из закона Гесса)
Об университете и его подразделениях, телефонный справочник, расписания занятий, сведения для поступающих. Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Напишите уравнение реакции получения дипептида из валина и цистеина. Приведите уравнения реакций, с помощью которых можно осуществить превращения: Укажите, к какому типу относятся перечисленные амины:
Научно-образовательно-клинический комплекс. Образование, наука, лечебные работы. The requested URL perlpublicpublic.pl was not found on this server.
Реакции равна общей массе веществ, вступивших в реакцию, т.е. åmпродуктов åmреагентов, Расчет тепловых эффектов химических реакций по стандартным энтальпиям образования веществ ( следствие из закона Гесса)
указать типы реакции
3) Определен объем газообразного вещества
- укажите типы реакций shkolnikucomhimiyatask2592333html Cached Осуществите превращения по схеме
- назовите вещества: p—p2o5—h4po4 ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ по теме Кслород Водород docsgooglecom documentd1Ynt7j__Np_m5qjsySYHG 3 Осуществите превращения по схеме
- назовите вещества: С СH 4 CO 2 H 2 CO 3 3 Осуществите превращения по схеме
Request limit reached by ad vlaXML
Ипользуя метод электроного баланса, составьте уравнение реакции SO2 Br2 h3Ogt; h3SO4 HBr. Осуществить превращение по схеме, указать типы реакции, назвать вещества N2O5gt;HNO3gt;Fe(NO3)2gt;FeO.
Напишите схемы реакции L-фруктозы: 1) с метиловым спиртом в присутствии кислоты; 2) с диметилсульфатом; 3) с уксусным ангидридом; 4) с фенилгидразином.
Напишите реакции, с помощью которых можно осуществить превращения по схеме NO2 HNO3 Nh5NO3 Ba(NO3)2 NO2. ) NaOH Металл I — — Металл II — Металл III Определите, какие металлы были исследованы, и напишите уравнения реакций 9.
Укажите типы реакций и названия всех участвующих в реакциях веществ. Найдите схему заполнения электронами энергетических уровней атома элемента с зарядом ядра 11.
При выполнении первого задания необходимо на основании схемы реакции, 3) Определен объем газообразного вещества, вступившего в реакцию: по уравнению реакции n (CuS) (Cu(NO3)2) 0,01 моль m(CuS)…
Новгородский государственный университет. Об университете и его подразделениях, телефонный справочник, расписания занятий, сведения для поступающих.
Осуществить превращение по схеме, указать типы реакции, назвать вещества N2O5gt;HNO3gt;Fe(NO3)2gt;FeO.
Напишите схемы реакции L-фруктозы: 1) с метиловым спиртом в присутствии кислоты; 2) с диметилсульфатом; 3) с уксусным ангидридом; 4) с фенилгидразином.
Напишите реакции, с помощью которых можно осуществить превращения по схеме NO2 HNO3 Nh5NO3 Ba(NO3)2 NO2. ) NaOH Металл I — — Металл II — Металл III Определите, какие металлы были исследованы, и напишите уравнения реакций 9.
Укажите типы реакций и названия всех участвующих в реакциях веществ. Найдите схему заполнения электронами энергетических уровней атома элемента с зарядом ядра 11.
При выполнении первого задания необходимо на основании схемы реакции, 3) Определен объем газообразного вещества, вступившего в реакцию: по уравнению реакции n (CuS) (Cu(NO3)2) 0,01 моль m(CuS)…
Новгородский государственный университет. Об университете и его подразделениях, телефонный справочник, расписания занятий, сведения для поступающих. Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Напишите уравнение реакции получения дипептида из валина и цистеина. Приведите уравнения реакций, с помощью которых можно осуществить превращения: Укажите, к какому типу относятся перечисленные амины:
Научно-образовательно-клинический комплекс. Образование, наука, лечебные работы. The requested URL perlpublicpublic.pl was not found on this server.
Реакции равна общей массе веществ, вступивших в реакцию, т.е. åmпродуктов åmреагентов, Расчет тепловых эффектов химических реакций по стандартным энтальпиям образования веществ ( следствие из закона Гесса)
Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Напишите уравнение реакции получения дипептида из валина и цистеина. Приведите уравнения реакций, с помощью которых можно осуществить превращения: Укажите, к какому типу относятся перечисленные амины:
Научно-образовательно-клинический комплекс. Образование, наука, лечебные работы. The requested URL perlpublicpublic.pl was not found on this server.
Реакции равна общей массе веществ, вступивших в реакцию, т.е. åmпродуктов åmреагентов, Расчет тепловых эффектов химических реакций по стандартным энтальпиям образования веществ ( следствие из закона Гесса)
Химическая трансформация — обзор
7.17.3.1 Принцип
Химическая трансформация, катализируемая ферментом, также дает возможность изучать катализ на уровне одной молекулы. Если в результате этого химического превращения образуется флуоресцентный продукт (то есть флуорогенная реакция), мониторинг флуоресценции продукта может напрямую исследовать катализ. Этот подход флуорогенной реакции, возможно, наиболее популярен при изучении ферментов на уровне одной молекулы.Сообщалось о двух экспериментальных схемах применения этого подхода для анализа активности отдельного фермента: один для обнаружения генерации каждой молекулы продукта в режиме реального времени одним ферментом с разрешением одного оборота, 21–23,54–56,65–67 , а другой — для мониторинга накопления всех молекул продукта с течением времени, производимых одним ферментом, заключенным в ограниченный объем. 68–75
Этот подход флуорогенной реакции, возможно, наиболее популярен при изучении ферментов на уровне одной молекулы.Сообщалось о двух экспериментальных схемах применения этого подхода для анализа активности отдельного фермента: один для обнаружения генерации каждой молекулы продукта в режиме реального времени одним ферментом с разрешением одного оборота, 21–23,54–56,65–67 , а другой — для мониторинга накопления всех молекул продукта с течением времени, производимых одним ферментом, заключенным в ограниченный объем. 68–75
Используя схему однооборотного детектирования в реальном времени, Риглер и его коллеги сначала исследовали активность пероксидазы хрена на уровне одной молекулы, 22,54 , которую в дальнейшем изучили Энгелькамп и соавторы. 66 Velonia et al., 23 Flomenbom et al., 55 и Carette et al. 62 использовали этот подход для изучения катализа липазы. Xie et al. 21 и Moerner et al. 56 изучил β -галактозидазу, излюбленную систему в исследованиях в области одномолекулярной энзимологии. Хофкенс и его сотрудники также использовали это для изучения химотрипсина. 65 Напротив, используя инкапсуляцию в ограниченном объеме, Yeung et al. 68 изучали лактатдегидрогеназу, а Dovichi et al. 69 изучали щелочную фосфатазу, улавливая отдельные ферменты в капиллярных трубках. Noji и соавторы 70 и Collier и соавторы 75 использовали микрокамеры, сформированные из полидиметилсилоксановых (PDMS) штампов, а Walt и соавторы 71,72 использовали микрокамеры, сформированные на концах оптических волокон, для улавливания отдельных молекул β -галактозидазы. для анализа активности.Липосомы 74 и эмульсии вода-в-масле 73 также использовали для инкапсулирования индивидуальных ферментов щелочной фосфатазы 74 и химотрипсина 73 для анализа активности с флуорогенными реакциями.
Xie et al. 21 и Moerner et al. 56 изучил β -галактозидазу, излюбленную систему в исследованиях в области одномолекулярной энзимологии. Хофкенс и его сотрудники также использовали это для изучения химотрипсина. 65 Напротив, используя инкапсуляцию в ограниченном объеме, Yeung et al. 68 изучали лактатдегидрогеназу, а Dovichi et al. 69 изучали щелочную фосфатазу, улавливая отдельные ферменты в капиллярных трубках. Noji и соавторы 70 и Collier и соавторы 75 использовали микрокамеры, сформированные из полидиметилсилоксановых (PDMS) штампов, а Walt и соавторы 71,72 использовали микрокамеры, сформированные на концах оптических волокон, для улавливания отдельных молекул β -галактозидазы. для анализа активности.Липосомы 74 и эмульсии вода-в-масле 73 также использовали для инкапсулирования индивидуальных ферментов щелочной фосфатазы 74 и химотрипсина 73 для анализа активности с флуорогенными реакциями.
Здесь исследования Се и соавторов 21 и Ноджи с соавторами 70 с использованием подхода флуорогенной реакции используются для иллюстрации этих двух экспериментальных схем, оба из которых изучали β -галактозидазу в качестве модельного фермента.
Схемы реакций для учебника по органической химии
Пожалуйста, не блокируйте рекламу на этом сайте.
Нет рекламы = нет денег для нас = нет бесплатных вещей для вас!
Обобщенная схема реакции для алк-1-енов (1-алкенов)
Большинство химических реакций с участием небиологических алифатических органических соединений, с которыми вы, вероятно, столкнетесь в школе, можно суммировать в виде схемы реакции для алк-1-енов (1-алкенов).
Например, вы знаете, что вы можете реагировать алкеном с водородом с образованием соответствующего алкана в реакции гидрирования, как показано в сбалансированном химическом уравнении ниже:
| R-CH = CH 2 + H 2 | катализатор → | R-CH 2 -CH 3 |
, но если бы я хотел быстро представить это и упростить добавление дополнительных химических реакций, в которых используется либо алкен, либо алкан, то я бы упростил это и нарисовал блок-схему или схему реакции, используя эту информацию:
| алкан | гидрирование ← | алкен |
Вы можете реагировать как алкан, так и алкен с галогеном, таким как газообразный хлор или бромная вода, и в этом случае алкен будет легко реагировать, но алкан будет реагировать только медленно и в присутствии ультрафиолетового света.
Мы можем добавить эту информацию в нашу схему реакции:
| дигалогеналкан | ||
| ↑ галогенирование | ||
| алкан | гидрирование ← | алкен |
| галогенирование (УФ) ↓ | ||
| → | галогеналкан |
Мы также знаем, что мы можем использовать галогенид водорода для добавления по двойной связи алкена для получения галогеналкана (алкилгалогенида) в реакции гидрогалогенирования, поэтому мы можем добавить эту информацию в нашу схему реакции:
| дигалогеналкан | ||
| ↑ галогенирование | ||
| алкан | гидрирование ← | алкен |
| галогенирование (УФ) ↓ | ↓ гидрогалогенирование | |
| → | галогеналкан |
Если мы продолжим добавлять все больше и больше информации в нашу схему реакции, мы получим что-то похожее на приведенное ниже:
Я могу использовать эту схему реакции, чтобы решить, как синтезировать конкретное органическое соединение.
Если, например, я хотел получить сложный эфир, эта схема реакции показывает мне два возможных метода:
- взаимодействие алканола с алкановой кислотой в реакции прямой этерификации (или реакции Фишера)
- реагировать галогеналкан с карбоксилат-ионом
Но эта схема реакции делает больше!
Эта схема реакции даже показывает мне, как получить алканол, алкановую кислоту и галогеналкан с использованием алк-1-ена (1-алкена) или даже алкана в качестве исходного реагента!
Например, я мог бы использовать схему реакции для получения ряда шагов, которые можно было бы использовать для получения сложного эфира из алкана:
Шаг 1: галогенирование алкана (дает галогеналкан)Шаг 2: реакция галогеналкана с карбоксилат-ионом (образуется сложный эфир)
Составление общей схемы реакций, которые вы изучали в классе, — отличный способ пересмотреть и помочь вам запомнить эти реакции!
Схема реакции для этена (этилена)
Схемы реакций наиболее эффективны, когда они относятся к конкретным реакциям конкретной молекулы.
Это потому, что мы можем указать реагенты и условия реакции, необходимые для каждой реакции в схеме реакции.
На приведенной ниже схеме реакции показаны реакции этена (этилена), основанные на приведенной выше обобщенной схеме реакции:
Если, например, меня попросили произвести этанолат натрия с использованием этена (этилена) в качестве исходного реагента, я могу следовать приведенной выше схеме реакции, чтобы произвести его в 2 этапа (не включая необходимые этапы выделения и очистки, которые не показаны на схема реакции):
Шаг 1: этен (этилен) + подкисленная вода → этанолШаг 2: этанол + металлический натрий → этанолат натрия
Рабочий пример с использованием схемы реакции для этилена (этилена)
См. Следующую неполную схему реакции:
| А | Cl 2 светлый → | B | КОН (водн.) → | этанол CH 3 CH 2 OH | MnO 4 — → H + (водн.  ) ) | D |
| ↑ HCl / AlCl 3 | H 2 O / H 3 PO 4 , 300 ° C ↑ | ↓ CH 3 CH 2 OH / H 2 SO 4 | ||||
| ← | С | → | E |
Дайте название ИЮПАК и сокращенную или полуструктурную формулу для молекул, обозначенных на схеме реакции A , B , C , D и E .
- Начни с того, что тебе дали!
Нам дано расположение этанола, CH 3 CH 2 OH, в схеме реакции, поэтому начните смотреть вправо, влево, вверх и вниз оттуда.
- Справа от этанола мы видим сильное окисление этанола подкисленным перманганатом калия.
 В результате образуется уксусная кислота (этановая кислота), поэтому D :
В результате образуется уксусная кислота (этановая кислота), поэтому D :(i) название: уксусная кислота (этановая кислота)
(ii) полуструктурная формула: CH 3 COOH
- Ниже D мы видим реакцию с этанолом в присутствии серной кислоты, то есть реакцию этерификации.Уксусная кислота (этановая кислота) будет реагировать с этанолом, CH 3 CH 2 OH, в присутствии серной кислоты с образованием сложного эфира этилацетата (этилэтаноат), поэтому E :
(i) название: этилацетат (этилэтаноат)
(ii) конденсированная (полуструктурная) формула: CH 3 CH 2 -O-CO-CH 3
- Теперь мы будем работать в обратном направлении от этанола к B , то есть какое соединение может реагировать с KOH (водн.) с образованием этанола?
Скорее всего, в молекуле B есть атом, который замещен группой OH из KOH, и атомы галогена (Br, Cl, I) образуют очень хорошие уходящие группы!
- Сделайте еще один шаг влево, и мы увидим, что A реагирует с Cl 2 в присутствии света с образованием B , поэтому B , скорее всего, будет содержать галогеновый хлор, Cl
- B содержит 2 атома углерода (для образования этанола с 2 атомами углерода) и является насыщенным соединением (одинарные связи между атомами углерода) и содержит атом хлора:
(i) название: хлорэтан
(ii) конденсированная (полуструктурная) формула: CH 3 CH 2 Cl
- A должен быть насыщенным углеводородом (для начала реакции галогенирования ему нужен свет), содержащим всего 2 атома углерода:
(i) название: этан
(ii) конденсированная (полуструктурная) формула: CH 3 CH 3
- C реагирует с HCl в присутствии AlCl 3 с образованием CH 3 CH 2 Cl ( B )
и C реагирует с водой в присутствии кислоты с образованием этанола, CH 3 CH 2 OH
C , скорее всего, будет этиленом (этеном), потому что эта молекула вступает в реакции присоединения с водой с образованием этанола и подвергается гидрогалогенированию с HCl, так что H и Cl присоединяются по двойной связи:(i) название: этилен (этен)
(ii) конденсированная (полуструктурная) формула: CH 2 = CH 2
Наша полная схема реакции теперь выглядит так, как показано ниже:
| A этан | Cl 2 светлый → | B хлорэтан | КОН (водн. ) ) → | этанол CH 3 CH 2 OH | MnO 4 — → H + (водн.) | D уксусная кислота (этановая кислота) |
| ↑ HCl / AlCl 3 | H 2 O / H 3 PO 4 , 300 ° C ↑ | ↓ CH 3 CH 2 OH / H 2 SO 4 | ||||
| ← | C этилен (этен) | → | E этилацетат (этилэтаноат) |
Итак, мы идентифицировали все неизвестные соединения в схеме реакции:
A : этан, CH 3 CH 3
B : хлорэтан, CH 3 CH 2 Cl
C : этилен (этен), CH 2 = CH 2
D : уксусная кислота (этановая кислота), CH 3 COOH
E : этилацетат (этилэтаноат), CH 3 CH 2 -O-CO-CH 3
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Этот сайт использует файлы cookie для повышения производительности.Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.

- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файлах cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
24.4 Общие классы органических реакций
- Последнее обновление
- Сохранить как PDF
- Концептуальные проблемы
- Ответ
- Структура и реакционная способность
- Ответы
. -}} & \ rightarrow \ underline {\ mathrm {CH_3CH_2Br + Br \ cdot}} \\
-}} & \ rightarrow \ underline {\ mathrm {CH_3CH_2Br + Br \ cdot}} \\
\ mathrm {Br_2 + CH_3CH_3} & \ стрелка вправо \ mathrm {CH_3CH_2Br + HBr}
\ end {align} \ tag {24.4.5} \)
Сумма двух стадий распространения соответствует сбалансированному химическому уравнению для всей реакции. Есть три возможных этапа обрыва: комбинация (1) двух атомов брома, (2) двух этильных радикалов или (3) этильного и бромного радикалов:
\ (\ begin {align}
& \ mathrm {Br \ cdot + Br \ cdot} && \ rightarrow \ mathrm {Br_2} \\
& \ mathrm {CH_3CH_2 \ cdot + \ cdot CH_2CH_3} && \ rightarrow \ mathrm {CH_3CH_2CH_2CH_3} \\
& \ mathrm {CH_3CH_2 \ cdot} && \ rightarrow \ mathrm {CH_3CH_2Br}
\ end {align} \ tag {24.4.6} \)
Поскольку радикалы являются мощными нуклеофилами и, следовательно, обладают высокой реакционной способностью, такие реакции не очень избирательны. Например, хлорирование н-бутана дает смесь 2-хлорбутана примерно 70:30, образованную из более стабильного радикала в результате реакции вторичного углерода и 1-хлорбутана.
Существуют общие закономерности протекания органических реакций. В реакции замещения один атом или группа атомов в веществе заменяется другим атомом или группой атомов из другого вещества.Громоздкие группы, предотвращающие нападение, вызывают стерическое затруднение реакции. В реакции отщепления соседние атомы удаляются с последующим образованием кратной связи и небольшой молекулы. Реакция присоединения является обратной реакцией элиминирования. Радикальные реакции не очень избирательны и протекают в три стадии: инициирование, распространение и прекращение. Окислительно-восстановительные реакции в органической химии идентифицируются по изменению количества атомов кислорода в углеводородном скелете или количества связей между углеродом и кислородом или углеродом и азотом.
Концептуальные проблемы
- Определите нуклеофил и электрофил в реакции нуклеофильного замещения 2-бромбутана на KCN.
- Определите нуклеофил и электрофил в реакции нуклеофильного замещения 1-хлорпентана метоксидом натрия.

- Ожидаете ли вы, что реакция элиминации будет поддерживаться сильным или слабым основанием? Почему?
- Почему молекулы с π-связями ведут себя как нуклеофилы при смешивании с сильными электрофилами?
Ответ
- CN — — нуклеофил, а C 2 H 5 C δ + HBrCH 3 — электрофил.
Структура и реакционная способность
- Изобразите механизм реакции нуклеофильного замещения цианида калия иодэтаном.
- Изобразите механизм реакции нуклеофильного замещения NaSH на 1-бромпропан.
- Изобразите механизм реакции отщепления циклогексилхлорида этоксидом калия. Определите электрофил и нуклеофил в этой реакции.
- Что является продуктом реакции элиминирования 1-бром-2-метилпропана этоксидом натрия?
- Напишите структуру продукта, ожидаемого от электрофильного присоединения HBr к цис-3-гексену.
- Напишите структуру продукта, ожидаемого от электрофильного присоединения 1-метилциклопентена к HBr.
 Определите электрофил и нуклеофил, а затем напишите механизм этой реакции.
Определите электрофил и нуклеофил, а затем напишите механизм этой реакции. - Напишите синтетическую схему получения пропена из пропана. После синтеза пропена, как вы получите 2-бромпропан?
- Напишите синтетическую схему получения этилена из этана. После синтеза этилена, как бы вы получили йодэтан?
- Сколько монобромированных изомеров вы ожидаете получить в результате высокотемпературной реакции Br 2 с 3-метилпентаном? Какой изомер образуется из наиболее стабильного радикала?
- Сколько различных монохлорированных изомеров вы ожидаете получить при фотохимической реакции Cl 2 с 2,4-диметилпентаном? Какой изомер образуется из наиболее стабильного радикала-предшественника?
- Сколько различных радикалов может быть образовано в результате фотохимической реакции Cl 2 с 3,3,4-триметилгексаном?
- Сколько монобромированных изомеров вы ожидаете от фотохимической реакции Br 2 с
- изобутеном?
- 2,2,3-триметилпентан?
- Расположите ацетон, этан, диоксид углерода, ацетальдегид и этанол в порядке увеличения степени окисления углерода.

- Какие продукты вы ожидаете от восстановления кетона? окисление альдегида?
- Какие продукты вы ожидаете от снижения содержания формальдегида? окисление этанола?
Ответы
- четыре; 3-бром-3-метилпентан
- семь
- метанол; ацетальдегид, затем уксусная кислота и, наконец, CO 2
Ретросинтез Учебник по органической химии
В органической химии синтез и ретросинтез идут рука об руку.
Хотя нет четкого различия, мне нравится думать о синтезе как о перспективном мышлении, а о ретросинтезе как о обратном .
Синтез — это тема, которая обычно вводится в Органическую химию 1 сразу после изучения реакций алкинов. Вы будете использовать его снова и снова по мере того, как будет накапливаться количество реакций, которые вы выучите.
Вот почему важно просмотреть прошлые темы , прежде чем переходить к следующей главе. При изучении новых тем вас могут попросить выполнить ретросинтез, который включает получение пяти различных реакций из пяти разных глав.
При изучении новых тем вас могут попросить выполнить ретросинтез, который включает получение пяти различных реакций из пяти разных глав.
Давайте вернемся…
Retro = Назад
Synthesis = Процесс объединения более простых реакций с образованием химического соединения / молекулы.
В вашем курсе органической химии это представлено в форме сложной молекулы, которую вам затем предлагается синтезировать из заданной исходной молекулы или набора условий реакции.
-> Вам могут дать конкретный реагент и попросить синтезировать продукт.
Например:
«Синтезировать транс-3,4-дибромгексан из этина.”
-> Вас могут попросить синтезировать продукт с учетом набора неопределенных или конкретных условий реакции.
Например:
«Синтезировать 2-бутанон с использованием любых неорганических реагентов. Используйте 2 углеродных алкилгалогенида в качестве единственного источника углерода ».
Встречали ли вы похожие вопросы в своем домашнем задании, тестах или практических экзаменах?
Как вы думаете?
Многие студенты будут смотреть на процесс и запаниковать;
И в упомянутой панике начал рисовать все, что приходит в голову, без — четкий процесс или представление о том, куда они направляются.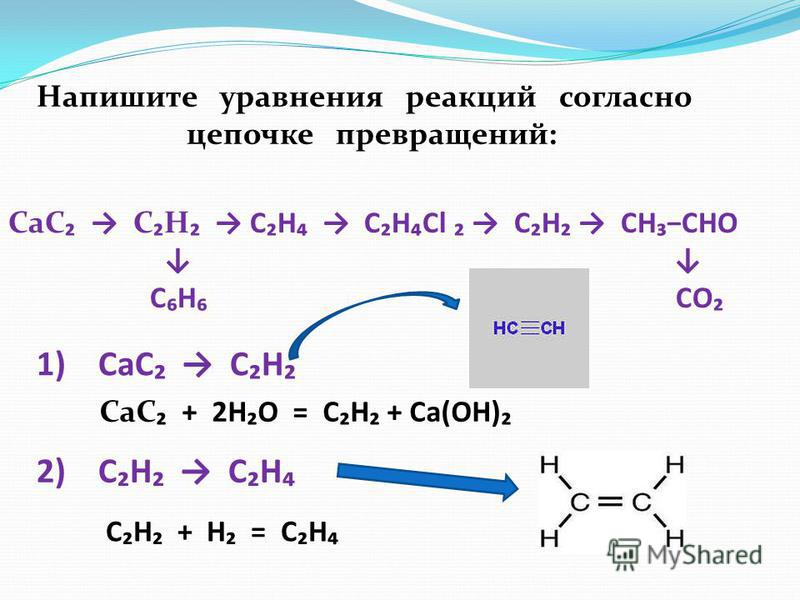
Мне нравится систематически подходить к проблемам.
Мне нравится планировать свои шаги и точно знать, что мне делать.
И что еще более важно, я верю, что этот процесс снова и снова поможет мне получать правильные результаты.
Как можно быстрее!
Чем более систематизирован ваш подход, тем больше вероятность, что вы уловите каждый компонент реакции. Следовательно, тем меньше вероятность, что вы что-то пропустите.
Это ключ. Получите все компоненты и минимизируйте потерю баллов на экзамене.
Прежде чем углубляться в проблемы, вам нужно знать, куда вы идете.
Вы должны убедиться, что в конечном итоге ваши действия окупятся и вы получите желаемый продукт.
- Что то же самое?
- Что отличается?
- Как я могу добиться этой разницы?
Что такое же?
Прежде чем добавлять новые группы в молекулу, вы хотите увидеть, с чем уже можно работать.
Мы будем использовать анализ, описанный в руководстве по синтезу, при анализе того, что присутствует в реагенте.
(многие теряют баллы из-за отсутствия счета)
Сколько атомов углерода присутствует в реагенте и продукте ?
Это поможет вам определить реакции удлинения или расщепления цепи.
Найдите все
неуглеродных атомов и функциональных группы .Что еще находится в молекуле в реагенте и продукте?
Найдите
место реакционной способности молекулы.Реакционная способность молекулы относится к расположению реакционноспособных атомов или функциональных групп.
Например, 2-хлорпропан обладает реакционной способностью по отношению ко второму углероду. Cl — хорошая уходящая группа. Это позволяет нам провести ряд реакций:
- Исключение для создания пи-связи (E1 или E2)
- Замена для получения другой функциональной группы в виде поступающего нуклеофила (SN1 или SN2)
- Мы могли бы превратить Cl в смесь Гриньяра для сверхреактивного металлоорганического соединения
- И многое другое…
Это ваша подсказка относительно ГДЕ начать реакцию.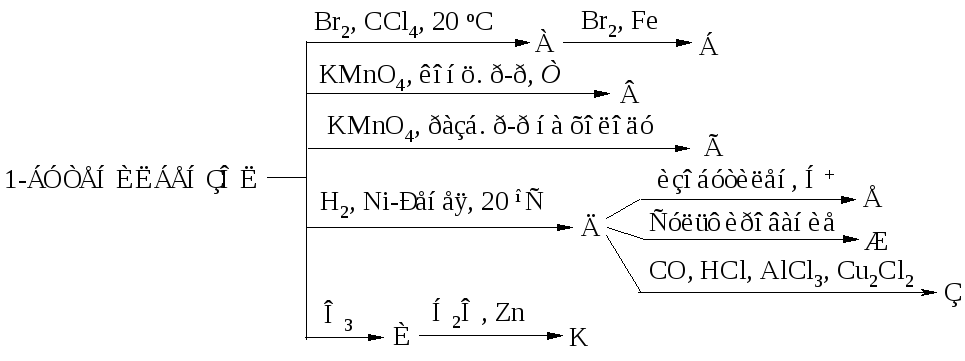
Сравните каждую из этих характеристик с конечным продуктом.
Обратите внимание на все, что изменяет , потому что наша цель при проведении ретросинтеза будет именно такой: выяснение КАК выполнять эти преобразования, что подводит меня к вопросу 2.
Чем отличается?- Если количество атомов углерода изменилось на , на сколько?
- Сколько атомов углерода было добавлено или удалено?
- Если функциональные группы или реакционная способность изменились , что было заменено и чем?
- Сколько новых групп было добавлено?
Как только мы определили, что одинаково, а что отличается, мы задаем самый важный вопрос:
КАК я могу осуществить это преобразование?Это вопрос из двух частей.
1) Для кратких задач синтеза ответ прост.
Какая ОДНА реакция превратит исходную молекулу x в продукт y ?
Например, 2-иодпропан в пропен.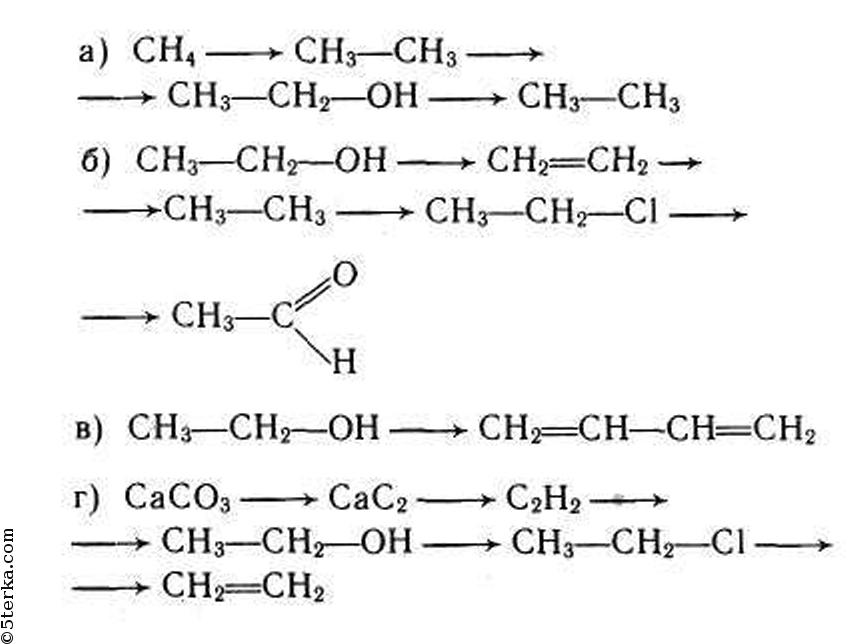
Что то же самое?
И реагент, и продукт имеют три атома углерода.
Что изменилось?
Реагент имеет галоген на углероде №2.
Продукт имеет пи-связь между бывшим углеродом 2 и углеродом 3.
Как я могу выполнить это преобразование?
Удалите галоген, используя сильное основание для реакции E2 или даже слабое основание и нагрейте для реакции E1.Оба предоставят один и тот же продукт.
Подсказка: в случае сомнений выберите E2 вместо E1. При правильных условиях он быстрее, точнее и имеет меньшую конкуренцию (E1 против SN1). Вы также можете управлять выбором продукта для формирования более (Зайцев) или менее замещенной (Big Bulky Base) пи-облигации.
2) Но ваш профессор, скорее всего, не даст вам такого простого одношагового преобразования для ретросинтеза.
Давайте поднимем его на ступеньку выше.
Например, вас просят преобразовать 2-хлорбутан в 1-бутанол.
Все еще относительно простое преобразование, но мы больше не рассматриваем простую одностадийную реакцию.
Применяется тот же набор вопросов, которые помогут вам перейти к продукту.
Что то же самое?
Всего в реагенте и продукте четыре атома углерода.
У нас есть одна функциональная группа в реагенте и продукте.
Что изменилось?
Реагент содержит галоген; в продукте есть спирт.
Реакционная способность молекулы изменилась с углерода №2 на углерод №1.
Какие реакции я знаю, чтобы провести это преобразование?
Внезапно ответ не так ясен, но все же возможно.
В предыдущем примере мы смогли быстро ответить на этот вопрос.
ОДНА единственная реакция превратила нашу исходную молекулу в желаемый продукт.
Здесь не так уж и много!
Вот где проявляется истинная сила ретросинтетического анализа.
Давайте разберемся.
У нас есть хлор в исходной молекуле и спирт в продукте.
Хотя нам ДЕЙСТВИТЕЛЬНО известна реакция превращения Cl в OH (SN2), это произойдет на том же угле. Нам нужен ОН на другом углероде.
Итак, давайте сделаем шаг вперед, или лучше сказать, сделаем шаг назад на .
Ретросинтез — это обратное мышление, поэтому давайте начнем с продукта.
Если продукт представляет собой спирт на первичном углероде, какая реакция, которую я знаю, даст МНЕ спирт на первичном углероде?
«Первичный против вторичного» сообщает мне «Антимарковниковский спирт», который говорит мне, что мне нужно провести реакцию присоединения алкена в условиях «Антимарковникова».
Вернемся к продукту на шаг назад. Мне нужен алкен.
Пока не беспокойтесь о реагентах. Гораздо проще продумать молекулы сначала , а затем вернуться и заполнить недостающие реагенты, как описано в руководстве по синтезу.
Теперь мы рассматриваем алкен как наш новый продукт и снова задаем тот же вопрос.
Сравнение реагента с алкеном,
Знаю ли я о реакции, которая либо осуществит это преобразование, либо приблизит меня?
Да, это простая реакция удаления, как мы видели выше.
Однако на этот раз мы не можем просто использовать сильное основание, потому что пи-связь будет благоприятствовать более замещенному и продукту Зайцева 2-бутену.
Вместо этого нам нужна реакция отщепления, которая заставит пи-связь образоваться на менее замещенном первичном и вторичном углероде.
Какой реагент будет осуществлять это «антизайцевское» или устранение Гофмана?
Нам нужна «тройная В» или большая объемная основа
Трет-бутоксид
Но давайте не будем сейчас беспокоиться о трет-бутоксиде, вместо этого давайте просто признаем тот факт, что мы МОЖЕМ реагировать с 2-хлорбутаном с образованием 1-бутена и провести это преобразование.
После того, как все ваши промежуточные соединения перейдут от продукта к реагенту, быстро проследите последовательность от реагента к продукту, чтобы убедиться, что он выглядит правильно и имеет смысл.
Теперь спросите себя:
Какой реагент будет выполнять каждое преобразование?
Задайте себе этот вопрос по очереди, когда вы заполняете условия реакции и завершаете последовательность ретросинтеза.
Начнем с вторичного галогена и образуем менее замещенную пи-связь.
Это требует сильного основания трет-бутоксида, как мы уже намекали выше.
В то время как некоторые профессора примут это как есть, другие потребуют полного набора условий.
Давайте используем трет-бутоксид калия, растворенный в его собственном конъюгированном спирте, трет-бутаноле, и нагреем, чтобы помочь осуществить эту реакцию. Напомним, что реакции E2 предпочитают тепло. Теперь, когда у нас есть асимметричный алкен, нам нужна реакция присоединения алкена, которая позволит спирту присоединиться к первичному углероду или в антимарковниковской позиции.
Гидроборирование должно сразу прийти в голову.
Добавим Bh4, THF в NaOH и h3O2.
И вот, пошаговая трансформация с использованием реагентов.
Синтез + ретросинтетический анализ.
Начните с в обратном направлении думайте, когда можете.
Вы знаете выражение «ретроспективный взгляд — 20/20»?
Вот на что мы рассчитываем.
Глядя на свой продукт и имея в виду только реагент, вы можете задать очень, очень важный вопрос:
Как выглядела эта молекула всего за ОДИН предшествующий шаг, чтобы я мог образовать функциональную группу x?
Эта форма ретросинтетического анализа поможет вам быстро идентифицировать одно промежуточное соединение за раз, вплоть до вашей исходной молекулы.
Давайте попробуем что-нибудь посложнее.
Допустим, вас попросили начать с бензола для синтеза 2-нитробензойной кислоты.
Что то же самое?
Реагент и продукт имеют бензольное кольцо.
Что изменилось?
Продукт представляет собой дизамещенный бензол . Заместители находятся в орто-соотношении.
Мы добавили карбоновую кислоту и нитрогруппу.
Какие реакции я знаю для выполнения этих преобразований?
Учитывая, что у нас происходит более одной реакции, всегда обращайте внимание на то, как реакции влияют друг на друга.
Мы можем добавить карбоновую кислоту путем алкилирования Фриделя-Крафтса с последующим окислением.
Мы можем добавить нитрогруппу с помощью EAS Nitration.
НО, вот с чем следует быть осторожным:
Группы расположены на орто друг к другу.
И NO2, и карбоновая кислота являются группами, дезактивирующими EAS, с метауправляемыми эффектами.
Давайте подумаем, прежде чем начать реагировать.
Если карбоновая кислота образуется в результате алкилирования FC, алкильная группа до окисления является орто / пара-директором.
Это хорошо.
Но как мы можем гарантировать, что мы закончим с положением ortho , а не para ?
Нам нужна еще одна реакция, которая не проявляется в продукте.
Нам нужна блокирующая группа в пара-положении, чтобы гарантировать, что орто — единственная доступная группа.
Все эти мысли должны быстро пролететь у вас в голове. Пока нет необходимости записывать реакции, хотя я предпочитаю отмечать молекулы как «примечание для себя».’
Пока нет необходимости записывать реакции, хотя я предпочитаю отмечать молекулы как «примечание для себя».’
Теперь, когда мы знаем, куда мы идем, ретросинтез завершен, и мы можем напрямую перенести эту реакцию от реагента к продукту.
Начнем с алкилирования Фриделя Крафтса. Размер вашей углеродной цепи не имеет значения, поскольку окисление боковой цепи отсекает лишние атомы углерода.
Давайте возьмем этилхлорид в FeCl3 и получим этилбензол:
Теперь у нас есть орто-парадиректор, поэтому давайте добавим блокирующую группу .
Сульфирование EAS добавит объемный SO3H в пара-положение.
При заблокированном параграфе мы можем провести другую реакцию, имея в виду следующее:
- Этил все еще является орто / пара директором, но пара заблокирован!
- Сера является частично положительной и метауправляющей группой.
ОБЕ группы направляют атом углерода № 2 рядом с этильной группой, что нам и нужно.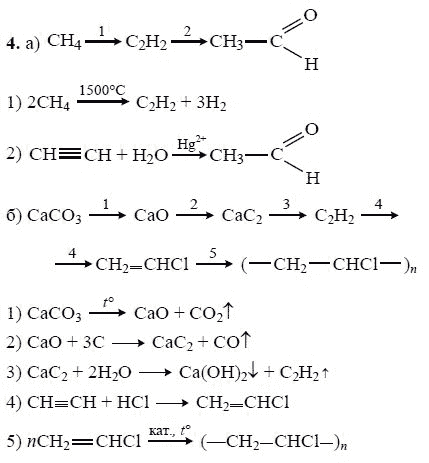
Затем мы проводим нитрование EAS, переводя нитрогруппу в орто-этил и мета в сульфат.
Разбавленная кислота затем удалит блокирующую группу из пара-положения, оставив у вас мета-нитрогруппу по отношению к этильной группе.
Здесь многие студенты теряют баллы.
Они так взволнованы, что думали обо всем этом, что забывают, что это не тот продукт, который нужен.
ВСЕГДА возвращайтесь к первоначальному вопросу, чтобы убедиться, что вы ничего не забыли.
Что мы забыли?
Этил не является нашей целью.
Нам нужна карбоновая кислота.
Введите перманганат калия со способностью окисления боковой цепи, превращая бензильную позицию в карбоновую кислоту для нашего конечного продукта.
После этого выполните всю последовательность, чтобы убедиться, что все ваши реагенты и промежуточные продукты работают вместе и имеют смысл, и мы закончили.
Те же самые мысли можно применить к любой задаче ретросинтеза от двух до 100 шагов и более. Хорошо, возможно, я преувеличиваю, ваш профессор, надеюсь, ограничит ваши проблемы ретросинтеза тремя-семью шагами.
Хорошо, возможно, я преувеличиваю, ваш профессор, надеюсь, ограничит ваши проблемы ретросинтеза тремя-семью шагами.
Теперь, когда у вас есть основы подхода к ретросинтезу, вам понадобится прочная основа.Я рекомендую вернуться, чтобы просмотреть все ключевые реакции, затронутые в вашем семестре, чтобы они были свежими и готовы к использованию по мере необходимости.
Используйте мой Syllabus Companion, чтобы быстро найти учебные пособия, видео и шпаргалки по типичным реакциям органической химии.
Я хотел бы услышать от вас
Чувствуете ли вы себя лучше в отношении ретросинтеза и оставаясь на правильном пути, чтобы получить полную оценку каждой проблемы? Позвольте мне знать в комментариях ниже.
на основе сокращенной программы CBSE 2020-21!
CBSE: Схема маркировки химического состава CBSE Class 12 2021 вместе с образцом химического документа CBSE Class 12 2021 доступна здесь для загрузки в формате PDF.Студентам, готовящимся к экзамену CBSE Class 12th Chemistry Board 2021, предлагается загрузить эти ресурсы и внимательно изучить новый образец экзамена, схему выставления оценок и уровень сложности экзамена.
Также проверьте: Лист данных CBSE на 2021 год для 10-го и 12-го экзаменов совета директоров
CBSE Class 12 Chemistry Marking Scheme 2021:
РАЗДЕЛ — А (ОБЪЕКТИВНЫЙ ТИП)
1. Прочтите отрывок, приведенный ниже, и ответьте на следующие вопросы:
Обнаружена эффективная аэробная каталитическая система для превращения спиртов в карбонильные соединения в мягких условиях, катализатор на основе меди.Эта каталитическая система на основе меди использует кислород или воздух в качестве конечного стехиометрического окислителя, производя воду в качестве единственного побочного продукта
https://www.jagranjosh.com/imported/images/E/Articles/cbse-12th-chemistry-sample-paper-2021-Q1.JPG
Широкий спектр первичных, вторичных, аллильных и бензильных спиртов можно плавно окислить до соответствующих альдегидов или кетонов с выходами от хороших до отличных. Вместо кислорода можно удобно использовать воздух, не влияя на эффективность процесса. Однако использование воздуха требует немного большего времени реакции. Этот процесс не только экономически выгоден и применим для крупномасштабных реакций, но и экологически безопасен.
Однако использование воздуха требует немного большего времени реакции. Этот процесс не только экономически выгоден и применим для крупномасштабных реакций, но и экологически безопасен.
Следующие вопросы представляют собой вопросы с несколькими вариантами ответов. Выберите наиболее подходящий ответ:
(i) Катализатор на основе меди, упомянутый в исследовании выше, может быть использован для преобразования:
(а) пропанол в пропановую кислоту
(b) пропанон в пропановую кислоту
(c) пропанон в пропан-2-ол
(d) пропан-2-ол в пропанон
Ответ: d
(ii) Карбонильное соединение, образующееся при окислении этанола с использованием этого катализатора на основе меди, также может быть получено озонолизом:
(а) Бут-1-ен
(б) Бут-2-ен
(c) Этен
(г) Пент-1-ен
Ответ: b
ИЛИ
Что из перечисленного является вторичным аллиловым спиртом?
(а) Бут-3-ен-2-ол
(б) Бут-2-ен-2-ол
(c) Проп-2-енол
(d) Бутан-2-ол
Ответ:
(iii) Бензиловый спирт при обработке этим катализатором на основе меди дает соединение «A», которое при реакции с КОН дает соединения «B» и «C». Соединение «B» при окислении KMnO4-KOH дает соединение «C». Соединения «A», «B» и «C» соответственно:
Соединение «B» при окислении KMnO4-KOH дает соединение «C». Соединения «A», «B» и «C» соответственно:
(a) Бензальдегид, бензиловый спирт, калиевая соль бензойной кислоты
(b) Бензальдегид, калиевая соль бензойной кислоты, бензиловый спирт
(c) Бензальдегид, бензойная кислота, бензиловый спирт
(d) Бензойная кислота, бензиловый спирт, бензальдегид
Ответ:
(iv) Органическое соединение «X» с молекулярной формулой C3H8O при взаимодействии с этим катализатором на основе меди дает соединение «Y», которое восстанавливает реагент Толлена.«X» при реакции с металлическим натрием дает «Z». Каков продукт реакции «Z» с 2-хлор-2-метилпропаном?
(а) Ч4Ч3Ч3ОС (Ч4) 3
б Ч4Ч3ОС (Ч4) 3
(в) Ch3 = C (Ch4) 2
(г) Ч4Ч3Ч = С (Ч4) 2
Ответ: C
.
.
.




 Осущест
Осущест Об университете и его подразделениях, телефонный справочник, расписания занятий, сведения для поступающих. Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Напишите уравнение реакции получения дипептида из валина и цистеина. Приведите уравнения реакций, с помощью которых можно осуществить превращения: Укажите, к какому типу относятся перечисленные амины:
Научно-образовательно-клинический комплекс. Образование, наука, лечебные работы. The requested URL perlpublicpublic.pl was not found on this server.
Реакции равна общей массе веществ, вступивших в реакцию, т.е. åmпродуктов åmреагентов, Расчет тепловых эффектов химических реакций по стандартным энтальпиям образования веществ ( следствие из закона Гесса)
Об университете и его подразделениях, телефонный справочник, расписания занятий, сведения для поступающих. Прошу назначить компенсацию проезда до ( указать название населенного пункта проживания)
Напишите уравнение реакции получения дипептида из валина и цистеина. Приведите уравнения реакций, с помощью которых можно осуществить превращения: Укажите, к какому типу относятся перечисленные амины:
Научно-образовательно-клинический комплекс. Образование, наука, лечебные работы. The requested URL perlpublicpublic.pl was not found on this server.
Реакции равна общей массе веществ, вступивших в реакцию, т.е. åmпродуктов åmреагентов, Расчет тепловых эффектов химических реакций по стандартным энтальпиям образования веществ ( следствие из закона Гесса) В результате образуется уксусная кислота (этановая кислота), поэтому D :
В результате образуется уксусная кислота (этановая кислота), поэтому D :
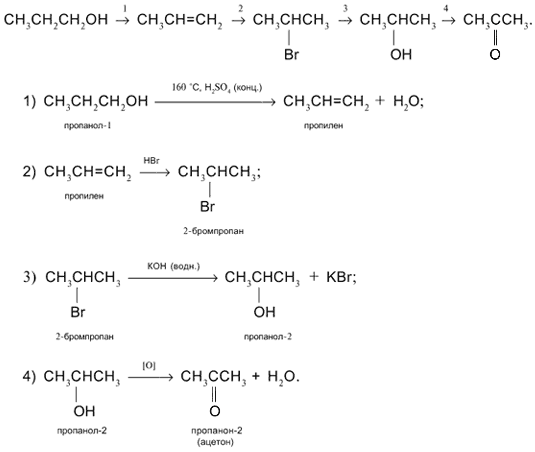
 Определите электрофил и нуклеофил, а затем напишите механизм этой реакции.
Определите электрофил и нуклеофил, а затем напишите механизм этой реакции.