Практическая работа № 6. Решение экспериментальных задач по органической химии
1. С помощью характерных реакций распознайте, в кассой из пробирок находятся водные растворы: а) этанола; б) уксусной кислоты; в) глюкозы; г) глицерина.
2. С помощью характерных реакций распознайте, в какой из пробирок находятся водные растворы: а) фенола; б) глицерина; в) формальдегида; г) глюкозы.
3. С помощью характерных реакций распознайте, в какой из пробирок находятся: а) глицерин; б) растительное масло; в) машинное масло, полученное из нефти; г) сахарный сироп.
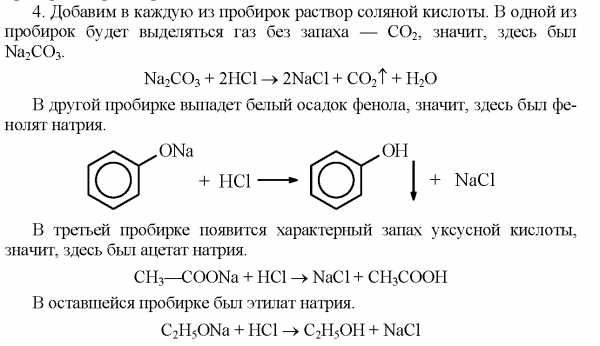
4. Распознайте с помощью одного и того же реактива, в какой из пробирок находятся водные растворы: а) фенолята натрия; б) эти лата натрия; в) ацетата натрия; г) карбоната натрия.
5. Распознайте с помощью одного и того же реактива, в какой из пробирок находятся растворы: а) мыла; б) белка; в) соды.
6. Используя одну и ту же реакцию, но разные условия ее протекания, распознайте, в какой из трех пробирок находятся растворы: а) глицерина; б) формалина; в) белка.
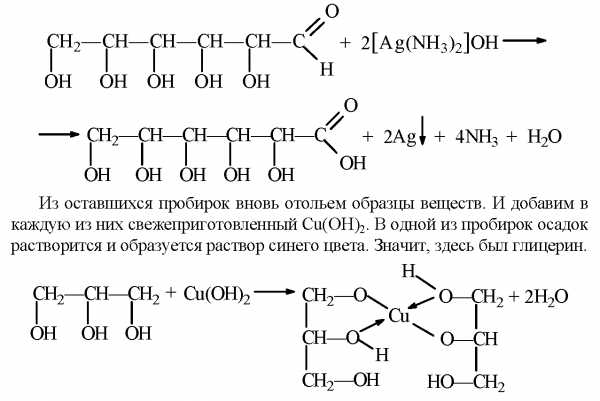
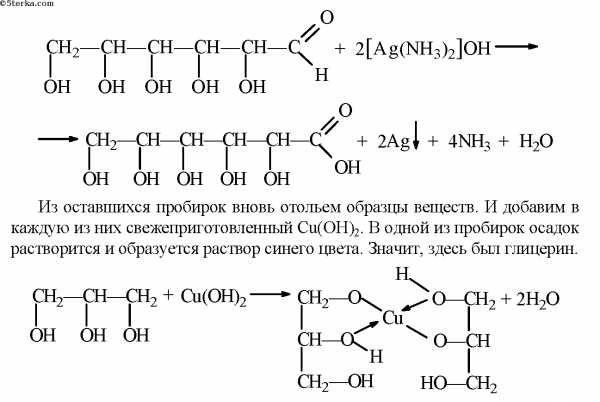
1. Отольем из каждой пробирки образец вещества и прильем в каждую из них аммиачный раствор оксида серебра. В одной из пробирок произойдет реакция: выпадет осадок серебра. Значит, здесь был раствор глюкозы.

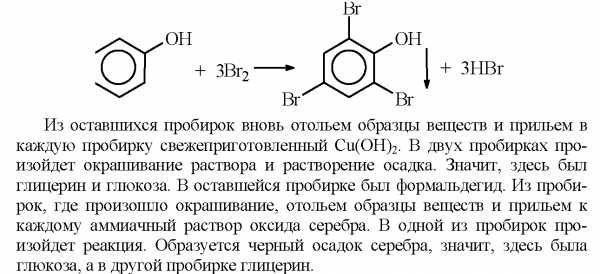
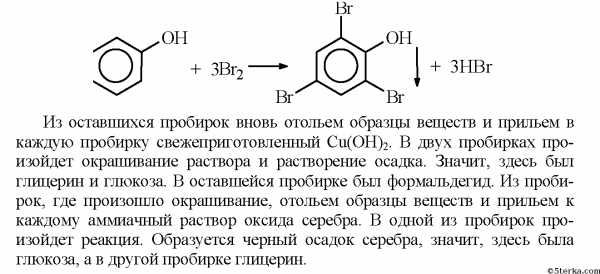
2. Отольем из каждой пробирки образец вещества. И добавим в каждую из них бромную воду. В одной из пробирок выпадет белый осадок, значит, здесь был фенол

5terka.com
Практическая работа. Решение экспериментальных задач по органической химии
Разделы: Химия
Цели:
- Продолжить формировать умение применять теоретические знания о химических свойствах и качественных реакциях органических соединений для решения экспериментальных задач, наблюдать явления, описывать их и делать умозаключения.
- Развивать специальные умения и навыки обращения с веществами, учить выполнять несложные исследования, соблюдая правила ТБ.
- Способствовать воспитанию экологической грамотности, как основы экологической культуры и здорового образа жизни.
Реактивы и оборудование: пробирки, спиртовки, мензурки, стаканы, пипетки, спички, пробиркодержатель.
Гречка, растительное масло, мед, антифриз, этиловый спирт, белок куриного яйца, сульфат меди, гидроксид натрия, азотная кислота, соляная кислота, фенол, щелочь, ацетат свинца, йод, раствор перманганата калия.
Презентация к уроку.
Ход урока
I. Организационный этап.
Вводное слово учителя.
Тема практической работы: «Решение экспериментальных задач по органической химии».
Слайд №1.
Какова цель нашего урока? (Цель урока — решить экспериментальные задачи).
Что мы должны знать к этому уроку? (Знать свойства органических веществ, их качественные реакции, правила техники безопасности).
Что должны уметь? (Уметь записывать уравнения реакций, обращаться с реактивами, с химическим оборудованием, на основании полученных результатов эксперимента — делать выводы).
Сегодня на уроке вы должны применить теоретические знания и умения для решения практических задач. Знаний у нас достаточно, чтобы применять их для решения реальных задач повседневной жизни. Доказать, что умеем ориентироваться в полученной информации, обращаться с веществами окружающими нас в быту.
Вспомним правила работы с веществами и оборудованием.
Слайд №2.
Работаем в парах. Каждая группа получает задание и инструкцию с теоретической справкой. Проводите эксперимент, обсуждаете результаты, готовите выступление, используя материал теоретической справки.
Вам для работы выданы тетради на печатной основе. Подпишите их. В этой тетради записаны все задачи, которые будут рассмотрены на уроке. Находите свою задачу и заполняете все необходимое по задаче. В дальнейшем вы слушаете своих одноклассников и по ходу выступления заполняете пропущенные места. В конце занятия вы сдаете эту тетрадь.
На эксперимент и выводы дается 10 — 15 минут.
II. Основной этап. Решение экспериментальных задач. (10 — 15минут)
Слайд №3
Задача № 1. Исследовать водный раствор смыва с крупы на содержание пестицидов.
Задача № 2. Исследовать влияние этилового спирта различной концентрации на белок.
Задача № 3. Докажите опытным путем содержание многоатомного спирта этиленгликоля в антифризе и исследуйте его влияние на белок.
Задача № 4. Исследуйте влияние минеральных кислот, щелочей, солей тяжелых металлов и фенола на белок.
Задача № 5. Исследуйте реакцию раствора мыла и сделайте вывод, какие из исследуемых вами сортов мыла наиболее подходит для ухода за вашей кожей.
Задача № 6. Исследовать растительное масло на пригодность к употреблению.
Задача № 7. Исследуйте мед на содержание сахарозы вместо глюкозы в поддельном меде.
Задача № 8. Исследуйте мед на содержание крахмала в поддельном меде.
Выступление от групп.
Учитель: Переходим к обсуждению полученных результатов по решению экспериментальных задач.
Слайд №4.
Утро французского короля Людовика XIV начиналось с многочасового ритуала одевания и очень короткого умывания. Ему приносили большую великолепную чашу, на дне которой плескалась вода. Король смачивал кончики пальцев и слегка дотрагивался ими до век. На этом процедура заканчивалась — мыться в те времена не принято.
Слайд №5.
В России промышленное производство мыла было налажено при Петре I, вплоть до середины XIX века им пользовалась только знать. Крестьяне стирали и мылись щелоком — древесную золу заливали кипятком и распаривали в печке.
Как вы догадались, речь пойдет о моющих средствах. Слово предоставляется ребятам, которые исследовали щелочность мыла.
Слайд №6.
Группа № 1. (Примерный ответ) Выступление по теме «Щелочность мыла».
Цель нашей работы: «Исследовать реакцию раствора мыла и сделать выводы, какие из исследованных сортов мыла наиболее подходит для ухода за кожей разного типа».
Мы исследовали 10 сортов мыла на щелочность. Основой мыла являются соли натрия (твердое мыло) и калия (жидкое мыло), высших карбоновых кислот.
Разберем соль стеарата натрия С17Н35СООNa
Соль образована слабой кислотой и сильным основанием в водной среде подвергается гидролизу.
С17Н35СООNa +Н2О > С17Н35СООH + Na +
OH —В результате реакции образуется сильная щелочь, которая и обусловливает щелочную среду. Щелочь сушит кожу, поэтому важно правильно подобрать мыло для своей кожи.
С помощью индикаторной универсальной бумаги исследовали среду мыла и с помощью цветовой эталонной шкалы на упаковке индикатора и цифровой шкалы мы установили рН мыла.
с рН = 7,
рН > 7,
pH <7.
Различают следующие типы кожи (сообщение).
Учитель: Дальше разговор пойдет о меде.
Слайд № 7.
Варят поддельный мед из сахарного сиропа, в который для запаха добавляют немного натурального меда. А еще добавляют мел и крахмал, поэтому, если нагреть настоящий мед, то он превратится в совершенно прозрачную жидкость. Мед же с примесью крахмала и сахара при нагревании дают густую мутную жидкость, которая при охлаждении окрашивается несколькими каплями раствора йода в синеватый или буроватый цвет.
Как отличить поддельный мед от натурального меда занимались две группы. Каждой группе даны две пробы и согласно задаче должны определить, где находится натуральный мед, а где поддельный.
Слово первой группе, которая исследовала мед на содержание сахарозы.
Слайд № 8.
Группа № 2. Выступление 1 по теме «Углеводы».
Цель работы: Исследовать мед на содержание глюкозы.
В основе определения глюкозы в растворе лежит реакция ее окисления свежеосажденным гидроксидом меди (II). Эта качественная реакция на альдегидную группу.
Уравнение реакции окисления глюкозы:
СН2ОН-(СНОН)4-СНО + 2Cu(OH)2 > СН2ОН-(СНОН)4-СОOH +Cu 2O +2H2O
В результате взаимодействия сахарозы с водой также образуется глюкоза и фруктоза. Однако эта реакция в нейтральной среде протекает очень медленно, а в щелочной среде сахароза не подвергается гидролизу. Мы проводили реакцию в сильно щелочной среде. Следовательно, о соотношении глюкозы и сахарозы можно судить по количеству красного осадка.
У нас было 2 пробы с медом, в одной пробирке находился натуральный мед, в другой - поддельный.
Провели качественную реакцию на глюкозу с гидроксидом меди. Образовался осадок в каждой пробирке. Интенсивность красного осадка больше в натуральном меде, чем в поддельном.
Вывод:
В пробирке № 1-натуральный мед.
В пробирке № 2 — поддельный мед.
Слово второй группе. Ребята исследовали мед на содержание крахмала и мела.
Слайд № 9.
Группа № 3. Выступление по теме «Углеводы».
Цель: Исследовать мед на содержание крахмала и мела.
Так как качественной реакцией на крахмал является реакция с раствором йода, образуется синее окрашивание, то мы в пробирки с медом добавили раствор йода.
В пробирке №2 обнаружили синее окрашивание, следовательно, это поддельный мед. В пробирке №1 натуральный мед.
Чтобы обнаружить мел, на пробы с медом подействовали соляной кислотой (в домашних условиях можно использовать уксусную кислоту). В пробирке с поддельным медом наблюдали пузырьки газа, так как проходит реакция:
СаСО3 + 2HCI > CaCI2 + CO2^ + H2O
В другой пробирке пузырьков газа не наблюдали.
Вывод:
1. В пробирке № 1-натуральный мед.
В пробирке № 2 — поддельный мед.
Учитель: Дальше разговор пойдет о растительном масле.
Слайд № 10.
Срок хранения растительного масла от 4 до 6 месяцев. Не секрет, что запасы растительного масла в России сохранились со времен ВОВ. И очень важно уметь определять пригодность растительного масла в употребление. Растительное масло содержит незаменимые жирные кислоты, которые уменьшают содержание холестерина в крови, а также содержат витамины В,А,Е,К. По степени пригодности к употреблению и биологической ценности растительные масла располагаются:
Кукурузное — оливковое — горчичное - подсолнечное — соевое — арахисовое — хлопковое.
Слово предоставляется ребятам, которые исследовали растительное масло на пригодность к употреблению.
Слайд № 11.
Группа № 4. Выступление по теме «Жиры».
Цель работы: Исследовать растительное масло на пригодность к употреблению.
В состав жидких жиров, растительных масел входят высшие непредельные карбоновые кислоты, которые способны к реакциям присоединения по месту двойных связей.
Уравнение взаимодействия с йодом в водной среде.
CH2 — O — CО — (CH2)7— CH=CH-(CH2)7-CH3
CH — O — CО — (CH2)7— CH=CH-(CH2)7-CH3 + 3I2 >
CH2 — O — CО — (CH2)7— CH=CH-(CH2)7-CH3
CH2 — O — CО — (CH2)7— CHI — CHI — (CH2)7-CH3
CH — O — CО — (CH2)7— CHI — CHI — (CH2)7-CH3
CH2 — O — CО — (CH2)7— CHI — CHI — (CH2)7-CH3
Исследовали масло «::» и использованное, старое масло.
При добавлении йодной воды наблюдали обесцвечивание в масле сорта «::.», а в старом, использованном масле йодная вода не обесцветилась.
По мере старения масло за счет реакций окисления двойные связи в радикалах непредельных карбоновых кислот подвергаются деструкции, т. е. неспособны присоединять. Поэтому масло легко исследовать на пригодность в домашних условиях. Старое масло нельзя употреблять в пищу. У человека появляется сильная изжога, тошнота — первые признаки отравления.
Вывод: В пробирке № 1 — масло, в пробирке № 2 — .
Старое масло можно легко отличить от пригодного по реакции с раствором йода. В пригодном масле раствор йода обесцвечивается, в старом масле не обесцвечивается.
Учитель: Дальше разговор пойдет о пестицидах.
Слайд № 12.
За последние десятилетия использование пестицидов в нашей стране увеличилось в 7 раз.
Серьезную опасность для живых организмов представляет то обстоятельство, что чужеродные для природы вещества нередко обладают мутагенными действиями.
Предпочтение следует отдавать пестицидам, которые быстро разлагаются на безопасные вещества. К сожалению таких ядохимикатов очень мало. И мы чаще всего сталкиваемся с вредными для природы веществами.
Слово предоставляется группе, которая исследовала водные растворы смыва с круп.
Слайд № 13.
Группа № 5. Выступление по теме «Пестициды».
Цель работы: Исследовать водный раствор смыва с крупы на содержание пестицидов.
Сорняки и вредители уничтожают более трети урожая. Поэтому человек использует пестициды для сохранения урожая. Это единственный вид загрязняющих веществ, который человек вносит сознательно в окружающую среду.
Отличительная черта этих ядохимикатов - стойкость к воздействию факторов среды. Они почти не разлагаются в воде, и почве. Накапливаются в растениях, почве. Попадают в организм человека. Возникает хроническое отравление с поражениями у человека печени, ЦНС и других жизненно важных органов.
Мы исследовали водные растворы смыва с крупы гречки на содержание пестицидов. Взяли смывы после каждого промывания крупы и действовали раствором перманганатом калия на каждый смыв. Моментальное обесцвечивание раствора перманганата калия подтверждает предположение о присутствии пестицидов.
На 5-м смыве крупы раствор не обесцветился.
Вывод: Гречку и другие крупы следует промывать перед употреблением от 4 до 5 раз.
Учитель: Наш город Нефтеюганск насыщен автомобильным транспортом. И всем хорошо знакомо слово антифриз. Основой антифриза является ядовитое вещество этиленгликоль.
Слайд № 14.
Антифриз хранят и перевозят в герметичных емкостях с завертывающимися пробками. На таре должны быть надпись «ЯД» и знак маркировки, установленный для ядовитых веществ. Для переливания антифриза, применяют насосы, засасывать его ртом нельзя. После работы с антифризом следует тщательно вымыть руки водой с мылом.
Слово предоставляется группе, которая исследовала антифриз на содержание этиленгликоля и его влияние на белок.
Слайд № 15.
Группа № 6. Выступление по теме «Многоатомные спирты».
Цель работы: доказать опытным путем содержание многоатомного спирта этиленгликоля в антифризе и исследовать его влияние на белок.
Антифризы используются как незамерзающая жидкость. В северных условиях часто применяемое вещество, без которого обойтись нельзя. Основой антифризов является многоатомный спирт этиленгликоль. Этиленгликоль сильнейший яд и с ним надо правильно обращаться.
Мы исследовали антифриз на содержание этиленгликоля. Провели качественную реакцию на многоатомные спирты с гидроксидом меди. Образовался ярко-синий раствор.
Далее исследовали влияние антифриза на белок куриного яйца. Наблюдали осаждение белка.
Вывод:
1 Антифриз содержит этиленгликоль.
2. Антифриз разрушает белок куриного яйца.
3. Антифриз яд, с ним надо работать осторожно.
Учитель: Основой всех алкогольных напитков является этиловый спирт.
Слайд № 16.
Смертность от алкоголизма превышает число смертельных случаев, вызываемых всеми инфекционными заболеваниями вместе взятыми. Этиловый спирт окисляется до конечных продуктов распада только в том случае, если суточное потребление этанола составляет 20 г, при увеличении дозы в организме накапливаются промежуточные вещества распада, а именно уксусный альдегид. Вещество, которое в 30 раз токсичнее этилового спирта.
Слово предоставляется группе, которая исследовала влияние этилового спирта на белок.
Слайд № 17.
Группа № 7. Выступление по теме «Одноатомные спирты»
Цель нашей работы «Исследовать влияние этилового спирта разной концентрации на белок».
Приготовили пять растворов этилового спирта с разной концентрацией, которые отличаются, друг от друга на пять объемов воды. При взаимодействии этилового спирта с водой образуются гидраты, за счет водородных связей.
Наиболее токсичны гидраты, образующие при крепости 86-70%. При снижении крепости токсичность снижается в несколько раз быстрее, чем концентрация. Поэтому токсичность спирта в слабоалкогольных напитках выражена гораздо меньше, чем в таком же количестве крепких напитков.
Этими растворами спирта подействовали на белок. Наблюдали образование осадков. Интенсивность осадков уменьшается с разбавлением спирта.
В организме этиловый спирт окисляется под действием ферментов до уксусного альдегида ядовитого вещества.
СН3-СН2-ОН + [O] фермент> СН3- СНО + Н2О
Альдегид ядовитое вещество разрушает жизненно важные органы.
Наносит вред организму.
Вывод: Моментальное осаждение белка под действием спирта, означает, что спирт имеет отрицательное влияние на живой организм.
Учитель: «Жизнь — есть способ существование белковых тел» определение жизни дал немецкий философ Ф. Энгельс.
Слайд № 18.
Иллюстрации, расположенные на слайде красочнее всяких слов выражают действие токсичных веществ на живые организмы.
Слово предоставляется группе, которая исследовала влияние различных веществ на белок.
Слайд № 19.
Группа № 8. Выступление по теме «Белки».
Цель нашей работы: исследовать влияние минеральных кислот, щелочей, солей тяжелых металлов, фенола на белок.
Подействовали азотной кислотой качественная реакция на белок, щелочью, ацетатом свинца, фенолом на белок. Во всех случаях наблюдали осаждение белка.
Белки теряют присущие им специфические свойства, становятся нерастворимыми, денатурируют.
Денатурация — это разрушение пространственных структур белка. Денатурация бывает двух видов: обратимая и необратимая.
Опыты по осаждению белков свидетельствует о том, что загрязнения природной среды минеральными кислотами, щелочами, солями тяжелых металлов и фенолом имеет отрицательное последствие на живые организмы.
Увеличение концентрации тяжелых металлов в окружающей среде увеличивает число мутаций, передающих по наследству. Мутанты подвержены порокам физического и умственного развития. Средняя продолжительность жизни в России 60 лет. Поэтому необходимо уже сейчас резко ставить вопросы об экологических проблемах. Нельзя допускать попадание этих вредных веществ в окружающую среду превышающих ПДК.
Вывод: Минеральные кислоты, щелочи, соли тяжелых металлов, и фенолы являются токсичными веществами для живых организмов.
I
urok.1sept.ru
Решение экспериментальных задач. Контрольный урок по курсу органической химии за 10-й класс
Разделы: Химия
Цель: проверить уровень усвоенности знаний по курсу органической химии за 10 класс.
Задачи: проверить сознательное усвоение учащимися химических свойств основных классов органических соединений и качественных реакций на них; развитие мышления и творческой активности; воспитание трудолюбия, нравственности, интереса к предмету, воспитание коллективизма, сотрудничества и взаимопомощи; формирование умения проводить химический эксперимент, предварительно проанализировав условие задачи и определив пошаговое решение; умение находить ошибки и исправлять их.
Оборудование и реактивы: водный раствор гидроксида натрия, разбавленная серная кислота, водный раствор карбоната натрия, водный раствор перманганата калия, бромная вода, водный раствор сульфата меди, аммиачный раствор оксида серебра, вода, бензойная кислота, анилин, глюкоза, формалин, этиловый спирт, сахароза, уксусная кислота, глицерин; штативы, спиртовки, спички, пробирки, держатели.
ХОД УРОКА
Этот урок лучше проводить на сдвоенном занятии. Предварительно из класса отбираются шесть учеников, которые будут контролировать ход работы. Они проходят инструктаж по ТБ проведения лабораторных опытов, сдают учителю теорию и выполняют сами опыты.
Остальной класс делится на шесть групп. Каждой группе выдается маршрутный лист с названиями станций А, Б, В, Г, Д, Е. Названия станций также указывают на то, какие органические вещества необходимо будет на них распознавать. Каждая группа предварительно подписывает сверху свои фамилии. В столбцах указывают качественную реакцию, кратко описывает ход эксперимента и, если правильно определили вещества, получают отметку о прохождении станции. За урок учащиеся успевают обойти все шесть станций.
В классе по кругу расставляются парты с реактивами по названиям станций. На каждой станции находится уже проверенный ученик – контролер. В его обязанности входит проверка правильности поставки опытов с учетом ТБ, возможность наводящей подсказки и отметка о прохождении своей станции ( знаком «+», если прошел успешно, знаком «-», если не прошел).
Им также выдаются заранее подготовленные листы контроля, на которых контролеры проставляют баллы за участие в решении поставленной задачи. Также на станциях имеются наборы реактивов и по два распознаваемых вещества.
Маршрутный лист представляет из себя нижеследующую таблицу
(целесообразно его оформлять на развернутом листе)
|
СТАНЦИЯ А |
СТАНЦИЯ Б |
СТАНЦИЯ В |
СТАНЦИЯ Г |
СТАНЦИЯ Д |
СТАНЦИЯ Е |
||||||
|
Бензойная кислота |
Анилин |
Глюкоза |
Бензойная кислота |
Формалин |
Этиловый спирт |
Глюкоза |
Сахароза |
Уксусная кислота |
Этиловый спирт |
Глюкоза |
Глицерин |
Листок контроля
|
Фамилия, имя ученика |
Теоретические знания |
Практические навыки |
Полезные советы |
Соблюдение ТБ |
Составление уравнений |
Оформление работы |
Две последние графы заполняет учитель после сдачи работы. Оценка выставляется по количеству набранных баллов.
Критерии оценки:
0 баллов – если ученик пассивен во всем;
1 балл – если дает правильные советы по теме, частично участвует в постановке опытов;
2 балла – если ученик активен во всем.
Выставление отметки:
10 – 12 баллов – отметка «5»;
8 – 10 баллов – отметка «4»;
5 – 8 баллов – отметка «3»;
меньше 5ти баллов – отметка «2».
ЗАДАЧИ НА УРОК
В вашем распоряжении имеется газовая горелка и набор реактивов:
- Водный раствор гидроксида натрия;
- Разбавленная серная кислота;
- Водный раствор карбоната натрия;
- Водный раствор перманганата калия;
- Бромная вода;
- Водный раствор сульфата меди;
- Аммиачный раствор оксида серебра;
- Вода.
и
- Бензойная кислота и анилин;
- Глюкоза и бензойная кислота;
- Формалин и этиловый спирт;
- Глюкоза и сахароза;
- Уксусная кислота и этиловый спирт;
- Глюкоза и глицерин.
С помощью минимального числа реагентов, указанных вначале, определите содержимое в каждой паре пробирок. Напишите уравнения соответствующих реакций и оформите работу в виде отчетной таблицы (смотри домашнее задание).
РЕШЕНИЕ
СТАНЦИЯ А
1. Распознавание бензойной кислоты:
2С6Н5 – СООН + Nа2СО3 → 2С6Н5 – СООNа + Н2СО3 (разлагается на Н2О + СО2)
Ход реакции мы увидим, если опустим газотводную трубку в стакан с водой. В нем будут выделяться бесцветные пузырьки газа (СО2).
2. Распознавание анилина:
С6Н5 – NН2 + 3Вr2 → С6Н2Вr3 -NН2 + 3НВr
6 – 7 мл воды встряхнуть с 1 каплей анилина. Прибавить к этому раствору по каплям бромную воду, которая обесцвечивается и выпадает белый осадок 2,4,6-триброманилина.
СТАНЦИЯ Б
1. Распознавание глюкозы
СН2ОН – (СНОН)4 – СНО + Аg2О СН2ОН – (СНОН)4 – СООН + 2 Ag↓
В пробирку наливают 1 – 2 мл раствора глюкозы в воде, прилить 1 – 2 мл аммиачного раствора оксида серебра и нагреть на водяной бане.
2. Распознавание бензойной кислоты:
2С6Н5 – СООН + Nа2СО3 → 2С6Н5 – СООNа + Н2СО3 (разлагается на Н2О + СО2)
Ход реакции мы увидим, если опустим газотводную трубку в стакан с водой. В нем будут выделяться бесцветные пузырьки газа (СО2).
СТАНЦИЯ В
1. Распознавание формалина
Н – СНО + Аg2О Н – СООН + 2 Аg ↓
К 1 – 2 мл формалина прилить 1 – 2 мл аммиачного раствора оксида серебра. Равномерно нагреть пробирку, вращая вокруг пламени спиртовки, но не допускать кипения.
2. Распознавание этилового спирта.
5С2Н5ОН + 4КМnО4 + 6Н2SО4 → 5СН3 – СООН + 2К2SО4 + 4МnSО4 + 11Н2О
Налейте в пробирку 2 мл этанола, прибавьте 2 мл разбавленного раствора перманганата калия и несколько капель серной кислоты. Аккуратно нагрейте. Произойдет обесцвечивание раствора.
СТАНЦИЯ Г
1. Распознавание глюкозы
СН2ОН – (СНОН)4 – СНО + Аg2О СН2ОН – (СНОН)4 – СООН + 2 Аg ↓
В пробирку наливают 1 – 2 мл раствора глюкозы в воде, прилить 1 – 2 мл аммиачного раствора оксида серебра и нагреть на водяной бане.
2. Распознавание сахарозы
| С12Н22О11 + Н2О | С6Н12О6 | + С6Н12О6 |
| глюкоза | фруктоза |
СН2ОН – (СНОН)4 – СНО + Аg2О СН2ОН – (СНОН)4 – СООН +2 Аg↓
Сахароза при обычных условиях не дает реакции «серебряного зеркала», необходимо провести гидролиз. К 1 – 2 мл раствора сахарозы в воде прилить несколько капель серной кислоты. Нагреть на водяной бане. Затем вновь повторить реакцию «серебряного зеркала». Т.к. одним из продуктов гидролиза является глюкоза, реакция произойдет.
СТАНЦИЯ Д
1. Распознавание уксусной кислоты
| СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
| голубой осадок |
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
| СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
| голубой осадок |
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
СТАНЦИЯ Е
1 .Распознавание глюкозы
| СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
| голубой осадок |
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 СН2ОН – (СНОН)4 – СООН + Сu2О ↓ + 2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
2. Распознавание глицерина
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
ДОМАШНЕЕ ЗАДАНИЕ
Оформить работу в виде отчетной таблицы.
Отчетная таблица
|
Что делали |
Что наблюдали |
Уравнения реакций |
Выводы |
4.05.2010
urok.1sept.ru
Практическая работа по теме Решение экспериментальных задач по неорганической и органической химии
Конспект урока химии в 11 классе
Практическая работа «Решение экспериментальных задач по неорганической и органической химии»
Тип урока: урок обобщающего повторения.
Вид урока: урок — практикум.
Методы обучения: проблемно-поисковый и исследовательский .
Цели урок: Учащиеся должны знать качественные реакции органических соединений; качественные реакции на катионы и анионы неорганических соединений.
Задачи урока:
Обучающая: обобщить знания обучающихся о качественных реакциях на органические и неорганические вещества, через организацию исследовательской деятельности на уроке, выработать умения записывать химические реакции, подтверждающие индивидуальные свойства веществ.
Развивающая: развивать у школьников умение выделять главное, сравнивать, обобщать изученные факты, логически излагать свои мысли при выполнении заданий различного уровня сложности; развивать у школьников самостоятельность, умение преодолевать трудности в учении; развивать положительное отношение к предмету, создавая условия для успешности в обучении.
Воспитывающая: создание педагогических ситуаций успешности для повышения собственной самооценки и статуса учащихся в глазах сверстников, педагогов и родителей; формирование познавательных способностей в соответствии с логикой химической науки.
Формы и приемы работы:
Индивидуальная работа со справочными материалами, выполнение тестовых заданий различного уровня, парная работа исследовательского характера
Оборудование: компьютер, мультимедийный проектор, спиртовка, пробирки, пипетки, спички, химические реактивы: хлорид железа(II), хлорид железа(III), сульфат меди, фосфат калия, нитрат серебра, хлорид алюминия,глицерин, крахмал,этанол, глицин,крахмал,глюкоза, йод,радонид калия, жёлтая кровяная соль, гидроксид натрия, аспирин
Ход урока:
Подводит учащихсяк самостоятельной
формулировке целей урока
Учитель: Было бы замечательно, если бы к концу урока каждому удалось переместить галочку хотя бы на одну клетку влево. Для этого нужно задуматься над вопросом: может ли человека заинтересовать трудный и не очень понятный для него учебный материал? Что для этого нужно сделать?
Самостоятельно формулируют цель урока и определяют оптимальный способ изучения качественных реакций – это практическая работа.
Знать: качественные реакции органических соединений; качественные реакции на катионы и анионы неорганических соединений.
Уметь: распознавать некоторые катионы и анионы; наблюдать свойства неорганических и органических веществ и происходящие с ними явления; формулировать выводы по результатам проведенного эксперимента.
Операционно – исполнительс-кий
Организует работу обучающихся
Учитель: используя , имеющие на столах реактивы и оборудование проведите качественную задачу экспериментально
Парная работа
Обучающиеся выполняют эксперимент и оформляют свои результаты в тетрадь.
Вариант №4 Определите, какие катионы образуют ваданные вам цветные осадки?(за помощью обратитесь к таблице «Качественное определение ионов»)
(ответы обучающихся) На столе: осадок синий , осадок зеленый , осадок белый и реактивы Cu SO4; FeCl2; АlCl3; NaOH
Цель: определить при взаимодействии, каких катионов получаются цветные осадки?
Гипотеза : Мы предполагаем , что голубой осадок от солей меди,зеленый от солей железа (2),бурый от солей железа (3)
Определение:
NaOH
Cu SO4
Cu(OH) 2 ↓ ( голубой осадок)
FeCl2;
Fe (OH)2 ↓ ( светло-зелёный)
АlCl3
Al (OH)3 ↓ (белый)
1)Cu SO4 + 2NaOH = Cu(OH) 2 ↓+ Na2SO4
голубой
2.) FeCl2 + 2NaOH = Fe (OH)2 ↓+2NaCl
Св. зеленый
3.) AlCl3 + 3NaOH = Al (OH)3 ↓+3NaCl
Белый
Вывод: катионы Cu2+ , Fe2+ , Fe3+ образуют при взаимодействии с гидроксид ионом ОН— цветные осадки.
Вариант №5. С помощью одного реактива определите каждое из трёх соединений калия (хлорид,бромид и фосфат ), находящихся в пронумерованных пробирках.
(ответы обучающихся)На столе : KCl , KBr, К3РО4 , AgNO3
Цель : Распознать выданные вещества.
Гипотеза исследования: возможно, их можно распознать одним реактивом
Определение:
AgNO3
KCl
Ag+ + Сl— = AgCl ( белый осадок)
KBr
Ag+ + Br— = AgBr ( светло-желтый)
К3РО4
3Ag+ + РО4 3- = Ag3 РО4 (желтый)
Вывод: Доказали, что нитратом серебра можно доказать хлорид- ион, иодид -ион, фосфат- ион.
Вариант №1.В трёх пронумерованных пробирках находятся растворы белка,глюкозы,глицерина.
Исходя из выданных вам реактивов, составьте план и определите вещества
(за помощью обратитесь к таблице «Качественное определение ионов»)
(ответы обучающихся)
На столе:пронумерованные пробирки с р-рами глюкозы,глицерина,белка, реактивы Cu(OH)2, NaOH
Цель : распознать выданные вещества
Гипотеза исследования: зная строение глюкозы, она имеет альдегидную и карбоксильную группы, можно предположить, что она проявляет свойства, как альдегида так и многоатомного спирта.
Реакция глюкозы с Сu (OH)2 при нагреваниии
Вывод : используя качественные реакции на органические вещества , можно определить под какими номерами в пробирках они находятся .
Вариант №2 В трёх пронумерованных пробирках находятся растворы крахмала, глицина,этанола
Используя выданные вам реактивы,определите в какой пробирке находится глицин(аминоуксусная кислота).
Составьте план определения и возможные уравнения реакций.
(ответы обучающихся)
На столе :в пронумерованных пробирках р-ры сахарозы , глицина, крахмала
Цель : Распознать выданные вещества.
Реакция глицина с CuO
Реакция этанола с подкисленным КMnO4
Вывод: используя качественные реакции на органические вещества , определили под какими номерами находятся неизвестные вещества.
Вариант № .Пользуясь инструкцией, раскрыть «тайны аспирина».
Дать научное объяснение использования аспирина как консервирующей добавки.
(ответы обучающихся)На столе: таблетка асперина, вода, спиртовка, спички,FeCl3
Цель — составить структурную формулу,определить наличие функциональных группы и провести реакции согласно инструкции
Гипотеза исследования:использование аспирина в качестве консервирующей добавки невозможно
Определение :
+ HOH →салициловая кислота+ уксусная кислота
салициловая кислота + FeCl3 → фиолетовое окрашивание
Вывод: Провели качественную реакцию, капнув раствором FeCl3, раствор окрасился в фиолетовый цвет Это говорит о том, что в таблетке присутствуют фенолы.
C6H5OН — органическое соединение, в молекулах которого гидроксильная группа связанна с бензольным ядром. С хлорным железом даёт интенсивное фиолетовое окрашивание. Опасен для здоровья.
Вариант № 6 Проведите реакции взаимодействия хлорида железа (III) с выданными реактивами.Объясните происходящие изменения.
(ответы обучающихся)На столе : жёлтая кровяная соль,KSCN,NaOH,FeCl3,
Цель: провести реакции выданной соли с предложенными реактивами
Гипотеза: соль может вступать в реакцию с выданными реактивами
Определение:
FeCl3 + 3NaOH = Fe (OH)3 ↓+3NaCl(бурый)FeCl3 + 3KSCN = Fe (SCN)3 ↓+3KCl(кроваво — красный )
FeCl3 + K4(Fe(CN)6) = KFe(Fe (CN)6) ↓+3KCl(синий -берлинская лазурь)
Вывод : для распознания хлорида железа (III) можно использовать несколько реактивов , которые дают осадки разного цвета
Рефлексивно-оценочный
Организует работу обучающихся по проверке результатов исследований.
Учитель: Возвращаемся к вопросу
«Может ли человека заинтересовать трудный и не очень понятный для него учебный материал? Что для этого нужно сделать?»
Подведение итога урока, объяснение домашнего задания.
Домашнее задание:
1. Выполнить
Тест по материалам
ЕГЭ -2018г
вопрос 33
1.Проверка выполненных заданий
2.Тест в формате ЕГЭ
1. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
Вещества Реактив
А) К2СО3 и КJ 1) ВаСО3
Б) NaCl и NaNO3 2) ВаСl2
В) К3РО4 и КСl 3) AgNO3
Г) КВr и КNO3 4) Ag2O (NH3 р-р)
5) К
2. Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества
Вещества Реактив
А) метан и этилен 1) ВаСО3
Б) пентин-2 и глицерин 2) НСl
В) гексен-2 и бензол 3) Br2 (водный0
Г) этиловый спирт и фенол 4) Ag2O (NH3 р-р)
5) К
Обучающиеся получают тесты с заданиями.
infourok.ru
Практическая работа по химии «Решение экспериментальных задач на получение и распознавание органических веществ»
Эпиграф урока «Настоящий химик должен быть и теоретиком , и практиком. М.В.Ломоносов »
Практическая работа №2
«Решение экспериментальных задач на получение и распознавание органических веществ».
Цель работы: повторить основные качественные реакции органических веществ, научиться решать экспериментальные задачи на распознавание органических веществ.
Реактивы и оборудование: раствор KMnO4(розовый), Аммиачный раствор оксида серебра – реактив Толленса[Ag(NH3)2]OH (упрощённо +Ag2O NH3 раствор→), раствор FeCl3(светло-жёлтый), свежеосаждённый гидроксид меди (II) в сильнощелочной среде, лакмус, фенолфталеин, насыщенный раствор соли кальция.
Литература: Г.Е.Рудзитис, Ф.Г.Фельдман, химия 10 класс, стр.149
С правилами по технике безопасности ознакомлен:______________________(подпись)
Ход работы:
Оформить работу в виде отчетной таблицы.
Отчетная таблица
Что делали | Что наблюдали | Уравнения реакций | Выводы |
|
|
|
|
|
|
|
1.Распознавание уксусной кислоты (уксусная кислота –одна из самых древних кислот ,которую удалось выделить и использовать человечеству. В организме человека за сутки образуется до 400 грамм этой кислоты)
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
2СН3 – СООН + Сu(ОН)2 → (СН3 – СОО)2Сu + Н2О
Получить свежеосажденный гидроксид меди. Прилить к нему 1 – 2 мл этанола. Голубой осадок растворяется, образуя раствор такого же цвета.
2. Распознавание глюкозы
СuSО4 + 2NаОН → | Сu(ОН)2 ↓ | + Nа2SО4 |
голубой осадок |
СН2ОН – (СНОН)4 – СНО + 2Сu(ОН)2 СН2ОН – (СНОН)4 – СООН + Сu2О↓ +2Н2О
К 1 – 2 мл глюкозы прилить свежеосажденный гидроксид меди. Сначала осадок растворяется, затем при нагревании раствор приобретает окраску от красной до желто – оранжевой. Это свидетельствует о наличии в исследуемой жидкости глюкозы.
3. Распознавание глицерина(глицерин входит в состав мазей, в пищевой промышленности глицерин под кодом Е-422).
2СН2ОН – СНОН – СН2ОН + Сu(ОН)2 → глицерат меди (II) + 2Н2О
К 2 мл глицерина прилить свежеосажденный гидроксид меди. Раствор окрашивается в ярко – синий цвет в результате образования комплексного соединения глицерата меди (II).
4. Распознавание сахарозы. Сахар-сложное орган.в-во, содержащее много С. Чтобы доказать возьмем немного сахара и добавим к нему серную кислоту. Она забирает воду, получается свободный углерод(черное в-во) С12Н22О11——серн.к-та————12С+11Н2О
5.Распознавание крахмала. Капнем р-ром иода на картофель и белый хлеб. Если образуется синее пятно, то они содержат крахмал.
6. Определение кислотности р-ров глицерина и мыла с помощью имеющихся индикаторов.
(лакмус, фенолфталеин,метилоранж). Глицерин имеет слабокислую среду, а мыло-щелочную.
Общий вывод(на основе цели)!
videouroki.net
| Решение задачи: 1. с помощью характерных реакций распознайте, в кассой из пробирок находятся водные растворы: а) этанола; б) уксусной кислоты; в) глюкозы; г) глицерина. |
davay5.com
| страница 1 Практическая работа №8 Решение экспериментальных задач по органической химии Цель работы: совершенствовать умение решать качественные химические задачи, применяя знания органической химии; продолжить отработку навыков проблемно-поисковой деятельности. Оборудование и реактивы: штатив с пробирками, спиртовка, спичка, держатели, аммиачный раствор гидроксида серебра, растворы гидроксида натрия, сульфата меди (II), йода, карбоната натрия, пробирки с растворами глицерина, крахмала, этанола, глюкозы, этиленгликоля, уксусной кислоты. Химическими опытами подтвердите наличие в глюкозе разных функциональных групп.
Экспериментальная задача I. Уровень II Химическими опытами подтвердите наличие в глюкозе разных функциональных групп.
Экспериментальная задача I. Уровень III Химическими опытами подтвердите наличие в глюкозе разных функциональных групп.
Экспериментальная задача I. Уровень IV Химическими опытами подтвердите наличие в глюкозе разных функциональных групп. В трех пронумерованных пробирках находятся растворы органических веществ. Определите каждое вещество с помощью химических реакций: растворы глицерина, крахмала, этанола.
Экспериментальная задача II. Уровень II В трех пронумерованных пробирках находятся растворы органических веществ. Определите каждое вещество с помощью химических реакций: растворы глицерина, крахмала, этанола.
Экспериментальная задача II. Уровень III В трех пронумерованных пробирках находятся растворы органических веществ. Определите каждое вещество с помощью химических реакций: растворы глицерина, крахмала, этанола.
Экспериментальная задача II. Уровень IV В трех пронумерованных пробирках находятся растворы органических веществ. Определите каждое вещество с помощью химических реакций: растворы глицерина, крахмала, этанола. В трех пронумерованных пробирках находятся растворы органических веществ. Определите каждое вещество с помощью химических реакций: растворы глюкозы, уксусной кислоты, этиленгликоля.
Экспериментальная задача III. Уровень II В трех пронумерованных пробирках находятся растворы органических веществ. Определите каждое вещество с помощью химических реакций: растворы глюкозы, уксусной кислоты, этиленгликоля.
Экспериментальная задача III. Уровень III В трех пронумерованных пробирках находятся растворы органических веществ. Определите каждое вещество с помощью химических реакций: растворы глюкозы, уксусной кислоты, этиленгликоля.
Экспериментальная задача III. Уровень IV В трех пронумерованных пробирках находятся растворы органических веществ. Определите каждое вещество с помощью химических реакций: растворы глюкозы, уксусной кислоты, этиленгликоля. По результатам практической работы заполните таблицу:
Вариант 1
Вариант 2
Вариант 3
страница 1
| |||
zaeto.ru