Практическая работа 9 класс Решение экспериментальных задач по теме «Подгруппа кислорода».
Практическая работа
«Экспериментальные задачи по теме «Подгруппа кислорода»»
Цель:
проверить знания учащихся полученные при изучении темы «Подгруппа кислорода» и закрепить их практически с помощью опытов;
продолжить формировать умения и навыки работать с лабораторным оборудованием и реактивами соблюдая технику безопасности
Оборудование: штатив для пробирок, пробирки, набор реактивов: серная кислота, гидроксид калия, хлорид бария, хлорид железа(3),цинк, магний; индикаторы-метилоранжевый, лакмус.
Ход занятия
I. Организационный момент.
На предыдущем уроке разбиралось выполнение задач, которые будут проделываться на практической работе. Это задачи № 1 и 4 учебника О. С. Габриеляна Химия 9 кл. : для общеобразовательных учреждений. Москва, Дрофа, 2013 г. на с.259. Объяснялось выполнение работы.
: для общеобразовательных учреждений. Москва, Дрофа, 2013 г. на с.259. Объяснялось выполнение работы.
Дано задание: подготовиться к практической работе (продумать цель, вещества и их формулы, ход выполнения работы уравнения и выводы).
На уроке в тетради записываем число, практическая работа, название работы, цель, оборудование.
Цель для всей работы определяем вместе с учащимися и учителем. Она такова: практически решить задачи по теме «Подгруппа кислорода», соблюдая технику безопасности и оформить работу.
На столе находится оборудование для практической работы.
Теоретические сведения
Элементы подгруппы кислорода(кислород, сера, селен, теллур, полоний).
Халькогены -рождающие руды., горные породы (в виде- оксидов, сульфидов, сульфатов).
Значение , применение серной кислоты и ее солей.(сообщения учащихся)
II. Выполнение работы.
Задача 1(Опыт№1). Провести реакции, подтверждающие качественный состав серной кислоты.(Определение ионов водорода и сульфат-ионов в растворе серной кислоты.). Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Задача 2.(Опыт№2).Взаимодействие цинка и магния с серной кислотой. В пробирку поместите 1-2 гранулы цинка и прилейте в нее серную кислоту. Что наблюдаете? Напишите уравнение окислительно-восстановительной реакции.
Демонстрационный опыт. Взаимодействие магния с серной кислотой. От чего зависит скорость взаимодействия металлов с кислотой?
Задача 3.(Опыт №3) Даны вещества: FeCl3; KOH; H2SO4 используя их получите в две стадии сульфат железа (III) (Fe2(SO4)3). Запишите уравнения соответствующих реакций в молекулярном и ионном виде.
Рассказывается ход работы и затем учащиеся выполняют ее в парах.
Примеры практико-ориентированных расчетных задач по теме.
1.Для подкормки плодово-ягодных культур используют сульфат цинка, получаемый при взаимодействии цинковой стружки с разбавленной серной кислотой. Какую массу 5%-ного раствора серной кислоты необходимо взять для растворения 1 кг цинка? Какая масса сульфата цинка будет получена при этом?
2. Медный купорос – фунгицид, предназначенный для опрыскивания плодово-ягодных, декоративных деревьев и кустарников от парши и других болезней, а также для дезинфекции ран у плодовых, восполнения дефицита меди в почве, для борьбы с насекомыми — вредителями. К примеру, для некорневой подкормки вегетирующих растений доза составляет 1-2 г медного купороса на 10 л воды.
3. При рентгеноскопии врач получает снимок того или иного органа. Однако, на рентгеновском снимке четко отображаются только достаточно плотные образования (например, кости, суставы), а также органы, содержащие большое количество воздуха (например, легкие). Перечисленные органы обладают так называемой естественной контрастностью. Другие органы, такие как желудок и кишечник, кровеносные сосуды, выводящая система почек, можно увидеть на рентгеновском снимке только после их искусственного контрастирования, т.е. при введении в них специальных контрастных веществ, четко видимых на рентгеновских снимках. К примеру, в качестве контрастного вещества при рентгенологическом исследовании желудка и двенадцатиперстной кишки используют взвесь сульфата бария, которую готовят из расчета 100 г порошка на 80 мл воды.
Перечисленные органы обладают так называемой естественной контрастностью. Другие органы, такие как желудок и кишечник, кровеносные сосуды, выводящая система почек, можно увидеть на рентгеновском снимке только после их искусственного контрастирования, т.е. при введении в них специальных контрастных веществ, четко видимых на рентгеновских снимках. К примеру, в качестве контрастного вещества при рентгенологическом исследовании желудка и двенадцатиперстной кишки используют взвесь сульфата бария, которую готовят из расчета 100 г порошка на 80 мл воды.
В лаборатории имеется 300 г 40%-ной серной кислоты. Как изменится концентрация кислоты при добавлении 100 г воды? В какой последовательности необходимо проводить работу?
III. Закрепление.
По окончании работы учащиеся оформляют отчет о проделанной работе, можно заполнить таблицу.
Цель опыта | Формула и название вещества | Что делали, наблюдали, уравнения реакции | Выводы | |||
1. | H2SO4 – серная кислота, лакмус, BaCl2 – хлорид бария, | Раствор H2SO4, находящийся в пробирке, делим на 2 части, т.е. отливаем в другую пробирку. В одну пробирку добавляем лакмус (или метилоранжевый), раствор стал красным, значит среда кислая. Кислая среда определяется наличием ионов H+. Во вторую пробирку приливаем раствор BaCl2, выпадает белый осадок, значит там присутствуют сульфат-ионы. H2SO4 + BaCl2 → BaSO4↓ + 2HCl белый 2 H+ + SО42- + Ba 2+ + 2Cl— → BaSO4↓ + 2H+ + 2Cl— Ba2+ + SO4 2- → BaSO4↓ | H2SO4 состоит из ионов H+, т. | |||
2. Взаимодействие цинка и магния с серной кислотой | H2SO4 – серная кислота, Zn,Mg | В пробирку поместите 1-2 гранулы цинка и прилили в нее серную кислоту. Наблюдаем выделение газа. Zn + H2SO4= ZnSO4 + H2 Zn-восстановитель H-окислитель В пробирку поместите измельченные гранулы магния и прилили в нее серную кислоту. Наблюдаем бурное выделение газа. | При взаимодействии цинка и магния с серной кислотой выделяется водород. Взаимодействие с магнием протекает более энергично, т.к. магний более активный металл, чем цинк. | |||
3. | FeCl3; KOH; H2SO4 | 1 стадия. Из хлорида железа получаем гидроксид железа. FeCl3 + 3KOH = Fe(OH)3 + 3KCl Fe3+ + 3OH— = Fe(OH)3 осадок бурого цвета 2 стадия. Из гидроксида железа получаем сульфат железа. 2Fe(OH)3 + 3H2SO4 = Fe2(SO4)3 + H2O 2Fe(OH)3 + 6H+ = 2Fe3+ + 6H2O | Сульфат железа получили в две стадии, при взаимодействии хлорида железа (III) с гидроксидом калия, растворение гидроксида железа серной кислотой. | |||
IV. Рефлексия.
Работа может быть оценена с учетом подготовки к практической работе, выполнения опытов и оформления.
Практическая работа 4 по химии 9 класса Решение экспериментальных задач по теме Подгруппа кислорода
Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т.Б. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O. | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т.Б. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O. | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т.Б. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O. |
Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т.Б. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O. | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т.Б. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O. | Практическая работа №4 Решение экспериментальных задач по теме «Подгруппа кислорода» Инструктаж по Т.Б. Цель работы: Закрепить теоретические знания качественных реакций на практике. Оборудование: Штатив с пробирками, чашка для выпаривания, спиртовка. Реактивы: Индикатор фенолфталеин, AgNO3,BaCl2, NaOH,H2SO4,HCl, NaCl, KI,ZnSO4. Ход работы: Задание 1. Определить в какой пробирке находится какое из веществ NaOH, H2SO4,HCl.(стр.147№4) Задание2. Привести качественные реакции для веществ NaCl, KI,ZnSO4.(стр.147 №6) Задание 3. Получить из CuO,CuSO4, и CuSO4∙5H2O. |
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/314942-prakticheskaja-rabota-4-po-himii-9-klassa-res
Практическая работа по химии в 9 классе «Решение экспериментальных задач по теме подгруппа кислорода»
Муниципальное казенное общеобразовательное учреждение
«Средняя общеобразовательная школа д.Бурмистрово им.В.С. Чумака»
Искитимского района Новосибирской области
Практическая работа в 9 классе.
Тема: Решение экспериментальных задач по теме «Подгруппа кислорода»
Автор:
учитель химии
Щурина Елена Юрьевна
д.Бурмистрово 2016г
Тип урока: урок — практика с использованием информационно-коммуникационных технологий.
Цель: применяя полученные на уроках знания осуществлять практическое решение задач не только в реальном эксперименте, но и в виртуальной лаборатории.
Задачи урока:
I. формирование УУД
1.Личностные УУД – возможность самоопредения на практической работе по интеллектуальным возможностям (организатор берёт лист, оценивая свои способности и возможности).
2.Регулятивные УУД – формирование цели, планирование и организация деятельности, прогнозирование, контроль, коррекция, оценка.
3.Познавательные УУД – исследовательские действия (применение знаний в конкретной ситуации, решение экспериментальных задач, как компонент воспитания логического мышления)
4 Коммуникативные УУД – организация и планирование работы в группе, умение договориться и находить общее решение, построение межличностных отношений.
II. Используя знания о качественных реакциях на ионы, опытным путём научиться распознавать химические вещества;
III. Развивать познавательную деятельность учащихся в процессе выполнения эксперимента;
IV. Воспитывать аккуратность, бережное отношение при расходовании химических реактивов;
V.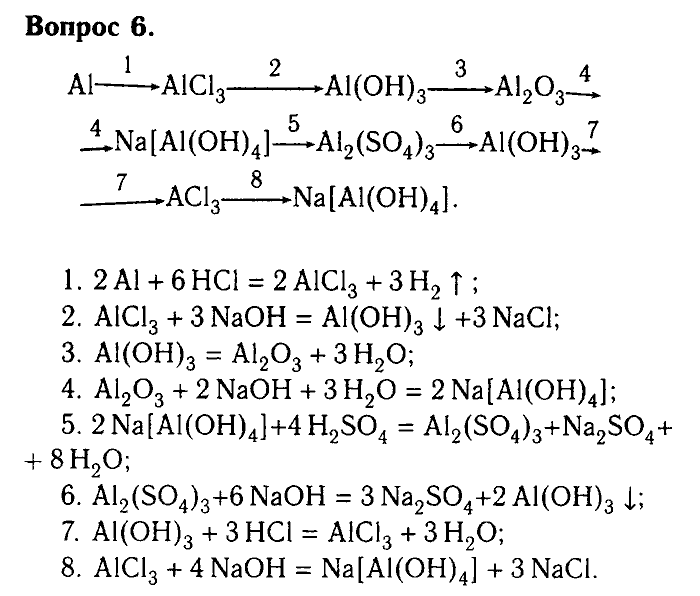 Закрепить навыки работы с виртуальной лабораторией.
Закрепить навыки работы с виртуальной лабораторией.
Для решения поставленных целей и задач работать будем в группах по три человека. В течение работы, учащиеся распределяют роли и по мере решения задач меняются ими.
Организатор (работает с инструкционной карточкой, выясняя, что делать, даёт указания исполнителю)
Исполнитель — практик (проводит реакции )
Контролёр — аналитик (анализирует наблюдения и корректирует работу организатора)
Целесообразно предложить каждой группе для решения по три задачи.
Ход урока
Оргмомент.
Мотивация: добавьте слово в словосочетание
ХИМИЧЕСКИЕ
Обратите внимание на доску. Я написала лишь одно слово «ХИМИЧЧЕСКИЕ», добавьте слова, чтобы получились словосочетания (ЭКСПЕРИМЕНТЫ, РЕАКЦИИ, ЯВЛЕНИЯ,ПРОЦЕССЫ и т.д.)
Скажите, а есть ли что ни будь, что может объединить все эти словосочетания? (ПРАКТИЧЕСКАЯ работа).
Верно. И сегодня на уроке мы будем с вами выполнять практическую работу. Работаем, как обычно, по группам. Откройте тетради, запишите число и тему работы «Решение экспериментальных задач по теме «Подгруппа кислорода».
Работаем, как обычно, по группам. Откройте тетради, запишите число и тему работы «Решение экспериментальных задач по теме «Подгруппа кислорода».
Дома, готовясь к сегодняшнему уроку, вы посмотрели задачи на странице 146-147 ваших учебников (Учебник О.С. Габриелян, 9 класс) и подумали над целью. Как по-вашему она должна звучать?
применить знания, полученные при изучении темы «Подгруппа кислорода», в экспериментальном решении задач;
закрепить навыки проведения химического эксперимента.
Хорошо, давайте запишем цель работы в тетради.
Чтобы работа прошла успешно и без последствий для здоровья надо?
Соблюдать правила по ТБ и правила работы в группах.
Повторяем правила Т.Б. (повторяем по таблице, где оставлены только картинки)
На слайде появляется изображение
Вспомните правила работы в группах (озвучивают без подсказок)
— соблюдение всех правил ТБ
— соблюдайте тишину, не мешайте другим, они тоже работают
— проговаривайте свои мысли, не критикуйте других
— умейте договариваться, находить общее решение.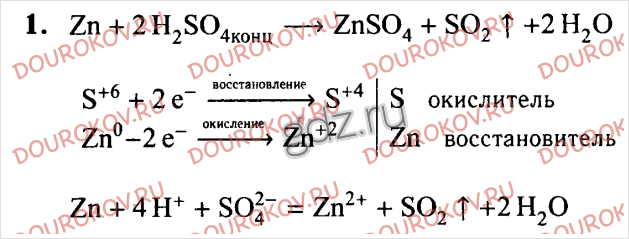
На столах папка с инструкциями к выполнению работы.
-распределяем роли. Напоминаю, что
а) организатор (работает с инструкционной карточкой, выясняя, что делать, даёт указания исполнителю)
б) исполнитель — практик ( проводит реакции )
Первую задачу (задача №4 на странице 147) мы решим с вами при помощи виртуальной лаборатории.
Ребята, распределите роли. Определились?
Предлагаю открыть сайт виртуальной лаборатории http://www.virtulab.net (скриншот №1)
затем следовать маршрутом : главная —>закладка химия стр2 левый столбик ,первая практическая работа «Решение экспериментальных задач». http://www.virtulab.net/index.php?option=com_content&view=article&id=265:2009-11-14-22-37-18&catid=57:2009-11-14-21-25-00&Itemid=108
Откроем задачу №2 (скриншот №2 ) http://www.virtulab.net/index.php?option=com_content&view=article&id=265:2009-11-14-22-37-18&catid=57:2009-11-14-21-25-00&Itemid=108
Выполняйте задачу
Проверим результаты.
Напоминаю о составлении отчётной таблицы.
Продолжаем выполнять работу и переходим к реальным экспериментам. Не забывайте о смене ролей в группах.
Учащиеся работают со своими инструкционными картами (приложение)
Подведение итога: какой вывод вы сделали по итогам работы? (Корректируем его.)
Ребята, подходит к концу наш урок. Что вы можете сказать о сегодняшней работе?
Памятка на слайде:
— Мне больше всего удалось……
— Я могу похвалить себя за то, что……
— Я могу похвалить одноклассников…..
— Меня удивило……
— На мой взгляд не удалось….., потому, что…….
— На будущее я учту……….
Хорошо, а сейчас наводим порядок на рабочих местах, сдаём тетради на проверку
Заключительная часть.
Спасибо всем за работу, результаты вы узнаете на следующем уроке. Дома повторите состав воздуха и подумайте над следующим заданием.
ДОМАШНИЙ ОПЫТ
Из предложенных материалов: 50мл.
Приложение (Группа 1).
Задача №1
Условие задачи на стр 147 учебника, задача №4. Распределите роли и действуйте по инструктивной карте.
Открыть сайт виртуальной лаборатории http://www.virtulab.net (скриншот №1)
затем следовать маршрутом : главная —>закладка химиястр2левый столбик ,первая практическая работа «Решение экспериментальных задач». http://www.virtulab.net/index.php?option=com_content&view=article&id=265:2009-11-14-22-37-18&catid=57:2009-11-14-21-25-00&Itemid=108
Открыть задачу №2 (скриншот №2 ) http://www.virtulab.net/index.php?option=com_content&view=article&id=265:2009-11-14-22-37-18&catid=57:2009-11-14-21-25-00&Itemid=108
Выполняйте задачу
Проверим результаты
Заполняем отчетную таблицу
Задача №2
ОРГАНИЗАТОР На «3»
Вам даны три пробирки с бесцветными растворами. Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Прежде всего напоминаю о соблюдении правил техники безопасности, в данном случае при работе с компьютером. Даны три вещества и три реактива (лакмус, хлорид бария и гидроксид калия). Гидроксид калия – явно в данном случае лишний, так как при взаимодействии со всеми предложенными веществами видимых изменений происходить не будет (хлорид калия и сульфат калия растворимы).
Для определения гидроксида натрия NaOH, используем лакмус. В щелочной среде он посинеет. Приливаем в пробирки поочереди лакмус.
В двух пробирках лакмус покраснел. Отливаем из склянок 2и3 вещества в чистые пробирки. Для определения серной кислоты используем раствор хлорида бария. (Это качественная реакция на сульфат ион). Там где выпал белый осадок находится серная кислота.
Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Определить в какой из пробирок находится соляная кислота, серная кислота и гидроксид натрия. | В пробирки прилили лакмус | 1 — цвет ______ . 2 – цвет – 3 — цвет | В первой – щёлочь Во второй – В третьей — |
В пробирки с кислотами прилили BaCl2. | Образование белого ____ в пробирке №__________ | это качественная реакция на ионы SO-24 h3SO4 + BaCl2 → BaSo4↓ + ______ |
ОРГАНИЗАТОР На «4»
Даны три пробирки с бесцветными растворами. Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Прежде всего напоминаю о соблюдении правил техники безопасности, в данном случае при работе с компьютером. Даны три вещества и три реактива (лакмус, хлорид бария и гидроксид калия).
Для определения гидроксида натрия NaOH, используем_____________. В щелочной среде он __________.
В щелочной среде он __________.
Отливаем из склянок 2и3 вещества в чистые пробирки. Для определения серной кислоты используем раствор _________ (Это качественная реакция на сульфат ион). Там где выпал________находится серная кислота.
Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Определить в какой из пробирок находится соляная кислота, серная кислота и гидроксид натрия. | В пробирки прилили лакмус | 1 — цвет ______ . 2 – цвет – 3 — цвет | В первой – Во второй – В третьей — |
В пробирки с кислотами прилили | Образование белого ____ в пробирке №__________ | это качественная реакция на ионы SO-24 |
ОРГАНИЗАТОР На «5»
Даны три пробирки с бесцветными растворами. Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Определить в какой из них находится соляная кислота, серная кислота и гидроксид натрия. Написать уравнения соответствующих реакций в молекулярном и ионном виде.
Прежде всего напоминаю
Для определения гидроксида натрия NaOH,
Отливаем из склянок ____________вещества в чистые пробирки. Для определения серной ______
Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Определить в какой из пробирок находится соляная кислота, серная кислота и гидроксид натрия. | В пробирки прилили | 1 — цвет ______ . 2 – цвет – 3 — цвет | В первой – Во второй – В третьей — |
В пробирки с кислотами прилили |
|
Контролёр эксперимента ____________________________________
Задача №2
Организатор | Контроль | Исполнитель |
Ф. | ||
Взята карта организатора на | ||
Прочёл задание | ||
Правила ТБ. Работаем с небольшим количеством вещества. С кислотой обращаемся осторожно. Приливая растворы из склянок держим их этикетками вверх | ||
Берем пробы из 3х пронумерованных пробирок, т.е. отливаем небольшое количество реактива в чистые пробирки. В эти пробы добавляем лакмус. В 2х пробирках раствор красный, в третьей – синий, значит там, где синий раствор – это щелочь, т.е. NaOH. | ||
Оставляем ее, т.е. мы ее определили. От оставшихся 2х пробирок вновь берем пробы и в эти пробы добавляем BaCl2 . | ||
Сделан вывод. | ||
Заполнена отчётная таблица |
Задача 3.
Организатор эксперимента На «3»
Проведите реакции, подтверждающие качественный состав серной кислоты. Напишите уравнения реакций.
Прежде всего, напоминаю, что работая с кислотой нужно соблюдать осторожность. Склянки с растворами веществ держим этикетками вверх. Работаем с использованием чистых, сухих и целых пробирок. Формула серной кислоты_____________. Докажем наличие водорода при помощи универсальной индикаторной бумаги. Для этого намочим кусочек бумажки в исследуемом растворе. Бумажка изменила цвет. Сравниваем с эталоном. Среда КИСЛАЯ.
Проведём качественную реакцию на сульфат ион.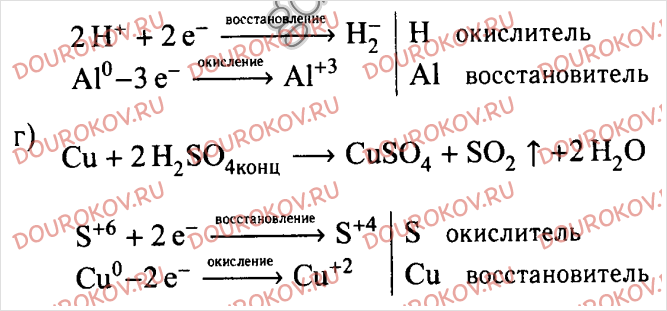 Для этого в сухую, чистую, целую пробирку приливаем 1 мл серной кислоты. Добавляем несколько (6-7) капель хлорида бария________________. Выпадает белый осадок сульфата бария. Оформляем работу в тетради.
Для этого в сухую, чистую, целую пробирку приливаем 1 мл серной кислоты. Добавляем несколько (6-7) капель хлорида бария________________. Выпадает белый осадок сульфата бария. Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Доказать качественный состав серной кислоты | В пробирку поместили полоску универсальной индикаторной бумаги | полоска ______ цвета. рН ____________, среда кислая. | Ионы водорода меняют цвет индикатора |
В пробирку с кислотой прилили BaCl2. | Образование белого ____ | это качественная реакция на ионы SO-24 |
Организатор эксперимента. На «4»
На «4»
Проведите реакции, подтверждающие качественный состав серной кислоты. Напишите уравнения реакций.
Прежде всего, напоминаю, что работая с кислотой ____________________. Склянки с растворами веществ держим этикетками ____________. Работаем с использованием ____________________. Формула серной кислоты_____________. Для доказательства наличия водорода проведём реакцию серной кислоты с _______________________________________________________________________________________________________
Проведём качественную реакцию на сульфат ион. Для этого в сухую, чистую, целую пробирку приливаем 1 мл серной кислоты. Добавляем несколько (6-7) капель ________________. Выпадает ________________________.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Доказать качественный состав серной кислоты | В пробирку | полоска ______ цвета. рН ____________, среда кислая. | |
В пробирку с кислотой прилили | Образование белого ____ | это качественная реакция на ионы SO-24 |
Организатор эксперимента. На «5»
Проведите реакции, подтверждающие качественный состав серной кислоты. Напишите уравнения реакций.
1.______________________________
2.______________________________
3.______________________________
Задача | Что делал | Что наблюдал | Выводы, реакции |
Доказать качественный состав серной кислоты |
| ||
|
Контролёр эксперимента ____________________________________
Задача №3
Организатор | Контроль | Исполнитель |
Ф. | ||
Взята карта организатора на | ||
Прочёл задание | ||
Правила ТБ. Работаем с небольшим количеством вещества. С кислотой обращаемся осторожно. Приливая растворы из склянок держим их этикетками вверх | ||
Катион водорода проверяем универсальным индикатором. Цвет сравниваем с эталоном. Делаем вывод. Можно доказать наличие водорода в кислоте при помощи металла, например Zn. В пробирку помещаем кусочек цинка и приливаем 1 мл серной кислоты. Наблюдаем выделение газа (водорода) | ||
На сульфат анион проводим качественную реакцию с растворимой солью бария (хлоридом бария). В пробирку приливаем 1 мл серной кислоты и 6-7 капель хлорида бария. Наблюдаем выпадение белого осадка. | ||
Сделан вывод. | ||
Заполнена отчётная таблица |
Группа 2.
Организатор эксперимента
Задача 2 На «3»
С помощью характерных реакций установите, является выданная вам соль сульфатом, иодидом или хлоридом. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Прежде всего, напоминаю, что работая с химическими реактивами нужно соблюдать осторожность. Склянки с растворами веществ держим этикетками вверх. Работаем с использованием чистых, сухих и целых пробирок. Работаем с небольшим количеством вещества. Если предложенная соль сульфат, то проведём качественную реакцию на сульфат ион. Для этого в сухую, чистую, целую пробирку приливаем 1 мл исследуемого раствора. Добавляем несколько (9-10) капель хлорида бария________________. Если выпадает белый осадок, то данная соль является сульфатом, так как с хлоридом и иодидом такая реакция не идёт. Если осадок не выпал. Приливаем в чистую пробирку 1 мл исследуемого раствора соли и добавляем 9-10 капель нитрата серебра. Если это хлорид выпадет белый осадок, если иодид – жёлтый. Оформляем работу в тетради.
Для этого в сухую, чистую, целую пробирку приливаем 1 мл исследуемого раствора. Добавляем несколько (9-10) капель хлорида бария________________. Если выпадает белый осадок, то данная соль является сульфатом, так как с хлоридом и иодидом такая реакция не идёт. Если осадок не выпал. Приливаем в чистую пробирку 1 мл исследуемого раствора соли и добавляем 9-10 капель нитрата серебра. Если это хлорид выпадет белый осадок, если иодид – жёлтый. Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
установить, выданная соль является сульфатом, иодидом или хлоридом. | В пробирку прилили 1мл раствора соли и прилили BaCl2. | Образование белого ____ | это качественная реакция на ионы SO-24 |
В пробирку прилили 1мл раствора соли и прилили AgNO3. |
|
Организатор эксперимента. Задача 2 На «4»
С помощью характерных реакций установите, является выданная вам соль сульфатом, иодидом или хлоридом. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
Прежде всего, напоминаю, что работая с химическими реактивами нужно____________________________________ Если предложенная соль сульфат, то проведём качественную реакцию на сульфат ион. Для этого в сухую, чистую, целую пробирку приливаем 1 мл исследуемого раствора. Добавляем несколько (9-10) капель ________________.
Если выпадает _______ осадок, то данная соль является сульфатом, так как с хлоридом и иодидом такая реакция не идёт. Если осадок не выпал. Приливаем в чистую пробирку __________________________ и добавляем 9-10 капель нитрата серебра. Если это хлорид выпадет белый осадок, если иодид – жёлтый. Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
установить, выданная соль является сульфатом, иодидом или хлоридом. | В пробирку прилили 1мл раствора соли и прилили BaCl2. | Образование белого ____ | это качественная реакция на |
В пробирку прилили 1мл раствора соли и прилили ________ | _______________________ | _________________________________ |
Организатор эксперимента. Задача 2 На «5»
С помощью характерных реакций установите, является выданная вам соль сульфатом, иодидом или хлоридом. Напишите уравнения соответствующих реакций в молекулярном и ионном видах.
1.______________________________
2.______________________________
3.______________________________
Задача | Что делал | Что наблюдал | Выводы, реакции |
установить, выданная соль является сульфатом, иодидом или хлоридом. |
| ||
|
Контролёр эксперимента ____________________________________
Задача №2
Организатор | Контроль | Исполнитель |
Ф.И. | ||
Взята карта организатора на | ||
Прочёл задание | ||
Правила ТБ. Работаем с небольшим количеством вещества. Приливая растворы из склянок, держим их этикетками вверх. Используем чистую, сухую посуду | ||
На сульфат анион проводим качественную реакцию с растворимой солью бария (хлоридом бария). В пробирку приливаем 1 мл раствора соли и 9-10 капель хлорида бария. Наблюдаем выпадение белого осадка. Если осадок не выпал, значит это раствор не сульфата. | ||
Приливаем в пробирку 1 мл исследуемой соли и добавляем несколько капель нитрата серебра. Если нам дан хлорид – выпадет белый осадок Если иодид – осадок жёлтого цвета | ||
Сделан вывод | ||
Заполнена отчётная таблица |
Задача №3 На «3»
Осуществите на опытах следующие превращения
Прежде всего, напоминаю, что работая со щелочами нужно соблюдать осторожность. Склянки с растворами веществ держим этикетками вверх. Работаем с использованием чистых, сухих и целых пробирок. Формула сульфата меди (II) _____________. Чтобы получить гидроксид меди (II) нужно к сульфату меди(II) прилить гидроксид натрия. Берём сухую, чистую пробирку и приливаем 1 мл сульфата меди (II). Добавляем несколько капель гидроксида натрия. Выпадает голубой желеобразный осадок________________________.
Работаем с использованием чистых, сухих и целых пробирок. Формула сульфата меди (II) _____________. Чтобы получить гидроксид меди (II) нужно к сульфату меди(II) прилить гидроксид натрия. Берём сухую, чистую пробирку и приливаем 1 мл сульфата меди (II). Добавляем несколько капель гидроксида натрия. Выпадает голубой желеобразный осадок________________________.
Нерастворимые в воде оснавания при нагревании разлагаются. Зажигаем спиртовку. Закрепляем пробирку в верхней третьей части, чтобы она могла проворачиваться. Осторожно прогреваем. Продолжаем нагревать. Видим образование_____________________________ Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Осуществите на опытах следующие превращения | В пробирку приливаем 1 мл сульфата меди (II). |
| |
Зажигаем спиртовку. Закрепляем пробирку в верхней третьей части, чтобы она могла проворачиваться. Осторожно прогреваем | Образование ____ |
Задача №3 На «4»
Осуществите на опытах следующие превращения
Прежде всего, напоминаю, что работая со щелочами ____________________________________ Формула сульфата меди (II) _____________. Чтобы получить гидроксид меди (II) нужно к сульфату меди(II) _________________. Берём сухую, чистую пробирку ____________________. Добавляем несколько капель______________. Выпадает голубой желеобразный ________________________.
Нерастворимые в воде оснавания при нагревании ________________. Зажигаем спиртовку. Закрепляем пробирку в ____________________. Осторожно ____________________________ . Видим образование _____________________ . Оформляем работу в тетради.
Оформляем работу в тетради.
Задача | Что делал | Что наблюдал | Выводы, реакции |
Осуществите на опытах следующие превращения | В пробирку _________ |
| |
Зажигаем спиртовку. _______________ | Образование ____ |
Задача №3 На «5»
Осуществите на опытах следующие превращения
ТБ.
Чтобы получить гидроксид меди (II) нужно ______________
Нерастворимые в воде ______________
________________________________
Задача | Что делал | Что наблюдал | Выводы, реакции |
Осуществите на опытах следующие превращения |
| ||
|
|
Контролёр эксперимента ____________________________________
Задача №3
Организатор | Контроль | Исполнитель |
Ф. | ||
Взята карта организатора на | ||
Прочёл задание | ||
Правила ТБ. Работаем с небольшим количеством вещества. С веществами обращаемся осторожно. Приливая растворы из склянок держим их этикетками вверх. Тушить спиртовку можно только колпачком. При нагревании веществ в пробирках, сначала прогреть всю пробирку | ||
Приливаем 1 мл сульфата меди в пробирку и добавляем к нему несколько капель гидроксида натрия. Выпал синий осадок. Cu(OH)2 нерастворимое основание, при нагревании разлагается на оксид меди и воду. | ||
Зажигаем спиртовку и аккуратно нагреваем пробирку с полученным осадком. | ||
Сделан вывод. | ||
Заполнена отчётная таблица |
Опубликовано в группе «УРОК.РФ: группа для участников конкурсов»
4: Свойства газообразного кислорода (эксперимент)
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 95809
- Колледж Санта-Моники
- Колледж Санта-Моники
Цели
- Для получения (и сбора) газообразного кислорода путем разложения перекиси водорода.

- Для изучения свойств кислорода, в частности, как агента горения.
Кислород — один из самых распространенных элементов на этой планете. Наша атмосфера на 21% состоит из свободного элементарного кислорода. Кислород также широко связан в соединениях земной коры, таких как вода (89 %), и в минеральных оксидах. Даже человеческое тело на 65% состоит из кислорода по массе.
Свободный элементарный кислород встречается в природе в виде газа в виде двухатомных молекул \(\ce{O2}\) ( г ). Кислород обладает многими уникальными физическими и химическими свойствами. Например, кислород — бесцветный газ без запаха, с плотностью большей, чем у воздуха, и очень низкой растворимостью в воде. На самом деле последние два свойства значительно облегчают сбор кислорода в этой лаборатории. Среди уникальных химических свойств кислорода — его способность поддерживать дыхание растений и животных, а также его способность поддерживать горение.
В этой лаборатории кислород будет образовываться в результате разложения перекиси водорода. Катализатор используется для ускорения скорости реакции разложения, которая в противном случае была бы слишком медленной для использования в качестве источника кислорода. Катализатор не расходуется в ходе реакции и может быть собран для повторного использования после завершения реакции. Конкретным катализатором, используемым в этой лаборатории, является оксид марганца (IV).
Катализатор используется для ускорения скорости реакции разложения, которая в противном случае была бы слишком медленной для использования в качестве источника кислорода. Катализатор не расходуется в ходе реакции и может быть собран для повторного использования после завершения реакции. Конкретным катализатором, используемым в этой лаборатории, является оксид марганца (IV).
Производство газообразного кислорода:
\[\ce{2 h3O2 (водн.) -> [катализатор] 2 h3O (ж) + O2 (г)}\]
\[\text{перекись водорода} \ce{->} \text{вода} + \text{кислород}\]
Произведенный газообразный кислород будет собираться в бутылки методом, известным как вытеснение воды вниз (см. рис. 1). После сбора будет проведено несколько тестов, чтобы исследовать роль кислорода в нескольких реакциях горения.
Реакцию горения обычно называют «горением». Во время реакции горения кислород вступает в химическую реакцию с горящим веществом. Обратите внимание, что поскольку наша атмосфера примерно на 21% состоит из кислорода, многие вещества легко сгорают на воздухе.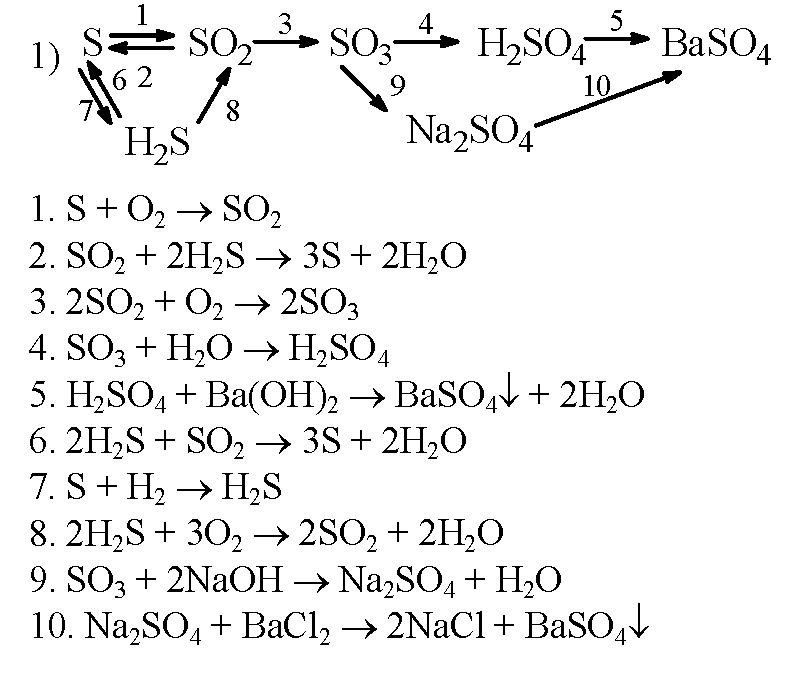 В ходе реакции горения расходуются как кислород, так и сжигаемое вещество (реагенты), а образуются новые вещества (продукты) и тепловая энергия. Поскольку выделяется тепло, это экзотермическая реакция.
В ходе реакции горения расходуются как кислород, так и сжигаемое вещество (реагенты), а образуются новые вещества (продукты) и тепловая энергия. Поскольку выделяется тепло, это экзотермическая реакция.
Реакции горения:
\[\text{Сжигаемое вещество} + \text{Кислород} \ce{->} \text{Продукты} + \text{Тепло}\]
Фактические продукты реакции горения зависят от того, какое вещество сжигается и сколько кислорода присутствует. В общем, однако, когда чистый элемент сгорает в кислороде, продукт называется оксидом. Оксид представляет собой соединение, содержащее как элемент, так и кислород, химически объединенные вместе.
Некоторые примеры горения элементов показаны ниже. Несколько таких реакций будут проведены с использованием газообразного кислорода, собранного в этой лаборатории.
Горение элемента:
\[\text{Элемент} + \text{Кислород} \ce{->} \text{Окись элемента} + \text{Тепло}\]
\[\ce{C(s) + O2(g) -> CO2(g) + Heat}\]
\[\text{углерод} + \text{кислород} \ce{->} \text{двуокись углерода} + \text{тепло}\]
\[\ce{2Hg(l) + O2(g) -> 2HgO(s) + Heat}\]
\[\text{ртуть} + \text{кислород} \ce{->} \text{оксид ртути(II)} + \text{тепло}\]
Процедура
Материалы и оборудование
Материалы: 9% раствор перекиси водорода, оксид марганца(IV), деревянные щепки, свеча, сера, стальная вата, магниевая лента, металлический цинк и 6М соляная кислота пять широкогорлых бутылей, четыре стеклянных «крышки», пневматический желоб, аппарат «пробка + чертополох + трубка»*, универсальный зажим, подставка, ложка для дефлаграции, щипцы для тигля, малый и средний стаканы и большая пробирка.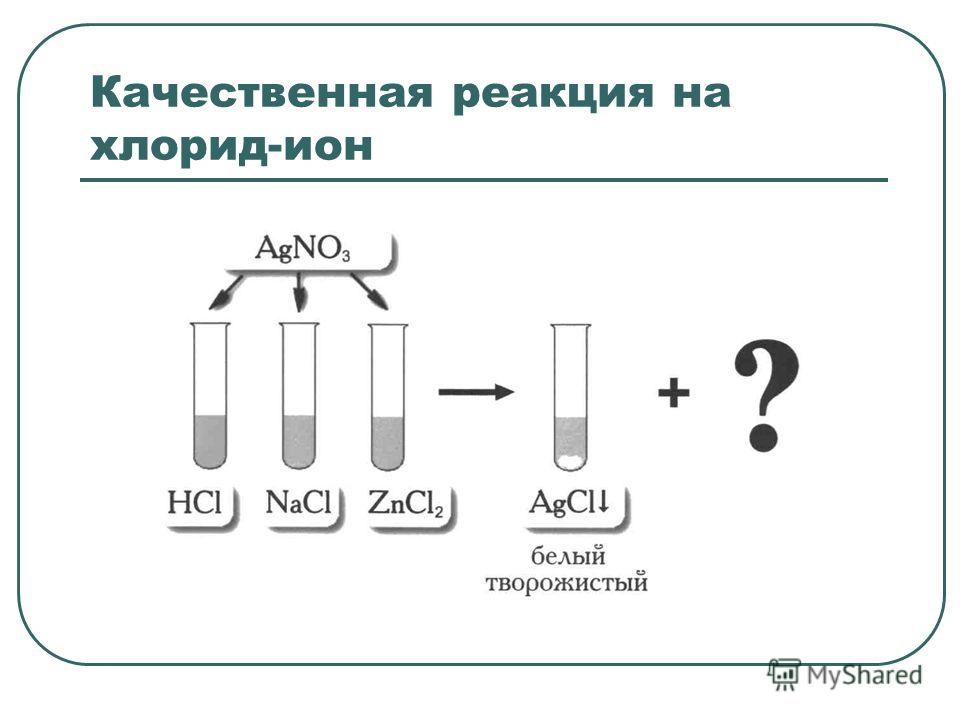
Безопасность
Во-первых, будьте осторожны при использовании перекиси водорода (\(\ce{h3O2}\)) и соляной кислоты (\(\ce{HCl}\)), так как они могут вызвать химические ожоги и раздражение кожи. . Если какое-либо из этих химических веществ попало на кожу, немедленно промойте кожу водой в течение как минимум пятнадцати минут и сообщите об этом своему инструктору. Во-вторых, не смотрите прямо на горящий магний. Помимо того, что он очень яркий, он излучает вредное УФ-излучение, которое может повредить сетчатку ваших глаз.
Часть A: Производство и сбор газообразного кислорода
- Получите следующее оборудование:
- Колба Эрленмейера 250 мл (шкафчик)
- Аппарат «пробка с двумя отверстиями + трубка чертополоха + трубка стеклянная + трубка резиновая» (склад)
- Пять широкогорлых газосборных баллонов (под раковиной)
- Четыре стеклянных накладки (стойка регистрации)
- Пневматический желоб (под мойку), наполненный водой на 1/2 дюйма выше металлической полки
- Наполните четыре из пяти широкогорлых бутылок до краев водой (пятая будет использована позже).
 Затем осторожно наденьте стеклянную пластину на горлышко каждой бутылки. Убедитесь, что в верхней части стеклянной пластины нет пузырьков воздуха.
Затем осторожно наденьте стеклянную пластину на горлышко каждой бутылки. Убедитесь, что в верхней части стеклянной пластины нет пузырьков воздуха. - Удерживая указательным и средним пальцами стеклянную пластину, аккуратно переверните бутылку и опустите ее в воду в пневматическом желобе. Снимите стеклянную пластину, когда горлышко бутылки окажется ниже уровня воды в пневматическом желобе. Повторите это для всех четырех бутылок. Отложите стеклянные тарелки в сторону на бумажное полотенце, так как они будут использоваться позже.
- Поместите один газосборный баллон на металлическую полку. Следите за тем, чтобы горлышко бутылки не высовывалось из воды.
- Теперь сосредоточьтесь на своем реакционном сосуде, колбе Эрленмейера. Добавьте в колбу количество размером с горошину оксида марганца (IV) (катализатор), а затем около 50 мл водопроводной воды.
- Наконец, соберите все свое оборудование вместе, как показано инструктором или как показано на рисунке ниже.
 Убедитесь, что
Убедитесь, что
- конец трубки чертополоха полностью покрыт водой на дне колбы,
- конец стеклянной трубки, идущей от колбы Эрленмейера, вставлен под отверстие в колбе .
- дно металлической полки в газосборный баллон (заполненный водой),
- Колба Эрленмейера стабилизируется с помощью универсального зажима.
- Наберите около 30 мл 9% водного раствора перекиси водорода (\(\ce{h3O2}\)) в самый маленький химический стакан. Затем осторожно добавьте около 10 мл этого \(\ce{h3O2}\) через пробирку с чертополохом. Генерация газообразного кислорода должна начаться немедленно. Если в какой-то момент времени скорость реакции в колбе Эрлемейера замедлится, добавьте еще 10 мл \(\ce{h3O2}\).
- Произведенный кислород заполнит перевернутую бутылку, вытеснив в ней воду. Это связано с тем, что кислород не растворяется в воде из-за его низкой растворимости. Когда первый баллон будет полностью заполнен газом, поместите второй баллон на металлическую подставку на его место и дайте ему наполниться таким же образом.
 Повторите это для третьей и четвертой бутылок.
Повторите это для третьей и четвертой бутылок. - Как только каждая бутылка будет полностью заполнена, извлеките ее, поместив стеклянную пластину под горлышко бутылки, пока она находится под водой, а затем поднимите бутылку и пластину из пневматического желоба. Поместите бутылку на лабораторный стол рот вверх и не снимайте стеклянную пластину . Так как кислород плотнее воздуха, он опускается на дно колбы и не может легко вытечь через верх.
- Используя клейкую ленту, пометьте каждую бутылку с газом в порядке их сбора: бутылка № 1, бутылка № 2, бутылка № 3 и бутылка № 4. Пометьте пятую неиспользованную пустую бутылку «Бутылка для воздуха».
- После того, как все четыре баллона заполнены кислородом, больше не добавляйте \(\ce{h3O2}\) в колбу Эрленмейера. Отложите его в сторону и дайте реакции завершиться. По окончании лабораторной работы химические вещества, оставшиеся в реакционной колбе, и все неиспользованные \(\ce{h3O2}\) должны быть утилизированы в маркированном контейнере для отходов в вытяжном шкафу.
 А пока переходите к Части B.
А пока переходите к Части B.
Часть B: Свойства газообразного кислорода
Утилизируйте все химические вещества, использованные в этих тестах, как указано вашим инструктором
Тест 1: Горение дерева
Подожгите деревянную щель, а затем задуйте ее. Пока шина еще светится красным, быстро вставьте шину в бутылку № 1 (наполненную кислородом). Сколько раз вы можете повторить это? Запишите свои наблюдения. Теперь снова зажгите ту же деревянную щель и снова задуйте ее. Поместите его в пустую бутылку (наполненную воздухом), пока она еще светится. Запишите свои наблюдения.
Тест 2: Горение свечного воска
Поместите маленькую свечу на стеклянную пластину и зажгите ее. Затем откройте и осторожно опустите Бутылку № 2 (наполненную кислородом) над свечой. Измерьте и запишите количество секунд, в течение которых свеча продолжает гореть. Затем снова зажгите свечу, опустите на нее пустую бутылку (наполненную воздухом).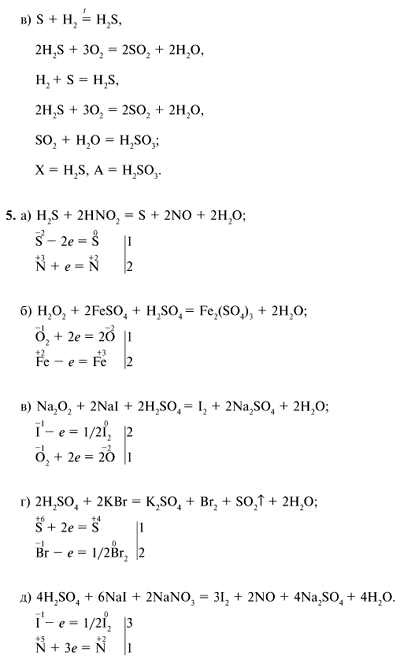 Снова измерьте и запишите количество секунд, в течение которых свеча продолжает гореть. Также не забудьте записать любые другие соответствующие наблюдения.
Снова измерьте и запишите количество секунд, в течение которых свеча продолжает гореть. Также не забудьте записать любые другие соответствующие наблюдения.
Испытание 3: сжигание серы
Этот тест должен проводиться в капюшоне под наблюдением инструктора. Отнесите бутылку №3 (наполненную кислородом) и пустую бутылку (наполненную воздухом) к вытяжке, к которой вас направит инструктор. Поместите небольшой комок серы в ложку для дефлаграции (находится в колпаке). Зажгите горелку Бунзена в колпаке и нагрейте серу в ложке. Сера сначала расплавится, а затем сгорит почти невидимым голубым пламенем. Вставьте ложку с горящей серой в бутыль №3 и запишите свои наблюдения. Затем вставьте его в пустую бутылку и снова запишите свои наблюдения. Когда закончите, погасите горящую серу в стакане с водой, который находится в капюшоне.
Тест 4: Горение железа
Налейте около 20 мл водопроводной воды в бутыль № 4 (наполненную кислородом) и быстро замените стеклянную пластину. Возьмите свободный, изношенный 2-3-сантиметровый кусок стальной ваты и подержите его в пламени горелки Бунзена в течение очень короткого времени с помощью щипцов для тигля (он будет светиться красным). Затем немедленно опустите стальную вату в бутылку № 4. Запишите свои наблюдения. Повторите с пустой бутылкой (наполненной воздухом) и запишите свои наблюдения.
Возьмите свободный, изношенный 2-3-сантиметровый кусок стальной ваты и подержите его в пламени горелки Бунзена в течение очень короткого времени с помощью щипцов для тигля (он будет светиться красным). Затем немедленно опустите стальную вату в бутылку № 4. Запишите свои наблюдения. Повторите с пустой бутылкой (наполненной воздухом) и запишите свои наблюдения.
Испытание 5: Горение водорода
Этот тест должен проводиться только на воздухе. (Примечание: водород, сжигаемый в этом тесте, должен сначала образоваться в результате реакции между цинком и соляной кислотой.) В большую пробирку добавьте 1-2 кусочка металлического цинка, а затем около 3 мл соляной кислоты. Сразу после образования газообразного водорода должно начаться быстрое барботирование, и дно пробирки сильно нагреется. Поместите пробирку в средний химический стакан. По истечении 60 секунд зажгите деревянную шину. Не выдувайте его. Поднесите горящую лучинку к отверстию пробирки (где выделяется газообразный водород) и запишите свои наблюдения.
Тест 6: Горение магния
Этот тест является демонстрацией для инструктора. Он должен выполняться только в воздухе. Держите 1-дюймовый кусок металлического магния в пламени горелки Бунзена с помощью тигельных щипцов, пока он не загорится (в воздухе). Запишите свои наблюдения, не забывая смотреть прямо на горящий магний!
Предлабораторное задание: Свойства газообразного кислорода
- Газообразный кислород образуется в результате реакции разложения определенного вещества.
- Назовите вещество, которое будет разлагаться.
- Назовите два продукта, образующихся в результате этой реакции.
- Катализатор, называемый оксидом марганца (IV), \(\ce{MnO2}\), будет использоваться для облегчения производства газообразного кислорода. Что именно делает катализатор?
- Внимательно прочитайте процедуру производства газообразного кислорода (Часть A) и изучите прилагаемый рисунок установки оборудования
- В какой колбе протекает реакция разложения?
- Какое химическое вещество добавлено в эту колбу через трубку чертополоха?
- Какие химические вещества уже находятся в колбе?
- В каких баллонах собирается газообразный кислород?
- После того, как кислород собран, вы храните его в этих баллонах, правильно или вверх дном? (обведите один вариант) Объясните, почему.

- После получения и сбора кислорода вы исследуете его роль в реакциях горения
- Является ли кислород реагентом или продуктом реакции горения?
- Являются ли реакции горения экзотермическими или эндотермическими?
- В части B вы будете сжигать различные вещества в газообразном кислороде, собранном в части A.
- Какое одно из этих веществ должно быть сожжено в вытяжке ?
- Какие два из этих веществ должны сжигаться только в воздухе ?
- Какое вещество (только одно) будет сжигать инструктор?
Лабораторный отчет: Свойства газообразного кислорода
Часть A: Получение и сбор газообразного кислорода
- Напишите уравнение реакции, используемой для получения газообразного кислорода.
- Словесное уравнение:
- Формула Уравнение:
- Какое название и формула катализатора, используемого в этой реакции? Каково назначение этого катализатора?
- Какое еще вещество образуется в результате этой реакции помимо кислорода? Где собирают это вещество?
- Двумя примечательными физическими свойствами кислорода являются его низкая растворимость в воде и плотность выше, чем у воздуха
- Какое из этих свойств позволяет хранить собранный газообразный кислород в бутылях горлышком вверх ? Объяснять.

- Какое из этих свойств позволяет собирать газообразный кислород посредством вытеснения воды ? Объяснять.
Часть B: Свойства газообразного кислорода
Тест | Наблюдения |
|---|---|
| Тест 1 | |
Светящаяся шина в бутылке №1 | |
Светящаяся шина в баллоне с воздухом |
Тест 2 | |
Горящая свеча в бутылке №2 | Свеча горела _______ секунд. |
Горящая свеча в воздушном баллоне | Свеча горела _______ секунд. |
Тест 3 | |
Горящая сера в бутылке №3 | |
Горящая сера в баллоне с воздухом | |
Тест 4 | |
Светящаяся сталь в бутылке №4 | |
Светящаяся сталь в баллоне с воздухом | |
| Тест 5 | |
Сжигание водорода в воздухе | |
Тест 6 | |
Горение магния в воздухе |
Анализ результатов горения
- Рассмотрите результаты первых четырех выполненных вами тестов.
 В каких сосудах, наполненных воздухом или кислородом, реакции горения протекали более бурно? Почему?
В каких сосудах, наполненных воздухом или кислородом, реакции горения протекали более бурно? Почему?
- Являются ли реакции горения кислорода экзотермическими или эндотермическими? Подтвердите свой ответ одним или несколькими конкретными наблюдениями из проведенных вами тестов.
- Рассмотрите результаты теста 2. Хотя свеча горит в течение более длительного периода времени в одной бутылке, в конечном итоге она гаснет как в пустой бутылке, так и в Бутылке № 2. Почему он гаснет?
- Когда элемент сгорает в кислороде, продукт называется оксидом.
- Древесина шины состоит в основном из углерода. При сгорании углерода образуется двуокись углерода \(\ce{CO2}\). Напишите уравнение горения древесины (углерода).
- Словесное уравнение:
- Уравнение сбалансированной формулы:
- При сгорании серы образуется диоксид серы \(\ce{SO2}\).
 Напишите уравнение горения серы.
Напишите уравнение горения серы.- Словесное уравнение:
- Уравнение сбалансированной формулы:
- Стальная вата состоит в основном из железа. При сгорании железа образуется оксид железа (III) \(\ce{Fe2O3}\). Напишите уравнение горения стальной ваты (железа).
- Словесное уравнение:
- Уравнение сбалансированной формулы:
- При сгорании водорода образуется вода \(\ce{h3O}\). Напишите уравнение горения водорода.
- Словесное уравнение:
- Уравнение сбалансированной формулы:
- При сгорании магния образуется оксид магния \(\ce{MgO}\). Напишите уравнение горения магния.
- Словесное уравнение:
- Уравнение сбалансированной формулы:
- Ожидаете ли вы, что продукт, образовавшийся при сгорании магния в испытании 6 (пепельный оксид магния), будет весить больше, меньше или такой же, как исходный кусок магния? Объяснять.

- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Колледж Санта-Моники
- Лицензия
- CC BY-NC
- Показать страницу TOC
- № на стр.
- Теги
- Кислород
Перфузия по сравнению с доставкой кислорода при переливании «свежих» и «старых» эритроцитов: экспериментальные данные
1. Bernard AC, Davenport DL, Chang PK, Vaughan TB, Zwischenberger JB. Интраоперационное переливание от 1 до 2 единиц эритроцитарной массы связано с повышенной 30-дневной смертностью, инфекциями в области хирургического вмешательства, пневмонией и сепсисом у пациентов общей хирургии. J Am Coll Surg. 2009 г.;208:931–937. 7. [PubMed] [Google Scholar]
Bernard AC, Davenport DL, Chang PK, Vaughan TB, Zwischenberger JB. Интраоперационное переливание от 1 до 2 единиц эритроцитарной массы связано с повышенной 30-дневной смертностью, инфекциями в области хирургического вмешательства, пневмонией и сепсисом у пациентов общей хирургии. J Am Coll Surg. 2009 г.;208:931–937. 7. [PubMed] [Google Scholar]
2. Klein HG, Spahn DR, Carson JL. Переливание эритроцитарной массы в клинической практике. Ланцет. 2007; 370:415–426. [PubMed] [Google Scholar]
3. Мерфи Г.Дж., Ривз Б.К., Роджерс К.А., Ризви С.И., Каллифорд Л., Анджелини Г.Д. Повышенная смертность, послеоперационная заболеваемость и стоимость переливания эритроцитарной массы у пациентов, перенесших операцию на сердце. Тираж. 2007; 116: 2544–2552. [PubMed] [Google Scholar]
4. Engoren MC, Habib RH, Zacharias A, Schwann TA, Riordan CJ, Durham SJ. Влияние переливания крови на долгосрочную выживаемость после операции на сердце. Энн Торак Серг. 2002; 74: 1180–1186. [PubMed] [Академия Google]
5. Tsai AG, Friesenecker B, McCarthy M, Sakai H, Intaglietta M. Вязкость плазмы регулирует капиллярную перфузию во время экстремальной гемодилюции на модели кожной складки хомяка. Am J Physiol. 1998;275:h3170–h3180. [PubMed] [Google Scholar]
Tsai AG, Friesenecker B, McCarthy M, Sakai H, Intaglietta M. Вязкость плазмы регулирует капиллярную перфузию во время экстремальной гемодилюции на модели кожной складки хомяка. Am J Physiol. 1998;275:h3170–h3180. [PubMed] [Google Scholar]
6. Cabrales P, Tsai AG, Intaglietta M. Расширитель альгинатной плазмы поддерживает перфузию и вязкость плазмы во время экстремальной гемодилюции. Am J Physiol. 2005; 288:h2708–h2716. [PubMed] [Google Scholar]
7. Cabrales P, Tsai AG, Intaglietta M. Микрососудистое давление и функциональная плотность капилляров при экстремальной гемодилюции с расширителями низкой и высокой вязкости плазмы. Am J Physiol. 2004; 287:h463–h473. [PubMed] [Академия Google]
8. Кабралес П., Мартини Дж., Интальетта М., Цай А.Г. Вязкость крови поддерживает состояние микроциркуляторного русла при нормоволемической анемии независимо от способности крови переносить кислород. Am J Physiol Heart Circ Physiol. 2006; 291:H581–H590. [PubMed] [Google Scholar]
9. Kerger H, Saltzman DJ, Menger MD, Messmer K, Intaglietta M. Системная и подкожная диссоциация микрососудов pO 2 во время 4-часового геморрагического шока у хомяков в сознании. Am J Physiol. 1996; 270:H827–H836. [PubMed] [Академия Google]
Kerger H, Saltzman DJ, Menger MD, Messmer K, Intaglietta M. Системная и подкожная диссоциация микрососудов pO 2 во время 4-часового геморрагического шока у хомяков в сознании. Am J Physiol. 1996; 270:H827–H836. [PubMed] [Академия Google]
10. Веттштейн Р., Цай А.Г., Эрни Д., Лукьянов А.Н., Торчилин В.П., Интальетта М. Улучшение микроциркуляции более эффективно, чем замещение эритроцитов, для коррекции метаболических нарушений при экспериментальном геморрагическом шоке. Шок. 2004; 21: 235–240. [PubMed] [Google Scholar]
11. Cabrales P, Tsai AG, Intaglietta M. Реанимация при геморрагическом шоке с использованием крови, насыщенной окисью углерода. Реанимация. 2007; 72: 306–318. [PubMed] [Google Scholar]
12. Салазар Васкес Б.Я., Кабралес П., Цай А.Г., Джонсон П.С., Интальетта М. Снижение артериального давления за счет увеличения гематокрита с помощью эритроцитов, не поглощающих оксид азота. Am J Respir Cell Mol Biol. 2008; 38: 135–142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
13. Cabrales P, Tsai AG, Intaglietta M. Ограничивается ли реанимация при геморрагическом шоке кислородоемкостью крови или вязкостью крови? Шок. 2007; 27: 380–389. [PubMed] [Google Scholar]
Cabrales P, Tsai AG, Intaglietta M. Ограничивается ли реанимация при геморрагическом шоке кислородоемкостью крови или вязкостью крови? Шок. 2007; 27: 380–389. [PubMed] [Google Scholar]
14. Saltzman D, DeLano FA, Schmid-Schönbein GW. Микрососуды в скелетных мышцах. VI. Адренергическая иннервация артериол у нормотензивных и спонтанно гипертензивных крыс. Микроваск Рез. 1992; 44: 263–273. [PubMed] [Google Scholar]
15. Tsai AG, Friesenecker B, Mazzoni MC, et al. Микрососудистый и тканевой кислородный градиент в брыжейке крысы. Proc Nat Acad Sci. 1998;95:6590–6595. [PMC free article] [PubMed] [Google Scholar]
16. Валтис Д., Кеннеди А. Дефектная газотранспортная функция депонированных эритроцитов. Ланцет. 1954; 1: 119–124. [PubMed] [Google Scholar]
17. Макдональд Р. 2,3-дифосфоглицерат эритроцитов и сродство к кислороду. Анестезия. 1977; 32: 544–553. [PubMed] [Google Scholar]
18. Proctor HJ, Fry J. Повышение уровня 2,3-DPG в эритроцитах: полезность при гипоксии.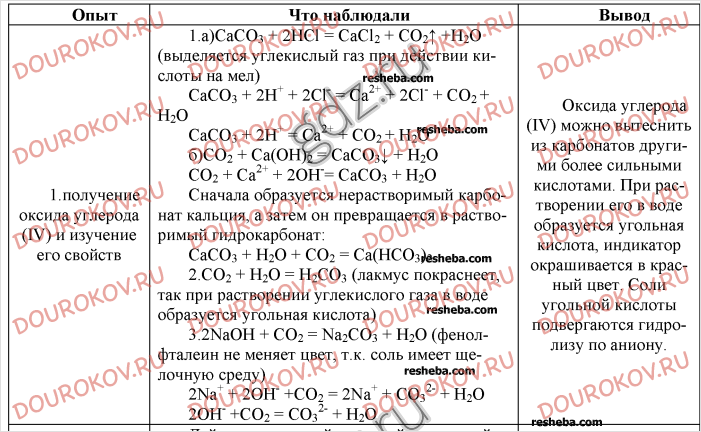 J Surg Res. 1974; 16: 569–574. [PubMed] [Академия Google]
J Surg Res. 1974; 16: 569–574. [PubMed] [Академия Google]
19. Proctor HJ, Parker JC, Fry J, Johnson G. Jr. Лечение тяжелой гипоксии с помощью эритроцитов с высоким содержанием 2,3-дифосфоглицерата. J Травма. 1973; 13: 340–345. [PubMed] [Google Scholar]
20. Valeri CR, Rorth M, Zaroulis CG, Jakubowski MS, Vescera SV. Физиологические эффекты гипервентиляции и флеботомии у павианов: системная и церебральная экстракция кислорода. Энн Сург. 1975; 181: 99–105. [Бесплатная статья PMC] [PubMed] [Google Scholar]
21. Valeri CR, Rorth M, Zaroulis CG, Jakubowski MS, Vescera SV. Физиологические эффекты переливания эритроцитов с высоким или низким сродством к кислороду павианам с пассивной гипервентиляцией и анемией: системная и церебральная экстракция кислорода. Энн Сург. 1975;181:106–113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Spector JI, Zaroulis CG, Pivacek LE, Emerson CP, Valeri CR. Физиологические эффекты эритроцитов с нормальным или низким сродством к кислороду у павианов с гипоксией.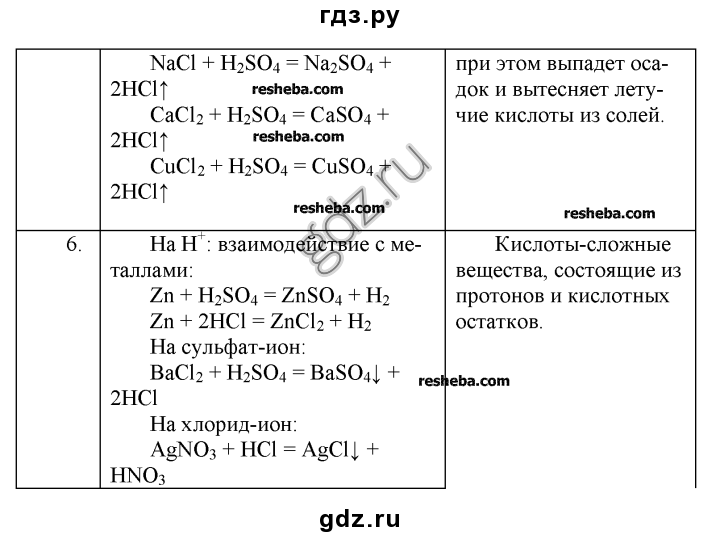 Am J Physiol. 1977; 232:H79–H84. [PubMed] [Google Scholar]
Am J Physiol. 1977; 232:H79–H84. [PubMed] [Google Scholar]
23. Коллинз Дж. А., Стеченберг Л. Влияние концентрации и функции гемоглобина на выживаемость крыс после кровоизлияния. Операция. 1979; 85: 412–418. [PubMed] [Google Scholar]
24. Tsai AG, Cabrales P, Intaglietta M. Микроваскулярная перфузия при обменном переливании сохраненных эритроцитов в условиях нормоволемической анемии. Переливание. 2004; 44: 1626–1634. [PubMed] [Академия Google]
25. Cabrales P, Tsai AG, Intaglietta M. Модуляция перфузии и оксигенации кислородным сродством эритроцитов во время острой анемии. Am J Respir Cell Mol Biol. 2008; 38: 354–361. [Бесплатная статья PMC] [PubMed] [Google Scholar]
26. Виллела Н.Р., Кабралес П., Цай А.Г., Интальетта М. Микроциркуляторные эффекты изменения сродства гемоглобина крови к кислороду во время реанимации геморрагического шока в экспериментальной модели. Шок. 2009; 31: 645–652. [PubMed] [Google Scholar]
27. Интальетта М., Ричардсон Д. Р., Томпкинс В.Р. Кровяное давление, кровоток и эластические свойства в микрососудах кошачьего сальника. Am J Physiol. 1971;221:922–928. [PubMed] [Google Scholar]
Р., Томпкинс В.Р. Кровяное давление, кровоток и эластические свойства в микрососудах кошачьего сальника. Am J Physiol. 1971;221:922–928. [PubMed] [Google Scholar]
28. Mazzoni MC, Borgström P, Intaglietta M, Arfors KE. Сужение просвета и набухание эндотелиальных клеток в капиллярах скелетных мышц при геморрагическом шоке. Цирк Шок. 1989; 29: 27–39. [PubMed] [Google Scholar]
29. Boswell CA, Majno G, Joris I, Ostrom KA. Острое сокращение эндотелиальных клеток in vitro: сравнение с гладкомышечными клетками сосудов и фибробластами. Микроваск Рез. 1992; 43: 178–191. [PubMed] [Академия Google]
30. Colantuoni A, Bertuglia S, Intaglietta M. Количественная оценка изменений ритмического диаметра в артериальной микроциркуляции. Am J Physiol. 1984; 246:H508–H517. [PubMed] [Google Scholar]
31. Цай А.Г., Фризенекер Б., Интальетта М. Нарушение капиллярного кровотока и функциональная плотность капилляров. Int J Microcirc: Clin Exp. 1995; 15: 238–243. [PubMed] [Google Scholar]
32./001.jpg) Линдбом Л., Арфорс К.Е. Механизм и место контроля за изменением количества перфузируемых капилляров в скелетных мышцах. Int J Microcirc: Clin Exp. 1985;4:121–127. [PubMed] [Google Scholar]
Линдбом Л., Арфорс К.Е. Механизм и место контроля за изменением количества перфузируемых капилляров в скелетных мышцах. Int J Microcirc: Clin Exp. 1985;4:121–127. [PubMed] [Google Scholar]
33. Menger MD, Rucker M, Vollmar B. Капиллярная дисфункция при ишемии/реперфузии поперечнополосатых мышц: о механизмах капиллярного «отсутствия обратного потока». Шок. 1997; 8: 2–7. [PubMed] [Google Scholar]
34. Гидлоф А., Льюис Д.Х., Хаммерсен Ф. Влияние длительной тотальной ишемии на ультраструктуру капилляров скелетных мышц человека. Морфометрический анализ. Int J Microcirc Clin Exp. 1988; 7: 67–86. [PubMed] [Google Scholar]
35. Harris AG, Steinbauer M, Leiderer R, Messmer K. Роль лейкоцитарной закупорки и отека в ишемически-реперфузионном повреждении скелетных мышц. Am J Physiol. 1997;273:H989–H996. [PubMed] [Google Scholar]
36. Boswell CA, Joris I, Majno G. Концепция клеточного тонуса: отражение эндотелия, фибробластов и гладкомышечных клеток. Перспект Биол Мед. 1992; 36: 79–86. [PubMed] [Google Scholar]
1992; 36: 79–86. [PubMed] [Google Scholar]
37. Bennett-Guerrero E, Veldman TH, Doctor A, et al. Эволюция неблагоприятных изменений в сохраненных эритроцитах. Proc Natl Acad Sci U S A. 2007; 104:17063–17068. [Бесплатная статья PMC] [PubMed] [Google Scholar]
38. Greenwalt TJ, Bryan DJ, Dumaswala UJ. Везикуляция мембран эритроцитов и изменение состава мембран при хранении в цитрат-фосфат-декстрозе-аденине-1. Вокс Санг. 1984;47:261–270. [PubMed] [Google Scholar]
39. Рамсби М.Г., Троттер Дж., Аллан Д., Мичелл Р.Х. Восстановление мембранных микровезикул из эритроцитов человека, хранящихся для переливания: механизм преобразования формы эритроцитов из дискоцитов в сфероциты. Биохим Сок Транс. 1977; 5: 126–128. [PubMed] [Google Scholar]
40. Дерн Р.Дж., Гвинн Р.П., Виорковски Дж.Дж. Исследования по сохранению крови человека. I. Вариабельность характеристик хранения эритроцитов у здоровых доноров. J Lab Clin Med. 1966;67:955–965. [PubMed] [Google Scholar]
41. Березина Т.Л., Заец С.Б., Морган С. и соавт. Влияние хранения на реологические свойства эритроцитов. J Surg Res. 2002; 102:6–12. [PubMed] [Google Scholar]
Березина Т.Л., Заец С.Б., Морган С. и соавт. Влияние хранения на реологические свойства эритроцитов. J Surg Res. 2002; 102:6–12. [PubMed] [Google Scholar]
42. Аннисс А.М., Воробей Р.Л. Вариабельная адгезия различных продуктов эритроцитов к активированному эндотелию сосудов в условиях потока. Am J Гематол. 2007; 82: 439–445. [PubMed] [Google Scholar]
43. Харадин А.Р., Виид Р.И., Рид С.Ф. Изменение физических свойств депонированных эритроцитов в зависимости от выживаемости in vivo. Переливание. 1969;9:229–237. [PubMed] [Google Scholar]
44. Beutler E, Kuhl W. Контроль объема эритроцитов при хранении. Роль маннитола. Переливание. 1988; 28: 353–357. [PubMed] [Google Scholar]
45. Latham JT, Jr, Bove JR, Weirich FL. Химические и гематологические изменения в сохраненной крови CPDA-1. Переливание. 1982; 22: 158–159. [PubMed] [Google Scholar]
46. Greenwalt TJ, Zehner Sostok C, Dumaswala UJ. Исследования сохранения эритроцитов. 2. Сравнение образования везикул, морфологии и липидов мембран при хранении в AS-1 и CPDA-1. Вокс Санг. 1990;58:90–93. [PubMed] [Google Scholar]
Вокс Санг. 1990;58:90–93. [PubMed] [Google Scholar]
47. Lier H, Krep H, Schroeder S, Stuber F. Предпосылки гемостаза при травмах: обзор. Влияние ацидоза, гипокальциемии, анемии и гипотермии на функциональный гемостаз при травме. J Травма. 2008; 65: 951–960. [PubMed] [Google Scholar]
48. Fitzgerald RD, Martin CM, Dietz GE, Doig GS, Potter RF, Sibbald WJ. Переливание эритроцитов, хранящихся в растворе цитрата фосфата декстрозы аденина-1 в течение 28 дней, не улучшает оксигенацию тканей у крыс. Крит Уход Мед. 1997;25:726–732. [PubMed] [Google Scholar]
49. van Bommel J, de Korte D, Lind A, et al. Влияние переливания хранящихся эритроцитов на оксигенацию микрососудов кишечника у крыс. Переливание. 2001;41:1515–1523. [PubMed] [Google Scholar]
50. d’Almeida MS, Jagger J, Duggan M, White M, Ellis C, Chin-Yee IH. Сравнение биохимических и функциональных изменений эритроцитов крысы и человека, хранящихся в CPDA-1 в течение 29 дней: последствия для моделей переливания на животных. Трансфус Мед. 2000;10:291–303. [PubMed] [Google Scholar]
Трансфус Мед. 2000;10:291–303. [PubMed] [Google Scholar]
51. Makley AT, Goodman MD, Friend LA, et al. Банк крови мышей: характеристика и сравнение с кровью человека. Shock [бесплатная статья PMC] [PubMed] [Google Scholar]
52. Toffelmire EB, Boegman RJ. Продолжительность жизни эритроцитов у дистрофических хомячков. Может J Physiol Pharmacol. 1980; 58: 1245–1247. [PubMed] [Google Scholar]
53. Corry WD, Meiselman HJ. Центробежный метод определения деформируемости эритроцитов. Кровь. 1978; 51: 693–701. [PubMed] [Академия Google]
54. Майзельман Г.Дж. Морфологические детерминанты деформируемости эритроцитов. Scand J Clin Lab Invest. 1981; 156 Приложение: 27–34. [PubMed] [Google Scholar]
55. Henkelman S, Dijkstra-Tiekstra MJ, de Wildt-Eggen J, Graaff R, Rakhorst G, van Oeveren W. Сохраняется ли реология эритроцитов при обычном хранении в банке крови? Переливание. 2009 [PubMed] [Google Scholar]
56. Каменева М.В., Гарретт К.О., Ватач М.Дж., Боровец Х. С. Старение эритроцитов и риск сердечно-сосудистых заболеваний. Clin Hemorheol Microcirc. 1998;18:67–74. [PubMed] [Google Scholar]
С. Старение эритроцитов и риск сердечно-сосудистых заболеваний. Clin Hemorheol Microcirc. 1998;18:67–74. [PubMed] [Google Scholar]
57. Cicco G, Cicco S. Гемореологические аспекты микроциркуляторного русла при некоторых патологиях. Adv Exp Med Biol. 2007; 599:7–15. [PubMed] [Google Scholar]
58. Антонова Н., Цветкова Е., Иванов И., Савов Ю. Гемореологические изменения и характерные параметры по вискозиметрии цельной крови у хронических героиновых наркоманов. Clin Hemorheol Microcirc. 2008; 39: 53–61. [PubMed] [Google Scholar]
59. Powell LW, Halliday JW, Knowles BR. Связь содержания липидов мембраны эритроцитов с морфологией эритроцитов и выживаемостью у пациентов с заболеваниями печени. Aust NZ J Med. 1975;5:101–107. [PubMed] [Google Scholar]
60. Scott MD, Kuypers FA, Butikofer P, Bookchin RM, Ortiz OE, Lubin BH. Влияние осмотического лизиса и повторного запечатывания на структуру и функцию эритроцитов. J Lab Clin Med. 1990; 115:470–480. [PubMed] [Google Scholar]
61. Глен А.И., Глен Э.М., Хорробин Д.Ф. и соавт. Аномалия мембраны эритроцитов в подгруппе больных шизофренией: свидетельство двух заболеваний. Шизофр Рез. 1994; 12:53–61. [PubMed] [Google Scholar]
Глен А.И., Глен Э.М., Хорробин Д.Ф. и соавт. Аномалия мембраны эритроцитов в подгруппе больных шизофренией: свидетельство двух заболеваний. Шизофр Рез. 1994; 12:53–61. [PubMed] [Google Scholar]
62. Hess JR, Greenwalt TG. Хранение эритроцитов: новые подходы. Transfus Med Rev. 2002; 16: 283–29.5. [PubMed] [Google Scholar]
63. Hessel E, Lerche D. Изменения клеточной поверхности при хранении крови, характеризующиеся искусственной агрегацией отмытых эритроцитов. Вокс Санг. 1985; 49: 86–91. [PubMed] [Google Scholar]
64. Chien S. Деформируемость эритроцитов и ее значение для кровотока. Annu Rev Physiol. 1987; 49: 177–192. [PubMed] [Google Scholar]
65. Эрнст Э. Влияние регулярных физических нагрузок на реологические свойства крови. Eur Heart J. 1987; (8 Suppl G): 59–62. [PubMed] [Академия Google]
66. Мохандас Н., Часис Дж. А., Шохет С. Б. Влияние скелета мембраны на деформируемость эритроцитов, свойства материала мембраны и форму. Семин Гематол. 1983; 20: 225–242. [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
67. Бейтман Р.М., Джаггер Дж.Э., Шарп М.Д., Эллсворт М.Л., Мехта С., Эллис К.Г. Деформируемость эритроцитов является опосредованным оксидом азота фактором снижения плотности капилляров при сепсисе. Am J Physiol Heart Circ Physiol. 2001; 280:h3848–h3856. [PubMed] [Google Scholar]
68. Weiss DJ, Richwagen K, Evanson OA. Влияние гематокрита и деформируемости эритроцитов на давление в легочных сосудах в перфузируемых легких пони. Am J Vet Res. 1996;57:346–350. [PubMed] [Google Scholar]
69. Кабралес П. Влияние гибкости эритроцитов на перфузию микрососудов и оксигенацию при острой анемии. Am J Physiol Heart Circ Physiol. 2007;293:h2206–h2215. [PubMed] [Google Scholar]
70. Karai I, Fukumoto K, Horiguchi S. Взаимосвязь между осмотической хрупкостью эритроцитов и различными гематологическими данными у рабочих, подвергшихся воздействию свинца. Int Arch Occup Environ Health. 1982; 50:17–23. [PubMed] [Google Scholar]
71. Augustine PC, Witlock DR. Снижение осмотической хрупкости эритроцитов индеек, инфицированных Eimeria adenoeides. Авиан Дис. 1984;28:343–351. [PubMed] [Google Scholar]
Снижение осмотической хрупкости эритроцитов индеек, инфицированных Eimeria adenoeides. Авиан Дис. 1984;28:343–351. [PubMed] [Google Scholar]
72. Исаакс Р.Е., Ким Х.Д. Фосфатный состав эритроцитов и осмотическая хрупкость у австралийских двоякодышащих рыб Neoceratodus Fosteri и остеоглоссидов Scleropages schneichardti. Comp Biochem Physiol A Comp Physiol. 1984; 79: 667–671. [PubMed] [Google Scholar]
73. Гладвин М.Т., Ким-Шапиро Д.Б. Нарушение хранения в консервированной крови из-за гемолиззависимого нарушения гомеостаза оксида азота. Карр Опин Гематол. 2009; 16: 515–523. [PubMed] [Академия Google]
74. Игнарро Л.Дж., Бирнс Р.Э., Буга Г.М., Вуд К.С. Эндотелиальный релаксирующий фактор легочной артерии и вены обладает фармакологическими и химическими свойствами, идентичными радикалу оксида азота. Цирк рез. 1987; 61: 866–879. [PubMed] [Google Scholar]
75. Furchgott RF, Jothianandan D. Эндотелий-зависимая и независимая вазодилатация с участием циклического GMP: релаксация, вызванная оксидом азота, окисью углерода и светом. Кровеносный сосуд. 1991; 28: 52–61. [PubMed] [Академия Google]
Кровеносный сосуд. 1991; 28: 52–61. [PubMed] [Академия Google]
76. Беверс Л.М., Браам Б., Пост Дж.А. и др. Тетрагидробиоптерин, но не L-аргинин, уменьшает разобщение NO-синтазы в клетках, экспрессирующих высокие уровни эндотелиальной NO-синтазы. Гипертония. 2006; 47:87–94. [PubMed] [Google Scholar]
77. Hsu LL, Champion HC, Campbell-Lee SA, et al. Гемолиз у серповидноклеточных мышей вызывает легочную гипертензию из-за глобального нарушения биодоступности оксида азота. Кровь. 2007; 109:3088–3098. [Бесплатная статья PMC] [PubMed] [Google Scholar]
78. Воллни Т., Яковьелло Л., Бушко В., де Гаэтано Г., Донати М.Б. Удлинение времени кровотечения при остром гемолизе у крыс: роль оксида азота. Am J Physiol. 1997; 272:h3875–h3884. [PubMed] [Google Scholar]
79. Lancaster JR. Моделирование диффузии и реакции эндогенно продуцируемого оксида азота. Proc Natl Acad Sci USA. 1994; 91:8137–8141. [Бесплатная статья PMC] [PubMed] [Google Scholar]
80. Olson JS, Foley EW, Rogge C, Tsai AL, Doyle MP, Lemon DD. Отсутствие очищающего и гипертензивного действия кровезаменителей на основе гемоглобина. Свободный Радик Биол Мед. 2004; 36: 685–69.7. [PubMed] [Google Scholar]
Отсутствие очищающего и гипертензивного действия кровезаменителей на основе гемоглобина. Свободный Радик Биол Мед. 2004; 36: 685–69.7. [PubMed] [Google Scholar]
81. Conklin DJ, Smith MP, Olson KR. Фармакологическая характеристика аргинин-вазотоциновых рецепторов гладкой мускулатуры сосудов форели (Oncorhynchus mykiss) in vitro. Джен Комп Эндокринол. 1999; 114:36–46. [PubMed] [Google Scholar]
82. Doherty DH, Doyle MP, Curry SR, et al. Скорость реакции с оксидом азота определяет гипертензивное действие внеклеточного гемоглобина. Природная биотехнология. 1998; 16: 672–676. [PubMed] [Google Scholar]
83. Цай А.Г., Кабралес П., Манджула Б.Н., Ачарья С.А., Уинслоу Р.М., Интальетта М. Диссоциация локальной концентрации оксида азота и вазоконстрикция в присутствии бесклеточных гемоглобиновых переносчиков кислорода. Кровь. 2006; 108:3603–3610. [Бесплатная статья PMC] [PubMed] [Google Scholar]
84. Мессмер К.Ф. Допустимые уровни гематокрита у хирургических больных. Мир J Surg. 1987; 11:41–46. [PubMed] [Google Scholar]
Мир J Surg. 1987; 11:41–46. [PubMed] [Google Scholar]
85. Spahn DR, Casutt M. Отказ от переливания крови: новые аспекты и перспективы. Анестезиология. 2000; 93: 242–255. [PubMed] [Google Scholar]
86. Habler OP, Kleen MS, Hutter JW, et al. Влияние гипероксической вентиляции на изменения, вызванные гемодилюцией, у собак под наркозом. Переливание. 1998; 38: 135–144. [PubMed] [Google Scholar]
87. Habler OP, Kleen MS, Podtschaske AH, et al. Влияние острой нормоволемической гемодилюции (АНГ) на сократимость миокарда у собак под наркозом. Анест Анальг. 1996;83:451–458. [PubMed] [Google Scholar]
88. Цай А.Г., Фризенекер Б., Маккарти М., Сакаи Х., Интальетта М. Вязкость плазмы регулирует капиллярную перфузию во время экстремальной гемодилюции в модели кожной складки хомяка. Am J Physiol. 1998;275:h3170–h3180. [PubMed] [Google Scholar]
89. Cabrales P, Sakai H, Tsai AG, Takeoka S, Tsuchida E, Intaglietta M. Транспорт кислорода гемоглобиновыми везикулами с низким и нормальным сродством к кислороду при экстремальной гемодилюции. Am J Physiol Heart Circ Physiol. 2005;288:h2885–h2892. [PubMed] [Google Scholar]
Am J Physiol Heart Circ Physiol. 2005;288:h2885–h2892. [PubMed] [Google Scholar]
90. Cabrales P, Kanika ND, Manjula BN, Tsai AG, Acharya SA, Intaglietta M. PO2 в микрососудах во время экстремальной гемодилюции с сайтом гемоглобина, специфически пегилированным по Cys-93 (бета) у хомяка. оконная камера. Am J Physiol Heart Circ Physiol. 2004; 287:h2609–h2617. [PubMed] [Google Scholar]
91. Guyton AC. Учебник медицинской физиологии. Филадельпия: WB. Сондерс; 1996. Локальная регуляция кровотока тканями и гуморальная регуляция; стр. 199–207. [Google Scholar]
92. Guyton AC, Jones CE, Coleman TC. Физиология кровообращения: сердечный выброс и его регуляция. 1973 [Google Scholar]
93. Villela NR, Salazar Vazquez BY, Intaglietta M. Микроциркуляторные эффекты внутривенных жидкостей при критических состояниях: расширение плазмы за пределы кристаллоидов и коллоидов. Курр Опин Анаэстезиол. 2009; 22: 163–167. [PubMed] [Google Scholar]
94. Cabrales P, Tsai AG, Intaglietta M. Изоволемическое обменное переливание с повышением концентрации раствора гемоглобина с низким сродством к кислороду ограничивает доставку кислорода из-за вазоконстрикции. Am J Physiol Heart Circ Physiol. 2008;295:h3212–h3218. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Изоволемическое обменное переливание с повышением концентрации раствора гемоглобина с низким сродством к кислороду ограничивает доставку кислорода из-за вазоконстрикции. Am J Physiol Heart Circ Physiol. 2008;295:h3212–h3218. [Бесплатная статья PMC] [PubMed] [Google Scholar]
95. Cabrales P, Tsai AG, Intaglietta M. Баланс между вазоконстрикцией и усиленной доставкой кислорода. Переливание. 2008;48:2087–2095. [Бесплатная статья PMC] [PubMed] [Google Scholar]
96. Ван дер Линден П.Дж., Харди Дж.Ф., Дапер А., Тренчан А., Де Херт С.Г. Кардиохирургия с искусственным кровообращением: влияет ли апротинин на исход? Бр Джей Анаст. 2007; 99: 646–652. [PubMed] [Google Scholar]
97. Van der Linden P, De Hert S, Belisle S, et al. Сравнительное влияние переливания эритроцитов и увеличения кровотока на оксигенацию тканей в условиях, зависящих от поступления кислорода. Am J Respir Crit Care Med. 2001; 163:1605–1608. [PubMed] [Академия Google]
Эксперимент «Синяя бутылка» | Эксперимент
- Четыре из пяти
Превращение метилтиониния хлорида (метиленового синего) из синего в бесцветный и обратно путем смешивания его с глюкозой и встряхивания раствора с последующим отстаиванием
Щелочной раствор глюкозы действует как восстановитель и восстанавливает добавленный метиленовый синий из синего до бесцветной формы. Встряхивание раствора повышает концентрацию кислорода в смеси, и это окисляет метиленовый синий обратно в его синюю форму. Когда растворенный кислород израсходован, метиленовый синий медленно восстанавливается до бесцветной формы оставшейся глюкозой, и цикл можно повторять много раз при дальнейшем встряхивании.
Встряхивание раствора повышает концентрацию кислорода в смеси, и это окисляет метиленовый синий обратно в его синюю форму. Когда растворенный кислород израсходован, метиленовый синий медленно восстанавливается до бесцветной формы оставшейся глюкозой, и цикл можно повторять много раз при дальнейшем встряхивании.
Задействованные реакции не являются частью обычной учебной программы по химии, но этот эксперимент имеет хорошее визуальное воздействие и может быть одним из способов стимулировать интерес к химии, возможно, через день открытых дверей.
Демонстрация длится около 3–5 минут, но на предварительную подготовку требуется около 15–20 минут.
Оборудование
Аппарат
- Защита глаз: при приготовлении раствора следует надевать защитные очки
- Коническая колба (1 дм 3 )
- Пробка или пробка для колбы
Химикаты
- Гидроксид калия (КОРРОЗИОННОЕ, РАЗДРАЖАЮЩЕЕ), 8 г
- Глюкоза (декстроза), 10 г
- Метиленовый синий (ВРЕДЕН), 0,05 г
- Этанол (IDA – промышленный денатурированный спирт) (ЛЕГКО ВОСПЛАМЕНЯЕМЫЙ, ВРЕДНЫЙ), 50 см 3
- Доступ к баллону с азотом (дополнительно)
Здоровье, безопасность и технические примечания
- Прочтите наше стандартное руководство по охране труда и технике безопасности
- Защита глаз.
 Наденьте защитные очки при приготовлении раствора.
Наденьте защитные очки при приготовлении раствора. - Гидроксид калия, KOH(s), (КОРРОЗИОННОЕ, РАЗДРАЖАЮЩЕЕ ВЕЩЕСТВО) – см. карточку опасности CLEAPSS HC091b.
- Глюкоза (декстроза), C 6 H 12 O 6 (s) — см. CLEAPSS Hazcard HC040c.
- Метиленовый синий (ВРЕДНЫЙ) – см. карточку опасности CLEAPSS HC032.
- Этанол (IDA – промышленный денатурированный спирт), C 2 H 5 OH(l), (ЛЕГКО ВОСПЛАМЕНЯЕМОЕ, ВРЕДНОЕ) – см. карточку опасности CLEAPSS HC040a.
Процедура
Перед демонстрациейПредпочтительно менее чем за 20 минут.
- Приготовьте раствор 0,05 г метиленового синего в 50 см 3 этанола (0,1%).
- Отвесить 8 г гидроксида калия в коническую колбу 3 вместимостью 1 дм.
- Добавьте 300 см 3 воды и 10 г глюкозы и взболтайте, пока твердые вещества не растворятся.
- Добавьте 5 см 3 раствора метиленового синего.
 Точное используемое количество не имеет решающего значения.
Точное используемое количество не имеет решающего значения. - Полученный синий раствор станет бесцветным примерно через одну минуту. Закройте колбу пробкой и пометьте ее как РАЗДРАЖАЮЩАЯ (из-за присутствия гидроксида калия).
- Удерживая пробку на месте, энергично встряхните колбу, чтобы воздух растворился в растворе.
- Цвет изменится на синий и снова станет бесцветным примерно через 30 секунд.
- Чем сильнее тряска, тем дольше будет исчезать синий цвет.
- Процесс можно повторять более 20 циклов.
- Через несколько часов раствор станет желтым, и изменение цвета не произойдет.
Учебные заметки
Белый фон помогает сделать изменение цвета более ярким. Идеально подойдет белый лабораторный халат.
В холодный день может потребоваться нагреть раствор не менее чем до 20 °C, в противном случае изменения будут очень медленными.
Метиленовый синий является окислительно-восстановительным индикатором и бесцветен в восстановительных условиях, но восстанавливает свой синий цвет при окислении.
Удаление синей окраски вызвано глюкозой, которая в щелочных условиях восстанавливает метиленовый синий до бесцветной формы. Встряхивание раствора пропускает кислород, который повторно окисляет метиленовый синий обратно в синюю форму.
Чтобы подтвердить, что за изменение цвета отвечает кислород, через раствор можно барботировать азот в течение нескольких минут, чтобы вытеснить воздух из раствора и колбы. Если теперь закрыть пробку и встряхнуть бутылку, изменения цвета не произойдет. Повторное введение воздуха путем переливания раствора в другую колбу и встряхивания восстановит систему.
Можно использовать природный газ (в вытяжном шкафу), если азот недоступен. Некоторые учителя могут представить этот эксперимент как фокус. Изменение цвета можно вызвать, просто наливая раствор с достаточной высоты в большой химический стакан.
Этот эксперимент может стать популярным днем открытых дверей. Если посетителям разрешается встряхивать бутылку самостоятельно, было бы разумно использовать пластиковую бутылку с завинчивающейся крышкой, чтобы исключить риск отрыва пробки или падения и поломки бутылки. Раствор, похоже, не взаимодействует с пластиком в течение дня, но было бы разумно заранее опробовать бутылку, которую вы собираетесь использовать.
Раствор, похоже, не взаимодействует с пластиком в течение дня, но было бы разумно заранее опробовать бутылку, которую вы собираетесь использовать.
Использование других окислительно-восстановительных индикаторов
Окислительно-восстановительные индикаторы, отличные от метиленового синего, можно использовать для представления других цветов и сделать демонстрацию действительно яркой. В каждом случае добавьте указанное количество индикатора к основному рецепту из 10 г глюкозы и 8 г гидроксида калия в 300 см 3 воды. Также можно использовать смеси красителей.
Феносафранин Красный при окислении и бесцветный при восстановлении. Используйте около 6 капель 0,2% раствора в воде для бутылочки, которая становится розовой при встряхивании и бесцветной при стоянии. Первоначальный розовый цвет сначала становится бесцветным через некоторое время. Смесь феносафранина (6 капель) и метиленового синего (около 20 капель 0,1% раствора в этаноле) дает бутылку, которая при легком встряхивании становится розовой, затем фиолетовой при большем встряхивании и, в конце концов, синеет. Это изменит последовательность на стояние.
Это изменит последовательность на стояние.
Используйте 4 см 3 1% раствора в воде. Смесь изменит цвет с желтого на красно-коричневый при легком встряхивании и на бледно-зеленый при более энергичном встряхивании. Изменения обратные при стоянии. Это цвета светофоров.
РезазуринРАЗДРАЖАЮЩЕЕ – см. CLEAPSS Карточка опасности HC032. Используйте около 4 капель 1% раствора в воде. Цвет меняется от бледно-голубого до пурпурно-розового при встряхивании и меняется на противоположный при стоянии. При первом добавлении красителя раствор становится темно-синим. Это исчезает примерно через одну минуту.
Дополнительная информация
Это ресурс проекта «Практическая химия», разработанного Фондом Наффилда и Королевским химическим обществом. Эта коллекция из более чем 200 практических заданий демонстрирует широкий спектр химических концепций и процессов. Каждое задание содержит исчерпывающую информацию для учителей и техников, включая полные технические примечания и пошаговые инструкции.

 Доказать, что H2SO4 состоит из H+и сульфат-ионов
Доказать, что H2SO4 состоит из H+и сульфат-ионов к. при действии лакмуса или метилоранжевого, раствор красный, это говорит о наличии H+; и из сульфат-ионов, т.к. BaCl2 является качественным реактивом на сульфат-ионы.
к. при действии лакмуса или метилоранжевого, раствор красный, это говорит о наличии H+; и из сульфат-ионов, т.к. BaCl2 является качественным реактивом на сульфат-ионы. Даны вещества: FeCl3; KOH; H2SO4 используя их получите в две стадии сульфат железа (III) (Fe2(SO4)3).
Даны вещества: FeCl3; KOH; H2SO4 используя их получите в две стадии сульфат железа (III) (Fe2(SO4)3). (стр147 №7)
(стр147 №7) (стр147 №7)
(стр147 №7) (стр147 №7)
(стр147 №7) (стр147 №7)
(стр147 №7) (стр147 №7)
(стр147 №7) (стр147 №7)
(стр147 №7)
 И.
И. Там где выпадает белый осадок — серная кислота.
Там где выпадает белый осадок — серная кислота.
 И.
И.
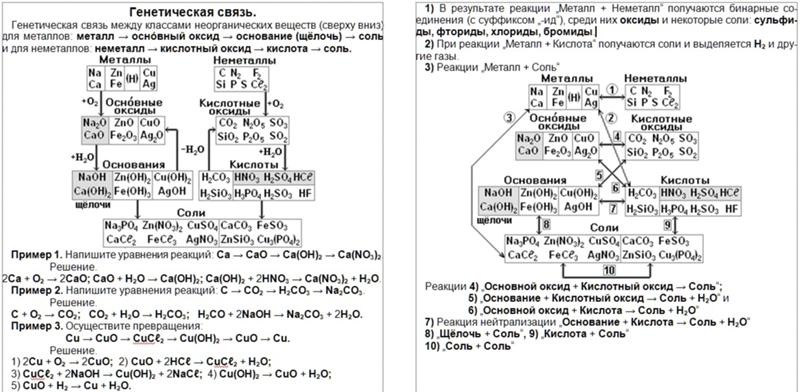



 Добавляем несколько капель гидроксида натрия.
Добавляем несколько капель гидроксида натрия. И.
И. Видим образование черного оксида меди.
Видим образование черного оксида меди.
 Затем осторожно наденьте стеклянную пластину на горлышко каждой бутылки. Убедитесь, что в верхней части стеклянной пластины нет пузырьков воздуха.
Затем осторожно наденьте стеклянную пластину на горлышко каждой бутылки. Убедитесь, что в верхней части стеклянной пластины нет пузырьков воздуха. Убедитесь, что
Убедитесь, что Повторите это для третьей и четвертой бутылок.
Повторите это для третьей и четвертой бутылок. А пока переходите к Части B.
А пока переходите к Части B.


 В каких сосудах, наполненных воздухом или кислородом, реакции горения протекали более бурно? Почему?
В каких сосудах, наполненных воздухом или кислородом, реакции горения протекали более бурно? Почему? Напишите уравнение горения серы.
Напишите уравнение горения серы.
 Наденьте защитные очки при приготовлении раствора.
Наденьте защитные очки при приготовлении раствора. Точное используемое количество не имеет решающего значения.
Точное используемое количество не имеет решающего значения.