Реакция разложения перекиси водорода в присутствии катализатора. Катализаторы, ускоряющие разложение пероксида водорода
Пероксид (перекись) водорода представляет собой бесцветную сиропообразную жидкость плотностью , затвердевающую при — . Это очень непрочное вещество, способное разлагаться со взрывом на воду и кислород, причем выделяется большое количество теплоты:
Водные растворы пероксида водорода более устойчивы; в прохладном месте они могут сохраняться довольно долго. Пергидроль — раствор, который поступает в продажу, — содержит . В нем, а также в высококонцентрированных растворах пероксида водорода содержатся стабилизирующие добавки.
Разложение пероксида водорода ускоряется катализаторами. Если, например, в раствор пероксида водорода бросить немного диоксида марганца , то происходит бурная реакция и выделяется кислород. К катализаторам, способствующим разложению пероксида водорода, принадлежат медь, железо, марганец, а также ионы этих металлов. Уже следы этих металлов могут вызвать распад .
Пероксид водорода образуется в качестве промежуточного продукта при горении водорода, но ввиду высокой температуры водородного пламени тотчас же разлагается на воду и кислород.
Рис. 108. Схема строения молекулы . Угол близок к , угол — к . Длины связей: .
Однако если направить водородное пламя на кусок льда, то в образующейся воде можно обнаружить следы пероксида водорода.
Пероксид водорода получается также при действии атомарного водорода на кислород.
В промышленности пероксид водорода получают в основном электрохимическими методами, например анодным окислением растворов серной кислоты или гидросульфата аммония с последующим гидролизом образующейся при этом пероксодвусерной кислоты (см. § 132). Происходящие при этом процессы можно изобразить схемой:
В пероксиде водорода атомы водорода ковалентно связаны с атомами кислорода, между которыми также осуществляется простая связь. Строение пероксида водорода можно выразить следующей структурной формулой: Н-О-О-Н.
Молекулы обладают значительной полярностью , что является следствием их пространственной структуры (рис. 106).
В молекуле пероксида водорода связи между атомами водорода и кислорода полярны (вследствие смещения общих электронов в сторону кислорода). Поэтому в водном растворе под влиянием полярных молекул воды пероксид водорода может отщеплять ионы водорода, т. е. он обладает кислотными свойствами. Пероксид водорода — очень слабая двухосновная кислота в водном растворе он распадается, хотя и в незначительной степени, на ионы:
Диссоциация по второй ступени
практически не протекает. Она подавляется присутствием воды — вещества, диссоциирующего с образованием ионов водорода в большей степени, чем пероксид водорода. Однако при связывании ионов водорода (например, при введении в раствор щелочи) диссоциация по второй ступени происходит.
С некоторыми основаниями пероксид водорода реагирует непосредственно, образуя соли.
Так, при действии пероксида водорода на водный раствор гидроксида бария выпадает осадок бариевой соли пероксида водорода:
Соли пероксида водорода называются пероксидами или перекисями. Они состоят из положительно заряженных ионов металла и отрицательно заряженных ионов , электронное строение которых можно изобразить схемой:
Они состоят из положительно заряженных ионов металла и отрицательно заряженных ионов , электронное строение которых можно изобразить схемой:
Степень окисленности кислорода в пероксиде водорода равна -1, т. е. имеет промежуточное значение между степенью окисленности кислорода в воде и в молекулярном кислороде (0). Поэтому пероксид водорода обладает свойствами как окислителя, так и восстановителя, т. е. проявляет окислительно-восстановительную двойственность. Все же для него более характерны окислительные свойства, так как стандартный потенциал электрохимической системы
в которой выступает как окислитель, равен 1,776 В, в то время как стандартный потенциал электрохимической системы
в которой пероксид водорода является восстановителем, равен 0,682 В. Иначе говоря, пероксид водорода может окислять вещества, которых не превышает 1,776 В, а восстанавливать только те, которых больше 0,682 В. По табл. 18 (на стр. 277) можно видеть, что в первую группу входит гораздо больше веществ.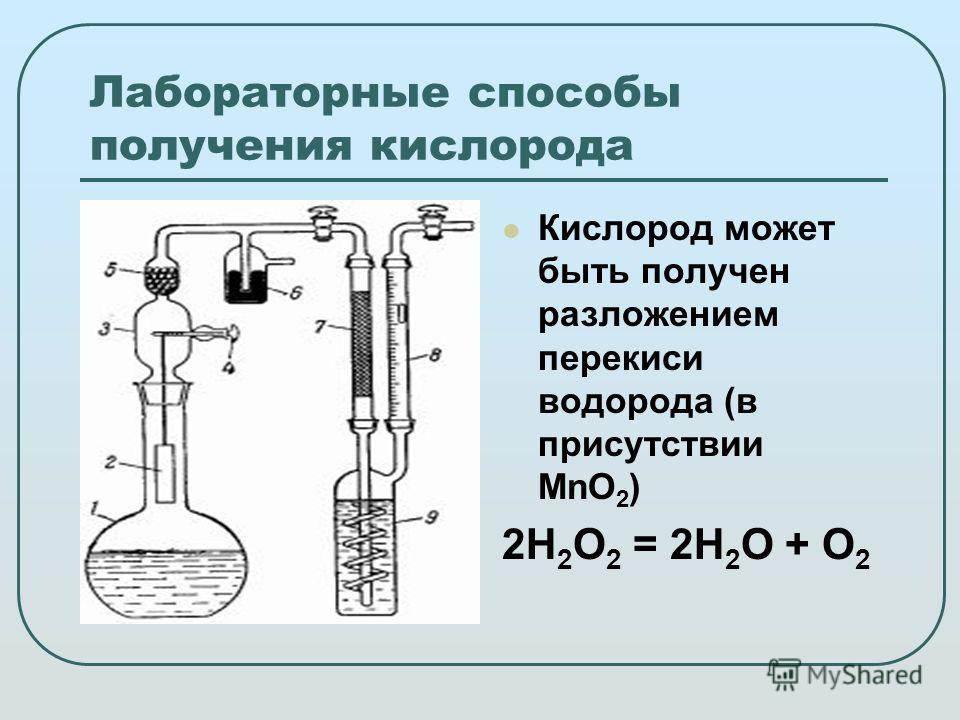
В качестве примеров реакций, в которых служит окислителем, можно привести окисление нитрита калия
и выделение иода из иодида калия:
Его используют для отбелки тканей и мехов, применяют в медицине (3% раствор — дезинфицирующее средство), в пищевой промышленности (при консервировании пищевых продуктов), в сельском хозяйстве для протравливания семян, а также в производстве ряда органических соединений, полимеров, пористых материалов. Как сильный окислитель пероксид водорода используется в ракетной технике.
Пероксид водорода применяют также для обновления старых картин, написанных масляными красками и потемневших от времени вследствие превращения свинцовых белил в черный сульфид свинца под действием содержащихся в воздухе следов сероводорода. При промывании таких картин пероксидом водорода сульфид свинца окисляется в белый сульфат свинца:
О.С.ЗАЙЦЕВ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИКЛАБОРАТОРНЫЙ ПРАКТИКУМНАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22/2004
(продолжение)
ЗАДАЧИ И ВОПРОСЫ
1. Воспользовавшись электронно-ионным способом подбора стехиометрических коэффициентов, составьте уравнения окислительно-восстановительных реакций, протекающих по следующим схемам (формула воды не указана):
Обратите внимание, что среди соединений есть
органические вещества! Попытайтесь подобрать
коэффициенты, пользуясь степенями окисления или
валентностями.
2. Выберите любые два уравнения
электродных реакций:
Составьте из двух выписанных уравнений
электродных процессов одно суммарное уравнение.
Назовите окислитель и восстановитель.
Рассчитайте ЭДС реакции, ее G и константу равновесия. Сделайте вывод о
направлении смещения равновесия этой реакции.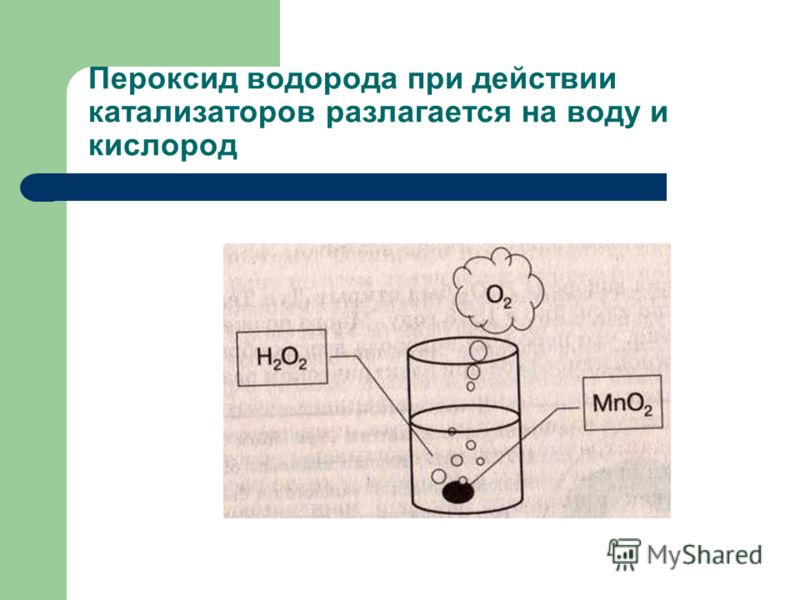
Если вы забыли, как следует поступить, вспомним, что говорилось выше. Вы выписываете из этого списка два любых уравнения. Смотрите на значения их электродных потенциалов и одно из уравнений переписываете в противоположном направлении. Какое, почему и зачем?
Вспоминаете, что числа отданных и принятых электронов должны быть равны, умножаете коэффициенты на некоторое число (какое?) и суммируете оба уравнения. Также суммируются и электродные потенциалы, но их вы не умножаете на число участвующих в процессе электронов. Положительное значение ЭДС говорит о возможности прохождения реакции. Для расчета G и константы равновесия подставьте вычисленное вами значение ЭДС в формулы, которые были выведены ранее.
3. Устойчив ли водный раствор перманганата калия? По-другому вопрос можно сформулировать так: будет ли перманганат-ион реагировать с водой с образованием кислорода, если
4. Окисление кислородом воздуха в водном растворе описывается уравнением:
О 2 + 4Н + + 4е = 2Н 2 О, E = 0,82 В.
Определите, можно ли кислородом воздуха окислить вещества, записанные в правой части любого уравнения задания 2. В правой части этих уравнений записаны восстановители. Учитель укажет вам номер уравнения.
Вам может показаться, что это задание трудно выполнить. Это и есть основной недостаток вашего характера – вам кажется, что задача невыполнима, и вы сразу отказываетесь от попытки ее решить, хотя все необходимые знания у вас имеются. В данном случае следует написать уравнение реакции между кислородом и ионами водорода и интересующее вас уравнение. Посмотреть, какая из реакций обладает более высокой способностью отдавать электроны (ее потенциал должен быть более отрицательным или менее положительным), переписать ее уравнение в противоположном направлении, изменив знак электродного потенциала на противоположный, и просуммировать с другим уравнением. Положительное значение ЭДС укажет на возможность прохождения реакции.
5. Напишите уравнение реакции между
перманганат-ионом и пероксидом водорода Н 2 О 2 .
А у меня получилось следующее уравнение:
7Н 2 О 2 + 2 + 6Н + = 2Mn 2+ + 6О 2 + 10Н 2 О.
Найдите ошибку, если я ее сделал, или объясните, почему ваши коэффициенты другие. Это задание рассчитано на проверку вашей сообразительности и знание материала других разделов химии.
Реакция перманганат-иона с пероксидом водорода в кислотном растворе (серная кислота) может быть представлена несколькими уравнениями с различными коэффициентами, например:
5Н 2 О 2 + 2 + 6Н + = 2Mn 2+ + 5О 2 + 8Н 2 О,
7Н 2 О 2 + 2 + 6Н + = 2Mn 2+ + 6О 2 + 10Н 2 О,
9Н 2 О 2 + 2 + 6Н + = 2Mn 2+ + 7О 2 + 12Н 2 О.
Укажите причину этого и напишите хотя бы еще одно уравнение реакции перманганат-иона с пероксидом водорода.
Если вам удалось объяснить причину такого странного явления, объясните причину возможности написания следующих уравнений:
3Н 2 О 2 + 2 + 6Н + = 2Mn 2+ + 4О 2 + 6Н 2 О,
Н 2 О 2 + 2 + 6Н + = 2Mn 2+ + 3О 2 + 4Н 2 О.
Могут ли проходить реакции в соответствии с двумя этими уравнениями?
Ответ. На реакцию перманганат-ионов с пероксидом водорода накладывается параллельная реакция разложения пероксида водорода:
2Н 2 О 2 = О 2 + 2Н 2 О.
Вы можете основное уравнение реакции просуммировать с бесконечно большим числом этого уравнения и получить множество уравнений с различными стехиометрическими коэффициентами.
6. Это задание может служить темой реферата или доклада.
Обсудите возможность прохождения реакции восстановления ионов Fe 3+ пероксидом водорода в водном растворе:
2Fe 3+ + H 2 O 2 = 2Fe 2+ + O 2 + 2H + .
Рассчитайте ЭДС реакции, ее G и константу равновесия, воспользовавшись стандартными электродными потенциалами:
Изучение зависимости скорости реакции от
концентрации компонентов показало, что при
увеличении концентрации по отдельности Fe 3+
или H 2 O 2 в два раза скорость реакции
возрастает в два раза. Каково кинетическое
уравнение реакции? Определите, как изменится
скорость реакции при увеличении концентрации Fe 3+
или H 2 O 2 в три раза. Предскажите, как
изменится скорость реакции при разбавлении
раствора водой в два или десять раз.
Каково кинетическое
уравнение реакции? Определите, как изменится
скорость реакции при увеличении концентрации Fe 3+
или H 2 O 2 в три раза. Предскажите, как
изменится скорость реакции при разбавлении
раствора водой в два или десять раз.
Предложен следующий механизм реакции:
Н 2 О 2 = Н + Н + (быстрая),
Fe 3+ + H = Fe 2+ + HO 2 (медленная),
Fe 3+ + HO 2 = Fe 2+ + H + + O 2 (быстрая).
Докажите, что этот механизм не противоречит вышерассмотренной зависимости скорости от концентраций реагирующих веществ. Какая стадия является лимитирующей? Какова ее молекулярность и каков ее порядок? Каков общий порядок реакции? Обратите внимание на существование таких сложных ионов и молекул, как H и HO 2 , и на то, что в каждой реакции образуется две частицы или даже три. (Почему нет стадий с образованием одной частицы?)
7. Переведите на русский язык.
Аn important reaction type is the electron-transfer reaction, also known as the
oxidation-reduction, or redox, reaction. In such a reaction one or more electrons appear
to be transferred from one atom to another. Oxidation is a word originally meant
combination with oxygen gas, but so many other reactions were seen to resemble reactions
with oxygen that the term was eventually broadened to refer to any reaction in which a
substance or species loses electrons. Reduction is a gain electrons. The term seems to
have its origins in metallurgical terminology: the reduction of an ore to its metal.
Reduction is just the opposite of oxidation. An oxidation cannot take place without its
having a reduction coupled with it; that is, electrons cannot be lost unless something
else gains them.
In such a reaction one or more electrons appear
to be transferred from one atom to another. Oxidation is a word originally meant
combination with oxygen gas, but so many other reactions were seen to resemble reactions
with oxygen that the term was eventually broadened to refer to any reaction in which a
substance or species loses electrons. Reduction is a gain electrons. The term seems to
have its origins in metallurgical terminology: the reduction of an ore to its metal.
Reduction is just the opposite of oxidation. An oxidation cannot take place without its
having a reduction coupled with it; that is, electrons cannot be lost unless something
else gains them.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Предлагаемые вам задания, как это и было раньше, представляют собой короткие научно-исследовательские работы. Для опытов отобраны реакции, имеющие важное значение не только в химии, но и в экологии. Совсем необязательно выполнить все опыты – выберите те, которые вас заинтересуют.
Работать желательно малыми группами (по 2–3 человека). Это уменьшает время эксперимента, позволяет избежать ошибок и, самое главное, позволяет вам участвовать в научном общении, что развивает научную речь.
1. Окислительно-восстановительные свойства пероксида водорода.
Пероксид водорода Н 2 О 2 – важнейший окислитель, который используется в быту, в технологии, при очистке воды от органических загрязнений. Пероксид водорода – экологически чистый окислитель, т.к. продукты его разложения – кислород и вода – не загрязняют окружающую среду. Известна роль пероксида водорода и пероксидных органических соединений в процессах биологического окисления-восстановления.
3–6%-е растворы пероксида водорода для бытовых и учебных целей готовят обычно из 30%-го раствора разбавлением водой. Пероксид водорода при хранении разлагается с выделением кислорода (нельзя хранить в плотно закрытых сосудах!) . Чем меньше концентрация пероксида водорода, тем он устойчивее.Для замедления разложения пользуются добавками фосфорной, салициловой кислот и других веществ. Особенно сильно действуют на пероксид водорода соли железа, меди, марганца и фермент каталаза.
3%-й раствор пероксида водорода в медицине используют для промывания рта и полоскания горла при стоматите и ангине.
30%-й раствор пероксида водорода называют пергидролем . Пергидроль не взрывоопасен. Попадая на кожу, пергидроль вызывает ожоги, жжение, зуд и образование пузырей, кожа при этом белеет. Обожженное место следует быстро промыть водой. Пергидроль в медицине используют для лечения гнойных ран и для обработки десен при стоматите. В косметологии его используют для удаления пигментных пятен на коже лица. Пятна на одежде от пероксида водорода удалить невозможно. Пероксид водорода в текстильной отрасли промышленности используют для отбеливания шерсти и шелка, а также мехов.
Производство концентрированных (90–98%-х) растворов пероксида водорода постоянно растет.Хранят такие растворы в алюминиевых сосудах с добавкой пирофосфата натрия Na 4 P 2 O 7 . Концентрированные растворы могут разлагаться со взрывом. Концентрированный раствор пероксида водорода на оксидном катализаторе при 700 °С распадается на пары воды и кислород, который служит окислителем для топлива в реактивных двигателях.
Пероксид водорода может проявлять как
окислительные, так и восстановительные свойства.
Роль окислителя для пероксида водорода более
характерна:
Н 2 О 2 + 2Н + + 2е = 2Н 2 О,
например, в реакции:
2KI + Н 2 О 2 + H 2 SO 4 = I 2 + K 2 SO 4 + 2H 2 О.
Пероксид водорода как восстановитель:
1) в кислотной среде:
Н 2 О 2 – 2e = O 2 + 2H + ;
2) в осно»вной (щелочной) среде:
Н 2 О 2 + 2ОН — – 2e = O 2 + 2H 2 O.
Примеры реакций:
1) в кислотной среде:
2KMnO 4 + 5H 2 O 2 + 3H 2 SO 4 = K 2 SO 4 + 2MnSO 4 + 5O 2 + 8H 2 O;
2) в осно»вной среде:
2KMnO 4 + Н 2 О 2 + 2KOH = 2K 2 MnO 4 + O 2 + 2H 2 O
Окислительные свойства пероксида водорода
более сильно проявляются в кислотной среде, а
восстановительные – в щелочной.
1а. Разложение пероксида водорода.
Налейте в пробирку 2–3 мл раствора пероксида
водорода и нагрейте раствор на водяной бане.
Должно начаться выделение газа. (Какого?) Докажите экспериментально, что это именно тот
газ, который вы ожидали получить.
В другую пробирку с раствором пероксида водорода
бросьте крупинку диоксида марганца. Докажите,
что выделяется тот же газ.
Напишите уравнение разложения пероксида
водорода и отдельно уравнения приема и отдачи
электронов. К какому типу относится эта
окислительно-восстановительная реакция?
Рассчитайте ЭДС реакции, если:
Какая из этих двух реакций обладает большей способностью отдавать электроны и ее следует переписать в противоположном направлении? Из значения ЭДС реакции рассчитайте G реакции и константу равновесия.
Сравните результаты с G и константой равновесия, полученными из термодинамических данных:
Результаты ваших расчетов совпали? Если имеется некоторое расхождение в результатах, попытайтесь найти причины.
1б. Обнаружение пероксида водорода.
К разбавленному и подкисленному серной
кислотой раствору (2–3 мл) йодида калия добавьте
несколько капель раствора пероксида водорода.
Раствор окрасится в желто-бурый цвет. При
добавлении в него нескольких капель раствора
крахмала цвет смеси мгновенно становится синим.
Напишите уравнение реакции (образующиеся
вещества вы знаете!) .
Рассчитайте ЭДС реакции, чтобы убедиться, что
реакция возможна (выберите нужную вам реакцию):
1в. Черный сульфид свинца и пероксид водорода.
Старые мастера писали свои картины красками, приготовленными на основе свинцовых белил, в состав которых входил белый основный карбонат 2PbCO 3 Pb(OH) 2 . С течением времени свинцовые белила чернеют, а краски на их основе изменяют свою окраску из-за действия сероводорода, при этом образуется черный сульфид свинца PbS. Если картину осторожно протереть разбавленным раствором пероксида водорода, сульфид свинца переходит в белый сульфат свинца PbSO 4 и картине почти полностью возвращается ее первоначальный вид.
В пробирку налейте 1–2 мл 0,1М раствора нитрата
свинца Pb(NO 3) 2 или ацетата свинца Pb(СН 3 СОО) 2 (продается в аптеке как свинцовая примочка) .
Прилейте немного раствора сероводорода или
сульфида натрия. Слейте раствор с
образовавшегося черного осадка и подействуйте
на него раствором пероксида водорода. Напишите
уравнения реакций.
Все соединения свинца ядовиты!
1г. Приготовление раствора пероксида водорода из гидроперита.
Если вам не удалось достать раствор пероксида водорода, то для лабораторных работ можно пользоваться гидроперитом, таблетки которого можно купить в аптеке.
Гидроперит представляет собой комплексное соединение пероксида водорода с карбамидом (мочевиной) NH 2 CONH 2 H 2 O 2 . При растворении в воде получается раствор пероксида водорода и карбамида NH 2 CONH 2 . Раствор гидроперита используют вместо раствора пероксида водорода как антисептическое средство и при покраске волос.
Для полоскания рта и горла растворяют 1 таблетку в стакане воды (0,25%-й раствор пероксида водорода). Одна таблетка гидроперита весит 1,5 г и соответствует 15 мл
(1 столовой ложке) 3%-го раствора пероксида водорода.
Рассчитайте, сколько таблеток гидроперита
следует растворить в 100 мл воды, чтобы получить
приблизительно 1%-й раствор пероксида водорода.
Какой объем кислорода (н.у.) можно получить из
одной таблетки гидроперита?
Опытным путем определите, сколько миллилитров
кислорода можно получить из одной таблетки
гидроперита. Предложите конструкцию прибора и
соберите его. Объем выделившегося кислорода
приведите к нормальным условиям. Для получения
более точных результатов расчета вы можете
учесть давление пара воды над раствором, которое
при комнатной температуре (20 °С)
приблизительно равно 2300 Па.
Простая наука | Много пены из ничего
Простая наука | Много пены из ничего — химический опыт с перекисью водорода youtube.com/embed/lE7k_PVCWCk?rel=0″ frameborder=»0″ allowfullscreen=»»>Вам также могут понравиться
ВыбратьЧерный сахар или экзотермическая реакция
ВыбратьЗмея из песка
ВыбратьОгненное облако в бутылке — горение паров спирта
ВыбратьУксус и сода надувают воздушный шарик
ВыбратьКровавые руки — химический фокус
- Описание
- Что понадобится
- Ход опыта
Эффектно и зрелищно! В голове рождаются мысли о том, что, наверняка, тут происходят сложные химические реакции, описанные длинными уравнениями, в которые даже не хочется вникать.
Однако, этот опыт всего лишь наглядная демонстрация реакции разложения перекиси водорода (H2O2)
Перекись водорода имеет свойство самопроизвольно разлагаться на воду и кислород из-за слабой связиО-О.
2H2O2 = 2H2O + O2
При разложении одной части 6%-ного раствора перекиси водорода выделяется 20 частей газообразного кислорода. Ничего себе так. Сколько же образовывается кислорода из 50%-ного раствора?! Не будем считать. Много.
Скорость разложения зависит от температуры, концентрации, наличия примесей. Под действием катализаторов (каталитическое разложение) оно происходит быстрее. В этой роли выступают ионы переходных металлов (медь, железо, кобальт и др.) а также некоторые ферменты.
В раствор медного купороса добавим аммиак и получим аммиакат меди, который будет катализатором в нашей реакции разложения.
CuSO4 + 6NH3 + 2H2O = [Cu(NH3)4](OH)2 + (NH4)2SO4
Все готово. Смешиваем жидкое мыло с раствором перекиси водорода, а затем добавляем к смеси катализатор. Реакция разложения запущена.
Смешиваем жидкое мыло с раствором перекиси водорода, а затем добавляем к смеси катализатор. Реакция разложения запущена.
Мыльный раствор не дает кислороду «улететь». Пузырьки выделившегося кислорода обволакиваются слоем молекул мыла и поднимаются на поверхность. Соприкасаясь друг с другом, они образуют ячеистую структуру – пену. Пена получается плотной и долго не оседает из-за низкого содержания воды.
Для пущей зрелищности можно добавить красители перед началом реакции. Но и так неплохо. Гора пены из стаканчика жидкости! Волшебно!
Для эксперимента понадобится
| Реактивы: | ацетат натрия , медный купорос , перекись водорода |
| Посуда: | треугольная колба |
| Расходные материалы: | жидкое мыло , цветы |
Стадии эксперимента
- В колбе смешиваем раствор перекиси водорода и жидкое мыло.

- Аммиак смешиваем с медным купоросом, получая сульфат аммония.
- Доливаем полученный раствор в колбу.
- Наблюдаем бурную реакцию пенообразования.
Похожие опыты
ВыбратьСердце на батарейке — простейший электромотор
ВыбратьЭлектрический ритм — опыт со статикой
ВыбратьДве вилки и спичка — опыт на равновесие
ВыбратьВода течет вверх по салфетке
ВыбратьБумажная крышка и атмосферное давление
ВыбратьТруба Рубенса — опыт со стоячей волной
ВыбратьГрафитовый реостат
ВыбратьРасширение и сжатие воздуха — опыт с жидким азотом
ВыбратьВеселый клей на воде
ВыбратьМыльные пузыри плавают в углекислом газе
Можно отфильтровать опыты по использованным реактивам, посуде, инструментам и так далее.
Каталитическое разложение перекиси водорода йодидом калия
Краткое описание:
При смешивании двух растворов образуется пена, напоминающая огромную струю зубной пасты. Это классическая реакция «Слоновья зубная паста».
Цель/Задача:
Процедура представляет собой пример катализируемой реакции.
Пояснение к эксперименту:
Быстрое выделение газообразного кислорода происходит в результате следующей реакции:
- 2 H 2 O 2 (водн.) = 2 H 2 O (л) + O 2 (г) + тепло
Разложение перекиси водорода в присутствии йодид-иона происходит в две стадии:
- H 2 O 2 (водн.) + I- (водн.) = H 2 + O (0 14 23 O — (водный)
- H 2 O 2 (водн.) + OI- (водн.
 ) = H 2 O (л) + O 2 (г) + I — (водн.)
) = H 2 O (л) + O 2 (г) + I — (водн.)
Подготовка материалов:
- 20 мл 30% перекиси водорода, можно приобрести в учреждениях, поставляющих химикаты
- Йодид калия 2 М – Приготовьте исходный раствор, смешав 33,2 г KI в дистиллированной воде и разбавив до 100 мл
- Средство для мытья посуды – примерно 5 мл
- Пищевой краситель
- Градуированные цилиндры – 500 мл и 10 мл
- Большой сервировочный поднос и резиновые перчатки для уборки
- Отмерьте 20 мл 30% перекиси водорода в мерный цилиндр. Добавьте 5 мл жидкости для мытья посуды и 10 капель пищевого красителя в мерный цилиндр и встряхните, чтобы перемешать содержимое, но не слишком энергично, чтобы избежать образования пены. Отмерьте 5 мл 2 М раствора KI в градуированном цилиндре на 10 мл.
Представление:
Быстро налейте 2 М раствор KI в мерный цилиндр на 500 мл, содержащий перекись водорода плюс мыло, и отойдите в сторону. Образовавшийся кислород взаимодействует с мылом, образуя пенную «змейку», которая быстро заполняет цилиндр и выливается на большой поднос. Поскольку это экзотермическая реакция, из цилиндра может выходить пар. Возможное присутствие коричневого цвета в пене свидетельствует о наличии йода в реакционном сосуде.
Образовавшийся кислород взаимодействует с мылом, образуя пенную «змейку», которая быстро заполняет цилиндр и выливается на большой поднос. Поскольку это экзотермическая реакция, из цилиндра может выходить пар. Возможное присутствие коричневого цвета в пене свидетельствует о наличии йода в реакционном сосуде.
Опасности:
Следует соблюдать осторожность при обращении с 30% перекисью водорода – она сильно разъедает кожу, глаза и дыхательные пути. Не стойте над реакцией – быстро образуется пар и кислород. Йодид калия слабо токсичен. Во время демонстрации следует надевать защитные очки и перчатки.
Утилизация:
Пену и раствор, оставшиеся в цилиндре, можно смыть в канализацию большим количеством воды.
Видео:
Общая концепция:
- Кинетика
Тип реакции:
- Экзотермическая
- Эволюция газа
Основной номер:
- Гросс, Г.
 Р. и др., Демонстрация в день – год химических демонстраций, Flinn Scientific, стр. 55.
Р. и др., Демонстрация в день – год химических демонстраций, Flinn Scientific, стр. 55.
Вторичный номер:
- Summerlin, L.R. и Или, Дж. Л., Химические демонстрации — Справочник для учителей, том. 1 стр.101.
Теги:
Разложение перекиси водорода – Химия, Йоркский университет
Эта страница проекта впервые появилась в выпуске Chemistry Review за сентябрь 1995 года, том 5, номер 1, страница 30.
изучение. Он не предназначен для использования в качестве набора инструкций для практической работы и не содержит списка мер предосторожности. CHEMISTRY REVIEW не несет ответственности за использование Project Page каким-либо образом в качестве набора инструкций.
Каталитическое разложение перекиси водорода открывает ряд возможностей для проектов различной продолжительности и сложности. Это связано с разнообразием катализаторов, которые увеличивают скорость разложения, и методов, которые можно использовать для мониторинга реакции: Использование ферментного катализатора
Во многих живых организмах пероксид водорода является продуктом метаболизма, который необходимо расщеплять, так как в заметных концентрациях он токсичен. Скорость разложения увеличивается внутриклеточным ферментом каталазой.
Скорость разложения увеличивается внутриклеточным ферментом каталазой.
В качестве довольно простого проекта вы можете сравнить эффективность ферментов из разных источников, таких как картофель, сельдерей и печень. Это может привести вас к более тщательному исследованию других факторов, влияющих на активность каталазы, включая, возможно, температуру, рН, концентрацию субстрата и фермента и присутствие ингибиторов фермента.
Такие эксперименты на первый взгляд могут показаться довольно простыми, но когда вы попытаетесь интерпретировать свои результаты, вы столкнетесь с довольно сложными, но очень интересными аспектами химической кинетики и механизмов реакций.
Использование неорганического катализатора
Интересно отметить, что аналогичное увеличение скорости разложения перекиси водорода может быть достигнуто с использованием неорганического катализатора, такого как оксид марганца (IV) или оксид свинца (IV).
Вы можете посмотреть, как такие факторы, как концентрация пероксида, количество катализатора и температура, влияют на скорость разложения. Эксперименты такого рода могут привести вас к возможному механизму реакции и к расчету задействованной энергии активации.
Эксперименты такого рода могут привести вас к возможному механизму реакции и к расчету задействованной энергии активации.
Химия контактных линз
Каталитическое разложение перекиси водорода будет хорошо знакомо некоторым учащимся, так как это неотъемлемая часть одной из систем очистки контактных линз. В этом методе 18 декабря 2008 г. его очищают, а затем оставшийся раствор разлагают с помощью катализатора с платиновым покрытием. Возможно, вам захочется исследовать, как эффективность этого катализатора меняется в различных условиях, и сравнить его с другими катализаторами.
Мониторинг разложения
Существует несколько способов контроля реакции разложения. Вы можете решить проследить за падением концентрации перекиси водорода. Вы можете сделать это, взяв образцы реакционной смеси в разное время и погрузив их в подкисленный раствор йодида калия. Образовавшийся йод можно оттитровать раствором тиосульфата с индикатором крахмала:
2H + + H 2 O 2 + 2I – → I 2 + 2H 2 O
I 2 + 2S 2 O 3 2 — → 2i — + S 4 O 6 2–
of . титрование обеспечивает измерение количества перекиси водорода в реакционной смеси в разное время. В качестве альтернативы вы можете предпочесть измерить объем кислорода, образующегося при разложении перекиси водорода. Это можно сделать, подключив стеклянный газовый шприц к колбе Бюхнера или трубке Хирша.
титрование обеспечивает измерение количества перекиси водорода в реакционной смеси в разное время. В качестве альтернативы вы можете предпочесть измерить объем кислорода, образующегося при разложении перекиси водорода. Это можно сделать, подключив стеклянный газовый шприц к колбе Бюхнера или трубке Хирша.Существует еще один, более новый подход к наблюдению за катализируемой ферментами реакцией, который вы могли бы попробовать. Сначала приготовьте экстракт каталазы. Затем с помощью дырокола для бумаги вырежьте круги из фильтровальной бумаги. Замочите один из этих кругов в экстракте фермента, слейте воду, затем с помощью стеклянной палочки воткните его на дно пробирки с раствором перекиси водорода. Пузырьки кислорода, образующиеся при разложении пероксида, прилипают к кружку фильтровальной бумаги и переносят его на поверхность жидкости. Время, необходимое для этого, дает удивительно точную меру относительной активности фермента в различных условиях.
Советы по проекту
- Экстракт каталазы можно легко получить путем мацерации равных количеств картофеля или другого источника ферментов с водой в кухонном комбайне или блендере.


 Работать желательно
малыми группами (по 2–3 человека). Это уменьшает
время эксперимента, позволяет избежать ошибок и,
самое главное, позволяет вам участвовать в
научном общении, что развивает научную речь.
Работать желательно
малыми группами (по 2–3 человека). Это уменьшает
время эксперимента, позволяет избежать ошибок и,
самое главное, позволяет вам участвовать в
научном общении, что развивает научную речь. Для замедления разложения
пользуются добавками фосфорной, салициловой
кислот и других веществ. Особенно сильно
действуют на пероксид водорода соли железа, меди,
марганца и фермент каталаза.
Для замедления разложения
пользуются добавками фосфорной, салициловой
кислот и других веществ. Особенно сильно
действуют на пероксид водорода соли железа, меди,
марганца и фермент каталаза. Хранят такие растворы в алюминиевых сосудах с
добавкой пирофосфата натрия Na 4 P 2 O 7 .
Концентрированные растворы могут разлагаться со
взрывом. Концентрированный раствор пероксида
водорода на оксидном катализаторе при 700 °С
распадается на пары воды и кислород, который
служит окислителем для топлива в реактивных
двигателях.
Хранят такие растворы в алюминиевых сосудах с
добавкой пирофосфата натрия Na 4 P 2 O 7 .
Концентрированные растворы могут разлагаться со
взрывом. Концентрированный раствор пероксида
водорода на оксидном катализаторе при 700 °С
распадается на пары воды и кислород, который
служит окислителем для топлива в реактивных
двигателях.

 Для полоскания рта и горла
растворяют 1 таблетку в стакане воды (0,25%-й
раствор пероксида водорода). Одна таблетка
гидроперита весит 1,5 г и соответствует 15 мл
Для полоскания рта и горла
растворяют 1 таблетку в стакане воды (0,25%-й
раствор пероксида водорода). Одна таблетка
гидроперита весит 1,5 г и соответствует 15 мл
 ) = H 2 O (л) + O 2 (г) + I — (водн.)
) = H 2 O (л) + O 2 (г) + I — (водн.) Р. и др., Демонстрация в день – год химических демонстраций, Flinn Scientific, стр. 55.
Р. и др., Демонстрация в день – год химических демонстраций, Flinn Scientific, стр. 55.