§25. Практическая работа 5. Получение аммиака и изучение его свойств. (стр. 87-88). Задание №1
§39. Характеристика металлов. (стр. 138-141):
Лабораторный опыт:
39-pod;Подумай, ответь, выполни:
1; 2; 3; 4; 5; 6;Тестовые задания:
1; 2; 3;§40. Нахождение металлов в природе и общие способы их получения. (стр. 142-143):
Подумай, ответь, выполни:
1; 2; 3;§41. Химические свойства металлов. Электрохимический ряд напряжения металлов. (стр. 144-148):
Лабораторный опыт:
1;Подумай, ответь, выполни:
1; 2; 3;§42. Сплавы. (стр. 149-150):
Подумай, ответь, выполни:
1; 2; 3;§43. Щелочные металлы. (стр. 151-155):
Подумай, ответь, выполни:
1; 2; 3; 4; 5; 6;Тестовые задания:
1; 2; 3;§44. Магний. Щелочноземельные металлы. (стр. 156-158):
Подумай, ответь, выполни:
1; 2; 3; 4; 5;Тестовые задания:
1; 2; 3;Лабораторный опыт:
1;Подумай, ответь, выполни:
1; 2; 3; 4; 5;Тестовые задания:
1; 2; 3;Интернет задание:
1;§46. Алюминий. (стр. 164-167):
Тестовые задания:
1; 2; 3; 4;§47. Важнейшие соединения алюминия. (стр. 168-170):
Лабораторный опыт:
1;Подумай, ответь, выполни:
1; 2; 3; 4; 5;§48. Железо. (стр. 171-173):
Подумай, ответь, выполни:
1; 2; 3; 4;Тестовые задания:
1; 2; 3;§49. Соединения железа. (стр. 174-176):
Лабораторный опыт:
1;Подумай, ответь, выполни:
1; 2; 3; 4;Тестовые задания:
1; 2; 3;§50. Практическая работа 7. Решение экспериментальных задач по теме ,,Металлы”. (стр. 177):
gdzplus.me
Параграф §35 Практическая работа №5
§1. Предмет химии. Вещества и их свойства
Лабораторный опыт:
1;Подумай, ответь, выполни:
1; 2; 3; 4; 5;§2. Методы познания в химии
Подумай, ответь, выполни:
1; 2;Тестовые задания:
1; 2;§3. Практическая работа №1
§4. Чистые вещества и смеси
Лабораторный опыт:
1;Подумай, ответь, выполни:
1; 2; 3; 4; 5;§5. Практическая работа №2. Очистка грязной поваренной соли
§6. Физические и химические явления. Химические реакции
Лабораторный опыт:
1; 2;Подумай, ответь, выполни:
1; 2; 3;Тестовые задания:
1; 2;§7. Атомы, молекулы и ионы
Тестовые задания:
1; 2;§8. Вещества молекулярного и немолекулярного строения
Лабораторный опыт:
1;Подумай, ответь, выполни:
Тестовые задания:
1; 2;§9. Простые и сложные вещества
Подумай, ответь, выполни:
1; 2; 3;Тестовые задания:
1; 2; 3;§10. Химические элементы
Лабораторный опыт:
1;Подумай, ответь, выполни:
1; 2; 3;Тестовые задания:
1; 2;§11. Относительная атомная масса химических элементов
Тестовые задания:
1; 2;Подумай, ответь, выполни:
1; 2; 3;§12. Знаки химических элементов
Тестовые задания:
1; 2; 3;Подумай, ответь, выполни:
1; 2; 3; 4;§13. Закон постоянства состава вещества
Подумай, ответь, выполни:
1; 2; 3;§14. Химические формулы. Относительная молекулярная масса
Тестовые задания:
1; 2; 3; 4;§15. Вычисления по химическим формулам. Массовая доля элемента в соединении
Тестовые задания:
1; 2;§16. Валентность химических элементов. Определение валентности элементов по формулам их соединений
Тестовые задания:
1; 2;Подумай, ответь, выполни:
1; 2; 3; 4; 5;§17. Составление химических формул по валентности
Тестовые задания:
1; 2;§18. Атомно-молекулярное учение
Подумай, ответь, выполни:
1; 2; 3;§19. Закон сохранения массы веществ
Тестовые задания:
1; 2;Подумай, ответь, выполни:
1; 2; 3; 4;§20. Химические уравнения
Тестовые задания:
1; 2;Подумай, ответь, выполни:
1; 2; 3; 4; 5; 6;§21. Типы химических реакций
Лабораторный опыт:
1; 2;Подумай, ответь, выполни:
1; 2; 3;gdzplus.me
Химия 9 класс — практическая работа 5 Габриелян, Лысова, ГДЗ, решебник, онлайн
Издательство:
Дрофа
ГДЗ(готовые домашние задания), решебник онлайн по химии за 9 класс авторов Габриелян, Лысова практическая работа 5 — вариант решения практической работы 5
Введение. Общая характеристика химических элементов:
- §1. Характеристика химического элемента на основании его положения в периодической системе Д. И. Менделеева:
1
2
3
4
5
6
7
8
9
10
§2. Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений:
1
2
3
4
§3. Периодический закон и Периодическая система химических элементов Д. И. Менделеева:
1
2
3
4
5
6
7
8
9
10
11
Глава первая. Металлы:
- §4. Век медный, бронзовый, железный:
1
2
3
4
5
6
§5. Положение металлов в Периодической системе Д. И. Менделеева:
1
2
3
§6. Физические свойства металлов:
1
2
3
4
5
§7. Сплавы:
1
2
3
4
§8. Химические свойства металлов:
1
2
3
4
5
6
7
§9. Получение металлов:
1
2
3
4
5
6
§10. Коррозия металлов:
1
2
3
4
5
6
§11. Щелочные металлы:
1
2
3
4
5
§12. Бериллий, магний и щелочноземельные металлы:
1
2
3
4
5
6
7
Глава третья. Неметаллы:
- §15. Неметаллы: атомы и простые вещества. Кислород, озон, воздух:
1
2
3
4
5
6
§16. Химические элементы в клетках живых организмов:
1
2
3
4
5
6
§17. Водород:
1
2
3
4
5
§18. Галогены:
1
2
3
4
5
6
7
§19. Соединения галогенов:
1
2
3
4
§20. Получение галогенов. Биологическое значение и применение галогенов и их соединений:
1
2
3
4
5
6
7
§22. Сера:
1
2
3
4
5
§23. Соединения серы:
1
2
3
4
5
6
7
8
§ 24. Азот:
1
2
3
4
5
§26. Соли аммония:
1
2
3
4
5
§27. Кислородные соединения азота:
1
2
3
4
5
6
7
§28. Фосфор и его соединения:
1
2
3
4
5
6
7
§30. Кислородные соединения углерода:
1
2
3
4
5
6
7
§31. Кремний и его соединения:
1
2
3
4
5
6
Глава пятая. Органическая химия:
- §32. Предмет органической химии:
1
2
3
4
5
6
§33. Предельные углеводороды:
1
2
3
4
5
§34. Непредельные углеводороды. Этан:
1
2
3
§36. Предельные одноосновные карбоновые кислоты. Сложные эфиры:
1
2
3
lab
§38. Аминокислоты и белки:
1
2
3
4
lab
§40. Полимеры:
1
2
3
4
5
Приложения:
- 1. Общая классификация удобрений:
1
2
3
4
5
6
7
2. Химическая мелиорация почв:
1
2
3
4
5
3. Азотные, калийные и фосфорные удобрения:
1
2
3
4
5
6
7
4. Практическая работа «Распознавание минеральных удобрений»:
П.р.
Практические работы:
gdz-five.ru
Химия 9 класс — практическая работа 5 Рудзитис, Фельдман, ГДЗ, решебник, онлайн
Автор:
Рудзитис Г.Е., Фельдман Ф.Г.Издательство:
Просвещение

ГДЗ(готовые домашние задания), решебник онлайн по химии за 9 класс авторов Рудзитис, Фельдман практическая работа 5 — вариант решения практической работы 5
§ 1-3:
§ 4-6:
§ 7-10:
§ 11-12:
- Вопросы:
1
2
3
4
5
§ 13:
§ 14:
- Вопросы:
1
2
3
4
5
§ 15-18:
§ 19-20:
§ 21-23:
§ 24-29:
§ 30-33:
§ 34-38:
§ 39:
§ 40-41:
§ 42:
§ 43-44:
§ 45-47:
§ 48-54:
§ 55-59:
gdz-five.ru
Практическая работа № 5(н). Экспериментальные задачи по теме «Подгруппы азота и углерода»
Задача 1.
Проведите реакции, с помощью которых можно доказать, что выданное вам в закрытых сосудах вещество является:
а) хлоридом аммония;
б) карбонатом натрия;
в) нитратом аммония;
г) нашатырным спиртом;
д) карбонатом кальция;
е) силикатом натрия.
Напишите уравнения проведенных реакций в молекулярном и ионном видах.

Задача 2.
Докажите опытным путем, что сульфат аммония и нитрат аммония нельзя смешивать с известью перед внесением этих удобрений в почву, и объясните почему. Напишите уравнения реакций.
Задача 3.
Докажите опытным путем, что:
а) в состав хлорида аммония входят ионы NH4+ и Cl—;
б) в состав сульфата аммония входят ионы NH4+ и SO42-.
Напишите уравнения проведенных реакций в молекулярном и ионном видах.

Задача 4.
Получите аммиак из следующих солей:
а) хлорида аммония;
б) сульфата аммония;
в) нитрата аммония.
Напишите уравнения проведенных реакций в молекулярном и ионном видах.

Задача 5.
Проведите реакции, которые выражаются сокращенными ионными уравнениями:
Напишите уравнения проведенных реакций в молекулярном и ионном видах.
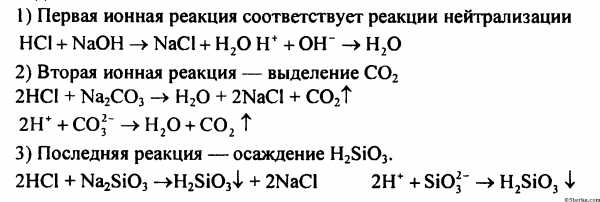
Задача 6.
В четырех пробирках вам выданы кристаллические вещества: сульфат натрия, хлорид цинка, карбонат калия, силикат натрия. Определите, какое вещество находится в каждой пробирке. Составьте уравнения реакций в молекулярном и ионном видах.

5terka.com
Практическая работа № 5 стр. 102 Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов
1) Получение оксида углерода (IV) и определение его свойств
а) Действия: В пробирку кладем несколько кусочков мрамора, добавляем раствор соляной кислоты. Наблюдения: Выделяется газ. Уравнения реакции:Выводы: При действии на мрамор соляной кислотой, она вытесняет из карбоната слабую угольную кислоту, которая затем разлагается на H2O и CO2
б) Действия: Конец газоотводной трубки помещаем в пробирку с известковой водой. Наблюдения: Образуется белый осадок, который растворяется. Уравнения реакции:
Выводы: При пропускании углекислого газа через известковую воду образуется карбонат кальция, который затем растворяется, превращаясь в гидрокарбонат. в) Действия: Пропускаем углекислый газ через дистиллированную воду. Затем добавляем синий лакмус. Наблюдения: Лакмус краснеет. Уравнения реакции:
Выводы: Т.к. синий лакмус краснеет, следовательно, при растворении в воде образуется кислота. г) Действия: Наливаем в пробирку разбавленный
добавляем фенолфталеин и пропускаем углекислый газ. Наблюдения: В растворе щелочи фенолфталеин розовеет, при пропускании углекислого газа — обесцвечивается. Уравнения реакции:
Выводы: Идет реакция между
Это еще раз подтверждает кислотные свойства
2) Распознавание карбонатов.
Даны вещества:а) Действия: Ко всем веществам добавляем соляную кислоту. Наблюдения: В одной из пробирок выделяется газ. Уравнения реакции:
Выводы: В данной пробирке — карбонат калия, это качественная реакция на карбонат-ион. б) Наблюдения: В другой пробирке образ. прозрачный осадок. Уравнения реакции:
Выводы: В данной пробирке — силикат натрия, т.к. происходит образование нерастворимой кремниевой кислоты. в) Действия: Два оставшихся вещества растворяем водой и добавляем раствор хлорида бария. Наблюдения: В одной из пробирок образовался белый осадок. Уравнения реакции:
Выводы: Это качественная реакция на сульфат-ион, значит, в данной пробирке находится сульфат натрия. г) Действия: В оставшийся р-р добавляем р-р нитрата серебра (I). Наблюдения: Образовался белый осадок. Уравнения реакции:
Выводы: Реакция является качественной на хлорид-ион, следовательно, в данной пробирке — хлорид цинка.
5terka.com
ГДЗ по химии для 9 класса О.С. Габриелян
- ГДЗ
- 1 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Информатика
- Природоведение
- Основы здоровья
- Музыка
- Литература
- Окружающий мир
- Человек и мир
- Технология
- 2 Класс
- Математика
- Английский язык
- Русский язык
- Немецкий язык
- Украинский язык
- Информатика
- Природоведение
- Основы здоровья
- Музыка
- Литература
- Окружающий мир
- Технология
- 3 Класс
- Математика
- Английский язык
resheba.me
