Получение, собирание, распознавание газов. (Практическая работа 2)
Похожие презентации:
Сложные эфиры. Жиры
Физические, химические свойства предельных и непредельных карбоновых кислот, получение
Газовая хроматография
Хроматографические методы анализа
Искусственные алмазы
Титриметрические методы анализа
Биохимия гормонов
Антисептики и дезинфицирующие средства. (Лекция 6)
Клиническая фармакология антибактериальных препаратов
Биохимия соединительной ткани
1. Практическая работа № 2 (6). Получение, собирание,распознавание газов
2. В процессе работы заполняем таблицу:
ОпытХод опыта
Наблюдения (рисунок,
уравнения реакций).
Вывод
Опыт
Ход опыта
1) Получение,
собирание и
распознавание
водорода
Собрать прибор для
получения газов. В
пробирку положить
несколько гранул
Zn и прилить 1-2 мл
h3SO4. Закрыть
пробирку
газоотводной
трубкой, собирать
газ в пробирку
дном вверх.

Собранный газ
поджечь лучиной.
Наблюдения (рисунок,
уравнения реакций).
Вывод
Опыт
Ход опыта
1) Получение,
собирание и
распознавание
водорода
Собрать прибор
для получения
газов. В пробирку
положить
несколько гранул
Zn и прилить 1-2
мл h3SO4. Закрыть
пробирку
газоотводной
трубкой, собирать
газ в пробирку
дном вверх.
Собранный газ
поджечь лучиной.
Наблюдения (рисунок, уравнения
реакций).
При
взаимодействии
Zn с h3SO4
выделяются
пузырьки газа:
Zn + h3SO4 →
h3↑ + ZnSO4
При внесении
горящей
лучины
раздается
характерный
хлопок.
Выв
од
Опыт
Ход опыта
2) Получение,
собирание и
распознавание
аммиака.
Собрать прибор для
получения газов. В
пробирку положить
равное количество
Nh5Cl Ca(OH)2,
закрепить в лапке
штатива Закрыть
пробирку
газоотводной
трубкой и нагреть
спиртовкой.

Собирать газ в
пробирку дном
вверх.
Поднести
намоченную
лакмусовую бумажку
к отверстию
пробирки
Наблюдения (рисунок,
уравнения реакций).
Вывод
Опыт
Ход опыта
2) Получение,
собирание и
распознавани
е аммиака.
Собрать прибор
для получения
газов. В пробирку
положить равное
количество Nh5Cl
и Ca(OH)2,
закрепить в лапке
штатива Закрыть
пробирку
газоотводной
трубкой и нагреть
спиртовкой.
Собирать газ в
пробирку дном
вверх.
Поднести
намоченную
лакмусовую
бумажку к
отверстию
пробирки.
Наблюдения (рисунок,
уравнения реакций).
Вывод
Опыт
Ход опыта
2) Получение,
собирание и
распознавание
аммиака.
Собрать прибор для
получения газов. В
пробирку положить
равное количество
Nh5Cl и Ca(OH)2,
закрепить в лапке
штатива Закрыть
пробирку
газоотводной
трубкой и нагреть
спиртовкой.

Собирать газ в
пробирку дном
вверх.
Поднести
намоченную водой
лакмусовую
бумажку к
отверстию
пробирки.
Наблюдения (рисунок,
уравнения реакций).
Взаимодействие Nh5Cl и
Ca(OH)2 можно выразить
уравнением:
2Nh5Cl + Ca(OH)2 →
CaCl2 + 2h3O + 2Nh4↑
При поднесении
влажной лакмусовой
бумажки к отверстию
пробирки, бумажка
синеет.
Вывод
Опыт
Ход опыта
3) Получение,
собирание и
распознавание
кислорода.
Собрать прибор для
получения газов.
Налить раствор
перекиси водорода
в пробирку,
добавить несколько
кристаллов
перманганата
калия, закрыть
газоотводной
трубкой.
Выделяющийся газ
собирать в
пробирку дном
вниз.
В пробирку внести
тлеющую лучинку.
Наблюдения (рисунок,
уравнения реакций).
Вывод
Опыт
Ход опыта
3) Получение,
собирание и
распознавание
кислорода.
Собрать прибор для
получения газов.

Налить раствор
перекиси водорода
в пробирку,
добавить несколько
кристаллов
перманганата
калия, закрыть
газоотводной
трубкой.
Выделяющийся газ
собирать в
пробирку дном
вниз.
В пробирку внести
тлеющую лучинку.
Наблюдения (рисунок,
уравнения реакций).
Из раствора бурно
выделяется кислород.
Реакция идет по уравнению:
При внесении тлеющей
лучинки в пробирку с
кислородом, лучинка
вспыхивает.
Вывод
Опыт
Ход опыта
4) Получение,
собирание и
распознавание
углекислого
газа.
В пробирку
положить небольшое
количество мрамора
CaСO3 и прилить к
нему 1-2 мл h3SO4,
закрепить в лапке
штатива. Закрыть
пробирку
газоотводной
трубкой. Конец
газоотводной трубки
опустить в пробирку
с 2-3 мл известковой
водой Ca(ОН)2.
Наблюдения (рисунок,
уравнения реакций).
Вывод
Опыт
Ход опыта
Наблюдения (рисунок,
уравнения реакций).

4) Получение,
собирание и
распознавание
углекислого
газа.
В пробирку
положить небольшое
количество мрамора
CaСO3 и прилить к
нему 1-2 мл h3SO4,
закрепить в лапке
штатива. Закрыть
пробирку
газоотводной
трубкой. Конец
газоотводной трубки
опустить в пробирку
с 2-3 мл известковой
водой Ca(ОН)2.
В растворе выделяется газ.
Уравнение реакции:
CaСO3 + h3SO4 → CaSO4 + СO2↑
+ h3O
При пропускании газа через
раствор известковой воды
выделяется осадок:
СO2↑ + Ca(ОН)2 → CaСO3↓ +
h3O.
Вывод
12. Домашнее задание:
Оформить работу до конца. Написать всевыводы, сделать общий вывод. Написать
химические свойства углерода.
English Русский Правила
Практическая работа Получение, собирание и распознавание газов
Практическая работа №3 «Получение, собирание и распознавание газов». (9 класс).
Цель:закрепить на практике способы получения, собирания и распознавания газов.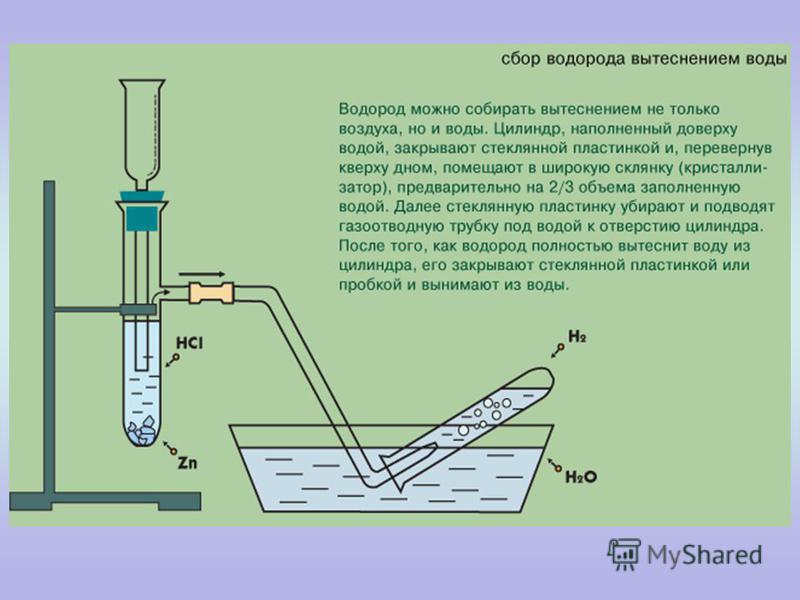
Задачи:повторить правила техники безопасности при проведении химических экспериментов;
на практике получить водород, углекислый газ, кислород, аммиак и изучить их свойства;
воспитание аккуратности.
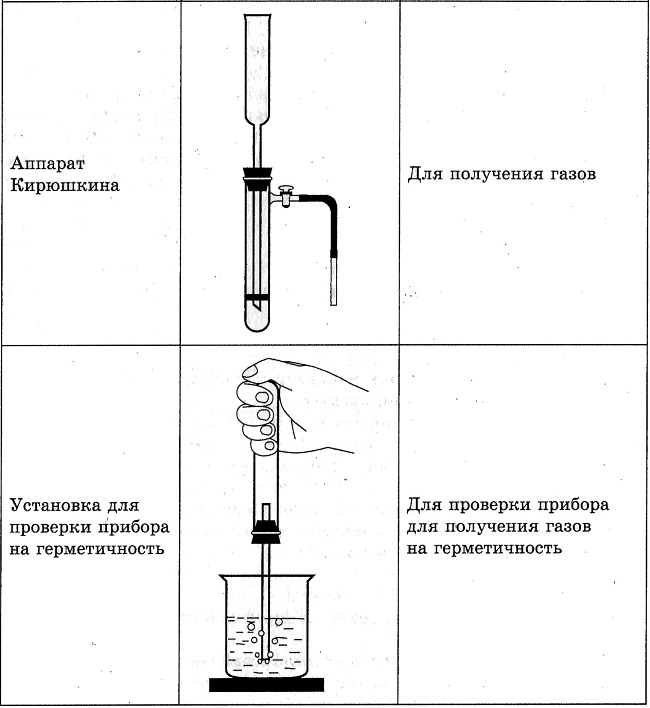
Оборудование:штатив с пробирками, химический стаканчик, штатив лабораторный, прибор Кирюшкина, сухое горючее, универсальная индикаторная бумага, фарфоровая ступка, стеклянная палочка, мокрая вата, лучинка.
Реактивы:гранулы цинка – Zn, соляная кислота – HCl; хлорид аммония — NH4Cl, гидроксид кальция – Са(ОН)2, раствор фенолфталеина; пероксид водорода Н2О2, оксид марганца (IV) – MnO2,
кусочки мрамора или мела – СаСО3, известковая вода – Са(ОН)2.
Ход урока.
Организационный момент.
Вводная часть:
Т. Б. обращение с лабораторным оборудованием; отбор сухих реактивов и растворов; обращение со спиртовкой; правила поведения во время практических занятий.
3. Цель, содержание работы.
4. Выполнение практической работы.
5. Заполнение таблицы.
6. Сбор тетрадей на проверку.
7. Итог урока.
Порядок выполнения работы (заполнение таблицы):
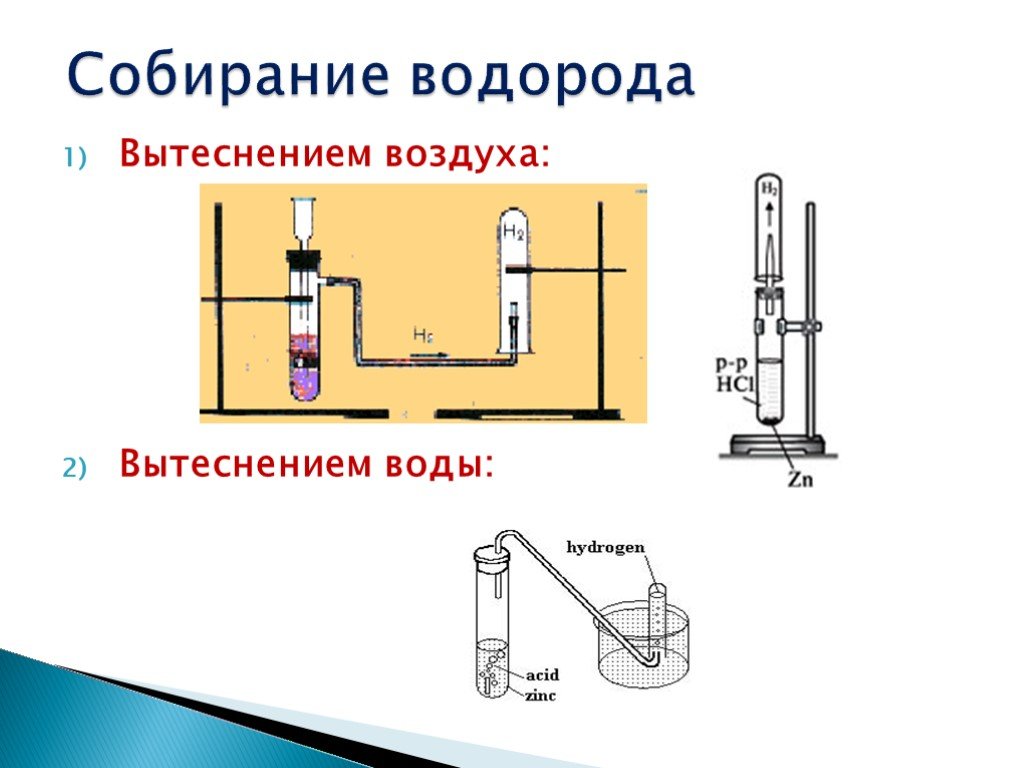
№1. Получение, собирание и распознавание водорода.
Соберите прибор для получения газов и проверьте его на герметичность. В пробирку положите 1-2 гранулы цинка и прилейте в неё 1-2 мл соляной кислоты. Закройте пробирку пробкой с газоотводной трубкой (см. рис. 43 стр. 99 учебника) и наденьте на кончик трубки ещё одну пробирку. Что наблюдаете?
Подождите некоторое время, чтобы пробирка заполнилась выделяющимся газом. Снимите пробирку с водородом и, не переворачивая её, поднесите к горящей спиртовке. Если водород взрывается с глухим хлопком, то он чистый, а если с «лающим» звуком, значит, водород собран в смеси с воздухом («гремучий газ»).
Запишите все наблюдения в таблицу. Составьте уравнение реакции и рассмотрите её с точки зрения процессов окисления-восстановления.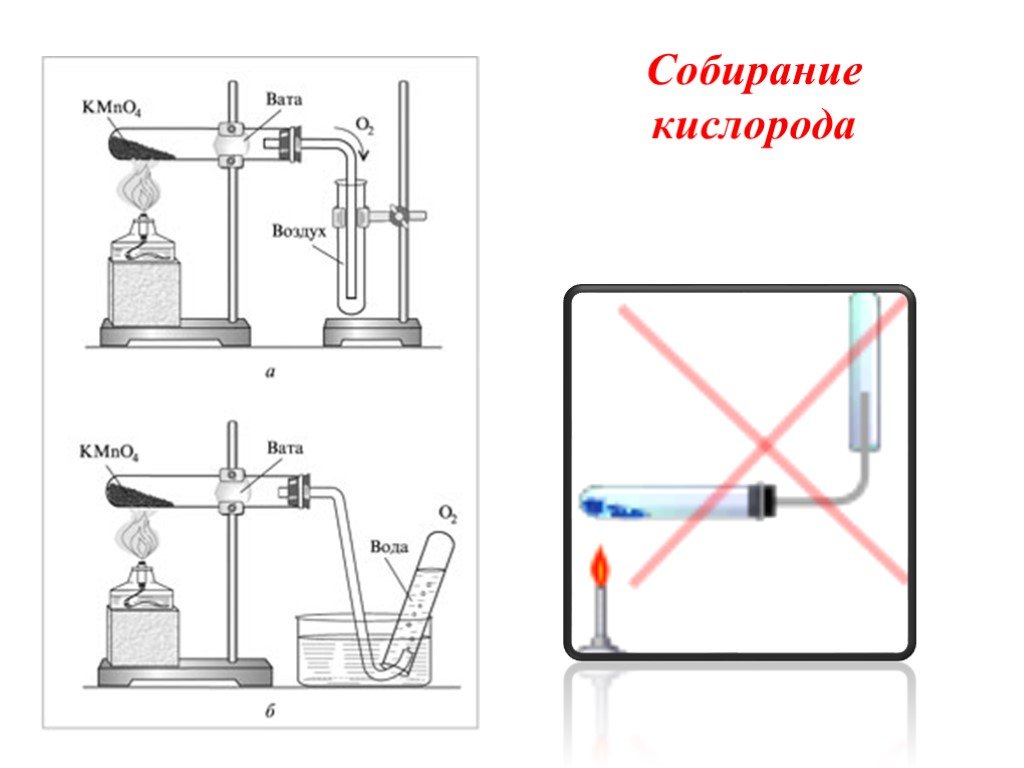
На основе наблюдений при проведении опыта сделайте выводы о физических свойствах водорода и способах его собирания. Опишите, как можно распознать водород.
№2.Получение,собирание и распознавание аммиака.
Соберите прибор для получения газов (см. рис. 113 на стр. 190). Смешайте в фарфоровой ступке по одной ложечке для сжигания веществ хлорида аммония и гидроксида кальция и высыпьте смесь в сухую пробирку. Закройте её пробкой с газоотводной трубкой, направив её конец вверх, и укрепите в лапке штатива (обратите внимание на наклон пробирки относительно отверстия). На газоотводную трубку наденьте пробирку-приёмник.
Нагревайте пробирку с реагирующей смесью. Наполнение приёмной пробирки аммиаком контролируйте по изменению цвета влажной индикаторной бумажки, поднесённой к отверстию пробирки.
Собрав аммиак, прекратите нагревание смеси. Пробирку с аммиаком закройте пальцем или пробкой и опустите в сосуд с водой пробкой вниз. (Конец газоотводной трубки сразу же закройте кусочком мокрой ваты). Откройте пробирку под водой. Что вы наблюдаете? Почему вода поднялась в пробирке. Затем вновь закройте пальцем отверстие пробирки под водой и выньте её из сосуда. Добавьте в пробирку 2-3 капли раствора фенолфталеина. Что наблюдаете?
Откройте пробирку под водой. Что вы наблюдаете? Почему вода поднялась в пробирке. Затем вновь закройте пальцем отверстие пробирки под водой и выньте её из сосуда. Добавьте в пробирку 2-3 капли раствора фенолфталеина. Что наблюдаете?
Все наблюдения запишите в таблицу. Составьте уравнение реакции между хлоридом аммония и гидроксидом кальция, рассмотрите его в молекулярном и ионных видах. На основе наблюдений опишите физические свойства аммиака, способы его собирания. Опишите способы распознавания аммиака.
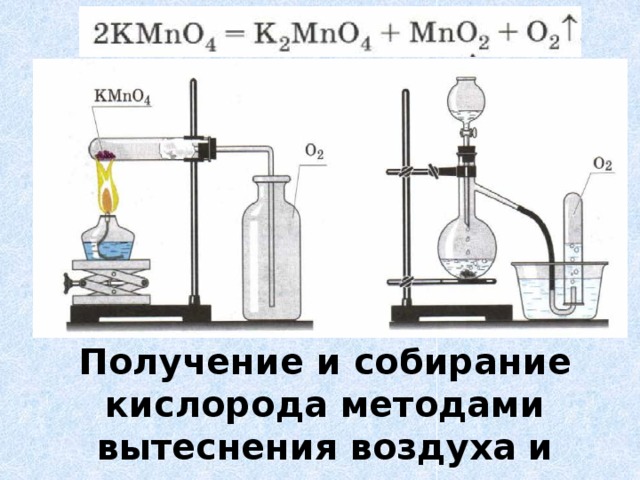
№3. Получение, собирание и распознавание кислорода.
В пробирку насыпьте порошка оксида марганца (IV) и налейте пероксида водорода. Пробирку закройте пробкой с газоотводной трубкой, соединённую с другой пробиркой.
Через некоторое время во вторую пробирку опустите тлеющую лучинку. Что наблюдаете?
Напишите уравнение реакции разложения пероксида водорода. Какую роль выполняет оксид марганца (IV)? Опишите, как распознают кислород.
№4. Получение, собирание и распознавание оксида углерода (IV).
Получение, собирание и распознавание оксида углерода (IV).
Подготовьте заранее две пробирки: одну – с 4-5 мл раствора лакмуса в дистиллированной воде (вода из-под крана не годится!), другую – с 3-4 мл известковой воды с добавлением фенолфталеина.
Соберите прибор для получения газов. В пробирку поместите несколько кусочков мрамора или мела, налейте 2 мл соляной кислоты и закройте пробирку трубкой с газоотводной трубкой. Конец трубки опустите в пробирку с раствором лакмуса так. Чтобы конец газоотводной трубки был ниже уровня раствора. Пропускайте углекислый газ до изменения окраски индикатора на розовую.
Затем погрузите газоотводную трубку в пробирку с известковой водой так, чтобы конец газоотводной трубки был ниже уровня раствора. Пропускайте углекислый газ до изменения окраски раствора и выпадения осадка. Продолжайте пропускать углекислый газ до исчезновения осадка.
Сделайте вывод о способах получения углекислого газа, напишите соответствующее уравнение реакции. Рассмотрите уравнение реакции в молекулярном и ионных видах. На основе своих наблюдений сделайте выводы о физических свойствах углекислого газа. Опишите способы собирания и распознавания углекислого газа.
Рассмотрите уравнение реакции в молекулярном и ионных видах. На основе своих наблюдений сделайте выводы о физических свойствах углекислого газа. Опишите способы собирания и распознавания углекислого газа.
По итогам проведённых опытов заполните таблицу и сделайте выводы.
Исходные вещества | Что делали? Что наблюдали? | Уравнения реакций | Выводы |
№1.Zn, HCl | |||
№2.Ca(OH)2, NH4Cl, вода, фенолфталетн | |||
№3. Н2О2,MnO2 | |||
№4.CaCO3,HCl, раствор лакмуса, известковая вода с фенолфталеином |
Используемая литература:
Учебник для общеобразовательных учреждений «Химия. 9 класс». О.С.Габриелян.
О.С.Габриелян.
Настольная книга учителя. 9 класс. О.С.Габриелян.
Адрес публикации: https://www.prodlenka.org/metodicheskie-razrabotki/267414-prakticheskaja-rabota-poluchenie-sobiranie-i-
4 способа получения газообразного водорода дома или в лаборатории водородный газ. (Wikihow/CC BY-NC-SA 3.0)
Газообразный водород легко получить дома или в лаборатории, используя обычные химические вещества и повседневные материалы. Если у вас есть газ, вы можете использовать его для множества интересных научных проектов. Конечно, вы не «делаете» водород, поскольку это элемент. Он производится химическими реакциями, которые высвобождают его. Вот как безопасно производить водород.
Получение газообразного водорода — метод 1
Электролиз воды (H 2 O) — один из самых простых способов получения газообразного водорода. Электролиз разлагает воду на газообразный водород и газообразный кислород. Таким образом, вы также можете собирать нечистый кислород, используя этот метод.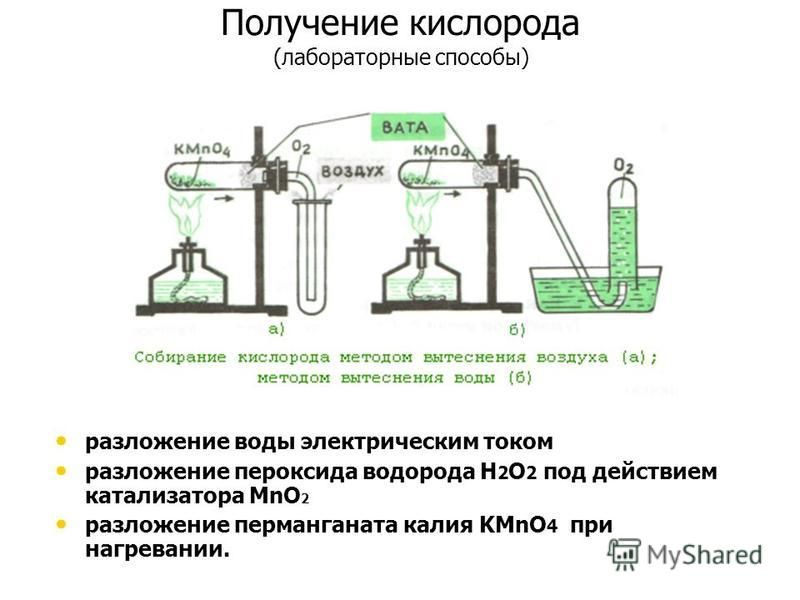
Материалы
Для этого метода необходимы только основные материалы:
- Вода
- 9-вольтовая батарея
- 2 Скрепки (или проволока)
- Контейнер с водой
Процедура
- Разогните скрепки и подсоедините по одной к каждой клемме аккумулятора.
- Поместите другие концы, не соприкасаясь, в емкость с водой. Поздравляем! У вас электроэпиляция.
- Вы увидите пузыри, отрывающиеся от обоих проводов. Тот, у кого больше пузырьков, выделяет чистый водород. Остальные пузырьки — нечистый кислород. Вы можете проверить, какой газ является водородом, поднеся зажженную спичку или зажигалку к контейнеру. Пузырьки водорода сгорят; пузырьки кислорода не будут гореть.
- Как только вы определили источник водорода, вы можете собрать его. Соберите газообразный водород, перевернув заполненную водой трубку или банку над проволокой, производящей газообразный водород. Причина, по которой вам нужна вода в контейнере, заключается в том, что вы можете собирать водород без получения воздуха.
 Воздух содержит 20 % кислорода, поэтому вы должны держать его подальше от контейнера, чтобы он не стал опасно воспламеняющимся. Не собирайте газ, выходящий из обоих проводов, в один и тот же контейнер, так как это смесь водорода и кислорода, которая легко воспламеняется. При желании вы можете использовать вторую емкость с водой для сбора нечистого кислорода.
Воздух содержит 20 % кислорода, поэтому вы должны держать его подальше от контейнера, чтобы он не стал опасно воспламеняющимся. Не собирайте газ, выходящий из обоих проводов, в один и тот же контейнер, так как это смесь водорода и кислорода, которая легко воспламеняется. При желании вы можете использовать вторую емкость с водой для сбора нечистого кислорода. - Отсоедините аккумулятор. Закройте или закройте контейнер с водой и газом, прежде чем перевернуть его вверх дном. Промаркируйте свой контейнер.
Получение газообразного водорода – метод 2
Хотя электролиз является хорошим методом получения водорода, есть два усовершенствования, которые значительно повышают выход. Первый заключается в использовании карандашного «грифеля» (чистого графита) в качестве электродов. Второй совет: добавьте в воду щепотку соли, чтобы она служила электролитом.
Из графита получаются хорошие электроды, поскольку он электрически нейтрален и не растворяется во время электролиза. Соль диссоциирует на свои ионы в воде и увеличивает ток, ускоряя реакцию электролиза.
Соль диссоциирует на свои ионы в воде и увеличивает ток, ускоряя реакцию электролиза.
Материалы
Помимо добавления карандашей и соли, существенным изменением является то, что у вас есть больше вариантов для батареи.
- 2 карандаша
- Соль (хлорид натрия или английская соль)
- Картон
- Вода
- Батарея (может быть до 1,5 В, так как есть электролит)
- 4 5 902 скрепки или электрические провода Емкость с водой
Процедура
- Снимите ластики и металлические колпачки с карандашей и заточите оба конца, чтобы обнажить грифель.
- Добавьте щепотку соли в емкость с водой.
- Используйте картон, чтобы поддерживать карандаши в соленой воде. Поместите картон над емкостью с водой. Вставьте карандаши через картон так, чтобы грифель был погружен в жидкость, но не касался дна или стенок контейнера.
- Прикрепите проволоку к каждому карандашу. Подсоедините каждый провод к клемме аккумулятора.

- Соберите газ, как и раньше, в контейнер, наполненный водой.
Получение газообразного водорода – метод 3
Химические реакции часто выделяют газообразный водород. Одна реакция происходит между цинком и соляной кислотой с образованием хлорида цинка и газообразного водорода:
Zn (т) + 2HCl (ж) → ZnCl 2 (л)+ H 2 (г)
Большинство металлов реагируют с кислотой для высвобождения водорода, поэтому не стесняйтесь заменять железо или алюминий, если они более доступны. Собрать газ немного сложнее из-за кислоты. Рекомендуется проводить эту реакцию в вытяжном шкафу и надевать защитные очки и перчатки. Один из методов заключается в том, чтобы перевернуть стеклянный сосуд с кислотой на металл, чтобы газ вытеснил жидкость. Гораздо безопаснее перевернуть пустую бутыль для сбора над реакцией и позволить водороду вытеснить воздух. Водород легче воздуха и будет подниматься вверх. Бутылка для сбора будет содержать немного воздуха (и кислорода) в конце процесса.
Материалы и методика
- Соляная кислота или соляная кислота
- Гранулы цинка (или полоски алюминиевых или железных опилок)
При смешивании кислоты и металла немедленно образуются пузырьки газообразного водорода. Будьте осторожны, чтобы не прикоснуться к кислоте. Кроме того, ожидайте выделение тепла этой экзотермической реакцией.
Получение газообразного водорода – Метод 4
Сильные основания также энергично реагируют со многими металлами. Гидроксид натрия (NaOH) и гидроксид калия (KOH) содержат водород и выделяют газообразный водород. Например, алюминий и гидроксид натрия реагируют с образованием водорода и алюмината натрия:
2AL (S) + 6NAOH (AQ) → 3H 2 (G) + 2NA 3 ALO 3 (AQ)
Материалы
- Гидроксид SODRXID
- Алюминий (часто входит в состав средств для чистки канализации или вы можете использовать алюминиевую фольгу)
- Вода
Процедура
- Поместите средство для чистки канализации и алюминий в стеклянную посуду.
 Не используйте металл или пластик, потому что очиститель канализации может вступить в реакцию с металлом. Тепло, выделяющееся в результате реакции, может повредить пластик.
Не используйте металл или пластик, потому что очиститель канализации может вступить в реакцию с металлом. Тепло, выделяющееся в результате реакции, может повредить пластик. - Наполните стеклянный контейнер водой, чтобы собрать газообразный водород.
- Переверните контейнер с водой над кучей химикатов и соберите газообразный водород.
Информация о безопасности
- Ознакомьтесь с информацией о безопасности для любых химических веществ, которые вы можете использовать. В частности, соляная кислота (сильная кислота) и гидроксид натрия (сильное основание) являются едкими веществами и могут вызывать химические ожоги. Если вы используете эти химические вещества, обязательно наденьте перчатки, защитные очки и другое защитное снаряжение.
- Храните газообразный водород вдали от открытого огня, тепла и источников воспламенения.
- Имейте в виду, что смешивание газообразного водорода с кислородом или воздухом (который содержит кислород) повышает его воспламеняемость, поскольку кислород является окислителем.

Если вам понравилось производить газообразный водород и вы хотели бы попробовать подобный проект, попробуйте сделать газообразный хлор.
Ссылки
- Фаббри, Эмилиана; Шмидт, Томас Дж. (5 октября 2018 г.). «Реакция выделения кислорода — загадка электролиза воды». АСЦ Катализ . 8 (10): 9765–9774. doi:10.1021/acscatal.8b02712
- Гидди, С.; Кулкарни, А .; Бадвал, С.П.С. (2015). «Производство водорода с низким уровнем выбросов за счет электролиза с использованием углерода». Международный журнал водородной энергетики . 40: 70–74. doi:10.1016/j.ijhydene.2014.11.033
- Практическая физика (2008). «Электролиз воды и концепция заряда». (в архиве)
Химия капусты — Поиск кислот и оснований
Поделиться на Facebook
Поделиться в Twitter
Поделиться на Reddit
Share на LinkedIn
Поделитесь по электронной почте
9
9
Ключевые концепции
Химия
Кислоты
Базы
Свет
Введение
Возможно, в школе вы проводили эксперименты с четко обозначенными кислотами и основаниями, но задумывались ли вы когда-нибудь, является ли определенная пища или химическое вещество в доме кислотой или основанием? Узнать это можно, используя краснокочанную капусту для приготовления индикаторного раствора.
Когда два или более ингредиента полностью растворяются друг в друге, у вас есть решение. Например, при смешивании соли с водой получается прозрачный раствор, несмотря на то, что соль присутствует и раствор имеет соленый вкус. При смешивании с водой то, «отдает» ли химическое вещество заряженную частицу (называемую ионом) раствору — в данном случае ион водорода — или «принимает» его, определяет, является ли раствор кислотным или щелочным. Индикатор меняет цвет при воздействии на такую смесь в зависимости от того, является ли раствор кислым или щелочным.
Фон
Кислоты представляют собой растворы, которые теряют ионы водорода и обычно имеют кислый вкус. Некоторыми очень распространенными бытовыми растворами являются кислоты, такие как соки цитрусовых и домашний уксус. Основания — это растворы, которые вытягивают ионы водорода из раствора на себя, «принимая» их, и обычно кажутся скользкими. Базы имеют множество практических применений. Например, «антациды», такие как TUMS, используются для снижения кислотности в желудке. Из других оснований получаются полезные бытовые чистящие средства.
Из других оснований получаются полезные бытовые чистящие средства.
Чтобы определить, является ли что-то кислотой или основанием, вы можете использовать химическое вещество, называемое индикатором. Индикатор меняет цвет при контакте с кислотой или основанием. Существует множество различных типов индикаторов, некоторые из которых представляют собой жидкости, а другие сосредоточены на маленьких полосках «лакмусовой» бумаги. Индикаторы могут быть извлечены из многих различных источников, включая пигменты многих растений. Например, краснокочанная капуста содержит молекулу индикаторного пигмента, называемую флавином, который представляет собой тип молекулы, называемой антоцианином. Очень кислые растворы окрашивают антоциан в красный цвет, тогда как нейтральные растворы делают его пурпурным, а щелочные растворы окрашивают его в зеленовато-желтый цвет. Следовательно, цвет раствора антоцианина можно использовать для определения pH раствора — меры того, насколько щелочным или кислым является раствор.
Материалы
• Маленькая красная капуста
• Кипящая вода
• Сетчатый фильтр
• Две большие миски или кастрюли
• Измеритель столовых ложек
• Большая ложка (опционально)
• Три или более маленьких белых бумажных стаканчика (также подойдут маленькие белые бумажные стаканы или тарелки)
• Защитные очки или другие защитные очки
• Сок лимона или лайма
• Уксус
• Чистящее средство на основе отбеливателя
• Другие продукты для тестирования, такие как газированная вода, раствор пищевой соды, яичные белки, помидоры, творог (по желанию)
Подготовка
• Натрите небольшую краснокочанную капусту. Если вы не хотите натирать всю капусту, достаточно натереть половину капусты. Положите мелко натертую капусту с мякотью в большую миску или кастрюлю.
• Вскипятите кастрюлю с водой. Будьте осторожны при обращении с кипящей водой. Налейте кипящую воду в миску с мякотью капусты, пока вода не покроет капусту.
Налейте кипящую воду в миску с мякотью капусты, пока вода не покроет капусту.
• Поместите сито над другой большой миской или кастрюлей и вылейте капустную смесь через сито, чтобы удалить капустную мякоть. Надавите на мякоть в сите, например, большой ложкой, чтобы выдавить из мякоти больше жидкости.
• Теперь в миске должна быть только жидкость фиолетового или синего цвета. Это будет ваш индикаторный раствор, который вы будете использовать для проверки pH различных жидкостей.
• Дети должны носить защитные очки или другие защитные очки, а взрослые должны контролировать и соблюдать осторожность при работе с отбеливателем и уксусом, поскольку они могут вызвать раздражение глаз и кожи.
Процедура
• Наполните небольшой белый бумажный стаканчик, стакан для питья или белую тарелку одной столовой ложкой индикаторного раствора капусты.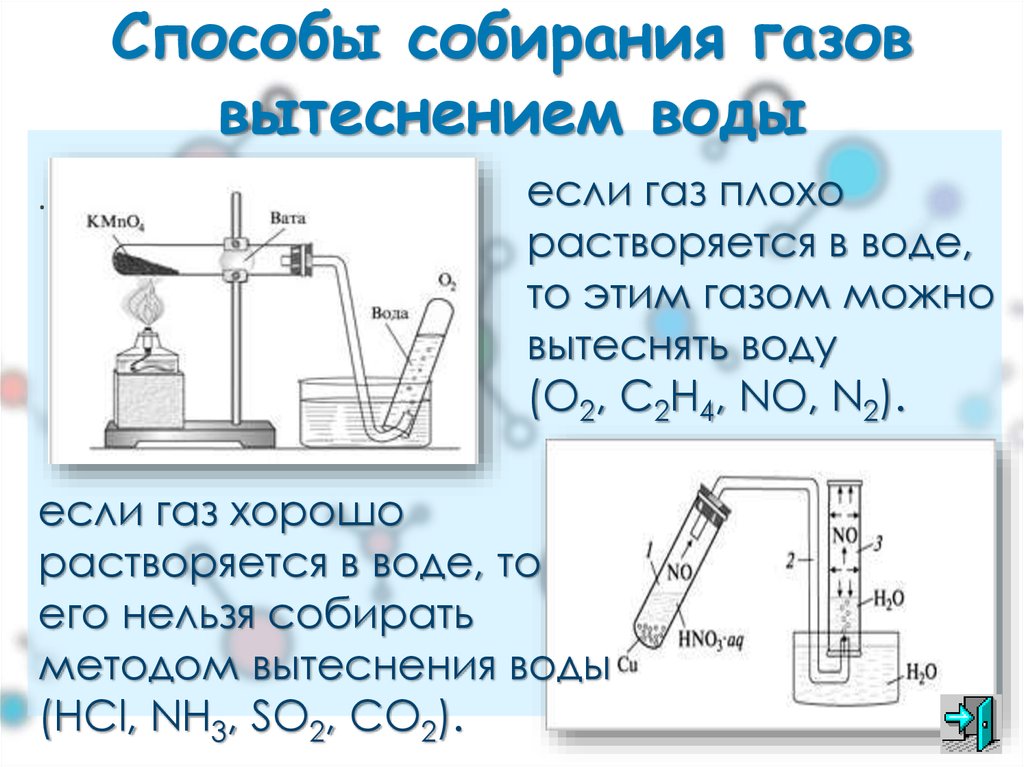
• Добавляйте капли сока лимона или лайма в раствор индикатора, пока не увидите изменение цвета раствора. Аккуратно взболтайте раствор и убедитесь, что цвет остается прежним. Какого цвета стал раствор?
• Цвет раствора будет меняться в зависимости от его pH: красный цвет означает, что pH равен 2; Фиолетовый указывает на рН 4; Фиолетовый указывает на рН 6; Синий указывает на рН 8; Сине-зеленый указывает на рН 10; Зеленовато-желтый указывает на рН 12.
• Каков pH раствора сока лимона или лайма, исходя из его цвета?
• В другой маленький белый бумажный стаканчик добавьте одну столовую ложку исходного раствора индикатора капусты. Добавляйте капли уксуса, пока не увидите, как раствор меняет цвет. Какого цвета стал уксусный раствор? Каков рН раствора?
• В третий маленький белый бумажный стаканчик добавьте одну столовую ложку исходного раствора индикатора капусты. Обращаясь с ним осторожно, добавляйте капли отбеливающего чистящего средства, пока не увидите, что раствор меняет цвет.
 Какого цвета стал раствор хлорной извести и что это говорит о его рН?
Какого цвета стал раствор хлорной извести и что это говорит о его рН? • Если вы хотите проверить pH других продуктов, снова добавьте одну столовую ложку исходного раствора индикатора капусты в небольшой белый бумажный стаканчик и добавляйте продукты по каплям, пока не увидите, что раствор меняет цвет. Если пища не находится в жидкой форме, раздавите ее или растворите в небольшом количестве воды, прежде чем добавлять в раствор индикатора. Какого цвета стал раствор и что это говорит о его рН?
• Дополнительно: Существуют и другие овощи и фрукты, которые также можно использовать для изготовления индикаторов pH: красный лук, кожицу яблок, чернику, кожуру винограда и сливы. Какие различные источники пигмента дают наилучшие показатели?
• Дополнительно: Вы можете использовать индикаторное решение для написания секретных сообщений. Просто используйте сильный лимонный сок, чтобы написать невидимое сообщение на бумаге и дайте сообщению высохнуть.
 Чтобы показать сообщение, нарисуйте капусту-индикатор на бумаге кистью.
Чтобы показать сообщение, нарисуйте капусту-индикатор на бумаге кистью. Наблюдения и результаты
Изменился ли цвет раствора индикатора, когда вы добавили сок лайма или лимона, уксус и отбеливатель? Указывал ли цвет раствора на то, что сок лайма или лимона и уксус были кислыми (имели более низкий pH) и что отбеливатель был щелочным (с более высоким pH)?
Раствор с pH от 5 до 7 является нейтральным, 8 или выше — основанием, а 4 или ниже — кислотой. Сок лайма, лимонный сок и уксус являются кислотами, поэтому они должны окрашивать раствор индикатора в красный или фиолетовый цвет. Отбеливатель является сильным основанием, поэтому он должен был придать раствору индикатора зеленовато-желтый цвет.
Насколько щелочным или кислым является раствор, зависит от количества ионов водорода в нем. Основной раствор принимает ионы водорода (или отдает электронные пары в виде ионов гидроксида), тогда как кислый раствор отдает ионы водорода (или принимает электронные пары).

 Воздух содержит 20 % кислорода, поэтому вы должны держать его подальше от контейнера, чтобы он не стал опасно воспламеняющимся. Не собирайте газ, выходящий из обоих проводов, в один и тот же контейнер, так как это смесь водорода и кислорода, которая легко воспламеняется. При желании вы можете использовать вторую емкость с водой для сбора нечистого кислорода.
Воздух содержит 20 % кислорода, поэтому вы должны держать его подальше от контейнера, чтобы он не стал опасно воспламеняющимся. Не собирайте газ, выходящий из обоих проводов, в один и тот же контейнер, так как это смесь водорода и кислорода, которая легко воспламеняется. При желании вы можете использовать вторую емкость с водой для сбора нечистого кислорода.
 Не используйте металл или пластик, потому что очиститель канализации может вступить в реакцию с металлом. Тепло, выделяющееся в результате реакции, может повредить пластик.
Не используйте металл или пластик, потому что очиститель канализации может вступить в реакцию с металлом. Тепло, выделяющееся в результате реакции, может повредить пластик.