ГДЗ по химии 9 класс Рудзитис, Фельдман решебник с подробными ответами на вопросы
9класс
1глава
Классификация химических реакций. (Страницы с 4 по 19)
§1. Окислительно-восстановительные реакции. (стр. 4-8):
Подумай, ответь, выполни:
1;2;3;4;5;6;
Тестовые задания:
1;2;
§2. Тепловые эффекты химических реакций. (стр. 9-11):
Подумай, ответь, выполни:
1;2;3;4;
§3. Скорость химических реакций. (стр. 12-15):
Подумай, ответь, выполни:
1;2;3;4;
Тестовые задания:
1;2;
§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на ее скорость. (стр. 16-17):
1;
§5. Обратимые реакции. Химическое равновесие. (стр. 17-19):
Подумай, ответь, выполни:
1;2;3;
Тестовые задания:
1;2;3;
2глава
Химические реакции в водных растворах. (Страницы с 20 по 42)
(Страницы с 20 по 42)
§6. Сущность процесса электрической диссоциации. (стр. 20-25):
Подумай, ответь, выполни:
1;2;3;4;
§7. Диссоциация кислот, оснований и солей. (стр. 26-29):
Подумай, ответь, выполни:
1;2;3;
Тестовые задания:
1;2;3;
§8. Слабые и сильные электролиты. Степень диссоциации. (стр. 30-32):
Подумай, ответь, выполни:
1;2;3;4;
Тестовые задания:
1;2;3;
§9. Реакции ионного обмена. (стр. 33-37):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;4;5;6;
Тестовые задания:
1;2;3;
§10. Гидролиз солей. (стр. 38-40):
Подумай, ответь, выполни:
1;2;3;
Тестовые задания:
1;2;
§11. Практическая работа 2. Решение экспериментальных задач по теме” Свойства кислот, оснований и солей как электролитов”. (стр. 41-42):
Практическая работа 2. Решение экспериментальных задач по теме” Свойства кислот, оснований и солей как электролитов”. (стр. 41-42):
1;
3глава
Галогены. (Страницы с 43 по 60)
§12. Характеристика галогенов. (стр. 43-80):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;4;5;
Тестовые задания:
1;2;
§13. Хлор. (стр. 49-53):
Подумай, ответь, выполни:
1;2;3;4;5;6;7;
Тестовые задания:
1;2;3;
§14. Хлороводород: получение и свойства. (стр. 54-55):
Подумай, ответь, выполни:
1;2;3;
§15. Соляная кислота и ее соли. (стр. 56-58):
Подумай, ответь, выполни:
1;2;3;4;5;
Тестовые задания:
1;2;
§16.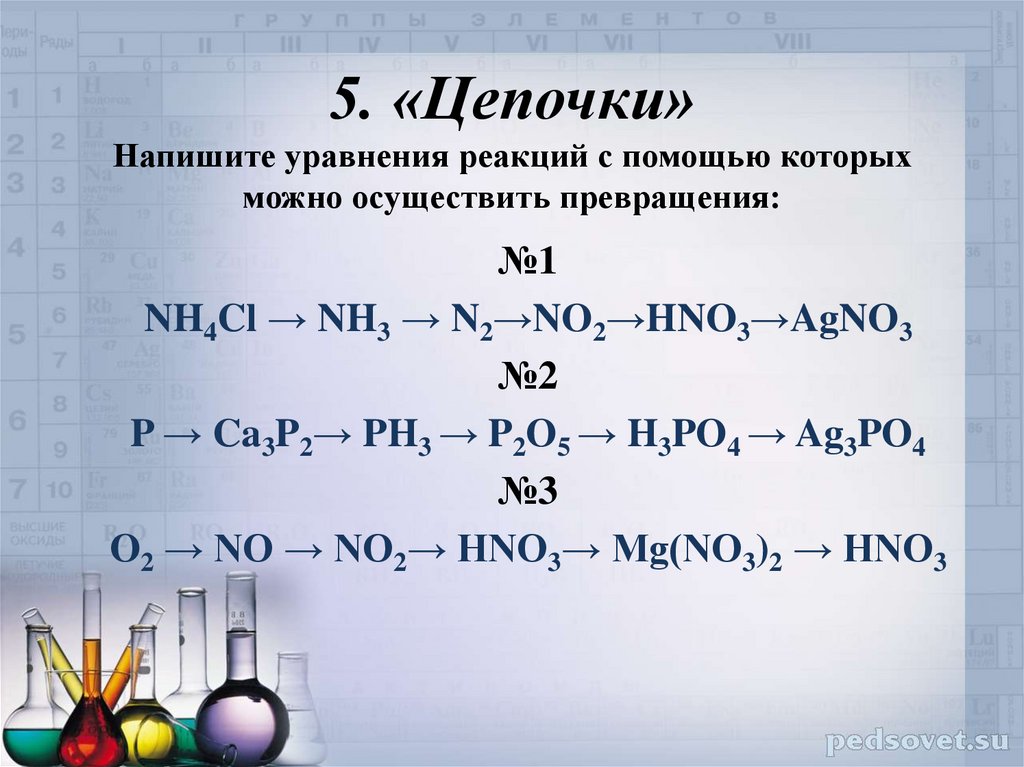 Практическая работа 3. Получение соляной кислоты и изучение ее свойств. (стр. 59-60):
Практическая работа 3. Получение соляной кислоты и изучение ее свойств. (стр. 59-60):
1;
4глава
Кислород и сера. (Страницы с 61 по 79)
§17. Характеристика кислорода и серы. (стр. 61-64):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;4;
Тестовые задания:
1;2;3;
§18. Свойства и применения серы.
(стр. 65-67):Подумай, ответь, выполни:
1;2;3;
Тестовые задания:
1;2;
§19. Сероводород. Сульфиды. (стр. 68-70):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;4;
Тестовые задания:
1;2;
§20. Оксид серы (IV). Сернистая кислота. (стр. 71-73):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;4;
Тестовые задания:
1;2;
§21. Оксид серы (VI). Серная кислота. (стр. 74-78):
Оксид серы (VI). Серная кислота. (стр. 74-78):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
Тестовые задания:
1;2;
§22. Практическая работа 4. Решение экспериментальных задач по теме кислород и сера. (стр. 79):
1;
5глава
Азот и фосфор. (Страницы с 80 по 100)
§23. Характеристика азота и фосфора. Физические и химические свойства азота. (стр. 80-82):
Подумай, ответь, выполни:
1;2;3;
§24. Аммиак. (стр. 83-86):
Подумай, ответь, выполни:
1;2;3;
Тестовые задания:
1;2;
§25. Практическая работа 5. Получение аммиака и изучение его свойств. (стр. 87-88):
1;
§26. Соли аммония. (стр. 89-91):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;4;5;
Тестовые задания:
1;2;
§27. Азотная кислота. (стр. 92-96):
Азотная кислота. (стр. 92-96):
Подумай, ответь, выполни:
1;2;3;4;5;6;7;
Тестовые задания:
1;2;
§28. Соли азотной кислоты. (стр. 97-101):
Подумай, ответь, выполни:
1;2;3;
Интернет задание:
1;
§29. Фосфор. (стр. 102-105):
Подумай, ответь, выполни:
1;2;3;4;
Тестовые задания:
1;2;
§30. Оксид фосфора (IV). Фосфорная кислота и ее соли. (стр. 106-110):
Подумай, ответь, выполни:
1;2;3;4;
6глава
Углерод и кремний. (Страницы с 111 по 137)
§31. Характеристика углерода и кремния. (стр. 111-114):
Подумай, ответь, выполни:
1;2;3;4;
Интернет задание:
1;
§32. Химические свойства углерода. Адсорбция. (стр. 115-117):
Химические свойства углерода. Адсорбция. (стр. 115-117):
Подумай, ответь, выполни:
1;2;3;4;5;6;7;
Тестовые задания:
1;2;
§33. Оксид углерода (II) – угарный газ. (стр. 118-120):
Подумай, ответь, выполни:
1;2;3;
Тестовые задания:
1;2;
§34. Оксид углерода (IV) – углекислый газ. (стр. 121-123):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;4;
§35. Угольная кислота и ее соли. (стр. 124-129):
Лабораторный опыт:
1;Подумай, ответь, выполни:
1;2;3;4;5;6;7;
Тестовые задания:
1;2;
§36. Практическая работа 6. Получение оксида углерода (IV). Распознавание карбонатов. (стр. 130):
(стр. 130):
1;
§37. Кремний. Оксид кремния (IV). (стр. 131-134):
Подумай, ответь, выполни:
1;2;3;
Тестовые задания:
1;2;
§38. Кремниевая кислота и ее соли. Стекло. Цемент. (стр. 135-137):
Подумай, ответь, выполни:
1;2;3;4;5;
7глава
Металлы. (Страницы с 138 по 177)
§39. Характеристика металлов. (стр. 138-141):
Лабораторный опыт:
39-pod;
Подумай, ответь, выполни:
Тестовые задания:
1;2;3;
§40. Нахождение металлов в природе и общие способы их получения. (стр. 142-143):
Подумай, ответь, выполни:
1;2;3;
§41. Химические свойства металлов. Электрохимический ряд напряжения металлов. (стр. 144-148):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;
§42.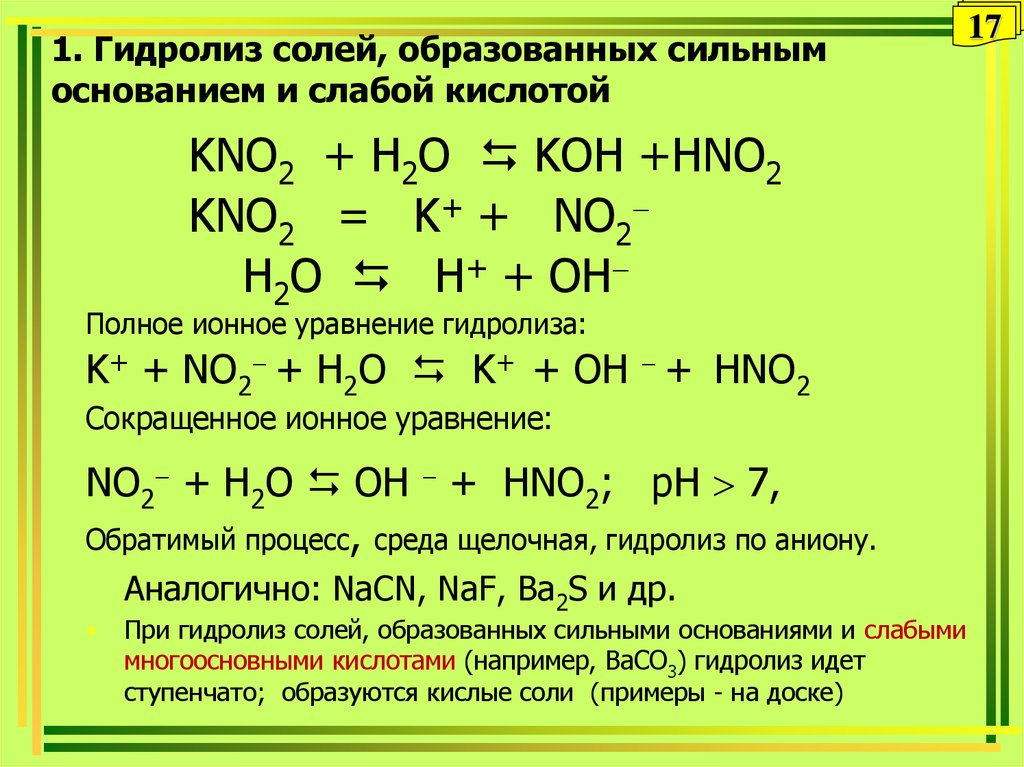 Сплавы. (стр. 149-150):
Сплавы. (стр. 149-150):
Подумай, ответь, выполни:
1;2;3;
§43. Щелочные металлы. (стр. 151-155):
Подумай, ответь, выполни:
1;2;3;4;5;6;
Тестовые задания:
1;2;3;
§44. Магний. Щелочноземельные металлы.
(стр. 156-158):Подумай, ответь, выполни:
1;2;3;4;5;
Тестовые задания:
1;2;3;
§45. Важнейшие соединения кальция. Жесткость воды. (стр. 159-163):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;4;5;
Тестовые задания:
1;2;3;
Интернет задание:
1;
§46. Алюминий. (стр. 164-167):
Подумай, ответь, выполни:
1;2;3;4;5;6;7;8;
Тестовые задания:
1;2;3;4;
§47. Важнейшие соединения алюминия. (стр. 168-170):
Важнейшие соединения алюминия. (стр. 168-170):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
§48. Железо. (стр. 171-173):
Подумай, ответь, выполни:
1;2;3;4;
Тестовые задания:
1;2;3;
§49. Соединения железа. (стр. 174-176):
Лабораторный опыт:
1;
Подумай, ответь, выполни:
1;2;3;4;
Тестовые задания:
1;2;3;
§50. Практическая работа 7. Решение экспериментальных задач по теме ,,Металлы”. (стр. 177):
1;
8глава
Первоначальные представления об органических веществах. (Страницы с 178 по 199)
§51. Органическая химия. (стр. 178-180):
Подумай, ответь, выполни:
1;2;3;4;5;6;
Тестовые задания:
1;2;
§52.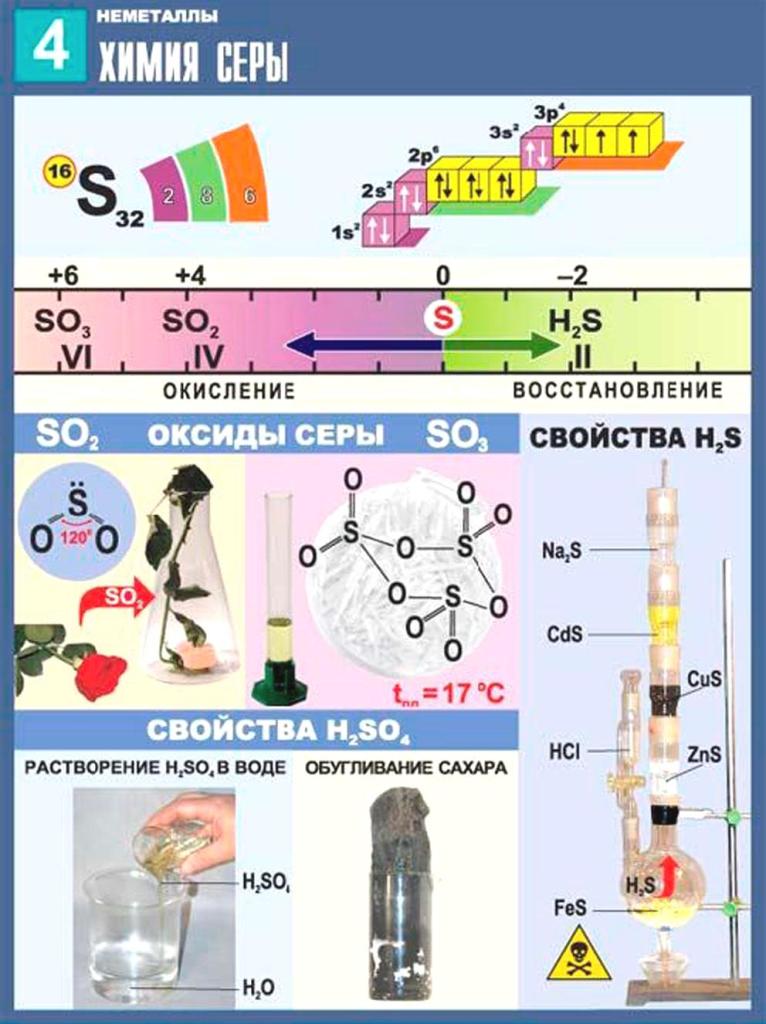 Предельные углеводороды. (стр. 181-183):
Предельные углеводороды. (стр. 181-183):
Подумай, ответь, выполни:
1;2;3;4;
Тестовые задания:
1;2;
Интернет задание:
1;
§53. Непредельные углеводороды. (стр. 184-186):
Подумай, ответь, выполни:
1;2;3;4;5;
§54. Полимеры. (стр. 187-188):
Подумай, ответь, выполни:
1;2;
§55. Производные углеводородов. Спирты. (стр. 189-191):
Подумай, ответь, выполни:
1;2;3;
Тестовые задания:
1;2;
§56. Карбоновые кислоты. Сложные эфиры. Жиры. (стр. 192-195):
Подумай, ответь, выполни:
1;2;3;4;5;6;
Тестовые задания:
1;2;
Интернет задание:
1;
§57. Углеводы. (стр. 196-197):
Углеводы. (стр. 196-197):
Подумай, ответь, выполни:
1;2;3;
§58. Аминокислоты. Белки. (стр. 198-199):
Подумай, ответь, выполни:
1;2;3;4;5;
По мере углубления в химию, как в науку и учебный предмет, современные школьники сталкиваются с более сложными темами. Особенно это становится заметным в процессе изучения теоретического материала и на практических занятиях в старших классах. Ответы к упражнениям из учебника Рудзитиса за 9 класс помогают самостоятельно разбираться с трудными задачами, и всегда находить правильное решение, быстро сделать домашнюю работу, готовиться к контрольным, тестовым заданиям, получать качественные знания во время удаленного обучения.
Общее описание решебника
Последнее издание решебника по химии 9 класс Рудзитиса представляет собой подробное пособие с ответами к задачам в учебнике с пошаговым описанием их решения, и это очень важный нюанс. Рассматривая данные алгоритмы, ребенок не будет бездумно списывать. Он начнет обретать понимание предмета. В дальнейшем сможет справляться с упражнениями или вопросом по теме любой главы или параграфа без помощи преподавателя, и в этом смысле ГДЗ является хорошим подспорьем к учебе в школе.
Он начнет обретать понимание предмета. В дальнейшем сможет справляться с упражнениями или вопросом по теме любой главы или параграфа без помощи преподавателя, и в этом смысле ГДЗ является хорошим подспорьем к учебе в школе.
Усилиями авторов в методичке проработана каждая страница. Особое внимание они уделили основным темам, изучаемым на протяжении учебного года в классе. Таким, к примеру, как окислительные и восстановительные реакции, а также использование органических соединений, классификация химических элементов.
Изучая ГДЗ Рудзитиса, девятиклассники научатся выполнять непростые уравнения. Осваивать в короткий срок много полезного материала, получать необходимые знания в полном объеме.
Польза ГДЗ для родителей и учителей
Так как подобного рода пособия содержат готовые ответы на задания, которые ученики решают на уроках и дома, а значит, могут быть полезны родителям и педагогам. Больше не нужно тратить огромное количество времени, чтобы вникать в ту или иную задачу, решить уравнение, чтобы проверить уровень подготовки сына или дочери.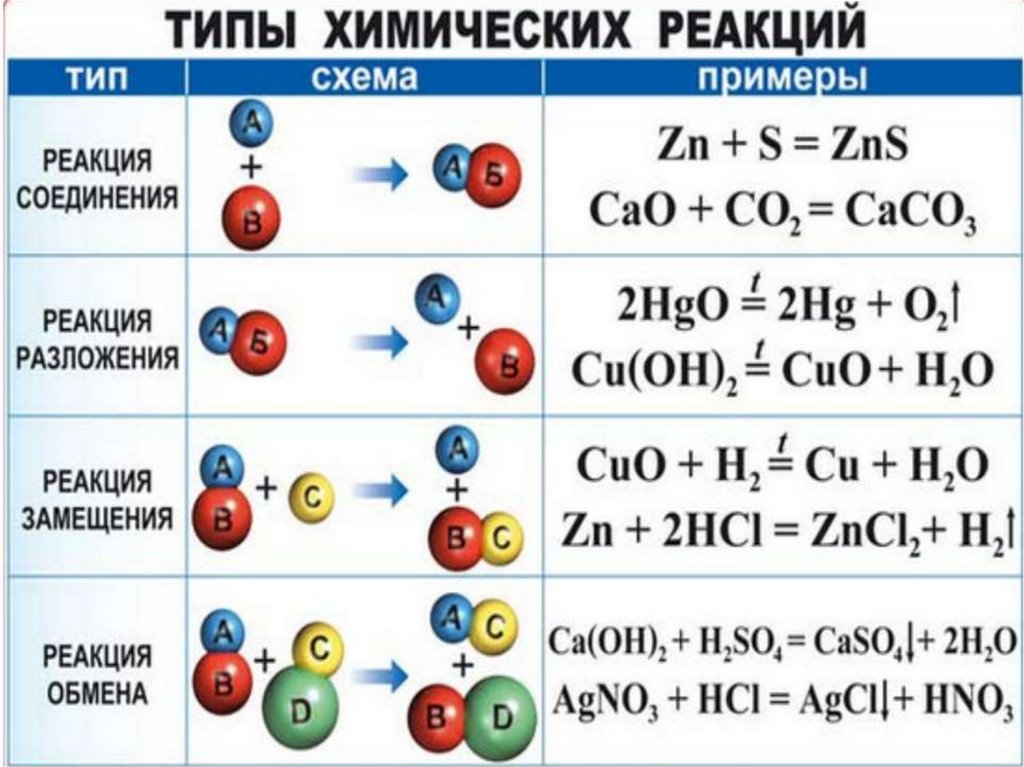
Достаточно скачать ГДЗ по химии 9 класс Рудзитис на ноутбук, декстоптное устройство и пользоваться им по мере необходимости или зайти на сайт онлайн. Таким образом можно осуществлять контроль успеваемости своего ребенка, не углубляясь в содержащуюся в учебниках информацию.
Учителям ГДЗ помогает готовиться к предстоящим занятиям, прорабатывать новые методики обучения, выбирать оптимальные варианты решения уравнений для разбора их на уроке, а так же проверять рабочие тетради. Относительно последнего, можно добавить, что только педагогу известно, сколько доставляет проблем и отнимает времени рутинная работа по проверке письменных контрольных, домашних, тестов, и т.д. Разработанное Гудзитисом Г.Е. и Фельдманом Ф.Г пособие в этом плане, однозначно лучший выход.
Важность науки
Важность этой науки переоценить невозможно. Без знания свойств химических веществ и их соединений сегодня не обходится ни одно производство или промышленность. Будь то газовые, нефтеперерабатывающие комплексы, фармакология или сельское хозяйство.
Предмет обширен и глубок, и что самое главное, важен. Именно по этой причине преподавание его начинается в общеобразовательном учебном заведении, и здесь важно не упустить момент, и вовлечь учащегося в процесс обучения. Увлечь его интересными теориями, теоремами и формулами, при этом дать понять, что при должном старании освоить его не так уж и сложно. Особенно, если это делать с подобными данному решебнику Рудзитиса сборниками, наполненными важной и полезной информацией.
ГДЗ (решебник) по химии 9 класс Рудзитис, Фельдман ответы к учебнику – РЕШАТОР!
§1. Окислительно-восстановительные реакции. (стр. 4-8):
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6;
Тестовые задания:1; 2;
§2. Тепловые эффекты химических реакций. (стр. 9-11):
Подумай, ответь, выполни:1; 2; 3; 4;
§3. Скорость химических реакций. (стр. 12-15):
Подумай, ответь, выполни:1; 2; 3; 4;
Тестовые задания:1; 2;
§4.
 Практическая работа 1. Изучение влияния условий проведения химической реакции на ее скорость. (стр. 16-17):1;
Практическая работа 1. Изучение влияния условий проведения химической реакции на ее скорость. (стр. 16-17):1; §5. Обратимые реакции. Химическое равновесие. (стр. 17-19):
Подумай, ответь, выполни:1; 2; 3;
Тестовые задания:1; 2; 3;
§6. Сущность процесса электрической диссоциации. (стр. 20-25):
Подумай, ответь, выполни:1; 2; 3; 4;
§7. Диссоциация кислот, оснований и солей. (стр. 26-29):
Подумай, ответь, выполни:1; 2; 3;
Тестовые задания:1; 2; 3;
§8. Слабые и сильные электролиты. Степень диссоциации. (стр. 30-32):
Подумай, ответь, выполни:1; 2; 3; 4;
Тестовые задания:1; 2; 3;
§9. Реакции ионного обмена. (стр. 33-37):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6;
Тестовые задания:1; 2; 3;
§10. Гидролиз солей. (стр. 38-40):
Подумай, ответь, выполни:1; 2; 3;
Тестовые задания:1; 2;
§11. Практическая работа 2.
 Решение экспериментальных задач по теме” Свойства кислот, оснований и солей как электролитов”. (стр. 41-42):1;
Решение экспериментальных задач по теме” Свойства кислот, оснований и солей как электролитов”. (стр. 41-42):1; §12. Характеристика галогенов. (стр. 43-80):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4; 5;
Тестовые задания:1; 2;
§13. Хлор. (стр. 49-53):
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6; 7;
Тестовые задания:1; 2; 3;
§14. Хлороводород: получение и свойства. (стр. 54-55):
Подумай, ответь, выполни:1; 2; 3;
§15. Соляная кислота и ее соли. (стр. 56-58):
Подумай, ответь, выполни:1; 2; 3; 4; 5;
Тестовые задания:1; 2;
§16. Практическая работа 3. Получение соляной кислоты и изучение ее свойств. (стр. 59-60):1;
§17. Характеристика кислорода и серы. (стр. 61-64):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4;
Тестовые задания:1; 2; 3;
§18. Свойства и применения серы.
 (стр. 65-67):
(стр. 65-67):Подумай, ответь, выполни:1; 2; 3;
Тестовые задания:1; 2;
§19. Сероводород. Сульфиды. (стр. 68-70):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4;
Тестовые задания:1; 2;
§20. Оксид серы (IV). Сернистая кислота. (стр. 71-73):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4;
Тестовые задания:1; 2;
§21. Оксид серы (VI). Серная кислота. (стр. 74-78):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4; 5;
Тестовые задания:1; 2;
§22. Практическая работа 4. Решение экспериментальных задач по теме кислород и сера. (стр. 79):1;
§23. Характеристика азота и фосфора. Физические и химические свойства азота. (стр. 80-82):
Подумай, ответь, выполни:1; 2; 3;
§24. Аммиак. (стр. 83-86):
Подумай, ответь, выполни:1; 2; 3;
Тестовые задания:1; 2;
§25. Практическая работа 5. Получение аммиака и изучение его свойств.
 (стр. 87-88):1;
(стр. 87-88):1; §26. Соли аммония. (стр. 89-91):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4; 5;
Тестовые задания:1; 2;
§27. Азотная кислота. (стр. 92-96):
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6; 7;
Тестовые задания:1; 2;
§28. Соли азотной кислоты. (стр. 97-101):
Подумай, ответь, выполни:1; 2; 3;
Интернет задание:1;
§29. Фосфор. (стр. 102-105):
Подумай, ответь, выполни:1; 2; 3; 4;
Тестовые задания:1; 2;
§30. Оксид фосфора (IV). Фосфорная кислота и ее соли. (стр. 106-110):
Подумай, ответь, выполни:1; 2; 3; 4;
§31. Характеристика углерода и кремния. (стр. 111-114):
Подумай, ответь, выполни:1; 2; 3; 4;
Интернет задание:1;
§32. Химические свойства углерода. Адсорбция. (стр. 115-117):
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6; 7;
Тестовые задания:1; 2;
§33. Оксид углерода (II) – угарный газ. (стр. 118-120):
Подумай, ответь, выполни:1; 2; 3;
Тестовые задания:1; 2;
§34.
 Оксид углерода (IV) – углекислый газ. (стр. 121-123):
Оксид углерода (IV) – углекислый газ. (стр. 121-123):Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4;
§35. Угольная кислота и ее соли. (стр. 124-129):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6; 7;
Тестовые задания:1; 2;
§36. Практическая работа 6. Получение оксида углерода (IV). Распознавание карбонатов. (стр. 130):1;
§37. Кремний. Оксид кремния (IV). (стр. 131-134):
Подумай, ответь, выполни:1; 2; 3;
Тестовые задания:1; 2;
§38. Кремниевая кислота и ее соли. Стекло. Цемент. (стр. 135-137):
Подумай, ответь, выполни:1; 2; 3; 4; 5;
§39. Характеристика металлов. (стр. 138-141):
Лабораторный опыт:39-pod;
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6;
Тестовые задания:1; 2; 3;
§40. Нахождение металлов в природе и общие способы их получения. (стр. 142-143):
Подумай, ответь, выполни:1; 2; 3;
§41. Химические свойства металлов.
 Электрохимический ряд напряжения металлов. (стр. 144-148):
Электрохимический ряд напряжения металлов. (стр. 144-148):Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3;
§42. Сплавы. (стр. 149-150):
Подумай, ответь, выполни:1; 2; 3;
§43. Щелочные металлы. (стр. 151-155):
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6;
Тестовые задания:1; 2; 3;
§44. Магний. Щелочноземельные металлы. (стр. 156-158):
Подумай, ответь, выполни:1; 2; 3; 4; 5;
Тестовые задания:1; 2; 3;
§45. Важнейшие соединения кальция. Жесткость воды. (стр. 159-163):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4; 5;
Тестовые задания:1; 2; 3;
Интернет задание:1;
§46. Алюминий. (стр. 164-167):
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6; 7; 8;
Тестовые задания:1; 2; 3; 4;
§47. Важнейшие соединения алюминия. (стр. 168-170):
Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4; 5;
§48. Железо. (стр. 171-173):
Подумай, ответь, выполни:1; 2; 3; 4;
Тестовые задания:1; 2; 3;
§49.
 Соединения железа. (стр. 174-176):
Соединения железа. (стр. 174-176):Лабораторный опыт:1;
Подумай, ответь, выполни:1; 2; 3; 4;
Тестовые задания:1; 2; 3;
§50. Практическая работа 7. Решение экспериментальных задач по теме ,,Металлы”. (стр. 177):1;
§51. Органическая химия. (стр. 178-180):
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6;
Тестовые задания:1; 2;
§52. Предельные углеводороды. (стр. 181-183):
Подумай, ответь, выполни:1; 2; 3; 4;
Тестовые задания:1; 2;
Интернет задание:1;
§53. Непредельные углеводороды. (стр. 184-186):
Подумай, ответь, выполни:1; 2; 3; 4; 5;
§54. Полимеры. (стр. 187-188):
Подумай, ответь, выполни:1; 2;
§55. Производные углеводородов. Спирты. (стр. 189-191):
Подумай, ответь, выполни:1; 2; 3;
Тестовые задания:1; 2;
§56. Карбоновые кислоты. Сложные эфиры. Жиры. (стр. 192-195):
Подумай, ответь, выполни:1; 2; 3; 4; 5; 6;
Тестовые задания:1; 2;
Интернет задание:1;
§57.
 Углеводы. (стр. 196-197):
Углеводы. (стр. 196-197):Подумай, ответь, выполни:1; 2; 3;
§58. Аминокислоты. Белки. (стр. 198-199):
Подумай, ответь, выполни:1; 2; 3; 4; 5;
Тесты по химии для 9 класса онлайн
-
Химическая связь. Виды химической связи.
10.11.2017 19794
Тест содержит вопросы по 4-ем видам химической связи, клторые позваляют закремить тему.
-
Окислительно-восстановительная реакция
06.02.2017 19537
Тест содержит вопросы по темам: «Степень окисления», «Окислительная-восстановительная реакция».
-
Понятия: химический элемент и простое вещество.

05.12.2021 114 0
Тест предназначен для обучающихся 8-9 классов с целью отработки понятий — химический элемент и простое вещество
-
Тест по химии «Оксиды»
08.04.2020 15948
Тест по предмету «Химия» на проверку знаний по изученной теме «Основные классы неорганических соединений — ОКСИДЫ»
-
Cтроение атома.Периодический закон и периодическая система Д.И. Менделеева.
18.11.2015 8639
Tест составлен на основе сборника типовых тестов для подготовки к ОГЭ, включает в себя 33 задания уровня «А».

-
Электролитическая диссоциация. Реакции ионного обмена.
08.11.2016 12618
Тест предназначен для проверки знаний по теме электролитическая диссоциация и реакции ионного обмена .Содержит вопросы как по теории так и практические задания.
-
Итоговый тест по теме «Металлы»
08.04.2020 11384
Итоговый тест по разделу «Металлы». Состоит из 16 разноуровневых заданий. Есть вопросы открытого типа, на установление соответствия, решение химических уравнений и задачи.
-
Тест по теме «Галогены».
 Вариант 1
Вариант 1
23.10.2012 19184
Тест из 8-ми вопросов по химии для 9-х классов по теме «Галогены». В конце — правильные ответы.
-
Химия. 8 класс. 1-2.Атомы. Молекулы. Вещества. Строение атома.
09.05.2019 3000
Образовательный тест проверяет усвоенный материал по химии в школе за определённый класс.Вы можете протестироваться,указав верный вариант и другие методы.Тест абсолютно бесплатный и не требует регистрации.Также доступен сертификат при результате выше 70%.Сертификат бесплатный.Его можно скачать в форме JPG или PDF.Доступна статистика теста.Разрешены комментарии.Желаем успехов!
-
Тест по теме «Классы неорганических соединений».
 1 вариант
1 вариант
23.10.2012 8014
Тест из 9-ти вопросов по химии для учеников 9-го класса по теме «Классы неорганических соединений». По окончании теста — правильные ответы.
-
Тест по теме «Галогены». Вариант 2
23.10.2012 9164 0
Тест из 8-ми вопросов по химии для 9-х классов по теме «Галогены». В конце — правильные ответы.
-
химия. 9-10 класс. Органическая и неорганическая химии
23.10.2016 4847 0
тетс предназначен для учащихся 9-10 классов.
 В тест входят органическая и неорганическая химии.
В тест входят органическая и неорганическая химии.
-
Щелочные металлы
01.11.2015 9939
Тест предназначен для проверки усвоения материала по теме «Щелочные металлы»
-
Тест по химии №2
11.01.2013 37985
За последнее время наиболее актуальной становится такая форма проверки знаний, как тесты. Кроме того в учреждениях вводятся ЕГЭ и ГИА.Именно с этой целью я создал тест, чтобы вы проверили свой уровень знаний.
-
Тест 2 Правила безопасной работы в школьной лаборатории.
 Лабораторная посуда и оборудование.
Лабораторная посуда и оборудование.
27.06.2013 1250 0
Тест предназначен для подготовки к ГИА и самоконтроля в 9-х классах.Тема теста «Правила безопасной работы в школьной лаборатории. Лабораторня посуда и оборудование. Разделение смесей м очистка веществ.»
-
Химия 9 класс. Основные положения теории электролитической диссоциации
23.09.2021 420 0
Тест для текущего контроля знаний по теме «Основные положения теории электролитической диссоциации» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химические реакции.
 Обобщение 9 класс.
Обобщение 9 класс.
23.04.2020 5464 0
Тест для 9 класса. Состоит из 10 вопросов разного уровня сложности. Проверяет знания о химических реакциях за курс основной школы.
-
Химия 9 класс. Итоговая работа по химии за курс основной школы
24.05.2020 4022 0
Работа предназначена для проведения итогового контроля знаний по курсу химии в 9 классах общеобразовательных школ.
-
Возникновение и развитие органической химии
14.08.2020 54 0
В тесте представлены вопросу по первому параграфу темы «органическая химия»
-
Химические свойства металлов
01.
 11.2012
18304
11.2012
18304
Мини-тест по теме: «Химические свойства металлов», 1 вариант с ответами.
-
итоговый тест по химии за 9 класс
20.05.2020 1646 0
данный тест предназначен для итоговой проверки знаний за курс химии 9 класса
-
Как хорошо вы знаете гомологи? (15)
14.09.2022 6 0
Химия родная. СИМУЛЯТОР ДИКТАНТА У Т.М.ОТВЕТЫ ПИСАТЬ КАПСОМ — чтобы не было недоразумений на этапе оглашения результатов.
-
Характеристика химического элемента по его положению в ПСХЭ
02.
 09.2012
2266
0
09.2012
2266
0
Тест по теме «Положение химического элемента в ПСХЭ» можно использовать при подготовке к ГИА для отработки вопросов части А № 1,2,4,5
-
Тест 1 Строение молекулы. Химическая связь: ковалентная, ионная, металлическая. Вопрос А3
23.05.2013 4539
Тест предложен из учебно-методического пособия для подготовки к базовому, повышенному и высокому уровню сложностей.
-
Классификация веществ
15.04.2018 833 0
Тест по теме «Классификация неорганических веществ», разработан на основе примерной рабочей программы
-
Химия 9 класс.
 Галогены. Соединения галогенов
Галогены. Соединения галогенов
24.12.2020 1810 0
Тест для текущего контроля знаний по теме «Галогены и их соединения» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия 9 класс. Гидролиз солей
07.10.2021 351 0
Тест для текущего контроля знаний по теме «Гидролиз солей» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Тест по химии по теме «Металлы»
30.08.2015 12718
межпредметные вопросы о металлах по теме «Металлы и биология» можно использовать как на уроке так и при проведении внеклассных мероприятий для повышения интереса учащихся 9 класса к предмету, чтобы мотивировать их к поиску дополнительных сведений по изучаемой теме, развивать таланты, коммуникативные способности и творческое мышление школьников.

-
Растворы. 1 вариант.
04.10.2016 3254 0
Тест позволяет определить уровень знаний по теме растворы: классифмкация диспесных систем, растворимость, истинные растворы, массовая доля вещества в растворе.
-
Химия 9 класс. Практическая работа №6 «Жёсткость воды и способы её устранения»
20.03.2021 207 0
Практическая работа №6 по теме «Жёсткость воды и способы её устранения» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия 9 класс.
 Практическая работа «Экспериментальные задачи по теме — Неметаллы»
Практическая работа «Экспериментальные задачи по теме — Неметаллы»
29.03.2021 406 0
Решение экспериментальных задач по получению и распознаванию соединений неметаллов
-
Хлор. Соединения хлора
07.12.2021 364 0
Тест для проверки знаний учеников 9 класса по теме «Хлор. Соединения хлора»
-
Экологический квест «Мусорное приключение»
18.04.2022 534 0
Отходы существуют ровно столько, сколько существует человечество.
 В древних городах и поселениях уже были специальные места, где оставляли бытовые отходы. В Средние века нечистоты связали с возникновением инфекционных заболеваний, именно потому запретили выливать их на улицы города.
Вплоть до XIX века отходы по большей части представляли только эпидемиологическую опасность. Это были органические вещества и материалы, не загрязняющие окружающую среду. С возникновением промышленности, возникла и проблема мусора. Чем больше разрастались предприятия, тем больше становилось отходов. С началом нефтепереработки ситуация ухудшилась. Теперь возникли отходы, которые и вовсе не разлагаются.
В конце XX века решение проблемы мусора было очень неожиданным. Пластик и другие трудноразлагающиеся предметы попросту вывозились в страны третьего мира. Так в Африке возникли целые регионы, утопающие в мусоре развитых стран. В XXI веке стало понятно, что это не решает проблему, а только усугубляет ее. Сейчас вопрос экологии стал актуальным, как никогда.
В древних городах и поселениях уже были специальные места, где оставляли бытовые отходы. В Средние века нечистоты связали с возникновением инфекционных заболеваний, именно потому запретили выливать их на улицы города.
Вплоть до XIX века отходы по большей части представляли только эпидемиологическую опасность. Это были органические вещества и материалы, не загрязняющие окружающую среду. С возникновением промышленности, возникла и проблема мусора. Чем больше разрастались предприятия, тем больше становилось отходов. С началом нефтепереработки ситуация ухудшилась. Теперь возникли отходы, которые и вовсе не разлагаются.
В конце XX века решение проблемы мусора было очень неожиданным. Пластик и другие трудноразлагающиеся предметы попросту вывозились в страны третьего мира. Так в Африке возникли целые регионы, утопающие в мусоре развитых стран. В XXI веке стало понятно, что это не решает проблему, а только усугубляет ее. Сейчас вопрос экологии стал актуальным, как никогда. -
Сера и её соединения
26.
 08.2012
19411
08.2012
19411
Тест по химии для 9-го класса по теме «Сера и её соединения».
-
Тест по биологии и химии
19.04.2018 1753
Определение знания учащихся 11 класса по биологии и химии
-
Химия 9 класс. Сероводород и сульфиды
23.11.2021 467 0
Тест для текущего контроля знаний по теме «Сероводород и сульфиды» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия 9 класс.
 Общая характеристика металлов
Общая характеристика металлов
12.02.2022 777 0
Тест для текущего контроля знаний по теме «Общая характеристика металлов» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Физические свойства металлов. Вариант 1
27.08.2012 7581
Тест по химии для 9-го класса по теме «Металлы. Физические свойства металлов».
-
Подготовка к ГИА (А1 — А5)
04.10.2012 1630
Тест позволяет проработать вопросы А1 — А5 при подготовке к ГИА по химии
-
Тест по теме «Классы неорганических соединений».
 2 вариант
2 вариант
23.10.2012 2220 0
Тест из 9-ти вопросов по химии для учеников 9-го класса по теме «Классы неорганических соединений». По окончании теста — правильные ответы.
-
химия органическая и неорганическая
03.05.2016 4134
химия 8,9 класс ,органическая,неорганическая,вопросы на любой вкус,10 вопрос. на каждый вопрос один правильный ответ. заходим все и отвечаем.очень интересный тест! всем нравится весело ,интересно,угадывай,разгадывай,отвечай и получай,а также зарабатывай баллы,за прохождения теста на сайте тест пад
-
Химические свойства простых веществ: металлов и неметаллов
18.
 04.2020
1326
04.2020
1326
Результат считается неудовлетворительным, если ученик получил менее 50% от максимально возможной суммы, и отличным — если получено более 90% от максимального числа баллов.
-
Органические вещества
18.05.2020 636 0
Данный тест предназначен для проверки знаний по теме»Введение в органическую химию» (9 класс, базовый уровень), его можно использовать при подготовке к ОГЭ.
-
Общие физические свойства металлов
11.11.2020 960 0
Тест на тему: «Общие физические свойства металлов».
 Химия 9 класс.
Химия 9 класс. -
Силикатная промышленность
30.11.2020 53 0
Предлагаемый тест предназначен, в первую очередь для учащихся 9-го класса, изучающих химию по учебнику О.С.Габриляна. Система знаний построенна в полном соответствии со структурой и логикой изложения материала в учебнике, содержит разнообразные по форме задания двух уровней сложности: тесты, задания со свободно конструируемым ответом, расчетные задачи. Значимая часть заданий построена на основе новых методических идей и не имеет опубликованных аналогов.
-
Неметаллы. Галогены
02.12.2020 433 0
Тестовые задания предназначены для контроля знаний учащихся по теме «Галогены».
 Содержат разные виды заданий: с выбором одного ответа, на установление соответствия, расчетные задачи
Содержат разные виды заданий: с выбором одного ответа, на установление соответствия, расчетные задачи -
Одноатомные и многоатомные спирты
07.12.2020 383 0
Предлагаемый тест предназначен, в первую очередь для учащихся 10-го класса, изучающих химию по учебнику О.С.Габриляна. Система знаний построенна в полном соответствии со структурой и логикой изложения материала в учебнике, содержит разнообразные по форме задания двух уровней сложности: тесты, задания со свободно конструируемым ответом, расчетные задачи. Значимая часть заданий построена на основе новых методических идей и не имеет опубликованных аналогов.
-
Химия 9 класс. Кислородные соединения углерода
03.
 01.2021
290
0
01.2021
290
0
Тест для текущего контроля знаний по теме «Кислородные соединения углерода» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия 9 класс. Химические свойства металлов.
16.02.2021 444 0
ест для текущего контроля знаний по теме «Химические свойства металлов» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия 9 класс. Опыт 2. Практическая работа №7 «Решение экспериментальных задач по теме «Металлы».
23.03.
 2021
86
0
2021
86
0
Практическая работа №7 по теме «Решение экспериментальных задач по теме «Металлы»» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия 9 класс. Опыт 3. Практическая работа №7 «Решение экспериментальных задач по теме «Металлы».
23.03.2021 103 0
Практическая работа №7 по теме «Решение экспериментальных задач по теме «Металлы»» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия 9 класс. Кислородные соединения серы.
28.
 11.2021
114
0
11.2021
114
0
Тест для текущего контроля знаний по теме «Кислородные соединения серы» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия 9 класс. Практическая работа №5 «Получение углекислого газа. Качественная реакция на карбонат-ион»
25.12.2021 512 0
Практическая работа 5 «Получение углекислого газа. Качественная реакция на карбонат-ион» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Физические свойства металлов. Вариант 2
27.
 08.2012
1890
08.2012
1890
Тест по химии для 9-го класса по теме «Металлы. Физические свойства металлов».
-
Тест по химии для 9-го класса
23.10.2012 3396 0
Тест по химии для учеников 9-го класса. По окончании теста — правильные ответы.
-
Металлы главных подгрупп ПСХЭ
04.10.2014 2280
Тест позволит проверить знания о металлах главных подгрупп:особенностях строения атомов, свойствах и нахождении в природе, а также умения составлять химические реакции и решать задачи.
-
Металлы и русский язык
30.
 08.2015
333
0
08.2015
333
0
Занимательный тест, который можно использовать как на уроке для переключения внимания, так и для внеклассных мероприятий, предметных недель.
-
Химия. Вариант из ОГЭ (9 класс)
02.01.2016 21871
Данный тест создан для возможности подготовки к экзамену по химии. В тесте 9 вопросов, предоставленных книгой Корощенко и др. Я надеюсь, что вам удастся хорошо написать этот тест и экзамены. Удачи
-
Проверка знаний по химии в 9 классе
16.03.2016 930 0
Тест может быть применен как в индивидуальном, так и в групповом исполнении.
 Но в отличие от группового в индивидуальном исследовании используется еще один важный прием: просят прочесть вслух написанные ответы.
Но в отличие от группового в индивидуальном исследовании используется еще один важный прием: просят прочесть вслух написанные ответы. -
Растворы. 2 вариант.
04.10.2016 621 0
Тест предназначен для проверки уровня знаний по теме: «Растворы. Массовая доля вещества в растворе».
-
Растворы. 3 вариант.
04.10.2016 636 0
Тест предназначен для проверки знаний по теме :»Растворы. Массовая доля вещества в растворе».
-
химия 9-10 класс
13.
 12.2016
785
12.2016
785
В этом тесте вы можете проверить свои знания в сфере алканов. Тест состоит из 11 вопросов. Удачи!
-
Неметаллы. Свойства.
03.03.2017 7603 0
Тест включает ряд вопросов по теме: «Неметаллы» на свойства и строение.
-
Итоговый тест. 9 класс.
14.05.2018 6303 0
Цель работы: Выявить сформированность базовых умений по химии на второй ступени общего образования. Каждое задание направлено на диагностику определенного умения. Задания считаются выполненными при отсутствии ошибок.

-
ОГЭ 2019 Химия Демонстрационный вариант
23.10.2018 2073
При ознакомлении с демонстрационным вариантом КИМ 2019 г. следует иметь в виду, что задания, в него включённые, не отражают всех элементов содержания, которые будут проверяться с помощью вариантов КИМ в 2019 г. Демонстрационный вариант предназначен для того, чтобы дать возможность любому участнику экзамена и широкой общественности составить представление о структуре экзаменационной работы, числе и форме заданий, а также об их уровне сложности.
-
Химия 9 класс
15.01.2019 3696
Данный тест предназначен для определения знания предмета «Химия» за курс 9 класса.

-
Кислоты неорганический и органический 9 класс
25.05.2019 203
Вы должны ответить на вопрос
-
Жанылмырза Жаныбаевна
19.02.2020 136 0
Азо́т (N, лат. nitrogenium) — химический элемент 15-й группы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе V группы, или к группе VA), второго периода периодической системы с атомным номером 7.Относится к пниктогенам.
 Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха.Один из самых распространённых элементов на Земле.Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов.Основной компонент воздуха (78 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака).Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент.Азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот
Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха.Один из самых распространённых элементов на Земле.Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов.Основной компонент воздуха (78 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака).Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент.Азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот -
ОГЭ (Практическая чать задание №23)
20.03.2020 1 0
Задание для тренировки по практической части в ОГЭ по химии.
-
ОГЭ химические свойства простых веществ
23.
 03.2020
7
0
03.2020
7
0
В заданиях отображены химические свойства металлов и неметаллов, тест можно использовать для обобщения и повторения материала и для подготовке к ОГЭ по химии.
-
Урок по теме «Фосфор и его соединения» 9 класс
06.04.2020 701 0
Сегодня на уроке мы вспомним особенности строения и свойств атомов фосфора, повторим аллотропные модификации фосфора и сравним их свойства, изучим свойства фосфора и его соединений, а также рассмотрим биологическое значение фосфора.
-
Обобщение и систематизация знаний по теме «Металлы» 9 класс
08.
 04.2020
5731
0
04.2020
5731
0
В ходе теста материал по теме «Металлы» закрепляется и систематизируется
-
Урок по теме»Углерод» 9 класс
08.04.2020 3445
Сегодня на уроке мы вспомним особенности строения и свойств атомов углерода, повторим аллотропные модификации углерода и сравним их свойства, рассмотрим химические свойства,а также биологическую роль углерода.
-
Фосфор и его соединения. 9 класс
10.04.2020 3941 0
Тест содержит вопросы по теме «Фосфор. Соединения фосфора».
 Тест направлен на знания о строении атома фосфора, химических свойствах фосфора, как простого вещества, так и его соединений. Содержит вопросы на знание его биологической роли и применения.
Тест направлен на знания о строении атома фосфора, химических свойствах фосфора, как простого вещества, так и его соединений. Содержит вопросы на знание его биологической роли и применения. -
Углерод и его соединения
14.04.2020 2346 0
Результат считается неудовлетворительным, если ученик получил менее 50% от максимально возможной суммы, и отличным — если получено более 90% от максимального числа баллов.
-
Урок по теме «Кислородные соединения углерода», 9 класс
15.04.2020 446 0
Уважаемые ребята, сегодня на уроке мы повторим свойства и получение оксида углерода (IV).
 Изучим свойства угольной кислоты и её солей. Рассмотрим взаимопревращения солей.
Изучим свойства угольной кислоты и её солей. Рассмотрим взаимопревращения солей. -
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева
15.04.2020 1222 0
Результат считается неудовлетворительным, если ученик получил менее 50% от максимально возможной суммы, и отличным — если получено более 90% от максимального числа баллов.
-
Углерод и его соединения
19.04.2020 1584
Данный тест составлен на основе темы «Углерод и его соединения», в тесте задания направлены на знание положения С в ПСХЭ Д.
 И, Менделлева, его физических свойств, а также химических свойств углерода и его соединений.
И, Менделлева, его физических свойств, а также химических свойств углерода и его соединений. -
Обобщение знаний по теме «Вещества»
21.04.2020 2023 0
Тест для 9 класса по химии. Проводится для обобщения и закрепления материала по теме «Вещества» за курс основной школы.
-
Урок по теме «Кремний и его соединения»
22.04.2020 2170 0
Уважаемые ребята, сегодня на уроке мы рассмотрим особенности строения, свойства и применение кремния и его соединений: оксида кремния (IV), кремниевую кислоту, силикаты.
-
Карбоновые кислоты.
 Сложные эфиры. Жиры.
Сложные эфиры. Жиры.
29.04.2020 1404 0
Тест предназначен для обучающихся 9 общеобразовательных классов сельских школ при дистанционном обучении.
-
Химия.9 класс. Первоначальные понятия об органических веществах. 2021
02.05.2020 674 0
Тест предназначен для проверки уровня знаний учащихся 9 класса по теме «Первоначальные понятия об органических веществах»
-
Итоговый тест за курс основной школы по химии
04.05.2020 8414 0
Итоговый тест за курс основной школы по химии.
 Содержит 32 вопроса разного уровня сложности.
Содержит 32 вопроса разного уровня сложности. -
Химический квиз
07.05.2020 285 0
Пространство химии огромно и волшебно: все состоит из вещества, и значит всё — химия. Химия может накормить,одеть, обуть, обеспечить урожай, дать крышу над головой, продезинфицировать, спасти, вылечить — проще сказать, где нет химии! Или нет, не проще — химия во всем, химия везде, химия — это жизнь! Пройди тест от Центра опережающей профессиональной подготовки Кузбасса, составленный совместно со специалистами химического гиганта КАО «Азот» — крупнейшим в Сибири производителем удобрений.
-
Классификация химических реакций
10.
 05.2020
177
0
05.2020
177
0
Данный тест предназначен для проверки темы»Классификация химических реакций»
-
Тест по теме: Углерод и кремний
11.05.2020 491 0
Тест для повторения по теме: Углерод и кремний, строение атома, строение вещества, свойства и получение.
-
Урок по теме «Классификация и свойства оксидов», 9 класс
13.05.2020 406 0
Уважаемые ребята, сегодня на уроке мы повторим состав и классификацию оксидов, рассмотрим свойства солеобразующих оксидов.
-
химия и жизнь
16.
 05.2020
585
0
05.2020
585
0
Тест предназначен для проверки знаний по теме «Химия и жизнь», проверяет знания по бытовой химической грамотности.Может быть использован для подготовки к ОГЭ.
-
Строение атома. ПСХЭ.
26.08.2020 704 0
Тест позволит проверить знания по теме «Строение атома и Периодическая система химических элементов». Во время выполнения теста не рекомендуется поьзоваться дополнительными материалами, кроме Периодической системы химических элементов.
-
Положение металлов в Периодической системе Д.И.Менделеева, строение атомов. Металлическая связь. Физические свойства металлов.

11.11.2020 396 0
Тема: Положение металлов в Периодической системе Д.И. Менделеева, строение атомов. Металлическая связь, металлическая кристаллическая решетка. Физические свойства металлов.
-
9 класс. Положение металлов в ПСХЭ Д.И. Менделеева. Физические свойства металлов.
17.11.2020 755 0
Образовательный тест направлен на закрепление знаний по данной теме
-
Алюминий и его соединения
18.11.2020 1265 0
Предлагаемый тест предназначен, в первую очередь для учащихся 9-го класса, изучающих химию по учебнику О.
 С.Габриляна. Система знаний построенна в полном соответствии со структурой и логикой изложения материала в учебнике, содержит разнообразные по форме задания двух уровней сложности: тесты, задания со свободно конструируемым ответом, расчетные задачи. Значимая часть заданий построена на основе новых методических идей и не имеет опубликованных аналогов.
С.Габриляна. Система знаний построенна в полном соответствии со структурой и логикой изложения материала в учебнике, содержит разнообразные по форме задания двух уровней сложности: тесты, задания со свободно конструируемым ответом, расчетные задачи. Значимая часть заданий построена на основе новых методических идей и не имеет опубликованных аналогов. -
Контрольная работа № 2
23.11.2020 36 0
Предлагаемый тест предназначен, в первую очередь для учащихся 9-го класса, изучающих химию по учебнику О.С.Габриляна. Система знаний построенна в полном соответствии со структурой и логикой изложения материала в учебнике, содержит разнообразные по форме задания двух уровней сложности: тесты, задания со свободно конструируемым ответом, расчетные задачи. Значимая часть заданий построена на основе новых методических идей и не имеет опубликованных аналогов.

-
Перегонка нефти
23.11.2020 23 0
Предлагаемый тест предназначен, в первую очередь для учащихся 10-го класса, изучающих химию по учебнику О.С.Габриляна. Система знаний построенна в полном соответствии со структурой и логикой изложения материала в учебнике, содержит разнообразные по форме задания двух уровней сложности: тесты, задания со свободно конструируемым ответом, расчетные задачи. Значимая часть заданий построена на основе новых методических идей и не имеет опубликованных аналогов.
-
9 класс. Химические свойства металлов
24.11.2020 1681 0
Тест направлен на выявления уровня знаний обучающихся по данной теме.
 Подходит для тренировки к подготовке к экзамену по химии
Подходит для тренировки к подготовке к экзамену по химии -
СОР №2 Раздел II.2В Окисление и восстановление
24.11.2020 12 0
Суммативное оценивание за раздел включает 10 вопросов различного уровня сложности. Количество баллов за СОР №2 12 баллов.
-
ПРОВЕРОЧНАЯ РАБОТА ПО ТЕМЕ: «ВЕРОЯТНОСТЬ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ»
26.11.2020 1 0
Вопросы теста предусматривают проверку знаний по теме «Вероятность протекания химических реакций»
-
Контрольная работа по химии 9 класс на тему :» Химические реакции в водных растворах)
27.
 11.2020
251
11.2020
251
Контрольная работа по химии 9 класс на тему: «Химические реакции в водных растворах» предназначена для контроля уровня знаний учащихся по данной теме. Влючает в себя 14 вопросов.
-
Химия 9 класс. Контрольная работа №3 по теме «Металлы»
30.11.2020 2803 0
Контрольная работа по теме «Металлы» к учебнику О.С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
-
Химия 9 класс. Азот и его свойства
01.12.2020 3738 0
Тест для текущего контроля знаний по теме «Азот» к учебнику О.
 С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
ГДЗ по Химии для 9 класса Усманова М.Б., Сакарьянова К.Н., Сахариева Б.Н. на 5
ГДЗ по Химии для 9 класса Усманова М.Б., Сакарьянова К.Н., Сахариева Б.Н. на 5Часто ищут
- Русский язык 9 класс
- Авторы: Рыбченкова Л.М., Александрова О.М., Загоровская О.В.
- Издательство: Просвещение 2015
- Английский язык 9 класс Книга для чтения Углубленный уровень
- Авторы: Афанасьева О.
 В., Михеева И.В.
В., Михеева И.В. - Издательство: Просвещение 2016
- Английский язык 9 класс Happy English
- Авторы: К.И. Кауфман, М.Ю. Кауфман
- Издательство: Титул 2015
- Английский язык 9 класс Рабочая тетрадь Новый курс
- Авторы: Афанасьева О.
 В., Михеева И.В.
В., Михеева И.В. - Издательство: Дрофа 2017
- Русский язык 9 класс Рабочая тетрадь Академический школьный учебник
- Авторы: Загоровская О.В., Чаплыгина Э.Н
- Издательство: Просвещение 2014
- Английский язык 9 класс Рабочая тетрадь Spotlight
- Авторы: В.
 Эванс, Д. Дули, О. Подоляко, Ю.Е. Ваулина
Эванс, Д. Дули, О. Подоляко, Ю.Е. Ваулина - Издательство: Просвещение 2016
- География 9 класс
- Авторы: В.П. Дронов, И.И. Баринова, В.Я. Ром, А.А. Лобжанидзе
- Издательство: Дрофа 2015
- Английский язык 9 класс New Millennium
- Авторы: Гроза О.
 Л., Дворецкая О.Б.
Л., Дворецкая О.Б. - Издательство: Титул 2015
- Английский язык 9 класс Spotlight
- Авторы: В. Эванс, Д. Дули, О. Подоляко, Ю.Е. Ваулина
- Издательство: Просвещение 2015
Репетиторы по химии для школьников 9 класса в Санкт-Петербурге
4301
Популярные категории репетиторов химии: Подготовка к ЕГЭ Подготовка к ОГЭ (ГИА) Школьный курс Репетиторы на дом
Найдено 4301 репетитор
Сбросить фильтры
Вероника Аркадьевна
Преподаватель вуза Стаж 6 лет
от 2 000 руб / час
свободенЛина Фуатовна
Частный преподаватель Стаж 13 лет
от 3 500 руб / час
свободенАнатолий Алексеевич
Школьный преподаватель Стаж 26 лет
от 500 руб / час
свободенСергей Евгеньевич
Частный преподаватель Стаж 4 года
от 1 500 руб / час
свободенДмитрий Владимирович
Частный преподаватель Стаж 8 лет
У репетитора есть видеопрезентация смотреть видеопрезентация
от 1 350 руб / час
свободенАнастасия Эдуардовна
Частный преподаватель Стаж 9 лет
У репетитора есть видеопрезентация смотреть видеопрезентация
от 2 000 руб / час
свободенИрина Леонидовна
Частный преподаватель Стаж 29 лет
от 1 300 руб / час
свободенАртем Александрович
Частный преподаватель Стаж 4 года
от 1 200 руб / час
свободенЕгор Андреевич
Частный преподаватель Стаж 9 лет
от 2 000 руб / час
свободенСветлана Борисовна
Школьный преподаватель Стаж 36 лет
от 700 руб / час
свободен- Москва и Московская область
- Санкт-Петербург и Ленинградская область
- Абакан и Республика Хакасия
- Анадырь и Чукотский автономный округ
- Архангельск и Архангельская область
- Астрахань и Астраханская область
- Барнаул и Алтайский край
- Белгород и Белгородская область
- Биробиджан и Еврейская автономная область
- Благовещенск и Амурская область
- Брест и Брестская область
- Брянск и Брянская область
- Великий Новгород и Новгородская область
- Витебск и Витебская область
- Владивосток и Приморский край
-
Владикавказ
и Респ.
 Северная Осетия-Алания
Северная Осетия-Алания
- Владимир и Владимирская область
- Волгоград и Волгоградская область
- Вологда и Вологодская область
- Воронеж и Воронежская область
- Гомель и Гомельская область
- Горно-Алтайск и Республика Алтай
- Гродно и Гродненская область
- Грозный и Республика Чечня
- Екатеринбург и Свердловская область
- Иваново и Ивановская область
- Ижевск и Удмуртская республика
- Иркутск и Иркутская область
- Йошкар-Ола и Республика Марий Эл
- Казань и Республика Татарстан
- Калининград и Калининградская область
- Калуга и Калужская область
- Кемерово и Кемеровская область
- Киров и Кировская область
- Кострома и Костромская область
- Краснодар и Краснодарский край
- Красноярск и Красноярский край
- Курган и Курганская область
- Курск и Курская область
- Кызыл и Республика Тыва
- Липецк и Липецкая область
- Магадан и Магаданская область
- Майкоп и Республика Адыгея
- Махачкала и Республика Дагестан
- Минск и Минская область
- Могилев и Могилевская область
- Мурманск и Мурманская область
- Назрань и Республика Ингушетия
-
Нальчик
и Кабардино-Балкарская Респ.

- Нарьян-Мар и Ненецкий автономный округ
- Нижний Новгород и Нижегородская область
- Новосибирск и Новосибирская область
- Омск и Омская область
- Орел и Орловская область
- Оренбург и Оренбургская область
- Пенза и Пензенская область
- Пермь и Пермский край
- Петрозаводск и Республика Карелия
- Петропавловск-Камчатский и Камчатский край
- Псков и Псковская область
- Ростов-на-Дону и Ростовская область
- Рязань и Рязанская область
-
Салехард
и Ямало-Ненецкий авт.
 округ
округ
- Самара и Самарская область
- Саранск и Республика Мордовия
- Саратов и Саратовская область
- Севастополь
- Симферополь и Республика Крым
- Смоленск и Смоленская область
- Ставрополь и Ставропольский край
- Сыктывкар и Республика Коми
- Тамбов и Тамбовская область
- Тверь и Тверская область
- Томск и Томская область
- Тула и Тульская Область
- Тюмень и Тюменская область
- Улан-Удэ и Республика Бурятия
- Ульяновск и Ульяновская область
- Уфа и Республика Башкортостан
- Хабаровск и Хабаровский край
-
Ханты-Мансийск
и Ханты-Мансийский авт.
 округ
округ
- Чебоксары и Чувашская республика
- Челябинск и Челябинская область
- Черкесск и Карачаево-Черкесская Респ.
- Чита и Забайкальский край
- Элиста и Республика Калмыкия
- Южно-Сахалинск и Сахалинская область
- Якутск и Республика Саха (Якутия)
- Ярославль и Ярославская область
- Города России и зарубежья
Билеты по химии 9 класс с ответами
Автор публикации: Владимир Соколов, ХМАО, преподаватель
Примерный вариант экзаменационных материалов по химии для устного экзамена: вопросы, примерные ответы на вопросы билетов, задания и решение задач. Как и в случае с билетами по биологии, мы предлагаем свой вариант текста. Это один из возможных вариантов ответа на вопросы билетов и не претендует на исчерпывающее изложение материала.
Как и в случае с билетами по биологии, мы предлагаем свой вариант текста. Это один из возможных вариантов ответа на вопросы билетов и не претендует на исчерпывающее изложение материала.
Серым шрифтом набран текст, способствующий лучшему пониманию материала, но не обязательно включать его в ответ, можно заменить изложением своего материала, который лучше знаешь.
Отличие от найденных в сети веб-страниц — здесь приводятся ответы к примерным билетам 2007 г.
Учитывая, что при малом опыте практической работы с химическими веществами многим школьникам приходится специально заучивать те или иные реакции, мы не стремились к разнообразию примеров реакций. А напротив, показываем возможность использования одних и тех же несложных уравнений при ответе на разные темы.
Дополнительно: Билеты по биологии 9 класс с ответами.
При копировании ответов на билеты прямая индексируемая ссылка на данную страницу обязательна.
Билет № 1
1. Периодический закон и периодическая система химических элементов Д.
 И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного) номера.
И. Менделеева. Закономерности изменения свойств элементов малых периодов и главных подгрупп в зависимости от их порядкового (атомного) номера.Периодическая система стала одним из важнейших источников информации о химических элементах, образуемых ими простых веществах и соединениях.
Дмитрий Иванович Менделеев создал Периодическую систему в процессе работы над своим учебником «Основы химии», добиваясь максимальной логичности в изложении материала. Закономерность изменения свойств элементов, образующих систему, получила название Периодического закона.
Согласно периодическому закону, сформулированному Менделеевым в 1869 году, свойства химических элементов находятся в периодической зависимости от их атомных масс. То есть с увеличением относительной атомной массы, свойства элементов периодически повторяются.*
Сравните: периодичность смены времен года с течением времени.
Данная закономерность иногда нарушается, например, аргон (инертный газ) превышает по массе следующий за ним калий (щелочной металл). Это противоречие было объяснено в 1914 году при изучении строения атома. Порядковый номер элемента в Периодической системе — это не просто очередность, он имеет физический смысл — равен заряду ядра атома. Поэтому
Это противоречие было объяснено в 1914 году при изучении строения атома. Порядковый номер элемента в Периодической системе — это не просто очередность, он имеет физический смысл — равен заряду ядра атома. Поэтому
современная формулировка Периодического закона звучит так:
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома.
Период — это последовательность элементов, расположенных в порядке возрастания заряда ядра атома, начинающаяся щелочным металлом и заканчивающаяся инертным газом.
В периоде, с увеличением заряда ядра, растет электроотрицательность элемента, ослабевают металлические (восстановительные) свойства и растут неметаллические (окислительные) свойства простых веществ. Так, второй период начинается щелочным металлом литием, за ним следует бериллий, проявляющий амфотерные свойства, бор — неметалл, и т. д. В конце фтор — галоген и неон — инертный газ.
(Третий период снова начинается щелочным металлом — это и есть периодичность)
1–3 периоды являются малыми (содержат один ряд: 2 или 8 элементов), 4–7 — большие периоды, состоят из 18 и более элементов.
Составляя периодическую систему, Менделеев объединил известные на тот момент элементы, обладающие сходством, в вертикальные столбцы. Группы — это вертикальные столбцы элементов, имеющих, как правило, валентность в высшем оксиде равную номеру группы. Группу делят на две подгруппы:
Главные подгруппы содержат элементы малых и больших периодов, образуют семейства со сходными свойствами (щелочные металлы — I A, галогены — VII A, инертные газы — VIII A).
(химические знаки элементов главных подгрупп в периодической системе располагаются под буквой «А» или, в очень старых таблицах, где нет букв А и Б — под элементом второго периода)
Побочные подгруппы содержат элементы только больших периодов, их называют переходные металлы.
(под буквой «Б» или «B»)
В главных подгруппах с увеличением заряда ядра (атомного номера) растут металлические (восстановительные) свойства.
Закрепить знания о периодической системе — тест онлайн «Характеристика элемента»
* точнее, веществ, образованных элементами, но это часто опускают, говоря «свойства элементов»
2. Опыт. Проведение реакций, подтверждающих химические свойства хлороводородной кислоты
Хлороводородная кислота:
- Окрашивает растворы индикаторов лакмуса и метилового оранжевого в красный цвет, вследствие диссоциации в водном растворе:
HCl → H+ + Cl− - Взаимодействует с металлами, находящимися в ряду напряжений левее водорода, например, с цинком, с образованием соли и газообразного водорода:
Zn + 2HCl = ZnCl2 + H2↑ - Взаимодействует с оснóвными оксидами с образованием соли и воды:
CuO + 2HCl = CuCl2 + H2O
(при проведении реакции с оксидом меди (II), пробирку желательно слегка подогреть) - Взаимодействует с основаниями с образованием соли и воды:
NaOH + HCl = NaCl + H2O - Вытесняет слабые кислоты из растворов их солей:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑ - Качественная реакция на хлорид-ион — при сливании с раствором соли серебра, образуется белый творожистый осадок, нерастворимый в концентрированной азотной кислоте:
AgNO3 + HCl = HNO3 + AgCl↓
Химическая связь класс 9 химия
Большинство веществ, встречающихся в природе, находятся в виде кластеров или агрегатов атомов. Любое такое скопление, в котором атомы удерживаются вместе и которое является электрически нейтральным, называется молекулой. Молекулы состоят из двух или более атомов, соединенных вместе некоторой силой, действующей между ними. Сила называется химической связью. Таким образом, химическая связь определяется как сила, действующая между двумя или более атомами и удерживающая их вместе в виде стабильной молекулы.
Любое такое скопление, в котором атомы удерживаются вместе и которое является электрически нейтральным, называется молекулой. Молекулы состоят из двух или более атомов, соединенных вместе некоторой силой, действующей между ними. Сила называется химической связью. Таким образом, химическая связь определяется как сила, действующая между двумя или более атомами и удерживающая их вместе в виде стабильной молекулы.
Альбрехт Кёссель и Гилберт Льюис были первыми, кто успешно объяснил образование химической связи в 1916 году. Они объяснили химическую связь инертностью инертных газов.
Теория химической связи Льюиса
- Атом представляет собой положительно заряженное «ядро» (ядро и внутренние электроны) и внешнюю оболочку.
- Внешняя оболочка может удерживать только восемь электронных пар.
- Восемь электронов во внешней оболочке занимают углы куба вокруг «ядра».
- Атомы с октетной конфигурацией, т. е. с восемью электронами во внешней оболочке, символизируют стабильную конфигурацию.

- Атомы могут достичь этого стабильного образования, образуя химические связи с другими атомами. Эта химическая связь может быть образована путем приобретения или потери электронов (NaCl, MgCl 2 ) или, в некоторых случаях, из-за обмена электронами (F 2 ).
- Во внешней оболочке присутствуют только электроны, также известные как валентные электроны, которые участвуют в образовании химических связей. Гилберт Льюис использовал специальные обозначения, более известные как символы Льюиса, для представления этих электронов в валентности.
- В общем, значение элемента может быть равно количеству точек в соответствующем символе Льюиса или восьми минус количество точек (или валентных электронов).
Теория химической связи Косселя
- Благородные газы, разделяющие галогены, являются очень сильными электроотрицательными и щелочными металлами.
- Галогены могут образовывать отрицательно заряженные ионы, принимая электрон.
 Однако щелочные металлы могут образовывать положительно заряженные ионы для потери электронов.
Однако щелочные металлы могут образовывать положительно заряженные ионы для потери электронов. - Эти ионы имеют отрицательный заряд и хорошо заряженные ионы с правильным газообразованием из 8 электронов во внешней оболочке. Стандартная электронная конфигурация приличных газов (кроме гелия) представлена ns 2 np 6 .
- Поскольку разноименные заряды притягиваются друг к другу, эти разнозаряженные частицы удерживаются вместе за счет мощного электростатического притяжения между ними. Например, MgCl 2 , ион магния и ионы хлорида связаны друг с другом электростатическим притяжением. Этот тип химической связи между разноименными заряженными частицами известен как электровалентная связь.
Объяснение подхода Косселя-Льюиса
В 1916 году Коссель и Льюис дали эффективное объяснение, основанное на концепции электронной конфигурации благородных газов, почему атомы объединяются в молекулы. Атомы тонких газов практически не контактируют с другими атомами или атомами других элементов. Это означает, что эти атомы должны иметь стабильную электронную конфигурацию.
Это означает, что эти атомы должны иметь стабильную электронную конфигурацию.
Благодаря стабильной конфигурации атомы инертных газов не имеют тенденции приобретать или терять электроны. Следовательно, их связывающая способность или валентность равна нулю. Они настолько инертны, что даже не образуют двухатомных молекул и существуют в виде газообразных одноатомных атомов.
Типы химических связей
Некоторые важные типы химических связей:
- Ионная или электровалентная связь
- Ковалентная связь
- Дательный падеж или Координатная связь
Атом может достичь стабильной электронной конфигурации тремя различными способами: потеряв электроны, приобретя или разделив электроны.
Элементы можно разделить на следующие три типа:
- Электроположительные элементы: атом которых довольно легко отдает один или несколько электронов.
- Электроотрицательные элементы: Которые будут принимать электрон.

- Элементы, которые имеют небольшую тенденцию терять или приобретать электроны.
В зависимости от электроположительного или электроотрицательного характера вовлеченного атома могут образовываться три различных типа связей.
Электроположительный элемент + Электроположительный элемент → Металлическая связка
Электроположительный элемент + Электроотрицательный элемент → Ионная связь
Электроотрицательный элемент + Электроотрицательный элемент → Ковалентная связь.
NCERT Solutions for Class 9 Science , подготовленный Physics Wallah, поможет вам решить упражнение из учебника NCERT.
Также проверьте
- Металлическая связка
- Ковалентная связь
- Электроотрицательность
Химия (9-12 лет) Образование | University of St.
 Thomas
ThomasБакалавр гуманитарных наук в области химии (9-12) Образование сочетает изучение химии с образовательными курсами, чтобы подготовить вас к преподаванию химии и общих наук в старшей или средней школе. Удовлетворить острую потребность в преподавателях естественных наук, вдохновляя при этом будущих ученых. Преподаватели химии устанавливают критическую связь между физикой и естественными науками, помогая учащимся понять материю на ее самом фундаментальном уровне.
Зачем изучать химию (9-12) Образование в Сент-Томас?
В рамках этой программы вы получаете начальную лицензию на преподавание химии в 9-12 классах, а также степень бакалавра в области образования – и все это в течение четырех лет. Вы также можете получить одобрение по общим наукам, что позволит вам преподавать в 5–8 классах. Опытные преподаватели, которые в настоящее время работают в классе K-12, помогут вам стать вдохновляющим учителем, которым вы хотите быть.
По окончании обучения вы будете иметь:
- Степень бакалавра с двойной специализацией в области образования и химии.

- Лицензия на преподавание в 5-12 классах наряду с важными лидерскими навыками.
- Знания и навыки, чтобы оказать положительное влияние на студентов.
- Поддерживающая сеть сокурсников, выпускников и преподавателей, которые будут вдохновлять и поддерживать вас на протяжении всей вашей карьеры.
- Глубокое понимание системы образования в Миннесоте.
Обзор программы
Требования к курсу
Ваша курсовая работа сочетает в себе образовательные занятия по учебной программе и инструкции, полевой опыт, а также курсы по естественным наукам и математике с упором на химию верхнего уровня.
Четырехлетний план
Наши преподаватели здесь, чтобы разработать ваш четырехлетний план, ориентированный на ваши личные и профессиональные цели.
- Посмотреть образец плана обучения
Присуждена степень
- Бакалавр химических наук
- Бакалавр искусств в среднем образовании
Клиническая практика с наставником
Мы поддерживаем вас в развитии ваших навыков преподавания. Во время обучения студентов вы регулярно проводите семинары с преподавателями и коллегами. Наставничество, которое вы получаете, гарантирует, что ваш опыт преподавания студентов соответствует вашим потребностям и способствует вашему личному и профессиональному росту.
Требования к курсу
Требования к курсу
Ваша курсовая работа сочетает в себе образовательные занятия по учебной программе и инструкции, полевой опыт, а также курсы по естественным наукам и математике с упором на химию верхнего уровня.
Четырехлетний план
Четырехлетний план
Наши преподаватели здесь, чтобы разработать ваш четырехлетний план, ориентированный на ваши личные и профессиональные цели.
- Посмотреть образец плана обучения
Присуждена степень
Присуждена степень
- Бакалавр химических наук
- Бакалавр искусств в среднем образовании
Курируемая клиническая практика
Клиническая практика с наставником
Мы поддерживаем вас в развитии ваших навыков преподавания. Во время обучения студентов вы регулярно проводите семинары с преподавателями и коллегами. Наставничество, которое вы получаете, гарантирует, что ваш опыт преподавания студентов соответствует вашим потребностям и способствует вашему личному и профессиональному росту.
Джош Лейфилд, доцент
Открытие нейлона в 1930-х годах привело к созданию всего, от синтетических рубашек без железа до космических скафандров. «Как и нейлон, 25 процентов всех химических веществ, поступающих на рынок, в какой-то момент своего синтеза вступают в двухфазную реакцию», — сказал доцент Джош Лейфилд. Он руководит студентами-химиками Сент-Томаса в изучении жидкостных реакций, которые реорганизуют молекулы. Подобные эксперименты в химической лаборатории Сент-Томаса — это семена изобретательства.
Career Paths
Мы даем вам инструменты, необходимые для достижения успеха в естественнонаучном образовании.
- Учитель химии средней школы
- Учитель общих наук средней школы
- 5-12 Учитель общей науки
Краткая информация
95%
наших кандидатов в учителя начальной и средней школы успешно сдают экзамены на получение лицензии по базовым навыкам и педагогике с первой попытки.
100%
наших выпускников сдают экзамены по естествознанию и чтению в средней школе с первого раза.
8
8 Томми были названы учителем года Миннесоты с 2000 года.
Преподавание студентов
Ваш опыт преподавания начинается уже на первом курсе обучения. К моменту выпуска вы завершите один год обучения студентов под наблюдением.
Полевой опыт
Разнообразный полевой опыт в государственных, частных, приходских и чартерных школах, с которыми у нас сложились тесные связи, поможет вам обрести уверенность в преподавании.
Сделайте следующий шаг
О Сент-Томасе нужно узнать больше; в том числе наш рейтинг школы с лучшим соотношением цены и качества по версии US News & World Report, множество классных и внеклассных мероприятий, которые станут частью вашего студенческого опыта, и многое другое. Запланируйте визит, чтобы увидеть наш красивый кампус, или подайте заявку сегодня.
- Применить сейчас
- Информация о запросе
- Студенческая жизнь
- Финансовая помощь
- Посетите кампус
Selina Solutions for Concise Science Chemistry 1 Class 9 ICSE
Concise Science Chemistry 1 Class 9 ICSE
Автор: SelinaPublisher: Selina PublishersЯзык: английский Краткая научная химия 1 класс 9 ICSE . Shaalaa — это, безусловно, сайт, который используют большинство ваших одноклассников, чтобы хорошо сдать экзамены.
Вы можете решить вопросы учебника Concise Science Chemistry 1 Class 9 ICSE и использовать решения Shaalaa Selina для химии Class 9, чтобы проверить свои ответы.
Появляется в
- ICSE Class 9 CISCE
Selina Class 9 решения по другим предметам
Мы также предлагаем решения по другим предметам, которые помогут вам лучше сдать экзамены. Эти решения Selina специально подобраны с учетом шаблонов экзаменов и старых работ. Найдите лучшие вопросы и решения здесь. Нажмите сейчас, чтобы получить к нему доступ.
Эти решения Selina специально подобраны с учетом шаблонов экзаменов и старых работ. Найдите лучшие вопросы и решения здесь. Нажмите сейчас, чтобы получить к нему доступ.
- Решения Selina для краткой математики, класс 9 ICSE
- Решения Selina для краткой физики, класс 9 ICSE
- Решения Selina для краткой биологии, класс 9 ICSE
Понятия, охватываемые языком химии, включают атомную массу, балансирующее химическое уравнение, химическое уравнение, химическую формулу или молекулярную формулу, классификацию молекул, элементы , Эмпирическая формула соединения, Водород, Ионы (радикалы) и их виды, Вещество (вещество), Молекулярная масса, Молекулы, Наименование химических соединений, Процентный состав, Эмпирическая и молекулярная формулы, Чистые вещества, Символы, используемые для обозначения атомов различных элементов , Чтобы вычислить валентность по формуле, валентность, переменная валентность
Selina Class 9 Chemistry (9th) Chapter 1: The Language of Chemistry exercises
| Exercise | No. of questions of questions | Pages |
|---|---|---|
| Exercise 1 (A) | 66 | 9 to 10 |
| Exercise 1 (B) | 28 | 15 |
| Exercise 1 (C) | 71 | 18 to 19 |
Selina Class 9Химия (9) Глава 2: Химические изменения и реакции решения
Понятия, охватываемые в разделе Химические изменения и реакции, включают химическую реакцию, классификацию изменений: химические изменения, условия, необходимые для химических реакций, реакции разложения, реакцию прямого соединения (или синтеза), Реакция двойного замещения, изменение энергии в химических реакциях, реакции одинарного замещения, типы химических изменений или химических реакций
Селина Класс 9 Химия (9th) Chapter 2: Chemical Changes and Reactions exercises
| Exercise | No. of questions | Pages |
|---|---|---|
| Exercise 2 (A) | 27 | 23 to 24 |
| Exercise 2 (B) | 36 | 29 |
| Упражнение 2 (C) | 31 | 32 |
.
 Химия (9) Глава 3: Водные растворы
Химия (9) Глава 3: Водные растворы Понятия, изложенные в разделе Вода: преимущества и недостатки жесткой воды, причины жесткости, химические свойства воды, классификация воды: мягкая и жесткая вода, компоненты растворов, концентрация раствора , Кристаллы и кристаллизация, Различные типы растворов, Высушивающие и обезвоживающие вещества, Высолы, гигроскопичные и разжижающие вещества, Гидратированные и безводные вещества, Физические свойства воды, Предотвращение загрязнения воды, Удаление жесткости воды, Соли, Насыщенные растворы, Растворимость , Растворы как «смеси» твердых веществ в воде, Вода – универсальный растворитель, Вода, Наш спасательный круг
Selina Class 9 Chemistry (9th) Chapter 3: Water exercises
| Exercise | No. of questions | Pages |
|---|---|---|
| Exercise 3 (A) | 24 | 36 to 37 |
| Exercise 3 (B) | 43 | 47 |
| Exercise 3 (C) | 28 | 52 |
Selina Class 9 Chemistry (9th) Chapter 4: Atomic Structure and Решения для химического склеивания
Концепции, рассматриваемые в разделе «Атомная структура и химическая связь», включают атомную массу, атомный номер (Z), массовое число (A) и количество нейтронов (n), атомы: строительные блоки материи, химическая связь, атомная теория Дальтона, открытие. заряженных частиц в веществе, электронная конфигурация атома, электроны (e), электровалентная (или ионная) связь, элементы, образование электровалентной (или ионной) связи, образование ковалентной связи, история атома, изобары, изотопы, Дж. Дж. Томсон Модель атома, Модель атома лорда Резерфорда, Модель атома Нильса Бора, Нейтроны (n), Ядро, Протоны (p), Причина химической активности атома, Структура атома, Ковалентная связь, Типы ковалентной связи, Валентность Электроны
заряженных частиц в веществе, электронная конфигурация атома, электроны (e), электровалентная (или ионная) связь, элементы, образование электровалентной (или ионной) связи, образование ковалентной связи, история атома, изобары, изотопы, Дж. Дж. Томсон Модель атома, Модель атома лорда Резерфорда, Модель атома Нильса Бора, Нейтроны (n), Ядро, Протоны (p), Причина химической активности атома, Структура атома, Ковалентная связь, Типы ковалентной связи, Валентность Электроны
Селина Класс 9 Химия (9 -е место) Глава 4: Упражнения по атомной структуре и химическим связям
| Упражнения | № Вопросы | страницы | страницы | страницы | . 59 |
|---|---|---|
| Exercise 4 (B) | 12 | 63 |
| Exercise 4 (C) | 44 | 66 to 67 |
| Exercise 4 (D) | 22 | 71 |
| Упражнение 4 (E) | 47 | 76 до 77 |
Реклама.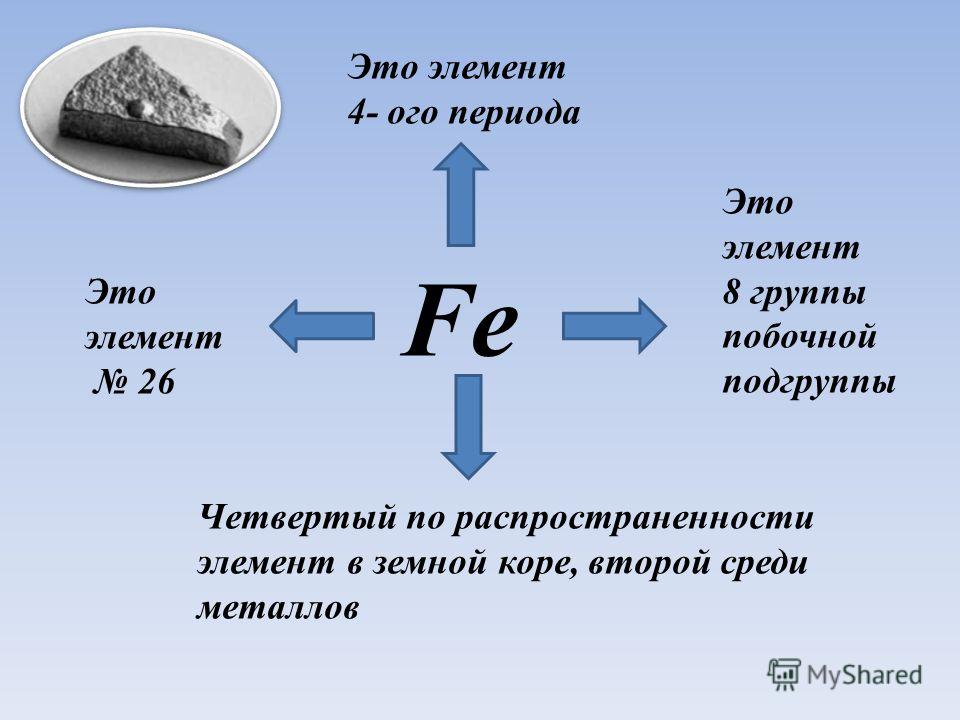
Понятия, охватываемые периодической таблицей, являются преимуществами и недостатками современной периодической таблицы, триадами Доберейнера, группой I (щелочные металлы), группой II (щелочноземельные металлы), группой VIIA или группой 17 (галогены), группой Zero или группой 18 ( Благородные газы), История периодической таблицы: ранние попытки классификации элементов, Периодическая таблица Менделеева, Достоинства и недостатки периодической таблицы Менделеева, Современный периодический закон, Закон октав Ньюленда, Периодические свойства, Периодические свойства: атомный радиус или размер атома, Периодические свойства: металлический характер, Периодические свойства: свойства элементов, Периодические свойства: оболочки (орбиты), Периодические свойства: валентность, Изучение конкретных групп в периодах c Таблица, Современная периодическая таблица, Типы элементов на основе периодической таблицы, Типы элементов: металлы, Использование периодической таблицы
Selina Class 9 Chemistry (9th) Chapter 5: The Periodic Table exercises
| Exercise | No. of questions of questions | Pages |
|---|---|---|
| Exercise 5 (A) | 22 | 82 to 102 |
| Exercise 5 (B) | 28 | 89 |
| Exercise 5 (C) | 56 | 94 to 95 |
Selina Class 9 Chemistry (9th) Глава 6: Изучение первого элемента – растворы водорода
Концепции, изложенные в разделе «Изучение первого элемента – водород», включают в себя применение ряда действий при получении водорода, химические свойства водорода, водород, лабораторное получение водорода, производство водорода, окисление, восстановление и окислительно-восстановительные реакции, физические свойства водорода, положение водорода в периодической таблице, получение водорода, сходство между водородом и щелочными металлами, сходство между водородом и галогенами, использование водорода
Selina Class 9 Chemistry (9th) Chapter 6: Study of the First Element — Hydrogen exercises
| Exercise | No. of questions of questions | Pages |
|---|---|---|
| Exercise 6 (A) | 41 | 102 to 105 |
| Exercise 6 (B) | 27 | 105 to 106 |
| Exercise 6 (C) | 39 | 108 to 109 |
| Exercise 6 (D) | 46 | с 112 до 113 |
Реклама Удалить все объявления
Селина Класс 9 Химия (9th) Глава 7: Исследование газовых законовКонцепция. , Уравнение газа, Газы и их характеристики, Молекулярное движение: Зависимость температуры, давления и объема, Зависимость давления и объема или закон Болье, Шкалы термометров, Стандартная температура, давление (STP), Температуры, Зависимость температуры от объема или Закон Чарльза, The Влияние влаги и давления. Газовые законы
Selina Class 9 Chemistry (9th) Chapter 7: Study of Gas Laws exercises
| Exercise | No. of questions of questions | Pages |
|---|---|---|
| Exercise 7 (A) | 52 | 125 до 126 |
| Упражнение 7 (B) | 28 | 126–127 |
Class.0002 Концепции, охватываемые атмосферным загрязнением, включают кислотные дожди, преимущества парникового эффекта, загрязнение воздуха и его причины, атмосферное загрязнение, причины кислотных дождей, последствия загрязнения воздуха, газообразные загрязнители и их последствия, глобальное потепление, парниковый эффект, озон, Истощение озонового слоя, предотвращение загрязнения воздуха, превентивные меры глобального потепления
Селина Класс 9 Химия (9-й) Глава 8: Учения по загрязнению атмосферы
| Упражнение | No. of questions | Pages |
|---|---|---|
| Exercise 8 (A) | 14 | 131 |
| Exercise 8 (B) | 9 | 133 |
| Exercise 8 (C) | 10 | 134 |
| Упражнение 8 (D) | 37 | 137 |
 333333333333333 гг. Абсолютный ноль, Кислотный дождь, Преимущество и недостаток жесткой воды, Преимущество и недостаток современной периодической таблицы, Преимущество парникового эффекта, Загрязнение воздуха и его причины, Применение ряда активности при получении водорода, Атмосферное загрязнение, Атомная масса, Атомный номер (Z), массовое число (A) и количество нейтронов (n), атомы: строительные блоки материи, уравновешивающее химическое уравнение, причины кислотных дождей, причины жесткости, химия l Связь, химическое уравнение, химическая формула или молекулярная формула, химические свойства водорода, химические свойства воды, химическая реакция, классификация изменений: химические изменения, классификация молекул, классификация воды: мягкая и жесткая вода, компоненты растворов, концентрация раствора, условия, необходимые для химических реакций, кристаллы и кристаллизация, атомная теория Дальтона, реакции разложения, различные типы растворов, реакция прямого соединения (или синтеза), обнаружение заряженных частиц в веществе, триады Доберейнера, реакция двойного смещения, сушка и Обезвоживающие вещества, воздействие загрязнения воздуха, высолы, гигроскопические и расплывающиеся вещества, электронная конфигурация атома, электроны (e), электровалентная (или ионная) связь, элементы, эмпирическая формула соединения, изменение энергии в химических реакциях, образование Электровалентная (или ионная) связь, образование ковалентной связи, газообразные загрязнители и их влияние , газовое уравнение, газы и их характеристики, глобальное потепление, парниковый эффект, группа I (щелочные металлы), группа II (щелочноземельные металлы), группа VIIA или группа 17 (галогены), нулевая группа или группа 18 (благородные газы) , История атома, История периодической таблицы: ранние попытки классификации элементов, гидратированные и безводные вещества, водород, ионы (радикалы) и его типы, изобары, изотопы, модель атома Дж.
333333333333333 гг. Абсолютный ноль, Кислотный дождь, Преимущество и недостаток жесткой воды, Преимущество и недостаток современной периодической таблицы, Преимущество парникового эффекта, Загрязнение воздуха и его причины, Применение ряда активности при получении водорода, Атмосферное загрязнение, Атомная масса, Атомный номер (Z), массовое число (A) и количество нейтронов (n), атомы: строительные блоки материи, уравновешивающее химическое уравнение, причины кислотных дождей, причины жесткости, химия l Связь, химическое уравнение, химическая формула или молекулярная формула, химические свойства водорода, химические свойства воды, химическая реакция, классификация изменений: химические изменения, классификация молекул, классификация воды: мягкая и жесткая вода, компоненты растворов, концентрация раствора, условия, необходимые для химических реакций, кристаллы и кристаллизация, атомная теория Дальтона, реакции разложения, различные типы растворов, реакция прямого соединения (или синтеза), обнаружение заряженных частиц в веществе, триады Доберейнера, реакция двойного смещения, сушка и Обезвоживающие вещества, воздействие загрязнения воздуха, высолы, гигроскопические и расплывающиеся вещества, электронная конфигурация атома, электроны (e), электровалентная (или ионная) связь, элементы, эмпирическая формула соединения, изменение энергии в химических реакциях, образование Электровалентная (или ионная) связь, образование ковалентной связи, газообразные загрязнители и их влияние , газовое уравнение, газы и их характеристики, глобальное потепление, парниковый эффект, группа I (щелочные металлы), группа II (щелочноземельные металлы), группа VIIA или группа 17 (галогены), нулевая группа или группа 18 (благородные газы) , История атома, История периодической таблицы: ранние попытки классификации элементов, гидратированные и безводные вещества, водород, ионы (радикалы) и его типы, изобары, изотопы, модель атома Дж. Дж. Томсона, лабораторное получение водорода, атомная модель лорда Резерфорда модель, Производство водорода, Материя (вещество), Периодическая таблица Менделеева, Достоинства и недостатки периодической таблицы Менделеева, Современный периодический закон, Молекулярная масса, Молекулярное движение: связь температуры, давления и объема, Молекулы, Наименование химических соединений, Модель Нильса Бора атома, нейтроны (n), закон октав Ньюленда, ядро, реакции окисления, восстановления и окислительно-восстановительные реакции, озон, истощение озонового слоя, процентный состав, эмпирическая и молекулярная формулы, периодические свойства es, периодические свойства: атомный радиус или атомный размер, периодические свойства: металлический характер, периодические свойства: свойства элементов, периодические свойства: оболочки (орбиты), периодические свойства: валентность, физические свойства водорода, физические свойства воды, положение водорода в периодической таблице, получение водорода, соотношение давления и объема или закон Болье, предотвращение загрязнения воздуха, предотвращение загрязнения воды, меры по предотвращению глобального потепления, протоны (p), чистые вещества, причина химической активности атома, удаление Жесткость воды, соли, насыщенные растворы, шкалы термометров, сходство между водородом и щелочными металлами, сходство между водородом и галогенами, реакции одиночного замещения, растворимость, растворы как «смеси» твердых тел в воде, стандартная температура, давление (СТП), структура атома, изучение определенных групп периодической таблицы, символы, используемые для обозначения атомов различных элементов, температуры, темпера ture — Отношение объема или закон Шарля, Ковалентная связь, Влияние влаги и давления, Газовые законы, Современная периодическая таблица, Расчет валентности по формуле, Типы химических изменений или химических реакций, Типы ковалентной связи, Типы элементов на основе периодической таблицы, типы элементов: металлы, использование водорода, использование периодической таблицы, валентность, валентность электронов, переменная валентность, вода — универсальный растворитель, вода, наша линия жизни
Дж. Томсона, лабораторное получение водорода, атомная модель лорда Резерфорда модель, Производство водорода, Материя (вещество), Периодическая таблица Менделеева, Достоинства и недостатки периодической таблицы Менделеева, Современный периодический закон, Молекулярная масса, Молекулярное движение: связь температуры, давления и объема, Молекулы, Наименование химических соединений, Модель Нильса Бора атома, нейтроны (n), закон октав Ньюленда, ядро, реакции окисления, восстановления и окислительно-восстановительные реакции, озон, истощение озонового слоя, процентный состав, эмпирическая и молекулярная формулы, периодические свойства es, периодические свойства: атомный радиус или атомный размер, периодические свойства: металлический характер, периодические свойства: свойства элементов, периодические свойства: оболочки (орбиты), периодические свойства: валентность, физические свойства водорода, физические свойства воды, положение водорода в периодической таблице, получение водорода, соотношение давления и объема или закон Болье, предотвращение загрязнения воздуха, предотвращение загрязнения воды, меры по предотвращению глобального потепления, протоны (p), чистые вещества, причина химической активности атома, удаление Жесткость воды, соли, насыщенные растворы, шкалы термометров, сходство между водородом и щелочными металлами, сходство между водородом и галогенами, реакции одиночного замещения, растворимость, растворы как «смеси» твердых тел в воде, стандартная температура, давление (СТП), структура атома, изучение определенных групп периодической таблицы, символы, используемые для обозначения атомов различных элементов, температуры, темпера ture — Отношение объема или закон Шарля, Ковалентная связь, Влияние влаги и давления, Газовые законы, Современная периодическая таблица, Расчет валентности по формуле, Типы химических изменений или химических реакций, Типы ковалентной связи, Типы элементов на основе периодической таблицы, типы элементов: металлы, использование водорода, использование периодической таблицы, валентность, валентность электронов, переменная валентность, вода — универсальный растворитель, вода, наша линия жизниSelina Class 9 Chemistry (9th) Chapter 9: Practical Work exercises
| Exercise | No. of questions of questions | Pages |
|---|---|---|
| Exercise 9 (A) | 24 | 142 |
| Exercise 9 (B) | 17 | 146 |
| Exercise 9 (C) | 22 | 153 |
Finding the best Class 9 Chemistry (9th) Решения Selina очень важны если вы хотите полностью подготовиться к экзамен. Крайне важно убедиться, что вы полностью готовы к любым проблемам, которые могут возникнуть, и это почему тяжелый, профессиональный акцент на химию Selina Class 9 решения могут быть очень хорошей идеей. Как вы узнаете решения, вам намного проще получить желаемые результаты, а сам опыт может быть ошеломляет каждый раз.
Selina Class 9 Химия (9th) Справочник Назад Ответы
Мы надеемся, что следующие CISCE Selina Class 9Химия (9-я) Книга
Ответы Руководство по решениям Pdf Free Download in English Medium будет вам полезен. Ответный материал разработан в соответствии с
последний образец экзамена и является частью Selina Class 9 Books Solutions. Вы не пропустите ни одного
темы или концепции, обсуждаемые в книге, и получат больше концептуальных знаний из учебного материала. Если у вас есть вопросы о CISCE
Новая программа для 9 класса Химия для 9 класса (9) Руководство Pdf of Text Book Назад
Вопросы и ответы, примечания, важные вопросы по главам, типовые вопросы и т. д., пожалуйста, свяжитесь с нами.
Вы не пропустите ни одного
темы или концепции, обсуждаемые в книге, и получат больше концептуальных знаний из учебного материала. Если у вас есть вопросы о CISCE
Новая программа для 9 класса Химия для 9 класса (9) Руководство Pdf of Text Book Назад
Вопросы и ответы, примечания, важные вопросы по главам, типовые вопросы и т. д., пожалуйста, свяжитесь с нами.
Комплексные решения Selina для краткой научной химии 1, класс 9 ICSE
Очень важно иметь решения Selina для краткой научной химии, 1 класс 9 ICSE поскольку они могут предложить хорошее руководство в относительно того, что вам нужно улучшить. Если вы хотите становиться все лучше и лучше, вам нужно подталкивать границы и выйти на новый уровень. Это, безусловно, очень помогает и может привести к огромное количество преимуществ каждый раз. Это выводит опыт на новый уровень, а отдача в одиночку может быть экстраординарным.
Что вы хотите от раствора Селина Химия (9) 9 класс
это большая точность. Без
точные решения, вы никогда не получите желаемых результатов и ценности.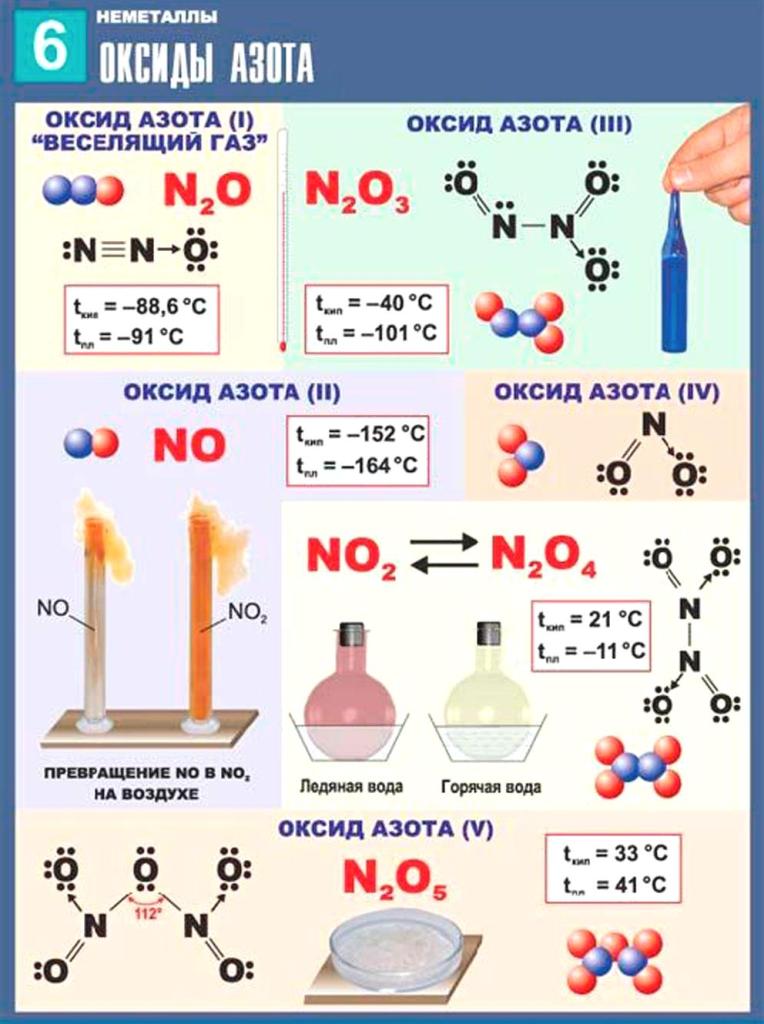 Вот почему вам нужно качество,
надежность и согласованность с чем-то вроде этого. Если он у вас есть, все, безусловно, будет удивительным и
вы получите, чтобы преследовать свои мечты.
Вот почему вам нужно качество,
надежность и согласованность с чем-то вроде этого. Если он у вас есть, все, безусловно, будет удивительным и
вы получите, чтобы преследовать свои мечты.
Правильное форматирование
Если вы приобрели растворы Chemistry Selina Class 9 на этой странице, они полностью отформатированы и готовы к использовать. Это помогает сделать опыт проще и удобнее, предлагая результаты и ценность. тебе нужно. Это то, к чему вы стремитесь, — истинный акцент на качество и ценность, и отдача может быть отличной. благодаря этому.
Все решения Selina Concise Science Chemistry 1 Class 9 ICSE охватывают все 9 глав.
В результате вы сможете полностью
подготовьтесь к экзамену должным образом и не беспокойтесь о том, что что-то упустите. Вы редко получаете
такое преимущество, и это само по себе является тем, что действительно делает решения Concise Science Chemistry 1 Class 9 ICSE Selina
вот такое необыкновенное преимущество, на которое всегда можно положиться. Просто подумайте о том, чтобы попробовать
себя, и вы найдете его очень всеобъемлющим, профессиональным и удобным одновременно.
Просто подумайте о том, чтобы попробовать
себя, и вы найдете его очень всеобъемлющим, профессиональным и удобным одновременно.
Наши решения Selina для Concise Science Chemistry 1 Class 9 ICSE охватывают все, от Язык химии, химические изменения и реакции, вода, строение атома и химическая связь, периодическая таблица, изучение первого элемента — водорода, изучение газовых законов, загрязнение атмосферы, практическая работа и другие темы. Да, эти являются лучшими решениями Selina 12 Chemistry на рынке. Вы сможете полностью подготовиться к экзамену в надежным и всеобъемлющим образом. Вы просто должны проверить это сами, и опыт может быть действительно впечатляет.
Не стесняйтесь и проверьте наши решения Concise Science Chemistry 1 Class 9 ICSE сегодня, если вы хотите
справиться с этим экзаменом с большим
простота. Каждый раз он будет предлагать необыкновенный опыт, и вам не придется беспокоиться ни о чем.
вопросы. Просто просмотрите наши решения прямо сейчас, и вы обнаружите, что справляетесь с экзаменом Selina. вопросы в кратчайшие сроки!
вопросы в кратчайшие сроки!
Решенные заметки по химии для 9-го класса PDF Пенджабская доска на английском языке Скачать
В 9-м классе учащиеся впервые появляются на экзаменах у доски и сдают работы на уровне зрелости. Учащиеся готовятся к 9й класс учиться как можно больше, чтобы получить отличные оценки по различным предметам на выпускных экзаменах. Один из способов подготовиться к экзаменам наилучшим образом — это изучить конспекты 9 класса. Если вы пришли сюда за конспектом по химии 9-го класса , то вы попали по адресу.
Мы добавили заметки по химии для 9-го класса в формате PDF на наш веб-сайт, Ilmkidunya и другие материалы, чтобы у вас были все учебные материалы на одном веб-сайте.
Плата за скачивание 9 не взимается.0070 9th Class Chemistry Notes English Medium с нашего сайта. Поскольку химия является сложным курсом, некоторые учащиеся тратят время на ее изучение и понимание ее концепций вместе с решенными упражнениями по химии 9-го класса pdf, такими как заметки по химии 9-го класса, глава 1, вместе с решенным упражнением по химии 9-го класса, глава 1. Вы можете найти MCQ примечаний по химии 9-го класса Punjab Board и других глав решаемых упражнений по химии 9-го класса, таких как .
Вы можете найти MCQ примечаний по химии 9-го класса Punjab Board и других глав решаемых упражнений по химии 9-го класса, таких как .
Химия 9 класс Глава 1 Примечания PDF Скачать
Название главы: Основы химии
Коротких вопросов к 9 главе химии 12 штук. 10 MCQ и 4 длинных вопроса представлены в уроке химии 9 главы 1 решенного упражнения в формате pdf.
MCQ Глава 1 : 10 вопросов
Короткие вопросы, глава 1 : 12 вопросов
Длинные вопросы Глава 1 : 4 вопроса
Глава 2 Примечания Скачать PDF Химия 9й класс
Название главы: Структура атомов
MCQ Глава 2 : 10 вопросов
Короткие вопросы Глава 2 : 13 вопросов
Длинные вопросы Глава 2 : 10 вопросов
9-й класс Глава 3 Примечания Химия PDF Скачать
Название главы: Периодическая таблица и периодичность свойств
MCQ Глава 3 : 10 вопросов
Короткие вопросы Глава 3 : 9 вопросов
Длинные вопросы Глава 3 : 10 вопросов
Примечания к главе 4 Скачать PDF 9-й класс Химия
Название главы: Структура молекул
MCQ Глава 4 : 16 вопросов
Короткие вопросы Глава 4 : 17 вопросов
Длинные вопросы Глава 4 : 11 вопросов
Примечания по химии Глава 5 Класс 9 PDF
Название главы: Физические состояния материи
MCQ Глава 5 : 11 вопросов
Короткие вопросы Глава 5 : 7 вопросов
Длинные вопросы Глава 5 : 6 вопросов
Глава 6 Примечания Скачать PDF Химия 9-й класс
Название главы: Решения
MCQ Глава 6 : 13 вопросов
Короткие вопросы Глава 6 : 12 вопросов
Длинные вопросы Глава 6 : 9 вопросов
Заметки по химии Глава 7 Класс 9 Скачать PDF
Название главы: Электрохимия
MCQ Глава 7 : 10 вопросов
Короткие вопросы Глава 7 : 22 вопроса
Длинные вопросы Глава 7 : 10 вопросов
Загрузить PDF 9 Класс Глава 8 Химия Примечания
Название главы: Химическая реактивность
MCQ Глава 8 : 11 вопросов
Короткие вопросы Глава 8 : 18 вопросов
Длинные вопросы Глава 8 : 12 вопросов
Примечания по химии Класс 9 2022
Эти заметки по химии 2022 сделаны с помощью опытных и замечательных учителей, чтобы учащиеся могли правильно изучить все понятия, которые находятся на уровне химии 9-го класса, например, вы можете начать с основ, таких как определение химии и ее основные типы, а также другие главы химии. 9 классрешенные упражнения.
9 классрешенные упражнения.
Скачать конспекты по химии для 9-го класса PDF бесплатно
Хороший способ, который может помочь учащимся лучше понять, — это использовать исчерпывающие и хорошие заметки по химии в классе 9. PDF-файлы с заметками по химии для 9-го класса имеют хорошее качество, что позволяет вам учиться более эффективно, поскольку они хорошо читаемы. Кроме того, вы также можете использовать заметки по химии для 9 класса, чтобы повторять свои темы перед экзаменами, а не читать книгу повторно.
Заметки по химии для 9 класса
На Ilmkidunya мы предоставляем вам не только конспекты по химии для 9 класса, но и конспекты по другим предметам. Вы можете найти заметки по английскому языку , физике, математике и т. д. В дополнение к этому, эти заметки по химии, представленные здесь, соответствуют последнему изданию учебника по химии за учебный год 2022. Вы также можете воспользоваться средством . Заметки по химии для 9-го класса на урду PDF .
Конспект по химии для 9 класса
Эти заметки по химии 2022 сделаны с помощью опытных и замечательных учителей, чтобы учащиеся могли правильно изучить все понятия, которые находятся на уровне химии 9-го класса, например, вы можете начать с основ, таких как атомная масса и ее основные типы или стойки из ПВХ. или легчайшая частица атома, или важность химии, или переходные элементы, или что подразумевается под молью, или селен хрупкий.
Химия Класс 9 Примечания
С помощью класс химии 9 отмечает , вы также можете узнать о разнице между прокариотической и эукариотической клеткой для класса 9, поскольку основное различие между ними заключается в том, что у эукариотических клеток есть мембрана вне ядра, а у прокариотических клеток нет.
Определить класс материи 9 по химии CBSE
Ответ
Проверено
221,4 тыс.+ просмотров
Подсказка: Материя — это «вещество», из которого состоит Вселенная. Все, что занимает пространство и массу, называется материей.
Все, что занимает пространство и массу, называется материей.
Материя — это «вещество», из которого состоит вселенная — все, что занимает пространство и имеет массу, — это материя. Атомы соединяются вместе, образуя молекулы, которые действуют как строительные блоки для всех типов материи. Атомы и молекулы удерживаются вместе посредством межмолекулярной силы притяжения. Различают три состояния вещества: твердое, жидкое и газообразное.
Полный пошаговый ответ:
Любое вещество, имеющее массу и занимающее пространство, называется материей.
Материя состоит из атомов или молекул. Расположение строительных блоков, которыми являются атомы и молекулы, придает материи различные состояния, физические и химические свойства. Сила взаимодействия между этими частицами материи придает материи ее физические свойства. Свойства, на основании которых материю можно разделить на твердую, жидкую или газообразную. Сила взаимодействия между атомами или молекулами оказывается наибольшей в твердых телах и наименьшей в жидкости и еще меньше в газах.
Существуют следующие состояния вещества:
1) Твердое:
Твердое состояние — это состояние вещества, в котором частицы плотно упакованы. Составляющие частицы могут быть атомами или твердыми телами.
Свойства твердого тела:
i) Твердое тело имеет определенную массу, объем и форму
ii) Межмолекулярные расстояния между твердыми частицами малы и, следовательно, велики силы притяжения. Поскольку межмолекулярные силы обратно пропорциональны расстоянию между частицами.
iii) Атомы или молекулы твердого тела имеют фиксированное положение. Они могут колебаться относительно своего среднего положения.
iv) Твердые тела изменяют свою форму при приложении к ним силы.
v) По своим свойствам твердые тела делятся на кристаллические и аморфные. В кристаллических телах атомы расположены в правильном порядке. например, лед.
vi) Твердые тела, в которых атомы расположены не в правильном порядке или в случайном порядке, называются некристаллическими или аморфными твердыми телами. Например, стекло.
Например, стекло.
2) Жидкое состояние:
Жидкое состояние – это состояние вещества, в котором межмолекулярные силы притяжения слабее, чем в твердом состоянии, но сильнее, чем в газообразном состоянии.
Свойства жидкости:
i) Молекулы в жидком состоянии расположены так близко друг к другу, что между ними есть небольшие межмолекулярные промежутки.
ii) Молекулы жидкости удерживаются вместе силами притяжения.
iii) Жидкость имеет определенный объем, потому что молекулы не отделяются друг от друга, пока к ней не будет приложена энергия. Он принимает форму сосуда.
iv) Молекулы жидкости могут свободно двигаться, поэтому жидкости могут течь, выливаться и принимать форму сосуда, в котором они хранятся
v) Когда твердое тело нагревается выше точки плавления, оно превращается в жидкость.
vi) Наиболее известным примером жидкости является вода.
3) Газообразное состояние:
Газообразное состояние – это состояние вещества, при котором межмолекулярные силы притяжения даже ниже, чем у жидкости. Частицы газа имеют большее расстояние между частицами. Молекула обладает кинетической энергией и, следовательно, имеет малые межмолекулярные силы.
Частицы газа имеют большее расстояние между частицами. Молекула обладает кинетической энергией и, следовательно, имеет малые межмолекулярные силы.
Свойства газового состояния:
i) Межмолекулярные силы притяжения в газах самые слабые.
ii) Из-за больших пустых пространств между частицами газа частицы газа обладают высокой сжимаемостью.
iii) Они имеют меньшую плотность, чем твердые и жидкие вещества.
iv) Газы имеют объем и расширяются в сосуде, в который они помещены.
v) Газы обладают свойством диффузии. Они смешиваются с другими во всех пропорциях без какой-либо механической помощи.
vi) Например, $\text{C}{{\text{O}}_{\text{2}}}\text{,}{{\text{N}}_{\text{2}} }$газы.
Примечание: Кроме этих трех состояний известны еще два состояния вещества: плазма и конденсат Бозе-Эйнштейна. Плазма является электропроводным газом. В плазменном состоянии вещества положительно заряженные ядра плавают в море отрицательно заряженных свободно движущихся электронов.
Недавно обновленные страницы
Рассчитать изменение энтропии, связанное с конверсией Химия класса 11 JEE_Main
Закон, сформулированный доктором Нернстом, является первым законом термодинамики Класс 11 химии JEE_Main
Для реакции при rm0rm0rmC и нормальном давлении Класс A 11 химия JEE_Main
Двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC класс 11 химия JEE_Main
Для реакции rm2Clg в rmCrmlrm2rmg признаки 11 класса химии JEE_Main
Изменение энтальпии перехода жидкой воды в химический класс 11 JEE_Main
Рассчитайте изменение энтропии при переходе в химический класс 11 JEE_Main
Закон, сформулированный доктором Нернстом, представляет собой Первый закон термодинамики 11-го класса химии JEE_Main
Для реакция при rm0rm0rmC и нормальном давлении А химический класс 11 JEE_Main
Двигатель, работающий между rm15rm0rm0rmC и rm2rm5rm0rmC химический класс 11 JEE_Main
0003
Изменение энтальпии перехода жидкой воды, класс 11, химия JEE_Main
Тенденции сомнения
12 Принципы зеленой химии
Разработано Полом Анастасом и Джоном Уорнером в следующих схемах*, в 1998 г. создание более экологичного химического вещества, процесса или продукта.
создание более экологичного химического вещества, процесса или продукта.
Нажимайте на вкладки, чтобы открыть статьи о каждом принципе. Эти статьи изначально были разработаны для блога Nexus.
Лучше предотвратить образование отходов, чем перерабатывать или убирать отходы после их образования.
Предоставлено Беркли В. Кью-младшим, доктором философии, BWC Pharma Consulting, LLC.
В своей публикации « Зеленая химия, теория и практика » в 1998 году Анастас и Уорнер представили свои 12 принципов. Я считаю, что первый принцип, который часто называют принципом предотвращения, является наиболее важным, а остальные принципы — это «как» его достичь
Часто используемой мерой отходов является Е-фактор , описанный Роджером Шелдоном, который связывает вес совместно произведенных отходов с весом желаемого продукта.
 Совсем недавно Фармацевтический круглый стол Института зеленой химии ACS (ACS GCIPR) одобрил массовую интенсивность процесса , которая выражает отношение веса всех используемых материалов (вода, органические растворители, сырье, реагенты, технологические добавки) к весу. произведенного активного ингредиента лекарственного средства (АФИ). Это важная тема круглого стола из-за исторически большого количества отходов, образующихся при производстве лекарств — во многих случаях более 100 кг на килограмм АФИ. Однако, когда компании применяют принципы «зеленой» химии к разработке процесса API, часто достигается резкое сокращение отходов, иногда даже в десять раз. Таким образом, важно распространить впечатляющие результаты, достигнутые ACS GCIPR, на все части фармацевтической промышленности, особенно на биофармацевтические и генерические отрасли, а также на другие отрасли химических предприятий, где синтетическая химия используется для производства их продуктов.
Совсем недавно Фармацевтический круглый стол Института зеленой химии ACS (ACS GCIPR) одобрил массовую интенсивность процесса , которая выражает отношение веса всех используемых материалов (вода, органические растворители, сырье, реагенты, технологические добавки) к весу. произведенного активного ингредиента лекарственного средства (АФИ). Это важная тема круглого стола из-за исторически большого количества отходов, образующихся при производстве лекарств — во многих случаях более 100 кг на килограмм АФИ. Однако, когда компании применяют принципы «зеленой» химии к разработке процесса API, часто достигается резкое сокращение отходов, иногда даже в десять раз. Таким образом, важно распространить впечатляющие результаты, достигнутые ACS GCIPR, на все части фармацевтической промышленности, особенно на биофармацевтические и генерические отрасли, а также на другие отрасли химических предприятий, где синтетическая химия используется для производства их продуктов.Дополнительные ресурсы и примеры:
Process Mass Intensity Tool
Победитель PGCCA 2012 г.
 : Codexis, Inc. и профессор Йи Тан, Калифорнийский университет, Лос-Анджелес « Эффективный биокаталитический процесс производства симвастатина 3»
: Codexis, Inc. и профессор Йи Тан, Калифорнийский университет, Лос-Анджелес « Эффективный биокаталитический процесс производства симвастатина 3»Победитель PGCCA: Pfizer, Inc. «
«Зеленая химия» в обновлении процесса производства сертралина »Pharma Strives for Green Goals , Stephen K. Ritter, Chemical & Engineering News, 90(22), 28 мая 2012 г.
Процитированные статьи:
Фактор E: пятнадцать лет на ; Р.А. Шелдон; Зеленый хим. 2007, (9), стр. 1273-1283, DOI: 10.1039/B713736M
Использование правильного зеленого критерия: почему интенсивность процесса используется в фармацевтической промышленности для управления более устойчивыми процессами ; Консепсьон Хименес-Гонсалес, Селия С. Пондер, Квиринус Б. Брокстерман и Джули Б. Мэнли; Орг. Процесс Рез. Дев., 2011, 15 (4), стр. 912–917, DOI: 10.1021/op20009.7д.
Синтетические методы должны быть разработаны таким образом, чтобы максимально использовать все материалы, используемые в процессе, в конечном продукте.

Предоставлено Майклом Канном, доктором философии, профессором химии Скрэнтонского университета
Второй принцип зеленой химии можно просто сформулировать как «атомную экономику» реакции. Атомная экономика, которую разработал Барри Трост 1 задает вопрос «какие атомы реагентов включаются в конечный желаемый продукт (продукты) и какие атомы теряются?»
Традиционно эффективность реакции измерялась путем расчета процентного выхода. Предположим, что следующая реакция замещения дает 100% выход. Хотя это замечательно, мы можем пролить больше света на эффективность реакции, рассчитав «экономию атомов в процентах» следующим образом:
% экономии атомов = (FW использованных атомов/FW всех реагентов) X 100 = (137/ 275) Х 100 = 50%
Процентная атомная экономия представляет собой просто формульную массу желаемого продукта (продуктов) (соединение 4, 137 г/моль), деленную на сумму формульных масс всех реагентов (275 г/моль), что дает 50% в таком случае.
 Проще говоря, даже если наш процентный выход составляет 100%, только половина массы атомов реагентов включается в желаемый продукт, а другая половина тратится впустую на нежелательные побочные продукты. Представьте, что вы рассказываете маме, что испекли торт и выбросили половину ингредиентов! Таким образом, химики должны не только стремиться к максимальному процентному выходу, но и разрабатывать такие синтезы, которые обеспечивают максимальное включение атомов реагентов в желаемый продукт.
Проще говоря, даже если наш процентный выход составляет 100%, только половина массы атомов реагентов включается в желаемый продукт, а другая половина тратится впустую на нежелательные побочные продукты. Представьте, что вы рассказываете маме, что испекли торт и выбросили половину ингредиентов! Таким образом, химики должны не только стремиться к максимальному процентному выходу, но и разрабатывать такие синтезы, которые обеспечивают максимальное включение атомов реагентов в желаемый продукт.Принцип №2 касается реагентов. Однако, как известно тем из нас, кто проводил химическую реакцию, во время синтеза мы обычно используем другие материалы, такие как растворители и разделяющие агенты. Эти материалы обычно составляют основную часть вводимых материалов, и поэтому мы также должны учитывать отходы, которые из них производятся. Оставайтесь с нами, так как вы увидите, как они обсуждаются в последующих «Принципах зеленой химии».
Дополнительные ресурсы и примеры:
Атомная экономика: мера эффективности реакции .
 Майкл С. Канн и Марк Э. Коннелли; Реальные случаи в зеленой химии; ACS, Вашингтон, 2000 г.
Майкл С. Канн и Марк Э. Коннелли; Реальные случаи в зеленой химии; ACS, Вашингтон, 2000 г.Победитель PGCCA 1998 г.: профессор Барри М. Трост из Стэнфордского университета, « Развитие концепции атомной экономики ».
Процитированные статьи:
1. Атомная экономика – поиск синтетической эффективности; Барри М. Трост; Science 1991, (254), стр. 1471-1477.
Везде, где это практически возможно, методы синтеза должны быть разработаны для использования и получения веществ, малотоксичных или нетоксичных для здоровья человека и окружающей среды.
Предоставлено Дэвидом Дж. К. Констеблом, доктором философии, директором Института зеленой химии ACS. ». Произнесение этих двух слов подразумевает, что может быть непрактично или невозможно избежать использования токсичных веществ, и это, если хотите, карточка выхода из тюрьмы, которую использует большинство химиков, чтобы попытаться избежать применения этого принципа в своей работе.
 Давайте смотреть правде в глаза; химики все время используют токсичные вещества, потому что реактивные химические вещества вызывают реакции, которые кинетически и термодинамически благоприятны. И до тех пор, пока не будут разработаны замещающие химические вещества вместе с новыми синтетическими протоколами, токсичные по своей природе материалы будут продолжать использоваться. Но проще сказать, что это неосуществимо, и не думать о выборе химических веществ.
Давайте смотреть правде в глаза; химики все время используют токсичные вещества, потому что реактивные химические вещества вызывают реакции, которые кинетически и термодинамически благоприятны. И до тех пор, пока не будут разработаны замещающие химические вещества вместе с новыми синтетическими протоколами, токсичные по своей природе материалы будут продолжать использоваться. Но проще сказать, что это неосуществимо, и не думать о выборе химических веществ.Не то чтобы следовать этому принципу особенно трудно; дело скорее в том, что химики не заинтересованы в этом. Для химика-органика важно осуществить успешное химическое превращение новым способом, с новой молекулой или в новом порядке. Я слышал такие аргументы, как «все остальное в колбе просто для того, чтобы сделать трансформацию возможной, так что на самом деле это не имеет значения» или «вы должны быть реалистом и сосредоточиться на науке». Говоря это, мы подразумеваем, что единственная наука, имеющая значение, — это активация атома углерода для его функционализации или добавление лиганда к катализатору и т.
 д. и т. д. Этот принцип требует от химиков расширить свое определение того, что составляет хорошую науку.
д. и т. д. Этот принцип требует от химиков расширить свое определение того, что составляет хорошую науку.Многие снова и снова доказывали, что токсичность и сопутствующие опасности и риски, связанные с химической реакцией, напрямую связаны со всеми остальными «материалами» в колбе. На самом деле химия или химическое преобразование в синтезе обычно меньше всего влияет на общий профиль токсичности (и большинство других показателей устойчивости и экологичности) продукта или процесса, за исключением тех случаев, когда мы намеренно производим молекулу, которая является токсичной или биологически активны по замыслу. Это, безусловно, относится ко многим молекулам, которые синтезируются, например, в фармацевтике или сельском хозяйстве — молекулы токсичны и/или имеют другие последствия для живых организмов.
Химикаты и материалы, используемые для проведения химических превращений, имеют значение, и химикам следует уделять больше внимания выбору того, что они помещают в колбу. Легко отказаться от всех остальных «вещей» и сосредоточить всю нашу энергию на синтетическом пути, который дает желаемый продукт.
 Но когда мы игнорируем все остальные «вещи», мы платим высокую цену, и это цена, которую нам нужно перестать платить.
Но когда мы игнорируем все остальные «вещи», мы платим высокую цену, и это цена, которую нам нужно перестать платить.Иногда химики производят молекулы, которые оказывают токсическое или другое опасное действие, и следующий принцип будет говорить о создании более безопасных молекул.
Химические продукты должны быть разработаны таким образом, чтобы сохранить эффективность функционирования при одновременном снижении токсичности.
Предоставлено Николасом Д. Анастас, доктором философии, Агентство по охране окружающей среды США, Новая Англия
Минимизация токсичности при одновременном сохранении функциональности и эффективности может быть одним из самых сложных аспектов разработки более безопасных продуктов и процессы. Для достижения этой цели требуется понимание не только химии, но и принципов токсикологии и науки об окружающей среде. Высокореактивные химические вещества часто используются химиками для производства продуктов, потому что они очень ценны для воздействия на молекулярные превращения.
 Однако они также с большей вероятностью реагируют с непреднамеренными биологическими целями, человеческими и экологическими, что приводит к нежелательным неблагоприятным последствиям. Без понимания фундаментальной взаимосвязи структурных опасностей даже самый опытный молекулярный волшебник приступает к решению задачи, не имея полного набора инструментов.
Однако они также с большей вероятностью реагируют с непреднамеренными биологическими целями, человеческими и экологическими, что приводит к нежелательным неблагоприятным последствиям. Без понимания фундаментальной взаимосвязи структурных опасностей даже самый опытный молекулярный волшебник приступает к решению задачи, не имея полного набора инструментов.Овладение искусством и наукой токсикологии требует новаторских подходов к химической характеристике, которые утверждают, что опасность является недостатком конструкции и должна быть устранена при зарождении молекулярного дизайна. Опасность, присущая элементам и молекулам, является фундаментальным химическим свойством, которое необходимо характеризовать, оценивать и контролировать в рамках системной стратегии химического проектирования.
Сейчас самое подходящее время для разработки всеобъемлющих и совместных усилий токсикологов и химиков, направленных на обучение следующего поколения ученых разработке более безопасных химических веществ на действительно целостной и междисциплинарной основе с помощью инновационных учебных программ.
 Область токсикологии быстро развивается, включая и применяя достижения молекулярной биологии для выявления механизмов токсичности. Выяснение этих путей служит отправной точкой для формулирования правил проектирования, которые требуются химикам, чтобы направлять их выбор в поисках более безопасных химических веществ. Мы находимся на заре нового рассвета, готового осветить путь к более безопасному, здоровому и устойчивому миру.
Область токсикологии быстро развивается, включая и применяя достижения молекулярной биологии для выявления механизмов токсичности. Выяснение этих путей служит отправной точкой для формулирования правил проектирования, которые требуются химикам, чтобы направлять их выбор в поисках более безопасных химических веществ. Мы находимся на заре нового рассвета, готового осветить путь к более безопасному, здоровому и устойчивому миру.Дополнительные ресурсы и примеры
Anastas, N. Green Toxicology, 2012 г. в: Green Techniques for Organic Synthesis and Medicinal Chemistry , W. Zhang and B. Cue, eds., J Wiley.
Анастас, Н. Д. и Дж. К. Уорнер. 2005. Включение снижения опасности в качестве критерия проектирования в «зеленой» химии , Chem. Здоровье. Безопасность, 3-15 марта/апреля.
Показатели зеленой химии: измерение и мониторинг устойчивых процессов , 2009 г., А. Лапкин и Д. Констебл ред., J. Wiley.
Образование в области зеленой химии: изменение курса химии , 2009 г.
 , серия симпозиумов ACS 1011, P.T. Анастас, И. Леви и К.Е. Родитель, ред. J. Wiley
, серия симпозиумов ACS 1011, P.T. Анастас, И. Леви и К.Е. Родитель, ред. J. WileyDesigning Safer Chemicals , 1996, S. DeVito and R. Garrett eds., ACS Symposium Series 640.
US EPA, 2013, http://epa.gov/ncct/Tox21/ ( по состоянию на 03.03.13)
Отказ от ответственности:
Хотя эти ссылки даны для предоставления дополнительной информации, которая может быть полезной или интересной, EPA не несет ответственности и не может подтвердить точность содержания этих статьи.
Использование вспомогательных веществ (например, растворителей, разделителей и т. д.) должно быть по возможности ненужным и безвредным при использовании.
Доктор Консепсьон (Кончита) Хименес-Гонсалес, директор по операционной устойчивости, GlaxoSmithKline
Это была конференция по зеленой химии, и очень известный химик-синтетик только что получил вопрос о том, почему он выбрал растворитель, вопрос очень плохой выбор.
 Вы должны быть реалистами, химики интуитивно знают, что лучше, а растворители не имеют значения. Это химия, которая имеет значение. Я неоднократно слышал такое замечание на протяжении многих лет, несмотря на то, что оно противоречит духу и букве Принципа 59.0003
Вы должны быть реалистами, химики интуитивно знают, что лучше, а растворители не имеют значения. Это химия, которая имеет значение. Я неоднократно слышал такое замечание на протяжении многих лет, несмотря на то, что оно противоречит духу и букве Принципа 59.0003Растворители и агенты для разделения масс всех видов имеют большое значение для химии, не говоря уже о химическом процессе и общей «зелености» реакции. Во многих случаях реакции не могли бы протекать без растворителей и/или агентов для разделения масс. Сказать, что они не имеют значения или что имеет значение только химия, — это не просто логическая ошибка, это неверно с химической точки зрения. Растворители и разделители обеспечивают перенос массы и энергии, без которых многие реакции не протекают.
Также было показано, что растворители составляют от 50 до 80 процентов массы в стандартной периодической химической операции, в зависимости от того, включаете ли вы воду или нет. Кроме того, на растворители приходится около 75% совокупного воздействия на окружающую среду стандартного периодического химического процесса в течение жизненного цикла.

Растворители и агенты для разделения масс также являются причиной большей части потребления энергии в процессе. Подумайте об этом на мгновение. Растворители попеременно нагревают, перегоняют, охлаждают, перекачивают, смешивают, перегоняют под вакуумом, фильтруют и т. д. И это до того, как они могут или не могут быть переработаны. Если они не перерабатываются, их часто сжигают.
Растворители также являются основными факторами, влияющими на общий профиль токсичности, и из-за этого составляют большинство материалов, вызывающих озабоченность, связанных с технологическим процессом. В среднем они вызывают наибольшую озабоченность по вопросам безопасности технологического процесса, потому что они легко воспламеняются и летучи, или при определенных условиях взрывоопасны. Они также обычно заставляют рабочих надевать те или иные средства индивидуальной защиты.
Нам всегда будут нужны растворители, а многие вещи в химических процессах требуют торговли. Оптимизируйте растворитель в соответствии с одной зеленой метрикой, и много раз есть три других, которые выглядят не так хорошо.
 Цель состоит в том, чтобы выбрать растворители, которые имеют химический смысл, снижают потребность в энергии, имеют наименьшую токсичность, имеют наименьшее воздействие на окружающую среду в течение жизненного цикла и не оказывают серьезного воздействия на безопасность.
Цель состоит в том, чтобы выбрать растворители, которые имеют химический смысл, снижают потребность в энергии, имеют наименьшую токсичность, имеют наименьшее воздействие на окружающую среду в течение жизненного цикла и не оказывают серьезного воздействия на безопасность.Растворители и разделители имеют значение, несмотря на то, что один или несколько известных химиков-органиков могут подумать. Можно сделать лучший выбор, и именно этому должно способствовать применение этого принципа.
Потребности в энергии должны учитывать их экологические и экономические последствия и должны быть сведены к минимуму. Синтетические методы следует проводить при температуре и давлении окружающей среды.
Д-р Дэвид Констебл, директор Института зеленой химии ACS ®
их. Среди синтетических химиков-органиков не уделяется внимания температуре или давлению.
 Химик просто следует протоколу, чтобы довести реакцию до конца и выделить желаемый продукт с максимально возможным выходом. Энергия, с точки зрения химика, не имеет значения и во всех смыслах и целях бесплатна. Просто вставьте заглушку в стену или нагревательный змеевик вокруг колбы или вылейте жидкий азот из сосуда Дьюара.
Химик просто следует протоколу, чтобы довести реакцию до конца и выделить желаемый продукт с максимально возможным выходом. Энергия, с точки зрения химика, не имеет значения и во всех смыслах и целях бесплатна. Просто вставьте заглушку в стену или нагревательный змеевик вокруг колбы или вылейте жидкий азот из сосуда Дьюара.Для тех, кто думает об энергии, большая часть, если не все внимание, которое энергия получает от химиков, посвящено нагреву, охлаждению, разделению, электрохимии, накачке и, неохотно, расчетам, связанным с термодинамикой (например, свободной энергии Гиббса). Внимание не в том, чтобы свести к минимуму или рассмотреть, откуда берется энергия, или если имеет значение, какая форма используется, это просто данность, что нам нужно нагреть или охладить или втолкнуть электроны в реакцию, чтобы образовать или разорвать связи. Размышляя о моем собственном обучении в качестве химика, меня никогда не просили преобразовывать потребности в нагреве, охлаждении, перекачке или электрохимии в стоимость электричества, пара или какой-либо другой полезности.
 Это может быть сделано в химической технологии, но не в химии.
Это может быть сделано в химической технологии, но не в химии.Энергия — ключевой вопрос 21 века. Большая часть производимой энергии основана и будет по-прежнему производиться на ископаемом топливе. И большая часть энергии, которая доставляется к месту использования, теряется при преобразовании и передаче. Это означает, что если вы посмотрите на жизненный цикл производства энергии и посмотрите, сколько энергии фактически доступно для полезной работы в момент необходимости, то это будет меньше 1 или 2 процентов энергии, которая была доступна изначально. в ископаемом топливе. Верно также и то, что большая часть энергии ископаемого топлива используется для транспортных услуг того или иного вида, а второе место по объему использования приходится на отопление и охлаждение помещений. У химиков есть огромное количество возможностей изменить этот профиль энергопотребления, но, по моему опыту, очень немногие химики считают себя частью транспорта или искусственной среды.
Если вы думаете о том, где большинство химиков обучаются энергии, и, конечно же, инженеры-химики, это около ∆H в уравнении свободной энергии Гиббса.
 Теплоты образования, теплоты парообразования, энтальпии, экзотермические реакции и т.д.; это то, о чем мы думаем. Интересно то, что природа в основном работает с ∆S и слабыми силами взаимодействия. Вы не увидите дерево, осуществляющее фотосинтез при кипячении с использованием растворителя, или клеточную мембрану, не выдавливаемую при температуре плавления чего-то вроде полистирола.
Теплоты образования, теплоты парообразования, энтальпии, экзотермические реакции и т.д.; это то, о чем мы думаем. Интересно то, что природа в основном работает с ∆S и слабыми силами взаимодействия. Вы не увидите дерево, осуществляющее фотосинтез при кипячении с использованием растворителя, или клеточную мембрану, не выдавливаемую при температуре плавления чего-то вроде полистирола.Энергия и вовлечение химиков в размышления об энергии — это гораздо больше, чем просто просьба проводить реакции при температуре и давлении окружающей среды. На сами реакции редко уходит большая часть энергии; большинство из них используется при удалении растворителя для подготовки к следующей реакции, или для удаления одного растворителя и замены его другим, или для выделения желаемого продукта, или для удаления примесей. Помимо гидрирования или реакций, чувствительных к кислороду или влаге, большинство реакций проводят при атмосферном давлении. Это не означает, что энергия не важна, она просто важна в тех областях, где большинство химиков не занимается.

Опять же, размышление о более чем одной части реакции или процесса при разработке новой молекулы имеет решающее значение не только с точки зрения энергии, но и с многих других точек зрения. Энергия — например, размышления о том, как организовать синтез с наименьшим количеством стадий, или использовать самые дешевые исходные материалы, или любой другой аспект, представляющий интерес для химика-синтетика или технолога, — это просто еще один параметр проектирования. Исторически так не считалось, но мы больше не можем позволить себе конструировать новые молекулы без подробного и расширенного рассмотрения того, как будет использоваться энергия.
Сырье или исходные материалы должны быть возобновляемыми, а не истощаться, когда это технически и экономически целесообразно.
Доктор Ричард Вул, профессор химической и биомолекулярной инженерии и директор программы «Доступные композиты из возобновляемых материалов» Университета Делавэра.

Концепция производства всех наших будущих видов топлива, химикатов и материалов из сырья, которое никогда не истощается, представляет собой интересную концепцию, которая на первый взгляд кажется неосуществимой. В настоящее время человечество извлекает ископаемое топливо, уголь, нефть и природный газ из-под земли и извлекает полезные ископаемые для получения прибыли, пока они не истощатся. В частности, наши запасы ископаемого топлива для углеродсодержащих химических веществ и материалов предсказуемым образом быстро истощаются в связи с ожидаемым ростом населения планеты и расширением энергоемкой экономики на нескольких континентах. Воздействие на здоровье человека и окружающую среду является значительным и создаст серьезные проблемы для наших ученых и руководителей в ближайшие 50 лет.
Можем ли мы решить эти глобальные проблемы с помощью принципа «Зеленая химия №7»? Да, мы получим наше сырье, как по волшебству, из «из воздуха» и оно будет возобновляемым. Углерод в воздухе находится в форме двуокиси углерода CO 2 и метана CH 4 и удаляется в результате процессов фотосинтеза, приводимых в действие солнцем, с образованием растений, деревьев, сельскохозяйственных культур, водорослей и т.
 д., которые мы вместе называем « биомасса».
д., которые мы вместе называем « биомасса».Ежегодно природа производит около 170 миллиардов тонн биомассы растений, из которых в настоящее время мы используем около 3,5 процентов для нужд человека. Подсчитано, что для полного создания экономики, основанной на биотехнологии, потребуется около 40 миллиардов тонн биомассы, или около 25 процентов годового производства. Техническая задача при использовании такого возобновляемого сырья заключается в разработке низкоэнергетических, нетоксичных способов преобразования биомассы в полезные химические вещества таким образом, чтобы не генерировалось больше углерода, чем удаляется из «разреженного воздуха»; разница между C(in) из воздуха и C(out) из использованной энергии представляет собой углеродный след ΔC. В идеале при использовании принципа № 7 все углеродные следы должны быть положительными, так что C (вход) >> C (выход). Это естественным образом приводит к сокращению выбросов парниковых газов, влияющих на наше текущее изменение климата.
 Мы также должны гарантировать, что новые химические вещества и материалы, полученные из возобновляемых ресурсов, нетоксичны и не вредны для здоровья человека и биосферы.
Мы также должны гарантировать, что новые химические вещества и материалы, полученные из возобновляемых ресурсов, нетоксичны и не вредны для здоровья человека и биосферы.В 2002 г. Министерство энергетики США в своем видении биоэнергии и биопродуктов в США заявило:
«К 2030 г. ожидается хорошо зарекомендовавшая себя, экономически жизнеспособная отрасль производства биоэнергии и биопродуктов. создать новые экономические возможности для сельской Америки [глобализация посредством локализации], защитить и улучшить окружающую среду, укрепить энергетическую независимость США, обеспечить экономическую безопасность и поставлять потребителям улучшенные продукты».
За последние 10 лет были достигнуты значительные успехи в разработке топлива, химикатов и материалов из возобновляемого сырья. К ним, например, относятся биодизель из растительных масел и водорослей, биоэтанол и бутанол из сахаров и лигноцеллюлозы, пластмассы, пены и термореактивные материалы из лигнина и растительных масел и даже электронные материалы из куриных перьев.
 С точки зрения принципа «зеленой» химии № 7, наше будущее светлое и пронизанное оптимизмом благодаря продолжающемуся плодотворному сотрудничеству между несколькими дисциплинами, включая биотехнологию, агрономию, токсикологию, физику, инженерию и другие, где извлекаются новые виды топлива, химикаты и материалы. возобновляемое сырье из «разреженного воздуха» с минимальным воздействием на здоровье человека и окружающую среду.
С точки зрения принципа «зеленой» химии № 7, наше будущее светлое и пронизанное оптимизмом благодаря продолжающемуся плодотворному сотрудничеству между несколькими дисциплинами, включая биотехнологию, агрономию, токсикологию, физику, инженерию и другие, где извлекаются новые виды топлива, химикаты и материалы. возобновляемое сырье из «разреженного воздуха» с минимальным воздействием на здоровье человека и окружающую среду.Дополнительный ресурс
Видение биоэнергии и биопродуктов в США – обновлено в 2006 г.
Ненужную дериватизацию (использование блокирующих групп, защиту/снятие защиты, временную модификацию физических/химических процессов) следует свести к минимуму или по возможности избегать, поскольку такие стадии требуют дополнительных реагентов и могут привести к образованию отходов.
Питер Дж. Данн, руководитель отдела зеленой химии, Pfizer
Одним из ключевых принципов зеленой химии является сокращение использования производных и защитных групп при синтезе целевых молекул.
 Одним из лучших способов сделать это является использование ферментов. Ферменты настолько специфичны, что часто могут реагировать с одним участком молекулы и оставлять остальную часть молекулы в покое, поэтому защитные группы часто не требуются.
Одним из лучших способов сделать это является использование ферментов. Ферменты настолько специфичны, что часто могут реагировать с одним участком молекулы и оставлять остальную часть молекулы в покое, поэтому защитные группы часто не требуются.Прекрасным примером использования ферментов для устранения защитных групп и процессов очистки является промышленный синтез полусинтетических антибиотиков, таких как ампициллин и амоксициллин.
В первом промышленном синтезе пенициллин G (R=H) сначала защищают в виде силилового эфира [R = Si(Me) 3 ], затем подвергают реакции с пентахлоридом фосфора при -40 o C с образованием хлоримидата 1 Последующий гидролиз дает желаемый 6-АПК, из которого производятся полусинтетические пенициллины.
(i) TMSCl, затем PCl5, PhNMe2, Ch3Cl2, -40oC (ii) n-BuOH, -40oC, затем h3O, 0oC (iii) Пенацилаза, вода
Этот синтез был в значительной степени заменен более новым ферментативным процессом с помощью пен-ацилазы.
 Этот синтез происходит в воде при температуре чуть выше комнатной. Новый синтез имеет много преимуществ с экологической точки зрения, одно из которых заключается в том, что силильная защитная группа не требуется.
Этот синтез происходит в воде при температуре чуть выше комнатной. Новый синтез имеет много преимуществ с экологической точки зрения, одно из которых заключается в том, что силильная защитная группа не требуется.Ежегодно производится более 10 000 метрических тонн 6-APA, и большая часть этого количества производится с помощью экологически чистого ферментативного процесса, так что это фантастический пример того, как «зеленая химия» реально меняет ситуацию.
Дополнительные ресурсы
Важность «зеленой» химии в технологических исследованиях и разработках
Каталитические реагенты (максимально селективные) превосходят стехиометрические реагенты.
Предоставлено Роджером А. Шелдоном, доктором философии, почетным профессором биокатализа и органической химии Делфтского технологического университета и генеральным директором CLEA Technologies B.
 V. отходов при производстве химикатов и сопутствующих товаров: «профилактика лучше лечения» . Это требует изменения парадигмы в концепции эффективности органического синтеза, от той, которая сосредоточена на химическом выходе, к той, которая придает значение минимизации отходов. В чем причина отходов? Ключ лежит в концепции атомной экономики: «методы синтеза должны быть разработаны таким образом, чтобы максимально использовать все материалы, используемые в процессе, в конечном продукте» . На схеме реакции мы сравниваем, например, восстановление кетона до соответствующего вторичного спирта с использованием боргидрида натрия или молекулярного водорода в качестве восстановителя. Восстановление с первым имеет атомную экономию 81%, а восстановление со вторым — 100% атомную экономию, то есть все заканчивается в продукте, и, в принципе, нет отходов.
V. отходов при производстве химикатов и сопутствующих товаров: «профилактика лучше лечения» . Это требует изменения парадигмы в концепции эффективности органического синтеза, от той, которая сосредоточена на химическом выходе, к той, которая придает значение минимизации отходов. В чем причина отходов? Ключ лежит в концепции атомной экономики: «методы синтеза должны быть разработаны таким образом, чтобы максимально использовать все материалы, используемые в процессе, в конечном продукте» . На схеме реакции мы сравниваем, например, восстановление кетона до соответствующего вторичного спирта с использованием боргидрида натрия или молекулярного водорода в качестве восстановителя. Восстановление с первым имеет атомную экономию 81%, а восстановление со вторым — 100% атомную экономию, то есть все заканчивается в продукте, и, в принципе, нет отходов.К сожалению, при нормальных условиях водород ни в какой степени не реагирует с кетонами. Для этого нам нужен катализатор, такой как палладий-на-угле.
 Катализатор определяется как «вещество, которое изменяет скорость реакции, не изменяясь при этом само в процессе» . Он снижает энергию активации реакции, но при этом не расходуется. Это означает, что, по крайней мере в принципе, его можно использовать в небольших количествах и бесконечно перерабатывать, то есть он не производит никаких отходов. Кроме того, молекулярный водород также является наименее дорогим восстановителем, и по этой причине каталитическое гидрирование широко применяется в нефтехимической промышленности, где использование других восстановителей, как правило, экономически нецелесообразно. Однако только в последние два десятилетия, после появления зеленой химии, катализ стал широко применяться в фармацевтической и тонкой химической промышленности с целью минимизации огромного количества отходов, образующихся при использовании стехиометрических неорганических реагентов. . Это включает в себя использование всего спектра катализа: гетерогенных, гомогенных, органокатализаторов и, совсем недавно, собственных изысканных катализаторов природы: ферментов.
Катализатор определяется как «вещество, которое изменяет скорость реакции, не изменяясь при этом само в процессе» . Он снижает энергию активации реакции, но при этом не расходуется. Это означает, что, по крайней мере в принципе, его можно использовать в небольших количествах и бесконечно перерабатывать, то есть он не производит никаких отходов. Кроме того, молекулярный водород также является наименее дорогим восстановителем, и по этой причине каталитическое гидрирование широко применяется в нефтехимической промышленности, где использование других восстановителей, как правило, экономически нецелесообразно. Однако только в последние два десятилетия, после появления зеленой химии, катализ стал широко применяться в фармацевтической и тонкой химической промышленности с целью минимизации огромного количества отходов, образующихся при использовании стехиометрических неорганических реагентов. . Это включает в себя использование всего спектра катализа: гетерогенных, гомогенных, органокатализаторов и, совсем недавно, собственных изысканных катализаторов природы: ферментов. Последние особенно эффективны при катализе высокоселективных процессов со сложными субстратами в мягких условиях и, следовательно, находят широкое применение в фармацевтике и смежных отраслях. Более того, ожидается, что они сыграют важную роль в переходе от химической промышленности, основанной на невозобновляемых ископаемых ресурсах, к более устойчивой биологической экономике, использующей возобновляемую биомассу в качестве сырья, что является еще одной благородной целью зеленой химии.
Последние особенно эффективны при катализе высокоселективных процессов со сложными субстратами в мягких условиях и, следовательно, находят широкое применение в фармацевтике и смежных отраслях. Более того, ожидается, что они сыграют важную роль в переходе от химической промышленности, основанной на невозобновляемых ископаемых ресурсах, к более устойчивой биологической экономике, использующей возобновляемую биомассу в качестве сырья, что является еще одной благородной целью зеленой химии. Дополнительные ресурсы и примеры
Р.А. Шелдон, И. Арендс и У. Ханефельд, Зеленая химия и катализ , Wiley-VCH, Weinheim, 2007 (ISBN 978-3-527-30715-9)
R.A. Шелдон, Основы «зеленой» химии: эффективность проектирования реакций , Хим. соц. 41 (2012) 1437-1451.
Р.А. Шелдон, E Факторы, зеленая химия и катализ: одиссея Chem. коммун. (2008) 3352-3365.
Химические продукты должны быть разработаны таким образом, чтобы в конце их действия они распадались на безвредные продукты разложения и не сохранялись в окружающей среде.

Предоставлено Ричем Уильямсом, основателем и президентом компании Environmental Science & Green Chemistry Consulting, LLC
Специалисты по зеленой химии стремятся оптимизировать коммерческую функцию химического вещества, сводя к минимуму его опасность и риск. Опасность, способность причинять вред, есть неотъемлемая характеристика, вытекающая, как и функция, из стереохимии химического вещества (состава и расположения атомов). Принципы «зеленой» химии 3, 4, 5 и 12 помогают дизайнерам снизить опасность химических веществ. Принцип 10, однако, определяет дизайн продуктов, которые разлагаются после их коммерческого использования, чтобы снизить риск или вероятность причинения вреда. Риск зависит как от присущей молекуле опасности, так и от воздействия — контакта между химическим веществом и биологическим видом. Разложение может устранить значительное воздействие, тем самым сводя к минимуму риск, независимо от опасности используемого химического вещества.
Воздействие стойких химических веществ может быть значительным в результате глобального рассеивания, обусловленного такими свойствами, как летучесть или сорбция частиц, и разделения на организмы на основе таких свойств, как растворимость в жирах.
 Регулирующие органы установили критерии (период полураспада в воде, почве, воздухе), которые определяют стойкость в рамках, используемых для идентификации химических веществ как СБТ (стойкие, способные к биоаккумуляции, токсичные).
Регулирующие органы установили критерии (период полураспада в воде, почве, воздухе), которые определяют стойкость в рамках, используемых для идентификации химических веществ как СБТ (стойкие, способные к биоаккумуляции, токсичные).Целью «зеленой» химии является определение молекулярных характеристик, отвечающих за опасные характеристики и риск. Компромиссы или альтернативные подходы должны быть оценены, когда молекулярные свойства, которые должны быть разработаны для коммерческой функции, перекрываются с теми, которые должны быть разработаны для снижения опасности и риска.
Биодеградация, гидролиз и фотолиз могут быть включены в химические продукты. Точно так же, как знания механистической токсикологии необходимы для выявления и определения молекулярных свойств, лежащих в основе опасностей, понимание механизмов разложения и стойкости необходимо для разработки химических свойств, способствующих разложению, и устранения свойств, способствующих сохранению. Многие стойкие соединения сильно хлорированы.
 Галогены, такие как хлор, являются электроноакцепторными, тем самым ингибируя ферментные системы микробов, поскольку аэробная микробная деградация благоприятствует структурам, богатым электронами.
Галогены, такие как хлор, являются электроноакцепторными, тем самым ингибируя ферментные системы микробов, поскольку аэробная микробная деградация благоприятствует структурам, богатым электронами.Методы прогнозирования, которыми можно руководствоваться при проектировании молекулярной архитектуры, которая, как ожидается, будет разлагаться, включают эмпирические правила, связывающие структурные особенности со способностью к разложению или стойкости, базы данных существующих знаний, модели, которые оценивают способность к биологическому разложению или свойства ПБТ, а также экспериментальные испытания. Все эти инструменты могут быть адаптированы к отдельным химическим секторам и конкретным задачам.
Понимание предполагаемых путей выброса и переноса химического вещества помогает выбрать эффективную стратегию проектирования. Деградация должна происходить в соответствующем(их) отсеке(ах) окружающей среды и со значимой скоростью. Бытовые сточные воды обычно проходят через энергичный биореактор на очистных сооружениях (СОСВ).
 Индустрия потребительских товаров разработала молекулы для удаления в этих биореакторах. В начале 19В 60-х годах промышленность перешла от небиоразлагаемых поверхностно-активных веществ с разветвленной структурой, которые вызывали сильное пенообразование и другие проблемы со здоровьем в поверхностных водах, получающих стоки очистных сооружений, к биоразлагаемым детергентам на основе линейных алкилбензолсульфонатов – подход к инновационному дизайну, который продолжается и сегодня.
Индустрия потребительских товаров разработала молекулы для удаления в этих биореакторах. В начале 19В 60-х годах промышленность перешла от небиоразлагаемых поверхностно-активных веществ с разветвленной структурой, которые вызывали сильное пенообразование и другие проблемы со здоровьем в поверхностных водах, получающих стоки очистных сооружений, к биоразлагаемым детергентам на основе линейных алкилбензолсульфонатов – подход к инновационному дизайну, который продолжается и сегодня.В настоящее время существуют инструменты, позволяющие реализовать принцип 10, но прогресс в механистическом понимании, связывающем молекулярные свойства с опасностями и способностью к разложению, позволит более всесторонне применять зеленую химию для контроля опасностей и рисков. Эффективная коммуникация между дисциплинами также важна для предоставления дизайнерам знаний, которые они могут учитывать в сложностях проектирования продукта. Из-за нормативных и бизнес-ограничений многие решения по дизайну продукта должны приниматься относительно рано.
 Инструменты для прогнозирования принятия решений должны обеспечивать уверенность в отношении опасности и риска таким образом, чтобы это соответствовало срокам и масштабам решений по разработке, и, что наиболее важно, при сохранении гибкости для изменения молекулярного дизайна или состава продукта.
Инструменты для прогнозирования принятия решений должны обеспечивать уверенность в отношении опасности и риска таким образом, чтобы это соответствовало срокам и масштабам решений по разработке, и, что наиболее важно, при сохранении гибкости для изменения молекулярного дизайна или состава продукта.Необходимо дальнейшее развитие аналитических методологий, позволяющих осуществлять оперативный мониторинг и контроль в процессе до образования опасных веществ.
Предоставил Дуглас Рейни, доцент кафедры химии и биохимии Университета штата Южная Дакота
Представьте себе, что вы едете по оживленному шоссе в машине, все окна которой выкрашены в непрозрачный черный цвет!!! Хотя этот сценарий многим кажется нереалистичным (или безопасным), что, если бы у вас была камера 360° и датчики и технологии, разрабатываемые для беспилотных автомобилей? Теперь безопасность ваших поездок на работу более обеспечена.

Это описание, применяемое к автомобилям, иллюстрирует 11-й принцип зеленой химии. Точно так же, как нам нужна обратная связь в реальном времени для обеспечения безопасности вождения, обратная связь в реальном времени необходима для правильного функционирования химических процессов. Большинство химиков знакомы с лабораторным анализом еще со времен бакалавриата. Но анализ также может выполняться в режиме реального времени, в режиме реального времени или в режиме реального времени на химическом заводе, поддисциплина, известная как технологическая аналитическая химия. Такой анализ может обнаруживать изменения температуры процесса или pH до того, как реакция выйдет из-под контроля, может быть определено отравление катализаторов и другие вредные события до того, как произойдет крупный инцидент.
Анализ процесса настолько важен, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США поощряет такой подход к производству, проектированию и контролю фармацевтического производства.
 С 1984 года отраслево-академическое партнерство, Центр аналитической химии процессов, продвигает исследования новых методов аналитической химии процессов.
С 1984 года отраслево-академическое партнерство, Центр аналитической химии процессов, продвигает исследования новых методов аналитической химии процессов.В то время как традиционная роль аналитической химии также способствует достижению целей «зеленой» химии, эффективное применение технологической аналитической химии напрямую способствует безопасной и эффективной работе химических предприятий во всем мире.
Дополнительный ресурс:
Центр анализа и контроля процессов
Вещества и формы веществ, используемых в химическом процессе, следует выбирать таким образом, чтобы свести к минимуму вероятность химических аварий, включая выбросы, взрывы и пожары.
Предоставлено Шелли Брэдли, директором по химическому контролю в кампусе, Hendrix College; д-р Дэвид К. Финстер, профессор химии Виттенбергского университета; и доктор Том Гудвин, профессор химии Элберта Л.
 Фосетта, Колледж Хендрикс
Фосетта, Колледж Хендрикс Безопасность можно определить как контроль признанных опасностей для достижения приемлемого уровня риска. Принцип зеленой химии № 12 известен как «Принцип безопасности». Возможно, это самый недооцененный из двенадцати принципов, но он является логическим следствием многих других принципов. На самом деле практически невозможно достичь целей Принципа 12 без реализации хотя бы одного из остальных. Поскольку сама суть зеленой химии состоит в том, чтобы «…сокращать или устранять использование или образование опасных веществ», существует неотъемлемая связь с лабораторной безопасностью. Хотя есть несколько исключений, большинство принципов зеленой химии приводят к более безопасному сценарию.
Под эгидой Агентства по охране окружающей среды (EPA) основное внимание Green Chemistry явно направлено на то, чтобы сделать окружающую среду более безопасной. Материалы и процессы, более безопасные для окружающей среды, также, вероятно, будут более безопасными для широкой публики.
 Однако еще одна группа населения, получающая выгоду от зеленой химии и не часто упоминаемая, — это рабочие. Производственный или лабораторный работник часто является первым лицом, получающим выгоду от снижения опасности.
Однако еще одна группа населения, получающая выгоду от зеленой химии и не часто упоминаемая, — это рабочие. Производственный или лабораторный работник часто является первым лицом, получающим выгоду от снижения опасности.Здоровье и безопасность работников находятся в ведении Управления по охране труда и здоровья (OSHA). В недавнем выпуске новостей OSHA представила систему управления химическими веществами, предназначенную для повышения безопасности рабочих. Иерархия средств контроля безопасности, изложенная в новом Инструментарии OSHA по переходу на более безопасные химические вещества, иллюстрирует разницу между сосредоточением внимания на контроле или опасной части определения безопасности. Традиционные модели химической безопасности сосредоточены в первую очередь на контрольном компоненте этого определения. На графике (адаптированном из OSHA) показано, что наиболее эффективным средством повышения безопасности является устранение опасного компонента. Поскольку устранение опасностей является основным принципом зеленой химии, этот союз идей зеленой химии как OSHA, так и EPA должен иметь синергетическое воздействие на снижение опасности.




 Вариант 1
Вариант 1
 1 вариант
1 вариант
 В тест входят органическая и неорганическая химии.
В тест входят органическая и неорганическая химии. Лабораторная посуда и оборудование.
Лабораторная посуда и оборудование.
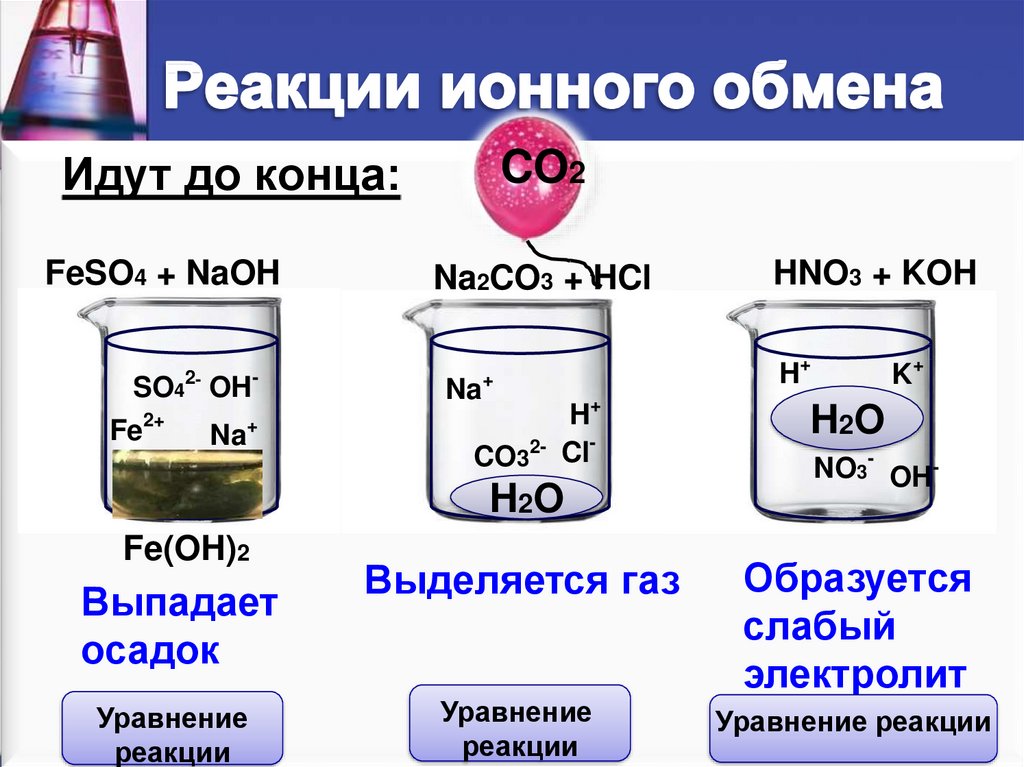 Обобщение 9 класс.
Обобщение 9 класс.
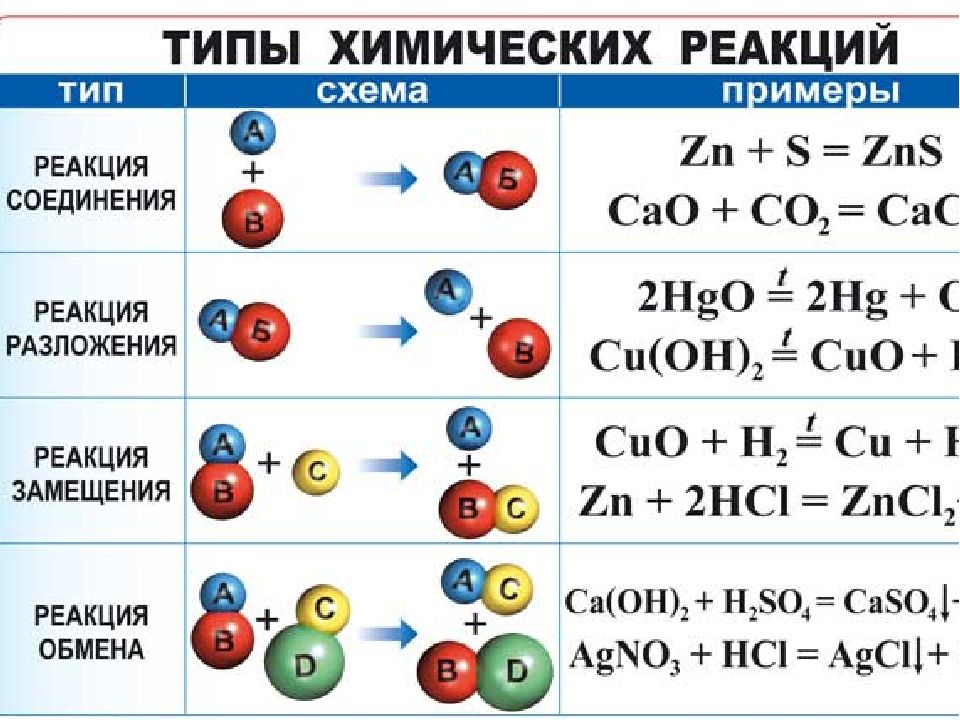 11.2012
18304
11.2012
18304
 09.2012
2266
0
09.2012
2266
0
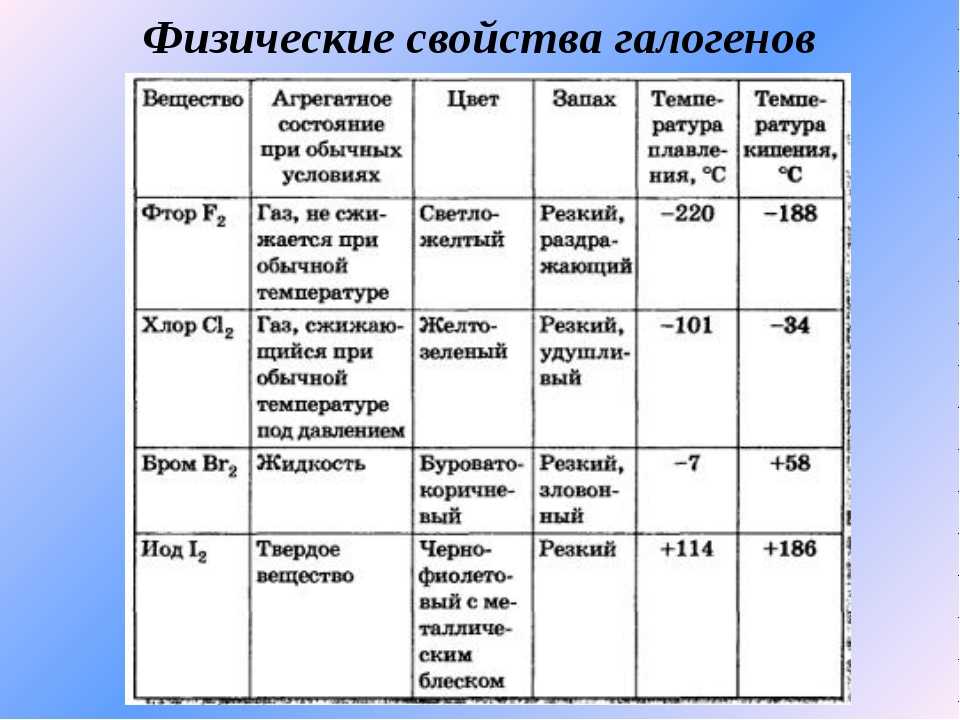 Галогены. Соединения галогенов
Галогены. Соединения галогенов
 Практическая работа «Экспериментальные задачи по теме — Неметаллы»
Практическая работа «Экспериментальные задачи по теме — Неметаллы»
 В древних городах и поселениях уже были специальные места, где оставляли бытовые отходы. В Средние века нечистоты связали с возникновением инфекционных заболеваний, именно потому запретили выливать их на улицы города.
Вплоть до XIX века отходы по большей части представляли только эпидемиологическую опасность. Это были органические вещества и материалы, не загрязняющие окружающую среду. С возникновением промышленности, возникла и проблема мусора. Чем больше разрастались предприятия, тем больше становилось отходов. С началом нефтепереработки ситуация ухудшилась. Теперь возникли отходы, которые и вовсе не разлагаются.
В конце XX века решение проблемы мусора было очень неожиданным. Пластик и другие трудноразлагающиеся предметы попросту вывозились в страны третьего мира. Так в Африке возникли целые регионы, утопающие в мусоре развитых стран. В XXI веке стало понятно, что это не решает проблему, а только усугубляет ее. Сейчас вопрос экологии стал актуальным, как никогда.
В древних городах и поселениях уже были специальные места, где оставляли бытовые отходы. В Средние века нечистоты связали с возникновением инфекционных заболеваний, именно потому запретили выливать их на улицы города.
Вплоть до XIX века отходы по большей части представляли только эпидемиологическую опасность. Это были органические вещества и материалы, не загрязняющие окружающую среду. С возникновением промышленности, возникла и проблема мусора. Чем больше разрастались предприятия, тем больше становилось отходов. С началом нефтепереработки ситуация ухудшилась. Теперь возникли отходы, которые и вовсе не разлагаются.
В конце XX века решение проблемы мусора было очень неожиданным. Пластик и другие трудноразлагающиеся предметы попросту вывозились в страны третьего мира. Так в Африке возникли целые регионы, утопающие в мусоре развитых стран. В XXI веке стало понятно, что это не решает проблему, а только усугубляет ее. Сейчас вопрос экологии стал актуальным, как никогда. 08.2012
19411
08.2012
19411
 Общая характеристика металлов
Общая характеристика металлов
 2 вариант
2 вариант
 04.2020
1326
04.2020
1326
 Химия 9 класс.
Химия 9 класс.  Содержат разные виды заданий: с выбором одного ответа, на установление соответствия, расчетные задачи
Содержат разные виды заданий: с выбором одного ответа, на установление соответствия, расчетные задачи 01.2021
290
0
01.2021
290
0
 2021
86
0
2021
86
0
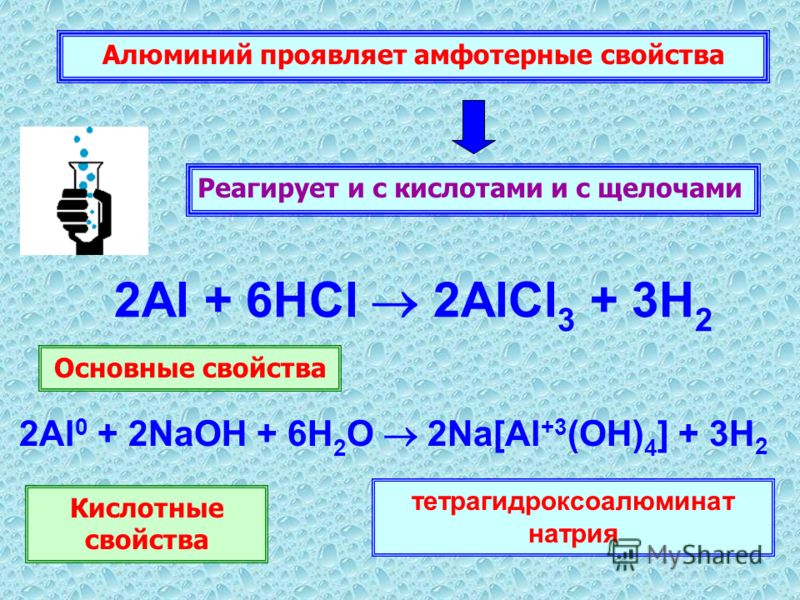 11.2021
114
0
11.2021
114
0
 08.2012
1890
08.2012
1890
 08.2015
333
0
08.2015
333
0
 Но в отличие от группового в индивидуальном исследовании используется еще один важный прием: просят прочесть вслух написанные ответы.
Но в отличие от группового в индивидуальном исследовании используется еще один важный прием: просят прочесть вслух написанные ответы.  12.2016
785
12.2016
785


 Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха.Один из самых распространённых элементов на Земле.Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов.Основной компонент воздуха (78 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака).Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент.Азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот
Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха.Один из самых распространённых элементов на Земле.Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов.Основной компонент воздуха (78 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака).Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент.Азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот 03.2020
7
0
03.2020
7
0
 04.2020
5731
0
04.2020
5731
0
 Тест направлен на знания о строении атома фосфора, химических свойствах фосфора, как простого вещества, так и его соединений. Содержит вопросы на знание его биологической роли и применения.
Тест направлен на знания о строении атома фосфора, химических свойствах фосфора, как простого вещества, так и его соединений. Содержит вопросы на знание его биологической роли и применения. Изучим свойства угольной кислоты и её солей. Рассмотрим взаимопревращения солей.
Изучим свойства угольной кислоты и её солей. Рассмотрим взаимопревращения солей.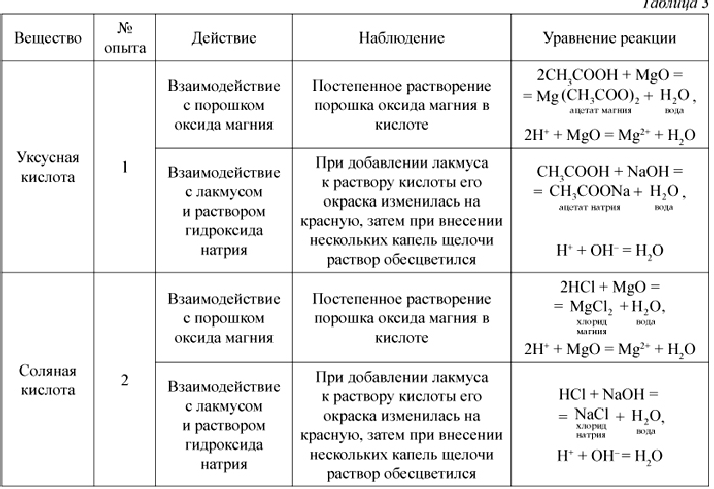 И, Менделлева, его физических свойств, а также химических свойств углерода и его соединений.
И, Менделлева, его физических свойств, а также химических свойств углерода и его соединений. Сложные эфиры. Жиры.
Сложные эфиры. Жиры.
 Содержит 32 вопроса разного уровня сложности.
Содержит 32 вопроса разного уровня сложности. 05.2020
177
0
05.2020
177
0
 05.2020
585
0
05.2020
585
0

 С.Габриляна. Система знаний построенна в полном соответствии со структурой и логикой изложения материала в учебнике, содержит разнообразные по форме задания двух уровней сложности: тесты, задания со свободно конструируемым ответом, расчетные задачи. Значимая часть заданий построена на основе новых методических идей и не имеет опубликованных аналогов.
С.Габриляна. Система знаний построенна в полном соответствии со структурой и логикой изложения материала в учебнике, содержит разнообразные по форме задания двух уровней сложности: тесты, задания со свободно конструируемым ответом, расчетные задачи. Значимая часть заданий построена на основе новых методических идей и не имеет опубликованных аналогов.
 Подходит для тренировки к подготовке к экзамену по химии
Подходит для тренировки к подготовке к экзамену по химии 11.2020
251
11.2020
251
 С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020
С. Габриеляна, И.Г. Остроумова, С.А. Сладкова Химия 9 класс, М.: Просвещение, 2020 В., Михеева И.В.
В., Михеева И.В. В., Михеева И.В.
В., Михеева И.В. Эванс, Д. Дули, О. Подоляко, Ю.Е. Ваулина
Эванс, Д. Дули, О. Подоляко, Ю.Е. Ваулина Л., Дворецкая О.Б.
Л., Дворецкая О.Б. Северная Осетия-Алания
Северная Осетия-Алания

 округ
округ
 округ
округ

 Однако щелочные металлы могут образовывать положительно заряженные ионы для потери электронов.
Однако щелочные металлы могут образовывать положительно заряженные ионы для потери электронов.
 Совсем недавно Фармацевтический круглый стол Института зеленой химии ACS (ACS GCIPR) одобрил массовую интенсивность процесса , которая выражает отношение веса всех используемых материалов (вода, органические растворители, сырье, реагенты, технологические добавки) к весу. произведенного активного ингредиента лекарственного средства (АФИ). Это важная тема круглого стола из-за исторически большого количества отходов, образующихся при производстве лекарств — во многих случаях более 100 кг на килограмм АФИ. Однако, когда компании применяют принципы «зеленой» химии к разработке процесса API, часто достигается резкое сокращение отходов, иногда даже в десять раз. Таким образом, важно распространить впечатляющие результаты, достигнутые ACS GCIPR, на все части фармацевтической промышленности, особенно на биофармацевтические и генерические отрасли, а также на другие отрасли химических предприятий, где синтетическая химия используется для производства их продуктов.
Совсем недавно Фармацевтический круглый стол Института зеленой химии ACS (ACS GCIPR) одобрил массовую интенсивность процесса , которая выражает отношение веса всех используемых материалов (вода, органические растворители, сырье, реагенты, технологические добавки) к весу. произведенного активного ингредиента лекарственного средства (АФИ). Это важная тема круглого стола из-за исторически большого количества отходов, образующихся при производстве лекарств — во многих случаях более 100 кг на килограмм АФИ. Однако, когда компании применяют принципы «зеленой» химии к разработке процесса API, часто достигается резкое сокращение отходов, иногда даже в десять раз. Таким образом, важно распространить впечатляющие результаты, достигнутые ACS GCIPR, на все части фармацевтической промышленности, особенно на биофармацевтические и генерические отрасли, а также на другие отрасли химических предприятий, где синтетическая химия используется для производства их продуктов. : Codexis, Inc. и профессор Йи Тан, Калифорнийский университет, Лос-Анджелес « Эффективный биокаталитический процесс производства симвастатина 3»
: Codexis, Inc. и профессор Йи Тан, Калифорнийский университет, Лос-Анджелес « Эффективный биокаталитический процесс производства симвастатина 3»
 Проще говоря, даже если наш процентный выход составляет 100%, только половина массы атомов реагентов включается в желаемый продукт, а другая половина тратится впустую на нежелательные побочные продукты. Представьте, что вы рассказываете маме, что испекли торт и выбросили половину ингредиентов! Таким образом, химики должны не только стремиться к максимальному процентному выходу, но и разрабатывать такие синтезы, которые обеспечивают максимальное включение атомов реагентов в желаемый продукт.
Проще говоря, даже если наш процентный выход составляет 100%, только половина массы атомов реагентов включается в желаемый продукт, а другая половина тратится впустую на нежелательные побочные продукты. Представьте, что вы рассказываете маме, что испекли торт и выбросили половину ингредиентов! Таким образом, химики должны не только стремиться к максимальному процентному выходу, но и разрабатывать такие синтезы, которые обеспечивают максимальное включение атомов реагентов в желаемый продукт. Майкл С. Канн и Марк Э. Коннелли; Реальные случаи в зеленой химии; ACS, Вашингтон, 2000 г.
Майкл С. Канн и Марк Э. Коннелли; Реальные случаи в зеленой химии; ACS, Вашингтон, 2000 г. Давайте смотреть правде в глаза; химики все время используют токсичные вещества, потому что реактивные химические вещества вызывают реакции, которые кинетически и термодинамически благоприятны. И до тех пор, пока не будут разработаны замещающие химические вещества вместе с новыми синтетическими протоколами, токсичные по своей природе материалы будут продолжать использоваться. Но проще сказать, что это неосуществимо, и не думать о выборе химических веществ.
Давайте смотреть правде в глаза; химики все время используют токсичные вещества, потому что реактивные химические вещества вызывают реакции, которые кинетически и термодинамически благоприятны. И до тех пор, пока не будут разработаны замещающие химические вещества вместе с новыми синтетическими протоколами, токсичные по своей природе материалы будут продолжать использоваться. Но проще сказать, что это неосуществимо, и не думать о выборе химических веществ. д. и т. д. Этот принцип требует от химиков расширить свое определение того, что составляет хорошую науку.
д. и т. д. Этот принцип требует от химиков расширить свое определение того, что составляет хорошую науку. Но когда мы игнорируем все остальные «вещи», мы платим высокую цену, и это цена, которую нам нужно перестать платить.
Но когда мы игнорируем все остальные «вещи», мы платим высокую цену, и это цена, которую нам нужно перестать платить. Однако они также с большей вероятностью реагируют с непреднамеренными биологическими целями, человеческими и экологическими, что приводит к нежелательным неблагоприятным последствиям. Без понимания фундаментальной взаимосвязи структурных опасностей даже самый опытный молекулярный волшебник приступает к решению задачи, не имея полного набора инструментов.
Однако они также с большей вероятностью реагируют с непреднамеренными биологическими целями, человеческими и экологическими, что приводит к нежелательным неблагоприятным последствиям. Без понимания фундаментальной взаимосвязи структурных опасностей даже самый опытный молекулярный волшебник приступает к решению задачи, не имея полного набора инструментов. Область токсикологии быстро развивается, включая и применяя достижения молекулярной биологии для выявления механизмов токсичности. Выяснение этих путей служит отправной точкой для формулирования правил проектирования, которые требуются химикам, чтобы направлять их выбор в поисках более безопасных химических веществ. Мы находимся на заре нового рассвета, готового осветить путь к более безопасному, здоровому и устойчивому миру.
Область токсикологии быстро развивается, включая и применяя достижения молекулярной биологии для выявления механизмов токсичности. Выяснение этих путей служит отправной точкой для формулирования правил проектирования, которые требуются химикам, чтобы направлять их выбор в поисках более безопасных химических веществ. Мы находимся на заре нового рассвета, готового осветить путь к более безопасному, здоровому и устойчивому миру. , серия симпозиумов ACS 1011, P.T. Анастас, И. Леви и К.Е. Родитель, ред. J. Wiley
, серия симпозиумов ACS 1011, P.T. Анастас, И. Леви и К.Е. Родитель, ред. J. Wiley Вы должны быть реалистами, химики интуитивно знают, что лучше, а растворители не имеют значения. Это химия, которая имеет значение. Я неоднократно слышал такое замечание на протяжении многих лет, несмотря на то, что оно противоречит духу и букве Принципа 59.0003
Вы должны быть реалистами, химики интуитивно знают, что лучше, а растворители не имеют значения. Это химия, которая имеет значение. Я неоднократно слышал такое замечание на протяжении многих лет, несмотря на то, что оно противоречит духу и букве Принципа 59.0003
 Цель состоит в том, чтобы выбрать растворители, которые имеют химический смысл, снижают потребность в энергии, имеют наименьшую токсичность, имеют наименьшее воздействие на окружающую среду в течение жизненного цикла и не оказывают серьезного воздействия на безопасность.
Цель состоит в том, чтобы выбрать растворители, которые имеют химический смысл, снижают потребность в энергии, имеют наименьшую токсичность, имеют наименьшее воздействие на окружающую среду в течение жизненного цикла и не оказывают серьезного воздействия на безопасность. Химик просто следует протоколу, чтобы довести реакцию до конца и выделить желаемый продукт с максимально возможным выходом. Энергия, с точки зрения химика, не имеет значения и во всех смыслах и целях бесплатна. Просто вставьте заглушку в стену или нагревательный змеевик вокруг колбы или вылейте жидкий азот из сосуда Дьюара.
Химик просто следует протоколу, чтобы довести реакцию до конца и выделить желаемый продукт с максимально возможным выходом. Энергия, с точки зрения химика, не имеет значения и во всех смыслах и целях бесплатна. Просто вставьте заглушку в стену или нагревательный змеевик вокруг колбы или вылейте жидкий азот из сосуда Дьюара. Это может быть сделано в химической технологии, но не в химии.
Это может быть сделано в химической технологии, но не в химии. Теплоты образования, теплоты парообразования, энтальпии, экзотермические реакции и т.д.; это то, о чем мы думаем. Интересно то, что природа в основном работает с ∆S и слабыми силами взаимодействия. Вы не увидите дерево, осуществляющее фотосинтез при кипячении с использованием растворителя, или клеточную мембрану, не выдавливаемую при температуре плавления чего-то вроде полистирола.
Теплоты образования, теплоты парообразования, энтальпии, экзотермические реакции и т.д.; это то, о чем мы думаем. Интересно то, что природа в основном работает с ∆S и слабыми силами взаимодействия. Вы не увидите дерево, осуществляющее фотосинтез при кипячении с использованием растворителя, или клеточную мембрану, не выдавливаемую при температуре плавления чего-то вроде полистирола.

 д., которые мы вместе называем « биомасса».
д., которые мы вместе называем « биомасса». Мы также должны гарантировать, что новые химические вещества и материалы, полученные из возобновляемых ресурсов, нетоксичны и не вредны для здоровья человека и биосферы.
Мы также должны гарантировать, что новые химические вещества и материалы, полученные из возобновляемых ресурсов, нетоксичны и не вредны для здоровья человека и биосферы. С точки зрения принципа «зеленой» химии № 7, наше будущее светлое и пронизанное оптимизмом благодаря продолжающемуся плодотворному сотрудничеству между несколькими дисциплинами, включая биотехнологию, агрономию, токсикологию, физику, инженерию и другие, где извлекаются новые виды топлива, химикаты и материалы. возобновляемое сырье из «разреженного воздуха» с минимальным воздействием на здоровье человека и окружающую среду.
С точки зрения принципа «зеленой» химии № 7, наше будущее светлое и пронизанное оптимизмом благодаря продолжающемуся плодотворному сотрудничеству между несколькими дисциплинами, включая биотехнологию, агрономию, токсикологию, физику, инженерию и другие, где извлекаются новые виды топлива, химикаты и материалы. возобновляемое сырье из «разреженного воздуха» с минимальным воздействием на здоровье человека и окружающую среду. Одним из лучших способов сделать это является использование ферментов. Ферменты настолько специфичны, что часто могут реагировать с одним участком молекулы и оставлять остальную часть молекулы в покое, поэтому защитные группы часто не требуются.
Одним из лучших способов сделать это является использование ферментов. Ферменты настолько специфичны, что часто могут реагировать с одним участком молекулы и оставлять остальную часть молекулы в покое, поэтому защитные группы часто не требуются. Этот синтез происходит в воде при температуре чуть выше комнатной. Новый синтез имеет много преимуществ с экологической точки зрения, одно из которых заключается в том, что силильная защитная группа не требуется.
Этот синтез происходит в воде при температуре чуть выше комнатной. Новый синтез имеет много преимуществ с экологической точки зрения, одно из которых заключается в том, что силильная защитная группа не требуется. V. отходов при производстве химикатов и сопутствующих товаров: «профилактика лучше лечения» . Это требует изменения парадигмы в концепции эффективности органического синтеза, от той, которая сосредоточена на химическом выходе, к той, которая придает значение минимизации отходов. В чем причина отходов? Ключ лежит в концепции атомной экономики: «методы синтеза должны быть разработаны таким образом, чтобы максимально использовать все материалы, используемые в процессе, в конечном продукте» . На схеме реакции мы сравниваем, например, восстановление кетона до соответствующего вторичного спирта с использованием боргидрида натрия или молекулярного водорода в качестве восстановителя. Восстановление с первым имеет атомную экономию 81%, а восстановление со вторым — 100% атомную экономию, то есть все заканчивается в продукте, и, в принципе, нет отходов.
V. отходов при производстве химикатов и сопутствующих товаров: «профилактика лучше лечения» . Это требует изменения парадигмы в концепции эффективности органического синтеза, от той, которая сосредоточена на химическом выходе, к той, которая придает значение минимизации отходов. В чем причина отходов? Ключ лежит в концепции атомной экономики: «методы синтеза должны быть разработаны таким образом, чтобы максимально использовать все материалы, используемые в процессе, в конечном продукте» . На схеме реакции мы сравниваем, например, восстановление кетона до соответствующего вторичного спирта с использованием боргидрида натрия или молекулярного водорода в качестве восстановителя. Восстановление с первым имеет атомную экономию 81%, а восстановление со вторым — 100% атомную экономию, то есть все заканчивается в продукте, и, в принципе, нет отходов. Катализатор определяется как «вещество, которое изменяет скорость реакции, не изменяясь при этом само в процессе» . Он снижает энергию активации реакции, но при этом не расходуется. Это означает, что, по крайней мере в принципе, его можно использовать в небольших количествах и бесконечно перерабатывать, то есть он не производит никаких отходов. Кроме того, молекулярный водород также является наименее дорогим восстановителем, и по этой причине каталитическое гидрирование широко применяется в нефтехимической промышленности, где использование других восстановителей, как правило, экономически нецелесообразно. Однако только в последние два десятилетия, после появления зеленой химии, катализ стал широко применяться в фармацевтической и тонкой химической промышленности с целью минимизации огромного количества отходов, образующихся при использовании стехиометрических неорганических реагентов. . Это включает в себя использование всего спектра катализа: гетерогенных, гомогенных, органокатализаторов и, совсем недавно, собственных изысканных катализаторов природы: ферментов.
Катализатор определяется как «вещество, которое изменяет скорость реакции, не изменяясь при этом само в процессе» . Он снижает энергию активации реакции, но при этом не расходуется. Это означает, что, по крайней мере в принципе, его можно использовать в небольших количествах и бесконечно перерабатывать, то есть он не производит никаких отходов. Кроме того, молекулярный водород также является наименее дорогим восстановителем, и по этой причине каталитическое гидрирование широко применяется в нефтехимической промышленности, где использование других восстановителей, как правило, экономически нецелесообразно. Однако только в последние два десятилетия, после появления зеленой химии, катализ стал широко применяться в фармацевтической и тонкой химической промышленности с целью минимизации огромного количества отходов, образующихся при использовании стехиометрических неорганических реагентов. . Это включает в себя использование всего спектра катализа: гетерогенных, гомогенных, органокатализаторов и, совсем недавно, собственных изысканных катализаторов природы: ферментов. Последние особенно эффективны при катализе высокоселективных процессов со сложными субстратами в мягких условиях и, следовательно, находят широкое применение в фармацевтике и смежных отраслях. Более того, ожидается, что они сыграют важную роль в переходе от химической промышленности, основанной на невозобновляемых ископаемых ресурсах, к более устойчивой биологической экономике, использующей возобновляемую биомассу в качестве сырья, что является еще одной благородной целью зеленой химии.
Последние особенно эффективны при катализе высокоселективных процессов со сложными субстратами в мягких условиях и, следовательно, находят широкое применение в фармацевтике и смежных отраслях. Более того, ожидается, что они сыграют важную роль в переходе от химической промышленности, основанной на невозобновляемых ископаемых ресурсах, к более устойчивой биологической экономике, использующей возобновляемую биомассу в качестве сырья, что является еще одной благородной целью зеленой химии. 
 Регулирующие органы установили критерии (период полураспада в воде, почве, воздухе), которые определяют стойкость в рамках, используемых для идентификации химических веществ как СБТ (стойкие, способные к биоаккумуляции, токсичные).
Регулирующие органы установили критерии (период полураспада в воде, почве, воздухе), которые определяют стойкость в рамках, используемых для идентификации химических веществ как СБТ (стойкие, способные к биоаккумуляции, токсичные). Галогены, такие как хлор, являются электроноакцепторными, тем самым ингибируя ферментные системы микробов, поскольку аэробная микробная деградация благоприятствует структурам, богатым электронами.
Галогены, такие как хлор, являются электроноакцепторными, тем самым ингибируя ферментные системы микробов, поскольку аэробная микробная деградация благоприятствует структурам, богатым электронами. Индустрия потребительских товаров разработала молекулы для удаления в этих биореакторах. В начале 19В 60-х годах промышленность перешла от небиоразлагаемых поверхностно-активных веществ с разветвленной структурой, которые вызывали сильное пенообразование и другие проблемы со здоровьем в поверхностных водах, получающих стоки очистных сооружений, к биоразлагаемым детергентам на основе линейных алкилбензолсульфонатов – подход к инновационному дизайну, который продолжается и сегодня.
Индустрия потребительских товаров разработала молекулы для удаления в этих биореакторах. В начале 19В 60-х годах промышленность перешла от небиоразлагаемых поверхностно-активных веществ с разветвленной структурой, которые вызывали сильное пенообразование и другие проблемы со здоровьем в поверхностных водах, получающих стоки очистных сооружений, к биоразлагаемым детергентам на основе линейных алкилбензолсульфонатов – подход к инновационному дизайну, который продолжается и сегодня. Инструменты для прогнозирования принятия решений должны обеспечивать уверенность в отношении опасности и риска таким образом, чтобы это соответствовало срокам и масштабам решений по разработке, и, что наиболее важно, при сохранении гибкости для изменения молекулярного дизайна или состава продукта.
Инструменты для прогнозирования принятия решений должны обеспечивать уверенность в отношении опасности и риска таким образом, чтобы это соответствовало срокам и масштабам решений по разработке, и, что наиболее важно, при сохранении гибкости для изменения молекулярного дизайна или состава продукта.
 С 1984 года отраслево-академическое партнерство, Центр аналитической химии процессов, продвигает исследования новых методов аналитической химии процессов.
С 1984 года отраслево-академическое партнерство, Центр аналитической химии процессов, продвигает исследования новых методов аналитической химии процессов. Фосетта, Колледж Хендрикс
Фосетта, Колледж Хендрикс  Однако еще одна группа населения, получающая выгоду от зеленой химии и не часто упоминаемая, — это рабочие. Производственный или лабораторный работник часто является первым лицом, получающим выгоду от снижения опасности.
Однако еще одна группа населения, получающая выгоду от зеленой химии и не часто упоминаемая, — это рабочие. Производственный или лабораторный работник часто является первым лицом, получающим выгоду от снижения опасности.