Оксид марганца(IV), химические свойства, получение
1
H
ВодородВодород
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
ГелийГелий
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
ЛитийЛитий
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
БериллийБериллий
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
БорБор
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
УглеродУглерод
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
7
N
АзотАзот
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
КислородКислород
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
ФторФтор
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
НеонНеон
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
НатрийНатрий
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
МагнийМагний
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
АлюминийАлюминий
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
КремнийКремний
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
ФосфорФосфор
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
СераСера
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
ХлорХлор
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
АргонАргон
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
КалийКалий
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
КальцийКальций
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
СкандийСкандий
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
ТитанТитан
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
ВанадийВанадий
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
ХромХром
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
МарганецМарганец
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
ЖелезоЖелезо
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
КобальтКобальт
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
НикельНикель
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
МедьМедь
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
ЦинкЦинк
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
ГаллийГаллий
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
ГерманийГерманий
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
МышьякМышьяк
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
СеленСелен
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
БромБром
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
КриптонКриптон
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
РубидийРубидий
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
СтронцийСтронций
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
ИттрийИттрий
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
ЦирконийЦирконий
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
НиобийНиобий
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
МолибденМолибден
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
ТехнецийТехнеций
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
РутенийРутений
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
РодийРодий
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
ПалладийПалладий
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
СереброСеребро
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
КадмийКадмий
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
ИндийИндий
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
ОловоОлово
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
СурьмаСурьма
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
ТеллурТеллур
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
ИодИод
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
КсенонКсенон
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
ЦезийЦезий
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
БарийБарий
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
ЛантанЛантан
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
ЦерийЦерий
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
ПразеодимПразеодим
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
НеодимНеодим
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
ПрометийПрометий
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
СамарийСамарий
150,36
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
ЕвропийЕвропий
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
ГадолинийГадолиний
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
ТербийТербий
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
ДиспрозийДиспрозий
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
ГольмийГольмий
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
ЭрбийЭрбий
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
ТулийТулий
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
ИттербийИттербий
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
ЛютецийЛютеций
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
ГафнийГафний
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
ТанталТантал
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
ВольфрамВольфрам
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
РенийРений
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
ОсмийОсмий
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
ИридийИридий
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
ПлатинаПлатина
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
ЗолотоЗолото
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
РтутьРтуть
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
ТаллийТаллий
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
СвинецСвинец
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
ВисмутВисмут
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
ПолонийПолоний
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
АстатАстат
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
РадонРадон
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
ФранцийФранций
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
РадийРадий
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
АктинийАктиний
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
ТорийТорий
232,04
f-элемент
Серый мягкий металл
91
Pa
ПротактинийПротактиний
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
УранУран
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
НептунийНептуний
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
ПлутонийПлутоний
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
АмерицийАмериций
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
КюрийКюрий
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
БерклийБерклий
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
КалифорнийКалифорний
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
ЭйнштейнийЭйнштейний
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
ФермийФермий
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
МенделевийМенделевий
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
НобелийНобелий
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
ЛоуренсийЛоуренсий
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
РезерфордийРезерфордий
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
ДубнийДубний
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
СиборгийСиборгий
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
БорийБорий
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
ХассийХассий
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
МейтнерийМейтнерий
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
ДармштадтийДармштадтий
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Задачи 30, 31 ЕГЭ по химии-2020
Задачи 30 и 31 из реального ЕГЭ по химии-2020, все задачи на окислительно-восстановительные реакции из реального экзамена ЕГЭ по химии, задания 30 и 31 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с текстовыми решениями и ответами.
| Выдержка из формулировки каждого варианта 30 задания: «В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.» Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.» Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания. Примечания: 1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества. 2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации. 3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту. |
1. Нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II).
2. Пероксид водорода, сульфид цинка, гидроксид калия, гидроксид хрома(III), сульфат аммония, хлорид бария.
3. Серная кислота, гидрокарбонат бария, сульфат калия, оксид меди(I), оксид марганца(IV), гидроксид калия.
4. Ацетат бария, гидросульфат натрия, оксид железа(II), пероксид водорода, гидроксид хрома(III), серная кислота.
5. Гидроксид бария, сульфит калия, аммиак, нитрат серебра, перманганат калия, дигидрофосфат калия.
6. Хромат калия, оксид серы(IV), нитрит калия, хлор, ацетат серебра, хлорид кальция.
7. Гидрокарбонат магния, сульфит калия, сульфат железа(II), дихромат калия, фосфат кальция, серная кислота.
8. Хромат натрия, бромид натрия, нитрит натрия, серная кислота, ацетат серебра, хлорид аммония.
9. Перманганат калия, иодоводород, гидроксид бария, серная кислота, сульфит аммония, гидрофосфат натрия.
10. Азотная кислота, гидроксид железа(II), хлорат калия, ацетат серебра, оксид хрома(III), сероводород.
11. Гидроксид стронция, сульфид меди(II), фосфин, азотная кислота, перманганат калия, дигидрофосфат натрия.
12. Азотная кислота, оксид меди(I), сероводород, ацетат аммония, оксид железа(III), оксид хрома(VI).
13. Ацетат бария, нитрит магния, сульфат железа(II), хромат калия, гидроксид меди(II), серная кислота.
14. Пероксид водорода, гидроксид железа(II), перманганат калия, дигидрофосфат магния, серная кислота, гидроксид калия.
Пероксид водорода, гидроксид железа(II), перманганат калия, дигидрофосфат магния, серная кислота, гидроксид калия.
15. Перманганат калия, гидроксид калия, гидрокарбонат кальция, пероксид водорода, серная кислота, йодид калия.
16. Перманганат калия, гидроксид хрома(III), хлор, сульфит аммония, бромоводород, гидроксид бария.
17. Перманганат калия, гидроксид лития, бром, сульфит аммония, хлороводород, нитрат кальция.
18. Ацетат аммония, гидроксид натрия, перманганат натрия, соляная кислота, нитрит натрия, оксид марганца(IV).
19. Силикат натрия, нитрит калия, дихромат калия, серная кислота, йодид калия, ацетат аммония.
20. Перманганат натрия, соляная кислота, сульфит натрия, хлорид бария, гидросульфат калия, бром.
21. Сульфид железа(II), гидроксид калия, перманганат калия, серная кислота, нитрит калия, гидрокарбонат бария.
22. Серная кислота, дихромат калия, сульфид меди(II), фосфин, гидроксид бария, ацетат аммония.
23. Сульфид меди(II), сера, цинк, азотная кислота, гидрокарбонат аммония, ацетат кальция.
24. Силикат калия, нитрит натрия, дихромат натрия, серная кислота, бромид натрия, ацетат аммония.
25. Нитрит калия, перманганат калия, серная кислота, гидроксид калия, нитрат аммония, сульфид железа(II).
26. Перманганат калия, соляная кислота, сульфит калия, нитрат бария, гидросульфат аммония, йод.
27. Сульфит бария, гидроксид натрия, перманганат натрия, серная кислота, нитрит натрия, гидрокарбонат магния.
28. Оксид серы(IV), пероксид натрия, гидрофосфат натрия, аммиак, йодоводород, гидроксид натрия.
29. Гидроксид бария, сероводород, аммиак, оксид серы(IV), перманганат натрия, дигидрофосфат натрия.
30. Гидрокарбонат магния, оксид кремния, нитрат аммония, серная кислота, графит, фосфин.
31. Азотная кислота, оксид меди(I), оксид марганца(IV), хлорид железа(III), сера, фторид аммония.
32. Перманганат калия, гидрокарбонат натрия, сульфит натрия, сульфат бария, гидроксид калия, пероксид водорода.
Понравилось это:
Нравится Загрузка…
Окисления системой «перекись водорода–комплекс марганца(IV)–карбоновая кислота». Часть 4. Эффективное кислотно-основное переключение между каталазной и оксигеназной активностью биядерного комплекса марганца(IV) в реакции с h3O2 и алканом
Часть 4.† Эффективное кислотно-основное переключение между каталазной и оксигеназной активностью биядерного комплекса марганца(IV) IV) комплекс в реакции с H 2 O 2 и алканом
Георгий Б. Шульпин* а Галина В.
Низова, и Юрий Н.
Козлов и а также
Ирина Г.
Печенкина и
Шульпин* а Галина В.
Низова, и Юрий Н.
Козлов и а также
Ирина Г.
Печенкина и
Принадлежности автора
* Соответствующие авторы
и Семенова Институт химической физики РАН, ул. Косыгина, дом 4, Москва, Россия
Электронная почта: [email protected],
Сайт: http://members. fortunecity.com/shulpin
fortunecity.com/shulpin
Аннотация
Тогда как биядерный комплекс марганца ( I V ) [LMn(O) 3 MnL](PF 6 ) 2 ( 1a , L = 1,4,7-триметил-1,4,7-триазациклононан) не реагирует с H 2 O 2 в растворе ацетонитрила, содержащем циклогексан, к этому добавляют уксусную кислоту смесь в небольших количествах вызывает каталитическое разложение пероксида водорода до O 2 и H 2 O (каталазная активность) и превращение циклогексана в циклогексилгидропероксид (оксигеназная активность). Добавление к раствору, содержащему уксусную кислоту, только 2 экв. (относительно Mn-катализатора) основания повышает активность каталазы и подавляет активность оксигеназы. Предлагаемый механизм включает образование биядерных дигидропероксипроизводных марганца, которые под действием уксусной кислоты могут трансформироваться в OMn( В )–Мн( I В )–OOH
разновидность. Последний может отрывать атом водорода от алкана. Взаимодействие образовавшегося радикала R˙ с Mn( I V )–OOH может дать алкилгидропероксид ROOH, который является основным первичным продуктом процесса окисления.
Предлагаемый механизм включает образование биядерных дигидропероксипроизводных марганца, которые под действием уксусной кислоты могут трансформироваться в OMn( В )–Мн( I В )–OOH
разновидность. Последний может отрывать атом водорода от алкана. Взаимодействие образовавшегося радикала R˙ с Mn( I V )–OOH может дать алкилгидропероксид ROOH, который является основным первичным продуктом процесса окисления.
Термокаталитическое поведение оксида марганца (IV) как нанопористого материала при диссоциации газовой смеси, содержащей пероксид водорода
1. Писарчик К. Соединения марганца. В: Крошвиц Дж. И., Зайдель А., Кирк Р. Э., Отмер Д. Ф., редакторы. Энциклопедия химической технологии Кирка-Отмера. Wiley-Interscience; Hoboken, NJ, USA: 2005. [Google Scholar]
2. Kappenstein C., Zaki M.I. Рентгеновская фотоэлектронная спектроскопия и дифрактометрия катализаторов MnO x : взаимосвязь состава поверхности и объема. Zeitschrift für Physikalische Chemie. 1992; 176: 97–116. [Google Scholar]
Zeitschrift für Physikalische Chemie. 1992; 176: 97–116. [Google Scholar]
3. Гарвиг П.Л. Гетерогенное разложение H 2 O 2 неорганическими катализаторами: Технический отчет AFRPL-TR-66-136, 1966
4. Koopmans R.J., Shrimpton J.S., Roberts G.T. Валидация и оптимизация конструкции двигателя на перекиси водорода; Материалы 47-й совместной конференции и выставки по двигателям AIAA/ASME/SAE/ASEE; Сан-Диего, Калифорния, США. 31 июля – 3 августа 2011 г.; Рестон, Вирджиния, США: Американский институт аэронавтики и астронавтики; 2011. [Google Scholar]
5. Бротон Д.Б., Вентворт Р.Л. Механизм разложения растворов перекиси водорода диоксидом марганца. И. Дж. Ам. хим. соц. 1947;69:741–744. doi: 10.1021/ja01196a003. [PubMed] [CrossRef] [Google Scholar]. и A = K или Sr) перовскиты. заявл. Катал. Ген. 2001; 215: 245–256. doi: 10.1016/S0926-860X(01)00536-1. [CrossRef] [Google Scholar]
7. До С.Х., Бэтчелор Б., Ли Х.К., Конг С.Х. Разложение пероксида водорода на оксиде марганца (пиролюзите): кинетика, промежуточные продукты и механизм.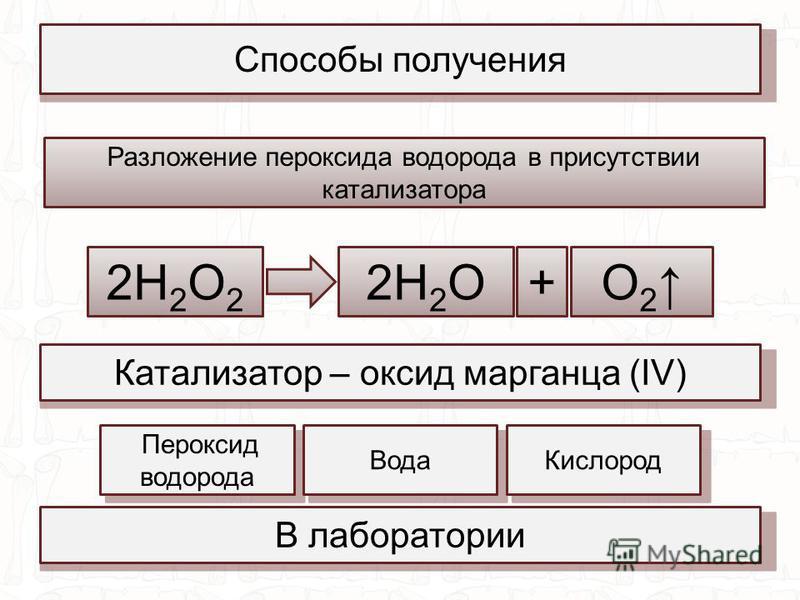 Хемосфера. 2009 г.;75:8–12. doi: 10.1016/j.chemosphere.2008.11.075. [PubMed] [CrossRef] [Google Scholar]
Хемосфера. 2009 г.;75:8–12. doi: 10.1016/j.chemosphere.2008.11.075. [PubMed] [CrossRef] [Google Scholar]
8. Хасан М.А., Заки М.И., Пасупулети Л., Кумари К. Повышение активности катализаторов оксида марганца по разложению перекиси водорода. заявл. Катал. Ген. 1999; 181: 171–179. doi: 10.1016/S0926-860X(98)00430-X. [CrossRef] [Google Scholar]
9. Hart A.B., McFadyen J., Ross R.A. Катализируемое твердым оксидом разложение паров пероксида водорода. Транс. Фарадей Сок. 1963; 59: 1458–1469. дои: 10.1039/tf9635
8. [CrossRef] [Google Scholar]10. Kirchner P., Li B., Spelthahn H., Henkel H., Schneider A., Friedrich P., Kolstad J., Keusgen M., Schöning M.J. Тонкопленочная калориметрия H 2 O 2 Датчик газа для проверки бактерицидной эффективности в процессах асептического наполнения. Сенсорные приводы B Chem. 2011; 154: 257–263. doi: 10.1016/j.snb.2010.01.058. [CrossRef] [Google Scholar]
11. Micoli L., Bagnasco G., Turco M., Trifuoggi M. , Russo Sorge A., Fanelli E., Pernice P., Aronne A. Паровая фаза H 2 O 2 разложение на монолитных катализаторах на основе марганца, синтезированных по инновационным методикам. заявл. Катал. Б Окружающая среда. 2013; 140–141: 516–522. doi: 10.1016/j.apcatb.2013.04.072. [CrossRef] [Google Scholar]
, Russo Sorge A., Fanelli E., Pernice P., Aronne A. Паровая фаза H 2 O 2 разложение на монолитных катализаторах на основе марганца, синтезированных по инновационным методикам. заявл. Катал. Б Окружающая среда. 2013; 140–141: 516–522. doi: 10.1016/j.apcatb.2013.04.072. [CrossRef] [Google Scholar]
12. Оберлендер Дж., Киршнер П., Бойен Х. Г., Шёнинг М. Дж. Обнаружение паров перекиси водорода с использованием оксида марганца (IV) в качестве катализатора для калориметрических газовых сенсоров. физ. Status Solidi A. 2014; 211:1372–1376. doi: 10.1002/pssa.201330359. [Перекрестная ссылка] [Академия Google]
13. Agalloco J.P., Akers J.E., редакторы. Усовершенствованная технология асептической обработки. КПР Пресс; Бока-Ратон, Флорида, США: 2010 г. Лекарства и фармацевтические науки. [Google Scholar]
14. Петри Б.Г., Уоттс Р.Дж., Тил А.Л., Хулинг С.Г., Браун Р.А. Основы ISCO с использованием перекиси водорода. В: Зигрист Р.Л., Крими М., Симпкин Т. Дж., редакторы. Химическое окисление на месте для восстановления грунтовых вод. Том 3. Спрингер; Нью-Йорк, штат Нью-Йорк, США: 2011. стр. 33–88. Технология восстановления окружающей среды SERDP/ESTCP. [Академия Google]
Дж., редакторы. Химическое окисление на месте для восстановления грунтовых вод. Том 3. Спрингер; Нью-Йорк, штат Нью-Йорк, США: 2011. стр. 33–88. Технология восстановления окружающей среды SERDP/ESTCP. [Академия Google]
15. Качер П., Шврчек Ю., Сыслова К., Вацлавик Ю., Павлик Д., Червены Ю., Кузьма М. Перекись водорода в паровой фазе – метод обеззараживания поверхностей и рабочих зон от органических загрязнителей. В: Пузын Т., редактор. Органические загрязнители через десять лет после Стокгольмской конвенции: экологический и аналитический обзор. ИнТех; Риека, Хорватия: 2012. [Google Scholar]
16. Хекерт Р. А., Бест М., Джордан Л. Т., Дулак Г. К., Эддингтон Д. Л., Стерритт В. Г. Эффективность испаряемой перекиси водорода против вирусов экзотических животных. заявл. Окружающая среда. микробиол. 1997;63:3916–3918. [Бесплатная статья PMC] [PubMed] [Google Scholar]
17. Ансари И.А., Датта А.К. Обзор методов стерилизации упаковочных материалов, используемых в системах асептической упаковки. Пищевые продукты Биопрод. Процесс. 2003; 81: 57–65. doi: 10.1205/096030803765208670. [CrossRef] [Google Scholar]
Пищевые продукты Биопрод. Процесс. 2003; 81: 57–65. doi: 10.1205/096030803765208670. [CrossRef] [Google Scholar]
18. Kirchner P., Oberländer J., Suso H.P., Rysstad G., Keusgen M., Schöning M.J. Мониторинг микробицидной эффективности газообразного перекиси водорода в процессах стерилизации с помощью калориметрического датчика газа . Пищевой контроль. 2013; 31: 530–538. doi: 10.1016/j.foodcont.2012.11.048. [Перекрестная ссылка] [Академия Google]
19. Нэтер Н., Хуарес Л. М., Эммерих Р., Бергер Дж., Фридрих П., Шёнинг М. Дж. Обнаружение перекиси водорода (H 2 O 2 ) при воздействии температур для промышленных процессов. Датчики. 2006; 6: 308–317. doi: 10.3390/s6040308. [CrossRef] [Google Scholar]
20. Саттерфилд К.Н., Штейн Т. Разложение паров перекиси водорода на относительно инертных поверхностях. Инд.Инж. хим. 1957; 49: 1173–1180. doi: 10.1021/ie50571a042. [CrossRef] [Google Scholar]
21. Fraise A.P., Maillard J.Y., Sattar S.A., редакторы. Принципы и практика дезинфекции, консервации и стерилизации. 5-е изд. Джон Уайли и сыновья; Чичестер, Великобритания: 2012. [Google Scholar]
Принципы и практика дезинфекции, консервации и стерилизации. 5-е изд. Джон Уайли и сыновья; Чичестер, Великобритания: 2012. [Google Scholar]
22. Кирк Р.Э., Отмер Д.Ф., редакторы. Энциклопедия химической технологии. Том 13 Уайли; Нью-Йорк, штат Нью-Йорк, США: 2003. [Google Scholar]
23. Фармакопея США USP. Кодекс пищевых химикатов. 9-е изд. USP Фармакопея США; Роквилл, Мэриленд, США: 2014. [Google Scholar]
24. Жигер П.А. Термическое разложение паров перекиси водорода. II. Можно. Дж. Рез. 1947; 25б: 135–150. doi: 10.1139/cjr47b-018. [PubMed] [CrossRef] [Академия Google]
25. Саттерфилд К.Н., Штейн Т.В. Гомогенное разложение паров перекиси водорода. Дж. Физ. хим. 1957; 61: 537–540. doi: 10.1021/j150551a006. [CrossRef] [Google Scholar]
26. Барсони И., Дючо К., Фюрьес П. Термометрическое определение газа. В: Comini E., Faglia G., Sberveglieri G., редакторы. Твердотельное определение газа. Спрингер США; Бостон, Массачусетс, США: 2009. стр. 1–24. [Google Scholar]
27. Оберлендер Дж., Кирхнер П., Кеусген М., Шёнинг М. Дж. Стратегии разработки тонкопленочных датчиков для мониторинга асептических пищевых процессов: теоретические соображения и исследования пассивирующих материалов. Электрохим. Акта. 2015; 183:130–136. doi: 10.1016/j.electacta.2015.06.126. [Перекрестная ссылка] [Академия Google]
Оберлендер Дж., Кирхнер П., Кеусген М., Шёнинг М. Дж. Стратегии разработки тонкопленочных датчиков для мониторинга асептических пищевых процессов: теоретические соображения и исследования пассивирующих материалов. Электрохим. Акта. 2015; 183:130–136. doi: 10.1016/j.electacta.2015.06.126. [Перекрестная ссылка] [Академия Google]
28. Джилдех З.Б., Кирхнер П., Оберлендер Дж., Кремерс А., Вагнер Т., Вагнер П.Х., Шёнинг М.Дж. Моделирование калориметрического датчика газа для мониторинга пероксида водорода на основе FEM. физ. Status Solidi A. 2017; 214 doi: 10.1002/pssa.201600912. [CrossRef] [Google Scholar]
29. McDonnell G.E., Sheard D. Практическое руководство по обеззараживанию в здравоохранении. Джон Уайли и сыновья, ООО; Hoboken, NJ, USA: 2012. [Google Scholar]
30. Tian R., Sun J., Qi Y., Zhang B., Guo S., Zhao M. Влияние VO 2 Морфология наночастиц при колориметрическом анализе H 2 O 2 и глюкозы. Наноматериалы. 2017;7:347. doi: 10.3390/nano7110347. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
doi: 10.3390/nano7110347. [Статья PMC free] [PubMed] [CrossRef] [Google Scholar]
31. Li Y., Su Z., Wei G., Xie G., Zhang M., Zhang X. Нанопористые углеродные нановолокна, украшенные наночастицами платины для неферментативное электрохимическое определение H 2 O 2 . Наноматериалы. 2015; 5:1891–1905. doi: 10.3390/nano5041891. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
32. Kirchner P., Ng Y.A., Spelthahn H., Schneider A., Henkel H., Friedrich P., Kolstad J., Berger J., Keusgen M., Schöning M.J. -пленочная термобатарея для обнаружения H 2 O 2 . физ. Статус солиди А. 2010; 207: 787–792. doi: 10.1002/pssa.200983309. [CrossRef] [Google Scholar]
33. Kirchner P., Oberländer J., Friedrich P., Berger J., Suso H.P., Kupyna A., Keusgen M., Schöning M.J. Оптимизация и изготовление калориметрического газового сенсора на полиимидной подложке для H 2 O 2 мониторинг. физ. Status Solidi A. 2011; 208:1235–1240. doi: 10.1002/pssa.201001132. [CrossRef] [Google Scholar]
2011; 208:1235–1240. doi: 10.1002/pssa.201001132. [CrossRef] [Google Scholar]
34. Kirchner P., Oberländer J., Friedrich P., Berger J., Rysstad G., Keusgen M., Schöning M.J. пищевая промышленность. Сенсорные приводы B Chem. 2012; 170:60–66. doi: 10.1016/j.snb.2011.01.032. [CrossRef] [Google Scholar]
35. Kirchner P., Reisert S., Pütz P., Keusgen M., Schöning M. J. Характеристика полимерных материалов в качестве пассивирующего слоя для калориметрии H 2 O 2 датчики газа. физ. Статус солиди А. 2012; 209: 859–863. doi: 10.1002/pssa.201100773. [CrossRef] [Google Scholar]
36. Kirchner P. Ph.D. Тезис. Fachbereich Pharmazie, Филипс-Университет Марбург; Марбург/Лан, Германия: 2013. Калориметрические датчики газа для мониторинга перекиси водорода в асептических пищевых процессах. [Google Scholar]
37. Макки Д. Каталитическое разложение перекиси водорода металлами и сплавами платиновой группы. Дж. Катал. 1969; 14: 355–364. дои: 10.1016/0021-9517(69)90326-1. [CrossRef] [Google Scholar]
[CrossRef] [Google Scholar]
38. Оно Ю., Мацумура Т., Китадзима Н., Фукузуми С. Образование супероксид-иона при разложении перекиси водорода на нанесенных металлах. Дж. Физ. хим. 1977; 81: 1307–1311. doi: 10.1021/j100528a018. [CrossRef] [Google Scholar]
39. Зорге А.Р., Турко М., Пилоне Г., Баньяско Г. Разложение пероксида водорода на катализаторах MnO 2 /TiO 2 . Дж. Пропулс. Сила. 2004; 20:1069–1075. дои: 10.2514/1.2490. [Перекрестная ссылка] [Академия Google]
40. Накаяма М., Сато А., Ямагути Р. Разложение и обнаружение перекиси водорода с помощью сигма-MnO 2 тонкопленочного электрода с самовосстанавливающимся свойством. Электроанализ. 2013;26:2283–2288. [Google Scholar]
41. Лин С.С., Гурол М.Д. Каталитическое разложение пероксида водорода на оксиде железа: кинетика, механизм и последствия. Окружающая среда. науч. Технол. 1998; 32:1417–1423. doi: 10.1021/es970648k. [CrossRef] [Google Scholar]
42. Заки М.И. , Хасан М.А., Пасупулети Л., Кумари К. Объемные и поверхностные характеристики чистого и щелочного марганца 2 O 3 : TG, IR, XRD, XPS, специфическая адсорбция и окислительно-восстановительные каталитические исследования. NJ Chem. 1998; 22: 875–882. doi: 10.1039/a800796i. [CrossRef] [Google Scholar]
, Хасан М.А., Пасупулети Л., Кумари К. Объемные и поверхностные характеристики чистого и щелочного марганца 2 O 3 : TG, IR, XRD, XPS, специфическая адсорбция и окислительно-восстановительные каталитические исследования. NJ Chem. 1998; 22: 875–882. doi: 10.1039/a800796i. [CrossRef] [Google Scholar]
43. Крейчи Д., Вошнак А. Разложение перекиси водорода для микродвигателей: моделирование и экспериментальная проверка; Материалы 47-й совместной конференции и выставки по двигателям AIAA/ASME/SAE/ASEE; Сан-Диего, Калифорния, США. 31 июля – 3 августа 2011 г.; Рестон, Вирджиния, США: Американский институт аэронавтики и астронавтики; 2011. [Google Академия]
44. Джанг Д., Квон С., Джо С. Влияние стабилизаторов фосфатов на разложение перекиси водорода на катализаторы на основе марганца. Дж. Пропулс. Сила. 2015; 31: 904–911. дои: 10.2514/1.B35310. [CrossRef] [Google Scholar]
45. Zhou X., Hitt D.L. Одномерное моделирование катализированного разложения H 2 O 2 в микроканальных потоках; Материалы 33-й конференции и выставки по гидродинамике AIAA; Орландо, Флорида, США. 23–26 июня 2003 г.; Рестон, Вирджиния, США: Американский институт аэронавтики и астронавтики; 2003. [Google Академия]
23–26 июня 2003 г.; Рестон, Вирджиния, США: Американский институт аэронавтики и астронавтики; 2003. [Google Академия]
46. Купманс Р.Дж., Шримптон Дж.С., Робертс Г.Т. Параметрические исследования ракетного двигателя на перекиси водорода; Материалы 4-й Европейской конференции по аэрокосмическим наукам EUCASS; Санкт-Петербург, Россия. 4–8 июля 2011 г. [Google Scholar]
47. Widdis S.J., Hitt D.L., Asante K., Cross M.W., Varhue W.J., McDevitt M.R. Расчетные и экспериментальные исследования каталитического разложения H 2 O 2 в микрореакторах. ; Материалы 43-й конференции AIAA по теплофизике; Новый Орлеан, Лос-Анджелес, США. 25–28 июня 2012 г.; Рестон, Вирджиния, США: Американский институт аэронавтики и астронавтики; 2012. [Google Академия]
48. Widdis S.J., Asante K., Hitt D.L., Cross M.W., Varhue W.J., McDevitt M.R. Каталитический микрореактор на основе МЭМС для монотопливной микродвигательной установки H 2 O 2 . IEEE/ASME Trans. Мехатрон. 2013;18:1250–1258. doi: 10.1109/ТМЕЧ.2013.2249085. [CrossRef] [Google Scholar]
Мехатрон. 2013;18:1250–1258. doi: 10.1109/ТМЕЧ.2013.2249085. [CrossRef] [Google Scholar]
49. Купманс Р.Дж. Кандидат наук. Тезис. Университет Саутгемптона; Саутгемптон, Великобритания: 2013. Моделирование многофазных многокомпонентных химически реагирующих потоков через уплотненные слои. [Академия Google]
50. Мартинес-Дуарте Р., Мадоу М. Фотолитография SU-8 и ее влияние на микрофлюидику. В: Митра С.К., Чакраборти С., редакторы. Справочник по микрофлюидике и нанофлюидике. КПР Пресс; Рока-Ратон, Флорида, США: 2012. стр. 231–268. [Google Scholar]
51. Льюис Р.В., Нитиарасу П., Ситхараму К.Н. Основы метода конечных элементов для теплового и жидкостного потока. Джон Уайли и сыновья, ООО; Чичестер, Великобритания: 2004. [Google Scholar]
52. Кахела Д. Р., Татарчук Б. Дж. Проницаемость спеченных микроволокнистых композитов для гетерогенного катализа и другие возможности химической обработки. Катал. Сегодня. 2001;69: 33–39. doi: 10.1016/S0920-5861(01)00352-2. [CrossRef] [Google Scholar]
53.

