Дата | Предмет химия | Класс 11 (ог) Урок 6 | ||
Название занятия | Практическая работа №1: Определение качественного состава органических веществ. | |||
Общие цели | Цель: Образовательная: Усвоение новых знаний по теме «Определение качественного состава органических веществ» Знать, как с помощью эксперимента можно определить качественный состав органических веществ. Уметь составлять уравнения химических реакций. Уметь решать качественные задачи на определение органических веществ. Развивающие: Воспитывающая: Соблюдать правила техники безопасности при выполнении практической работы. Продолжить формирование научного мировоззрения. Воспитание культурной личности. Коммуникативные качества. Умение работать в группе. Создание атмосферы сотрудничества и взаимопонимания. | |||
Результат обучения | Знают, как с помощью эксперимента можно определить качественный состав органических веществ. Умеют составлять уравнения химических реакций. Умеют решать качественные задачи на определение органических веществ. Умеют сравнивать, анализировать, сопоставлять, делать выводы. Умеют аргументировать свое понимание. | |||
Ключевые идеи | Качественные реакции на органические вещества. Составление уравнений качественных химических реакций. Решение экспериментальных задач. Соблюдение техники безопасности. | |||
Источники | Презентация «Качественные реакции на органические вещества». Сборник «Практические работы» | |||
Материалы и оборудование | ИКТ. Компьютер, проектор, экран, презентация, электронный учебник «Химия 11 класс». Карточки инструкции. Оборудование: свечка, глюкоза, известковая вода, химический стакан, спички, спиртовка, держатель | |||
Ход занятия | ||||
Этапы проведения занятия | Время – | Действия учителя и действия учеников | ||
1. Организационный момент. 2. Мотивация. | 1 мин. 1 мин. | Подготовка к уроку. Приветствие. Краткое, сообщение плана урока. Тема урока «Практическая работа №1: Определение качественного состава органических веществ. | ||
3. Актуализация | 5 мин. | 1.Знакомство с заданием практического занятия по инструктивной карточке. 2. Техника безопасности при проведении практического занятия 3. Учащиеся формулируют цель работы. 4. Требование к оформлению и критерии оценивания | ||
4. Формирование новых знаний и способов действия ИКТ (презентация) | 23 мин. |
Оборудование и реактивы: глюкоза, известковая вода, держатель, химический стакан, скальпель, спиртовка, спички. Выполнение работы. Опыт 1. Определение углерода входящего в состав органических веществ
C6H12O6 = 6C + 6H Задания: 1. Запишите наблюдения. 2. Сделайте вывод о том, какой химический элемент входит в состав глюкозы. Опыт 2. Определение водорода входящего в состав органических веществ
С14H30 + O2 = CO2 + H2O Расставьте коэффициенты в схеме. 1. Запишите наблюдения. 2. Сделайте вывод о том, какой элемент входит в состав глюкозы Опыт №3. Доказательство образования углекислого газа при окислении органических веществ Над горящей парафиновой свечей поместили стакан, смоченный известковой водой и провели наблюдения. Ca(OH) 2 + CO2 = CaCO3 + H2O Завершите работу
| ||
5.Физкультминутка 6. Применение. Формирование умений и навыков. | 2 мин. 10 мин. | Выполнение физических упражнений под музыку. Сделайте вывод по итогам проведенной работы Привести в порядок рабочее место | ||
ОдО и ОО | 1 мин. | Свод оценок по листу оценивания. Подведение итогов по уроку. Объявление результатов формативного оценивания. | ||
7. Информация о домашнем задании | 1мин. | Учитель информирует о домашнем задании Подготовка к контрольной работе повторить § 1-6 | ||
Рефлексия. Подведение итогов урока. | 1 мин. | Что нового вы узнали на уроке? Что вызвало затруднение? Как вы оцениваете работу своей группы. На стикерах напишите свои пожелания и поместите в «Корзину предложений». Секретарь даст оценку работе каждого в группе по оценочному листу. Учитель дает оценку работе класса. Отмечает лучшие ответы. | ||
Урок органической химии в 11 классе.
Урок — практическая работа
«Определение качественного состава органических
соединений»
Задачи: В процессе практической работы сформировать у учащихся знания об особенностях органических веществ, их составе и свойствах, научить технике безопасности при работе с этими веществами;Учить проводить исследования и наблюдения, делать самостоятельные выводы; совершенствовать умения составлять уравнения химических реакций с участием органических веществ, использовать при этом метод электронного баланса;
В ходе урока совершенствовать технологию группового обучения;
Развивать навыки самостоятельности и аккуратности при оформлении работы.
Оборудование: лоток с приборами и материалами, спиртовка, спички, штатив с пробирками, газоотводная трубка, химические стаканы.
Реактивы: спирт, парафин, оксид меди, керосин, известковая вода, тетрахлорметан.
План урока
- Объявление темы и цели урока
Учитель: Сегодня у нас урок- практическая работа «Определение качественного состава органических веществ». В ходе урока мы должны научиться определять качественный состав органических веществ и овладеть навыками работы с органическими веществами. Прежде, чем выполнять работу необходимо к ней хорошо подготовиться, что вы и сделали дома. Проверим.
- Подготовка к выполнению практической работы
Учитель: Любая работа в кабинете химии требует соблюдения правил техники безопасности, а тем более практическая работа. Какие важнейшие правила т.б. необходимо вспомнить?
-Нельзя входить и работать в кабинете химии в верхней одежде;
-На рабочем столе не должно быть посторонних предметов;
-Нельзя проводить опыты, не относящиеся к данной работе, трогать вещества руками, пробовать их на вкус;
-Необходимо соблюдать правша работы с веществами;
-Надо следить за тем, чтобы реактивы не попали на руки и одежду;
-При нагревании пробирок, пользоваться держателем.
Учитель: Сегодня часто придется пользоваться спиртовкой, кто вспомнит правила работы со спиртовкой?
Ответ: Перед зажиганием спиртовки необходимо убедиться в ее исправности. Зажигать спиртовку можно только спичкой ши лучиной, а гасить — специальным колпачком. При нагревании пробирки, необходимо сначала прогреть ее всю, а потом нагревать в нужном месте. Нельзя прикасаться горячей пробиркой к холодному фитшю спиртовки. После проведения опыта спиртовку надо закрыть колпачком, чтобы спирт не испарялся.
Учитель: Мы работаем сегодня с органическими веществами, какие особенности этих веществ надо знать?
Ответ: Органические вещества имеют молекулярное строение, поэтому у них низкие температуры кипения, плавления и воспламенения. Все- горючи. При воспламенении органических веществ последствия оказываются более тяжелыми, т.к. ожег может сопровождаться отравлением воспламенившихся веществ ши продуктами их горения. Пары этих веществ взрывоопасны. Большинство обладают резкими запахами. Поэтому при работе с органическими веществами необходимо строго соблюдать требования и инструкции.
Ответ: Необходимо соблюдать правша техники безопасности, требования и инструкции к работе. Осторожно обращаться с легко воспламеняющимися веществами при нагревании. При воспламенении, во- первых, необходимо погасить спиртовку, а если необходимо, то засыпать огонь песком.
- Практическая работа
Цель: Определить наличие атом углерода и водорода в органических соединениях, научиться работать с органическими веществами.
Оборудование: лоток с приборами и материалами, спиртовка, спички, штатив с пробирками, газоотводная трубка, химические стаканы.
Реактивы: спирт или парафин, оксид меди, керосин, известковая вода, тетрахлорметан. Учитель: Как можно определить качественный состав вещества?
Ответ: Состав вещества можно определить по:
-продуктам горения, если выделяется вода, значит, есть водород, а по углекислому газу определяем присутствие углерода;
-водород можно обнаружить по восстановлению меди из ее оксида;
-наличие углерода можно увидеть по обугливанию органических веществ концентрированной серной кислотой.
Учитель: Как можно определить хлор в органическом соединении?
Ответ: При сжигании хлорсодержащего соединения на прокаленной медной проволоке образуется хлорид меди, окрашивающий пламя спиртовки в зеленый цвет. Значит, можно определить по цвету пламени.
Учитель: Итак, вы готовы к практической работе. Работать будете в группах, у каждой группы есть свое задание, выполняя которое вы составляете уравнения проведенных реакций, делаете необходимые выводы, краткий отчет записываете на доске и готовитесь отчитаться по каждому этапу своей работы.
Выполнение практических опытов.
Отчет групп.
Учитель: Обсудим итоги и подведем итоги проделанной работы.
Что удалось установить в ходе первого опыта? (Заслушать ответы групп, проверить правильность составления уравнений реакций).
Что обнаружили при выполнении второго опыта? (Заслушать ответы групп, проверить правильность составления уравнений реакций).
Две группы наблюдали действие концентрированной серной кислоты на органические вещества, какие вы сделали выводы? (Заслушать ответы групп).
Общие выводы по практической работе:
-В состав всех органических веществ входит углерод, поэтому органическую химию называют химией углерода и его соединений;
-Почти всегда в органических веществах присутствует водород;
-Могут входить в состав молекул и другие элементы и функциональные группы, мы обнаружили наличие хлора;
-Органические вещества обладают особенными свойствами, поэтому при работе с ними необходимо соблюдать особую осторожность.
IV Оформление письменного отчета в тетрадях. (Учитель объявляет и комментирует оценки групп).
Домашнее задание: решить задачу «Выведите формулу органического вещества, если при его сгорании массой 13,8 г получен оксид углерода (IV) массой 26,4 г и вода массой 16,2 г. плотность паров вещества по воздуху равна 1,587.(Прокомментировать решение задачи)
Карточка- задание № 1
- Определите наличие атомов углерода и водорода в парафине.
- Проведите реакцию восстановления меди из оксида продуктами термического разложения керосина.
- Определите, в какой из трех пробирок содержится хлорсодержащее органическое соединение?
Карточка- задание № 2
- Определите наличие атомов углерода и водорода в этиловом спирте (С2Н5ОН).
- Проведите реакцию восстановления меди из оксида продуктами термического разложения керосина.
- Определите, в какой из трех пробирок содержится хлорсодержащее органическое соединение?
Карточка- задание № 3
- Определите наличие атомов углерода и водорода в ацетилене, объясните, как получить ацетилен из карбида кальция.
- Проведите реакцию восстановления меди из оксида продуктами термического разложения керосина. Составьте уравнение методом электронного баланса.
- Определите наличие хлора в органическом соединении.
Карточка- задание № 4
- Определите наличие атомов углерода и водорода в этилене (С2Н4). Объясните, как в лабораторных условиях можно получить этилен из этилового спирта.
- Проведите реакцию восстановления меди из оксида продуктами термического разложения керосина. Составьте уравнение методом электронного баланса.
- Определите наличие хлора в органическом соединении.
Ученик _________класса МБОУ СОШ № 3 _____________________________
Дата_________________
Практическая работа № 1
Определение качественного состава органических веществ
Цель: определить наличие углерода и водорода и хлора в органических соединений, научится работать с органическими веществами.
Оборудование: лоток с приборами и материалами, спиртовка, спички, штатив с пробирками, газоотводная трубка, химический стакан.
Выполнение работы
Опыт1 Качественное определение углерода и водорода
Зажгите спиртовку или парафиновую свечу. Подержите 2-3 ч над пламенем сухой стакан в перевернутом положении. Почему стакан запотел? Запишите уравнение реакции.
______________________________________________________________________________________________________________________________________________________________________________________________________
Смочите стакан раствором гидроксида кальция и снова в таком положении подержите над пламенем. Обьясните причину появления белых пятен. Запишите уравнение реакции.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Составьте уравнения реакции горения парафина, приняв что в его составе есть алкан, содержащий 18 атомов углерода.
____________________________________________________________________________________________________________________________________
В сухую пробирку поместите 0,5- 1 г оксида меди (II) + 0,1 г парафина. Пробирку нагрейте до плавления парафина, затем встряхните. Пробирку со смесью закрепите на штативе как показано на рис.Конец газоотводной трубки опустите в пробирку с известковой водой. Какие изменения происходят? Запишите уравнение реакции
 __________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
После изменения окраски оксида меди выньте конец газоотводной трубки из пробирки с раствором, и прекратите нагревание. Дождитесь, пока пробирка остынет, затем извлеките продукт реакции. Во что превратился оксид меди(II) при окислении углеводородов? Запишите уравнение реакции.
______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 2 Качественное определение хлора
Для проведения опыта один конец медной проволоки загните в кольцо(спираль), прокалите проволоку в пламени спиртовки до прекращения его окрашивания. Остывшую проволоку опустите в небольшую порцию исследуемого вещества Затем вновь внесите кольцо в пламя спиртовки. что наблюдаете?
__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вывод:________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Вопросы
1.Дайте полное определение, Алканы -это__________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2.Какой тип химических реакций характерен для алканов?
____________________________________________________________________________________________________________________________________
3.Запишите реакцию Коновалова, исходный веществом является н-бутан. Назовите продукты реакции.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________



(за практическую) (за теоретическую) (итоговая)
Нечаев Дмитрий Валерьевич, учитель химии
ГУ ЛНР «ЛУВК « ИНТЕЛЛЕКТ»
Практическая работа № 1
Качественное определение углерода, водорода и хлора в органических веществах.
Цель: научиться осуществлять качественный анализ органических веществ, совершенствовать навыки работ с лабораторным оборудованием.
Оборудование: лабораторный штатив, пробирки, пробка с газоотводной пробкой, спиртовая горелка.
Реактивы: CuO, C23H48 (парафин), CuSO4 безводный, Ca(OH)2, CCl4, медная проволока.
Ход работы
С правилами техники безопасности ознакомлен(а) и обязуюсь их выполнять.
Смесь парафина и CuO поместили в пробирку. Безводный CuSO4 внесли ближе к отверстию. Закрепили пробирку с содержимым в горизонтальном положении. Пробирку закрыли пробкой с газоотводной трубкой, конец которой опустили во вторую пробирку с Са(ОН)2. Содержимое первой пробирки нагрели.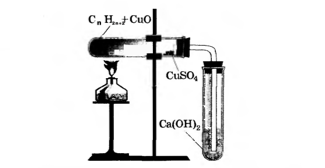
Парафин окисляется в присутствии оксида меди (II). При этом углерод превращается в углекислый газ, а водород — в воду:
С23Н48+70СuO→23CO2↑+24H2O+70Cu.
Выделяющийся углекислый газ взаимодействует с гидроксидом кальция, что вызывает помутнение известковой воды, вследствие образования нерастворимого карбоната кальция:
CO2+Ca(OH)2→CaCO3↓+H2O.
Безводный сульфат меди (II) приобретает голубую окраску при взаимодействии с водой, в результате чего образуется кристаллогидрат:
CuSO4+5H2O→ CuSO4*5H2O.
По продуктам окисления парафина CO2 и H2O установили, что в его состав входит углерод и водород.
2.
Качественное определение хлора в молекулах галогенпроизводных углеводоровов.
Конец медной проволоки согнули в виде спирали и прокалили в пламени горелки до исчезновения окраски пламени. Затем охладили спираль и нанесли на нее каплю тетрахлорметана и снова внесли в пламя.
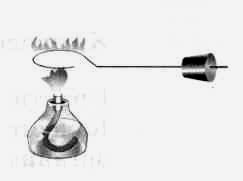
Пламя окрашивается в изумрудно-зеленый цвет.
Данная реакция является качественной для определения хлора в органических соединениях. Следовательно, в исходном веществе содержится хлор.
Общий вывод: на данной практической работе мы научились осуществлять качественный анализ органических веществ, а именно, химическим путем определили углерод и водород в предельных углеводородах и хлор в молекулах галогенпроизводных углеводоровов. А также усовершенствовали навыки работ с лабораторным оборудованием.
Задание учителя:
I вариант
Относительная плотность паров дихлоралкана по водороду равна 49,5. Установите формулу дихлоралкана.
Решение:
D(H2)=49,5
CnH2nCl2
М (CnH2nCl2)= D(H2) · М (H2) = 49,5 · 2 = 99 г/моль
М (CnH2nCl2) = 12n + 2n + 2 · 35,5= 99 г/моль
14n=28
n=2
C2H4Cl2 искомый дихлоралкан
II вариант
Один из бромалканов содержит 65,04% брома. Установите молекулярную формулу этого вещества.
Решение:
ω(Br)=65,04%
CnH2n+1Br-?
М (CnH2n+1Br) = 12n + 2n + 1 + 80 = 123 г/моль
14n=42
n=3
C3H7Br искомый бромалкан
Задание. Установите наличие элементов углерода и водорода в составе любого предложенного углеводорода (парафина, метана).
Оборудование. Штатив с пробирками, пробки с газоотводными трубками, лабораторный штатив, стеклянная палочка, химические стаканы (2 шт.) емкостью не менее 150 мл, горелка (спиртовка), спички.
Вещества. Парафин, вазелин, хлороформ (или дихлорэтан), сульфат меди (II) безводный, раствор гидроксида кальция, оксид меди (II), спирт и галогенопроизводные органические вещества — склянки № 1 и № 2.
Выполнение работы
1. Зажгите газовую горелку (спиртовку). Подержите 2—3 с над пламенем сухой стакан в перевернутом состоянии. Почему запотел стакан?
Смочите (сполосните) стакан раствором гидроксида кальция и снова в таком же состоянии подержите над пламенем. Объясните причину появления белых пятен на стенках стакана.
На основании обнаруженных воды и оксида углерода (IV) сделайте вывод о качественном составе Crоревшего вещества.
2. Зажгите парафиновую свечу и аналогичным путем установите качественный состав парафина. Проведите опыт по обнаружению свободного углерода в пламени свечи.
Составьте уравнение реакции горения парафина свечи, приняв, что в его молекуле содержится 16 атомов углерода.
Примечание: опыты 1 или 2 проводятся по выбору учащихся.
3. Соберите прибор, как указано на рисунке 22.5, и испытайте его на герметичность.
В сухую пробирку поместите 2— 2,5 г оксида меди и немного вазелина, чтобы его хватило только для пропитки подогретого оксида меди (II). Закрепите пробирку в штативе горизонтально и внесите в нее не более 0,5 г сульфата меди (II), разместив около отверстия пробирки. Закройте пробирку пробкой с газоотводной трубкой, конец которой
опустите в пробирку с известковой водой. Нагревайте пламенем горелки (спиртовки) смесь оксида меди (II) с вазелином.
Наблюдайте, какие изменения происходят с известковой водой. По окончании опыта, прежде чем погасить пламя горелки, поднимите вверх лапку штатива с прибором и выньте газоотводную трубку из пробирки. (Почему это надо проделать?)
На основании результатов опыта сделайте вывод о качественном составе вазелина. Составьте уравнение реакции полного окисления оксидом меди предельного углеводорода, в состав которого входит 16 атомов углерода.
Из опыта следует, что в сгоревшем веществе есть углерод и водород.
б) Эксперимент проводится аналогично опыту а). Уравнение реакции горения парафина:
Для обнаружения свободного углерода в пламени свечи нужно подержать чистое стекло над пламенем. Стекло постепенно закоптится. Это и есть свободный углерод.
в) Уравнение реакции:
Тип урока: урок-практикум.
Задачи урока:
Образовательные
- Закрепить теоретические навыки, полученные при изучении темы “Предельные углеводороды”. Уметь практически определять наличие углерода, водорода и хлора в органических веществах, проводить наблюдения, делать выводы; соблюдать правила техники безопасности при работе в химическом кабинете.
- Уметь применять теоретические знания о качественных реакциях. Контролировать и корректировать умения извлекать информацию при наблюдении за химическим опытом
- Продолжать формирование умений и навыков по составлению уравнений реакций.
Развивающие
- Развивать у учащихся умения сравнивать и анализировать сведения, полученные в ходе практической работы, логически излагать свои мысли.
Воспитывающие
- Продолжить формирование химической картины мира, способствовать осознанию реальности существования атомов и молекул, и материального единства на основе этих представлений (показывая многообразие органических соединений).
Методы: фронтальный опрос, беседа по проблемным вопросам, практическая работа, самостоятельная работа, частично-поисковый, рефлексия.
Оборудование и реактивы. Каждой группе выдается набор реактивов и лабораторных принадлежностей: лабораторный штатив, нагревательный прибор, простейший прибор для получения газов, держатель, фарфоровая чашка, парафин, оксид меди (II), известковая вода, прокаленный сульфат меди (II), медная проволочка (10 см), раствор тетрахлорметана, сахар, полимеры, содержащие х.э. хлор.
План урока
| Этапы урока | Деятельность учителя | Деятельность учащегося |
| 1.Организационный момент(1 мин.). | Приветствие | Готовятся к уроку, разбивка на группы. |
| 2.Знакомство с картой инструкцией(3 мин). | Рекомендует знакомство с картой инструкцией | Знакомятся с картой-инструкцией |
| 3. Сообщение темы и цели практикума. Инструктаж
по технике безопасности. ( 3 мин). |
Беседа о Т.Б. | Отвечают на вопросы. |
| 4.Изучение и обсуждение задания в группе. (3 мин) | Спрашивает каждую группу о затруднениях и консультирует по работе. | Выясняют порядок выполнения эксперимента, распределяют роли, обсуждают вопросы и отвечают на них. |
| 5.Выполнение задания. ( 15 мин) |
Наблюдает за ходом выполнения эксперимента, консультирует по сложным вопросам. | Выполняют опыты, анализируют, делают выводы. |
| 6.Письменный отчет. (5 мин) |
Выясняет правильность выводов. | Записывают результаты эксперимента. |
| 7.Устный отчет. Ответы на вопросы. ( 10мин) |
Слушает отчеты, задает наводящие вопросы, уточняет детали в случае неправильного ответа. | Выступают с отчетом. Слушают отчеты, задают вопросы, если что непонятно. |
| 8.Подведение итогов. Самооценка.(3 мин) | Учитель нацеливает на правильную самооценку. | Оценивают себя и работу товарищей. |
| 9.Постановка домашнего задания. ( 2 мин) |
На следующем уроке параграф 13, упр.2,4(а) | Записывают домашнее задание. |
| 10.Резервные задания | Сделать письменно теоретические задания. | Выполняют письменно задания. |
ХОД УРОКА-ПРАКТИКУМА
Математик Н.М. Крылов сказал: “Теория без практики мертва, практика без теории сверх того и пагубна”.
(Этот эпиграф записан на классной доске.)
На доске записана дата, практическая работа № 1, тема, цель, ход работы, таблица, план работы на уроке, регламент времени.
I. Вводная часть
Учитель. У нас сегодня урок-практикум. Ознакомьтесь с картой – инструкцией.
ПЛАН РАБОТЫ ГРУППЫ:
- Прочтите внимательно вопросы и задания. Обсудите. Составьте план выполнения. Выполните опыты.
- Проведите опыт.
Работайте с малыми количествами реактивов, выполняйте все операции аккуратно. Растворы, взятые в большем объеме, чем нужно, обратно в сосуд не выливайте — только в стакан для слива. Помните, как зажигать и гасить спиртовку, закреплять пробирку в держателе и нагревать ее. Обо всех экстренных случаях немедленно сообщите учителю. Будьте осторожны! Соблюдайте аккуратность!
- Оформите письменно отчет о проделанной работе. Сделайте выводы.
- Запишите уравнения реакций, осуществляемых в опыте, расставьте коэффициенты.
- Сделайте устный отчет.
- Приведите в порядок рабочее место.
Учитель: Сформулируйте тему урока и цель урока.
Ожидаемый ответ: Урок-практикум по теме “Качественный анализ органических соединений”.
Учитель: Предлагаю, не приступая к выполнению работы, побыть в роли теоретиков и поставить перед собой задачи урока.
Ожидаемый ответ: Задачи урока — научиться практически определять наличие углерода, водорода и хлора в органических веществах, проводить наблюдения, делать выводы; соблюдать правила техники безопасности при работе в химическом кабинете.
Учитель: Назовите основные правила техники безопасности.
Ожидаемый ответ:
ТБ:
- Пробирка закреплена правильно, если она не выпадает из лапки и может быть слегка повернута вокруг своей оси.
- Нагревайте осторожно сначала всю пробирку, а затем, не вынимая ее из пламени, ту часть, где находится вещество.
- Направляйте отверстие нагреваемой пробирки в сторону от себя и соседей, избегая выбрасывания жидкости.
- Не наклоняйтесь над нагреваемой пробиркой.
- При пользовании нагревательным прибором
запрещается:
— передача зажженного нагревательного прибора.
— зажигание одного нагревательного прибора от другого. - Гасите только накрывая пламя колпачком.
- Выньте газоотводную трубку из пробирки с водой, не прекращая нагревания пробирки с веществом, в противном случае воду из пробирки может перебросить в раскаленную пробирку с веществом!
Учитель: Итак, тема сегодняшнего урока практическая работа: по теме “Качественный анализ органических соединений» Запишем тему в тетрадь. Математик Н.М.Крылов сказал: “Теория без практики мертва, практика без теории сверх того и пагубная. Пусть эти слова послужат нам девизом к уроку.
Цель работы: Научится практически определять наличие углерода, водорода и хлора в органических веществах
II. Работа по группам
Учитель: Работать предстоит в группах, каждая группа получает карту-инструкцию и задание, которое оценено по уровням:
| № задания | уровень | оценка |
| 1.2,3 | 1 | 3 |
| 4,5,6. | 3 | 4,5 |
III. Изучение и обсуждение задания в группе (3 мин)
IV. Выполнение заданий (15 мин).
V. Письменный отчет (5 мин).
VI. Устный отчет (10 мин).
VII. В заключение урока учащимся предлагается заполнить карту самооценки (таблица).
| Д/З, самооценка подготовки к ПР | ТБ, самооценка Знаний. |
Эксперимент (Э) | Оценка лидера | Итог, самооценка работы в целом. |
На основании самооценки ученика за качество своей работы, оценок лидера группы и учителя выводится итоговая оценка деятельности каждого ученика на данном уроке-практикуме
VIII. Домашняя работа: Параграф № 13, упр. 2,4(а)
IX. Ответы на резервные задания.
Практическая работа № 1
Тема: Качественный анализ органических соединений.
Цель: Определить углерод и водород и наличие хлора.
Оборудование и реактивы: лабораторный штатив, нагревательный прибор, простейший прибор для получения газов, держатель, фарфоровая чашка, парафин, оксид меди(II), известковая вода, прокаленный сульфат меди(II), медная проволочка 10 см., раствор тетрахлорметана, сахар.
Опыт № 1
Соберите прибор, как показано на рисунке.
Смесь 1 – 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотводной трубкой. При этом конец трубки должен почти упираться в комочек ваты с сульфатом меди (П). Нижний конец газоотводной трубки должен быть погружен в пробирку с свежеприготовленным раствором известковой воды (раствор гидроксида кальция). Нагрейте пробирку (2–3 мин). Если пробка плотно закрывает пробирку, то через несколько секунд из газоотводной трубки начнут выходить пузырьки газа. Как только известковая вода помутнеет, пробирку с ней следует удалить и продолжать нагревание, пока пары воды не достигнут белого порошка сульфата меди(П) и не вызовут его посинения.
После изменения окраски сульфата меди (П) следует прекратить нагревание.
Ответить на вопросы:
1. Почему помутнел раствор известковой воды? Напишите уравнение реакции, считая условно формулу парафина С16Н34.
2. Почему белый порошок сульфата меди (П) стал голубым? Напишите уравнение реакции, учитывая что безводному сульфату меди (П) присоединяется 5 молекул воды.
3.Что произошло с чёрным порошком оксида меди (П)?
Сделайте выводы.
Опыт № 2
Для проведения опыта требуется медная проволока длиной около 10 см, загнутая на конце петлей и вставленная другим концом в держатель.
Прокалите петлю проволоки до исчезновения посторонней окраски пламени. Остывшую петлю, покрывшуюся черным налетом оксида меди(П), опустите в пробирку с хлороформом, затем смоченную веществом петлю вновь внесите в пламя горелки. Немедленно появляется характерная зеленовато-голубая окраска пламени, так как образующиеся при сгорании летучие галогениды меди окрашивают пламя горелки. Сделайте вывод.
Опыт № 3
Докажите, что сахар содержит углерод.
Поместите в фарфоровую чашку несколько кристаллов сахара. Поставьте чашку на кольцо лабораторного штатива. Нагревайте сахар в чашке. Что наблюдаете?
Сделайте вывод.
Оформите работу:
| № опыта | Что наблюдали? УХР. | Выводы |
Приведите в порядок своё рабочее место.
Приложение
Литература
1. Габриелян О.С., Маскаев Ф.Н., Пономарев С.Ю., Теренин В.И.. Химия 10 класс, учебник для общеобразовательных учреждений. Дрофа. Москва, 2003.
2. Габриелян О.С., Остроумов И.Г.. Настольная книга учителя химии, 10 класс. Учебное пособие для учителей и студентов старших курсов педагогических вузов. Блик. Москва, 2001.
3. Назарова Т.С., Лаврова В.Н.. КАРТЫ-ИНСТРУКЦИИ ДЛЯ ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО ХИМИИ, 8 — 11 классы. Гуманитарный издательский центр “Владос”, 2000.
4. Назарова Т. С. и др. Химический эксперимент в школе. Просвещение, 1987.— 240 с.: ил.— (Б-ка учителя химии). Издательство “Просвещение”, 1987.
Практическая работа №1
Качественное определение углерода и водорода в органических веществах
Реактивы и оборудования: лабораторный штатив, спиртовка, химический стаканчик, пробка с газоотводной трубкой, большая пробирка; порошок CuO (II), 0,2г парафина, безводн CuSO4 , известковая вода Ca(OH)2.
ЧТО ДЕЛАЛИ?
ЧТО НАБЛЮДАЛИ?
Собираем установку изображенную на рис.7 стр.27.
В пробирку засыпаем 0,2г парафина и 1г CuO. Недалеко от пробки с газоотводной трубкой помещаем чуть-чуть безводного CuSO4. Свободный конец газоотводной трубки опускаем в химический стаканчик с р-ром известковой воды — Ca(OH)2. Пробирку осторожно нагреваем.
( Рисунок установки со всеми обозначениями)
Воду обнаруживают безводным сульфатом меди (II). Под действием воды белый сульфат меди (II) переходит в голубой кристаллогидрат — медный купорос
CuSO4 + 5H2O = CuSO4 * 5 H2O
кристаллогидрат
голубого цвета
При нагревании парафина углерод окисляется до углекислого газа, а водород до воды. Оксид меди (II) восстанавливается до меди или до оксида одновалентной меди, имеющих красный цвет
С18Н38 + СuО = 18СО2 + 19 Н2О + 55Сu
Известковая вода мутнеет от углекислого газа.
Ca (OH)2 + CO2 = CaCO3 ↓ + H2O
Вывод: выполнив данную работу, мы убедились, что парафин состоит из С и Н. Значит парафин – углеводород.
Качественный анализ органических соединений.
Качественный анализ органических соединений.Качественный анализ органических соединений.
Анализ и идентификация неизвестных органических соединений представляет собой очень важный аспект экспериментального органического химия.Не существует определенной процедуры набора, которая может быть вообще применяется для органического качественного анализа. Различные книги имеют разные подходы, но системный подход, основанный на Схема, приведенная ниже, даст хорошие результаты.
Студенты должны, однако, обратиться к лабораторному руководству и Учебник практической органической химии, А.И. Фогель (4-й Издание).
Практические заметки
Перед изложением общей схемы, один или два пункта практическое значение следует отметить.а) Количество вещества для испытаний. Для большинства тестов о 0,1 г твердого вещества или 0,1 — 0,2 мл (2 — 3 капли) жидкого материала (НЕ БОЛЬШЕ) следует использовать.
(b) Реагенты, которые могут быть обнаружены в ходе органического анализа, включены полки для реагентов.Студентам рекомендуется разработать общий знание физических характеристик общего органического соединения. Если вы сомневаетесь в ожидаемом результате теста между определенным соединением и реагентом, проведите пробный тест с известным соединением и сравните с неизвестным.
(c) Количество производных веществ. Студенты впустую много времени и материала в прошлом, принимая слишком большое количество вещества для приготовления производного.В целом 0,5 — 1 г (или 0,5 — 1 мл) вещества дает наиболее удовлетворительное полученные результаты.
Если практическая книга дает указание использовать большее количество (3 — 4 г или более), количество должно быть уменьшено до 1 г или 1 мл неизвестного вещества и соответствующие количества реагенты должны быть использованы.
Общая схема анализа
А. Предварительные испытания(a) Обратите внимание на физические характеристики — твердое вещество, жидкость, цвет и запах.
(b) Провести испытание на воспламенение (нагреть небольшое количество на металле шпатель), чтобы определить, является ли соединение алифатическим или ароматический (то есть светящееся пламя — алифатическое; сажное пламя — ароматические).
B. Физические константы
Определите температуру кипения или плавления. Дистилляция рекомендуется в случае жидкостей (см. Приложение 3). Это служит двойная цель определения б.п., а также очистки жидкости для последующих испытаний.
C. Анализ присутствующих элементов
На уровне C10 вам будут рассказывать присутствующие элементы, но прочитайте метод.
D. Тесты на растворимость
Растворимость неизвестного в следующих реагентах предоставляет очень полезную информацию. Как правило, около 3 мл растворитель используется с 0,1 г или 0,2 мл (2 — 3 капли) вещество. Класс соединения может быть указан из следующая таблица:
ТАБЛИЦА РАСТВОРИМОСТИ
| РЕАГЕНТ И ТЕСТ | КЛАСС | ГРУППА СОЕДИНЕНИЙ |
| растворим в холоде или горячая вода.(Если неизвестно растворимый НЕ выполнить тесты на растворимость ниже) | Нейтральный, кислый или основной. (Тест с лакмус или универсал индикаторная бумага) | Нижние члены серии. Нейтральный, например спирты; Кислотный, например кислоты, фенолы; Basic, например амины | Растворим в HCl | Basic | Большинство аминов (кроме III амины с только ароматическими группами |
| Растворим вNaOH | Кислота | Большинство кислот, большинство фенолов. |
| Растворим в NaHCO 3 | Сильно кислый | Большинство карбоновых кислот. |
| Нерастворим в воде, кислота и щелочь | Нейтральный | Углеводороды, нитрогидрокарбонаты, алкил или арил галогениды, сложные и простые эфиры. Высокомолекулярные спирты, альдегиды и кетоны |
E.Групповые классификационные тесты
Из предыдущих тестов часто можно вывести функциональные группы присутствуют в неизвестном соединении. Проконсультируйтесь спектры, когда доступны.
Затем проводятся индивидуальные тесты для идентификации и подтверждения функциональные группы присутствуют.
ПРИМЕЧАНИЕ:
1. Студентам настоятельно рекомендуется не проводить ненужных тесты, так как они не только трата времени, но и увеличивают возможность ошибки.Таким образом, бессмысленно сначала проверять спирт или кетон в основном соединении, содержащем азот! Вместо этого должны быть проведены тесты на амины и т. Д. Для такого соединения.2. Системный подход нельзя переоценить в группе классификационные тесты, чтобы избежать путаницы и ошибок.
F. Консультация по литературе
После определения функциональной группы ссылка внесены в таблицы в книге по органическому анализу, для оценки возможности и для приготовления подходящего твердого производные.
Следует отметить, что хотя два вещества с одинаковым Функциональная группа может иногда иметь очень похожий б.п. или т. п., твердые производные обычно могут быть выбраны из литературы, с т.пл. различия около 10 (или более), которые различают две возможности.
Пример:
СОЕДИНЕНИЕ Б.П. ПРОИЗВОДНЫЕ (М.П.)
2,4-DNPH ПОЛУКАРБАЗОН
Диэтилкетон 102 156 139
Метил н-пропилкетон 102 144 112
ГРАММ.Приготовление производныхОкончательная характеристика неизвестного производится получение подходящих твердых производных. Производная должна быть тщательно отобранным и его т. пл. предпочтительно должно быть между 90 — 150 для простоты кристаллизации и т.пл. определение.
Следует попытаться получить одно производное. производное должно быть очищено перекристаллизацией, высушено и т.пл. определяется. Производные должны быть представлены правильно помечены для оценки вместе с записью.
Регистрация результатов
Результаты должны регистрироваться систематически. Полученные результаты должны быть записаны в практической книге в то время (не написано после).
Должна быть сделана запись каждого проведенного теста, независимо от того, был ли получен отрицательный результат .
Испытание, наблюдение и заключение должны быть даны.
По завершении анализа краткое резюме результатов должны быть включены, давая имя, б.п. или т. п., и формула анализируемое соединение.
Качественный анализ для элементов (только для справки)
В органических соединениях элементы, обычно встречающиеся вдоль с углеродом и водородом, кислород, азот, сера, хлор, бром и йод. Обнаружение этих элементов зависит от превращения их в водорастворимые ионные соединения и применение конкретных тестов.
Lassaigne’s Sodium Fusion Test
C, H, O, N, S, X NaX
NaCN
-> Na2S
NaCNS
ПРОЦЕДУРАПоместите кусок чистого металлического натрия размером с горошину в сварочную трубку.Добавьте немного соединения (50 мг или 2 — 3 капли). * Сначала слегка нагрейте пробирку, позволяя перегонке сформирован, чтобы упасть обратно на расплавленный натрий. Когда обугливание начинается, нагреть дно трубки до тупого покраснения в течение трех минут и, наконец, погрузить трубку, пока еще горячо, в чистое блюдо с холодной дистиллированной водой (6 мл) и крышкой сразу чистой проволочной сеткой. **
* Для жидкостей лучше сначала растопить натрий, добавить жидкость по капле.
** ВНИМАНИЕ! Трубка разрушается, и остаточный металлический натрий остается реагирует с водой. Размешайте смесь, варите 1 — 2 минуты на штатив и фильтр горячий через рифленую бумагу.
Фильтрат слияния, который должен быть прозрачным и бесцветным, используется для ОПРЕДЕЛЕННЫХ ИСПЫТАНИЙ, ОПИСАННЫХ НИЖЕ:
1. К части (2 мл) фильтрата «слияния» добавляют 0,2 г порошкообразные кристаллы сульфата железа. Варить смесь в течение половины минуту, охладить и подкислить, добавив разбавленную серную кислоту по каплям.Образование голубовато-зеленого осадка (прусский синий) или синий раствор указывает на то, что исходное вещество содержит азот. Если осадок не появляется, дайте постоять 15 минут, отфильтруйте и осмотрите фильтровальную бумагу.
2. СЕРЫ (СУЛЬФИД)
К холодному фильтрату слияния (1 мл) добавляют несколько холодных капель,
свежеприготовленный, разбавленный раствор нитропруссида натрия.
последний может быть приготовлен путем добавления небольшого кристалла твердого вещества к
2 мл воды.Производство насыщенного фиолетового цвета указывает на то, что
исходное вещество содержит серу. Этот тест очень
чувствительны. Значительными являются только сильные положительные результаты.
3. ГАЛОГЕНЫ (HALIDES)
Подкислять порцию (1 мл) фильтрата слияния с помощью 2 н. Азотной кислоты.
кислоты, и если присутствует азот и / или сера, кипятить 1 — 2
минут. * Охладить и добавить водный нитрат серебра (1 мл), сравнить
с пустым. Образование тяжелого, белого или желтого осадка
галогенид серебра указывает на галоген.Если положительный результат
получено: подкисляют оставшуюся часть фильтрата ‘fusion’
с разбавленной серной кислотой, отварить и остудить. Добавить углерод
тетрахлорид (1 мл) и несколько капель свежеприготовленного хлора
вода. Встряхните смесь.
а) Если слой четыреххлористого углерода остается бесцветным — указывает на хлор.
(b) Если слой четыреххлористого углерода коричневого цвета — указывает бром.
(c) Если слой четыреххлористого углерода является фиолетовым — указывает йод.
* Если также присутствуют азот и / или сера, добавление нитрат серебра в подкисленный раствор «термоядерный» осадить цианид серебра и / или сульфид серебра в дополнение к галогениды серебра. Удаление цианистого водорода и / или сероводород производится путем кипячения раствора для синтеза. ГРУППОВЫЕ КЛАССИФИКАЦИОННЫЕ ИСПЫТАНИЯ
Некоторые функциональные групповые тесты перечислены ниже. Студенты должны обратитесь к практическому учебнику для деталей, и далее информация, эл.грамм. Vogel.
Тесты на ненасыщенность
1. Холодный разбавленный раствор перманганата калия.
2. Раствор брома в четыреххлористом углероде.
Испытания для соединений, содержащих азот
1. Амины
(а) азотная кислота.
(б) Подтверждающие тесты.
2. Соединения, которые дают амины или аммиак на кислоте или щелочи
гидролиз:
Амиды, замещенные амиды, анилиды, нитрилы.
3.Соединения, которые дают амины при восстановлении:
Нитро, нитрозо, азо, гидразо, нитрилы.
Испытания для соединений, содержащих С, Н и, возможно, кислород
1. Карбоновые кислоты
Раствор Na2CO3 или NaHCO3 выделяет углекислый газ.
2. Фенолы
(а) Раствор гидроксида натрия (растворимый). Нерастворим в СО2 и не содержит его
из NaHCO3 (кроме случаев, когда присутствуют группы, привлекающие электроны, например,
2,4-динитрофенол).
(б) Раствор хлорида железа.
с) бромная вода.
3. Альдегиды и кетоны
(а) 2,4-динитрофенилгидразин (в качестве реагента Брэди) для
С = O.
(б) Иодоформный тест на Ch4CO-.
4. Только альдегиды (восстанавливающие свойства)
(а) Решение Фелинга.
(б) Реагент Толлена (аммиачный раствор AgNO3).
(в) реактив Джонса.
5. Спирты
(а) Реагент Лукаса для различения спиртов I, II и III.
(б) реактив Джонса.
(c) Металлический натрий (используйте сухую жидкость и сухую пробирку).
6. Сахар
(а) тест Молиша.
7. Эфиры
(а) Тест на гидроксамовую кислоту.
(б) гидролиз.
Запишите идентификацию неизвестного органического соединения
Дата......................................
Соединение, содержащее C, H (N, Hal, S)
Физические характеристики .................... (твердое вещество, жидкость, газ, цвет, запах и т. д.)
Испытание на воспламенение ........................... (ароматическое или алифатическое)
Физическая константа ........................ (точка кипения или точка плавления)
Тесты на растворимость (в табличной форме)
Групповые классификационные тесты (в табличной форме)
Тестовый вывод наблюдения
Из приведенных выше испытаний и наблюдений данное соединение, вероятно, является
,........................ (кислота, фенол, альдегид и т. д.)
Консультация литературы (Возможности) М.П. производного
(А)
(Б)
(С)
Приготовление производного (способ приготовления)
Наблюдаемый т. Пл. производного
Лит т.пл. производного
результат
№ соединения ........................ это ...................... ......
(дайте формулу)
ИСПЫТАНИЯ ДЛЯ ФУНКЦИОНАЛЬНЫХ ГРУПП
Я.Ненасыщенные соединенияДва распространенных типа ненасыщенных соединений являются алкены и алкины, характеризующиеся углерод-углеродными двойными и тройными связь, соответственно, как функциональная группа. Два общих качественные тесты на ненасыщенность являются реакциями соединения с (а) бромом в четыреххлористом углероде и (б) перманганат калия.
(а) 2% брома в четыреххлористом углероде
Растворить 0,2 г (или 0,2 мл) соединения в 2 мл углерода
тетрахлорид или другой подходящий растворитель и добавляют раствор
по каплям до 2 мл 2% раствора брома в четыреххлористом углероде
и встряхнуть.
Быстрое исчезновение цвета брома, чтобы дать бесцветный Решение является положительным тестом на ненасыщенность.
ПРИМЕЧАНИЕ. Реагент потенциально опасен. Оставь это
с вашей кожи и одежды; защитить ваши глаза и нос. (б) 2% водный перманганат калия
Растворить 0,2 г (или 0,2 мл) вещества в 2 мл воды.
(ацетон также может быть использован в качестве растворителя). Добавьте калий
раствор перманганата по каплям и наблюдаем за результатом.
Для определения бланка подсчитайте количество капель, добавленных к 2 мл ацетона до сохранения цвета. Значительный Разница в количестве капель, необходимых в двух случаях, составляет положительный тест на ненасыщенность.
II. СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ АЗОТ
1. Амины
(а) Реакция с азотистой кислотой Растворить амин (0,5 мл) в
концентрированную кислоту (2,0 мл) и воду (3 мл) и охлаждают раствор
до 0 — 5 в ледяной бане в течение 5 минут.Добавить холодное решение
(ледяная баня) нитрита натрия (0,5 г) в воде (2,0 мл) из
капельница с закручиванием пробирки, сохраняя при этом
смесь в ледяной бане.
АМИН РЕАКЦИЯ
У меня алифатическая N2 развивалась.
RNh3 + HNO2 -> ROH + N2 + h3O
__________________________________________________________________
Я ароматическая диазониевая соль образуется.ArNh3 + HNO2 -> ArN = N +
Добавить холодный раствор диазония и с завихрением
до холодного раствора 2-нафтола (0,2 г) в 5% NaOH
раствор (2 мл). Образуется оранжево-красный азокраситель.
__________________________________________________________________
II алифатические и желтые масляные нитрозамины обычно образуются.II ароматический R2NH + HNO2 -> R2N-NO
__________________________________________________________________
III алифатическая Нет видимой реакции.
__________________________________________________________________
III ароматические диалкиланилины дают зеленое твердое вещество п-нитрозо
соединения (если p-положение незамещено).
__________________________________________________________________
(б) Реакция с бензолсульфонилхлоридом
Бензолсульфонилхлорид реагирует с первичным и вторичным, но не с третичными аминами, чтобы получить замещенные сульфонамиды.
например (а) C6H5SO2Cl + H-NHR + NaOH -> C6H5SO2NHR + NaCl + h3O (b) C6H5SO2Cl + H-NR2 + NaOH -> C6H5SO2NR2 + NaCl + h3OЗамещенный сульфонамид, образованный из первичного амина растворяется в щелочной среде, в то время как из вторичный амин нерастворим в щелочи.
Поместите 0,5 мл (или 0,5 г) соединения, 15 — 10 мл 5% NaOH и 1 мл бензолсульфонилхлорида в пробирке, закрыв пробирку и встряхивайте, пока запах сульфонилхлорида не исчезнувший.Раствор должен быть щелочным (если нет реакции произошло, вещество, вероятно, третичный амин).
Если в щелочном растворе появляется осадок, разбавьте около 10 мл воды и встряхнуть; если осадка нет растворяется, вторичный амин указывается.
Если осадка нет, осторожно подкислите его до красного конго с концентрированной соляной кислотой (добавляется по каплям): осадок указывает на первичный амин.
2. Амиды R-CO-Nh3
Простые первичные амиды можно разложить путем кипячения с щелочью
и тем самым выделяется аммиак.
например Ch4-CO-Nh3 + NaOH -> Ch4-CO2-Na + + Nh4
Вскипятить 0,5 г соединения с 5 мл 10% гидроксида натрия
решение и наблюдать, выделяется ли аммиак.III. СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ С, Н И ВОЗМОЖНО КИСЛОРОД
1.Карбоновые кислоты — тест с 5% водн. NaHCO3
R-CO2H + NaHCO3 -> R-CO2-Na + + CO2 + h3OГидрокарбонат натрия реагирует с карбоновыми кислотами с образованием натриевая соль кислоты и выделяет углекислый газ. Если кислота не растворяется в воде и реакция вялая растворяется кислоту в метаноле и осторожно добавить в насыщенный натрий раствор гидрокарбоната, когда сильное вспенивание наблюдаться
2. Фенолы [Растворим в NaOH и не выделяет CO2 из
NaHCO3]
(а) Бромная вода
Фенолы, как правило, очень реактивны по отношению к электрофильным
реагенты и легко бромируются бромной водой. например
Растворить или суспендировать около 0,05 г соединения в 2 мл разбавьте соляную кислоту и добавьте бромную воду по каплям до цвет брома остается. Белый осадок бромфенола может сформироваться.Твердые производные бромфенола могут быть использованы для подтверждение структуры фенола (см. препарат производные).
(b) Тест на хлорное железо
Большинство фенолов реагирует с хлоридом железа (III) с образованием окрашенных
комплексы. Цвета варьируются — красный, фиолетовый, синий или зеленый —
в зависимости от различных факторов, например использованное фенольное соединение,
растворитель, концентрация. Так как некоторые фенолы не дают
цвета, отрицательный тест не должен восприниматься как значимый без
Вспомогательная информация.
Растворить 0,05 г соединения в 2 мл воды (или смеси вода и этанол, если соединение не растворяется в воде) и добавляют водный раствор хлорида железа по каплям. Соблюдайте любой изменения цвета, которые могут произойти.
3. Альдегиды и кетоны
(а) 2,4-Динитрофенилгидразин (в качестве реагента Брейди). Тест на
карбонильная группа (C = O) в альдегидах и кетонах.
2,4-динитрофенилгидразин дает труднорастворимый желтый или красный
2,4-динитрофенилгидразоны с альдегидами и кетонами.
Добавьте 3 мл реагента к 2 каплям соединения в тесте трубка и встряхнуть. Если сразу не образуется осадок, тепло и дать постоять 5 — 10 минут. Кристаллический осадок указывает на присутствие карбонильного соединения.
Настольный реагент очень разбавлен и предназначен для
только качественные тесты и не должны использоваться при подготовке
производного для целей идентификации. (б) йодоформный тест
для Ч4СО-
Растворить 0.1 г (или 5 капель) соединения в 2 мл воды; если
он нерастворим в воде, добавляют достаточное количество диоксана для получения
однородный раствор. Добавить 2 мл 5% раствора NaOH и затем
вводить йодистый калий — йодный реагент по каплям с
встряхивая, пока не сохранится определенный темный цвет йода. Разрешить
выдержать 2 — 3 минуты; если йодоформ не отделяется в комнате
температура, подогрейте пробирку в стакане с водой на 60. Добавить
еще несколько капель йодного реагента, если слабый йодный цвет
исчезает.Продолжайте добавлять реагент до темноты
цвет не разряжается после 2 минут нагрева при 60. удалять
избыток йода путем добавления нескольких капель разбавленного
раствор гидроксида натрия при встряхивании разбавляют равным
объем воды и оставьте на 10 минут. Тест
положительный, если выпадает желтый осадок йодоформа. Фильтр
от желтого осадка, высушите на подушках фильтровальной бумаги и
определить т. пл. Йодоформ плавится на 120 (это может быть
перекристаллизовывают из метанола-воды).
Реакция дается ацетальдегидом и простым метилом кетоны. Спирты, содержащие группу Ch4CHROH, будут окисляться в условиях реакции, а также дать положительный результат теста.
4. Только альдегиды (восстанавливающие свойства).
(а) Решение Фелинга
Альдегиды уменьшают раствор Фелинга до желтой или красной меди (I)
окись.
Подготовка реагента: смешать равные объемы Фелинга раствор раствор I (водный щелочной тартрат калия) и Раствор Фелинга II (раствор сульфата меди).
Добавьте 2 капли (или 0,05 г) соединения и 2 — 3 капли Реагент и нагреть на кипящей водяной бане 3 — 4 минуты.
Тест положительный на алифатические альдегиды, но часто нерешительный для ароматических альдегидов, где реагент Джонса часто полезно (см. 5).
(b) Реагент Толлена (раствор аммиачной селитры)
Альдегиды легко окисляются до карбоновых кислот и будут
уменьшить реагент Толлена, чтобы получить серебряное зеркало на внутренней стороне
чистой пробирки.
ПЕРВЫЙ очистить пробирку с небольшим количеством горячей азотной кислоты шкаф) и промыть дистиллированной водой.
Приготовление реагента: до 1 мл раствора нитрата серебра добавить несколько капель гидроксида натрия. Затем добавьте разбавленный аммоний гидроксид по каплям, пока осадок просто не растворится.
Добавить 2 — 3 капли соединения в метаноле к 2 — 3 мл Раствор Толлена содержится в очень чистой пробирке. Если нет реакция протекает на холоде, в тепле мягко в воде ванна.
ВНИМАНИЕ: После теста вылейте содержимое пробирку в раковину и промойте пробирку с разбавленным азотная кислота. Любой серебристый фульминат присутствует, что очень Взрывоопасно, когда высохнет, будет уничтожено.
(c) Реактив Джонса (см. Раздел под спиртами).
5. Спирты
Тесты на гидроксильную группу не только обнаруживают присутствие
группа, но может также указывать, является ли она первичной, вторичной
или третичный.
(а) Реактив Джонса (CrO 3 -H 2 SO 4 в H 2 O)
Этот реагент отличает первичные и вторичные спирты от
третичные спирты; тест основан на гораздо большем
устойчивость к окислению третичных спиртов по сравнению с
два других типа. Альдегиды также дают положительный результат теста.
Поместите 1 мл ацетона в пробирку и растворите одну каплю
жидкость или около 10 мг твердого спирта или альдегида в нем.Добавить
одну каплю реагента в раствор ацетона и встряхнуть
пробирка, чтобы смешать содержимое. Первичные и вторичные спирты реагируют
в течение двух секунд, о чем свидетельствует исчезновение
оранжевый цвет реагента и образование зеленого или
сине-зеленый осадок или эмульсия.
Третичные спирты не реагируют даже через 3 минуты.
(I) РЧ3ОН-> РЧО-> RCO2H (II) R2CHOH -> R2C = O (III) R3COH -> нет видимой реакции.
(b) Реагент Лукаса [ZnCl 2 — конц. HCl]
Этот реагент превращает спирты в соответствующий алкил
хлориды. Хлорид цинка (кислота Льюиса) повышает реакционную способность
спиртов в сторону кислоты. Тест зависит от скорости
реакция первичных, вторичных и третичных спиртов с
реагент при комнатной температуре.
(I) РЧ3ОН -> нет реакции при комнатной температуре. (II) R2CHOH -> R2CHCl + h3O (1 час или, возможно, дольше) (III) R3COH -> R3CCl + h3O (немедленно)К 1 мл спирта в маленькой пробирке добавить 6 мл Lucas ‘ реагент при комнатной температуре.Закройте пробку пробкой, встряхните и дать постоять.
(i) Первичные спирты — водная фаза остается чистой (за исключением аллиловый спирт — капли через 7 минут).
(ii) Вторичные спирты — очень медленная реакция (~ 1 час или возможно дольше), когда можно увидеть капли алкилхлорида.
(iii) Третичные спирты — очень быстрая реакция и капли алкилхлорид образуется почти сразу.
6.Сахар, углеводы
Тест Молиша
Это общий тест на углеводы. Растворить 20 — 30 мг
соединение в 2 мл воды и добавляют 0,5 мл реагента (20%
раствор 2-нафтола в этаноле). Залить 2 мл концентрированной
серная кислота из капельницы осторожно опускается по боковой поверхности трубки
так что кислота образует слой под водным раствором
без смешения с ним. Красная окраска, переходящая в темную
фиолетовые формы на границе.Провести второй тест на бланке
решение.
7. Эфиры
Гидроксамовая кислота тест
R-CO-OR '+ h3N-OH -> R-CO-NH-OH + R'-OHРеакция взаимодействия сложных эфиров
и гидроксиламина в присутствии натрия гидроксид с образованием натриевой соли соответствующего гидроксамата кислота. По подкислению и добавлению хлорида железа пурпурно-окрашенный комплекс железа (III) с гидроксамовой кислотой формируется.
Всегда желательно убедиться, что неизвестное соединение не дают окрасить хлоридом железа (III) перед проведением тест на гидроксамовую кислоту.
Процедура испытания гидроксамовой кислоты
(а) Испытание хлорида железа
Растворите каплю или несколько маленьких кристаллов соединения в 1 мл.
95% этанола (ректифицированный спирт) и добавляют 1 мл М соляной кислоты
кислота. Обратите внимание на цвет, полученный при 1 капле 5% железа (III)
хлорид добавляется в раствор.Если ярко выраженный фиолетовый, синий,
красный или оранжевый цвет, тест на гидроксамовую кислоту
описанное ниже НЕ ПРИМЕНИМО.
(b) Тест на гидроксамовую кислоту
Смешайте 1 каплю или несколько мелких кристаллов (около 0,05 г) соединения
с 1 мл 0,5 М гидрохлорида гидроксиламина в 95% этаноле и
добавляют 0,2 мл 6 М водного раствора гидроксида натрия. Нагреть смесь до
кипения и после охлаждения немного добавить 2 мл М.
соляная кислота. Если раствор мутный, добавьте 2 мл 95%
спирт этиловый.Соблюдайте цвет, полученный при 1 капле 5% железа (III)
добавлен раствор хлорида. Если полученный цвет не
продолжайте добавлять реагент по каплям до тех пор, пока
цвет пронизывает все решение. Обычно только 1 капля
необходим раствор хлорида железа (III). Сравните цвет
с тем, что получено в тесте (а). Положительный тест будет
ярко-бордовый или пурпурный цвет по сравнению с желтым
цвет, наблюдаемый при испытании исходного соединения с железом
(III) раствор хлорида в присутствии кислоты.Это часто
Желательно параллельно проводить тест с, скажем, этилом
ацетат, чтобы гарантировать, что условия для этого теста
верный.
ПРИГОТОВЛЕНИЕ ПРОИЗВОДНЫХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Предварительный экзамен и групповые классификационные тесты указать конкретный класс (функциональную группу), к которой относится неизвестное органическое соединение может принадлежать. Дальнейшая характеристика и идентификация зависит от выбора и подготовки подходящее твердое производное и точное определение его температура плавления (лучше всего, между 90 — 150).В следующей таблице перечислены некоторые классы органических соединения и выбор производных, которые могут быть получены для охарактеризовать их. Сверьтесь с таблицами температур плавления в Фогель, какие производные являются наиболее подходящими для характеристика вашего конкретного соединения.
| КЛАСС СОЕДИНЕНИЯ | ПРОИЗВОДНЫХ |
| 1. СПИРТЫ | 3,5-динитробензоат |
| 2.ФЕНОЛЫ | бензоат, ацетат, бромпроизводное |
| 3. Альдегиды и кетоны | семикарбазон, 2,4-динитрофенилгидразон, оксим |
| 4. КИСЛОТЫ | анилид, амид, п-толуидид. |
| 5. AMINES | бензоил, ацетил и сульфонамидные производные |
СПИРТЫ
(i) 3,5-динитробензоаты
3,5-динитробензоилхлорид обычно частично гидролизован и
следует готовить в чистом виде, осторожно нагревая смесь
3,5-динитробензойной кислоты (1 г) и пентахлорида фосфора
(1.5 г) в сухой пробирке, пока она не разжижится (5 мин).
жидкость наливают на сухое стекло для часов и дают затвердеть.
Фосфорилхлориды удаляются путем прессования твердого вещества
шпатель на пачке фильтровальной бумаги. Остаточный хлорангидрид
подходит для немедленного использования при приготовлении
производные.
* Работа под вытяжкой. Пары раздражают глаза и нос.
3,5-динитробензоилхлорид смешивают со спиртом (0.5 — 1 мл) в слабо закупоренной пробирке и нагретой на пару ванна около 10 мин. Вторичные и третичные спирты требуют до до 30 мин. При охлаждении добавляют 10 мл гидрокарбоната натрия Раствор перемешивают до тех пор, пока эфир не кристаллизуется, и насос. Вымойте немного карбонатного раствора, воды и сосите сохнуть. Перекристаллизовать из минимального количества горячего этанола или света нефть. Охлаждайте медленно, чтобы избежать образования масляных капель твой эфир.
ФЕНОЛЫ
(i) Бензоаты (метод Шттена-Бауманна).
К фенолу (0,5 г) добавляют 5% гидроксид натрия (10 мл) в
хорошо закупоренная кипящая трубка или небольшая коническая колба. бензоила
хлорид (2 мл) добавляют в небольших количествах одновременно, и
смесь энергично встряхивают с периодическим охлаждением под краном
или в ледяной воде. Через 15 минут твердый бензоат отделяется:
раствор должен быть щелочным в конце реакции; если
не щелочной, или, если продукт маслянистый, добавить твердый осадок
гидроксид натрия и снова встряхнуть.Собрать бензоат, промыть
с холодной водой, и перекристаллизовать из спирта или
легкая нефть.
(ii) Ацетаты
Ацетаты многих простых фенолов являются жидкостями; однако это
подходящее производное для многоатомных и замещенных фенолов.
фенол (0,5 г) растворяют в 10% -ном растворе гидроксида натрия и
добавляется равное количество колотого льда, затем уксус
ангидрид (2 мл). Смесь энергично встряхивают в закупоренной
пробирка, пока ацетат не отделяется.Продукт фильтруется
и перекристаллизован из спирта.
(iii) Бромпроизводные
Фенол (0,3 г) суспендируют в разбавленной соляной кислоте (10 мл)
и бромную воду добавляют по каплям, пока не прекращается обесцвечивание
происходит. Производное брома, которое выпадает в осадок, фильтруется.
выкл и перекристаллизован из спирта.
Альдегиды и кетоны
(i) поликарбазоны
Растворить гидрохлорид семикарбазида (1 г) и ацетат натрия
(1.5 г) в воду (8 — 10 мл), добавить альдегид или кетон (0,3 мл)
и встряхнуть. Встряхните смесь в течение нескольких минут и затем охладите в
вода со льдом. Отфильтровать кристаллы, промыть небольшим количеством холодной воды
и перекристаллизовать из метанола или этанола.
(ii) 2,4-динитрофенилгидразоны
Суспендируют 0,25 г 2,4-динитрофенилгидразина в 5 мл метанола
и осторожно добавить 0,5 мл концентрированной серной кислоты. Фильтр
теплый раствор и добавить раствор 0.2 г карбонила
соединение в 1 мл метанола. Перекристаллизовать производное из
метанол, этанол или этилацетат.
(iii) Оксимы
Гидроксиламин гидрохлорид (0,5 г) растворяют в воде (2
мл). 10% гидроксид натрия (2 мл) и карбонильное соединение (0,2 —
0,3 г) растворяют в спирте (1 — 2 мл), добавляют смесь
нагревают на паровой бане в течение 10 мин, а затем охлаждают на льду.
Кристаллизация вызывается поцарапать стороны теста
трубка со стеклянным стержнем.Оксимы могут быть кристаллизованы из
алкоголь.
КИСЛОТЫ
(i) Амиды, анилиды и п-толуидиды
Кислоту (0,5 г) кипятят с обратным холодильником с тионилхлоридом (2–3 мл) в
вытяжной шкаф в течение 30 минут. * Желательно разместить
пробка ваты в верхней части обратного холодильника, чтобы исключить
влаги. Конденсатор удаляется и избыток тионила
хлорид отгоняют (бп. 78). Таким образом, хлорангидрид
полученный обрабатывается концентрированным раствором аммиака (5 мл) или
анилин (0.5-1 мл) или п-толуидин (0,5-1 г), когда твердое вещество
производная отделяется. Собран и перекристаллизован из
спирт с добавлением обесцвечивающего угля, если это необходимо
* Альтернативно используйте PCl 5 для образования хлорангидрида кислоты.
AMINES
(i) Производные ацетила (ацетамиды)
Осторожно кипятят в маленькой сухой колбе под сухим конденсатором.
амин (1 г) с уксусным ангидридом (3 мл) в течение 15 мин. Охладить
Реакционную смесь выливают в 20 мл холодной воды.Отварить
разложить избыток уксусного ангидрида. Охладить и отфильтровать с помощью всасывания
нерастворимое производное. Перекристаллизовать из этанола.
(ii) Бензоильные производные (бензамиды)
Суспендируют 1 г амина в 20 мл 5% водного раствора гидроксида натрия.
в хорошо укупоренной колбе и добавляют 2 мл бензоилхлорида (дыма
капот!), около 0,5 мл за один раз, при постоянном встряхивании. Встряска
энергично в течение 5 — 10 мин до появления запаха бензоилхлорида
исчез.Убедитесь, что смесь остается щелочной. Фильтр
от твердого производного промыть небольшим количеством холодной воды и
перекристаллизовать из этанола.
(iii) Бензолсульфонамиды
К 1 г амина в 20 мл 5% раствора гидроксида натрия в
В хорошо укупоренную колбу добавляют 1 мл бензолсульфонилхлорида (дыма
капот!). Встряхните смесь до запаха сульфонила
хлорид исчезает. Убедитесь, что раствор щелочной. окисляться
при необходимости получить осажденное производное.Концентрированный
соляная кислота добавляется по каплям. Фильтровать
Продукт, вымыть с небольшим количеством холодной воды и высохнуть.
Перекристаллизовать из этанола.
Вернуться к химии, UWI-Mona, Домашняя страница
Copyright © 2005 Роберт Джон Ланкашир, все права защищены.
Создано и поддерживается профессором Робертом Дж. Ланкашир,Химический факультет Вест-Индского университета,
Кампус Мона, Кингстон 7, Ямайка. Создано в марте 1997 года. Ссылки проверены и / или в прошлом изменено 11 декабря 2005 г.
URL http://wwwchem.uwimona.edu.jm/lab_manuals/c10expt25.html ,
Автор:
Наталья Беликова , доктор философии, директор по аналитическим услугам — Life Science, Линкольншир, Иллинойс, США
Фармакопейная конвенция США (USP), Европейская фармакопея (Ph. Eur.) И Японская фармакопея (JP) определяют требования к качественному и количественному составу лекарственных средств.В этих фармакопеях также изложены аналитические методы, которые должны быть выполнены для фармацевтических продуктов, а также веществ и материалов, используемых при их производстве.
Аминокислотный анализв целом может использоваться для идентификации биофармацевтических активных ингредиентов и определения примесей и связанных веществ в активных фармацевтических ингредиентах. Он также может быть использован для количественного определения одной или всех аминокислот в лекарственных препаратах. Нашей целью было разработать метод жидкостной хроматографии для одновременного определения приблизительно 20 аминокислот в простых и сложных смесях, которые соответствуют требованиям пригодности системы Ph.Евро. общая глава (2.2.56).
Приложения
Для разработки метода рабочий стандарт содержал 17 различных аминокислот в концентрации 25 пмоль / мкл (Agilent Technologies) для оценки разделения и воспроизводимости. Программа была оптимизирована так, чтобы разрешение между лейцином и изолейцином было не менее 1,5. согласно Ph. Eur. общие требования главы 2.2.56. Кроме того, стандарт аммиака (0,12 ч / млн или 0,02% относительно концентрации образца) был запущен в то же время, чтобы показать, что пик не мешает другим пикам и имеет достаточное количество площадей пиков для точного расчета от цикла к циклу.Ph. Eur. монографии по аргинину и гистидину (нингидрин-положительные вещества и тесты на аммоний) были официально проверены на нашем предприятии. Несколько других монографий, в том числе L-лизин, L-аргинин, L-глицин, были успешно запущены в нашей лаборатории.
Позже, метод ВЭЖХ с пост-колоночной дериватизацией для тестирования нингидрин-положительных веществ и аммония в L-аргинине по Ph. Eur. был проверен. Монография перечислила L-орнитин, L-лизин и L-цитруллин в качестве известных примесей. Проверка включала специфичность, линейность, LOQ, LOD, точность, промежуточную точность и точность (спайк-восстановление).Метод, как было показано, является конкретным, линейным, точным и точным.
SGS Life Sciences (Чикаго, Иллинойс) успешно применили этот метод для тестирования аминокислот, присутствующих в сложных составах. Например, гидрохлорид аргинина служит стабилизатором для противовоспалительного препарата на основе биоподобных белков. Высокомолекулярный API отфильтровывали, а низкомолекулярную фракцию разбавляли и вводили для анализа. Мы продемонстрировали отличную линейность (корреляция 0,9997 в диапазоне 0.5-100 мкг / мл), хорошая точность метода (% RSD , n = 5 = 0,2-0,6%) и приемлемая точность в диапазоне 75-125% (восстановление в пределах 96-121%) при выполнении исследования восстановления спайка с использованием Placebo.
Наконец, метод регулярно используется для анализа аминокислотного состава небольших белков и полипептидов. Образец гидролизуют 6 н. HCl при 110 ° С в течение не менее 20 часов и затем вводят. Индивидуальные аминокислоты идентифицируют и определяют количественно по известным стандартам. Этот тест служит в качестве идентификационного теста и основан на относительном составе отдельных аминокислот (относительном соотношении каждой аминокислоты к общему количеству аминокислот, присутствующих в образце).
Метод
Использовали систему ВЭЖХ с системой доставки растворителя, автосамплером, детектором с двумя длинами волн и модулем сбора данных (Waters). В этом методе использовалась программа градиента подвижной фазы, а также программа градиента температуры в колонке для отделения представляющих интерес аминокислот. После разделения элюент подвергали пост-колоночной дериватизации нингидрином с последующим детектированием при 570 нм и 440 нм для аминокислот и иминокислот, соответственно (Pinnacle PCX Post-Column Derivatiization Instrument).Параметры ВЭЖХ приведены в таблице 1, а программа градиента подвижной фазы представлена в таблице 2. Таблица 3 иллюстрирует параметры системы дериватизации после столбца, а программа градиента температуры в столбце представлена в таблице 4.
Стандарты и испытуемый образец вводили в ВЭЖХ с колонкой на основе натрия (натриевая биржа Pickering Labs, 4,6 × 110 мм, 5 мкм). Образцы разделяли с помощью программы градиента подвижной фазы в сочетании с программой градиента температуры для оптимизации разделения аминокислот.Элюент из колонки подвергался дериватизации после колонки нингидрином. Нингидрин-положительные вещества на основе аминокислот были обнаружены при 570 нм; нингидрин-положительные вещества на основе иминокислот, такие как пролин, были обнаружены при 440 нм.
результатов
Использование Ph. Eur. В общей главе (2.2.56) методом мы смогли выделить и идентифицировать аминокислоты. Во время удерживания представляющих интерес аминокислот не наблюдалось никаких пустых помех, что указывает на специфичность метода (рисунок 1).Пики холостого хода из-за градиента подвижной фазы были назначены на основе инъекции холостого хода. Аналогично, аммонийный стандарт дал один пик (фиг.2). Аминокислоты в стандартной смеси продемонстрировали хорошее разделение и были легко идентифицируемы (Рисунок 3), как и гидролизованный тестовый образец (Рисунок 4). Пролин, который является иминокислотой, был единственным пиком, обнаруженным при 440 нм (фиг.5).
Анализ был проверен на пригодность с набором избранных аминокислот (таблица 5).% RSD рабочего стандарта (точность прибора) для аминокислот (~ 1,2 мкг / мл или 0,2% к концентрации образца для анализа отдельных аминокислот на Ph. Eur. Монографии) было не более 15%. % RSD для пика аммония (0,12 ч / млн или 0,02% к концентрации образца) составляло не более 15%. Разрешающая способность между лейцином и изолейцином была не менее 1,5. Пик симметрии для аминокислот и пика аммония составлял 0,8-1,5. Было показано, что метод является линейным для выбранных аминокислот в диапазоне 0.3-1,5 мкг / мл (таблица 6). LOQ метода для нескольких аминокислот составлял ~ 0,3 мкг / мл или 0,05% относительно концентрации образца; тогда как LOD метода составлял ~ 0,1 мкг / мл или 0,015% относительно концентрации образца.
Выводы
Разработанный метод был оптимизирован для соответствия требованиям пригодности системы согласно Ph. Eur. общая глава (2.2.56). Наша лаборатория успешно проверила метод анализа нингидрин-положительных веществ в отдельных образцах аминокислот по Ph.Евро. монографии. В то время как этот метод использовался для оценки концентраций вспомогательных веществ (аминокислот) в генерических и биоподобных препаратах, метод использовался для оценки относительного аминокислотного состава в небольших белках и пептидах.
Рекомендации
Тел. Евр. 9.0 (2.2.56) Аминокислотный анализ
Тел. Евр. 8,0 Аргинин гидрохлорид монография
USP 39 <1226> Проверка составления процедур
Pickering Laboratories Method Abstract / 391 Анализ аминокислот в соответствии с Европейской Фармакопеей 8.0
ICH Q2 (R1) Валидация аналитических процедур, текста и методологии
,Морская вода , вода, которая составляет океаны и моря, покрывая более 70 процентов поверхности Земли. Морская вода представляет собой сложную смесь из 96,5% воды, 2,5% солей и небольшого количества других веществ, в том числе растворенных неорганических и органических материалов, твердых частиц и нескольких атмосферных газов.
Чистая вода океана возле пляжа на острове Гранд Багама на Багамах. © Philip Coblentz — Digital Vision / Getty ImagesБританика Викторина
Мировой океан: факт или вымысел?
Атлантический океан имеет самые глубокие воды в мире.
Морская вода представляет собой богатый источник различных коммерчески важных химических элементов. Большая часть магния в мире извлекается из морской воды, а также большое количество брома. В некоторых частях мира хлорид натрия (поваренная соль) по-прежнему получают путем испарения морской воды. Кроме того, вода из моря, если она обессолена, может обеспечить безграничную подачу питьевой воды. Многие крупные опреснительные установки были построены в засушливых районах вдоль побережья на Ближнем Востоке и в других местах, чтобы восполнить нехватку пресной воды.
Химические и физические свойства морской воды
Шесть наиболее распространенных ионов морской воды — хлорид (Cl — ), натрий (Na + ), сульфат (SO 2 4 — ), магний (Mg 2+ ), кальций ( Са 2+ ) и калий (К + ). По весу эти ионы составляют около 99 процентов всех морских солей. Количество этих солей в объеме морской воды варьируется из-за локального добавления или удаления воды (например,через осаждение и испарение). Содержание соли в морской воде обозначается соленостью ( S ), которая определяется как количество соли в граммах, растворенной в одном килограмме морской воды и выраженной в частях на тысячу. Наблюдалось, что соленость в открытом океане колеблется от 34 до 37 частей на тысячу (0/00 или ppt), что также может быть выражено как 34 — 37 практических единиц солености (psu).
Неорганический углерод, бромид, бор, стронций и фтор составляют другие основные растворенные вещества морской воды.Из многих незначительных растворенных химических компонентов неорганический фосфор и неорганический азот являются одними из наиболее заметных, поскольку они важны для роста организмов, населяющих океаны и моря. Морская вода также содержит различные растворенные атмосферные газы, в основном азот, кислород, аргон и углекислый газ. Некоторые другие компоненты морской воды представляют собой растворенные органические вещества, такие как углеводы и аминокислоты, и частицы, богатые органическими веществами. Эти материалы происходят главным образом из верхних 100 метров (330 футов) океана, где растворенный неорганический углерод превращается в результате фотосинтеза в органическое вещество.
Получите эксклюзивный доступ к контенту из нашего первого издания 1768 года с вашей подпиской. Подпишитесь сегодняМногие характеристики морской воды соответствуют характеристикам воды в целом из-за их общих химических и физических свойств. Например, молекулярная структура морской воды, как и у пресной воды, способствует образованию связей между молекулами. Некоторые из отличительных качеств морской воды связаны с ее содержанием соли. Вязкость (то есть внутреннее сопротивление потоку) морской воды, например, выше, чем у пресной воды из-за ее более высокой солености.Плотность морской воды также выше по той же причине. Температура замерзания морской воды ниже, чем у чистой воды, а температура кипения выше.
Химический состав
На химический состав морской воды влияют самые разные химические транспортные механизмы. Реки добавляют растворенные и дисперсные химикаты к окраинам океана. Порошки, переносимые ветром, переносятся в районы среднего океана за тысячи километров от их континентальных источников. Гидротермальные растворы, которые циркулировали через вещества земной коры под морским дном, добавляют в глубокий океан как растворенные, так и дисперсные материалы.Организмы в верхних слоях океана превращают растворенные вещества в твердые вещества, которые в конечном итоге оседают на больших глубинах океана. Частицы при транспортировке к морскому дну, а также материалы как на морском дне, так и внутри него подвергаются химическому обмену с окружающими растворами. Благодаря этим местным и региональным механизмам ввода и удаления химических веществ каждый элемент в океанах проявляет пространственные и временные изменения концентрации. Физическое перемешивание в океанах (термохалинная и ветряная циркуляция) имеет тенденцию к гомогенизации химического состава морской воды.Противоположные влияния физического смешивания и биогеохимических механизмов ввода и удаления приводят к значительному разнообразию химических распределений в океанах.
,Рассмотрено несколько методов экстракции и аналитического определения для общих нефтяных углеводородов (TPHCs) в водных и твердых образцах. Инфракрасная спектроскопия является одним из эффективных методов, которые сегодня заменяются в результате избавления от некоторых галогенированных растворителей, классифицированных как озоноразрушающие вещества. Гравиметрический метод, который использует н-гексан в качестве экстракционного растворителя для определения масла и смазки, а также неполярных материалов, стал предпочтительным выбором, несмотря на то, что он не подходит для летучих веществ из-за обязательной стадии испарения.Другие часто используемые методы включают газовую хроматографию с пламенно-ионизационным детектором (FID) или масс-спектрометрическим детектором (MSD), который способен определять тип присутствующих углеводородов и применим как к летучим, так и к полулетучим образцам. Ультрафиолетовая флуоресценция является еще одним методом, который доступен как в качестве портативного полевого устройства, так и в качестве лабораторного оборудования за пределами площадки. Каждый из методов имеет свои преимущества и недостатки; следовательно, выбор метода определяется типом данных, которые подробно обсуждаются в этом обзоре.Было также рассмотрено распределение TPHC в воде и отложениях по всему земному шару и факторы, влияющие на распределение.
1. Введение
Нефтяные углеводороды (ПГК) являются важными среди органических загрязнителей, которые часто сбрасываются в морскую среду в более низких концентрациях в виде городских стоков, автомобильных отходов, ливневых вод, промышленных стоков или бытовых отходов [1–3 ] и иногда в более высоких концентрациях в качестве крупного разлива нефти [4, 5].Основными составляющими этих ПГК являются разложившаяся сырая нефть, сгоревшее ископаемое топливо и нормальные алканы [6, 7]. Как правило, они менее растворимы в воде, но легко адсорбируются на твердые частицы и впоследствии удаляются в донный осадок, который стал резервуаром для нескольких гидрофобных загрязнителей. Опасность осаждения этих органических загрязнителей заключается в их тенденции к накоплению и биоконцентрации со временем в водных организмах [8–10].
Общее количество нефтяных углеводородов (TPHCs) — это термин, обычно используемый для описания количества углеводородов на нефтяной основе, извлекаемых и измеряемых определенным методом в матрице окружающей среды [11, 12].Аналитические методы TPHC сильно различаются по объему, каждый из которых дает результаты в определенном диапазоне, в то время как некоторые являются неспецифичными. Следовательно, понимание того, как был проведен анализ, очень важно для правильной интерпретации полученных результатов. Методы с разной эффективностью экстракции могут давать разные концентрации TPHC для одного и того же образца [13, 14]. Следовательно, результаты, полученные с использованием различных процедур, всегда трудно сравнивать, поскольку в них участвуют разные стандарты калибровки и экстрагирующие растворители [6].
Нефтяные углеводороды состоят в основном из трех групп соединений, а именно алканов, алкенов и ароматических соединений [15]. Алканы являются ключевыми компонентами многих очищенных нефтепродуктов (например, бензина, дизельного топлива, керосина, реактивного топлива и мазута) и подразделяются на несколько классов, которые включают следующие: линейные алканы (н-алканы), разветвленные алканы, изопреноиды циклоалканы (например, стераны и тритерпаны) и неразрешимые комплексные смеси (UCM), которые трудно разрешить методом газовой хроматографии на капиллярной колонке [6, 16].Присутствие UCM на хроматограммах обычно указывает на деградацию нефти. Они обычно находятся в высокомолекулярном диапазоне н-алканов, но иногда присутствуют и в низкомолекулярном диапазоне [17, 18].
TPHC иногда определяют как сумму концентраций н-алканов и UCM [19] или как общую концентрацию всех углеводородов, элюирующихся из н-нонана (C9) в н-гексатриаконтан (C36), за исключением приоритетных полициклических ароматических углеводородов [ 20]. В основном они обнаруживаются в диапазоне более высоких молекулярных масс углеводородов, а иногда и в диапазоне низких молекулярных масс [21].TPHC также можно измерить как сумму алифатических и ароматических углеводородов, особенно в следующих группах: C9-C18 (алифатические), C19-C36 (алифатические) и C11-C22 (ароматические) [22–24].
Общее количество нефтяных углеводородов (TPHCs) не может быть прямым указателем опасности для людей или окружающей среды [13, 25], но их наличие указывает на состояние здоровья водоема, а также используется для отслеживания источников загрязнения в прибрежные воды и отложения [26, 27].В этой статье мы рассмотрим существующие методы извлечения нефтяных углеводородов в образцах воды и твердых частиц, сравним методы окончательного определения и оценим уровни нефтяных углеводородов в водной среде по всему земному шару и доступные инструменты для отслеживания источников с использованием n- алканы в качестве эталонных соединений.
2. Физико-химические свойства
2.1. Точки кипения
Обычно температура кипения углеводородов (УВ) увеличивается с увеличением числа атомов углерода.Для н-алканов увеличение примерно на 20 ° C наблюдается при каждом добавлении нового атома углерода в цепь. ПАУС характеризуются более высокими температурами плавления и кипения, чем их соответствующие н-алканы, и поэтому они имеют твердую природу [28].
2.2. Растворимость, летучесть и стойкость
Степень взаимодействия углеводородных структур с водой зависит от степени их полярности. Алифатические углеводороды обычно менее полярны и поэтому менее растворимы в воде по сравнению с их соответствующими ароматическими аналогами.Например, растворимость алифатических углеводородов в диапазоне C5-C6 составляет 36 мг / л, в то время как ароматические углеводороды в том же диапазоне имеют растворимость до 220 мг / л. Наиболее растворимыми компонентами ароматических углеводородов являются соединения с более низким молекулярным весом. Следовательно, растворимость уменьшается по мере увеличения количества ароматических колец и увеличения молекулярной массы. С другой стороны, алифатические углеводороды относительно более летучие, чем ароматические углеводороды с аналогичным числом атомов углерода [29].Почти все нормальные алканы с углеродным числом менее 15 теряются в результате испарения в первые дни разлива, в то время как алканы с углеродным числом более 20 теряются через несколько недель [13, 30]. Углеводороды с более низким весом менее устойчивы в окружающей среде в отличие от высокомолекулярных углеводородов. Следовательно, стойкость нефтяных углеводородов возрастает с увеличением температуры кипения соединения [28].
2.3. Токсичность и микробная деградация
Ароматические углеводороды считаются относительно более токсичными и более устойчивыми к микробной деградации, чем соответствующие нормальные алканы, изоалканы, циклоалканы и ненасыщенные алифатические углеводороды [5, 31].Степень токсичности загрязнителей в воде будет в значительной степени зависеть от уровня их растворимости [28]. Микробная деградация углеводородов является функцией многих факторов, которые включают уровень растворенного кислорода, pH и микробную популяцию в окружающей среде. Популяция разлагающихся бактерий может быть ниже в незагрязненной среде, но может резко возрасти при контакте с разлитыми нефтяными веществами [32–36].
Степень восприимчивости углеводородов к микробной деградации различается в зависимости от класса [37, 38], и бактерии могут разлагать алифатические, алициклические и ароматические углеводороды с низким или средним весом с более высокой скоростью, когда условия окружающей среды очень идеальны.Тем не менее, скорость биодеградации уменьшается по мере увеличения сопротивления из-за увеличения молекулярной массы соединений [39]. Типичный порядок убывания биодеградации определяется следующим образом: н-алканы> разветвленные алканы> низкомолекулярные ароматические соединения> циклические алканы> высокомолекулярные ароматические соединения. Ароматические углеводороды обычно менее биоразлагаемы, чем соответствующие алифатические углеводороды [5, 37, 38].
Оксигеназы могут превращать алканы в спирт в процессе деградации.Спирт может быть окислен до альдегида, а затем до жирных кислот, которые впоследствии могут быть использованы для окисления алифатической цепи — . Аналогичным образом циклоалканы могут разлагаться до циклического спирта оксидазами и затем дегидрироваться до кетона. Аналогично, ароматические углеводороды могут превращаться в эпоксид под действием оксигеназ. Затем продукт может быть гидратирован до транс--дигидродиолов, которые затем окисляются до катехолов. Позднее катехол может быть окислен до муконовой кислоты или 2-гидроксимуконового полуальдегида [40], который в конечном итоге может разлагаться с образованием органических кислот, которые используются микроорганизмами для синтеза клеток и производства энергии [41].
3. Источники нефтяных углеводородов в морской среде
Нефтяные углеводороды в морской среде поступают из природных (биогенных или диагенетических) и антропогенных (петрогенных или пирогенных) источников [42]. Биогенные исходные углеводороды относятся к углеводородам, производимым живыми организмами (например, планктонами, водорослями и бактериями) или в результате биологических процессов с участием наземных растений. Примеры включают алифатические углеводороды C23-C33, которые в основном вырабатываются детритом наземных растений и нечетными н-алканами (C15, C17 и C19) из биогенного морского сырья, которое обычно доступно в небольшом количестве [43].Углеводороды из диагенетических источников — это те углеводороды, которые образуются в результате физических и геохимических изменений, произошедших в осадке после его первоначального осаждения при превращении в породу. Они попадают в морскую воду в основном за счет естественной утечки [44].
Антропогенные углеводороды обычно больше в окружающей среде, чем природные. Они обычно возникают в результате различных видов человеческой деятельности, таких как индустриализация, урбанизация, транспорт, утилизация нефти, эксплуатация и хранение, доставка и рыболовство [45, 46].Изобилие C16, C18 и C20 в большинстве случаев предполагает разлив нефти [18] из резервуаров и нефтепроводов, построенных для транспортировки сырой нефти из одного места в другое [44]. Для углеводородов, полученных из антропогенных источников, уровень нечетных алканов почти равен уровню четных, обычно в соотношении 1: 1 [43]. В начале 1980-х годов был сделан вывод о том, что примерно 10% сырой нефти в морской среде поступает из естественных нефтяных просачиваний, а еще 27% приходится на добычу, переработку и транспортировку нефти, в то время как 63% приходится на городские и речной сток, выбросы в атмосферу, а также коммунальные и промышленные сбросы, среди прочего [44].
4. Сбор и сохранение проб
Стратегии сбора и подготовки проб имеют решающее значение при анализе углеводородов нефти в окружающей среде [47]. Образец должен быть собран без загрязнения и должен полностью соответствовать среде окружающей среды, в которой он был взят [11, 13]. Аналитик должен следить за тем, чтобы во время и после сбора проб не было ошибок или ошибок. Оборудование для отбора проб должно быть тщательно очищено между точками отбора проб, чтобы избежать перекрестного загрязнения, и образец должен быть однородным.В хорошей практике для водных образцов требуется минимум один повторяющийся полевой образец, и для предотвращения переполнения следует оставить место для воздуха над образцом [47, 48].
Рекомендуется использовать 1-литровые бутылки из янтарного стекла с завинчивающейся крышкой с тефлоновым покрытием для сбора водной пробы. Образцы должны храниться во время сбора концентрированной HCl или H 2 SO 4 до pH <2 и выдерживаться при 4 ° C сразу после сбора до момента экстракции в течение 14 дней после сбора.Однако несохраненные образцы должны быть извлечены в течение 7 дней [23, 48, 49]. Пробы почвы или отложений должны быть собраны с помощью пробоотборника или керна или любого другого оборудования, которое будет сочтено целесообразным, в стеклянной банке с широким горлом объемом 120 мл или сосуде любых других размеров, в зависимости от количества образцов, необходимого для анализа [47]. Образцы должны быть охлаждены до 4 ° C и извлечены в течение 14 дней с момента сбора. Как водный, так и почвенный / осадочный экстракты должны быть проанализированы в течение 40 дней после экстракции [11, 49].Объем 400 мл - наименьший размер водной пробы, разрешенный для этого анализа, при условии соблюдения соотношения растворитель / проба [23].
Образцы почвы или отложений могут быть сохранены при температуре 4 ± 2 ° C во время сбора и впоследствии заморожены при -10 ° C в течение 48 часов. Образец должен быть извлечен не позднее, чем через 14 дней после оттаивания и проанализирован в течение следующих 40 дней. При необходимости замороженные образцы могут храниться до года перед анализом, но должны быть извлечены в течение 24 часов после размораживания [48].
