Урок-практикум в 10-м классе на тему: «Качественный анализ органических веществ»
Тип урока: урок-практикум.
Задачи урока:
Образовательные
- Закрепить теоретические навыки, полученные при изучении темы “Предельные углеводороды”. Уметь практически определять наличие углерода, водорода и хлора в органических веществах, проводить наблюдения, делать выводы; соблюдать правила техники безопасности при работе в химическом кабинете.
- Уметь применять теоретические знания о качественных реакциях. Контролировать и корректировать умения извлекать информацию при наблюдении за химическим опытом
- Продолжать формирование умений и навыков по составлению уравнений реакций.
Развивающие
- Развивать у учащихся умения сравнивать и
анализировать сведения, полученные в ходе
практической работы, логически излагать свои
мысли.

Воспитывающие
- Продолжить формирование химической картины мира, способствовать осознанию реальности существования атомов и молекул, и материального единства на основе этих представлений (показывая многообразие органических соединений).
Методы: фронтальный опрос, беседа по проблемным вопросам, практическая работа, самостоятельная работа, частично-поисковый, рефлексия.
Оборудование и реактивы. Каждой группе выдается набор реактивов и лабораторных принадлежностей: лабораторный штатив, нагревательный прибор, простейший прибор для получения газов, держатель, фарфоровая чашка, парафин, оксид меди (II), известковая вода, прокаленный сульфат меди (II), медная проволочка (10 см), раствор тетрахлорметана, сахар, полимеры, содержащие х.э. хлор.
План урока
| Этапы урока | Деятельность учителя | Деятельность учащегося |
1. Организационный момент(1 мин.). Организационный момент(1 мин.). |
Приветствие | Готовятся к уроку, разбивка на группы. |
| 2.Знакомство с картой инструкцией(3 мин). | Рекомендует знакомство с картой инструкцией | Знакомятся с картой-инструкцией |
| 3. Сообщение темы и цели практикума. Инструктаж
по технике безопасности. ( 3 мин). |
Беседа о Т.Б. | Отвечают на вопросы. |
| 4.Изучение и обсуждение задания в группе. (3 мин) | Спрашивает каждую группу о затруднениях и консультирует по работе. | Выясняют порядок выполнения эксперимента, распределяют роли, обсуждают вопросы и отвечают на них. |
| 5.Выполнение задания. ( 15 мин) |
Наблюдает за ходом выполнения эксперимента, консультирует по сложным вопросам. | Выполняют опыты, анализируют, делают выводы. |
| 6.Письменный отчет. (5 мин) |
Выясняет правильность выводов. | Записывают результаты эксперимента. |
| 7.Устный отчет. Ответы на вопросы. ( 10мин) |
Слушает отчеты, задает наводящие вопросы, уточняет детали в случае неправильного ответа. | Выступают с отчетом. Слушают отчеты, задают вопросы, если что непонятно. |
| 8.Подведение итогов. Самооценка.(3 мин) | Учитель нацеливает на правильную самооценку. | Оценивают себя и работу товарищей. |
| 9.Постановка домашнего задания. ( 2 мин) |
На следующем уроке параграф 13, упр.2,4(а) | Записывают домашнее задание. |
| 10.Резервные задания | Сделать письменно теоретические задания. | Выполняют письменно задания. |
ХОД УРОКА-ПРАКТИКУМА
Математик Н. М. Крылов сказал: “Теория без
практики мертва, практика без теории сверх того и
пагубна”.
М. Крылов сказал: “Теория без
практики мертва, практика без теории сверх того и
пагубна”.
(Этот эпиграф записан на классной доске.)
На доске записана дата, практическая работа № 1, тема, цель, ход работы, таблица, план работы на уроке, регламент времени.
I. Вводная часть
Учитель. У нас сегодня урок-практикум. Ознакомьтесь с картой – инструкцией.
ПЛАН РАБОТЫ ГРУППЫ:
- Прочтите внимательно вопросы и задания. Обсудите. Составьте план выполнения. Выполните опыты.
- Проведите опыт.
Работайте с малыми количествами реактивов, выполняйте все операции аккуратно. Растворы, взятые в большем объеме, чем нужно, обратно в сосуд не выливайте — только в стакан для слива. Помните, как зажигать и гасить спиртовку, закреплять пробирку в держателе и нагревать ее. Обо всех экстренных случаях немедленно сообщите учителю.
 Будьте осторожны!
Соблюдайте аккуратность!
Будьте осторожны!
Соблюдайте аккуратность! - Оформите письменно отчет о проделанной работе. Сделайте выводы.
- Запишите уравнения реакций, осуществляемых в опыте, расставьте коэффициенты.
- Сделайте устный отчет.
- Приведите в порядок рабочее место.
Учитель: Сформулируйте тему урока и цель урока.
Ожидаемый ответ: Урок-практикум по теме “Качественный анализ органических соединений”.
Учитель: Предлагаю, не приступая к выполнению работы, побыть в роли теоретиков и поставить перед собой задачи урока.
Ожидаемый ответ: Задачи урока — научиться практически определять наличие углерода, водорода и хлора в органических веществах, проводить наблюдения, делать выводы; соблюдать правила техники безопасности при работе в химическом кабинете.
Учитель: Назовите основные правила техники
безопасности.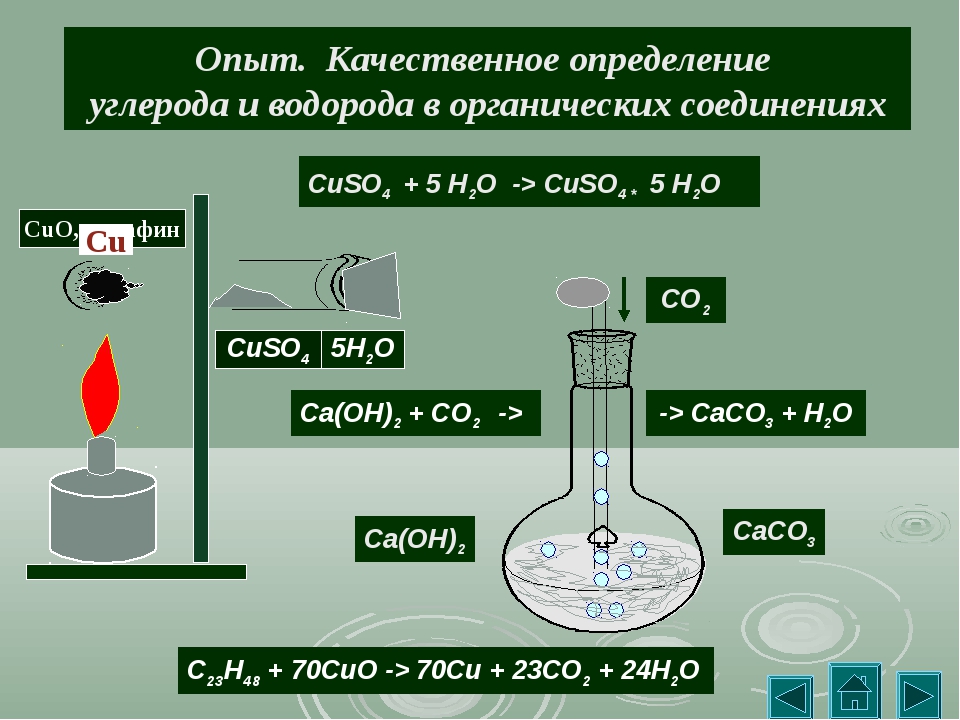
Ожидаемый ответ:
ТБ:
- Пробирка закреплена правильно, если она не выпадает из лапки и может быть слегка повернута вокруг своей оси.
- Нагревайте осторожно сначала всю пробирку, а затем, не вынимая ее из пламени, ту часть, где находится вещество.
- Направляйте отверстие нагреваемой пробирки в сторону от себя и соседей, избегая выбрасывания жидкости.
- Не наклоняйтесь над нагреваемой пробиркой.
- При пользовании нагревательным прибором
запрещается:
— передача зажженного нагревательного прибора.
— зажигание одного нагревательного прибора от другого. - Гасите только накрывая пламя колпачком.
- Выньте газоотводную трубку из пробирки с водой, не прекращая нагревания пробирки с веществом, в противном случае воду из пробирки может перебросить в раскаленную пробирку с веществом!
Учитель: Итак, тема сегодняшнего урока
практическая работа: по теме “Качественный
анализ органических соединений» Запишем тему
в тетрадь.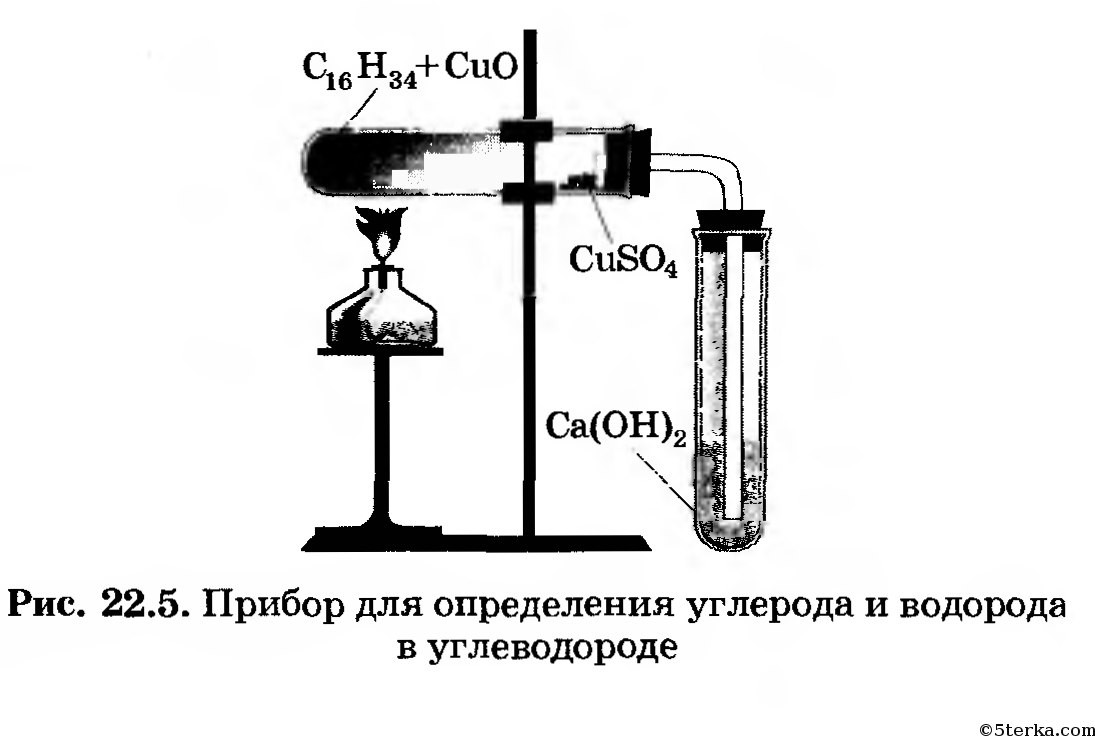
Цель работы: Научится практически определять наличие углерода, водорода и хлора в органических веществах
II. Работа по группам
Учитель: Работать предстоит в группах, каждая группа получает карту-инструкцию и задание, которое оценено по уровням:
| № задания | уровень | оценка |
| 1.2,3 | 1 | 3 |
| 4,5,6. | 3 | 4,5 |
III. Изучение и обсуждение задания в группе (3 мин)
IV. Выполнение заданий (15 мин).
V. Письменный отчет (5 мин).
VI. Устный отчет (10 мин).
VII. В заключение урока учащимся
предлагается заполнить карту самооценки
(таблица).
| Д/З, самооценка подготовки к ПР | ТБ, самооценка Знаний. |
Эксперимент (Э) | Оценка лидера | Итог, самооценка работы в целом. |
На основании самооценки ученика за качество своей работы, оценок лидера группы и учителя выводится итоговая оценка деятельности каждого ученика на данном уроке-практикуме
VIII. Домашняя работа: Параграф № 13, упр. 2,4(а)
IX. Ответы на резервные задания.
Практическая работа № 1
Тема: Качественный анализ органических соединений.
Цель: Определить углерод и водород и
наличие хлора.
Оборудование и реактивы: лабораторный штатив, нагревательный прибор, простейший прибор для получения газов, держатель, фарфоровая чашка, парафин, оксид меди(II), известковая вода, прокаленный сульфат меди(II), медная проволочка 10 см., раствор тетрахлорметана, сахар.
Опыт № 1
Соберите прибор, как показано на рисунке.
Смесь 1 – 2 г оксида меди (П) и 0,2 г парафина хорошо перемешайте и поместите на дно пробирки. Сверху насыпьте еще немного оксида меди (П). В верхнюю часть пробирки введите в виде пробки небольшой кусочек ваты и насыпьте на нее тонкий слой белого порошка безводного сульфата меди (П). Закройте пробирку пробкой с газоотво
Практическая работа № 1. «Качественный анализ органических соединений»
- Подробности
- Категория: О.С. Габриелян-10кл
«Химия. 10 класс». О.С. Габриелян (гдз)
10 класс». О.С. Габриелян (гдз)
Опыт 1. Обнаружение углерода и водорода в органическом соединении.
Условия выполнения работы:
Собрали прибор как показано на рис. 44 учебника. Насыпали в пробирку щепотку сахара и немного оксида меди (II) СuO. Положили в пробирку, где-то на уровне две трети её небольшой ватный тампон, потом насыпали немного безводного медного купороса CuSO4. Закрыли пробирку пробкой с газоотводной трубкой, так, чтобы нижний её конец был опущен в другую пробирку с предварительно налитым туда гидроксидом кальция Са(ОН)2. Нагрели пробирку в пламени горелки. Наблюдаем выделение пузырьков газа из трубки, помутнение известковой воды и посинение белого порошка CuSO4.
С12Н22О11 + 24CuO → 12CO2 + 11H2O + 24Cu
Ca(OH)2 + CO2 → CaCO3↓ + H2O
CuSO4 + 5H2O → CuSO4 .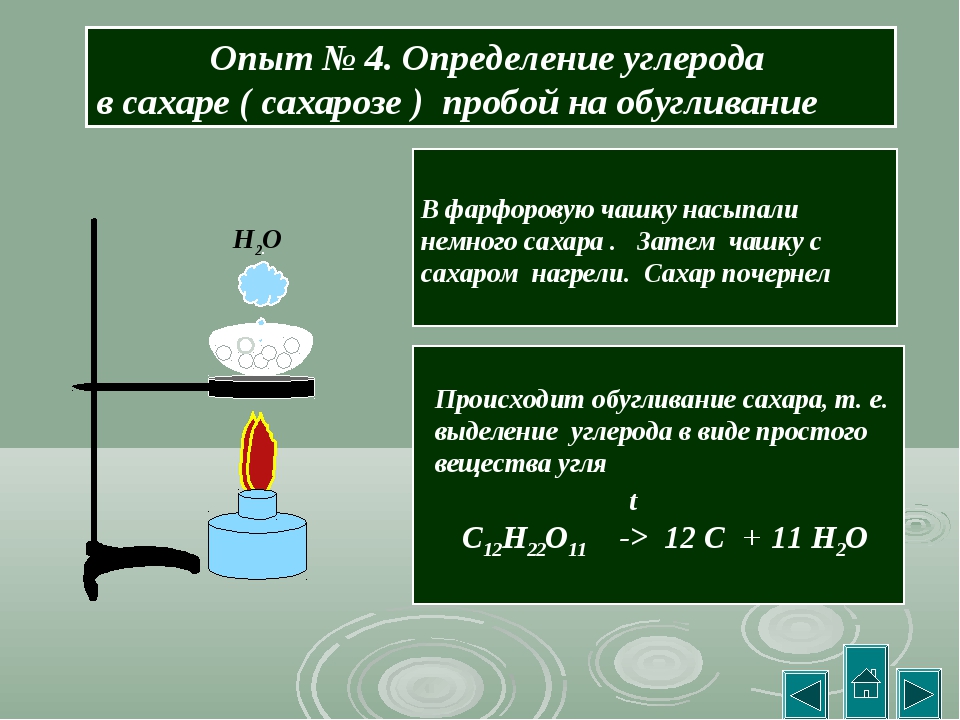 5H2O
5H2O
Вывод: В исходном веществе присутствует углерод и водород, так как получили углекислый газ и воду в результате окисления, а в окислителе CuO они не содержались.
Опыт 2. Обнаружение галогенов
Условия выполнения работы:
Взяли медную проволоку, загнутую на конце петлёй щипцами, прокалили её в пламени до образования чёрного налёта оксида меди (II) СuO. Затем остывшую проволоку окунули в раствор хлороформа и вновь внесли её в пламя горелки. Наблюдаем окрашивание пламени в голубовато-зелёный цвет, так как соли меди окрашивают пламя.
5CuO + 2CHCl3 = 3CuCl2 + 2CO2 + H2O + 2Cu
Практическая работа «Качественное определение органических веществ» (химия, 10 класс, базовый уровень)
Фамилия имя ___________________________________________________
Практическая работа №___
Тема Качественные реакции на органические вещества
Цель: с помощью качественных реакций решить задачи:
1. Доказать, что глицерин – это многоатомный спирт
Доказать, что глицерин – это многоатомный спирт
2.Доказать, что глюкоза является альдегидоспиртом.
3.Провести реакцию, с помощью которой можно отличить крахмал от целлюлозы.
4.Решить экспериментальные задачи на качественный анализ органических веществ (см. электронный модуль)
Оборудование:
Реактивы:
Ход работы:
№ задачи | Ход опыта | Признаки реакций, вывод (какая реакция является качественной?) |
1 | К 1 мл раствора NaOH прилить 1 мл раствора CuSO4 и добавить 1 каплю глицерина | |
2 | К 1 мл раствора NaOH прилить 1 мл раствора CuSO4 добавить шпателем немного глюкозы, встряхнуть и нагреть |
№ задачи | Ход опыта | Признаки и уравнения реакций | ||
3 | В пробирку поместить немного крахмала, добавить 1 каплю спиртового раствора йода, встряхнуть | |||
4 | Выполнить упражнения (см МОДУЛЬ и заполнить таблицу-ВЫВОД) | Вещество | Реагенты для распознавания | Признак реакции |
Глицерин | ||||
Глюкоза | ||||
Фенол | ||||
Крахмал | ||||
Уксусная кислота | ||||
Муравьиная кислота | ||||
Метиламин | ||||
Анилин | ||||
Белок | ||||
Программа для просмотра ресурса с сайта
http://fcior. edu.ru/programma-prosmotra-resursov
edu.ru/programma-prosmotra-resursov
Параграф 2 — Химия. 10 класс. Кузнецова Н.Е. — Викирешебник
Данные задания относятся к первому разделу учебника — Теоретические основы органической химии, второго параграфа — Отличительные признаки органических соединений. Правки, дополнительные вопросы по заданиям и теме в целом можно оставлять на странице обсуждения.
Отличительные признаки органических соединений[править | править код]
Задание 1. Органические соединения[править | править код]
Органические вещества — класс соединений, в состав которых входит углерод (за исключением карбидов, угольной и синильной кислоты, карбонатов, оксидов углерода и цианидов). Органические соединения обычно построены из цепочек атомов углерода, связанных между собой ковалентными связями, и различных заместителей, присоединенных к этим углеродным атомам. Примеры органических веществ: глюкоза (C6h22O6{\displaystyle {\ce {C6h22O6}}}), этиловый спирт (C2H5OH{\displaystyle {\ce {C2H5OH}}}), уксусная кислота (Ch4COOH{\displaystyle {\ce {Ch4COOH}}}), бензол (C6H6{\displaystyle {\ce {C6H6}}}) и др. Органические вещества схожи тем, что являются соединениями углерода, который всегда четырехвалентный в этих соединениях.
Органические вещества схожи тем, что являются соединениями углерода, который всегда четырехвалентный в этих соединениях.
Многообразие органических веществ обусловлено способностью углерода образовывать углеродные цепи разного типа или углеродный скелет соединения, а также благодаря существованию изомерии.
Проблема: Как различить эти соединения. относящиеся к разным областям химии? Есть ли признаки, раскрывающие их особенности?
- Одна из отличительных особенностей органических соединений от неорганических, заключена в своеобразном их отношении к нагреванию. Их температуры плавления, в отличие от многих неорганических соединений, низкие, они легко плавятся.
Задание 2. Усвоение азота живыми организмами[править | править код]
- Вспомните, как происходит усвоение азота живыми организмами и как называется этот процесс.
Хотя азот в молекулярной форме является доминирующим компонентом атмосферы, ни одно зеленое растение не может питаться непосредственно азотом атмосферы. Процесс фиксации молекулярного азота в природе осуществляется двумя путями:
Процесс фиксации молекулярного азота в природе осуществляется двумя путями:
- за счет жизнедеятельности сине-зеленых водорослей (основной путь) и азотофиксирующих бактерий в симбиозе с бобовыми растениями;
- за счет электрических и, в том числе грозовых, разрядов, при которых атмосферные азот и кислород взаимодействуют с последующим образованием нитратов. Нитраты являются доступной формой азота для усвоения растениями.
Проблема: Как экспериментально отличить органическое вещество от неорганического?
- Органические вещества в отличие от неорганических хорошо горят. У многих органических соединений молекулы неполярные, поэтому они плохо растворимы в воде, и хорошо — в неполярных органических растворителях.
Задание 3. Лабораторный опыт[править | править код]
- Смешайте выданное вам органическое вещество (например. парафин, вазелин и др.) с порошком оксида меди(II) и поместите смесь в сухую пробирку. Пробирку закройте пробкой с газоотводной трубкой, согнутой под прямым углом.
 Пробирка с исходными веществами должна быть закреплена в штативе под прямым углом или с небольшим наклоном вниз. Пробирку со смесью осторожно нагревайте в пламени горелки, опустите затем газоотводную трубку в другую пробирку, на 1/4 заполненную известковой водой — насыщенным раствором гидроксида кальция Ca(OH)2{\displaystyle {\ce {Ca(OH)2}}} (рис. 1). Что наблюдаете? Какую роль в данном эксперименте играют оксид меди и гидроксид кальция? Какие элементы, входящие в состав органического вещества, вы обнаружили с помощью этого опыта? Когда вы обнаружите слой восстановленной меди, подняв лапку штатива, выньте газоотводную трубку из пробирки с известковой водой, нагревание прекратите.
Пробирка с исходными веществами должна быть закреплена в штативе под прямым углом или с небольшим наклоном вниз. Пробирку со смесью осторожно нагревайте в пламени горелки, опустите затем газоотводную трубку в другую пробирку, на 1/4 заполненную известковой водой — насыщенным раствором гидроксида кальция Ca(OH)2{\displaystyle {\ce {Ca(OH)2}}} (рис. 1). Что наблюдаете? Какую роль в данном эксперименте играют оксид меди и гидроксид кальция? Какие элементы, входящие в состав органического вещества, вы обнаружили с помощью этого опыта? Когда вы обнаружите слой восстановленной меди, подняв лапку штатива, выньте газоотводную трубку из пробирки с известковой водой, нагревание прекратите.
Решение: Парафин окисляется в присутствии оксида меди (II). T.e. оксида меди (II) — окислитель:
CxHy+CuO→txCO2↑+y2h3O+Cu{\displaystyle {\ce {{C_{x}}{H_{y}}+CuO->[{\ce {t}}]xCO2\uparrow +{\frac {y}{2}}{h3O}+Cu}}}
В ходе реакции известковая вода мутнеет, поскольку вступает в реакцию с выделяющимся из органического соединения углекислым газом.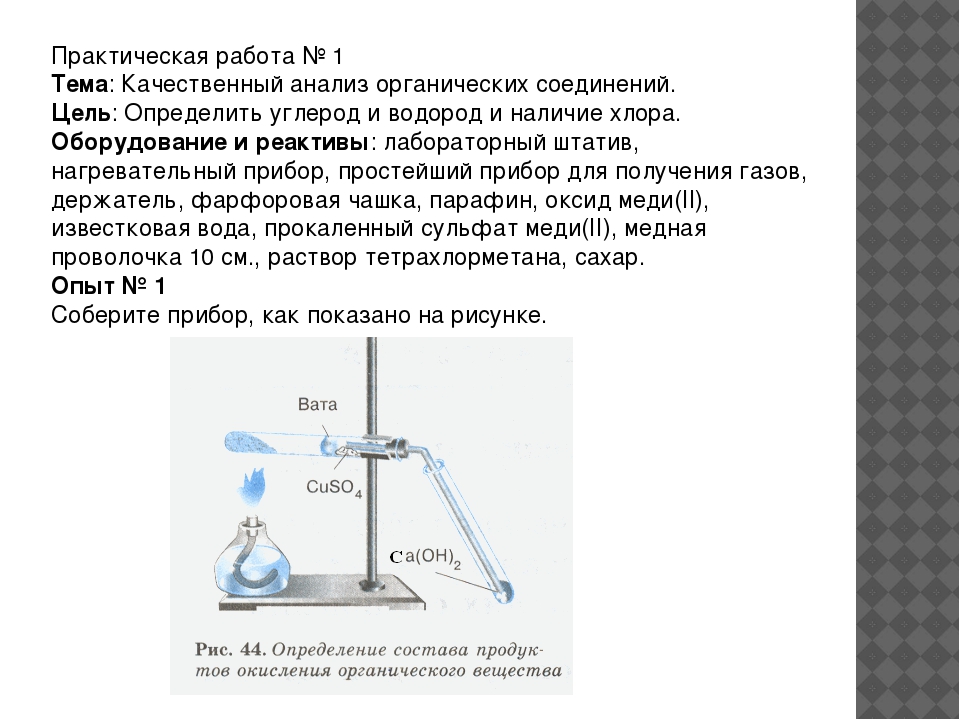 Образуется нерастворимый карбонат кальция:
Образуется нерастворимый карбонат кальция:
Ca(OH)2+CO2=CaCO3↓+h3O{\displaystyle {\ce {Ca(OH)2 + CO2 = CaCO3(v) + h3O}}}
Известковая вода — качественный реагент на углекислый газ.
С помощью данного опыта мы обнаружили, что в состав исходного вещества входит углерод (в опыте с CO2{\displaystyle {\ce {CO2}}}) и водород (капельки воды h3O{\displaystyle {\ce {h3O}}} конденсируются на стенках).
По окончанию опыта сначала нужно отделить пробирку с известковой водой, а затем прекратить нагревание, чтобы часть раствора известковой воды не была переброшена в колбу с реагирующими веществами, из-за некоторого разрежения, которое создается в колбе при перегонке.
Проблема: В чём причина такого явления, в каком направлении надо её искать?
- Явление изомерии является одной из причин многообразия органических соединений. Причину надо искать в характере связей атомов в веществе и в особенности его строения.
Задание 4. Образования ковалентной связи[править | править код]
- Раскройте механизм образования ковалентной связи и дайте её описание.

Ковалентная связь — химическая связь между двумя атомами, возникающая при обобществлении электронов, принадлежавших этим атомам. Может образовываться по обменному механизму, когда каждый атом предоставляет по одному электрону для образования связи (Ch5,C2H5OH,CO2{\displaystyle {\ce {Ch5, C2H5OH, CO2}}}) и по донорно-акцепторному, когда один атом является донором электронной пары, а другой акцептором (Nh5+{\displaystyle {\ce {Nh5+}}} — катион аммония, C2H5Nh4+Cl−{\displaystyle {\ce {C2H5Nh4+Cl-}}} хлорид этиламмония).
Ковалентная связь может быть полярной, если возникает между атомами с разной электроотрицательностью (HF,h3O{\displaystyle {\ce {HF, h3O}}}) и неполярной, если возникает между атомами с Одинаковой или близкой электроотрицательностью (N2,h3{\displaystyle {\ce {N2, h3}}})
Ha примере метана видно, что в молекуле имеется 4 ковалентные связи между углеродом и водородами, причем каждый из атомов предоставляет по одному своему электрону для образования ковалентной связи (обменный механизм). Все связи являются ковалентно-неполярными, поскольку углерод и водород имеют близкие значения электроотрицательности.
Все связи являются ковалентно-неполярными, поскольку углерод и водород имеют близкие значения электроотрицательности.
H:C¨H¨H:H{\displaystyle {\ce {H{:}{\overset {\displaystyle H}{\underset {\displaystyle {\ddot {H}}}{\ddot {C}}}}{:}H}}} — электронная формула метана.
Задание 5. Дополнительные вопросы[править | править код]
- Раскройте особенности состава и строения органических веществ.
- Органические соединения обязательно включают в свой состав атомы C{\displaystyle {\ce {C}}} — углерода, а также могут включать галогены H,N,O,S,P{\displaystyle {\ce {H, N, O, S, P}}} (водорода, азота, кислорода, серы, фосфора). Атомы углерода способны связываться друг с другом, образуя углеродные цепи разной длины и структуры.
- Как экспериментально можно установить элементарный состав и молекулярную формулу органических соединений? Опишите прибор и методику проведения опыта.
- Сжигая органическое соединения и измеряя объемы выделившихся при этом газов, можно определить качественный и количественный состав органического соединения.
 Для этого вещество нужно поместить в сухую пробирку, закрытую пробкой с газоотводной трубкой, согнутой под прямым углом. Нагревая пробирку, собирают выделяющиеся в ходе реакции газы. С помощью качественных реагентов, определяют, что за газы выделяются, это дает возможность установить какие элементы входят в состав исходного вещества (качественный состав). По объему выделившихся газов определяю количественный состав исходного соединения.
Для этого вещество нужно поместить в сухую пробирку, закрытую пробкой с газоотводной трубкой, согнутой под прямым углом. Нагревая пробирку, собирают выделяющиеся в ходе реакции газы. С помощью качественных реагентов, определяют, что за газы выделяются, это дает возможность установить какие элементы входят в состав исходного вещества (качественный состав). По объему выделившихся газов определяю количественный состав исходного соединения.
- Укажите отличительные особенности органических соединений и причины их проявления.
- Почти все органические соединения, за исключением сравнительно немногих (например, четыреххлористого углерода), горючи. В то время как большинство неорганических соединений не горит.
- Т.к. органическим веществам свойственна молекулярная кристаллическая решетка, то они обычно представляют собой газы, жидкости или низкоплавкие твердые вещества. Огромное большинство твердых органических веществ плавится в интервале сравнительно невысоких температур(от комнатной до 400 °С).
 Большая часть неорганических соединений (в основном ионная, атомная или металлическая кристаллическая решетка) представляет собой твердые вещества, плавящиеся при весьма высоких температурах.
Большая часть неорганических соединений (в основном ионная, атомная или металлическая кристаллическая решетка) представляет собой твердые вещества, плавящиеся при весьма высоких температурах. - У многих органических соединений молекулы неполярные, поэтому они плохо растворимы в воде, и хорошо — в неполярных органических растворителях.
- Какие вещества называются изомерами? Напишите структурные формулы всех изомеров гексана.
- Изомеры — соединения, одинаковые по атомному составу и молекулярной массе, но различающиеся по строению или расположению атомов в пространстве и, в следствие этого, по свойствам.
- Ch4−Ch3−Ch3−Ch3−Ch3−Ch4{\displaystyle {\ce {Ch4-Ch3-Ch3-Ch3-Ch3-Ch4}}} — гексан
- структурные изомеры гескана:
- Ch4−CH|h4C−Ch3−Ch3−Ch4{\displaystyle {\ce {Ch4-{\overset {\displaystyle }{\underset {| \atop \displaystyle h4C}{CH}}}-Ch3-Ch3-Ch4}}} — 2-метилпентан
- Ch4−Ch3−CH|h4C−Ch3−Ch4{\displaystyle {\ce {Ch4-Ch3-{\overset {\displaystyle }{\underset {| \atop \displaystyle h4C}{CH}}}-Ch3-Ch4}}} — 3-метилпентан
- h4C−C|Ch4Ch4|−Ch3−Ch4{\displaystyle {\ce {h4C-{\overset {\displaystyle Ch4 \atop |}{\underset {| \atop \displaystyle Ch4}{C}}}-Ch3-Ch4}}} — 2,2-диметилбутан
- h4C−CH|h4C−CHCh4|−Ch4{\displaystyle {\ce {h4C-{\overset {\displaystyle }{\underset {| \atop \displaystyle h4C}{CH}}}-{\overset {\displaystyle Ch4 \atop |}{\underset {\displaystyle }{CH}}}-Ch4}}} — 2,3-диметилбутан
- Предложите способ экспериментального определения качественного состава дихлорэтана в условиях школьной лаборатории.

- Дихлорэтан имеет формулу Ch3Cl2{\displaystyle {\ce {Ch3Cl2}}}. Нужно доказать, что в состав входит C{\displaystyle {\ce {C}}} — углерод, H{\displaystyle {\ce {H}}} — водород и Cl{\displaystyle {\ce {Cl}}} — хлор. Сожжем вещество.
- Дихлорэтан загорается с трудом, горит светящимся пламенем с зеленой каймой, что свидетельствую о наличии хлора в соединении. Если поднести к газоотводной трубке влажную лакмусовую бумажку, то она окрасится в красный цвет, что говорит о том, что одним из образующихся при горении продуктов является кислота Все кислоты содержат водород, значит и в состав исходного соединения входит водород. Наличие водорода в исходном соединении можно установить по образующимся конденсирующимся на стенках капелькам волы h3O{\displaystyle {\ce {h3O}}}.Обнаружить‚ что в состав исходного вещества входит углерод можно, пропуская выделяющиеся газы через гидроксид кальция. Образуется нерастворимый карбонат кальция: Ca(OH)2+CO2=CaCO3↓+h3O{\displaystyle {\ce {Ca(OH)2 + CO2 = CaCO3(v) + h3O}}}
- Опираясь на знания особенностей органических веществ, предложите способ удаления пятна от смолы с одежды из хлопчатобумажной ткани.

- Значительно облегчить выведение смоляного пятна поможет его заморозка. Низкая температура сделает смолу твердой и хрупкой. Испачканную вещь необходимо поместить в морозильную камеру приблизительно на 1,5-2 часа. Комочек замерзшего вещества легко удаляется с изделия.
- Для удаления остатков загрязнения понадобится использовать другие способы. Справиться с таким загрязнением могут органические растворители, под действием которых смола растворяется или набухает. С хлопчатобумажных тканей пятна от смолы хорошо выводить скипидаром или спиртом, а затем промывать их мыльной водой.
- Избавление от смолы с помощью утюга является самым легким и безопасным способом. Он успешно применяется для выведения свежих и небольших загрязнений. Под испачканный участок и на него укладывают бумажные салфетки (подойдут также бумажные полотенца или хлопчатобумажная ветошь). Раскаленным утюгом загрязненное место проглаживается. Под воздействием высокой температуры смола плавится и впитывается в салфетки.
 Процедуру следует повторять до полного исчезновения загрязнения, постоянно меняя впитываюший материал. Если загрязненный участок предварительно обработать скипидаром, то избавиться от пятна получится быстрее.
Процедуру следует повторять до полного исчезновения загрязнения, постоянно меняя впитываюший материал. Если загрязненный участок предварительно обработать скипидаром, то избавиться от пятна получится быстрее.
- При сгорании алкана массой 4,4 г образовался оксид углерода (IV) объемом 6,72 л (н. у.) и 7,2 л водяных паров. Плотность этого вещества равна 1,97 г/л. Найдите молекулярную формулу этого алкана. Соотнесите эту задачу с той, которая дана в параграфе.
- Общая формула горения алканов:
- Cnh3n+2+3n+12O2=nCO2+(n+1)h3O{\displaystyle {\ce {{C_{n}}{H_{{2n}+{2}}}+{\frac {{3n}+1}{2}}O2={nCO2}+({n}+1)h3O}}}
- M(Cnh3n+2)=(12n+2n+2){\displaystyle M(C_{n}H_{2n+2})=(12n+2n+2)} г/моль =(14n+2){\displaystyle =(14n+2)} г/моль
- В реакцию вступил алкан химическим свойством:
- n(Cnh3n+2)=m(Cnh3n+2)M(Cnh3n+2)=4,414n+2{\displaystyle n(C_{n}H_{2n+2})={\frac {m(C_{n}H_{2n+2})}{M(C_{n}H_{2n+2})}}={\frac {4,4}{14n+2}}}моль
- Из 1 моль Cnh3n+2{\displaystyle C_{n}H_{2n+2}} получается n{\displaystyle n} моль CO2{\displaystyle {\ce {CO2}}}
- x=4,4⋅n14n+2{\displaystyle x={\frac {4,4\cdot n}{14n+2}}} моль
- V(CO2)={\displaystyle {\ce {V(CO2)=}}}Vm⋅n=4,4⋅n14n+2{\displaystyle V_{m}\cdot n={\frac {4,4\cdot n}{14n+2}}} моль ⋅22,4{\displaystyle \cdot 22,4} л/моль 98,56⋅n14n+2{\displaystyle {\frac {98,56\cdot n}{14n+2}}} л.

- С учётом условия получаем:
- 98,56⋅n14n+2{\displaystyle {\frac {98,56\cdot n}{14n+2}}}л=6,72{\displaystyle =6,72}л. Отсюда n=3{\displaystyle n=3}
- C3H8{\displaystyle {\ce {C3H8}}} — пропан
| Химия. 10 класс. Кузнецова Н.Е. | |||||
|---|---|---|---|---|---|
| |||||
| |||||
| |||||
| |||||
| |||||
Тема: Качественный анализ органических соединений.
Практическая работа № 4
Тема: Качественный анализ органических соединений.
Получение метана и изучение его свойств.
Составление формул органических веществ.
Цели:1. Научиться, опытным путем, доказывать качественный состав углеводородов и хлоропроизводных органических соединений.
2. Познакомиться с лабораторным способом получения метана, и лабораторным способом доказать его свойства.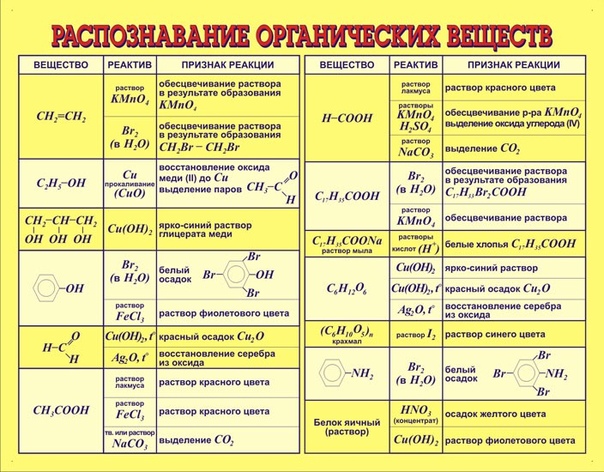
4. Приобрести навыки составления формул углеводородов и их изомеров..
Оборудование:штатив металлический с лапкой, пробирка с газоотводной трубкой, спиртовка, спички, пробирки, тигельные щипцы, промывная склянка для улавливания примесей , колба, набор шаростержневых моделей.
Реактивы:парафин, оксид меди (2), известковая вода, медная проволока со спиралью на одном конце, дихлорэтан, раствор соляной кислоты (1:3), ацетат натрия, оксид кальция.
Ход работы:
Опыт № 1. Определение углерода и водорода в парафине.
Взять 0,2 парафина, насыпать в пробирку, добавить 1г.оксида меди (2) , смешать, укрепить в лапке штатива, закрыть пробкой с газоотводной трубкой. Конец газоотводной трубки опустить в известковую воду, как указано на рисунке №1. Пробирку с парафином и оксидом меди (2) нагреть.
Взять 0,2 парафина, насыпать в пробирку, добавить 1г. оксида меди (2) , смешать, укрепить в лапке штатива, закрыть пробкой с газоотводной трубкой. Конец газоотводной трубки опустить в известковую воду, как указано на рисунке №1. Пробирку с парафином и оксидом меди (2) нагреть.
оксида меди (2) , смешать, укрепить в лапке штатива, закрыть пробкой с газоотводной трубкой. Конец газоотводной трубки опустить в известковую воду, как указано на рисунке №1. Пробирку с парафином и оксидом меди (2) нагреть.
Рис. 1. Установка для получения этилена. Рис. 2. Определение хлора.
Наблюдения:
1. Что замечаете на стенках пробирки?
__________________________________________________________________________________
2. Что происходит с известковой водой?
__________________________________________________________________________________
3.Во что превращается оксид меди? __________________________________________________________________________________
Сделайте выводы и запишите уравнения реакции.
Выводы:
- Каков качественный состав парафина? Как это доказали?
__________________________________________________________________________________
- Что является продуктами окисления парафина?
__________________________________________________________________________________________________________________________________________________________________
- Допишите уравнение окисления парафина: C30H62 + CuO→
__________________________________________________________________________________
- По каким продуктам реакции можно судить о наличии в органическом веществе элементов углерода и водорода?
__________________________________________________________________________________
- Почему для реакции используют оксид меди (2), не оксид другого металла?
__________________________________________________________________________________________________________________________________________________________________
Опыт № 2. Определение хлора в дихлорэтане.
Определение хлора в дихлорэтане.
Прокалить спираль из медной проволоки до тех пор, пока пламя не будет окрашиваться. Опустить эту медную проволоку в дихлорэтан и опять в пламя горелки. Прокалить снова медную проволоку, поместить на её поверхность 1-2 капли раствора соляной кислоты и снова поместить в пламя.
Наблюдения:
1. В какой цвет окрашивается пламя?
_________________________________________________________________________________
Выводы:
1. В чем убеждает вас этот опыт?
____________________________________________________________________________________________________________________________________________________________________
2. Как доказать наличие хлора в органических соединениях?
___________________________________________________________________________________________________________________________________________________________________
3. Почему в обоих случаях пламя окрашивается в зеленый цвет?
Почему в обоих случаях пламя окрашивается в зеленый цвет?
___________________________________________________________________________________________________________________________________________________________________
Опыт № 3.Получение метана.
Взаимодействие ацетата натрия, щелочи и оксида кальция является общим способом получения углеводородов. Образующиеся при этом углеводороды содержат в молекуле на один атом углерода меньше, чем исходная соль. Реакция в общем виде изображается уравнением:
CnH2n+1COONa + NaOH CnH2n+2+Na2CO3
Щелочь – вещество гигроскопическое. Присутствие влаги мешает успешному прохождению реакции, поэтому для связывания влаги, а так же чтобы меньше разрушалось стекло при нагревании, к щелочи добавляют оксид кальция. Смесь щелочи с известью и представляет собой натровою известь.
Собрать установку как указано на рисунке. В колбу поместить смесь ацетата натрия и натровой извести. Смесь нагреть. Образующийся газ собрать в пробирку перевернутой вверх дном путем вытеснения воды. После этого пробирку не переворачивая вынуть из воды, закрыть её и использовать для следующего опыта.
В колбу поместить смесь ацетата натрия и натровой извести. Смесь нагреть. Образующийся газ собрать в пробирку перевернутой вверх дном путем вытеснения воды. После этого пробирку не переворачивая вынуть из воды, закрыть её и использовать для следующего опыта.
Рис.3. Установка для получения метена (Обозначьте рисунок)
Наблюдения:
1. Что наблюдали в пробирке при получении метана?
__________________________________________________________________________________
2.Какого цвета и запаха выделяющийся газ? __________________________________________________________________________________
2. Почему метан необходимо собрать в пробирке, перевернутой вверх дном?
__________________________________________________________________________________
Уравнение реакции получения метана:
__________________________________________________________________________________
__________________________________________________________________________________
Выводы:
1. Каковы условия получения метана в лабораторных условиях?
Каковы условия получения метана в лабораторных условиях?
____________________________________________________________________________________________________________________________________________________________________
Опыт № 4.Горение метана.
Стеклянный цилиндр (емкостью, например, 250мл.), заполненный метаном, или пробирку с метаном с предыдущего опыта ставят на стол, снимают с него пластинку или открывают пробку и без промедления поджигают газ лучинкой. По мере сгорания метана пламя опускается внутрь цилиндра.
Чтобы пламя держалось все время над цилиндром, и было хорошо заметно студентам, в цилиндр с горящим метаном можно вливать постепенно воду, вытесняя тем самым газ наружу. Наблюдения:
1. Каким пламенем горит метан?
________________________________________________________________________________
Уравнение реакции горения метана:
__________________________________________________________________________________
Выводы:
__________________________________________________________________________________
_________________________________________________________________________________
__________________________________________________________________________________
ВЫПОЛНИТЕ ЗАДАНИЯ:
Задание 1. Составьте структурные формулы молекул по их названиям:
Составьте структурные формулы молекул по их названиям:
а) 3-этилпентан;
__________________________________________________________________________________
б) 2,4-диметилгексан;
__________________________________________________________________________________
_________________________________________________________________________________
в) 2-метил-3-этилгептан;
__________________________________________________________________________________
__________________________________________________________________________________
г) 2,2-диметил-5-этилгептан;
__________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________
д) 3,3,4,4,5,5-гексаметилгексан;
__________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________
е) 2,3-дихлор-4,4-диметилпентан;
__________________________________________________________________________________
____________________________________________________________________________________________________________________________________________________________________
Задание 4. Составить формулы пяти изомеров состава C7H16 и дать им названия.
Составить формулы пяти изомеров состава C7H16 и дать им названия.
___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выполнил___________________ Проверил________________ Дата________________
Практическая работа № 5
Вопросы для обсуждения.
— В чем особенности строения алкинов?
— Как образуются — связи в молекулах алкинов?
— Какими химическими свойствами обладает ацетилен?
CaC2 H2O Br2 KMnO4
(вода) (раствор)
. Рис.1. Установка для получения ацетилена
В прибор для получения газов поместите небольшой кусочек карбида кальция, добавьте воды, закрыть пробкой с газоотводной трубкой, конец газоотводной трубки опустите сначала в бромную воду, затем в раствор перманганата калия. Затем конец газоотводной трубки поднимите кверху и выделяющийся газ подожгите.
Наблюдения:
1. Каким пламенем горит газ?
_________________________________________________________________________________
2. Что происходит с бромной водой и раствором перманганата калия?
__________________________________________________________________________________
Выводы:
- Запишите уравнения реакции:
а) карбидного способа получения ацетилена
___________________________________________________________________________
б) взаимодействия ацетилена с бромной водой
___________________________________________________________________________
в) окисления ацетилена перманганатом калия
__________________________________________________________________________
г) горения ацетилена
________________________________________________________________
2. Почему ацетилен горит коптящим пламенем?
Почему ацетилен горит коптящим пламенем?
__________________________________________________________________________________________________________________________________________________________________
Практическая работа № 6
Тема: Свойства спиртов и фенолов.
Цели:1. Исследовать химические свойства многоатомных и одноатомных спиртов и фенолов и доказать сходные свойства исследуемых веществ как следствие одинаковых функциональных групп.
2.Исследовать качественные реакции многоатомных спиртов и фенолов и научиться отличать их от одноатомных спиртов.
3.Доказать взаимное влияние атомов в молекуле фенола на основе химических свойств.
Оборудование: пипетка, пробирки, штатив, пробирки с пробками.
Реактивы: C2H5OH, C6H5OH, глицерин, Na, раствор CuSO4 (CuCl2), раствор NaOH (KOH) (10-12%), раствор фенола 3%, бромная вода (6к. Br2 на 50 мл H2O), фенолфталеин, хлорид железа (III).
Br2 на 50 мл H2O), фенолфталеин, хлорид железа (III).
ВАРИАНТ 1.
1.Запишите для пропанола-2 уравнения реакций:
а) взаимодействия с натрием ______________________________________________________________________________________________________________________________________________________________
б) взаимодействия с уксусной кислотой ______________________________________________________________________________________________________________________________________________________________
в) внутримолекулярной дегидратации. ________________________________________________________________________________________________________________________________________
2.Напишите уравнение реакции получения тринитроглицерина _____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
ВАРИАНТ 2.
1.Запишите для пропанола-2 уравнения реакций:
а) взаимодействия с бромводородом ______________________________________________________________________________________________________________________________________________________________
б) взаимодействия с муравьиной кислотой ______________________________________________________________________________________________________________________________________________________________
в) межмолекулярной дегидратации ______________________________________________________________________________________________________________________________________________________________
2.Напишите уравнение реакции получения триацетата глицерина ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Выполнил___________________ Проверил________________ Дата__________________
Практическая работа № 7
ВАРИАНТ 1.
1.Напишите формулу:
а) масляного альдегида______________________________________________________________ б) 2,2-диметилбутаналя ____________________________________________________________________________________________________________________________________________________________________
2. Написать уравнение реакции получения альдегидов из:
а) бутанола __________________________________________________________________________________
б) 1,1-дибромпропана ____________________________________________________________________________________________________________________________________________________________________
3. Какое вещество получается при взаимодействии? Напишите уравнения реакций
а) пропаналя с гидроксидом меди (II) __________________________________________________________________________________
б) метаналя с водородом ________________________________________________________________________________
4. Решите задачу:
Решите задачу:
Вычислить массу образовавшейся кислоты, если в реакцию вступит гидроксид меди (II) с раствором уксусного альдегида массой 55гр.с массовой долей CH3COH 20% Дано:____________________________________Решение:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Найти:__________________________________________________________________________________________________________________________________________________
Ответ:_______________________________________________________________________
ВАРИАНТ 2.
1. Напишите формулу:
а) валерьянового альдегида___________________________________________________________
б) 3,4-диэтилгексаналя __________________________________________________________________________________
2. Написать уравнение реакции получения альдегидов из:
Написать уравнение реакции получения альдегидов из:
а) пропанола __________________________________________________________________________________
б) 1,1-дибромбутана __________________________________________________________________________________
3. Какое вещество получается при взаимодействии? Напишите уравнения реакций.
а) этаналя с аммиачным раствором оксида серебра __________________________________________________________________________________
б) бутаналя с водородом __________________________________________________________________________________
4. Решите задачу:
Какова масса серебра, образующегося при взаимодействии раствора формальдегида массой 200гр. с массовой долей CH2O 30% с аммиачным раствором оксида серебра.
Дано:____________________________________Решение:___________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________Найти:__________________________________________________________________________________________________________________________________________________
Ответ:______________________________________________________________________
Выполнил___________________ Проверил________________ Дата__________________
Практическая работа № 8
Практическая работа № 9
Тема: Свойства углеводов.
Цели: 1. Опытным путем научиться доказывать, что глюкоза является альдегидоспиртом, что сахароза и крахмал являются многоатомными спиртами.
2. Доказать, что при гидролизе крахмала образуется глюкоза.
Реактивы: раствор глюкозы (1%), раствор сульфата меди (11), раствор гидроксида натрия (10-12%), раствор сахарозы (1%), крахмал, раствор йода спиртовой (1%).
Оборудование: спиртовка, спички, пробиркодержатель, пробирки.
Опыт № 1. Свойства глюкозы.
В пробирку внесите 3 капли раствора глюкозы, 1 каплю раствора соли меди, прибавьте при взбалтывании несколько капель гидроксида натрия до образования синего раствора (щелочь в избытке). Полученный раствор нагрейте до образования осадка кирпично-красного цвета.
Наблюдения:
Какие изменения происходят до и после нагревания?
____________________________________________________________________________________________________________________________________________________________________
Выводы:
1. Что доказывает появление синего раствора и красного осадка?.
Что доказывает появление синего раствора и красного осадка?.
____________________________________________________________________________________________________________________________________________
2.Наличие каких функциональных групп в молекуле глюкозы подтверждает этот опыт?
____________________________________________________________________________________________________________________________________________________________________
3.Составьте уравнения реакций взаимодействия глюкозы с гидроксидом меди (11).
а) как альдегид __________________________________________________________________________________б) как многоатомный спирт ______________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Практическая работа №10
Тема: Цветные реакции на белки. Амины. Распознавание органических веществ.
Амины. Распознавание органических веществ.
Цели:1. Изучить действие ядов на белок.
2. Научиться определять органические вещества по их качественным реакциям.
3. Опытным путем доказать основные и ароматические свойства анилина.
Реактивы: водный раствор яичного белка (готовится из расчета 1мл белка на 5 мл насыщенного раствора поваренной соли), раствор сульфата меди, азотная кислота (1:5), раствор фенола, формалин, аммиак, шерстяная нить, раствор NAOH (10-12%), спиртово-водный раствор анилина, слабый раствор соляной кислоты, бромная вода (на 50 мл воды 6 капель брома), лакмус
Оборудование: металлический штатив с лапкой, пробирки, две пробирки с подогнанными к ним пробками, спиртовка, пробиркодержатель, пипетка, спички
Опыт № 1. Свойства белков.
- В 3 пробирки налейте раствора белка в воде, в первую — прилейте раствор сульфата меди (II), во вторую – фенол, в третью – концентрированную азотную кислоту.

- В пробирку прилейте 2 мл раствора белка и добавьте 2 мл раствора гидроксида натрия, затем несколько капель раствора сульфата меди (II).
- В пробирку с 2 мл раствора белка добавьте несколько капель концентрированной азотной кислоты. Нагрейте содержимое пробирки. Охладите смесь и добавьте к ней по каплям 3-4 мл раствора аммиака.
- Подожгите несколько нитей шерстяной ткани.
Наблюдения:
1). Какие изменения произошли в пробирках №1, №2, №3?
№1_______________________________________________________________________________№2_______________________________________________________________________________№3_______________________________________________________________________________
Вывод: Какие вещества вызвали коагуляцию, а какие денатурацию белка? ____________________________________________________________________________________________________________________________________________________________________
Наблюдения:
2),3). Как изменилась окраска? __________________________________________________________________________________
Как изменилась окраска? __________________________________________________________________________________
Вывод:1. По каким реакциям можно распознать белки? __________________________________________________________________________________
. Какая реакция является биуретовой, какая – ксантопротеиновой? __________________________________________________________________________________
Наблюдения:
4). Охарактеризуйте запах горящей шерсти. __________________________________________________________________________________
Вывод:
Как можно отличить натуральный шелк от искусственного, натуральную кожу от искусственного __________________________________________________________________________________
Уравнения реакции:
____________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________________________
______________________________________________________________________
Свойства анилина.
Практическая работа № 4
Тема: Качественный анализ органических соединений.
Рекомендуемые страницы:
Определение эмпирических формул | Состав веществ и растворов
Определение эмпирических формул
Как упоминалось ранее, наиболее распространенный подход к определению химической формулы соединения — это сначала измерение масс составляющих его элементов. Однако мы должны помнить, что химические формулы представляют собой относительные числа , а не массы атомов в веществе. Следовательно, любые экспериментально полученные данные, включающие массу, должны использоваться для получения соответствующего количества атомов в соединении.
Для этого мы можем использовать молярные массы для преобразования массы каждого элемента в число молей. Затем мы рассматриваем количество молей каждого элемента относительно друг друга, преобразовывая эти числа в целочисленное соотношение, которое можно использовать для вывода эмпирической формулы вещества. Рассмотрим образец соединения, содержащий 1,71 г C и 0,287 г H. Соответствующее количество атомов (в молях) составляет:
Рассмотрим образец соединения, содержащий 1,71 г C и 0,287 г H. Соответствующее количество атомов (в молях) составляет:
\ (1,17 \ text {g C} × \ frac {1 \ text {mol C}} {12.01 \ text {g C}} = 0.142 \ text {mol C} \)
\ (0,287 \ text {g H} × \ frac {1 \ text {mol H}} {1,008 \ text {g H}} = 0,284 \ text {mol H} \ )
Таким образом, мы можем точно представить это соединение формулой C 0,142 H 0,248 . Конечно, согласно принятому соглашению, формулы содержат индексы целых чисел, что может быть достигнуто путем деления каждого индекса на меньший индекс:
\ (\ text {C} _ {\ frac {0.142} {0.142}} \ text { H} _ {\ frac {0.248} {0.142}} \) или \ (\ text {CH} _2 \)
(Напомним, что нижние индексы «1» не записываются, а предполагаются, если нет другого числа.)
Таким образом, эмпирическая формула этого соединения: CH 2 . Это также может быть или не быть молекулярной формулой соединения ; однако нам потребуется дополнительная информация, чтобы сделать это определение (как описано далее в этом разделе).
Рассмотрим в качестве другого примера образец соединения, содержащего 5,31 г Cl и 8,40 г O. Следуя тому же подходу, получаем предварительную эмпирическую формулу:
\ (\ text {Cl} _ {0.150} \ text {O} _ {0.525} \) \ (= \ text {Cl} _ {\ frac {0.150} {0.150}} \ text {O} _ {\ frac {0.525} {0.150}} \) \ (= \ text {ClO} _ {3.5} \)
В этом случае деление на наименьший нижний индекс все равно оставляет нам десятичный индекс в эмпирической формуле. Чтобы преобразовать это в целое число, мы должны умножить каждый из нижних индексов на два, сохраняя то же соотношение атомов и получая Cl 2 O 7 в качестве окончательной эмпирической формулы.
Таким образом, эмпирические формулы выводятся из экспериментально измеренных масс элементов следующим образом:
- Получение количества молей каждого элемента из его массы
- Деление молярного количества каждого элемента на наименьшее молярное количество, чтобы получить индексы для предварительной эмпирической формулы
- Умножение всех коэффициентов на целое число, если необходимо, для обеспечения наименьшего целочисленного отношения индексов.

На рисунке ниже показана эта процедура в виде блок-схемы для вещества, содержащего элементы A и X.
Эмпирическая формула соединения может быть получена из масс всех элементов в образце. Изображение предоставлено: OpenStax, Biology
Определение эмпирической формулы соединения по массам его элементов
Образец черного минерала гематита (см. Изображение ниже), оксида железа, содержащегося во многих железных рудах, содержит 34,97 г железа и 15,03 г кислорода. Какая эмпирическая формула гематита?
Гематит — это оксид железа, который используется в ювелирных изделиях. Изображение предоставлено: Mauro Cateb
Решение
Для этой задачи нам дана масса каждого элемента в граммах.Начните с поиска молей каждого:
\ (34.97 \ text {g Fe} \ left (\ frac {\ text {mol Fe}} {55.85 \ text {g}} \ right) = 0,6261 \ text {mol Fe } \)
\ (15.03 \ text {g O} \ left (\ frac {\ text {mol O}} {16.00 \ text {g}} \ right) = 0. 9394 \ text {mol O} \)
9394 \ text {mol O} \)
Затем выведите молярное отношение железа к кислороду, разделив его на меньшее количество молей:
\ (\ frac {0.6261} {0.6261} = 1.000 \ text {mol Fe} \)
\ (\ frac {0.9394 } {0,6261} = 1,500 \ text {mol O} \)
Соотношение равно 1.000 моль железа на 1.500 моль кислорода (Fe 1 O 1,5 ). Наконец, умножьте соотношение на два, чтобы получить наименьшие возможные индексы целых чисел, сохраняя при этом правильное соотношение железа и кислорода:
\ (2 (\ text {Fe} _1 \ text {O} _ {1.5}) = \ text {Fe} _2 \ text {O} _3 \)
Эмпирическая формула: Fe 2 O 3 .
Видео, иллюстрирующее вывод эмпирических формул
Для получения дополнительных рабочих примеров, иллюстрирующих вывод эмпирических формул, вы можете посмотреть видео ниже, написанное г-ном МистеромCausey.
Метод Лассена | Определение молекулярной массы-Аскиити
Спасибо за регистрацию.
Один из наших научных консультантов свяжется с вами в течение 1 рабочего дня.
Пожалуйста, проверьте свою электронную почту, чтобы узнать данные для входа.Нажмите, чтобы поговорить
1800-1023-196
+ 91-120-4616500
КОРЗИНА 0
МОЯ КОРЗИНА (5)
Используйте купон: CART20 и получите скидку 20% на все учебные материалы онлайн
ВЕЩЬ
ДЕТАЛИ
MRP
СКИДКА
ОКОНЧАТЕЛЬНАЯ ЦЕНА
$ {Имя}
Активация: сразу после оплаты
Rs.$ {Price}
$ {DiscountPercent}%
Rs. $ {DiscountPrice}
Rs.$ {Price}
0%
Rs. $ {Price}
$ {Имя}
Активация: сразу после оплаты
Rs.$ {CalculateBundlePrice (Темы)}
$ {DiscountPercent.toFixed ()}%
Rs. $ {CalculateBundleDiscountedPrice (Topics, DiscountPercent)}
Что такое качественное исследование? | Методы и примеры
Качественное исследование включает сбор и анализ нечисловых данных (например,g., текст, видео или аудио), чтобы понять концепции, мнения или опыт. Его можно использовать для глубокого понимания проблемы или генерирования новых идей для исследования.
Качественное исследование противоположно количественному исследованию, которое включает сбор и анализ числовых данных для статистического анализа.
Качественные исследования обычно используются в гуманитарных и социальных науках, таких как антропология, социология, образование, науки о здоровье, история и т. Д.
Примеры вопросов для качественного исследования- Как социальные сети влияют на образ тела у подростков?
- Как дети и взрослые понимают здоровое питание в Великобритании?
- Какие факторы влияют на удержание сотрудников в крупной организации?
- Как во всем мире переживают тревогу?
- Как учителя могут интегрировать социальные вопросы в учебные программы по естествознанию?
Подходы к качественным исследованиям
Качественное исследование используется для понимания того, как люди воспринимают мир.Несмотря на то, что существует множество подходов к качественному исследованию, они, как правило, гибкие и сосредоточены на сохранении богатого смысла при интерпретации данных.
Общие подходы включают обоснованную теорию, этнографию, исследование действия, феноменологическое исследование и повествовательное исследование. Они имеют некоторое сходство, но подчеркивают разные цели и перспективы.
| Подход | Что это значит? |
|---|---|
| Обоснованная теория | Исследователи собирают обширные данные по интересующей теме и индуктивно разрабатывают теории. |
| Этнография | Исследователи погружаются в группы или организации, чтобы понять свою культуру. |
| Исследование действий | Исследователи и участники совместно связывают теорию с практикой, чтобы стимулировать социальные изменения. |
| Феноменологические исследования | Исследователи исследуют явление или событие, описывая и интерпретируя жизненный опыт участников. |
| Нарративное исследование | Исследователи изучают, как рассказываются истории, чтобы понять, как участники воспринимают и осмысливают свой опыт. |
Качественные методы исследования
Каждый из исследовательских подходов предполагает использование одного или нескольких методов сбора данных. Вот некоторые из наиболее распространенных качественных методов:
- Наблюдения: записывает то, что вы видели, слышали или встречали, в подробных полевых заметках.
- Интервью: лично задает вопросы людям в беседах один на один.
- Фокус-группы: задают вопросы и инициируют обсуждение в группе людей.
- Опросы: раздача анкет с открытыми вопросами.
- Вторичное исследование: Сбор существующих данных в виде текстов, изображений, аудио- или видеозаписей и т. Д.
- Вы делаете полевые заметки с наблюдениями и размышляете над собственным опытом корпоративной культуры.
- Вы рассылаете открытые опросы сотрудникам во всех офисах компании по электронной почте, чтобы выяснить, меняется ли культура в разных местах.
- Вы проводите подробные интервью с сотрудниками в своем офисе, чтобы более подробно узнать об их опыте и перспективах.
Качественные исследователи часто считают себя «инструментами» в исследованиях, потому что все наблюдения, интерпретации и анализы фильтруются через их личную линзу.
По этой причине при составлении методологии качественного исследования важно обдумать свой подход и подробно объяснить свой выбор при сборе и анализе данных.
Что может сделать корректура для вашей статьи?
РедакторыScribbr не только исправляют грамматические и орфографические ошибки, но и укрепляют ваше письмо, убеждаясь в том, что в вашей статье нет расплывчатой лексики, лишних слов и неудобных фраз.
См. Пример редактирования
Качественный анализ данных
Качественные данные могут принимать форму текстов, фотографий, видео и аудио.Например, вы можете работать со стенограммами интервью, ответами на опрос, полевыми заметками или записями из естественных условий.
Большинство типов качественного анализа данных разделяют одни и те же пять шагов:
- Подготовьте и систематизируйте свои данные. Это может означать расшифровку интервью или напечатание полевых заметок.
- Просмотрите и исследуйте свои данные. Изучите данные на наличие шаблонов или повторяющихся идей.
- Разработать систему кодирования данных. Основываясь на ваших первоначальных идеях, установите набор кодов, которые вы можете применить для категоризации ваших данных.
- Назначьте коды данным. Например, при качественном анализе опроса это может означать просмотр ответов каждого участника и пометку их кодами в электронной таблице. Просматривая данные, вы можете создавать новые коды для добавления в вашу систему при необходимости.
- Определите повторяющиеся темы. Свяжите коды в единые всеобъемлющие темы.
Есть несколько конкретных подходов к анализу качественных данных. Хотя эти методы имеют схожие процессы, они подчеркивают разные концепции.
| Подход | Когда использовать | Пример |
|---|---|---|
| Контент-анализ | Для описания и категоризации общих слов, фраз и идей в качественных данных. | Исследователь рынка может провести анализ контента, чтобы выяснить, на каком языке написано описание терапевтических приложений. |
| Тематический анализ | Выявить и интерпретировать закономерности и темы в качественных данных. | Психолог может применить тематический анализ к блогам о путешествиях, чтобы изучить, как туризм влияет на самоидентификацию. |
| Анализ текста | Для изучения содержания, структуры и дизайна текстов. | Исследователь СМИ может использовать текстовый анализ, чтобы понять, как изменилось освещение новостей о знаменитостях за последнее десятилетие. |
| Дискурс-анализ | Для изучения коммуникации и того, как язык используется для достижения эффекта в определенных контекстах. | Политолог может использовать анализ дискурса, чтобы изучить, как политики вызывают доверие к избирательным кампаниям. |
Преимущества качественного исследования
Качественное исследование часто пытается сохранить голос и точку зрения участников и может корректироваться по мере возникновения новых исследовательских вопросов.Качественное исследование подходит для:
Процесс сбора и анализа данных может быть адаптирован по мере появления новых идей или моделей. Они не определены заранее.
Сбор данных происходит в реальных условиях или естественным образом.
Подробное описание опыта, чувств и восприятий людей может быть использовано при разработке, тестировании или улучшении систем или продуктов.
Открытые ответы означают, что исследователи могут открывать новые проблемы или возможности, о которых они не подумали бы иначе.
Недостатки качественного исследования
Исследователи должны учитывать практические и теоретические ограничения при анализе и интерпретации своих данных. Качественное исследование страдает:
Реальные условия часто делают качественное исследование ненадежным из-за неконтролируемых факторов, влияющих на данные.
Из-за того, что исследователь играет первостепенную роль в анализе и интерпретации данных, качественные исследования не могут быть воспроизведены. Исследователь решает, что важно, а что не имеет отношения к анализу данных, поэтому интерпретация одних и тех же данных может сильно различаться.
Небольшие выборки часто используются для сбора подробных данных о конкретных контекстах. Несмотря на строгие процедуры анализа, трудно сделать обобщающие выводы, поскольку данные могут быть предвзятыми и нерепрезентативными для более широкого населения.
Хотя программное обеспечение можно использовать для управления и записи больших объемов текста, анализ данных часто приходится проверять или выполнять вручную.
Часто задаваемые вопросы о качественных исследованиях
- Каковы основные подходы к качественному исследованию?
Существует пять общих подходов к качественному исследованию:
- Обоснованная теория включает сбор данных для разработки новых теорий.
- Этнография включает погружение в группу или организацию, чтобы понять ее культуру.
- Нарративное исследование включает интерпретацию историй, чтобы понять, как люди осмысливают свой опыт и восприятие.
- Феноменологическое исследование включает исследование явлений на основе жизненного опыта людей.
- Исследование действий связывает теорию и практику в несколько циклов для стимулирования инновационных изменений.
- Что такое сбор данных?
Сбор данных — это систематический процесс, посредством которого наблюдения или измерения собираются в ходе исследования. Он используется во многих различных контекстах учеными, правительствами, предприятиями и другими организациями.
1. Почвы и питательные вещества для растений
Эта глава учит людей:
- Определите физические свойства почвы и опишите, как они влияют на пригодность почвы для выращивания растений.
- Опишите органические вещества и способы их использования для улучшения почвы.
- Объясните, как собрать образец почвы и как использовать отчет об испытании почвы.
- Для каждого из шести макроэлементов опишите симптомы дефицита или избытка.
- Определить стратегии по снижению воздействия удобрений на качество воды.
- Опишите разнообразие почвенных жителей, их преимущества и стратегии по укреплению их здоровья.
Почва — это живая, дышащая, естественная сущность, состоящая из твердых тел, жидкостей и газов. Почва выполняет пять основных функций:
- Обеспечивает среду обитания для организмов
- Перерабатывает отходы
- Фильтры для воды
- Служит конструкционным материалом
- Обеспечивает среду для роста растений 1
Мы сосредоточимся на пятой функции.В этой роли почва обеспечивает структурную стабильность для растений и удерживает и отводит воду и питательные вещества, необходимые для роста растений.
Идеальная почва для роста растений содержит 50% пор и 50% твердых веществ, при этом поровое пространство заполнено равными частями воздуха и воды. Такое распределение происходит редко, потому что поровое пространство зависит от текстуры почвы и управления почвой. Например, обработка почвы увеличивает поровое пространство, а плохой дренаж и уплотнение уменьшают его.
Твердые вещества почвы представляют собой смесь минеральных материалов и органических веществ .Минеральные материалы обычно представляют собой выветрившуюся породу разного размера, называемую песком, илом и глиной. Органическое вещество состоит из разлагающихся остатков растений и микробов. Относительные количества порового пространства, минерального и органического вещества сильно различаются в зависимости от типа почвы. Но для роста растений большинство почвоведов согласны с тем, что 50% порового пространства, 45% минеральных веществ и 5% органических веществ составляют идеальное соотношение (рис. 1–1а). Распределение почв и порового пространства в уплотненной и плохо дренированной почве показано на Рисунках 1–1b и 1–1c.
Даже небольшое количество органического вещества может сильно повлиять на физические, химические и биологические свойства почвы.
1 Brady, N.C. и R.R. Weil. 2004. Элементы природы и свойств почв, 2-е издание. Атланта, Джорджия: Prentice Hall
.
Рисунок 1–1а.Распределение твердых частиц и порового пространства в идеальной почве.
Рисунок 1–1b. Распределение твердых частиц и порового пространства в уплотненном грунте.
Рисунок 1–1c.Распределение твердых частиц и порового пространства в плохо дренированной почве.
Большинство естественных, нетронутых почв состоит из трех отдельных слоев различной толщины. Слои — это верхний слой почвы, подпочва и основной материал .Каждый слой может иметь два или более подслоя, называемых горизонтами . В совокупности горизонты составляют почвенный профиль. Преобладающий исходный материал зависит от региона Северной Каролины. В предгорьях и горах Северной Каролины материнским материалом обычно является выветренная коренная порода, известная как сапролит. В днищах рек и на террасах ручьев предгорий и гор Северной Каролины материнскими материалами являются пойменные отложения, доставленные из верховьев рек, где произошла эрозия. На прибрежной равнине Северной Каролины материнскими веществами являются морские отложения, отложившиеся в течение эонов по мере того, как океаны проходят естественные циклы наступления и отступления.На самой восточной прибрежной равнине Северной Каролины преобладающим материнским материалом является органическое вещество. Эти органические почвы обычно встречаются в районах, которые всего 50 000 лет назад находились ниже уровня моря. Это болота, где растут и процветают растения. Но эти участки слишком влажные, чтобы остатки растений (листья, ветви, корни, стволы и т. Д.) Могли эффективно разложиться.
Свойства почв меняются в зависимости от глубины почвы. Поверхность почвы или верхний слой почвы (горизонт O и A на рис. 1-2) обычно содержит меньше глины, но больше органического вещества и воздуха, чем нижние слои почвы.Верхний слой почвы обычно более плодороден, чем другие слои, и имеет наибольшую концентрацию корней растений.
Подземный слой (горизонты B и C на Рисунке 1-2), известный как подпочва, обычно имеет более высокое содержание глины и более низкое содержание органических веществ, чем верхний слой почвы.
Свойства почвы часто ограничивают глубину проникновения корней растений. Например, корни не прорастут через непроницаемый слой. Этот слой может быть скальной породой (рис. 1–3), уплотненной почвой или химическим барьером, например кислым (очень низким) pH .Высокий уровень грунтовых вод также может ограничить рост корней из-за плохой аэрации почвы. Немногие большие деревья растут на мелкой почве, потому что большие деревья не могут развить достаточно сильную корневую систему, чтобы предотвратить их опрокидывание. Мелкие почвы также более подвержены засухе, потому что они содержат меньше воды и, следовательно, высыхают быстрее, чем более глубокие почвы. Вода, теряемая в результате стока на мелководных почвах, вместо этого будет поглощена более глубокими почвами. Кроме того, глубокая почва позволяет корням исследовать больший объем, что означает, что корни могут удерживать больше воды и питательных веществ для растений.
Почвы меняются в трех измерениях. Первое измерение идет сверху вниз по профилю почвы. Два других измерения — с севера на юг и с востока на запад. Практическое значение этой трехмерной изменчивости состоит в том, что когда вы перемещаетесь по штату, округу или даже полю, почвы меняются. Это изменение объясняется пятью факторами почвообразования:
- Основной материал
- Биологическая активность
- Климат
- Топография
- Время
Различие даже в одном из этих факторов приведет к другому типу почвы.Почвы, сформированные из разных почвенных материалов, различаются. Почвы, сформированные из одного и того же исходного материала, в разных климатических условиях различаются. Почвы на вершине холма отличаются от почв внизу. Вершина холма теряет материал из-за естественной эрозии; нижняя часть получает материал сверху. Учитывая количество возможных комбинаций этих пяти факторов, неудивительно, что в настоящее время в Северной Каролине нанесено на карту более 450 уникальных серий почв. В мире насчитывается более 20 000 различных серий почв.Ряды почв на уровне микрорайона можно найти, набрав «Web Soil Survey» в любой поисковой системе в Интернете.
Рисунок 1–2. Почвенные горизонты.
Джон А. Келли, USDA-Служба сохранения природных ресурсов
Джон А.Келли, Служба охраны природных ресурсов Министерства сельского хозяйства США
Распечатать изображениеРисунок 1–3. Серия грунтов Craggey; пример неглубокой почвы.
Джон А. Келли, USDA-Служба сохранения природных ресурсов
Джон А.Келли, Служба охраны природных ресурсов Министерства сельского хозяйства США
Распечатать изображениеФизические свойства почвы — это характеристики, которые можно увидеть, почувствовать или измерить.К ним относятся цвет, текстура, структура и водоудерживающая способность. Такие свойства обычно определяют пригодность почвы в качестве питательной среды. Некоторые физические свойства, такие как текстура, экономически нецелесообразно изменять в больших масштабах.
Плодородие почвы, которое является химическим свойством, изменить легче, чем физические свойства почвы.
Органические вещества, присутствующие в почве минералы и условия дренажа влияют на цвет почвы. Сам по себе цвет не является показателем качества почвы, но цвет дает подсказку об определенных условиях.Например, светлые или бледные цвета зернистого верхнего слоя почвы часто связаны с низким содержанием органических веществ, высоким содержанием песка и чрезмерным выщелачиванием. Темный цвет почвы может быть результатом плохого дренажа или высокого содержания органических веществ. Оттенки красного указывают на то, что глинистая почва хорошо аэрируется, а оттенки серого обозначают недостаточный дренаж (рис. 1–4). В хорошо дренированных почвах гор Северной Каролины и Пьемонта цвета подпочвы часто имеют оттенки красного, коричневого и желтого. В слабо дренированных почвах подпочва имеет более серый цвет. Цвет
Текстура
Текстура почвы, которая относится к пропорциям песка, ила и глины, влияет почти на все аспекты использования почвы и управления ею. Песок — самая крупная частица (от 2,0 до 0,05 мм), ил намного меньше (0,05-0,002 мм), а глина — самая маленькая (менее 0,002 мм) (рис. 1–5). Чтобы сравнить размеры частиц, представьте, что песчинка размером с баскетбольный мяч. В таком масштабе частица ила была бы размером с мрамор, а частица глины была бы острым предметом.От того, насколько мелкая (глинистая) или крупная (песчаная) почва, зависят многие ее физические и химические свойства.
Большая часть способности частицы почвы вступать в реакцию с водой и питательными веществами зависит от доступной площади поверхности (Таблица 1 — 1). Когда размер отдельных частиц невелик, больше отдельных частиц может поместиться в данном пространстве и, таким образом, сделать доступной большую площадь поверхности. Глина с ее крошечными частицами и пластинчатой структурой эффективно удерживает воду и питательные вещества, в то время как песок, имеющий крупную крупнокусковую структуру, не удерживает.Частицы глины не только меньше по размеру, но и состоят из минералов, отличных от песка и ила, а структура частицы глины больше похожа на стопку бумажных тарелок, чем на песчинку (рис. 1–6).
Таблица 1 — 1. Тип частиц, количество частиц на грамм и средняя площадь поверхности на грамм.
| Тип частиц | Диаметр (мм) | Количество частиц на грамм | Удельная поверхность (см 2 / г) |
| глина | <0.002 | 90 260 853 000 | 8 000 000 |
| Крупный песок | 1,00–0,50 | 720 | 23 |
| Мелкий песок | 0,25-0,10 | 46 000 | 91 |
| Песок средний | 0,50–0,25 | 5,700 | 45 |
| Ил | 0.05-0.002 | 5 776 000 | 454 |
| Очень крупный песок | 2,00–1,00 | 90 | 11 |
| Очень мелкий песок | 0,10-0,05 | 722 000 | 227 |
Камни и гравий
Камни и гравий, которые являются крупными крупными материалами, можно найти во многих почвах, но они не учитываются при определении текстуры почвы.Хотя некоторые камни и гравий в почве не влияют на усвоение питательных веществ растениями, они могут затруднить копание почвы. Если сад состоит в основном из камней или гравия, почва будет иметь пониженную способность удерживать воду и питательные вещества и будет непригодна для выращивания растений. В такой ситуации проще всего будет установить грядки и завозить грунт.
Добавление органических веществ — более экономически выгодная альтернатива улучшения почвы. Добавление органических веществ не изменяет структуру почвы — процентное содержание песка, ила и глины в почве, — но добавление органических веществ изменяет структуру почвы за счет увеличения порового пространства и улучшения дренажа.Садовники могут добиться успеха с любой структурой почвы, если они знают свойства и ограничения этой почвы. Относительные пропорции песка, ила и глины определяют текстурный класс почвы (рис. 1–7). Например, почва, состоящая из 12% песка, 55% глины и 33% ила, относится к классу текстуры глины. Текстура почвы — это постоянная характеристика, которую нелегко изменить в результате деятельности человека. Рассмотрим типичную минеральную почву глубиной 6 дюймов на 1 акре. Эта почва весит около 2 миллионов фунтов. Чтобы изменить содержание песка всего на 1%, потребуется добавить 20 000 фунтов (или 10 тонн) песка.Изменение содержания песка на 1% будет иметь минимальный эффект. Значительный эффект может потребовать изменения на 10%, что означает добавление 100 тонн песка.
Обычно для определения текстуры почвы используются лабораторные процедуры. Однако можно использовать процедуру, описанную на рис. 1–8, для определения класса текстуры методом « feel ». Это требует практики и калибровки, но может дать разумную оценку текстуры почвы.
Песчаные или крупнозернистые почвы (рис. 1–9)
- Низкое содержание органических веществ и естественное плодородие.
- Быстро проницаемый и не удерживающий влагу почвы.
- Выщелачивание питательных веществ вызывает беспокойство, поэтому правильное внесение удобрений является обязательным. Применяйте меньшее количество питательных веществ и применяйте их чаще.
- Низкое содержание катионита Буферная емкость и .
- Хорошо подходит для фундаментов дорог и строительных площадок.
- Почувствуйте себя песчаным.
Суглинистые или среднетекстурированные почвы (рис. 1–10)
- Содержит больше органических веществ.
- Разрешают более медленное движение воды и лучше удерживают влагу и питательные вещества.
- Обычно более плодовиты.
- Обладают более высокой катионообменной и буферной емкостью.
- На ощупь рассыпчатый.
Глинистые или мелкозернистые почвы (рис. 1–11)
- Повышенная удерживающая способность.
- Более высокая водоудерживающая способность.
- Мелкозернистые почвы проявляют свойства, с которыми трудно справиться или преодолеть их.
- Часто бывает слишком липким в мокром состоянии и слишком твердым в сухом для выращивания.
- Может иметь характеристики усадки и разбухания, которые влияют на использование в строительстве.
- Почувствуйте себя скользким.
Как типы почвы влияют на садоводов?
Уплотнение. Уплотнение происходит, когда к частицам почвы прилагается давление, а воздух и вода выталкиваются из порового пространства. Крупные частицы песка кубической формы с трудом уплотняются. Частицы глины, мелкие и пластинчатые, легко выравниваются и могут уплотняться, особенно во влажном состоянии.Уплотнение препятствует движению воды, газов (воздуха) и корней. Уплотненные почвы имеют меньшую инфильтрацию, больший сток, более высокий риск эрозии и более ограниченный рост корней, чем почвы без уплотнения. Вода стекает медленно, что может увеличить вероятность заболеваний корней растений.
Эрозия. Частицы песка тяжелые, поэтому их сложно поднять и сдвинуть под действием воды или ветра. Частицы глины липкие, поэтому их трудно сдвинуть. Частицы илистого суглинка легкие и не липкие, поэтому эрозионные силы легко перемещают их.Эродированные почвы обычно труднее обрабатывать и имеют более низкую продуктивность, чем почвы без эрозии. Основными причинами эрозии почвы в Северной Каролине являются недостаточный растительный покров или мульчированный покров, а также неправильное оборудование и методы, используемые для подготовки и обработки почвы (рис. 1–12).
Эрозию почвы можно свести к минимуму, приняв несколько профилактических мер:
- Выбирайте растения, подходящие к почве, чтобы они хорошо прижились.
- Ежегодно мульчируйте поверхность органическими материалами на глубину от 1 до 3 дюймов.
- Достаточно удобряйте, чтобы способствовать энергичному, но не чрезмерному росту растений.
- Создайте водозабор, например водный путь из травы, чтобы уловить и замедлить движение воды.
- Выровняйте ряды по контуру земли, чтобы вода, стекающая с холма, замедлялась.
- Используйте правильные методы обработки почвы, например, не вспахивайте слишком влажную почву и не заделывайте ее.
- Посадить озимую покровную культуру.
- Рассмотрите возможность установки дождевых садов для сбора наносов и стоков.
Площадь поверхности. Самая активная часть частицы почвы — это площадь ее поверхности. На поверхности частицы происходит обмен питательными веществами. Частицы песка имеют небольшую площадь поверхности по сравнению с их массой, что означает, что они плохо удерживают питательные вещества. Частицы глины имеют большую площадь поверхности по сравнению с их массой, поэтому небольшое количество глины может добавить значительную площадь поверхности к почве, увеличивая способность удерживать питательные вещества.
Структура
Структура почвы означает группировку отдельных частиц почвы в более крупные части, называемые peds или агрегаты .Структура верхнего слоя почвы обычно зернистая и напоминает крошки шоколадного печенья (рис. 1–13). Хорошая зернистая структура обеспечивает быстрое движение воздуха и воды в почве. Плохая зернистая структура уменьшает движение воздуха и воды. Хорошая структура почвы способствует широкому развитию корней; плохая структура может ограничить рост корней. Добавление достаточного количества органического вещества и обработка почвы только тогда, когда она не слишком влажная, способствует хорошей структуре верхнего слоя почвы.
Водоемкость
Вода попадает в почву в результате атмосферных осадков или орошения.Он выходит через дренаж из почвы, испаряясь с поверхности, и через транспирацию из листьев растений. Влагоудерживающая способность — удерживание воды, проходящей через почву, — зависит от различий в пространстве пор почвы. Идеальные почвы — это полупористое пространство с равным количеством воздуха и воды, заполняющими поры. Слишком много воздуха означает, что растения увянут. Слишком много воды означает снижение жизнеспособности растений и подверженность корневой гнили, которая возникает из-за анаэробных условий.
Почвы различаются количеством крупных (макро), средних (мезо) и мелких (микро) пор.Макропоры, которые чаще встречаются в песчаных почвах, быстрее впитывают воду и быстрее дренируют, чем мезо- и микропоры. Этот быстрый сток из макропор называется «гравитационной водой», потому что более слабые силы адгезии и сцепления в макропорах не могут преодолеть силу тяжести. В течение 24 часов после проливного дождя гравитационная вода достигает нижних горизонтов почвы, и почва имеет полевую емкость : мезо- и микропоры все еще заполнены водой, потому что их силы сцепления и сцепления сильнее силы тяжести.Вода в мезопорах доступна растениям. Но когда мезопоры теряют воду по мере высыхания почвы из-за поглощения растениями и транспирации, влажность почвы достигает точки постоянного увядания. В точке постоянного увядания микропоры все еще заполнены водой, но эта вода удерживается настолько плотно, что недоступна для растений. Обратите внимание, что растения могут увядать до точки постоянного увядания, если растение пропускает воду через листья быстрее, чем может забирать воду из почвы через корни. Вот почему растения могут увядать в жаркие дни, а затем восстанавливаться после захода солнца, и почему растения могут сбалансировать поглощение с транспирацией (рис. 1–14).
Как устранить уплотнение
Уплотнение является вероятной проблемой, если в этом районе недавно были строительные работы или другие транспортные средства. Для разрыхления почвы может потребоваться глубокая обработка почвы, при которой верхние слои почвы от 6 дюймов до 2 футов перемешиваются культиватором, диском или ручными инструментами. Включение органических веществ во время глубокой культивации может помочь восстановить структуру почвы за счет создания агрегатов и макропор (для дренажа) и мезопор (для воды, доступной для растений).Выкопка или обработка почвы, когда она влажная или чрезмерно сухая, могут разрушить структуру.
Будьте осторожны с быстрыми решениями, такими как начало работы с грузовиком верхнего слоя почвы. К сожалению, нет стандартов на материал, продаваемый как «верхний слой почвы». На место могут быть доставлены новые проблемы, такие как семена сорняков и болезнетворные организмы. Добавление нового верхнего слоя почвы к существующей почве также может создать проблемы с дренажом, когда вода проходит через приобретенный верхний слой почвы и достигает уплотненного слоя. Вода может скапливаться и создавать неблагоприятные условия для роста корней.
Глинистые почвы, которые имеют тенденцию удерживать чрезмерное количество воды и легко уплотняются, представляют некоторые сложные проблемы. Распространенные ошибки — добавление песка или торфяного мха для улучшения дренажа. Добавление песка в глину уменьшит структуру почвы, уменьшив поровое пространство. Добавление торфяного мха увеличит высокую влагоудерживающую способность глинистой почвы. Лучший совет — последовательно добавлять меньшее количество органических веществ каждый год, минимизировать уплотнение и позволить биологии почвы естественным образом улучшить структуру с течением времени.
Городские почвы
По мере того, как движение за местные продукты питания набирает обороты, все больше людей занимаются садоводством в городских районах. Городские почвы могут содержать такие загрязнители, как свинец, остатки пестицидов или нефтепродукты. Перед садоводством и особенно перед тем, как производить какие-либо продукты питания на городской почве, важно понять историю земли и правильно определить любые возможные загрязнители. S oilFacts: Минимизация рисков загрязнения почвы в городских садах (публикация NC State Extension номер AG-439-78) предоставляет подробную информацию об уровнях риска для отдельных загрязнений почвы, методах восстановления и ресурсах для профессионалов, которые могут помочь с анализом и консультациями.
Вот несколько советов по садоводству на загрязненных почвах:
Дизайн сада:
Сажайте декоративные растения на загрязненных территориях и размещайте съедобные продукты как можно дальше от загрязнителей.
Не сажайте возле дорог или зданий.
Рассмотрите возможность использования приподнятых грядок с привозной почвой (рис. 1–15).
Управление почвами:
Повышение pH почвы может помочь замедлить поглощение некоторыми загрязнителями растениями.
Органические вещества, такие как компост, могут связывать некоторые загрязнители в почве.
Если необходимо крупномасштабное восстановление, обратитесь к профессионалу за помощью в земляных работах, мытье или удалении паров.
Рекомендации по посадке:
Избегайте корнеплодов, съедобные части которых контактируют с почвой.
Побеговые и листовые культуры (салат, капуста, брокколи, сельдерей, ревень) будут иметь меньший риск заражения.
Плодовые культуры (помидоры, кабачки, фасоль, перец) будут иметь наименьший риск заражения.
Гигиена сада:
Надевайте перчатки и мойте руки и одежду после работы в саду.
Не носить в доме садовую обувь.
Внимательно следите за детьми, чтобы не попала грязь.
Вымойте продукты в мягком моющем средстве, удалите первые листья листовых культур (самые близкие к земле) и очистите корнеплоды.
Рисунок 1–4.Цвет как индикатор дренажа. Почва слева представлена серией Сесил, хорошо дренированной минеральной почвой, типичной для предгорий Северной Каролины. Почва справа — это серия Coxville, плохо дренированная минеральная почва, обнаруженная на прибрежной равнине Северной Каролины.
Джон А. Келли, USDA-Служба охраны природных ресурсов
Джон А.Келли, Служба охраны природных ресурсов Министерства сельского хозяйства США
Распечатать изображениеРисунок 1–5. Относительные размеры песка, ила и глины.
Рисунок 1–6. Изображение слева показывает крупный план частиц песка, которые кажутся зернистыми, если смотреть невооруженным глазом. Справа показана пластинчатая текстура глины, видимая только под микроскопом.
Рисунок 1–7.Пирамидальная диаграмма, показывающая типы почвы, основана на процентном содержании глины, песка и ила.
Рисунок 1–8. Метод Feel для определения текстурного класса почв.
Рисунок 1–9.Песчаные почвы малоплодородны и не удерживают почвенную влагу.
USDA, NRCS CC BY-SA — 4.0
Рисунок 1–10.Суглинистые почвы кажутся рассыпчатыми и обычно темнее, потому что содержат органические вещества.
USDA, NRCS CC BY-SA — 4.0
Рисунок 1–11.Глинистые почвы липкие во влажном состоянии и очень твердые в сухом.
Почвоведение, штат Северная Каролина CC BY — 2.0
Почвоведение, штат Северная Каролина
% PDF-1.3 % 359 0 объект > endobj xref 359 94 0000000016 00000 н. 0000002231 00000 н. 0000003694 00000 н. 0000003868 00000 н. 0000003935 00000 н. 0000004051 00000 н. 0000004164 00000 п. 0000004337 00000 н. 0000004477 00000 н. 0000004604 00000 н. 0000004720 00000 н. 0000004904 00000 н. 0000005116 00000 п. 0000005252 00000 н. 0000005414 00000 н. 0000005620 00000 н. 0000005807 00000 н. 0000005932 00000 н. 0000006053 00000 н. 0000006161 00000 п. 0000006284 00000 н. 0000006407 00000 н. 0000006531 00000 н. 0000006654 00000 н. 0000006777 00000 н. 0000006903 00000 н. 0000007090 00000 н. 0000007259 00000 н. 0000007379 00000 н. 0000007490 00000 н. 0000007598 00000 н. 0000007721 00000 н. 0000007844 00000 н. 0000007968 00000 п. 0000008091 00000 н. 0000008214 00000 н. 0000008340 00000 н. 0000008562 00000 н. 0000008732 00000 н. 0000008921 00000 н. 0000009053 00000 н. 0000009185 00000 п. 0000009317 00000 п. 0000009453 00000 п. 0000009585 00000 н. 0000009691 00000 п. 0000009852 00000 н. 0000009998 00000 н. 0000010168 00000 п. 0000010349 00000 п. 0000010503 00000 п. 0000010660 00000 п. 0000010810 00000 п. 0000010987 00000 п. 0000011163 00000 п. 0000011284 00000 п. 0000011396 00000 п.


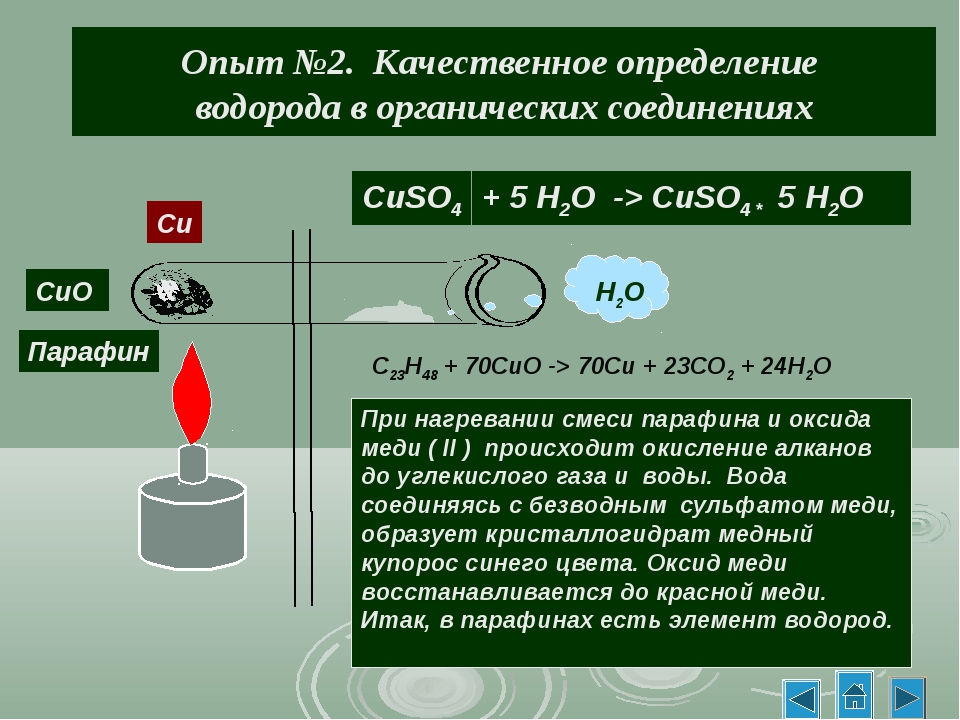
 Будьте осторожны!
Соблюдайте аккуратность!
Будьте осторожны!
Соблюдайте аккуратность! Пробирка с исходными веществами должна быть закреплена в штативе под прямым углом или с небольшим наклоном вниз. Пробирку со смесью осторожно нагревайте в пламени горелки, опустите затем газоотводную трубку в другую пробирку, на 1/4 заполненную известковой водой — насыщенным раствором гидроксида кальция Ca(OH)2{\displaystyle {\ce {Ca(OH)2}}} (рис. 1). Что наблюдаете? Какую роль в данном эксперименте играют оксид меди и гидроксид кальция? Какие элементы, входящие в состав органического вещества, вы обнаружили с помощью этого опыта? Когда вы обнаружите слой восстановленной меди, подняв лапку штатива, выньте газоотводную трубку из пробирки с известковой водой, нагревание прекратите.
Пробирка с исходными веществами должна быть закреплена в штативе под прямым углом или с небольшим наклоном вниз. Пробирку со смесью осторожно нагревайте в пламени горелки, опустите затем газоотводную трубку в другую пробирку, на 1/4 заполненную известковой водой — насыщенным раствором гидроксида кальция Ca(OH)2{\displaystyle {\ce {Ca(OH)2}}} (рис. 1). Что наблюдаете? Какую роль в данном эксперименте играют оксид меди и гидроксид кальция? Какие элементы, входящие в состав органического вещества, вы обнаружили с помощью этого опыта? Когда вы обнаружите слой восстановленной меди, подняв лапку штатива, выньте газоотводную трубку из пробирки с известковой водой, нагревание прекратите.
 Для этого вещество нужно поместить в сухую пробирку, закрытую пробкой с газоотводной трубкой, согнутой под прямым углом. Нагревая пробирку, собирают выделяющиеся в ходе реакции газы. С помощью качественных реагентов, определяют, что за газы выделяются, это дает возможность установить какие элементы входят в состав исходного вещества (качественный состав). По объему выделившихся газов определяю количественный состав исходного соединения.
Для этого вещество нужно поместить в сухую пробирку, закрытую пробкой с газоотводной трубкой, согнутой под прямым углом. Нагревая пробирку, собирают выделяющиеся в ходе реакции газы. С помощью качественных реагентов, определяют, что за газы выделяются, это дает возможность установить какие элементы входят в состав исходного вещества (качественный состав). По объему выделившихся газов определяю количественный состав исходного соединения.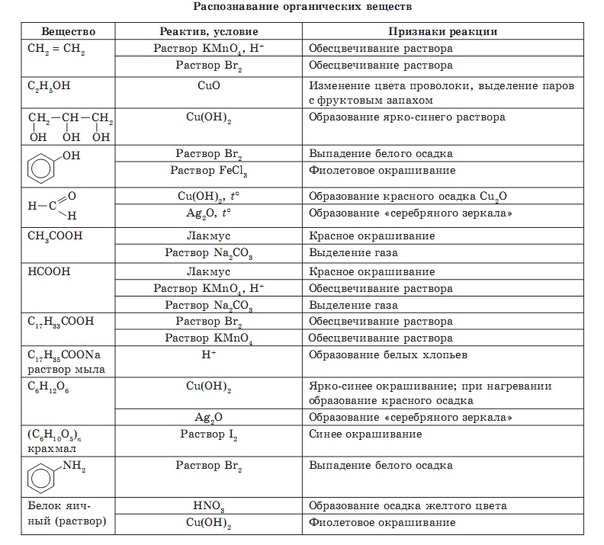 Большая часть неорганических соединений (в основном ионная, атомная или металлическая кристаллическая решетка) представляет собой твердые вещества, плавящиеся при весьма высоких температурах.
Большая часть неорганических соединений (в основном ионная, атомная или металлическая кристаллическая решетка) представляет собой твердые вещества, плавящиеся при весьма высоких температурах.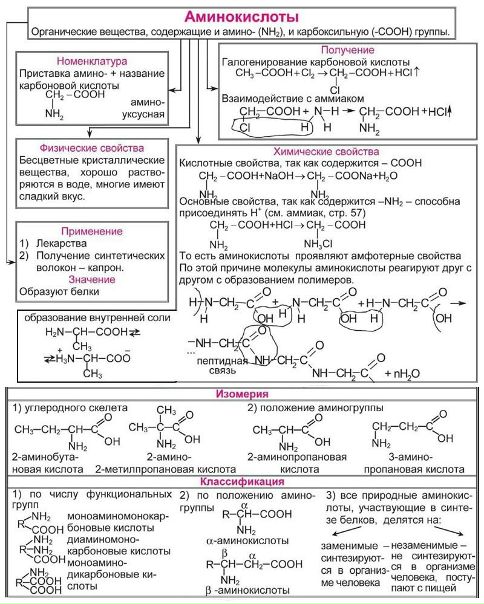
 Процедуру следует повторять до полного исчезновения загрязнения, постоянно меняя впитываюший материал. Если загрязненный участок предварительно обработать скипидаром, то избавиться от пятна получится быстрее.
Процедуру следует повторять до полного исчезновения загрязнения, постоянно меняя впитываюший материал. Если загрязненный участок предварительно обработать скипидаром, то избавиться от пятна получится быстрее.
 Органическая химия в жизни человека
Органическая химия в жизни человека
