Проба на окрашивание пламени • Джеймс Трефил, энциклопедия «Двести законов мироздания»
200 законов мироздания > Химия
Присутствие металлов можно идентифицировать по цвету пламени, образующегося при их горении.
При совершении электроном квантового скачка с одной разрешенной орбитали на другую (см. Атом Бора) атом испускает свет. А поскольку энергетические уровни атомов двух элементов различны, свет, испускаемый атомом одного элемента, будет отличаться от света, испускаемого атомом другого. Это положение лежит в основе науки, которую мы называем спектроскопией (см. Открытие Кирхгофа—Бунзена).
На этом же положении (что атомы разных элементов испускают свет разной длины волны) основана проба на окрашивание пламени в химии. При нагревании в пламени газовой горелки раствора, содержащего ионы одного из щелочных металлов (то есть одного из элементов первой колонки периодической системы Менделеева), пламя окрасится в определенный цвет в зависимости от того, какой металл присутствует в растворе. К примеру, ярко-желтый цвет пламени выдает присутствие натрия, фиолетовый — калия, а карминно-красный — лития. Происходит это окрашивание пламени так: столкновение с горячими газами пламени переводит электроны в возбужденное состояние, из которого они возвращаются в исходное, одновременно испуская свет характерной длины волны.
К примеру, ярко-желтый цвет пламени выдает присутствие натрия, фиолетовый — калия, а карминно-красный — лития. Происходит это окрашивание пламени так: столкновение с горячими газами пламени переводит электроны в возбужденное состояние, из которого они возвращаются в исходное, одновременно испуская свет характерной длины волны.
Это свойство атомов объясняет, почему лес, прибитый к океанскому берегу, так высоко ценится для топки каминов. Долгое время находясь в море, бревна адсорбируют большое количество разных веществ, и при горении бревен эти вещества окрашивают пламя во множество разных цветов.
3
Показать комментарии (3)
Свернуть комментарии (3)
Kostja 01.12.2008 03:00 Ответить
В подпись под картинкой:
«Три металла (слева направо) — натрий, стронций и бор»
вкралась опечатка, бор не является металлом.Ответить
Evgen271081 13.
 01.2010 19:34
Ответить
01.2010 19:34
ОтветитьБор -может проявлять как металлические, так и неметаллические свойства!
Приглашаю посетить сайт ЗАНИМАТЕЛЬНАЯ ХИМИЯ
http://www.kristallikov.netОтветить
Написать комментарий
конец XVIII в. | Проба на окрашивание пламени |
1859 | Открытие Кирхгофа—Бунзена |
1859 | Спектроскопия |
1913 |
1742
Проблема Гольдбаха
1891
Принцип эквивалентности
Новостная рассылка
«Элементы» в соцсетях:
Окрашивание пламени как один из методов аналитической химии.

МАОУ СОШ № 40
Тема
Окрашивание пламени как один из методов аналитической химии.
Авторы:
Дылдина Юдия,
9г кл., МАОУ СОШ № 40
Руководитель:
Гуркина Светлана Михайловна,
Учитель биологии и химии.
Пермь, 2015
Оглавление
- Введение.
- Глава 1 Аналитическая химия.
- Глава 2 Методы аналитической химии.
- Глава 3 Реакции окрашивания пламени.
- Заключение.
Введение.
С самого раннего детства меня завораживала работа ученых-химиков. Они казались волшебниками, которые познав какие-то скрытые законы природы, творили неведомое. В руках этих волшебников вещества меняли цвет, загорались, нагревали или охлаждались, взрывались. Когда я пришла на уроки химии, то занавеса начала приподниматься, и я начала понимать, как происходят химические процессы. Пройденного курса химии мне оказалось мало, поэтому я решила поработать над проектом. Хотелось, чтобы тема, над которой я работаю, была содержательной, помогла лучше подготовиться к экзамену по химии и удовлетворила мою тягу к красивым и ярким реакциям.
Окрашивание пламени ионами металлов в разные цвета мы изучаем еще на уроках химии, когда проходим щелочные металлы. Когда я заинтересовалась этой темой, оказалось, что в данном случае, она не раскрыта до конца. Я решила изучить ее более подробно.
Цель: с помощью данной работы я хочу научиться определять качественный состав некоторых солей.
Задачи:
- Познакомиться с аналитической химией.
- Изучить методы аналитической химии и выбрать наиболее приемлемый для моей работы.
- С помощью эксперимента определить какой металл входит в состав соли.
Глава 1.
Аналитическая химия .
Аналитическая химия — раздел химии, изучающий химический состав и отчасти структуру веществ.
Цель данной науки заключается в определении химических элементов или групп элементов, входящих в состав веществ.
Предмет её изучения является совершенствование существующих и разработка новых методов анализа, поиск возможностей их практического применения, исследование теоретических основ аналитических методов.
В зависимости от задачи методов различают качественный и количественный анализ.
- Качественный анализ — совокупность химических, физико-химических и физических методов, применяемых для обнаружения элементов, радикалов и соединений, входящих в состав анализируемого вещества или смеси веществ. В качественном анализе можно использовать легко выполнимые, характерные химические реакции, при которых наблюдается появление или исчезновение окрашивания, выделение или растворение осадка, образование газа и др. Такие реакции называют качественными и с помощью них можно с легкостью проверить состав вещества.
Качественный анализ чаще всего проводят в водных растворах. Он основан на ионных реакциях и позволяет обнаружить катионы или анионы веществ, которые там содержатся. Основоположником такого анализа считается Роберт Бойль. Он ввёл это представление о химических элементах как о не разлагаемых основных частях сложных веществ, после чего он систематизировал все известные в его время качественные реакции.
- Количественный анализ — совокупность химических, физико-химических и физических методов определения соотношения компонентов, входящих в состав
анализируемого вещества. По результатам этого можно определить константы равновесия, произведения растворимости, молекулярные и атомные массы. Такой анализ выполнять сложнее, так как он требует аккуратного и более кропотливого подхода, в ином случае результаты могут давать высокие погрешности и работа будет сведена к нулю.
Количественному анализу обычно предшествует качественный анализ.
Глава 2.
Методы химического анализа.
Методы химического анализа делят на 3 группы.
- Химические методы основаны на химических реакциях.
В данном случае для анализа можно использовать только такие реакции, которые сопровождаются наглядным внешним эффектом, например изменением окраски раствора, выделением газов, выпадением или растворением осадков и т. п. Эти внешние эффекты и послужат в данном случае аналитическими сигналами. Происходящие химические изменения называют аналитическими реакциями, а вещества, вызывающие эти реакции — химическими реагентами.
Происходящие химические изменения называют аналитическими реакциями, а вещества, вызывающие эти реакции — химическими реагентами.
Все химические методы делят на две группы:
- Реакцию проводят в растворе, так называемым «мокрым путем».
- Способ выполнения анализа с твердыми веществами без использования растворителей, такой способ называют «сухим путем». Он делится на пирохимический анализ и анализ методом растирания. При пирохимическом анализе исследуемое вещество нагревают в пламени газовой горелки. При этом летучие соли (хлориды, нитраты, карбонаты) ряда металлов придают пламени определенную окраску. Другой прием пиротехнического анализа—получение окрашенных перлов (стекол). Для получения перлов соли и оксиды металлов сплавляют с тетраборатом натрия (Na2 В4О7′ 10Н2О) или гидрофосфатом натрия-аммония (NaNh5HP04 • 4Н20) и наблюдают окраску образующихся стекол (перлов).
- Метод растирания был предложен в 1898 г. Ф. М. Флавицким. Твердое исследуемое вещество растирают с твердым реагентом, при этом наблюдают внешний эффект.
 Например, соли кобальта с тиоцианатом аммония могут дать синее окрашивание.
Например, соли кобальта с тиоцианатом аммония могут дать синее окрашивание.
- При анализе физическими методами изучают физические свойства вещества с помощью приборов, не прибегая к химическим реакциям. К физическим методам можно отнести спектральный анализ, люминесцентный, рентгеноструктурный и другие способы анализов.
- С помощью физико-химических методов изучают физические явления, которые происходят в химических реакциях. Например, при колориметрическом методе измеряют интенсивность окраски в зависимости от концентрации вещества, в кондуктометрическом анализе измеряют изменение электрической проводимости растворов .
Глава 3.
Лабораторная работа.
Реакции окрашивания пламени.
Цель: Изучить окрашивания пламени спиртовки ионами металлов .
В своей работе я решила воспользоваться методом пиротехнического анализа окрашивания пламени ионами металлов.
Исследуемые вещества: соли металлов (фторид натрия, хлорид лития, сульфат меди, хлорид бария, хлорид кальция, сульфат стронция, хлорид магния, сульфат свинца).
Оборудование: фарфоровые чашки, этиловый спирт, стеклянная палочка, концентрированная соляная кислота.
Для проведения работы, я делала раствор соли в этиловом спирте, а затем поджигала. Свой опыт я провела несколько раз, на последнем этапе были отобраны наилучшие образцы, поле чего мы сделали видео.
Выводы:
- Реакции окрашивания пламени удаются хорошо как правило только с летучими солями, например с хлоридами, карбонатами и нитратами, а нелетучие соли, такие как бораты, силикаты или фосфаты, перед горением следует смочить концентрированной соляной кислотой для перевода их в летучие хлориды. В моем случае это оказался сульфат меди смоченный концентрированной соляной кислотой, он дал ярко зеленое пламя.
- Многие соли металлов дают окрашивание пламени в различные цвета, но иногда, это окрашивание не является ярким и насыщенным.
Заключение.
Химический анализ используется человеком в очень многих областях, на уроках же химии мы знакомимся лишь с небольшой областью этой сложной науки. Приемы, которые используются в пирохимическом анализе, используются в качественном анализе как предварительное испытание при анализе смеси сухих веществ или как проверочные реакции. В качественном анализе реакции «сухим» путем играют только вспомогательную роль, их используют обычно в качестве первичных испытаний и проведения проверочных реакций.
Приемы, которые используются в пирохимическом анализе, используются в качественном анализе как предварительное испытание при анализе смеси сухих веществ или как проверочные реакции. В качественном анализе реакции «сухим» путем играют только вспомогательную роль, их используют обычно в качестве первичных испытаний и проведения проверочных реакций.
Кроме того, данные реакции используются человеком и в других отраслях, к примеру в фейерверках. Как мы знаем, фейерверк это декоративные огни разнообразных цветов и форм, получаемые при сжигании пиротехнических составов. Так вот в состав фейерверка пиротехники добавляют разнообразные горючие вещества, среди которых широко представлены неметаллические элементы (кремний, бор, сера). В процессе окисления бора и кремния выделяется большое количество энергии, но не образуются газовые продукты, поэтому эти вещества применяются для изготовления взрывателей замедленного действия (чтобы воспламенить другие составы в определенное время). Многие смеси включают органические углеродсодержащие материалы.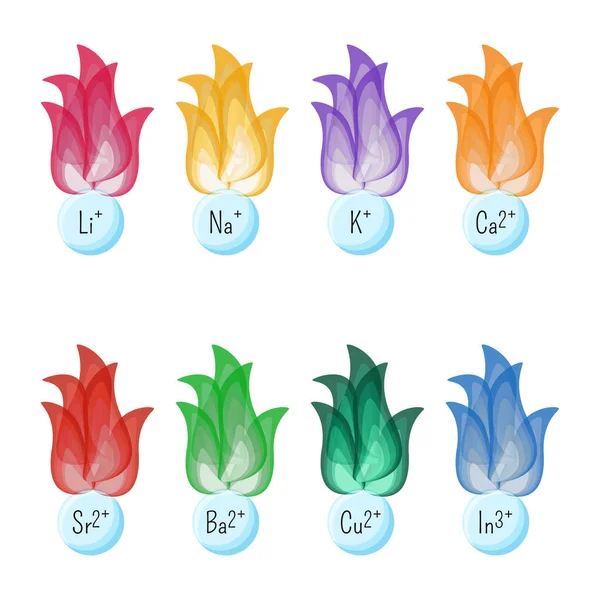 Например, древесный уголь (применяется в дымном порохе, снарядах для фейерверков) или сахар (дымовые гранаты). Используются химически активные металлы (алюминий, титан, магний), чье горение при высокой температуре дает яркий свет. Это их свойство стали использовать для запуска фейерверков.
Например, древесный уголь (применяется в дымном порохе, снарядах для фейерверков) или сахар (дымовые гранаты). Используются химически активные металлы (алюминий, титан, магний), чье горение при высокой температуре дает яркий свет. Это их свойство стали использовать для запуска фейерверков.
В процессе работы, я поняла насколько сложно и важно работать с веществами, не все удалось в полной мере, как бы хотелось. Как правило, на уроках химии не хватает практикой работы, благодаря которой отрабатываются теоретические навыки. Проект помог мне развить этот навык. Кроме того, я с большим удовольствием познакомила, своих одноклассников с результатами своей работы. Это помогло им закрепить теоретический знания.
Объяснение урока: Испытания пламенем | Nagwa
В этом объяснении мы узнаем, как определить использование тестов пламени и цвета, производимые атомами щелочных, щелочноземельных и других металлов во время испытание пламенем.
Фейерверки представляют собой впечатляющее зрелище для зрителей, потому что они освещают
ночное небо с ярким светом, как показано на изображении ниже.
Цвета испускаются, когда воспламеняется порох в фейерверках. Воспламенение пороха вызывает повышение температуры, и это высокое температура может возбуждать определенные химические элементы и заставлять их излучать красочные свет.
Многие химические элементы также могут излучать цветной свет, когда они нагревают в пламени бунзеновской горелки. Обычные горячие горелки Бунзена испускают характерное бледно-голубое пламя, которое обычно называют несветящимся пламя. Несветящееся пламя может быть преобразовано в пламя разных цветов, когда они вступают в контакт с различными типами соединений и образцами чистых металлы.
Определение: Несветящееся пламя
Несветящееся пламя представляет собой бледно-голубое пламя, возникающее, когда температура пламя очень высокое, потому что пламя питается от полного сгорания реакции.
Хлорид натрия излучает интенсивный желтый цвет при нагревании с сильным
Пламя бунзеновской горелки. Уличные фонари излучают похожий ярко-желтый цвет, когда они
включены, потому что они также содержат атомы натрия. В любом случае тепло
энергия пламени или электрическая энергия в лампе вызвали натрий
атомы излучают ярко-желтый свет. Испускание света любым элементом
можно понять, рассмотрев, как электроны перемещаются между дискретной энергией
уровней в атомах.
Уличные фонари излучают похожий ярко-желтый цвет, когда они
включены, потому что они также содержат атомы натрия. В любом случае тепло
энергия пламени или электрическая энергия в лампе вызвали натрий
атомы излучают ярко-желтый свет. Испускание света любым элементом
можно понять, рассмотрев, как электроны перемещаются между дискретной энергией
уровней в атомах.
Электроны в атомах могут существовать только на определенных энергетических уровнях. Электроны всегда сначала заполняют самый низкий энергетический уровень в любом одном атоме, а затем они заполняют другой более высокие энергетические уровни. Электроны могут быть возбуждены с одного низкого энергетического уровня на другой. более высокий энергетический уровень, если они поглощают дискретные пакеты энергии.
Возбужденные электроны нестабильны, и они почти всегда падают до
более низкий энергетический уровень. Это может происходить поэтапно по мере испускания всплесков энергии. один за другим, или это может произойти в одно короткое мгновение, как одна высокая энергия
фотон испускается возбужденным электроном.
один за другим, или это может произойти в одно короткое мгновение, как одна высокая энергия
фотон испускается возбужденным электроном.
Энергия выделяется в виде электромагнитного излучения при возбуждении электрон падает с одного высокого энергетического уровня на более низкий энергетический уровень. Энергия испускаемая электромагнитная энергия может быть рассчитана с помощью следующего уравнение: 𝐸=ℎ𝑣. В этом уравнении 𝐸 — энергия, ℎ — постоянная Планка, а 𝑣 — частота волны. Энергия, как правило, измеряется в джоулях (J), а частота волны обычно измеряется в герцах (Гц).
Мы видим, что энергия испускаемого электромагнитного излучения равна пропорциональна частоте электромагнитных волн.
Электромагнитный спектр представляет собой непрерывный спектр, состоящий из участков
различных видов электромагнитного излучения. Видимый свет составляет один
относительно небольшую часть электромагнитного спектра.
Химические элементы могут излучать видимый свет, если энергия разница между двумя энергетическими уровнями равна энергии пакета видимого световое излучение. Каждый элемент имеет свой уникальный набор энергетических уровней. будет иметь тенденцию производить свои собственные уникальные формы излучения видимого света. Некоторые химические элементы имеют тенденцию производить высокоэнергетическое излучение видимого света, и другие, как правило, производят низкоэнергетические формы излучения видимого света.
Синий свет имеет более высокую частоту и энергетическую ценность, чем зеленый свет. Зеленый
свет имеет более высокую частоту и энергетическую ценность, чем красный свет. Синий свет
возникает, когда возбужденные электроны перемещаются между состояниями, которые значительно
разные значения энергии.
На приведенной ниже диаграмме уровней энергии показана электронная конфигурация атома. натрия. Электронная конфигурация натрия в основном состоянии: 1с2с2п3с. Следовательно, атомы натрия имеют один валентный электрон. Когда эти атомы нагревается, энергии достаточно, чтобы возбудить электрон из подоболочка 3s к подоболочке 3p, как показано справа диаграмма.
Нагретые атомы натрия излучают ярко-желтый свет, когда их возбужденные электроны спуститься с высокоэнергетической подоболочки 3p на подоболочка 3s с более низкой энергией. Это приводит к характерный цвет пламени атомов натрия.
Пример 1: понимание того, какое свойство атома определяет изменение цвета пламени
Когда соль помещается в пламя горелки Бунзена, пламя изменяется цвет. Какую особенность ионов металлов в соль определяет цвет пламени в этом эксперименте?
- Расстояние между энергетическими уровнями электронов
- Энергия атомизации
- Реакционная способность с кислородом
- Энергия связи
- Расстояние между ядерными энергетическими уровнями
Ответ
Атомы металлов содержат электроны в основном состоянии
нормальные условия. Когда атом металла помещается в горячее пламя, энергия
предоставляется электронам в атоме, так что они возбуждаются до более высоких
энергетические уровни. Когда электроны возвращаются на свой первоначальный энергетический уровень,
энергия может быть высвобождена в виде видимого света. Полученный цвет зависит
от энергетического расстояния между заинтересованными энергетическими уровнями. Это имеет мало общего
с реакционной способностью соответствующего металла. Атомы металла не
«сгорели» или окислились.
Когда атом металла помещается в горячее пламя, энергия
предоставляется электронам в атоме, так что они возбуждаются до более высоких
энергетические уровни. Когда электроны возвращаются на свой первоначальный энергетический уровень,
энергия может быть высвобождена в виде видимого света. Полученный цвет зависит
от энергетического расстояния между заинтересованными энергетическими уровнями. Это имеет мало общего
с реакционной способностью соответствующего металла. Атомы металла не
«сгорели» или окислились.
Когда происходит это явление, атомы соли находятся в парообразном состоянии. Цвет, излучаемый атомом, не зависит от энергии атомизации атома.
соответствующий атом металла. Энергия атомизации соединения – это энергия
требуется для получения газообразных атомов из моля соединения в его
стандартное состояние в стандартных условиях. Это будет включать разрыв связи
и поэтому является эндотермическим процессом. Это изменение энтальпии является отдельным
от энергии, поглощаемой валентными электронами в атомах, когда они
возбуждается до более высоких уровней энергии в паровой фазе. Энергия связи не является
учитывать и здесь, так как атомы металла уже были атомизированы в
пламя. Энергии атомизации и энергии связи представляют собой изменения энтальпии, которые
не несут ответственности за цвет пламени.
Это изменение энтальпии является отдельным
от энергии, поглощаемой валентными электронами в атомах, когда они
возбуждается до более высоких уровней энергии в паровой фазе. Энергия связи не является
учитывать и здесь, так как атомы металла уже были атомизированы в
пламя. Энергии атомизации и энергии связи представляют собой изменения энтальпии, которые
не несут ответственности за цвет пламени.
Поскольку цвет пламени является явлением, связанным с валентными электронами в атомов, энергия ядра не имеет значения.
Мы можем использовать эти утверждения, чтобы определить, что вариант А является правильным ответ на этот вопрос.
Испытания на пламя – это качественные испытания, которые используются для обнаружения присутствия
металлов по их эмиссионным спектрам. Пламенные тесты относительно просты в настройке
и выполнять, и это объясняет, почему они используются столь многими различными типами
химики.
Здесь важно подчеркнуть, что не все металлы дают цветное пламя и испытания пламенем не могут быть использованы для проверки наличия всех металлов. Некоторые металлы не производят цветного пламени, потому что тепловая энергия горелки Бунзена недостаточно, чтобы возбудить электроны этих элементов достаточно, чтобы освободить энергии в видимом диапазоне.
Определение: Испытание пламенем
Испытание пламенем – это качественное испытание, используемое в химии для определения идентичность или возможная идентичность металла или металлоида по его излучению спектр.
Испытания на пламя проводят, сначала погружая нихромовую проволоку в раствор
концентрированная соляная кислота. Нихром – это сплав никеля и хрома,
не реагирует с соляной кислотой. Вместо него можно использовать платиновую проволоку.
потому что платина очень инертный металл, но она, как правило, более дорогая
вариант. Соляная кислота используется для очистки провода, и она используется для удаления
любые отложения ионов металлов. Соляная кислота также имеет тенденцию использоваться, потому что она
превращает металлы в соли хлоридов металлов. Хлористые соли металлов – это
обычно очень летучие, и их можно относительно легко испарить. Провод
затем помещают в горячее или бледно-голубое несветящееся пламя горелки Бунзена.
желтое безопасное пламя или светящееся пламя не следует использовать для проведения пламени
контрольная работа.
Соляная кислота также имеет тенденцию использоваться, потому что она
превращает металлы в соли хлоридов металлов. Хлористые соли металлов – это
обычно очень летучие, и их можно относительно легко испарить. Провод
затем помещают в горячее или бледно-голубое несветящееся пламя горелки Бунзена.
желтое безопасное пламя или светящееся пламя не следует использовать для проведения пламени
контрольная работа.
Определение: светящееся пламя
Светящееся пламя — это пламя желтого цвета, возникающее при повышении температуры. пламени относительно низкое, потому что пламя питается от неполного реакции горения.
Этот процесс очистки необходимо повторять до тех пор, пока провод не перестанет окрашиваться
к пламени горелки Бунзена. Затем проволоку погружают в раствор металла.
сложный. В качестве альтернативы проволоку можно смочить свежей кислотой, чтобы
несколько твердых кристаллов соединения металла. Затем конец проволоки возвращается к
пламя. Если в пламени наблюдается окрашивание, это отмечают и проволоку
затем снова очистили и готовы к другому испытанию пламенем. Цвет пламени может быть
довольно бледные, и они длятся иногда всего несколько
секунды. Тест
лучше всего проводить в темной комнате или затемненной лаборатории.
Затем конец проволоки возвращается к
пламя. Если в пламени наблюдается окрашивание, это отмечают и проволоку
затем снова очистили и готовы к другому испытанию пламенем. Цвет пламени может быть
довольно бледные, и они длятся иногда всего несколько
секунды. Тест
лучше всего проводить в темной комнате или затемненной лаборатории.
Здесь важно объяснить, что цвета пламени обычно создаются атомы, а не ионы. Ионы металлов обычно поглощают электроны и превращаются в нейтрально заряженных атомов до того, как они излучают видимый свет. Самое возбужденное состояние ионы имеют тенденцию испускать пакеты энергии, которые не видны человеческому глазу. Ионы имеют тенденцию испускать излучение невидимого света, когда их электроны падают с одного высокого и возбужденного энергетического уровня на более низкий энергетический уровень.
Пример 2. Объяснение того, почему соляная кислота используется в испытании пламенем
Перед анализом соединения с помощью испытания пламенем его обычно
растворяют в соляной кислоте. Что является основной причиной подготовки
образец таким образом?
Что является основной причиной подготовки
образец таким образом?
- Полученные соли более легко воспламеняются.
- Ионы в полученных солях дают более интенсивные цвета из-за их больший заряд.
- Обработка соляной кислотой удаляет примеси.
- Обработка соляной кислотой вытесняет анионы, которые могут изменить цвет пламени.
- Полученные соли легче испаряются.
Ответ
При проведении испытания пламенем ионы металлов в образце должны быть распылены в горячее пламя бунзеновской горелки. Это делается проще, если образец сделан в соль хлорида металла. Соли металлов, обработанные концентрированными соляной кислоты превращаются в более летучие соли хлоридов металлов. Это означает, что ионы легче испаряются.
При испытании пламенем соли не сгорают, поэтому воспламеняемость не определяется.
проблема. Заряд иона металла в соли хлорида металла остается
в неизменном виде по сравнению с исходным образцом соли. соляная кислота это
не окислитель.
соляная кислота это
не окислитель.
Хотя соляная кислота, помогающая очистить нихром или платину проволока, превращает соединения в растворимые соли хлора, она не удалит примеси из образца соли. Если присутствуют примеси, образец может перекристаллизовать, чтобы удалить их.
Большинство анионов не дают цветного пламени. Они либо содержат возбудимые электроны, которые излучают свет, не находящийся в видимой области спектра. электромагнитный спектр, или эффективность возбуждения этих анионов мало. Это означает, что по сравнению с катионами металлов большинство анионов дают мало или нет цвета пламени.
Используя эти утверждения, мы можем сделать вывод, что правильный ответ — вариант E.
Щелочные металлы – это элементы первой группы, составляющие крайний левый столбец таблицы.
периодическая таблица. Атомы щелочных металлов дают очень интересные и необычные
цвета пламени, когда они вступают в контакт с горячим пламенем горелки Бунзена. Цвета пламени пяти различных щелочных металлов показаны на рисунке.
следующее изображение.
Цвета пламени пяти различных щелочных металлов показаны на рисунке.
следующее изображение.
Атомы лития дают ярко-красное или малиновое пламя. Атомы натрия производят пламя золотисто-желтого цвета. Атомы калия производят пламя, которое имеет сиреневый, розовый или бледно-фиолетовый цвет. Атомы рубидия дают красно-фиолетовое пламя, а атомы цезия дают сине-фиолетовое пламя.
Металлы второй группы известны под общим названием щелочноземельные металлы, и они также могут давать интересные цвета пламени, когда их нагревают с помощью Бунзеновская горелка. Цвета пламени для кальция, стронция и бария показаны на следующее изображение.
Атомы кальция производят пламя, которое часто называют кирпично-красным, в то время как атомы стронция дают ярко-красное пламя. Атомы бария создают пламя, которое бледно-желто-зеленого цвета.
Хлористые соли металлов обычно используются для получения красок пламени. потому что они летучие, а ионы хлора не окрашивают пламя
свои собственные, которые будут мешать испытанию пламенем. проще проверить на
наличие металлов кальция или бария, если мы используем кальций или барий
хлорид (CaCl2 и
BaCl2), а не какой-либо другой кальций или
соединение бария.
потому что они летучие, а ионы хлора не окрашивают пламя
свои собственные, которые будут мешать испытанию пламенем. проще проверить на
наличие металлов кальция или бария, если мы используем кальций или барий
хлорид (CaCl2 и
BaCl2), а не какой-либо другой кальций или
соединение бария.
Многие другие металлические элементы могут быть возбуждены пламенем горелки Бунзена для получения характерные цвета пламени, такие как атомы свинца, которые дают серо-белый цвет пламени. Медь, пожалуй, самый интересный пример, потому что она дает характерное зеленое пламя. Пламенные испытания для этих двух элементов показаны на изображении ниже.
Пример 3. Воспроизведение цвета, придаваемого щелочным металлом в пламени Испытание
Какой из следующих терминов лучше всего описывает цвет пламени из солей рубидия?
- Синий
- Желтый
- Фиолетово-красный
- Оранжево-красный
- Сине-зеленый
Ответ
Рубидий — щелочной металл, находящийся в первой группе периодической таблицы. Все щелочные металлы дают цветное пламя при испытании на пламя. Литий
описывается как красный или малиновый. Натрий дает сильный желто-оранжевый цвет. Калий описывается как бледно-фиолетовый, сиреневый или розовый. Рубидий рассматривается как
пламя от красно-фиолетового, а цезий описывается как от сине-фиолетового.
Все щелочные металлы дают цветное пламя при испытании на пламя. Литий
описывается как красный или малиновый. Натрий дает сильный желто-оранжевый цвет. Калий описывается как бледно-фиолетовый, сиреневый или розовый. Рубидий рассматривается как
пламя от красно-фиолетового, а цезий описывается как от сине-фиолетового.
Лучшее описание рубидия, приведенное здесь, — фиолетово-красный.
Правильным ответом должен быть вариант C.
Пример 4. Воспроизведение цвета, создаваемого металлами s-блока в тесте на пламя
Какой металл s-блока не дает окрашенного пламени в тесте на пламя?
- Кальций
- Магний
- Рубидий
- Барий
- Цезий
Ответ
Металлы, встречающиеся в первой и второй группах периодической таблицы:
вместе описываются как элементы s-блока. Это связано с тем, что их валентность
электроны занимают s подоболочек. В первой группе рубидий и
цезий дает красно-фиолетовую и сине-фиолетовую окраску пламени соответственно. Из группы
во-вторых, барий дает бледно-зеленый цвет пламени, а кальций дает кирпично-красное пламя.
цвет. Эти цвета вызваны возбужденными электронами, испускающими видимый свет.
когда они возвращаются в свое основное состояние в атомах.
Из группы
во-вторых, барий дает бледно-зеленый цвет пламени, а кальций дает кирпично-красное пламя.
цвет. Эти цвета вызваны возбужденными электронами, испускающими видимый свет.
когда они возвращаются в свое основное состояние в атомах.
Металлический магний горит ярко-белым светом при нагревании в пламя Бунзена. Этот свет производится из-за высокой температуры, достигаемой при горении металлического магния. Химическая реакция между магнием металла и кислорода, является сильно экзотермической реакцией. Распространенное заблуждение среди студентов, которые наблюдали это, состоит в том, что соединения магния дают ярко-белый цвет пламени. Это не вариант; атомы магния в пламя не излучает видимого света, и цвет пламени не наблюдается.
Правильный ответ — вариант B.
Пламенные испытания обычно не используются для анализа смесей соединений, поскольку
пламя разных элементов может мешать друг другу. Это может быть
особенно сбивает с толку, когда смесь содержит различные типы металлических элементов
которые дают аналогичные результаты испытаний на пламя. Металлы лития, кальция и стронция
все элементы дают красное пламя, и бывает довольно трудно отличить
между ними. Было бы трудно попытаться обнаружить присутствие двух или
три из этих элементов, если бы мы анализировали цвет только
одно пламя.
Это может быть
особенно сбивает с толку, когда смесь содержит различные типы металлических элементов
которые дают аналогичные результаты испытаний на пламя. Металлы лития, кальция и стронция
все элементы дают красное пламя, и бывает довольно трудно отличить
между ними. Было бы трудно попытаться обнаружить присутствие двух или
три из этих элементов, если бы мы анализировали цвет только
одно пламя.
Металлические элементы из бария и меди также дают одинаковые цвета пламени. Элементы бария и меди дают пламя зеленого цвета, хотя интересно отметить, что барий имеет тенденцию делать более бледно-зеленое пламя, которое не сохраняться очень долго. Таким образом, испытание пламенем не является точным испытанием на определение металлических элементов, и другие качественные тесты могут быть необходимы для подтвердить подлинность металлического элемента.
Пример 5: Объяснение ограничений испытания пламенем
При растворении щелочного металла в соляной кислоте и анализе
при испытании пламенем наблюдается интенсивное оранжевое пламя. Почему может больше
необходима информация для подтверждения личности металла в
пример?
Почему может больше
необходима информация для подтверждения личности металла в
пример?
- Оранжевый цвет трудно отличить от цвета пламя Бунзена.
- Оранжевый цвет пламени обусловлен ионами хлора.
- Щелочной металл, вызывающий оранжевое пламя, может присутствовать в виде загрязнитель.
- Оранжевый цвет пламени обусловлен растворителем.
- Более чем один щелочной металл дает оранжевое пламя в пламени контрольная работа.
Ответ
Все щелочные металлы дают характерный цвет пламени при испытании пламенем. Пламя Бунзена должно быть несветящимся и иметь бледно-голубой цвет. Это достигается за счет того, что отверстие для воздуха на горелке Бунзена полностью открыто. Цвета, производимые щелочными металлами, весьма различны по сравнению с
к несветящемуся пламени Бунзена. Литий описывается как красный или малиновый. Натрий дает сильный желтый или золотисто-желтый цвет. Калий описан
как бледно-фиолетовый, сиреневый или розовый. Рубидий выглядит как красновато-фиолетовое пламя.
а цезий описывается как от синего до фиолетового. У нас не было бы проблем
отличая эти цвета от цвета пламени Бунзена.
Калий описан
как бледно-фиолетовый, сиреневый или розовый. Рубидий выглядит как красновато-фиолетовое пламя.
а цезий описывается как от синего до фиолетового. У нас не было бы проблем
отличая эти цвета от цвета пламени Бунзена.
Растворитель, соляная кислота, выбирают таким образом, чтобы он обеспечивал летучесть ионные хлориды. Ни растворитель, ни ионы хлора не излучают видимого света. свет в пламени. Это важное соображение, потому что мы не хотим интересующий цвет пламени должен быть замаскирован другими цветами.
Единственным щелочным металлом, дающим интенсивное оранжевое пламя, является натрий. Если в образце или на
платиновая проволока, характерный цвет пламени натрия часто является единственным, что
наблюдаемый. Это верно, когда натрий присутствует в качестве загрязняющего вещества. Интенсивный
цвет от золотисто-желтого до оранжевого может маскировать другие цвета, которые могут быть получены
присутствуют ионы других металлов. Могут потребоваться дополнительные тесты, чтобы определить, является ли
в образце присутствуют ионы других металлов.
Могут потребоваться дополнительные тесты, чтобы определить, является ли
в образце присутствуют ионы других металлов.
Правильным утверждением является вариант C.
Ключевые моменты
- Испытания пламенем проводятся для идентификации атомов металлов, которые могут присутствовать в образец неизвестного соединения.
- Соляная кислота используется для очистки инертной проволоки и образования летучих металлов хлористых солей перед введением образцов в пламя.
- Процесс определения огневого испытания описывается как ряд шагов с участием металлической проволоки.
- Цвет пламени создается энергично возбужденными электронами, высвобождающими энергии видимого света, когда они возвращаются на более низкие энергетические уровни.
- Возможная идентичность атома металла может быть установлена путем сопоставления
цвет, производимый атомом металла в несветящемся пламени горелки Бунзена, к
цвета, производимые известными солями металлов.

- Только определенное количество атомов металла дает цвет пламени. Большинство из них s-блок металлы, находящиеся в группе 1 и группе 2 периодической таблицы.
- Невозможно анализировать смеси соединений с помощью этого метода, так как цвета пламени, создаваемые несколькими металлами, могут мешать друг другу, давая ложный результат.
Тесты на пламя — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 3673
На этой странице описывается, как выполнить испытание пламенем для ряда ионов металлов, и кратко обсуждается, как возникает цвет пламени. Испытания пламенем используются для определения присутствия относительно небольшого количества ионов металлов в соединении. Не все ионы металлов окрашивают пламя. Для соединений группы 1 испытания пламенем обычно являются самым простым способом определения того, какой металл у вас есть. Для других металлов обычно существуют другие простые и более надежные методы, но испытание пламенем может дать полезную подсказку, где искать.
Не все ионы металлов окрашивают пламя. Для соединений группы 1 испытания пламенем обычно являются самым простым способом определения того, какой металл у вас есть. Для других металлов обычно существуют другие простые и более надежные методы, но испытание пламенем может дать полезную подсказку, где искать.
Практические сведения о проведении испытаний пламенем
- Очистите платиновую или нихромовую (никелево-хромовый сплав) проволоку, погрузив ее в концентрированную соляную кислоту, а затем подержав в горячем пламени Бунзена. Повторяйте это до тех пор, пока проволока не перестанет окрашиваться в пламя.
- Когда проволока станет чистой, снова смочите ее в кислоте, а затем опустите в небольшое количество испытуемого твердого вещества так, чтобы часть прилипла к проволоке.
 Поместите проволоку обратно в пламя.
Поместите проволоку обратно в пламя. - Если цвет пламени слабый, часто бывает полезно снова окунуть проволоку в кислоту и поместить ее обратно в пламя, как будто очищая ее. Это должно произвести очень короткую, но интенсивную вспышку цвета.
На самом деле, если вы используете нихром, в пламени всегда будет оранжевый след. Платина намного лучше в использовании, но она намного, намного дороже. Если у вас есть особенно грязный кусок нихромовой проволоки, вы можете просто отрезать конец. С платиной так не поступишь! Разбавленную соляную кислоту можно использовать вместо концентрированной кислоты из соображений безопасности, но она не всегда дает такие интенсивные цвета пламени.
Цвета в таблице \(\PageIndex{1}\) приведены только для справки. Почти все видят и описывают цвета по-разному. Я, например, несколько раз использовал слово «красный» для описания цветов, которые могут сильно отличаться друг от друга. Другие люди используют такие слова, как «кармин», «малиновый» или «алый», но не все знают разницу между этими словами, особенно если их родной язык не английский.
| Элемент | цвет пламени |
|---|---|
| Литий | красный |
| Натрий | сильный, стойкий оранжевый |
| Калий | сиреневый (розовый) |
| Рубидий | красный (красно-фиолетовый) |
| Цезий | синий/фиолетовый (см. ниже) |
| Кальций | оранжево-красный |
| Стронций | красный |
| Барий | бледно-зеленый |
| Медь | сине-зеленый (часто с белыми вспышками) |
| Свинец | серо-белый |
Что делать, если у вас есть красный цвет пламени для неизвестного соединения и вы не знаете, какой из различных красных это? Возьмите образцы известных соединений лития, стронция (и т. д.) и повторите испытание пламенем, сравнивая цвета, производимые одним из известных соединений и неизвестным соединением, пока не получите хорошее совпадение.
д.) и повторите испытание пламенем, сравнивая цвета, производимые одним из известных соединений и неизвестным соединением, пока не получите хорошее совпадение.
Происхождение цветов пламени
Если вы возбуждаете атом или ион очень сильным нагревом, электроны могут быть переведены из своего нормального невозбужденного состояния на более высокие орбитали. Когда они падают обратно на более низкие уровни (однократно или в несколько этапов), энергия высвобождается в виде света. Каждый из этих скачков включает в себя определенное количество энергии, высвобождаемой в виде световой энергии, и каждый соответствует определенной длине волны (или частоте). В результате всех этих скачков получится спектр линий, часть из которых окажется в видимой части спектра. Цвет, который вы видите, будет комбинацией всех этих отдельных цветов.
В случае ионов натрия (или другого металла) скачки связаны с очень высокими энергиями, что приводит к появлению линий в УФ-части спектра, невидимых вашим глазам. Скачки, которые вы можете увидеть в тестах на пламя, происходят от электронов, падающих с более высокого на более низкий уровень в металле атомов . Итак, если, например, вы поместите хлорид натрия, содержащий ионы натрия, в пламя, откуда берутся атомы? В горячем пламени некоторые ионы натрия возвращают свои электроны, чтобы снова образовать нейтральные атомы натрия. Атом натрия в невозбужденном состоянии имеет структуру 1s 2 2s 2 2p 6 3s 1 , но внутри пламени будут всевозможные возбужденные состояния электронов. Знакомый яркий оранжево-желтый цвет пламени натрия возникает из-за того, что активированные электроны падают с уровня 3p 1 на свой нормальный уровень 3s 1 .
Скачки, которые вы можете увидеть в тестах на пламя, происходят от электронов, падающих с более высокого на более низкий уровень в металле атомов . Итак, если, например, вы поместите хлорид натрия, содержащий ионы натрия, в пламя, откуда берутся атомы? В горячем пламени некоторые ионы натрия возвращают свои электроны, чтобы снова образовать нейтральные атомы натрия. Атом натрия в невозбужденном состоянии имеет структуру 1s 2 2s 2 2p 6 3s 1 , но внутри пламени будут всевозможные возбужденные состояния электронов. Знакомый яркий оранжево-желтый цвет пламени натрия возникает из-за того, что активированные электроны падают с уровня 3p 1 на свой нормальный уровень 3s 1 .
Точные размеры возможных скачков в энергетическом выражении варьируются от одного металла к другому. Это означает, что каждый отдельный металл будет иметь разный рисунок спектральных линий и, следовательно, разный цвет пламени. Цвета пламени образуются в результате движения электронов в ионах металлов, присутствующих в соединениях. Например, ион натрия в невозбужденном состоянии имеет электронную конфигурацию 1s 2 2s 2 2p 6 . При нагревании электроны получают энергию и могут быть возбуждены на любой из пустых орбиталей с более высокой энергией — 7s, 6p, 4d или любой другой, в зависимости от количества энергии, которое конкретный электрон поглощает из пламени. Поскольку электрон теперь находится на более высоком и энергетически нестабильном уровне, он падает обратно на исходный уровень, но не обязательно за один переход.
Это означает, что каждый отдельный металл будет иметь разный рисунок спектральных линий и, следовательно, разный цвет пламени. Цвета пламени образуются в результате движения электронов в ионах металлов, присутствующих в соединениях. Например, ион натрия в невозбужденном состоянии имеет электронную конфигурацию 1s 2 2s 2 2p 6 . При нагревании электроны получают энергию и могут быть возбуждены на любой из пустых орбиталей с более высокой энергией — 7s, 6p, 4d или любой другой, в зависимости от количества энергии, которое конкретный электрон поглощает из пламени. Поскольку электрон теперь находится на более высоком и энергетически нестабильном уровне, он падает обратно на исходный уровень, но не обязательно за один переход.
Электронные переходы, которые давали линии в видимом спектре, происходили с участием атомов, а не ионов.
Авторы и авторство
Flame Tests распространяется по незаявленной лицензии, автором, ремиксом и/или куратором является LibreTexts.

 01.2010 19:34
Ответить
01.2010 19:34
Ответить Например, соли кобальта с тиоцианатом аммония могут дать синее окрашивание.
Например, соли кобальта с тиоцианатом аммония могут дать синее окрашивание.