Ответы | Лаб. 2. Качественная реакция на хлорид-ионы — Химия, 9 класс
1. Результаты исследования занесите в таблицу.
Раствор вещества – хлороводородная кислота
Реактив – нитрат серебра (I)
На рисунке:
левая пробирка – HCl
верхняя пробирка – AgNO3
правая пробирка – AgCl
Признак реакции: выпадение белого осадка хлорида серебра (I).
Раствор вещества – хлорид натрия
На рисунке:
левая пробирка – NaCl
верхняя пробирка – AgNO3
правая пробирка – AgCl
Признак реакции: выпадение белого осадка хлорида серебра (I).
2. Исследуйте, содержит ли хлорид-ионы минеральная вода, которую вы употребляете в пищу. Прилейте несколько капель нитрата серебра (I) к вашему образцу. Что вы наблюдаете? Обнаружены ли хлорид-ионы в минеральной воде?
Минеральная вода совсем немного помутнела. Это значит, что в минеральной воде есть хлорд-ионы.
3.
 Составьте уравнения реакций обнаружения хлорид-ионов в растворах в молекулярном , полном и сокращенном ионном виде:
Составьте уравнения реакций обнаружения хлорид-ионов в растворах в молекулярном , полном и сокращенном ионном виде:
б) хлорид натрия + нитрат серебра (I)
Вывод
Обнаружить хлорид-ионы в растворах можно при помощи нитрата серебра (I) – это качественная реакция на ионы хлора. Выпадение осадка обусловлено связыванием ионов хлора с ионами серебра, которые вместе образуют нерастворимый осадок.
4.
 Задания
Задания
1.Из приведённых формул CO32-, Cl—, NO3—, K+, I— , Br— выберите и подчеркните формулы галогенид-ионов.
2.Из приведённых формул ионов H+, Cl—, Na+, F— выберите и подчеркните ион, который можно обнаружить в растворе с помощью нитрата серебра (I).
3.Укажите правильное утверждение:
Ион хлора:
г) в растворах можно обнаружить по реакции с ионами серебра
4. Укажите формулу иона: «В строении иона ан 17 протонов приходится 18 электронов, в электрическом поле он перемещается к аноду, не изменяет окраску индикаторов, в растворе с ионами серебра образует белый творожистый осадок». Это Cl—.
Укажите формулу иона: «В строении иона ан 17 протонов приходится 18 электронов, в электрическом поле он перемещается к аноду, не изменяет окраску индикаторов, в растворе с ионами серебра образует белый творожистый осадок». Это Cl—.
5.Имеется раствор, содержащий нитрат натрия и хлорид натрия. Предложите порядок действий, который позволит оставить в растворе только одну соль. Какую?
В раствор добавим нитрат серебра (I). В результате произойдет реакция между нитратом серебра (I) и хлоридом натрия. В результате выпадет осадок хлорида серебра (I). В растворе останется соль нитрата натрия.
Растворы нитрата серебра, фосфата натрия и хлорида натрия
В трех пронумерованных склянках без этикеток находятся растворы нитрата серебра, фосфата натрия и хлорида натрия. Как, не имея других реактивов, определить, какой раствор находится в каждой склянке? Напишите уравнения реакций, составьте ионные уравнения. Ответ
Как, не имея других реактивов, определить, какой раствор находится в каждой склянке? Напишите уравнения реакций, составьте ионные уравнения. ОтветПопарно сливать небольшие количества содержимых пробирок.
| Нитрат серебра | Фосфат натрия | |
|---|---|---|
| Нитрат серебра | ||
| Фосфат натрия |
Наблюдается выпадение белого осадка 3AgNO3 + Na3PO4 = 3NaNO3 + Ag3PO4↓ 3Ag+ + 3NO 3Ag+ + PO43- = Ag3PO4↓ |
|
| Хлорид натрия |
Наблюдается выпадение белого осадка AgNO3 + NaCl = NaNO3 + AgCl↓ Ag+ + NO3— + Na+ + Cl— = Na+ + NO3— + AgCl↓ Ag+ + Cl— = AgCl↓ |
Изменений не наблюдается |
gomolog. ru
ru
gomolog.ru11https://gomolog.ru/reshebniki/9-klass/zadachnik-kuznecova-2020/5-15.html
Хлорид калия+нитрат серебра — Документ
Хлорид калия+нитрат серебра
Гидроксид калия+ нитрат меди(II)
Сульфат натрия+ нитрат бария
Сульфат алюминия+ хлорид бария
Азотная кислота+ гидроксид железа(III)
Гидроксид бария+ ортофосфорная кислота
Магний+ кислород
Железо+ сульфат меди(II)
Оксид лития + вода
Сернистая кислота
Серная кислота+ алюминий
Фосфорная кислота+ оксид цинка
Гидроксид калия + гидроксид железа(III)
Гидроксид калия + хлорид железа(III)
Гидроксид калия+ сульфат меди(II)
Сульфат алюминия+ хлорид бария
Сульфат магния+ хлорид натрия
Фосфат натрия+ нитрат алюминия
Оксид углерода(II)+оксид железа(III)
Оксид меди(II)+ водород
Вода+оксид хрома(III)
Нитрат цинка+карбонат натрия
Сульфат цинка
Сульфид натрия+ сульфат калия
Вода+оксид серы(IV)
Цинк+ сульфат меди(II)
Нитрат серебра+сероводород
Гидроксид цинка+ гидроксид натрия
Вариант 1
1. Из приведенного списка
выпишите формулы солей и назовите их:
K2SO4,
Na2O,
CO2,
NaOH, CaCO3,
Cu(OH)2,
H2SO4,
AgCl, N2O5,
Fe2O3,
Ba(OH) 2,
HCl.
Из приведенного списка
выпишите формулы солей и назовите их:
K2SO4,
Na2O,
CO2,
NaOH, CaCO3,
Cu(OH)2,
H2SO4,
AgCl, N2O5,
Fe2O3,
Ba(OH) 2,
HCl.
2.Приведите три реакции, иллюстрирующие химические свойства оксида серы(VI).
3.Запишите уравнения реакций, изображенные в виде схемы:
Na NaOH Na2SO4 CaSO4
Какие из реакций будут протекать? Запишите их уравнения.
Ba + HCl
CO2 + KOH
NaNO3 + K2SO4
Ca(NO3)2 + Na2CO3
Получите из хлорида бария карбонат бария.
Получите из сульфата цинка нитрат цинка.
7. С какими из веществ,
приведенных ниже, реагирует соляная
кислота? Напишите уравнения реакций.
Cu,
CuO,
Fe(OH)3,
CaCO3
С какими из веществ,
приведенных ниже, реагирует соляная
кислота? Напишите уравнения реакций.
Cu,
CuO,
Fe(OH)3,
CaCO3
Вариант 2
Изприведенногоспискавыпишитеформулы оснований иназовитеих: K2SO4, Na2O, CO2, NaOH, CaCO3, Cu(OH)2, H2SO4, AgCl, N2O5, Fe2O3, Ba(OH)2, HCl. Формулы щелочей подчеркните.
Приведите три реакции, иллюстрирующие химические свойства оксида кальция.
Запишите уравнения реакций, изображенные в виде схемы:
S H2SO4Na2SO4 NaCl
Какие из реакций будут протекать? Запишите их уравнения.
CuO + HCl
SO3 + CO2
BaCl2 + K2SO3
H2SO4 + Na2CO3
Получите из хлорида натрия хлорид свинца.

Получите из сульфата железа(II) хлорид железа(II).
7.С какими из веществ, приведенных ниже, реагирует гидроксид натрия? Напишите уравнения реакций. CuO, CO2, Ba(OH)2, CuCl2, H2SO4.
Вариант 3
Из приведенного списка выпишите формулы кислот и назовите их: K2SO4, Na2O, CO2, NaOH, CaCO3, Cu(OH)2, H2SO4, AgCl, N2O5, Fe2O3, Ba(OH)2, HCl.
Приведите три реакции, иллюстрирующие химические свойства гидроксида железа (III).
Запишите уравнения реакций, изображенные в виде схемы:
Ca CaO CaCl2Ca(NO3)2
Какие из реакций будут протекать? Запишите их уравнения.

Na + H2O
NaCl + K2CO3
Fe(NO3)2 + K2S
N2O5 + NaOH
Получите из нитрат меди(II) из карбоната меди(II).
Получите оксид магния из хлорида магния.
С какими из веществ, приведенных ниже, реагирует серная кислота? Напишите уравнения реакций. Fe, SiO2, Cu(OH)2, BaSO3, CaSO4.
Вариант 4
Из приведенного списка выпишите формулы оксидов и назовите их: K2SO4, Na2O, CO2, NaOH, CaCO3, Cu(OH)2, H2SO4, AgCl, N2O5, Fe2O3, Ba(OH)2, HCl. Формулы кислотных оксидов подчеркните.
Приведите три реакции, иллюстрирующие химические свойства азотной кислоты.

Запишите уравнения реакций, изображенные в виде схемы:
Cu CuO Cu(NO3)2 Cu(OH)2
Какие из реакций будут протекать? Запишите их уравнения.
SO2 + H2O
Mg(OH)2 + HNO3
NaNO3 + K2S
CuSO4 + NaOH
Получите хлорид натрия из карбоната натрия.
Получите сульфат цинка из хлорида цинка.
7.С какими из веществ, приведенных ниже, реагирует гидроксид кальция? Напишите уравнения реакций. Fe, СO2, Cu(OH)2, Na2SO3, Н2SO4.
Вычисление массовой доли нитрата натрия
Иногда в тестах ЕГЭ встречаются задачи, в которых при расчете массы конечного раствора необходимо учитывать выпавшее в осадок вещество.
Для наглядности все условие задачи удобно отобразить в виде рисунка:
В условии указана информация, позволяющая определить количество вещества каждого из исходных участников реакции. Следовательно, сначала необходимо определить, какое вещество дано в недостатке, и далее по нему вести расчет. Кроме того, при определении массы конечного раствора следует учесть, что АgС1 выводиться из состава раствора в виде осадка.
Алгоритм решения данной задачи можно отразить следующей схемой:
1. Находим массу и количество вещества аNaС1 в первом исходном растворе:
2. Находим массу и количество вещества AgNO3 во втором исходном растворе:
3. Находим, какое вещество дано в недостатке.
Выберем за основу хлорид натрия и определим по уравнению реакции количество АgNО3, которое необходимо для расходования 0,1 моль NаС1.
Составляем пропорцию:
на 0,1 моль NаС1 должно расходоваться х моль АgNО3 (по условию)
на 1 моль МаС1 полностью расходуется 1 моль
АgNО3 (по уравнению)АgNО3 необходимо для полного расходования всего NаС1.
| n(АgNОз) необходимо | n(АgNОз) дано по условию |
| 0,1 моль > 0,015 моль | |
Нитрат серебра находится в недостатке и расходуется весь в процессе реакции. Поэтому дальнейшие расчеты по уравнению реакции будем проводить по количеству АgNО3.
4. По уравнению реакции, используя полученные значения количества вещества АgNО3, находим массу NaNО3 и АgС1:
5. Находим массовую долю NaNО3 в конечном растворе:
Масса раствора будет складываться из суммы масс исходных двух растворов, из которой вычтена масса осадка АgСl:
mкон. р-ра = mисх. р-ра(NaCl) + mисх. р-ра(AgNO3) – m(AgCl) =
= 1170 + 1275 – 2,15 = 2442,85 г.
Подставляем все данные в соотношение для массовой доли NaNО3:
Ответ: (NaNO3)в кон. р-ре = 0,052%.
р-ре = 0,052%.
Хлорид серебра, характеристика, свойства и получение, химические реакции
Хлорид серебра, характеристика, свойства и получение, химические реакции.
Хлорид серебра – неорганическое вещество, имеет химическую формулу AgCl.
Краткая характеристика хлорида серебра
Физические свойства хлорида серебра
Получение хлорида серебра
Химические свойства хлорида серебра
Химические реакции хлорида серебра
Применение и использование хлорида серебра
Краткая характеристика хлорида серебра:
Хлорид серебра – неорганическое вещество белого цвета. При плавлении становится оранжево-желтым. Застывая, расплав образует полупрозрачную массу, называемую в обиходе «роговое серебро».
Химическая формула хлорида серебра AgCl.
Хлорид серебра – неорганическое химическое соединение, соль хлороводородной (соляной) кислоты и серебра, бинарное соединение серебра и хлора.
Практически не растворяется в воде, ацетоне, этаноле, метаноле.
Кристаллогидратов не образует.
Негорюч. Пожаробезопасен.
В расплавленном виде хорошо пристает к стеклу, кварцу и металлам.
Хлорид серебра встречается в природе в виде минерала хлораргирита.
Физические свойства хлорида серебра:
| Наименование параметра: | Значение: |
| Химическая формула | AgCl |
| Синонимы и названия иностранном языке | silver chloride (англ.) серебро хлористое (рус.) хлораргирит (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | белые кубические кристаллы |
| Цвет | белый, при плавлении становится оранжево-желтым |
| Вкус | —* |
| Запах | без запаха |
Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм. ) ) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 5560 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 5,56 |
| Температура кипения, °C | 1550 |
| Температура плавления, °C | 455 |
| Молярная масса, г/моль | 143,32 |
| Растворимость в воде (10 oС), г/100 г | 0,00009 |
Получение хлорида серебра:
Хлорид серебра получают в результате следующих химических реакций:
- 1. взаимодействия нитрата серебра и хлорида калия:
AgNO3 + KCl → AgCl + KNO3.
В ходе реакции используется разбавленный раствор хлорида калия.
- 2. взаимодействия нитрата серебра и хлорида натрия:
AgNO3 + NaCl → AgCl + NaNO3.
В ходе реакции используется разбавленный раствор хлорида натрия.
- 3. взаимодействия нитрата серебра и хлорида кальция:
CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl.
- 4. взаимодействия серебра и хлорида железа (III):
Ag + FeCl3 → AgCl + FeCl2.
- 5. взаимодействия серебра и хлора:
2Ag + Cl2 → 2AgCl (t = 150-200 °C).
Химические свойства хлорида серебра. Химические реакции хлорида серебра:
Химические свойства хлорида серебра аналогичны свойствам хлоридов других металлов. Поэтому для него характерны следующие химические реакции:
1. реакция взаимодействия хлорида серебра и фтора:
2AgCl + 2F2 → 2AgF2 + Cl2.
В результате реакции образуются фторид серебра (II) и хлор.
2. реакция взаимодействия хлорида серебра и цинка:
2AgCl + Zn = ZnCl2 + 2Ag.
В результате реакции образуются хлорид цинка и серебро.
3. реакция взаимодействия хлорида серебра и оксида бария:
4AgCl + 2BaO → 2BaCl2 + 4Ag + O2 (t > 324°C).
В результате реакции образуются хлорид бария, серебро и кислород.
4. реакция взаимодействия хлорида серебра и гидроксида калия:
4AgCl + 4KOH → 4KCl + 4Ag + O2 + 2H2O (t > 450 °C).
В результате реакции образуются хлорид калия, серебро, кислород и вода.
5. реакция взаимодействия хлорида серебра и сульфида натрия:
2AgCl + Na2S → Ag2S + 2NaCl.
В результате реакции образуются сульфид серебра (II) и хлорид натрия.
6. реакция взаимодействия хлорида серебра и йодида натрия:
AgCl + NaI ⇄ AgI + NaCl.
В результате реакции образуются йодид серебра и хлорид натрия. Реакция носит обратимый характер.
Реакция носит обратимый характер.
7. реакция взаимодействия хлорида серебра и карбоната натрия:
4AgCl + 2Na2CO3 → 4Ag + 4NaCl + 2CO2 + O2 (t = 850-900 °C).
В результате реакции образуются серебро, хлорид натрия, оксид углерода (IV) и кислород.
8. реакция взаимодействия хлорида серебра и нитрата бария:
2AgCl + Ba(NO3)2 → BaCl2 + 2AgNO3 (kat = NH3).
В результате реакции образуются хлорид бария и нитрат серебра. Реакция протекает в растворе жидкого аммиака.
9. реакция взаимодействия хлорида серебра, пероксида водорода и гидроксида калия:
2AgCl + H2O2 + 2KOH → 2KCl + 2Ag + O2 + H2O.
В результате реакции образуются хлорид калия, серебро, кислород и вода.
10. реакция разложения хлорида серебра:
2AgCl → 2Ag + Cl2 (hv).
В результате реакции образуются серебро и хлор. Реакция протекает при комнатной температуре под действием светового излучения.
Применение и использование хлорида серебра:
Хлорид серебра используется во множестве отраслей промышленности и для бытовых нужд:
– как светочувствительный компонент фотографических эмульсий различных фотографических материалов;
– входит в состав антимикробных композиций на основе ионов серебра;
– в химической промышленности как реагент для получения сереброорганических соединений;
– как компонент электродов химических источников тока, электропроводящих стёкол;
– как материал для линз в ИК-спектроскопии.
Примечание: © Фото https://www.pexels.com, https://pixabay.com
карта сайта
хлорид серебра реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие хлорида серебра
реакции
Коэффициент востребованности 0
comments powered by HyperComments
Ссылка на источник
Ионный Реакции в растворе
Ионные соединения отличаются от соединений, содержащих только ковалентные связи. Последние существуют в виде молекул в чистом виде (кристаллы, жидкости) или в растворе. Первые представляют собой комбинацию двух разных типов частиц. Один вид (катионы) несут положительный заряд, а второй (анионы) — отрицательный. Хлорид натрия — типичное ионное соединение. Он существует не как единицы хлорида натрия, а как ионы натрия и ионы хлорида.В твердом состоянии эти ионы расположены в трехмерной решетке, причем один вид ионов чередуется с другим. В растворе ионы натрия и ионы хлора ведут себя независимо друг от друга.
Последние существуют в виде молекул в чистом виде (кристаллы, жидкости) или в растворе. Первые представляют собой комбинацию двух разных типов частиц. Один вид (катионы) несут положительный заряд, а второй (анионы) — отрицательный. Хлорид натрия — типичное ионное соединение. Он существует не как единицы хлорида натрия, а как ионы натрия и ионы хлорида.В твердом состоянии эти ионы расположены в трехмерной решетке, причем один вид ионов чередуется с другим. В растворе ионы натрия и ионы хлора ведут себя независимо друг от друга.
Рассмотрим конкретный пример такого независимого поведения. Предположим, у вас есть два решения. Один содержит ионы серебра и анион, соль серебра которого растворима. Второй содержит ионы хлора и катион, хлорид которого растворим. Когда два раствора объединяются, образуется белый осадок хлорида серебра.Мы можем написать уравнение реакции:
Ag + + Cl — AgCl ()
Остальные ионы все еще присутствуют в растворе, окружающем осадок
(надосадочная жидкость), но они не участвуют в реакции (см. рисунок
11.5а).
рисунок
11.5а).
Раньше мы писали уравнение иначе. Если предположить, что нитрат был анионом с серебром, а натрий — катионом с хлоридом, уравнение было бы следующим:
AgNO 3 + NaCl AgCl () + NaNO 3
Другой способ записать уравнение показывает ионные соединения в растворе как отдельные ионы:
Ag + + NO 3 — + Na + + Cl — AgCl () + Na + + НЕТ 3 —
Последнее уравнение ясно показывает, что в реакции принимают участие только ионы серебра и хлорида; ионы натрия и нитрата ничего не делают.Эти неучаствующие ионы называются
ионы-зрители,
Это означает, что они не участвуют в реакции — так же, как люди на трибунах на футбольном матче являются зрителями, то есть они не участвуют в игре. Лучшее уравнение реакции — это уравнение, которое показывает только участвующие ионы; такое уравнение называется
чистое ионное уравнение. Итоговое ионное уравнение реакции иона серебра с хлоридом имеет вид
Итоговое ионное уравнение реакции иона серебра с хлоридом имеет вид
Ag + + Класс — AgCl ()
Рассмотрим другую ситуацию.Когда кислота реагирует с гидроксидом, вода и образуются соли. Все кислоты выделяют ионы водорода в растворе. Гидроксидная композиция гидроксид-ионы. Ионы водорода и ионы гидроксида реагируют с образованием воды, ковалентной неионизированная молекула (см. рисунок 11.5b). В уравнение для этой реакции
H + + OH — H 2 O
Раньше мы бы записали эту реакцию нейтрализации, используя полные формулы.Например, уравнение реакции соляной кислоты с гидроксидом натрия будет выглядеть следующим образом:
HCl + NaOH NaCl + H 2 O
Переписав это уравнение, чтобы показать кислоту, гидроксид и соль в виде ионов — именно так эти соединения существуют в растворе, — получится уравнение
H + + Cl — + Na + + OH — Na + + Cl — + H 2 O
Это уравнение ясно показывает, что ионы водорода и гидроксида реагируют
и что ионы натрия и хлора являются ионами-наблюдателями. Они не появятся
в чистом ионном уравнении.
Они не появятся
в чистом ионном уравнении.
| РИСУНОК 11.5 (a) Когда раствор нитрата серебра добавляется к раствору хлорида натрия, ионы серебра объединяются с ионами хлорида с образованием осадка хлорида серебра. Ионы натрия и нитрата являются неучаствующими ионами-наблюдателями. (b) Когда соляная кислота добавляется к раствору нитрата калия, ионы водорода кислоты объединяются с ионами гидроксида гидроксида калия с образованием молекул воды.Ионы хлора и калия не участвуют в наблюдении. |
Чистые ионные уравнения также полезны для демонстрации реакций замещения. Когда магний добавляется к кислоте, образуются газообразный водород и ионы магния. Это утверждение дает нам достаточно информации, чтобы написать уравнение
мг + 2 ч + Мг 2+ + H 2
Опять же, идентичность аниона кислоты не важна.Он присутствует как ион-наблюдатель, и его не нужно показывать в уравнении.
Как и все уравнения, чистые ионные уравнения должны быть сбалансированы. Раньше нас интересовало только уравновешивание уравнений по количеству и типу атомов. Теперь мы также должны быть уверены, что уравнения уравновешиваются зарядом; то есть общий заряд реагентов должен равняться общему заряду продуктов.
Пример: а.Напишите чистое ионное уравнение образования нерастворимого соединения сульфид меди (II). г. Напишите чистое ионное уравнение образования осадка фосфат кальция. Для каждой реакции назовите соответствующие ионы-наблюдатели. Решение а. Формула сульфида меди (II) — CuS. Катион — Cu 2+ ; анион S 2-. чистое ионное уравнение для образование Cus показало бы только эти два иона. Cu 2+ + S 2- CuS Какой бы ни был анион с Cu 2+ и любым катионом
с S 2-; в реагентах не принимают участие
реакции и являются ионами-наблюдателями. г. Формула фосфата кальция: Ca 3 (PO 4 ) 2 . Катион — Ca 2+ ; анион PO 4 3-. Чистое ионное уравнение 3 Ca 2+ + 2 PO 4 3- Ca 3 (PO 4 ) 2 Обратите внимание, что чистый заряд реагентов равен нулю, как и заряд продукта. Подходящими ионами-спектрометрами могут быть нитрат в виде аниона, натрий в качестве катиона. |
Чистые ионные уравнения могут быть выведены из полных уравнений. Полное уравнение
написано первым. Он исследуется, чтобы определить, было ли изменение
по степеням окисления. Если такое изменение произошло, эти ионы или молекулы
которые содержат атомы, изменяющие степень окисления, изолированы для чистого ионного
уравнение. Если степень окисления не меняется, продукты исследуются, чтобы найти
образовалось ли ковалентное соединение.Если так, ионы, которые объединились, чтобы сформировать
эта молекула изолирована для чистого ионного уравнения. Если все продукты
ионный, и степени окисления не произошло, один из продуктов должен быть
осадок. Правила растворимости в таблице 8.3 используются для определения того, какие
продукт представляет собой осадок, а содержащиеся в нем ионы изолируются для чистой
ионное уравнение.
Если такое изменение произошло, эти ионы или молекулы
которые содержат атомы, изменяющие степень окисления, изолированы для чистого ионного
уравнение. Если степень окисления не меняется, продукты исследуются, чтобы найти
образовалось ли ковалентное соединение.Если так, ионы, которые объединились, чтобы сформировать
эта молекула изолирована для чистого ионного уравнения. Если все продукты
ионный, и степени окисления не произошло, один из продуктов должен быть
осадок. Правила растворимости в таблице 8.3 используются для определения того, какие
продукт представляет собой осадок, а содержащиеся в нем ионы изолируются для чистой
ионное уравнение.
Пример: Напишите чистое ионное уравнение для следующего: а.реакция между нитратом серебра и сульфатом калия г. реакция серной кислоты с гидроксидом натрия г. отделение брома от бромида натрия хлором Решение а. Степень окисления не изменилась. Ни один из продуктов не является ковалентным.
Согласно правилам растворимости сульфат серебра нерастворим.Изоляция
ионы, которые он содержит, дает чистое ионное уравнение , в котором мы вычеркнули неучаствующие ионы или ионы-наблюдатели. г. Полное уравновешенное уравнение реакции показаны степени окисления, и никто не изменился. Вода ковалентна, остальные соединения ионны.Итоговое ионное уравнение реакции должно быть. Написание полного уравнения в ионной форме дает: , а вычеркивание видимых ионов показывает, что наш выбор для чистого ионное уравнение было правильным. г. Полное уравнение реакции имеет вид Из степени окисления мы видим, что и бром, и хлорид имеют
изменена степень окисления. Полное ионное уравнение Вычеркнутые ионы натрия-наблюдателя дают такое же чистое ионное уравнение. |
конспектов лекций Джона Штрауба
конспектов лекций Джона ШтраубаОсаждение хлорида серебра из раствора
Капли бесцветного раствора добавляются в мерный цилиндр неподвижного и бесцветного раствора, образуя плавающее облако из белого осадка и следы «дождя».
Состав: нитрат серебра, хлорид натрия, мерный цилиндр.
Процедура: Ниже приводится частичный рецепт.
1. Приготовьте раствор нитрата серебра в мерном цилиндре.
2. Приготовьте раствор хлорида натрия.
3. Аккуратно добавьте в цилиндр капли раствора хлорида натрия и наблюдайте.
Понимание: Правила растворимости гласят, что соли нитратов растворимы в воде, и нитрат серебра не исключение. Когда раствор растворимой соли нитрата серебра (I) объединяют с раствором растворимой соли хлорида натрия, образуется белый осадок хлорида серебра (I).
Когда раствор растворимой соли нитрата серебра (I) объединяют с раствором растворимой соли хлорида натрия, образуется белый осадок хлорида серебра (I).
Ag + (водн.) + Cl — (водн.) → AgCl (s) (белый) K sp = a Ag + a Cl —
Основная часть осадка представляет собой взвешенное облако белого твердого вещества. При правильных условиях внутри облака образуются маленькие кристаллы хлорида серебра. Кристаллы более плотные, чем окружающий раствор, и проливают дождь , образуя след из белого хлорида серебра позади, как след от пути осадка.Обращает на себя внимание выпадение хлорида серебра. В то время как правила растворимости гласят, что большинство галогенидных солей растворимы, хлорид серебра — нет. Другие галогенидные соли, которые, в частности, только слабо растворимы , включают Hg 2 Cl 2 и PbI 2 .
Под воздействием света хлорид серебра разлагается на серое металлическое серебро и хлор. Светочувствительность хлорида серебра и других галогенидов серебра, таких как бромид серебра и йодид серебра, составляет основу фотографического процесса.
Светочувствительность хлорида серебра и других галогенидов серебра, таких как бромид серебра и йодид серебра, составляет основу фотографического процесса.
Применение нитрата серебра в медицине
Вопрос: Многие годы глаза новорожденных обрабатывали раствором нитрата серебра. Зачем?Вы можете проверить свои ответы здесь.
Растворение хлорида серебра
Вопрос: Хотя хлорид серебра нерастворим в водном растворе, обнаружено, что он растворим в водном растворе после добавления аммиака, тиосульфата натрия или цианида калия.Изобразите структуры Льюиса для молекулы аммиака, тиосульфат-иона и цианид-иона.Охарактеризуйте реакции ионов серебра с ионами аммиака, тиосульфата или цианида. Определите каждый вид как кислоту Льюиса или основание Льюиса.
Вы можете проверить свои ответы здесь.
Как определить хлорид-ионы в растворах для обработки железа с использованием нитрата серебра — Примечания Канадского института охраны природы (CCI) 4/5
Наука, лежащая в основе теста на хлорид-ионы
Взаимодействие нитрата серебра с хлорид-ионами
Когда соль, такая как хлорид натрия (NaCl), растворяется в воде, ионы, составляющие соль, рассеиваются в растворе, но только до определенного предела (называемого растворимостью). Если мы попытаемся получить раствор, в котором этот предел будет превышен, ионы будут объединяться в твердую соль. Образовавшееся твердое вещество называется осадком. Ключом к тесту в этой процедуре является низкая растворимость хлорида серебра в воде.
Если мы попытаемся получить раствор, в котором этот предел будет превышен, ионы будут объединяться в твердую соль. Образовавшееся твердое вещество называется осадком. Ключом к тесту в этой процедуре является низкая растворимость хлорида серебра в воде.
Большинство хлоридных солей хорошо растворимы в воде (Weast 1974). Например, хлорид натрия имеет растворимость 357 г / л при 0 ° C, что соответствует концентрации хлорид-иона 220 000 ppm. С другой стороны, хлорид серебра — одна из немногих хлоридных солей, которые обладают низкой растворимостью: 0.89 мг / л при 10 ° C или концентрации хлорид-иона 0,22 ppm.
Когда раствор, содержащий ионы серебра (Ag + ), добавляется к раствору, содержащему ионы хлорида (Cl — ), образуется белый осадок хлорида серебра (AgCl), если концентрация ионов хлора не очень низкая. Реакция записывается как:
Cl — (водный) + Ag + (водный) → AgCl (белое твердое вещество)
Чем выше начальные концентрации ионов серебра и хлорида, тем больше будет образовываться осадок.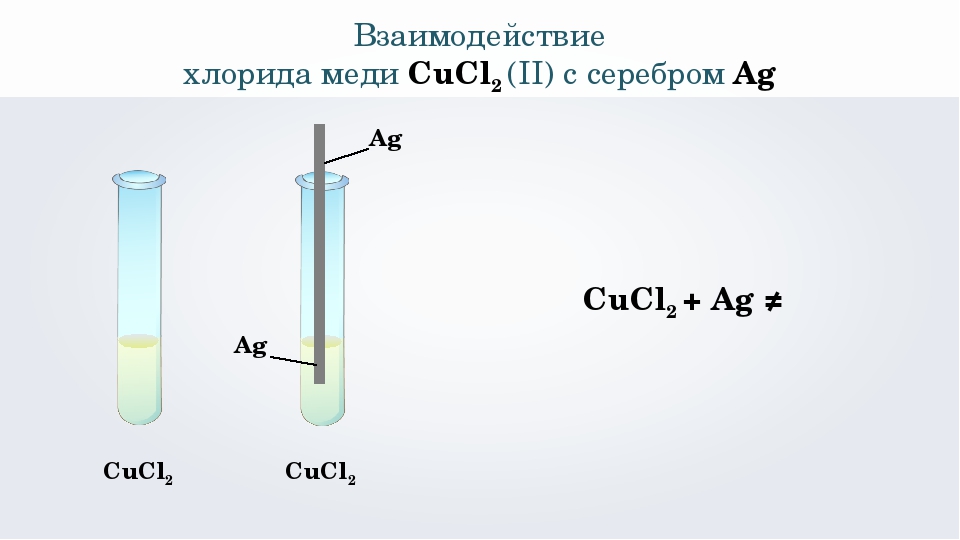
Определение частей на миллион (ppm)
Концентрация хлорид-иона часто указывается в частях на миллион (ppm). Части на миллион — это единица концентрации, определяемая как масса растворенного вещества (добавляемого иона или соединения), деленная на массу раствора (после добавления иона или соединения), а затем умноженная на один миллион (10 6 ). Распространенное предположение для разбавленных водных растворов состоит в том, что добавленные ионы не изменяют плотность воды, так что раствор имеет ту же плотность, что и чистая вода при комнатной температуре (приблизительно 1 г / мл) (Skoog et al.2014, стр. 72). При таком предположении определение ppm упрощается до:
Обратите внимание, что растворенным веществом является хлорид-ион. Это означает, что раствор хлорид-иона с концентрацией 1 ppm содержит 1 миллиграмм (мг) хлорид-иона на литр (л) раствора.
При приготовлении 100 мл (0,1 л) раствора A (3000 частей на миллион) в этой процедуре отмеряется 0,49 г хлорида натрия. Хлорид натрия содержит 39,3% натрия и 60,7% хлорида по весу, как определено из атомного веса натрия (22.99 г / моль) и хлора (35,45 г / моль). Это означает, что при растворении хлорида натрия в растворе имеется 0,30 г (300 мг) ионов хлора и 0,19 г ионов натрия. Таким образом, концентрация хлорид-ионов в миллионных долях равна 300 мг, деленному на 0,1 л, что составляет 3000 частей на миллион (а не 4900 частей на миллион).
Хлорид натрия содержит 39,3% натрия и 60,7% хлорида по весу, как определено из атомного веса натрия (22.99 г / моль) и хлора (35,45 г / моль). Это означает, что при растворении хлорида натрия в растворе имеется 0,30 г (300 мг) ионов хлора и 0,19 г ионов натрия. Таким образом, концентрация хлорид-ионов в миллионных долях равна 300 мг, деленному на 0,1 л, что составляет 3000 частей на миллион (а не 4900 частей на миллион).
Чтобы получить представление о масштабе частей на миллион, представьте, сколько хлорида натрия содержится в 10 мл раствора с 10 миллионными долями хлорид-ионов. Этот объем содержит 0,1 мг хлорид-ионов, а 0.065 мг ионов натрия, или 0,165 мг хлорида натрия, слишком мало для взвешивания на лабораторных весах. Эта масса соответствует кубу хлорида натрия со стороной 0,42 мм, что примерно равно крупинке соли.
Почему растворы образцов подкисляются
Растворы подкисляются разбавленной азотной кислотой для предотвращения осаждения некоторых солей серебра, кроме хлорида серебра, при добавлении нитрата серебра.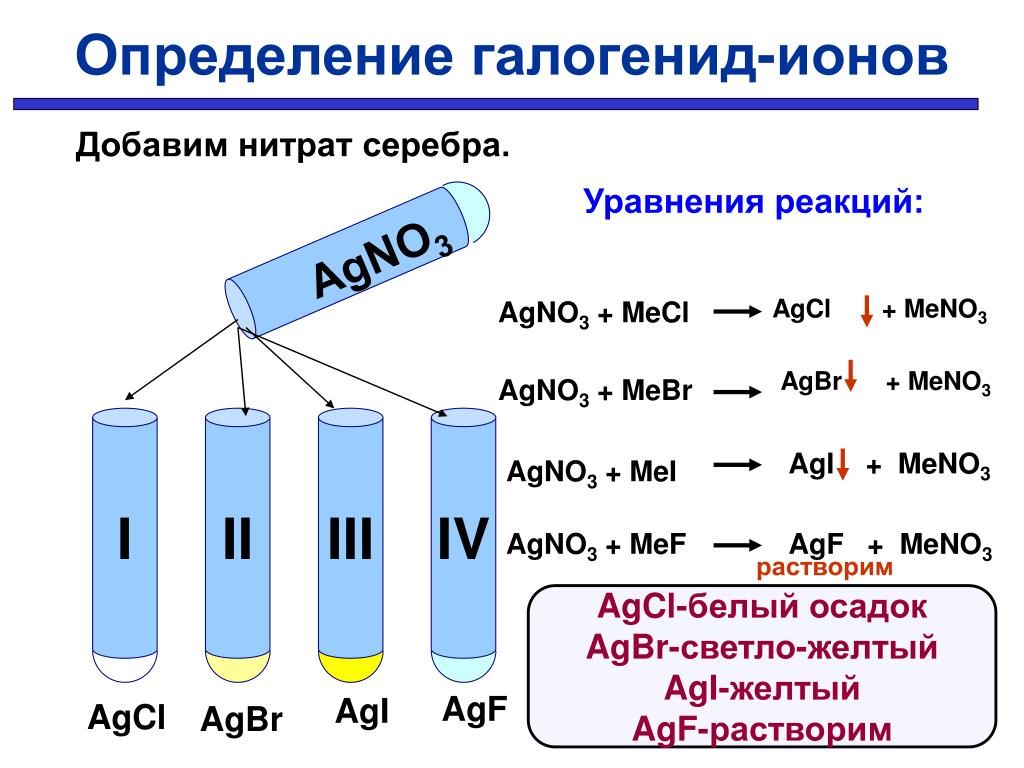 В нейтральных растворах может образоваться фосфат серебра или карбонат серебра, если присутствует достаточное количество ионов фосфата или карбоната (Bassett et al.1978). Если тестовый раствор имеет pH более 8, ионы серебра из нитрата серебра реагируют с ионами гидроксила (OH —) с образованием гидроксида серебра (AgOH) или оксида серебра (Ag 2 O). Реакция с гидроксильными ионами:
В нейтральных растворах может образоваться фосфат серебра или карбонат серебра, если присутствует достаточное количество ионов фосфата или карбоната (Bassett et al.1978). Если тестовый раствор имеет pH более 8, ионы серебра из нитрата серебра реагируют с ионами гидроксила (OH —) с образованием гидроксида серебра (AgOH) или оксида серебра (Ag 2 O). Реакция с гидроксильными ионами:
AgNO 3 + OH — → AgOH (светло-коричневый)
, за которым следует
2AgOH → H 2 O + Ag 2 O (темно-коричневый или черный)
На рис. 3 показано, что происходит, когда нитрат серебра добавляется к щелочному раствору, содержащему около 200 ppm хлорид-ионов.Этот образец был взят из ванны для обработки 1% (мас. / Об.) Гидроксидом натрия для археологического железа.
© Правительство Канады, Канадский институт охраны природы. CCI 120260-0413
Рис. 3. Оксид серебра осаждается в щелочном растворе примерно через 20 секунд после того, как две капли 2% (мас. / Об.) Нитрата серебра были добавлены к щелочному раствору, содержащему 1% (мас. / Об.) Гидроксида натрия и хлорида. концентрация ионов около 200 ppm.
/ Об.) Нитрата серебра были добавлены к щелочному раствору, содержащему 1% (мас. / Об.) Гидроксида натрия и хлорида. концентрация ионов около 200 ppm.
Появление осадков гидроксида серебра, оксида серебра и хлорида серебра в пробирке в течение 20 секунд после добавления нитрата серебра показано на видео.
Источники солей в объектах
Объекты, извлеченные из захоронения, загрязнены материалами из этой среды. Сюда часто входят различные соли, особенно если объекты извлекаются из моря. Преобладающими ионами в морской воде (Weast 1974) являются ионы хлора (Cl — , 19 000 частей на миллион) и ионы натрия (Na + , 10 600 частей на миллион), но также присутствуют магний (Mg 2+ , 1270 частей на миллион), сера (в основном в форме сульфат-ионов SO 4 2-, 880 ppm), кальций (Ca 2+ , 400 ppm), калий (K + , 380 ppm) и различные другие ионы с концентрациями ниже 100 частей на миллион.
Эти ионы или соли этих ионов могут повредить объекты, если их не удалить. Хлорид-ионы особенно опасны для металлических предметов, особенно для железа. Когда железо корродирует, оно покрывается слоем оксидов и гидроксидов железа. Этот слой обеспечивает некоторую защиту от дальнейшей коррозии. Однако хлорид-ионы мешают слою, значительно увеличивая скорость коррозии (Selwyn et al. 1999).
Другими объектами, поврежденными солями, являются пористые материалы, такие как керамика (Odegaard et al.2011). Повреждение возникает, когда соли превращаются из растворенных в растворе ионов в твердые кристаллы по мере испарения воды. Некоторые соли (в частности, сульфат натрия) подвергаются настолько большому объемному расширению при кристаллизации, что они наносят значительный ущерб окружающему материалу, если кристаллизация происходит внутри пористой структуры (Waller 1992).
Список литературы
Bassett, J., R.C. Денни, Г. Джеффри и Дж. Мендхэм. Учебник Фогеля по количественному неорганическому анализу , 4-е изд. Харлоу, Великобритания: Longman Group, 1978.
Харлоу, Великобритания: Longman Group, 1978.
Lagowski, J.J., and C.H. Сорум. Введение в полумикро качественный анализ , 8-е изд. Река Аппер Сэдл, Нью-Джерси: Pearson Prentice Hall, 2005.
Одегаард, Н., С. Кэрролл и У.С. Zimmt. Тесты для определения характеристик материалов предметов искусства и археологии , 2-е изд. Лондон, Великобритания: Archetype Publications, 2005.
.Odegaard, N., P. Hill, B. Santarelli и W. Zimmt. «Обнаружение и идентификация солей в процессе опреснения с помощью точечных пробных бумаг.» Вестник WAAC (Западная ассоциация сохранения произведений искусства) 33 (2011), стр. 14–17.
Plenderleith, H.J., and A.E.A. Вернер. Сохранение древностей и произведений искусства , 2-е изд. Лондон, Великобритания: Oxford University Press, 1971, стр. 201.
Риммер М., Д. Уоткинсон и К. Ван. «Эффективность извлечения хлоридов из археологических железных объектов с использованием деоксигенированных щелочных растворов». Исследования в области сохранения 57 (2012), стр.29–41.
Исследования в области сохранения 57 (2012), стр.29–41.
Риммер М., Д. Уоткинсон и К. Ван. «Влияние хлоридного опреснения на скорость коррозии археологического железа». Исследования в области сохранения 58 (2013), стр. 326–337.
Рис, Д. Тестирование хлоридов с нитратом серебра (формат PDF). Сохраните O грамм 6/3. Вашингтон, округ Колумбия: Служба национальных парков, 1993.
Semczak, C.M. «Сравнение тестов на хлориды». Исследования по сохранению 22 (1977), стр.40–41.
Селвин, Л. Анализ концентрации хлорид-иона в водных растворах с помощью потенциометрического титрования . Отчет Канадского института охраны природы № 2. Оттава, Онтарио: Канадский институт охраны природы, 2001 г.
Селвин, Л. «Обзор археологического железа: проблема коррозии, ключевые факторы, влияющие на обработку, и пробелы в современных знаниях». (Формат PDF) В J. Ashton and D. Hallam, eds., Metal 2004: Proceedings of the International Conference on Metals Conservation . Канберра, Австралия: Национальный музей Австралии, 2004 г., стр. 294–306.
Канберра, Австралия: Национальный музей Австралии, 2004 г., стр. 294–306.
Селвин, Л.С., П.Дж. Сироис и В. Аргиропулос. «Коррозия выкопанного археологического железа с подробностями о плаче и акаганеите». Исследования по сохранению 44 (1999), стр. 217–232.
Скуг, Д.А., Д.М. Уэст, Ф.Дж. Холлер и С. Присядь. Основы аналитической химии , 9 изд. Бельмонт, Калифорния: Брукс / Коул, 2014.
Валлер Р. «Минералогические и петрологические образцы, чувствительные к температуре и влажности.»В F.M. Howie, ed., . Уход и сохранение геологического материала: минералы, камни, метеориты и лунные находки . Оксфорд, Великобритания: Butterworth-Heinemann, 1992, стр. 25–50.
Ван, К., С. Дав, Ф. Ширман и М. Смирниу. «Оценка методов определения концентрации хлорид-иона и эффективности опреснительной обработки с использованием гидроксида натрия и щелочных сульфитных растворов». Консерватор 31 (2008), стр. 67–74.
Вист, Р.С., изд. Справочник по химии и физике , 54-е изд. Кливленд, Огайо: CRC Press, 1974.
Написано Линдси Селвин
Également publié en version française.
© Правительство Канады, Канадский институт охраны природы, 2016
ISSN 1928-1455
Реакции осаждения | Реакции в водном растворе
Нитрат серебра (\ (\ text {AgNO} _ {3} \)) реагирует с хлоридом калия (\ (\ text {KCl} \)), и образуется белый осадок.
Напишите вычисленное уравнение протекающей реакции. Включите государственные символы.
Как называется образующаяся нерастворимая соль?
Какие из солей в этой реакции растворимы?
Решение пока недоступно
Хлорид бария реагирует с серной кислотой с образованием сульфата бария и соляной кислоты.
Напишите вычисленное уравнение протекающей реакции. Включите государственные символы.
Образуется ли во время реакции осадок?
Опишите тест, который можно использовать для проверки присутствия сульфата бария в продуктах.
Решение пока недоступно
Пробирка содержит прозрачный бесцветный раствор соли.К раствору добавляют несколько капель раствора нитрата серебра и образуется бледно-желтый осадок. Добавляли хлорную воду и четыреххлористый углерод, в результате чего получали раствор пурпурного цвета. Какая из следующих солей растворилась в исходном растворе? Напишите сбалансированное уравнение реакции, протекающей между солью и нитратом серебра.
\ (\ text {NaI} \)
\ (\ text {KCl} \)
\ (\ text {K} _ {2} \ text {CO} _ {3} \)
\ (\ text {Na} _ {2} \ text {SO} _ {4} \)
Решение еще не доступно
Уравнение с символом для реакции осаждения Agno3 с государственными символами
Стенограмма видео
Когда водный раствор нитрата серебра
смешанный с водным раствором хлорида натрия, белый твердый осадок хлорида серебра
произведено. Уравнение символа для этого
реакция показана ниже. Бланк AgNO3 плюс холостой реагент NaCl
для формирования бланка AgCl плюс бланк NaNO3. Какие государственные символы нужно добавить
к каждому соединению, чтобы завершить уравнение?
Уравнение символа для этого
реакция показана ниже. Бланк AgNO3 плюс холостой реагент NaCl
для формирования бланка AgCl плюс бланк NaNO3. Какие государственные символы нужно добавить
к каждому соединению, чтобы завершить уравнение?
Этот вопрос просит нас добавить
символы состояния к уравнению реакции. Итак, давайте напомним себе, что мы
подразумевают под государственными символами. Государственные символы говорят нам, какие
физическое состояние, в котором находится вещество в данный момент.Мы используем букву s для твердого тела. Буква l для жидкости, g для газа,
и водный для водного, то есть растворенного в воде. Нам дана наша химическая реакция
уравнение в форме химического символа, но в нашей экспериментальной детали используется полное слово
названия для различных соединений. Чтобы сопоставить их, давайте конвертируем
наше уравнение химического символа в уравнение слова, чтобы облегчить жизнь.
Наша таблица Менделеева сообщает нам, что серебро — это Ag.Наш состав содержит азот и кислород, так что это должно сделать его нитратом. Итак, у нас есть серебро нитрат. Na — символ натрия и Cl, символ хлора. Итак, это дает нам хлорид натрия, что-то вроде того, что можно посыпать картошкой фри. Далее у нас есть серебро и хлор опять же, значит, это должен быть хлорид серебра. И наконец, снова натрий и нитрат, нитрат натрия. Далее нам нужно найти каждый из этих соединения в экспериментальных деталях, чтобы выяснить, в каком состоянии они находятся.
Нитрат серебра первый. И вопрос говорит нам, что это
водный. Водные средства растворяются в воде,
а символ состояния для водной среды — вод. Далее идет хлорид натрия. Он также указан как водный. Далее ищем первый
изделие, хлорид серебра. Вопрос говорит нам, что это
образуется в виде белого твердого осадка. Итак, это твердое тело, поэтому мы используем
письма. А как насчет натрия
нитрат? Это конкретно не указано.Мы знаем, что нитрат натрия не
осадок в виде твердого вещества. Так что, должно быть, он остался в
раствор как водный. Итак, мы можем обозначить это также как
водный. Итак, вот наша реакция
уравнение, дополненное государственными символами.
Итак, это твердое тело, поэтому мы используем
письма. А как насчет натрия
нитрат? Это конкретно не указано.Мы знаем, что нитрат натрия не
осадок в виде твердого вещества. Так что, должно быть, он остался в
раствор как водный. Итак, мы можем обозначить это также как
водный. Итак, вот наша реакция
уравнение, дополненное государственными символами.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно.Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.

- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом.Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Чтобы предоставить доступ без файлов cookie
потребует от сайта создания нового сеанса для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Нитрат серебра | химическое соединение
Нитрат серебра , едкое химическое соединение, важное в качестве антисептика при промышленном получении других солей серебра и в качестве реагента в аналитической химии. Его химическая формула — AgNO 3 . Нитрат серебра наносится на кожу и слизистые оболочки, он используется либо в виде палочек в виде лунного каустика (или каустического карандаша), либо в виде растворов нитрата серебра в воде от 0,01% до 10%. Палочка используется для удаления бородавок и грануляционной ткани, а также для прижигания ран и язв. Очень разбавленные растворы обладают вяжущим действием и обладают мягким антисептическим действием. 1-процентный или 2-процентный раствор эффективен против гонококковых бактерий, и его можно наносить на глаза новорожденных, чтобы предотвратить слепоту от гонореи.
Его химическая формула — AgNO 3 . Нитрат серебра наносится на кожу и слизистые оболочки, он используется либо в виде палочек в виде лунного каустика (или каустического карандаша), либо в виде растворов нитрата серебра в воде от 0,01% до 10%. Палочка используется для удаления бородавок и грануляционной ткани, а также для прижигания ран и язв. Очень разбавленные растворы обладают вяжущим действием и обладают мягким антисептическим действием. 1-процентный или 2-процентный раствор эффективен против гонококковых бактерий, и его можно наносить на глаза новорожденных, чтобы предотвратить слепоту от гонореи.
палочки из нитрата серебра.
© Rick’s Photography / Shutterstock.comЧистый нитрат серебра является промежуточным звеном при получении других солей серебра, включая коллоидные соединения серебра, используемые в медицине, и галогениды серебра, входящие в состав фотоэмульсий.
В аналитической химии водные растворы нитрата серебра используются при волюметрическом определении галогенидов, цианидов и тиоцианатов, а также для обнаружения восстановителей и катионов различных кислот, образующих нерастворимые соли серебра.




 Соответствующие ионы-зрители могут
нитрат в качестве аниона и натрий в качестве катиона. Мы выбрали эти ионы, потому что
реагенты должны быть растворимыми, и нитраты и соли натрия всегда
растворимый.
Соответствующие ионы-зрители могут
нитрат в качестве аниона и натрий в качестве катиона. Мы выбрали эти ионы, потому что
реагенты должны быть растворимыми, и нитраты и соли натрия всегда
растворимый.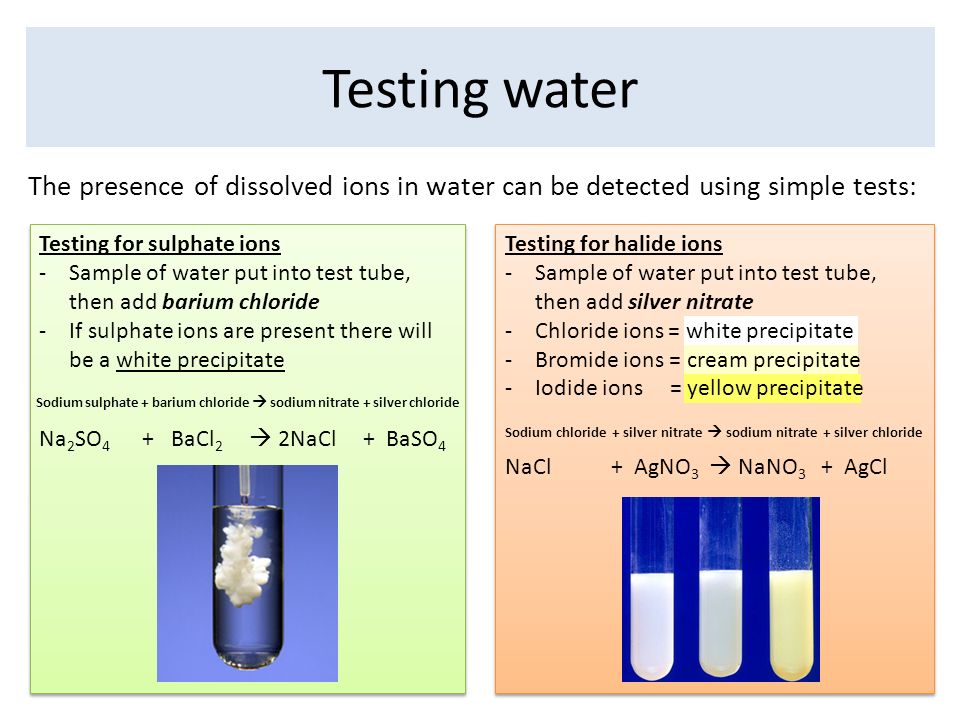 Полное сбалансированное уравнение реакции:
Полное сбалансированное уравнение реакции: Выделение этих ионов дает чистое ионное уравнение
Выделение этих ионов дает чистое ионное уравнение