Лабораторные работы по химии для 1 курса
Подборка по базе: Курсовая работа.pdf, Практическая работа-1.docx, Контрольная работа Земельное право 2.docx, 13 Лабораторная работа.docx, Курсовая работа. Расчет теплообменного аппарата. Вариант 26.doc, Контрольная работа по математике.docx, ОЭФ Курсовая работа Анализ продаж ЛП.docx, Лабораторная работа №5.pdf, Практическая работа №1 Стецко.docx, Контрольная работа Киселев Т.В.docx 1 2 3 4 5 Лабораторная работа №1 Моделирование построения Периодической таблицы химических элементов. Цель работы:
Ход работы Используя ранее полученные знания при изучении тем: «Основные понятия и законы химии», «Периодический закон и периодическая система химических элементов Д. Задание № 1 Воспользуйтесь учебником О.С.Габриелян, И.Г.Остроумова Химия тема: «Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома», ответьте на вопросы:
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________
Задание № 2. Теоретическая часть Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента. Наприме: дана формула оксида меди Cu2O, необходимо определить валентность меди Валентность кислорода постоянная и равна II, а на один атом кислорода приходится 2 атома меди. Следовательно, валентность меди равна I. Валентность Примеры формул соединений
I и II С постоянной валентностью С переменной валентностью
Cu2O, CuO Определить валентности следующих элементов: А) SiH4, CrO3, H2S, CO2, SO3, Fe2O3, FeO Б) CO, HCl, HBr, Cl2O5, SO2, РН3, Cu2O, B) Al2O3, P2O5, NO2, Mn2O7,Cl2O7, Cr2O3, Г) SiO2, B2O3, SiH4, N2O5,MnO, CuO, N2O3. ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задание № 3. Теоретическая часть Относительная молекулярная масса — сумма всех относительных атомных масс входящих в молекулу атомов химических элементов. Мr = Аr1 * i1+ Ar2* i2+ Аr3 * i3… Где Мr – относительная молекулярная масса вещества Аr1 , Ar2, Аr3 … – относительные атомные массы элементов входящих в состав этого вещества i1, i2, i3… – индексы при химических знаках химических элементов. Пример: Вычислить относительную молекулярную массу молекулы серной кислоты (H2SO4) Последовательность действий Выполнение действий 1. Записать молекулярную формулу серной кислоты. H2SO4 2. Подсчитать по формуле относительную молекулярную массу серной кислоты, подставив в формулу относительные атомные массы элементов и их индексы Mr (H2SO4 ) = Ar (H)· n + Ar (S)· n + Ar (O)· n = 1·2 + 32 + 16?4=98 3. Записать ответ. Ответ: Mr (H2SO4 ) = 98. Определить относительную молекулярную массу веществ: A) Cu2O, KNO3, Na2Si03, Н3РО4 Б) A12(S04)3, H2SO4 , K2S, Mg(OH)2 B) SO3, CaCO3, H2SO3, NH4OH Г) PO3, Zn(OH)2, H2SiO3, AlCl3 ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Задание № 4. Теоретическая часть «Атом» — греч «неделимый». Атомы, тем не менее, имеют сложное строение. В центре – атомное ядро, имеющее чрезвычайно малые размеры по сравнению с размерами атома. В состав ядра входят положительные частицы – протоны (р+) и нейтральные частицы – нейтроны (n0). Таким образом, ядро атома заряжено положительно. Протоны – частицы с положительным зарядом +1 и относительной массой 1. Нейтроны – электронейтральные частицы с относительной массой 1. Положительный заряд атома равен числу протонов. Число протонов в ядре соответствует порядковому номеру химического элемента в периодической сиситеме Электронная оболочка атома окружает положительно заряженное ядро и состоит из отрицательных частиц – электронов е—. Электроны – частицы с отрицательнымзарядом -1 и относительной массой 1/1837 от массы протона. Так как в целом масса всех электронов ничтожно мала, ее можно пренебречь. Значит, практически вся масса атома сосредоточена в ядре и представляет собой сумму масс протонов и нейтронов. Массовое число – суммарное число протонов и нейтронов, округленно равно значению относительной атомной массе химического элемента (Ar). Число нейтронов в ядре равно разности между массовым числом и числом протонов. N = A – Z N – число нейтронов A – массовое число Z – число протонов. Атом в целом электронейтрален. Число электронов, движущихся вокруг ядра, равно числу протонов в ядре. Определить число протонов, нейтронов и электронов и заряд ядра атома для следующих элементов, заполнив таблицу: А) I, Na, CI, Са, Al Б) S, P, C, K, Ne B) F, O, B, Ba, Si Г) H, N, Zn, Kr, As Элемент е— р+ n0 Заряд ядра Задание № 5. Например: Найти массовые отношения элементов в оксиде серы (IV) SO2. Последовательность действий Выполнение действий 1.Записать формулу для вычисления массовых отношений m(эл.1) : m(эл.2) = Ar (эл.1) ·n1 : Ar (эл.2) ·n2 2.Вычислить массовые соотношения серы и кислорода, подставив соотношения атомных масс m(S): m(O) = 32: 16×2=32 : 32 2. 3. Сократить полученные числа на 32 m(S) : m(O) = 1: 1 Найти массовые отношения между элементами по химической формуле сложного вещества: А) Са(ОН)2, CuNO3 Б) Na3P04, , H2SiO3 В) Na2Si03. Н3РО4 Г) H2SO3 , KNO3 Задание № 6. Распределить вещества по классам неорганических соединений: А) кислоты Б) основания В) соли Г) оксиды. и дайте им названия: Cu2O, KNO3, Na2Si03, Н3РО4, A12(S04)3, H2SO4 , K2S, Mg(OH)2 , SO3, CaCO3, H2SO3, NH4OH , PO3, Zn(OH)2, H2SiO3, AlCl3 , CO2 , H2S ,NaOH , K2O , Fe(OH)3 , H2CO3 , N2O3 , Cu(OH)2 ____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания 1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время 2. 3. Вы можете воспользоваться учебником, конспектом лекций Шкала оценки образовательных достижений: Критерии оценки: Выполнение работы более 90% –оценка «5», 70-90% — оценка «4», 50 -70% — оценка «3», Менее 50% — оценка «2». Лабораторная работа №2-3 Приготовление суспензии карбоната кальция в воде. Получение эмульсии моторного масла. Ознакомление со свойствами дисперсных систем. Цель:
Оборудование и реактивы:
Теоретическая часть Чистые вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси разных веществ в различных агрегатных состояниях могут образовывать гомогенные(растворы) и гетерогенные(дисперсные ) системы. Дисперсными- называют гетерогенные системы , в которых одно вещество — дисперсная фаза ( их может быть несколько) в виде очень мелких частиц равномерно распределено в объеме другого —дисперсионной среде. Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и газообразном. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся 2 группы :
|
ЛР1 КИП-18 — Моделирование построения периодической таблицы Д. И, Менделеева
Единственный в мире Музей Смайликов | Скачать 134.94 Kb.
|
Подборка по базе: 3д моделирование.  docx, Имитационное моделирование экономических процессов (тест Синерги, 3 Информационн о-технические основы построения сетей.doc, Практическая работа № анализ предметной области различными метод, Сальников Моделирование экон процессов.docx, логика таблицы.docx, 3 д моделирование.docx, ТИПЫ ПОСТРОЕНИЯ СЕТЕЙ ПО МЕТОДАМ ПЕРЕДАЧИ ИНФОРМАЦИИ..doc, Имитационное моделирование.ppt, Word — Пр №4 Таблицы.docx docx, Имитационное моделирование экономических процессов (тест Синерги, 3 Информационн о-технические основы построения сетей.doc, Практическая работа № анализ предметной области различными метод, Сальников Моделирование экон процессов.docx, логика таблицы.docx, 3 д моделирование.docx, ТИПЫ ПОСТРОЕНИЯ СЕТЕЙ ПО МЕТОДАМ ПЕРЕДАЧИ ИНФОРМАЦИИ..doc, Имитационное моделирование.ppt, Word — Пр №4 Таблицы.docxЛАБОРАТОРНАЯ РАБОТА № 1 Тема: Моделирование построения периодической таблицы Д.И, Менделеева. Цель: Смоделировать периодическую таблицу Д.И. Менделеева и найти закономерности в изменении свойств химических элементов. Студент должен: Знать: периодический закон и периодическую систему химических элементов Д.И. Менделеева; характеристику химических элементов по таблице Д.И. Менделеева: основные закономерности изменения свойств химических элементов в группах и периодах. Уметь: давать характеристику химических элементов по таблице Д. Задание № 1 При моделировании построения периодической таблицы необходимо рассмотрите периодичность изменения свойств химических элементов в ряду: H, He, Li, Be, B, C, N, O, F, Ne, Na, Mg, Al, Si, P, S, Cl, Ar. Затем разбейте этот ряд на горизонтальные и вертикальные ряды согласно вопросам задания. В итоге объедините эти ряды в прямоугольную таблицу, укажите номер периода, группы, порядковый номер химического элемента. Задание: 1. Расположите в порядке возрастания заряда ядра атома химические элементы 1,2,3 периодов. 2. Установите зависимость изменения химических свойств элементов от увеличения заряда ядра атома. 3. Расположите химические элементы в горизонтальные ряды в зависимости от увеличения заряда ядра атома и периодичности изменения свойств химических элементов. 1ряд ……….. 2 ряд………. 3 ряд………. 1 ряд 2 ряд 3 ряд : : : Задание № 2 Ряды химических элементов в которых свойства изменяются последовательно (металлические усиливаются, а неметаллические ослабевают) расположить друг под другом. Выявить:
Задание № 3 Записать схемы строения атомов химических элементов, электронные формулы и их графическое изображение, дать общую характеристику химических элементов периодической таблицы Д.И. Менделеева. Таблица1. Варианты заданий
Контрольные вопросы:
Содержание отчета:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
9. Содержание отчета
9.1. Наименование и цель работы.
9.2. Выполненное задание (результаты моделирования, наблюдения, выводы)
9.3. Ответы на контрольные вопросы.
10. Контрольные вопросы.
1. Запишите общую формулу аминокислот.
2. Дайте определения аминокислоты, реакции поликонденсации, пептидной связи.
3. Какие
вещества называют аминами?
Какие
вещества называют аминами?
4.Какие модели молекулы метиламина изображены на рисунке:
6.
7.
8.Запишите определения: пластмассы, волокна.
9.
10. Даны вещества, формулы которых:
11.
Практическая работа №1
Моделирование построения Периодической таблицы химических элементов
Цель работы
Изучить моделирование построения периодической таблицы химических элементов.
Подготовка к работе
Изучить материал по указанной литературе.
Ответить на контрольные вопросы.

Литература: 1.конспекты по химии;
2. Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для обще- образоват. учреждений.- М.,2009,стр. 10-11;13-19.
Перечень необходимых материалов
Задание
Используя методические указания и программу «Виртуальная химическая лаборатория» изучить моделирование построения периодической таблицы химических элементов.
Порядок выполнения работы
Получить допуск к работе.
Выполнить задание.
Методические указания
Запустить программу Виртуальная химическая лаборатория.
Получить допуск к работе.
 Для этого навести
курсор правой кнопкой мыши на панель
«Коллекция» и выбрать заголовок «Правила
выживания в химической лаборатории».
Для этого навести
курсор правой кнопкой мыши на панель
«Коллекция» и выбрать заголовок «Правила
выживания в химической лаборатории».
Навести курсор правой кнопкой мыши на панель «Коллекция» и выбрать заголовок «Периодический закон Д.И. Менделеева». Изучить все подзаголовки находящиеся в заголовке «Периодический закон Д.И. Менделеева».
Навести курсор правой кнопкой мыши на панель «Таблицы» и выбрать строку 1 « Периодическая система элементов Д.И. Менделеева». Рассмотреть таблицу.
Оформить отчет о проделанной работе.
7. Содержание отчета
7.1. Наименование и цель работы.
7.2. Ответы на контрольные вопросы.
8. Контрольные вопросы.
2.
3. Как был открыт Периодический закон?
4. Как изменялась формулировка Периодического закона по мере развития науки?
5. Запишите современную формулировку периодического закона.
6.
7.
8.Дайте характеристику элемента серы по его положению в Периодической системе Д.И. Менделеева.
Практическая работа №2
Решение экспериментальных задач
Цель работы
Научиться решать экспериментальные задачи по теме «Металлы и Неметаллы».
Подготовка к работе

Выполнить задания.
Оформить отчет о проделанной работе.
Литература: 1.конспекты по химии;
2. Габриелян О.С. Химия. 11 класс. Базовый уровень: учеб. для обще- образоват. учреждений.- М.,2009,стр. 164 – 180.
4. Задания
4.1. Нержавеющая (легированная) сталь содержит 8% хрома и 18% никеля.Рассчитайте количество (моль) хрома и никеля, содержащихся в образце нержавеющей стали массой 100 г.
4.2. Образец латуни массой 10 г обработали избытком разбавленного раствора серной кислоты. При этом выделилось 1,1 л (н.у.) газа. Определите массовые доли цинка и меди в сплаве.
4.3. Железную пластинку массой 10 г погрузили в раствор сульфата меди (II). Рассчитайте массу выделившейся меди, если в реакцию вступило 5,6 г железа. Во сколько раз изменится (увеличится или уменьшится) масса металлической пластинки по окончании реакции?
4. 4.
Найдите и исправьте ошибки в уравнениях:
4.5. Исправьте ошибки:
4.
Найдите и исправьте ошибки в уравнениях:
4.5. Исправьте ошибки:
Лабораторные работы по химии
Лабораторная работа №1
Моделирование построения Периодической системы (таблицы) элементов.
Цель: научиться выявлять законы по таблице элементов.
Оборудование: карточки размером 6х10 см
Ход работы:
Заготовьте 20 карточек размером 6 х 10 см для элементов с порядковыми номерами с 1-го по 20 –й в Периодической системе Менделеева. На каждую карточку запишите следующие сведения об элементе:
— химический символ
— название
— значение относительной атомной массы
— формулу высшего оксида (в скобках укажите характер оксида- основный, кислотный или амфотерный)
— формулу высшего гидроксида (для гидроксидов металлов также укажите в скобках характер — основный или амфотерный)
— формулу летучего водородного соединения (для неметаллов).
Расположите карточки по возрастанию значений относительных атомных масс.
Расположите сходные элементы, начиная с 3-го по 18-й друг под другом. Водород и калий над литием и под натрием соответственно, кальций под магнием, а гелий над неоном. Сформулируйте выявленную вами закономерность в виде закона.
Поменяйте в полученном ряду местами аргон и калий. Объясните почему.
Еще раз сформулируйте выявленную вами закономерность в виде закона.
Лабораторная работа № 2
Приготовление раствора заданной концентрации.
Цель: приготовить растворы солей определённой концентрации. ОК2, ОК3, ОК4, ОК6.
Оборудование: — стакан объёмом 50 мл,
— стеклянная палочка с резиновым наконечником,
— весы,
— стеклянная лопаточка,
— мерный цилиндр,
— соли,
— холодная кипячёная вода.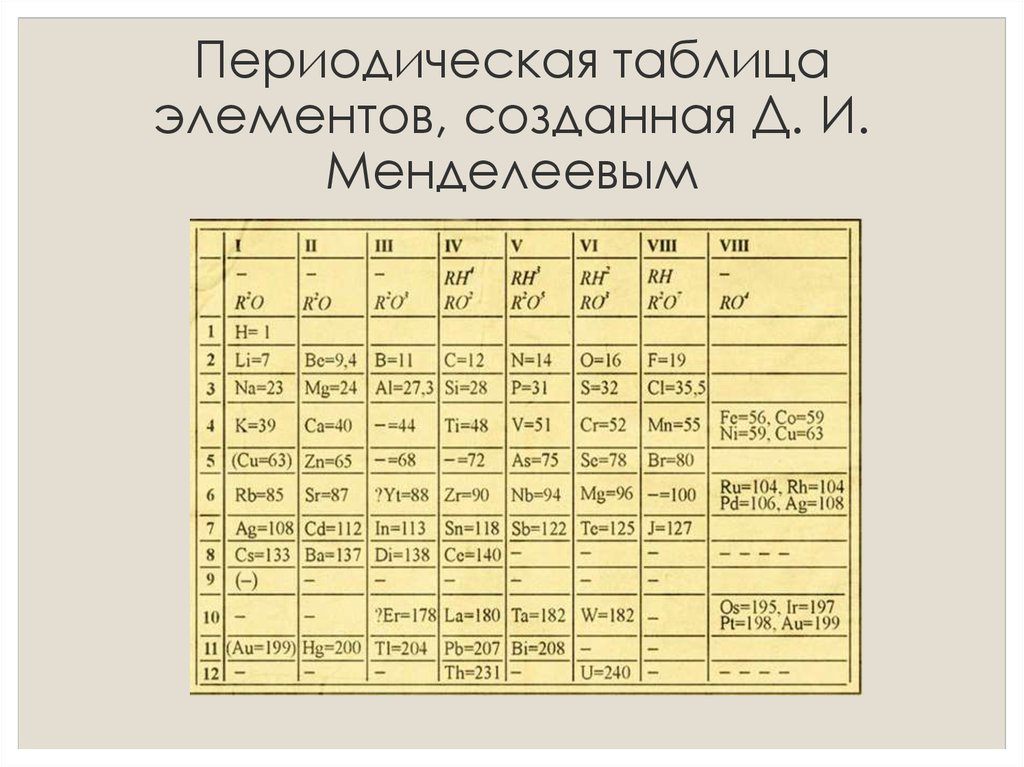
Ход работы:
Произвести расчёты: определите, какую массу соли и воды потребуется взять для приготовления раствора, указанного в условии задачи.
Задача: приготовьте 20 г водного раствора поваренной соли с массовой долей соли 5%
Отвесьте соль и поместите её в стакан.
Отмерьте измерительным цилиндром необходимый объём воды и вылейте в колбу с навеской соли.
Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости. Уровень жидкости прозрачных растворов устанавливают по нижнему мениску.
Отчёт о работе:
— проведите расчёты,
— последовательность ваших действий.
Лабораторная работа №3.
Испытание растворов кислот.
Цель: исследовать, как действуют кислоты на индикаторы. ОК2, ОК3, ОК4, ОК6.
ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — 4 пробирки или платины с гнёздами,
— раствор серной кислоты (1:5),
— раствор соляной кислоты (1:3),
— раствор лакмуса,
— раствор метилового оранжевого (метилоранж).
Ход работы:
В 2 пробирки или гнёзда пластины внесите по 5 капель раствора соляной кислоты, к одной добавьте каплю лакмуса, а к другой – каплю метилоранжа.
Как изменяется окраска индикаторов от действия кислоты?
Теперь проделайте то же самое с серной кислотой. Что наблюдаете? Какой можно сделать общий вывод о действии кислот на индикаторы – лакмус и метиловый оранжевый? Согласуется ли вывод с таблицей «Изменение цвета индикаторов»
Изменение цвета индикаторов
Индикатор | Среда | ||
Кислая | Нейтральная | Щелочная | |
Лакмус | Красные | Бурый | Синий |
Фенолфталеин | Бесцветный | Бесцветный | Красный |
Метилоранж | Красный | Красный | 0оранжевый |
Задание: даны растворы 2 веществ. Как можно практически доказать, что одно из них является раствором кислоты?
Как можно практически доказать, что одно из них является раствором кислоты?
Взаимодействие металлов с кислотами.
Цель: исследовать, все ли металлы реагируют с кислотами, всегда ли при этом выделяется кислород? ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — спиртовка,
— предметное стекло,
— стеклянная платина 30х60 мм,
— восемь пробирок,
— пипетка,
— две гранулы цинка,
— железные опилки,
— несколько кусочков меди, алюминия,
— раствор соляной кислоты (1:3),
— раствор серной кислоты (1:5).
Ход работы.
В пробирки положите разные металлы: в одну – гранулу цинка в другую – железные опилки, в третью – кусочки меди, в четвёртую – кусочки алюминия. Во все пробирки налейте по 1 мл раствора соляной кислоты. Что замечаете?
Во все пробирки налейте по 1 мл раствора соляной кислоты. Что замечаете?
В следующие четыре пробирки поместите те же металлы и в таком же количестве, прилейте по 1 мл раствора серной кислоты. Что замечаете? Если в какой-либо пробирке не наблюдается реакция, то слегка нагрейте её содержимое (осторожно!, но не доводя до кипения. Докажите, в каких пробирках выделяется газ водород.
Из пробирки, в которой осуществлялась реакция между алюминием и соляной кислотой, отберите 1-2 кали раствора поместите их на предметное стекло, держа высоко над пламенем, выпарите его. Что осталось?
Сделайте общий вывод об отношении кислот к металлам. Для этого воспользуйтесь схемой:
Отношение металлов к воде и к некоторым кислотам
K, Ca, Na, Mg, Al | Zn, Fe, Ni, Pb | Cu, Hg, Ag, Au | |
Реагируют с водой с выделением водорода | Не реагирует с водой при обычных условиях | Не реагируют с водой и растворами соляной и серной кислот | |
Реагируют с растворами соляной и серной кислот с выделением водорода | |||
Ответьте на вопросы:
Какой из металлов, взятый для опытов, не реагирует с растворами соляной и серной кислот? Какие ещё металлы не реагируют с этими кислотами?
2.
 К какому типу реакций относится взаимодействие кислоты с металлом?
К какому типу реакций относится взаимодействие кислоты с металлом?
3.Взаимодействие кислот с основаниями.
Цель: изучить взаимодействия кислот с основаниями. ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — раствор гидроксида натрия,
— раствор фенолфталеина,
— пробирки,
— раствор уксусной кислоты,
— пипетки.
Ход работы
В две пробирки налейте по 1-2 мл раствора гидроксида натрия и добавьте 2-3 капли раствора фенолфталеина. В первую пробирку прилейте 1-2 мл соляной кислоты, а во вторую – столько же раствора уксусной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
4. Взаимодействие кислот с солями
Цель: изучить взаимодействия кислот с солями. ОК2, ОК3, ОК4, ОК6.
ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — раствор карбоната калия,
— раствор соляной кислоты,
— раствор уксусной кислоты,
— раствор силиката калия,
— пробирки, пипетки.
Ход работы:
В две пробирки налейте по 1-2 мл раствора карбоната калия. В первую пробирку прилейте 1-2 мл соляной кислоты, а во вторую – столько же раствора уксусной кислоты. Что наблюдаете?
В две пробирки налейте по 1-2 мл раствора силиката калия. В первую пробирку прилейте 1-2 мл соляной кислоты, а во вторую – столько же раствора уксусной кислоты. Что наблюдаете?
Напишите уравнения реакций в молекулярной и ионной формах.
Лабораторная работа №4
Факторы, влияющие на скорость химических реакций.
Цель: исследовать, как различные факторы влияют на скорость протекания реакицй. ОК2, ОК3, ОК4, ОК6.
ОК2, ОК3, ОК4, ОК6.
Оборудование: — гранулы цинка, магний, железо,
— растворы соляной кислоты разной концентрации,
— раствор серной кислоты,
— CuO (II) (порошок),
— вода,
— спиртовка,
— пробирки,
— штатив.
Зависимость скорости взаимодействия цинка с соляной кислотой от её концентрации.
В две пробирки поместите по одной грануле цинка. В одну прилейте 1 мл соляной кислоты (1:3), в другую – столько же этой кислоты другой концентрации (1:10). В какой пробирке более интенсивно протекает реакция? Что влияет на скорость реакции?
Зависимость скорости взаимодействия соляной кислоты с металлами от их природы.
В три пробирки (подписанные, под номерами) прилить по 3 мл раствора НС1 и внести в каждую из пробирок навески опилок одинаковой массы: в первую – Mg, во вторую — Zn, в третью — Fe.
Что наблюдаете? В какой пробирке реакция протекает быстрее (или вообще не протекает)? Напишите уравнения реакций. Какой фактор влияет на скорость реакции? Сделайте выводы.
Зависимость скорости взаимодействия оксида меди с серной кислотой от температуры.
В три пробирки (под номерами) налить по 3 мл раствора H2SO4 (одинаковой концентрации). В каждую поместить навеску CuO (II) (порошок). Первую пробирку оставить в штативе, вторую – опустить в стакан с горячей водой, третью – нагреть в пламени спиртовки.
В какой пробирке цвет раствора меняется быстрее (голубой цвет)? Что влияет на интенсивность реакции? Напишите уравнение. Сделайте вывод.
Лабораторная работа №5
Ознакомление со структурами белого и серого чугуна
Цель: изучить микроструктуру, свойства, способы получения и применение чугуна, ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы:
Вопросы для подготовки:
Чем отличается белый чугун от серого?
На какие классы подразделяют серые чугуны в зависимости от формы графитовых включений?
Какая металлическая основа может быть в серых чугунах и от чего это зависит?
Как получить серый чугун?
Как получить ковкий чугун?
Как получить высокопрочный чугун?
Как маркируют серые чугуны?
Ход работы
Рис. 1. Структурная диаграмма чугунов:
а) Влияние C и Si на структуру чугуна,
б) Влияние толщины отливки и суммы (C+Si) на структуру чугуна,
I – белые чугуны,
II – половинчатые чугуны,
III – серые перлитные чугуны,
IV – серые ферритно-перлитные чугуны,
V – серые ферритные чугуны.
По атласу микроструктур изучить микроструктуру белого и серого чугунов. Заполнить таблицу 1.
Таблица 1.
Название чугуна | Фазовый состав | Структурные составляющие | Схема микростуктуры |
Зарисовать схему микроструктуры серого чугуна.
Определить фазовый и структурный состав чугуна.
Визуально определить количество (в процентах) каждой структурной составляющей.
Рассчитать количество углерода в чугуне. Заполнить таблицу 2.
Таблица 2.
Наименование чугуна | Количество структурных составляющих, % | Количество связанного углерода, % | Количество углерода в чугуне, % | ||||
Ф | П | Г | |||||
3. Описать способ получения чугуна, его свойства, области применения.
Справочный материал:
Определение содержания углерода в серых чугунах, %:
С=Ссвоб + Ссвяз.,
Где Ссвоб – количество углерода, содержащегося в свободном состоянии в виде графита, %:
Где Г – площадь шлифа, занятая графитом,
р1 – плотиностьт графита, равная 2,3 г/см3,
р2 – плотность чугуна, равная 7,7 г/см3.
Ссвяз — количество связанного углерода (в виде цементита), %.
Принято, что феррит практически не имеет углерода.
Лабораторная работа № 6
Получение, собирание и распознавание газов.
Цель: получит экспериментально некоторые газы.
Оборудование: гранулы цинка, соляная кислота, раствор пероксида водорода, оксид марганца, кусок мрамора, раствор уксусной кислоты, раствор известковой воды, раствор хлорида аммония, лакмусовая бумажка, спиртовка, пробирки, шпатель, стеклянная трубочка.
Ход работы:
Получение, собирание и распознавание водорода
В пробирку поместите две гранулы цинка и прилейте в нее 1-2 мл соляной кислоты. Что наблюдаете? Напишите уравнение реакции.
Накройте вашу пробирку пробиркой большего диаметра, немного заходя за край меньшей пробирки. Через 1—2 ми нуты поднимите большую пробирку вверх и, не перевора чивая ее, поднесите к пламени спиртовки. Что наблюдаете? Что можно сказать о чистоте собранного вами водорода? Почему водород собирали в перевернутую пробирку?
Через 1—2 ми нуты поднимите большую пробирку вверх и, не перевора чивая ее, поднесите к пламени спиртовки. Что наблюдаете? Что можно сказать о чистоте собранного вами водорода? Почему водород собирали в перевернутую пробирку?
2. Получение, собирание и распознавание кислорода
В пробирку объемом 20 мл прилейте 5—7 мл раствора пе роксида водорода. Подготовьте тлеющую лучинку (подожги те ее и, когда она загорится, взмахами руки погасите). Под несите к пробирке с пероксидом водорода, куда предвари тельно насыпьте немного (на кончике шпателя) оксида мар ганца (IV). Что наблюдаете? Запишите уравнение реакции.
3. Получение, собирание и распознавание углекислого газа
В пробирку объемом 20 мл поместите кусочек мра мора и прилейте раствор уксусной кислоты. Что наблюдаете? Через 1—2 минуты внесите в верхнюю часть пробирки горящую лучинку. Что наблюдаете? Запиши те уравнение реакции в молекулярной и ионной формах.
В пробирку налейте 1—2 мл прозрачного раствора из вестковой воды. Используя чистую стеклянную трубоч ку, осторожно продувайте через раствор выдыхаемый вами воздух. Что наблюдаете? Запишите уравнение ре акции в молекулярной и ионной формах.
4. Получение, собирание и распознавание аммиака
В пробирку прилейте 1—2 мл раствора хлорида аммо ния, а затем такой же объем раствора щелочи. Закрепите пробирку в держателе и осторожно нагрейте на пламени горелки. Что наблюдаете? Запишите уравнение реакции в молекулярной и ионной формах.
Поднесите к отверстию пробирки влажную красную лакмусовую бумажку. Что наблюдаете? Осторожно по нюхайте выделяющийся газ. Что ощущаете?
Лабораторная работа №7
Изготовление моделей молекул органических веществ
Цель: построить шаростержневые и масштабные модели молекул первых гомологов предельных углеводородов и их галогенопроизводных.
Оборудование: набор шаростержневых моделей.
Общие указания.
Для построения моделей используйте детали готовых наборов или пластилин с палочками. Шарики, имитирующие атомы углерода, готовят обычно из пластилина темной окраски, шарики, имитирующие атомы водорода, — из светлой окраски, атомы хлора – из зеленого или синего цвета. Для соединения шариков используют палочки.
Ход работы:
1.Соберите шаростержневую модель молекулы метана. На «углеродном» атоме наметьте четыре равноудаленные друг от друга точки и вставьте в них палочки, к которым присоединены «водородные» шарики. Поставьте эту модель (у нее должны быть три точки опоры).
2.Теперь соберите масштабную модель молекулы метана. Шарики «водорода» как бы сплющены и вдавлены в углеродный атом.
3.Сравните шаростержневую и масштабную модели между собой. Какая модель более реально передает строение молекулы метана? Дайте пояснения.
4.Соберите шаростержневую и масштабную модели молекулы этана. Изобразите эти модели на бумаги в тетради.
5.Соберите шаростержневые модели бутана и изобутана. Покажите на модели молекулы бутана, какие пространственные формы может принимать молекула, если происходит вращение атомов вокруг сигма связи. Изобразите на бумаге несколько пространственных форм молекулы бутана.
6.Соберите шаростержневые модели изомеров C5H12 . изобразите на бумаге.
7.Соберите шаростержневую модель молекулы дихлорметана CH2Cl2. Могут ли быть изомеры у этого вещества? Попытайтесь менять местами атомы водорода и хлора. К какому выводу вы приходите?
Лабораторная работа № 8
Качественная реакция на непредельные углеводороды
Цель работы:
-освоить лабораторный способ получения этилена, изучить его свойства, соблюдая правила по технике безопасности;
-закрепить умение подтверждать теоретические знания химическим экспериментом.
Оборудование: три пробирки, газоотводная трубка, резиновая пробка с отверстием под газоотводную трубку, металлический штатив, газовая горелка, этанол, концентрированная серная кислота, раствор перманганата калия, раствор бромной (или йодной) воды, кусочки пемзы.
Опыт.
Соберите прибор (см. рисунок), в пробирку налейте 0,5 мл этанола и добавьте туда 2 мл концентрированной серной кислоты (осторожно!). Положите туда небольшой кусочек пемзы (для равномерного кипения), полученную смесь сильно нагрейте. Выделяющийся этен пропустите по очереди через слабый раствор перманганата калия, а затем раствор бромной (или йодной) воды, взятые в количестве по 1 мл. Что вы наблюдаете?
После обесцвечивания растворов конец газоотводной трубки поднимите вверх и подожгите выделяющийся этен, не прекращая нагревания прибора. Отметьте характер пламени. Прекратите нагревание прибора, дайте ему остыть, разберите и помойте прибор.
Задание для самостоятельной работы
1.Как получают этен в лаборатории и промышленности? Напишите уравнения реакций.
2.Почему серная кислота, применяющаяся в опыте, должна быть концентрированной?
3.Почему этен легко обесцвечивает раствор перманганата калия и раствор бромной (или йодной) воды? Напишите уравнения реакций.
4. Напишите уравнение реакции горения этена.
Рисунок 3. Получение этена
Лабораторная работа №9
Кислородосодержащие органические соединения
Свойства глицерина
Цель: исследовать свойства глицерина. ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — градуированная пробирка или пипетка,
— пробирка,
— глицерин,
— раствор хлорида (сульфата) меди (с=0,5 моль/л),
— раствор гидроксида натрия (калия) (10-12%-ный).
Ход работы:
К 0,5 мл воды в пробирке добавьте 2 капли глицерина, содержимое взболтайте. Прибавьте ещё каплю глицерина и снова взболтайте. Прибавьте ещё каплю глицерина. Что можно сказать о растворимости глицерина?
К полученному раствору глицерина прилейте 2 капли раствора соли меди и по каплям добавляйте раствор щёлочи до изменения окраски раствора (щелочь должна быть в избытке). Образуется глицерат меди ярко-синего цвета. Запомните: эта реакция является качественной на глицерин (многоатомные спирты).
Лабораторная работа № 10
Доказательство непредельного характера растительного жира .
Цель работы:
–экспериментально получить сложный эфир и изучить физические и химические свойства жиров, соблюдая правила по технике безопасности;
-закрепить умение подтверждать теоретические знания химическим экспериментом.
Оборудование: пробирки, вода, этанол, бензин, бензол, бромная вода, кусочки животного жира, подсолнечное масло, газовая горелка.
Опыт 1. Растворимость жиров
В одну пробирку налейте 3 мл бензина, во вторую – воды, в третью – этанола, в четвертую – бензола. Во все пробирки с веществами поместите по кусочку жира и встряхните.
Задание
1.В каком растворителе растворился кусочек жира?
Опыт 2. Доказательство непредельного характера жира
В одну пробирку налейте 2 мл подсолнечного масла, во вторую поместите кусочек твердого животного жира. К содержимому пробирок добавьте немного бромной воды. (Пробирку с кусочком твердого животного жира нагрейте до расплавления).
Задание В какой из пробирок бромная вода обесцветилась? О чем это свидетельствует?
Лабораторная работа №11.
2.Взаимодействие глюкозы и сахарозы с гидроксидом меди (II).
Цель: изучить свойства углеводов. ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — раствор глюкозы и сахарозы,
— раствор медного купороса,
— гидроксид натрия,
— вода,
— пробирки,
— спиртовка.
Ход работы
а) В пробирке №1 налито 0,5 мл раствора глюкозы, добавьте 2 мл раствора гидроксида натрия. К полученной смеси добавьте 1 мл раствора медного купороса.
б) К полученному раствору аккуратно добавьте 1 мл воды и нагрейте на пламени спиртовки (соблюдайте правила ТБ обращения с нагревательными приборами). Прекратите нагревание, как только начнётся изменение цвета.
в) Прибавьте к раствору медного купороса раствор сахарозы, смесь взболтайте. Как изменилась окраска раствора? О чём это свидетелсьвует?
Как изменилась окраска раствора? О чём это свидетелсьвует?
Ответьте на вопросы:
Что наблюдаете?
Почему образовавшийся в начале осадок гидроксида меди (II) растворяется с образованием прозрачного синего раствора?
Наличием каких функциональных групп в глюкозе обусловлена эта реакция?
Почему при нагревании происходит изменение цвета реакционной смеси с синего на оранжево-желтый?
Что представляет собой желто-красный осадок?
Наличие какой функциональной группы в глюкозе является причиной данной реакции?
Что доказывает реакции с раствором сахарозы?
Лабораторная работа №12
Денатурация раствора белка куриного яйца солями тяжёлых металлов.
Цель: изучить свойства белков. ОК2, ОК3, ОК4, ОК6.
ОК2, ОК3, ОК4, ОК6.
Оборудование и реактивы: — раствор белка,
— раствор медного купороса,
— раствор ацетата свинца,
— пробирки.
Ход работы.
В 2 пробирки на лейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте с одну пробирку насыщенный раствор медного купороса, а в другую – раствор ацетата свинца. Отметьте образование труднорастворимых солеобразных соединений белка. Данный опыт иллюстрирует применение белка как противоядия при отравлении тяжёлыми металлами.
Оформите работу, сделайте выводы.
Растворение белков.
Многие белки растворяются в воде, то обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами, щелочной – белки, обладающие основными свойствами.
Альбумины хорошо растворяются в дистиллированной воде, глобулины растворимы в воде только в присутствии электролитов.
Не растворяются в воде белки опорных тканей (кератин, эластин и др.)
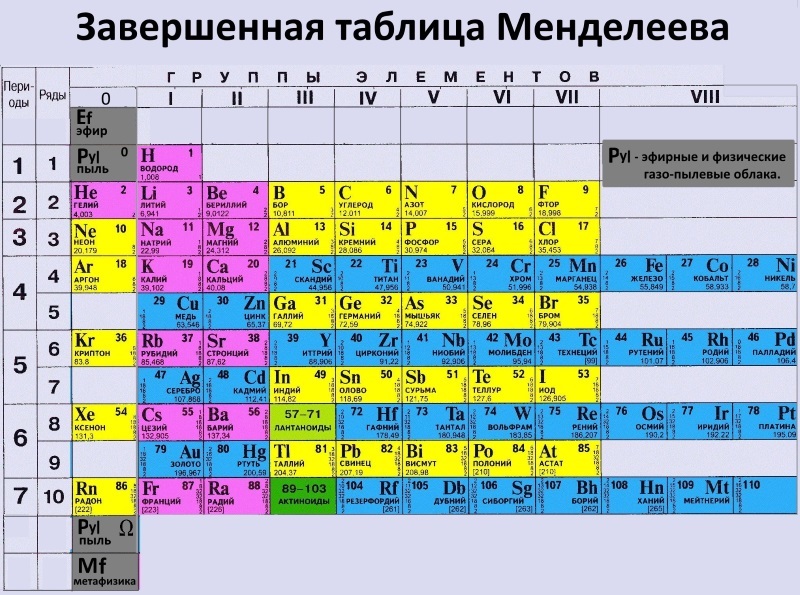
Число протонов в ядре соответствует порядковому номеру химического элемента в периодической сиситеме — Мегаобучалка
Министерство общего и профессионального образования Ростовской области
Государственное бюджетное образовательное учреждение среднего профессионального образования Ростовской области
«Ростовский — на — Дону строительный колледж»
Рабочая тетрадь
Для лабораторных и практических работ по дисциплине «Химия»
___________________
(Ф.И.О.)
Ростов-на-Дону
Химия: I курс: рабочая тетрадь для лабораторных и практических работ/ Н. А.Куринная
А.Куринная
Рабочая тетрадь предназначена для работы студентов I курса по выполнению лабораторных и практических работ. Содержит контрольные задания и методику выполнения лабораторных и практических работы, выполнение которых предусмотрено учебной программой дисциплины «Химия», разработанной в соответствии с «Рекомендациями по реализации образовательной программы среднего (полного) общего образования в образовательных учреждениях начального профессионального и среднего профессионального образования в соответствии с федеральным базисным учебным планом и примерными учебными планами для образовательных учреждений Российской Федерации, реализующих программы общего образования» (письмо департамента государственной политики и нормативно-правового регулирования в сфере образования Минобрнауки России от 29.05.2007г № 03-1180) и является частью основной профессиональной образовательной программы и составлена в соответствии с ФГОС СПО 3 по специальностям:
270101 — Архитектура
270802 — Строительство и эксплуатация зданий и сооружений
270809- — Производство неметаллических строительных изделий и Конструкций
270839 — Монтаж и эксплуатация внутренних сантехнических устройств, кондиционирования воздуха и вентиляции
270841 – Монтаж и эксплуатация оборудования и систем газоснабжения
Содержание
Лабораторная работа №1 Моделирование построения Периодической таблицы химических элементов. ………………………………………………………………………4
………………………………………………………………………4
Лабораторная работа №2Приготовление суспензии карбоната кальция в воде. Получение эмульсии моторного масла. Ознакомление со свойствами дисперсных систем.
Приготовление дисперсных систем. ………………………………………………………….8
Лабораторная работа №3-4 Испытание растворов кислот индикаторами. Взаимодействие металлов с кислотами. Взаимодействие кислот с оксидами металлов.
Взаимодействие кислот с основаниями. Взаимодействие кислот с солями.
Испытание растворов щелочей индикаторами. Взаимодействие щелочей с солями. Разложение нерастворимых оснований.
Взаимодействие солей с металлами. Взаимодействие солей друг с другом. Гидролиз солей различного типа. ………………………………………………………………………………10
Лабораторная работа №5Химические реакции. ………………………………………..14
Лабораторная работа №6Свойства соединений железа и хрома………………………..16
Лабораторная работа №7 Изготовление моделей молекул органических веществ. ……19
……19
Лабораторная работа №8Ознакомление с коллекцией образцов нефти и продуктов ее переработки. Ознакомление с коллекцией каучуков и образцами изделий из резины……21
Лабораторная работа №9Кислородсодержащие органические соединения.
Химические свойства глюкозы, сахарозы, крахмала………………………………………24
Лабораторная работа №10 Растворение белков в воде. Обнаружение белков в молоке и в мясном бульоне. Изучение свойств белков…………………………………………………27
Практическая работа № 1 Приготовление раствора заданной концентрации……………..
Практическая работа № 2 Получение, собирание и распознавание газов. Решение экспериментальных задач………………………………………………………………………
Практическая работа № 3 Решение экспериментальных задач на идентификацию органических соединений. Распознавание пластмасс и волокон………………………………
Лабораторная работа №1
Моделирование построения Периодической таблицы химических элементов.
Цель работы:
· изучить структуру и состав периодической таблицы химических элементов;
· умение давать характеристику элементов по месту их нахождения в таблице.
· закрепить представление о строении вещества.
Ход работы
Используя ранее полученные знания при изучении тем: «Основные понятия и законы химии», «Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома» студентам предлагается выполнить несколько вариантов заданий.
Задание № 1
Воспользуйтесь учебником О.С.Габриелян, И.Г.Остроумова Химия тема: «Периодический закон и периодическая система химических элементов Д.И. Менделеева в свете учения о строении атома», ответьте на вопросы:
1. Что Менделеев считал главной характеристикой атома при построении периодической системы?
_________
2. Сколько вариантов имеет периодическая система элементов?
_________
3. Изучите длинный и короткий вариант таблицы Менделеева. Напишите, чем они отличаются?
Изучите длинный и короткий вариант таблицы Менделеева. Напишите, чем они отличаются?
_________
4. *Предложите свою структуру периодической системы таблицы Менделеева (задание выполняется в свободной форме на отдельном листе).
Задание № 2.
Теоретическая часть
Зная формулы веществ, состоящих из двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
Наприме: дана формула оксида меди Cu2O, необходимо определить валентность меди Валентность кислорода постоянная и равна II, а на один атом кислорода приходится 2 атома меди. Следовательно, валентность меди равна I.
| Валентность | Примеры формул соединений | |
| I II III I и II II и III II и IV III и V II, III и VI II, IV и VI | С постоянной валентностью H, Na, K, Li O, Be, Mg, Ca, Ba, Zn Al, B С переменной валентностью Cu Fe, Co, Ni Sn,Pb P Cr S | H2O, Na2O MgO, CaO Al2O3 Cu2O, CuO FeO, Fe2O3 SnO, SnO2 PH3, P2O5 CrO, Cr2O3, CrO3 H2S, SO2, SO3 |
Определить валентности следующих элементов:
А) SiH4, CrO3, H2S, CO2, SO3, Fe2O3, FeO
Б) CO, HCl, HBr, Cl2O5, SO2, РН3, Cu2O,
B) Al2O3, P2O5, NO2, Mn2O7,Cl2O7, Cr2O3,
Г) SiO2, B2O3, SiH4, N2O5,MnO, CuO, N2O3.
____________________
Задание № 3.
Теоретическая часть
Относительная молекулярная масса — сумма всех относительных атомных масс входящих в молекулу атомов химических элементов.
Мr = Аr1 * i1+ Ar2* i2+ Аr3 * i3…
Где Мr – относительная молекулярная масса вещества
Аr1 , Ar2, Аr3 … – относительные атомные массы элементов входящих в состав этого вещества
i1, i2, i3… – индексы при химических знаках химических элементов.
Пример: Вычислить относительную молекулярную массу молекулы серной кислоты (H2SO4)
| Последовательность действий | Выполнение действий |
1. Записать молекулярную формулу серной кислоты.
| H2SO4 |
| 2. Подсчитать по формуле относительную молекулярную массу серной кислоты, подставив в формулу относительные атомные массы элементов и их индексы | Mr (H2SO4 ) = Ar (H)· n + Ar (S)· n + Ar (O)· n = 1·2 + 32 + 16?4=98 |
| 3. Записать ответ. | Ответ: Mr (H2SO4 ) = 98. |
Определить относительную молекулярную массу веществ:
A) Cu2O, KNO3, Na2Si03, Н3РО4
Б) A12(S04)3, H2SO4 , K2S, Mg(OH)2
B) SO3, CaCO3, H2SO3, NH4OH
Г) PO3, Zn(OH)2, H2SiO3, AlCl3
____________________
Задание № 4.
Теоретическая часть
«Атом» — греч «неделимый». Атомы, тем не менее, имеют сложное строение.
В центре – атомное ядро, имеющее чрезвычайно малые размеры по сравнению с размерами атома. В состав ядра входят положительные частицы – протоны (р+) и нейтральные частицы – нейтроны (n0). Таким образом, ядро атома заряжено положительно.
Протоны – частицы с положительным зарядом +1 и относительной массой 1.
Нейтроны – электронейтральные частицы с относительной массой 1.
Положительный заряд атома равен числу протонов.
Число протонов в ядре соответствует порядковому номеру химического элемента в периодической сиситеме
Электронная оболочка атома окружает положительно заряженное ядро и состоит из отрицательных частиц – электронов е—.
Электроны – частицы с отрицательнымзарядом -1 и относительной массой 1/1837 от массы протона.
Так как в целом масса всех электронов ничтожно мала, ее можно пренебречь. Значит, практически вся масса атома сосредоточена в ядре и представляет собой сумму масс протонов и нейтронов.
Массовое число – суммарное число протонов и нейтронов, округленно равно значению относительной атомной массе химического элемента (Ar).
Число нейтронов в ядре равно разности между массовым числом и числом протонов. N = A – Z
N – число нейтронов
A – массовое число
Z – число протонов.
Периодическая система элементов Д.И.Менделеева: Новые подходы
Посещение N 11301 с 03.03.2008 |
Построить атом
В этом упражнении вы будете строить атомы. Используйте периодическую таблицу, чтобы узнать, какие ингредиенты вам понадобятся.
Элемент
?
Символ
?
Протоны
?
Нейтроны
?
Электроны
?
Информация об игроке | Информация об учителе
| Имя | Символ | Атомный номер |
|---|---|---|
| Актиний | Ас | 89 |
| Алюминий | Ал | 13 |
| Америций | Ам | 95 |
| Сурьма | Сб | 51 |
| Аргон | Ар | 18 |
| Мышьяк | Как | 33 |
| Астатин | В | 85 |
| Барий | Ба | 56 |
| Берклиум | Бк | 97 |
| Бериллий | Быть | 4 |
| Висмут | Би | 83 |
| Борий | Бх | 107 |
| Бор | Б | 5 |
| Бром | Бр | 35 |
| Кадмий | CD | 48 |
| Кальций | Са | 20 |
| Калифорния | См. | 98 |
| Углерод | С | 6 |
| Церий | Се | 58 |
| Цезий | цез | 55 |
| Хлор | Кл | 17 |
| Хром | Кр | 24 |
| Кобальт | Со | 27 |
| Медь | Медь | 29 |
| Кюриум | См | 96 |
| Дармштадтиум | Дс | 110 |
| Дубниум | Дб | 105 |
| Диспрозий | Дай | 66 |
| Эйнштейний | Эс | 99 |
| Эрбий | Er | 68 |
| Европий | ЕС | 63 |
| Фермиум | фм | 100 |
| Фтор | Ф | 9 |
| Франций | Пт | 87 |
| Гадолиний | Гд | 64 |
| Галлий | Га | 31 |
| Германий | Гэ | 32 |
| Золото | Золото | 79 |
| Гафний | Хф | 72 |
| Хассиум | Гс | 108 |
| Гелий | Он | 2 |
| Гольмий | Хо | 67 |
| Водород | Х | 1 |
| Индий | В | 49 |
| Йод | я | 53 |
| Иридиум | Ир | 77 |
| Железо | Фе | 26 |
| Криптон | Кр | 36 |
| Лантан | Ла | 57 |
| Лоуренсиум | Лр | 103 |
| Свинец | Пб | 82 |
| Литий | Ли | 3 |
| Лютеций | Лу | 71 |
| Магний | мг | 12 |
| Марганец | Мн | 25 |
| Мейтнерий | Мт | 109 |
| Менделевий | Мд | 101 |
| Меркурий | рт. ст. ст. | 80 |
| Молибден | Мо | 42 |
| Неодим | Нд | 60 |
| Неон | Не | 10 |
| Нептуний | Нп | 93 |
| Никель | Ni | 28 |
| Ниобий | № | 41 |
| Азот | Н | 7 |
| нобелий | № | 102 |
| Осмий | ОС | 76 |
| Кислород | О | 8 |
| Палладий | Пд | 46 |
| Фосфор | Р | 15 |
| Платина | Пт | 78 |
| Плутоний | Пу | 94 |
| Полоний | По | 84 |
| Калий | К | 19 |
| Празеодим | Пр | 59 |
| Прометий | вечера | 61 |
| Протактиний | Па | 91 |
| Радий | Ра | 88 |
| Радон | Рн | 86 |
| Рений | перед | 75 |
| Родий | Рх | 45 |
| Рентгений | Рг | 111 |
| Рубидий | руб | 37 |
| Рутений | Ру | 44 |
| Резерфордий | Рф | 104 |
| Самарий | См | 62 |
| Скандий | Ск | 21 |
| Сиборгиум | Сг | 106 |
| Селен | Se | 34 |
| Кремний | Си | 14 |
| Серебро | Аг | 47 |
| Натрий | На | 11 |
| Стронций | Старший | 38 |
| Сера | С | 16 |
| Тантал | Та | 73 |
| Технеций | Тс | 43 |
| Теллур | Те | 52 |
| Тербий | Тб | 65 |
| Таллий | Тл | 81 |
| Торий | Т | 90 |
| Тулий | Тм | 69 |
| Олово | Сн | 50 |
| Титан | Ти | 22 |
| Вольфрам | Вт | 74 |
| Унунбиум | Ууб | 112 |
| Унунгексий | Ууу | 116 |
| Унуноктий | Ууо | 118 |
| Унунпентиум | Ууп | 115 |
| Унунквадиум | Уук | 114 |
| Унунсептиум | Уус | 117 |
| Унунтриум | Уут | 113 |
| Униум | Ууу | 111 |
| Уран | У | 92 |
| Ванадий | В | 23 |
| Ксенон | Хе | 54 |
| Иттербий | Ыб | 70 |
| Иттрий | Д | 39 |
| Цинк | Цин | 30 |
| Цирконий | Зр | 40 |
00 | 00 |
Хх | |
Правильно!
Гелий — легкий и бесцветный газ.
Ой!
Повторите попытку.
Вес
Материал
Подсказка
Подсказка:
Найдите символ гелий.
Протоны
Нейтроны
Электроны
Новые формы элементов, предсказанные моделированием
Периодическая таблица элементов является основой химии. Тем не менее известно, что поведение элементов и их химические свойства значительно меняются под давлением.
Обычно инертные платина и ксенон становятся высокореактивными, калий становится переходным металлом, а водород, кислород и сера становятся сверхпроводниками. Высокое давление — это путь к получению новых материалов с экзотическими структурами и свойствами, и такие материалы значительно расширяют наше понимание химических связей между атомами. Однако эксперименты при высоких давлениях очень сложны и часто не позволяют определить структуру.
Высокое давление — это путь к получению новых материалов с экзотическими структурами и свойствами, и такие материалы значительно расширяют наше понимание химических связей между атомами. Однако эксперименты при высоких давлениях очень сложны и часто не позволяют определить структуру.
Недавно Артем Р. Оганов и Колин В. Гласс из Лаборатории кристаллографии ETH Zurich разработали новую методологию моделирования, основанную на законах квантовой механики и позволяющую предсказывать структуру материала при любом давлении-температуре. условиях дана только химическая формула.
Теперь они применяют его к ряду интересных с химической точки зрения систем, включая ряд химических элементов под давлением. Это исследование — представлено в Journal of Chemical Physics 9.1046 — разрешает несколько споров, которые продолжались в течение последних нескольких десятилетий, и указывает на класс потенциально полезных в технологическом отношении материалов на основе углерода.
Водород – сложное поведение простейшего элемента
Водород – самый распространенный элемент во Вселенной. В Периодической таблице его положение неоднозначно – его можно поставить либо с щелочными металлами, либо с неметаллическими галогенами. Металлизация водорода под давлением используется для объяснения магнитных полей планет-гигантов Юпитера и Сатурна.
В Периодической таблице его положение неоднозначно – его можно поставить либо с щелочными металлами, либо с неметаллическими галогенами. Металлизация водорода под давлением используется для объяснения магнитных полей планет-гигантов Юпитера и Сатурна.
Считается, что металлический водород должен быть сверхпроводником вплоть до рекордно высоких температур (возможно, 300°С). Однако структура водорода при очень высоком давлении неизвестна. Принято считать, что он должен превратиться в молекулярный металл при давлении около 3,5 Мбар, а затем превратиться в немолекулярный металл при ~5 Мбар. Теперь исследователи ETH Оганов и Гласс предсказывают, что молекулярное состояние выдержит по крайней мере до 6 Мбар. Для сравнения: более прочная молекула азота разрушается при гораздо более низком давлении ~0,5 Мбар. Это ставит водород гораздо ближе к галогенам, чем к щелочным металлам.
Выяснены уникальные структуры красного и черного кислорода
Известно, что под давлением происходит резкое изменение физического состояния кислорода – из голубого магнитного материала он становится темно-красным и немагнитным. Затем при еще более высоких давлениях он превращается в черное сверхпроводящее вещество. Используя свой новый метод моделирования, Оганов и Гласс смогли прояснить уникальные структуры красного и черного кислорода.
Затем при еще более высоких давлениях он превращается в черное сверхпроводящее вещество. Используя свой новый метод моделирования, Оганов и Гласс смогли прояснить уникальные структуры красного и черного кислорода.
Кислород удерживает O 2 молекул, но слабые связи развиваются и между молекулами, образуя экзотические цепочки молекул и другие молекулярные агрегаты (например, пары молекул). Увеличение межмолекулярных взаимодействий под давлением является ключом к пониманию изменения цвета и электропроводности.
Навстречу новым материалам
Углерод известен разнообразием химических связей, которые он может принимать. Эта химическая гибкость делает углерод очень подходящим элементом жизни. Различные структуры углерода, например. графит, алмаз или фуллерены обладают совершенно разными свойствами. Используя свою технику моделирования, исследователи ETH предсказали несколько новых форм углерода при атмосферном давлении.
Два из них особенно интересны тем, что содержат элементы как графитовой, так и алмазной структур, и можно ожидать, что они будут обладать уникальной твердостью и электрическими свойствами. Подобно фуллеренам, эти формы потребуют особых условий синтеза, но однажды приготовленные могут стать технологически важными материалами.
Подобно фуллеренам, эти формы потребуют особых условий синтеза, но однажды приготовленные могут стать технологически важными материалами.
Образец цитирования: Оганов А.Р., Гласс К.В. (2006). Предсказание кристаллической структуры с использованием эволюционных методов: принципы и приложения. J. Chem. Физ . 124, выпуск 24.
Источник: ETH Zuerich
Подробнее
Структурное происхождение аномальных свойств стекла SiO2 под давлением
Ссылка : Новые формы элементов, предсказанные моделированием (22 июня 2006 г.) получено 24 сентября 2022 г. с https://phys.org/news/2006-06-elements-simulation.html
Этот документ защищен авторским правом. Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Помимо любой добросовестной сделки с целью частного изучения или исследования, никакие
часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в ознакомительных целях.
Классные ресурсы | Симуляторы | AACT
Просмотрите наш разблокированный репозиторий интерактивных симуляций. Чтобы просмотреть моделирование, щелкните заголовок моделирования.
Члены-учителя, вы можете делиться симуляциями без создания студенческого пропуска.
Моделирование
Коллигативные свойства
В этой симуляции учащиеся будут исследовать влияние различных растворенных веществ и различных количеств этих растворенных веществ на температуру кипения и точку замерзания раствора. Студенты увидят анимацию кипения и замерзания на уровне частиц с различными типами и количествами растворенных веществ, а также графическое представление результатов каждого испытания.

Моделирование
Графика
В этом симуляторе учащиеся познакомятся с хорошими методами построения графиков и интерпретацией данных, представленных на графике. Они знакомятся с аббревиатурой TAILS (название, оси, интервалы, метки, масштаб), чтобы помочь им запомнить, как строить график и понятия линии наилучшего соответствия, положительной и отрицательной корреляции, а также интерполяции и экстраполяции. Затем учащиеся выполняют тест из шести вопросов по этим темам.
Моделирование
Гальванические / гальванические элементы 2
В этой симуляции учащиеся могут создавать различные гальванические/гальванические элементы в стандартных и нестандартных условиях.
 Студенты выберут металл и раствор для каждой половины ячейки, а также концентрацию этих растворов. Они могут создавать концентрационные ячейки и другие нестандартные ячейки, регистрировать потенциал ячейки с помощью вольтметра и наблюдать соответствующие полуреакции окисления и восстановления.
Студенты выберут металл и раствор для каждой половины ячейки, а также концентрацию этих растворов. Они могут создавать концентрационные ячейки и другие нестандартные ячейки, регистрировать потенциал ячейки с помощью вольтметра и наблюдать соответствующие полуреакции окисления и восстановления.Моделирование
Гальванические / гальванические элементы
В этой симуляции учащиеся выбирают различные металлы и водные растворы для создания гальванического/гальванического элемента, вырабатывающего электрическую энергию, и наблюдают соответствующие полуреакции окисления и восстановления.
Моделирование
Металлы в водных растворах
В этом упражнении учащиеся проведут смоделированные испытания различных металлов в водных растворах, чтобы определить относительную реакционную способность этих металлов.
 Всего будет наблюдаться восемь металлов в различных сочетаниях с соответствующими растворами нитратов металлов и соляной кислотой. Студенты будут интерпретировать собранные данные, чтобы построить ряд действий элементов, используемых в этой симуляции.
Всего будет наблюдаться восемь металлов в различных сочетаниях с соответствующими растворами нитратов металлов и соляной кислотой. Студенты будут интерпретировать собранные данные, чтобы построить ряд действий элементов, используемых в этой симуляции.Моделирование
Понимание удельной теплоемкости
В этой симуляции учащиеся будут играть роль инженера. Они рассчитают удельную теплоемкость различных материалов, чтобы определить, какие из них соответствуют установленным критериям, а затем проведут анализ затрат, чтобы определить, какой материал использовать.
Моделирование
Межмолекулярные силы
В этом моделировании учащиеся рассмотрят три основных типа межмолекулярных сил и ответят на вопросы викторины, используя относительную силу этих сил, чтобы сравнить различные вещества, учитывая их название, формулу и структуру Льюиса.

Моделирование
Подготовка решений
В этой симуляции учащиеся выполнят вычисления, чтобы
определить молярность раствора, объем раствора или массу растворенного вещества. Кроме того, будет отображаться соответствующая диаграмма частиц для решения, чтобы помочь учащимся лучше визуализировать решение на уровне частиц. Наконец, учащиеся познакомятся с надлежащими лабораторными методами приготовления раствора, поскольку им будет показан пошаговый анимированный процесс, демонстрирующий эту процедуру.Моделирование
Прогнозирование продуктов
В этом моделировании учащиеся будут обращаться к ряду действий и диаграмме растворимости, чтобы точно предсказать продукты химических реакций одинарного и двойного замещения.
 Связанные диаграммы частиц будут отображаться, чтобы помочь учащимся лучше понять реакцию на уровне частиц. Студентам также будет предложено сбалансировать химическое уравнение. Моделирование разработано как викторина из пяти вопросов, которую учащиеся могут использовать несколько раз.
Связанные диаграммы частиц будут отображаться, чтобы помочь учащимся лучше понять реакцию на уровне частиц. Студентам также будет предложено сбалансировать химическое уравнение. Моделирование разработано как викторина из пяти вопросов, которую учащиеся могут использовать несколько раз.Моделирование
Состояние вещества и фазовые переходы
В этой симуляции учащиеся примут участие в викторине из 10 вопросов. Некоторые вопросы заставят учащихся проанализировать данные, чтобы определить правильное состояние вещества для конкретного образца, а затем связать выбранное состояние с анимированной диаграммой частиц. Кроме того, учащиеся изучат поведение частиц в анимированном образце по мере того, как они претерпевают изменение фазы, и должны правильно определить происходящее изменение.
Моделирование
Скорость реакции
В ходе моделирования, проведенного в мае 2018 г.
 , учащиеся исследуют несколько факторов, которые могут повлиять на начальную скорость химической реакции, включая концентрацию, температуру, площадь поверхности реагентов и добавление катализатора.
, учащиеся исследуют несколько факторов, которые могут повлиять на начальную скорость химической реакции, включая концентрацию, температуру, площадь поверхности реагентов и добавление катализатора. Моделирование
Химические реакции и стехиометрия
В этой симуляции учащиеся практикуются в классификации различных химических реакций, уравновешивании уравнений и решении стехиометрических задач.
Моделирование
Прогнозирование сдвигов в равновесии: Q против K
В этой симуляции учащиеся будут проходить тест из 15 вопросов. Каждый вопрос викторины состоит из двух частей. В первой части учащийся должен рассчитать значение коэффициента реакции Q.
 Во второй части вопроса учащиеся сравнивают значение Q с константой равновесия K и предсказывают, в какую сторону сместится реакция, чтобы достичь равновесие. Моделирование включает пять различных реакций, каждая из которых имеет три сценария: Q > K, Q = K и Q < K.
Во второй части вопроса учащиеся сравнивают значение Q с константой равновесия K и предсказывают, в какую сторону сместится реакция, чтобы достичь равновесие. Моделирование включает пять различных реакций, каждая из которых имеет три сценария: Q > K, Q = K и Q < K.Моделирование
Измерение объема
В этой симуляции учащиеся примут участие в викторине из 10 вопросов. Каждый вопрос викторины состоит из двух частей, первая часть требует от учащегося анализа изображения градуированного цилиндра, чтобы сообщить о точном измерении. Студенты должны использовать правильное количество цифр на основе маркировки, представленной на цилиндре, при сообщении об измерении. Во второй части вопроса учащиеся должны определить значение неопределенности градуированного цилиндра, опять же, анализируя его маркировку. Симуляция состоит из градуированных цилиндров нескольких разных размеров, каждый из которых имеет уникальную маркировку, поэтому учащимся будет предложено проанализировать каждый из них по отдельности.

Моделирование
Изотопы и расчет средней атомной массы
В ходе моделирования, проведенного в мае 2017 года, учащиеся сначала узнают, как определяется средняя атомная масса, с помощью учебного пособия, основанного на содержании изотопа углерода. Затем учащиеся будут взаимодействовать в рабочей области, где они будут выбирать количество изотопов, массу каждого изотопа, а также их изобилие, чтобы успешно построить загадочный элемент. Наконец, они будут использовать свой выбор для расчета средней атомной массы загадочного элемента.
Моделирование
Исследование периода полураспада
В ходе моделирования в марте 2017 года учащиеся получат возможность исследовать распад двух образцов нестабильных атомов.
 Студенты будут взаимодействовать с симуляцией, чтобы разложить нестабильные образцы, что приведет к визуальной и графической интерпретации периода полураспада.
Студенты будут взаимодействовать с симуляцией, чтобы разложить нестабильные образцы, что приведет к визуальной и графической интерпретации периода полураспада.Моделирование
Изменения энергии в химических реакциях
В ноябре 2016 г. моделирование, студенты будут оценивать изменения энергии в эндотермической и экзотермическая химическая реакция. Студенты будут иметь возможность сравнить, как энергия поглощается и высвобождается в каждой реакции, и установит связь между стандартными энергетическими диаграммами, связанными с каждым типом реакции.
Моделирование
Ионные и ковалентные связи
В сентябре 2016 г. моделирование, студенты исследуют как ионную, так и ковалентную связь.
 Студенты будут иметь возможность взаимодействовать со многими возможными
комбинации атомов и будет поставлена задача определить тип
связь и количество атомов, необходимых для образования каждой из них. Студенты станут
знакомы с молекулярной формулой, а также с системой наименования для
каждый тип соединения и геометрическая форма, если применимо.
Студенты будут иметь возможность взаимодействовать со многими возможными
комбинации атомов и будет поставлена задача определить тип
связь и количество атомов, необходимых для образования каждой из них. Студенты станут
знакомы с молекулярной формулой, а также с системой наименования для
каждый тип соединения и геометрическая форма, если применимо.Моделирование
Периодические тенденции II: сродство к электрону, атомный радиус и ионный радиус
Май 2016 г. симуляция является продолжением симуляции марта 2016 года. Студенты будут сосредоточить свои исследования на сродстве атома к электрону. Через использование этого моделирования студенты будут иметь возможность изучить образования аниона, а также сравнить атомный радиус нейтрального атома к ионному радиусу его аниона.
Моделирование
Периодические тренды: энергия ионизации, атомный радиус и ионный радиус
В этом моделировании для номера за март 2016 года учащиеся могут исследовать периодические тренды атомного радиуса, энергии ионизации и ионного радиуса.
 Выбирая элементы из периодической таблицы, атомы могут быть выбраны для параллельного сравнения и анализа. Студенты также могут попытаться ионизировать атом, удалив его валентные электроны. Количественные данные доступны для каждой периодической тенденции и могут быть дополнительно изучены на графике.
Выбирая элементы из периодической таблицы, атомы могут быть выбраны для параллельного сравнения и анализа. Студенты также могут попытаться ионизировать атом, удалив его валентные электроны. Количественные данные доступны для каждой периодической тенденции и могут быть дополнительно изучены на графике.Моделирование
Моделирование газовых законов
Симулятор ноябрь 2015 выпуск позволяет учащимся исследовать три фундаментальных газовых закона, включая закон Бойля, закон Шарля и закон Гей-Люссака. Студенты будут иметь возможность визуально изучить эффект от изменения связанные переменные давления, объема или температуры в каждом ситуация. Также учащиеся проведут анализ проб газа на частицах уровне, а также манипулировать количественными данными в каждом сценарии. Окончательно учащиеся будут интерпретировать тенденции в данных, изучая график связанных с каждым из газовых законов.

Моделирование
Плотность
Моделирование для выпуска за сентябрь 2015 г. позволяет учащимся исследовать влияние изменения переменных как на объем, так и на плотность твердых, жидких и газообразных образцов. Студенты будут анализировать различные состояния материи на уровне частиц, а также количественно.
Моделирование
Кривая нагрева воды
В мае 2015 г. вопрос, учащиеся исследуют кривую нагрева воды из качественного и количественная перспектива. Учащиеся сравнивают иллюстрации каждого физическое состояние, изображенное на кривой, и рассчитать требуемую энергию для перехода из одного состояния в другое.
Моделирование
Возбуждающие электроны
В марте 2015 г.
 учащиеся изучают, что происходит, когда электроны внутри общего
атом возбуждается из основного состояния. Они увидят, что когда
электрон релаксирует из возбужденного состояния в основное, энергия
высвобождается в виде электромагнитного излучения.
учащиеся изучают, что происходит, когда электроны внутри общего
атом возбуждается из основного состояния. Они увидят, что когда
электрон релаксирует из возбужденного состояния в основное, энергия
высвобождается в виде электромагнитного излучения.Моделирование
Сравнение сил притяжения
В ноябре 2014 г. проблема, учащиеся исследуют различные силы притяжения между парами молекул, перетаскивая изображение «звезды». В сопроводительном деятельности, учащиеся исследуют различные виды межмолекулярных сил (Лондонская дисперсия и диполь-диполь). В анализе, который следует за исследования, они связывают IMFs (включая водородную связь) с физическими свойства (температура кипения и растворимость).
Моделирование
Уравновешивание химических уравнений
Моделирование для сентябрьского выпуска 2014 г.
 создано PhET и помогает учащимся практиковаться в составлении химических уравнений. AACT помог профинансировать преобразование этой популярной симуляции в формат, совместимый со всеми устройствами, включая iPad. PhET предоставляет руководства для учителей для многих своих симуляций и созданные учителем действия, которые могут сопровождать симуляции.
создано PhET и помогает учащимся практиковаться в составлении химических уравнений. AACT помог профинансировать преобразование этой популярной симуляции в формат, совместимый со всеми устройствами, включая iPad. PhET предоставляет руководства для учителей для многих своих симуляций и созданные учителем действия, которые могут сопровождать симуляции.
21 Увлекательные занятия по периодической таблице для студентов-химиков всех возрастов
Периодическая таблица элементов является ключом к пониманию и освоению химических концепций. Эти упражнения с периодической таблицей веселые и увлекательные, и вы можете использовать многие из них как с младшими, так и со старшими учениками. Выберите несколько, чтобы попробовать в своем собственном классе!
Напоминаем, что WeAreTeachers может собирать часть продаж по ссылкам на этой странице. Спасибо за Вашу поддержку!
1. Начните с якорной диаграммы
Периодическая таблица — оригинальная конструкция, но она требует небольшого пояснения. Эти якорные диаграммы объясняют расположение и детали и являются отличным справочным материалом для использования во всех ваших действиях с периодической таблицей.
Эти якорные диаграммы объясняют расположение и детали и являются отличным справочным материалом для использования во всех ваших действиях с периодической таблицей.
Подробнее: Scholastic
2. Изучите иллюстрированную таблицу Менделеева
Учителя любят эту таблицу, и не зря. Это оживляет таблицу, помогая студентам-химикам понять, какую роль каждый элемент играет в окружающем нас мире. Вы можете бесплатно распечатать его копии или купить плакаты и наборы открыток. Есть даже интерактивная версия!
Узнайте больше: elements.wlonk.com
3. Раскрасьте и узнайте об элементах
Вы можете использовать эту умную книжку-раскраску для всех видов занятий с периодической таблицей. Попробуйте несколько бесплатных печатных страниц с сайта автора Терезы Бондора здесь. Если они вам нравятся, купите книжку-раскраску «Периодическая таблица элементов» на Amazon.
4. Спойте песенку о таблице Менделеева
Хотя детям не обязательно запоминать таблицу Менделеева, такие песни могут помочь, если они захотят попробовать! Нам нравится этот новый современный взгляд, но старая классика Тома Лерера из 1959 тоже очень весело.
5. Соберите модель из картонных коробок из-под яиц
Любите хорошие поделки из вторсырья? Это деятельность, которую вы ищете! Накопите картонные коробки для яиц и используйте их для создания модели таблицы Менделеева.
Подробнее: Weird Unsocialized Homeschoolers
6. Создайте колоду карт элементов
Эти бесплатные распечатанные карточки отлично подходят для повторения элементов, особенно если вы работаете над запоминанием некоторых или всех из них.
Подробнее: Домашнее школьное творчество
7.
 Изготовление моделей элементов для чистки труб
Изготовление моделей элементов для чистки трубПолучите более глубокое представление о конструкции каждого элемента, создавая модели с помпонами, бусинами и ершиками для труб.
Узнать больше: Научи рядом со мной
8. Найдите элементы, чтобы победить в игре
Ознакомьтесь с расположением каждого элемента на столе вместе с их сокращениями с помощью этого простого (и бесплатного) пункта компьютерная игра.
Подробнее: Mr. Nussbaum Обучение + развлечение
9. Отправляйтесь на поиски элементов
Отправьте учащихся на поиск реальных примеров различных элементов. Они будут удивлены тем, как легко их найти.
Подробнее: Pinay Homeschooler
10. Составьте периодическую таблицу из гигантских плиток
Этот классический исследовательский проект объединяется в гигантской периодической таблице. Вы можете использовать доску для плакатов или добавить трехмерный элемент, вместо этого создав плитки на коробках для пиццы.
Узнать больше: missmiklius
11. Играть в периодическую таблицу Морской бой
Вот еще одна забавная игра, которая поможет детям познакомиться с тем, где находятся различные элементы на столе. Узнайте, как играть по ссылке.
Подробнее: Teach Beside Me
12. Превратите элементы в супергероев (или злодеев)
Это такой забавный поворот в обычном проекте по исследованию элементов. Учащиеся узнают больше о характеристиках своей стихии, а затем решают, супергерой это или злодей!
Подробнее: Morpho Science/Teachers Pay Teachers
13. Загрузите приложение Atomidoodle
Это классное маленькое приложение, доступное как в Apple AppStore, так и в Google Play, предлагает учащимся рисовать пути в лабиринтах. Они используют слияние (сложение) и деление (деление) для создания новых атомов, изучая при этом сотни фактов об элементах.
Узнать больше: Atomidoodle
14.
 Сортировать «периодических людей» в таблицу
Сортировать «периодических людей» в таблицуЭто умное задание дает учащимся возможность увидеть, как Менделеев сортировал элементы, чтобы создать свою блестящую периодическую таблицу. Получите бесплатно по ссылке.
Узнать больше: Sunrise Science
15. Повесьте таблицу Менделеева на потолок
Источник: Sentinel округа Джексон
Используйте все свободное пространство в классе, превратив плитку на потолке в огромную таблицу Менделеева! Клейкий винил хорошо подходит для этого амбициозного проекта.
16. Разгадать
Тайна периодической таблицыЧитателям средних классов понравится этот рассказ о разработке периодической таблицы, в ходе которой они узнают о различных ученых, участвовавших в ее разработке. Купите The Mystery of the Periodic Table на Amazon здесь.
17. Знакомство с персонажами Элемента
Каждый элемент имеет свой собственный набор характеристик, которые почти можно назвать его личностью. В этом и заключается идея этих невероятно забавных карт, которые представляют элементы как живых персонажей. Вы можете использовать набор из них для всех видов периодической таблицы.
В этом и заключается идея этих невероятно забавных карт, которые представляют элементы как живых персонажей. Вы можете использовать набор из них для всех видов периодической таблицы.
Узнайте больше: Элементы — эксперименты с дизайном персонажей
18. Победите квест-комнату с периодической таблицей
Квест-комнаты сейчас в моде, и они также доставляют массу удовольствия в классе. Создайте свой собственный набор задач, основанных на химии, или купите эту готовую квест-комнату с таблицей Менделеева на сайте Teachers Pay Teachers.
Узнать больше: Kesler Science
19. Сделать пиксельную графику периодической таблицы
В этой бесплатной интерактивной программе учащиеся отвечают на вопросы об элементах, чтобы разблокировать квадраты периодической таблицы, создавая пиксельную картинку. Бонус: пусть дети создают свои собственные пиксельные картинки, используя таблицу!
Подробнее: Преподавание над тестом
20.
 Соберите разноцветные плитки
Соберите разноцветные плиткиЭти разноцветные кусочки соединяются друг с другом, образуя интерактивную головоломку, которую можно использовать для множества различных действий с периодической таблицей. Купите набор на Amazon.
21. Соревнуйтесь в таблице Менделеева Бинго
Бинго всегда весело, но эта версия также поможет вам выучить различные сокращения элементов. Сделайте свои карты или купите готовый набор по ссылке.
Узнайте больше: Семейство с питанием от STEAM
Хотите узнать больше о практических исследованиях? Попробуйте лучшие научные наборы для детей, выбранные учителями.
Плюс, 20 лучших научных досок объявлений и идей декора классных комнат.
Периодическая таблица Образовательные ресурсы для детей от 15 до 18 лет
Упражнения
Периодическая таблица тенденций Упражнение
Загрузите, распечатайте и вырежьте карточки, необходимые для выполнения этого задания. Затем посмотрите обучающее видео (на английском или испанском), чтобы научиться играть.
Затем посмотрите обучающее видео (на английском или испанском), чтобы научиться играть.
Идентификатор Youtube: 3-izAsCGCzQ
Идентификатор Youtube: Ceb90BpYlas
Занятия в средней школе
Просмотрите ресурсы для занятий по химии от Американской ассоциации учителей химии.
Работа с периодической таблицей
Хотите узнать больше об этом центральном элементе химии? Выбирайте из этой коллекции ссылок об элементах и периодической таблице! Постройте элементный шар, решайте периодические головоломки и проверьте некоторые из самых необычных периодических таблиц, которые вы когда-либо видели.
Игра «Назови химию»
Играя в игру «Назови химию», учащиеся узнают, почему соединения образуются именно так, а не иначе. Они также научатся правильно называть химические соединения и писать химические формулы.
Мероприятия в День крота
Отмечаемый ежегодно 23 октября с 6:02 до 18:02 День крота посвящен числу Авогадро (6,02 x 10 23 ), которое является основной единицей измерения в химии. Найдите способы отпраздновать этот праздник химии!
Найдите способы отпраздновать этот праздник химии!
Алхимия
Основной целью многих алхимиков прошлого было превращение свинца в золото. Эта коллекция ссылок исследует историю алхимии, связь алхимии с современной химией, а также некоторые забавные занятия, чтобы ощутить вкус жизни алхимика.
Работа с металлическим лигандом — связь с криминалистикой
Эта деятельность интегрирована в исследование места преступления, в ходе которого под ботинком каждого подозреваемого обнаруживается грязь. Затем каждый образец грязи сравнивают с грязью, найденной на месте преступления. Распыление Windex на образцы дает цвет, который зависит от металла, находящегося в грязи. Сравнивая цвета разных образцов, мы могли бы определить настоящего виновника.
Очистка с помощью атомной экономики
Принцип зеленой химии атомной экономики применяется к химическим реакциям и минимизирует отходы вплоть до молекулярного уровня. В этом упражнении используются молекулярные модели для расчета экономии атомов в реакции омыления.
Контрольные вопросы по зеленой химии
Контрольные вопросы по зеленой химии для средней школы
Графика и видео
Периодическая таблица родинок
В рамках 10 9 ChemClub’s 10 года года мы попросили клубы создать элементы таблицы Менделеева с изображением родинки.
Элементы, находящиеся под угрозой исчезновения Инфографика
Периодическая таблица элементов, находящихся под угрозой исчезновения, представляет элементы, поставки которых в ближайшие годы будут ограничены. Исследование было проведено Сетью передачи знаний о химических инновациях.
Periodic Graphics
Ежемесячное сотрудничество между C&EN и Энди Браннингом, преподавателем химии и автором популярного графического блога Compound Interest.
Загрузите обновленную периодическую таблицу из публикаций ACS
Периодическая таблица висит в вашей лаборатории, классе или офисе безнадежно устаревшей? Замените эту старую реликвию бесплатной обновленной периодической таблицей от ACS Publications!
Большие акулы и марганец
В этом видео Сэм Кин рассказывает истории о марганце.
Планы уроков
План раздела: Периодическая таблица
Этот план раздела от Американской ассоциации учителей химии 9В 1046 есть все, что вам нужно для составления индивидуального плана вашего класса: уроки, занятия, лабораторные работы, проекты, видео, симуляции и анимации. Мы разработали модульный план, используя ресурсы AACT, который предназначен для обучения ваших студентов периодической таблице.
Ptable.com Investigations
В этом упражнении учащиеся будут использовать периодическую онлайн-таблицу ptable.com для изучения ряда химических концепций. Студенты будут использовать этот онлайн-ресурс для изучения информации об элементах, включая исторические данные, физические свойства, периодические тенденции и многое другое.
Изучение элементов
В этом проекте учащиеся должны выбрать элемент, а затем использовать Ptable.com для изучения аспектов элемента, включая его периодичность, электронную конфигурацию, историю и использование в промышленности.
Вопросы и ответы с Майклом Дайей
Недавно Chemistry Solutions связались с Майклом Дайей, создателем ptable.com — одной из первых периодических таблиц в Интернете. Мы попросили его поделиться своей историей о том, как он создал ptable.com, когда учился в средней школе, и как он с тех пор обновлял его, чтобы поддерживать учителей в последние годы.
План урока вехи химии: открытие кислорода
Узнайте, как практиковалась химия во времена Джозефа Пристли (1733–1804), события, приведшие к открытию кислорода, исторический контекст научных открытий, сделанных в то время, и связанные с ними разработки в химии, которые имели место в конце 1700-х и начале 1800-х годов.
Химический ориентир План урока: разработка разрыхлителя
Получите представление об истории и химии, использованных при разработке разрыхлителя.
План урока Chemical Landmark: Человек и материалы через историю
Узнайте о связи между наукой о материалах и культурными и технологическими достижениями, в частности о разработке первого в мире синтетического пластика, бакелита.
Химический ориентир План урока: открытие фуллеренов
Узнайте об увлекательной химии фуллеренов и событиях, которые привели к их открытию.
Безопасность и рекомендации
Руководство по безопасности в химической лаборатории в средней школе s
Это руководство было разработано, чтобы помочь учителям старших классов по всем естественнонаучным предметам постепенно углублять свое понимание передового опыта, чтобы обеспечить безопасность своих учеников и самих себя в процессе научного обучения. . Есть надежда, что эти рекомендации помогут преподавателям прививать культуру научной безопасности на ранних этапах академической и профессиональной карьеры учащихся. Также есть надежда, что эти рекомендации подготовят учителей к действиям в любых инцидентах или чрезвычайных ситуациях, которые могут возникнуть в классе естественных наук или в лаборатории..
Руководство и рекомендации по преподаванию химии в средних и старших классах
Научитесь ориентироваться в основных понятиях химии на основе рекомендуемых стандартов для учащихся средних и старших классов. Уроки химии часто включают практические занятия в лаборатории. ACS предоставляет вам различные инструменты для обеспечения безопасности ваших учебных помещений, планов уроков и материалов для вас и ваших учеников. Эти стратегии написаны специально для учителей химии и решают задачи, помогающие учащимся максимально раскрыть свой потенциал в химии.
Уроки химии часто включают практические занятия в лаборатории. ACS предоставляет вам различные инструменты для обеспечения безопасности ваших учебных помещений, планов уроков и материалов для вас и ваших учеников. Эти стратегии написаны специально для учителей химии и решают задачи, помогающие учащимся максимально раскрыть свой потенциал в химии.
Атомы, молекулы и соединения | manoa.hawaii.edu/ExploringOurFluidEarth
Chemical Structures
Свойства элементов и соединений определяются их структурой. Простейшей структурной единицей элемента является атом. Атомы очень малы. Сто миллионов (100 000 000) атомов водорода, поставленных рядом, составляют всего один сантиметр!
Некоторые элементы являются одноатомными , то есть состоят из одного ( мон-) атом (-атомный ) в их молекулярной форме. Гелий (He, см. рис. 2.8) является примером одноатомного элемента. Другие элементы содержат два или более атомов в своей молекулярной форме (рис. 2.8). Например, молекулы водорода (H 2 ), кислорода (O 2 ) и хлора (Cl 2 ) содержат по два атома. Другая форма кислорода, озон (O 3 ), состоит из трех атомов, а сера (S 8 ) состоит из восьми атомов. Все элементарные молекулы состоят из атомов одного элемента.
2.8). Например, молекулы водорода (H 2 ), кислорода (O 2 ) и хлора (Cl 2 ) содержат по два атома. Другая форма кислорода, озон (O 3 ), состоит из трех атомов, а сера (S 8 ) состоит из восьми атомов. Все элементарные молекулы состоят из атомов одного элемента.
Молекулы соединений содержат атомы двух или более различных элементов. Например, вода (H 2 O) имеет три атома, два атома водорода (H) и один атом кислорода (O). Метан (CH 4 ), распространенный парниковый газ, имеет пять атомов, один атом углерода (C) и четыре атома водорода (H, см. рис. 2.9).
Электростатические силы
Электростатические силы удерживают атомы в молекулах. Электростатические силы, которые удерживают атомы вместе в молекулах, относятся к тому же типу сил, которые вызывают статическое электричество. Типичными примерами статического электричества являются случаи, когда кто-то получает удар током, когда тянется к дверной ручке, или когда волосы ребенка поднимаются дыбом при спуске с пластиковой горки (рис. 2.10).
2.10).
Деятельность
Определить, как взаимодействует заряженная материя.
Части атомов
Частицы, из которых состоит атом, называются субатомными частицами ( sub — означает «меньший размер»). Эти частицы представляют собой
- протон (p + ), который заряжен положительно (+);
- электрон (е – ), который заряжен отрицательно (–); и
- нейтрон (n 0 ), у которого нет заряда, он нейтрален (0).
Протоны и нейтроны занимают ядро , или центр атома. Электроны существуют в областях, называемых оболочками , вне ядра атома (рис. 2.11).
Электростатические силы удерживают атомы вместе в молекулах — подобно тому, как два атома водорода удерживаются вместе в газе h3. Электростатические силы также удерживают вместе электроны и протоны в атоме. Притяжение между отрицательно заряженными электронами и положительно заряженными протонами в атоме определяет структуру атома. сильная сила удерживает нейтроны и протоны вместе в ядре. Эта сила получила свое название потому, что она достаточно сильна, чтобы преодолеть силу отталкивания положительно заряженных протонов друг от друга. Количество электронов и протонов в атоме определяет его химические свойства. К химическим свойствам относятся особые способы взаимодействия атомов и молекул и энергия, которую они выделяют или используют в этих реакциях.
Притяжение между отрицательно заряженными электронами и положительно заряженными протонами в атоме определяет структуру атома. сильная сила удерживает нейтроны и протоны вместе в ядре. Эта сила получила свое название потому, что она достаточно сильна, чтобы преодолеть силу отталкивания положительно заряженных протонов друг от друга. Количество электронов и протонов в атоме определяет его химические свойства. К химическим свойствам относятся особые способы взаимодействия атомов и молекул и энергия, которую они выделяют или используют в этих реакциях.
Размер субатомных частиц
Сто миллионов (100 000 000) атомов водорода, поставленных рядом, составляют около сантиметра. Протоны и нейтроны составляют примерно одну тысячную (1/1000) диаметра атома водорода. Это означает, что потребуется около ста миллиардов (100 000 000 000) протонов или нейтронов, положенных бок о бок, чтобы получился сантиметр. Электроны составляют примерно одну тысячную (1/1000) диаметра протона или нейтрона. Это означает, что потребуется сто триллионов (100 000 000 000 000) электронов, положенных бок о бок, чтобы получить сантиметр!
Это означает, что потребуется сто триллионов (100 000 000 000 000) электронов, положенных бок о бок, чтобы получить сантиметр!
Нейтральные атомы
Элементарные частицы в атоме определяют свойства атома. Некоторые атомы существуют в природе как нейтральные или незаряженные атомы. Одиночный незаряженный атом имеет равное количество протонов (+) и электронов (–). Незаряженный атом электрически нейтрален, потому что электроны и протоны имеют противоположные заряды одинаковой величины. Когда количество протонов и электронов в атоме одинаково, заряды компенсируются или противодействуют друг другу.
Протоны и нейтроны
Каждый атом определенного элемента имеет одинаковое количество протонов. Атомный номер равен количеству протонов в элементе. В периодической таблице атомный номер обычно указывается как целое число над символом элемента (см. рис. 2.13). Например, водород (Н) имеет атомный номер один (1). Это означает, что атом водорода имеет один протон. Если атом водорода нейтрален, он также должен иметь один электрон. Атом кислорода (O) имеет атомный номер восемь (8). Это означает, что нейтральный атом кислорода имеет восемь протонов и восемь электронов. Элемент Actium (Ac) имеет атомный номер 89., поэтому в нейтральном атоме 89 протонов и 89 электронов. В таблице 2.2 показаны атомный номер, символ атома, атомная структура и количество протонов, нейтронов и электронов для первых трех элементов.
Если атом водорода нейтрален, он также должен иметь один электрон. Атом кислорода (O) имеет атомный номер восемь (8). Это означает, что нейтральный атом кислорода имеет восемь протонов и восемь электронов. Элемент Actium (Ac) имеет атомный номер 89., поэтому в нейтральном атоме 89 протонов и 89 электронов. В таблице 2.2 показаны атомный номер, символ атома, атомная структура и количество протонов, нейтронов и электронов для первых трех элементов.
| Водород | Гелий | Литий | |
| Атомный номер | 1 | 2 | 3 |
| Атомный символ | Х | Он | Ли |
| Количество протонов | 1 | 2 | 3 |
| Количество электронов | 1 | 2 | 3 |
| Количество нейтронов | 0 | 2 | 4 |
| Атомная структура |
Нейтроны влияют на массу атома и играют роль в стабильности атомов. В отличие от протонов количество нейтронов в элементах различно. Например, у большинства атомов водорода нет нейтронов, но у некоторых есть один нейтрон, а у некоторых редких атомов водорода есть два нейтрона. Большинство атомов гелия имеют два нейтрона, но некоторые имеют три нейтрона.
В отличие от протонов количество нейтронов в элементах различно. Например, у большинства атомов водорода нет нейтронов, но у некоторых есть один нейтрон, а у некоторых редких атомов водорода есть два нейтрона. Большинство атомов гелия имеют два нейтрона, но некоторые имеют три нейтрона.
Периоды, группы и периодическая таблица
Периодическая таблица (рис. 2.12) — широко используемый метод организации элементов, предоставляющий полезную информацию об элементах и их поведении. На рис. 2.12 элементы синего цвета — это металлы, а элементы желтого цвета — неметаллы. На рис. 2.13 запись для водорода выделена размещением атомного номера, символа элемента, имени элемента и атомного веса.
Таблица Менделеева имеет три важные особенности. Во-первых, периодическая таблица выстроена в горизонтальные ряды, которые называются периодами . Есть семь периодов. В периоде 1 есть два элемента: водород (H) и гелий (He). Второй и третий периоды содержат по восемь элементов, четвертый и пятый периоды содержат по 18 элементов, а шестой и седьмой периоды содержат по 32 элемента.
Второй и третий периоды содержат по восемь элементов, четвертый и пятый периоды содержат по 18 элементов, а шестой и седьмой периоды содержат по 32 элемента.
Во-вторых, все элементы перечислены последовательно в соответствии с их атомными номерами. Атомный номер соответствует количеству протонов и находится над символом элемента. Например, на рис. 2.13 атомный номер водорода равен 1, что соответствует H.9.0003
В-третьих, периодическая таблица состоит из столбцов элементов, которые реагируют одинаково. Эти столбцы называются группами . Номер группы находится в верхней части столбца. Группы 1–12 содержат только металлы, группы 13–16 содержат как металлы, так и неметаллы, а группы 17 и 18 содержат только неметаллы. Единственным исключением является водород. Хотя технически водород является неметаллом, он обладает свойствами как металлов, так и неметаллов и часто помещается в Группу 1. Два длинных ряда в нижней части периодической таблицы являются исключениями. Элементы в каждой из этих строк ведут себя одинаково, поэтому считаются группами. Эти две группы расположены в строках, а не в столбцах.
Элементы в каждой из этих строк ведут себя одинаково, поэтому считаются группами. Эти две группы расположены в строках, а не в столбцах.
Металлы и неметаллы
Металлы — это элементы, проводящие тепло и электричество. Металлы обычно ковкие , их можно сгибать или формовать без разрушения, и блестящие или блестящие. Большинство металлов имеют серебристый цвет (рис. 2.14 A–C), хотя некоторые из них не имеют серебристого цвета, например медь (Cu, рис. 2.14 D). Большинство металлов находятся в твердом состоянии при комнатной температуре. Единственным исключением является ртуть (Hg), которая при комнатной температуре представляет собой жидкость (рис. 2.14 А). Элементы группы 1, включая литий (Li), натрий (Na, рис. 2.14 B), калий (K, рис. 2.14 C) и рубидий (Rb), все являются металлами. Эти металлические элементы группы 1 обладают схожими реактивными свойствами. На рис. 2.12 металлы показаны синим цветом.
Неметаллы плохо проводят тепло и электричество; они не блестят и существуют в природе в виде твердых тел, жидкостей или газов. В твердом состоянии неметаллы имеют тенденцию быть хрупкими, например, сера, которая отслаивается, а не изгибается, как металл (рис. 2.15 А). Элементы группы 17, включая фтор (F 2 ), хлор (Cl 2 , рис. 2.15 Б), бром (Br 2 , рис. 2.15 В) и йод (I 2 , рис. 2.15 D), все неметаллы. Все неметаллы 17-й группы являются двухатомными (два атома) в своей элементарной форме и обладают сходными реакционными свойствами. На рис. 2.12 неметаллы показаны желтым цветом.
В твердом состоянии неметаллы имеют тенденцию быть хрупкими, например, сера, которая отслаивается, а не изгибается, как металл (рис. 2.15 А). Элементы группы 17, включая фтор (F 2 ), хлор (Cl 2 , рис. 2.15 Б), бром (Br 2 , рис. 2.15 В) и йод (I 2 , рис. 2.15 D), все неметаллы. Все неметаллы 17-й группы являются двухатомными (два атома) в своей элементарной форме и обладают сходными реакционными свойствами. На рис. 2.12 неметаллы показаны желтым цветом.
См. сводку свойств металлов и неметаллов в Таблице 2.3.
| Металлы | Неметаллы | |
| Физические свойства | Хороший проводник тепла и электричества | Плохой проводник тепла и электричества |
| Ковкий — можно бить или деформировать без образования трещин; гибкий | Хрупкий | |
| Ковкий — можно превратить в проволоку | Непластичный | |
| Блестящий | Не блестящий, может быть непрозрачным или прозрачным | |
| Твердое вещество при комнатной температуре (кроме Hg и некоторых других металлов, находящихся в жидком состоянии при комнатной температуре или близкой к ней) | Твердое вещество, жидкость или газ при комнатной температуре | |
| Химические свойства | Обычно имеют 1-3 валентных электрона | Обычно имеют 4-8 валентных электронов |
| Склонны к потере валентных электронов | Тенденция к получению электронов |
Другие организационные особенности Периодической таблицы
Существуют и другие организационные особенности таблицы Менделеева.

 Напишите, чем они отличаются?
Напишите, чем они отличаются?



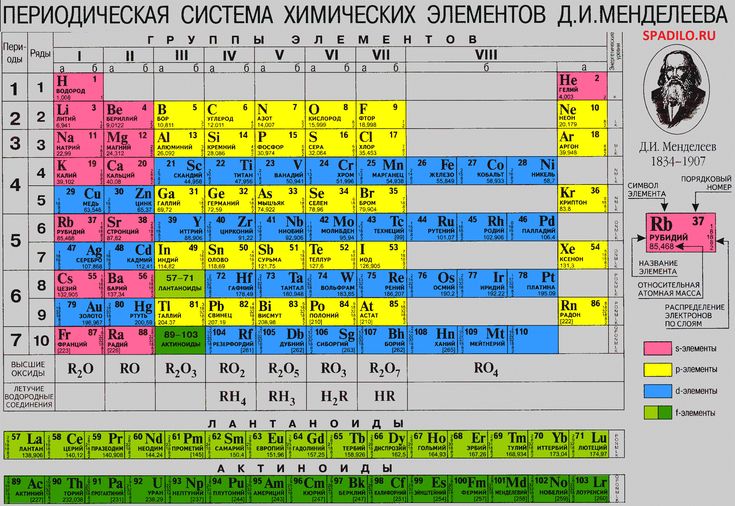
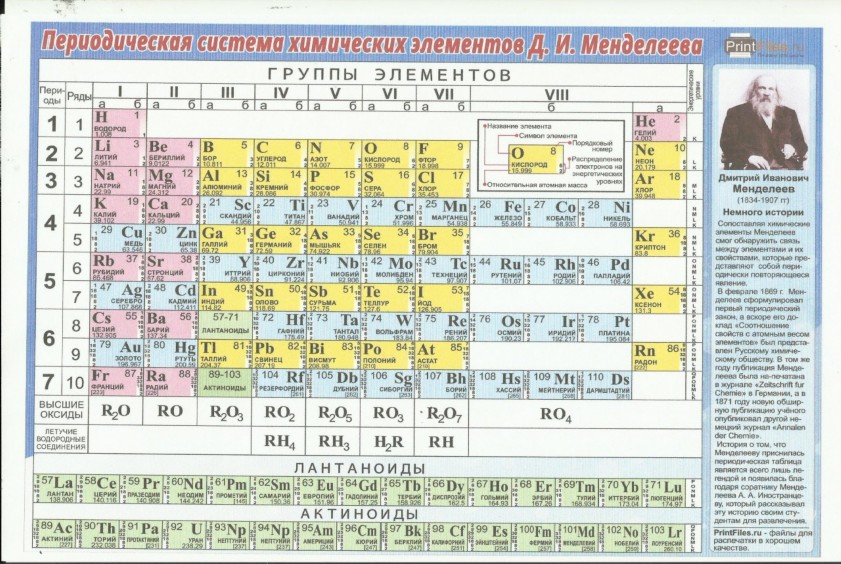
 Максимальное время выполнения задания: ____90_______ мин.
Максимальное время выполнения задания: ____90_______ мин.


 Пропустить через раствор луч света фонарика на фоне темной бумаги
Пропустить через раствор луч света фонарика на фоне темной бумаги Максимальное время выполнения задания: ____90_______ мин.
Максимальное время выполнения задания: ____90_______ мин. И. Менделеева записывать схемы строения атомов химических элементов, электронные формулы, их графическое изображение.
И. Менделеева записывать схемы строения атомов химических элементов, электронные формулы, их графическое изображение.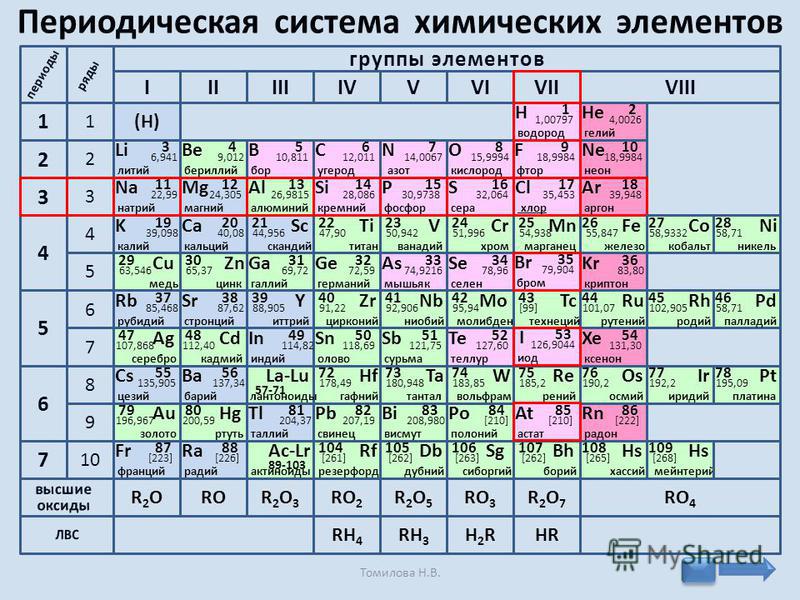
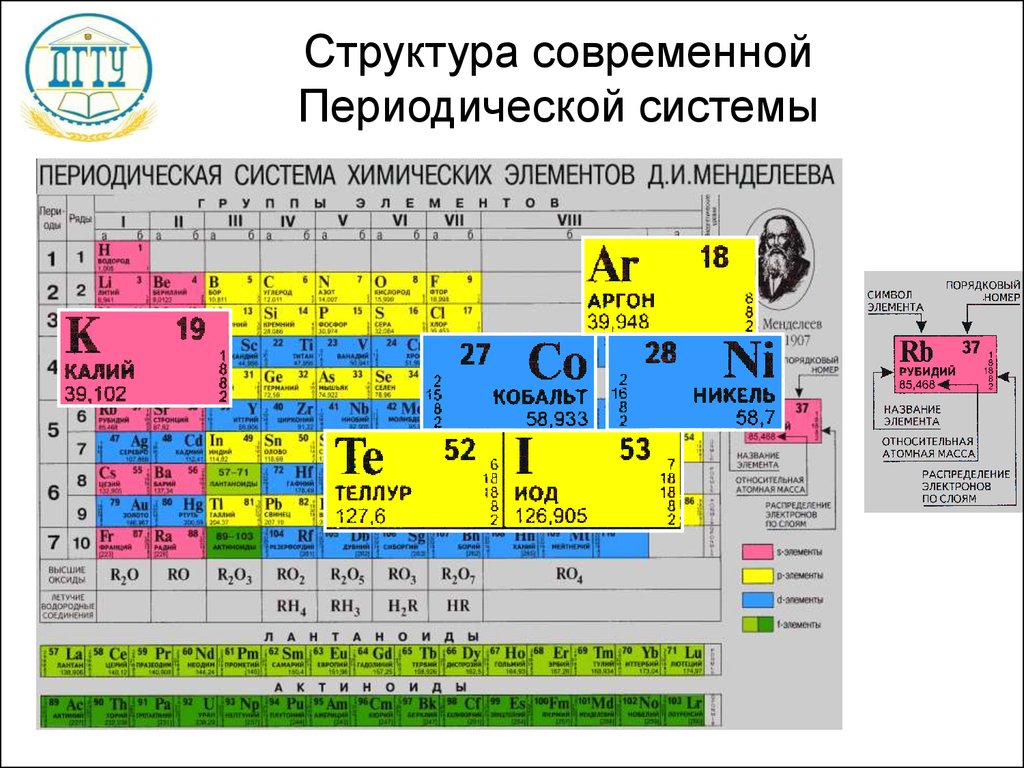
 И. Менделеева.
И. Менделеева.
 Для этого навести
курсор правой кнопкой мыши на панель
«Коллекция» и выбрать заголовок «Правила
выживания в химической лаборатории».
Для этого навести
курсор правой кнопкой мыши на панель
«Коллекция» и выбрать заголовок «Правила
выживания в химической лаборатории».